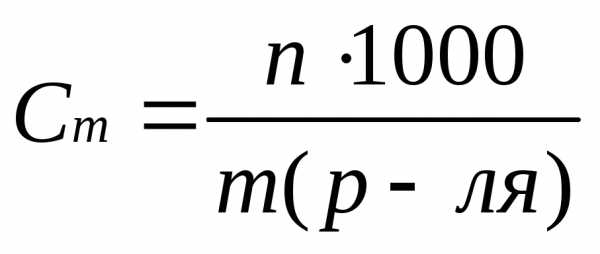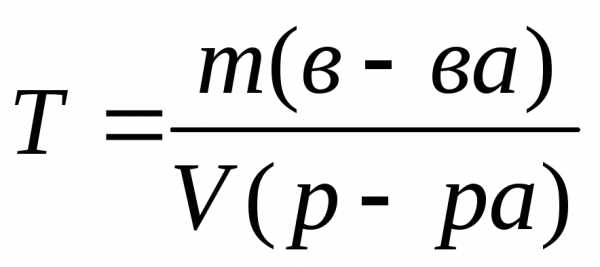Тема6 Растворы. Способы выражения концентрации растворов
Пример Найти массу AlCl3, необходимую для приготовления 2 л раствора этой соли с массовой долей 12%. Плотность раствора ρ=1090 кг/м3 (1090 г/л). Вычислите нормалльность (молярную концентрацию эквивалента), молярность (молярную концентрацию), моляльность и титр раствора.
Решение:
1. Масса раствора m(р-ра) = V ∙ρ, m(р-ра) = 2л∙1090 г/л = 2180 г
2. Массовая доля ω – число граммов растворенного вещества в 100 г раствора
Находим массу AlCl3 для приготовления 2 л раствора с массовой долей 12%.
3.
По таблице Менделеева находим молярную
массу AlCl3
(потребуется для расчета молярной
концентрации) и вычисляем молярную
массу эквивалента AlCl
М(AlCl3) = 27+3∙35,5=133,5 (г/моль) – молярная масса AlCl3,
МЭКВ(AlCl3) = 133,5/3 = 44,5 г/моль-экв – молярная масса эквивалента AlCl3.
Как найти эквивалет соли описано в главе 1.
Находим число молей AlCl3 (количество вещества) и число моль-эквивалентов
n(в-ва)=m(в-ва)/М(в-ва)=261,6 / 133,5 = 1,96 (моль)
nэкв(в-ва)=m(в-ва)/Мэкв(в-ва)= 261,6 / 44,5= 5,88 моль-экв
4. Находим молярную концентрацию СМ, т.е. число молей AlCl3 в 1 л раствора.
См = n / V = 1,96 /2 = 0,98 моль/л
5. Находим молярную концентрацию эквивалента (нормальность) СH, т.е. число эквивалентов вещества в 1 л раствора (моль-экв/л), т.е.
|
Сн = См для NaCl |
Сн = 3См для AlCl3 |
|
Сн = 2См для CaCl2, CuSO4 |
Сн = 6См для Al2(SO4)3 |
6. Находим моляльность раствора Сm, т.е. число молей растворенного вещества в 1 кг растворителя (моль/кг). Для этого найдем массу воды.
m(воды) = m(р-ра) – m(в-ва) = 2180,0 г – 261,6 г = 1918,4 г=1,92 кг
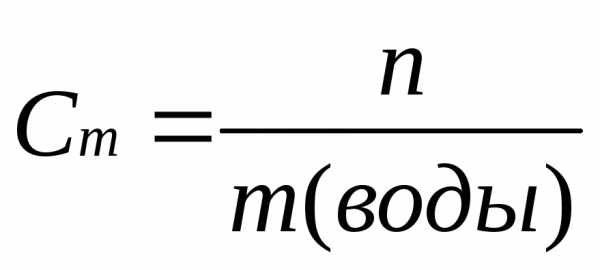 =
=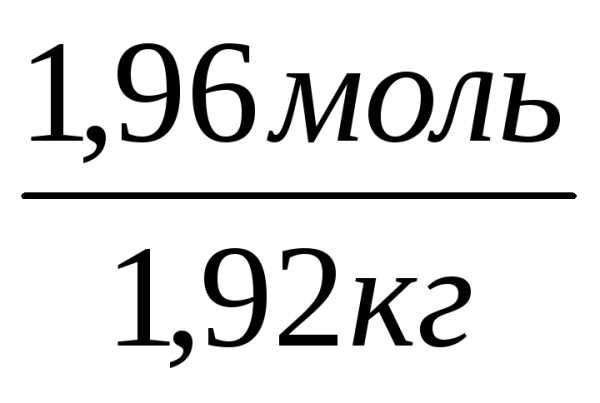 =
1,02 моль/кг.
=
1,02 моль/кг.
7. Находим титр раствора, т.е. массу (г) растворенного вещества, содержащегося в 1 мл раствора.
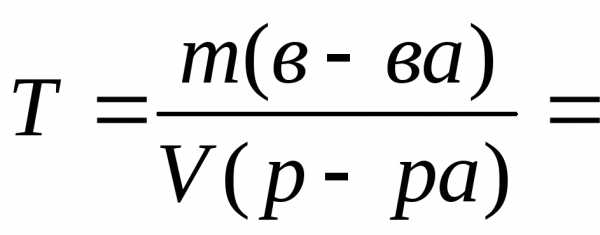
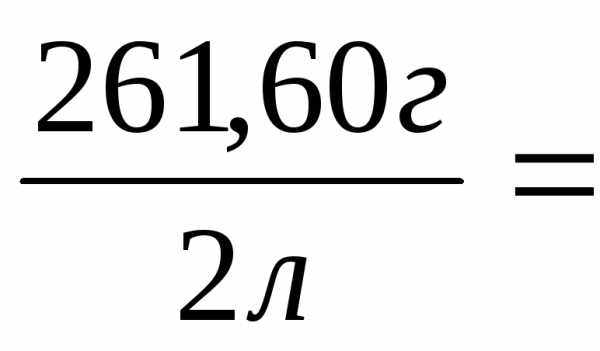 0,1308
г/мл.
0,1308
г/мл.Задание 6 контрольной работы
Найдите массу соли, необходимую для приготовления раствора объемом V л с массовой долей . Плотность раствора Вычислите молярную концентрацию эквивалента, молярную концентрацию, моляльность и титр этого раствора.
|
Вариант |
Соль |
V, л |
,% |
ρ, кг/м3 |
|
151 |
AlCl 3 |
0,5 |
6 |
1052 |
|
152 |
AgNO3 |
1,5 |
8 |
1069 |
|
153 |
AgNO3 |
0,8 |
6 |
1050 |
|
154 |
Al |
0,8 |
6 |
1061 |
|
155 |
Al2(SO4)3 |
1,5 |
4 |
1040 |
|
156 |
BaCl2 |
3,0 |
4 |
1034 |
|
157 |
BaCl2 |
0,3 |
2 |
1015 |
|
158 |
CaCl2 |
0,5 |
12 |
1083 |
|
159 |
CaCl2 |
0,9 |
4 |
1031 |
|
160 |
CuSO4 |
2,5 |
8 |
1084 |
|
161 |
CuSO4 |
0,65 |
2 |
1019 |
|
162 |
FeCl3 |
0,9 |
12 |
1085 |
|
163 |
FeCl3 |
1,7 |
6 |
1049 |
|
164 |
FeSO4 |
1,5 |
4 |
1037 |
|
165 |
FeSO4 |
3,5 |
8 |
1078 |
|
|
K2CO3 |
2,0 |
12 |
1090 |
|
167 |
K2CO3 |
0,6 |
2 |
1016 |
|
168 |
K2Cr2O7 |
2,5 |
8 |
1055 |
|
169 |
K2Cr2O7 |
0,4 |
6 |
1040 |
|
170 |
K2SO4 |
3,0 |
6 |
1047 |
|
171 |
K2SO4 |
1,2 |
12 |
|
|
172 |
MgSO4 |
4,0 |
4 |
1039 |
|
173 |
MgSO4 |
1,6 |
6 |
1060 |
|
174 |
Na2CO3 |
0,5 |
12 |
1102 |
|
175 |
Na2CO3 |
3,5 |
2 |
1019 |
|
176 |
Na2SO4 |
3,5 |
8 |
1072 |
|
177 |
Na2SO4 |
1,7 |
6 |
1053 |
|
178 |
Pb(NO3)2 |
1,5 |
6 |
1052 |
|
179 |
Pb(NO3)2 |
2,5 |
8 |
1072 |
|
180 |
Pb(NO3)2 |
0,5 |
12 |
1016 |
|
Таблица 5 Способы выражения содержания растворенного вещества в растворе | ||||
|
Название концентрации (синоним) |
Обозна-чение |
Способ выражения содержания растворенного вещества в растворе |
Формула |
Единица измерения |
|
Массовая доля (процентная концентрация) |
ω |
Отношение массы растворенного вещества к общей массе раствора |
где ρ – плотность раствора |
% |
|
Мольная доля |
Хi |
Отношение количества (числа молей) растворенного вещества к сумме количеств (числа молей) всех веществ, находящихся в растворе. |
, где Σ ni – сумма количеств (молей) всех веществ в растворе |
– |
|
Молярная концентрация (молярность) |
См, или М |
Количество (число молей) растворённого вещества в единице объёма раствора (в 1 литре) |
где М – молярная масса вещества |
моль/л, |
|
Молярная концентрация эквивалента (нормальная концентрация, нормальность) |
Сн, или N |
Количество эквивалентов (число молей эквивалентов) растворённого вещества в единице объёма раствора (в 1 литре) |
, где M =z∙Мэкв , z=1/fэкв Мэкв – молярная масса эквивалента, fэкв – фактор эквивалентности |
моль-экв/л |
|
Моляльная концентрация (моляльность) |
Сm |
Количество растворённого вещества (число молей) в 1000 г растворителя |
|
моль/кг |
|
Титр раствора |
Т |
Масса вещества, содержащегося в 1 мл раствора |
|
г/см3 кг/см3 |
studfiles.net
Перевод концентрации газов. ПДК газов. Переводные коэффициенты из мг/м3 в ppmv. Таблица для взрывоопасных и токсичных веществ по ГОСТ 51330.19-99, ГОСТ 12.1.005-88, ВСН 64-86Перевод единиц измерения концентраций газов и их взаимный пересчет
Перевод единиц измерения Концентраций газов и их взаимный пересчет:
Примечание:
| |||||||||||||||
www.dpva.ru
Концентрация вещества молярная — Справочник химика 21
В растворах, образованных жидкими и газообразными или твердыми веществами, жидкий компонент называется растворителем, а другой компонент-растворенным вешеством. Если раствор образован двумя жидкими веществами, это различие становится довольно условным, но вещество, присутствующее в большем количестве, обычно рассматривают как растворитель. Наиболее распространенным способом выражения концентрации раствора служит указание его молярной концентрации, или молярности, т. е. [c.76]I — толщина слоя, см С — концентрация вещества, моль/л е — молярный коэффициент поглощения (экстинкции), л/(моль-см). [c.50]
Для растворов каких веществ молярная и нормальная концентрации совпадают Приведите примеры. [c.42]
В выражении (4-15) символ с используется в двух смыслах во-первых, им обозначается молярная концентрация веществ (моль л ), а во-вторых,— число молей вещества С.] [c.184]
К 500 мл 0,2 М раствора азотнокислого алюминия добавили 900 мл 0,1 и. раствора щелочи. Рассчитайте молярную концентрацию веществ в растворе, если после отделения ссадка суммарный объем раствора уменьшился на 10 мл. [c.28]
По величине осмотического давления, найденной в предыдущей задаче, рассчитайте молярные концентрации веществ в крови, если известно, что 1/4 осмотического давления крови вызвана присутствием неэлектролитов, а 3/4 — солями, полностью распадающимися на 2 иона. [c.51]
Под растворимостью парафинов, так же как и под растворимостью других веществ вообще, подразумевается наибольшее количество вещества, которое способно раствориться в рассматриваемом растворителе при данной температуре. Другими словами, растворимость может быть определена как концентрация вещества, образующая в растворителе при данной температуре насыщенный раствор. Величина растворимости может выражаться в тех же единицах, как и концентрация, например количеством долей растворенного вещества в единице количества раствора. Числовое значение растворимости обычно обозначается буквой х. Часто величина растворимости выражается количеством долей растворенного вещества, приходящегося на единицу чистого растворителя и обозначается в этом случае буквой г. Растворимость может выражаться также молярными долями или х . Пересчет числовых значений растворимости из одной системы и другую проводится по следующим соотношениям [c.81]
Количественный анализ. После выяснения качественного состава продуктов изучаемой реакции необходимо определить их количественное соотношение. ИК-спектры (в отличие от спектров в УФ-области) приводятся в таблицах с точным указанием положения каждой полосы в спектре и приблизительным описанием интенсивности полос (сильная, средняя, слабая и т. п.). Количественная характеристика — молярный коэффициент поглощения — обычно не приводится. Поэтому невозможно точно определить концентрацию вещества по ИК-спектру, используя только табличные данные. Это можно объяснить сложностью количественных изменений при работе с кюветами для ИК-измерений, а также спецификой ИК-спектрометра. [c.213]
Введем следующие обозначения [ А]о —исходная концентрация вещества РА] — концентрация триплетных состояний [ А] —концентрация невозбужденных молекул ет, ео —молярные коэффициенты экстинкции триплетного состояния и исходного соединения. Учитывая, что [ А]о = [ А]-1-РА], и выражая концентрацию триплетных молекул через оптическую плотность, получим следующее уравнение [c.187]
Концентрации вещества часто выражаются в весовых единицах введение их в уравнения (2-349) и (2-350) вместо молярных долей, которыми обычно пользуются, требует известных преобразований. При этом следует исходить из общих соотношений между этими концентрациями [c.248]
Таким же уравнением в симметричной системе стандартных состояний определяется энтропия растворенного вещества. В несимметричной системе стандартных состояний и для моляльных концентраций парциальная молярная энтропия растворенного вещества будет равна [c.379]
Пусть G — некоторое свойство (давление, оптическая плотность при некоторой длине волны и т. п.), пропорциональное концентрации вещества, и пусть Ga и Gq. — соответствующие молярные величины (т. е. парциальное давление при концентрации 1 моль л, оптическая плотность раствора при концентрации 1 моль л и т. п.) для А и Bj. Тогда [c.156]
Чтобы расположить в ряд по уменьшению электропроводности растворы приведенных веществ, нужно перейти от процентной концентрации к молярной и учесть количество ионов, образующихся при диссоциации сильных электролитов (хлористый магний, сернокислая медь, азотнокислый цинк), и степень диссоциации слабых электролитов (муравьиная кислота). Глицерин — не электролит. [c.210]
Молярная концентрация, или молярность (М), — количество молей растворенного вещества в 1 л раствора [c.33]
Молярной концентрацией вещества называется отношение его количества (числа моль п), содержащегося в систе и, к объему У системы с= п/У. [c.15]
Для смесей и растворов часто в качестве стандартного выбирают состояние идеальной смеси или раствора с концентрацией вещества, равной единице (молярности или моляльности). [c.38]
Молярная концентрация с(Х) — отношение количества вещества X (моль) к объему раствора. В СИ основной единицей является молярная концентрация моль/м , а рекомендуемой для практики единицей является моль/дм или моль/л. Термин молярная концентрация распространяется на концентрацию любых частиц, например молярная концентрация молекул, молярная концентрация ионов и т. п. Например, с (НС1) = =0,1 моль/л, с(Н ) = 1 моль/л. Использование термина молярность не рекомендуется. Однако термин молярный сохраняется. [c.23]
Как определяют концентрацию вещества фотометрическим методом, используя среднее значение молярного коэффициента погашения [c.137]
На практике состав растворов выражают с помощью следующих величин безразмерных — массовая и молярная доли и размерных — молярная концентрация вещества, молярная концентрация вещества эквивалента, мо-ляльность и массовая концентрация вещества. [c.115]
Свойства раствора определяются качественным и количественным составом раствора. На практике количественный состав растворов выражают при помощи следующих величин а) безразмерных -массовая, объемная и молярная доли б) размерных — массовая концентрация вещества, молярная концентрация вещества, молярная концентрация эквивалента вещества и молялъностъ. [c.58]
Если концентрация поглощающего вещества выражена в молях иа 1 л и толщина слоя I в сантиметрах, то величина е, являю цаяся коэффициентом пропорциональности между оптической плотностью и концентрацией вещества в растворе илн толщиной поглощающего слоя, называется молярным коэффициентом светопоглощения. При С — ] М и I = ] см г представляет собой О одномолярного раствора, помещенного в кювету с / = 1 см (е — О). [c.462]
У денствптелыгостп стандартное состояние но может быть состоянием прп бесконечном ра. шеденни, так как оно должно представлять собой определенное термодинамическое состояние с фиксированным составом. Мы понимаем иод бесконечным разведением такое состояние системы, в котором взаимодействие между частицами растворенного вещества пренебрежимо мало, и в реальном стандартном состоянии система будет иметь, следовательно, некоторый состав, отвечающий этому идеальному условию. На практике чаще всего для обозначения концентрации пользуются молярностями, а за стандартное состояние обычно выбирается гипотетический одномолярный раствор , т. е. 1 М раствор, в котором взаимодействие растворенного вещества и растворителя равно нулю. [c.431]
Пример 10 [26]. Изучалась реакция, протекающая по схеме А + В + С- В в ьодно-спиртовом растворе. На качество и количество продукта О (у) влияли следующие факторы 2, — время реакции, ч 2а — содержание спирта в водно-спгртовом растворе, мол. доли гз — концентрация вещества С, мол. доли 24 — колцентрация вещества В, мол. доли 25 — молярное соотношение веществ В и А. Основной уровень и интервалы варьирования факторов приведены ниже [c.228]
Смещение равновесия под влиянием изменения давления определяется изменением объема, которое происходит в процессе реакции. Для газовых реакций изменение объема можно определить, принимая во внимание, что молярные объемы различных газов при одинаковых условиях также одинаковы. Таким образом, если реакция идет с уменьшением числа молей (реакция соединения), то ее течение сопровождается уменьшением объема. В тоже время повышение давления при постоянной температуре и постоянных количествах реагирующих веществ осуществляется посредством сжатия системы, т. е. уменьшения ее объема. При этом, очевидно, увеличиваются концентрации всех составляющих систему веществ. Изменение концентрации веществ сильнее сказывается на скорости той из обратимых реакций, когорая идег с уменьшением числа молей. Следовательно, при увеличении давления равновесие сментается в направлении реакции, идущей с уменьшением числа молекул, и, наоборот, понижение давления вызывает смешение равновесия в сторону реакции с увеличением числа молекул. Значительные изменения объема могут происходить только в реакциях, в которых участвуют газы, т. е. когда хотя бы одно нз [c.103]
Если подобрать эталонный раствор известного вещества и определенной молярной концентрации так, чтобы растворитель не перегонялся из него в ту часть прибора, в которой помещен раствор с исследуемым веществом, то в этом случае изотермическая перегонка паров растворителя будет идти в обратном направлении, т. е. пз раствора исследуемого вещества к эталонному раствору до тех нор, пока не установится равновесие между обоими растворами. Равновесие же наступит тогда, когда будет достигнуто равенство молярных концентраций (долей) компонентов в эталонном и исследуемом растворах. Зная молярную концентрацию вещества в эталонном растворе, определяют и равную ей молярную концентрацию раствора исследуемого вещества, и весо- вую концентрацию последнего. Исходя из этих данных вычисляют молекулярный вес исследуемого вещества. В качестве растворителя в опытах использовался толуол, а в качестве эталонного вещества — азобензол. Размер капель в приборе измерялся с помощью микроскопа. При обеспечении достаточной нрецезионности измерения размеров капель метод этот представляется перспективным. [c.81]
При монохроматическом излучении и отсутствии наложения соседних полос ИК-полоса характеризуется положением максимума Vм. к , пропусканием Т = 1Ио (%) или оптической плотностью D = g(Io l), коэффициентом молярного поглощения в максимуме вмаг.о = П1С1 (л/моль-см), где С — концентрация вещества, моль/л [c.213]
К 1000 лл 0,2 н. раствора хлористого бария прибавлено 88,5 мл 14,2%-ного раствора сернокислого натрия (плотность 1,13). Определите молярную концентрацию вещества, содержащегсся в растворе, если после отделения ссадка суммарный объем раствора уменьшился на 13,5 мл. [c.28]
Как мы уже знаем, химическая формула вещества, заключенная в квадратные скобки, например [N113], означает концентрацию данного вещества. Для реакций в растворах концентрации обычно выражают в молях на литр, т. е. указывают молярную концентрацию, или молярность. Для реакций в газовой фазе в качестве единиц измерения концентрации можно также пользоваться молярностью, но можно наряду с этим измерять концентрации парциальными давлениями соответствующих газов, выраженными в атмосферах. При использовании молярных концентраций константу равновесия обозначают символом К а при измерении концентраций газообразных веществ в атмосферах константу равновесия обозначают символом Поскольку численные зна- [c.46]
Выведите формулу для расчета задач типа В каком объемном отношении нужно смешать Л-нормальный и В-нормальный растворы некоторого вещества для получения С-нбрмального раствора Будет ли такая формула справедливой, если нормальную концентрацию заменить молярной [c.31]
Коэффициент к называют коэффициентом поглощения его определяет электронное строение поглощающего соединения. Абсолютное значение коэффициента к зависит от способа выражения концентрации вещества в растворе и толщины поглощающего слоя. Если концентрация выражена в моль/л, а толщина слоя в см, то коэффициент поглощения называется молярным коэффициентом погашения (е) при с=1М и /=1 см величина е = Л, т. е. молярный коэффициент погашения численно равен оптической плотности раствора с концентрацией 1 М, помещенного в кювету с толщиной слоя 1 см. Его размерность — МОЛЬ Xсм2 — безразмерная величина). [c.47]
Количество вещества (символ п ) измеряют в молях. Моль -это количество вещества, содержащее столько реальных или условных частиц, сколько атомов содержится в 0,012 кг углероц-12. При использовании моль как единицы количества вещества нужно указывать, какие именно реальные или условные частиЩ) имеются в виду. Под реальными частицами подразумевают атомы, ионы, молекулы, радикалы, электроны и т.п., а под условными частицами (УЧ) такие, как, например, 1/2 молекулы Н2 0 , 1/6 молекулы К2СГ2О7, 1/5 молекулы КМпО/ и т.п. Молярная концентрация вещества может бьггь также выражена [c.49]
Эта формулировка в более общей форме была дана позднее Гульдбергом и Вааге (1867) скорость химической реакции пропорциональна действующим массам. Под действующими массами понимаются молярные концентрации веществ, участвующих в реакциях. [c.181]
Раствором называется однофазная система, образованная не менее чем двумя компонсрпами и способр1ая в известных пределах к непрерывному изменению состава. Состав раствора или его концентрацию чаще всего выражают в молях растворенного вещества на один литр раствора (молярная концентрация), в молях растворенного вещества иа 1000 г растворителя (моляльная концентрация), в молярных долях или в весовых процентах. Для перехода от одного способа выражения концентрации раствора к другому необходимо знать молекулярные веса компонентов и, в некоторых случаях, плотность раствора (при переходе от весовой концентрации к объемной и обратно). [c.180]
chem21.info
Способы выражения концентрации растворов
Многие химические реакции протекают в растворах. Растворы – это гомогенные (состоящие из одной фазы) многокомпонентные смеси переменного состава. Растворы могут быть газообразными, жидкими и твердыми. Среди соединений, образующих раствор, условно выделяют растворенные вещества и растворитель. Растворителем принято считать компонент, который в чистом виде существует в том же агрегатном состоянии, что и образовавшийся раствор, или компонент, содержание которого в растворе выше содержания остальных компонентов, называемых растворенными веществами. Наибольшее практическое значение имеют жидкие растворы, в частности водные, в которых растворителем является вода.
Для выражения состава раствора и содержания растворенного вещества применяют различные способы.
1. Массовая доля компонента ωi – отношение массы i-го компонента mi к массе раствора
(11),
где ωi– безразмерная величина, принимающая значения от 0 до 1 или от 0 до 100 % (в последнем случае говорят о процентной концентрации).
2. Молярная (мольная) доля компонента Xi – отношение числа молей i-го компонента ni к сумме молей всех компонентов, образующих раствор, безразмерная величина
(12).
3. Моляльная концентрация, или моляльность, Сm – число молей n растворенного вещества, приходящихся на 1 кг растворителя, моль/кг:
(13).
где m – масса растворенного вещества, г; М – молярная масса растворенного вещества, г/моль; mS –масса растворителя, кг.
4. Молярная концентрация, или молярность, С – число молей n растворенного вещества в 1 л раствора, моль/л, или сокращенно М:
(14),
где V – объем раствора, л; m – масса растворенного вещества, г; М – молярная масса растворенного вещества, г/моль.
5. Молярная концентрация химического эквивалента, или нормальная концентрация, или нормальность, Сэкв – число молей химического эквивалента nэкв растворенного вещества в 1 л раствора, моль экв/л, или сокращенно н.:
(15),
где Мэкв – молярная масса химического эквивалента растворенного вещества, г/моль экв; zэкв – число эквивалентности растворенного вещества; V – объем раствора, л; m – масса растворенного вещества, г; М – молярная масса растворенного вещества, г/моль.
6. Массовая концентрация, Смасс – масса растворенного вещества m в 1 л раствора, г/л:
(16),
где V – объем раствора, л.
Можно применять и другие способы выражения состава раствора. Например, в справочниках растворимость данного вещества, т.е. состав насыщенного раствора, выражают как отношение массы растворенного вещества к массе растворителя.
При проведении химических реакций часто требуется использовать растворы определенной концентрации. Для приготовления раствора заданной концентрации взвешивают необходимую массу (отмеряют необходимый объем) чистых компонентов раствора. Также можно использовать более концентрированные растворы известной концентрации, в частности, фиксаналы – растворы, помещенные в герметичные ампулы заводского производства, содержащие строго определенное (обычно 0,1 моль) количество химического соединения.
При расчете массы (объема) компонентов раствора учитывают соотношения между различными способами выражения его состава, например, представленные в таблице 1 соотношения концентраций бинарного раствора, то есть раствора, состоящего из двух компонентов – растворителя и растворенного вещества.
Таблица 1
Соотношения между различными способам выражения состава бинарного раствора
Примечание: ρ – плотность раствора данного состава, г/л.
Похожие статьи:
poznayka.org
Концентрация вещества — Справочник химика 21
Применение метода абсорбционной спектроскопии не ограничивается только определением концентраций веществ. В результате поглощения излучения энергия систем з1 меняется настолько незначительно, что это не приводит обычно к нарушению целостности молекул поглощающего вещества. Однако в результате смещения химического равновесия в растворе под влиянием различных факторов его поглощающие свойства могут изменяться весьма значительно. На этом основано применение метода абсорбционной спектроскопии для изучения равновесий в растворах, реакций гидролиза и полимеризации, определения состава комплексных соединений, их констант устойчивости и т. п. . В данной главе рассматривается только метод абсорбционной спектроскопии как один из методов количественного анализа. [c.458]Необратимая реакция первого порядка. Необратимая реакция диссоциации первого порядка может быть записана в виде А —> продукты, так как ее скорость не зависит от числа и концентрации продуктов реакции. Если с — концентрация вещества А и реакция имеет первый порядок по этому веществу, то скорость уменьшения с, очевидно, пропорциональна самой величине с. т. е. [c.91]
Предположим теперь, что к реакционной смеси добавляется дополнительное количество вещества А или В (или того и другого) и что объем смеси при этом не меняется. Концентрация вещества А и В (или того и другого) в этом случае увеличивается, и вероятность столкновения молекул возрастает (подобно тому как в час пик, когда автострада забита машинами, вероятность их столкновения намного больше, чем ранним утром, когда машин относительно мало). [c.112]
Таким образом, с повышением концентрации вещества А или В (или того и другого) скорость 1 увеличивается, а с уменьшением концентрации снижается. Точно так же с ростом концентрации вещества С или О (или и С, и О) увеличивается скорость 2. Меняя скорость 1 или 2, можно изменить состав равновесной смеси. С изменением концентрации любого из участвующих в реакции веществ меняется положение точки равновесия. [c.112]
Гиббс также показал, что с изменением концентрации веществ, образующих эту систему, свободная энергия системы до некоторой степени меняется. Поэтому если свободная энергия, определенная при стандартных значениях концентраций, для А+В ненамного отличается от свободной энергии С+О, то даже небольшие изменения концентрации могут привести к тому, что свободная энергия А+В окажется больше или меньше, чем свободная энергия С+О. В такой системе направление реакции определяется соотношением концентраций, но и в том, и в другом направлении реакция пойдет самопроизвольно. [c.113]
Влияние концентрации. Адсорбция тех или иных молекул или ионов возрастает с увеличением их концентрации в растворе, однако не пропорционально концентрации, а более медленно, как следует из рис. 16. По изотерме адсорбции (см. риС. 16) можно установить, что 1) степень адсорбции падает с увеличением концентрации вещества в растворе 2) с увеличением концентрации вещества в растворе увеличивается абсолютное количество адсорбированного вещества и 3) с увеличением концентрации вещества в растворе количество адсорбированного вещества стремится к некоторому конечному значению. [c.111]
В начальный момент времени на любых расстояниях от поглотителя концентрация вещества одна и та же и равна начальной [c.147]
С другой стороны, с изменением общей концентрации вещества может изменяться число поглощающих частиц данного вида в результате полимеризации или диссоциации. [c.467]
Определить, во сколько раз изменится (уменьшится нли увеличится) скорость химической реакции Л(г)+В(г)+С(г) =D(r) в тот момент, когда концентрация вещества А уменьшится на 10% по сравнению со скоростью в первоначальный момент. Исходные концентрации веществ равны [А] = 1 кмоль/м , [В] =2, [С] = = 0,8 кмоль/м . [c.102]
Строчные буквы — концентрации веществ, обозначенных соответствующими заглавными буквами). [c.80]
Методы измерения поглощения излучений и расчета концентраций веществ в растворах [c.474]
Здесь концентрация вещества уменьшается и в анодном, и в катодном пространствах. Сохраняя прежние обозначения, теперь можно написать [c.108]
Для увеличения движущей силы процесса, равной разности между действующей концентрацией вещества в передающей фазе Сд и равновесной концентрацией этого вещества над воспринимающей фазой Ср, необходимо [c.97]
Хотя мы и не касаемся непосредственно механизма реакций, нри обсуждении вопроса, является ли стехиометрическое уравнение данной реакции полным, существенную помощь могут оказать простейшие представления о ее механизме. Пусть, например, реакция Л —> 5 идет в присутствии катализатора, например, энзима Е. Будем считать, что процесс в действительности проходит в две стадии сначала А и Е образуют комплекс С, а затем С диссоциирует на В VI Е. Тогда реакция А В заменяется на две реакции А Е С и С —> 5 -Ь . Если скорость реакции зависит только от текущих (мгновенных) концентраций веществ А и В, уравнение реакции А В является полным. Скорость реакции может также зависеть от фиксированной начальной или общей концентрации энзима, и тогда эта концентрация будет параметрической переменной. Но если скорость реакции зависит от мгновенной концентрации комплекса С или энзима Е, уравнение реакции Л —> i не будет полным. Можно предположить, что концентрация комплекса С всегда постоянна, Г и, таким образом, исключить ее из кинетического закона, выразив скорость реакции А В только через концентрации этих двух ве-. л ществ или одного из них. К сожалению, гипотезы подобного рода почти никогда не оправдываются в точности. Например, если в на-чальный момент в системе нет комплекса С, должно пройти некоторое время прежде чем будет достигнута его стационарная концентрация, которая хотя и не является строго постоянной, но сравнительно медленно меняется во времени. Б некоторых случаях период индукции бывает очень коротким, так что гипотеза о постоянстве концентрации комплекса С выполняется в течение почти всего периода реакции и выведенный с ее помощью кинетический закон находится в достаточно хорошем соответствии с экспериментальными данными. При необходимости уравнения таких реакций могут быть выделены в особый класс почти полных , но такое выделение вызывает возражения в теоретическом отношении, хотя и может оказаться практически полезным. [c.17]
Мольная концентрация. Если в объеме V находятся Nj молей вещества Aj, то мольная концентрация вещества А — равна [c.26]
Су —мольная концентрация вещества А,, моль/ед. объема. [c.37]
Су —мольная концентрация вещества Aj, моль ед. объема. [c.61]
Aj — j-e химическое вещество. j, суо —концентрация п исходная концентрация вещества Aj. [c.86]
Таким образом, концентрация вещества А экспоненциально спадает до нуля, а концентрации продукта или продуктов реакции растут пропорционально их стехиометрнческим коэффициентам и количеству израсходованного вещества А. Последнее определяется соотношением [c.91]
Упражнение V.2. Для реакции А — В измерена концентрация вещества А как функция времени при различных исходных составах а , Ь , но при одинаковой суммарной концентрации о + Ьд = I. Покажите, что для реакции [c.93]
Если диссоциация А —> продукты идет ио п-му порядку, концентрация вещества А удовлетворяет уравнению [c.94]
Л4 = О протекает изотермически со скоростью г = 9с с — (где с, — концентрация вещества А,). Смесь, состоящая из равных количеств А и А , начинает реагировать в момент = О, и к моменту концентрация вещества А1 достигает доли [.1 от своего равновесного значения. Покажите, что [c.98]
Если обозначать концентрации веществ соответствующими строчными буквами, то [c.110]
В предыдущей главе мы видели, как изменяется скорость реакции с изменением состава и температуры реагирующей смеси. В этой главе мы хотим исследовать измененпе состава в ходе реакции. Так как скорость реакции зависит от температуры по закону Аррениуса и эта зависимость сильно нелинейна, то мало надежды решить в явном виде любое уравпенпе процесса, протекающего при переменной температуре. Поэтому здесь мы будем рассматривать только изотермические реакции, обозначая буквой к (с различивши индексами) константы скоростп реакции, которые в данном случае действительно постоянны в ходе реакции. Остающаяся нелинейность уравнений зависит от порядка реакции. В качестве зави-симо11 переменной мы будем использовать иногда концентрацию вещества, а иногда — степень полноты реакцип. Обе эти переменные равноправны, однако всегда следует применять ту из них, введение которой максимально упрощает задачу. Проводить общие исследования, по-видимому, удобнее, применяя степени полноты реакцпп, так как при этом используется стандартный метод, позволяющий избежать ошибок при анализе сложных систем. В простейших случаях уравнения часто становятся менее громоздкими, если их выразить через концентрации реагентов. [c.88]
Несмотря на очевидную симметрию этих стадий относительно стадии 4 — химической реакции, анализировать такой процесс очень трудно. Так, скорость стадии 1 зависит от концентрации вещества А в ядре потока и у внешней поверхности частицы При анализе стадии 2 величина является граничным условием, а концентрация внутри пор катализатора — зависимой переменной. Стадия 3 зависит от а и концентраций адсорбированных веществ [c.123]
В 1863 г. норвежские химики Като Максимилиан Гульдберг (1836—1902) и Петер Вааге (1833—1900) опубликовали брошюру, в которой излагали свою точку зрения на причины, определяющие направление течения самопроизвольных реакций. Эти ученые вернулись к предположению, высказанному Бертолле (см. гл 4) за полстолетия до этого Бертолле считал, что направление реакции зависит от массы участвующих в ней отдельных веществ. Гульдберг и Вааге полагали, что направление реакции определяется не просто массой отдельных веществ, а скорее массой отдельных веществ, приходящейся на данный объем реагирующей смеси, другими словами — концентрацией веществ. [c.111]
Приведенное уравнение справедливо для широкого диапазона концентраций. Вещество А может присутствовать в водном растворе и органическом растворителе в различных формах (например, в виде простых и комплексных ионов, между которыми существует равновесие). Поэтому с практической точки зрения важна величина кажущейся константы распределения, т. е. отношение yм apнoй концентрации всех форм вещества А в органическом растворителе к суммарной концентрации всех форм вещества А в водном растворе. [c.129]
Действительно, если взятые окислитель и восстановитель соответственно сильнее восстановителя и окислителя, образующихся при реакции, это значит, что Еок — / вос >0. В таком случае lg/( > О и /( > 1. Это показывает, что произведение концентраций веществ, образующихся в результате реакции, при равновесии больше, чем произведение концентрации непрореагировавших веществ, т. е. что реакция идет в направлении слева направо (—> ) и при достаточно большой разности стандартных потенциалов дойдет практически до конца. Наоборот, если Еок абсолютная величина разности стандартных потенциалов обеих пар. [c.359]
Если концентрация поглощающего вещества выражена в молях иа 1 л и толщина слоя I в сантиметрах, то величина е, являю цаяся коэффициентом пропорциональности между оптической плотностью и концентрацией вещества в растворе илн толщиной поглощающего слоя, называется молярным коэффициентом светопоглощения. При С — ] М и I = ] см г представляет собой О одномолярного раствора, помещенного в кювету с / = 1 см (е — О). [c.462]
Закон дсйстпня масс п его классической форме применим только к неэлектролитам и слабы.м электролитам и разбавленных нодных растворах. В случае применения закона действия масс к сильным электро.штам вместо ранновссных концентраций веществ подставляют н.к активности, т. с. произведение иеличнн равновесных концентраций на коэффициенты пх активностей. [c.92]
Химикам часто необходимо выяснить, является ли данная реакция на самом деле конечным результатом некоторого числа промежуточных реакций. В прикладной химической кинетике такие вопросы не рассматриваются все, что нам нужно — это иметь кинетический закон, пригодный для использования. Мы еще не дали точного определения скорости реакции, но можно полагать, что это скорость, с которой продукты образуются из реагентов. Скорость реакции зависит от состава реагирующей смеси, температуры, давления, и, возможно, от других величин, например, от характера и интенсивности радиации. Далее мы будем называть температуру и давление или любую эквивалентную комбинацию этих двух величин термодинамическими переменными, а величины тина pH или концентрации катализатора — параметрическими переменными. Меры состава или концентрации реагирующих веществ будут определены ниже. Урав-ненне (II. 4) является полным, если в кинетический закон описываемой им реакции, кроме концентраций веществ А ,. .., 4 , не входят никакие другие концентрации. Когда необходимо принимать во [c.16]
Суо —исходная мольная концентрация вещества А,, моль1ед. объема. [c.37]
Следовательно, приближение к равновесию всегда носит характер экспоненциального спада п затухающие колебания не возникают. Это является общим свойством всех процессов установления химического равновесия. Принцип микроскопической обратимости (называемый также принципом детального равновесия) утверждает, что при равновесии сложной системы химических реакций каждая отдельная реакция должна находиться в равновесии. Это исключает возможность образования непрерывных циклов, например цепи реакций А В С А, скорости которых таковы, что концентрации всех веществ остаются постоянными. Таким образом, очевидно, что, приближаясь к равновесию, разность между текущими концентрациями веществ и их равновесными значениями затухает экспоненциально, а не путем затухающих колебаний. Конечно, в ходе реакции концентрации некоторых веществ могут проходить через максимумы или минимумы, прежде чем достигнуть своих равновесных значений. Однако число таких экстремумов ограничено (их может быть не более В — 1 в процессе, включающем Я независпмых реакций), в то время как в случае затухаюшцх колебаний чпсло максимумов и минимумов бесконечно. [c.78]
Упражнение У.23. Найдите концентрации веществ X, V, Р тл. Q как функ-ции времени для системы реакций Денбига [c.105]
chem21.info
Расчет концентрации вещества
Для упрощения расчетов пользуются коэффициентами К (приложение 1), вычисленными для температур в пределах от 6 до 40 °С и давлений от 97,33 до 104,0 кПа (730—780 мм рт. ст.).[ …]
В сборниках технических условий на методы определения вредных веществ и некоторых методических указаний и во многих практических руководствах по санитарной химии в составе приложений имеются таблицы коэффициентов пересчета объема воздуха к нормальным условиям (0°С и 760 мм рт. ст.).[ …]
Численные значения коэффициентов в этих таблицах приведены с точностью до четвертого знака для температур от 5 до 40 °С с интервалом в 1° и давлений от 730 до 780 мм рт. ст. с интервалом в 2 мм рт. ст.[ …]
Однако нет практической необходимости в столь многозначных и слишком подробных таблицах, так как максимальная погрешность четырехзначных коэффициентов составляет всего лишь ±0,006 %. Согласно ГОСТу 12.1.005—76, погрешность измерения объема воздуха не должна превышать ±10%, поэтому точность коэффициентов пересчета на уровне ± 1 % следует считать вполне достаточной. С целью устранения резкого различия в точности измерения и связанных с ним вычислений в «Руководстве по контролю загрязнения атмосферы» (1979) в подобной таблице коэффициенты вычислены с точностью до второго знака для температур и давлений с интервалом в 5 ед. Погрешность цифр этой упрощенной таблицы достигает ±2 % и может несколько возрасти при вычислении коэффициентов для промежуточных значений Р и 1.[ …]
Если проба воздуха отобрана в газовую пипетку, бутыль, шприц и др., расчет концентрации ведется с учетом объема с поправкой на температуру и давление воздуха в точке отбора пробы.[ …]
Автоматические и полуавтоматические газоанализаторы, применяемые для определения газов и паров, в большинстве случаев дают возможность получить сведения о содержании веществ в объемных процентах (Тхоржевский В. П., 1969].[ …]
В связи с этим возникает необходимость пересчета объемных долей на концентрации, выраженные в мг/м3 с учетом стандартных условий: температуры 20 °С и давления 101,33 кПа (760 мм рт. ст.).[ …]
В табл. 6 приведены формулы пересчета концентраций газов и паров из одной размерности в другую.[ …]
Примечание, а — численное значение концентрации в исходной разности; Ь — то же в искомой размерности; М — молекулярная масса вещества, г/моль.[ …]
Фактор пересчета находят по месту пересечения строки исходной концентрации с графой искомой размерности.[ …]
Вернуться к оглавлениюru-ecology.info
Расчеты при приготовлении растворов молярной и нормальной концентрации
Для приготовления растворов молярной и нормальной концентрации навеску вещества отвешивают на аналитических весах, а растворы готовятся в мерной колбе. При приготовлении растворов кислот нужный объем концентрированного раствора кислоты отмеряют бюреткой со стеклянным краном.
Навеска растворяемого вещества подсчитывается с точностью до четвертого десятичного знака, а молекулярные массы берутся с точностью, с которой они приведены в справочных таблицах. Объем концентрированной .кислоты подсчитывается с точностью до второго десятичного знака.
Пример 1. Сколько граммов хлорида бария необходимо для приготовления 2 л 0,2 М раствора?
Решение. Молекулярная масса хлорида бария равна 208,27. Следовательно. 1л 0,2 М раствора должен содержать 208,27-0,2= = 41,654 г ВаС12. Для приготовления 2 л потребуется 41,654-2 = 83,308 г ВаС12.
Пример 2. Сколько граммов безводной соды Na2C03 потребуется для приготовления 500 мл 0,1 н. раствора?
Решение. Молекулярная масса соды равна 106,004; эквивалент-пая масса 5Na2C03 =М : 2 = 53,002; 0,1 экв. = 5,3002 г.
1000 мл 0,1 н. раствора содержат 5,3002 г Na2C03
500 »» » » » х » Na2C03
5,3002-500
х=—— Гооо—- = 2-6501 г Na2C03.
Пример 3. Сколько концентрированной серной кислоты (96%: d=l,84) требуется для приготовления 2 л 0,05 н. раствора серной кислоты?
Решение. Молекулярная масса серной кислоты равна 98,08. Эквивалентная масса серной кислоты 3h2so4 =М : 2=98,08 : 2 = 49,04 г. Масса 0,05 экв. = 49,04-0,05 = 2,452 г.
Найдем, сколько H2S04 должно содержаться в 2 л 0,05 н. раствора:
1 л—2,452 г H2S04
2 »— х » H2S04
х = 2,452-2 = 4,904 г H2S04.
ЧтобА определить, сколько для этого надо взять 96,% раствора H2S04, составим пропорцию:
\ в 100 г конц. H2S04—96 г H2S04
У » » H2S04—4,904 г H2S04
4,904-100
У =——— §6—— = 5,11 г H2S04.
Пересчитываем это количество на объем: ,. Р 5,11
К= 7 = ТЖ =2‘77мл—
Таким образом, для приготовления 2 л 0,05 н. раствора надо взять 2,77 мл концентрированной серной кислоты.
Пример 4. Вычислить титр раствора NaOH, если известно что его точная концентрация равна 0,0520 н.
Решение. Напомним, что титром называется содержание в 1 мл раствора вещества в граммах. Эквивалентная масса NaOH=40 01 г Найдем, сколько граммов NaOH содержится в 1 л данного раствора:
40,01-0,0520 = 2,0805 г.
2,0805
1итр раствора: -щ=- =0,00208 г/мл. Можно воспользоваться также формулой:
9N
~ 1000 •
где Т — титр, г/мл; Э — эквивалентная масса; N — нормальность раствора.
Тогда титр данного раствора:
ф 40,01 0,0520
«NaOH =——— jooo—— 0,00208 г/мл.
„ «РиеР 5— Вычислить нормальную концентрацию раствора HN03, если известно, что титр данного раствора равен 0,0065 Для расчета воспользуемся формулой:
Т ■ 1000 63,05
5hno3 = j— = 63,05.
Нормальная концентрация раствора азотной кислоты равна:
„ 0,0065-1000
—V= 63,05 = 0,1030 н.
Пример 6. Какова нормальная концентрация раствора, если известно, что в 200 мл этого раствора содержится 2,6501 г Na2C03
Решение. Как было вычислено в примере 2, Зма2со(=53,002.
Найдем, сколько эквивалентов составляет 2,6501 г Na2C03: Г
2,6501 : 53,002 = 0,05 экв. /
Для того чтобы вычислить нормальную концентрацию раствора, составим пропорцию:
200 мл содержат 0,05 экв.
1000 » » х »
1000-0,05
х =—————— =0,25 экв.
В 1 л данного раствора будет содержаться 0,25 эквивалентов, т. е. раствор будет 0,25 н.
Для такого расчета можно воспользоваться формулой:
Р-1000
где Р — количество вещества в граммах; Э — эквивалентная масса вещества; V — объем раствора в миллилитрах.
Зыа2со3=53,002, тогда нормальная концентрация данного раствора
2,6501-10С0 N= 53,002-200
505days.com

 ,
, ,
,