Готовимся к углубленному изучению химии : 10.4 Карбоновые кислоты
10.4. Карбоновые кислоты Карбоновые кислоты – это кислородсодержащие органически вещества, молекулы которых содержат одну или несколько карбоксильных групп (-СOOH), соединённых с углеродным радикалом или водородным атомом. Карбоксильная группа содержит две функциональные группы – карбонил >С=О и гидроксил -OH, непосредственно связанные друг с другом: Классификация А) По числу карбоксильных групп в молекуле| 1) Одноосновные | Метановая, муравьиная кислота Этановая, уксусная кислота |
| 2) Двухосновные | Щавелевая кислота |
|
3) Многоосновные |
| 1) Предельные (насыщенные) | Метановая, муравьиная кислота Этановая, уксусная кислота |
| 2) Непредельные | Акриловая кислота Кротоновая кислота СН3–СН=СН–СООН Олеиновая СН3–(СН2)7–СН=СН–(СН2)7–СООН Линолевая СН3–(СН2)4–(СН=СН–СН2)2–(СН2)6–СООН Линоленовая СН3–СН2–(СН=СН–СН2)3–(СН2)6–СООН |
| 3) Ароматические | С6Н 5СООН – бензойная кислота НООС–С6Н4–СООН Пара-терефталевая кислота |
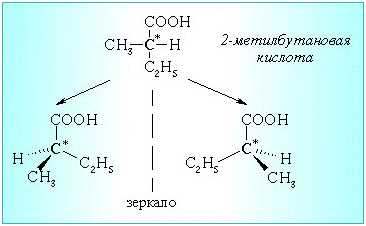 Б) Цис-
транс – изомерия для непредельных кислот
Номенклатура карбоновых кислот
Систематические
названия кислот даются по названию соответствующего углеводорода с добавлением
суффикса -овая и слова кислота.
Чтобы
указать положение заместителя (или радикала), нумерацию углеродной цепи
начинают от атома углерода карбоксильной группы. Например, соединение с разветвленной
углеродной цепью (CH
Б) Цис-
транс – изомерия для непредельных кислот
Номенклатура карбоновых кислот
Систематические
названия кислот даются по названию соответствующего углеводорода с добавлением
суффикса -овая и слова кислота.
Чтобы
указать положение заместителя (или радикала), нумерацию углеродной цепи
начинают от атома углерода карбоксильной группы. Например, соединение с разветвленной
углеродной цепью (CH| Название кислоты R-COOH | Название остатка RCOO— | ||
| систематическое | |||
| гексадекановая | пальмитиновая | ||
| октадекановая | |||
| бензолкарбоновая | |||
В водном растворе карбоновые кислоты диссоциируют на ионы: Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей. С увеличением молекулярной массы растворимость кислот в воде уменьшается.
 Названия солей составляют из названий остатка RCOO– (карбоксилат-иона)
и металла. Например, CH3COONa – ацетат натрия, (HCOO)2Ca
– формиат кальция, C17H35COOK – стеарат калия и т.п.
I. Общие с другими кислотами
1. Диссоциация:
Названия солей составляют из названий остатка RCOO– (карбоксилат-иона)
и металла. Например, CH3COONa – ацетат натрия, (HCOO)2Ca
– формиат кальция, C17H35COOK – стеарат калия и т.п.
I. Общие с другими кислотами
1. Диссоциация:Уксусная кислота широко распространена в природе – содержится в выделениях животных (моче, желчи, испражнениях), в растениях (в зеленых листьях). Образуется при брожении, гниении, скисании вина, пива, содержится в кислом молоке и сыре. Температура плавления безводной уксусной кислоты + 16,5°C, кристаллы ее прозрачны как лед, поэтому ее называют ледяной уксусной кислотой. Впервые получена в конце XVIII века русским ученым Т. Е. Ловицем. Натуральный уксус содержит около 5% уксусной кислоты. Из него приготовляют уксусную эссенцию, используемую в пищевой промышленности для консервирования овощей, грибов, рыбы. Уксусная кислота широко используется в химической промышленности для различных синтезов.
 Представители ароматических и непредельных карбоновых
кислот
Бензойная
кислота C6H5COOH — наиболее
важный представитель ароматических кислот. Распространена в природе в
растительном мире: в бальзамах, ладане, эфирных маслах. В животных организмах
она содержится в продуктах распада белковых веществ. Это кристаллическое
вещество, температура плавления 122°C, легко возгоняется. В холодной воде
растворяется плохо. Хорошо растворяется в спирте и эфире.
Ненасыщенные
непредельные кислоты с одной двойной связью в молекуле имеют общую формулу CnH2n-1COOH.
Высокомолекулярные
непредельные кислоты часто упоминаются диетологами (они называют их ненасыщенными). Самая
распространенная из них – олеиновая СН3–(СН2)7–СН=СН–(СН2)7–СООН
или C17H33COOH. Она
представляет собой бесцветную жидкость, затвердевающую на холоде.
Представители ароматических и непредельных карбоновых
кислот
Бензойная
кислота C6H5COOH — наиболее
важный представитель ароматических кислот. Распространена в природе в
растительном мире: в бальзамах, ладане, эфирных маслах. В животных организмах
она содержится в продуктах распада белковых веществ. Это кристаллическое
вещество, температура плавления 122°C, легко возгоняется. В холодной воде
растворяется плохо. Хорошо растворяется в спирте и эфире.
Ненасыщенные
непредельные кислоты с одной двойной связью в молекуле имеют общую формулу CnH2n-1COOH.
Высокомолекулярные
непредельные кислоты часто упоминаются диетологами (они называют их ненасыщенными). Самая
распространенная из них – олеиновая СН3–(СН2)7–СН=СН–(СН2)7–СООН
или C17H33COOH. Она
представляет собой бесцветную жидкость, затвердевающую на холоде.Особенно важны полиненасыщенные кислоты с несколькими двойными связями:линолевая СН3–(СН2)4–(СН=СН–СН2)2–(СН2)6–СООН или C17H31COOH с двумя двойными связями, линоленовая СН3–СН2–(СН=СН–СН2)3–(СН2)6–СООН илиC17H29COOH с тремя двойными связями и арахидоновая СН3–(СН2)4–(СН=СН–СН2)4–(СН2)2–СООН с четырьмя двойными связями; их часто называют незаменимыми жирными кислотами. Именно эти кислоты обладают наибольшей биологической активностью: они участвуют в переносе и обмене холестерина, синтезе простагландинов и других жизненно важных веществ, поддерживают структуру клеточных мембран, необходимы для работы зрительного аппарата и нервной системы, влияют на иммунитет. Отсутствие в пище этих кислот тормозит рост животных, угнетает их репродуктивную функцию, вызывает различные заболевания. Линолевую и линоленовую кислоты организм человека сам синтезировать не может и должен получать их готовыми с пищей (как витамины). Для синтеза же арахидоновой кислоты в организме необходима линолевая кислота. Полиненасыщенные жирные кислоты с 18 атомами углерода в виде эфиров глицерина находятся в так называемых высыхающих маслах – льняном, конопляном, маковом и др.Линолевая кислота C17H31COOH и линоленовая кислота C17H29COOH входят в состав растительных масел. Например, льняное масло содержит около 25% линолевой кислоты и до 58% линоленовой. Сорбиновая (2,4-гексадиеновая) кислота СН3–СН=СН–СН=СНСООН была получена из ягод рябины (на латыни – sorbus). Эта кислота – прекрасный консервант, поэтому ягоды рябины не плесневеют. Простейшая непредельная кислота, акриловая СН2=СНСООН, имеет острый запах (на латыни acris – острый, едкий). Акрилаты (эфиры акриловой кислоты) используются для получения органического стекла, а ее нитрил (акрилонитрил) – для изготовления синтетических волокон. Называя вновь выделенные кислоты, химики, нередко, дают волю фантазии. Так, название ближайшего гомолога акриловой кислоты, кротоновой СН3–СН=СН–СООН, происходит вовсе не от крота, а от растения Croton tiglium, из масла которого она была выделена. Очень важен синтетический изомер кротоновой кислоты –метакриловая кислота СН2=С(СН3)–СООН, из эфира которой (метилметакрилата), как и из метилакрилата, делают прозрачную пластмассу – оргстекло. Непредельные карбоновые кислоты способны к реакциям присоединения: СН2=СН-СООН + Н2 → СН3-СН2-СООН СН2=СН-СООН + Сl2 → СН2Сl-СНСl-СООН СН2=СН-СООН + HCl → СН2Сl-СН2-СООН СН2=СН-СООН + Н2O → НО-СН2-СН2-СООН Две последние реакции протекают против правила Марковникова. Непредельные карбоновые кислоты и их производные способны к реакциям полимеризации. 1. Каким образом можно осуществить реакции: ацетат натрия → уксусная кислота → хлоруксусная кислота? Напишите уравнения реакций. Уксусная кислота — слабая, поэтому сильные кислоты вытесняют ее из ее солей: CH3COONa + HCl = СН3СООН + NaCl. Уксусная кислота на свету реагирует с хлором: СН3СООН + Сl2 = СН2СlСООН + HCl↑. ________________________________________________________________ 2. Как можно получить пропионовую кислоту из бромэтана? СН3СН2Br → СН3СН2СООН. В молекуле пропионовой кислоты содержится три атома углерода, а в молекуле бромэтана — два. Дополнительный атом углерода можно ввести в состав молекулы, используя реакцию замещения с цианидом калия: CH3CH2Br + KCN → CH3CH2CN + КBr. В этой реакции образуется нитрил пропионовой кислоты (этилцианид), который гидролизуется при нагревании с образованием пропионата аммония: CH3CH2CN + 2Н2О → СН3СН2СООМН4. Подкисление раствора пропионата аммония дает пропионовую кислоту: CH3CH2COONH4 + HCl → СН3СН2СООН + NH4Cl. Другой способ решения этой задачи связан с использованием магнийорганических соединений и может быть проиллюстрирован схемой: Мg СО2. Н2О
С2Н5Br → С2Н5МgBr → С2Н5СООМgBr → С2Н5СООН ________________________________________________________________ 3. Напишите схему превращений, с помощью которой из 3,3,3-трихлорпропена можно получить 3-гидроксипропановую кислоту. Укажите условия проведения реакций. Хлороводород присоединяется к 3,3,3-трихлорпропену против правила Марковникова за счет -/-эффекта группы ССl3: ССl3-СН=СН2 + HCl →ССl3-СН2-СН2Сl. Гидролиз образующегося тетрахлорпроизводного водным раствором КОН дает (после подкисления) гидроксикислоту: CCl3CH2CH2Cl + 4KOH → НООС-СН2-СН2ОН + 4KCl + Н2О ________________________________________________________________ 4. Уксусную кислоту массой 5,40 г поместили в сосуд объемом 4,50 л и нагрели до температуры 200 °С. Давление паров при этом составило 43,7 кПа. Определите число молекул димера уксусной кислоты в газовой фазе. В парах уксусная кислота находится частично в виде димеров, а частично в виде отдельных молекул: х моль х/2 моль
2СН3СООН → (СН3СООН)2 Исходное количество уксусной кислоты: v(CH3COOH) = m/ M = 5,4 / 60 = 0,09 моль. Пусть в реакцию димеризации вступило х моль СН3СООН, тогда образовалось х/2 моль димера (СН3СООН)2 и осталось (0,09 — х) моль СН3СООН. Общее количество веществ в газовой фазе равно: v = PV / (RT) = 43,7 * 4,50 / (8,31 * 473) = 0,05 = х/2 + (0,09 – х), откуда х = 0,08 моль. Число молекул димера уксусной кислоты в газовой фазе равно: N[(СН3СООН)2] = v * NA = 0,08 / 2 * 6,02*1023 = 2,408*1022. Ответ. 2,408*1022 молекул (СН3СООН)2. ________________________________________________________________ 5. Напишите уравнения реакций, соответствующие следующей схеме: 1) Этанол окисляется до ацетата натрия хроматом натрия в щелочном растворе: ЗС2Н5ОН + 4Na2CrO4 + 7NaOH + 4H2O = 3CH3COONa + 4Na3[Cr(OH)6]. 2) Этилацетат гидролизуется под действием щелочей: СН3СООС2Н5 + NaOH = CH3COONa + С2Н5ОН. 3) Этанол окисляется до уксусной кислоты дихроматом калия в кислом растворе: 5С2Н5ОН + 4KMnO4 + 6H2SO4 = 5СН3СООН + 2K2SO4 +4MnSO4 + 11H2O. 4) Этилацетат можно получить из ацетата натрия действием этилиодида: CH3COONa + C2H5I = СН3СООС2Н5 + Nal. 5) Уксусная кислота — слабая, поэтому сильные кислоты вытесняют ее из ацетатов: CH3COONa + HCl = СН3СООН + NaCl 6) Сложный эфир образуется при нагревании уксусной кислоты с этанолом в присутствии серной кислоты:
| СН3СООН + С2Н5ОН | ⇌СН3СООС2Н5 + Н2О |
6.

________________________________________________________________
7.

______________________________________________________________
himiy88.blogspot.com
Карбоновые кислоты — это… Что такое Карбоновые кислоты?
Карбоновые кислотыКарбо́новые кисло́ты — класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп -COOH. Кислые свойства объясняются тем, что данная группа может сравнительно легко отщеплять протон. За редкими исключениями карбоновые кислоты являются слабыми. Например, у уксусной кислоты CH3COOH константа кислотности равна 1,75·10−5. Ди- и трикарбоновые кислоты более сильные, чем монокарбоновые.
Номенклатура
По международной номенклатуре ИЮПАК, карбоновые кислот называют, выбирая за основу наиболее длинную углеродную цепочку, содержащую группу -СООН, и добавляя к названию соответствующего углеводорода окончание «овая» и слово «кислота«. При этом атому углерода, входящему в состав карбоксильной группы, присваивается первый номер. Например СН3-СН2-СООН — пропановая кислота, СН3-С(СН3)2-СООН — 2,2-диметилпропановая кислота.
По рациональной номенклатуре к названию углеводорода добавляют окончание «карбоновая» и слово «кислота«, не включая при этом в нумерацию цепи атом углерода карбоксильной группы. Например, С5Н9СООН — циклопентанкарбоновая кислота, СН3-С(СН3)2-СООН — трет-бутилкарбоновая кислота.
Многие из карбоновых кислот имеют тривиальные названия (некоторые из них приведены в таблице).
Классификация
В зависимости от радикала, связанного с карбоксилом, различают следующие группы карбоновых кислот:
- ароматические
- алифатические (в том числе предельные и непредельные)
- алициклические
- гетероциклические.
По числу карбоксильных групп кислоты могут быть одно-, двух- и многоосновными. При введении в молекулы кислоты других функциональных групп (например, -ОН, =CO, -NH2 и др.) образуются окси-, кето-, аминокислоты и другие классы соединений.
Применение
Карбоновые кислоты — исходные соединения для получения промежуточных продуктов органического синтеза, в частности кетенов, галогенангидридов, виниловых эфиров, галогенкислот. Соли карбоновых кислот и щелочных металлов применяют как мыла, эмульгаторы, смазочные масла; соли тяжелых металлов — сиккативы, инсектициды и фунгициды, катализаторы. Эфиры кислот — пищевые добавки, растворители; моно- и диэфиры гликолей и полигликолей пластификаторы, компоненты лаков и алкидных смол; эфиры целлюлозы — компоненты лаков и пластмассы. Амиды кислот эмульгаторы и флотоагенты.
Получение
- Окисление спиртов
- Окисление альдегидов
- Гидролиз тригалогеналканов
- Карбоксилирование металлорганических соединений
- Гидролиз сложных эфиров
- Гидролиз нитрилов
Катализируется кислотой или основанием; первоначально образуется амид, который гидролизуется до кислоты; лишь в редких случаях амид устойчив к гидролизу; удобный лабораторный метод (если нитрил доступен)
- Реакция Арндта-Эйстерта
Используется для получения высших гомологов кислот из низших.
Физические свойства
Низшие карбоновые кислоты — жидкости с острым запахом, хорошо растворимые в воде. С повышением относительной молекулярной массы растворимость кислот в воде и их плотность уменьшаются, а температура кипения повышается. Высшие кислоты, начиная с пеларгоновой (н-нонановой) СН3-(СН2)7-СООН, — твердые вещества, без запаха, нерастворимые в воде. Низшие карбоновые кислоты в безводном виде и в виде концентрированных растворов раздражают кожу и вызывают ожоги, особенно муравьиная кислота и уксусная кислота.
На физических свойствах карбоновых кислот сказывается значительная степень ассоциации вследствие образования водородных связей. Кислоты в отличие от спиртов, образуют более прочные водородные связи, вследствие того что связи в них в большей степени поляризованы по типу Кроме того, у карбоновых кислот имеется возможность образования водородных связей с кислородом карбонильного диполя, обладающим значительной электроотрицательностью, а не только с кислородом другой гидроксильной группы. Действительно, в твердом и жидком состояниях карбоновые кислоты существуют в основном в виде циклических димеров.
Характерные химические реакции
Наиболее важные химические свойства, характерные для большинства карбоновых кислот:
1. Карбоновые кислоты при реакции с металлами, их оксидами или их осно́вными гидроксидами дают соли соответствующих металлов:
2. Карбоновые кислоты могут вытеснять более слабую кислоту из её соли, например:
3. Карбоновые кислоты в присутствии кислого катализатора реагируют со спиртами, образуя сложные эфиры (реакция этерификации):
4. При нагревании аммонийных солей карбоновых кислот образуются их амиды:
5. Под действием карбоновые кислоты превращаются в соответствующие хлорангидриды:
Литература
- Общая органическая химия т. 4 под ред. Д. Бартона и Д. Оллиса. М.: Химия. 1983
- Сайкс П. Механизмы реакций в органической химии. М.: Химия. 1991
- Адамс М. Карбоновые кислоты в органике. М.: Химия. 1990
- Дж. Роберт, М.Касерио «Основы органической химии» т. 1 Издание 2-е, дополненное. 1978
Ссылки
См. также
dic.academic.ru
Химические свойства карбоновых кислот | Химия онлайн
Для насыщенных монокарбоновых кислот характерна высокая реакционная способность. Они вступают в реакции с различными веществами и образуют разнообразные соединения, среди которых большое значение имеют функциональные производные, т.е. соединения, полученные в результате реакций по карбоксильной группе.

I. Реакции с разрывом связи О-Н
(кислотные свойства, обусловленные подвижностью атома водорода карбоксильной группы)
Предельные монокарбоновые кислоты обладают всеми свойствами обычных кислот.
Карбоновые кислоты изменяют окраску индикаторов.
1. Диссоциация
В водных растворах монокарбоновые кислоты ведут себя как одноосновные кислоты: происходит их ионизация с образованием иона водорода и карбоксилат-иона:
Карбоновые кислоты являются слабыми кислотами. Наиболее сильной в гомологическом ряду насыщенных кислот является муравьиная кислота, в которой группа –СООН связана с атомом водорода.
Все карбоновые кислоты – слабые электролиты (НСООН – средней силы). Карбоновые кислоты проявляют все свойства минеральных кислот.
Карбоновые кислоты в целом – слабые кислоты: в водных растворах их соли сильно гидролизованы.
Сила кислот в гомологическом ряду уменьшается с ростом углеводородного радикала.
Видеоопыт «Растворимость в воде различных карбоновых кислот» Видеоопыт «Карбоновые кислоты — слабые электролиты»
2. Образование солей
Карбоновые кислоты реагируют с активными металлами, основными оксидами, основаниями и солями слабых кислот.
а) взаимодействие с активными металлами
Видеоопыт «Взаимодействие уксусной кислоты с металлами»
б) взаимодействие c основаниями (реакция нейтрализации) Видеоопыт «Взаимодействие уксусной кислоты с раствором щелочи»
в) взаимодействие с основными и амофтерными оксидами
Видеоопыт «Взаимодействие уксусной кислоты с оксидом меди (II)»
г) взаимодействие с солями более слабых кислот Видеоопыт «Взаимодействие уксусной кислоты с карбонатом натрия»
д) взаимодействие с аммиаком или гидроксидом аммония
Названия солей составляют из названий остатка RCOO– (карбоксилат-иона) и металла. Например, CH3COONa – ацетат натрия, (HCOO)2Ca – формиат кальция, C17H35COOK – стеарат калия и т.п.
Свойства солей карбоновых кислот
1) Взаимодействие с сильными кислотами
Карбоновые кислоты – слабые, поэтому сильные минеральные кислоты вытесняют их из соответствующих солей.
2) Гидролиз по аниону
Соли карбоновых кислот в водных растворах гидролизуются (среда солей щелочная).
Видеоопыт «Гидролиз ацетата натрия»
II. Реакции с разрывом связи C-О
(замещение ОН-группы)
Пониженная электронная плотность (δ+) на атоме углерода в карбоксильной группе обусловливает возможность реакций нуклеофильного замещения группы –ОН с образованием функциональных производных карбоновых кислот (сложных эфиров, амидов, ангидридов и галогенангидридов).
1. Взаимодействие со спиртами с образованием сложных эфиров (реакция этерификации)
2. Взаимодействие с аммиаком с образованием амидов
Амиды получают из карбоновых кислот и аммиака через стадию образования аммониевой соли, которую затем нагревают:
Вместо карбоновых кислот чаще используют их галогенангидриды:
Амиды образуются также при взаимодействии карбоновых кислот (их галогенангидридов или ангидридов) с органическими производными аммиака (аминами):
Амиды играют важную роль в природе. Молекулы природных пептидов и белков построены из a-аминокислот с участием амидных групп — пептидных связей.
3. Взаимодействие с галогенидами фосфора (PCl5, PCl3) с образованием галогенангидридов карбоновых кислот
4. Образование ангидридов кислот (межмолекулярная дегидратация)

Смешанные ангидриды карбоновых кислот можно получить при взаимодействии хлорангидрида одной кислоты и соли другой кислоты:
III. Реакции с разрывом связи C-Н у ɑ-углеродного атома (реакции с участием радикала)
1. Реакции замещения (с галогенами)
Атомы водорода у ɑ-углеродного атома более подвижны, чем другие атомы водорода в радикале кислоты и могут замещаться на атомы галогена с образование ɑ-галогенкарбоновых кислот:
IV. Реакции окисления (горение)
В атмосфере кислорода карбоновые кислоты окисляются до СО2 и Н2О:
Особенности строения и свойства муравьиной кислоты
Муравьиная (метановая) кислота НСООН по своему строению и свойствам отличается от остальных членов гомологического ряда предельных монокарбоновых кислот.
В отличие от других карбоновых кислот в молекуле муравьиной кислоты функциональная карбоксильная группа
связана не с углеводородным радикалом, а с атомом водорода. Поэтому муравьиная кислота является более сильной кислотой по сравнению с другими членами своего гомологического ряда.
Все предельные карбоновые кислоты устойчивы к действия концентрированной серной и азотной кислот. Но муравьиная кислота при нагревании с концентрированной серной кислотой разлагается на воду и монооксид углерода (угарный газ).
Разложение при нагревании
При нагревании с концентрированной H2SO4 муравьиная кислота разлагается на оксид углерода (II) и воду:
Видеоопыт «Разложение муравьиной кислоты»
Молекула муравьиной кислоты, в отличие от других карбоновых кислот, содержит в своей структуре альдегидную группу:
Поэтому муравьиная кислота вступает в реакции, характерные как для кислот, так и для альдегидов. Как и альдегиды, НСООН проявляет восстановительные свойства. Проявляя свойства альдегида, муравьиная кислота легко окисляется до угольной кислоты:
Муравьиная кислота окисляется аммиачным раствором Ag2О и гидроксидом меди (II) Cu (OH)2, т.е. дает качественные реакции на альдегидную группу.
Реакция «серебряного зеркала»
Окисление гидроксидом меди (II)
Окисление хлором
ЦОР
Видеоопыт «Горение уксусной кислоты на воздухе»
Видеоопыт «Свойства карбоновых кислот»
Видеоопыт «Взаимодействие бромной воды с олеиновой кислотой»
Видеоопыт «Окисление муравьиной кислоты раствором перманганата калия»
Карбоновые кислоты
himija-online.ru
Карбоновые кислоты — Электронный учебник K-tree
Химические свойства
Состав карбоновых кислот
Карбоновые кислоты — соединения, имеющие в составе карбоксильную группу -COOH, атом углерода присоединённый к атому кислорода O и гидроксильной группе OH.
Что бы разобраться со структурами карбоксильной группы и карбоксилат-иона, необходимо обратиться к теории резонанса. Теория резонанса — это предположение, что распределение электронов в молекуле является комбинацией различных конфигураций двухэлектронных ковалентных связей.
Существует две возможных конфигурации карбоксильной группы:
O=C/R-O-H
O—-C/R=O+-H
Резонансная структура: Oδ--C/R-Oδ+-H
И две конфигурации карбоксилат-иона:
Две эквивалентные структуры:
O=C/R-O—
O—-C/R=O δ-
Резонансная структура: Oδ--C/R-Oδ-
Так вот, согласно теории резонанса, структуры без разделённого заряда являются более стабильными, поэтому резонансная структура карбоксилат-иона более стабильна, чем карбоксильной группы, откуда следует, что ионизация карбоксильной группы выгодна с точки зрения энергии молекулы.
Кислотность карбоновых кислот
Если в карбоновой кислоте присутствует электрофильный компонент, например, Cl, то протон (атом водорода) легче отщепляется от гидроксильной группы, следовательно кислота является более сильной. Чем больше электрофильных компонентов в углеродной группе, тем сильнее кислота: наличие трёх атомов хлора наделяет карбоновую кислоту кислотностью, схожей с HCl.
Аналогичным образом воздействуют нуклеофилы на молекулу, делая отщепление водорода более энергозатратным, понижая кислотные свойства молекулы.
Физические свойства
Наличие двойной связи C=O и гидроксильная группа наделяют молекулы карбоновых кислот полярными свойствами. Карбоновые кислоты хорошо взаимодействуют с водой, спиртами и друг с другом с помощью водородной связи. Карбоновые кислоты, имеющие до 10 атомов углерода в составе цепи, являются жидкостями с характерным запахом, больше 10 атомов — твёрдые восковые субстанции без запаха.
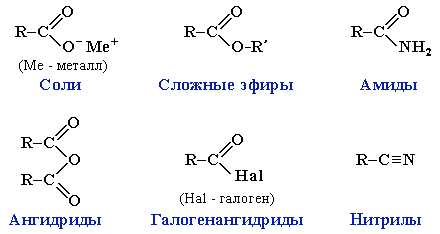
Производные карбоновых кислот
Группа R=C-O называется ацил, в группе ацила одна свободная связь, к которой может быть присоединены различные элементы, галоген — образуется галогенангидрид, COOR — образуется ангидрид кислоты, OR — сложный эфир (эстер), NH2(R,R) — амиды.
Основные карбоновые кислоты
| Традиционное название | Систематическое наименование | Формула | Нахождение в природе |
|---|---|---|---|
| Уксусная кислота | Этаноловая кислота | CH3-COOH | Продукт брожения вина |
| Муравьиная кислота | Метановая кислота | H-COOH | Рыжие муравьи, пчёлы, крапива и хвоя |
| Бензойная кислота | C6H5-COOH | Смола ладана (бензойная смола) | |
| Янтарная кислота | Этан-1,2-дикарбоновая кислота | НООС-СН2-СН2-COOH | В янтаре |
| Салициловая кислота | 2-гидроксибензойная кислота | С6Н4(ОН)СООН | Кора ивы |
| Щавелевая кислота | Этандиеновая кислота | НООС-СООН | В щавеле, ревене, карамболе и некоторых других растениях |
| Молочная кислота | 2-гидроксипропановая кислота | CH3-CH(OH)-COOH | Образуется при молочнокислом брожении сахаров, в частности, в прокисшем молоке, при брожении вина и пива. |
| Яблочная кислота | Гидроксибутандиовая кислота | НООС-СН2-СН(ОН)-СООН | Содержится в незрелых яблоках, винограде, рябине, барбарисе и малине. |
| Лимонная кислота | 2-гидроксипропан-1,2,3-трикарбоновая кислота | HOOC-CH2-C(OH)COOH-CH2-COOH | Сок недозрелых лимонов |
| Ацетилсалициловая кислота | 2-ацетилоксибензойная кислота | C9H8O4 | В коре молодых ветвей белой ивы |
| Таблица 1. Основные карбоновые кислоты | |||
Как выглядят молекулы карбоновых кислот
Нажмите на молекулу в списке и 3D-модель появится в чёрном окне
k-tree.ru
Физические свойства карбоновых кислот | Химия онлайн
Низшие члены ряда карбоновых кислот при обычных условиях представляют собой жидкости, обладающие характерным острым запахом. Например, этановая (уксусная) кислота имеет характерный «уксусный» запах. Безводная уксусная кислота при комнатной температуре представляет собой жидкость. При 170С она замерзает, превращаясь в льдистое вещество, которое получило название «ледяная» уксусная кислота. Средние представители этого гомологического ряда (С4-С9) — вязкие маслянистые жидкости; начиная с С10 — твердые вещества.
Низшие гомологи С1-С3 смешиваются с водой в любых соотношениях. С увеличением углеводородного радикала растворимость кислот в воде уменьшается. Высшие кислоты, например, пальмитиновая С15Н31СООН и стеариновая С17Н35СООН – бесцветные твердые вещества, не растворимые в воде. 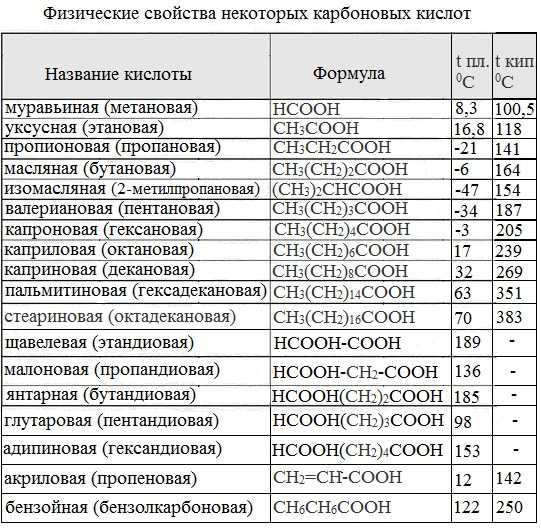
При одной и той же длине углеводородного радикала температуры плавления и кипения зависят от наличия кратных связей – с ростом их числа соответствующие температуры уменьшаются.
Ненасыщенные кислоты при комнатной температуре – жидкости.
Все дикарбоновые и ароматические кислоты при комнатной температуре – кристаллические вещества.
Муравьиная кислота НСООН – бесцветная жидкость с резким запахом, кипит при 1010С. Растворяется в воде в любых количествах. Вызывает ожоги на коже. Содержится в выделениях желез муравьев, а также в некоторых растениях (например, в листьях крапивы).
Уксусная кислота СН3СООН при обычной температуре – бесцветная жидкость, кислая на вкус, с резким запахом. Температура кипения 100%-й уксусной кислоты – 1180C. При температуре ниже + 16,60С она затвердевает в виде кристаллов, похожих на лед, вследствие чего получила название ледяной уксусной кислоты. 3-9% водный раствор ее известен под названием столового уксуса, который применяется как приправа к пище. 70-80% уксусная кислота называется уксусной эссенцией.
Смешивается во всех отношениях с водой, спиртом, эфиром, бензолом. Ледяная уксусная кислота хороший растворитель многих органических веществ. Концентрированные растворы уксусной кислоты при попадании на кожу вызывают ожоги.

Видеоопыт «Замораживание уксусной кислоты (демонстрация ледяной уксусной кислоты)»
Пальмитиновая и стеариновая кислоты — твердые вещества, белого цвета, жирные на ощупь, нерастворимы в воде, умеренно растворимы в спирте, эфире, хлороформе и других органических растворителях. Температура плавления стеариновой кислоты +69,30С, температура кипения от 360 до 3700С.
Простейшая ароматическая кислота — бензойная C6H5COOH (т. пл. 122,40С) — легко возгоняется, т.е. переходит в газообразное состояние, минуя жидкое. При охлаждении её пары сублимирутся в кристаллы. Это свойство используется для очистки вещества от примесей. В холодной воде растворяется плохо. Хорошо растворяется в спирте и эфире.
Видеоопыт «Возгонка бензойной кислоты»
Температуры кипения кислот значительно выше температур кипения спиртов и альдегидов с тем же числом атомов углерода, что объясняется образованием циклических и линейных димеров между молекулами кислот за счет водородных связей.
В твердом и жидком состоянии молекулы монокарбоновых кислот димеризуются в циклические димеры:
В водных растворах кислоты образуют линейные димеры:
Карбоновые кислоты
himija-online.ru
Карбоновые кислоты. Методы получения и свойства
 Сегодня — урок по химии 40 – Карбоновые кислоты. Методы получения и свойства.
Сегодня — урок по химии 40 – Карбоновые кислоты. Методы получения и свойства.
Карбоновыми кислотами называются соединения, содержащие функциональную карбоксильную группу – С(О) ОН
Карбоксильная группа содержит в себе карбонильную и гидроксильную группы. Вследствие близкого расположения они оказывают сильное влияние друг на друга.
Гидроксогруппа кислот легче отщепляет протон водорода, чем гидроксогруппа спиртов. Причина усиления кислотности – полярная карбонильная группа. Карбонильный атом углерода, несущий положительный заряд, стремится погасить дефицит электронов, притягивая электронные пары не только связей R – C и С = О, но и свободные электронные пары кислорода гидроксильной группы. Поэтому гидроксильный кислород сильнее оттягивает электронную пару связи О–Н, усиливая положительный заряд на атоме водорода.
По числу карбоксильных групп карбоновые кислоты делят на монокарбоновые, или одноoсновные (одна группа – СООН), дикарбоновые, или двухосновные (две группы — СООН) и т.д. В зависимости от строения углеводородного радикала, с которым связана карбоксильная группа, карбоновые кислоты бывают алифатическими, алициклическими или ароматическими. Для названия карбоновых кислот пользуются тривиальной номенклатурой и международной номенклатурой ИЮПАК. По международной номенклатуре названия кислот производят от названия углеводородов с тем же числом атомов углерода, что и в молекуле кислоты, с добавлением окончания «-овая кислота». Приведем формулы некоторых кислот, и назовем их по тривиальной и международной номенклатурам:
O
||
Н – С – ОН СН3 –С(О)ОН НО-(О)С – СН2 – С(О)ОН
муравьиная, уксусная, этановая малоновая, пропандиовая
метановая кислота кислота кислота
СН2 = СН – С(О)ОН С6Н5-С(О)ОН
акриловая, пропеновая кислота бензойная кислота
В непредельных карбоновых кислотах имеет место пространственная геометрическая изомерия (подобно этиленовым углеводородам). Например, цис-изомер – малеиновая кислота и транс-изомер – фумаровая кислота.
Методы получения карбоновых кислот.
1. Общий способ получения карбоновых кислот – окисление альдегидов и первичных спиртов.
СН3 – СН2ОН → СН3 – СОН → СН3 – СООН
2. Гидролиз сложных эфиров.
СН3 – СООС2Н5 + Н2О ↔ СН3 – СООН + С2Н5ОН
3. Из моногалогенпроизводных при действии цианида калия и последующим разложением полупродукта водой.
С2Н5СI + КСN → КСI + С2Н5 – С ≡ N
С2Н5 – С ≡ N + 2Н2О → СН3 – СН2 – СООН + NН3
4. Гидролизом трехгалогенпроизводных углеводородов.
СН3 – ССI3 + 3NаОН → СН3 – СООН + 3NаСI + Н2О
5. Отдельные кислоты получают специфическими методами. Муравьиную кислоту получают из оксида углерода (II) и гидроксида натрия с последующим разложением формиата натрия сильной кислотой.
200оС, Р Н2SO4
NаОН + СО → НСООNа → НСООН
6. Уксусную кислоту получают каталитическим окислением бутана кислородом воздуха:
С4Н10 + 5О2 → 4СН3 – СООН + 2Н2О
Химические свойства карбоновых кислот.
1. Карбоновые кислоты обладают кислыми свойствами, окрашивая лакмус в красный цвет, что обусловлено диссоциацией.
СН3 – СООН ↔ СН3 – СОО— + Н+
Карбоновые кислоты слабее неорганических, наиболее сильной из них является муравьиная.
2. Водород карбоксила замещается на металлы при реакциях с активными металлами, основными оксидами, гидроксидами и солями слабых кислот.
2СН3 – СООН + Ва → (СН3 – СОО)2Ва + Н2↑
2СН3 – СООН + СаО → (СН3 – СОО)2Са + Н2О
СН3 – СООН + КОН → СН3 – СООК + Н2О
СН3 – СООН + КНСО3 → СН3 – СООК + СО2 + Н2О
3. При взаимодействии с треххлористым фосфором (а), пятихлористым фосфором (б) и хлористым тионилом (в) образуются хлорангидриды кислот:
а) 3СН3 – СН2 – СООН + РСI3 → 3СН3 – СН2 – СОСI + Н3РО3
б) СН3 – СООН + РСl5 → CH3 – COCl + POCl3 + HCl
в) CH3 – COOH + SOCl2 → CH3 – COCl + SO2 + HCl
4. Замещение гидроксила на остаток кислоты приводит к образованию ангидрида.
СН3 – СООН + НООС – СН3 → СН3 – С(О) – O — (О)С – СН3 + Н2О
5. Замещение гидроксила в карбоксильной группе на остаток спирта приводит к получению сложного эфира.
НСООН + СН3ОН ↔ НСООСН3 + Н2О
6. Атомы водорода в радикальной части могут замещаться на галогены.
Н3С – СООН + 3СI2 → СI3С – СООН + 3НСI
7. Присоединение водорода. Получается альдегид, затем спирт
НСООН + Н2 → НСОН + Н2О, НСОН + Н2 → СН3ОН
8. Присоединение воды с образованием ортогидратов.
СН3 – СООН + Н2О → СН3 – С(ОН)3
Это был урок по химии 40 – Карбоновые кислоты. Методы получения и свойства.
Friend me:
к нашему сайту.
sovety-tut.ru
Карбоновые кислоты — это… Что такое Карбоновые кислоты?
класс органических соединений, содержащих карбоксильную группу (карбоксил)
Большинство К. к. имеет тривиальные названия, многие из которых связаны с их нахождением в природе, например муравьиная, яблочная, валериановая, лимонная кислоты. По Женевской номенклатуре наименования К. к. производят от названий углеводородов с тем же числом атомов углерода, прибавляя окончание «овая» и слово «кислота», например метановая кислота (муравьиная), этановая кислота (уксусная) и т.д. Нередко К. к. рассматривают как производные углеводородов; например, кислоту строения HC ≡ С — COOH называют ацетиленкарбоновой кислотой.
Кислотные свойства обусловлены способностью К. к. к диссоциации в водном растворе:
RCOOH ⇔ RCOO— + H+.
Как правило, К. к. слабее минеральных. Константы диссоциации одноосновных насыщенных кислот жирного ряда при 25°С изменяются от 1,7․10-4 (муравьиная кислота) до 1,3.10-5 (высшие гомологи). Сила К. к. существенно зависит также от электрофильности радикала, связанного с карбоксилом. Введение электроотрицательных заместителей (например, NO2, CN, Cl) в положение, соседнее с карбоксильной группой, резко повышает кислотность, например циануксусная кислота CNCH2COOH примерно в 200 раз сильнее уксусной кислоты CH3COOH. По мере удаления от карбоксила влияние заместителей ослабевает. Дикарбоновые кислоты сильнее монокарбоновых, причём влияние одного карбоксила на другой тем больше, чем они ближе расположены друг к другу. Так, в ряду кислот щавелевая кислота HOOC—COOH сильнее малоновой кислоты HOOCCH2COOH, которая, в свою очередь, сильнее янтарной HOOC (CH2)2COOH, и т.д. Кислотность непредельных кислот выше, чем предельных; влияние двойной связи тем сильнее, чем она ближе расположена к карбоксилу. Так, акриловая кислота CH2=CH—СООН в 4 раза сильнее пропионовой CH3—CH2—COOH. Ароматические кислоты сильнее предельных алифатических (например, константа диссоциации бензойной кислоты (См. Бензойная кислота) 6,5.10-5).К. к. — жидкие (например, низшие жирные кислоты) или твёрдые (например, высшие жирные и ароматические кислоты) вещества (см. табл.). Низшие члены насыщенных К. к. жирного ряда хорошо растворимы в воде, средние члены (C4 — C10), а также ароматические кислоты — ограниченно, высшие жирные кислоты в воде не растворимы; как и ароматические кислоты, они хорошо растворяются в спирте, эфире, бензоле.
RCOOH + NaOH → RCOONa + H2O.
2) RCOCI + 2NH3 → RCONH2 + NH4CI.
Насыщенные углеводороды могут быть подвергнуты деструктивному окислению с образованием смеси продуктов, в том числе и карбоновых кислот. Этим методом из 1 m парафина обычно получают около 350 кг К. к. Окисление боковой цепи жирно-ароматических углеводородов либо многоядерных ароматических углеводородов приводит к ароматическим К. к.; например, фталевая кислота получается окислением о-ксилола или нафталина:
Ненасыщенные углеводороды окисляются по месту двойной связи:
Важный метод синтеза К. к. — гидролиз их нитрилов, легко получаемых взаимодействием галогенопроизводных углеводородов с цианистым натрием:
RCI + NaCN → RCN → RCOOH.
В настоящее время промышленное значение приобрёл метод синтеза К. к. карбонилированием, т. е. введением группы CO в органические соединения:
Некоторые К. к. получают из природных продуктов. Так, щелочным гидролизом (омылением) жиров (См. Жиры) получают соли высших жирных кислот (мыла) и Глицерин. Лимонную кислоту получают из ботвы хлопчатника и из стеблей махорки (после выделения из них никотина). Многие К. к. получают сбраживанием углеводов в присутствии бактерий определённого вида (маслянокислое, молочнокислое, лимоннокислое и др. виды брожения). К. к. широко распространены в природе в свободном состоянии и в виде производных (главным образом сложных эфиров). Так, в летучем масле герани содержится пеларгоновая кислота, в лимонах — лимонная. В состав животных и растительных жиров и масел входят Глицериды высших нормальных К. к. жирного ряда, из которых преобладают Пальмитиновая кислота, Стеариновая кислота и Олеиновая кислота. К. к., их производные, а также многочисленные соединения, содержащие наряду с карбоксильной иные функциональные группы (например, Аминокислоты, Оксикислоты и др.), имеют большое биологическое значение и находят разнообразное практическое применение. Муравьиную и уксусную кислоты, например, применяют при крашении и печатании тканей; уксусную кислоту и уксусный ангидрид — в производстве ацетилцеллюлозы (См. Ацетилцеллюлоза). Аминокислоты входят в состав белков. В медицине используют салициловую кислоту, n-аминосалициловую кислоту (ПАСК) и др. Высшие жирные К. к. широко применяют как сырьё для производства Мыла, лаков (См. Лаки) и красок (См. Краски), поверхностно-активных веществ, как эмульгаторы в производстве каучуков, как пластификаторы в производстве резин и др. Адипиновая кислота — один из исходных продуктов в производстве полиамидного волокна (См. Полиамидные волокна) (найлона), терефталевая — в производстве полиэфирного волокна (лавсана, терилена), полимерный нитрил акриловой кислоты (орлон) применяют как синтетическое волокно, близкое по свойствам к натуральной шерсти. Полимеры и сополимеры эфиров метакриловой кислоты используют как органическое стекло.Некоторые представители карбоновых кислот и их свойства
———————————————————————————————————————————————————————-
| Наименование | Формула | Температура | Температура | Плотность,* г/см2 |
| | | плавления, °С | кипения, °С | |
|———————————————————————————————————————————————————————|
| Алифатические (жирные) кислоты |
|———————————————————————————————————————————————————————|
| Муравьиная | НСООН | 8,4 | 100,5 | 1,220(20) |
|———————————————————————————————————————————————————————|
| Уксусная | СН3СООН | 16,6 | 118,2 | 1,049(20) |
|———————————————————————————————————————————————————————|
| Пеларгоновая | СН3(СН2)7СООН | 12,3 | 255,6 | 0,906(20) |
| | | | | |
|———————————————————————————————————————————————————————|
| Пальмитиновая | СН3(СН2)14СООН | 62,8 | 390 | 0,841(80) |
|———————————————————————————————————————————————————————|
| Стеариновая | СН3(СН2)16СООН | 69,6 | 360 (с | 0,839(80) |
| | | | разложением) | |
|———————————————————————————————————————————————————————|
| Адипиновая | НООС(СН2)4СООН | 153,5 | 265(100 мм рт. | 1,366(20) |
| | | | ст.)** | |
|———————————————————————————————————————————————————————|
| Акриловая | СН2=СНСООН | 12,3 | 140,0 | 1,062(16) |
|———————————————————————————————————————————————————————|
| Метакриловая | СН2=С(СНЗ)СООН | 16 | 163 | 1,015(20) |
|———————————————————————————————————————————————————————|
| Олеиновая | СН3(СН2)7СН=СН(СН2)7СООН | 16 | 223(10 мм рт. | 0,895(18) |
| | | | ст.) | |
|———————————————————————————————————————————————————————|
| Ароматические кислоты |
|———————————————————————————————————————————————————————|
| Бензойная | С6Н5СООН | 121,7 | 249,2 | 1.322(20) |
|———————————————————————————————————————————————————————|
| Коричная | С6Н5СН=СНСООН | 136 | 300 | 1,245(20) |
|———————————————————————————————————————————————————————|
| Терефталевая | n=НООСС6Н4СООН | — | 300 (возгоняется) | — |
|———————————————————————————————————————————————————————|
———————————————————————————————————————————————————————-
*В скобках указана температура (в °С). ** 1 мм рт. ст. = 133,322 н/м2.
Лит.: Неницеску К. Д., Органическая химия, пер. с рум., т. 1—2, М., 1962—1963; Несмеянов А. Н., Несмеянов Н. А., Начала органической химии, кн. 1—2, М., 1969—70.
Большая советская энциклопедия. — М.: Советская энциклопедия. 1969—1978.
dic.academic.ru
