Химик.ПРО — Вычисление объема раствора серной кислоты через нормальную концентрацию
Сколько миллилитров 96%-ного (по массе): раствора серной кислоты (H2SO4) (р = 1,84 г/мл) нужно взять для приготовления 1 л раствора с молярной концентрацией эквивалента 0,25 моль-экв/л?
Решение задачи
Учитывая, что молярная масса серной кислоты (H2SO4) равна 98 г/моль, найдем молярную массу эквивалента серной кислоты (H2SO4) по формуле:
Напомню то, что молярная масса эквивалента – это масса одного моль эквивалента вещества, равная произведению фактора эквивалентности на молярную массу вещества.
Получаем:
Фактор эквивалентности (fэкв) – число, показывающее какая доля частицы (атома, молекулы) этого вещества равноценна одному иону водорода (H+) в реакциях обмена или одному электрону в окислительно-восстановительных реакциях.
Найдем сколько серной кислоты (H
Напомню, что под нормальной концентрацией (молярной концентрацией эквивалента) понимают количество грамм-эквивалентов данного вещества, содержащегося в 1 л раствора. Нормальную концентрацию выражают в моль-экв/л или используют сокращение «н», «N».
Рассчитаем массу 0,25 н серной кислоты (H2SO4) по формуле:
Получаем:
m (H2SO4) = 0,25 ∙ 49 ∙ 1 = 12,25 (г).
Следовательно, в 1 л 0,25 н раствора серной кислоты (H2SO4) содержится 12,25 г серной кислоты (H2SO4).
Используя формулу нахождения массовой доли растворенного вещества:
выразим массу раствора серной кислоты (H2SO4):
Получаем:
m (раствора H2SO4) = 12,25 г/ 0,96 = 12,76 (г).
Если раствор 96-процентный, то массовая доля серной кислоты (H2SO4) в нем 0,96.
Вычислим объем раствора серной кислоты (H2SO4), который потребуется для приготовления 1 л раствора молярной концентрацией эквивалента 0,25 моль-экв/л. Будем использовать формулу, устанавливающую связь между объемом и массой раствора:
Получаем:
V (раствора H2SO4) = 12,76 /1,84 = 6,94 (мл).
Ответ:
объем раствора серной кислоты равен 6,94 мл.
Похожие задачи по химии
himik.pro
В каком объеме раствора с молярной концентрацией эквивалента 0,1 моль/л содержится 0, 4900 г серной кислоты.
Поиск Лекций2. Определяем количество вещества серной кислоты:
3. Рассчитываем объем раствора:
Ответ:100мл
9. Вычислите массу 30%-ного раствора перекиси водорода, необходимую для приготовления 300 г 3%-ного раствора.
3. Рассчитываем массу исходного раствора:
Ответ: для приготовления 300г 3%-ного раствора необходимо 30г 30%-ного раствора перекиси водорода
10. Вычислите массу Na2SO4 · 10H2O и объем воды, необходимые для приготовления 50 г 14,2%-ного раствора.
2. Определяем количество вещества сульфата натрия:
3. Так как в молекулу кристаллогидрата входит одна молекула сульфата натрия, то:
4. Рассчитываем массу кристаллогидрата:
5. Определяем массу воды:
Ответ:для приготовления 50 г 14,2%-ного растворанеобходимо 16,1г Na2SO4 · 10H2O растворить в 33,9г воды.
11. Для обработки рук хирурга, ран, операционного поля используется йодная настойка с массовой долей 5%. В каком массовом соотношении нужно смешать растворы с массовыми долями йода 2,5% и 30%, чтобы получить 330г йодной настойки с массовой долей 5%?
Ответ:для приготовления 330г 5%-ной йодной настойки необходимо смешать растворы йода с массовыми долями 2,5% и 30% в соотношении 10:1
12. При некоторых аллергических заболеваниях взрослым назначают раствор с массовой долей хлорида кальция CaCl2 – 10%, детям — с массовой долей CaCl2 — 5%. Рассчитайте массу 10%-ного и 2%-ного растворов CaCl
тогда масса второго раствора:
3. Определяем массу растворенного хлорида кальция в первом и втором растворах:
4. Исходя из того, что:
Получаем:
Ответ:для приготовления 400г 5%-ного раствора CaCl2 необходимо смешать 150г 10%-ного и 250г 2%-ного растворов.
13. Дать название и разобрать комплексные соединения: K4[Fe(CN)6], [Ag(NH3)2]Cl, К3[AlF6]
Решение:
14. Дать название и разобрать комплексные соединения: K3[Fe(CN)6], [Cu(NH3)4]Cl2, K3[Co(NO 2)6]
Решение:
15. Дать название и разобрать комплексные соединения: Na3[Co(NO2)6], [Zn(NH3)4]SO4, K[Ag(CN)2]
Решение:
16. Дать название и разобрать комплексные соединения: [Cr(H2O)6]Cl3, K2[Cu(OH)4], K3[Co(NO2)6]
Решение:
17. Дать название и разобрать комплексные соединения: [Pt(NH3)3Cl]Cl, K2[HgI4], [Cu(NH3)4]SO4
Решение:
Рекомендуемые страницы:
Задачи по растворам
Способы выражения состава ( концентрации) растворов
Содержание растворенного вещества в растворе может быть выражено либо безразмерными единицами – долями или процентами, либо величинами размерными – концентрациями.
В системе СИ единицей массы является кг, количества вещества – моль, объема – куб. м.
Молярная
масса имеет размерность г/моль и числена
равна
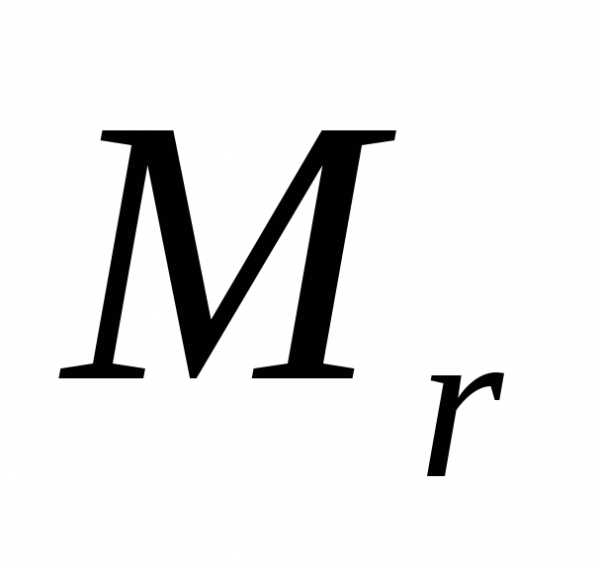 .
Количественная характеристика
.
Количественная характеристика
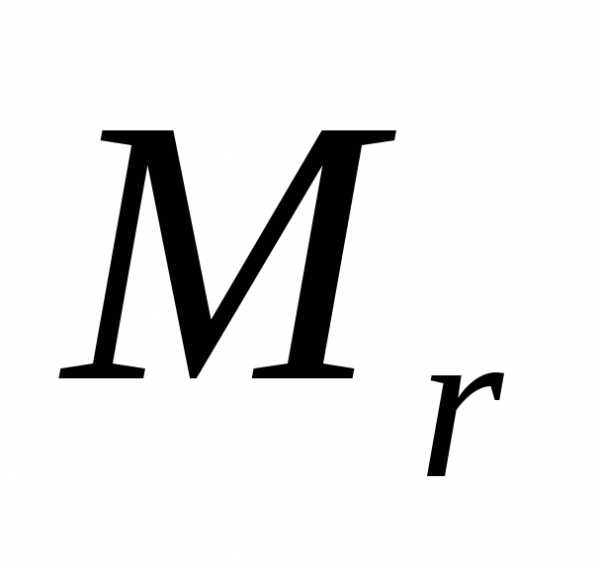 — моль. Различают моль молекул, атомов
или ионов. Количества моль молекуь
рассчитывают по формуле:
— моль. Различают моль молекул, атомов
или ионов. Количества моль молекуь
рассчитывают по формуле: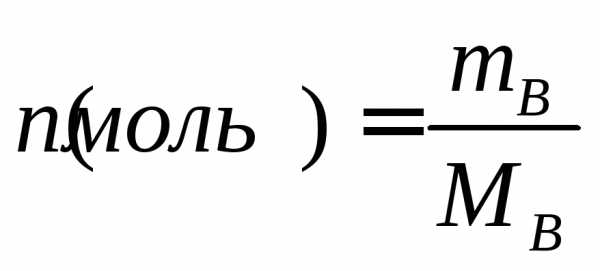
Известно несколько способов выражения концентрации растворов.
Массовая доля – масса вещества в 1 г или 100 г раствора.
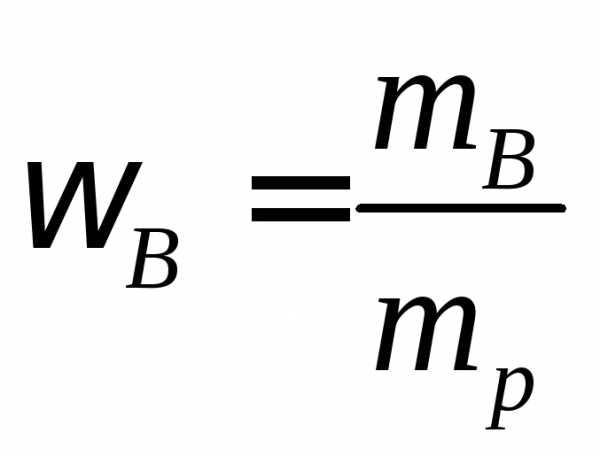

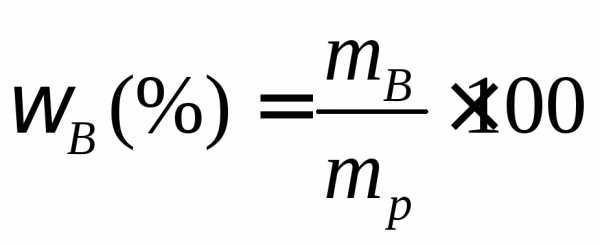 где
где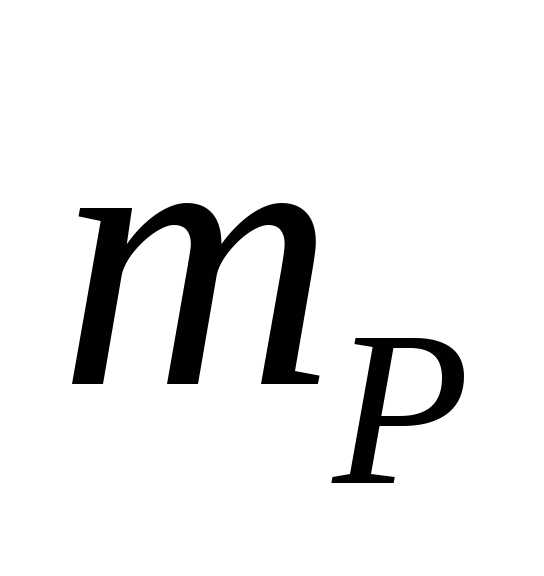 —
масса вещества,
—
масса вещества,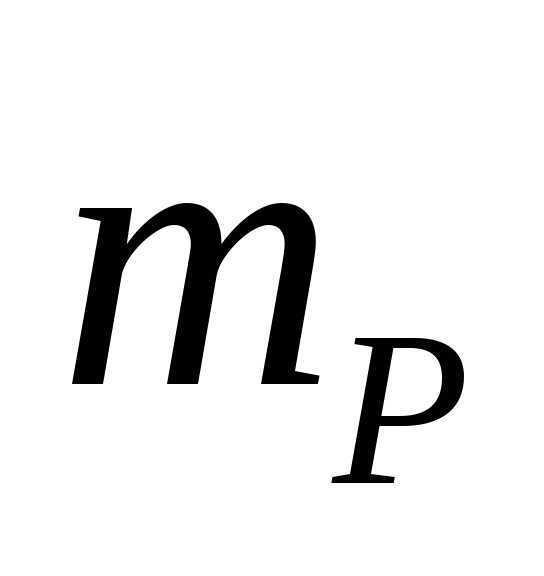 -масса
раствора
-масса
раствора
Молярная концентрация (–отношение количества вещества В (моль), содержащегося в системе, к объемуVэтой системы:
где n-число молей вещества; m-масса вещества, г; М-молярная масса вещества.
Молярную концентрацию выражают в Вместо обозначенийили моль/л допускается обозначение М.
Моляльная
концентрация ( )–количество
молей вещества в 1 кг растворителя..
)–количество
молей вещества в 1 кг растворителя..
где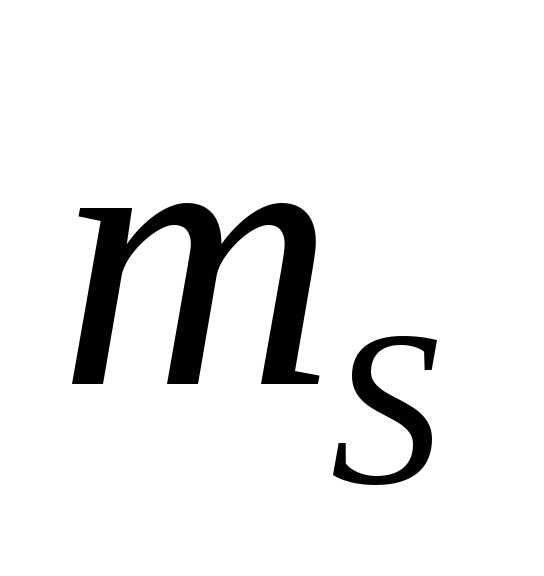 —
масса растворителя
—
масса растворителя
Молярная
концентрация эквивалента 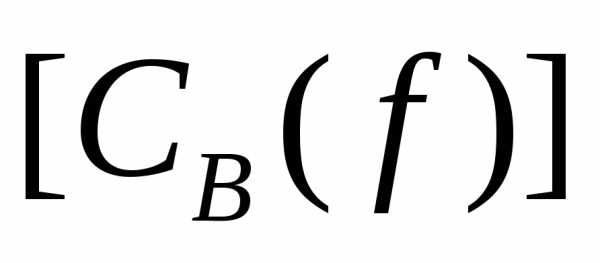 –отношение
массы вещества (в молярных массах
эквивалента), содержащейся в системе,
к объемуVэтой системы.
–отношение
массы вещества (в молярных массах
эквивалента), содержащейся в системе,
к объемуVэтой системы.
Молярных
массах эквивалента вещества (моль) –
это масса 1 моль эквивалента вещества,
равная произведению фактора эквивалентности
(
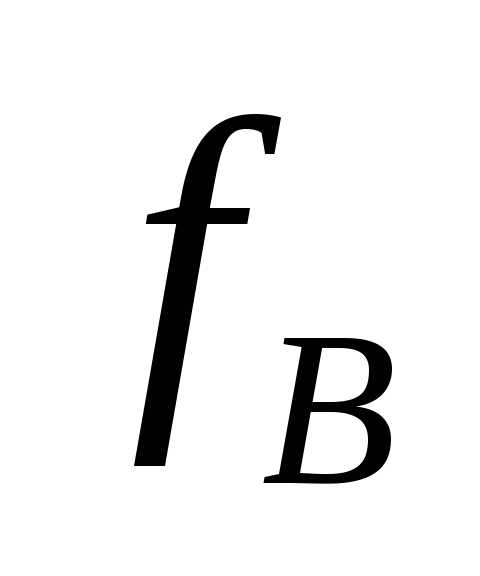 -фактор
эквивалентности вещества В
-фактор
эквивалентности вещества В
Молярная концентрация эквивалента выражают в ,принято называть нормальностью Допускают обозначение «н».
Фактор
эквивалентности (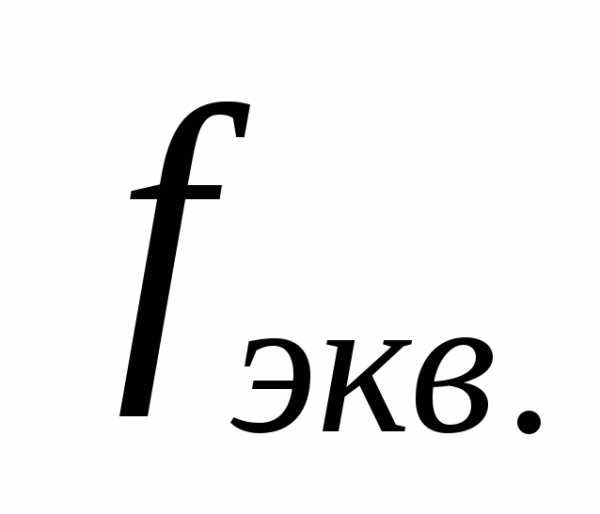 )–
безразмерная величина- число, обозначающее,
какая доля реальной частицы вещества
x
эквивалентна одному электрону в данной
кислотно-основной реакции или одному
электрону в данной ОВР.Для реакции
Одна частица А эквивалентнаb/a
частицам вещества B.
.
)–
безразмерная величина- число, обозначающее,
какая доля реальной частицы вещества
x
эквивалентна одному электрону в данной
кислотно-основной реакции или одному
электрону в данной ОВР.Для реакции
Одна частица А эквивалентнаb/a
частицам вещества B.
.
Фактор эквивалентности имеет вид меньше единицы.
Например, для реакции
Между 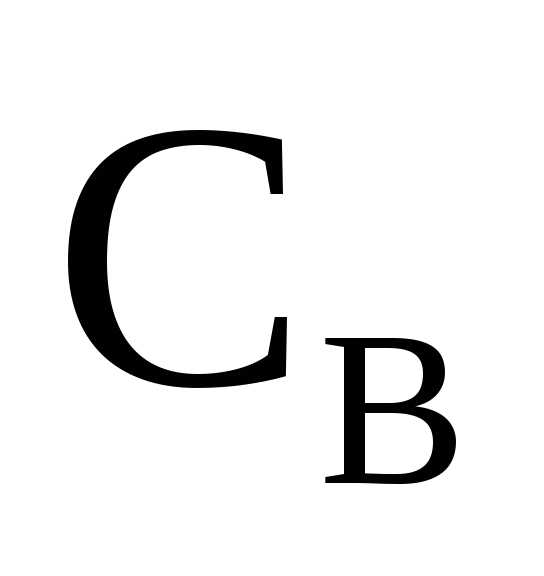 и
и 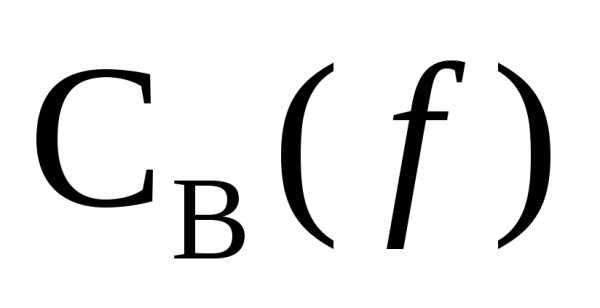 существует зависимость
существует зависимость
Молярная
концентрация
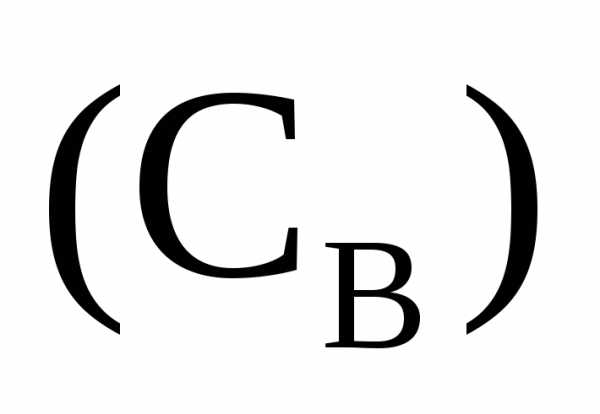 в
1/fраз меньшемолярной
концентрации эквивалента
в
1/fраз меньшемолярной
концентрации эквивалента
Молярная доля компонента в растворе
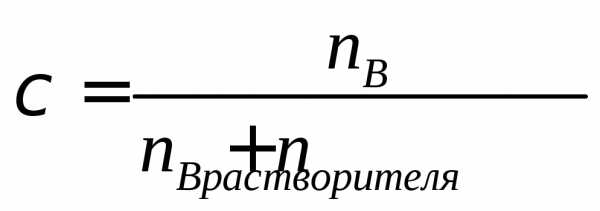
При взаимодействии растворов, концентрация которых выражена как нормальность, расчеты производят по выражению
1.Какой объем 0,3 н. раствора кислоты требуется для нейтрализации раствора, содержащего 0,32 г NaOH в 40 см3?
Решение.Так как вещества взаимодействуют между собой в эквивалентных соотношениях, то растворы равной нормальности реагируют в равных объемах. При разных нормальностях объемы растворов реагирующих веществ обратно пропорциональны их нормальностям, т.е.V1CН1 =V2CН2 .
Нормальность раствора NaOHрассчитываем по формуле:
Из выражения
Ответ: 26,7 см .
.
2.Вычислите
эквивалентную и моляльную концентрации
20,8%-ного раствора
 плотностью 1,12 г/
плотностью 1,12 г/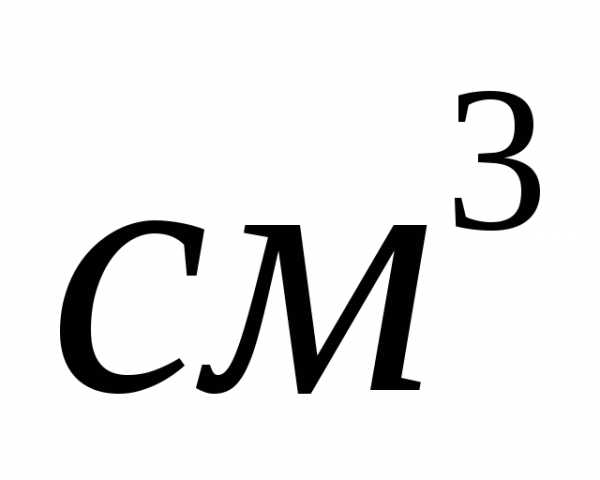 .
Сколько граммов кислоты содержится в
4 л этого раствора?
.
Сколько граммов кислоты содержится в
4 л этого раствора?
Решение.Массовая доля в процентах показывает
количество граммов растворенного
вещества в 100 г раствора. Следовательно,
в 100 г раствора содержится 20,8 г
 .
.
Масса растворителя
в этом растворе составляет 100-20,8=79,2 г.
Мольная масса
 равна 63 г/моль. Моляльную концентрацию
раствора находим из формулы:
равна 63 г/моль. Моляльную концентрацию
раствора находим из формулы:
Эквивалентная
масса
 =М/1=63,0/1=63,0
г/моль, объем 100 г раствора находим из
формулымл
или 0,08929 л.
=М/1=63,0/1=63,0
г/моль, объем 100 г раствора находим из
формулымл
или 0,08929 л.
Эквивалентная концентрация или нормальность показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора, то из формулы
н.
В 4 л этого раствора содержится:
г кислоты.
3. На нейтрализацию 31 см3 0,16 н. раствора щелочи требуется 217 см3 раствора Н2SO4. Чему равны нормальность и титр раствора Н2SO4?
Решение.Так как вещества взаимодействуют между собой в эквивалентных соотношениях, то растворы равной нормальности реагируют в равных объемах. При разных нормальностях объемы растворов реагирующих веществ обратно пропорциональны их нормальностям, т.е.
V1CН1 =V2CН2 31*0,16=217CН2, откудаCН2=31*0,16/217=0,02286 н.
Титром раствора называется число граммов растворенного вещества в 1 см3(мл) раствора. Зная нормальность раствора и эквивалентную массу (mЭ) растворенного вещества, титр можно найти по формуле
Т=СнmЭ/1000, откуда Т=0,02286*49/1000=0,001120 г/см3.
Ответ: 0,023 н.; 1,12*10-3 г/см3.
4. Растворимость гидрофосфата аммония в воде при 20С 69г. Вычислить массовую долю и молярную концентрацию этого раствора, если =1,21 г/мл.
Решение. Растворимость вещества измеряется содержанием вещества в его насыщенном растворе.
Коэффициент растворимости– масса вещества растворяющегося при данных условиях в 100 г растворителя с образованием насыщенного раствора. при данной температуре.
Массовая доля – масса вещества в 1 г или 100 г раствора.
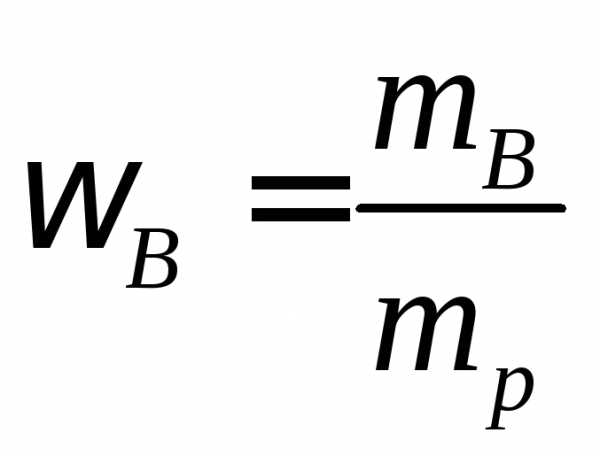

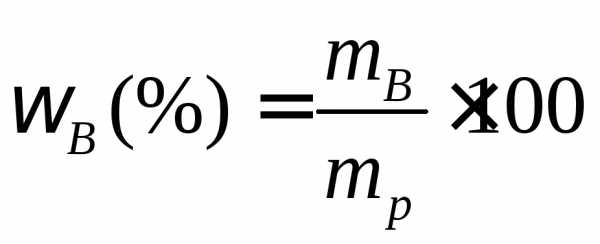 где
где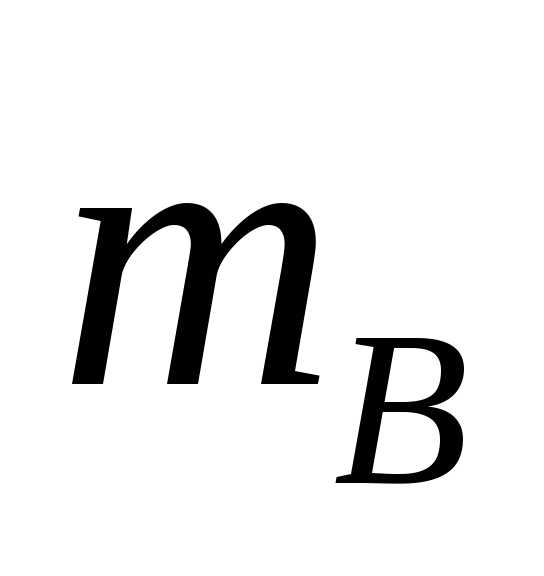 —
масса вещества,
—
масса вещества, -масса
раствора
-масса
раствора
Молярная концентрация (–отношение количества вещества В (моль), содержащегося в системе, к объемуVэтой системы:
гдеn-число молей вещества;m-масса вещества, г; М-молярная масса вещества.
Молярную концентрацию выражают в Вместо обозначенийили моль/л допускается обозначение М.
Из условий
задачи и определения растворимости
масса вещества
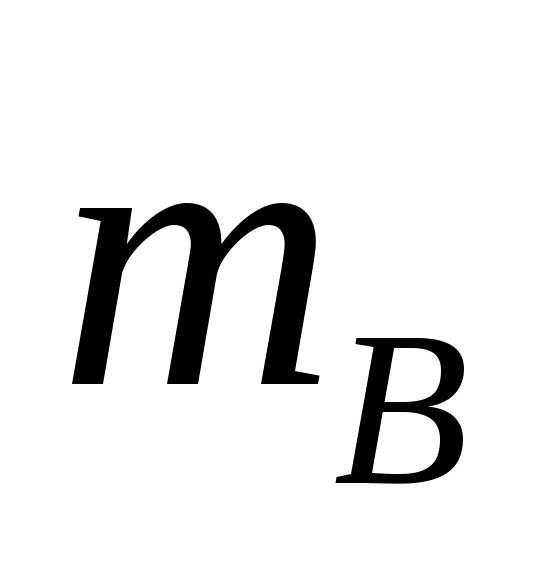 =69
г, масса растворителя
=69
г, масса растворителя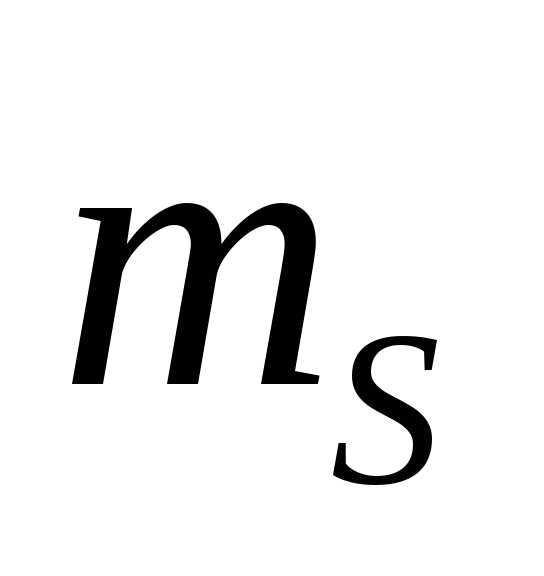 =100
г, масса раствора
=100
г, масса раствора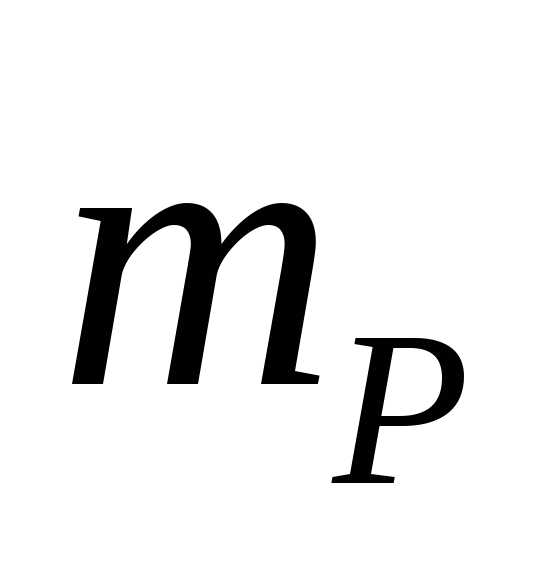 =100+69=169
г. Массовую долю раствора рассчитываем
по уравнению:
=100+69=169
г. Массовую долю раствора рассчитываем
по уравнению: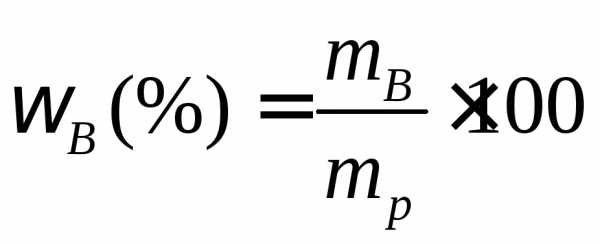 =.
=.
Молярная масса гидрофосфата аммония равна (14+4)х2+1+31+(16х4)=134 г/моль. Объем раствораили 0,13967 л. Из выражения
Ответ: 40,83%; 3,68 моль/л
5.Вычислите
эквивалентную и моляльную концентрации
20,8%-ного раствора
 плотностью 1,12 г/
плотностью 1,12 г/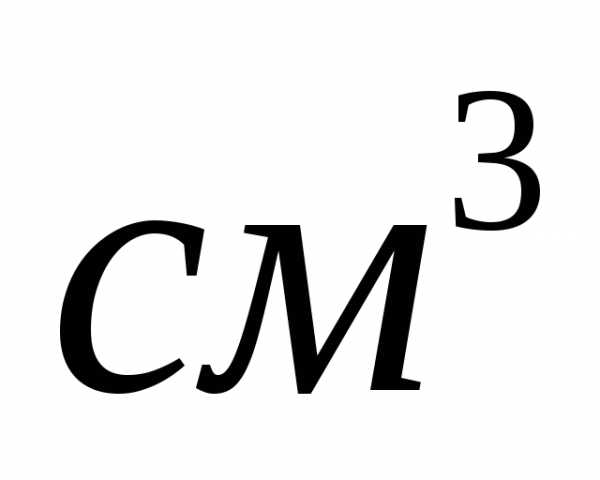 .
Сколько граммов кислоты содержится в
4 л этого раствора?
.
Сколько граммов кислоты содержится в
4 л этого раствора?
Решение.Массовая доля в процентах показывает
количество граммов растворенного
вещества в 100 г раствора. Следовательно,
в 100 г раствора содержится 20,8 г
 .
.
Масса растворителя
в этом растворе составляет 100-20,8=79,2 г.
Мольная масса
 равна 63 г/моль. Моляльную концентрацию
раствора находим из формулы:
равна 63 г/моль. Моляльную концентрацию
раствора находим из формулы:
Эквивалентная
масса
 =М/1=63,0/1=63,0
г/моль, объем 100 г раствора находим из
формулымл
или 0,08929 л.
=М/1=63,0/1=63,0
г/моль, объем 100 г раствора находим из
формулымл
или 0,08929 л.
Эквивалентная концентрация или нормальность показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора, то из формулы
н.
В 4 л этого раствора содержится:
г кислоты.
Задача. Рассчитать массовую долю раствора, содержащего 50 г хлорида кальция и 250 г воды.

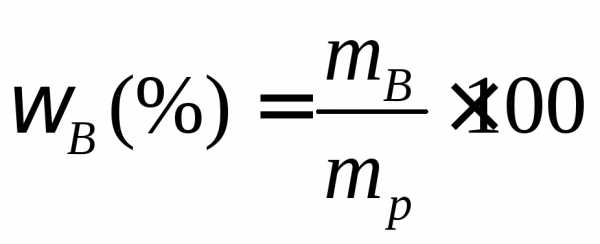
Задача. В 150 г воды растворено 30 г кристаллогидрата . Вычислить массовую долю кристаллогидрата и безводного сульфата железа (II) в растворе.
Решение.или 16,7%
Молярная
масса
.
Равна 278 г/моль, а — 152 г/моль. В 30 г кристаллогидрата
содержится 16,4 г безводной соли. Тогда
— 152 г/моль. В 30 г кристаллогидрата
содержится 16,4 г безводной соли. Тогда
Задача. При
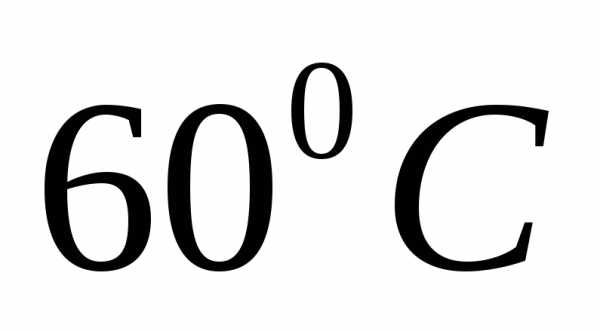 насыщенный
раствор
насыщенный
раствор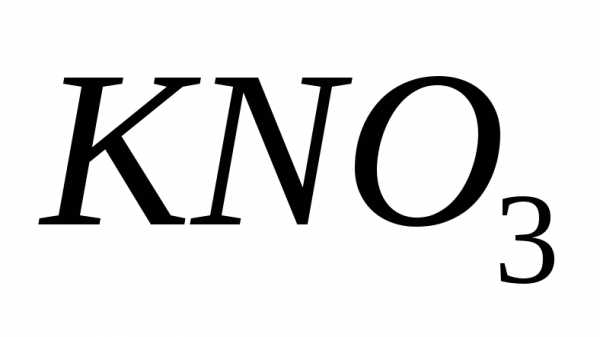 содержит
52,4% соли. Найти коэффициент растворимости
соли при этой температуре.
содержит
52,4% соли. Найти коэффициент растворимости
соли при этой температуре.
Решение.Коэффициент растворимости находим из пропорции:
На 47,6 г воды
приходится 52,4 г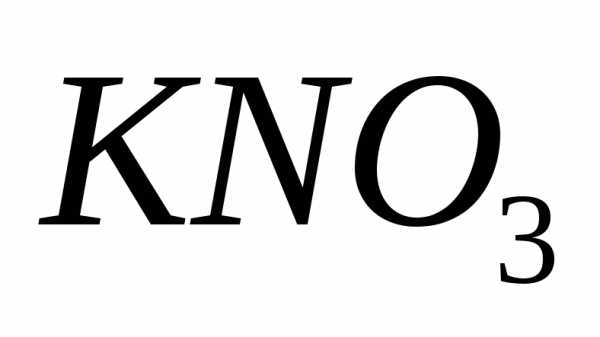 .
.
На 100 г «
Х г
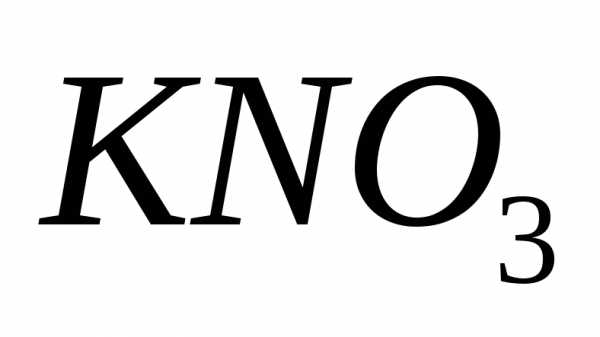
Таким образом,
растворимость
 при
при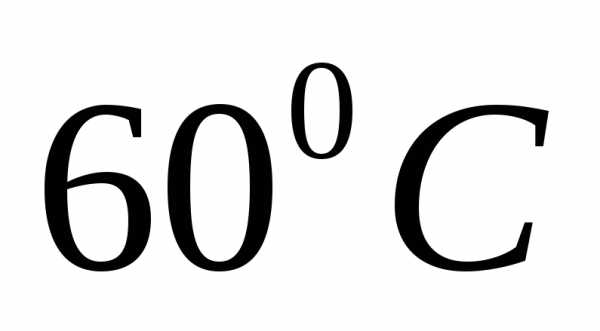 равна 110 г в 100 г воды.
равна 110 г в 100 г воды.
Задача. Вычислить моляльность, нормальность и молярность 15%-ного раствора (по массе) серной кислоты, если г/мл.
Решение.Для расчета используем 100 г раствора, который содержит 15 г серной кислоты.
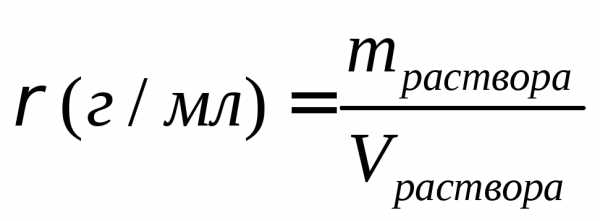
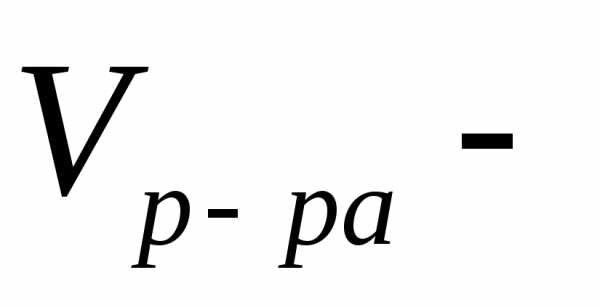 объем
раствора в литрах.
объем
раствора в литрах.
Моляльную конц. рассчитываем по формуле
Нормальность раствора рассчитываем по формуле
Молярную долю рассчитываем по выражению
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
При упаривании раствора хлорида натрия массой 500г с массовой долей соли 1% получен новый раствор массой 150г. Вычислите массовую долю и молярную долю соли в новом растворе.
Вычислите рН 3,8% раствора HCl(=1,017 г/мл).Какой объем 2М раствора гидроксида калия потребуется для нейтрализации 10мл указанного раствораHCl.
Вычислите рН, молярную, моляльную и моль-эквивалентную концентрации 20% раствора серной кислоты плотностью 1,12 г/мл.
Сколько воды надо добавить к раствору массой 3кг и с массовой долей соли 20% для получения раствора с массовой долей 15%?
Вычислите молярную, моляльную концентраци и молярную долю гидроксида натрия в растворе, содержащем 12 г гидроксида натрия в 50 г воды (р-ра= 1,2 г/мл).
Сколько воды необходимо прибавить к 80 мл 20%-го раствора хлорида натрия (ρ= 1,148 г/мл), чтобы получить 10%- й раствор (=1,07 г/мл)? Вычислите молярную концентрацию последнего.
Вычислите молярность, моляльность и мольную долю вещества в растворе Н3РО4с массовой долей 30% и плотностью 1,18 г/мл.
Растворимость гидрокарбоната натрия в воде при 25С 24,8г. Вычислите массовую долю и молярную концентрацию этого раствора, если=1,1 г/мл.
Вычислите произведение растворимости PbBr2при 25C, если растворимость соли при этой температуре равна 1,3210-2моль/л.
Вычислите массы воды и CaCl26H2O, необходимые для приготовления 500 мл раствора хлористого кальция с массовой долей соли 40% и плотностью 1,4 г/мл. Определите молярную и моляльную концентрацию раствора.
Растворимость сульфата натрия в воде при 25°С 27,9г. Вычислите массовую долю и моляльную концентрацию этого раствора, еслиr=1,28 г/мл.
Растворимость хлорида натрия при 20°С составляет 35,9г, а при 60С- 37,22г. Вычислите массу осадка, который образуется при охлаждении 500г раствора насыщенного при 60С до 20С.
Вычислите произведение растворимости хромата серебра (Ag2CrO4), если при 18°С в 500мл воды растворяется 0,0166г этой соли.
Вычислите объем концентрированной серной кислоты H2SO4 с плотностью 1,84 г/мл и массовой долей 98% следует взять для получения 800мл раствора с концентрацией 3М?
Сколько воды надо добавить к раствору массой 3кг и с массовой долей соли 20% для получения раствора с массовой долей 5 %?
6. Определить массовую долю вещества в растворе, полученном смещением 300 г 25%-ного и 400 г 40%-ного (по массе) растворов этого вещества
Вычислите молярную, моляльную концентрации и мольную долю нитрата натрия в 10% растворе (= 1,06 г/мл).
4Сколько воды надо добавить к раствору массой 3кг и с массовой долей соли 20% для получения раствора с массовой долей 15%?
Вычислите объем 37% раствора азотной кислоты (=1,23г/мл), необходимый для приготовления 1л 25% (=1,14г/мл).
Вычислите молярную, моляльную, моль-эквивалентную концентрацию 10% раствора серной кислоты с плотностью 1,06 г/мл.
3. Вычислите молярную и моляльную концентрации 20 и 40% растворов этанола в воде, если плотности растворов равны 0,969 и 0,935 г/мл соответственно. Плотность этанола равна 0,789 г/мл.
Вычислите объем воды, который необходимо прибавить к 10 мл 20%-го раствора хлорида натрия (ρ= 1,152 г/мл), чтобы получить 4%-й раствор?
Растворимость сульфата натрия в воде при 25°С 27,9г. Вычислите массовую долю и моляльную концентрацию этого раствора, еслиr=1,28 г/мл.
Вычислите молярную, моляльную, моль-эквивалентную концентрацию 15% раствора фосфорной кислоты с плотностью 1,085 г/мл.
При упаривании раствора хлорида натрия массой 500г с массовой долей соли 1% получен новый раствор массой 150г. Вычислите массовую долю и молярную долю соли в новом растворе.
Вычислите массы воды и CaCl26H2O, необходимые для приготовления 500 мл раствора хлористого кальция с массовой долей соли 40% и плотностью 1,4 г/мл. Определите молярную и моляльную концентрацию раствора.
Вычислите молярность, моляльность и мольную долю вещества в растворе Н3РО4с массовой долей 30% и плотностью 1,18 г/мл.
4. Вычислите молярную и моляльную концентрации 10% раствора ортофосфорной кислоты, если =1,055 г/мл.
4. Вычислите молярную, моляльную концентрации и рН 10% раствора гидроксида натрия плотностью 1,05 г/мл.
3. Вычислите молярную и моляльную концентрацию 20% раствора NH4Cl(=1,057 г/мл). Рассчитать мольную долю соли.
Рассчитайте молярную, моляльную концентрации и рН 10% раствора гидроксида натрия плотностью 1,05 г/мл.
Вычислите объем 37% раствора азотной кислоты (=1,23г/мл), необходимый для приготовления 1л 25% (=1,14г/мл).
Растворимость гидрокарбоната натрия в воде при 25С 24,8г. Вычислите массовую долю и молярную концентрацию этого раствора, если=1,1 г/мл.
Вычислите произведение растворимости PbBr2при 25C, если растворимость соли при этой температуре равна 1,3210-2моль/л.
Плотность раствора карбоната калия 1,22 г/мл. Из 1 л раствора действием соляной кислоты выделено 33,6 л СО2.Вычислите моляльную концентрацию раствора и мольную долю соли.
Вычислите молярную, моляльную, моль- эквивалентную концентрацию 10% раствора сульфата меди (=1,04 г/мл).
5. Вычислите произведение растворимости хромата серебра (Ag2CrO4), если при 18°С в 500мл воды растворяется 0,0166г этой соли.
Вычислите объем концентрированной серной кислоты H2SO4 с плотностью 1,84 г/мл и массовой долей 98% следует взять для получения 800мл раствора с концентрацией 3М?
6. К 100мл 10% раствора NaCl (r= 1,12 г/мл) прилили 100 мл 0,02 М раствор нитрата серебра. Вычислите концентрацию Cl— и Ag+в растворе, если ПР(AgCl)= 1,8×10-10.
При упаривании раствора хлорида натрия массой 500г с массовой долей соли 1% получен новый раствор массой 150г. Рассчитать массовую долю и молярную долю соли в новом растворе.
Сколько воды необходимо прибавить к 80 мл 20%-го раствора хлорида натрия (ρ= 1,148 г/мл), чтобы получить 10%- й раствор (=1,07 г/мл)? Рассчитайте молярную концентрацию последнего.
7
studfiles.net
