Составление химических формул простым и доступным языком
Одной из самых главных задач в химии является правильное составление химических формул. Химическая формула — это письменное представление состава химического вещества с помощью латинского обозначения элемента и индексов. Для правильного составления формулы нам обязательно понадобится таблица Менделеева и знание простых правил. Они достаточно простые и запомнить их смогут даже дети.
Как составлять химические формулы
Основным понятием при составлении химических формул является «валентность«. Валентность — это свойство одного элемента удерживать определенное число атомов в соединении. Валентность химического элемента можно посмотреть в таблице Менделеева, а также нужно помнить и уметь применять простые общие правила.
- Валентность металла всегда равна номеру группы, при условии, что он находится в главной подгруппе. Например, калий имеет валентность 1, а кальций — 2.
- С неметаллами немного сложнее. Неметалл может иметь высшую и низшую валентности. Высшая валентность равна номеру группы. Низшую валентность можно определить вычтя номер группы элемента из восьми. При соединении с металлами неметаллы всегда имеют низшую валентность. Кислород всегда имеет валентность 2.
- В соединении двух неметаллов низшую валентность имеет тот химический элемент, который находится в таблице Менделеева правее и выше. Однако, фтор всегда имеет валентность 1.
- И еще одно важное правило при расстановке коэффициентов! Общее число валентностей одного элемента всегда должно быть равно общему количеству валентностей другого элемента!
Закрепим полученные знания на примере соединения лития и азота. Металл литий имеет валентность, равную 1. Неметалл азот располагается в 5 группе и имеет высшую валентность 5 и низшую — 3. Как мы уже знаем, в соединениях с металлами неметаллы всегда имеют низшую валентность, поэтому азот в данном случае будет иметь валентность равную трем. Расставляем коэффициенты и получаем искомую формулу: Li 3N.
Вот так, достаточно просто, мы научились составлять химические формулы! А для лучшего запоминания алгоритма составления формул мы подготовили его графическое представление.
Составление химических формул: алгоритм
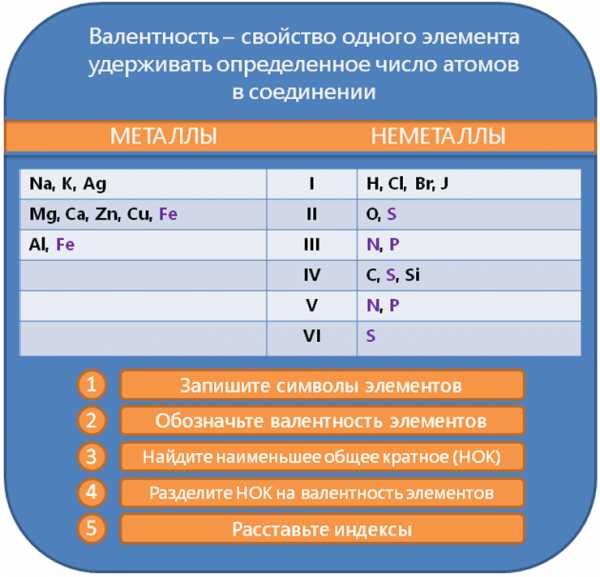 Алгоритм составления химических формул
Алгоритм составления химических формул
www.alto-lab.ru
Как составлять химические формулы
«Знание шрифтов – одно из самых элементарных требований, предъявляемых к сыщику!», — так наставлял когда-то великий Шерлок Холмс своего друга и летописца доктора Ватсона. Аналогично этому, можно смело сказать: «Знание того, как составляются химические формулы – одно из самых элементарных требований, предъявляемых к химику!» В самом деле, как можно рассуждать о превращениях веществ, не умея составлять их формулы?
— таблица Менделеева.
Спонсор размещения P&G Статьи по теме «Как составлять химические формулы» Как перевести амперы в квт Как посчитать процент роста Как построить окружность в изометрииИнструкция
1
Тут вам надо опираться на такое понятие, как «валентность», то есть способность атома одного вещества присоединять к себе определенное количество атомов другого вещества. Валентность любого элемента можно узнать, заглянув в таблицу Менделеева и помня некоторые общие правила.
2
Валентность металла, находящегося в «главной» подгруппе, равна номеру группы. Например, щелочные металлы литий, натрий, калий и т.д. – одновалентные, щелочноземельные кальций, стронций, барий и т.д. – двухвалентные.
3
Неметаллы имеют две валентности – высшую (которая равна номеру группы) и низшую (которую определяют, вычитая из 8 номер группы). В соединениях с металлами неметаллы имеют низшую валентность!
4
Если два неметалла соединяются между собой, то низшую валентность проявляет тот неметалл, который находится в Таблице Менделеева правее и выше. Фтор является исключением из этих правил, и всегда проявляет валентность, равную 1.
5
Необходимо также помнить, что в соединениях, состоящих из двух элементов, общее число валентностей одного элемента всегда должно быть равно общему количеству валентностей другого элемента!
6
Запомнив эти весьма несложные положения, вы сможете легко составлять химические формулы. Например, какова будет формула фосфорного ангидрида, то есть оксида фосфора? Во-первых, сразу возьмите на заметку: и фосфор, и кислород – неметаллы. Во-вторых, смотрите в таблицу Менделеева. Фосфор располагается в пятой группе, кислород – в шестой. Следовательно, низшую валентность в этом соединении проявит кислород, и она будет равна 2 (8 – 6 = 2). Валентность фосфора, соответственно, будет равна 5.
7
Какие же коэффициенты надо подставить и к фосфору, и к кислороду, чтобы соблюсти правило: сумма валентностей одного элемента должна равняться сумме валентностей второго? Легко можно увидеть, что для цифр 2 и 5 наименьшее общее кратное — 10. Следовательно, искомая формула фосфорного ангидрида такова: Р2О5.
8
Ну, а какова будет формула азида лития, то есть, вещества, образованного неметаллом азотом и щелочным металлом литием? Литий имеет валентность, равную 1. Азот, располагаясь в 5 группе, может иметь высшую валентность, равную 5, и низшую, равную 3. А поскольку в соединениях с металлами неметаллы имеют низшую валентность, легко вывести формулу этого соединения: Li3N.
Как простоmasterotvetov.com
Урок по химии в 8 классе на тему «Составление химических формул по валентности».
Урок в 8 классеТема: « Составление химических формул по валентности».
Цели:
закрепить умения определять валентность по формулам соединений;
ввести понятие «бинарные соединения»;
научить составлять названия бинарных соединений по их формулам;
научить составлять формулы соединений по валентности элементов.
(Вы узнаете:
какие вещества называют бинарными;
как правильно составлять название бинарного соединения;
как с помощью валентности уточняют названия веществ;
как по названию бинарных соединений составляют их формулы.
Вспомните
что такое валентность;
как определить валентность, зная формулу вещества.)
Ход урока.
Организационный момент. Проверка домашнего задания.
Что такое валентность химических элементов?
Почему валентность водорода принята за единицу?
Какие химические элементы имеют постоянную валентность?
Какие химические элементы имеют переменную валентность?
Новая тема.
На прошлом уроке мы научились определять валентность химических элементов по формулам веществ. Определите валентность элементов в данных соединениях.
(самостоятельно, потом проверка со всем классом)
Na2O SO3 Fe2O3 Ag2O CaH2 H2S
Во всех этих соединениях валентность одного элемента мы знали. А если нет химического элемента с известной валентностью? На помощь придет ПСХЭ (8 групп, металлы и неметаллы).
Правила по определению валентности:
Валентность металлов, находящихся в группе А равна номеру группы.
Неметаллы проявляют две валентности: максимальную, равную номеру группы и минимальную, равную 8 – номер группы.
Давайте посмотрим еще раз на ряд соединений, написанный на доске. Что общего в этих соединениях?
(сложные вещества; состоят из двух химических элементов)
Соединения, образованные атомами двух химических элементов называются бинарными. Приведите еще пример бинарного соединения, с которым встречаетесь каждый день (
Сейчас мы с вами научимся давать названия бинарным соединениям. В химии для названия веществ и составления формул разработаны специальные правила, которые называют номенклатурой. Лишь для небольшого числа веществ сохраняются так называемые тривиальные названия (т.е. исторически сложившиеся). С правилами химической номенклатуры мы будем знакомиться постепенно, по мере ознакомления с классификацией веществ.
Составление названий бинарных соединений (приложение 1):
Называем химический элемент, знак которого в формуле находится на втором месте. Используем его латинское название. Выделяем корень и добавляем к нему суффикс – ид.
Называем химический элемент, знак которого в формуле вещества стоит на первом месте. Используем русское название в родительном падеже.
Презентация, слайд 2.
Дать названия веществам, изображенным на доске. (Все вместе).
Давайте составим номенклатурные названия углекислого и угарного газов:
углекислый газ – СО2 – оксид углерода;
угарный газ – СО – оксид углерода.
Получилось, что у разных веществ одинаковые названия. А такого быть не может. Что же нам делать?
Здесь поможет валентность. Определите валентность углерода в этих соединениях. Записывают: оксид углерода (IV), оксид углерода (II).
Зная валентность элементов, мы можем составлять формулы веществ. Составим формулу оксида азота (V). Для этого нужно выполнить следующие действия (приложение 2, презентация, слайд 3):
Записать знаки химических элементов.
Обозначить валентность элементов.
Найти НОК.
Разделить НОК на валентность элементов.
Расставить индексы (справа внизу).
Презентация, слайд 4.
Пользуясь алгоритмом, составьте формулу оксида алюминия.
Итог урока.
Определите валентность атомов хрома в соединениях:
CrO3
CrO
Cr2O3
Дайте им названия.
Проверка: презентация, слайд 6.
Домашнее задание.
§12, вопросы 4-7 стр.37 (письменно), задача 2 стр. 37.
Приложение 1. Составление названий бинарных соединений:
Называем химический элемент, знак которого в формуле находится на втором месте. Используем его латинское название. Выделяем корень и добавляем к нему суффикс –ид.
Называем химический элемент, знак которого в формуле вещества стоит на первом месте. Используем русское название в родительном падеже.
CaO – оксид кальция
NaCl – хлорид натрия
PbS – сульфид свинца
-
Знак химического элемента
Латинское название
Русское название
Са
кальций
О
оксигениум
кислород
Na
натрий
Cl
хлорум
хлор
Pb
свинец
S
сульфур
сера
Приложение 2. Составление химических формул бинарных соединений по их названиям.
оксид азота (V)
Записать знаки химических элементов. N O
V II
Обозначить валентность элементов. N O
10
Найти НОК.
Разделить НОК на валентность элементов. [N] 10: V=2 [O] 10: II=5
Расставить индексы (справа внизу). N2O5
www.metod-kopilka.ru
Составление химических формул — Мегаобучалка
Формулы химических соединений составляются на основе понятия «степень окисления». Степень окисления(с.о.) – это условный заряд, атома, если бы он отдал или присоеденил соответствующее число электронов.
Металлы в соединениях имеют только положительную степень окисления, т.к. металлы отдают электроны. Неметаллы имеют как положительную, так и отрицательную степень окисления (неметаллы могут как присоеденять, так и отдавать электроны). Значение максимальной степениокисления определяется, как правило, по номеру группы, в которой находится элемент.
Na — металл, I группа, с.о. = +1, например Na+12O-2
Mn — металл, VII группа, с.о. = +7, например Mn+72O-27
Для неметаллов характерны несколько степеней окисления, они определяются также по номеру группы, если номер группы четный, то все степени окисления выражаются четными числами, если номер группы нечетный, то – нечетными числми:
S — неметалл, VI группа, с.о. = +6, +4, +2, 0, -2.
Cl — неметалл, VII группа, с.о. = +7, +5, +3, +1, 0, -1.
Простые вещества определяются нулевой степенью окисления. Отрицательная степень окисления также определяется исходя из номера группы. Она равна количеству электронов, которых не хватает до получения устойчивой электронной конфигурации — 8 электронов.
Для элементов побочных подгрупп высшая степень окисления определяется, как правило, номером группы, низшая для большинства элементов равна +2. Данные зависимости степеней окисления от структуры ПСЭ определяются электронным строением атомов (см. главу 2).
Свойства классов неорганических соединений
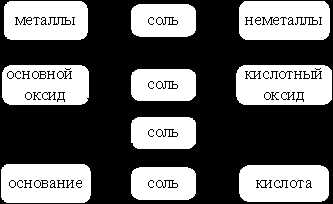 |
продукт реакции
Рис. 3. Генетическая связь между классами
Данная схема (рис. 3) отражает свойства классов неорганических соединений – оксидов (основных, кислотных), кислот, оснований: во взаимодействие вступают противоположные по своей природе соединения.Продуктом взаимодействия является соль.
Оксиды– сложные вещества, состоящие из двух элементов, одним из которых является кислород.
Основные оксидыобразуются от типичных металлов. К типичным (активным) металлам относят щелочные (Li – Fr) и щелочноземельные металлы (Ca – Ra).
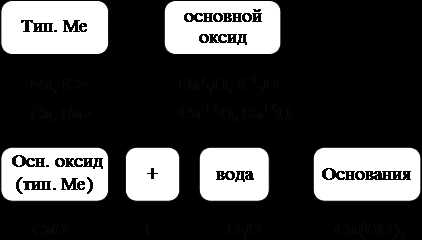
Рис. 4.Основные оксиды
Оксиды переходных металлов
Менее активные металлы – переходные металлы (элементы побочных подгрупп) тоже могут образовывать основные, а также кислотные и амфотерные оксиды в зависимости от степени окисления элемента.
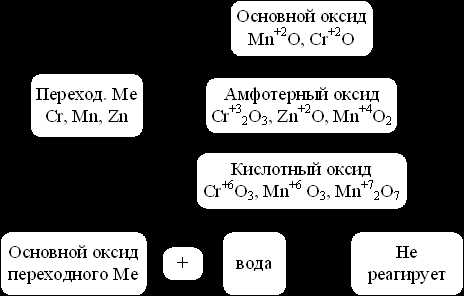 |
Рис. 5. Оксиды переходных металлов
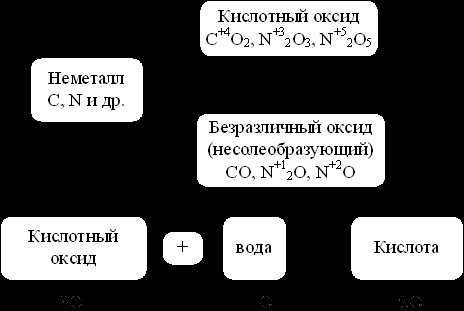 |
Кислотные оксидыобразуются, как правило, от неметаллов.
Рис. 6. Кислотные оксиды
Основания — сложные соединения, состоящие из ионов металла и ионов гидроксила.
Таблица 1
Основания
| Щелочные металлы: Na, K… и щелочноземельные: Ca, Sr… | à | Cильные основания (щелочи): NaOH, KOH, Ca(OH)2, Ba(OH)2 растворимые в воде |
| Средне и мало активные металлы (все кроме щелочных и щелочноземельных) — Al, Zn, Cu, Fe и др. | à | Слабые основания : Al(OH)3, Zn(OH)2, Cu(OH)2, Fe(OH)2 Не растворимые или малорастворимые в воде |
Получение сильных оснований
1. Оксид с водой — CaO + H2O® Ca(OH)2
2. Металл с водой — 2Na + H2O® 2NaOH + H2
3. Электролиз растворов соли — NaCl, KCl (см. главу 12)
megaobuchalka.ru
правила, примеры. Запись химической реакции
Поговорим о том, как составить химическое уравнение, ведь именно они являются основными элементами данной дисциплины. Благодаря глубокому осознанию всех закономерностей взаимодействий химических процессов и веществ, можно управлять ими, применять их в различных сферах деятельности.
Теоретические особенности
Составление химических уравнений — важный и ответственный этап, рассматриваемый в восьмом классе общеобразовательных школ. Что должно предшествовать данному этапу? Прежде чем педагог расскажет своим воспитанникам о том, как составить химическое уравнение, важно познакомить школьников с термином «валентность», научить их определять данную величину у металлов и неметаллов, пользуясь таблицей элементов Менделеева.

Составление бинарных формул по валентности
Для того чтобы понять, как составить химическое уравнение по валентности, для начала нужно научиться составлять формулы соединений, состоящих из двух элементов, пользуясь валентностью. Предлагаем алгоритм, который поможет справиться с поставленной задачей. Например, необходимо составить формулу оксида натрия.
Сначала важно учесть, что тот химический элемент, который в названии упоминается последним, в формуле должен располагаться на первом месте. В нашем случае первым будет записываться в формуле натрий, вторым кислород. Напомним, что оксидами называют бинарные соединения, в которых последним (вторым) элементом обязательно должен быть кислород со степенью окисления -2 (валентностью 2). Далее по таблице Менделеева необходимо определить валентности каждого из двух элементов. Для этого используем определенные правила.
Так как натрий – металл, который располагается в главной подгруппе 1 группы, его валентность является неизменной величиной, она равна I.
Кислород — это неметалл, поскольку в оксиде он стоит последним, для определения его валентности мы из восьми (число групп) вычитаем 6 (группу, в которой находится кислород), получаем, что валентность кислорода равна II.
Между определенными валентностями находим наименьшее общее кратное, затем делим его на валентность каждого из элементов, получаем их индексы. Записываем готовую формулу Na2O.
Инструкция по составлению уравнения
А теперь подробнее поговорим о том, как составить химическое уравнение. Сначала рассмотрим теоретические моменты, затем перейдем к конкретным примерам. Итак, составление химических уравнений предполагает определенный порядок действий.
- 1-й этап. Прочитав предложенное задание, необходимо определить, какие именно химические вещества должны присутствовать в левой части уравнения. Между исходными компонентами ставится знак «+».
- 2-й этап. После знака равенства необходимо составить формулу продукта реакции. При выполнении подобных действий потребуется алгоритм составления формул бинарных соединений, рассмотренный нами выше.
- 3-й этап. Проверяем количество атомов каждого элемента до и после химического взаимодействия, в случае необходимости ставим дополнительные коэффициенты перед формулами.
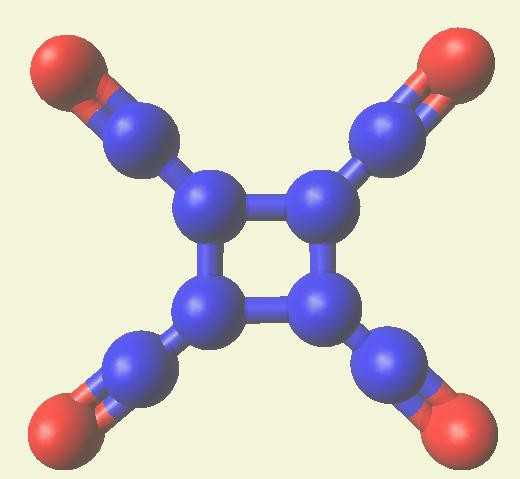
Пример реакции горения
Попробуем разобраться в том, как составить химическое уравнение горения магния, пользуясь алгоритмом. В левой части уравнения записываем через сумму магний и кислород. Не забываем о том, что кислород является двухатомной молекулой, поэтому у него необходимо поставить индекс 2. После знака равенства составляем формулу получаемого после реакции продукта. Им будет оксид магния, в котором первым записан магний, а вторым в формуле поставим кислород. Далее по таблице химических элементов определяем валентности. Магний, находящийся во 2 группе (главной подгруппе), имеет постоянную валентность II, у кислорода путем вычитания 8 — 6 также получаем валентность II.
Запись процесса будет иметь вид: Mg+O2=MgO.
Для того чтобы уравнение соответствовало закону сохранения массы веществ, необходимо расставить коэффициенты. Сначала проверяем количество кислорода до реакции, после завершения процесса. Так как было 2 атома кислорода, а образовался всего один, в правой части перед формулой оксида магния необходимо добавить коэффициент 2. Далее считаем число атомов магния до и после процесса. В результате взаимодействия получилось 2 магния, следовательно, в левой части перед простым веществом магнием также необходим коэффициент 2.
Итоговый вид реакции: 2Mg+O2=2MgO.
Пример реакции замещения
Любой конспект по химии содержит описание разных видов взаимодействий.
В отличие от соединения, в замещении и в левой, и в правой части уравнения будет два вещества. Допустим, необходимо написать реакцию взаимодействия между цинком и раствором соляной кислоты. Алгоритм написания используем стандартный. Сначала в левой части через сумму пишем цинк и соляную кислоту, в правой части составляем формулы получаемых продуктов реакции. Так как в электрохимическом ряду напряжений металлов цинк располагается до водорода, в данном процессе он вытесняет из кислоты молекулярный водород, образует хлорид цинка. В результате получаем следующую запись: Zn+HCL=ZnCl2+H2.
Теперь переходим к уравниванию количества атомов каждого элемента. Так как в левой части хлора был один атом, а после взаимодействия их стало два, перед формулой соляной кислоты необходимо поставить коэффициент 2.
В итоге получаем готовое уравнение реакции, соответствующее закону сохранения массы веществ: Zn+2HCL=ZnCl2+H2.

Заключение
Типичный конспект по химии обязательно содержит несколько химических превращений. Ни один раздел этой науки не ограничивается простым словесным описанием превращений, процессов растворения, выпаривания, обязательно все подтверждается уравнениями. Специфика химии заключается в том, что с все процессы, которые происходят между разными неорганическими либо органическими веществами, можно описать с помощью химических символов, знаков, коэффициентов, индексов.
Чем еще отличается от других наук химия? Химические уравнения помогают не только описывать происходящие превращения, но и проводить по ним количественные вычисления, благодаря которым можно осуществлять лабораторное и промышленное получение разных веществ.
fb.ru
Вывод химических формул — Знаешь как
Чтобы вывести формулу сложного вещества, нужно прежде всего путем анализа установить, из каких элементов состоит вещество и в каких весовых отношениях соединены друг с другом входящие в него элементы. Обычно состав сложного вещества выражают в процентах, но он может быть выражен и в любых других числах, указывающих отношение между весовыми количествами элементов, образующих данное вещество. Например, состав окиси алюминия, содержащей 52,94% алюминия и 47,06% кислорода, будет вполне определен, если мы скажем, что алюминий и кислород соединены в весовом отношении 9:8, т. е. что на 9 вес. ч. алюминия приходится 8 вес. ч. кислорода. Понятно, что отношение 9: 8 должно равняться отношению 52,94 : 47,06.
Зная весовой состав сложного вещества и атомные веса образующих его элементов, нетрудно найти относительное число атомов каждого элемента в молекуле взятого вещества и таким образом установить его простейшую формулу.Положим, например, что требуется вывести формулу хлористого кальция, содержащего 36% кальция и 64% хлора. Атомный вес кальция 40, хлора 35,5.
Обозначим число атомов кальция в молекуле хлористого кальция через х, а число атомов хлора через у. Так как атом кальция весит 40, а атом хлора 35,5 кислородных единиц, то общий вес атомов кальция, входящих в состав молекулы хлористого кальция, будет равен 40 х, а вес атомов хлора 35,5 у. Отношение этих чисел, очевидно, должно равняться отношению весовых количеств кальция и хлора в любом количестве хлористого кальция. Но последнее отношение равно 36 : 64.Приравняв оба отношения, получим:
40x: 35,5y = 36:64
Затем освободимся от коэффициентов при неизвестных х и у путем деления первых членов пропорции на 40, а вторых на 35,5:
Числа 0,9 и 1,8 выражают относительное число атомов в молекуле хлористого кальция, но они дробны, тогда как в молекуле может содержаться только целое число атомов. Чтобы выразить отношение х :у двумя целыми числами, делим оба члена ^второго отношения на наименьший из них. Получаем
х: у = 1 : 2
Следовательно, в молекуле хлористого кальция на один атом кальция приходятся два атома хлора. Этому условию удовлетворяет целый ряд формул: СаСl2, Са2Сl4, Са3Сl6 и т. д. Так как у нас нет данных, чтобы судить, какая из написанных формул отвечает действительному атомному составу молекулы хлористого кальция, то мы остановимся на простейшей из них СаСl2, указывающей наименьшее возможное число атомов в молекуле хлористого кальция.Однако произвол в выборе формулы отпадает, если наряду с весовым составом вещества известен также его молекулярный вес. В этом случае нетрудно вывести формулу, выражающую истинный состав молекулы. Приведем пример.
Путем анализа установлено, что глюкоза содержит на 4,5 вес. ч. углерода 0,75 вес. ч. водорода и 6 вес. ч. кислорода. Молекулярный вес ее был найден равным 180. Требуется вывести формулу глюкозы.
Как и в предыдущем случае, находим сперва отношение между числом атомов углерода (атомный вес 12), водорода и кислорода в молекуле глюкозы. Обозначив число атомов углерода через х, водорода через у и кислорода через z, составляем пропорцию:
2х:у: 16z = 4,5 : 0,75 : 6
откуда
Разделив все три члена второй половины равенства на 0,375, получаем:
х :у:z= 1 : 2 : 1
Следовательно, простейшая формула глюкозы будет СН2O. Но вычисленный по ней молекулярный вес равнялся бы 30, тогда как в действительности молекулярный вес глюкозы 180, т. е. в шесть раз больше. Очевидно, что для глюкозы нужно принять формулу C6H12O6.Формулы, основанные, кроме данных анализа, также и на определении молекулярного веса и указывающие действительное число атомов в молекуле, называются истинными или молекулярнымиформулами; формулы же, выведенные только из данных анализа, называются простейшими или эмпирическими.
Познакомившись с выводом химических формул,» легко понять, как устанавливаются точные молекулярные веса. Как мы уже упоминали, существующие методы определения молекулярных весов в большинстве случаев не дают вполне точных результатов. Но, зная хотя бы приблизительный молекулярный вес и процентный состав вещества, можно установить его формулу, выражающую атомный состав молекулы. Так как вес молекулы равняется сумме весов образующих ее атомов, то, сложив веса атомов, входящих в состав молекулы, мы определим ее вес в кислородных единицах, т. е. молекулярный вес вещества. Точность найденного молекулярного веса будет такой же, как и точность атомных весов.Нахождение формулы химического соединения во многих случаях может быть значительно упрощено, если воспользоваться понятием овалентности элементов.
Напомним, что валентностью элемента называется свойство его атомов присоединять к себе или замещать определенное число атомов другого элемента.
Валентность элемента определяется числом, показывающим, сколько атомов водорода (или другого одновалентного элемента) присоединяет или замещает атом данного элемента.О более глубоком смысле, который вкладывает в понятие «валентность» современная химия, будет сказано в гл. V.
Понятие о валентности распространяется не только на отдельные атомы, но и на целые группы атомов, входящие в состав химических соединений и участвующие как одно целое в химических реакциях. Такие группы атомов получили название радикалов. В неорганической химии наиболее важными радикалами являются: 1) водный остаток, или гидроксил ОН; 2) кислотные остатки; 3) основные остатки.
Водный остаток, или гидроксил, получается, если отмолекулы воды отнять один атом водорода. В молекуле воды гидроксил связан с одним атомом водорода, следовательно, группа ОН одновалентна.
Кислотными остатками называются группы атомов (аиногда и один атом), «остающиеся» от молекул кислот, если мысленно отнять от них один или несколько атомов водорода, замещаемых металлом. Валентность этих групп определяется числом отнятых атомов водорода. Например, серная кислота дает два кислотных остатка — один двухвалентный SO4и другой одновалентный HSO4,входящий в состав различных кислых солей. Фосфорная кислотаН3РО4может дать три кислотных остатка: трехвалентный РО4,двухвалентный НРО4и одновалентныйН2РО4и т. д.
Основными остатками мы будем называть; атомы или группы атомов, «остающиеся» от молекул оснований, если мысленно отнять от них один или несколько гидроксилов. Например, последовательно отнимая от молекулы Fe(OH)3 гидро-ксилы, получаем следующие основные остатки: Fe(OH)2, FeOH и Fe. Валентность их определяется числом отнятых гидроксиль-ных групп:Fe(OH)2 — одновалентен; Fe(OH)—двухвалентен; Fe — трехвалентен.Основные остатки, содержащие гидроксильные группы, входят в состав так называемых основных солей. Последние можно рассматривать как основания, в которых часть гидроксилов замещенакислотными остатками. Так, при замещении двух гидроксилов вFe(OH)3 кислотным остатком SO4 получается основная соль FeOHSO4, при замещении одного гидроксила в Bi(OH)3
кислотным остатком NO3 получается основная соль Bi(OH)2NO3 и т.д.
Знание валентностей отдельных элементов и радикалов позволяет в простых случаях быстро составлять формулы очень многих химических соединений, что освобождает химика от необходимости механически их заучивать.
Так как составление простейших формул — окислов, оснований и нормальных солей хорошо известно из элементарного курса химии, то мы ограничимся здесь лишь примерами составления формул кислых и основных солей.
Пример 1. Составить формулу гидрокарбоната кальция — кислой соли угольной кислоты.
В состав этой соли должны входить атомы кальция и одновалентные кислотные остатки НСО3. Так как кальций двухвалентен, то на один атом кальция надо взять два кислотных остатка. Следовательно, формула соли будет Са(НСО3)г.Промер 2. Составить формулу основного карбоната меди — основноймедной соли угольной кислоты.
Эта соль должна состоять из одновалентных основных остатков СuОН и двухвалентных кислотных остатков СО3. Поэтому формула соли будет (СuОН)2СО3 или Сu2(ОН)2СО3.
Правило составления формул по валентности приобретает большую наглядность, если изображать состав молекул так называемымиструктурными формулами. Примерами структурных формул некоторых простейших соединений могут служить следующие:
Структурные формулы показывают не только, из каких атомов состоит молекула соединения, но и как эти атомы связаны между собой в молекуле. Во многих случаях эти формулы дают возможность объяснить те или иные свойства соединения, разобраться в валентности образующих его атомов и т. п. Особенно большую роль они играют в органической химии, где вещество часто состоит из очень сложных молекул.
Вы смотрите, статья на тему Вывод химических формул
znaesh-kak.com
Как составить формулу вещества
Вам необходимо составить химическую формулу, но вы абсолютно забыли основы школьной химии? Поверьте, не стоит переживать. На сегодняшний день известно более 20 миллионов химических соединений, и, поверьте, никто не держит их формулы у себя в голове. Достаточно знать простой принцип их написания.
Вам понадобитсяпериодическая таблица Менделеева, таблица растворимости солей
Спонсор размещения P&G Статьи по теме «Как составить формулу вещества» Как читать таблицу Менделеева Как научиться читать таблицу химических элементов Д.И. Менделеева Как вычислить молярную массу веществаИнструкция
1
Задача составления химической формулы вещества сводится к созданию электронейтральной системы. Поэтому вам необходимо будет подобрать некоторое число электронов для каждого элемента соединения так, чтобы оно было уравновешено.
Однако перед тем, как это сделать, вам следует вспомнить некоторые теоретические основы.
Любой элемент периодической таблицы Менделеева обладает своей валентностью (степенью окисления), то есть способностью отдавать или принять некоторое количество электронов, с учетом своей валентности, не более восьми электронов. Валентность каждого химического элемента соответствует номеру группы в периодической таблице (верхняя строка, написанная римскими цифрами). Стоит заметить, что все элементы таблицы Менделеева можно условно разделить на два класса: окислители и восстановители. Первые, как правило, только забирают электроны, вторые – отдают.
2
Для составления химической формулы также необходимо знать, с каким типом соединений вы имеете дело. Их можно разделить на следующие группы:1. Бинарные;
2. Основания, соли, кислоты.
3
Для составления формулы бинарных соединений вам потребуется таблица Менделеева, а для остальных групп – таблица растворимости солей. В формулах бинарных соединений на первом месте принято писать металл или элемент с меньшей валентностью, на втором – неметалл или элемент с большей валентностью.Допустим, необходимо составить формулу оксида тантала. Запишите рядом обозначения этих элементов и проставьте их валентность: Та5О6. Тантал, соответственно, способен отдать 3 электрона, а кислород – принять два, то есть: Та3+О2-. Таким образом, для создания уравновешенной системы методом «крест-на-крест» (меняя индексы химических элементов местами и отбрасывая их знаки) вы получаете следующую формулу: Та2О3.
4
Для составления формул оснований, солей и кислот необходимо воспользоваться таблицей растворимости солей. В верхней ее строке указаны катионы – вещества, отдающие электроны, а в левом столбце – анионы, то есть соединения, способные принимать электроны. Пользуясь таблицей растворимости солей, можно получить следующую формулу для сульфата алюминия: Al3+ SO42-. Используя принцип «крест-на-крест», окончательная формула вещества будет иметь вид: Аl2(SO4)3.Как видите, алгоритм составления химических формул очень прост. Он остается неизменным для любых других соединений.
Как простоmasterotvetov.com
