28 Зависимость скорости реакции от концентрации реагирующих веществ. Закон действия масс.
Скоростью химической реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема системы.
При повышении концентрации реаг. Веществ скорость реакции возрастает. Для того, чтобы вступить в реакцию, две химические частицы должны сблизиться, поэтому скорость реакции зависит от числа столкновений между ними. Увеличение числа частиц в данном объеме приводит к более частым столкновениям и к возрастанию скорости реакции. Рассмотрим реакцию между веществами А и В, протекающую по схеме: а А + в В = с С + d D
Количественно зависимость между скоростью реакции и концентрациями реагирующих веществ описывается основным постулатом химической кинетики — законом действующих масс:скорость химической реакции в каждый момент времени пропорциональна текущим концентрациям реагирующих веществ, возведенным в степени их стехиометрических коэффициентов:
v = k . [A]а . [B]в.
Выражение такого типа называют кинетическим уравнением реакции. Коэффициент пропорциональности k называют константой скорости..
Чтобы понять физический смысл константы скорости реакции, надо в кинетическом уравнении принять, что [А]= 1 моль/л и [В]= 1 моль/л (либо приравнять единице их произведение) и тогда v=k. Отсюда ясно, что константа скорости k численно равна скорости реакции, когда концентрации реагирующих веществ (или их произведение в уравнениях скорости) равны единице.
ЗАКОН ДЕЙСТВУЮЩИХ МАСС скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях равных им коэффициентам в уравнении реакции. Закон выполняется только для элементарных хим. Реакций, протекающих в одну стадию. Если реакция протекает последовательно через несколько стадий, то суммарная скорость всего процесса определяется самой медленной его частью.закон относится к гомогенным реакциям. Если репгенты находятся в разных агреганых состояниях, то в уравнения входят только жидкие или газообразные реагенты, а твердые исключаются, оказывая влияние только на константу скорости K
Константа скорости реакции (удельная скорость реакции) — коэффициент пропорциональности в кинетическом уравнении.
29 Зависимость скорости реакции от температуры. Правило Вант-Гоффа.
Влияние температуры на количество столкновений молекул может быть показано с помощью модели. В первом приближении влияние температуры на скорость реакций определяется правилом Вант-Гоффа (сформулировано Я. Х. Вант-Гоффом на основании экспериментальн В интервале температур от 0оС до 100оС при повышении температуры на каждые 10 градусов скорость химической реакции возрастает в 2-4 раза:
где g — tтемпературный коэффициент, принимающий значения от 2 до 4.
.Влияние
температуры
|
химические реакции при высоких температурах протекают быстрее, чем при низких температурах |
Возрастание химические реакfции при высоких температурах протекают быстрее, чем при низких температурах скорости реакции при нагревании в первом приближении подчиняется следующему правилу:
|
при повышении температуры на 10 0С скорость химической реакции возрастает в два — четыре раза. |
studfiles.net
Вопрос 2. Зависимость скорости реакции от концентрации
реагирующих веществ. Закон действующих масс.
О скорости химической реакции судят по изменению концентраций реагирующих веществ (исходных или продуктов) реакции в единицу времени.
Пусть,
например, в момент времени
 концентрация вещества была С1,
а для момента
концентрация вещества была С1,
а для момента
 стала
С2. Тогда
средняя скорость реакции для интервала
времени
стала
С2. Тогда
средняя скорость реакции для интервала
времени
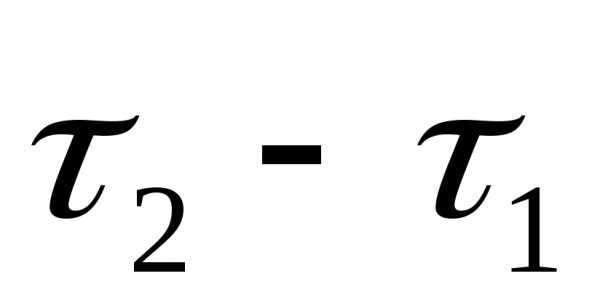

Знак «минус» берется в том случае, если рассматриваются концентрации исходных веществ, которые, естественно, уменьшаются в ходе реакции, а знак «плюс» берется в том случае, если рассматриваются концентрации продуктов реакции, которые, естественно, увеличиваются в ходе реакции.
Если
взять бесконечно малый промежуток
времени
 ,
то получим выражение для мгновенной
скорости в любой конкретный момент
времени:
,
то получим выражение для мгновенной
скорости в любой конкретный момент
времени:
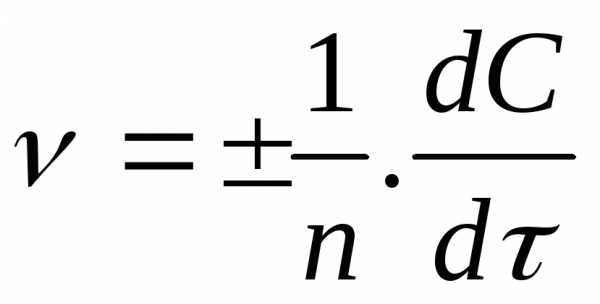
Скорость гомогенной реакции может быть определена по изменению концентрации любого из реагирующих веществ в единицу времени. Например, скорость реакции
аА+вВ=сС+dD
может быть определена по убыли веществ А и В, а с другой стороны, по приращению продуктов реакции C и D. Т.к., все вещества в этой реакции взаимодействуют в стехиометрических соотношениях, то скорость реакции может быть выражена через изменение концентрации любого реагента. Так, для реакции, N2(г) +3Н2(г) =2NH3(г) скорость м.б. выражена соотношением:
С ростом концентрации реагирующих веществ увеличивается общее число молекул в единице объема и, следовательно, увеличивается доля активных молекул и частота их столкновений, что приводит к увеличению скорости реакции.
Рассмотрим взаимодействие молекулы А с молекулой В в некотором объеме (рис. 3).
|
Рис.3 |
Коэффициент пропорциональности называют константой скорости. Очевидно, для реакции aA + bB, то есть для a молей вещества А и b молей вещества В ЗДМ формально запишется в виде
VAB= k[A]a[B]b
Скорость химической реакции прямо пропорциональна произведению молярных концентраций реагирующих веществ в степенях их стехиометрических коэффициентов.
Это определение относится к гомогенным реакциям. Если реакция геторогенная (реагенты находятся в разных агрегатных состояниях), то в уравнениие ЗДМ входят только жидкие или только газообразные реагенты, а твердые исключаются, оказывая влияние только на константу скорости k.
Константа скорости k химической реакции зависит только от природы реагирующих веществ и температуры. Физический смысл константы заключается в том, что она равна скорости реакции, когда концентрации каждого из реагирующих веществ равны 1 моль/л.
Константа скорости характеризуя зависимость скорости от природы реагирующих веществ, дает возможность сравнивать скорости различных реакций. Так, вещества, состоящие из полярных молекул, реагируют быстрее, чем вещества, состоящие из неполярных молекул. Дело в том, что полярные молекулы, притягиваясь противоположными полюсами, дольше находятся в соприкосновении, вследствие чего вероятность их взаимодействия больше.
Реакции с участием углеводородов, молекулы которых образованы прочной ковалентной малополярной связью, при невысоких температурах идут медленно (энергия активации велика). В растворах электролитов реакции протекают практически мгновенно (энергия активации мала), т.к. внутримолекулярные связи разрушаются уже при растворении веществ, и взаимодействие происходит между противоположно заряженными ионами.
studfiles.net
Химическая кинетика.Скорость химических реакций | CHEMEGE.RU
Темы кодификатора ЕГЭ: Скорость реакции. Ее зависимость от разных факторов.
Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией.
Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени.
Определение скорости химической реакции связано с условиями ее проведения. Если реакция
υ = ΔC / Δt.
Если реагенты, или продукты находятся в разных фазах, и столкновение частиц происходит только на границе раздела фаз, то реакция называется гетерогенной, и скорость ее определяется изменением количества вещества в единицу времени на единицу реакционной поверхности:
υ = Δν / (S·Δt).
Как заставить частицы чаще сталкиваться, т.е. как увеличить скорость химической реакции?
1. Самый простой способ – повысить температуру. Как вам, должно быть, известно из курса физики, температура – это мера средней кинетической энергии движения частиц вещества. Если мы повышаем температуру, то частицы любого вещества начинают двигаться быстрее, а следовательно, сталкиваться чаще.
Однако при повышении температуры скорость химических реакций увеличивается в основном благодаря тому, что увеличивается число эффективных соударений. При повышении температуры резко увеличивается число активных частиц, которые могут преодолеть энергетичекий барьер реакции. Если понижаем температуру – частицы начинают двигаться медленнее, число активных частиц уменьшается, и количество эффективных соударений в секунду уменьшается. Таким образом, при повышении температуры скорость химической реакции повышается, а при понижении температуры — уменьшается.
Обратите внимание! Это правило работает одинаково для всех химических реакций (в том числе для экзотермических и эндотермических). Скорость реакции не зависит от теплового эффекта. Скорость экзотермических реакций при повышении температуры возрастает, а при понижении температуры – уменьшается. Скорость эндотермических реакций также возрастает при повышении температуры, и уменьшается при понижении температуры.
Более того, еще в XIX веке голландский физик Вант-Гофф экспериментально установил, что большинство реакций примерно одинаково увеличивают скорость (примерно в 2-4 раза) при повышении температуры на 10оС. Правило Вант-Гоффа звучит так: повышение температуры на 10оС приводит к увеличению скорости химической реакции в 2-4 раза (эту величину называют температурный коэффициент скорости химической реакции γ). Точное значение температурного коэффициента определяется для каждой реакции.
здесь v2 — скорость реакции при температуре T2, v1 — скорость реакции при температуре T1, γ — температурный коэффициент скорости реакции, коэффинциент Вант-Гоффа.
В некоторых ситуациях повысить скорость реакции с помощью температуры не всегда удается, т.к. некоторые вещества разлагаются при повышении температуры, некоторые вещества или арстворители испаряются при повышенной температуре и т.д., т.е. нарушаются условия проведения процесса.
2. Концентрация. Также повысить число эффективных соударений можно, изменив концентрацию реагирующих веществ. Понятие концентрации, как правило, используется для газов и жидкостей, т.к. в газах и жидкостях частицы быстро двигаются и активно перемешиваются. Чем больше концентрация реагирующих веществ (жидкостей, газов), тем больше число эффективных соударений, и тем выше скорость химической реакции.
На основании большого числа экспериментов в 1867 году в работах норвежских ученых П. Гульденберга и П. Вааге и, независимо от них, в 1865 году русским ученым Н.И. Бекетовым был выведен основной закон химической кинетики, устанавливающий зависимость скорости химической реакции от концентрации реагирующих веществ:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении химической реакции.
Для химической реакции вида: aA + bB = cC + dD закон действующих масс записывается так:
здесь v — скорость химической реакции,
CA и CB — концентрации веществ А и В, соответственно, моль/л
k – коэффициент пропорциональности, константа скорости реакции.
Например, для реакции образования аммиака:
N2 + 3H2 ↔ 2NH3
закон действующих масс выглядит так:
Константа скорости реакции показывает, с какой скоростью будут реагировать вещества, если их концентрации равны 1 моль/л, или их произведение равно 1. Константа скорости химической реакции зависит от температуры и не зависит от концентрации реагирующих веществ.
В законе действующих масс не учитываются концентрации твердых веществ, т.к. они реагируют, как правило, на поверхности, и количество реагирующих частиц на единицу поверхности при этом не меняется.
В большинстве случаев химическая реакция осстоит из несольких простых этапов, в таком случае уравнение химической реакции показывает лишь суммарное или итоговое уравнение происходящих процессов. При этом скорость химической реакции сложным образом зависит (или не зависит) от концентрации реагирующих веществ, полупродуктов или катализатора, поэтому точная форма кинетического уравнения определяется экспериментально, или на основании анализа предполагаемого механизма реакции. Как правило, скорость сложной химической реакции определяется скоростью его самого медленного этапа (лимитирующей стадии).
3. Давление. Для газов концентрация напрямую зависит от давления. При повышении давления повышается концентрация газов. Математическое выражение этой зависимости (для идеального газа) — уравнение Менделеева-Клапейрона:
pV = νRT
Таким образом, если среди реагентов есть газообразное вещество, то при повышении давления скорость химической реакции увеличивается, при понижении давления — уменьшается.
Например. Как изменится скорость реакции сплавления извести с оксидом кремния:
CaCO3 + SiO2 ↔ CaSiO3 + CO2
при повышении давления?
Правильным ответом будет – никак, т.к. среди реагентов нет газов, а карбонат кальция – твердая соль, нерастворимая в воде, оксид кремния – твердое вещество. Газом будет продукт – углекислый газ. Но продукты не влияют на скорость прямой реакции.
4. Катализатор. Еще один способ увеличить скорость химической реакции – направить ее по другому пути, заменив прямое взаимодействие, например, веществ А и В серией последовательных реакций с третьим веществом К, которые требуют гораздо меньших затрат энергии (имеют более низкий активационный энергетический барьер) и протекают при данных условиях быстрее, чем прямая реакция. Это третье вещество называют катализатором.
Катализаторы – это химические вещества, участвующие в химической реакции, изменяющие ее скорость и направление, но не расходующиеся в ходе реакции (по окончании реакции не изменяющиеся ни по количеству, ни по составу). Примерный механизм работы катализатора для реакции вида А + В можно изобрать так:
A + K = AK
AK + B = AB + K
Процесс изменения скорости реакции при взаимодействии с катализатором называют катализом. Катализаторы широко применяют в промышленности, когда необходимо увеличить скорость реакции, либо направить ее по определенному пути.
По фазовому состоянию катализатора различают гомогенный и гетерогенный катализ.
Гомогенный катализ – это когда реагирующие вещества и катализатор находятся в одной фазе (газ, раствор). Типичные гомогенные катализаторы – кислоты и основания. органические амины и др.
Гетерогенный катализ – это когда реагирующие вещества и катализатор находятся в разных фазах. Как правило, гетерогенные катализаторы – твердые вещества. Т.к. взаимодействие в таких катализаторах идет только на поверхности вещества, важным требованием для катализаторов является большая площадь поверхности. Гетерогенные катализаторы отличает высокая пористость, которая увеличивает площадь поверхности катализатора. Так, суммарная площадь поверхности некоторых катализаторов иногда достигает 500 квадратных метров на 1 г катализатора. Большая площадь и пористость обеспечивают эффективное взаимодействие с реагентами. К гетерогенным катализаторам относятся металлы, цеолиты — кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия), и другие.
Пример гетерогенного катализа – синтез аммиака:
N2 + 3H2 ↔ 2NH3
В качестве катализатора используется пористое железо с примесями Al2O3 и K2O.
Сам катализатор не расходуется в ходе химической реакции, но на поверхности катализатора накапливаются другие вещества, связывающие активные центры катализатора и блокирующие его работу (каталитические яды). Их необходимо регулярно удалять, путем регенерации катализатора.
В биохимических реакция очень эффективными оказываются катализаторы – ферменты. Ферментативные катализаторы действуют высокоэффективно и избирательно, с избарительностю 100%. К сожалению, ферменты очень чувствительны к повышению температуры, кислотности среды и другим факторам, поэтому есть ряд ограничений для реализации в промышленных масштабах процессов с ферментативным катализом.
Катализаторы не стоит путать с инициаторами процесса и ингибиторами. Например, для инициирования радикальной реакции хлорирования метана необходимо облучение ультрафиолетом. Это не катализатор. Некоторые радикальные реакции инициируются пероксидными радикалами. Это также не катализаторы.
Ингибиторы – это вещества, которые замедляют химическую реакцию. Ингибиторы могут расходоваться и участвовать в химической реакции. При этом ингибиторы не являются катализаторами наоброт. Обратный катализ в принципе невозможен – реакция в любом случае будет пытаться идти по наиболее быстрому пути.
5. Площадь соприкосновения реагирующих веществ. Для гетерогенных реакций одним из способов увеличить число эффективных соударений является увеличение площади реакционной поверхности. Чем больше площадь поверхности контакта реагирующих фаз, тем больше скорость гетерогенной химической реакции. Порошковый цинк гораздо быстрее растворяется в кислоте, чем гранулированный цинк такой же массы.
В промышленности для увеличения площади контактирующей поверхности реагирующих веществ используют метод кипящего слоя. Например, при производстве серной кислоты методом кипящег ослоя производят обжиг колчедана.
6. Природа реагирующих веществ. На скорость химических реакций при прочих равных условиях также оказывают влияние химические свойства, т.е. природа реагирующих веществ. Менее активные вещества будут имеют более высокий активационный барьер, и вступают в реакции медленнее, чем более активные вещества. Более активные вещества имеют более низкую энергию активации, и значительно легче и чаще вступают в химические реакции.
При небольших значениях энергии активации (менее 40 кДж/моль) реакция проходит очень быстро и легко. Значительная часть столкновений между частицами заканчивается химическим превращением. Например, реакции ионного обмена происходят при обычных условиях очень быстро.
При высоких значениях энергии активации (более 120 кДж/моль) лишь незначительное число столкновений заканчивается химическим превращением. Скорость таких реакций пренебрежимо мала. Например, азот с кислородом практически не взаимодействует при нормальных условиях.
При средних значениях энергии активации (от 40 до 120 кДж/моль) скорость реакции будет средней. Такие реакции также идут при обычных условиях, но не очень быстро, так, что их можно наблюдать невооруженным глазом. К таким реакциям относятся взаимодействие натрия с водой, взаимодействие железа с соляной кислотой и др.
Вещества, стабильные при нормальных условиях, как правило, имеют высокие значения энергии активации.
Поделиться ссылкой:
chemege.ru
Зависимость скорости гомогенной химической реакции от концентрации реагирующих веществ
Чтобы произошло химическое взаимодействие, необходимо столкновение реагирующих частиц. При одной и той же температуре количество столкновений растет с увеличением количества реагирующих частиц в единице объема, т.е. с возрастанием концентрации реагентов. Соответственно, скорость реакции повышается с увеличением концентрации реагирующих веществ.
Выведенное на основе экспериментальных данных уравнение, выражающее зависимость скорости от концентраций реагирующих веществ, показывает, что скорость химической реакции пропорциональна произведению концентраций реагентов в степенях, называемых порядками реакции по реагентам и определяемых опытным путем.
Уравнение, устанавливающее зависимость скорости от концентрации реагирующих веществ, называется дифференциальным кинетическим уравнением реакции.
Например, для реакции аА + bB = cC + dD выражение для скорости реакции будет иметь следующий вид:
υ = k[A]n [B]m
(2.3)
где k – коэффициент пропорциональности, называемый константой скорости реакции; [A] и [B] молярные концентрации реагирующих веществ; n и m показатели степеней при концентрациях реагентов (порядки реакции по веществам А и B).
Общим порядком, или просто порядком реакции, называется величина, равная сумме показателей степеней при концентрациях реагентов в кинетическом уравнении реакции (n+m). Порядок реакции равен сумме порядков по реагирующим веществам.
Константа скорости k – постоянная величина (при T = const) и не зависит от концентрации реагентов. Она определяется природой реагирующих веществ и зависит от температуры.
Из уравнения (2.3) следует, что при единичных концентрациях реагирующих веществ (например, [A] = [B] = 1 моль/л) константа скорости реакции численно равна скорости реакции.
Из этого же уравнения видно, что размерность константы скорости реакции зависит от порядка реакции, поскольку размерность скорости реакции для всех гомогенных реакций одинакова. Единицу измерения константы скорости реакции определяют из анализа размерностей.
Порядок реакции зависит от ее сложности.
Для простой (элементарной) реакции стехиометрическое уравнение передает механизм процесса, стехиометрические коэффициенты уравнения реакции совпадают с порядками по реагентам, молекулярность совпадает с общим кинетическим порядком.
Для необратимой элементарной реакции зависимость скорости от концентрации реагентов выражается законом действующих масс.
При постоянной температуре скорость элементарной химической реакции пропорциональна произведению концентраций реагирующих веществ в степенях, равных их стехиометрическим коэффициентам.
Рассмотрим необратимые элементарные реакции разного вида и применим к ним закон действующих масс.
1. Скорость реакции первого порядка
А → продукты,
характеризуется кинетическим уравнением
υ = k [A].
Константа скорости реакции первого порядка имеет размерность
[с-1].
Например, для термораспада диметилового эфира
Ch4OCh4 → Ch5 + h3 + CO,
υ = k [Ch4OCh4]
2. Скорость реакции второго порядка в соответствии с законом действующих масс равна:
2А → продукты, υ = k [А]2;
А + В → продукты, υ = k [А] [В].
Размерность константы скорости реакции второго порядка
[л· моль-1·с-1].
Например, для реакции разложения иодида водорода
2 HI → h3 + I2
υ = k [ HI]2.
Или, для реакции этерификации уксусной кислоты этанолом
Ch4COOH + C2H5OH → Ch4COOC2H5 + h3O,
υ = k [Ch4COOH] [C2H5OH].
3. Скорость реакции третьего порядка
A + B + C → продукты, υ = k [А] [В] [C],
2A + B → продукты, υ = k [А]2 [B];
3A → продукты, υ = k [А]3.
Размерность константы скорости третьего порядка [л²· моль-2·с-1].
Например, реакция взаимодействия оксида азота с хлором
2NO + Cl 2 → 2NOCl,
υ = k [NO]2 [Cl 2].
Закон действующих масс справедлив только для элементарных реакций.
В большинстве случаев реакции многостадийны.
Для сложных (многостадийных) реакций порядки реакции по реагентам не совпадают со стехиометрическими коэффициентами, общий порядок реакции не равен сумме стехиометрических коэффициентов.
Порядок сложной реакции может быть целым, дробным числом и даже равным нулю.
Порядок сложной реакции определяют экспериментально.
Например, реакция: 2N2O5 = 2N2O4 + O2 является сложной и протекает по стадиям:
N2O5 = N2O3 + O2 (а) N2O3 = NO2 + NO (б) NO + N2O5 = 3NO2 (в)
2NO2 = N2O4. (г)
Наиболее медленно протекает стадия (а), т.е. эта стадия является лимитирующей. Скорость стадии (а) и соответственно всей сложной реакции будет равна
υ ≈ υ =
a
k [N2O5].
a
Так, приведенная выше сложная реакция имеет первый порядок по оксиду азота (V) и общий первый порядок.
2.3. Графический метод определения констант дифференциального кинетического уравнения
Определим константы дифференциального кинетического уравнения для следующей реакции:
аА + bB → продукты.
Зависимость скорости от концентраций выражается уравнением
(2.3)
υ = k[A]n [B]m .
Прологарифмируем это выражение
ln υ = lnk + n ln[A] + m ln[B] . (2.4)
Так как величины k, n и m для рассматриваемой реакции (при T =
const) являются постоянными и не зависят от концентрации реагентов, то для их нахождения достаточно определить зависимость скорости реакции от концентрации одного из реагентов при фиксированной концентрации другого реагента.
Пусть в трех опытах концентрация вещества А будет постоянной
и равной [A]0, тогда в уравнении (2.4) сумма ( ln k + n ln[A]
0
величиной постоянной, обозначим ее
) будет тоже
ln k + n ln[A]
0
= D .
Тогда уравнение (2.4) можно переписать как
ln υ = m ln[B] + D . (2.5)
Зависимость (2.5) представляет собой в координатах ln[B] —
ln υ
уравнение прямой линии, тангенс угла наклона которой к оси абсцисс численно равен порядку реакции по веществу В.
По экспериментальным данным строят график зависимости от ln[B] (рис. 3) и находят порядок реакции по веществу B
ln υ
m = lnυ2 −
ln[B]2 −
lnυ1 .
ln[B]1
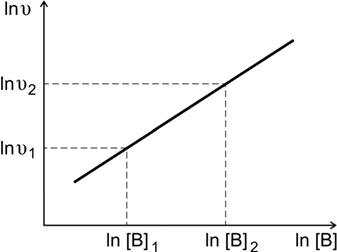
Рис.3. Определение порядка реакции по веществу В
В последующих опытах определяют скорость реакции при различных исходных концентрациях вещества А и постоянной концентрации [B]0. Находят порядок реакции по веществу А
n = ln υ2 −
ln[A]2 −
ln υ1 .
ln[A]1
Из уравнения (2.3) с учетом найденных порядков реакции по веществам А и В рассчитывают константу скорости
k = υi ,
i [A] n [B] m
i i
где
υi , [A]i, [B]i экспериментальные данные, относящиеся к одному
опыту.
2.4. Зависимость концентрации реагирующих веществ от времени для реакции первого порядка.
Интегральное кинетическое уравнение
На практике чаще всего интересует не само значение скорости химической реакции, а то, сколько вещества израсходовано или образовалось к определенному моменту времени после начала реакции.
Рассмотрим эту задачу на примере реакции первого порядка
А → продукты.
Скорость такой реакции выражается следующим уравнением:
υ = k[A] . (2.6)
В дифференциальном виде
− d[A] = k[A] . (2.7)
dt
Перепишем это уравнение в следующем виде:
− d [A] =kdt ,
[A]
и возьмем определенный интеграл от обеих частей уравнения от исходного состояния ([A]0, t0 = 0) до текущего момента ([A]t, t):
[ A]t d[A] t
− ∫ = k ∫ dt .
[ A]0
[A] 0
Решение этого уравнения приводит к следующей зависимости:
или
[A]t
= [A
]0 •
e− kt
(2.8)
(2.9)
ln[A]t
= ln[ A]0 −
kt .
Соотношения (2.8) и (2.9) являются интегральными кинетическими уравнениями реакции первого порядка.
Зная исходную концентрацию вещества [A]0 и константу скорости реакции k, можно рассчитать концентрацию [A]t через любое время t после начала реакции.
Если же известны исходная концентрация [A]0 и концентрация реагирующего вещества [A]t через какое-то время t после начала реакции, то можно рассчитать константу скорости этой реакции
[A]
k = ln 0
t [A]t
. (2.10)
Часто для характеристики скорости реакции пользуются временем полупревращения t1/2 (для реакции первого порядка чаще говорят
«период полураспада»). t1/2 это время, за которое прореагирует по[A]0
ловина исходного вещества
[A]t =
2 . Тогда, исходя из уравнения
(2.10), получим следующие зависимости:
k = 1 ln
[A]0
= ln 2 = 0,693 ;
t1/ 2
[A]0 / 2
t1/ 2
t1/ 2
(2.11)
t
1/ 2
0,693
= .
k
(2.12)
Материал взят из книги Основы химической кинетики (К.И. Болячевская)
studik.net
3. Зависимость скорости гомогенной химической реакции от концентрации реагирующих веществ
Уравнение, устанавливающее зависимость скорости от концентрации реагирующих веществ, называется дифференциальным кинетическим уравнением реакции.
Например, для реакции аА + bB = cC + dD выражение для скорости реакции будет иметь следующий вид:
|
|
(3) |
где k –константа скорости реакции;
[A]и [B] — молярные концентрации реагирующих веществ;
n—порядок реакции по веществу А;
m —порядок реакции по веществуB;
(n+m) —общий порядок реакции.
Константа скорости k – постоянная величина (приT=const) и не зависит от концентрации реагентов. Она определяется природой реагирующих веществ и зависит от температуры.
Из уравнения (3) следует, что при единичных концентрациях реагирующих веществ (например, [A] = [B] = 1 моль/л) константа скорости реакции численно равна скорости реакции. Единицу измерения константы скорости реакции определяют из анализа размерностей.
Порядок реакции зависит от ее сложности.
Для простой (элементарной) реакции стехиометрическое уравнение передает механизм процесса, стехиометрические коэффициенты уравнения реакции совпадают с порядками по реагентам, молекулярность совпадает с общим кинетическим порядком.
Для необратимой элементарной реакции зависимость скорости от концентрации реагентов выражается законом действующих масс, который сформулировали в 1865 г. Н.Н. Бекетов, а в 1867 г. норвежские ученые К. Гульдберг и П. Вааге.
При постоянной температуре скорость элементарной химической реакции пропорциональна произведению концентраций реагирующих веществ в степенях, равных их стехиометрическим коэффициентам.
1. Скорость реакции первого порядка
А продукты,
характеризуется кинетическим уравнением:
 =k [A].
=k [A].
Константа скорости реакции первого порядка имеет размерность [с-1].
Например, для термораспада диметилового эфира:
CH3OCH3 CH4 + H2 + CO,
 = k
[CH3OCH3]
= k
[CH3OCH3]
2. Скорость реакции второго порядкав соответствии с законом действующих масс равна:
А + А продукты,
 =k [А]2;
=k [А]2;
А + В ®продукты,
 =k [А] [В]
.
=k [А] [В]
.
Размерность константы скорости реакции второго порядка
[л·моль-1·с-1].
Например, для реакции разложения иодида водорода:
2 HJH2 +J2
 =k [
HJ]2
=k [
HJ]2
Или, для реакции этерификации уксусной кислоты этанолом:
CH3COOH + C2H5OH ® CH3COOC2H5 + H2O,
 = k [CH3COOH]
[C2H5OH]
= k [CH3COOH]
[C2H5OH]
3. Скорость реакции третьего порядка:
A+B+C®продукты,
 =k [А] [В] [C],
=k [А] [В] [C],
2A+B®продукты,
 =k [А]2 [B];
=k [А]2 [B];
3A®продукты,
 =k [А]3.
=k [А]3.
Размерность константы скорости третьего порядка [л²· моль-2·с-1].
Например, реакция взаимодействия оксида азота с хлором:
2NO + Cl 2 ® 2NOCl,
 = k [NO]2
[Cl 2]
= k [NO]2
[Cl 2]
В большинстве случаев реакции многостадийны.
Для сложных (многостадийных) реакций порядки реакции по реагентам не совпадают со стехиометрическими коэффициентами, общий порядок реакции не равен сумме стехиометрических коэффициентов.
Порядок сложной реакции может быть целым, дробным числом, и даже равным нулю.
Порядок сложной реакции определяют только экспериментально.
Например, реакция: 2N2O5=2N2O4+ O2 является сложной и протекает по стадиям:
|
N2O5 = N2O3 + O2 |
(а) |
|
N2O3 = NO2 + NO |
(б) |
|
NO + N2O5 = 3NO2 |
(в) |
|
2NO2 = N2O4 |
(г) |
Наиболее медленно протекает стадия (а), т.е. эта стадия является лимитирующей. Скорость стадии (а) и соответственно всей сложной реакции будет равна

 akа
[N2O5]
akа
[N2O5]
Так, приведенная выше сложная реакция имеет первый порядок по оксиду азота (V) и общий первый порядок.
studfiles.net
Экспериментальная часть Опыт 1. Зависимость скорости реакции от концентрации реагирующих веществ
Зависимость скорости реакции от концентрации реагирующих веществ в данном опыте изучают на примере реакции взаимодействия тиосульфата натрия Na2S2O3 с серной кислотой H2SO4:
Na2S2O3+ H2SO4= S+ SO2+ Na2SO4+ H2O.
Качественным признаком реакцииявляется помутнение раствора вследствие образования коллоидной серы.
Скорость реакции измеряется временем от начала сливания растворов до появления во всех опытах одинаковой степени мутности раствора.
Выполнение опыта
В три пробирки налейте 1 н. раствор тиосульфата натрия Na2S2O3 и воду в количествах, указанных в табл. 2.
Таблица 2
|
Номер пробирки |
Объем, количество капель |
Условная концент-рация Na2S2O3 |
Время до начала помутнения, (), с |
Условная
скорость реакции,
с–1 | ||
|
Na2S2O3 |
H2O |
Н2SO4 | ||||
|
1 |
4 |
8 |
1 |
1 | ||
|
2 |
8 |
4 |
1 |
2 | ||
|
3 |
12 |
– |
1 |
3 | ||
Содержимое пробирок 1и2осторожно встряхните (перемешайте).
К раствору тиосульфата натрия в первой пробирке добавьте каплю2 н. раствора серной кислоты (необходимо стараться, чтобы капля кислоты сразу попала в раствор, а не на стенку пробирки),и сразу включите секундомер. Как только в растворе появится муть, остановите секундомер, замерьте время и запишите его в табл. 2.
Аналогичные опыты повторите с пробирками 2 и 3. Занесите полученные данные в табл. 2. Рассчитайте условную скорость реакции.
На основании полученных значений постройте график зависимости скорости реакции от концентрации Na2S2O3: по оси абсцисс отложите условную концентрацию Na2S2O3, по оси ординат – условную скорость реакции. Сделайте вывод о зависимости скорости реакции от концентрации тиосульфата натрия в растворе.
Опыт 2. Зависимость скорости реакции от температуры
Влияние температуры на скорость химической реакции в данном опыте изучается на примере реакции, описанной в опыте 1.
Опыт проводят при следующих температурах: Т1– комнатная температура,Т2– на 10С выше комнатной температуры,Т3– на 20С выше комнатной температуры.
Экспериментальные данные опыта 1 для пробирки 1перенесите в табл. 3. Укажите значение комнатной температуры (Т1), при которой проводился опыт 1.
Выполнение опыта
Заполните по две пробирки 1и2в соответствии с данными табл. 3.
Таблица 3
|
Номер опыта |
Объем, количество капель |
Т, С |
Время до начала помутнения , с |
Условная
скорость реакции,
| ||
|
Пробирка 1 |
Пробирка 2 | |||||
|
Na2S2O3 |
H2O |
Н2SO4 | ||||
|
1 |
4 |
8 |
1 | |||
|
2 |
4 |
8 |
1 | |||
|
3 |
4 |
8 |
1 | |||
Приготовьте стакан с водой, температура которой на 10 С выше комнатной температуры. В данный стакан поместите пробирки1и2и выдержите их в течение 3–5 минут. Быстро выньте пробирки, слейте их содержимое (раствор из пробирки2необходимо приливать к раствору тиосульфата в пробирке1) и отметьте время до начала помут-нения.
Аналогично повторите опыт при температуре на 20 выше комнатной.
Данные (температуру Т2 иТ3, время до помутнения в опытах 2 и 3) занесите в таблицу (результаты опытов 2 и 3).
Пользуясь правилом Вант–Гоффа и значениями условной скорости реакции при разных температурах, рассчитайте значения температурного коэффициента 1,2, средпо формулам:
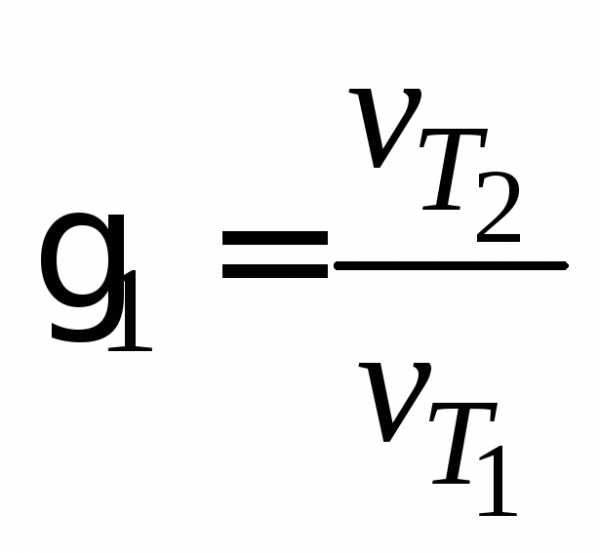 ,
,
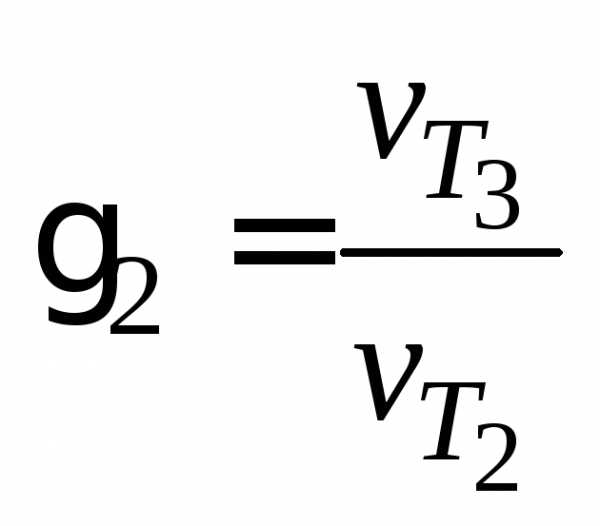 ,
,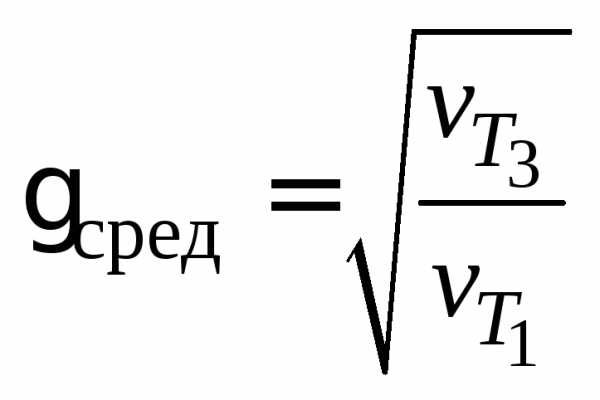 .
.
Постройте
график зависимости скорости реакции
от температуры, отложив по оси абсцисс
температуру, а по оси ординат величины 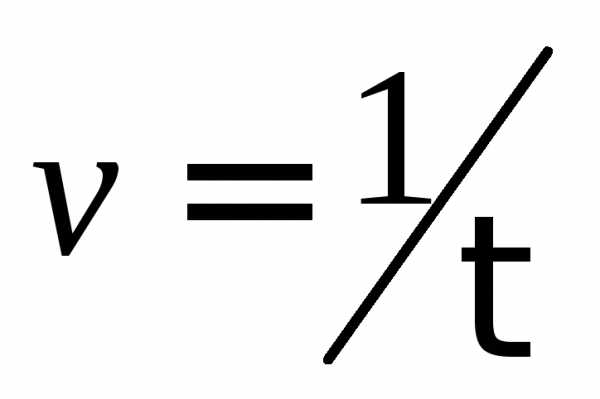 .
.
Рассчитайте энергию активации данной реакции при температурах Т1иТ2по уравнению Аррениуса:
.
Сделайте выводы о выполнении правила Вант–Гоффа и о зависимости скорости химической реакции от температуры.
studfiles.net
Зависимость скорости реакции от концентрации реагирующих веществ
Зависимость скорости реакций от концентрации реагирующих веществ. Количественно скорость химической реакции принято характеризовать изменением концентрации реагирующих веществ в единицу времени. По существу безразлично, концентрацию какого из реагирующих веществ рассматривать. Концентрации исходных веществ будут уменьшаться, а получаемых — возрастать. [c.463]Основным законом химической кинетики является постулат, выражающий зависимость скорости реакции от концентрации реагирующих веществ скорость реакции в каждый момент времени пропорциональна произведению возведенных в некоторую степень концентраций реагирующих веществ (закон действия масс). Так, для реакции (а) скорость может быть записана [c.320]
Порядок реакции. Порядок химической реакции определяется по более формальному признаку, чем ее молекулярность,— по виду уравнения, выражающего зависимость скорости реакций от концентраций реагирующих веществ. Порядок реакции равен сумме показателей степеней концентраций в уравнении, выражающем зависимость скорости реакции от концентраций реагирующих веществ. Реакции разделяются на реакции первого порядка, второго порядка, третьего порядка (реакции более высоких порядков не встречаются). Кроме того, известны так называемые реакции нулевого порядка и некоторые реакции, порядок которых выражается дробным числом. [c.467]
В пособии по химии написано Зависимость скорости реакции от концентрации реагирующих веществ определяется законом действующих масс скорость химической реакции при постоянной температуре пропорциональна произведению концентраций реагирующих веществ, возведенных в степень их стехиометрических коэффициентов . Найдите ошибки и неточности е определении. [c.119]
Если зависимость скорости реакции от концентрации реагирующих веществ записывается в виде [c.47]
В курсе общей химии рассматривается вывод уравнения константы равновесия кинетическим путем—на основе равенства скоростей прямой и обратной реакций и зависимости скорости реакции от концентрации реагирующих веществ. Таким же путем закон действия масс был выведен Гульдбергом и Вааге (1867). Однако этот путь можно применить лищь для сравнительно простых реакций. В общем же случае следует использовать термодинамический вывод. [c.259]
Для каких реакций можно предсказать зависимость скорости реакции от концентраций реагирующих веществ [c.119]
В формальной кинетике рассматривается зависимость скорости реакции от концентрации реагирующих веществ. Она основана на ряде положений, из которых наиболее важными являются закон химической кинетики, принцип независимости протекания химических реакций в системе и уравнение материального баланса реагентов. Закономерности протекания элементарного химического акта и влияние ИХ на общую скорость процесса в формальной кинетике не рассматриваются. [c.533]
Таким образом, порядок реакции характеризует формально-кинетическую зависимость скорости реакции от концентрации реагирующих веществ, а молекулярность — элементарный механизм отдельных стадий сложного процесса. Эти понятия совпадают только для простых по механизму реакций. [c.18]
Зависимость скорости реакции от концентрации реагирующих веществ подчиняется закону действия масс при постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ. Например, для реакции [c.32]
Зависимость скорости реакции от концентрации реагирующих веществ выражает закон действия масс скорость химической реакции пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам, стоящим перед формулами веществ в уравнении химической реакции [c.3]
Кинетическое уравнение характеризует зависимость скорости реакции от концентрации реагирующих веществ и температуры. Выбор формы этого уравнения может быть продиктован или теоретическими соображениями, исходя из некоторой модели, или же кинетическое уравнение является эмпирическим описанием экспериментальных данных. Во всех случаях значение констант уравнения можно определить только опытным путем. Предсказать их теоретически в настоящее время невозможно. [c.58]
Скорость реакции зависит от природы системы, концентрации ее компонентов, присутствия в системе катализаторов или ингибиторов, а также от температуры и давления системы. Зависимость скорости реакции от концентрации реагирующих веществ описывается основным законом кинетики-. [c.112]
Как вытекает из уравнения ЗДМ, для реакции синтеза аммиака повышение давления или концентрации азота и водорода в 2 раза должно вызвать увеличение скорости реакции в 16 раз. Однако наблюдаемое увеличение скорости намного меньше, т. е. реальная зависимость скорости реакции от концентрации реагирующих веществ не подчиняется ЗДМ. Объяснить это можно следующим образом. Когда записывается уравнение ЗДМ для скорости реакции синтеза аммиака исходя из химического уравнения реакции, то предполагается, что взаимодействие происходит в один акт путем одновременного столкновения трех молекул Нг и одной молекулы N2. В действительности же эта реакция протекает через ряд промежуточных стадий, каждая из которых описывается характерным для [c.112]
В отличие от молекулярности реакции, порядок реакции определяется по уравнению, выражающему зависимость скорости реакции от концентрации реагирующих веществ. [c.314]
Зависимость скорости реакции от концентраций реагирующих веществ. Необходимым условием того, чтобы между частицами (атомами, молекулами, ионами) исходных веществ произошло химическое взаимодействие, является их столкновение друг с другом (соударение). Точнее говоря, частицы должны сблизиться друг с другом настолько, чтобы атомы одной из них испытывали бы действие электрических полей, создаваемых атомами другой. Только при этом станут возможны те переходы электронов и перегруппировки атомов, в результате которых образуются молекулы новых веществ — продуктов реакции. Поэтому скорость реакции пропорциональна числу соударений, которые претерпевают молекулы реагирующих веществ. [c.194]
Зависимость вида (11.8) практически всегда выполняется для реакций, протекающих в одну стадию. В гл. 1П показано, что кинетическое уравнение, описывающее зависимость скорости реакции от концентрации реагирующих веществ для такой одностадийной (элементарной) реакции, протекающей по стехиометрическому уравнению [c.44]
Запись данных опыта. Данные опыта занести в таблицу. Начертить график зависимости скорости реакции от концентрации реагирующих веществ. На оси абсцисс отложить в определенном масштабе относительные концентрации Тиосульфата натрия, на оси ординат —соответствующие им скорости. [c.44]
О характере зависимости скорости реакции от концентрации реагирующих веществ можно судить по значениям константы скорости и порядка реакции. Это очевидно из сравнения кинетических кривых реакций разных порядков, приведенных на рис. П1.3. [c.157]
Зависимость скорости реакции от концентрации реагирующих веществ выражается кинетическим уравнением [c.59]
Зависимость скорости реакции от концентраций реагирующих веществ выражается законом действия масс скорость химической реакции прямо пропорциональна произведению молярных концентраций реагирующих веществ, взятых в степени, равной стехиомет-рическому коэффициенту данного вещества в уравнении реакции. Для реакции общего вида [c.105]
Таким образом, только в отдельных простейших случаях исходя из химического уравнения реакции можно вывести уравнение ЗДМ, описывающее реальную зависимость скорости реакции от концентрации реагирующих веществ. В большинстве других случаев этого сделать нельзя, так как из хими-уравнения следует только то, какие вещества и в каких мольных соотношениях взаимодействуют. О механизма протекания реакций химические уравнения ничего не говорят, Для вывода уравнения ЗДМ, описывающего реальную зависимость скорости реакции от концентраций реагирующих веществ, необходимо изучить механизм и расшифровать все стадии реакций. [c.113]
Вторая стадия — самая медленная (лимитирующая). Каков ожидаемый вид зависимости скорости реакции от концентрации реагирующих веществ [c.153]
Закон действия масс первоначально был сформулирован как выражение зависимости скорости реакции от концентрации реагирующих веществ, см. 11.9. [c.120]
Зависимость скорости реакции от концентрации реагирующих веществ [c.111]
Удобнее всего рассмотреть зависимость скорости реакции от концентрации реагирующих веществ для случая, когда все реагирующие вещества находятся в газообразном состоянии. Особенностью таких реакций является то, что химическое взаимодействие протекает во всем объеме реакционной среды. Такие реакции называются гомогенными в отличие от гетерогенных реакций, когда реагирующие вещества находятся в различных агрегатных состояниях и взаимодействие веществ происходит на поверхности одного из них. Например, реакции окисления железа, растворения цинка в кислоте, горения твердого или жидкого топлива на воздухе относятся к гетерогенным. [c.111]
Уравнения, показывающие зависимость скорости реакции от концентраций реагирующих веществ, называются кинетическими уравнениями. [c.81]
Чтобы осуществлялось химическое взаимодействие веществ А и В, пх молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает реакция. А число столкновений тем больше, чем выше концентрация реагирующих веществ. Отсюда на основе обширного экспериментального материала сформулирован основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентрации реагирующих веществ скорость химической реакции пропорциональна произведению концентраций реагирующих веществ. Для приведенной выше реакции этот закон выразится уравнением [c.64]
Во второй половине XIX века были разработаны начала учения о скорости химических реакций — химической кинетике—и учения о равновесиях в химических системах. Вскоре после указанных выше работ Бекетова шведскими учеными Гульд-бергом и Вааге (1867) был открыт закон, количественно выражающий зависимость скорости реакции от концентрации реагирующих веществ и выражающий соотношение между концентрациями веществ, участвующих в реакции при равновесии, — закон действия масс. [c.17]
Характер зависимости скорости реакции от концентрации реагирующих веществ определяется порядком реакции. [c.21]
Зависимость скорости реакции от концентрации реагирующих веществ определяется основным законом химической кинетики скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. [c.68]
Действительный, экспериментально найденный характер зависимости скорости реакции от концентраций реагирующих веществ и определяет порядок реакции (который лишь для элементарных реакций определяется суммой стехиометрических коэффициентов). В общем случае для реакции [c.201]
Все данные опыта занесите в таблицу. Сделайте вывод о зависимости скорости реакции от концентрации реагирующих веществ. Как согласуются ваши наблюдения с законом действия масс [c.42]
На первой стадии изучения реакции надо прежде всего определить скорость протекания изучаемой реакции. Эта область кинетических исследований называется формальной кинетикой. Она включает также изучение зависимости скорости реакции от концентрации реагирующих веществ, температуры и давления. [c.111]
Зависимость скорости реакции от концентрации реагирующих веществ выражена в законе действия масс Скорость реакции прямо пропорциональна произведению концентраций реагируюи их веществ [c.78]
Для объяснения зависимости скорости реакции от концентрации реагирующих веществ необходимо знать, сколько молекул (атомов или ионов) реагента одновременно участвует в одном элементарном акте реакции, т. е. молекулярность реакции. Если в элементарном акте участвует одна молекула реагента (как, например, в реакции разложения МзОд = N02 + + N0 4- О2), то это — мономоле к улярная реакция, если две — бимолекулярная, если три — тримоле-кулярная. Может показаться, что для нахождения моле-кулярности реакции достаточно знать коэффициенты в уравнении процесса. Однако сам процесс может складываться из различных элементарных актов, происходящих последовательно или параллельно. В этом случае уравнение химической реакции отражает лишь суммарный эффект этих взаимодействий. [c.171]
Зависимость скорости реакции от концентрации реагирующих веществ можно понять, исходя из представлений молекулярно-кинетической теории. Для этого рассмотрим в качестве примера взаимодействие между двумя газообразными веществами при условии, что их молекулы сталкиваются друг с другом беспрепятственно. Молекулы газов, находясь в непрерывном движении, неизбеж-сталкиваются друг с другом. Взаимодействие между молекулами, очевидно, может происходить только при их столкновении, следовательно, чем чаще будут сталкиваться молекулы, тем быстрее будет протекать химическая реакция. Частота же столкновений молекул прежде всего зависит от числа реагирующих молекул в единице объема, т. е. от концентраций реагирующих веществ. [c.129]
Для химического взаимодействия веществ А и В их молекулы или частицы должны столкнуться. Чем больше столкновений, тем быстрее протекает реакция. А число столкновений тем больше, чем выше концентрация реагирующих веществ. Отсюда на основе обншрного экспериментального материала сформулирован основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентрации реагирующих веществ [c.112]
Для объяснения зависимости скорости реакции от концентрации реагирующих веществ необходимо знать, сколько молекул (атомов или ионов) реагента одновременно участвует ь одном элементарном акте реакции, т. е. молекулярность реакции. Если в элементарном акте участвует одна молекула реагента (как, например, в реакции разложения N205=N02+N0 + 02), то это — мои о молекулярная реакция, если, две — бимолекулярная, если три — тримолекулярн а я. Может показаться, что для [c.129]
Считая началом реакции момент сливания растворов реагентов, а концом — момент выделения свободного иода (появление синей окраски), можно установить время течения процесса по секундомеру или метроному. Изменяя концентрацию раствора одного из реагентов (в данном опыте — иодата калия), можно установить зависимость скорости реакции от концентрации реагирующих веществ при посто51нной температуре. [c.40]
chem21.info

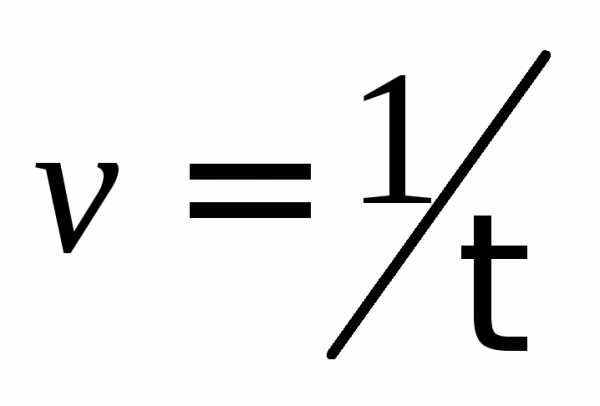 ,
,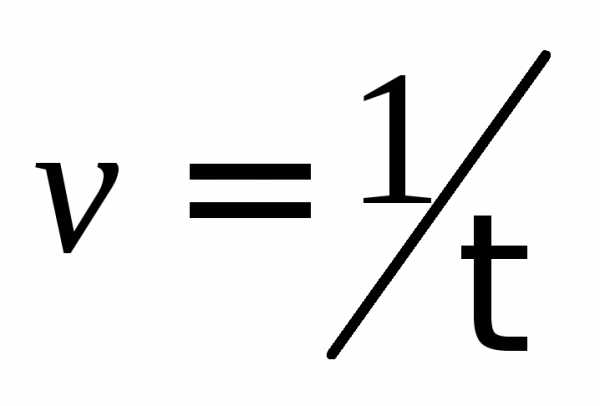 ,
с–1
,
с–1