«Методика решения химических задач по уравнениям реакций по известным параметрам исходного вещества без примесей и с примесями. в формате ОГЭ и ЕГЭ»
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
СЛУШАТЕЛЯ ПРОГРАММЫ ДОПОЛНИТЕЛЬНОГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ ПОВЫШЕНИЯ КВАЛИФИКАЦИИ «МЕТОДИЧЕСКИЕ ПОДХОДЫ К РЕШЕНИЮ РАСЧЁТНЫХ И ЭКСПЕРИМЕНТАЛЬНЫХ ЗАДАЧ ДЛЯ ПОДГОТОВКИ К ОГЭ И ЕГЭ ПО ХИМИИ»
По теме «Методика решения химических задач по уравнениям реакций по известным параметрам исходного вещества без примесей и с примесями.
в формате ОГЭ и ЕГЭ»
Учителя МБОУ Нахабинская СОШ № 3
Г.о. Красногорск п. Нахабино
Московской области
Новиковой Татьяны Юрьевны
ГОРОД КРАСНОГОРСК
2018
Расчётные задачи по химии учащиеся решают с начала VIII класса и до конца обучения в школе. Решение задач позволяет:
расширять кругозор учащихся;
развивать умение логически мыслить;
воспитывать самостоятельность, внимательность, умение анализировать, делать правильные выводы;
устанавливать связь химии с другими науками: физикой, математикой, биологией, экологией и др.;
способствует политехнической подготовке учащихся, готовиться к успешной аттестации по предмету (в том числе в форме ОГЭ и ЕГЭ).
Решая задачи, учащиеся более глубоко усваивают учебный материал, учатся применять приобретённые теоретические знания на практике.
Использование задач в школе позволяет решать основные функции обучения и воспитания.
Обучающие функции обеспечиваются формированием важных структурных элементов знаний, осмыслением химической сущности явлению, умением применять усвоенные знания в конкретно заданной ситуации. Решение задач – это активный познавательный процесс.
Воспитывающие функции реализуются формированием мировоззрения, расширением кругозора. Учебные задачи являются действенным средством воспитания трудолюбия, настойчивости, воли, характера.
Развивающиеся функции проявляются в результате формирования логического, творческого мышления, развитие смекалки учащихся. Решение задач – это мыслительный процесс.
Традиционная методика обучения решения химических задач (чаще всего – это решение задач методом составления пропорций) имеет ряд недостатков. В результате лишь немногие учащиеся сознательно и творчески овладевают общим подходом к решению, умеют оценивать свои действия в процессе решения, самостоятельно составлять условия задач, умеют выбирать рациональные способы решения и др.
Представленная методика обучения решения задач от общих приёмов к частным позволяет решить недостатки традиционных способов обучения. В данной работе показываются приёмы решения задач с использованием основных физических величин. Среди них величина n (или ν) — количество вещества — позволяет связать все основные физические величины друг с другом. Это даёт возможность составлять логические схемы решения задач с использованием этих физических величин
Задача учителя состоит в том, чтобы научить учащихся понимать смысл этих физических величин и применять физические формулы при решении расчётных задач различных типов, научить анализировать условия задач, через составление логической схемы решения конкретной задачи на основе знания общего подхода к решению. Составление логической схемы задачи предотвращает многие ошибки, которые допускают учащиеся.
При решении задач необходимо руководствоваться несколькими простыми правилами:
Порядок решения задачи:
Прочитайте задачу, запишите краткое условие.
Составьте уравнение химической реакции.
Рассчитайте массу чистого вещества, необходимого для реакции по уравнению реакции .
Вычислите массу примесей в образце по условию.
Вычислите массовую долю примесей по формуле: ωприм. = mприм./mсмеси.
Образец решения:
Определите массовую долю примесей в техническом образце карбида кальция, если из 200 г его получили 56 л ацетилена.
Р е ш е н и е:
Записываем уравнение химической реакции:
CaC2 + 2Н2О = С2Н2 + Са(ОН)2
Определяем количество вещества ацетилена:
n= V/Vm n= 56/22,4 =2,5 моль,
следовательно, по уравнении химической реакции чистого CaC2 вступило в реакцию 2,5 моль
m(
m(CaC2) = 2,5 ×64 = 160г
m примесей = 200-160=40 г
3) определяем массовую долю примесей:
ωприм = 40 г/ 200 г = 0,2 (или 20%).
Ответ: ωприм = 20%.
Решение расчетных задач «на примеси» и определение массовой доли вещества в растворе после реакции.
При решении задач такого типа считается, что примеси – это вещества, не способные вступать в реакцию по составленному для решения уравнению.
Пример 1. 10 г железа, содержащего 16 % примесей, растворили в 150 мл 10 % раствора соляной кислоты (плотностью 1,05 г/мл). Вычислите объем выделяющегося газа (н. у.) и массовую долю хлороводорода в полученном растворе.
Алгоритм решения:
Составляем уравнение реакции по условию задачи, расставляем коэффициенты.
Fe + 2HCl = FeCl2 + H2
16% от 10 г – примеси, которые не реагируют по составленному уравнению. Находим массу чистого вещества железа. m(Fe) = 10 . (1 – 0,16) = 8,4
Находим количество вещества железа по формуле n = m/M,
(n(Fe) = 8,4/56 = 0,15 моль
Учитываем, что коэффициенты в любом химическом уравнении указывают на соотношение количеств веществ участников реакции. Следовательно, количество вещества израсходованной HCl будет в два раза больше, чем количество вещества железа (коэффициенты 2 и 1, соответственно), а количество вещества водорода будет равно количеству вещества железа (коэффициенты 1 и 1, соответственно).
Находим массу израсходованного хлороводорода m(HCl) = 0,3 . 36,5 = 10,95 г
Объем образующегося водорода (н. у.) рассчитываем по формуле V = n . 22,4, что составит V(HCl) = 0,15 . 22,4 = 3,36 л.
По условию задачи требуется найти массовую долю хлороводорода в растворе после прохождения реакции (соляная кислота – это раствор хлороводорода в воде). Массовую долю находим по формуле w = m части/mцелого.
В данном случае часть – это масса оставшегося после прохождения реакции хлороводорода, целое — масса раствора после реакции.
Очень важно понимать, что в состав раствора входит растворитель (вода в данном случае) и вещества, растворенные в этом растворителе. Образующийся нерастворимый в воде газ и осадки не входят в состав раствора.
Находим массу исходного раствора соляной кислоты по формуле:
mраствора = Vраствора . p(плотность раствора)
После чего массу вещества хлороводорода в растворе рассчитываем по формуле
m = mраствора × массовую долю вещества (выраженную десятичным числом).
Соединяем две последние формулы и получаем m(HCl) = 150 × 1,05 ×0.1 = 15,75 г.
Из этой массы израсходовано на растворение железа 10,95 г хлороводорода, следовательно осталось 15,75 – 10,95 = 4,8 г.
Находим массу раствора после реакции. Для этого надо сложить массу исходных железа (оно растворилось в кислоте полностью) и раствора соляной кислоты, затем вычесть из полученной суммы массу улетевшего из раствора водорода
m(раствора после реакции) = 8,4 + 150 . 1,05 – 0,15 . 2 = 166,2 г
Определяем массовую долю хлороводорода в растворе после прохождения реакции
w = 4,8/166,2 = 0,0289 или 2,89 %.
Пример 2. 11,2 г мрамора растворили в избытке соляной кислоты и получили 2, 24 л газа (н.у.). Рассчитайте массовую долю примесей в израсходованном образце мрамора.
Алгоритм решения
Мрамор – это минерал, основу которого составляет карбонат кальция. Составляем уравнение реакции, расставляем коэффициенты
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
Рассчитываем количество вещества газа (газ — это углекислый газ)
n (CO2) = 2,24/22,4 = 0,1 моль
Исходя из соотношения количеств веществ в уравнении (1 к 1 при формуле карбоната кальция и углекислого газа), количество вещества карбоната кальция такое же, 0,1 моль. 2. Находим массу чистого карбоната кальция в образце мрамора.
m(CaCO3) = 0,1 . 100 = 10 г
Следовательно, масса примесей составит 11,2 – 10 = 1,2 г
Массовая доля примесей w(примесей) = 1,2/11,2 = 0,1071 или 10,71%.
Пример 3. Технический карбид кальция массой 20 г обработали избытком воды, получив ацетилен, при пропускании которого через избыток бромной воды образовался 1,1,2,2 –тетрабромэтан массой 86,5 г. Определите массовую долю СаС2 в техническом карбиде.
Дано: m = 20 г; m(C2h3Br4)=86,5 г.
Найти: ω(СаC2) =?
Решение: записываем уравнения взаимодействия карбида кальция с водой и ацетилена с бромной водой и расставляем стехиометрические коэффициенты.
CaC2 +2 H2O = Ca(OH)2 + C 2H2
C2H2 +2 Br2 = C2H2Br4
Находим количество вещества тетрабромэтана.
n(C2h3Br4) = m(C2h3Br4)/ М(C2h3Br4) = 86,5/ 346 = 0,25 моль.
Из уравнений реакций следует, что n(C2h3Br4) =n(C2h3) = n(СаC2) =0,25 моль. Отсюда мы можем найти массу чистого карбида кальция (без примесей).
m(СаC2) = n(СаC2) • М(СаC2) = 0,25• 64 = 16 г.
Определяем массовую долю СаC2 в техническом карбиде.
ω(СаC2) =m(СаC2)/m = 16/20 = 0,8 = 80%.
Пример 4. В бензоле объемом 170 мл растворили серу массой 1,8 г. Плотность бензола равна 0,88 г/мл. Определите массовую долю серы в растворе.
Дано: V(C6H6) =170 мл;
m(S) = 1,8 г;
ρ(C6H6)=0,88 г/мл.
Найти: ω(S) =?
Решение: для нахождения массовой доли серы в растворе необходимо рассчитать массу раствора. Определяем массу бензола.
m(C6
Находим общую массу раствора.
m(р-ра) = m(С6C6) + m(S) =149,6 + 1,8 = 151,4 г.
Рассчитаем массовую долю серы.
ω(S) =m(S)/m=1,8 /151,4 = 0,0119 = 1,19 %.
Задачи для самостоятельного решения 9 класс
1.Какая масса азотной кислоты образуется при взаимодействии серной кислоты с 200г нитрата натрия, содержащего 10% примесей?
2.Какой объем газа выделится при разложении 300г нитрата лития, содержащего 20% примесей?
3. Какая масса азотной кислоты образуется при взаимодействии 196г серной кислоты и 100г нитрата калия, сод.20% примесей?
4.При разложении 250г нитрата натрия выделился газ объемом 22,4л. Найдите долю чистого вещества нитрата натрия в исходном образце?
infourok.ru
Задачи по химии. Выход продукта реакции. Примеси. Потери
При восстановлении водородом оксида меди (II) массой 64 кг была получена медь массой 43,52 кг. Укажите выход (%) продукта реакции.
а) В избытке кислорода сожгли углерод массой 240 г. Укажите массу (г) оксида углерода (IV), который был получен, если потери в производстве (реакции) составляют 10%.
б) В избытке кислорода сожгли углерод массой 240 г. Укажите массу (г) оксида углерода (IV), который был получен, если практический выход реакции равен 90%
в) В избытке кислорода сожгли углерод массой 240 г. Укажите массу (г) оксида углерода (IV), который был получен, если исходное вещество содержит 10% примесей по массе.
Над нагретой серой массой 20,48 г пропустили водород. Образовавшийся сероводород пропустили через избыток раствора гидроксида калия. Определите массу (г) образовавшегося сульфида, если выход продукта реакции на первой стадии равен 90%, на второй – 85%.
Кусочек мела массой 2,5 г, массовая доля карбоната кальция в котором равна 95%, опустили в раствор массой 10 г с массовой долей серной кислоты 33,33%. В результате реакции выделился газ объёмом (н.у.) 500 см3. Определите выход (%) продукта реакции.
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ, ЦТ и РТ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув здесь «Получить все материалы сайта»
www.yoursystemeducation.com
Практикум решения различных типов задач по химии (8 класс)
Практикум по решению задач – 8 класс
Расчётные задачи на выход продукта реакции от теоретически возможного
1.Вычислите выход соли от теоретически возможного, если при взаимодействии 56 грамм гидроксида калия с серной кислотой было получено 80 грамм соли.
2. Вычислите выход бария, если при его восстановлении из 4,59 килограмм оксида бария с помощью алюминия, было получено 3,6 кг бария.
3.При взаимодействии 8 грамм гидроксида натрия с хлоридом цинка было получено 9 грамм гидроксида цинка. Определите массовую долю выхода гидроксида цинка от теоретически возможного (в %).
4. Вычислите выход водорода, если при взаимодействии 20 грамм натрия с водой было получено 10 литров водорода. Схема реакции : Na + H2O → NaOH + H2↑.
5.Вычислите объёмную долю выхода хлороводорода (HCℓ), если при взаимодействии 5 литров водорода с хлором (Cℓ2) было получено 6 литров хлороводорода.
6. Вычислите выход аммиака (NH3),если при взаимодействии 20 грамм хлорида аммония (NH4Cℓ) с избытком гидроксида кальция было получено 7,9 литров аммиака. Схема реакции: NH4Cℓ + Ca(OH)2 →NH3 ↑ + H2O + CaCℓ2.
7.Вычислите массу азотной кислоты, которую можно получить при реакции 20,2 граммов нитрата калия с серной кислотой, если массовая доля выхода азотной кислоты составляет 90% от теоретически возможного.
8.Какой объём водорода можно получить при взаимодействии 20граммов кальция с соляной кислотой, если объёмная доля выхода водорода от теоретически возможного составляет 91% ?
9.Вычичлите объём аммиака (NH3), который может быть получен при нагревании 25 грамм хлорида аммония (NH4Cℓ) с избытком гидроксида кальция, если объёмная доля выхода аммиака составляет 85%от теоретически возможного.
10.Каую массу сульфата магния можно получить при взаимодействии 48граммов магния с серной кислотой, если массовая доля выхода сульфата магния составляет 82 % от теоретически возможного?
11. При взаимодействии 5,4 грамм алюминия с соляной кислотой было получено 4,48 литров водорода. Вычислите выход водород в процентах от теоретически возможного.
12. Какой объём сероводорода (H2S) может быть получен при взаимодействии 194граммов сульфида цинка с соляной кислотой, если объёмная доля выхода сероводорода от теоретически возможного составляет 80 % ?
13.Расчитайте массу гидроксида железа (III), который может быть получен при взаимодействии 160 грамм гидроксида натрия и хлорида железа (III). При этом выход гидроксида железа (III) составляет 70 %.
14.Сколько граммов меди можно получить при взаимодействии хлорида меди (II) с железом, если массовая доля выхода меди составляет 72 % от теоретически возможного?
infourok.ru
Задачи на примеси
Documents войти Загрузить ×- Естественные науки
- Химия
Related documents
Задания по химии для проведения олимпиады вузов Росрыболовства Заочный тур 10 класс

— pedportal.net

ХИМИЧЕСКИЕ СВОЙСТВА АЛКЕНОВ Вариант № ________

ОТВЕТЫ НА ЗАДАНИЯ Вариант №1

1. 24. 42. фида. Рассчитайте молярные массы эквивалентов металла и его сульфида.

ОТВЕТЫ НА ЗАДАНИЯ Вариант №2

Вариант № 4 Тесты в форме…

СХЕМЫ по органической химии, составленные обучающимися

Итоговая контрольная работа за курс химии 10

Задачи по химии для учащихся 10 класса 1. Имеется два сосуда
Скачать advertisement StudyDoc © 2018 DMCA / GDPR Пожаловатьсяstudydoc.ru
Решение задач на расчёт массы и массовой доли вещества
Важно знать! Как научиться решать задачи по химии.
Задача 1-10. Сколько граммов кислорода можно получить при нагревании 25 г перманганата калия, если реакция разложения протекает с выходом 86% ?
Решение. Выход реакции η определяется как отношение практически полученной массы продукта к теоретической массе, рассчитанной по уравнению реакции:
η = (mпракт / mтеор) • 100%
Выход дан в условии задачи, а теоретическую массу кислорода рассчитаем по уравнению реакции:
2KMnO4 = К2MnO4 + MnO2 + O2↑.
v(KMnO4) = m(KMnO4) /M (KMnO4) = 25 / 158 = 0,16 моль.
В уравнении реакции разложения коэффициент перед O2 в 2 раза меньше, чем коэффициент перед KMnO4, поэтому количество вещества кислорода также в 2 раза меньше:
v(O2) = v(KMnO4) / 2 = 0,08 моль.
Теоретически возможная масса кислорода
mтеор(O2) = v(O2) • М(O2) = 0,08 • 32 = 2,56 (г).
Согласно уравнению реакции
из 2 моль (2 • 158 = 316 г) KMnO4 образуется 1 моль (32 г) O2;
из 25 г KMnO4 ->>- x г O2.
x = 25 • (32 / 316) = 2,56 (г)
Практическую массу кислорода находим, умножая теоретическую на выход:
mпракт(O2) = mтеор(O2) • η = 2,56 • 0,86 = 2,2 (г)
Ответ: 2,2 г O2.
Задача 1-11. Рассчитайте массовые доли веществ в смеси этилового спирта и воды, в которой число атомов кислорода в 2,5 раза больше числа атомов углерода.
Решение. Стандартный способ решения расчетных задач на установление состава смеси состоит в том, чтобы обозначить количества
веществ через неизвестные переменные и составить для них систему уравнений.
Пусть моль, моль. По условию общее число атомов кислорода (из этилового спирта и воды) в 2,5 раза больше числа атомов углерода (из этилового спирта):
Теперь надо выразить количества атомов через количества молекул, т. е. через x и y. В молекуле содержится один атом , поэтому в х моль содержится столько же, т. е. x моль ; в y моль содержится y моль : Углерод содержится только в этиловом спирте: в молекуле содержится два атома , поэтому в x моль содержится в два раза больше, т. е. 2x моль : . Подставим эти количества атомов в условие задачи:
,
откуда .
Число молекул воды в смеси в 4 раза больше числа молекул спирта.
Массы веществ можно выразить черед количества вещества и учесть соотношение между x и y:
;
;
.
При расчете массовых долей переменная x сокращается, и мы еще раз убеждаемся, что массовая доля вещества не зависит от общего количества смеси:
;
.
Ответ:
[Сборник задач и упражнений по химии: Школьный курс / В.В. Еремин, Н.Е. Кузьменко]
Массовая доля. Расчеты по химическим формулам. Задачи по химии. Решение задач на растворы (массовая доля).
Видео ютуб канала «День знаний»
Поделитесь с друзьями:
zadachi-po-ximii.megapetroleum.ru
|
«Химии требуется не такой, который из одного чтения книг понял всю науку, но который собственным искусством в ней прилежно упражнялся» М.В. Ломоносов
Задачи по химии для самостоятельного решения.
Формулы для решения расчетных задач скачать>>>
Алгоритмы решения расчетных задач:
Для решения экспериментальных задач:
|
|
|||||||||||||||||||||||||||||||||||||||||||||
shishebarova.ucoz.ru
«Методика решения расчетных задач с использованием основных физических величин»
Разделы: Химия
Расчётные задачи по химии учащиеся решают с начала VIII класса и до конца обучения в школе. Решение задач позволяет:
- расширять кругозор учащихся;
- развивать умение логически мыслить;
- воспитывать самостоятельность, внимательность, умение анализировать, делать правильные выводы;
- устанавливать связь химии с другими науками: физикой, математикой, биологией, экологией и др.;
- способствует политехнической подготовке учащихся, готовиться к успешной аттестации по предмету (в том числе и в форме ЕГЭ).
Решая задачи, учащиеся более глубоко усваивают учебный материал, учатся применять приобретённые теоретические знания на практике.
Традиционная методика обучения решения химических задач (чаще всего – это решение задач методом составления пропорций) имеет ряд недостатков. В результате лишь немногие учащиеся сознательно и творчески овладевают общим подходом к решению, умеют оценивать свои действия в процессе решения, самостоятельно составлять условия задач, умеют выбирать рациональные способы решения и др.
Представленная методика обучения решения задач от общих приёмов к частным позволяет решить недостатки традиционных способов обучения. В данной работе показываются приёмы решения задач с использованием основных физических величин. Среди них величина n (или ν) — количество вещества — позволяет связать все основные физические величины друг с другом. Это даёт возможность составлять логические схемы решения задач с использованием этих физических величин.
Задача учителя состоит в том, чтобы научить учащихся понимать смысл этих физических величин и применять физические формулы при решении расчётных задач различных типов, научить анализировать условия задач, через составление логической схемы решения конкретной задачи на основе знания общего подхода к решению. Составление логической схемы задачи предотвращает многие ошибки, которые допускают учащиеся.
Ниже приведены основные формулы физических величин и их взаимосвязи, которые учащиеся должны знать в обязательном порядке и использовать их при решении.
В данной работе показываются примеры решения некоторых основных типов задач, по которым можно понять методический подход при обучении учащихся.
Исходные формулы, отображающие взаимосвязь физических величин.1. Относительная атомная масса (Ar):
, где x – любой химический элемент.
2. Относительная молекулярная масса (Mr): ;
.
3. Плотность вещества (ρ) позволяет связать собой массу (m) и объем (V) вещества: .
4. Масса, объем, число частиц (N), количество теплоты (Q) связаны между собой универсальной физической величиной – количеством вещества – n(или ν):
5. Относительная плотность (D):
6. Массовая доля ω:
элемента в веществе: ; ;
примеси в веществе: ;
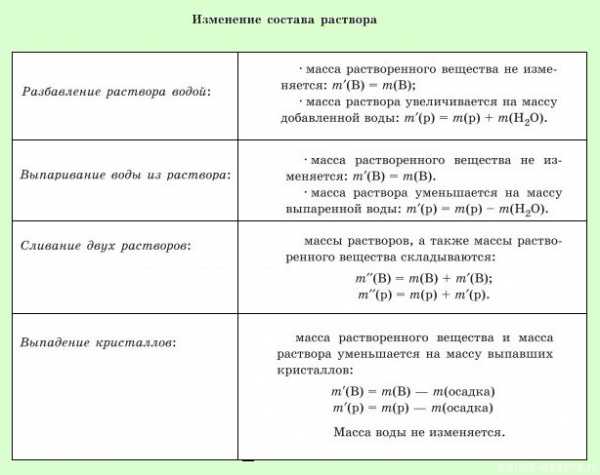
растворенного вещества в растворе: ; mр-ра = mр.в.+ mр-ля
mр-ра=Vр-ра· ρр-ра.
7. Объемная доля вещества в смеси (φ) (для газов): .
8. Молярная концентрация (Сm или С): .
9. Уравнение Клапейрона — Менделеева: .
Методика решения задач различных типов.
Расчеты по химическим формулам.
Решение данного типа задач начинается с осмысления понятия записи химической формулы, с осмыслением того, что учащиеся могут узнать по записи химической формулы. Рассмотрим примеры решения задач с использованием веществ только молекулярного строения. Молекулярная (истинная) формула показывает действительное число атомов каждого элемента в молекуле. В таблице №1 показано, какие сведения о веществе можно узнать по записи формулы вещества.
Таблица № 1.
Алгоритм решения базовой задачи.
- Заданный по условиям параметр переводим в количество вещества (n или ν).
- По индексам определяем количество вещества искомого химического элемента (n(х) или ν(х)).
- По формулам, отображающим взаимосвязь величин, рассчитываем неизвестный параметр.
Графическая схема решения базовой задачи.
Примеры задач
Задача 1. Рассчитайте число атомов углерода и кислорода в 11,2 л. (н.у.) углекислого газа.
Задача 2. В каком объеме углекислого газа содержится 9,03·1023 атомов кислорода?
Какова его масса?
Задача 3. Газ, плотность которого равна 1,96 г/л (н.у.), состоит из углерода и кислорода, причем ω(C) = 0,27. Определите формулу данного вещества.
Логическая схема решения задачи:
Расчёты по химическим уравнениям.
Химическими уравнениями называют условную запись химической реакции посредством химических знаков, формул и коэффициентов.
Уравнение химической реакции показывает, какие вещества вступают в реакцию и какие образуются, а также соотношение количеств этих веществ. Иными словами, химическое уравнение – это способ выражения (передачи) качественной и количественной информации о химическом явлении.
Запишем уравнение реакции в общем виде: aA + bB ® cC +dD, где А и В – исходные вещества, С и D – продукты реакции, a, b, c, d – стехиометрические коэффициенты.
Стехиометрические коэффициенты подбирают на основе того, что число атомов каждого элемента до и после реакции остается неизменным. Это можно рассматривать как следствие закона сохранения массы.
Рассмотрим информацию, содержащуюся в стехиометрических коэффициентах.
Отношение стехиометрических коэффициентов равно:
отношению числа частиц, вступивших в реакцию и образовавшихся в результате реакции
a : b : c : d = N(A) : N(B) : N(C) : N(D)
отношению молярных количеств веществ, вступивших в реакцию и образовавшихся в результате реакции a : b : c : d = n(A) : n(B) : n(C) : n(D)
отношению объемов, вступивших в реакцию и образовавшихся в результате реакции газообразных веществ a : b : c : d = V(A) : V(B) : V(C) : V(D).
Последнее отношение выполняется, если:
- это газообразные вещества, близкие по свойствам к идеальному газу,
- объемы этих газов измерены при одинаковом давлении и температуре.
Несмотря на большое разнообразие задач данного типа, принцип решения их одинаков: по известному параметру (N, m, V) одного вещества рассчитывается неизвестный параметр X (Nx, mx, Vx) другого вещества. Такая задача является простейшей (базовой).
Алгоритм решения базовой задачи (последовательность действий).
- Составляем уравнение химической реакции и выписываем мольные соотношения прореагировавших и получившихся веществ.
- По формулам, отображающим взаимосвязь физических величин, переводим заданную по условию величину в количество (n или ν) исходного вещества.
- По мольным отношениям рассчитываем n определяемого вещества (Х).
- По формулам, отображающим взаимосвязь физических величин, рассчитываем неизвестный параметр X.
Графическая схема решения базовой задачи.
В качестве базовых рассмотрим решение следующих задач:
Задача 1. Вычислите n, m, V углекислого газа, полученного при действии на 50 г карбоната кальция избытком раствора соляной кислоты.
Задача 2. При взаимодействии цинка с избытком раствора соляной кислоты выделилось 1,12 л водорода (н.у.). Вычислите массы растворившегося цинка и образовавшейся соли.
Задача 3. При взаимодействии с избытком соляной кислоты металла (валентность, которого во всех соединениях равна II) массой 12 г образовался водород объемом 6,72 л (н.у.).
Определите, какой это металл.
Усложнение базовой задачи.
Расчет массы реагирующих или образующихся химических соединений на практике осложнен. Это обусловлено несколькими причинами:
- Исходные вещества или продукты реакции задаются в условиях отличных от нормальных.
- Исходные вещества вводятся в виде растворов.
- Во многих случаях реагенты содержат примеси, которые в данной конкретной реакции либо не участвуют вообще, либо образуют отличные от целевого продукта вещества.
- Выход продуктов не соответствует теоретическому, т.к. очистка целевого вещества приводит не только к освобождению от многочисленных примесей, но и к частичной потери основного вещества.
Таким образом, перед использованием исходных данных для решения задачи и подстановки их в основную цепь расчетов необходимо провести те или иные дополнительные преобразования. Для перевода условий, отличных от нормальных (для газообразных веществ) используется исходная формула 9 — расчеты физико-химических величин по управлению Клапейрона — Менделеева.
1. Исходные вещества вводятся в виде раствора.
Задача. Сколько граммов 10%-ного раствора гидроксида натрия требуется для нейтрализации
20 г 4,9%-нго раствора серной кислоты?
2. Расчет количественных параметров продуктов реакции, если исходные вещества содержат примеси, расчет массовой доли примеси.
Абсолютно чистого вещества в природе не бывает, поэтому в химических производствах вынуждены использовать исходные вещества, содержащие примеси. Эти примеси обычно имеют отличные от основного вещества свойства и, поэтому не образуют в процессе производства нужные продукты.
В связи с этим, чтобы определить количественные параметры получаемого продукта, необходимо вначале рассчитать количественные параметры вступающего в реакцию чистого вещества, которое содержится в исходном объекте. После этого решается базовая задача.
Обратные задачи заключаются в оценке чистоты исходных веществ по количеству продуктов реакции.
Содержание примеси обычно выражают в частях от единицы (или выражают в %). Эта величина показывает массовую долю чистого вещества (примеси) в исходном образе (формула 1).
Для вычисления массы чистого вещества (или примесей), содержащегося в смеси, используют формулу 2.
(1)
m(смеси) = m(осн.в.) + m(прим.) (2)
Задача. При взаимодействии 10,8 г кальцинированной соды (безводный карбонат натрия)
с избытком раствора соляной кислоты получили 2,24 л (н.у.) оксида углерода (IV).
Вычислите содержание примеси в соде.
3. Расчеты по химическим уравнениям, если одно из реагирующих веществ дано в избытке.
Как быть, если одновременно заданы параметры нескольких реагирующих веществ? По какому из них вести расчет? Это определяют, сравнения отношения стехиометрических коэффициентов и отношение количеств вещества, взятых для данной реакции.
Если один из реагентов присутствует в количестве больше, чем стехиометрическое, то часть его остается неиспользованной после окончания реакции (избыток вещества). Очевидно, что расчеты нужно вести по веществу, которое в данной реакции расходуется полностью (т.е. находится в недостатке).
Задача. В реакционном сосуде смешали 6,72 л оксида углерода (II) и 2,24 л кислорода и смесь подожгли. Определите объемный состав полученной смеси.
Используемая литература:
- Кузнецова Н.Е., Лёвкин А.Н. Задачники по химии для учащихся 8 и 9 классов общеобразовательных учреждений. М.: Вентана-Граф, 2008.
- Лидин Р.А., Аликберова Л.Ю. Химия: Справочник для старшеклассников и поступающих в вузы – М.: АСТ-ПРЕСС ШКОЛА, 2002.
- Лидин Р.А., Аликберова Л.Ю. Задачи, вопросы и упражнения по химии: 8-11 кл.: Пособие для учащихся общеобразовательных учреждений. – М.: Просвещение, 2002.
xn--i1abbnckbmcl9fb.xn--p1ai

