Задачи на концентрации растворов
Для решения задач необходимо знать определения и математические выражения следующих способов выражения концентраций растворов: массовой доли W(%), молярной концентрации С(моль/л), молярной концентрации эквивалента С( (моль/л) и титра t или Т (г/мл), а также связь указанных способов выражения концентрации между собой.
Массовая доля W (процентная концентрация) показывает отношение массы растворенного вещества х, содержащегося в системе, к общей массе этой системы (раствора). W может быть выражена в долях и в процентах:
и (1)
Молярная концентрация С(х) (молярность) – это отношение количества вещества х (в молях), содержащегося в растворе, к объему этого раствора, то есть она показывает, сколько молей растворенного вещества содержится в 1 л раствора.
(моль/л) (2)
Молярная концентрация эквивалента
(моль/л), (3)
где или fэкв(х) – фактор эквивалентности – показывает, какая доля частицы вещества x соответствует одному иону водорода в реакциях без изменения степени окисления или одному электрону в ОВР. — безразмерная величина. Например, =1; =1/2; =1/2; =1/3; =1/6; =1; в кисл. среде)=1/5, т.к. в кислой среде Mn+7 восстанавливается до Mn+2, принимая 5 электронов.
Молярная масса эквивалента вещества — – масса одного моля эквивалента вещества.
(г/моль) (4)
Например, ; = =31, г/моль.
Количество вещества эквивалента — количество вещества, в котором частицами являются эквиваленты
= (моль) (5)
Прежнее название молярной концентрации эквивалента – нормальная концентрация или нормальность. Например, раствор с =0,1 моль/л называется децинормальным или 0,1Н.
Титр раствора t или T – это масса вещества, содержащегося в 1 мл раствора. Единица измерения – г/мл.
(г/мл) (6)
Из основных формул можно вывести и вспомогательные. Из формул (2) и (3) выражают массу (в г):
(г) (7)
и (г) (8)
Связь между молярной концентрацией и массовой долей:
(моль/л) (9)
Вывод формулы (9):
поскольку
из (1), а (г/мл)
Связь между молярной концентрацией эквивалента и массовой долей:
(моль/л) (10)
Вывод формулы (10) аналогичен выводу формулы (9).
Связь между молярной концентрацией и титром:
(г/мл) (11)
Вывод формулы (11):
Связь между молярной концентрацией эквивалента и титром:
(г/мл) (12)
Вывод формулы аналогичен выводу формулы (11).
Связь между титром и массовой долей:
Вывод формулы (13):
Связь между молярной концентрацией и молярной концентрацией эквивалента
(моль/л) (14)
Отсюда (моль/л) (15)
Приравняем правые части формул (7) и (8)
Вместо подставляем ее выражение из (4), т.е. . После сокращения V и М в левой и правой частях уравнения получим формулу (14).
Решение задач
Пример 1. Какой объем раствора H3PO4 с W=30% и r=1,25 г/мл потребуется для приготовления 2 л раствора с молярной концентрацией 0,2 моль/л?
| Дано: W%=30% r=1,25 г/мл V=2 л С(H3PO4) = 0,2 моль/л | Решение: 1) m(H3PO4) = C(моль/л)×V(л)×М(г/моль) = = 0,2×2×98 = 39,2 г 2) m(р-ра) = = = = 130,7 г 3) V(р-ра) = = = 104,56 мл Ответ: 104,56 мл |
| V30% р-ра = ? |
Пример 2. Сколько граммов Na2CO3 нужно взять для приготовления 0,5 л раствора с массовой долей 12% и плотностью 1,1 г/см3?
| Дано: V(р-ра)=0,5л=500 мл r=1,1г/см3 (г/мл) W%=12% | Решение: 1) m(р-ра)=V(p-pa) × r=500мл×1,1 г/мл = 550 г. 2) m(Na2CO3)= =66 г Ответ: 66 г. |
| m(Na2CO3) – ? |
Пример 3. Смешали 100 г раствора NaOH с W%=10% и 0,3 л раствора NaOH c W%=25% (r=1,3 г/мл). Какова массовая доля полученного раствора?
Пример 4. (Разбавление раствора). Сколько воды нужно прибавить к 100 мл 20%-го раствора серной кислоты (r=1,14 г/мл), чтобы получить 3%-ный раствор?
| Дано: W1%=20% W2%=3% V(р-ра)= 100 мл r=1,14 г/мл | Решение: 1) m(р-ра)=V(p-pa) × r= 100мл×1,14 г/мл = 114 г. 2) m(H2SO4)= =22,8 г 3) Так как масса вещества после разбавления остается той же, то m(p-pa)2=m(H2SO4) × 100% / W2% = = =760 г. 4) V(H2O)=m(H2O)=760 г – 114 г = 646 г. Ответ: 646 г или 646 мл. |
| V(H2O) или m(H2O) –? |
Пример 5. (Укрепление раствора). Сколько граммов NaCl нужно добавить к 200 мл 10%-го раствора (r=1,27 г/мл), чтобы получить раствор с массовой долей 15%?
| Дано: V(р-ра)= 100 мл r=1,27 г/мл W1%=10% W2%=15% m(NaCl)доб – ? | Решение: 1) m(р-ра)=V(p-pa) × r= 100мл×1,27 г/мл = 127 г. 2) m(NaCl)= =12,7 г 3) Обозначим m(NaCl) доб за х. Тогда на х г увеличатся массы и вещества и раствора в 15%-ном растворе. 15%= 15×(127+х)=(12,7+х)×100 1905+15х=1270+100х 635=85х; х=7,47 г Ответ: нужно добавить 7,47 г NaCl. |
Пример 6. Сколько граммов щавелевой кислоты H2C2O4×2H2O необходимо взять для приготовления 200 мл децинормального (0,1 моль/л) раствора?
| Дано: C( V(р-ра)= 200 мл = 0,2 л m(H2C2O4×2H2O) – ? | Решение: m(H2C2O4×2H2O)=C( H2C2O4) × V× ×M( H2C2O4×2H2O)=0,1моль/л×0,2л×63г/моль= = 1,26 г. Ответ: 1,26 г H2C2O4×2H2O |
Пример 7.
| Дано: t = 0,004 г/мл r = 1,15 г/мл W% –? C(x) – ? C( ) – ? | Решение: Воспользуемся формулами связи разных способов выражения концентрации между собой, например, формулами (11), (13) и (15). =0,04 моль/л C( H3PO4) = C(H3PO4)×Z=0,04 моль/л×3= =0,12моль/л Ответ: 0,35%; 0,04 моль/л; 0,12 моль/л. |
Пример 8. Навеска технического карбоната калия массой 0,7 г растворена в 50 мл воды. На реакцию полученного раствора затрачено 48 мл раствора HCl с молярной концентрацией 0,2 моль/л. Определить C(K2CO3), t, m(K2CO3) в растворе и W%(K2CO3) в навеске.
Рекомендуемые страницы:
lektsia.com
Методика решения задач на определение молярной концентрации.
Задачи на определение молярной концентрации вещества
В 500 мл раствора содержится 56 г гидроксида калия. Определите молярную концентрацию раствора. (2б)
В 100 мл раствора содержится 0,98 г серной кислоты. Определите молярную концентрацию данного раствора. (2б)
Из 2, 65 г карбоната натрия приготовили 250 мл раствора. Какова его молярная концентрация? (2б)
Какая масса уксусной кислоты СН3СООН содержится в 250 мл 0,2 М раствора? (2б)
Какая масса хлорида железа (lll) содержится в 150 мл 2М раствора? (2б)
Слили 300 мл 2 М и 200 мл 8 М раствора серной кислоты. Рассчитайте молярную концентрацию полученного раствора.
Какую массу нитрата аммония NН4NО3 надо взять для приготовления 5 л 2 М раствора? (2б)
Какой объем 38 % — го раствора HCL (р = 1,19 г/мл) надо взять, чтобы приготовить из него 2 л 2 М раствора? (3б)
Раствор серной кислоты с массовой долей h3SO4 30 % имеет плотность 1,219 г/мл. Какова молярная концентрация этого раствора? (3б)
Сульфат натрия массой 21,3 г растворили в 150 г воды, плотность полученного раствора 1,12 г/мл. Какова его молярная концентрация? (3б)
Какова молярная концентрация 10 % раствора гидроксида калия, плотность которого равна 1,09 г/мл? (3б)
Какое количество вещества нитрата натрия содержится в растворе объемом 1 л с массовой долей NaNO3 40 %, плотность которого 1,32 г/мл? (3б)
Какой объем раствора с массовой долей серной кислоты 9,3 % (p = 1,05 г/ мл) потребуется для приготовления 0,35 М раствора h3SO4 объемом 40 мл? (3б)
Какой объем раствора с массовой долей карбоната натрия 0,15 (плотностью1,16 г/мл) надо взять для приготовления раствора 0,45M Na2CO3 объемом120 мл? (3б)
В лаборатории имеется раствор 3М KCL. Определите его объем, который потребуется для приготовления раствора объемом 200 мл с массовой долей KCL 8% и плотностью 1,05 г/мл. (3б)
К воде массой 200 г прилили раствор 2М KCL объемом 40 мл и плотностью 1,09 г/мл. Определите молярную концентрацию и массовую долю KCL в полученном растворе, если его плотность равна 1,015 г/мл. (4б)
Какой объем раствора 3 М Na CL плотностью 1,12 г/мл надо прилить к воде массой 200 г, чтобы получить раствор с массовой долей NaCL 10 %? (4б)
К раствору 3,5 М Nh5CL объемом 80 мл и плотностью 1,05 г/мл прилили воду
объемом 40 мл. Определите массовую долю соли в полученном растворе.
В воде массой 128 г растворили метиловый спирт объемом 40 мл и плотностью 0,8 г/мл. Определите молярную концентрацию полученного раствора, если его плотность равна 0,97 г/мл. (4б)
Определите массовую долю хлорида кальция в растворе 1,4 М CaCL2, плотность которого равна 1,12 г/мл. (4б)
Упарили вдвое (по объему) 4 л 10 % -го раствора NaCL (р = 1,07 г/мл). Определите молярную концентрацию нового раствора. (4б)
Вычислите молярную концентрацию раствора с массовой долей серной кислоты
44 % и плотностью 1,34 г/мл. (4б)
Определите молярную концентрацию азотной кислоты, полученной смешиванием 40 мл 96 % — го раствора HNO3 (р= 1,5 г/мл) и 30 мл 48 % — го раствора HNO3(р= 1,3 г/мл), если полученный раствор имеет плотность р = 1,45 г/мл. (4б)
Эталоны ответов
1. Дано: Решение:
V р – ра = 500 мл n = 56 г/ 56г/моль = 1 моль
m кон = 56 г С = 1 моль / 0,5 л = 2 М
С — ? Ответ: 2 М
2. Дано: Решение:
V р – ра = 100 мл n = 0,98 г/ 98 г/моль = 0,01 моль
m н2SО4= 0,98 г С = 0,01 моль / 0,1 л = 0,1 моль
С — ? Ответ: 0,1 моль
3. Дано: Решение:
V р – ра = 250 мл n = 2,65 г/ 106 г/моль = 0,025 моль
m Na2CO3 = 2,65 г С = 0,025 моль / 0,25 л = 0,1 М
С — ? Ответ: 0,1 моль
4. Дано: Решение:
V р – ра = 200 мл n = С ∙ V = 0,2 М ∙ 0,2 л = 0,04 моль
С = 0,2 М m = n ∙ М = 0,04 моль ∙ 60 г/моль = 2,4 г
m сн3соон — ? Ответ: 2,4 г
5. Дано: Решение:
V р – ра = 150 мл n = С ∙ V = 2 М ∙ 0,15 л = 0,3 моль
С = 2 М m = n ∙ М = 0,3 моль ∙ 162,5 г/моль = 48,75 г
m FeCl3 — ? Ответ: 48,75 г
6. Дано: Решение:
V 1 = 300 мл 1.n1 = 2М ∙ 0,3 л = 0,6 моль
С 1 = 2 М 2. n2 = 8 М ∙ 0,2 л = 1,6 моль
V2 = 200 мл 3. n3 = 0,6 моль + 1 ,6 моль = 2,2 моль
С 2 = 8 М 4.V3 = 0,3 л + 0,2 л = 0,5 л
С 3 -?
5 . С 3 = 2,2 моль/0,5л =4,4 М
Ответ: 4,4 М
7. Дано: Решение:
V р – ра =5 л n = С ∙ V = 2 М ∙ 5 л = 10 моль
С = 2 М m NH4NO3 = n ∙ М = 10 моль ∙ 80 г/моль = 800 г
m NH4NO3 — ? Ответ: 800 г
8.Дано: Решение:
ω р-ра = 38 % 1. n = 2М ∙ 2 л = 4 моль
ρ р- ра = 1,19 г/мл 2. m в-ва = 4 моль ∙36,5 г/моль = 146 г
Vр-ра 1 = 2 л 3. m р — ра = 146 г/0,38 = 384 г
С = 2 М 4. V р-ра = 398 г / 1,19 г/мл = 322,6 мл
V -? Ответ: 322,6 мл
9. Дано: Решение:
m Na2 SO4 = 21,3г 1. m р-ра = 21,3 г + 150 г = 171,3 г
m воды = 150 г
ρ р-ра = 1,12 г/мл 2. n Na2SO4= 21,3 г /142г/моль = 0,15 моль
С — ? 3. V р-ра = 171,3 г /1,12г/мл ≈ 153 мл ≈ 0,153 л
4. С = 0,15 моль /0,153л ≈ 1М
Ответ: 1 М
10. Дано: Решение:
ωр-ра= 10 % 1.Берем объем раствора 1 л, тогда
ρ р-ра = 1,09 г/мл m р-ра = 1000 мл ∙ 1,09 г/мл = 1090 г
С — ? 2. m в-ва = 1090 г ∙ 0,1 = 109 г
3.n КОН = 109 г /56г/моль = 1,95 моль
4. С = 1,95 моль/1л = 1,95 М
Ответ: 1,95 М
11. Дано: Решение:
ω р-ра= 9,3 % 1.n = 0,35 М ∙ 0,04 л = 0,014 моль
ρ р-ра = 1,05 г/мл 2. m в-ва = 0,014 моль ∙ 98 г/моль = 1,372 г
С р-ра 1 = 0,35 М 3. m р-ра = 1,372г / 0, 093 = 14,75г
V р-ра 1 = 40 мл = 0,04 л 4. V р-ра = 14,75 г / 1,05г/мл = 14 мл
Vр-ра — ? Ответ: 14 мл
12. Дано: Решение:
Vр-ра= 1 л 1.m р-ра = 1000мл ∙ 1,32 г/мл = 1320 г
ω р-ра = 40 % 2.m в-ва = 1320г ∙ 0,4 = 528г
ρ р-ра= 1,32 г/моль 3. n NaNO3 = 528 г / 85г/моль = 6,2 моль
n NaNO 3 — ? Ответ: 6,2 моль
13. Дано: Решение:
С= 0,45 М 1.n = 0,45 М ∙ 0,12 л = 0,054 моль
V р-ра = 120 мл = 0,12 л
2. m в-ва = 0,054 моль ∙ 106 г/моль = 5,724 г
ω р-ра 1 = 0,15 3. m р-ра = 5,724г / 0,15 = 38,16 г
ρ р-ра 1 = 1,16 г/мл 4. V р-ра = 38,16 г /1,16 г/мл = 32,9 мл
Vр-ра 1 — ? Ответ: 32,9 мл
14.Дано: Решение:
Vр-ра = 200 мл = 0,2 л 1.m р-ра = 200 мл ∙ 1,05 г/мл = 210 г
2. m в-ва = 0,08 ∙ 200 = 16,8 г
ω р-ра = 8 % 3. m в-ва 1 = 3 моль∙ 74,5 г/моль = 223,5 г
ρ р-ра = 1,05 г/мл 4. 1 л р-ра — 223,5г в-ва
С= 3М х л – 16,8 г в-ва
x = (16,8 г∙ 1 л) /223,5г = 0,075 л = 75 мл
V р-ра 1 — ?
Ответ: 75 мл
15.Дано: Решение:
m воды = 200 г 1.m р-ра = 40 мл ∙ 1,09 г/мл = 43,6 г
С = 2 М 2.n = 2 моль/л ∙ 0,04 л = 0,08 моль
V р-ра = 40 мл = 0,04 л 3. m в-ва = 0,08 моль∙ 74,5 г/моль =5,96 г
ρ р-ра = 1,09 г/мл 4. m р-ра = 200 г+ 43,6 г = 243,6 г
ρ р-ра 1= 1,015 г/мл 5. V р-ра 1 = 243,6 г / 1,015г/мл = 240 мл = 0,24 л
С 1 — ? ω- ? 6. ωр-ра 1 = 5,96 г / 243,6 г ∙100 % = 2,45 %
7.С р-ра 1 = 0,08 моль / 0,24л ≈ 0,33 М
Ответ: 0,33 М
16.Дано: Решение:
С = 3 М 1.n = 3М ∙ 1л = 3 моль
Ρ р-ра = 1,12 г/м 2. m в-ва = 3 моль ∙ 58,5 г/моль = 175,5 г
m воды = 200 г 3. m в-ва 1000 мл ∙ 1,12 г/мл = 1 120 г
ω р-ра = 10 % 4. ωр-ра = 175,5 г / 1120г ∙100 % ≈ 15,7 %
V р-ра — ?
5. 15,7 % 10 м.ч
10 %
0 5,7 м.ч
6. 5,7 м.ч – 200 г 1 м.ч = 200 г/ 5,7 ≈ 35,1 г
10 м.ч = 351 г
7.m р-ра = 351 г, тогда V р-ра = 351 г/1,12г/мл ≈ 314 мл
Ответ: 314 мл
17. Дано: Решение:
С = 3,5 М 1.n = 3,5 М∙ 0,08 л = 0,28 моль
V р-ра = 80 мл = 0,08 л 2. m в-ва = 0,28 моль ∙ 53,5 г/моль = 14,98 г≈ 15 г
Р р-ра = 1,05 г/мл 3. m р-ра 1 = (80 мл∙1,05 г/мл) + 40 г = 124 г
Vводы = 40 мл 4. ω р-ра 1 = (15 г /124г) ∙ 100 % = 12,1 %
ω р-ра 1 — ? Ответ: 12,1 %
Дано: Решение:
m воды = 128 г 1.m сn. = 40 мл ∙ 0,8 г/мл = 32 г
V сn. = 40 мл 2. m р-ра = 128 г + 32 г = 160 г
ρ сn. = 0,8 г/мл 3.n сn. = 32 г /32 г/мл = 1 моль
ρ р-ра = 0,97 г/мл 4.Vр-ра = 160 г /0,97 г/мл ≈ 165 мл = 0,165 л
С-? 5. С = 1 моль / 0,165 л ≈ 6,06 М
Ответ: 6,06 М
19. Дано: Решение:
С = 1,4 М 1.m р-ра = 1000 мл ∙ 1,12 г/мл = 1120 г
ρ р-ра = 1,12 г/мл 2.n = 1,4 М ∙ 1 л = 1,4 моль
ω — ? 3. m в-ва = 1,4 моль ∙ 111 г/моль = 155,4 г
4. ω = (155,4 г / 1120г ) ∙ 100% = 13,87%
Ответ: 13,87 %
Дано: Решение:
V р-ра = 4 л 1.m р-ра = 4000 мл ∙ 1,07 г/мл = 4280 г
ω р-ра = 10 % 2. m в-ва = 4280 г ∙ 0,1 = 428 г
ρ р-ра = 1,07 г/мл 3.Vр-ра 1 = 4 л/ 2 = 2 л
С р-ра 1 — ? 4. n = 428 г / 58,5 г/моль = 7,3 моль
5. С р-ра 1 = 7,3 моль / 2 л = 3,65 М
Ответ: 3,65 М
Дано: Решение:
ω р-ра = 44 % 1.m р-ра = 1000 мл ∙ 1,34 г/мл = 1340 г
ρ р-ра = 1,34 г/мл 2. m в-ва = 1340 г ∙ 0,44 = 589,6 г
С- ? 3. n = 589,6 г / 98 г/моль = 6 моль
4. С = 6 моль / 1 л = 6 М
Ответ: 6 М
Дано: Решение:
С = 2,1 М 1.m р-ра = 1000 мл ∙ 1,13 г/мл = 1130 г
ρ р-ра = 1,13 г/мл 2.n = 2,1 М ∙ 1 л = 2,1 моль
ω р-ра- ? 3. m в-ва = 2,1 моль ∙ 98 г/моль = 205,8 г
4. ω р-ра = (205,8 г / 1130г) ∙ 100 % = 18,2 %
Ответ: 18,2 %
Дано: Решение:
С= n/V
Vр-ра 1 = 40 мл 1.m р-ра 1 = 40 мл ∙ 1,5 г/мл = 60 г
ω р-ра 1 = 96 % 2.m в-ва 1 = 60 г ∙ 0,96 = 57,6 г
ρ р-ра 1 = 1,5 г/мл 3. m р-ра 2 = 30 мл ∙ 1,3 г/мл = 39 г
Vр-ра 2 = 30 мл 4. m в-ва 2 = 39 г ∙ 0,48 = 18,72 г
ω р-ра 2= 48 % 5. m р-ра 3 = 60 г + 39 г = 99 г
p р-ра 2 = 1,3 г/мл 6. Vр-ра 3 = 99 г / 1,45 г/мл = 68,3 мл = 0,0683 л
p р-ра 3 = 1,45 г/мл
С р-ра 3 — ? 7. n в-ва 3 = 57,6 г + 18,72 г = 1,21 моль
63,г/моль
8.С = 1,21 моль / 0, 0683 л = 17,7 М
Ответ: 17,7 М
kopilkaurokov.ru
Концентрация растворов. Правило креста
В данном разделе рассмотрены задачи на пересчет концентрации растворов, применение правила креста для нахождения концентрации при смешении и разбавлении растворов.
Концентрация растворов и способы ее выражения
Задача 1. К 150 г 20% раствора сахарозы добавили 45 г глюкозы. Рассчитайте массовые доли углеводов в новом растворе.
Показать решение »
Решение.
Вначале сахарозы было 30 г:
20 г сахарозы содержится в 100 г раствора
х г — в 150 г
х =30 г
После прибавления глюкозы:
mобщ = m (сахарозы) + m (глюкозы) = 150 + 45 = 195 г
m раствора стала 195 г
Найдем полученные массовые доли сахарозы и глюкозы:
30 г сахарозы содержится в 195 г раствора
х г — в 100 г
х =15,4
ω2 (сахарозы) = 15,4%:
45 г глюкозы содержится в 195 г раствора
х г — в 100 г
х = = 23,1
ω2 (глюкозы) = 23,1%
Задача 2. Для нейтрализации 20 мл 0,1 н раствора кислоты потребовалось 6 мл раствора едкого натра. Определить нормальную концентрацию раствора едкого натра.
Задача 3. Нормальная концентрация раствора KNO3 равна 0,2 моль/л. Найти процентную концентрацию раствора KNO3 и молярную концентрацию раствора KNO3. Плотность раствора принять раной 1 г/мл.
Показать решение »
Решение:
Найдем молярную массу и молярную массу эквивалента KNO3.
В данном случае, они совпадают.
М (KNO3) = 39+14+(16×3) = 101 г/моль
Найдем массу KNO3, содержащуюся в его 0,2 н. растворе:
1 н раствор KNO3 содержит – МЭ KNO3 в 1000 мл
Т.е. 1 н – 101 г
0,2 н. – х г
х = 20,2 г
Теперь вычислим молярную концентрацию
1М раствор KNO3 содержит – М KNO3 в 1000 мл
Т.е. 1 М – 101 г
х – 20,2 г
х = 0,2 моль/л
Таким образом, Сн = См = 0,2 моль/л
Далее находим процентную концентрацию.
Сначала необходимо рассчитать массу раствора объемом 1000 мл.
m = ρ×V = 1×1000 = 1000 г
тогда, решая пропорцию, находим:
20,2 г KNO3 содержится – в 1000 г раствора
х г – в 100 г раствора
х = 2,02 г
ω = 2,02%
Задача 4. Вычислите молярную и молярную концентрацию эквивалента 20 % раствора хлорида кальция плотностью 1,178 г/мл.
Показать решение »
Решение.
Найдем массу раствора
mр-ра = V·ρ = 1000 · 1,178 = 1178 г.
Найдем массу CaCl2, содержащуюся в 1178 г. 20 % раствора
20 г CaCl2 содержится в 100 г раствора
х г — в 1178 г раствора
х = 235,6 г.
Молярность определим с помощью соотношения:
См = n/V
n = m/M = 235,6/111 = 2,1 моль
M(CaCl2) = 40+35,5·2 = 111 г/моль
См = 2,1/1 = 2,1 М
Молярная концентрация эквивалента определяется с помощью соотношения:
Сн = nэ/V
Мэ = fэкв· М(CaCl2) = 1/2·111 = 55,5 г/моль
nэ = m/ Мэ = 235,6/55,5 = 4,2 моль
Сн = 4,2/1 = 4,2 н
Задача 5. Чему равна нормальность 30% раствора NaOH плотностью 1,328 г/мл? К 1 л этого раствора прибавили 5 л воды. Вычислите массовую долю полученного раствора.
Показать решение »
Решение.
Найдем массу NaOH, содержащуюся в 1328 г. 30 % раствора используя формулу:
ω(NaOH) = m (NaOH)/m
mр-ра = V·ρ = 1000 · 1,328 = 1328 г.
m(NaOH) = ω(NaOH) · m = 0,3 · 1328 = 398,4 г.
Найдем Молярную концентрацию эквивалента или нормальность:
M(NaOH) = 23+16+1 = 40 г/моль
Сн = nэ/V
Мэ = fэкв· М(NaOH) = 1·40 = 40 г/моль
nэ = m/ Мэ = 398,4/40 = 9,96 моль
Сн = 9,96/1 = 9,96 н
Найдем массу раствора после прибавления 5 л воды:
m2 = 1328 + 5000 = 6328 г
Далее находим процентную концентрацию или массовую долю вещества.
ω2(NaOH) = m (NaOH)/m2 = 398,4/6328 = 0,063 или 6,3 %
Задача 6. К 3 л 10 % раствора HNO3 плотностью 1,054 г/мл прибавили 5 л 2 % раствора той же кислоты плотностью 1,009 г/мл. Вычислите массовую долю в процентах и молярную концентрацию полученного раствора, объем которого равен 8 л.
Показать решение »
Решение.
Найдем массу растворов объемом 3 л и 5 л
m1= V1·ρ = 3000·1,054 = 3162 г
m2= V2·ρ = 5000·1,009 = 5045 г
Найдем массу HNO3, содержащуюся в 3162 г. 10 % раствора
10 г HNO3 содержится в 100 г ее раствора
х1 г — в 3162 г раствора
х1 = 316,2 г
Найдем массу HNO3, содержащуюся в 5045 г. 2 % раствора
2 г HNO3 содержится в 100 г ее раствора
х2 г — в 5045 г раствора
х2 = 100,9 г
При смешивании:
m (HNO3) = 316,2+100,9 = 417,1 г
mр-ра (HNO3) = 3162+5045 = 8207 г
Найдем Молярность
См = n/V
n = m/M = 417,1/63 = 6,62 моль
M(HNO3) = 1+14+16·3 = 63 г/моль
См= 6,62/1 = 6,62 М
ω(HNO3) = m (HNO3)/mр-ра = 417,1/8207 = 0,05 или 5 %
Задача 7. Определить молярность, нормальность, моляльность и титр 4 % раствора FeSO4 объем которого равен 1,5 л, плотность 1037 кг/м3
Показать решение »
Решение.
M (FeSO4) = 56+32+16·4 = 152 г/моль
Мэ = fэкв· М(FeSO4) = 1/2·152 = 76 г/моль
Найдем m раствора объемом 1,5 л
m = V·ρ = 1,5·10-3 ·1037 = 1,56 кг
Найдем m 4 % раствора
m(FeSO4) = ω(FeSO4) · mр-ра = 0,04·1,56 = 0,0624 кг = 62,4 г
Найдем молярность, которая определяется как количество молей растворенного вещества в одном литре раствора
n = m/М = 62,4/152 = 0,41 моль
См = n/V = 0,41/1,5 = 0,274 М
Найдем нормальность:
nэ = m/Мэ = 62,4/76 = 0,82 моль
Сн = nэ/V = 0,82/1,5 = 0,547 н
Моляльная концентрация равна:
b (x) = n(x)/m
Масса растворителя равна: mH2O = 1560-62,4 = 1497,6 г = 1,5 кг
b (FeSO4) = n(FeSO4)/m = 0,41/1,5 = 0,27 моль/кг
Титр определим следующим образом:
Т (х) = m (х)/V
Т (FeSO4) = m (FeSO4)/V = 62,4/1500 = 0,0416 г/мл
Задачи на смешение и разбавление растворов
Такие задачи можно решить с помощью правила креста или правила смешения. Суть его заключается в составлении «креста», в виде которого располагают две прямые линии. В центре пишут ту концентрацию, которую надо получить, у концов линий креста слева – концентрации исходных растворов (большую – сверху, меньшую — снизу), у концов линий креста справа – искомые концентрации (или массы) растворов, которые получают вычитанием по направлению линий из большей величины меньшей. В общем виде схема решения задач по правилу креста имеет вид:
Таким образом, следует взять mА грамм раствора с массовой долей а% и прибавить к нему mB грамм раствора с массовой долей b%. Если надо узнать, какие массы растворов данной концентрации следует взять, чтобы получить заданную массу раствора новой концентрации, то сначала определяют отношение mА и mB . Затем пропорционально этому отношению делят заданную массу.
Задача 8. Сколько граммов раствора с массовой долей серной кислоты 96% необходимо влить в 1 л воды, чтобы получить раствор с массовой долей 10%
Показать решение »
Решение.
Для решения данной задачи используем правило креста.
Чистый растворитель (воду) можно представить как раствор с массовой долей растворенного вещества 0%
Определим m раствора с ω (H2SO4) = 96%, который надо влить в 1 л воды:
10 г H2SO4 надо влить в 86 г воды
х г — 1000 г
х = 116,28 г
m (р-ра H2SO4) = 116,28 г
Задача 9. Сколько мл 0,5 М и 0,1 М растворов азотной кислоты следует взять для приготовления 1000 мл 0,2 М раствора.
Показать решение »
Решение.
По правилу креста, определяем в каких соотношениях следует взять 0,5 М и 0,1 М растворы азотной кислоты, чтобы получить раствор заданной концентрации:
V0.5/V0.1 = 0,1/0,3 = 1/3
Взяв 0,1 л и 0,3 л исходных растворов, получим 0,4 л 0,2 М раствора HNO3, но по условию задачи нужно получить 1 л. Для этого разделим 1 л на две части в соотношении 1:3, составив пропорции:
Для 0,5 М раствора HNO3
из 0,1 л 0,5 М раствора получим 0,4 л 0,2 М р-ра HNO3
х1 л — 1 л
х1 = 0,25 л
Для 0,1 М раствора HNO3
из 0,3 л 0,5 М раствора получим 0,4 л 0,2 М р-ра HNO3
х2 л — 1 л
х2 = 0,75 л
zadachi-po-khimii.ru
Задачи по химии на тему «Растворы»
Выполнила студентка гр.ВХМС-31 Боякова Алена
Условия задач по теме «Растворы» (5 задач)
Требуется приготовить 1 кг 15%-го раствора аммиака. Сколько нужно взять для этого 25%-го раствора аммиака и воды?
К 80 г раствора соли неизвестной концентрации прибавили 40 г воды. Вычислите массовую долю соли в исходном растворе, если после разбавления она стала равной 18%.
Из 400 г 20%-го раствора соли упариванием удалили 100 г воды. Чему стала равна массовая доля соли в полученном растворе?
В результате упаривания 450 г 10%-го раствора хлорида кальция его массовая доля увеличилась вдвое. Вычислите массу испарившейся воды.
Имеются два раствора аммиака с массовой долей 25% и 5%. Сколько граммов каждого раствора надо взять, чтобы получить 125 г 10%-го раствора аммиака?
Пример решенной задачи по теме растворы:
Задача для примера решения
Сколько граммов воды надо испарить из 800 г 15%-го раствора вещества, чтобы увеличить его массовую долю на 5%?
ДАНО:
ω(в-ва)=15%=0,15
m(p-pa)=800г
ω'(в-ва)=(15+5)%=20%=0,2
НАЙТИ:
mисп.(H2O)=?
РЕШЕНИЕ:
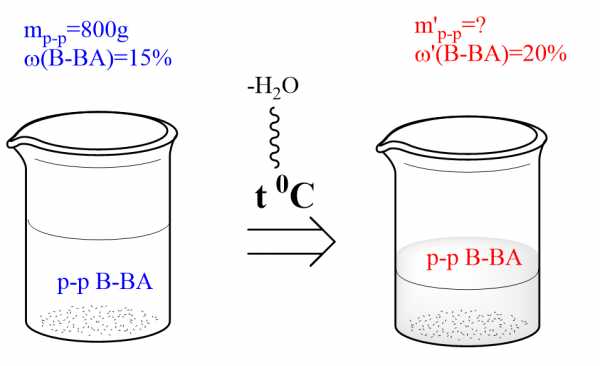
1)Найдем массу растворенного вещества в исходном растворе:
m(в-ва)=ω(в-ва)⋅m(p−pa)=0,15⋅800г=120г
2) Поскольку испаряется только вода, масса вещества остается неизменной: m(в-ва) = m'(в-ва)=120г
3) Зная массу растворенного вещества и его массовую долю, найдем массу полученного раствора:
m′(р-ра)=m(в-ва))ω(в-ва)=120г0,2=600г
Масса испаренной воды — разность масс полученного и исходного растворов:
mисп.(h3O)= m(р-ра) — m'(р-ра) = 800г — 600г = 200г
ОТВЕТ: необходимо испарить 200г воды
Список используемой литературы:
1. И.Г. Хомченко «Сборник задач и упражнений по химии для средней школы»
Москва. Новая волна – 2008г.
2. ЕГЭ – Химия 2011 под редакцией А.А. Ковериной. Москва Национальное образование
2011 г.
infourok.ru
В помощь учащимся. Решаем задачи «Способы выражения концентрации раствора».
Процентная концентрация раствора. Процентной концентрацией раствора (С) называется массовая доля растворённого вещества в растворе (W), выраженная в %:С% = W% (растворённого вещества) = (m растворённого вещества• 100%) /m раствора
1. Процентная концентрация показывает, сколько единиц массы (г, кг) растворённого вещества содержится в каждых 100 единицах массы (г, кг) раствора
2. При смешивании двух различных растворов, массовую долю растворённого вещества во вновь полученном растворе определяют по правилу смешения
m1/m2 = (W3-W2)/(W1-W3)Молярная концентрация раствора. Молярную концентрацию (Cm) растворов определяют по формуле:
Cm = υрастворённого вещества/ Vраствора
где ν = m/M — количество вещества
(здесь М — молярная масса вещества), V – объём
Cm измеряют в моль/л или моль/м3 (в системе СИ).
Молярная концентрация показывает количество растворённого вещества (моль), содержащегося в 1л раствора. Задачи
Какую
массу соли и объем воды необходимо
взять для приготовления 50 г 0,5 %-ного
раствора (ответ: 0,25 г, h3O — 49,75 мл)?
Задачи
Какую
массу соли и объем воды необходимо
взять для приготовления 50 г 0,5 %-ного
раствора (ответ: 0,25 г, h3O — 49,75 мл)?
| m (р-ра) = 50 г w(соли) = 0,005 m (соли) = ? |
Решение: m (соли) = 50 г · 0,005 = 0,25 г соли m (h3O) = 50 г — 0,25 г = 49,75 г V (h3O) = 49,75 г ? 1 г/мл = 49,75 Ответ: m (соли) = 0,25 г |
Какой объем воды надо прилить к 0,5 г сахара, чтобы получить 1 %-ный раствор?
| m (сахара) = 0,5 г w(cах.) = 0,01 (1 %) V(Н2О) = ? | Решение: 1) m (р-ра) В 100 г р-ра – 1 г сахара х — 0,5 г сахара 2) m (h3O) = 50 – 0,5 = 45,5 г 45,5 г 3) V(Н2О) = ———— = 45,5 мл 1 г/мл Ответ: V(Н2О) = 45,5 мл |
| V(Н2О) = 200 мл
w(соли) = 0,03 (3 %)
m (соли) = ? | Решение: 1) 3 %-ный раствор – это на 100 г р-ра – 3 г соли и 97 г воды 2) m (200 мл Н2О) = 200 мл · 1 г/мл = 200 г 3) m (соли) = ? 3 г соли – на 97 г Н2О х — 200 г Н2О 3 х 200 х = ———- = 6,2 г. 97 Ответ: m (соли) = 6,2 г |
m (p. HCl) = 150 г
w(HCl) = 0,2 (20 %)
V(Н2О) = 200 мл
Найти:
w(HCl) = ?
Решение:
m (HCl) = 150 г х 0,2 = 30 г
m (p-ра) = 150 г + 200 г = 350 г
m (h3O) = 200 мл х 1 г/мл = 200 г
30 г
w(HCl) = ———= 0,086 (8,6 %)
350 г
Ответ:w (HCl) = 0,086 (8,6 %).
Определить молярную концентрацию раствора серной кислоты, полученного при смешивании 25 мл 10-молярного раствора серной кислоты и 225 мл воды.
V(p. h3SO4) = 25 мл
C(h3SO4) = 10 м/л
V(h3O) = 225мл
Найти: C(h3SO4) = ?
Решение:
n(h3SO4) — ?
В 1000 мл – 10 моль
в 25 мл – х моль
х = 0,25 моль
V(р-ра) = 225 мл + 25 мл = 250 мл
C(h3SO4) — ?
himoza1977.blogspot.com
Задачи по теме Растворы
Задачи по теме «Растворы и растворимость»
Вычисление массовой доли вещества в растворе
- Натрий сульфат массой 8 г растворили в воде массой 192 г. Определите массовую долю натрий сульфата в полученном растворе.
- Вычислите массы хлорида натрия и воды, необходимых для приготовления 200 г раствора с массовой частью соли 5%
- В результате выпаривания раствора массой 80 г получили твердый остаток хлорида калия массой 16 г. Вычислите массовую долю хлорида каля в растворе.
Вычисление массовой доли газообразного вещества в растворе
- Гидроген хлорид объемом 179,3 л растворили в воде массой 708 г. Вычислите массовую часть гидроген хлорид в полученном растворе.
- В 400 мл воды растворили 33,6 л хлороводорода. Определите массовую долю соляной кислоты в растворе
Вычисление массовой доли вещества в растворе при смешивании
1) при добавлении растворенного вещества
- Вычислите массовую часть хлорида натрия в растворе, который образуется при растворении 5 г соли в 245 г раствора с массовой частью хлорида натрия 10%
- К раствору массой 120 г с массовой долей ортофосфатной кислоты 15% добавили ортофосфатную кислоту массой 40 г. Определите массовую долю вещества в полученном растворе.
- К раствору гидрокарбоната натрия массой 200 г с массовой долей соли 10% добавили 5г гидрокарбоната натрия. Определите массовую долю соли.
2) при изменении количества растворителя
- Вычислите массовую часть гидроксида натрия в растворе, который образуется при добавлении 150 г воды к раствору гидроксида натрия массой 450 г с массовой долей щелочи 5%.
- Уксусная эссенция – это 80% раствор уксусной кислоты в воде. Сколько эссенции надо взять, чтобы получить 190 г 50% раствора?
- Какую массу раствора с массовой долей карбоната натрия 25% необходимо добавить к воде массой 500 г, чтобы получить раствор с массовой долей карбоната натрия 5%?
3) при смешивании двух растворов
- Определите массовую часть сульфатной кислоты в растворе, который образуется при смешивании 200 г раствора с массовой частью кислоты 40% и 300 г раствора с массовой частью этой же кислоты 20%.
- Смешали 250 г 10% и 750 г 15% растворов глюкозы. Вычислите массовую долю глюкозы в полученном растворе.
- Смешали растворы нитратной кислоты массой 80 г с массовой долей кислоты 20% и массой 120 г с массовой долей 10%. Определите массовую часть нитратной кислоты в полученном растворе.
- Вычислите массу раствора сульфатной кислоты с массовой долей 50%, которую необходимо добавить в раствор сульфатной кислоты массой 400 г с массовой долей 10%, чтобы получить раствор с массовой долей вещества 30%
- Необходимо приготовить 60г 50% раствора нитратной кислоты. Какую массу 20% и 80% растворов нитратной кислоты надо взять для этого?
- В лаборатории есть только 10% и 50% растворы сульфатной кислоты. Какую массу каждого раствора надо взять, чтобы приготовить 40 г 30% раствора.
Вычисление массовой доли вещества в растворе, который образуется вследствие химического взаимодействия растворенного вещества с растворителем
- Определите массовую часть вещества в растворе, которое образовалось в результате растворения оксида натрия массой 93 г в 507 г воды.
- К раствору массой 120 г с массовой долей ортофосфатной кислоты 15% добавили оксид фосфора (V) массой 14,2 г. Определите массовую долю вещества в растворе.
- Вычислите массу раствора с массовой долей гидроксида калия 7,93%, в котором необходимо растворить 47 г оксида калия, чтобы получить раствор с массовой частью гидроксида калия 7,93%.
Вычисление массовой доли вещества в растворе, который образуется вследствие химического взаимодействия растворенного вещества с растворителем, если в результате выделяется газообразный продукт
- Определите массовую долю вещества в растворе, который образуется в результате растворения 4,6 г натрия в воде массой 75, 6 г.
Задачи с использованием понятия «плотность раствора»
- Рассчитайте массовую долю нитратной кислоты в растворе, 1 литр которого содержит 224 г кислоты, а плотность раствора равна 1,12 г/мл.
- Определите массовую часть нитратной кислоты в растворе, который образуется в результате добавления воды массой 400 г в раствор нитратной кислоты объемом 200 мл с массовой частью кислоты 63% (ρ = 1,4 г/мл)
Вычисление объемной части растворенного вещества
- К воде массой 40 г прилили ацетон объемом 100 мл и плотностью 0,79 г/мл и получили раствор плотностью 0,88 г/мл. Определите объемную часть ацетона в растворе.
Вычисление коэффициента растворения и задачи с использованием коэффициента растворимости
- В 270 г насыщенного раствора при температуре 150С содержится 70 г хлорида аммония. Определите коэффициент растворимости хлорида аммония
- Коэффициент растворимости соли при температуре 500С составляет – 40, а при 100С – 15. Определите массу осадка, полученного вследствие охлаждения раствора массой 70 г от 500С до 100С
- Какую массу воды и кухонной соли надо взять для приготовления 300 г насыщенного раствора при 800С. Растворимость хлорида натрия при данной температуре составляет 38,1 г на 100 г воды.
Вычисление молярной концентрации
- В воде растворили гидроксид калия массой 11,2 г, объем довели до 200 мл. Вычислите молярную концентрацию полученного раствора.
- Рассчитайте молярную концентрацию300 мл раствора сульфата натрия с массовой долей 5% и плотностью раствора 1,03 г/мл
- Рассчитайте молярную концентрацию 96% раствора этилового спирта в воде (ρ = 1,56 г/мл).
Задачи с использованием понятия «кристаллогидрат»
- Определите массовую часть сульфата купрума (ІІ) в растворе, который образуется в результате растворения медного купороса массой 25 г в воде массой 175 г.
- Определите массы медного купороса и раствора сульфата меди для приготовления раствора массой 420 г с массовой долей растворенного вещества 16%.
- Определите массу воды, в которой необходимо растворить 27,8 г железного купороса, чтобы получить раствор с массовой частью сульфата феррума (ІІ) 3,8%.
Перерасчеты количественных характеристик растворов
- Определите массовую долю хлорида кальция в растворе, молярная концентрация которого составляет 1,4моль/л, а плотность равна 1,12 г/мл.
- Коэффициент растворимости хлорида купрума (ІІ) при температуре 200С составляет 74,5г. Вычислите массовую долю хлорида купрума в насыщенном растворе данной температуры.
- Найдите молярную концентрацию 30% серной кислоты, плотность раствора которой 1,22 г/мл.
nafleshku.com.ua
Интегрированный урок математики и химии по теме «Решение задач на процентную концентрацию, сплавы и растворы»
Разделы: Математика, Химия
Цели урока:
1. Обобщить и закрепить теоретический материал из курса математики и химии:
А) выражение процентов в виде десятичных дробей;
Б) выражение десятичных дробей в процентах;
В) понятия: растворы, примесь, сплав, а также концентрация растворов (процентное содержание растворенного вещества в растворителе).
2. Показать и раскрыть суть способа решения задач на “Конверт Пирсона”, закрепить навыки решения расчетных задач по математике и по химии.
3. Развивать познавательный интерес, реализуя межпредметные связи курсов математики и химии.
Тип урока: Интегрированный урок с химией.
Оборудование урока:
- карточки с заданиями для самостоятельной работы;
- карточки с дифференцированными домашними заданиями.
Учителя:
- математики – Яковлева Н.С.
- химии – Семенова А.П.
Ход урока
I. Организационный момент:
— сообщение темы, цели урока
— ознакомить учащихся с планом урока.
II. Повторение основных понятий (устно)
- Выразить проценты в виде десятичных дробей;
- Запишите в процентах десятичные дроби;
- Назовите целую и дробные части числа.
III.Фронтальная письменная работа
Учитель химии:
Задача №1:
К 60 г. соли добавили 100 г. воды. Определите содержание соли в растворе (содержимость соли в %).
Решение:
— найдем массу всего раствора: 60+100=160 (г)
— отсюда находим содержание соли в %: 150 г. -100%
60 г. – х
х=60*100/150=40%
Ответ: в растворе 40% соли
Задача №2
К 200г. 20% раствору соли добавили 60г. соли. Найдите концентрацию раствора.
Решение:
1) Находим массу соли в первом растворе:
200г. – 100%
х – 20%
х= 200*20/100 = 40г. соли
2) Найдем всю массу соли: 40+60=100г. соли во всем растворе
3) Находим массу нового раствора: 200+60=260г.
4) Найдем % концентрацию соли в конечном растворе:
260 – 100%
100 – у
у=100*100/260=38,46%
Ответ: в новом растворе содержимость соли будет 38,46%.
Учитель химии:
Ребята, давайте вспомним алгоритм решения задач на “примеси”, “сплавы”, “растворы”.
- Если дана масса примеси в условии задачи, то отнимем массу или объем примеси от всей массы (объема) вещества, содержащего примесь.
- По необходимости составляет уравнение реакции.
- Далее решаем как обычную задачу на составление пропорции.
Для решения задач на смеси растворов применяется метод называемый “конверт Пирсона”.
Сущность этого приема состоит в том, что по диагоналям из большей величины массовой доли растворенного вещества (в %) вычитают меньшую:
где а – большая массовая доля I раствора,
в — меньшая массовая доля II раствора,
с — искомая массовая доля (%) растворенного вещества в растворе.
Задача №3.
Смешали 30% и 10% растворы соленой кислоты и получили 600г. 15% раствора. Сколько граммов каждого вещества взяли?
Решение: (учитель химии) “Конверт Пирсона”:
| 30% | 5% | 3 – 450г. | ||
| 600г. | 15% | 5 | ||
| 10% | 15% | 1 – 150г. |
600 : (1+3) = 150г. — 10% раствор.
150*3 = 450г. — 30% раствор.
(учитель математики) Алгебраический:
I раствор – х (г) — 30% кислота — 0,3х
II раствор – у (г) — 10% кислота — 0,1у
Смесь: 600(г) – 15% кислота = > 0,15*600=90(г)
0,15*600=90(г) – кислоты содержит смесь
тогда:
0,3х+0,1у=90
х+у=600
у=450
х=150
Ответ: 150(г) и 450(г)
Задача №4.
(Половина класса решают алгебраическим, другая – применяя “Конверт Пирсона”).
Как приготовить 630 г. 36% раствор из 9% и 72% растворов?
Решение: “Конверт Пирсона”
9% 36 4-360(г) 630(г) 36% 9 72% 27 3-270(г)
1) 36-9=27, 72-36=36.
2) НОД (36;27) = 9.
3) 36:9=4 (массовой части 9% раствора),
27:9=3 (массовой части 72% раствора).
4) 630:(3+4)=90(г) раствора с соответственно на одну массовую часть раствора
5) 90*4=360(г) – 9% раствор,
90*3=270(г) – 72% раствор.
Алгебраический:
I раствор – х(г) – 9% — 0,9х
II раствор – у(г) – 72% — 0,72у
630(г)-36% — 0,36*630=226,80 (г)
х+у=630 => у=630-х
0,09х+0,72у=226,80
0,09х+0,72(630-х)=226,80
0,09х+453,6-0,72х=226,80
453,6-226,80=0,72х-0,09х
226,8=0,63х
х=360(г) – 9% раствор
630-360=270(г) – 72% раствор
Ответ:
1 раствор- 9% и весит 360 г,
11 раствор — 72% — 270 г.
Задача №5. (учитель математики)
Имеется два сплава золота и серебра. В одном количества этих металлов находится в отношении 2:3, а в другом – 3:7. Сколько нужно взять каждого сплава, чтобы получить 8 кг нового сплава, в котором золото и серебро были бы в отношении 5:11?
Решение: (Удобно составлять следующую таблицу).
| Взято (кг) | Отношение золота к серебру | Отношения веса золота к весу сплава | Взяли золота (кг) | |
| 1 сплав | Х | 2:3 | 2:5 | 2/3 Х |
| 2 сплав | 8 – Х | 3:7 | 3:10 | 3/10 (8 – Х) |
| новый | 8 | 5:11 | 5:16 | 2/3 Х+3/10 (8 – Х) |
(2/3 Х+3/10 (8 – 10)) : 8=5/16
Отсюда находим, что х=1
1кг. взяли из 1сплава, 7кг. – 2 сплав.
Ответ: 1 (кг) и 7 (кг).
IV. Самостоятельная работа (Раздаются карточки)
Задача №1
Найдите концентрацию всего раствора, если к 200(г) 40% раствору добавили 300(г) 50% раствора этого вещества.
Решение: (удобно решать алгебраическим способом).
1. Найдем массу соли в каждом растворе:
I раствор – 200(г) – 40% — 200*0,40=80(г) соли .
II раствор – 300(г) – 50% — 300*0,50=150(г) соли.
Смесь: 500(г) — ? —
2. Найдем концентрацию всего раствора:
500(г) – 100%
230(г) — х-?
х=230*100:500=46% — соли содержится в новом растворе
Ответ: 46%
Задача №2.
Нужно приготовить 25% раствор серной кислоты, смешав 76% и 15% растворы. Сколько надо взять каждого раствора?
Решение: “Конверт Пирсона”:
76% 10 част. 76% раст. 25% 15% 51 част. 15% раст.
Ответ:
10 частей – 76% раствора
15 частей — 15% раствора.
Задача №3.
Сплав меди и цинка содержал меди на 640 г больше, чем цинка. После того как из сплава выделили 6/7, содержащейся в нем меди и 60% цинка, масса сплава оказалась равной 200г. Сколько весил сплав первоначально?
Решение:
| Было: | х(г) цинка —————— | Осталось: 1- 0,6 = 0,4 части цинка, |
| х + 640 г меди ————- | 1 — 6/7 = 1/7 часть меди. |
Сплав: 2
00 = 0,4 х + 1/7(х + 640)
Отсюда х = 200.
Значит, первоначально, было 200(г) цинка, 840 (г) меди, а масса сплава равна 200 + 840 = 1 кг 40 г.
Ответ: Сплав весил 1 кг 40 г.
Проверка:
(Открывается задняя сторона доски, ребята проверяют результаты работы своих соседей, совместно с учителями выставляют оценки)
V. Раздаются карточки с заданиями для самостоятельного решения на дом:
(задание дифференцированное, учащиеся сами выбирают, первые 3 задачи легкие, последние 4 - посложнее)
1. К раствору, содержащему 40г. Соли, добавили 200г. воды, в результате чего концентрация уменьшилось на 10%. Сколько воды содержал раствор и каково его процентное содержание?
Ответ: 160 г. воды и 20%
2. Имеется 2 слитка серебра с оловом. В первом слитке имеется 360г. серебра и 40г. олова. Во втором слитке – 450г. серебра и 150г. олова. Сколько взяли от каждого, если масса нового слитка 200г. и содержится в нем 81% серебра?
Ответ: 80 г. и 120г.
3. Имеется лом стали двух сортов с содержанием никеля 5% и 40%. Сколько нужно взять металла из этих сортов, чтобы получить 140 тонн стали, содержащей 30% никеля?
Ответ: 1 сорт – 40(т) и 2 сорт – 100(т)
4. Имеется два раствора 30% и 3% перекиси водорода, нужно смешать их, чтобы получилось 12% раствор. Как их нужно взять в массовом отношении?
Ответ: 3% раствор нужно взять в 2 раза больше.
5. Имеется 2 слитка сплава золота и меди. В первом слитке содержится 230г. золота и 20г. меди, а во втором – 240г. золота и 60г. меди. От каждого слитка взяли по кусочку, сплавили их и получилось 300г. сплава, в которых 84% золота. Определить массу кусочка, взятого от первого слитка.
Ответ: от 1 слитка взяли 100 (г) золота.
6. Если смешать 6 кг и 2 кг растворов серной кислоты разной концентрации, то получается 12% раствор кислоты. При смешивании двух одинаковых масс, тех же растворов, получается 15% раствор. Определить первоначальную концентрацию каждого раствора.
Ответ: 10% и 20%.ъ
7. Два куска латуни имеют массу 30 кг, первый кусок содержит 5кг чистой меди, а второй – 4кг. Сколько процентов меди содержит первый кусок, если второй содержит меди на 15% больше, чем первый?
VI. Подведение итогов урока.
VII. Выставление оценок.
VIII. Домашнее задание.
Учитель математики:
На следующем уроке сдача зачета №5 и защита домашней работы.
xn--i1abbnckbmcl9fb.xn--p1ai
