Ионные уравнения. Задача 31 на ЕГЭ по химии. Полные и краткие ионные уравнения
Переходим от полного ионного уравнения к краткому
← Начало статьи
Пора двигаться дальше. Как мы уже знаем, полное ионное уравнение нуждается в «чистке». Необходимо удалить те частицы, которые присутствуют и в правой, и в левой частях уравнения. Эти частицы иногда называют «ионами-наблюдателями»; они не принимают участия в реакции.
В принципе, ничего сложного в этой части нет. Нужно лишь быть внимательным и осознавать, что в некоторых случаях полное и краткое уравнения могут совпадать (подробнее — см. пример 9).
Пример 5. Составьте полное и краткое ионные уравнения, описывающие взаимодействие кремниевой кислоты и гидроксида калия в водном растворе.
Решение. Начнем, естественно, с молекулярного уравнения:
H2SiO3 + 2KOH = K2SiO3 + 2H2O.
Кремниевая кислота — один из редких примеров нерастворимых кислот; записываем в молекулярной форме. KOH и K2SiO3 пишем в ионной форме. H
H2SiO3 + 2K+ + 2OH— = 2K+ + SiO32- + 2H2O.
Видим, что ионы калия не изменяются в ходе реакции. Данные частицы не принимают участия в процессе, мы должны убрать их из уравнения. Получаем искомое краткое ионное уравнение:
H2SiO3 + 2OH— = SiO32- + 2H2O.
Как видите, процесс сводится к взаимодействию кремниевой кислоты с ионами OH—. Ионы калия в данном случае не играют никакой роли: мы могли заменить КОН гидроксидом натрия или гидроксидом цезия, при этом в реакционной колбе протекал бы тот же самый процесс.
Пример 6. Оксид меди (II) растворили в серной кислоте. Напишите полное и краткое ионные уравнения данной реакции.
Решение. Основные оксиды реагируют с кислотами с образованием соли и воды:
H2SO4 + CuO = CuSO4 + H2O.
Соответствующие ионные уравнения приведены ниже. Думаю, комментировать что-либо в данном случае излишне.
2H+ + SO42- + CuO = Cu2+ + SO42- + H2O
2H+ + CuO = Cu2+ + H2O
Пример 7. C помощью ионных уравнений опишите взаимодействие цинка с соляной кислотой.
Решение. Металлы, стоящие в ряду напряжений левее водорода, реагируют с кислотами с выделением водорода (специфические свойства кислот-окислителей мы сейчас не обсуждаем):
Zn + 2HCl = ZnCl2 + H2↑.
Полное ионное уравнение записывается без труда:
Zn + 2H+ + 2Cl— = Zn2+ + 2Cl— + H2↑.
К сожалению, при переходе к краткому уравнению в заданиях такого типа школьники часто делают ошибки. Например, убирают цинк из двух частей уравнения. Это грубая ошибка! В левой части присутствует простое вещество, незаряженные атомы цинка. В правой части мы видим ионы цинка. Это совершенно разные объекты! Попадаются и еще более фантастические варианты. Например, в левой части зачеркиваются ионы H+, а в правой — молекулы H
Естественно, в данном примере мы можем (и должны!) стереть только ионы хлора. Получаем окончательный ответ:
Zn + 2H+ = Zn2+ + H2↑.
В отличие от всех разобранных выше примеров, данная реакция является окислительно-восстановительной (в ходе данного процесса происходит изменение степеней окисления). Для нас, однако, это совершенно непринципиально: общий алгоритм написания ионных уравнений продолжает работать и здесь.
Пример 8. Медь поместили в водный раствор нитрата серебра. Опишите происходящие в растворе процессы.
Решение. Более активные металлы (стоящие левее в ряду напряжений) вытесняют менее активные из растворов их солей. Медь находится в ряду напряжений левее серебра, следовательно, вытесняет Ag из раствора соли:
Сu + 2AgNO3 = Cu(NO3)2 + 2Ag↓.
Полное и краткое ионные уравнения приведены ниже:
Cu0 + 2Ag+ + 2NO3— = Cu2+ + 2NO3— + 2Ag↓0,
Cu0 + 2Ag+ = Cu2+ + 2Ag↓0.
Дабы уберечь вас от соблазна считать, что Сu2+ и Cu (или Ag+ и Ag) — это «одно и то же», я снабдил нейтральные атомы нулевыми зарядами. Естественно, ионами-наблюдателями являются ионы NO
Пример 9. Напишите ионные уравнения, описывающие взаимодействие водных растворов гидроксида бария и серной кислоты.
Решение. Речь идет о хорошо знакомой всем реакции нейтрализации, молекулярное уравнение записывается без труда:
Ba(OH)2 + H2SO4 = BaSO4↓ + 2H2O.
Полное ионное уравнение:
Ba2+ + 2OH— + 2H+ + SO42- = BaSO4↓ + 2H2O.
Пришло время составлять краткое уравнение, и тут выясняется интересная деталь: сокращать, собственно, нечего. Мы не наблюдаем одинаковых частиц в правой и левой частях уравнения. Что делать? Искать ошибку? Да нет, никакой ошибки здесь нет. Встретившаяся нам ситуация нетипична, но вполне допустима. Здесь нет ионов-наблюдателей; все частицы участвуют в реакции: при соединении ионов бария и сульфат-аниона образуется осадок сульфата бария, а при взаимодействии ионов H + и OH— — слабый электролит (вода).
«Но, позвольте!» — воскликните вы. — «Как же нам составлять краткое ионное уравнение?»
Никак! Вы можете сказать, что краткое уравнение совпадает с полным, вы можете еще раз переписать предыдущее уравнение, но смысл реакции от этого не изменится. Будем надеяться, что составители вариантов ЕГЭ избавят вас от подобных «скользких» вопросов, но, в принципе, вы должны быть готовы к любому варианту развития событий.
Пора начинать работать самостоятельно. Предлагаю вам выполнить следующие задания:
Упражнение 6. Составьте молекулярные и ионные уравнения (полное и краткое) следующих реакций:
- Ba(OH)2 + HNO3 =
- Fe + HBr =
- Zn + CuSO4 =
- SO2 + KOH =
Как решать задание 31 на ЕГЭ по химии
В принципе, алгоритм решения данной задачи мы уже разобрали. Единственная проблема заключается в том, что на ЕГЭ задание формулируется несколько… непривычно. Вам будет предложен список из нескольких веществ. Вы должны будете выбрать два соединения, между которыми возможна реакция, составить молекулярное и ионные уравнения. Например, задание может формулироваться следующим образом:
Пример 10. В вашем распоряжении имеются водные растворы гидроксида натрия, гидроксида бария, сульфата калия, хлорида натрия и нитрата калия. Выберите два вещества, которые могут реагировать друг с другом; напишите молекулярное уравнение реакции, а также полное и краткое ионные уравнения.
Решение. Вспоминая свойства основных классов неорганических соединений, приходим к выводу, что единственная возможная реакция — это взаимодействие водных растворов гидроксида бария и сульфата калия:
Ba(OH)2 + K2SO4 = BaSO 4↓ + 2KOH.
Полное ионное уравнение:
Ba2+ + 2OH— + 2K+ + SO42- = BaSO4↓ + 2K+ + 2OH—.
Краткое ионное уравнение:
Ba2+ + SO42- = BaSO4↓.
Кстати, обратите внимание на интересный момент: краткие ионные уравнения получились идентичными в данном примере и в примере 1 из первой части данной статьи. На первый взгляд, это кажется странным: реагируют совершенно разные вещества, а результат одинаковый. В действительности, ничего странного здесь нет: ионные уравнения помогают увидеть суть реакции, которая может скрываться под разными оболочками.
И еще один момент. Давайте попробуем взять другие вещества из предложенного списка и составить ионные уравнения. Ну, например, рассмотрим взаимодействие нитрата калия и хлорида натрия. Запишем молекулярное уравнение:
KNO3 + NaCl = NaNO
Пока все выглядит достаточно правдоподобно, и мы переходим к полному ионному уравнению:
K+ + NO3— + Na+ + Cl— = Na+ + NO3— + K+ + Cl—.
Начинаем убирать лишнее и обнаруживаем неприятную деталь: ВСЕ в этом уравнении является «лишним». Все частица, присутствующие в левой части, мы находим и в правой. Что это означает? Возможно ли такое? Да, возможно, просто никакой реакции в данном случае не происходит; частицы, изначально присутствовавшие в растворе, так и останутся в нем. Реакции нет!
Видите, в молекулярном уравнении мы спокойно написали чепуху, но «обмануть» краткое ионное уравнение не удалось. Это тот самый случай, когда формулы оказываются умнее нас! Запомните: если при написании краткого ионного уравнения, вы приходите к необходимости убрать все вещества, это означает, что либо вы ошиблись и пытаетесь «сократить» что-то лишнее, либо данная реакция вообще невозможна.
Пример 11. Карбонат натрия, сульфат калия, бромид цезия, соляная кислота, нитрат натрия. Из предложенного перечня выберите два вещества, которые способны прореагировать друг с другом, напишите молекулярное уравнение реакции, а также полное и краткое ионные уравнения.
Решение. В приведенном списке присутствуют 4 соли и одна кислота. Соли способны реагировать друг с другом только в том случае, если в ходе реакции образуется осадок, но ни одна из перечисленных солей не способна образовать осадок в реакции с другой солью из этого списка (проверьте этот факт, пользуясь таблицей растворимости!) Кислота способна прореагировать с солью лишь в том случае, когда соль образована более слабой кислотой. Серная, азотная и бромоводородная кислоты не могут быть вытеснены действием HCl. Единственный разумный вариант — взаимодействие соляной кислоты с карбонатом натрия.
Na2CO3 + 2HCl = 2NaCl + H
Обратите внимание: вместо формулы H2CO3, которая, по идее, должна была образоваться в ходе реакции, мы пишем H2O и CO2. Это правильно, т. к. угольная кислота крайне неустойчива даже при комнатной температуре и легко разлагается на воду и углекислый газ.
При записи полного ионного уравнения учитываем, что диоксид углерода не является электролитом:
2Na+ + CO32- + 2H+ + 2Cl— = 2Na+ + 2Cl— + H2O + CO2↑.
Убираем лишнее, получаем краткое ионное уравнение:
CO32- + 2H+ = H2O + CO2↑.
А теперь поэкспериментируйте немного! Попробуйте, как мы это сделали в предыдущей задаче, составить ионные уравнения неосуществимых реакций. Возьмите, например, карбонат натрия и сульфат калия или бромид цезия и нитрат натрия. Убедитесь, что краткое ионное уравнение вновь окажется «пустым».
Пора двигаться дальше. В третьей части статьи мы:
- рассмотрим еще 6 примеров решения заданий ЕГЭ-31,
- обсудим, как составлять ионные уравнения в случае сложных окислительно-восстановительных реакций,
- приведем примеры ионных уравнений с участием органических соединений,
- затронем реакции ионного обмена, протекающие в неводной среде.
Продолжение статьи →
www.repetitor2000.ru
Ионные уравнения реакций | Kursak.NET
Тема: Ионные уравнения реакций
План лекции:
- Решение ионных уравнений.
В растворах электролитов реакции происходят между гидратированными ионами, поэтому их называют ионными реакциями. В направлении их важное значение имеют природа и прочность химической связи в продуктах реакции. Обычно обмен в растворах электролитов приводит к образованию соединения с более прочной химической связью. Так, при взаимодействии растворов солей хлорида бария ВаСl2 и сульфата калия K2SO4 в смеси окажутся четыре вида гидратированных ионов Ва2+(Н2О)n, Сl— (H2O)m, K+(H2O)p, SO2-4(H2O)q, между которыми произойдет реакция по уравнению:
BaCl2+K2SO4=BaSO4+2КСl
Сульфат бария выпадет в виде осадка, в кристаллах которого химическая связь между ионами Ва 2+ и SO2-4 более прочная, чем связь с гидратирующими их молекулами воды. Связь же ионов К+ и Сl— лишь незначительно превышает сумму энергий их гидратации, поэтому столкновение этих ионов не приведет к образованию осадка.
Следовательно, можно сделать следующий вывод. Реакции обмена происходят при взаимодействии таких ионов, энергия связи между которыми в продукте реакции намного больше, чем сумма энергий их гидратации.
Реакции ионного обмена описываются ионными уравнения-ми. Труднорастворимые, летучие и малодиссоциированные соеди-нения пишут в молекулярной форме. Если при взаимодействии растворов электролитов не образуется ни одного из указанных видов соединения, это означает, что практически реакции не протекают.
Образование труднорастворимых соединений
Например, взаимодействие между карбонатом натрия и хлоридом бария в виде молекулярного уравнения запишется так:
Na2CO3+ ВаСl2 = BaCO3+2NaCl или в виде:
2Na++СO2-3+Ва2+ +2Сl— = BaCO3+ 2Na++2Сl —
Прореагировали только ионы Ва2+ и СО-2, состояние остальных ионов не изменилось, поэтому краткое ионное уравнение примет вид:
CO 2-3+Ba 2+ =BaCO3
Образование летучих веществ
Молекулярное уравнение взаимодействия карбоната кальция и соляной кислоты запишется так:
СаСO3+2НСl=СаСl2+Н2О+CO2
Один из продуктов реакции — диоксид углерода СО2 — выделился из сферы реакции в виде газа. Развернутое ионное уравнение имеет вид:
СаСО3+2Н++2Сl — = Са 2+ +2Сl —+Н2O+CO2
Результат реакции описывается следующим кратким ионным уравнением:
СаСO3+2Н+=Са 2+ +Н2О+CO2
Образование малодиссоцированного соединения
Примером такой реакции служит любая реакция нейтрализации, в результате чего образуется вода — малодиссоциированное соединение:
NaOH+НСl=NaCl+Н2О
Na++ОН-+Н++Cl— = Na++Сl —+Н2О
ОН-+Н+= Н2O
Из краткого ионного уравнения следует, что процесс выразился во взаимодействии ионов Н+ и ОН-.
Все три вида реакций идут необратимо, до конца.
Если слить растворы, например, хлорида натрия и нитрата кальция, то, как показывает ионное уравнение, никакой реакции не произойдет, так как не образуется ни осадка, ни газа, ни малодиссоциирующего соединения:
Na++Сl—+К++NO—3 + Na+ + NO—3+К+ + Сl—
Пример 1. Составьте молекулярное и ионное уравнение реакции взаимодействия нитрата серебра с хлоридом калия.
Решение:
Составим молекулярное уравнение реакции:
AgNO3+KCl = AgCl + KNO3
По таблице растворимости устанавливаем, что AgNO3, КСl, KNO3 — растворимые соединения, AgCl — нерастворимое вещество.
Составляем ионное уравнение реакции с учетом растворимости соединений:
Ag+ + NO—3 + K+ + Сl— = AgCl + К+ + NO—3
Исключаем из правой и левой частей уравнения одинаковые ионы и получим краткое ионное уравнение:
Ag+ + Cl— = AgCl
Краткое ионное уравнение раскрывает сущность происходящего химического превращения. Видно, что фактически приняли участие в реакции лишь ионы Ag+ и Сl—. Остальные ионы остались без изменения.
Пример 2. Составьте молекулярное и ионное уравнение реакции между: а) хлоридом железа (III) и гидроксидом калия; б) сульфатом калия и иодидом цинка.
Решение:
а) Составляем молекулярное уравнение реакции между FeCl3 и КОН:
FeCl3+3KOH =Fe (OH)3 + 3KCl
По таблице растворимости устанавливаем, что из полученных соединений нерастворим только гидроксид железа Fe(OH)3. Составляем ионное уравнение реакции:
Fe 3+ +3Cl —+3K+ +3OH— =Fe (OH)3+ 3K++3Сl—
В ионном уравнении показано, что коэффициенты 3, стоящие в молекулярном уравнении, в равной степени относятся к ионам. Это общее правило составления ионных уравнений. Изобразим уравнение реакции в краткой ионной форме:
Fe 3+ +3OH— = Fe(OH)3
Это уравнение показывает, что в реакции принимали участие лишь ионы Fe3+ и ОН-.
б) Составим молекулярное уравнение для второй реакции:
K2SO4+ZnI2 = 2KI+ZnSO4
Из таблицы растворимости следует, что исходные и полученные соединения растворимы, поэтому реакция обратима, не доходит до конца. Действительно, здесь не образуется ни осадка, ни газообразного соединения, ни малодиссоциированного соединения. Составим полное ионное уравнение реакции:
2К++SO2-4+Zn2+ +2I— + 2К+ + 2I— +Zn 2+ +SO2-4
Пример 3. По ионному уравнению: Cu2+ +S2- -= CuS составить молекулярное уравнение реакции.
Решение:
Ионное уравнение показывает, что в левой части уравнения Должны быть молекулы соединений, имеющих в своем составе ионы Cu 2+ и S2-. Эти вещества должны быть растворимы в воде.
По таблице растворимости выберем два растворимых соединения, в состав которых входят катион Cu2+ и анион S2-. Составим молекулярное уравнение реакции между данными соединениями:
CuSO4+Na2S CuS+Na2SO4
kursak.net
Реакции ионного обмена
Написанием ионных уравнений подчеркивается тот факт, что, согласно теории диссоциации, в растворах происходят реакции не между молекулами, а между ионами.
С точки зрения теории диссоциации при реакциях между ионами в растворах электролитов возможны два исхода:
1. Образующиеся вещества — сильные электролиты, хорошорастворимые в воде и полностью диссоциирующие на ионы.
2. Одно (или несколько) из образующихся веществ — газ, осадок или слабый электролит (хорошо растворимый в воде).
В ионной форме эти уравнения запишутся следующим образом:
В данном случае алюминий не является электролитом, а молекула воды записывается в не диссоциированной форме потому, что является очень слабым электролитом. Неполярные молекулы водорода практически нерастворимы в воде и удаляются из сферы реакции. Одинаковые ионы в обеих частях уравнений можно сократить, и тогда эти уравнения преобразуются в одно сокращенное ионное уравнение взаимодействия алюминия с щелочами:
Очевидно, что при взаимодействии алюминия с любой щелочью реакция будет описываться уравнением. Следовательно, ионное уравнение, в отличие от молекулярного, относится не к одной какой-нибудь реакции между конкретными веществами, а к целой группе аналогичных реакций. В этом его большая практическая ценность и значение, например благодаря этому широко используются качественные реакции на различные ионы.
С учетом вышеизложенного можно сформулировать правило, которым удобно руководствоваться при изучении процессов, протекающих в растворах электролитов.
Реакции между ионами в растворах электролитов идут практически до конца в сторону образования осадков, газов и слабых электролитов.
Следовательно, реакции идут с образованием веществ с меньшей концентрацией ионов в растворе в соответствии с законом действующих масс. Скорость прямой реакции пропорциональна произведению концентраций ионов реагирующих компонентов, а скорость обратной реакции пропорциональна произведению концентраций ионов продуктов. Но при образовании газов, осадков и слабых электролитов ионы связываются (уходят из раствора) и скорость обратной реакции уменьшается.
Согласно теории электролитической диссоциации все реакции в водных растворах электролитов являются реакциями между ионами. Они называются ионными реакциями , а уравнения этих реакций — ионными уравнениями . Они проще уравнений реакций, записанных в молекулярной форме, и имеют более общий характер.
При составлен ии ио нных уравнений реакций следует руководствоваться тем,что вещества малодиссоциированные , малорастворимые (выпадающиев осадок) и газообразные записываются в молекулярной форме. Знак ↓ , стоящий при формуле вещества,обозначает, что это вещество уходит из сферы реакции в виде осадка, знак ↑ обозначает, что вещество удаляется изсферы реакции в виде газа. Сильные электролиты, как полностью диссоциированные,записывают в виде ионов. Сумма электрических зарядов левой части уравнениядолжна быть равна сумме электрических зарядов правой части.
Для закрепления этих положений рассмотрим два примера.
Пример 1. Напишите уравненияреакций между растворами хлорида железа (III) и гидроксида натрия в молекулярной и ионной формах.
Разобьем решение задачи на четыре этапа.
1. Запишем уравнение реакции в молекулярной форме:
FeCl + 3NaOH = Fe(OH)3 + 3NaCl
2. Перепишем это уравнение, изобразив хорошо диссоциирующие вещества в виде молекул:
FeЗ+ + 3Cl— + 3N а++ 3ОН— = Fе(ОН)3↓ +3N а++ 3Cl—
Это ионное уравнение реакции.
3. Исключим из обеих частей ионного уравнения одинаковые ионы, т.е. ионы, не участвующие в реакции (они подчеркнуты):
Fe3++ 3Cl—+ 3Na—+ 3ОН— = Fе(ОН)3↓ + 3Na++ 3Cl—.
4. Запишем уравнение реакции в окончательном виде:
Fe3++ 3ОН— = Fe(OH)3↓
Это сокращенное ионное уравнение реакции. Как видно из этого уравнения, сущность реакции сводится к взаимодействию ионов Fe3+ и ОН—, в результате чего образуется осадок Fе(ОН)3. При этом вовсе не имеет значения, в состав каких электролитов входили эти ионы до их взаимодействия.
Пример 2. Напишите уравнения реакций между растворами хлорида калия и нитрата натрия.
Так как продукты взаимодействия хорошо растворимы в воде и не уходят из сферы реакции, то данная реакция обратима.
Как и в примере 1, записываем по этапам:
KCl + NaNO3 = KNO3 + NaCl
K++ Cl—+ Na++ NO—3 = K++ NO—3+ Na++ Cl—
Уравнения для следующих этапов написать нельзя, так как с точки зрения теории электролитической диссоциации реакция не происходит. Однако если выпаривать этот раствор, то будут возникать новые химические связи между ионами и получится смесь четырех солей: КСl, NаNО3, NaСl, КNO 3.
Ионными уравнениями могут быть изображены любые реакции, протекающие в растворах между электролитами. Если при таких реакциях не происходит изменения зарядов ионов (не изменяется степень окисления), то они называются ионообменными.
examchemistry.com
Составление уравнений реакций ионного обмена — КиберПедия
В растворах электролитов направление реакций определяется следующим правилом: ионные реакции протекают в сторону образования малорастворимых веществ, газов, слабых электролитов и комплексных ионов, такие реакции являются практически необратимыми.
Это правило легко объяснимо, т.к. в результате этих реакций один или несколько ионов выводятся из сферы реакции, что, в соответствии с принципом Ла-Шателье, приводит к более полному протеканию химической реакции.
При составлениие ионных реакций обмена, уравнения реакций записывают в 3 строчки:
1) молекулярная форма;
2) полная ионная форма;
3) сокращенно-ионная форма.
В молекулярно-ионных уравнениях растворимые, сильные электролиты пишутся в виде ионов, а слабые электролиты и малорастворимые вещества в виде молекул.
1. Взаимодействие сильных электролитов с образованием осадка:
BaCl2 + H2SO4 = BaSO4 ¯ + 2HCl (молекулярное уравнение)
Ba2++ 2Cl¯ +2H+ + SO42− = BaSO4 ¯+ 2H+ + 2Cl¯ (полное ионное уравнение)
Ba2+ + SO42− = BaSO4 ¯(сокращенное ионное уравнение)
2. Взаимодействие двух сильных электролитов с образованием слабого электролита:
KCN + HCl = KCl + HCN (молекулярное уравнение)
K+ + CN¯ + H+ + Cl¯ = K+ + Cl¯ + HCN (полное ионное уравнение)
CN¯ + H+ = HCN (сокращенное ионное уравнение)
3. Взаимодействие слабого электролита с сильным:
H2S + Pb(NO3)2 = PbS¯ + 2HNO3 (молекулярное уравнение)
H2S + Pb2+ + 2NO3¯ = PbS¯ + 2H+ + 2NO3¯(полное ионное уравнение)
H2S + Pb2+ = PbS¯ + 2H+ (сокращенное ионное уравнение)
4. Взаимодействие осадка с кислотой:
ВaCO3¯+ 2HCl = BaCl2 + H2O + CO2(молекулярное уравнение)
BaCO3¯+2H+ + 2Cl¯ = Ba2+ + 2Cl¯ + H2O +CO2 (полное ионное уравнение)
BaCO3¯ + 2H+ = Ba2+ + H2O + CO2 (сокращенное ионное уравнение)
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Пример 1. Исходя из значений ПР, укажите наиболее растворимый и наименее растворимый в воде гидроксид:
1) Ni(OH)2; 2) Pb(OH)2; 3) Sn(OH)2; 4) Zn(OH)2; 5) Ca(OH)2.
Решение: Выписываем значения ПР для всех оснований:
Сравнивая значения, видим, что наибольшее значение ПР у Са(ОН)2, значит данный гидроксид наиболее растворим в воде.
Наименьшее значение ПР у Sn(ОН)2, значит данный гидроксид наименее растворим в воде.
Пример 2. Будет ли образовываться осадок СaSO4, если концентрация ионов кальция в растворе – 0,001 моль/л, концентрация сульфат — ионов – 0,003 моль/л.
Решение:
| Дано: | Условие образования осадка: В соответствии с уравнением реакции: Сa2+ + SO42− = CaSO4 c 0,001 моль/л ионами кальция будет реагировать 0,001 моль/л сульфат-ионов: 2,5∙10-5 < 0,001·0,001 2,5∙10-5 < 1·10−6 Осадок будет образовываться. |
Пример 3. Для данных соединений: CoS, CaF2, Ag2S, Ca3(PO4)2 напишите выражение произведения растворимости.
Решение: В насыщенном растворе малорастворимого соединения произведение концентрации его ионов в степени их стехиометрических коэффициентов есть величина постоянная, называемая произведением растворимости – ПР. Составим уравнения диссоциации солей:
СоS ⇄ Co2+ + S2− =>
CaF2 ⇄ Ca2+ + 2F¯ =>
Ag2S ⇄ 2Ag+ + S2− =>
Ca3(P4)2 ⇄ 3Ca2+ + 2PO43− =>
Пример 4. Какая из предложенных реакций обмена идет до конца ?
1) Na2CO3 + 2KCl = 2NaCl + K2CO3
2) MgCO3 + 2HNO3 = Mg(NO3)2 + H2CO3
3) K2CO3 + 2NaOH = 2KOH + Na2CO3
4) Li2CO3 + 2KOH = 2LiOH + K2CO3
5) Na2CO3 + K2SO4 = Na2SO4 + K2CO3
Решение: Реакция протекает необратимо (т.е. до конца), при условии:
— выпадения вещества в осадок,
— образования слабого электролита (слабой кислоты H2S, H2CO3 и т.д., слабого основания — NH4OH или воды),
— неэлектролита (газа — CO2, SO2 и т.д.)
В продуктах реакции находим нерастворимую соль или основание, воду или слабые электролиты. В данном случае это угольная кислота – H2CO3. Составляем полное ионное и сокращенное ионное уравнения (карбонат магния не растворим в воде):
MgCO3 + 2H+ +2NO3¯ = Mg2+ + 2NO3¯ + СO2 + H2O
MgCO3 + 2H+ = Mg2+ + CO2↑ + H2O
Пример 5. Какое из молекулярных уравнений реакции можно выразить следующим сокращенным ионным уравнением:
Ca2+ + CO32−→ CaCO3 ?
1) Ca3(PO4)2 + 3Na2CO3 = 3CaCO3 + 2Na3PO4
2) Ca3(PO4)2 + 3PbCO3 = 3CaCO3 + Pb3(PO4)2
3) CaSO4 + ZnCO3 = CaCO3 + ZnSO4
4) CaCl2 + CuCO3 = CaCO3 + CuCl2
5) CaCl2 + Na2CO3 = CaCO3 + 2NaCl
Решение: Для получения в растворе ионов Ca2+, необходимо подобрать в исходных веществах растворимую соль кальция. Фосфат и сульфат кальция нерастворимы в воде, поэтому выбираем хлорид кальция. Т.е. варианты ответов № 1,2,3 уже не верные. Для получения в растворе ионов CO32- необходимо подобрать в исходных веществах растворимую соль содержащую карбонат-ионы. Т.к. карбонат меди не растворим, то выбираем карбонат натрия. Правильным ответом является вариант № 5.
Пример 6. Рассчитайте рН 0,1 моль/л раствора NaOH.
Решение: Концентрация ионов OH— в растворе, в соответствии с уравнением диссоциации гидроксида натрия, равна 0,1моль/л:
NaOH → Na+ + OH¯
В соответствии с уравнением:
, концентрация ионов водорода нам не известна.
Из ионного произведения воды найдем концентрацию ионов водорода:
Пример 7. Напишите уравнения диссоциации ортофосфорной кислоты по ступеням и константы диссоциации по каждой ступени.
Решение:
1 ступень диссоциации: H3PO4 ⇄ H+ + H2PO4¯
2 ступень диссоциации: H2PO4¯⇄ H+ + HPO42−
3 ступень диссоциации: HPO42−⇄ H+ + PO43−
Пример 8. Напишите уравнения диссоциации гидроксида меди по ступеням и константы диссоциации по каждой ступени.
Решение:
1 ступень диссоциации: Cu(OH)2 ⇄ CuOH+ + OH¯
2 ступень диссоциации: CuOH+ ⇄ Cu2+ + OH¯
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Написать уравнения ступенчатой диссоциации и выражения констант диссоциации по каждой ступени для ортофосфорной кислоты, гидроксида цинка.
2. Для данных солей CuS, NiS, ZnS, PbS, FeS выписать значения ПР и выбрать наиболее растворимую и наиболее нерастворимую соль.
3. Для данных соединений– PbI2, CaCO3, Ag2SO4 написать выражение произведения растворимости.
4. Концентрация раствора HCl равна 0,01 моль/л, вычислить рН раствора и концентрацию ионов ОН¯.
5. Какие из реакций протекают до конца, для них напишите уравнения реакций в молекулярном и ионном виде:
— хлорид кобальта(II) и гидроксид калия
— хлорид меди(II) и сероводородная кислота
— серная кислота и гидроксид натрия
— сульфат натрия и хлорид никеля(II)
— гидроксид цинка и гидроксид натрия
6. Для данного сокращенно – ионного уравнения подберите 4 молекулярные реакци Zn2+ + S2−= ZnS¯
4 ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование:штативы, пробирки, набор реактивов в капельницах и бюксах.
Опыт 1. Ионные реакции обмена с образованием осадков.
а) Налейте в три пробирки по 5-6 капель фосфата натрия и добавьте в первую пробирку — 5-6 капель нитрата кобальта, во вторую — 5-6 капель сульфата никеля, в третью пробирку — 5-6 капель сульфата меди. Составьте уравнения реакций в молекулярном и ионном виде.
б) Исходя из ионного уравнения, составьте молекулярное уравнение и проведите опыт:
Pb2+ + 2I¯ = PbI2¯
Ba2+ + Cr2O72- =BaCr2O7¯
Опыт 2. Ионные реакции обмена с образованием слабого электролита.
а) Положите в пробирку несколько кристаллов ацетата натрия и добавьте разбавленную серную кислоту. Напишите уравнения реакции в молекулярном и ионном виде.
б) Налейте в пробирку несколько капель хлорида аммония и добавьте гидроксид калия, определите выделяющийся газ по запаху (при отсутствии запаха пробирку можно слегка подогреть). Напишите уравнение реакции в молекулярном и ионном виде.
в) Внесите в 2 пробирки по 1 шпателю карбоната кальция и добавьте в первую немного дистиллированной воды, во вторую 5-6 капель соляной кислоты. В какой пробирке происходит растворение осадка? Напишите уравнение реакции в молекулярном и ионном виде.
Опыт 3. Смещение ионного равновесия.
а) Налейте в две пробирки по 6-8 капель гидроксида аммония, добавьте 2 капли фенолфталеина. Затем в одну из пробирок добавьте 1 шпатель хлорида аммония, отметьте изменение интенсивности окраски. Объясните, как смещается равновесие в растворе при добавлении хлорида аммония.
б) Налейте в две пробирки по 6-8 капель уксусной кислоты, добавьте 2 капли метилового оранжевого, в одну из пробирок добавьте 1 шпатель ацетата натрия. Сравните интенсивность окраски в пробирках. Отметьте, как смещается равновесие в растворе при добавлении соли.
Опыт 4. Выпадение осадков малорастворимых веществ в зависимости от их произведения растворимости.
Внесите в две пробирки 5-6 капель сульфата натрия, в первую добавьте 5-6 капель хлорида кальция. Во вторую 5-6 капель хлорида бария. Объясните образование осадков, на основании ПР, образующихся солей. Напишите уравнение реакции в молекулярном и ионном виде.
Лабораторная работа № 6
ГИДРОЛИЗ СОЛЕЙ
Цель работы:составление уравнений гидролиза одной соли, совместного гидролиза двух солей, определение рН раствора. Смещение равновесия при гидролизе солей
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Гидролизом солейназываются обменные химические реакции ионов солей с водой, сопровождающиеся, как правило, изменением рН среды.
Гидролиз солей может протекать тогда, когда в результате взаимодействия ионов соли и воды образуются малодиссоциированные вещества. Сущность гидролиза состоит в том, что катион соли (слабое основание) либо её анион (слабая кислота) связывают соответственно ионы OH¯ или H+ с образованием слабого электролита (соответственно основания или кислоты).
Гидролизу подвергаются соли образованные:
1. слабым основанием и сильной кислотой (гидролиз по катиону),
2. сильным основанием и слабой кислотой (гидролиз по аниону),
3. слабым основанием и слабой кислотой.
Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются.
Уравнения реакций гидролиза пишутся аналогично ионным уравнениям: слабые электролиты (в том числе и вода), малорастворимые вещества и газообразные продукты гидролиза пишутся в виде молекул, сильные электролиты записываются в виде ионов. Реакции солей, образованные многоосновными кислотами и многокислотными основаниями пишутся по ступеням, в соответствии с их ступенчатой диссоциацией. Следует помнить, что гидролиз соли по второй и третьей ступени протекает в очень незначительной степени.
Уравнения гидролиза
1) Гидролиз соли, образованной сильным основанием и слабой кислотой.
KCN + H2O ⇄ HCN + KOH молекулярное уравнение
K+ + CN¯ + H2O ⇄ HCN + K+ + OH¯полное ионно-молекулярное уравнение
CN¯ + H2O ⇄HCN + OH¯ сокращенное ионно-молекулярное уравнение
Ступенчатый гидролиз:
I ступень:
K2CO3 + H2O ⇄ KHCO3 + KOH
2K+ + CO32¾ + H2O ⇄ K+ + HCO3¯ + K+ + OH¯
CO32¾ + H2O ⇄ HCO3¯ + OH¯
II ступень:
KHCO3 + H2O ⇄ H2CO3 + KOH
K+ + HCO3¯ + H2O ⇄ H2CO3 + K+ + OH¯
HCO3¯ + H2O ⇄ H2CO3 + OH¯
Соль сильного основания и слабой кислоты гидролизуется с увеличением концентрации гидроксид-ионов в растворе, при этом рН раствора становится больше 7.
2) Гидролиз соли, образованной слабым основанием и сильной кислотой.
NH4Cl + H2O ⇄ NH4OH + HCl молекулярное уравнение
NH4+ + Cl¯ + H2O ⇄ NH4OH + H+ + Cl¯ полное ионно-молекулярное уравнение
NH4+ + H2O ⇄ NH4OH + H+ сокращенное ионно-молекулярное уравнение
Ступенчатый гидролиз:
I ступень:
CuCl2 + H2O ⇄ CuOHCl + HCl
Cu2+ + 2Cl¯ + H2O ⇄ CuOH+ + Cl¯ + H+ + Cl¯
Cu2+ + H2O ⇄ CuOH+ + H+
II ступень:
CuOHCl + H2O ⇄ Cu(OH)2 + HCl
CuOH+ + Cl¯ + H2O ⇄ Cu(OH)2 + H+ + Cl¯
CuOH+ + H2O ⇄ Cu(OH)2 + H+
Соль слабого основания и сильной кислоты гидролизуется с увеличением концентрации ионов водорода в растворе, при этом рН раствора становится меньше 7.
3) Гидролиз соли, образованной слабым основанием и слабой кислотой.
NH4CN + H2O ⇄ HCN + NH4OH
В реакции гидролиза участвуют и катион, и анион соли, связывающие соответственно гидроксид-ионы и ионы водорода. Гидролиз протекает практически до конца. Поэтому реакция среды в результате гидролиза определяется относительной силой образующейся слабой кислоты и слабого основания, и часто бывает нейтральной. Для определения реакции среды в данном случае следует сравнить константы диссоциации полученной кислоты и основания. Так, для приведенного примера: Кд (NH4OH) = 1,8×10-5, Kд (HCN) = 7,1×10-10, циановодородная кислота является более слабым электролитом, поэтому реакция среды будет щелочной.
Если рассмотреть гидролиз ацетата аммония:
CH3COONH4 + H2O ⇄CH3COOH + NH4OH
то реакция среды будет нейтральная, т.к. Кд(CH3COOH)=1,8×10-5
Kд(NH4OH) = 1,8×10-5.
4) Гидролиз соли, образованной сильным основанием и сильной кислотой.
Гидролиз соли образованной сильным основанием и сильной кислотой не протекает.
5) Совместный гидролиз двух солей
Гидролиз некоторых солей, образованных очень слабыми кислотами и основаниями является необратимым, например гидролиз сульфидов и карбонатов Al3+, Cr3+, Fe3+.
Al2S3 + 6H2O = 2Al(OH)3 +3H2S
Эти соединения нельзя получить в водном растворе (в таблице растворимости стоит прочерк). При взаимодействии солей этих металлов с растворами сульфидов и карбонатов в осадок выпадают не сульфиды и карбонаты, а гидроксиды алюминия, хрома (III), железа (III).
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3¯ + 3H2S + 6NaCl
2Al3+ + 6Cl¯+ 6Na+ + 3S2¾ + 6H2O = 2Al(OH)3 ¯+ 3H2S + 6Na+ + 6Cl¯
2Al3+ + 3S2¾ + 6H2O = 2Al(OH)3¯ + 3H2S
Константа гидролиза
С количественной точки зрения гидролиз можно охарактеризовать константой гидролиза.
1) Гидролиз соли образованной сильным основанием и слабой кислотой:
CH3COO¯ + H2O ⇄ CH3COOH + OH¯
(константа гидролиза)
но [OH¯] = Kw/[H+] (из ионного произведения воды), тогда
выражение
где Ккисл – константа диссоциации слабой кислоты
Аналогично для других случаев получим:
2) Гидролиз соли образованной слабым основанием и сильной кислотой
(Косн – константа диссоциации слабого основания)
3) Гидролиз соли образованной слабым основанием и слабой кислотой
В соответствии с принципом Ла-Шателье гидролитическое равновесие может смещаться под влиянием различных факторов. Разбавление раствора соли может рассматриваться как увеличение концентрации воды, что приводит к усилению гидролиза.
Повышение температуры влияет на гидролиз главным образом вследствие резкой температурной зависимости степени диссоциации воды. Поэтому при нагревании увеличивается диссоциация воды и следовательно вероятность связывания ионов водорода и гидроксид-ионов в малодиссоциирующее соединение. Гидролиз усиливается.
Чтобы уменьшить гидролиз следует добавить кислоту или основание в зависимости от того, какой гидролиз протекает — по катиону или аниону.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование:штативы, пробирки, спиртовки, держатели, набор реактивов в капельницах и бюксах.
Опыт 1. Определение реакции среды в растворах солей
В первую пробирку внесите 5-6 капель соляной кислоты, во вторую пробирку внесите 5-6 капель воды, в третью пробирку внесите 5-6 гидроксида калия. Во все пробирки добавьте по 1-2 капли тимолового синего. Заполните таблицу 6.1.
Таблица 6.1
Окраска индикатора в зависимости от среды
| Вещество | Среда | рН | Окраска индикатора |
| HCl | |||
| H2O | |||
| KOH |
Внесите в пробирки по 1/2 шпателя солей, указанных в таблице, добавьте к ним 1 мл воды. Внесите во все пробирки 1-2 капли индикатора тимолового синего. По окраске индикатора определите реакцию среды, значение рН определите как, рН>7, pH<7, pH=7. Также значения рН можно определить по окраске универсального индикатора и рН-метром. Заполните таблицу 6.2.
Напишите уравнения гидролиза для каждой соли в молекулярном и ионно-молекулярном виде, укажите тип гидролиза.
Таблица 6.2
Реакция среды в растворах солей
| Формула соли | Окраска индикатора | Реакция среды | рН |
| SnCl2 Li2CO3 NaCl AlCl3 KNO2 Pb(CH3COO)2 |
Опыт 2. Совместный гидролиз двух солей
Налейте в пробирки по 5-6 капель хлорида алюминия и хлорида хрома, добавьте в пробирки несколько капель карбоната натрия, до выпадения осадка.Напишите уравнения совместного гидролиза в молекулярном и ионно-молекулярном виде.
Опыт 3. Влияние температуры на степень гидролиза
К раствору ацетата натрия добавьте 1 каплю фенолфталеина, отметьте окраску раствора. Нагрейте пробирку с раствором до кипения, как изменится интенсивность окраски? Объясните полученный результат. Пробирку охладите в холодной воде. Что происходит?
Опыт 4. Смещение равновесия реакции гидролиза соли при разбавлении раствора
Налейте в колбу 50 мл дистиллированной воды и внесите 1-2 капли раствора сульфата меди. Через некоторое время наблюдайте появление осадка. Объясните, почему при разбавлении раствора усиливается гидролиз.
Лабораторная работа № 7
cyberpedia.su
Растворы электролитов. Ионно–молекулярные уравнения
При растворении в воде не все вещества имеют способность проводить электрический ток. Те соединения, водные растворы которых способны проводить электрический ток называются электролитами. Электролиты проводят ток за счет так называемой ионной проводимости, которой обладают многие соединения с ионным строением (соли, кислоты, основания). Существуют вещества, имеющие сильнополярные связи, но в растворе при этом подвергаются неполной ионизации (например, хлорид ртути II) – это слабые электролиты. Многие органические соединения (углеводы, спирты), растворенные воде, не распадаются на ионы, а сохраняют свое молекулярное строение. Такие вещества электрический ток не проводят и называются неэлектролитами.
Приведем некоторые закономерности, руководствуясь которыми можно определить к сильным или слабым электролитам относится то или иное соединение:
- Кислоты. К сильным кислотам из наиболее распространенных относятся HCl, HBr, HI, HNO3, H2SO4, HClO4. Почти все остальные кислоты – слабые электролиты.
- Основания. Наиболее распространенные сильные основания – гидроксиды щелочных и щелочноземельных металлов (исключая Be). Слабый электролит – NH3.
- Соли. Большинство распространенных солей – ионных соединений, — электролиты сильные. Исключения составляют, в основном, соли тяжелых металлов.
Теория электролитической диссоциации
Электролиты, как сильные, так и слабые и даже очень сильно разбавленные не подчиняются закону Рауля и принципу Вант-Гоффа. Имея способность к электропроводности, значения давления пара растворителя и температуры плавления растворов электролитов будут более низкими, а температуры кипения более высокими по сравнению с аналогичными значениями чистого растворителя. В 1887 г С. Аррениус, изучая эти отклонения, пришел к созданию теории электролитической диссоциации.
Электролитическая диссоциация предполагает, что молекулы электролита в растворе распадаются на положительно и отрицательно заряженные ионы, которые названы соответственно катионами и анионами.
Теория выдвигает следующие постулаты:
- В растворах электролиты распадаются на ионы, т.е. диссоциируют. Чем более разбавлен раствор электролита, тем больше его степень диссоциации.
- Диссоциация — явление обратимое и равновесное.
- Молекулы растворителя бесконечно слабо взаимодействуют (т.е. растворы близки к идеальным).
Разные электролиты имеют различную степень диссоциации, которая зависит не только от природы самого электролита, но природы растворителя, а также концентрации электролита и температуры.
Степень диссоциации α, показывает какое число молекул n распалось на ионы, по сравнению с общим числом растворенных молекул N:
α = n/N
При отсутствии диссоциации α = 0, при полной диссоциации электролита α = 1.
С точки зрения степени диссоциации, по силе электролиты делятся на сильные (α > 0,7), средней силы ( 0,3 > α > 0,7), слабые (α < 0,3 ).
Более точно процесс диссоциации электролита характеризует константа диссоциации, не зависящая от концентрации раствора. Если представить процесс диссоциации электролита в общем виде:
Aa Bb ↔ aA— + bB+
K = [A—]a·[B+]b/[Aa Bb]
Для слабых электролитов концентрация каждого иона равна произведению α на общую концентрацию электролита С таким образом, выражение для константы диссоциации можно преобразовать:
K = α2C/(1-α)
Для разбавленных растворов (1-α) =1, тогда
K = α2C
Отсюда нетрудно найти степень диссоциации
α = (K/C)1/2
Ионно–молекулярные уравнения
Рассмотрим пример нейтрализации сильной кислоты сильным основанием, например:
HCl + NaOH = NaCl + HOH
Процесс представлен в виде молекулярного уравнения. Известно, что как исходные вещества, так и продукты реакции в растворе полностью ионизированы. Поэтому представим процесс в виде полного ионного уравнения:
H+ + Cl— +Na+ + OH— = Na+ + Cl— + HOH
После «сокращения» одинаковых ионов в левой и правой частях уравнения получаем сокращенное ионное уравнение:
H+ + OH— = HOH
Мы видим, что процесс нейтрализации сводится к соединению H+ и OH— и образованию воды.
При составлении ионных уравнений следует помнить, что в ионном виде записываются только сильные электролиты. Слабые электролиты, твердые вещества и газы записываются в их молекулярном виде.
Далее рассмотрим реакцию осаждения. Смешаем водные растворы AgNO3 и HI:
| Молекулярное уравнение | AgNO3 + HI →AgI↓ + HNO3 |
| Полное ионное уравнение | Ag+ + NO3— + H+ + I— →AgI↓ + H+ + NO3— |
| Сокращенное ионное уравнение | Ag+ + I— →AgI↓ |
Процесс осаждения сводится к взаимодействию только Ag+ и I— и образованию нерастворимого в воде AgI.
Чтобы узнать способно ли интересующее нас вещество растворяться в воде, необходимо воспользоваться таблицей нерастворимости.
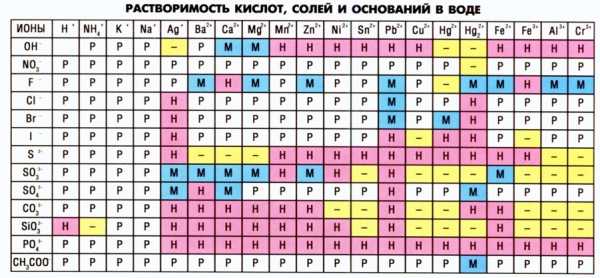
Рассмотрим третий тип реакций, в результате которой образуется летучее соединение. Это реакции взаимодействия карбонатов, сульфитов или сульфидов с кислотами. Например,
| Молекулярное уравнение | Na2SO3 + 2HI → 2NaI + SO2↑ + H2O |
| Полное ионное уравнение | 2Na+ + SO32- + 2H+ + 2I— → 2Na+ + 2I— + SO2↑ + H2O |
| Сокращенное ионное уравнение | SO32- + 2H+ → SO2↑ + H2O |
При смешении некоторых растворов ионных соединений, взаимодействия между ними может и не происходить, например
| Молекулярное уравнение | CaCl2 + 2NaI = 2NaCl +CaI2 |
| Полное ионное уравнение | Ca2+ + Cl— + 2Na+ + I— = 2Na+ + Cl— + Ca2++ 2I— |
| Сокращенное ионное уравнение | отсутствует |
Итак, подводя итог, отметим, что химические превращения наблюдаются в случаях, если соблюдается одно из следующих условий:
- Образование неэлектролита. В качестве неэлектролита может выступать вода.
- Образование осадка.
- Выделение газа.
- Образование слабого электролита, например уксусной кислоты.
- Перенос одного или нескольких электронов. Это реализуется в окислительно – восстановительных реакциях.
- Образование или разрыв одной или нескольких ковалентных связей.
zadachi-po-khimii.ru
Ионные уравнения
Количество просмотров публикации Ионные уравнения — 1283
Большинство химических реакций протекает в растворах. Растворы электролитов содержат ионы, в связи с этим реакции и растворах электролитов фактически сводятся к реакциям между ионами. Реакции между ионами называют ионными реакциями, а уравнения таких реакций — ионными уравнениями. При составлении ионных уравнении следует руководствоваться тем, что формулы веществ малодиссоциирующих, нерастворимых и газообразных записываются в молекулярном виде.
Белое вещество выпадает в осадок, то рядом с его формулой ставят стрелку, направленную вниз, а если в ходе реакции выделяется газообразное вещество, то рядом с его формулой ставят стрелку, направленную вверх.
Перепишем это уравнение, изобразив сильные электролиты в виде ионов, а уходящие из сферы реакции — в виде молекул:
Мы записали, таким образом, полное ионное уравнение реакции.
В случае если исключить из обеих частей равенства одинаковые ионы, то есть не участвующие в реакции в левой и правой часто уравнения), то получим сокращенное ионное уравнение реакции:
Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, сокращенные ионные уравнения представляют из себяуравнения в общем виде, которые характеризуют сущность химической реакции показывают, какие ионы реагируют и какое вещество образуется в результате.
Реакции ионного обмена протекают до конца в тех случаях, когда образуется или осадок, или малодиссоциирующее вещество, к примеру вода. Беля к раствору гидроксида натрия, окрашенного фенолфталеином в малиновый цвет, прилить избыток раствора азотной кислоты, то раствор обесцветится, что послужит сигналом протекания химической реакции:
Оно показывает, что взаимодействие сильной кислоты и щелочи сводится к взаимодействию ионов Н+ и ионов ОН -, в результате которого образуется малодиссоцвирующее вещество — вода.
Указанная реакция взаимодействия сильной кислоты со щелочью принято называть реакцией нейтрализации. Это частный случай реакции обмена.
Подобная реакция обмена может протекать не только между кислотами и щелочами, но и между кислотами и нерастворимыми основаниями. К примеру, в случае если получить голубой осадок нерастворимого гидроксида меди (II) взаимодействием сульфата меди II со щелочью:
а затем поделить полученный осадок на три части и прилить к осадку в первой пробирке раствор серной кислоты, к осадку во второй пробирке раствор соляной кислоты, а к осадку в третьей пробирке раствор азотной кислоты, то во всех трех пробирках осадок растворится. Это будет означать, что во всех случаях прошла химическая реакция, суть которой и отражена с помощью одного и того же ионного уравнения.
Чтобы в данном убедиться, запишите молекулярные, полные и сокращенные ионные уравнения приведенных реакций.
Рассмотрим ионные реакции, которые протекают с образованием газа. В две пробирки нальем по 2 мл растворов карбоната натрия и карбоната калия. Далее в первую прильем раствор соляной, а во вторую — азотной кислоты. В обоих случаях мы заметим характерное «вскипание» из-за выделяющегося углекислого газа. Запишем уравнения реакций для первого случая:
Реакции, протекающие в растворах электролитов, эапис каются с помощью ионных уравнений. Эти реакции называл реакциями ионного обмена, так как в растворах электролиты обмениваются своими ионами. Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, можно сделать два вывода. 1. Реакции в водных растворах электролитов являются реакциями между ионами, а потому изображаются в виде ионных уравнений. Οʜᴎ проще молекулярных и носят более общий характер.
2. Реакции ионного обмена в растворах электролитов практически необратимо протекают только в том случае, в случае если в результате образуется осадок, газ или малодиссоциирующее вещество.
7. Комплексные соединения
referatwork.ru
Внеклассный урок — Примеры составления уравнений реакции ионного обмена
Примеры составления уравнений реакции ионного обмена
НЕОБРАТИМЫЕ РЕАКЦИИ
Реакции с образованием малорастворимых веществ (осадков).
Составим молекулярное и ионно-молекулярные уравнения реакции между растворами хлорида железа(III) и гидроксида натрия.
1. Запишем молекулярное уравнение и подберем коэффициенты:
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
2. Найдем вещество, которое вызывает протекание реакции. Это Fe(OH)3. Ставим знак осадка ↓:
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
3. Укажем силу основания и растворимость солей:
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
растворимая сильное осадок растворимая
соль основание соль
4. Запишем полное ионно-молекулярное уравнение (в виде ионов представляем растворимые соли и сильное основание):
Fe3+ + 3Cl – + 3Na+ + 3OH – = Fe(OH)3↓ + 3Na+ + 3Cl –
5. Подчеркнем формулы, не участвующие в реакции (это формулы одинаковых ионов в обеих частях уравнения):
Fe3+ + 3Cl – + 3Na+ + 3OH – = Fe(OH)3↓ + 3Na+ + 3Cl –
6. Исключим подчеркнутые формулы и получим сокращенное ионно-молекулярное уравнение:
Fe3+ + 3OH – = Fe(OH)3↓
Сокращенное ионно-молекулярное показывает, что сущность реакции сводится к взаимодействию ионов Fe3+ и OH –, в результате чего образуется осадок гидроксида железа(III) Fe(OH)3.
Реакции с образованием слабодиссоциирующих веществ (слабых электролитов).
Составим молекулярное и ионно-молекулярные уравнения реакции между растворами азотной кислоты и гидроксида калия.
Молекулярное уравнение:
HNO3 + KOH = KNO3 + H2O
сильная сильное растворимая слабый
кислота основание соль электролит
Полное молекулярно-ионное уравнение:
H+ + NO3– + K+ + OH – = K+ NO3– + H2O
Сокращенное ионно-молекулярное уравнение:
H+ + OH – = H2O
Реакции с образованием газообразных веществ.
Составим молекулярное и ионно-молекулярные уравнения реакции между растворами сульфида натрия и серной кислоты.
Молекулярное уравнение:
Na2S + H2SO4 = Na2SO4 + H2S↑
растворимая сильная растворимая газ
соль кислота соль
Полное молекулярно-ионное уравнение:
2Na+ + S2– + 2H+ + SO42– = 2Na+ + SO42– + H2S↑
Сокращенное ионно-молекулярное уравнение:
2H+ + S2– = H2S↑
ОБРАТИМЫЕ РЕАКЦИИ
Разберем процессы, протекающие при сливании растворов нитрата калия и хлорида натрия.
Молекулярное уравнение:
KNO3 + NaCl = KCl + NaNO3
растворимая растворимая растворимая растворимая
соль соль соль соль
Полное молекулярно-ионное уравнение:
K+ + NO3– + Na+ + Cl – ⇄ K+ + Cl – + Na+ + NO3–
В данном случае сокращенное ионно-молекулярное уравнение написать нельзя: согласно теории электролитической диссоциации, реакция не протекает. Если такой раствор выпарить, то получим смесь четырех солей: KNO3, NaCl, KCl, NaNO3.
raal100.narod.ru
