Фосфористый водород — это… Что такое Фосфористый водород?
Фосфи́н (фосфористый водород, гидрид фосфора, по номенклатуре IUPAC — фосфан РН3) — бесцветный, очень ядовитый, довольно неустойчивый газ со специфическим запахом гнилой рыбы;
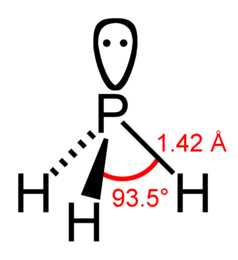
Молекула фосфина имеет форму тригональной пирамиды c молекулярной симметрией C3v (dPH = 0.142 нм, HPH = 93.5o). Дипольный момент составляет 0,58 D, сушественно ниже, чем у аммиака. Водородная связь между молекулами PH3 практически не проявляется и поэтому фосфин имеет более низкие температуры плавления и кипения.
Фосфин сильно отличается от его аналога аммиака. Его химическая активность выше, чем у аммиака, он плохо растворим в воде, как основание значительно слабее аммиака. Последнее объясняется тем, что связи H-P поляризованы слабо, а активность неподелённой пары электронов у фосфора (3s²) ниже, чем у азота (2s²) в аммиаке.
Химические свойства
В отсутствие кислорода разлагается на элементы, на воздухе самопроизвольно воспламеняется (в присутствии паров дифосфина или при температуре свыше 100 °C):
PH3 + 2O2 = H3PO4.
При взаимодействии с сильными донорами протонов фосфин может давать соли фосфония, содержащие ион PH4+ (аналогично аммонию). Соли фосфония, бесцветные кристаллические вещества, крайне неустойчивы, большинство из них либо просто не существует, либо гидролизуется. Эти соли образуются только с сильными кислотами (HCl, HBr, HClO4).
PH3 + HBr = PH4Br
PH4I + H2O = PH3↑ + H3O+ + I—
PH4I → PH3↑ + HI↑ + Q
Как и сам фосфин, так и его соли являются сильными восстановителями.
Получение
Получают фосфин при взаимодействии белого фосфора с горячей щёлочью, например:
8P + 3Ca(OH)2 + 6H2O = 2PH3↑ + 3Ca(H2PO 2)2
Также его можно получить воздействием воды или кислот на фосфиды:
Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3↑
Mg3P2 + 6HCl = 3MgCl2 + 2PH3↑
Токсичность
Фосфин сильно ядовит. ПДК = 0,1 мг/м³.
Интересные сведения
В романах Энн Маккэфри (Пернитский цикл) фосфин использовался для добычи драконами огня.
Wikimedia Foundation. 2010.
dic.academic.ru
Ортофосфорная кислота — это… Что такое Ортофосфорная кислота?
| Ортофосфорная кислота | |
| Общие | |
|---|---|
| Систематическое наименование | Ортофосфорная кислота |
| Химическая формула | H3PO4 |
| Физические свойства | |
| Состояние (ст. усл.) | твердое |
| Отн. молек. масса | 98,0 а. е. м. |
| Молярная масса | 98,0 г/моль г/моль |
| Плотность | 1,685 (жидк) г/см³ |
| Динамическая вязкость (ст. усл.) | 2,4-9,4 сПуаз Па·с (при 20 °C) |
| Термические свойства | |
| Температура плавления | 42,35 °C |
| Температура кипения | 158 °C |
| Химические свойства | |
| pKa | 2,12, 7,21, 12,67 |
| Растворимость в воде | 548 г/100 мл |
| Классификация | |
| Рег. номер CAS | [7664-38-2] |
Ортофо́сфорная кислота́ (фо́сфорная кислота́)[1] — неорганическая кислота средней силы, с химической формулой H3PO4, которая при стандартных условиях представляет собой бесцветные гигроскопичные кристаллы.
При температуре выше 213 °C она превращается в пирофосфорную кислоту H4P2O7. Очень хорошо растворима в воде. Обычно ортофосфорной (или просто фосфорной) кислотой называют 85 % водный раствор (бесцветная сиропообразная жидкость без запаха). Растворима также в этаноле и других растворителях.
Получение
Фосфорную кислоту получают из фосфата:
Можно получить гидролизом пентахлорида фосфора:
Или взаимодействием с водой оксида фосфора(V), полученного сжиганием фосфора в кислороде:
С водой реакция идет очень бурно, поэтому оксид фосфора(V) обрабатывают нагретым до 200 °C концентрированным раствором ортофосфорной кислоты.
Расплавленная ортофосфорная кислота и ее концентрированные растворы обладают большой вязкостью, что обусловлено образованием межмолекулярных водородных связей.
Свойства
H3PO4 — трехосновная кислота средней силы. При взаимодействии с очень сильной кислотой, например, с хлорной HClO4, фосфорная кислота проявляет признаки амфотерности — образуются соли фосфорила, например [Р(ОН)4]·(ClO4).
Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра — образуется жёлтый осадок:
Качественной реакцией на ион РО43− является образование ярко-жёлтого осадка молибденофосфата аммония:
Фосфаты
Соли фосфорной кислоты называются фосфатами. Фосфорная кислота образует одно-, двух- и трехзамещенные соли.
-
- (дигидрофосфат натрия)
- (гидрофосфат натрия)
- (фосфат натрия)
Дигидрофосфаты (однозамещенные фосфаты) имеют кислую реакцию, гидрофосфаты (двузамещенные фосфаты) — слабощелочную, средние (трехзамещенные фосфаты, или просто фосфаты) — щелочную.
Дигидрофосфаты обычно хорошо растворимы в воде, почти все гидрофосфаты и фосфаты растворимы мало. Прокаливание солей приводит к следующим превращениям:
Фосфаты при прокаливании не разлагаются, исключение составляет фосфат аммония (NH4)3PO4.
Органические фосфаты играют очень важную роль в биологических процессах. Фосфаты сахаров участвуют в фотосинтезе. Нуклеиновые кислоты также содержат остаток фосфорной кислоты.
Применение
Используется при пайке в качестве флюса (по окисленой меди, по чёрному металлу, по нержавеющей стали), для исследований в области молекулярной биологии. Применяется также для очищения от ржавчины металлических поверхностей. Образует на обработанной поверхности защитную плёнку, предотвращая дальнейшую коррозию. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество.
Пищевая промышленность
Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках.
Применение ортофосфорной кислоты в сельском хозяйстве. В звероводстве (в частности, при выращивании норок) используют выпойку раствора ортофосфорной кислоты для профилактики повышенного рН желудка и мочекаменной болезни.
Применение ортофосфорной кислоты в стоматологии. Ортофосфорная кислота применяется для снятия зубной эмали перед пломбированием зубов. При применении адгезивных материалов 2 и 3 поколения требуется тотальное протравливание зуба кислотой, с последующим промыванием и просушиванием. Кроме дополнительных временных затрат на проведение данные этапы несут в себе опасность возникновения различных ошибок и осложнений.
При нанесении ортофосфорной кислоты сложно проконтролировать степень и глубину деминерализации дентина и эмали. Это приводит к тому, что нанесенный адгезив не полностью (по всей глубине) заполняет открытые дентинные канальцы, а это в свою очередь не обеспечивает образование полноценного гибридного слоя.
Кроме того, не всегда удается полностью удалить ортофосфорную кислоту после ее нанесения на дентин. Это зависит от того, каким способом сгущена фосфорная кислота. Остатки ортофосфорной кислоты ухудшают прочность бондинга, а также приводят к образованию так называемой «кислотной мины».
Поэтому с появлением адгезивных материалов 5 и 6 поколения ортофосфорная кислота использоваться перестала.
См. также
Примечания
Литература
- Карапетьянц М. Х. Дракин С. И. Общая и неорганическая химия. М.: Химия1994
- Блум У. Адгезивные системы обзор и сравнение// Дент. Арт.- 2003,№ 2.-С.5-11.
- Давыдова А. В. Характеристика адгезивных систем// Материалы научно-практической конференции «Новые технологии в стоматологии».- Ростов на Дону, 2004.-С.45-46
- Enamel-dentin adhesives, self-etching primers// CRA Newsletter.- Vol.24,№ 11.-2000.-P.1-2.
Ссылки
Фосфорная кислота
dic.academic.ru
Фосфин — WiKi
Фосфи́н (фосфористый водород, фосфид водорода, гидрид фосфора, по номенклатуре IUPAC — фосфан) РН3 — бесцветный ядовитый газ (при нормальных условиях). Чистый фосфин не имеет запаха, но образцы технического продукта обладают неприятным запахом, похожим на запах тухлой рыбы.
| Фосфин | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Фосфин |
| Хим. формула | PH3 |
| Физические свойства | |
| Состояние | газ |
| Молярная масса | 34,00 г/моль |
| Плотность | 1,379 г/л, газ (25 °C) |
| Энергия ионизации | 9,96 ± 0,01 эВ[1] |
| Термические свойства | |
| Т. плав. | −133,8 °C |
| Т. кип. | −87,8 °C |
| Пр. взрв. | 1,79 ± 0,01 об.%[1] |
| Энтальпия образования | 5,4 кДж/моль |
| Давление пара | 41,3 ± 0,1 атм[1] |
| Растворимость в воде | 31,2 мг/100 мл (17 °C) |
| Классификация | |
| Рег. номер CAS | [7803-51-2] |
| PubChem | 24404 |
| Рег. номер EINECS | 232-260-8 |
| SMILES | |
| InChI | |
| RTECS | SY7525000 |
| ChEBI | 30278 |
| Номер ООН | 2199 |
| ChemSpider | 22814 |
| Безопасность | |
| Токсичность | Чрезвычайно токсичен, СДЯВ |
| NFPA 704 |
|
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Физические свойства
Бесцветный газ. Плохо растворяется в воде, образует с ней неустойчивый гидрат, который проявляет очень слабые основные свойства[2]. При низких температурах образует твёрдый клатрат 8РН3·46Н2О. Растворим в бензоле, диэтиловом эфире, сероуглероде. При −133,8 °C образует кристаллы с гранецентрированной кубической решёткой.
Молекула фосфина имеет форму тригональной пирамиды c молекулярной симметрией C3v (dPH = 0,142 нм, ∠HPH = 93,5°). Дипольный момент составляет 0,58 Д, существенно ниже, чем у аммиака. Водородная связь между молекулами PH3 практически не проявляется и поэтому фосфин имеет более низкие температуры плавления и кипения.
Получение
Химические свойства
Фосфин сильно отличается от своего аналога, аммиака. Его химическая активность выше, чем у аммиака, он плохо растворим в воде, как основание значительно слабее аммиака. Последнее объясняется тем, что связи H−P поляризованы слабо и активность неподелённой пары электронов у фосфора (3s2) ниже, чем у азота (2s2) в аммиаке.
В отсутствие кислорода при нагревании разлагается на элементы:
- 2Ph4 →t 2P+3h3{\displaystyle {\mathsf {2PH_{3}\ {\xrightarrow {\mathit {t}}}\ 2P+3H_{2}}}}
На воздухе самопроизвольно воспламеняется (в присутствии паров дифосфина или при температуре свыше 100 °C):
- Ph4+2O2 → h4PO4{\displaystyle {\mathsf {PH_{3}+2O_{2}\ {\xrightarrow {\ \ }}\ H_{3}PO_{4}}}}
Проявляет сильные восстановительные свойства:
- Ph4+3h3SO4 → h3(PHO2)+3SO2↑+ 3h3O{\displaystyle {\mathsf {PH_{3}+3H_{2}SO_{4}\ {\xrightarrow {\ \ }}\ H_{2}(PHO_{2})+3SO_{2}\uparrow +\ 3H_{2}O}}}
- Ph4+8HNO3 → h4PO4+8NO2↑+ 4h3O{\displaystyle {\mathsf {PH_{3}+8HNO_{3}\ {\xrightarrow {\ \ }}\ H_{3}PO_{4}+8NO_{2}\uparrow +\ 4H_{2}O}}}
- Ph4+2I2+2h3O → H(Ph3O2)+4HI{\displaystyle {\mathsf {PH_{3}+2I_{2}+2H_{2}O\ {\xrightarrow {\ \ }}\ H(PH_{2}O_{2})+4HI}}}
В связи с тем, что:
- 4h3(PHO3) →170−200∘C Ph4↑+3h4PO4{\displaystyle {\mathsf {4H_{2}(PHO_{3})\ {\xrightarrow {170-200^{\circ }C}}\ PH_{3}\uparrow +3H_{3}PO_{4}}}}
то возможно протекание следующей реакции:
- Ph4+4h3SO4 →200∘C h4PO4+4SO2↑+4h3O{\displaystyle {\mathsf {PH_{3}+4H_{2}SO_{4}\ {\xrightarrow {200^{\circ }C}}\ H_{3}PO_{4}+4SO_{2}\uparrow +4H_{2}O}}}
При взаимодействии с сильными донорами протонов фосфин может давать соли фосфония, содержащие ион PH4+ (аналогично аммонию). Соли фосфония, бесцветные кристаллические вещества, крайне неустойчивы, легко гидролизуется.
- Ph4+HCl →30∘C Ph5Cl{\displaystyle {\mathsf {PH_{3}+HCl\ {\xrightarrow {30^{\circ }C}}\ PH_{4}Cl}}}
- Ph4+HI → Ph5I{\displaystyle {\mathsf {PH_{3}+HI\ {\xrightarrow {\ \ }}\ PH_{4}I}}}
Соли фосфония, как и сам фосфин, являются сильными восстановителями.
Токсичность
Фосфин очень ядовит, негативно воздействует на нервную систему, нарушает обмен веществ. ПДК = 0,1 мг/м³. Запах ощущается при концентрации 2—4 мг/м³, длительное вдыхание при концентрации 10 мг/м³ приводит к летальному исходу. В крови человека содержание фосфина не более 0,001 мг/л.
Самовозгорание
Примечания
Литература
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
ru-wiki.org
Фосфин — это… Что такое Фосфин?
Фосфи́н (фосфористый водород, гидрид фосфора, по номенклатуре IUPAC — фосфан РН3) — бесцветный, очень ядовитый, довольно неустойчивый газ (при нормальных условиях) со специфическим запахом гнилой рыбы.
Физические свойства
Бесцветный газ. Плохо растворяется в воде, не реагирует с ней. При низких температурах образует твердый клатрат 8РН3·46Н2О. Растворим в бензоле, диэтиловом эфире, сероуглероде. При −133,8 °C образует кристаллы с гранецентрированной кубической решёткой.
Молекула фосфина имеет форму тригональной пирамиды c молекулярной симметрией C3v (dPH = 0.142 нм, HPH = 93.5o). Дипольный момент составляет 0,58 D, существенно ниже, чем у аммиака. Водородная связь между молекулами PH3 практически не проявляется и поэтому фосфин имеет более низкие температуры плавления и кипения.
Получение
Фосфин получают при взаимодействии белого фосфора с горячей щёлочью, например:
Также его можно получить воздействием воды или кислот на фосфиды:
Возможен синтез непосредственно из элементов:[источник не указан 273 дня]
Хлористый водород при нагревании взаимодействует с белым фосфором:
Разложение йодида фосфония:
Разложение фосфоновой кистоты:
или её восстановление:
Химические свойства
Фосфин сильно отличается от его аналога аммиака. Его химическая активность выше, чем у аммиака, он плохо растворим в воде, как основание значительно слабее аммиака. Последнее объясняется тем, что связи H-P поляризованы слабо и активность неподелённой пары электронов у фосфора (3s2) ниже, чем у азота (2s2) в аммиаке.
В отсутствие кислорода при нагревании разлагается на элементы:
на воздухе самопроизвольно воспламеняется (в присутствии паров дифосфина или при температуре свыше 100 °C):
Проявляет сильные восстановительные свойства:
При взаимодействии с сильными донорами протонов фосфин может давать соли фосфония, содержащие ион PH4+ (аналогично аммонию). Соли фосфония, бесцветные кристаллические вещества, крайне неустойчивы, легко гидролизуется.
Соли фосфина, как и сам фосфин, являются сильными восстановителями.
Токсичность
Фосфин сильно ядовит, действует на нервную систему, нарушает обмен веществ. ПДК = 0,1 мг/м³. Запах ощущается при концентрации 2-4 мг/м³, длительное вдыхание при концентрации 10 мг/м³ приводит к летальному исходу. В крови человека содержание фосфина не более 0,001 мг/м³.
Самовозгорание
Фосфин способен к самовозгоранию при контакте с кислородом воздуха. Может вызывать появление «блуждающих огней»[1][2].
Примечания
- ↑ Благодатный огонь — взгляд скептика
- ↑ Осторожно — фосфин!
Литература
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0
dic.academic.ru
Словарь названий и формул неорганических веществ
СЛОВАРЬ НАЗВАНИЙ И ФОРМУЛ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ.Вещества расположены в порядке их усложнения в соответствии с возрастанием степеней окисления элементов.
ВНИМАНИЕ!!! Названия и формулы веществ, выделенные жирным шрифтом, надо знать или уметь выводить их формулы, об остальных веществах желательно иметь представление.
ПРОСТЫЕ ВЕЩЕСТВА.
Азот – N2.
Бром – Br2.
Водород – H2.
Йод – I2.
Кислород – O2.
Озон — O3.
Сера кристаллическая — S8.
Фосфор белый — P4.
Фтор – F2.
Хлор – Cl2.
ОКСИДЫ.
Оксид лития – Li2O.
Оксид калия – K2O.
Оксид натрия – Na2O.
Оксид магния –Mg2O.
Оксид кальция —CaO.
Оксид бария — BaO.
Оксид цинка – ZnO.
Оксид меди(I) – Cu2O.
Оксид меди(II) – CuO.
Оксид железа(II) — FeO.
Оксид железа(III) – Fe2O3.
Оксид алюминия –Al2O3.
Оксид марганца(IV) – MnO2.
Оксид марганца(VII) –Mn2O7.
Оксид хрома(II) -CrO.
Оксид хрома(III) – Cr2O3.
Оксид хрома(VI) –CrO3.
Оксид азота(I) – N2O.
Оксид азота(II) — NO.
Оксид азота(III) – N2O3.
Оксид азота(IV) – NO2.
Оксид азота(V) –N2O5.
Оксид углерода(II) — CO.
Оксид углерода(IV) – CO2.
Оксид кремния(IV) – SiO2.
Оксид серы(IV) – SO2.
Оксид серы(VI) – SO3.
Оксид фосфора(III) – P2O3.
Оксид фосфора(V) – P2O5.
Оксид хлора(I) – Cl2O.
Оксид хлора(III) – Cl2O3.
Оксид хлора(V) – Cl2O5.
Оксид хлора(VII) – Cl2O7.
Оксид ксенона(VIII) — XeO4
ВОДОРОДНЫЕ СОЕДИНЕНИЯ НЕМЕТАЛЛОВ.
Аммиак – NH3.
Арсин – AsH3.
Бромоводород — HBr.
Вода – H2O.
Герман – GeH4.
Диборан — В2Н6.
Иодоводород — HI.
Метан – CH4.
Селеноводород – H2Se.
Сероводород – H2S.
Силан – SiH4.
Стибин — SbН3.
Теллуроводород – H2Te.
Фосфин – PH3.
Фтороводород — HF.
Хлороводород — HCl.
БИНАРНЫЕ СОЕДИНЕНИЯ НЕКОТОРЫХ МЕТАЛЛОВ И НЕМЕТАЛЛОВ.
Арсенид лития – Li3As.
Арсенид натрия – Na3As.
Арсенид калия – K3As.
Арсенид магния – Mg3As2.
Арсенид кальция – Ca3As2.
Арсенид бария – Ba3As2.
Борид лития – Li3B.
Борид натрия – Na3B.
Борид калия – K3B.
Борид магния — MgB2.
Борид (гексаборид) кальция – CaB6.
Борид (додекаборид) алюминия — AlB12.
Бромид лития — LiBr.
Бромид калия — KBr.
Бромид натрия — NaBr.
Бромид магния –MgBr2.
Бромид кальция – CaBr2.
Бромид бария – BaBr2.
Бромид цинка – ZnBr2.
Бромид меди(I) – CuBr.
Бромид меди(II) – CuBr2.
Бромид железа(II) – FeBr2.
Бромид железа(III) – FeBr3.
Бромид алюминия – AlBr3.
Бромид азота(III) — NBr3.
Бромид серы(II) — SBr2.
Бромид серы(IV) — SBr4.
Бромид серы(VI) — SBr6.
Бромид углерода(IV) — СBr4.
Гидрид лития — LiH.
Гидрид натрия — NaH.
Гидрид калия — KH.
Гидрид магния – MgH2.
Гидрид кальция – CaH2.
Гидрид бария – BaH2.
Иодид лития — LiI.
Иодид калия — KI.
Иодид натрия — NaI.
Иодид магния –MgI2.
Иодид кальция – CaI2.
Иодид бария – BaI2.
Иодид цинка – ZnI2.
Иодид меди(II) – CuI2.
Иодид железа(II) – FeI2.
Иодид железа(III) – FeI3.
Иодид алюминия – AlI3.
Иодид азота(III) — NI3.
Иодид серы(II) — SI2.
Иодид серы(IV) — SI4.
Иодид серы(VI) — SI6.
Иодид углерода(IV) — СI4.
Карбид меди(I) – Cu2C2
Карбид серебра(I) – Ag2C2.
Карбид кальция – CaC2.
Карбид алюминия – Al4C3.
Карбид бора – B4C
Нитрид лития – Li3N.
Нитрид натрия – Na3N.
Нитрид магния – Mg3N2.
Нитрид кальция – Ca3N2.
Нитрид бария – Ba3N2.
Пероксид калия – K2O2.
Пероксид натрия – Na2O2.
Пероксид водорода – Н2O2.
Пероксид бария – BaO2.
Надпероксид (супероксид) калия – KO2.
Надпероксид (супероксид) натрия – NaO2.
Силицид лития – Li4Si.
Силицид натрия – Na4Si.
Силицид калия – K4Si.
Силицид кальция – Ca2Si.
Силицид бария – Ba2Si.
Сульфид лития – Li2S.
Сульфид калия – K2S.
Сульфид натрия – Na2S.
Сульфид магния — MgS.
Сульфид кальция — CaS.
Сульфид бария — BaS.
Сульфид цинка — ZnS.
Сульфид меди(II) — CuS.
Сульфид железа(II) — FeS.
Сульфид алюминия – Al2S3.
Сульфид углерода(IV) — СS2.
Селенид лития – Li2Se.
Селенид натрия – Na2Se.
Селенид калия – K2Se.
Селенид магния — MgSe.
Селенид кальция — CaSe.
Селенид бария — BaSe.
Теллурид лития – Li2Te.
Теллурид натрия – Na2Te.
Теллурид калия – K2Te.
Теллурид магния – Mg2Te2.
Теллурид кальция – Ca2Te2.
Теллурид бария – Ba2Te2.
Фосфид лития – Li3P.
Фосфид натрия – Na3P.
Фосфид калия – K3P.
Фосфид магния – Mg3P2.
Фосфид кальция – Ca3P2.
Фосфид бария – Ba3P2.
Фторид лития — LiF.
Фторид калия — KF.
Фторид натрия — NaF.
Фторид магния –MgF2.
Фторид кальция – CaF2.
Фторид бария – BaF2.
Фторид цинка – ZnF2.
Фторид меди(II) – CuF2.
Фторид железа(II) – FeF2.
Фторид железа(III) – FeF3.
Фторид алюминия – AlF3.
Фторид азота(III) — NF3.
Фторид кислорода — ОF2.
Фторид серы(II) — SF2.
Фторид серы(IV) — SF4.
Фторид серы(VI) — SF6.
Фторид углерода(IV) — СF4.
Хлорид лития — LiCl.
Хлорид калия — KCl.
Хлорид натрия — NaCl.
Хлорид магния –MgCl2.
Хлорид кальция – CaCl2.
Хлорид бария – BaCl2.
Хлорид цинка – ZnCl2.
Хлорид меди(I) – CuCl.
Хлорид меди(II) – CuCl2.
Хлорид железа(II) – FeCl2.
Хлорид железа(III) – FeCl3.
Хлорид алюминия – AlCl3.
Хлорид азота(III) — NCl3.
Хлорид углерода(IV) — СCl4.
Хлорид серы(II) — SCl2.
Хлорид серы(IV) — SCl4.
Хлорид серы(VI) — SCl6.
ОСНОВАНИЯ.
Гидроксид аммония (водный раствор аммиака) – NH4OH (NH3·H2O).
Гидроксид лития — LiOH.
Гидроксид калия — KOH.
Гидроксид натрия — NaOH.
Гидроксид магния –Mg(OH)2.
Гидроксид кальция — Ca(OH)2.
Гидроксид бария -Ba(OH)2.
Гидроксид цинка — Zn(OH)2.
Гидроксид меди(I) — CuOH.
Гидроксид меди(II) — Cu(OH)2.
Гидроксид железа(II) — Fe(OH)2.
Гидроксид железа(III) —Fe(OH)3.
Гидроксид алюминия —Al(OH)3.
КИСЛОТЫ.
Азотистая кислота – HNO2.
Азотная кислота – HNO3.
Метаборная кислота — HBO2.
Ортоборная (борная) кислота — H3BO3.
Бромоводородная кислота — HBr.
Бромноватистая кислота — HBrO.
Бромистая кислота – HBrO2.
Бромноватая кислота – HBrO3.
Бромная кислота – HBrO4.
Иодоводородная кислота — HI.
Кремниевая кислота — H2SiO3.
Маргановистая кислота – H2MnO4.
Марганцевая кислота – HMnO4.
Мышьяковистая кислота — H3AsO3.
Мышьяковая кислота — H3AsO4.
Селенистая кислота — H2SeO3.
Селеновая кислота — H2SeO4.
Сероводородная кислота – H2S.
Сернистая кислота – H2SO3.
Серная кислота – H2SO4.
Пиросерная кислота — H2S2O7.
Угольная кислота – H2CO3.
Фосфорноватистая кислота — H3PO2 .
Фосфорноватая кислота — H4P2O6.
Фосфористая кислота – H3PO3.
Пирофосфористая кислота – H4P2O5.
Метафосфорная кислота – HPO3.
Ортофосфорная (фосфорная) кислота – H3PO4.
Пирофосфорная кислота — H4P2O7.
Фтороводородная (плавиковая) кислота — HF.
Хромовая кислота – H2CrO4.
Двухромовая кислота – H2Cr2O7.
Хлороводородная кислота — HCl.
Хлорноватистая кислота — HClO.
Хлористая кислота – HClO2.
Хлорноватая кислота – HClO3.
Хлорная кислота – HClO4.
Циановодородная (cинильная) кислота — HCN.
Циановая кислота — HCNO.
СРЕДНИЕ СОЛИ.
Средние соли бинарного типа см. в БИНАРНЫХ СОЕДИНЕНИЯХ.
Бихромат-анион — Cr2O72-
Бихромат аммония – (NH4)2Cr2O7 .
Бихромат лития — Li2Cr2O7.
Бихромат натрия — Na2Cr2O7.
Бихромат калия — K2Cr2O7.
Бихромат магния -MgCr2O7.
Бихромат кальция — CaCr2O7.
Бихромат бария — BaCr2O7.
Бихромат алюминия – Al2(Cr2O7)3.
Гипохлорит-анион — ClO—
Гипохлорит аммония – NH4ClO
Гипохлорит лития — LiClO.
Гипохлорит натрия — NaClO.
Гипохлорит калия — KClO.
Гипохлорит магния -Mg(ClO)2.
Гипохлорит кальция — Ca(ClO)2.
Гипохлорит бария – Ba(ClO)2.
Карбонат–анион — CO32-
Карбонат аммония – (NH4)2CO3
Карбонат лития — Li2CO3.
Карбонат натрия — Na2CO3.
Карбонат калия — K2CO3.
Карбонат магния —MgCO3.
Карбонат кальция — CaCO3.
Карбонат бария — BaCO3.
Карбонат цинка — ZnCO3.
Карбонат меди(II) — CuCO3.
Карбонат железа(II) — FeCO3.
Карбонат железа(III) — Fe2(CO3)3.
Карбонат алюминия – Al2(CO3)3.
Манганат-анион — MnO42-.
Манганат лития – Li2MnO4.
Манганат натрия — Na2MnO4.
Манганат калия — K2MnO4.
Манганат магния -MgMnO4.
Манганат кальция — CaMnO4.
Манганат бария — BaMnO4.
Нитрат-анион — NO3—.
Нитрат аммония – NH4NO3
Нитрат лития — LiNO3.
Нитрат натрия — NaNO3.
Нитрат калия — KNO3.
Нитрат магния –Mg(NO3)2.
Нитрат кальция — Ca(NO3)2.
Нитрат бария — Ba(NO3)2.
Нитрат цинка — Zn(NO3)2.
Нитрат меди(II) — Cu(NO3)2.
Нитрат железа(II) — Fe(NO3)2.
Нитрат железа(III) — Fe(NO3)3.
Нитрат алюминия – Al(NO3)3.
Нитрит-анион — NO2—.
Нитрит аммония – NH4NO2
Нитрит лития — LiNO2.
Нитрит натрия — NaNO2.
Нитрит калия — KNO2.
Нитрит магния —Mg(NO2)2.
Нитрит кальция — Ca(NO2)2.
Нитрит бария — Ba(NO2)2.
Нитрит цинка — Zn(NO2)2.
Нитрит меди(II) — Cu(NO2)2.
Нитрит железа(II) — Fe(NO2)2.
Нитрит железа(III) — Fe(NO2)3.
Нитрит алюминия – Al(NO2)3.
Перманганат-анион — MnO4—
Перманганат лития — LiMnO4.
Перманганат натрия — NaMnO4.
Перманганат калия — KMnO4.
Перманганат магния -Mg(MnO4)2.
Перманганат кальция — Ca(MnO4)2.
Перманганат бария — Ba(MnO4)2.
Персульфат-анион — S2O82-
Персульфат лития – Li2S2O8.
Персульфат натрия – Na2S2O8.
Персульфат калия – K2S2O8.
Персульфат магния -MgS2O8.
Персульфат кальция — CaS2O8.
Персульфат бария — BaS2O8.
Перхлорат-анион ClO4—
Перхлорат аммония – NH4ClO4
Перхлорат лития — LiClO4.
Перхлорат натрия — NaClO4.
Перхлорат калия — KClO4.
Перхлорат магния –Mg(ClO4)2.
Перхлорат кальция — Ca(ClO4)2.
Перхлорат бария — Ba(ClO4)2.
Пиросульфат-анион S2O72-
Пиросульфат лития — Li2S2O7.
Пиросульфат натрия — Na2S2O7.
Пиросульфат калия — K2S2O7.
Силикат-анион SiO32-
Силикат лития — Li2SiO3.
Силикат натрия — Na2SiO3.
Силикат калия — K2SiO3.
Силикат магния —MgSiO3.
Силикат кальция — CaSiO3.
Силикат бария — BaSiO3.
Силикат цинка — ZnSiO3.
Силикат меди(II) — CuSiO3.
Силикат железа(II) — Fe.
Силикат железа(III) — Fe.
Силикат алюминия – Al2(SiO3)3.
Сульфат-анион SO42-
Сульфат аммония – (NH4)2SO4.
Сульфат лития — Li2SO4.
Сульфат натрия — Na2SO4.
Сульфат калия — K2SO4.
Сульфат магния -MgSO4.
Сульфат кальция — CaSO4.
Сульфат бария — BaSO4.
Сульфат цинка — ZnSO4.
Сульфат меди(II) — CuSO4.
Сульфат железа(II) — FeSO4.
Сульфат железа(III) — Fe2(SO4)3.
Сульфат алюминия – Al2(SO4)3.
Сульфит-анион SO32-
Сульфит аммония – (NH4)2SO3
Сульфит лития — Li2SO3.
Сульфит натрия — Na2SO3.
Сульфит калия — K2SO3.
Сульфит магния —MgSO3.
Сульфит кальция — CaSO3.
Сульфит бария — BaSO3.
Сульфит цинка — ZnSO3.
Сульфит меди(II) — CuSO3.
Фосфат-анион PO43-.
Фосфат аммония – (NH4)3PO4.
Фосфат лития — Li3PO4..
Фосфат натрия — Na3PO4..
Фосфат калия — K3PO4..
Фосфат магния -Mg3(PO4)2.
Фосфат кальция — Ca3(PO4)2.
Фосфат бария — Bа3(PO4)2.
Фосфат цинка — Zn3(PO4)2.
Фосфат меди(II) — Cu3(PO4)2.
Фосфат железа(II) — Fe3(PO4)2.
Фосфат железа(III) – FePO4.
Фосфат алюминия – AlPO4.
Хлорат-анион ClO3—
Хлорат аммония – NH4ClO3
Хлорат натрия — NaClO3.
Хлорат калия — KClO3.
Хлорат магния –Mg(ClO3)2.
Хлорат кальция — Ca(ClO3)2.
Хлорит-анион ClO2—
Хлорит аммония – NH4ClO2.
Хлорит натрия — NaClO2.
Хлорит калия — KClO2..
Хлорит магния -Mg(ClO2)2.
Хлорит кальция — Ca(ClO2)2.
КИСЛЫЕ СОЛИ.
Гидросульфид-анион – HS—.
Гидросульфид аммония – NH4HS
Гидросульфид лития — LiHS.
Гидросульфид натрия — NaHS.
Гидросульфид калия — KHS.
Гидросульфид магния –Mg(HS)2.
Гидросульфид кальция — Ca(HS)2.
Гидросульфид бария — Ba(HS)2.
Гидросульфит-анион – HSO3—.
Гидросульфит аммония – NH4HSO3
Гидросульфит лития — LiHSO3.
Гидросульфит натрия — NaHSO3.
Гидросульфит калия — KHSO3.
Гидросульфит магния –Mg(HSO3)2.
Гидросульфит кальция — Ca(HSO3)2.
Гидросульфит бария — Ba(HSO3)2.
Гидросульфат-анион – HSO4—.
Гидросульфат аммония – NH4HSO4
Гидросульфат лития – LiHSO4.
Гидросульфат натрия – NaHSO4.
Гидросульфат калия – KHSO4.
Гидросульфат магния –Mg(HSO4)2.
Гидросульфат кальция — Ca(HSO4)2.
Гидросульфат бария — Ba(HSO4)2
Гидрокарбонат-анион – HCO3—.
Гидрокарбонат лития — LiHCO3.
Гидрокарбонат натрия — NaHCO3.
Гидрокарбонат калия — KHCO3.
Гидрокарбонат магния –Mg(HCO3)2.
Гидрокарбонат кальция — Ca(HCO3)2.
Гидрокарбонат бария — Ba(HCO3)2.
Дигидрофосфат-анион – H2PO4—.
Дигидрофосфат аммония – NH4H2PO4
Дигидрофосфат лития — LiH2PO4.
Дигидрофосфат натрия — NaH2PO4.
Дигидрофосфат калия — KH2PO4.
Дигидрофосфат магния –Mg(H2PO4)2.
Дигидрофосфат кальция — Ca(H2PO4)2.
Дигидрофосфат бария — Ba(H2PO4)2.
Дигидрофосфат цинка — Zn(H2PO4)2.
Дигидрофосфат алюминия – Al(H2PO4)3.
Гидрофосфат-анион – HPO42-.
Гидрофосфат аммония – (NH4)2HPO4
Гидрофосфат лития – Li2HPO4.
Гидрофосфат натрия – Na2HPO4.
Гидрофосфат калия – K2HPO4.
Гидрофосфат магния -MgHPO4.
Гидрофосфат кальция — CaHPO4.
Гидрофосфат бария — BaHPO4.
ОСНОВНЫЕ СОЛИ.
В некоторых изданиях приставка «гидроксо» добавляется к названию металла.
Гидроксохлорид магния – хлорид гидроксомагния.
В настоящем словаре использована номенклатура, приведённая в «Химическом энциклопедическом словаре».
Катион гидроксомагния -MgОН+..
Катион гидроксокальция – CaОН+.
Катион гидроксобария — BaОН+.
Катион гидроксоцинка — ZnОН+.
Катион гидроксомеди(II) — CuОН+.
Катион гидроксожелеза(II) — FeОН+.
Катион гидроксожелеза(III) – FeОН2+.
Катион гидроксоалюминия – AlОН2+..
Катион дигидроксожелеза(III) — Fe(ОН)2+.
Катион дигидроксоалюминия – Al(ОН)2+.
Гидроксохлорид магния –Mg(ОН)Cl.
Гидроксохлорид кальция – Ca(ОН)Cl.
Гидроксохлорид бария – Ba(ОН)Cl.
Гидроксохлорид цинка – Zn(ОН)Cl.
Гидроксохлорид меди(II) – Cu(ОН)Cl.
Гидроксохлорид железа(II) – Fe(ОН)Cl.
Гидроксохлорид железа(III) – Fe(ОН)Cl2.
Гидроксохлорид алюминия – Al(ОН)Cl2.
Гидроксосульфат магния –(MgОH)2SO4.
Гидроксосульфат кальция – (CaОH)2SO4.
Гидроксосульфат бария – (BaОH)2SO4.
Гидроксосульфат цинка – (ZnОH)2SO4.
Гидроксосульфат меди(II) – (CuОH)2SO4.
Гидроксосульфат железа(II) – (FeОH)2SO4.
Гидроксосульфат железа(III) – Fe(ОН)SO4.
Гидроксосульфат алюминия – Al(ОН)SO4.
Гидроксонитрат магния –Mg(ОH)NO3.
Гидроксонитрат кальция – Ca(ОH)NO3.
Гидроксонитрат бария – Ba(ОH)NO3.
Гидроксонитрат цинка – Zn(ОH)NO3.
Гидроксонитрат меди(II) – Cu(ОH)NO3.
Гидроксонитрат железа(II) – Fe(ОH)NO3.
Гидроксонитрат железа(III) – Fe(ОH)(NO3)2.
Гидроксонитрат алюминия – Al(ОH)(NO3)2.
Гидроксофосфат магния –(MgОН)3PO4.
Гидроксофосфат кальция – (CaОН)3PO4.
Гидроксофосфат бария – (BaОН)3PO4.
Гидроксофосфат цинка – (ZnОН)3PO4.
Гидроксофосфат меди(II) – (CuОН)3PO4.
Гидроксофосфат железа(II) – (FeОН)3PO4.
Гидроксофосфат железа(III) – (FeОН)3(PO4)2.
Гидроксофосфат алюминия – (AlОН)3(PO4)2.
Дигидроксохлорид железа(III) – Fe(ОН)2Cl.
Дигидроксохлорид алюминия – Al(ОН)2Cl.
Дигидроксосульфат железа(III) – (Fe(ОН)2)2SO4
Дигидроксосульфат алюминия – (Al(ОН)2)2SO4
Дигидроксонитрат железа(III) — Fe(ОН)2NO3.
Дигидроксонитрат алюминия – Al(ОН)2NO3.
Дигидроксофосфат железа(III) – (Fe(ОН)2)3PO4.
Дигидроксофосфат алюминия – (Al(ОН)2)3PO4.
ДВОЙНЫЕ СОЛИ.
Сульфат калия-алюминия – KАl(SO4)2.
Сульфат натрия-калия — NaKSO4.
Фосфат дикалия-натрия — K2NaPO4.
Хлорид калия-магния — KCl·MgCl2.
www.dereksiz.org
фосфин | PPDB
Каталог пестицидов — PPDB
| phosphine ** phosphamine ** phosphorus trihydride ** На других языках |
Поведение в окружающей среде — Экотоксичность — Здоровье человека — Токсиколого-гигиеническая характеристика
Описание: Главные использования фосфина — как фумигант в течение памяти{хранения} сельскохозяйственных продуктов и против позвоночных животных. Часто сгенерируемый через расстройство{поломку} других веществ{сущностей}, типа алюминиевого фосфида.
Год официальной регистрации: приблизительно 1780
Выпуск пестицидов на рынок (директива 91/414/ЕЭС), статус:
| Статус | Приложение 1 |
| Досье докладчика / содокладчика | — |
| Дата включения истекает | — |
Разрешен к применению (V) или известен (#) в следующих Европейских странах:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Основные сведения:
| Тип пестицида | Инсектицид, Метаболит, Фумигант |
| Тип метаболита | почва |
| Группа по химическому строению | Не классифицирован |
| Характер действия | Токсин нерва с дыхательным действием, митохондриальные сложные IV электронов транспортируют схему запрета |
| Регистрационный номер CAS | 7803-51-2 |
| Шифр КФ (Код Фермента) | 232-260-8 |
| Шифр Международного совместного аналитического совета по пестицидам (CIPAC) | — |
| Химический код Агентства по охране окружающей среды США (US EPA) | 066500 |
| Химическая формула | PH3 |
| SMILES | P |
| Международный химический идентификатор (InChI) | InChI=1/h4P/h2h4 |
| Структурная формула | |
| Молекулярная масса (г/моль) | 34.0 |
| Название по ИЮПАК | phosphane |
| Название по CAS | phosphorus trihydride |
| Другая информация | — |
| Устойчивость к гербициду по HRAC | Не определяется |
| Устойчивость к инсектициду по IRAC | 24C |
| Устойчивость к фунгициду по FRAC | Не определяется |
| Физическое состояние | Бесцветный, огнеопасный газ |
Может быть продуктом:
| aluminium phosphide | почва | 1.00 | основной продукт разложения, соответствует | |
| magnesium phosphide | почва | 1.00 | основной продукт разложения, соответствует | |
| calcium phosphide | почва | 1.000 | Major, соответствует | |
| zinc phosphide | почва | 1.00 | основной продукт разложения, соответствует | |
Выпуск:
| Показатель | Значение | |||
| Производители пестицида |
| |||
| Коммерческие названия препаратов, содержащих д.в. | — | |||
| С этим веществом связаны: | ||||
| Оценка риска от пестицида для местной экологии (Англия) | Нет | |||
| Препаративная форма и особенности применения | Фумигант. | |||
| Растворимость в воде при 20oC (мг/л) | 312 | Q3 | Умеренно | |
| Растворимость в органических растворителях при 20oC (мг/л) | 5.0 | L3 — Ethanol | — | |
| 20 | L3 — Ether | — | ||
| 2856 | L3 — Cyclohexanol | — | ||
| Температура плавления (oC) | -132 | L3 | — | |
| Температура кипения (oC) | -87.7 | V3 | — | |
| Температура разложения (oC) | — | — | — | |
| Температура вспышки (oC) | -15 | V3 — (Ignition is due to presence of diphosphane) | — | |
| Коэффициент распределения в системе октанол/вода при pH 7, 20oC | P: | — | — | — |
| Log P: | — | — | — | |
| Удельная плотность (г/мл) / Удельный вес | 1.512 | L3 | — | |
| Константа диссоциации (pKa) при 25oC | — | — | — | |
| Примечание: | ||||
| Давление паров при 25oC (МПа) | 3440000 | A5 | Летучий | |
| Константа закона Генри при 25oC (Па*м3/моль) | 33269 | L3 | Летучий | |
| Константа закона Генри при 20oC (безразмерная) | 1.54 X 10-01 | Рассчитывается | Летучий | |
| Период распада в почве (дни) | ДТ50 (типичный) | 0.2 | A5 | Неустойчивый |
| ДТ50 (лабораторный при 20oC): | 0.23 | A5 | Неустойчивый | |
| ДТ50 (полевой): | — | — | — | |
| ДТ90 (лабораторный при 20oC): | 0.69 | A2 | — | |
| ДТ90 (полевой): | — | — | — | |
| Примечание: | По данным лабораторных исследований евросоюза DT50 0.22-0.24 дней, sand, n=2; DT90 estimated between 0.66-0.72 дней | |||
| Водный фотолиз ДТ50 (дни) при pH 7 | Значение: | — | A5 | — |
| Примечание: | не соответствует | |||
| Водный гидролиз ДТ50 (дни) при 20oC и pH 7 | Значение: | Very rapid | A5 | Очень устойчивый |
| Примечание: | 1 to 1.5 дней при pH 4, 7 и 9, 20 deg C | |||
| Водное осаждение ДТ50 (дни) | — | — | — | |
| Только водная фаза ДТ50 (дни) | — | — | — | |
| Индекс потенциального вымывания GUS | — | — | — | |
| Индекс роста концентрации в грунтовых водах SCI (мкг/л) при дозе внесения 1 кг/га (л/га) | Значение: | — | — | — |
| Примечание: | — | |||
| Potential for particle bound transport index | — | Рассчитывается | Низкий | |
| Koc — коэффициент распределения органического углерода (мл/г) | — | — | — | |
| pH устойчивость: | ||||
| Примечание: | ||||
| Изотерма адсорбции Фрейндлиха | Kf: | — | — | — |
| 1/n: | — | — | ||
| Примечание: | — | |||
| Максимальное УФ-поглощение (л/(моль*см)) | — | — | — | |
| Коэффициент биоконцентрации | BCF: | — | — | — |
| CT50 (дни): | — | — | ||
| Потенциал биоаккумуляции | — | — | — | |
| Млекопитающие — Острая оральная ЛД50 (мг/кг) | — | — | — | |
| Млекопитающие — Короткопериодный пищевой NOEL | (мг/кг): | — | — | — |
| (ppm пищи): | — | — | ||
| Птицы — Острая ЛД50 (мг/кг) | — | — | — | |
| Птицы — Острая токсичность (СК50 / ЛД50) | — | — | — | |
| Рыбы — Острая 96 часовая СК50 (мг/л) | 0.007 | A3 Радужная форель, mean Значение | Высокий | |
| Рыбы — Хроническая 21 дневная NOEC (мг/л) | — | — | — | |
| Водные беспозвоночные — Острая 48 часовая ЭК50 (мг/л) | 0.2 | L3 Дафния магна (Дафния большая, Блоха водяная большая) | Умеренно | |
| Водные беспозвоночные — Хроническая 21 дневная NOEC (мг/л) | — | — | — | |
| Водные ракообразные — Острая 96 часовая СК50 (мг/л) | — | — | — | |
| Донные микроорганизмы — Острая 96 часовая СК50 (мг/л) | — | — | — | |
| Донные микроорганизмы — Хроническая 28 дневная NOEC, static, Вода (мг/л) | — | — | — | |
| Донные микроорганизмы — Хроническая 28 дневная NOEC, Осадочная порода (мг/кг) | — | — | — | |
| Водные растения — Острая 7 дневная ЭК50, биомасса (мг/л) | — | — | — | |
| Водоросли — Острая 72 часовая ЭК50, рост (мг/л) | — | — | — | |
| Водоросли — Хроническая 96 часовая NOEC, рост (мг/л) | — | — | — | |
| Пчелы — Острая 48 часовая ЛД50 (мкг/особь) | — | — | — | |
| Почвенные черви — Острая 14-дневная СК50 (мг/кг) | — | — | — | |
| Почвенные черви — Хроническая 14-дневная максимально недействующая концентрация вещества, размножение (мг/кг) | — | — | — | |
| Другие почвенные макро-организмы, например Ногохвостки | LR50 / EC50 / NOEC / Действие (%) | — | — | — |
| Другие Членистоногие (1) | LR50 (г/га): | — | — | — |
| Действие (%): | — | — | — | |
| Другие Членистоногие (2) | LR50 (г/га): | — | — | — |
| Действие (%): | — | — | — | |
| Почвенные микроорганизмы | — | — | — | |
| Имеющиеся данные по мезомиру (мезокосму) | NOEAEC мг/л: | — | — | — |
| NOEAEC мг/л: | — | — | — | |
Основные показатели:
| Млекопитающие — Острая оральная ЛД50 (мг/кг) | — | — | — | |
| Млекопитающие — Кожная ЛД50 (мг/кг массы тела) | — | — | — | |
| Млекопитающие — Ингаляционная СК50 (мг/л) | 0.015 | A5 Крыса | — | |
| ДСД — допустимая суточная доза (мг/кг массы тела в день) | 0.001 | A5 Крыса, SF=100 | — | |
| ARfD — среднесуточная норма потребления (мг/кг массы тела в день) | 0.019 | A5 Крыса, SF=100 | — | |
| AOEL — допустимый уровень системного воздействия на оператора | 0.011 | EU 2008 | — | |
| Поглощение кожей (%) | 10 | A5 | — | |
| Директива по Опасным Веществам 76/464/ЕС | — | — | — | |
| Виды ограничений | — | — | — | |
| по категории | Общие: | — | ||
| Профессиональные: | [May be fatal if inhaled, swallowed or absorbed through skin.] | |||
| Примеры Европейских МДУ (мг/кг) | Значение: | — | ||
| Примечание: | ||||
| ПДК в питьевой воде (мкг/л) | — | — | — | |
Токсиколого-гигиеническая характеристика:
V : Да, известно что вызывает
X : Нет, известно что не вызывает
? : Возможно, точно не определено
— : Нет данных
Законодательство:
| Основное | [Огнеопасен], [Вызывает коррозию], [Reacts violently with air, oxygen, halogens и other oxidants causing fire и explosion hazard] | ||||||
| Классификация рисков Европейской Комиссии | [T+ — Очень высокая токсичность: R26 ], [H — Законодательство: R12, R17, R34], [Опасность для окружающей среды: R50] | ||||||
| Классификация безопасности Европейской Комиссии | S1/2, S28, S36/37, S45, S61, S63 | ||||||
| Классификация ВОЗ | FM | — | Фумигант, not classified | ||||
| Классификация Агентства по охране окружающей среды США (US EPA) | I | — | Danger — Высокая токсичность | ||||
| UN Номер | — | ||||||
| Упаковка и утилизация | — | ||||||
| Английский | phosphine |
| Французский | — |
| Немецкий | Phosphorwasserstoff |
| Датский | — |
| Итальянский | — |
| Испанский | — |
| Греческий | — |
| Словенский | — |
| Польский | fosforowodor |
| Шведский | — |
| Венгерский | — |
| Голландский | — |
Последнее обновление сайта: Friday 18 February 2011
rupest.ru
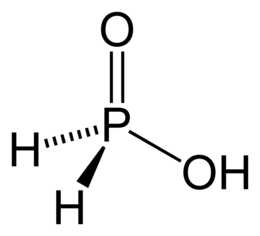
Фосфорноватистая кислота — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 6 июля 2018; проверки требует 1 правка. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 6 июля 2018; проверки требует 1 правка. Перейти к навигации Перейти к поиску| Фосфорноватистая кислота | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
фосфорноватистая кислота |
| Традиционные названия | фосфиновая кислота, гипофосфористая кислота |
ru.wikipedia.org
