KI + h3O2= ? уравнение реакции
В зависимости условий проведения реакции взаимодействия KI + h3O2 = ? возможно получение различных продуктов. Так, в комнатных условиях образуется свободный йод и гидроксид калия, а если проводить реакцию в концентрированном растворе KOH, то можно получить иодат калия и воду. Молекулярные уравнения реакций имеют вид:
Йод представляет собой летучие кристаллы фиолетово-черного цвета с металлическим блеском. Он плохо растворяется в воде, в ничтожно малой степени (по сравнению с хлором и бромом), подвергается дисмутации. Хорошо растворяется в органических растворителях (с фиолетовым или коричневым окрашиванием), в водных растворах иодидов металлов, жидком диоксиде серы. Слабый восстановитель и окислитель; реагирует с концентрированными серной и азотной кислотами, «царской водкой», металлами, неметаллами, щелочами, сероводородной водой. Образует соединения с другими галогенами.
Для получения йода можно использовать электролиз его солей, однако на практике обычно окисляют его соли, применяя в качестве окислителя хлор. Такой метод оказывается выгодным экономически, так как сравнительно дешевый реагент, а иодиды просто «черпают» из морской воды.
ru.solverbook.com
Ответы@Mail.Ru: Помогите уравнять окислительно-восстановительные реакции:
1) 2О-1 — 2е = О2о (заряд был -1. справа стал «о») Сr был +6 стал +3 Сr+6 +3е = Сr3+ окислитель пр. восстановления коэффициенты ставим к кислороду -3 к хрому -2 подставляем эти коэффициенты в уравнение 3Н2О2 + K2Cr2O7 + 8HCl = 2CrClз +2KCl + 3O2 + 7h3O коэффициент перед соляной кислотой рассчитывается по числу атомов Cl справа. после чего ставят коэф. перед водой Проверка по кислороду: Слева 6+7= справа 6+7 все «ОК» 2) 2О-1 + 2е = 2О-2 окислитель. процесс восстановления N был +3 -3е = N+6 восстановитель процесс окисления коэф. к кислороду — 3. к азоту 2 ставим эти коэф. в ур-ние 3h3O2 + 2KNO2 = 2КNOз + 3h3O
1. h302+K2Cr207+8HCl2CrCl2+2KCl+2O2+5h3O 2. Во втором всё уравненно
touch.otvet.mail.ru
Свойства перекиси водорода | Дистанционные уроки
15-Апр-2014 | Нет комментариев | Лолита Окольнова
Это вещество продается во всех аптеках, т.е. его может приобрести любой человек. Химик Л. Ж. Тенар считается первооткрывателем «окисленной воды»
Давайте подробно разберем

Строение молекулы
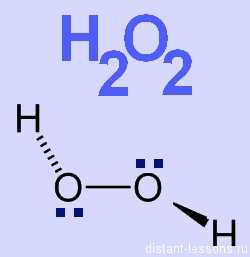
- валентность O = 2
- степень окисления O = -1
- молекула полярна
Физические свойства перекиси водорода
жидкое бесцветное вещество без запаха; с «металлическим» привкусом
очень хорошо растворимо в воде, точнее, перекись может смешиваться с h3O в любых соотношениях;
хорошо растворяется в полярных (органических) растворителях).
Химические свойства перекиси водорода
- Часто можно наблюдать, как капелька перекиси водорода «пузырит» — вещество очень легко разлагается на свету — образуется вода и выделяется кислород:
2H2O2 = 2H2
O + O2↑
Поэтому перекись нельзя держать открытой на воздухе — со временем в склянке останется только вода.
пероксид водорода проявляет свойства очень слабой кислоты (слабее угольной):
с.о. -1 делает возможным и окислительные — восстановление до O(-2), и восстановительные — окисление до O2, свойства:
|
|
|
В кислой среде H2O2 восстанавливается до H2O: H2O2 +2H(+) +2e(-) = 2H2O KNO2 + H2O2 = KNO3 + H2O В щелочной или нейтральной — до OH-:H2O2 +2e(-)= 2OH(-) 2KI + H2O2 = I2 + 2KOH Если реакция идет с сильными окислителями, то образуется кислород: H2O2-2e(-) = O2 + 2H(+) |
H2O2 + Ag2O -> 2Ag + O2 + H2O Если реакция идет с сильными окислителями, то образуется кислород: H2O2 -2e(-)-> O2 + 2H(+) H2O2 +2OH(-) -2e(-) ->O2 + 2H2O 2KMnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + 5O2 + K2SO4 + 8H2O 3H2O2 + 2KMnO4 = 2MnO2 + 2KOH + 3O2 + 2H2
|
Биологические свойства перекиси водорода
— безвредное для организма противомикробное средство, дезинфицирующее средство
Методы получения:
- лабораторный:
- промышленный:
Благодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель, в аналитической химии, в медицине — как антисептик, в производстве дезинфицирующих и отбеливающих средств.
Перекись водорода применяется также для обесцвечивания волос (пергидроль) и отбеливания зубов, однако эффект в обоих случаях основан на окислении, а следовательно, разрушении тканей, и потому такое применение (особенно в отношении зубов) не рекомендуется специалистами.
Еще на эту тему:
Обсуждение: «Свойства перекиси водорода»
(Правила комментирования)distant-lessons.ru
