Гибридизация орбиталей — Википедия
Материал из Википедии — свободной энциклопедии
Модель молекулы метана, образованной sp3-гибридными орбиталямиГибридизация орбиталей — гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам.
 Схема гибридизации атомных орбиталей атома углерода
Схема гибридизации атомных орбиталей атома углерода
Концепция гибридизации валентных атомных орбиталей была предложена американским химиком Лайнусом Полингом для ответа на вопрос, почему при наличии у центрального атома разных (s, p, d) валентных орбиталей, образованные им связи в многоатомных молекулах с одинаковыми лигандами оказываются эквивалентными по своим энергетическим и пространственным характеристикам.
Представления о гибридизации занимают центральное место в методе валентных связей. Сама гибридизация не является реальным физическим процессом, а только удобной моделью, позволяющей объяснить электронное строение молекул, в частности гипотетические видоизменения атомных орбиталей при образовании ковалентной химической связи, в частности, выравнивание длин химических связей и валентных углов в молекуле.
Концепция гибридизации с успехом была применена для качественного описания простых молекул, но позднее была расширена и для
ru.wikipedia.org
Гибридные орбитали Википедия
Модель молекулы метана, образованной sp3-гибридными орбиталямиГибридизация орбиталей — гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам.
Концепция гибридизации
 Схема гибридизации атомных орбиталей атома углерода
Схема гибридизации атомных орбиталей атома углерода
Концепция гибридизации валентных атомных орбиталей была предложена американским химиком Лайнусом Полингом для ответа на вопрос, почему при наличии у центрального атома разных (s, p, d) валентных орбиталей, образованные им связи в многоатомных молекулах с одинаковыми лигандами оказываются эквивалентными по своим энергетическим и пространственным характеристикам.
Представления о гибридизации занимают центральное место в методе валентных связей. Сама гибридизация не является реальным физическим процессом, а только удобной моделью, позволяющей объяснить электронное строение молекул, в частности гипотетические видоизменения атомных орбиталей при образовании ковалентной химической связи, в частности, выравнивание длин химических связей и валентных углов в молекуле.
Концепция гибридизации с успехом была применена для качественного описания простых молекул, но позднее была расширена и для более сложных. В отличие от теории молекулярных орбиталей не является строго количественной, например, она не в состоянии предсказать фотоэлектронные спектры даже таких простых молекул, как вода. В настоящее время используется в основном в методических целях и в синтетической органической химии.
В 1954 году Нобелевский комитет удостоил Л.Полинга премии по химии «За изучение природы химической связи и его применение к объяснению строения сложных молекул». Но сам Л.Полинг не был удовлетворён введением σ,π — описания для двойной и тройной связи и сопряжённых систем.
В 1958 году на симпозиуме, посвящённом памяти Кекуле, Л. Полинг развил теорию изогнутой химической связи, учитывающую кулоновское отталкивание электронов. По этой теории двойная связь описывалась как комбинация двух изогнутых химических связей, а тройная связь как комбинация трёх изогнутых химических связей.[1]
Этот принцип нашёл отражение в теории отталкивания электронных пар Гиллеспи — Найхолма, первое и наиболее важное правило которое формулировалось следующим образом:
- «Электронные пары принимают такое расположение на валентной оболочке атома, при котором они максимально удалены друг от друга, т.е электронные пары ведут себя так, как если бы они взаимно отталкивались»[2].
Второе правило состояло в том, что «все электронные пары, входящие в валентную электронную оболочку, считаются расположенными на одинаковом расстоянии от ядра».[2]
Виды гибридизации
sp-гибридизация
sp-гибридизацияПроисходит при смешивании одной s- и одной p-орбиталей. Образуются две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра центрального атома. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов.
sp2-гибридизация
sp2-гибридизацияПроисходит при смешивании одной s- и двух p-орбиталей. Образуются три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей
sp3-гибридизация
sp3-гибридизацияПроисходит при смешивании одной s- и трех p-орбиталей, образуя четыре равноценные по форме и энергии sp3-гибридные орбитали.
Оси sp3-гибридных орбиталей направлены к вершинам тетраэдра, тогда как ядро центрального атома расположено в центре описанной сферы этого тетраэдра. Угол между любыми двумя осями приближённо равен 109°28′[3], что соответствует наименьшей энергии отталкивания электронов. Также sp3-орбитали могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов. Такое состояние характерно для атомов углерода в насыщенных углеводородах и соответственно в алкильных радикалах и их производных.
Гибридизация и геометрия молекул
Представление о гибридизации атомных орбиталей лежит в основе теории отталкивания электронных пар Гиллеспи-Найхолма. Каждому типу гибридизации соответствует строго определённая пространственная ориентация гибридных орбиталей центрального атома, что позволяет её использовать как основу стереохимических представлений в неорганической химии.
В таблице приведены примеры соответствия наиболее распространённых типов гибридизации и геометрической структуры молекул в предположении, что все гибридные орбитали участвуют в образовании химических связей (отсутствуют неподелённые электронные пары)[4].
| Тип гибридизации | Число гибридных орбиталей |
Геометрия | Структура | Примеры |
|---|---|---|---|---|
| sp | 2 | Линейная |
BeF | |
| sp2 | 3 | Треугольная |
BF3, NO3—, CO32- | |
| sp3, d3s | 4 | Тетраэдрическая |
CH4, ClO4—, SO42-, NH4+ | |
| dsp2 | 4 | Плоскоквадратная | [Ni(CN)4,](2-) [PdCl4]2- | |
| sp3d | 5 | тригонально-бипирамидальная | PCl5, AsF5 | |
| sp3d2, d2sp3 | 6 | Октаэдрическая | SF6, Fe(CN)6 3-, CoF63- |
Примечания
- ↑ Под редакцией Р. Х. Фрейдлиной. Теоретическая органическая химия. — пер. с англ. канд. хим. наук Ю.Г.Бунделем. — М.: Издательство иностранной литературы, 1963. — Т. 1. — С. 11. — 365 с.
- ↑ 1 2 Гиллеспи Р. Геометрия молекул / Пер. с англ. Е. З. Засорина и В. С. Мастрюкова, под ред. Ю. А. Пентина. — М.: Мир, 1975. — С. 18-19. — 278 с.
- ↑ Теоретически этот угол в правильном тетраэдре равен arccos(-1/3)≈109°28′.
- ↑ Здесь A — центральный атом, X — гибридные связывающие орбитали
Литература
- Полинг Л. Природа химической связи / Пер. с англ. М. Е. Дяткиной. Под ред. проф. Я. К. Сыркина. — М.; Л.: Госхимиздат, 1947. — 440 с.
- Полинг Л. Общая химия. Пер. с англ. — М.: Мир, 1974. — 846 с.
- Минкин В. И., Симкин Б. Я., Миняев Р. М. Теория строения молекул. — Ростов-на-Дону: Феникс, 1997. — С. 397-406. — ISBN 5-222-00106-7.
- Гиллеспи Р. Геометрия молекул / Пер. с англ. Е. З. Засорина и В. С. Мастрюкова, под ред. Ю. А. Пентина. — М.: Мир, 1975. — 278 с.
Ссылки
wikiredia.ru
Гибридизация орбиталей — Википедия РУ
Модель молекулы метана, образованной sp3-гибридными орбиталямиГибридизация орбиталей — гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам.
 Схема гибридизации атомных орбиталей атома углерода
Схема гибридизации атомных орбиталей атома углерода
Концепция гибридизации валентных атомных орбиталей
была предложена американским химиком Лайнусом Полингом для ответа на вопрос, почему при наличии у центрального атома разных (s, p, d) валентных орбиталей, образованные им связи в многоатомных молекулах с одинаковыми лигандами оказываются эквивалентными по своим энергетическим и пространственным характеристикам.Представления о гибридизации занимают центральное место в методе валентных связей. Сама гибридизация не является реальным физическим процессом, а только удобной моделью, позволяющей объяснить электронное строение молекул, в частности гипотетические видоизменения атомных орбиталей при образовании ковалентной химической связи, в частности, выравнивание длин химических связей и валентных углов в молекуле.
Концепция гибридизации с успехом была применена для качественного описания простых молекул, но позднее была расширена и для более сложных. В отличие от теории молекулярных орбиталей не является строго количественной, например, она не в состоянии предсказать фотоэлектронные спектры даже таких простых молекул, как вода. В настоящее время используется в основном в методических целях и в синтетической органической химии.
В 1954 году Нобелевский комитет удостоил Л.Полинга премии по химии «За изучение природы химической связи и его применение к объяснению строения сложных молекул». Но сам Л.Полинг не был удовлетворён введением σ,π — описания для двойной и тройной связи и сопряжённых систем.
В 1958 году на симпозиуме, посвящённом памяти Кекуле, Л. Полинг развил теорию изогнутой химической связи, учитывающую кулоновское отталкивание электронов. По этой теории двойная связь описывалась как комбинация двух изогнутых химических связей, а тройная связь как комбинация трёх изогнутых химических связей.[1]
Этот принцип нашёл отражение в теории отталкивания электронных пар Гиллеспи — Найхолма, первое и наиболее важное правило которое формулировалось следующим образом:
- «Электронные пары принимают такое расположение на валентной оболочке атома, при котором они максимально удалены друг от друга, т.е электронные пары ведут себя так, как если бы они взаимно отталкивались»[2].
Второе правило состояло в том, что «все электронные пары, входящие в валентную электронную оболочку, считаются расположенными на одинаковом расстоянии от ядра».[2]
sp-гибридизация
sp-гибридизацияПроисходит при смешивании одной s- и одной p-орбиталей. Образуются две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра центрального атома. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов.
sp2-гибридизация
sp2-гибридизацияПроисходит при смешивании одной s- и двух p-орбиталей. Образуются три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей
sp3-гибридизация
sp3-гибридизацияПроисходит при смешивании одной s- и трех p-орбиталей, образуя четыре равноценные по форме и энергии sp3-гибридные орбитали.
Оси sp3-гибридных орбиталей направлены к вершинам тетраэдра, тогда как ядро центрального атома расположено в центре описанной сферы этого тетраэдра. Угол между любыми двумя осями приближённо равен 109°28′[3], что соответствует наименьшей энергии отталкивания электронов. Также sp3-орбитали могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов. Такое состояние характерно для атомов углерода в насыщенных углеводородах и соответственно в алкильных радикалах и их производных.
Представление о гибридизации атомных орбиталей лежит в основе теории отталкивания электронных пар Гиллеспи-Найхолма. Каждому типу гибридизации соответствует строго определённая пространственная ориентация гибридных орбиталей центрального атома, что позволяет её использовать как основу стереохимических представлений в неорганической химии.
В таблице приведены примеры соответствия наиболее распространённых типов гибридизации и геометрической структуры молекул в предположении, что все гибридные орбитали участвуют в образовании химических связей (отсутствуют неподелённые электронные пары)[4].
| Тип гибридизации | Число гибридных орбиталей |
Геометрия | Структура | Примеры |
|---|---|---|---|---|
| sp | 2 | Линейная |
BeF2, CO2, NO2+ | |
| sp2 | 3 | Треугольная |
BF3, NO3—, CO32- | |
| sp3, d3s | 4 | Тетраэдрическая |
CH4, ClO4—, SO42-, NH4+ | |
| dsp2 | 4 | Плоскоквадратная | [Ni(CN)4,](2-) [PdCl4]2- | |
| sp3d | 5 | тригонально-бипирамидальная | PCl5, AsF5 | |
| sp3d2, d2sp3 | 6 | Октаэдрическая | SF6, Fe(CN)63-, CoF63- |
http-wikipediya.ru
Гибридные орбитали Википедия
Модель молекулы метана, образованной sp3-гибридными орбиталямиГибридизация орбиталей — гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам.
Концепция гибридизации[ | ]
 Схема гибридизации атомных орбиталей атома углерода
Схема гибридизации атомных орбиталей атома углерода
Концепция гибридизации валентных атомных орбиталей была предложена американским химиком Лайнусом Полингом для ответа на вопрос, почему при наличии у центрального атома разных (s, p, d) валентных орбиталей, образованные им связи в многоатомных молекулах с одинаковыми лигандами оказываются эквивалентными по своим энергетическим и пространственным характеристикам.
Представления о гибридизации занимают центральное место в методе валентных связей. Сама гибридизация не является реальным физическим процессом, а только удобной моделью, позволяющей объяснить электронное строение молекул, в частности гипотетические видоизменения атомных орбиталей при образовании ковалентной химической связи, в частности, выравнивание длин химических связей и валентных углов в молекуле.
Концепция гибридизации с успехом была применена для качественного описания простых молекул, но позднее была расширена и для более сложных. В отличие от теории молекулярных орбиталей не является строго количественной, например, она не в состоянии предсказать фотоэлектронные спектры даже таких простых молекул, как вода. В настоящее время используется в основном в методических целях и в синтетической органической химии.
В 1954 году Нобелевский комитет удостоил Л.Полинга премии по химии «За изучение природы химической связи и его применение к объяснению строения сложных молекул». Но сам Л.Полинг не был удовлетворён введением σ,π — описания для двойной и тройной связи и сопряжённых систем.
В 1958 году на симпозиуме, посвящённом памяти Кекуле, Л. Полинг развил теорию изогнутой химической связи, учитывающую кулоновское отталкивание электронов. По этой теории двойная связь описывалась как комбинация двух изогнутых химических связей, а тройная связь как комбинация трёх изогнутых химических связей.[1]
Этот принцип нашёл отражение в теории отталкивания электронных пар Гиллеспи — Найхолма, первое и наиболее важное правило которое формулировалось следующим образом:
- «Электронные пары принимают такое расположение на валентной оболочке атома, при котором они максимально удалены друг от друга, т.е электронные пары ведут себя так, как если бы они взаимно отталкивались»[2].
Второе правило состояло в том, что «все электронные пары, входящие в валентную электронную оболочку, считаются расположенными на одинаковом расстоянии от ядра».[2]
Виды гибридизации[
ru-wiki.ru
Гибридизация орбиталей — WiKi
Модель молекулы метана, образованной sp3-гибридными орбиталямиГибридизация орбиталей — гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам.
 Схема гибридизации атомных орбиталей атома углерода
Схема гибридизации атомных орбиталей атома углерода
Концепция гибридизации валентных атомных орбиталей была предложена американским химиком Лайнусом Полингом для ответа на вопрос, почему при наличии у центрального атома разных (s, p, d) валентных орбиталей, образованные им связи в многоатомных молекулах с одинаковыми лигандами оказываются эквивалентными по своим энергетическим и пространственным характеристикам.
Представления о гибридизации занимают центральное место в методе валентных связей. Сама гибридизация не является реальным физическим процессом, а только удобной моделью, позволяющей объяснить электронное строение молекул, в частности гипотетические видоизменения атомных орбиталей при образовании ковалентной химической связи, в частности, выравнивание длин химических связей и валентных углов в молекуле.
Концепция гибридизации с успехом была применена для качественного описания простых молекул, но позднее была расширена и для более сложных. В отличие от теории молекулярных орбиталей не является строго количественной, например, она не в состоянии предсказать фотоэлектронные спектры даже таких простых молекул, как вода. В настоящее время используется в основном в методических целях и в синтетической органической химии.
В 1954 году Нобелевский комитет удостоил Л.Полинга премии по химии «За изучение природы химической связи и его применение к объяснению строения сложных молекул». Но сам Л.Полинг не был удовлетворён введением σ,π — описания для двойной и тройной связи и сопряжённых систем.
В 1958 году на симпозиуме, посвящённом памяти Кекуле, Л. Полинг развил теорию изогнутой химической связи, учитывающую кулоновское отталкивание электронов. По этой теории двойная связь описывалась как комбинация двух изогнутых химических связей, а тройная связь как комбинация трёх изогнутых химических связей.[1]
Этот принцип нашёл отражение в теории отталкивания электронных пар Гиллеспи — Найхолма, первое и наиболее важное правило которое формулировалось следующим образом:
- «Электронные пары принимают такое расположение на валентной оболочке атома, при котором они максимально удалены друг от друга, т.е электронные пары ведут себя так, как если бы они взаимно отталкивались»[2].
Второе правило состояло в том, что «все электронные пары, входящие в валентную электронную оболочку, считаются расположенными на одинаковом расстоянии от ядра».[2]
sp-гибридизация
sp-гибридизацияПроисходит при смешивании одной s- и одной p-орбиталей. Образуются две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра центрального атома. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов.
sp2-гибридизация
sp2-гибридизацияПроисходит при смешивании одной s- и двух p-орбиталей. Образуются три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей
sp3-гибридизация
sp3-гибридизацияПроисходит при смешивании одной s- и трех p-орбиталей, образуя четыре равноценные по форме и энергии sp3-гибридные орбитали.
Оси sp3-гибридных орбиталей направлены к вершинам тетраэдра, тогда как ядро центрального атома расположено в центре описанной сферы этого тетраэдра. Угол между любыми двумя осями приближённо равен 109°28′[3], что соответствует наименьшей энергии отталкивания электронов. Также sp3-орбитали могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов. Такое состояние характерно для атомов углерода в насыщенных углеводородах и соответственно в алкильных радикалах и их производных.
Представление о гибридизации атомных орбиталей лежит в основе теории отталкивания электронных пар Гиллеспи-Найхолма. Каждому типу гибридизации соответствует строго определённая пространственная ориентация гибридных орбиталей центрального атома, что позволяет её использовать как основу стереохимических представлений в неорганической химии.
В таблице приведены примеры соответствия наиболее распространённых типов гибридизации и геометрической структуры молекул в предположении, что все гибридные орбитали участвуют в образовании химических связей (отсутствуют неподелённые электронные пары)[4].
| Тип гибридизации | Число гибридных орбиталей |
Геометрия | Структура | Примеры |
|---|---|---|---|---|
| sp | 2 | Линейная |
BeF2, CO2, NO2+ | |
| sp2 | 3 | Треугольная |
BF3, NO3—, CO32- | |
| sp3, d3s | 4 | Тетраэдрическая |
CH4, ClO4—, SO42-, NH4+ | |
| dsp2 | 4 | Плоскоквадратная | [Ni(CN)4,](2-) [PdCl4]2- | |
| sp3d | 5 | тригонально-бипирамидальная | PCl5, AsF5 | |
| sp3d2, d2sp3 | 6 | Октаэдрическая | SF6, Fe(CN)63-, CoF63- |
ru-wiki.org
Гибридизация атомных орбиталей: понятие и основные виды
Одна из задач химии – это изучение строения вещества, в том числе выяснение механизма образования различных соединений из простых веществ, образуемых атомами одного химического элемента. Особенности взаимодействия атомов, точнее, их разноименно заряженных компонентов – электронных оболочек и ядер, – описываются как различные типы химической связи. Так, вещества, имеющие молекулярное строение, образуются посредством ковалентной связи, для описания которой в 1931 году американским химиком Л. Полингом была предложена модель гибридизации атомных орбиталей.
Понятие о ковалентной связи
В тех случаях, когда в процессе взаимодействия происходит образование общей для двух атомов пары валентных электронных облаков, говорят о ковалентной связи. В результате ее возникновения формируется мельчайшая частица простого или сложного вещества – молекула.

Одной из особенностей ковалентной связи является ее направленность – следствие сложной формы электронных орбиталей p, d и f, которые, не обладая сферической симметрией, имеют определенную пространственную ориентацию. Еще одна важная особенность данного типа химической связи – насыщаемость, обусловленная ограниченным количеством внешних – валентных – облаков в атоме. Именно поэтому существование молекулы, например, H2O, возможно, а H5O – нет.
Типы ковалентной связи
Образование общих электронных пар может происходить различными способами. В механизме образования ковалентной связи важную роль играет характер перекрытия облаков и пространственная симметрия результирующего облака. По данному критерию Л. Полинг предложил различать следующие типы:
- Сигма-связь (σ) отличается наибольшей степенью перекрытия по оси, проходящей через атомные ядра. Здесь плотность облака будет максимальной.
- Пи-связь (π) образуется при боковом перекрывании, и электронное облако, соответственно, имеет наибольшую плотность вне соединяющей ядра оси.
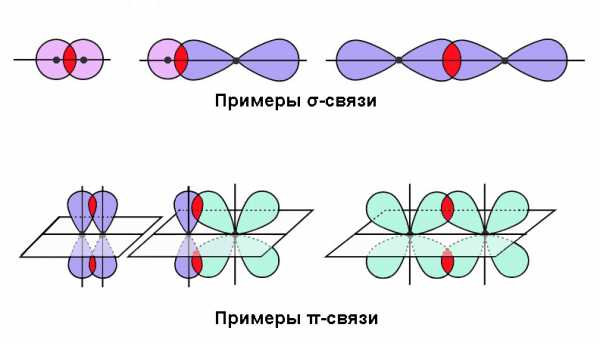
Эти пространственные характеристики имеют большое значение постольку, поскольку они коррелируют с энергетическими параметрами ковалентной связи.
Особенности многоатомных молекул
Концепция гибридизации атомных орбиталей была введена Полингом для объяснения одной из особенностей ковалентных связей в многоатомных молекулах. Известно, что связи, образуемые центральным атомом в таких молекулах, оказываются одинаковыми по пространственным и энергетическим характеристикам. Это происходит вне зависимости от того, какие орбитали (s, p или d) участвуют в формировании общей электронной пары.
Очень удобным и наглядным примером для иллюстрации этого явления служит атом углерода. При вступлении в химическую связь атом в возбужденном состоянии имеет 4 валентных орбитали: 2s, 2px, 2py и 2pz. Три последних отличаются от орбитали 2s по энергии и форме. Тем не менее в молекуле, например, метана CH4 все четыре связи совершенно равноценны и имеют валентные углы 109,5° (в то время как p-орбитали расположены под углами 90°). В других соединениях углерода встречаются валентные углы 120° и 180°; в молекулах, содержащих азот (аммиак NH3) и кислород (вода H2O) эти углы составляют 107,5° и 104,5°. Возникновение подобных валентных углов также потребовало объяснения.
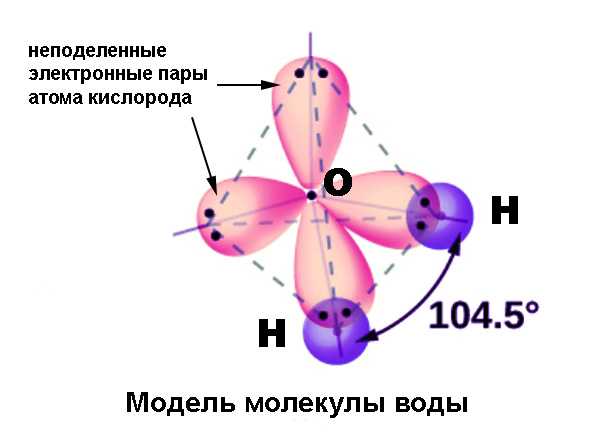
Суть явления
Идея гибридизации состоит в образовании усредненных орбиталей путем перекрывания электронных облаков разного типа с близкими значениями энергии – s, p, иногда d. Количество результирующих – гибридных – орбиталей соответствует числу перекрывающихся облаков. Поскольку орбиталь – это волновая функция, определяющая вероятность нахождения электрона в той или иной точке атома, гибридная орбиталь представляет собой наложение волновых функций, происходящее в результате электронных переходов при возбуждении атома. Оно приводит к возникновению равнозначных волновых функций, различающихся только направленностью.
Гибридные орбитали эквивалентны по энергии и имеют одинаковую форму в виде объемной восьмерки, имеющей сильную асимметрию относительно ядра. На гибридизацию затрачивается меньше энергии, чем выделяется при образовании прочной ковалентной связи с гибридными орбиталями, поэтому такой процесс энергетически выгоден, то есть наиболее вероятен.
Основные виды гибридизации орбиталей и геометрия молекул
Возможны различные варианты перекрывания (смешения) внешних электронных облаков в атоме. Самыми распространенными являются следующие виды наложения орбиталей:
- Sp3-гибридизация. Данный вариант реализуется при наложении одной s- и трех p-орбиталей. Результатом его становятся четыре гибридные орбитали, оси которых направлены для любой пары под углами 109,5°, соответствующим минимальному взаимному отталкиванию электронов. При вступлении этих орбиталей в σ-связи с другими атомами, формируется молекула тетраэдрической конфигурации, например, метан, этан C2H6 (комбинация двух тетраэдров), аммиак, вода. В молекуле аммиака одна, а в молекуле воды – две из вершин тетраэдра заняты неподеленными электронными парами, что приводит к уменьшению валентного угла.
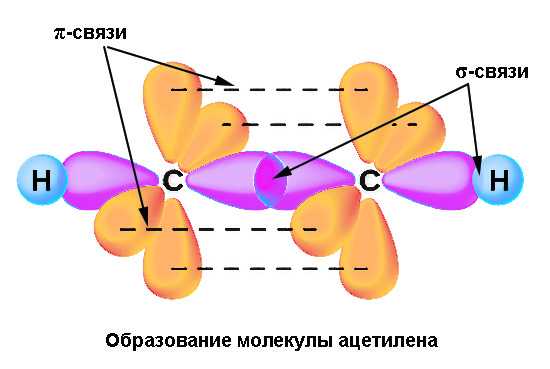
- Sp2-гибридизация возникает при комбинации одной s- и двух p-орбиталей. В этом случае тройка гибридных орбиталей располагается под углами 120° в одной плоскости. Подобную треугольную форму имеют, например, молекулы трихлорида бора BCl3, находящего применение в различных технологиях. Другой пример – молекула этилена – формируется за счет дополнительной π-связи между атомами углерода, в которых по одной p-орбитали негибридные и ориентированы перпендикулярно плоскости, образуемой двумя треугольниками.
- Sp-гибридизация происходит, когда смешиваются одна s- и одна p-орбиталь. Два гибридных облака располагаются под углом 180°, а молекула имеет линейную конфигурацию. Примерами могут служить молекулы хлорида бериллия BeCl2 или ацетилена C2H2 (в последней две негибридные p-орбитали углерода образуют дополнительные π-связи).
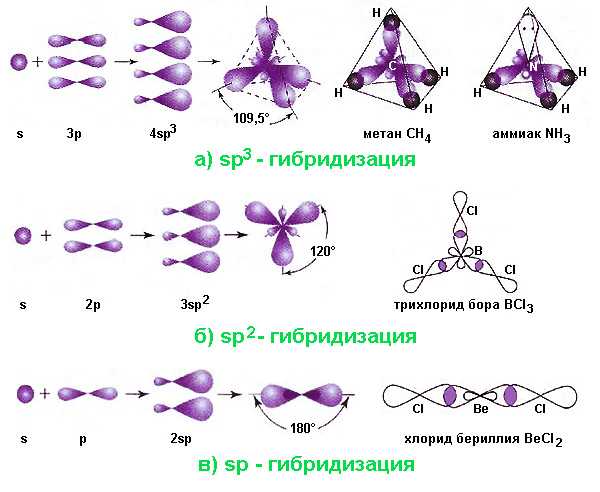
Существуют и более сложные варианты гибридизации атомных орбиталей: sp3d, sp3d2 и другие.
Роль модели гибридизации
Концепция Полинга дает хорошее качественное описание строения молекул. Она удобна и наглядна, успешно объясняет некоторые особенности ковалентных соединений, такие как величина валентных углов или выравнивание длины химической связи. Однако количественная сторона модели не может считаться удовлетворительной, поскольку не позволяет делать многие важные предсказания, касающиеся физических эффектов, связанных с особенностями строения молекул, – например, молекулярных фотоэлектронных спектров. Сам автор концепции гибридизации уже в начале 1950-х годов отмечал ее недостатки.
Тем не менее в становлении современных представлений о строении вещества модель гибридизации атомных орбиталей сыграла большую роль. На основе ее были разработаны более адекватные концепции, например, теория отталкивания электронных пар. Поэтому, безусловно, модель гибридизации явилась важным этапом в развитии теоретической химии, а при описании некоторых аспектов электронной структуры молекул она вполне применима и в настоящее время.
fb.ru
Гибридизация орбиталей Википедия
Модель молекулы метана, образованной sp3-гибридными орбиталямиГибридизация орбиталей — гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам.
Концепция гибридизации[ | ]
 Схема гибридизации атомных орбиталей атома углерода
Схема гибридизации атомных орбиталей атома углерода
Концепция гибридизации валентных атомных орбиталей была предложена американским химиком Лайнусом Полингом для ответа на вопрос, почему при наличии у центрального атома разных (s, p, d) валентных орбиталей, образованные им связи в многоатомных молекулах с одинаковыми лигандами оказываются эквивалентными по своим энергетическим и пространственным характеристикам.
Представления о гибридизации занимают центральное место в методе валентных связей. Сама гибридизация не является реальным физическим процессом, а только удобной моделью, позволяющей объяснить электронное строение молекул, в частности гипотетические видоизменения атомных орбиталей при образовании ковалентной химической связи, в частности, выравнивание длин химических связей и валентных углов в молекуле.
Концепция гибридизации с успехом была применена для качественного описания простых молекул, но позднее была расширена и для более сложных. В отличие от теории молекулярных орбиталей не является строго количественной, например, она не в состоянии предсказать фотоэлектронные спектры даже таких простых молекул, как вода. В настоящее время используется в основном в методических целях и в синтетической органической химии.
В 1954 году Нобелевский комитет удостоил Л.Полинга премии по химии «За изучение природы химической связи и его применение к объяснению строения сложных молекул». Но сам Л.Полинг не был удовлетворён введением σ,π — описания для двойной и тройной связи и сопряжённых систем.
В 1958 году на симпозиуме, посвящённом памяти Кекуле, Л. Полинг развил теорию изогнутой химической связи, учитывающую кулоновское отталкивание электронов. По этой теории двойная связь описывалась как комбинация двух изогнутых химических связей, а тройная связь как комбинация трёх изогнутых химических связей.[1]
Этот принцип нашёл отражение в теории отталкивания электронных пар Гиллеспи — Найхолма, первое и наиболее важное правило которое формулировалось следующим образом:
- «Электронные пары принимают такое расположение на валентной оболочке атома, при котором они максимально удалены друг от друга, т.е электронные пары ведут себя так, как если бы они взаимно отталкивались»[2].
Второе правило состояло в том, что «все электронные пары, входящие в валентную электронную оболочку, считаются расположенными на одинаковом расстоянии от ядра».[2]
Виды гибридизации[
ru-wiki.ru
