2.2. Гибридизация атомных орбиталей
Изучение
таких молекул, как
ВеСI2,
BCI3
,
СН4
,
показало,
что все связи в них равноценны, несмотря
на то, что
в
образовании их участвуют различные
орбитали
центрального атома.
Слейтер и Полинг объяснили
это явление тем, что орбитали различной
симметрии, не сильно отличающиеся по
энергиям, образуют гибридные орбитали.

Гибридизация — это процесс перераспределения электронных плотностей близких по энергии орбиталей, который приводит к их полной равноценности.
Число гибридных орбиталей равно числу орбиталей, участвующих в гибридизации. Гибридные орбитали более вытянуты в направлении образования химических связей и поэтому обусловливают лучшее перекрывание электронных облаков. По числу участвующих в гибридизации атомных орбиталей различают следующие, наиболее распространенные типы гибридизации:
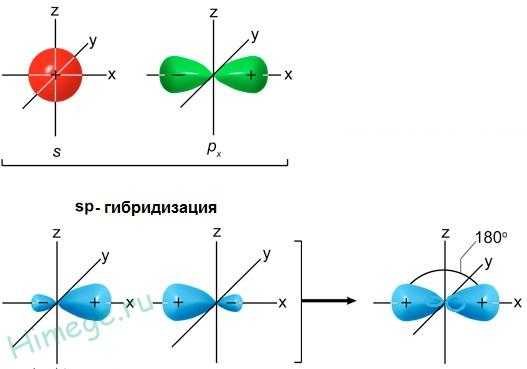
Гибридизация одной s — и одной р -электронных орбиталей приводит к образованию двух гибридных sp — орбиталей (рис. 9).
s – орбиталь и p — орбиталь → 2 гибридные sp -орбитали
Рис. 9. Образование sp — гибридных орбиталей
Относительно друг друга две гибридные sp — орбитали расположены под углом 180°, поэтому молекулы с таким видом гибридизации линейны, две связи в них расположены по прямой и противоположно направлены от ядра (рис. 10).
Рис. 10. sp – гибридизация
Гибридизация одной s — и двух р — электронных орбиталей приводит к образованию трех гибридных sр2 — орбиталей. Эти три гибридные орбитали расположены в одной плоскости и направлены в вершины равностороннего треугольника; углы между осями sр2 – гибридных орбиталей составляют 120° (рис. 11).
Рис. 11. sp2 — гибридизация
Рис. 12. sp3 — гибридизация
Гибридизация одной s — и трех р — электронных орбиталей приводит к образованию четырех гибридных sр3 — орбиталей. В этом случае четыре гибридные орбитали имеют оси, лежащие в пространстве под углами 109,5о; они направлены к вершинам правильного тетраэдра (рис. 12).
Таким образом, тип гибридизации определяется видом и количеством участвующих в гибридизации электронных орбителей (см. табл.6).
Таблица 6
Типы гибридизации и геометрия молекул
|
Тип моле-кулы |
Тип гибри-дизации |
Число гибридных орбиталей атома А |
Геометрия молекул |
Валент-ные углы |
Примеры |
|
АВ2 |
sp (s+p) |
2 |
линейная | 180о |
BeF2, CO2, C2H2 |
|
АВ3 |
sp2 (s+2p) |
3 |
плоская |
120о |
BCl3, AlF3, C2H4 |
|
АВ4 |
sp3 (s+3p) |
4 |
тетраэдри-ческая |
109,5о |
H2O, NH3, SiH4, CCl4, CH4, |
Пример 1. Перекрывание sp – гибридных орбиталей атома бериллия с 1s – АО двух атомов водорода приводит к образованию
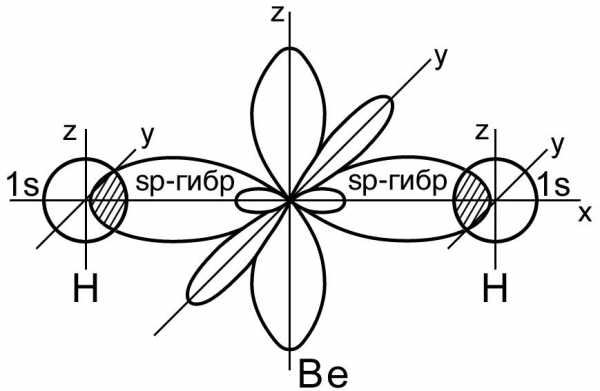
Рис. 13. Пространственная конфигурация молекулы BeH2
Пример 2. Перекрывание sp2– гибридных орбиталей атома бора с 1s – АО трех атомов водорода приводит к образованию треугольной (тригональной) молекулы гидрида бора BH3; валентный уголH – B – H в молекуле BH3 равен 120о (рис. 14).
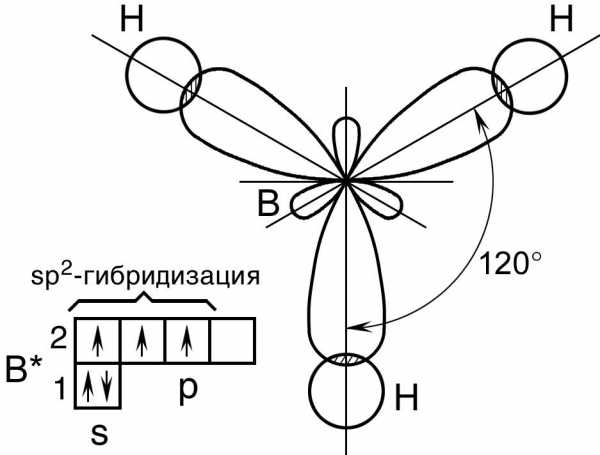
Рис. 14. Пространственная конфигурация молекулы BH3
Пример 3. Перекрывание sp3 – гибридных орбиталей атома кремния с 1s – АО четырех атомов водорода приводит к образованию тетраэдрической молекулы силана SiH4; валентный уголH-Si-H равен 109,5о (рис. 15).
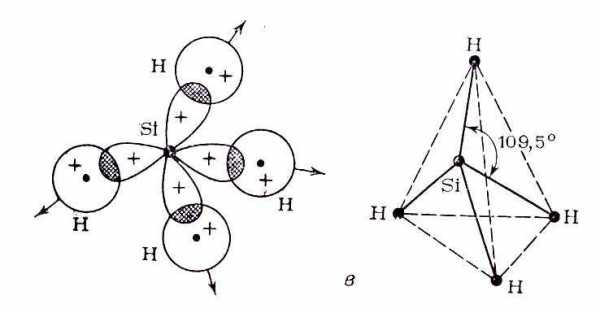
Рис. 15. Пространственная конфигурация молекулы SiH4
Разные по составу молекулы СН4, NH3 и H2O имеют одинаковое пространственное расположение связей. Этот факт подтверждает гибридизацию орбиталей. Атомы углерода, азота и кислорода в указанных молекулах находятся в состоянии sp3 — гибридизации.
Молекула аммиака. В невозбужденном состоянии центральный атом азота в молекуле аммиака NH3 имеет 1s2 2s2 2p3 — электронную конфигурацию.
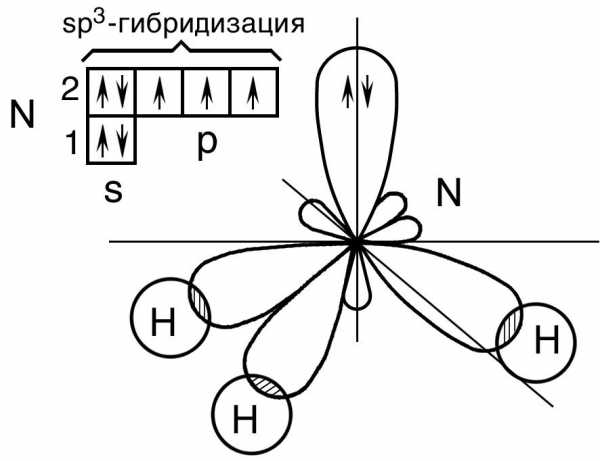
Рис. 16. Пространственная конфигурация молекулы NH3
Молекула воды. В молекуле воды H2O центральным атомом является атом кислорода, который в невозбужденном состоянии имеет следующую электронную конфигурацию: 1s22s22p2.
Кислород в молекуле воды также находится в состоянии sp3 – гибридизации (рис. 17).
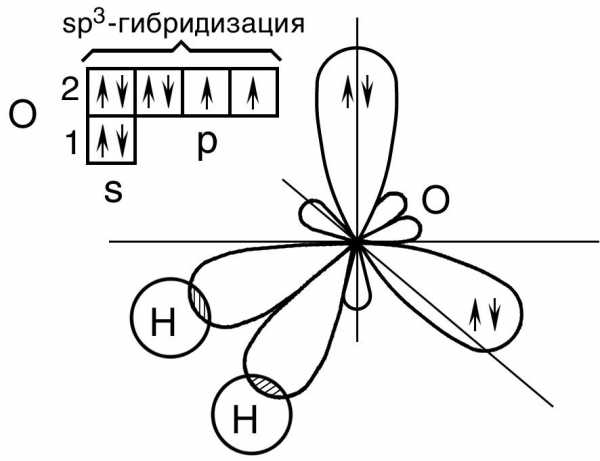
Рис. 17. Пространственная конфигурация молекулы Н2О
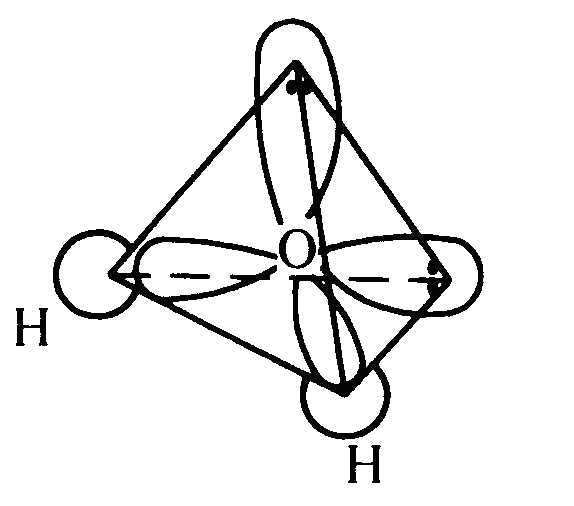
Рис. 18. Тетраэдрическое расположение связей в молекуле воды
В
отличие от молекулы аммиака, в молекуле
воды имеются две гибридные орбитали с
неподеленными парами электронов и две
гибридные орбитали, имеющие по одному
электрону. Валентный угол между связями
равен 104,5
У рассмотренных молекул аммиака и воды углы между связями отклоняются от тетраэдрического 109о29′ и прямого 90о. Это обусловлено различием сил взаимного отталкивания орбиталей, заполненных только парой электронов, и орбиталей, перекрывающихся с атомами водорода. Орбитали с парой электронов, т.е. не имеющие области перекрывания, обладают бόльшим отталкивающим эффектов по сравнению с орбиталями, образующими связь.
В молекуле NH3 имеется одна sp3 – гибридная орбиталь, заполненная парой электронов, и она отталкивает в направлении от себя три остальные орбитали связи N — H, уменьшая угол до 107о. В молекуле H2O — две орбитали с парами электронов. Их влияние на орбитали связи еще сильнее, и угол H-O-H уменьшается до 104,5 о.
studfiles.net
гибридизация форма электронных облаков — Справочник химика 21
Какой тип гибридизации атомных орбиталей азота имеет место при образовании молекулы аммиака. Какую геометрическую форму в связи с этим имеет эта молекула Дать схему перекрывания электронных облаков. [c.146]
Полученные таким путем гибридные орбитали лучше передают состояние электрона в молекуле. Например, гибридные орбитали зр, зр и зр имеют вид, представленный на рис. 20. Из рисунка следует, что гибридизация сопровождается изменением формы электронного облака. Оно является асимметричным и имеет по одну сторону ядра большую вытянутость, чем по другую. Химические связи с участием гибридных орбиталей более прочные. [c.86]
Форма электронных облаков или ориентация облаков электронных пар молекулы определяется не только типом гибридизации, но и взаимным отталкиванием электронных пар это отталкивание вызвано как чисто электростатическими силами, так и эффектом действия принципа Паули. Общее выражение для силы отталкивания содержит расстояние между центрами облаков в степени —п, где п может быть очень велико. Поэтому конфигурация электронной системы молекулы жестко определяется числом электронных пар.
Как известно, 5-электронное облако имеет шаровую форму, а /9-электронное —гантелеобразную. Гибридизация этих электронных облаков показана на рисунке 13. [c.77]
Атом лития на 25-подуровне имеет один неспаренный электрон и, следовательно, соединение должно иметь состав LiH. У атома бериллия этот подуровень заполнен и нет ни одного неспаренного электрона, следовательно, бериллий не должен образовывать ни одной химической связи. У бора и следующих за ним элементов (С, N, О, F) происходит последовательное заполнение 2р-подуровня, и атомы этих элементов будут иметь определенное число неспаренных электронов. Если при образовании связей учитывать только наличие неспаренных электронов, то для этих элементов должны образоваться следующие водородные соединения ВН, СН , Nh4, Н7О, HF. Отсюда видно, что, применяя только обменный механизм образования химической связи, можно вступить в противоречие с экспериментальными данными бериллий образует соединение с водородом состава ВеНг, водородные соединения бора также имеют другой состав, а простейшее соединение углерода с водородом имеет состав СН4.Устранить это противоречие можно, предположив, что атомы элементов второго периода в образовании молекул участвуют в возбужденном состоянии, т.е. происходит распаривание 5-электронов и переход их на р-подуровень. Но тут возникает другое несоответствие с опытными данными. Поскольку энергии 5- и р-электронов различны, то и энергии образуемых ими химических связей должны отличаться, а, следовательно, подобные связи Э-Н должны иметь разную длину (в зависимости от того, орбитали какого типа принимают участие в их образовании). Согласовать теорию и эксперимент можно, введя предположение об усреднении энергий 5- и р-подуровней и образовании новых уровней, на которых энергии электронов, находящихся уже на орбиталях другого типа, одинаковы. А раз это так, то по правилу Хунда, в атоме появляется максимальное число неспаренных электронов. Эта гипотеза получила название явления гибридизации, а орбитали, образующиеся в результате усреднения энергий подуровней, называются гибридными. Естественно, что при этом меняются и форма электронных облаков, и их расположение в пространстве. В зависимости от того, какие орбитали участвуют в образовании гибридных орбиталей, рассматривают различные типы гибридизации и пространственные конфигурации образовавшихся гибридных орбиталей (см. рис. 14.). Число получившихся гибридных орбиталей должно быть равно общему числу орбиталей, вступивших в гибридизацию. В зависимости от того, какие орбитали взаимодействуют между собой, рассматривают несколько типов гибридизации [c.48]
Квантовый расчет, показывающий, что орбитали с различной симметрией в свободном атоме при образовании химической связи принимают одинаковую форму, называется гибридизацией атомных орбиталей. Часто термином гибридизация обозначают расположение электронных облаков в молекуле, соответствующее данному приближенному расчету. Волновая функция гибридной орбитали составляется из волновых функций валентных электронов, умноженных на некоторые коэ( ициенты. Так, волновые [c.91]
Согласно этому представлению химические связи формируются электронами не чистых , а смешанных , так называемых гибридных орбиталей. Последние являются результатом смешения атомных орбиталей. Иначе говоря, при гибридизации первоначальная форма и энергия орбиталей (электронных облаков) взаимно изменяются и образуются орбитали (облака) новой, но уже одинаковой формы и одинаковой энергии. [c.73]
На рис. 68,а изображена форма электронного облака, возникающая в результате / -гибридизации. Все 4 связи между атомом С и четырьмя одинаковыми одновалентными атомами, например атомами С1 или Н, располагаются под равными углами, каждый из которых равен 109°28. [c.280]
Чаще атом образует связи за счет электронов разных энергетических состояний. Например, у возбужденного атома бериллия (валентная конфигурация 2s 2p ) в образовании связи участвуют один s- и один р-электроны, у возбужденного атома бора 2s 2p )— один s- и два р-электрона, у возбужденного атома углерода (2s 2p ) — один s- и три р-электрона и т. д. В этом случае происходит так называемая гибридизация первоначальная форма электронных облаков (орбиталей) взаимно изменяется, и образуются облака (орбитали) новой, но уже одинаковой формы. На рисунке 72 схематически показан вид гибридного облака, возникающего при комбинации облаков s- и р-электронов. Гибридное sp-об-лако имеет большую вытянутость по одну сторону от ядра, чем по другую. Вследствие этого перекрывание облаков будет более полным, и связи, образованные за счет участия гибридных облаков, более прочны, чем связи, образованные отдельными s- и р-облаками. Гибридизация связана с энергетическим выигрышем за счет образования более прочных связей и более симметричного распределения электронной плотности в молекуле. Чтобы гибридное состояние было устойчивым, необходимы энергетическая близость и доста- [c.85]
Облака так называемых — и / -электронов (т. е. электронов с орбитальными квантовыми числами, соответственно равными О и 1) имеют различную форму облако 5-электрона имеет форму шара, а облако / -электро-на — форму объемной восьмерки (рис. 32, А и В). Считают, что четырех-валентный атом углерода, связанный с четырьмя другими атомами, имеет в наружном электронном слое четыре одинаковых по форме электронных облака, представляющих гибриды одного -электрона и трех / -электро-нов (5/) -гибридизация). Форма такого гибридизированного электронного облака представлена на рис. 32, В. Четыре таких гибридизированных электронных облака направлены в пространстве под углами 109°28. [c.61]
Теория гибридизации. Обычрю атомы формируют связи за счет электронов разных энергетических состояний. Так, у атомов бериллия (2s 2p ), бора (2s 2p ) и углерода (2з 2р ) в образовании связей одновременно принимают участие как 5-, так и р-электроны. Несмотря на различие форм исходных электронных облаков, связи, образованные с их участием, оказываются равноценными и расположенными симметрично. В молекулах ВеС12, ВС1 з и СС14, например, валентный угол С1ЭС1 равен 180°, 120° и 109°28 соответственно. [c.70]
У Опытным путем доказано, что у метана тетраэдрическая форма строения молекул. Как этот экспериментальный факт объясняет учение о формах электронных облаков и их гибридизации [c.8]
Облако четвертого валентного электрона каждого из атомов углерода (т. е. облако р-электрона, не участвующего в гибридизации) имеет форму объемной восьмерки ( гантели ) и ориентировано перпендикулярно плоскости бензольного кольца. Каждое из таких р-электронных облаков перекрывается над и под плоскостью кольца с р-электронными облаками двух соседних атомов углерода. Это Рис. 29.12. Схема образования показано на рис. 29.13, а и, в проекции, ст-связей в молекуле бензола. на рис. 29.13, б. [c.568]
Изучение свойств ароматических молекул позволяет сделать вывод о том, что этот класс охватывает соединения, характеризующиеся цикличностью, планарностью и зр -гибридизацией атомов углерода (или аналогичным состоянием гетероатомов) и наличием значительной энергии делокализации. Строение ароматических молекул еще раз подтверждает мысль, что представления о строгой локализации электронов в связях, о дублете электронов как единственной форме связи, совершенно недостаточны и нуждаются в более широком рассмотрении, которое учитывало бы динамическую природу химического взаимодействия атомов, подвижность и квантовые характеристики электронного облака. [c.88]
Иногда взаимное перекрывание электронных облаков приводит к резкому изменению самой их формы. Меняется и направленность валентной связи. Это явление называют гибридизацией (сочетание, смешение ). Тогда отвечающие им химические связи называют гибридными. На рисунке 1У-5 в качестве примера приведена гибридизация 3- и р-облаков при их взаимном наложении. [c.65]
Одинаковую прочность связей объясняют гибридизацией орбита-лей, т. е. смешиванием их и выравниванием по форме и энергии. При этом первоначальная форма электронных облаков (орбиталей) взаимоизменяется и образуются облака (орбитали) одинаковой формы (рис. 16). Гибридная орбиталь имеет грушевидную форму и сильно вытянута по одну сторону от ядра. Химическая связь гибридной орбитали более прочная, чем негибридной (чистой), так как происходит большее перекрывание. Сама же гибридизация возникает всегда, когда в образовании связи участвуют электроны разного типа. [c.87]
Мы уже знаем, что для органических соединений наиболее характерна ковалентная малополярная связь, которая образуется перекрыванием электронных облаков. Нам также известно, что электронные облака имеют различную форму, которая может изменяться в результате гибридизации. Причем и р-облака, и гибридные электронные облака могут по-разному располагаться в пространстве. Так, например, в молекуле метана гибридные электронные облака атома углерода располагаются в пространстве так, что их вытянутые концы направлены к вершинам тетраэдра (III, с. 13). [c.51]
Вам уже известно также, что электронные облака могут изменить свою форму в результате гибридизации (II, 80). Гибридные электронные облака тоже могут по-разному располагаться в пространстве. [c.77]
Гибридизация электронных облаков — это распростра-неииое явление, когда в процессе образования связей в мо лекулах происходит перестройка электронных облаков атома так, что все образуемые им химические связи становятся одинаковыми, ти связи ие являются Ь — Р, 8 — 5 или другими. связями, а представляют собой своеобразный гибрид тех и других. Например, у возбужденного атома бериллия электронная конфигурация 152, 25 , 2Р и в образовании связи участвуют один 5 — и один Р — электрон. В ходе образования новой молекулы с участием атома бериллия происходит гибридизация электронов первоначальная форма электронных облаков (орбиталей) взаимно изменяется и образуется облако (орбиталь) новой, но уже одинаковой формы. [c.30]
Электронные облака, соответствуюш,ие функциям ф , расположены в одной плоскости под углом 120° одно относительно другого (рис. 5.8). Четвертый электрон атома углерода в гибридизации не участвует. Облако этого электрона имеет форму симметричной гантели. Его ось перпендикулярна плоскости чертежа. В молекуле СаН эти электроны образуют одну л-связь. [c.130]
Электронное строение бензола. Каждый атом углерода в молекуле бензола находится в состоянии гибридизации (см. 3.2). Он связан с двумя соседними атомами углерода и атомом водорода тремя а-связями. В результате образуется плоский шестиугольник все шесть атомов углерода и все а-связи С—С и С—Н лежат в одной плоскости (ряс. 16.1). Электронное облако четвертого электрона (р-электрона), не участвующего в гибридизации, имеет форму гантели п ориентиро- [c.297]
При обобщении знаний учащихся о структуре веществ весьма эффективно использование наложений графопособий для характеристики геометрии и пространственного строения молекул (например, молекул фтороводорода и воды, воды и аммиака, аммиака и метана). При изучении типов гибридизации электронных орбиталей метод наложения позволяет проследить последовательность изменения энергий связей, форм электронных облаков, величин валентных углов и т. д., что обеспечивает более целенаправленное понимание теоретических вопросов. Новые возможности открывают прием, обратный наложению,— снятие транспарантов, что позволяет выделить детали, укрупнить их, освободив фон от других частей изображения. Так, в обучении химии снятие дает возможность выделить формулы веществ в уравнениях реакций, тепловые эффекты реакций, показать закономерность изменения свойств, физических констант и т. д. [c.130]
При таком расспаривании, как видно из схемы, один электрон оказывается на s-, а второй на р-орбитали. У хлора валентный электрон находится на р-орбитали. Если у бериллия валентные электроны будут различными, то в молекуле ВеСЬ одна связь ВеС1 будет (р — р)ст-связью, а вторая (s—р) ст-связью. Очевидно, что связи должны быть неравноценными. Однако опыт показывает, что обе связи ВеС1 в молекуле ВеСЬ одинаковы. Это может быть лишь в том случае, если оба валентных электрона у атома бериллия идентичны, т. е. имеют одинаковую энергию. Следовательно, в процессе расспаривания электронов энергии их выравниваются, s- и р-орбитали смешиваются — происходит так называемая гибридизация атомных орбиталей. Гибридизация, кроме выравнивания энергий электронов, всегда означает еще и изменение формы электронных облаков. В самом деле, сферическая s-орбиталь смешивается (гибридизуется) с гантелевидной р-орбиталью, вследствие чего образуются две новые гибридные орбитали с одинаковой энергией. Такие орбитали характеризуются грушевидной конфигурацией электронного облака [c.91]
Таким образом, число гибридных орбиталей всегда равно суммарному числу исходных орбиталей. Кроме того, при возникновении гибридных орбиталей необходимо соблюдение следующих условий 1) хорошее перекрывание гибридизируемых электронных облаков, достигаемое лишь при близких угловых направлениях этих облаков в местах перекрывания 2) небольшая разница в -)нергиях атомных орбиталей, участвующих в гибридизации. Например, 15-орбитали не могут гибридизироваться с 2р-орбиталями, так как у них различные значения главного квантового числа, а потому их энергии сильно различаются. Гибридизация всегда сопровождается изменением формы электронного облака. При этом гибридное электронное облако асимметрично имеет большую вы-тянутость по одну сторону от ядра, чем по другую. Поэтому хими- [c.105]
Таким образом, число гибридных орбиталей всегда равно суммарному числу исходных орбиталей. Кроме того, при возникновении гибридных орбиталей необходимо соблюдение следующих условий Г) хорошее перекрывание гибридизу-емых электронных орбиталей 2) небольшая разница в энергиях атомных орбита-лей, участвующих в гибридизации. Например, Х -орбитали не могут гибридизо-ваться с 2 норбиталями, так как у них различные значения главного квантового числа, а потому их энергии сильно различаются. Гибридизация всегда сопровождается изменением формы электронного облака. При этом гибридное электронное облако асимметрично имеет большую вытянутость по одну сторону от ядра, чем по другую. Поэтому химические связи, образованные с участием гибридных орбиталей, обладают большей прочностью, чем связи за счет чистых негибридных электронных облаков. Гибридизация одной 5-орбита,ди и одной р-орбитали приводит к возникновению двух гибридных облаков, расположенных под углом 180° (рис. 36). Это так называемая р-гибридизация, в результате которой гибридные облака располагаются по прямой. Отсюда легко объяснить прямолинейность молекулы ВеС12 в- и р-орбитали атома бериллия подвергаются в -гибриди-зации и образуют две гибридные связи с двумя атомами хлора (рис. 37). У каждого атома хлора имеется по одному неспаренному р-электрону, которые и являются валентными. [c.80]
Одинаковую прочность связей объясняют гибридизацией орбиталей, т. е. смешиванием их и выравниванием по форме и энергии, В этом случае первоначальная форма электронных облаков (орбиталей) взаимоизменяется и образуются облака (орбитали) одинаковой формы (рис. 14). [c.69]
Гибридизация сопряжена с изменением формы электронного облака и, следовательно, с изменением т1анравленности В. Комбинация двух электронов в 4- и /(-состояниях всегда приводит к образованию двух гибридных связей под углом 180° [c.258]
Каждый ИЗ атомов углерода в кольце бензола находится в состоянии / -гибридизации и затрачивает по три валентных электрона на образование ст-связей с двумя соседними атомами углерода и с одним атомом водорода. При этом все шесть атомон углерода и все о-связи С—С и С—Н лежат н одной плоскости (рис. 131). Облако четвертого валентного электрона каждого из атомов углерода (т. е, облако / -электрона, не участвующего Б гибридизации) имеет форму объемной восьмерки ( гантели ) и ориентировано перпендикулярно плоскости бензольного кольца. Каждое из таких р-электронных облаков перекрывается над и под плоскостью кольца с р-электронными облаками двух соседних атомов углерода. Зто показано на рис. 132, а и, в проекции, на [c.477]
Как видно из рис. 10.11, гибридная АО отличается от водородо-подобыых АО значительным концентрированием электронной плотносги в определенном направлении пространства. Естественно полагать, что именно в этих направлениях будут возникать химические связи при перекрывании электронных облаков орбиталей, образующих связь атомов. В обобщенной форме эта идея известна как принцип максимального перекрывания-, наиболее прочные химические связи образуются в направлении наибольшего перекрывания орбиталей атомов. Таким образом, определив относите.пьную ориентацию гибридных АО атома, можно установить напранление образуемых ими связей. Проследим за тем, как представления о гибридизации АО позволяют описать геометрическую форму молекул. Полезно при этом также рассмотреть, как можно подойти к концепции гибридизации с чисто качественных позиций (Л. Полинг, Дж. Слэтер). [c.388]
Теория валентных связей предполагает участие а образовании ковалентных связей не только чистых» атомньсх орбиталей, но и «смешанных , так называемых гибридных атомных орбиталей. При гибридизации первоначальная форма и энергия орбиталей (электронных облаков) взаимно изменяются и [c.22]
При sp -гибридизации образуются три гибридных облака, которые лежат в одной плоскости и ориентированы друг к другу под углом 120° (рис, 15). Эти три гибридных электронных облака перекрываются с р-электронными облаками атома хлора, и образуется плоская молекула треугольной формы — ВС1з (рис. 16), [c.78]
При образовании соединений элементами подгруппы П1А (ВС1з, Н3ВО3) в их атомах наблюдается гибридизация одного 5- и двух р-электронных облаков. В данном случае у атомов В — зр -г и б-ридизация. Три гибридных облака расположены водной плоскости под углами 120° по отношению друг к другу (рис. 29,6). Поэтому соответствующие молекулы имеют форму плоского треугольника. [c.95]
Одинаковая прочность связе1 1 объясняется гибридизацией валентных (внешних) орбиталей, т. е. их смешением и выравниванием ио форме и энергии. В этом случае первоначальная форма и энергия электронных облаков (орбиталей) атома взаимопзме-няются и образуются электронные облака (орбитали) одинаковой формы и энергии. Гибридная орбиталь асимметрична и сильно вытянута по одну сторону от ядра (рис. 14). [c.83]
chem21.info
Лекция №2 (II) семестр «Строение атома углерода. Гибридизация. — Лекции по химии — Студентам — Каталог файлов
Гибридизация — это смешивание валентных электронных облаков и образование качественно новых, равноценных гибридных валентных электронных облаков.
У атома углерода в возбужденном состоянии 4 валентных электрона
Они неравноценны: s-электрон сферической формы, р-электроны имеют форму восьмерки и направлены по осям х, у, z.
При образовании химических связей у атома углерода происходит гибридизация. В зависимости от вида гибридизации атомы углерода могут находиться в трех валентных состояниях:
I валентное состояние. Для него характерна sр3-гибридизация. В случае sp3— гибридизации образуется четыре гибридных облака, которые направлены из центра тетраэдра к его вершинам. Угол между осями гибридных электронных облаков оказывается равным 109°28». Так образуется метан и его гомологи — алканы с общей формулой
CnH2n + 2.
Алканы в пространстве имеют зигзагообразное строение — это ряд тетраэдров, соединенных своими вершинами:
Анимация образования sp3 гибридизации
II валентное состояние — sр2-гибридизация. Если происходит sр2-гибридизация, то образуется три гибридных валентных облака, которые лежат на плоскости под углом 120°.
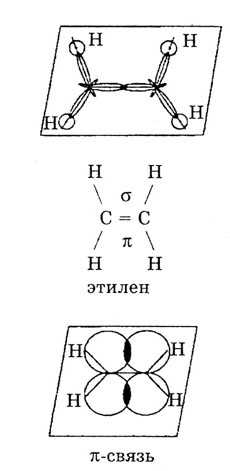
Они образуют на плоскости три сигма-связи. Четвертая связь с соседним атомом углерода образуется в перпендикулярной плоскости двумя р-электронами, которые не участвовали в гибридизации. Так образуется этилен и его гомологи с общей формулой CnH2n.
Анимация образования sp2 гибридизации
III валентное состояние — sp-гибридизация. В случае sp-гибридизации образуются два гибридных облака, которые лежат на осевой линии, соединяющей ядра двух атомов под углом 180°. Они образуют две сигма-связи по осевой линии — с водородом и углеродом. 2р-электрона, которые не участвовали в гибридизации, образуют с соседним атомом углерода две П-связи в двух взаимноперпендикулярных плоскостях. Так образуется ацетилен и его гомологи с общей формулой CnH2n + 2.
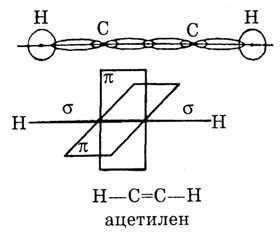
Анимация образования sp гибридизации
Выводы к лекции смотри здесь
lidijavk.ucoz.ru
Гибридизация электронных орбиталей и геометрия молекул
В 1930 г. Слейтером и Л. Полингом была развита теория образования ковалентной связи за счет перекрывания электронных орбиталей – метод валентных связей. В основе этого метода лежит метод гибридизации, который описывает образование молекул веществ за счет «смешивания» гибридных орбиталей («смешиваются» не электроны, а орбитали).
Определение типа гибридизации молекул с ковалентной связью
Определить тип гибридизации можно только для молекул с ковалентной связью типа АВn, где n больше или равно двум, А – центральный атом, В – лиганд. В гибридизацию вступают только валентные орбитали центрального атома.
Определим тип гибридизации на примере молекулы BeH2.
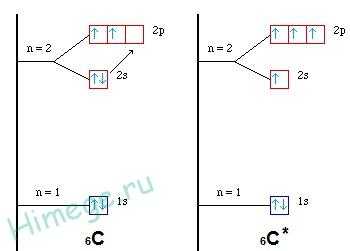
Первоначально записываем электронные конфигурации центрального атома и лиганда, рисуем электронно-графические формулы.
4Be 1s22s2
1h2s1
Атом бериллия (центральный атом) имеет вакантные 2p-орбитали, поэтому, чтобы принять по одному электрону от каждого атома водорода (лиганд) для образования молекулы BeH2 ему необходимо перейти в возбужденное состояние:
Образование молекулы BeH2 происходит за счет перекрывания валентных орбиталей атома Be
* красным цветом обозначены электроны водорода, черным – бериллия.
Тип гибридизации определяют по тому, какие орбитали перекрылись, т.о., молекула BeH2 находитс в sp – гибридизации.
Помимо молекул состава ABn, методом валентных связей можно определить тип гибридизации молекул с кратными связями. Рассмотрим на примере молекулы этилена C2H4. В молекуле этилена кратная двойная связь, которая образована и –связями. Чтобы определить гибридизацию, записываем электронные конфигурации и рисуем электронно-графические формулы атомов, входящих в состав молекулы:
6C 2s22s22p2
1h2s1
У атома углерода имеется еще одна вакантная p-орбиталь, следовательно, чтобы принять 4 атома водорода ему необходимо перейти в возбужденное состояние:
Одна p-орбиталь необходима для образования -связи (выделена красным цветом), поскольку -связь образуется за счет перекрывания «чистых» (негибридных) p — орбиталей. Остальные валентные орбитали идут в гибридизацию. Таким образом этилен находится в гибридизации sp2.
Определение геометрической структуры молекул
Геометрическую структуру молекул, а также катионов и анионов состава АВn можно с помощью метода Гиллеспи. В основе этого метода – валентные пары электронов. На геометрическую структуру оказывают влияние не только электроны, участвующие в образовании химической связи, но и неподеленные электронные пары. Каждую неподеленную пару электронов в методе Гиллеспи обозначают Е, центральный атом – А, лиганд – В.
Если неподеленных электронных пар нет, то состав молекул может быть АВ2 (линейная структура молекулы), АВ3 (структура плоского треугольника), АВ4 (тетраэдрическая структура), АВ5 (структура тригональной бипирамиды) и АВ6 (октаэдрическая структура). От базисных структур могут быть получены производные, если вместо лиганда появляется неподеленная электронная пара. Например: АВ3Е (пирамидальная структура), АВ2Е2 (угловая структура молекулы).
Чтобы определить геометрическую структуру (строение ) молекулы необходимо определить состав частицы, для чего вычисляют количество неподеленных лектронных пар (НЕП):
НЕП = (общее число валентных электронов – число электронов, пошедших на образование связи с лигандами) / 2
На связь с H, Cl, Br, I, F уходит по 1-му электрону от А, на связь с O – по 2 электрона, а на связь с N – по 3 электрона от центрального атома.
Рассмотрим на примере молекулы BCl3. Центральный атом – B.
5B 1s22s22p1
НЕП = (3-3)/2 = 0, следовательно неподеленных электронных пар нет и молекула имеет структуру АВ3 – плоский треугольник.
Подробно геометрическое строение молекул разного состава представлено в табл. 1.
Таблица 1. Пространственное строение молекул
|
Формула молекулы |
Тип гибридизации |
НЕП |
Тип молекулы |
Геометрия молекулы |
Пример |
|
АВ2 |
sp |
0 |
АВ2 |
линейная |
BeH2 |
|
АВ3 |
sp2 |
0 |
АВ3 |
треугольная |
BCl3 |
|
1 |
АВ2Е |
угловая |
GeF2 |
||
|
АВ4 |
sp3 |
0 |
АВ4 |
тетраэдр |
CH4 |
|
1 |
АВ3Е |
тригональная пирамида |
NH3 |
||
|
2 |
АВ2Е2 |
угловая |
H2O |
||
|
АВ5 |
sp3d |
0 |
АВ5 |
тригональная бипирамида |
PF5 |
|
1 |
АВ4Е |
дисфеноид |
SCl4 |
||
|
2 |
АВ3Е2 |
Т-образная |
ICl3 |
||
|
3 |
АВ2Е3 |
линейная |
XeF2 |
||
|
АВ6 |
sp3d2 |
0 |
АВ6 |
октаэдр |
SF6 |
|
1 |
АВ5Е |
квадратная пирамида |
IF5 |
||
|
2 |
АВ4Е2 |
квадрат |
XeF4 |
Примеры решения задач
ru.solverbook.com
Гибридизация атомных орбиталей углерода » HimEge.ru
Модель атома углерода
Валентные электроны атома углерода располагаются на одной 2s-орбитали и двух 2р-орбиталях. 2р-Орбитали расположены под углом 90° друг к другу, а 2s-орбиталь имеет сферическую симметрию. Таким образом, расположение атомных орбиталей углерода в пространстве не объясняет возникновения в органических соединениях валентных углов 109,5°, 120° и 180°.
Чтобы разрешить это противоречие, было введено понятие гибридизации атомных орбиталей. Для понимания природы трех вариантов расположения связей атома углерода понадобились представления о трех типах гибридизации.
Возникновением концепции гибридизации мы обязаны Лайнусу Полингу, много сделавшему для развития теории химической связи.
Концепция гибридизации объясняет, каким образом атом углерода видоизменяет свои орбитали при образовании соединений. Ниже мы будем рассматривать этот процесс трансформации орбиталей постадийно. При этом надо иметь в виду, что расчленение процесса гибридизации на стадии или этапы есть, на самом деле, не более чем мысленный прием, позволяющий более логично и доступно изложить концепцию. Тем не менее заключения о пространственной ориентации связей углеродного атома, к которым мы в итоге придем, полностью соответствуют реальному положению дел.
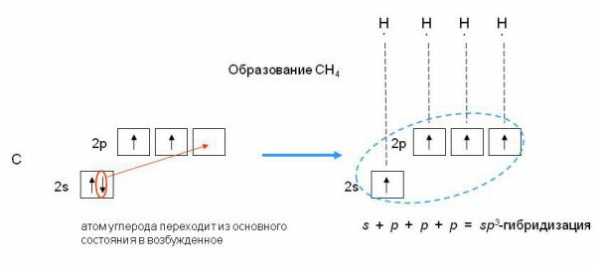
Электронная конфигурация атома углерода в основном и возбужденном состоянии
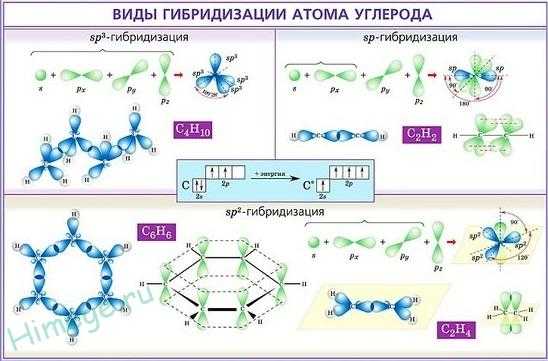
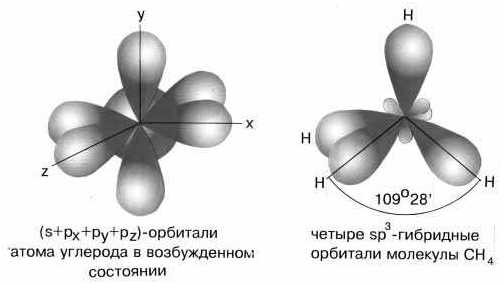
На рисунке слева показана электронная конфигурация атома углерода. Нас интересует только судьба валентных электронов. В результате первого шага, который называют возбуждением или промотированием, один из двух 2s-электронов перемещается на свободную 2р-орбиталь. На втором этапе происходит собственно процесс гибридизации, который несколько условно можно представить себе как смешение одной s- и трех р-орбиталей и образование из них четырех новых одинаковых орбиталей, каждая из которых на одну четверть сохраняет свойства s-орбитали и на три четверти — свойства р-орбиталей. Эти новые орбитали получили название sp3-гибридных. Здесь надстрочный индекс 3 обозначает не число электронов, занимающих орбитали, а число р-орбиталей, принявших участие в гибридизации. Гибридные орбитали направлены к вершинам тетраэдра, в центре которого находится атом углерода. На каждой sp3-гибридной орбитали находится по одному электрону. Эти электроны и участвуют на третьем этапе в образовании связей с четырьмя атомами водорода, образуя валентные углы 109,5°.
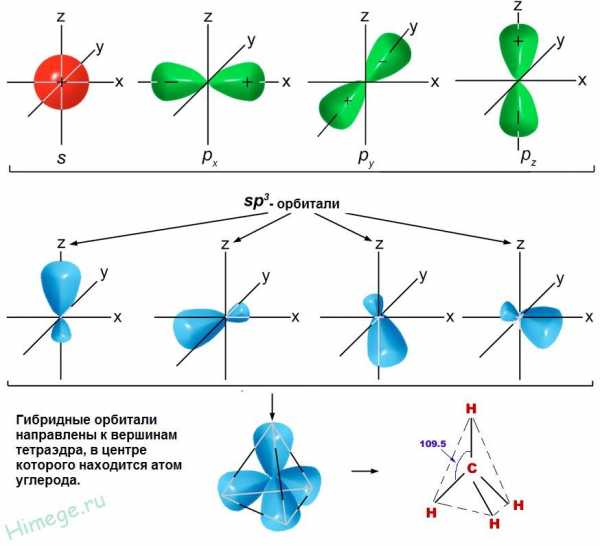
sp3 — гибридизация. Молекула метана.
Образование плоских молекул с валентными углами 120° показано на рисунке ниже. Здесь, как и в случае sp3-гибридизации, первый шаг — возбуждение. На втором этапе в гибридизации участвуют одна 2s- и две 2р — орбитали, образуя три sр2 -гибридных орбитали, расположенных в одной плоскости под углом 120° друг к другу.
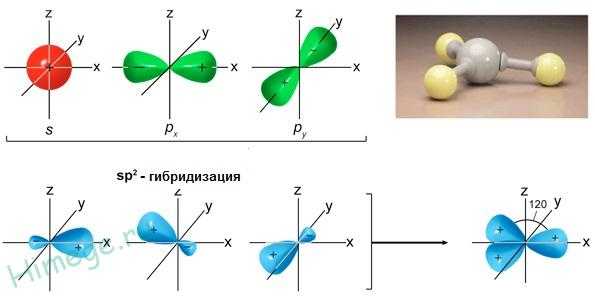
Образование трех sр2-гибридных орбиталей
Одна p-рорбиталь остается негибридизованной и располагается перпендикулярно плоскости sр2–гибридных орбиталей. Затем (третий шаг) две sр2-гибридные орбитали двух углеродных атомов объединяют электроны, образуя ковалентную связь. Такая связь, образующаяся в результате перекрывания двух атомных орбиталей вдоль линии, соединяющей ядра атома, называется σ -связью.
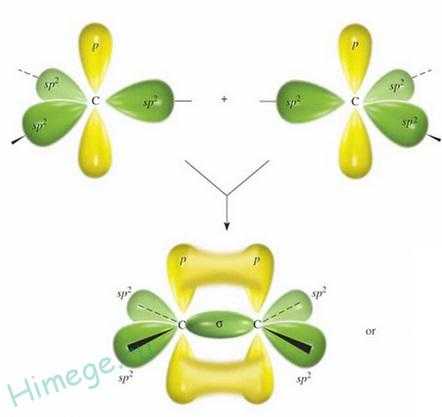
Образование сигма — и пи-связей в молекуле этилена
Четвертый этап — образование второй связи между двумя углеродными атомами. Связь образуется в результате перекрывания обращенных друг к другу краев негибридизованных 2р-орбиталей и называется π-связью. Новая молекулярная орбиталь представляет собой совокупность двух занятых электронами π-связи областей — над и под σ-связью. Обе связи (σ и π ) вместе составляют двойную связь между атомами углерода. И наконец, последний, пятый шаг — образование связей между атомами углерода и водорода с помощью электронов четырех оставшихся sр2-гибридных орбиталей.
Двойная связь в молекуле этилена
Третий, последний тип гибридизации, показан на примере простейшей молекулы, содержащей тройную связь,- молекулы ацетилена. Первый шаг — возбуждение атома, такой же, как раньше. На втором этапе происходит гибридизация одной 2s- и одной 2р-орбиталей с образованием двух sр-гибридных орбиталей, которые располагаются под углом 180°. И остаются не измененными две 2р-орбитали, необходимые для образования двух π-связей.
Образование двух sр-гибридных орбиталей
Следующий шаг — образование σ-связи между двумя sр-гибридизованными углеродными атомами, затем образуются две π-связи. Одна σ-связь и две π-связи между двумя атомами углерода вместе составляют тройную связь. И наконец, образуются связи с двумя атомами водорода. Молекула ацетилена имеет линейное строение, все четыре атома лежат на одной прямой.
Мы показали, каким образом три основных в органической химии типа геометрии молекул возникают в результате различных трансформаций атомных орбиталей углерода.
Можно предложить два способа определения типа гибридизации различных атомов в молекуле.
Способ 1. Наиболее общий способ, пригодный для любых молекул. Основан на зависимости валентного угла от гибридизации:
а) валентные углы 109,5°, 107° и 105° свидетельствуют об sр3-гибридизации;
б) валентный угол около 120° -sр2-гибридизация;
в) валентный угол 180°-sp-гибридизация.
Способ 2. Пригоден для большинства органических молекул. Поскольку тип связи (простая, двойная, тройная) связан с геометрией, можно по характеру связей данного атома определить тип его гибридизации:
а) все связи простые – sр3-гибридизация;
б) одна двойная связь – sр2 -гибридизация;
в) одна тройная связь — sp-гибридизация.
Гибридизация — это мысленная операция превращения обычных (энергетически наиболее выгодных) атомных орбиталей в новые орбитали, геометрия которых соответствует экспериментально определенной геометрии молекул.
himege.ru
Готовимся к углубленному изучению химии : 3.8 Гибридизация орбиталей
3.8. Гибридизация орбиталей. Пространственная форма молекул Образование одинаковых связей из атомных орбиталей разного вида потребовало введения такого понятия, как ГИБРИДИЗАЦИЯ (то есть “смешивание”) атомных орбиталей. Почему это понятие стало необходимо? Вернемся к уже знакомой нам молекуле BeCl2. Ее образование вполне понятно из электронного строения атомов бериллия и хлора, которое изображается формулами Льюиса: Электронная конфигурация валентной оболочки бериллия 2s2. Для реакции с двумя атомами хлора необходим переход электронов бериллия в возбужденное состояние: Если бы один атом хлора связывался с бериллием за счет 2s-электрона бериллия, а другой — за счет 2p-электрона бериллия, то связи Be—Cl не были бы равноценными. Однако на самом деле обе связи имеют одинаковую длину, прочность и расположены под углом 180о. Чтобы объяснить равноценность связей Be—Cl, говорят о sp-гибридизации валентных атомных орбиталей бериллия, при которой одна s-орбиталь и одна p-орбиталь (они обведены овалом на орбитальной диаграмме) как бы смешиваются и выравниваются по форме и энергии, давая две одинаковые sp-гибридные орбитали.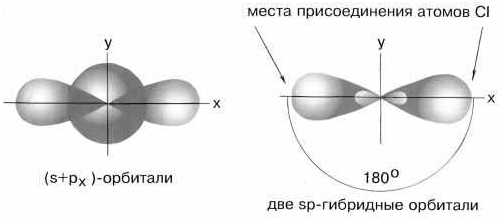 sp-гибридизация валентных орбиталей бериллия в
соединении BeCl2
sp-гибридизация валентных орбиталей бериллия в
соединении BeCl2Каждая гибридная орбиталь несимметрична (вытянута в сторону от ядра). Обе гибридные орбитали бериллия лежат на одной прямой. Считается, что благодаря sp-гибридизации молекула BeCl2 имеет линейную форму и все три ее атома находятся на одной прямой, а обе связи Be—Cl совершенно одинаковы. Такова геометрия и у всех других sp-гибридизованных молекул — независимо от элементов, которые входят в эти молекулы. Если валентная оболочка атома включает электроны на одной s-орбитали и двух p-орбиталях, то имеет место sp2-гибридизация орбиталей. Примером может служить sp2-гибридизация бора при образовании молекулы BF3. На орбитальной диаграмме обведены одна s- и две p-орбитали, которые “смешиваются”, то есть гибридизуются. Из ОВЭП мы уже знаем, что sp2-гибридные фрагменты молекул имеют форму плоского треугольника.
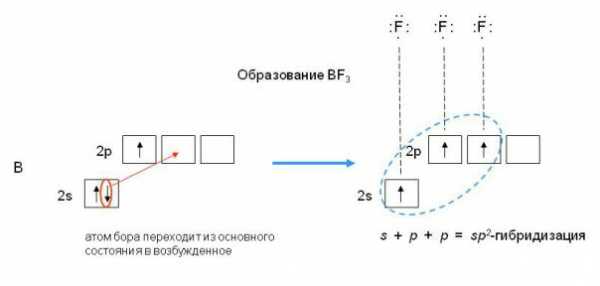
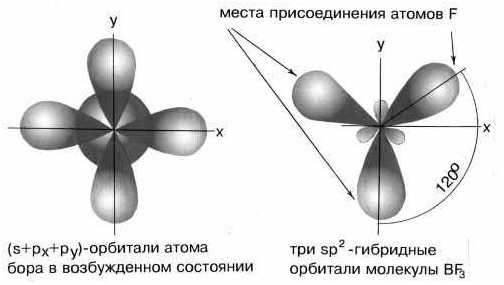 sp2-гибридизация
валентных орбиталей бора в соединении BF3
sp2-гибридизация
валентных орбиталей бора в соединении BF3Три sp2-гибридные орбитали бора лежат в одной плоскости под углом 120o. Наконец, когда смешиваются одна s- и три p-орбитали, возникают sp3-гибридизованные молекулы, имеющие геометрию тетраэдра (рис. 3-9). Примером может служить молекула метана СН4.
 sp3-гибридизация валентных орбиталей
углерода
Четыре
sp3-гибридные орбитали углерода направлены в вершины правильного
тетраэдра. Атом углерода находится в центре тетраэдра. Углы между всеми связями
равны и составляют 109°28′.
Существует
важное правило:
При гибридизации ЧИСЛО ГИБРИДНЫХ ОРБИТАЛЕЙ всегда РАВНО ЧИСЛУ ИСХОДНЫХ
АТОМНЫХ ОРБИТАЛЕЙ.
Если
все гибридные орбитали связаны с одинаковыми атомами, то связи ничем не
отличаются друг от друга. В других случаях встречаются небольшие отклонения от
стандартных валентных углов. Например, в молекуле воды H2O кислород
— sp3-гибридный, находится в центре неправильного тетраэдра, в
вершины которого «смотрят» два атома водорода и две неподеленные пары
электронов (рис. 3-10а). Форма молекулы угловая, если смотреть по центрам
атомов. Валентный угол HОН составляет 105о, что довольно близко к
теоретическому значению 109о.
sp3-гибридизация валентных орбиталей
углерода
Четыре
sp3-гибридные орбитали углерода направлены в вершины правильного
тетраэдра. Атом углерода находится в центре тетраэдра. Углы между всеми связями
равны и составляют 109°28′.
Существует
важное правило:
При гибридизации ЧИСЛО ГИБРИДНЫХ ОРБИТАЛЕЙ всегда РАВНО ЧИСЛУ ИСХОДНЫХ
АТОМНЫХ ОРБИТАЛЕЙ.
Если
все гибридные орбитали связаны с одинаковыми атомами, то связи ничем не
отличаются друг от друга. В других случаях встречаются небольшие отклонения от
стандартных валентных углов. Например, в молекуле воды H2O кислород
— sp3-гибридный, находится в центре неправильного тетраэдра, в
вершины которого «смотрят» два атома водорода и две неподеленные пары
электронов (рис. 3-10а). Форма молекулы угловая, если смотреть по центрам
атомов. Валентный угол HОН составляет 105о, что довольно близко к
теоретическому значению 109о.
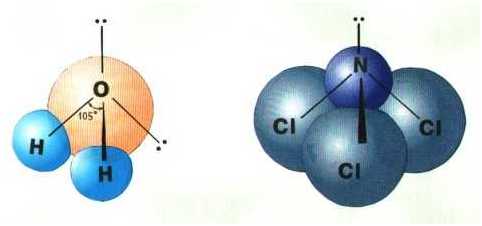 sp3-гибридизация атомов кислорода и азота в
молекулах а) H2O и б) NCl3
Если
бы не происходило гибридизации (“выравнивания” связей O-H), валентный угол HOH
был бы равен 90°, потому что атомы водорода были бы присоединены к двум взаимно
перпендикулярным р-орбиталям. В этом случае наш мир выглядел бы, вероятно,
совершенно по-другому.
Пространственная
форма молекул
Формулы Льюиса многое говорят об электронном строении
и устойчивости молекул, но пока ничего не могут сказать об их пространственном строении. В теории химической
связи существуют два хороших подхода к объяснению и предсказанию геометрии
молекул. Они хорошо согласуются между собой.
Первый подход называется теорией отталкивания
валентных электронных пар (ОВЭП). Несмотря на “страшное” название, суть этого
подхода очень проста и понятна:
химические связи и неподеленные электронные пары в
молекулах стремятся расположиться как можно дальше друг от друга.
Поясним на конкретных примерах. В молекуле BeCl2 есть две связи Be—Cl. Форма этой
молекулы должна быть такой, чтобы обе эти связи и атомы хлора на их концах
располагались как можно дальше друг от друга:
Это возможно только при линейной форме молекулы, когда
угол между связями (угол ClBeCl) равен 180о.
Другой пример: в молекуле BF3 имеется 3 связи B—F. Они располагаются
как можно дальше друг от друга и молекула имеет форму плоского треугольника,
где все углы между связями (углы FBF) равны 120о :
Еще один пример: в молекуле CH4 имеется 4 связи C—H. Все эти 4 связи расположатся
максимально далеко друг от друга только тогда, когда молекула примет форму
тетраэдра, у которого в центре находится атом C, а в вершинах — атомы H.
Кстати, в «квадратной» молекуле расстояние между атомами водорода
было бы меньше, поэтому реальная молекула CH4 имеет форму тетраэдра:
В молекуле CH4 угол НСН такой же, как в
математическом тетраэдре: 109о28’.
Последний пример: молекула H2O в своем
составе имеет две связи O—H и две неподеленные пары электронов. Вывод:
эта молекула также должна иметь форму, похожую на тетраэдр.
Реально этот тетраэдр слегка искажен, потому что
неподеленные пары отталкиваются между собой несколько сильнее, чем от
поделенных пар, и чем поделенные пары отталкиваются друг от друга. Поэтому
реальный угол HOH составляет не 109о, а немногим менее 105о.
Однако по центрам атомов, как можно видеть, молекула воды имеет угловую форму.
Если ввести обозначения: н.п — неподеленная пара, п.п — поделенная пара, то относительное
отталкивание между ними дает такой ряд:
(н.п/н.п) > (н.п/п.п) > (п.п/п.п).
Теория отталкивания валентных электронных пар (ОВЭП)
проста и наглядна. Она опирается на классическую геометрию и позволяет
правильно предсказывать форму молекул.
1. Какие электроны атомов (например, углерода
или азота) называют неспаренными?
Решение: Электроны, которые
находятся по одному на орбитали, называют неспаренными
электронами. Например, в электронографической формуле возбужденного атома
углерода – четыре неспаренных электрона, а у атома азота – три:
_____________________________________________________________
sp3-гибридизация атомов кислорода и азота в
молекулах а) H2O и б) NCl3
Если
бы не происходило гибридизации (“выравнивания” связей O-H), валентный угол HOH
был бы равен 90°, потому что атомы водорода были бы присоединены к двум взаимно
перпендикулярным р-орбиталям. В этом случае наш мир выглядел бы, вероятно,
совершенно по-другому.
Пространственная
форма молекул
Формулы Льюиса многое говорят об электронном строении
и устойчивости молекул, но пока ничего не могут сказать об их пространственном строении. В теории химической
связи существуют два хороших подхода к объяснению и предсказанию геометрии
молекул. Они хорошо согласуются между собой.
Первый подход называется теорией отталкивания
валентных электронных пар (ОВЭП). Несмотря на “страшное” название, суть этого
подхода очень проста и понятна:
химические связи и неподеленные электронные пары в
молекулах стремятся расположиться как можно дальше друг от друга.
Поясним на конкретных примерах. В молекуле BeCl2 есть две связи Be—Cl. Форма этой
молекулы должна быть такой, чтобы обе эти связи и атомы хлора на их концах
располагались как можно дальше друг от друга:
Это возможно только при линейной форме молекулы, когда
угол между связями (угол ClBeCl) равен 180о.
Другой пример: в молекуле BF3 имеется 3 связи B—F. Они располагаются
как можно дальше друг от друга и молекула имеет форму плоского треугольника,
где все углы между связями (углы FBF) равны 120о :
Еще один пример: в молекуле CH4 имеется 4 связи C—H. Все эти 4 связи расположатся
максимально далеко друг от друга только тогда, когда молекула примет форму
тетраэдра, у которого в центре находится атом C, а в вершинах — атомы H.
Кстати, в «квадратной» молекуле расстояние между атомами водорода
было бы меньше, поэтому реальная молекула CH4 имеет форму тетраэдра:
В молекуле CH4 угол НСН такой же, как в
математическом тетраэдре: 109о28’.
Последний пример: молекула H2O в своем
составе имеет две связи O—H и две неподеленные пары электронов. Вывод:
эта молекула также должна иметь форму, похожую на тетраэдр.
Реально этот тетраэдр слегка искажен, потому что
неподеленные пары отталкиваются между собой несколько сильнее, чем от
поделенных пар, и чем поделенные пары отталкиваются друг от друга. Поэтому
реальный угол HOH составляет не 109о, а немногим менее 105о.
Однако по центрам атомов, как можно видеть, молекула воды имеет угловую форму.
Если ввести обозначения: н.п — неподеленная пара, п.п — поделенная пара, то относительное
отталкивание между ними дает такой ряд:
(н.п/н.п) > (н.п/п.п) > (п.п/п.п).
Теория отталкивания валентных электронных пар (ОВЭП)
проста и наглядна. Она опирается на классическую геометрию и позволяет
правильно предсказывать форму молекул.
1. Какие электроны атомов (например, углерода
или азота) называют неспаренными?
Решение: Электроны, которые
находятся по одному на орбитали, называют неспаренными
электронами. Например, в электронографической формуле возбужденного атома
углерода – четыре неспаренных электрона, а у атома азота – три:
_____________________________________________________________
2. Что означает понятие «общие электронные пары» в соединениях с ковалентной связью (например, СН4 или Н2S)? Решение: Два электрона, участвующие в образовании одной химической связи, называют общей электронной парой. Обычно до образования химической связи один из электронов этой пары принадлежал одному атому, а другой электрон – другому атому: _____________________________________________________________ 3. Какие электронные состояния атомов (например, С или N) называют основными, а какие возбужденными? Решение: Электронное состояние атома, в котором соблюдается порядок заполнения электронных орбиталей: 1s2, 2s2, 2p2, 3s2, 3p2, 4s2, 3d2, 4p2 и т.д., называют основным состоянием. Ввозбужденном состоянии один из валентных электронов атома занимает свободную орбиталь с более высокой энергией, такой переход сопровождается разъединением спаренных электронов. Схематически это записывают так: Тогда как в основном состоянии было только два валентных неспаренных электрона, то в возбужденном состоянии таких электронов становится четыре. _____________________________________________________________
4. Какие типы гибридизации известны для атома углерода и в чем они заключаются? Решение: Для атома углерода известны три типа гибридизации: sp3, sp2 и sp.
Какие химические связи называют δ и какие π? Укажите δ— и π-связи в соединениях:
_____________________________________________________________ 5. Для атомов углерода приведенных ниже соединений укажите: а) тип гибридизации; б) типы его химических связей; в) валентные углы.Решение:
_____________________________________________________________ ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ 1. Какое геометрическое строение характерно для молекул, которые содержат sp-гибридизованные атомы. 2. Какова геометрическая форма молекул типа АВ3, которые содержат sp2-гибридизованный атом А. 3. Какова геометрическая форма молекул типа АВ4, которые содержат sp3-гибридизованный атом А. 4. Назовите известные вам виды пространственного строения молекул. Приведите примеры молекул. 5. Какие типы гибридизации являются наиболее важными. 6. Сколько гибридных орбиталей образуется в результате: sp-, sp2-, sp3-гибридизации. 7. Для атомов элементов 2-го и 3-го периодов напишите электронные и электронно-графические формулы внешнего электронного слоя в возможных возбужденных состояниях. 8. Какой тип гибридизации характерен для кремния в SiCl4. Нарисуйте схему перекрывания электронных облаков в данной молекуле. 9. Какой тип гибридизации характерен для кремния в MgBr2. Нарисуйте схему перекрывания электронных облаков в данной молекуле. 10. Какие из следующих молекул являются полярными и какие неполярными, почему:
| 1. Укажите неполярную молекулу: | |
| 2. Укажите неполярную молекулу с ковалентными полярными связями: | |
| 3. У какой частицы есть sр3-гибридные орбитали: | |
| 4. По какому типу гибридизованы валентные орбитали в молекуле ВеН2: | |
| 5. Какое свойство не присуще ковалентной связи: | |
| а) насыщенность | б) валентность |
| в) направленность | г) поляризуемость |
| 6. sр3 –гибридизация атомных орбиталей центрального атома может дать такие геометрические конфигурации молекул: | |
| в) тригональная пирамида | |
| 7. Чем оценивается степень полярности ковалентной связи: | |
| а) разностью электроотрицательностей | б) величиной эффективных зарядов |
| в) значением электрического момента диполя | г) длиной диполя |
| 8. Характеристиками ионной связи являются: | |
| а) насыщаемость | б) координационное число |
| в) направленность | г) разность электроотрицательностей |
| 9. Укажите соединение с ионной связью: | |
| 10. У какого соединения более ярко выражена ковалентная полярная связь: | |
himiy88.blogspot.com
Электронные облака гибридные — Справочник химика 21
У элементов третьего и последующих периодов в образовании гибридных электронных облаков могут участвовать и -орбитали. Особенно важен случай хр -гибридизации, когда в образовании гибридных орбиталей участвуют одна 5-, три р- и две -орбитали, В этом случае образуются шесть равноценных гибридных орбиталей, вытянутых в направлениях к вершинам октаэдра. Октаэдрическая структура молекулы 5Рд, ионов [5 Рбр , [Ре(СМб)р- и ми 1Г 1Х других объясняется хр гЯ-гибридизацией атомных орбиталей центрального атома. [c.139]
Согласно этому представлению химические связи формируются электронами не чистых , а смешанных , так называемых гибридных орбиталей. Последние являются результатом смешения атомных орбиталей. Иначе говоря, при гибридизации первоначальная форма и энергия орбиталей (электронных облаков) взаимно изменяются и образуются орбитали (облака) новой, но уже одинаковой формы и одинаковой энергии. [c.73]
На рис. П.11 схематически показана гиб- тали направлены к ридизация 5- и р-орбиталей типа р большая углам тетраэдра часть электронного заряда приходится на одну долю электронного облака . Гибридная орбиталь типа яр имеет характерную форму клеверного листа (рис. П.12). [c.115]
Гибридные облака, соответствующие данному типу гибридизации, располагаются в атоме так, чтобы взаимодсйстние между электронами было минимальным, т. е. как можно дальше друг от друга. Поэтому при 5р-гнбридизации электронные облака ориентируются в противоположных направлениях, при зр -гибридизацин — в направлениях, лежащих в одной плоскости и составляющих друг с другом углы в 120 (т. е. в направлениях к вершинам правильного треугольника), при 5р -гибридизации — к вершинам тет- [c.64]
Рассмотрим электронное облако гибридной орбитали фJ [c.31]
С, образованная перекрыванием двух яр -гибридных электронных облаков по линии, соединяющей центры атомов (по оси связи), как, например, в этане (рис. 29.5), представляет собой сг-связь. Связи С-И также являются сг-связями — они образуются перекрыванием по оси [c.554]
Квантовый расчет, показывающий, что орбитали с различной симметрией в свободном атоме при образовании химической связи принимают одинаковую форму, называется гибридизацией атомных орбиталей. Часто термином гибридизация обозначают расположение электронных облаков в молекуле, соответствующее данному приближенному расчету. Волновая функция гибридной орбитали составляется из волновых функций валентных электронов, умноженных на некоторые коэ( ициенты. Так, волновые [c.91]
Тройная связь С С (или С С) является сочетанием одной о-связи и двух л-связей. Например, при образовании молекулы ацетилена в каждом из атомов углерода в гибридизации участвует одна 5-орбиталь и только одна р-орбиталь (ер-гибридизация) в результате образуются два р-гибридных электронных облака, участвующие в образовании двух о-связей. Облака двух [c.459]
Возможны и другие случаи гибридизации атомных орбиталей, однако число образующихся гибридных орбиталей всегда равно общему числу исходных атомных орбиталей, участвующих в гибридизации. Так, при гибридизации одной я- и двух р-орбиталей зр—гибридизация) образуются три равноценные р -орбитали. В этом случае гибридные электронные облака располагаются в направлениях, лежащих в одной плоскости и ориентированных под углами 120° друг к другу (рис. 4.28). Очевидно, что этому типу гибридизации соответствует образование плоской треугольной молекулы. [c.137]
Тройная связь С С (или СНС) является сочетанием одной ст-связи и двух тг-связей. Например, при образовании молекулы ацетилена в каждом из атомов углерода в гибридизации участвует одна 5-орбиталь и только одна р-орбиталь (зр-гибридизация) в результате образуются два ер-гибридных электронных облака, участвующих в образовании двух ст-связей. Облака двух р-электронов каждого атома С не гибридизуются и участвуют в образовании двух тг-связей. Таким образом, в ацетилене всего три ст-связи (одна С-С и две С-Н), направленные вдоль одной прямой, и две тг-связи, ориентированные в двух взаимно перпендикулярных плоскостях (рис. 29.8). [c.555]
Переход кратных связей в простые объясняется тем, что обычно тг-связи обладают меньшей прочностью и поэтому большей лабильностью по сравнению с ст-связями. При образовании тг-Связей р-электронные облака с параллельными осями перекрываются в значительно меньшей степени, чем электронные облака, перекрывающиеся по оси связи (т. е. гибридные, з-электронные или ориентированные вдоль оси связи р-электронные облака). [c.555]
На рис. 5.4 показана форма гибридного облака, образовавшегося при комбинации облаков 5- и / -электронов. Их гибридная вр- [c.101]
В молекуле этилена наибольшее перекрывание электронных облаков и наименьшая потенциальная энергия системы наблюдаются тогда, когда одна -орбиталь и две р-орбитали атомов углерода образуют три ст-связи, лежащие в одной плоскости (рис. 5.8, б), направленные под углом в 120°. Третья р-орбиталь образует между атомами углерода я-связь, расположенную в плоскости, перпендикулярной к плоскости ст-связей. В образовании сг-связей участвуют одна 5- и две р-орбитали, происходит гибридизация и образуются 5р -гибридные орбитали, как у атома В (ВРз). [c.105]
Гибридизация одной 5- и одной р-орбитали называется р-гиб-. ридизацией (эс-пэ-гибридизация). Две р-гибридные орбитали под влиянием взаимного отталкивания электронных облаков [c.91]
Четыре гибридные орбитали атома углерода расположены под углом 109,5° друг к другу,— они направлены к вершинам тетраэдра, в центре которого находится атом углерода. На рис. 75 показана форма электронных облаков для гибридных орбиталей углеродного атома. Как видно из рис. 74 и 75, гибридная орбиталь сильно вытянута в одну сторону от ядра. Это обусловливает гораздо более сильное пере- [c.165]
На рис. 76 схематически показана перегруппировка электронных облаков атома углерода при образовании гибридных орбиталей. [c.166]
Из атомных -орбиталей могут образоваться молекулярные орбитали только ст-типа. Обратное неверно, так как молекулярные а-орбитали могут образовываться и при участии любых типов атомных орбиталей, в том числе и гибридных, причем последние обеспечивают более эффективное перекрывание по линии связи. На рис. 21 приведена схема перекрывания электронных облаков при образовании о-связей с участием р-орбиталей и гибридных орбиталей. На рис. 22 изображены электронные облака связывающих и разрыхляющих ст-орбиталей, образованных двумя з- или двумя р-ор-биталями. [c.60]
Природа кратных углерод-углеродных связей несколько иная. Так, в молекуле этилена при образованиадй ойной ковалентной связи С = С в каждом из атомов углерода в гибридизации участвует одна -орбиталь и только две р-орбитали (зр -гибридизация) одна из р-орбиталей каждого атома С не гибридизуется. В результате образуются три зр -гибридных электронных облака, которые участвуют в образовании трех ст-связей. Всего в молекуле этилена пять сг-связей [c.554]
Как мы уже знаем (см. стр. 167), при зр -гибридизации электронные облака расположены в одной плоскости под углами 120° друг к другу. Эти гибридные орбитали образуют три я-связи — одну связь С—С и две связи С—Н, которые лежат в одной плоскости под углами 120° друг к другу. Экспериментальное исследование показывает, что молекула С2Н4 действительно имеет плоское строение. Очевидно, что оставшиеся негибридизированными р-орбитали атомов углерода образуют я-связь. Ввиду стремления электронов разных связей избегать друг друга (см, стр. 162) я-связь расположится в плоскости, перпендикулярной плоскости, в которой лежат сг-связи (рис. 81). Такое расположение связей отвечает минимальной энергии молекулы, т.е. устойчиво-вому ее состоянию. [c.171]
Аналогично из функций 1)35, можно построить набор из трех гибридных орбиталей, электронные облака которых ориентированы в плоскости Охи под УГЛОМ 120°. [c.57]
Следует иметь в виду, что приведенные на рис. 16 варианты взаимной ориентации химических связей выполняются строго, лишь когда в их образовании участвует система полностью эквивалентных гибридных орбиталей. Эта эквивалентность наглядно видна из приведенной в том же параграфе структуры гибридных зр- и зр -орбиталей составляющие их волновые функции 5- и р-орбиталей входят в гибридные волновые функции с одинаковыми по модулю коэффициентами . Именно такая система полностью эквивалентных гибридных орбиталей более предпочтительна для образования атомом химических связей, если речь идет о связях с одинаковыми атомами. Поэтому структура СИ4 и ССЦ действительно представляет собой правильный тетраэдр с четырьмя атомами Н или С1 в вершинах и атомом С в центре. В случае взаимной ориентации связей с разными атомами или нескольких связей и электронных облаков неподеленных пар электронов возможны различные промежуточные случаи гибридизации. [c.77]
В молекулах воды и аммиака связи у атомов кислорода и азота образуются за счет электронов только одного р-подуровня. Поэтому только взаимной ориентацией р-электронных облаков обусловливается конфигурация соответствующих молекул. Сложнее происходит образование связей у атомов элементов подгрупп ПА, ПВ, П1А и IVA. В образовании связей, например, атомами бериллия, бора и углерода высшей валентности участвуют электроны разных подуровней у Ве — sp, в В — sp2, у С — sp ( 3). На основании этого можно было бы предположить, что валентная связь, образованная s-электронным облаком, будет отличаться от остальных пространственной конфигурацией, направленностью, прочностью и т. д. Изучение же молекул Be la, B I3, СН4 и им подобных показало, что связи в каждой из них равнозначны. Это явление Слейтер и Полинг объяснили тем, что во всех случаях связи у атомов Ве, В и С образовались за счет новых равноценных электронных облаков — гибридных (смешан- [c.94]
Простая ковалентная связь С—С (или С С), образованная перекрь ванием двух 5р -гибридных электронных облаков по ли-НИИ, соединяющей центры атомов (по осн связи), как, напрнмер, в этане (рис. 124), представляет собой о-связь (см. стр, 133). [c.457]
В л-комплексах образуются гибридные Пе-, Пр- и (гг—1)валентная оболочка). Если общее число электронов на этих орбиталях меньше числа электронов на аналогичных орбиталях благородного газа, незаполненные орбитали могут быть использованы для координации и последующего химического изменения молекул, окружающих комплекс, и тогда л-комплекс может проявлять каталитические свойства. Другой, более существенной причиной каталитической активности л-комплексов является неравномерность электронного облака, если металл окружен разными лигандами, как, например, в случае комплекса (СеН5СМ)2 Р(1С12. [c.102]
Как мы уже знаем, при р -гибридизации электронные облака расположены в одной плоскости под углами 120° друг к другу. Эти гибридные орбитали образуют три ст-связи — одну связь С—С и две связи С—Н, которые лежат в одной плойкости под углами 120° [c.90]
Примером первого случая является молекула фторида бора ВРз. В атоме бора три непарных электрона в гибридном состоянии образуют с р-электронами трех атомов фтора три равноценные связи. Примером второго случая является молекула аммиака HгiN, в атоме азота которой три р-элсктронных облака располагаются по координатным осям пространства и перекрыиаются с 5-электрон-иыми облаками трех атомов водорода, располагающихся в уг.пах треугольного основания пирамидальной молекулы. [c.61]
Молекулы, состоящие из пяти атомов.. Молекулы, в которых один атом одного элемента связан с четырьмя атомами другого элемента, образуются за счет взаимодействия 5- или р-электронов одного атома с 5- илн р-электронами четырех других атомов. В этих случаях молекулы имеют форму тетраэдра. Примерами являются молекулы метана СН4 и тетрафторида углерода F . В н,еитре тетраэдра располагается атом углерода, гибридные электронные облака которого перекрываются с 5-эле.ктрош1ыми облаками атомов водорода или р-электронньгми облаками атомов фтора, располагаюн ихся в вершинах тетраэдра. [c.61]
При таком расспаривании, как видно из схемы, один электрон оказывается на s-, а второй на р-орбитали. У хлора валентный электрон находится на р-орбитали. Если у бериллия валентные электроны будут различными, то в молекуле ВеСЬ одна связь ВеС1 будет (р — р)ст-связью, а вторая (s—р) ст-связью. Очевидно, что связи должны быть неравноценными. Однако опыт показывает, что обе связи ВеС1 в молекуле ВеСЬ одинаковы. Это может быть лишь в том случае, если оба валентных электрона у атома бериллия идентичны, т. е. имеют одинаковую энергию. Следовательно, в процессе расспаривания электронов энергии их выравниваются, s- и р-орбитали смешиваются — происходит так называемая гибридизация атомных орбиталей. Гибридизация, кроме выравнивания энергий электронов, всегда означает еще и изменение формы электронных облаков. В самом деле, сферическая s-орбиталь смешивается (гибридизуется) с гантелевидной р-орбиталью, вследствие чего образуются две новые гибридные орбитали с одинаковой энергией. Такие орбитали характеризуются грушевидной конфигурацией электронного облака [c.91]
Как и у алмаза, в графите каждый атом углерода образует друг с другом четыре связи. Однако эти связи неодинаковые. Три из них являются а-связямн, образованными в результате перекрывания р -гибридных орбиталей атомов углерода. Все они располагаются в одной плоскости под углом 120°, образуя непрерывную плоскую сетку, состоящую из правильных шестиугольников, в углах которых находятся атомы углерода. Четвертая я-связь образуется за счет перекрывания лепестков р-орбиталей выше и ниже плоскости, в которой расположены атомы углерода. п-Связь образует сплошное электронное облако по всему слою атомов углерода, как в случае металлической связи. Углеродные слои у графита связаны очень слабыми силами межмолекулярного пзаимодействия. Эти особенности строения графита и обусловливают такие его свойства, как электропроводность, слоистость и т. д. [c.241]
При хр -гибридизации электронные облака располагактя в одной плоскости под углом 120 друг к другу. Эти гибридные орбитали образуют три сг-связи — одну связь С-С н две связи [c.96]
Гибридизация одной s- и трех р-орбиталей (sp -гибридизация), как уже указывалось, объясняет валентности углеродного атома. Образование sp -гибридных связей характерно также и для аналогов углерода — кремния и германия валентности этих элементов также имеют тетраэдрическую направленность. Может возникнуть вопрос — если гибридные орбитали обеспечивают большую концентрацию электронного облака между ядрами и, следовательно, более прочную связь, то почему они не возникают в НаО л Nh4 На да шый вопрос следует ответить, что направленность связей в этих соединениях также можно объяснить sp -гибридизацией. Такой подход является даже более точным, чем изложенный на стр. 161 и 162. Не следует, однако, забывать, что оба подхода являются приближенными. При образовании молекулы HjO атом кислорода люжет приобретать конфигурацию наружного слоя где Ф2, Фз и — sp -гибридные волновые функции верхние индексы указывают количество электронов, занимающих данную орбиталь. Таким образом, две из четырех гибридных орбиталей атома кислорода заняты неспаренньши электронами и могут образовать химические связи угол между этими связями должен составлять 109,5°. Это значение ближе к экспериментальному (104,5°), чем величина 90°, даваемая схемой, рассмотренной на стр. 161. Однако если на стр. 161—162 пришлось объяснять отклонение теоретической величины от экспериментальной для молекулы HjO, то здесь нужно объяснить, почему углы между связями у аналогов воды HjS, HaSe и НаТе заметно отличаются от 109,5°. Это объясняется действием ряда факторов. В частности, в соединениях, содержащих большие атомы, связь слабая и выигрыш энергии в результате образования связи гибридными орбиталями не компенсирует некоторое возрастание энергии s-электронов, обусловленное их переходом на sp -гнбридные орбитали. Это препятствует гибридизации. Кроме того, как показали точные расчеты, при образовании связи Э—Н 25-орбитали кислорода (и азота) сильнее перекрываются с ls-орбиталями водорода, чем 2р-орбита-ли. Для аналогов кислорода, наоборот, сильнее перекрываются р-орбитали. Это обусловливает больший вклад s-состояний (гибридизацию) в образование химической связи в молекуле Н О, чем в ее аналогах. Поэтому валентные углы в h3S, HjSe и НаТе близки к 90°. [c.168]
chem21.info
