Геном человека — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 23 июля 2018; проверки требуют 19 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 23 июля 2018; проверки требуют 19 правок.Геном человека — совокупность наследственного материала, заключённого в клетке человека. Человеческий геном состоит из 23 пар хромосом, находящихся в ядре, а также митохондриальной ДНК. Двадцать две аутосомы, две половые хромосомы Х и Y, а также митохондриальная ДНК человека содержат вместе примерно 3,1 млрд пар оснований[1].
В ходе выполнения проекта «Геном человека» была определена последовательность ДНК всех хромосом и митохондриальной ДНК. В настоящее время эти данные активно используются по всему миру в биомедицинских исследованиях. Полное секвенирование выявило, что человеческий геном содержит 20—25 тыс. активных генов
ru.wikipedia.org
как это было и как это будет
Это было семь лет назад — 26-го июня 2000 года. На совместной пресс-конференции с участием президента США и премьер-министра Великобритании представители двух исследовательских групп — International Human Genome Sequencing Consortium (IHGSC) и Celera Genomics — объявили о том, что работы по расшифровке генома человека, начавшиеся ещё в 70-х годах, успешно завершены, и черновой его вариант составлен. Начался новый эпизод развития человечества — постгеномная эра.
Что может дать нам расшифровка генома, и стоят ли потраченные средства и усилия достигнутого результата? Фрэнсис Коллинз (Francis S. Collins), руководитель американской программы «Геном человека», в 2000 году дал следующий прогноз развития медицины и биологии в постгеномную эру:
- 2010 год — генетическое тестирование, профилактические меры, снижающие риск заболеваний, и генная терапия до 25 наследственных заболеваний. Медсёстры начинают выполнять медико-генетические процедуры. Широко доступна преимплантационная диагностика, активно обсуждаются ограничения в применении данного метода. В США приняты законы для предотвращения генетической дискриминации и соблюдения конфиденциальности. Практические приложения геномики доступны не всем, особенно это чувствуется в развивающихся странах.
- 2020 год — на рынке появляются лекарства от диабета, гипертонии и других заболеваний, разработанные на основе геномной информации. Разрабатывается терапия рака, прицельно направленная на свойства раковых клеток определенных опухолей. Фармакогеномика становится общепринятым подходом для создания многих лекарств. Изменение способа диагностики психических заболеваний, появление новых способов их лечения, изменение отношения общества к таким заболеваниям. Практические приложения геномики все еще доступны далеко не везде.
- 2030 год — определение последовательности нуклеотидов всего генома отдельного индивида станет обычной процедурой, стоимость которой менее $1000. Каталогизированы гены, участвующие в процессе старения. Проводятся клинические испытания по увеличению максимальной продолжительности жизни человека. Лабораторные эксперименты на человеческих клетках заменены экспериментами на компьютерных моделях. Активизируются массовые движения противников передовых технологий в США и других странах.
- 2040 год — Все общепринятые меры здравоохранения основаны на геномике. Определяется предрасположенность к большинству заболеваний (ещё до рождения). Доступна эффективная профилактическая медицина с учетом особенностей индивида. Болезни определяются на ранних стадиях путем молекулярного мониторинга.
Для многих заболеваний доступна генная терапия. Замена лекарств продуктами генов, вырабатываемыми организмом при ответе на терапию. Средняя продолжительность жизни достигнет 90 лет благодаря улучшению социо-экономических условий. Проходят серьезные дебаты о возможности человека контролировать собственную эволюцию.
Неравенство в мире сохраняется, создавая напряженность на международном уровне.
Как видно из прогноза, геномная информация в недалеком будущем может стать основой лечения и профилактики множества болезней. Без информации о своих генах (а она умещается на стандарный DVD-диск) человек в будущем сможет вылечить разве что насморк у какого-нибудь целителя в джунглях. Это кажется фантастикой? Но когда-то такой же фантастикой была поголовная вакцинация от оспы или интернет (заметьте, в 70-х его еще не существовало)! В будущем генетический код ребенка будут выдавать родителям в роддоме. Теоретически, при наличии такого диска, лечение и предотвращение любых недугов отдельно взятого человека станет сущим пустяком. Профессиональный врач сможет в предельно сжатые сроки поставить диагноз, назначить эффективное лечение, и даже определить вероятность появления разных болезней в будущем. К примеру, современные генетические тесты уже позволяют точно определить степень предрасположенности женщины к раку груди. Почти наверняка, лет через 40–50 ни один уважающий себя врач без генетического кода не захочет «лечить вслепую» — подобно тому, как сегодня хирургия не может обойтись без рентгеновского снимка.
Давайте зададимся вопросом — а достоверно ли сказанное, или, может быть, в действительности всё будет наоборот? Смогут ли люди наконец победить все болезни и придут ли они ко всеобщему счастью? Увы. Начнем с того, что Земля маленькая, и счастья на всех не хватит. По правде сказать, его не хватит даже для половины населения развивающихся стран. «Счастье» предназначено в основном для государств, развитых в плане науки, в частности — наук биологических. Например методика, с помощью которой можно «прочесть» генетический код любого человека, уже давно запатентована. Это отлично отработанная автоматизированная технология — правда, дорогостоящая и очень тонкая. Хочешь, покупай лицензию, а хочешь — придумывай новую методику. Только вот денег на подобную разработку хватит далеко не у всех стран! В итоге ряд государств будет обладать медициной, существенно опережающей уровень остального мира. Естественно, в слаборазвитых странах Красным Крестом будут строиться благотворительные больницы, госпитали и геномные центры. И постепенно это приведет к тому, что генетическая информация пациентов развивающихся стран (которых большинство), сосредоточится у двух-трех держав, финансирующих эту благотворительность. Что можно сделать, имея такую информацию — даже представить трудно. Может, и ничего страшного. Однако возможен и другой исход. Битва за приоритет, сопровождавшая секвенирование генома, наглядно подтверждает важность доступности генетической информации. Давайте кратко вспомним некоторые факты из истории программы «Геном человека».
Противники расшифровки генома считали поставленную задачу нереальной, ведь ДНК человека в десятки тысяч раз длиннее молекул ДНК вирусов или плазмид. Главный аргумент против был: «проект потребует миллиарды долларов, которых недосчитаются другие области науки, поэтому геномный проект затормозит развитие науки в целом. А если все-таки деньги найдутся и геном человека будет расшифрован, то полученная в результате информация не оправдает затрат…» Однако Джеймс Уотсон, один из первооткрывателей структуры ДНК и идеолог программы тотального прочтения генетической информации, остроумно парировал: « лучше не поймать большую рыбу, чем не поймать маленькую» [1], [2]. Аргумент учёного был услышан — проблему генома вынесли на обсуждение в конгресс США, и в итоге была принята национальная программа «Геном человека».
В американском городе Бетесда, что недалеко от Вашингтона, находится один из координационных центров HUGO (HUman Genome Organization). Центр координирует научную работу по теме «Геном человека» в шести странах — Германии, Англии, Франции, Японии, Китае и США. В работу включились учёные из многих стран мира, объединенные в три команды: две межгосударственные — американская Human Genome Project и британская из Wellcome Trust Sanger Institute — и частная корпорация из штата Мериленд, включившаяся в игру чуть позже, — Celera Genomics. Кстати, это пожалуй первый случай в биологии, когда на таком высоком уровне частная фирма соревновалась с межгосударственными организациями.
Борьба происходила с использованием колоссальных средств и возможностей. Как отмечали некоторое время назад российские эксперты, Celera стояла на плечах у программы «Геном Человека», то есть использовала то, что уже было сделано в рамках глобального проекта. Действительно, Celera Genomics подключилась к программе не сначала, а когда проект уже шёл полным ходом. Однако специалисты из Celera усовершенствовали алгоритм секвенирования. Кроме того, по их заказу был построен суперкомпьютер, который позволял складывать выявляемые «кирпичики» ДНК в результирующую последовательность быстрее и точнее. Конечно, все это не давало компании Celera безоговорочного преимущества, однако считаться с ней как с полноправным участником гонки заставило.
Появление Celera Genomics резко повысило напряженность — те, кто был занят в государственных программах, почувствовали жёсткую конкуренцию. Кроме того, после создания компании остро встал вопрос об эффективности использования государственных капиталовложений. Во главе Celera стал профессор Крейг Вентер (Craig Venter) [3], который имел огромный опыт научной работы по государственной программе «Геном человека». Именно он и заявил, что все публичные программы малоэффективны и что в его фирме геном секвенируют быстрее и дешевле. А тут появился ещё один фактор — спохватились крупные фармацевтические компании. Дело в том, что если вся информация о геноме окажется в открытом доступе, они лишатся интеллектуальной собственности, и нечего будет патентовать. Озабоченные этим, они вложили миллиарды долларов в Celera Genomics (с которой, вероятно, было проще договориться). Это еще более укрепило её позиции. В ответ на это коллективам межгосударственного консорциума срочно пришлось повышать эффективность работ по расшифровке генома. Сначала работа шла несогласованно, но потом были достигнуты определенные формы сосуществования — и гонка начала наращивать темп.
Финал был красивым — конкурирующие организации по взаимной договоренности одновременно объявили о завершении работ по расшифровке генома человека [4], [5]. Произошло это, как мы уже писали — 26 июня 2000 года. Но разница во времени между Америкой и Англией вывела на первое место США.

Рисунок 1. «Гонка за генóм», в которой участвовали межгосударственная и частная компании, формально завершилась «ничьей»: обе группы исследователей опубликовали свои достижения практически одновременно. Руководитель частной компании Celera Genomics Крейг Вентер опубликовал свою работу в журнале Science в соавторстве с ~270 учёными, работавшими под его началом [5]. Работа, выполненная международным консорциумом по секвенированию человеческого генома (IHGSC), опубликована в журнале Nature, и полный список авторов насчитывает около 2800 человек, работавших в почти трёх десятках центров по всему миру [4].
Исследования в сумме продлились 15 лет. Создание первого «чернового» варианта генома человека обошлось в 300 миллионов долларов. Однако на все исследования по этой теме, включая сравнительные анализы и решение ряда этических проблем, было выделено в сумме около трех миллиардов долларов. Celera Genomics вложила примерно столько же, правда, она истратила их всего за шесть лет. Цена колоссальная, но эта сумма ничтожна в сравнении с той выгодой, которую получит страна-разработчик от ожидаемой вскоре окончательной победы над десятками серьезных заболеваний. В начале октября 2002 года в интервью «Ассошиэйтед пресс» президент Celera Genomics Крейг Вентер заявил, что одна из его некоммерческих организаций планирует заняться изготовлением компакт-дисков, содержащих максимум информации о ДНК клиента. Предварительная стоимость такого заказа — более 700 тысяч долларов. А одному из первооткрывателей структуры ДНК — доктору Джеймсу Уотсону — уже в этом году были подарены два DVD-диска с его геномом общей стоимостью 1 млн. долларов [6], — как видим, цены падают. Так, вице-президент фирмы 454 Life Sciences Майкл Эгхолм (Michael Egholm) сообщил, что в скором времени компания сможет довести цену расшифровки до 100 тыс. долларов.
Широкая известность и масштабное финансирование — палка о двух концах. С одной стороны, за счет неограниченных средств работа продвигается легко и быстро. Но с другой стороны, результат исследований должен получиться таким, каким его заказывают. К началу 2001 года в геноме человека со стопроцентной достоверностью было идентифицировано больее 20 тыс. генов. Эта цифра оказалось в три раза меньше, чем было предсказано всего за два года до этого. Вторая команда исследователей из Национального института геномных исследований США во главе с Френсисом Коллинсом независимым способом получила те же результаты — между 20 и 25 тыс. генов в геноме каждой человеческой клетки. Однако неопределенность в окончательные оценки внесли два других международных совместных научных проекта. Доктор Вильям Хезелтайн (руководитель фирмы Human Genome Studies) настаивал, что в их банке содержится информация о 140 тыс. генов. И этой информацией он не собирается пока делиться с мировой общественностью. Его фирма вложила деньги в патенты и собирается зарабатывать на полученной информации, поскольку она относится к генам широко распространенных болезней человека. Другая группа заявила о 120 тыс. идентифицированных генов человека и также настаивала, что именно эта цифра отражает общее число генов человека.
Тут необходимо уточнить, что эти исследователи занимались расшифровкой последовательности ДНК не самого генома, а ДНК-копий информационных (называемых также матричными) РНК (иРНК или мРНК). Другими словами, исследовался не весь геном, а только та его часть, что перекодируется клеткой в мРНК и направляет синтез белков. Поскольку один ген может служить матрицей для производства нескольких различных видов мРНК (что определяется многими факторами: тип клетки, стадия развития организма и т. д.), то и суммарное число всех различных последовательностей мРНК (а это именно то, что запатентовала Human Genome Studies) будет значительно бóльшим. Скорее всего, использовать это число для оценки количества генов в геноме просто некорректно.
Очевидно, что наспех «приватизированная» генетическая информация будет в ближайшие годы тщательно проверяться, пока точное число генов станет, наконец, общепринятым. Но настораживает тот факт, что в процессе «познания» патентуется вообще все, что только можно запатентовать. Тут даже не шкура не убитого медведя, а вообще все, что находилось в берлоге, было поделено! Кстати, на сегодня дебаты сбавили обороты, и геном человека официально насчитывает только 21667 генов (версия NCBI 35, датированная октябрём 2005 года). Следует отметить, что пока большая часть информации всё-таки остаётся общедоступной. Сейчас существуют базы данных, в которых аккумулирована информация о структуре генома не только человека, но и геномов многих других организмов (например, EnsEMBL). Однако попытки получить исключительные права на использование каких-либо генов или последовательностей в коммерческих целях всегда были, есть сейчас и будут предприниматься впредь.
На сегодня основные цели структурной части программы уже в основном выполнены — геном человека почти полностью прочитан. Первый, «черновой» вариант последовательности, опубликованный в начале 2001 года [4], был далек от совершенства. В нём отсутствовало приблизительно 30% последовательности генома в целом, из них около 10% последовательности так называемого эухроматина — богатых генами и активно экспрессирующихся участков хромосом. Согласно последним подсчётам, эухроматин составляет примерно 93,5% от всего генома [7]. Оставшиеся же 6,5% приходятся на гетерохроматин — эти участки хромосом бедны генами и содержат большое количество повторов, которые представляют серьезные трудности для ученых, пытающихся прочесть их последовательность [8]. Более того, считается, что ДНК в гетерохроматине находится в неактивном состоянии и не экспрессируется. (Этим можно объяснить такое «невнимание» ученых к оставшимся «малым» процентам человеческого генома.) Но даже имевшиеся на 2001 год «черновые» варианты эухроматиновых последовательностей содержали большое количество разрывов, ошибок и неверно соединенных и ориентированных фрагментов. Нисколько не умаляя значения для науки и ее приложений появление этого «черновика», стоит однако отметить, что использование этой предварительной информации в крупномасштабных экспериментах по анализу генома в целом (например, при исследовании эволюции генов или общей организации генома) выявило множество неточностей и артефактов. Поэтому дальнейшая и не менее кропотливая работа, «последние вершки», была абсолютно необходима.

Рисунок 2. Слева: Автоматизированная линия подготовки образцов ДНК для секвенирования в Центре Геномных исследований института Уайтхеда. Справа: Лаборатория в Сэнгеровском институте, заполненная автоматами для высокопроизводительной расшифровки последовательностей ДНК.
Завершение расшифровки заняло еще несколько лет и привело почти что к удвоению стоимости всего проекта. Однако уже в 2004 г. было объявлено, что эухроматин прочитан на 99% с общей точностью одна ошибка на 100 000 пар оснований. Количество разрывов уменьшилось в 400 раз. Аккуратность и полнота прочтения стала достаточной для эффективного поиска генов, отвечающих за то или иное наследственное заболевание (например, диабет или рак груди). Практически это означает, что исследователям больше не надо заниматься трудоемким подтверждением последовательностей генов, с которыми они работают, так как можно полностью положиться на определенную и доступную каждому последовательность всего генома.
Таким образом, изначальный план проекта был значительно перевыполнен. Помогло ли это нам в понимании того, как устроен и работает наш геном? Безусловно. Авторы статьи в Nature, в которой был опубликован «окончательный» (на 2004 год) вариант генома [7], провели с его использованием несколько анализов, которые были бы абсолютно бессмысленны, имей они на руках только «черновую» последовательность. Оказалось, что более тысячи генов «родились» совсем недавно (по эволюционным меркам, конечно) — в процессе удвоения исходного гена и последующего независимого развития дочернего гена и гена-родителя. А чуть меньше сорока генов недавно «умерли», накопив мутации, сделавшие их совершенно неактивными. Другая статья, вышедшая в том же номере журнала Nature, прямо указывает на недостатки метода, использованного учеными из Celera [9]. Следствием этих недостатков стали пропуски многочисленных повторов в прочитанных последовательностях ДНК и, как результат, недооценённая длина и сложность всего генома. Чтобы не повторять подобных ошибок в будущем, авторы статьи предложили использовать гибридную стратегию — комбинацию высокоэффективного подхода, использовавшегося учеными из Celera, и сравнительно медленного и трудоемкого, но и более надежного метода, применявшегося исследователями из IHGSC.
Куда дальше будет направлено беспрецедентное исследование «Геном человека»? Кое-что об этом можно сказать уже сейчас. Основанный в сентябре 2003 года международный консорциум ENCODE (ENCyclopaedia Of DNA Elements) поставил своей целью обнаружение и изучение «управляющих элементов» (последовательностей) в геноме человека. Действительно, ведь 3 млрд. пар оснований (а именно такова длина генома человека) содержат всего лишь 22 тыс. генов, разбросанных в этом океане ДНК непонятным для нас образом. Что управляет их экспрессией? Зачем нам такой избыток ДНК? Действительно ли он является балластом, или же все-таки проявляет себя, обладая какими-то неизвестными функциями [10]?
Для начала, в качестве пилотного проекта, ученые из ENCODE «пристально вгляделись» в последовательность, составляющую 1% от генома человека (30 млн. пар оснований), используя новейшее оборудование для исследований в молекулярной биологии. Результаты были опубликованы в апреле нынешнего года в Nature [11]. Оказалось, что бóльшая часть генома человека (в том числе участки, считавшиеся ранее «молчащими») служит матрицей для производства различных РНК, многие из которых не являются информационными, поскольку не кодируют белков. Многие из этих «некодирующих» РНК перекрываются с «классическими» генами (участками ДНК, кодирующими белки). Неожиданным результатом было и то, как регуляторные участки ДНК были расположены относительно генов, экспрессией которых они управляли. Последовательности многих из этих участков мало изменялись в процессе эволюции, в то время как другие участки, считавшиеся важными для управления клеткой, мутировали и изменялись в процессе эволюции с неожиданно высокой скоростью [10]. Все эти находки поставили большое количество новых вопросов, ответы на которые можно получить лишь в дальнейших исследованиях.
Другая задача, решение которой станет делом недалекого будущего, — определение последовательности оставшихся «малых» процентов генома, составляющих гетерохроматин, т. е. бедных генами и богатых повторами участков ДНК, необходимых для удвоения хромосом в процессе деления клетки. Наличие повторов делает задачу расшифровки этих последовательностей неразрешимой для существующих подходов, и, следовательно, требует изобретения новых методов. Поэтому не удивляйтесь, когда году в 2010 выйдет очередная статья, объявляющая об «окончании» расшифровки генома человека — в ней будет рассказано о том, как был «взломан» гетерохроматин.
Конечно, сейчас в нашем распоряжении имеется лишь некий «усредненный» вариант человеческого генома. Образно говоря — мы сегодня имеем лишь самое общее описание конструкции автомобиля: мотор, ходовая часть, колёса, руль, сиденья, краска, обивка, бензин с маслом и т. д. Ближайшее рассмотрение полученного результата свидетельствует о том, что впереди — годы работ по уточнению наших знаний по каждому конкретному геному. Программа «Геном человека» не прекратила свое существование, она лишь меняет ориентацию: от структурной геномики осуществляется переход к геномике функциональной, предназначенной установить, как управляются и работают гены. Более того, все люди на уровне генов отличаются так же, как одни и те же модели автомобилей отличаются различными вариантами исполнения одних и тех же агрегатов. Не только отдельные основания в последовательностях генов двух разных людей могут отличаться, но и количество копий крупных фрагментов ДНК, порой включающих в себя несколько генов, может сильно варьировать. А это означает, что на передний план выходят работы по детальному сравнению геномов, скажем, представителей различных человеческих популяций, этнических групп, и даже здоровых и больных людей. Современные технологии позволяют быстро и точно проводить такие сравнительные анализы, а ведь еще лет десять назад об этом никто и не мечтал. Изучением структурных вариаций человеческого генома занимается очередное международное научное объединение. В США и Европе значительные средства выделяются на финансирование биоинформатики — молодой науки, возникшей на стыке информатики, математики и биологии, без которой никак не разобраться в безграничном океане информации, накопленном в современной биологии. Биоинформационные методы помогут нам ответить на многие интереснейшие вопросы — «как происходила эволюция человека?», «какие гены определяют те или иные особенности человеческого организма?», «какие гены ответственны за предрасположенность к болезням?» Знаете, как говорят англичане: “This is the end of the beginning” — «Это конец начала». Вот именно эта фраза точно отражает нынешнюю ситуацию [12]. Начинается самое главное и — я совершенно уверен — самое интересное: накопление результатов, их сравнение и дальнейший анализ.
«…Сегодня мы выпускаем в свет первое издание „Книги жизни“ с нашими инструкциями, — сказал в эфире телеканала «Россия» Фрэнсис Коллинз. — Мы будем обращаться к нему десятки, сотни лет. И уже скоро люди зададутся вопросом, как они могли обходиться без этой информации».
Другую точку зрения можно проиллюстрировать, процитировав академика Кордюма В. А.:
«…Надежды же на то, что новая информация о функциях генома будет полностью открытой, чисто символические. Можно прогнозировать, что возникнут (на базе уже имеющихся) гигантские центры, которые смогут все данные соединить в одно связное целое, некую электронную версию Человека и реализовывать её практически — в гены, белки, клетки, ткани, органы и что угодно ещё. Но во что? Угодное кому? Для чего? В процессе работ по программе „геном человека“ стремительно совершенствовались методы и аппаратура для определения первичной последовательности ДНК. В крупнейших центрах это превратилось в некое подобие заводской деятельности. Но даже на уровне лабораторных индивидуальных приборов (вернее их комплексов) уже создано столь совершенное оборудование, что оно способно определить за три месяца такую по объему последовательность ДНК, которая равна всему геному человека. Не удивительно, что возникла (и тут же начала стремительно реализоваться) идея определения геномов индивидуальных людей. Безусловно, это очень интересно — сравнить отличия разных индивидуумов на уровне их первоосновы. Польза от такого сравнения тоже несомненная. Можно будет установить, у кого имеются какие нарушения в геноме, прогнозировать их последствия и устранить то, что может привести к болезням. Здоровье будет гарантированным, да и жизнь продлится весьма существенно. Это с одной стороны. С другой же стороны всё совсем не очевидно. Получить и проанализировать всю наследственность индивидуума означает получение полного, исчерпывающего биологического досье на него. Оно, при желании того, кто его знает, позволит столь же исчерпывающе делать с человеком всё что угодно. По уже известной цепочке: клетка — молекулярная машина; человек состоит из клеток; клетка во всех своих проявлениях и во всём диапазоне возможных ответов, записана в геноме; с геномом можно ограниченно уже и сегодня манипулировать, а в обозримом будущем вообще манипулировать практически как угодно…»
Однако, наверное, пугаться таких мрачных прогнозов еще рано (хотя знать о них, безусловно, нужно). Для их осуществления надо полностью перестраивать многие социальные и культурные традиции. Очень хорошо по этому поводу сказал в интервью доктор биологических наук Михаил Гельфанд, и. о. заместителя директора Института проблем передачи информации РАН: «…если у вас есть, предположим, один из пяти генов, предопределяющих развитие шизофрении, то что может случиться, если эта информация — ваш геном — попала в руки вашего потенциального работодателя, который ничего в геномике не понимает! (и как следствие — вас на работу могут не принять, посчитав это рискованным; и это не смотря на то, что шизофрении у вас нет и не будет — прим. автора.) Другой аспект: с появлением индивидуализированной медицины, основанной на геномике, полностью изменится страховая медицина. Ведь одно дело — предусматривать риски неизвестные, а другое дело — совершенно определенные. Если честно, то все западное общество в целом, не только российское, к геномной революции сейчас не готово…» [13].
Действительно, чтобы разумно пользоваться новой информацией, надо ее понимать. А для того чтобы понять геном — не просто прочитать, этого далеко не достаточно, — нам потребуются десятилетия. Слишком уж сложная картина вырисовывается, и чтобы осознать её, нам надо будет поменять многие стереотипы. Поэтому на самом деле расшифровка генома ещё продолжается и будет продолжаться. И будем ли мы стоять в стороне или станем, наконец, активными участниками этой гонки — зависит от нас.
- Киселёв Л. (2001). Новая биология началась в феврале 2001 года. «Наука и Жизнь»;
- Киселёв Л. (2002). Вторая жизнь генома: от структуры к функции. «Знание–Сила». 7;
- Смыслы «жизни»;
- Eric S. Lander, Lauren M. Linton, Bruce Birren, Chad Nusbaum, Michael C. Zody, et. al.. (2001). Initial sequencing and analysis of the human genome. Nature. 409, 860-921;
- J. Craig Venter, Mark D. Adams, Eugene W. Myers, Peter W. Li, Richard J. Mural, et. al.. (2001). The Sequence of the Human Genome. Science. 291, 1304-1351;
- Геном Нобелевского лауреата Джеймса Уотсона скоро будет расшифрован;
- International Human Genome Sequencing Consortium. (2004). Finishing the euchromatic sequence of the human genome. Nature. 431, 931-945;
- Геном человека: полезная книга, или глянцевый журнал?;
- Xinwei She, Zhaoshi Jiang, Royden A. Clark, Ge Liu, Ze Cheng, et. al.. (2004). Shotgun sequence assembly and recent segmental duplications within the human genome. Nature. 431, 927-930;
- «Мусорная» ДНК управляет эволюцией млекопитающих?;
- Ewan Birney, The ENCODE Project Consortium, John A. Stamatoyannopoulos, Anindya Dutta, Roderic Guigó, et. al.. (2007). Identification and analysis of functional elements in 1% of the human genome by the ENCODE pilot project. Nature. 447, 799-816;
- Lincoln D. Stein. (2004). Human genome: End of the beginning. Nature. 431, 915-916;
- Гельфанд М. (2007). Постгеномная эра. «Коммерческая биотехнология».
biomolecula.ru
ГЕНОМ ЧЕЛОВЕКА | Энциклопедия Кругосвет
Содержание статьиГЕНОМ ЧЕЛОВЕКА, международная программа, конечной целью которой является определение нуклеотидной последовательности (секвенирование) всей геномной ДНК человека, а также идентификация генов и их локализация в геноме (картирование). Исходная идея проекта зародилась в 1984 среди группы физиков, работавших в Министерстве энергетики США и желавших заняться другой задачей после завершения работ в рамках ядерных проектов.
В 1988 Объединенный комитет, куда входили Министерство энергетики США и Национальные институты здоровья, представили обширный проект, в задачи которого – помимо секвенирования генома человека – входило всестороннее изучение генетики бактерий, дрожжей, нематоды, плодовой мушки и мыши (эти организмы широко использовались в качестве модельных систем в изучении генетики человека). Кроме того, предусматривался детальный анализ этических и социальных проблем, возникающих в связи с работой над проектом. Комитету удалось убедить Конгресс выделить на проект 3 млрд. долларов (один нуклеотид ДНК – за один доллар), в чем немалую роль сыграл ставший во главе проекта Нобелевский лауреат Дж.Уотсон. Вскоре к проекту присоединились другие страны (Англия, Франция, Япония и др.). В России в 1988 с идеей секвенирования генома человека выступил академик А.А.Баев, и в 1989 в нашей стране был организован научный совет по программе «Геном человека».
В 1990 была создана Международная организация по изучению генома человека (HUGO), вице-президентом которой в течение нескольких лет был академик А.Д.Мирзабеков. С самого начала работ по геномному проекту ученые договорились об открытости и доступности всей получаемой информации для его участников независимо от их вклада и государственной принадлежности. Все 23 хромосомы человека были поделены между странами-участницами. Российские ученые должны были исследовать структуру 3-й и 19-й хромосом. Вскоре финансирование этих работ в нашей стране было урезано, и реального участия в секвенировании Россия не принимала. Программа геномных исследований в нашей стране была полностью перестроена и сконцентрирована на новой области – биоинформатике, которая пытается с помощью математических методов понять и осмыслить все, что уже расшифровано.
Закончить работу предполагалось через 15 лет, т.е. примерно к 2005. Однако скорость секвенирования с каждым годом возрастала, и если в первые годы она составляла несколько миллионов нуклеотидных пар за год по всему миру, то на исходе 1999 частная американская фирма «Celera», возглавляемая Дж.Вентером (J.Venter), расшифровывала не менее 10 млн. нуклеотидных пар в сутки. Этого удалось достичь благодаря тому, что секвенирование осуществляли 250 роботизированных установок; они работали круглосуточно, функционировали в автоматическом режиме и сразу же передавали всю информацию непосредственно в банки данных, где она систематизировалась, аннотировалась и становилась доступной ученым всего мира. Кроме того, фирма «Celera» широко использовала данные, полученные в рамках Проекта другими его участниками, а также разного рода предварительные данные. 6 апреля 2000 состоялось заседание Комитета по науке Конгресса США, на котором Вентер заявил, что его компания завершила расшифровку нуклеотидной последовательности всех существенных фрагментов генома человека и что предварительная работа по составлению нуклеотидной последовательности всех генов (предполагалось, что их 80 тыс. и что они содержат примерно 3 млрд. нуклеотидов) будет завершена через 3–6 недель, т.е. гораздо раньше, чем планировалось.
Доклад был сделан в присутствии представителя HUGO, крупнейшего специалиста по секвенированию д-ра Р.Уотерсона. Расшифрованный фирмой «Celera» геном принадлежал анонимному мужчине, т.е. содержал как X-, так и Y-хромосомы, а HUGO использовали в своих исследованиях материал, полученный от разных людей. Между Вентером и HUGO велись переговоры о совместной публикации результатов, однако они закончились безрезультатно из-за разногласий по поводу того, что считать завершением расшифровки генома. По мнению компании «Celera», об этом можно говорить лишь в том случае, если гены полностью секвенированы и известно, как расшифрованные сегменты располагаются в молекуле ДНК. Этому требованию удовлетворяли результаты «Celera», в то время как результаты HUGO не позволяли однозначно определить взаимное положение расшифрованных участков. В результате в феврале 2001 в специальных выпусках двух авторитетнейших научных журналов, «Science» и «Nature», были раздельно опубликованы результаты исследований «Celera» и HUGO и приведены полные нуклеотидные последовательности генома человека, охватывающие около 90% его длины.
Общебиологическое значение исследований, проведенных в рамках Проекта.
Исследования генома человека «потянули» за собой секвенирование геномов огромного числа других организмов, гораздо более простых; без геномного проекта эти данные были бы получены гораздо позже и в гораздо меньшем объеме. Их расшифровка ведется все возрастающими темпами. Первым крупным успехом стало полное картирование в 1995 генома бактерии Haemophilus influenzae, позже были полностью расшифрованы геномы более 20 бактерий, среди которых – возбудители туберкулеза, сыпного тифа, сифилиса и др. В 1996 картировали геном первой эукариотической клетки (клетки, содержащей оформленное ядро) – дрожжевой, а в 1998 впервые секвенировали геном многоклеточного организма – круглого червя Caenorhabolits elegans (нематоды). Завершена расшифровка генома первого насекомого – плодовой мушки дрозофилы и первого растения – арабидопсиса. У человека уже установлено строение двух самых маленьких хромосом – 21-й и 22-й. Все это создало основы для создания нового направления в биологии – сравнительной геномики.
Знание геномов бактерий, дрожжей и немтоды дает биологам-эволюционистам уникальную возможность сравнения не отдельных генов или их ансамблей, а целиком геномов. Эти гигантские объемы информации только начинают осмысливаться, и нет сомнения, что нас ждет появление новых концепций в биологической эволюции. Так, многие «личные» гены нематоды, в отличие от генов дрожжей, скорее всего связаны с межклеточными взаимодействиями, характерными именно для многоклеточных организмов. У человека генов только в 4–5 раз больше, чем у нематоды, следовательно, часть его генов должна иметь «родственников» среди известных теперь генов дрожжей и червя, что облегчает поиск новых генов человека. Функции неизвестных генов нематоды изучать гораздо проще, чем у аналогичных генов человека: в них легко вносить изменения (мутации) или выводить их из строя, одновременно прослеживая изменения свойств организма. Выявив биологическую роль генных продуктов у червя, можно экстраполировать эти данные на человека. Другой подход – подавление активности генов с помощью особых ингибиторов и отслеживание изменений в поведении организма.
Весьма нтересным представляется вопрос о соотношении кодирующих и некодирующих областей в геноме. Как показывает компьютерный анализ, у C.elegans примерно равные доли – 27 и 26% соответственно – занимают в геноме экзоны (участки гена, в которых записана информация о структуре белка или РНК) и интроны (участки гена, не несущие подобной информации и вырезаемые при образовании зрелой РНК). Остальные 47% генома приходится на повторы, межгенные участки и т.д., т.е. на ДНК с неизвестными функциями. Сравнив эти данные с дрожжевым геномом и геномом человека, мы увидим, что доля кодирующих участков в расчете на геном в ходе эволюции резко уменьшается: у дрожжей она очень высока, у человека очень мала. Налицо парадокс: эволюция эукариот от низших форм к высшим сопряжена с «разбавлением» генома – на единицу длины ДНК приходится все меньше информации о структуре белков и РНК и все больше информации «ни о чем», на самом деле просто непонятой и непрочитанной нами. Много лет назад Ф.Крик, один из авторов «двойной спирали» – модели ДНК, – назвал эту ДНК «эгоистической», или «мусорной». Возможно, какая-то часть ДНК человека действительно относится к такому типу, однако теперь ясно, что основная доля «эгоистической» ДНК сохраняется в ходе эволюции и даже увеличивается, т.е. почему-то дает ее обладателю эволюционные преимущества. Никаких объяснений такого феномена в настоящее время не существует, и без детального анализа нуклеотидных последовательностей геномных ДНК их дать невозможно.
Еще один важный результат, имеющий общебиологическое (и практическое) значение – вариабельность генома. Вообще говоря, геном человека высококонсервативен. Мутации в нем могут либо повредить его, и тогда они приводят к тому или иному дефекту или гибели организма, либо оказаться нейтральными. Последние не подвергаются отбору, поскольку не имеют фенотипического проявления. Однако они могут распространяться в популяции, и если их доля превышает 1%, то говорят о полиморфизме (многообразии) генома. В геноме человека очень много участков, различающихся всего одним-двумя нуклеотидами, но передающихся из поколения в поколение. С одной стороны, этот феномен мешает исследователю, поскольку ему приходится разбираться, имеет ли место истинный полиморфизм или это просто ошибка секвенирования, а с другой – создает уникальную возможность для молекулярной идентификации отдельного организма. С теоретической точки зрения вариабельность генома создает основу генетики популяций, которая ранее основывалась на чисто генетических и статистических данных.
Практические приложения.
Самые большие надежды и ученые, и общество возлагают на возможность применения результатов секвенирования генома человека для лечения генетических заболеваний. К настоящему времени в мире идентифицировано множество генов, ответственных за многие болезни человека, в том числе и такие серьезные, как болезнь Альцгеймера, муковисцидоз, мышечная дистрофия Дюшенна, хорея Гентингтона, наследственный рак молочной железы и яичников. Структуры этих генов полностью расшифрованы, а сами они клонированы. Еще в 1999 была установлена структура 22-й хромосомы и определены функции половины ее генов. С дефектами в них связано 27 различных заболеваний, в том числе шизофрения, миелолейкоз и трисомия 22 – вторая по распространенности причина спонтанных абортов. Самым эффективным способом лечения таких больных была бы замена дефектного гена здоровым. Для этого, во-первых, необходимо знать точную локализацию гена в геноме, а во-вторых – чтобы ген попал во все клетки организма (или хотя бы в большинство), а это при современных технологиях невозможно. Кроме того, даже попавший в клетку нужный ген мгновенно распознается ею как чужой, и она пытается избавиться от него. Таким образом, «вылечить» удается только часть клеток и только на время. Еще одно серьезное препятствие на пути применения генной терапии – мультигенная природа многих заболеваний, т.е. их обусловленность более чем одним геном. Итак, массового применения генной терапии в ближайшем будущем вряд ли стоит ожидать, хотя успешные примеры такого рода уже есть: удалось добиться существенного облегчения состояния ребенка, страдающего тяжелым врожденным иммунодефицитом, путем введения ему нормальных копий поврежденного гена. Исследования в этой области ведутся по всему миру, и, может быть, успехи будут достигнуты раньше, чем предполагается, как это и произошло с секвенированием генома человека.
Еще одно важное применение результатов секвенирования – идентификация новых генов и выявление среди них тех, которые обусловливают предрасположенность к тем или иным заболеваниям. Так, есть данные о генетической предрасположенности к алкоголизму и наркомании, открыто уже семь генов, дефекты в которых приводят к токсикомании. Это позволит проводить раннюю (и даже пренатальную) диагностику заболеваний, предрасположенность к которым уже установлена.
Широкое применение несомненно найдет и еще один феномен: обнаружилось, что разные аллели одного гена могут обусловливать разные реакции людей на лекарственные препараты. Фармацевтические компании планируют использовать эти данные для производства лекарств, предназначенных разным группам пациентов. Это поможет избежать побочных эффектов терапии, снизить миллионные затраты. Возникает целая новая отрасль – фармакогенетика, которая изучает, как те или иные особенности строения ДНК могут повлиять на эффективность лечения. Появятся совершенно новые подходы к созданию лекарственных средств, основанные на открытии новых генов и изучении их белковых продуктов. Это позволит перейти от неэффективного метода «проб и ошибок» к целенаправленному синтезу лекарственных веществ.
Важный практический аспект вариабельности генома – возможность идентификации личности. Чувствительность методов «геномной дактилоскопии» такова, что достаточно одной капли крови или слюны, одного волоса, чтобы с абсолютной достоверностью (99,9%) установить родственные связи между людьми. После секвенирования генома человека этот метод, использующий теперь не только специфические маркеры в ДНК, но и однонуклеотидный полиморфизм, станет еще более надежным. Вариабельность генома породила направление геномики – этногеномику. Этнические группы, населяющие Землю, имеют некоторые групповые генетические признаки, характерные для данного этноса. Получаемая информация в ряде случаев может подтвердить или опровергнуть те или иные гипотезы, циркулирующие в рамках таких дисциплин, как этнография, история, археология, лингвистика. Еще одно интересное направление – палеогеномика, занимающаяся исследованием древней ДНК, извлеченной из останков, найденных в могильниках и курганах.
Проблемы и опасения.
Финансирование «геномной гонки» и участие в ней тысяч специалистов основывались прежде всего на постулате, что расшифровка нуклеотидной последовательности ДНК сможет решить фундаментальные проблемы генетики. Оказалось, однако, что лишь 30% генома человека кодируют белки и участвуют в регуляции действия генов в ходе развития. Каковы функции остальных участков ДНК и есть ли они вообще – остается совершенно неясным. Около 10% генома человека составляют так называемые Alu-элементы длиной 300 п.н. Они появились неизвестно откуда в ходе эволюции у приматов, и только у них. Попав к человеку, они размножались до полумиллиона копий и распределились по хромосомам самым причудливым образом, то образуя сгустки, то прерывая гены.
Другая проблема касается самих кодирующих участков ДНК. При чисто молекулярно-компьютерном анализе возведение этих участков в ранг генов требует соблюдения сугубо формальных критериев: есть в них знаки пунктуации, необходимые для прочитывания информации, или нет, т.е. синтезируется ли на них конкретный генный продукт и что он собой представляет. В то же время роль, время и место действия большинства потенциальных генов пока неясны. По мнению Вентера, для определения функций всех генов может потребоваться не меньше ста лет.
Далее необходимо договориться, что вкладывать в само понятие «геном». Часто под геномом понимается лишь генетический материал как таковой, однако с позиции генетики и цитологии его составляет не только структура элементов ДНК, но и характер связей между ними, который определяет, как гены будут работать и как пойдет индивидуальное развитие при определенных условиях среды. И наконец, нельзя не упомянуть о феномене так называемой «неканонической наследственности», привлекшем к себе внимание в связи с эпидемией «коровьего бешенства». Эта болезнь стала распространяться в Великобритании в 1980-х годах после того, как в корм коровам стали добавлять переработанные головы овец, среди которых встречались овцы, больные скрэпи (нейродегенеративное заболевание). Сходная болезнь стала передаваться людям, употреблявшим в пищу мясо больных коров. Обнаружилось, что инфекционным агентом являются не ДНК или РНК, а белки прионы (от англ. prions, protein infections particles, белковые инфекционные частицы). Проникая в клетку-хозяина, они изменяют конформацию нормальных белков-аналогов. Феномен прионов обнаружен также у дрожжей.
Таким образом, попытка представить расшифровку генома как чисто научно-техническую задачу несостоятельна. А между тем такой взгляд широко пропагандируется даже весьма авторитетными учеными. Так, в книге Код кодов (The Code of Codes, 1993) У.Гилберт, открывший один из методов секвенирования ДНК, рассуждает о том, что определение нуклеотидной последовательности всей ДНК человека приведет к изменениям в наших представлениях о самих себе. «Три миллиарда пар оснований могут быть записаны на одном компакт-диске. И любой может вытащить из кармана свой диск и сказать: «Вот он – Я!» Между тем необходимо знать не только порядок следования звеньев в цепи ДНК и не только взаимное расположение генов и их функции. Важно выяснить характер связей между ними, который определяет, как гены будут работать в конкретных условиях – внутренних и внешних. Ведь многие болезни человека обусловливаются не дефектами в самих генах, а нарушениями их согласованных действий, системы их регуляции.
Расшифровка генома человека и других организмов не только привела к прогрессу во многих областях биологии, но и породило множество проблем. Одна из них – идея «генетического паспорта», в котором будет указано, несет ли данный человек опасную для здоровья мутацию. Предполагается, что эти сведения будут конфиденциальными, но никто не может гарантировать, что не произойдет утечки информации. Прецедент уже был в случае «генетической паспортизации» афроамериканцев с той целью, чтобы определить, являются ли они носителями гена гемоглобина, содержащего мутацию, которая связана с серповидноклеточной анемией. Эта мутация распространена в Африке в малярийных районах, и если она присутствует в одном аллеле, то обеспечивает носителю устойчивость к малярии, обладатели же двух копий (гомозиготы) умирают в раннем детстве. В 1972 в рамках борьбы с малярией на «паспортизацию» было истрачено более 100 млн. долл., а после выполнения программы выяснилось, что а) у здоровых людей, носителей мутации, возникает комплекс вины, эти люди чувствуют себя не совсем нормальными, и такими их начинают воспринимать окружающие; б) появились новые формы сегрегации – отказ в приеме на работу. В настоящее время некоторые страховые компании выделяют средства на проведение ДНК-тестов в отношении ряда заболеваний, и если будущие родители, носители нежелательного гена, не соглашаются на прерывание беременности и у них рождается больной ребенок, им могут отказать в социальной поддержке.
Другая опасность – эксперименты по трансгенозу, созданию организмов с пересаженными от других видов генами, и распространению таких «химер» в окружающей среде. Здесь особую опасность представляет необратимость процесса. Если атомную станцию можно закрыть, использование ДДТ и аэрозолей прекратить, то изъять из биологической системы новый организм невозможно. Мобильные гены, открытые МакКлинток у растений, и сходные с ними плазмиды микроорганизмов передаются в природе от вида к виду. Ген, вредный или полезный (с точки зрения человека) для одного вида, может со временем перейти к другому виду и непредсказуемым образом изменить характер своего действия. В Америке мощная биотехнологическая компания «Монсанто» создала сорт картофеля, в клетки которого включен бактериальный ген, кодирующий токсин, который убивает личинок колорадского жука. Утверждается, что этот белок безвреден для человека и животных, однако страны Европы не дали разрешения на выращивание у себя этого сорта. Картофель испытывается в России. Опыты с трансгенными растениями предусматривают строжайшую изоляцию делянок с подопытными растениями, однако на охраняемых полях с трансгенными растениями Института фитопатологии в Голицыне под Москвой ремонтные рабочие выкопали картошку и тут же ее съели. На юге Франции ген устойчивости к насекомым «перескочил» от культурных растений к сорнякам. Другой пример опасного трансгеноза – выпуск в озера Шотландии лосося, который набирает вес в 10 раз быстрее, чем обычный лосось. Существует опасность, что этот лосось попадет в океан и нарушит сложившееся популяционное равновесие у других видов рыб.
www.krugosvet.ru
Геном человека — Лекция — Геном человека
Лекция — Геном человека
скачать (61 kb.)
Доступные файлы (1):
содержание
1.doc
Реклама MarketGid:Геном человека
Расшифровка генома человека – событие столь же важное в истории человечества, как открытие электричества, изобретение радио или создание компьютеров.
Немного истории. В 1988 году Национальный институт здоровья США начал проект «Геном человека», возглавил который нобелевский лауреат Джеймс Уотсон. Основная цель проекта – выяснить последовательность нуклеотидных оснований во всех молекулах ДНК человека и установить локализацию, т.е. полностью картировать все гены человека.
Планировалось, что работа но определению нуклеотидной последовательности ДНК человека (секвенирование ДНК) должна окончиться в 2005-м году. Однако после первого года работы стало ясно, что скорости секвениронания ДНК очень низкие и для полного завершения работы такими темпами потребуется около 100 лет.
Стало очевидно, что необходим поиск новых технологий секвенирования, создание новой вычислительной техники и оригинальных компьютерных программ. Это было невыполнимо в рамках отдельно взятого государства, и к программе подключились другие страны.
Широкомасштабные координированные исследования стали проводиться под эгидой международной организации ^ С 1989 г. в проект включилась и Россия. Все хромосомы человека были поделены между странами-участницами, и России для исследования достались 3-, 13- и 19-я хромосомы. В проекте оказались задействованы несколько тысяч ученых из 20 стран.
В 1996 были созданы всемирные банки данных по ДНК человека. Любая вновь определенная последовательность нуклеотидов размером более 1 тыс. оснований должна была быть обнародована через Интернет в течение суток после ее расшифровки, в противном случае статьи с этими данными в научные журналы не принимались. Любой специалист в мире мог воспользоваться этой информацией.
К началу 1998 г. было секвенировано всего около ^ . В это время к работе неожиданно подключилась частная американская компания из штата Мериленд «Celera Genomics» под руководством Крега Вентера, которая объявила, что закончит свою работу на 4 года раньше международного консорциума.
Началась беспримерная в науке гонка. Два коллектива работали независимо, не жалея сил, чтобы придти к финишу первыми. В ходе выполнения проекта «Геном человека» было разработано много новых методов исследования, большинство из которых значительно ускоряет и удешевляет работу по расшифровке ДНК. Эти методы анализа сейчас используются в медицине, криминалистике и т.д.
В июне 2000 года два конкурирующих коллектива объединили свои данные, официально объявив о завершении работ. А в феврале 2001 года появились научные публикации чернового варианта структуры генома человека. Качество секвенирования достаточно высокое и предполагает всего 1 ошибку на 50 тыс.п.н.
«Геном человека» вошел в историю как один из самых трудоемких и дорогостоящих проектов. На него было потрачено в сумме более ^
Возникает естественный вопрос: геном какого же человека определен в результате этих титанических усилий, кто этот конкретный человек? Согласно имеющимся данным, фирма Celera в основном ориентировалась на геном одного человека, о котором известно лишь, что это белый мужчина среднего возраста. Скорее всего, это был сам глава корпорации Крег Вентер. Международный консорциум использовал в своей работе материал не менее семи различных людей.
Геном человека состоит из 24 хромосом и 3,2 млрд. п.н. Хромосомы человека были пронумерованы согласно размеру: наибольший — у хромосомы 1, наименьший — у хромосомы 22. Со временем выяснилось, что хромосома 22 содержит больше ДНК, чем хромосома 21, но порядок нумерации не стали менять, чтобы не вносить путаницу. Отдельно идут две половые хромосомы: X и Y (условно их можно назвать томами № 23 и № 24 Энциклопедии человеческого генома).
^ содержится лишь 23 хромосомы из 24-х, и все они представлены в соматических клетках двумя экземплярами. У мужчин в клетках содержится полная Энциклопедия человека, все 24 хромосомы, но две из них (хромосомы X и Y) существуют в единичных экземплярах.
Разные хромосомы сильно отличаются друг от друга по числу и свойствам генов (в первой, самой большой, хромосоме содержится 263 млн. п.н., составляющих 2237 гена, а в 21 хромосоме – 50 млн.п.н. и 82 гена). www.ensembl.org
Также отличаются хромосомы и по важности записанной в них информации. Число генов, ассоциируемых с различными болезнями больше всего в Х хромосоме – 208; в 1 хмс – 157; и в 11 хмс – 135. Меньше всего таких генов в Y хмс – всего 3. Тем не менее, только совокупность всех хромосом обеспечивает клетки полной информацией, позволяющей человеку нормально развиваться и жить. В отсутствие любой из пар хромосом жизнь конкретного индивидуума становится невозможной.
При потере по каким-либо причинам только одной из пары хромосом состояние человека сильно отличается от нормы. Например, частичная моносомия 5-ой хромосомы приводит к синдрому кошачьего крика. У детей с этой аномалией отмечается необычный плач, что обусловлено изменением гортани, а также черепа и лица.
В клетках человека также имеется ДНК, расположенная не в хромосомах, а в митохондриях. Это тоже часть генома человека, называемая М-хромосомой. В отличие от ядерного генома митохондриальные гены располагаются компактно, как в геноме бактерий, и имеют свой собственный генетический код (своеобразный «генетический жаргон»). МитДНК ответственна в клетке за синтез всего лишь нескольких белков. Но эти белки очень важны для клетки, поскольку участвуют в обеспечении клетки энергией.
Предполагают, что митохондрии появились в клетках эукариот в результате симбиоза высших организмов с аэробными бактериями.
МитДНК передается из поколения в поколение только по женской линии. При оплодотворении в яйцо проникает сперматозоид с набором отцовских хромосом, но без отцовских митохондрий. Только яйцеклетка предоставляет зародышу свою митДНК. Поэтому митДНК удобно использовать для определения степени родства как внутри вида, так и между различными таксонами.
Одной из целей исследования генома человека являлось построение точной и подробной карты всех хромосом. Генетическая карта представляет собой схему, описывающую порядок расположения на хромосоме генов и других генетических элементов. (снипсы-повторы-гены).
В кодировании белков принимает участие не более 1,5 % хромосомной ДНК человека (т.е. генетические инструкции по формированию человеческого индивидуума занимают лишь 3 см на двухметровой молекуле ДНК человека).
Анализ генома человека позволил выявить у него порядка ^ . генов (на сегодня). Самые короткие гены содержат всего 20 п.н. (гены эндорфинов, вызывающих ощущение удовольствия). Самый длинный ген, кодирующий один из белков мышц (миодистрофин), содержит порядка 2,5 млн. п.н.
^ генов в хромосомах сильно различается. Средняя плотности составляет около 10 генов на 1 млн.п.н. Однако в хромосоме 19 плотность составляет 20 генов, а в Y-хромосоме — всего 1,5 гена на млн. Если сравнить плотность генов с плотностью расселения людей, то Y-хромосома напоминает нашу Сибирь, а хромосома 19 — Европейскую часть России. Плотность расположения генов падает по мере эволюционного усложнения организмов. Для сравнения: в геноме бактерий содержится свыше 1000 генов на 1,0 млн. и. н., у дрожжей около 450 генов на 1,0 млн. п. н., а у червя С. elegans — около 200.
Как у людей имеются семьи, так и гены объединяют в семейства по их схожести. В геноме человека присутствуют около 1,5 тыс. таких семейств. Причем только около сотни из них специфичны для человека и позвоночных животных. Основная же масса генных семейств имеется как у человека, так и у дождевого червя.
Разные гены одного семейства возникали в ходе эволюции из одного гена-предшественника как следствие мутаций. «Родственные» гены чаще всего выполняют сходную функцию. Например, геном человека имеет около 1 000 генов-рецепторов обоняния.
В семействах генов иногда встречаются псевдогены. Это гены, утратившие способность к экспрессии. Перед их названием ставят греческую букву . He совсем ясно, зачем геному нужны такие гены, почему он сохранил их в эволюции и не избавился от них. В геноме человека имеется около 20 000 таких псевдогенов. В частности, в огромной семействе генов обоняния около 60% являются псевдогенами. Считается, что массивная потеря функциональных генов произошла за последние 10 млн. лет в связи со снижением роли обоняния у человека по сравнению с другими млекопитающими.
Около 20 % генов человека функционируют во всех типах клеток человека. Остальные же гены работают только в определенных тканях и органах. Например, глобиновые гены экспрессируются только в клетках крови, поскольку основная их функция – обеспечивать перенос кислорода.
Примером высочайшей специализации генов служат обонятельные гены. В каждой клетке органа обоняния человека – обонятельной луковице — работает только 1 ген из 1000 возможных. Сильнейшее недоумение ученых вызвал тот факт, что некоторые из этих генов, кроме обонятельной луковицы, активизируются еще в одном типе клеток – сперматозоидах. Как это связано с восприятием запаха, пока не совсем ясно.
Картирование хромосом также позволило выявить локализацию участков, отвечающих за некоторые болезни человека.
Например, в первой хромосоме гены связанны с раком протоков молочной железы. Во второй – с ожирением. В третьей – с шизофренией. В четвертой хромосоме обнаружен ген, мутации которого приводят к развитию алкоголизма. Мутации в концевом участке Х-хромосомы вызывают предрасположенность к гомосекесуализму.
Внимание специалистов также привлекли гены, связанные с некоторыми особенностями поведения человека. Эти гены кодируют белки, участвующие в передаче сигналов между нервными клетками (например, белок серотонин). Ген, кодирующий рецептор серотонина, ученые назвали «геном самоубийства». Мутации по этому гену вызывают у людей склонностью к отрицательным эмоциям и суицидные наклонности.
Другой передатчик сигналов в нервной системе — дофамин – вещество, играющего ключевую роль в работе центров удовольствия мозга. Избыток дофамина вызывает у животных исследовательскую гиперактивность.. Было обнаружено, что один из генов, кодирующих белки-рецепторы дофамина, может существовать в разных аллельных формах (длинной и короткой). Люди с длинной аллелью больше склонны к поиску новых впечатлений, поэтому обнаруженный ген так и назвали «геном поиска новизны». У американцев длинная аллель гена рецептора дофамина встречается в 25 раз чаще, чем, скажем, у жителей Южной и Восточной Азии. Из истории мы знаем, как заселялась Америка европейцами. В первую очередь, это были энергичные люди, склонные к авантюризму, любопытные и импульсивные. Вот они то и внесли длинную аллель «гена поиска новизны» в современную американскую популяцию.
Недавно обнаружены два гена, которые отвечают за материнские инстинкты (эти гены так и были названы генами «материнского инстинкта»). При этом, ко всеобщему удивлению, выяснилось, что оба гена дочки получают от отцов. Животные, у которых гены «материнского инстинкта» отсутствовали, не заботились о новорожденных.
Необходимо подчеркнуть, что, в отличие от генов, ответственных за физические параметры, наличие «больных» генов, формирующих психику и поведение, еще не означает стопроцентную обреченность человека па определенные отрицательные проявления. Во-первых, как правило, не один, а совокупность генов отвечает за душевные характеристики. Между ними существует очень сложное и порой весьма неоднозначное взаимодействие, эффект которого зависит от множества различных факторов. Во-вторых, как считает большинство ученых, психика и поведение человека лишь процентов на 50 определяются генами.
Одним из методов изучения влияния окружающей среды на проявление генотипа является наблюдение за однояйцовыми близнецами. Такой подход в генетике получил название «близнецовый метод».
Однояйцовые близнецы образуются в результате деления одной и той же зиготы и содержат идентичные геномы. Хотя появление близнецов — довольно редкое явление (считается, что у человека одна двойня приходится па 80—85 родов), тем не менее, имеющихся случаев достаточно для проведения соответствующих исследований.
Одним из наиболее четких способов идентификации человека являются отпечатки пальцев. Характерные «узоры» закладываются у зародыша уже на третьем месяце развития и сохраняются без изменения в течение всей жизни. При сравнении кожных «узоров» у близнецов было выявлено, что они очень похожи, но, что удивительно, не всегда полностью идентичны.
При исследовании ряда других признаков также наблюдали их небольшие вариации у близнецов: цвет глаз и волос, форма уха.
Крупномасштабное сравнение однояйцовых близнецов друг с другом показало, что возникновение таких инфекционных заболеваний, как корь, коклюш, ветряная оспа практически полностью зависит от возбудителя заболевания, а вот полиомиелит и туберкулез определяются кроме того наследственными свойствами человека. В частности, заболеваемость туберкулезом обоих однояйцовых близнецов более чем в 3 раза выше, чем у двух разнояйцовых близнецов.
Исследование близнецов, проведенное в Каролинском институте в Стокгольме, убедительно показало существенное воздействие факторов окружающей среды (курения, загрязнений, питания, образа жизни) на развитие некоторых форм злокачественных заболеваний. Вместе с тем отмечено влияние генетических факторов на возникновение рака простаты, рака прямой кишки и рака груди.
При анализе близнецов удалось выяснить, что умственное развитие также могут объясняться генетически. Если один из пары однояйцовых близнецов слабоумен, то второй оказывается таким же почти всегда.
Российскими учеными было проведено исследование детей-близнецов в возрасте от 7 до 12 месяцев на предмет того, в какой мере генетика и среда влияют на агрессивность, раздражительность, активность и общительность. Оказалось, что первые три черты темперамента находятся под жестким генетическим контролем: агрессивность поведения младенца:на 94 процента определяется его генотипом, активность — па 89 процентов, раздражительность — па 85 процентов. А общительность почти на 90% формируется под влиянием среды, которую создают родители.
Благодаря методу близнецового анализа на генетический уровень вышла и широко обсуждаемая проблема гомосексуализма. Уже имеются достоверные данные, что около 57% однояйцовых близнецов, братьев мужчин-гомосексуалов также являются гомосексуалами. Для женщин-лесбиянок эта цифра составляет приблизительно 50%.
Осознание гомосексуализма как наследственной болезни возможно поможет решить как проблему гомофобии (плохо ненавидеть больных людей), так и проблему агрессивного гомосексуализма (эти люди требуют признания их здоровыми и полноценными, порой даже гордятся своей особенностью). Однако, если рассматривать гомосексуализм как болезнь, как патологию, ситуация кардинально меняется. Трудно представить себе человека, гордо стоящего с плакатом: «Я страдаю шизофренией, поэтому требую к себе уважения, как к полноценному члену общества!».
Согласно современным оценкам, продолжительность жизни человека, также связана с генетическими факторами, роль которых оценивается на уровне 65—70%.
Многочисленные и разнообразные данные позволяют утверждать, что геном определяет многое в нас, но и окружающая среда весьма заметно вмешивается в нашу сущность. Взаимосвязь между генами и окружающей средой ученые иногда сравнивают с заряженным пистолетом и курком. Пистолет не выстрелит, пока не будет нажат курок. Также обстоит ситуация и в клетке, где в качестве заряженного пистолета служит ген, а функцию курка выполняют всевозможные факторы окружающей среды. Имеется и другое сравнение — с карточной игрой: хороший игрок может выиграть и с плохими картами.
Чтобы разобраться в тех многочисленных взаимосвязях, которые существуют между проявлением отдельных вариантов генов и влиянием па этот процесс различных факторов окружающей среды, был создан специальный международный проект — The Environmental Genome Project. Среди множества задач данного проекта главной является, конечно же, изучение влияния окружающей среды па продолжительность жизни, а также на возникновение и развитие различных заболевании человека. В конечном итоге этот проект может оказаться не менее важным и сложным, чем знаменитый и очень дорогостоящий проект по секвенированию генома человека. А в том, что он будет продолжаться по времени значительно дольше, чем геномный проект, нет никакого сомнения.
Скачать файл (61 kb.)
gendocs.ru
Что такое гены и геном человека :: SYL.ru
С развитием естественных наук, которое произошло в начале 20 века, удалось выявить принципы наследственности. В этот же период возникли новые термины, описывающие, что такое гены и геном человека. Геном называют единицу наследственной информации, отвечающую за формирование в организме носителя какого-либо свойства. В живой природе именно передача этой информации является основой всего процесса размножения. Этот термин, как и само определение, что такое гены, впервые был использован ботаником Вильгельмом Йогансеном в 1909 году.
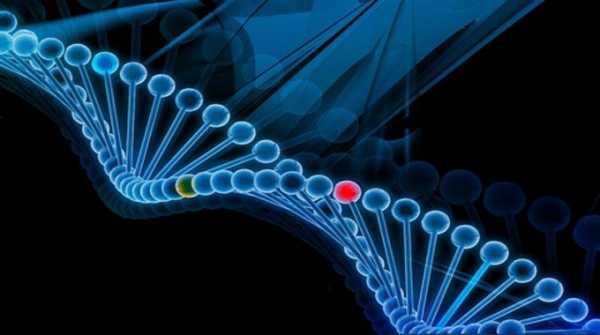
Структура гена
На сегодняшний день установлено, что гены – это отдельные участки ДНК – дезоксирибонуклеиновой кислоты. Каждый ген отвечает за передачу в организме человека данных о строении РНК (рибонуклеиновой кислоты) или белка. Как правило, в составе гена присутствует несколько участков ДНК. Структуры, которые берут на себя передачу наследственной информации, называют кодирующими последовательностями. Но при этом в ДНК есть и такие структуры, которые влияют на проявление гена. Данные участки называются регуляторными. То есть гены включают кодирующие и регуляторные последовательности, которые в ДНК расположены отдельно друг от друга.
Геном человека
В 1920 году Ганс Винклер ввел такое понятие, как геном. Сначала этот термин использовался для обозначения набора генов непарного одинарного набора хромосом, который присущ биологическому виду. Было такое мнение, что геном целиком восполняет все свойства организма определенного вида. Но в дальнейшем значение этого термина немного изменилось, так как проведенные исследования показали, что такое определение не совсем соответствует истине.
Генетическая информация
Было установлено, что такое гены и то, что в ДНК многих организмов присутствуют не кодирующие ничего последовательности. К тому же часть генетической информации содержится в ДНК, которые расположены вне ядра клетки. Часть генов, отвечающих за кодирование одного и того же признака, может существенно различаться по своей структуре. То есть геномом называют собирательный набор генов, которые содержатся в хромосомах и за их пределами. Он характеризует свойства определенной популяции особей, но при этом генетический набор каждого отдельного организма имеет существенные отличия от его генома.

Что является основой наследственности
В попытках определить, что такое гены, было проведено множество самых различных исследований. Поэтому нельзя однозначно ответить на этот вопрос. Если верить биологическому определению этого термина, то ген – это последовательность ДНК, содержащая информацию об определенном белке. И до недавних пор такого объяснения этого термина было вполне достаточно. Но сейчас установлено, что последовательность, в которой закодирован белок, не всегда является непрерывной. Она может прерываться вкрапленными в нее участками, не несущими никакой информации.
Идентификация гена
Можно идентифицировать ген по группе мутаций, каждая из которых предупреждает создание соответствующего белка. Тем не менее данное утверждение может считаться правильным и касаемо прерывистых генов. Свойства их кластеров в данном случае оказываются гораздо сложнее. Но это утверждение довольно спорное, так как многие гены с прерывистой цепочкой обнаружены в таких ситуациях, когда невозможно провести тщательный генетический анализ. Считалось, что геном довольно постоянен, и какие-либо изменения в его общей структуре происходят лишь в крайних случаях. А конкретно лишь в растянутой эволюционно-временной шкале. Но такое суждение противоречит недавно полученным данным, доказывающим, что в ДНК периодически происходят определенные перестройки, и что есть относительно изменчивые компоненты генома.

Свойства генов, выявленные в работе Менделя
В работе Менделя, а именно в его первом и втором законах, точно сформулировано, что такое гены и каковы их свойства. В первом законе рассматриваются особенности индивидуального гена. В организме присутствуют две копии каждого гена, то есть если говорить языком современности, он диплоиден. Одна из двух копий гена попадает к потомку от родителя через гаметы, то есть передается по наследству. Гаметы, объединяясь, образуют оплодотворенное яйцо (зиготу), которая несет по одной копии от каждого родителя. Следовательно, организм получает одну материнскую копию гена и одну отцовскую.
Двуликий ген старения
Как известно, старение человека объясняется не только накоплением неполадок в организме, но и работой определенных генов, несущих информацию о старении. Сразу возникает вопрос о том, почему в процессе эволюции этот ген сохранился. Зачем он нужен в организме и какую роль играет? Исследования на эту тему были основаны на выведении вида мышей без характерного белка p66Shc. Особи, у которых отсутствовал данный белок, не были склонны к накоплению жировой прослойки, медленнее старели, меньше страдали сдвигами метаболизма, сердечно-сосудистыми заболеваниями и диабетом. Выходит, этот белок является геном, ускоряющим процессы старения. Но такие результаты дали только лабораторные исследования. Потом животные были перенесены в естественные условия обитания, и в результате популяция мутантных особей стала снижаться. По этой причине было принято решение о дальнейшем исследовании, и как итог был подтвержден факт, что «ген старения» имеет большое значение в процессах адаптации организма и отвечает за естественный энергетический обмен в организме животных.

Ричард Докинз – биолог-эволюционист и его «Эгоистичный ген»
Книга, которую написал Ричард Докинз («Эгоистичный ген»), является наиболее популярной книгой по эволюции. В книге задается не совсем типичный угол обзора, показывается, что эволюция, а точнее естественный отбор, происходит в первую очередь на уровне генов. Конечно, сегодня этот факт уже не вызывает сомнения, но в 1976 году такое заявление было весьма новаторским. Мы созданы нашими генами. Все живые существа необходимы для того, чтобы сохранить гены. Мир эгоистичного гена – это мир безжалостной эксплуатации, жесткой конкуренции и обмана.
www.syl.ru
Геном человека
Немного истории
25 апреля теперь уже далекого 1953 г. журнал Nature опубликовал небольшое письмо молодых и никому неизвестных Ф.Крика и Дж.Уотсона редактору журнала, которое начиналось словами: «Мы хотели бы предложить свои соображения по поводу структуры соли ДНК. Эта структура имеет новые свойства, которые представляют большой биологический интерес». Статья содержала около 900 слов, но – и это не преувеличение – каждое из них было на вес золота.
«Ершистая молодежь» посмела выступить против нобелевского лауреата Лайнуса Полинга, автора знаменитой альфа-спирали белков. Полинг буквально накануне опубликовал статью, согласно которой ДНК представляла собой трехцепочечную спиральную структуру, наподобие девичьей косы. Тогда никто не знал, что у Полинга был просто недостаточно очищенный материал. Но и Полинг оказался отчасти прав – сейчас трехцепочечность некоторых участков наших генов хорошо известна. Это свойство ДНК даже пытались одно время использовать в борьбе с раком, выключая с помощью олигонуклеотидов те или иные раковые гены (онкогены).
Биологии нуклеиновых кислот долго не везло. Достаточно сказать, что первую нобелевскую премию за открытие строения нуклеотидов немец А.Коссель получил еще в 1910 г. А знаменитая реакция Фельгена для окрашивания ДНК была предложена накануне Первой мировой войны и усовершенствована в 1920-е гг. Тогда и могла бы начаться новая эра биологии, однако…
Однако биологи были уверены, что «монотонная» ДНК с ее только четырьмя различающимися основаниями просто не могла нести генетическую информацию о миллионах самых разнообразных белков. И хотя уже применялась азбука Морзе с тремя кодирующими элементами, менталитет исследователей еще не достиг уровня информационной эры с ее двоичной системой записи («0» и «1») любой информации.
Лишь к началу 1950-х гг. отдельные ученые стали обращать внимание на ДНК, роль которой в передаче наследственных признаков у микроорганизмов установил в 1943 г. Освальд Эйвери. Результатам Эйвери поверил Сальвадор Лурия, который вместе с Максом Дельбрюком организовал неподалеку от Нью-Йорка лабораторию на биостанции в местечке Колд-Спринг Харбор.
Заметим в скобках, что физик М.Дельбрюк был учеником Н.В. Тимофеева-Ресовского в биологии и соавтором их совместной с К.Циммером знаменитой статьи, посвященной определению размеров гена. Лурия с Дельбрюком изучали жизненный цикл бактериофагов – вирусов микроорганизмов, в результате чего и пришли к предположениям о биологической роли ДНК. Лурия послал своего аспиранта Джеймса Уотсона в Кавендишскую лабораторию в Кембридже, где Морис Уилкинс и Розалинд Франклин исследовали строение ДНК с помощью рентгена (англичане лидировали в рентгеноструктурном анализе биомолекул).
 В
лаборатории Уилкинса работал также еще
довольно молодой физик Фрэнсис Крик,
известный в узких лабораторных кругах
своим научным скепсисом: для него просто не
существовало никаких авторитетов, чем он и
заработал себе репутацию скандалиста.
Статью Полинга в лабораторию принес его сын,
который помог, кстати, Уотсону и Крику
уяснить роль попарного комплементарного
соединения азотистых оснований. Статья
стала последней каплей перед озарением, или
пониманием… тем, что оформилось в открытие
молодых ученых.
В
лаборатории Уилкинса работал также еще
довольно молодой физик Фрэнсис Крик,
известный в узких лабораторных кругах
своим научным скепсисом: для него просто не
существовало никаких авторитетов, чем он и
заработал себе репутацию скандалиста.
Статью Полинга в лабораторию принес его сын,
который помог, кстати, Уотсону и Крику
уяснить роль попарного комплементарного
соединения азотистых оснований. Статья
стала последней каплей перед озарением, или
пониманием… тем, что оформилось в открытие
молодых ученых.
Научное сообщество, однако, не сразу признало их открытие. Достаточно сказать, что сначала Нобелевскую премию за работы в области ДНК «судьи» из Стокгольма присудили в 1959 г. известным американским биохимикам Северо Очоа и Артуру Корнбергу. Очоа был первым (1955), кто сумел синтезировать рибонуклеиновую кислоту (РНК). Корнберг же получил премию за синтез ДНК в пробирке (1956).
В 1962 г. настал черед Крика, Уотсона и Уилкинса. Р.Франклин к тому времени уже умерла от рака в возрасте 37 лет, иначе это был бы единственный случай в истории Нобелевских премий, когда награду вручили бы четверым, хотя это и не допускается уставом. Вклад Франклин в развитие рентгеноструктурного анализа ДНК был просто неоценим.
После открытия Уотсона и Крика важнейшей проблемой стало выявление соответствия между первичными структурами ДНК и белков. Поскольку в составе белков обнаруживается 20 аминокислот, а нуклеиновых оснований всего 4, то для записи информации о последовательности аминокислот в полинуклеотидах необходимо не менее трех оснований. На основании таких общих рассуждений варианты «трехбуквенных» генетических кодов предложили физик Г.Гамов и биолог А.Нейфах. Однако их гипотезы были чисто умозрительными и не вызвали большого отклика среди ученых.
Трехбуквенный генетический код к 1964 г. расшифровал Ф.Крик. Вряд ли он тогда предполагал, что в обозримом будущем станет возможной расшифровка генома человека. Эта задача долгое время казалась неразрешимой. Однако два открытия позволили сдвинуть проблему с места.
В 1970 г. не известные широкой научной общественности Г.Темин и Д.Балтимор опубликовали в Nature статьи, посвященные обратной транскриптазе (ОТ) – ферменту РНК-содержащих, в том числе раковых, вирусов, которые синтезируют ДНК на матрице РНК, т.е. осуществляют реакцию, обратную той, которую до тех пор наблюдали в клетках.
Открытие обратной транскриптазы позволило выделить первые гены. Но процесс этот был крайне трудоемким и чрезвычайно дорогим. А спустя 15 лет некий химик из Калифорнии предложил на суд коллег уникальную полимеразную цепную реакцию (ПЦР), сразу же ставшую знаменитой. В этой реакции фермент, полимераза, «ходит как челнок» по фрагменту ДНК, поэтому ПЦР позволяет нарабатывать любые количества этого фрагмента, необходимые для анализа*.
ПЦР, а также появление новейшей электронной техники и компьютеров сделали вполне реальной задачу расшифровки всего генома человека. Долгие дебаты закончились в конце сентября 1988 г., когда во главе проекта HUGO – Организации по расшифровке генома человека – был поставлен Дж.Уотсон.
Журнал Time назвал в связи с этим Уотсона «охотником за генами». Сам же ученый сказал следующее: «Это захватывающая перспектива. Тридцать лет назад мы не могли и мечтать о том, чтобы узнать структуру генома даже мельчайшего вируса. А сегодня мы уже расшифровали геном вируса СПИДа и почти полностью прочитали геном кишечной палочки объемом в 4,5 млн букв ген-кода. Точное знание детальной структуры генома человека – это восхитительно!».
И вот геном прочитан
Завершение работ по расшифровке генома человека консорциумом ученых планировалось к 2003 г. – 50-летию открытия структуры ДНК. Однако конкуренция сказала свое слово и в этой области.
Крейг Вентер основал частную компанию «Селера», которая продает генные последовательности за большие деньги. Включившись в гонку по расшифровке генома, она за один год сделала то, на что у международного консорциума ученых из разных стран ушло десять лет. Это стало возможным благодаря новому методу чтения генетических последовательностей и использованию автоматизации процесса чтения.
Итак, геном прочитан. Казалось бы, надо радоваться, но ученые пришли в недоумение: уж очень мало генов оказалось у человека – примерно в три раза меньше, чем ожидалось. Раньше думали, что генов у нас около 100 тыс., а на самом деле их оказалось около 35 тыс. Но даже не это самое главное.
Недоумение ученых понятно: у дрозофилы 13 601 ген, у круглого почвенного червя – 19 тыс., у горчицы – 25 тыс. генов. Столь малое количество генов у человека не позволяет выделить его из животного царства и считать «венцом» творения.
Основную часть ДНК наших хромосом занимают пустынные участки и так называемые тандемные повторы. В пустынных участках просто-напросто не закодировано никаких генов, а повторы бессмысленны и следуют друг за другом наподобие велосипедов-тандемов, откуда и получили название. ДНК повторов называют также паразитической. Такое презрительное название она получила за то, что ничего не делает в геноме, однако сохраняется и увеличивает массу хромосом.
Зато там, где располагаются гены, активность ДНК и ферментов, синтезирующих ее копии в виде молекул информационной РНК, повышается в 200–800 раз! Это – «горячие точки» генома.
В геноме человека ученые насчитали 223 гена, которые сходны с генами кишечной палочки. Кишечная палочка возникла примерно 3 млрд лет назад. Зачем нам такие «древние» гены? Видимо, современные организмы унаследовали от предков какие-то фундаментальные структурные свойства клеток и биохимические реакции, для которых необходимы соответствующие белки.
Нет поэтому ничего удивительного и в том, что половина белков млекопитающих имеют сходство аминокислотных последовательностей с белками мухи дрозофилы. В конце концов мы дышим одним и тем же воздухом и потребляем животные и растительные белки, состоящие из одних и тех же аминокислот.
Удивительно, что с мышью мы имеем 90% общих генов, а с шимпанзе – вообще 99%!
В нашем геноме много последовательностей, доставшихся нам в «наследство» от ретровирусов. Эти вирусы, к которым относятся вирусы рака и СПИДа, вместо ДНК в качестве наследственного материала содержат РНК. Особенностью ретровирусов является, как уже говорилось, наличие обратной транскриптазы. После синтеза ДНК по РНК вируса вирусный геном встраивается в ДНК хромосом клетки.
Таких ретровирусных последовательностей у нас много. Время от времени они «вырываются» на волю, в результате чего возникает рак (но рак в полном соответствии с законом Менделя проявляется лишь у рецессивных гомозигот, т.е. не более чем в 25% случаев). Совсем недавно было сделано открытие, которое позволяет понять не только механизм встраивания вирусов, но и назначение некодирующих последовательностей ДНК. Оказалось, что для встраивания вируса необходима специфическая последовательность из 14 букв генетического кода. Таким образом, можно надеяться, что вскоре ученые научатся не только блокировать агрессивные ретровирусы, но и целенаправленно «внедрять» нужные гены, и генотерапия из мечты превратится в реальность.
В организме млекопитающих ретровирусы играют и еще одну немаловажную роль. В отношении млекопитающих, у которых плод развивается внутри организма матери, правомерен вопрос: почему иммунная система матери позволяет развиваться организму, который наполовину генетически ей чужероден, поскольку половина генома плода отцовская?
Все дело в ретровирусах, которые блокируют активность иммунных Т-лимфоцитов, ответственных за отторжение органов и тканей, содержащих чужеродные белки, например, после трансплантации органов. Эти ретровирусы активируются в геноме клеток плаценты, которая образуется тканями плода.
Недавно был обнаружен вирус, который блокирует развитие (экспрессию) ретровируса. Если этим вирусом-блокатором заразить беременную мышь, то мышата рождаются нормальными и в срок. Но если его ввести в клетки плаценты, то происходит выкидыш плода, так как активируются Т-лимфоциты матери.
Не стоит забывать, что ретровирусные последовательности возникают также непосредственно на концах хромосом – теломерах. Как известно, теломеры состоят из одноцепочечной ДНК, которая синтезируется ферментом теломеразой по матрице РНК. Считается, что теломеры являются нашими молекулярными часами, поскольку они укорачиваются с каждым клеточным делением. Раньше считалось, что в теломерах нет генов, однако расшифровка генома показала, что генов там довольно много и они активны в детстве и молодом возрасте, постепенно «угасая» по мере старения организма.
Не так уж бездеятельны и тандемные повторы. В норме они имеют определенное число повторяющихся троек, пятерок и даже семерок букв. Но в некоторых случаях в результате мутаций число повторов начинает нарастать, что ведет к нестабильности генома. Дело доходит даже до «поломок» концов хромосом. Фрагментация концевых участков хромосомы может привести к перемещениям (транслокации) участков ДНК в другую хромосому, а также синтезу таких форм белка, которые вызывают гибель нервных клеток, как это наблюдается при наследственной хорее Гентингтона.
К.Вентер говорил, что понимание генома потребует сотни лет. Ведь мы до сих пор не знаем функций и роли более чем 25 тыс. генов. И даже не знаем, как подступиться к решению этой задачи, поскольку большинство генов просто «молчит» в геноме, никак себя не проявляя.
Следует учитывать, что в геноме накопилось множество псевдогенов и генов-«перевертышей», которые также неактивны. Похоже, что некодирующие последовательности являются как бы изолятором активных генов. В то же время, хотя генов у нас и не слишком много, они обеспечивают синтез до 1 млн (!) самых разных белков. Как же это достигается при таком ограниченном наборе генов.
Как оказалось, в нашем геноме существует специальный механизм – альтернативный сплайсинг. Заключается он в следующеем. На матрице одной и той же ДНК происходит синтез разных альтернативных и-РНК. Сплайсинг и означает «расщепление», когда образуются разные молекулы РНК, которые как бы «расщепляют» ген на разные варианты. Этот приводит к невообразимому разнообразию белков при ограниченном наборе генов.
Функционирование генома человека, как и всех млекопитающих, регулируется различными транскрипционными факторами – специальными белками. Эти белки связываются с регуляторной частью гена (промотером) и таким образом регулируют его активность. Одни и те же факторы могут по-разному проявлять себя в разных тканях. У человека есть свои собственные, присущие только ему, транскрипционные факторы. Выявить эти чисто человеческие особенности генома еще только предстоит ученым.
СНП
Существует и еще один механизм генетического разнообразия, который выявился только в процессе прочтения генома. Это сингулярный нуклеотидный полиморфизм, или, так называемые факторы СНП.
Полиморфизмом в генетике называют ситуацию, когда гены одного и того же признака существуют в разных вариантах. Примером полиморфизма, или, другими словами, множественных аллелей, служат группы крови, когда в одном хромосомном локусе (участке) могут находиться варианты генов А, В или О.
Сингулярность по-латыни означает одиночество, что-то единственное. СНП – это изменение «буквы» генетического кода без «последствий для здоровья». Считается, что у человека СНП встречается с частотой 0,1%, т.е. каждый человек отличается от других одним нуклеотидом на каждую тысячу нуклеотидов. У шимпанзе, представляющей собой более древний вид, и к тому же гораздо более гетерогенный, число СНП при сравнении двух разных особей достигает 0,4%.
Но если различия в СНП не сказываются на здоровье особей, то чем они интересны и важны? Во-первых, изучение СНП имеет большое теоретическое значение. Именно они позволяет сравнивать возрасты популяций и определять пути их миграции. Так, например, в мужской половой хромосоме (Y) выделены 22 фактора СНП, анализ которых у 1007 европейцев позволил определить, что 80% европейских мужчин имеют сходный «СНП-паттерн», т.е. «рисунок». Это говорит о том, что тысячи поколений назад 4/5 европейских мужчин имели общего предка!
Но и практическое значение СНП велико. Возможно, не все знают, что сегодня самые распространенные лекарства эффективны не более чем для четверти населения. Минимальные генетические отличия, обусловленные СНП, определяют эффективность лекарств и их переносимость в каждом конкретном случае. Так, у больных диабетом выявили 16 специфических СНП. Всего при анализе 22-й хромосомы определили местоположение 2730 СНП. В одном из генов, кодирующих синтез рецептора адреналина, выявлено 13 СНП, которые могут комбинироватьcя друг с другом, давая 8192 различных варианта (гаплотипа).
Насколько скоро и полно начнет использоваться полученная информация, пока не совсем ясно. Пока же приведем еще один конкретный пример.
Среди астматиков довольно популярно лекарство албутерол, который взаимодействует с указанным рецептором адреналина и подавляет приступ удушья. Однако из-за разнообразия гаплотипов людей лекарство действует не на всех, а некоторым больным оно вообще противопоказано. Это обусловлено СНП: люди с последовательностью букв в одном из генов ТЦТЦЦ (Т–тимин, Ц–цитозин) не реагируют на албутерол, если же концевой цитозин заменен на гуанин (ТЦТЦГ), то реакция есть, но частичная. Для людей же с тимином вместо концевого цитозина в этом участке – ТЦТЦТ – лекарство токсично!
Протеомика
Эта совершенно новая отрасль биологии, изучающая структуру и функции белков и взаимосвязи между ними, названа по аналогии с геномикой, занимавшейся геномом человека. Само рождение протеомики уже объясняет, зачем нужна была программа «Геном человека». Поясним на примере перспективы нового направления.
В далеком 1962 г. вместе с Уотсоном и Криком в Стокгольм были приглашены из Кембриджа Джон Кэндрью и Макс Перутц. Они были удостоены Нобелевской премии по химии за впервые осуществленную расшифровку трехмерной структуры белков миоглобина и гемоглобина, ответственных за перенос кислорода в мышцах и эритроцитах соответственно.
Напомним, что даже в начале 1990-х гг. расшифровка структуры каждого нового белка представляла значительные трудности. Каждый анализ занимал до десятка лет. И хотя сейчас вместо рентгеновских лучей используют ядерно-магнитный резонанс (ЯМР), однако времени и денег на определение пространственной структуры каждого белка уходит очень много.
Протеомика позволяет ускорить и удешевить эти работы. К.Вентер отметил, что он 10 лет потратил на выделение и секвенирование гена адреналинового рецептора человека, теперь же его лаборатория тратит на это 15 с. Еще в середине 90-х гг. нахождение «адреса» гена в хромосомах занимало 5 лет, в конце 90-х – полгода, а в 2001 г. – одну неделю! Кстати, ускорению определения положения гена помогает информация о СНП, которых сегодня насчитываются уже миллионы.
Вернемся к протеомике. Знание аминокислотных последовательностей и трехмерной структуры определенных белков позволило разработать программы сопоставления генетических последовательностей с аминокислотными, а затем программы предположительного расположения их в трехмерной структуре полипептидов. Знание трехмерной структуры позволяет быстро находить химические варианты молекул, в которых блокирован, например, активный центр, или определять положение активного центра у мутантного фермента.
Известно, что повышение артериального давления вызывается ферментом АСЕ, сокращенное название которого переводится с английского как ангиотензин-конвертирующий фермент. Образующийся под действием фермента ангиотензин воздействует на стенки артерии, что и ведет к гипертонии. Уже относительно давно были найдены блокаторы фермента АСЕ, которые стали продаваться в качестве лекарств от повышенного давления. Однако, эти лекарственные средства оказались малоэффективными.
Анализ генома позволил выделить ген АСЕ-2, который кодирует более распространенный и эффективный вариант фермента. Затем была определена виртуальная структура белкового продукта, после чего подобраны химические вещества, активно связывающиеся с белком АСЕ-2. Так был найден новый препарат против артериального давления, причем за вдвое меньшее время и всего лишь за 200 вместо 500 млн долларов!
Признаемся, что это был пример «догеномного» периода. Теперь же, после прочтения генома, на первый план выходит протеомика, цель которой – быстрее разобраться с тем миллионом белков, которые потенциально могут существовать в наших клетках. Протеомика позволит более тщательно диагностировать генетические отклонения и блокировать неблагоприятное действие мутантных белков на клетку.
А со временем можно будет планировать и «исправление» генов.
И.Э. Лалаянц
*Одновременно и независимо полимеразная реакция была исследована и оптимизирована В.Барановым в Институте белка АН СССР, однако «в своем отечестве пророка нет», поэтому публикации на эту тему появились гораздо позже статей западных коллег.
learnbiology.narod.ru
Геном человека
Геном человека
Одна из задач международной программы «Геном человека»(HUGO) — определить последовательность 3.3 х 109 нуклеотидов ДНК всего генома человека, представленного 22 аутосомами и двумя половыми хромосомами: X и Y.
Координационный центр HUGO находится в американском городе Бетесда, недалеко от Вашингтона, и относится к системе национальных институтов здоровья (National Institutes of Health). Возглавляет его Фрэнсис Коллинз — директор Института геномных исследований в Бетесде. Центр координировал научную работу в шести странах — Германии, Англии, Франции, Японии, Китае и США. Но национальные программы по геномике сегодня имеют более 20 стран, а членами HUGO являются представители более 50 стран. Национальные программы есть в развивающихся странах, например в Китае и Бразилии, где правительства понимают важность геномной программы. Сейчас Россию в научном совете представляет профессор Н. К. Янковский.
Методический аспект проблемы отлично отработан и сегодня представляет собой заводскую технологию — дорогостоящую ( По не вполне официальным данным, на государственные программы под эгидой HUGO было истрачено более трех миллиардов долларов США, то есть в среднем по одному доллару на одну нуклеотидную пару из генома человека. «Селера» истратила примерно столько же. Правда, она их истратила за шесть лет. Государственные же программы примерно ту же сумму использовали за 10 лет. То есть интенсивность использования денег в частной компании оказалась выше.), очень тонкую, но технологию.
Дезоксирибонуклеиновая кислота, или ДНК, впервые была выделена из клеточных ядер. Поэтому ее и назвали нуклеиновой (греч. nucleus — ядро). ДНК состоит из цепочки нуклеотидов с четырьмя различными основаниями: аденином (А), гуанином (G), цитозином (С) и тимином (Т). ДНК почти всегда существует в виде двойной спирали, то есть она представляет собой две нуклеотидные цепи, составляющие пару. Вместе их удерживает так называемая комплементарность пар оснований. «Комплементарность» означает, что когда А и Т в двух цепях ДНК расположены друг против друга, между ними спонтанно образуется связь. Аналогично комплиментарную пару образуют G и С. В клетках человека содержится 46 хромосом. Длина генома человека (все ДНК в хромосомах) может достигать двух метров и состоит из трех миллиардов нуклеотидных пар. Ген — это единица наследственности. Он представляет собой часть молекулы ДНК и содержит закодированную информацию об аминокислотной последовательности одного белка или рибонуклеиновой кислоты (РНК).
Расшифровка ДНК стала реальностью после того, как в середине 70-х годов были разработаны два различных метода расшифровки нуклеотидной последовательности ДНК. Хронологически первым был метод Максама — Гилберта заключающийся в том, что молекулу ДНК разбивают на кусочки, затем эти кусочки подвергают химическим воздействиям, а потом специальным образом обрабатывают. Ученые смотрят, что при этом происходит с нуклеотидной последовательностью, и на основании этого делают вывод о порядке расположения нуклеотидов друг за другом в каждом фрагменте ДНК.
Английский ученый Фред Сэнгер предложил другой способ расшифровки структуры ДНК. Согласно методу Сэнгера молекулу ДНК с помощью специальной обработки ферментами не только расщепляют на фрагменты, но и «расплетают» ее двойную спираль на две нити. Потом по каждому из полученных обрывков, состоящих из отдельных нуклеотидных «нитей», с помощью специальных химических «затравок» восстанавливается недостающая вторая нить нуклеотидов. Но не полностью — ее синтез обрывают на разных нуклеотидах. При этом получался набор цепей ДНК с непрерывно изменяющейся длиной — «лесенка». Фрагменты разной длины помечены на концах флуоресцентной меткой, чтобы их было легко обнаружить.
За разработку этих методов Гилберт и Сэнгер получили Нобелевскую премию. Интересно, что для Сэнгера эта премия уже вторая, первую он получил за расшифровку аминокислотной последовательности белка инсулина. Случай в науке уникальный — один и тот же человек первым расшифровал структуру и белка и ДНК!
Все автоматы-секвенаторы построены по принципу метода Сэнгера, поскольку он оказался более удобным для автоматизации и комьютерной регистрации. Выпущено огромное количество автоматов и стандартных наборов реактивов для анализа. По сути, секвенирование (то есть определение нуклеотидной последовательности ДНК) стало рутинной лаборантской работой. А метод Максама-Гилбера имеет скорее историческое, чем практическое значение.
Еще 15-20 лет назад расшифровка нуклеотидной последовательности в 1000 нуклеотидов считалась почти научным подвигом, за это можно было сразу получить степень доктора наук. Но уже к 1990 году секвенирование ДНК стало массовой технологией. А сейчас квалифицированный лаборант проделывает такую работу меньше, чем за один день.
К настоящему времени Проект практически выполнен, причем 85% информации абсолютно достоверны, т.е. последовательность ДНК в этом объеме перепроверена не один раз и разночтения больше не выявляются. Примерное число генов человека — 30 000 ( а не 80000, как считалось еще год назад) Что удивляет самих ученых — насколько малая часть человеческого генома напрямую участвует в построении организма: 23 пары хромосом содержат весь чертеж человеческой жизни. Генетические инструкции по формированию личности занимают меньше 2,5 сантиметра на двухметровой ленте ДНК, заключенной практически внутри каждой клетки тела. Удивило и малое количество генов, несущих эти инструкции, — всего в пять раз больше, чем нужно для взращивания мухи.
Обнаружилось, что из 3 миллиардов генетических букв, составляющих человеческие гены, которые образуют ДНК, 99,9 процента одни и те же. Очевидно, всего одна десятая процента и делает нас теми, кто мы есть, — умными или глупыми, добрыми или, наоборот, жестокими и так далее. Причем основную ответственность за генетические ошибки несет мужская сперма, в которой содержится вдвое больше мутаций, чем в женской яйцеклетке, но она же является и главным источником эволюционных инноваций
В 80-е годы ученые брались за расшифровку только коротких молекул ДНК: вирусных, митохондриальных или плазмидных. (Плазмида — кольцевая молекула ДНК, находящаяся в цитоплазме бактерий и состоящяя из небольшого количества генов.) Но первые шаги были сделаны. И вот тогда в 1988 году наиболее отчаянные исследователи выступили с предложением — расшифровать геном человека.
В Америке таким пионером стал Джеймс Уотсон — один из двух «отцов» двойной спирали ДНК, а в России — академик Александр Александрович Баев, известный специалист в области генной инженерии. В обеих странах реакция ученых на эти предложения была неоднозначной.
Оппоненты расшифровки генома считали поставленную задачу нереальной, ведь ДНК человека в десятки тысяч раз длиннее молекул ДНК вирусов или плазмид. Второй аргумент против: проект потребует миллиарды долларов, которых недосчитаются другие области науки, поэтому геномный проект затормозит развитие науки в целом. И наконец, если все-таки деньги найдутся и геном человека будет расшифрован, то полученная в результате информация не оправдает затрат.
Но вот здесь и сыграли свою роль научный авторитет и неутомимая энергия Уотсона. В науке он считается полубогом и был и остается очень яркой личностью. Он объехал пол-Америки, выступая в научных коллективах, написал много статей в газетах, полемизировал с противниками. После того как Уотсон встретился с президентом США, проблему генома вынесли на обсуждение в конгресс, и была принята национальная программа США «Геном человека».
Над этой программой работали учёные многих стран мира, но по сути дела в азартной игре под названием «Кто первый крикнет ура?», то есть сообщит об успешной расшифровке генома, играли две команды ученых — из частной американской корпорации из штата Мериленд Celera Genomics и Human Genome Project, финансируемого из правительственных фондов.
В распоряжении Celera находится суперкомпьютер , который позволяет складывать выявляемые “кирпичики” ДНК в значимую последовательность, но, как отмечали некоторое время назад российские эксперты, “Celera стоит на плечах у Генома Человека”, то есть использует то, что уже сделано по глобальному проекту. Дело в том, что «Селера» подключилась к программе не сначала, а когда проект уже шел полным ходом. Спохватились крупные фармацевтические компании, осознавшие, что, если вся информация о геноме окажется в открытом доступе, они могут лишиться интеллектуальной собственности — нечего будет патентовать. Озабоченные этим, они вложили миллиарды долларов в «Селеру Геномикс». Во главе ее встал Крейг Вентер, который имел огромный опыт научной работы по государственной программе «Геном человека». Кроме того, он оказался выдающимся организатором
Появление «Селеры» сыграло позитивную роль, потому что те, кто был занят в государственных программах, почувствовали жесткую конкуренцию. Кроме того, после создания компании остро встал вопрос об эффективности использования государственных капиталовложений. Ведь Вентер заявил, что все публичные программы малоэффективны и что в его фирме геном секвенируют быстрее и дешевле. Научному сообществу срочно пришлось повышать эффективность работы по расшифровке генома. Сначала работа шла несогласованно, потом были достигнуты определенные формы сосуществования
Конкурирующие организации по взаимной договоренности одновременно объявили о завершении работ по расшифровке. Но разница во времени между Америкой и Англией вывела на первое место Human Genome Project.
Следует заметить что использование одного метода может давать систематическую ошибку, которую трудно «поймать». А «Селера Геномикс» и международный консорциум использовали разные методические подходы к секвенированию.
«Селера» применяла так называемое дробление — shotgun. ДНК дробили на маленькие фрагменты и у всех полученных «кусочков» определяли нуклеотидную последовательность. Одни и те же «кусочки» попадали в секвенатор по 10-20 раз. Компьютер потом «выстраивал» полученные данные в одну цепочку. Таким образом ученые колоссально экономили время и деньги на подготовке генетического материала — раздробить ДНК на фрагменты легко, — но теряли на том, что по много раз секвенировали одни и те же фрагменты.
У международного консорциума была противоположная тактика: «кусочки» молекул ДНК выстраивали друг за другом — делали карту, а потом по ней «шли». Таким образом ученые теряли время на подготовке материала, но выигрывали в секвенировании — не нужно было по многу раз делать одно и то же.
Именно потому, что разные стратегии дают во многом совпадающие результаты, им можно верить.
Все жалуются: «Селера» не все публикует». Какое это имеет значение, если на то, чтобы описать полученные данные уйдут скорее всего годы и годы. Море информации, которой никогда не было в биологической науке…
Сегодня геном — это на 95% нечто, чего мы не понимаем. Возникли огромные «ножницы» между знанием и пониманием. В отношении значительной доли генома мы много знаем, но мало что понимаем. Вот в 5% генома, где находятся те самые 32 тысячи генов, мы знаем многое о структуре и немногое о функциях. По-научному «бессмысленные» участки называют некодирующими. Некоторые американские ученые называют их «junk» — барахлом, мусором или «эгоистической ДНК». Однако Если мы не понимаем, для чего нужны какие-то участки ДНК, сие еще не значит, что они — мусор.
У бактерии «бессмысленных» участков вообще нет. У дрожжей почти нет. По мере повышения уровня организации живого организма накапливается все больше некодирующей ДНК. Я думаю, что некодирующие последовательности ДНК могут оказаться резервуаром эволюции, складом «запчастей». Если с каким-либо геном что-то не в порядке, возможно, клетка использует фрагменты некодирующей ДНК для ремонта поврежденного.
Следует отметить, что сделан лишь первый шаг. Расшифровать нуклеотидную последовательность — это все равно, что читать книгу, просто произнося названия букв подряд. Найти ген, значит понять, как буквы складываются в слова. Но нужно ещё понять и смысл фразы. Так, что основная работа впереди.
То, что мы можем получить в результате решения этой задачи, можно продемонстрировать на примере расшифрованных хромосом …
Или еще одного интересного аспекта, который начал развиваться два-три года назад и особенно бурно в многонациональной России. Ее населяют разные этнические группы. Оказывается, что геном у разных народностей слегка различается. Можно в ДНК выделить определенный «рисунок» нуклеотидов (особое расположение), который будет говорить о том, что этот человек — башкир, а этот — татарин. Геномы представителей разных этнических групп не идентичны, но различия между ними чрезвычайно незначительны, хотя и абсолютно достоверны, и поэтому возможно сравнивать разные этнические группы.
Такой подход связывает геномику с историей, лингвистикой, археологией, палеонтоло гией, этнографией. И возникают поразительно интересные находки. Так Славяне близки по материнской линии (поскольку изучается митохондриальная ДНК, передающаяся ребенку от матери) к нашим западным соседям: немцам, угро-финнам.
***
— Правда ли, что международная программа «Геном человека» прекращена и в связи с этим государственные средства на нее в США больше не выделяются?
— Основные цели структурной части программы уже в целом выполнены, хотя какие-то участки генома ученые будут «дорасшифровывать» еще долго. Программа «Геном человека» не прекращает существование, она меняет ориентацию: из структурной геномики превращается в функциональную, чтобы понять функции тех генов, которые ученые узнали. Например, американцы только что выделили 300 миллионов долларов на биоинформатику, потому что без нее ничего нельзя выяснить. Программа наконец-то начнет возвращать человечеству затраченные на нее миллиарды долларов.
Знаете, как говорят англичане: «This is the end of the beginning» — «Это конец начала». Вот именно эта фраза точно отражает нынешнюю ситуацию. Начинается самое главное и, я совершенно уверен, самое интересное.
Развитие науки идет таким образом, что мы все точнее и точнее знаем, чего не знаем. Теперь стало совершенно ясно — мы не понимаем, для чего нужна основная часть генома. «Что» — известно, «как» — предстоит узнать. Сейчас уже возможно сформулировать задачу, а это в науке самое трудное. Поставлен вопрос, который до расшифровки генома корректно поставить было просто невозможно.
secretworlds.ru
