Степень окисления фосфора (P), формула и примеры
Общие сведения о степени окисления фосфора
В чистом виде белый фосфор совершенно бесцветен и прозрачен; технический белый фосфор окрашен в желтоватый цвет и по внешнему виду похож на воск. Плотность 1,83 г/см3. На холоду белый фосфор хрупок, но при температуре выше 15oС становится мягким и легко режется ножом. На воздухе он легко окисляется, вследствие чего светится в темноте. Имеет молекулярную кристаллическую решетку в узлах которой находятся тетраэдрические молекулы P4. Ядовит.
Красный фосфор состоит из нескольких форм, являющихся полимерными веществами, состав которых до конца не изучен. Медленно окисляется на воздухе, не светится в темноте, неядовит. Плотность 2,0-2,4 г/см3. При нагревании сублимируется. При охлаждении паров красного фосфора получается белый фосфор.
Черный фосфор образуется из белого путем его нагревания под высоким давлением при 200-220oС. По внешнему виду похож на графит, жирный на ощупь. Плотность – 2,7 г/см
Степень окисления фосфора в соединениях
Фосфор может существовать в виде простого вещества (см. выше) – неметалла, а как известно, степень окисления неметаллов в элементарном состоянии равна нулю.
При нагревании фосфор окисляет почти все металлы, образуя фосфиды, в которых его степень окисления равна (-3):Mg3P-32, P-3H3.
В качестве соединений фосфора, в которых он проявляет степень окисления равную (+1) можно рассматривая производные фосфинат-иона ([P+1O2H2]—), например его водородное производное – фосфиновую кислоту (H[P+1O2H2]).
Для фосфора характерна степень окисления (+3): P+3Cl3, P+3Br3, P+32O3, H2[P+3O3H] (фосфоновая кислота).
Фосфор проявляет степень окисления (+5) в соединениях с галогенами, кислородом, серой и азотом (P+5Cl5, P+52O5, P+52S5, P+53N5), а также в соединениях смешанного типа (H3P+5O4, P+5OCl3, P+52O3S2, P+5ON, P+5NCl2 и т.д.).
Примеры решения задач
ru.solverbook.com
Соединения фосфора Степень окисления -3
В отличие от азота фосфор не реагирует с водородом непосредственно, т.е. водородные соединения получают косвенным путем:
Са3P2 + 6 H2O =3Са(ОН)2 + 2PH3
4Р + 3 NaOH + 3 H2O = PH3 + 3 NaH2PO2
3 Р -1е +2ОH¯ = H
1 Р+ 3е + 3H2O = РН3 + 3ОН¯
3Р + Р + 6ОH¯ +3 H2O = H2PO2¯ + РН3 +3ОН¯
Фосфин – газ с неприятным запахом, мало растворим в воде. Реагирует с сильными кислотами, образуя соли фосфония, которые в воде полностью гидролизуются.
PH3 + НС1 = PH4Cl.
Фосфин очень сильный восстановитель
PH3 + 4 CI2 + 4 H2O = H3PO4 +8НС1
1 PH3 – 8е + 4Н2О = H3PO4 + 8Н +
4 CI2 + 2е = 2 С1¯
PH3 + 4Н2О +4 CI2 = H3PO4 + 8Н + + 8С1.¯
Аналогом гидразина является дифосфин, который образуется одновременно с фосфином при гидролизе фосфидов. Представляет собой бесцветную жидкость, которая на воздухе самовоспламеняется, очень сильный восстановитель.
Степень окисления +1 :
В качестве соединений фосфора +1 можно рассматривать производные [РО2Н2]¯ — комплекса (фосфинат- ион). Его водородное производное Н[РО2Н2]-фосфиновая кислота в обычных условиях – бесцветное кристаллическое вещество хорошо растворимое в воде. Водный раствор Н[РО2Н2] — сильная одноосновная кислота, Ка = 7,9 × 10 2. Как кислота, так и ее соли (фосфинаты) – сильные восстановители .
Соединения фосфора +3
У производных фосфора +3 в образовании связи принимают участие три или четыре sp3 — гибридные орбитали атома фосфора, что соответствует пирамидальному или тетраэдрическому расположению связей. Бинарные соединения фосфора носят кислотный характер, о чем свидетельствует их гидролиз: Р2О3+ 2H
РCI 3 + 3H2O = 3HCI + Н2[РО3Н].
При гидролизе образуется фосфоновая кислота, в обычных условиях это бесцветное, гигроскопическое, легко растворимое в воде твердое вещество. Это кислота средней силы. Соли фосфоновой кислоты называются фосфонатами.
Как двухосновная кислота фосфоновая кислота может образовывать и средние соли Na 2[РО3Н] – фосфонаты, и кислые соли Na Н[РО3Н] — гидро-фосфонаты. Соединения фосфора (111) – сильные восстановители.
Соединения фосфора +5
Фосфор проявляет степень окисления +5 в соединениях с галогенами, кислородом, серой, азотом, а также в соединениях смешанного типа. Это самая устойчивая степень окисления фосфора. Бинарные соединения фосфора с кислородом, серой и азотом полимерны. Все они построены из тетраэдрических структурных единиц типа РХ4. Оксид фосфора в твердом состоянии имеет несколько модификаций, отличающихся характером расположения тетраэдров РО 4. Оксид фосфора в парообразном состоянии имеет состав Р4О10.
Р2О5 получают сжиганием фосфора, он имеет вид снегообразной массы. Оксид легко взаимодействует с водой, в связи с чем его широко используют для осушения газов и жидкостей.
Р2О5 + H2O =2НРО3 — метафосфорная кислота;
Р2О5 + 3H2O = 2Н3РО4 — ортофосфорная кислота;
Р2О5 + 2H2O = 2Н4РО7 — пирофосфорная кислота.
Молекула Н3РО4 имеет форму искаженного тетраэдра, в твердом и жидком состоянии молекулы объединяются за счет водородных связей, этим обусловлена повышенная вязкость растворов ортофосфорной кислоты.
Ортофофосфорная кислота – кислота средней силы ( К
Са3 (РО4) 2 + 3 H2SO4 = 3 СаSO4 + 2H3 РО4.
Ортофосфорная кислота – продукт гидролиза всех соединений фосфора (V).
Полифосфорные кислоты образуются при взаимодействии Р2O5 с ортофос-форной кислотой. Из фосфатов растворимы лишь фосфаты щелочных ме-таллов и аммония, соли бесцветны. Основная масса фосфатов применется в качестве удобрений: Са3 (Н2РО4) 2 × 2h3O — суперфосфат, СаНРО4 × 2H2O –преципитат, смесь (NH4 )Н2РО4 и (NH4)2НРО4 – аммофос.
Лекция 5
ХИМИЯ D — ЭЛЕМЕНТОВ
У элементов побочных подгрупп за исключением Zn , Cd, Hg, заполняются внутренние (n-1) d –оболочки. По свойствам они в той или иной степени близки к элементам соответствующих главных подгрупп. Это сходство особенно велико в 3-й группе, так как в этой группе только начинается заполнение d – подуровня. Затем оно уменьшается от 3-й группы к 7-й, а в 8-й — совсем исчезает.
Так как в атомах d — элементов на внешнем энергетическом уровне содержится не более двух электронов, то все эти элементы — металлы. Наличие d -электронов на предпоследнем энергетическом уровне, энергия которых мало отличается от энергии s– электронов последнего уровня, приводит к тому, что все d – элементы, за редким исключением, могут проявляют переменную валентность, их ионы окрашены хотя бы в одной степени окисления
Для каждой декады d-элементов наиболее устойчивы электронные конфигурации d 0 (Sc, ) , d5 ( Мn ) и d
В отличие от соединений главных подгрупп устойчивость соединений, отвечающих высшей степени окисления в подгруппах с ростом заряда ядра увеличивается.
В каждой подгруппе I-й элемент существенно отличается по свойствам от последующего, а 2 и 3-й очень похожи между собой, так как в результате лантаноидного сжатия их радиусы очень близки по размерам.
Для d-элементов характерно не только вертикальное но и горизонтальное сходство, например, Fe больше похоже на Cо иNi, чем на своих благородных
аналогов Ru и Os.
В некоторых случаях у элементов побочных групп особенно велико сходство со вторым элементом соответствующей главной подгруппы, Zn — Mg, Sc — Al и т.д.
Для d-элементов характерно образование соединений нестихиометричес-кого состава, например, МgО, но Тi1,983О2 .
В периоде слева направо восстановительная способность ионов в низших степенях окисления и окислительная способность ионов в высших степенях окисления увеличивается ( например , Zn 2+ -плохой восстановитель, а Тi2+ -хороший , Тi4+ — плохой окислитель, VO3— — окислитель средней силы, Cr2O72- и Mn2O7— -очень хорошие окислители).
В группах сверху вниз восстановительная способность ионов в низших степенях окисления и окислительная способность ионов в высших степенях окисления уменьшается.
Большинство d-элементов склонны к образованию полимерных неоргани-ческих соединений, многие образуют соединения кластерного типа.
ЭЛЕМЕНТЫ VIII ГРУППЫ
Восьмую группу разделяют на металлы триады железа и платиновые металлы. В семейство железа входят железо, кобальт и никель :
| Электронная структура | Fe
3d | Co 3d74s2 | Ni 3d84s2 |
| Атомная масса | 55,85 | 58,93 | 58,71 |
| Радиус атома, А0 | 1,26 | 1,257 | 1,245 |
| Валентность | II, III, УI | II, III | II, III |
| Координационные числа | 6, 12 | 4, 6, 8 | 6, 8 |
| Потенциалы ионизации, эв | 7,81 | 7,86 | 7,63 |
Распространение в природе.
Железо встречается в основном в виде оксидных руд: Fe2O3 красный же-
лезняк, Fe3O4 – магнитный железняк, FeOOH · nH2O –бурый железняк. Чисто кобaльтовые руды встречаются редко, более распространены CoAsS – кобальтин. Кобaльт обычно содержится в медных, никелевых, серебряных и железных рудах. Никель встречается в виде соединений с мышьяком и серой.
Получение:
Реакции, лежащие в основе получения железа, можно представить системой: COCOCO
Fe2O3 Fe3O4 FeO Fe
Углерод и примеси окисляют либо в мартеновских печах, либо по способу Бессемера. Последнее время из-за дороговизны коксующихся углей в промышленности используют метод прямого восстановления железной руды смесью СО и Н2. Однако в данном случае требуется сложная подготовка руды в виде окатышей.
Производство Со и Ni, которые обычно содержатся в рудах совместно, – сложный технологический процесс. Трудности связаны с небольшим со-держанием Со и Ni в руде и близостью их свойств. Для извлечения Ni и Со используют гидро – и пирометаллургические методы. На конечном этапе оксиды Со и Ni восстанавливают углеродом в электропечах, а затем про-водят их очистку электролизом.
Свойства простых веществ:
I) компактные железо, кобальт и никель – твердые металлы, стойкие на воздухе до 400 – 700ºС, благодаря защищающей их оксидной пленке. Наиболее стоек к действию окисляющих реагентов Ni, наименее – Fe. В высодисперсном состоянии металлы пирофорные; еских соединений не образуют, но поглощают его в значительных количе
2) с водородом химич ствах;
3) при нагревании в мелкораздробленном состоянии Fe, Co, Ni взаимодействуют практически со всеми неметаллами, образуя при этом твердые растворы (с С, Si, N, P, B) или соли ( F, Cl, S ). При этом образуются соли железа (111) и Со и Ni (11): 5) в ряду напряжения стоят до водорода (относятся к металлам средней активности), поэтому вытесняют его из растворов разбавленных кислот.
Ме + 2Н+ = Ме2+ + Н2.
В концентрированных серной и азотной кислотах пассивируются.
В водной среде чистые Fe, Co, Ni мало подвержены коррозии, особенно, Ni (устойчивость Fe к коррозии зависит от его чистоты).
2Fe + 3Cl2 = 2FeCl3;
Ni + Cl2 = NiCl2.
4) c растворами и расплавами щелочей не взаимодействуют;
Соединения Fe, Co, Ni в одинаковых степенях окисления очень похожи по структуре и термодинамическим свойствам, особенно большое сходство проявляют Со и Ni.
Степень окисления + 2
FeO CoO NiO
Fe(OH)2 Co(OH)2 Ni(OH)2
Основные свойства уменьшаются
Все гидроксиды проявляют основные свойства
Э2+ + 2ОН¯ = Э(ОН)2↓
Э(ОН)2 + 2Н+ = Э 2+ + 2Н2О.
Гидроксод железа (II) очень неустойчив, мгновенно окисляется кислородом воздуха:
4Fe(OH)2 + O2 = 4Fe(OH)3 + 2H2O;
1 O2 + 4ē + 2H2O = 4OH¯
4 Fe(OH)2 – 1 ē + OH¯ = Fe(OH )3+ H2O.
O2 +2H2O+4Fe(OH)2 +4OH¯=4OH¯+ Fe(OH )3+ 4H2O
Значительно медленнее окисляется Со(ОН)2:
4Co(OH)2 + О2 + 2H2O = 4Co(OH)3.
Гидроксид Ni(II) кислородом воздуха не окисляется, для этого нужен более сильный окислитель, например Вr2:
2Ni(OH)2+ Br2+2NaOH=2Ni(OH)3+2NaBr;
2 Ni(OH)2 – 1 ē + OH¯= Ni(OH)з
1 Br2 + 2 ē = 2Br ¯
2 Ni(OH)2 + 2OH¯ + Br2 = Ni(OH)з + 2Br ¯
Вышесказанное говорит о том, что восстановительная способность в ряду Fe2+, Co2+, Ni2+ уменьшается.
Соли Fe, Co, Ni(II) легко гидролизуются по катиону, например:
FeCl2 + H2O ↔ FeOHCl + HCl.
Для соединений Fe(II), Co(II), Ni(II) очень характерно комплексообразо-вание:
FeCl2 + 6KCN = K4[Fe(CN)6] + 2KCl.
Желтая кровяная соль широко используется в аналитической химии для обнаружения ионов Fe3+ :
FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6] + 3KCl;
берлинская лазурь
NiCl2 + 4KCN = K2[Ni(CN)4] + 2KCl.
Растворяя гидроксиды в концентрированном аммиаке, получают аммиакаты:
Со(ОН)2 + 6NH4OH = [Co(NH3)6](OH)2 + 6H2O.
Аммиакаты Fe получают при действии аммиака на безводные соли
FeCl2 + 6NH3 = [Fe(NH3)6]Cl2;
oни легко разрушаются водой
[Fe(NH3)6]Cl2 + 2HOH = Fe(OH)2 + 2NH4Cl + 4NH3.
Действием очень концентрированных растворов щелочей можно получить гидроксокомплексы, например:
Fe(OH)2 + 2NaOH = Na2[Fe(OH)4].
В водных растворах образуются аквакомплексы состава [Э(Н2О)6]2+.
Производные анионных комплексов Fe2+ малостойки и напоминают двойные соли (за исключением цианидов).
Степень окисления +3
Степень окисления +3 наиболее характерна для железа. Бинарные соединения Со(III), Ni (III) нехарактерны, для них данная степень окисления проявляется обычно в комплексных соединениях.
Fe2O3 Co3O4 —
Fe(OH)3 Co(OH)3 Ni(OH)3
основные свойства усиливаются
устойчивость уменьшается
Fe3+ + 3OH¯= Fe(OH)3
Fe(OH)3 + 3H+ = Fe3+ + 3H2O;
Fe(OH)3+NaOH tº, сплав NaFeO2 + 2H2O.
Co(OH)3 и Ni(OH)3 получают окислением двухвалентных гидроксидов:
2Со(ОН)2 + Н2О2 = 2Со(ОН)3
1 Н2О2+ 2ē =2ОН ¯
2 Со(ОН)2 – 1ē + ОН ¯= Со(ОН)3
Н2О2 + 2ОН ¯ + 2Со(ОН)2 = 2 Со(ОН)3 + 2ОН ¯
так как для Ni степень окисления +2 более устойчива, чем для Со, то и для окисления Ni(OH)2 требуется более сильный окислитель.
2Ni(OH)2 + Br2 + 2NаOH = 2Ni(OH)3 + 2NaBr.
Таким образом, окислительная способность в ряду Fe3+, Co3+, Ni3+ увеличивается, что можно подтвердить следующими уравнениями реакций:
Fe(OH)3 + 3HCl(к) = FeCl3 + 3H2O
2Co(OH)3 + 6HCl(к) = 2CoCl2 + Cl2↑ + 6 H2O
2 2Cl¯ – 2ē = Cl2
1 Co(OH)3 + 1ē + 3H+ = Co2+ + 3H2O
2 Co(OH)3 + 6H+ + 2Cl¯ = 2 Co2+ + 6H2O + Cl2
Ni(OH)3 + 6HCl(к) = 2NiCl2 + Cl2 ↑ + 6 H2O
Аналогично идут реакции с HNO3 и H2SO4 (конц.)
Ni(OH)3 + H2SO4 = NiSO4 + O2 ↑ + 10 H2O
4 Ni(OH)3 + 1ē + 3H+ = Ni2+ + 3 H2O
2 H2O – 4ē = O2 + 4H+
4 Ni(OH)3 + 12H+ + 2 H2O = 4 Ni2+ + 12 H2O + O2 + 4H+
Соли Fe(111) достаточно легко подвергаются гидролизу (сильнее, чем Fe2+):
FeCl3 + H2O ↔ FeOHCl + HCl;
2FeCl3 + 3Na2CO3 + 3H2O = 2Fe(OH)3↓ + 3CO2 ↑ + 6NaCl.
Действуя аммиаком на безводные соли, получают аммиакаты
ЭCl3 + 6NH3 = [Э(NH3)6]Cl3.
Устойчивы и цианиды
FeCl3 + 6KCN = K3[Fe(CN)6] + 3KCl.
Красная кровяная соль
Данная соль является реактивом на Fe2+:
FeCl2 + K3[Fe(CN)6] = KFe[Fe(CN)6] + 2KCl.
Турнбулевая синь
Степень окисления +6
При действии на соединения Fe(III) сильных окислителей можно получить соединения железа (VI):
Fe(OH)3 + 3Br2 + 10KOH = 2K2FeO4 + 6KBr ;
2 Fe(OH)3 — 3ē + 5OH¯ = FeO42– + 4H2O;
3 Br2 + 2ē = 2Br¯
2 Fe(OH)3+ 10OH¯ + 3Br2 = 2FeO42– + 8H2O +2Br¯.
Ферраты – сильные окислители (сильнее, чем KMnO4) :
2KFeO4 + 2NH3 = 2FeOOH + N2↑ + 4KOH;
2 FeO42– + 3ē + 4H2O = Fe(OH)3 +5OH¯;
1 2NH3 – 6ē = N2 + 6H+;
2FeO42– + 6H2O + 2NH3 = FeOOH +5OH¯ + N2 + 6H+.
Лекция 6
stydopedia.ru
Фосфор степени окисления — Справочник химика 21
Соединения фосфора (V). Фосфор проявляет степень окисления +5 в соединениях с галогенами, кислородом, серой и азотом [c.371]Фосфор Р (Is 2s 2/f 3s Зр ) по числу валентных электронов является аналогом азота. Однако как элемент 3-го периода он существенно отличается от азота — элемента 2-го периода. Это отличие состоит в том, что у фосфора больше размер атома, меньше энергия ионизации, большее сродство к электрону и большая поляризуемость атома, чем у азота. Максимальное координационное число фосфора шесть. Как и для других элементов 3-го периода, рл — рл-связывание для атома фосфора не характерно и поэтому в отличие от азота sp- и sp -гибридные состоянья орбиталей фосфора неустойчивы. Фосфор в соединениях проявляет степени окисления от —3 до +5. Наиболее характерна степень окисления +5. [c.365]
Соединения со степенью окисления фосфора —3 [c.410]
Наиболее устойчива для фосфора степень окисления +1 [c.426]
Фосфор проявляет степень окисления +5 в соединениях с галогенами, кислородом, серой и азотом [c.414]
К подгруппе ванадия относятся элементы побочной подгруппы пятой группы ванадий, ниобий и тантал. Имея в наружном электронном слое атома два или один электрон, эти элементы отличаются от элементов главной подгруппы (азота, фосфора и др.) преобладанием металлических свойств и отсутствием водородных соединений. Но производные элементов обеих подгрупп в высшей степени окисленности имеют значительное сходство. [c.651]
Соединения со степенью окисления фосфора —3. При нагревании фосфор окисляет почти все металлы, образуя фосфиды. В зависимости от природы металла доля того или иного типа связи в фосфидах меняется в широких пределах. Так, фосфиды s-элементов И группы состава Э3Р2 можно рассматривать как ионно-ковалентные соединения. Они солеподобны, легко разлагаются водой [c.367]
Составьте формулы следующих соединении а) нитрида лития (соединения лития с азотом) б) сульфида алюминия (соединения алюминия с серой) в) фторида фосфора, в которых электроположительный элемент проявляет максимальную степень окисления. [c.47]
Аналогичное поведение обнаруживается и у элементов группы VA, но граница между металлами и неметаллами в этой группе проходит ниже. Азот и фосфор являются неметаллами, химия их ковалентных соединений и возможные состояния окисления определяются наличием пяти валентных электронов в конфигурации Азот и фосфор чаще всего имеют степени окисления — 3, -Ь 3 и +5. Мыщьяк As и сурьма Sb-семи-металлы, образующие амфотерные оксиды, и только висмут обладает металлическими свойствами. Для As и Sb наиболее важным является состояние окисления + 3. Для Bi оно единственно возможное, если не считать степеней окисления, проявляемых в некоторых чрезвычайно специфических условиях. Висмут не может терять все пять валентных электронов требуемая для этого энергия слишком велика. Однако он теряет три бр-электро-на, образуя ион Bi . [c.455]
У фосфора по сравнению с азотом энергия связей с рл-донорными атомами увеличивается, а энергии связей Э — Н и Э — С уменьшаются (табл. 44). Из возможных степеней окисления фосфора +5, +3, +1 и —3 наиболее характерна +5. [c.408]
Они проявляют в соединениях степень окисления —3, -1 3, +5. Степень окисления -Н5 у фосфора более устой- [c.78]
Окислительно-восстановительные реакции весьма типичны для кислородных соединений азота и фосфора. Для определения направления протекания окислительно-восстановительных реакций можно использовать значения стандартных электродных потенциалов или свободной энтальпии АО. Наглядное представление о положении равновесия или о направлении хода реакций (без учета кинетических факторов) можно получить из диаграммы окислительных состояний элемента в водном растворе. Для ее построения необходимо найти степень окисления элемента в простом соединении или ионе (если атомы элемента связаны только с атомами кислорода или водорода), которая численно равна формальному заряду на атоме элемента, если принять для атома кислорода заряд —2, а для атома водоро- [c.540]
Чем обусловлена высокая стабильность иона Р0 Одинаковы ли причины малой устойчивости ионов РО7 и Р0 Учесть координационное число атома фосфора в ионе, долю л-связанности между атомами кислорода и фосфора, степень окисления атомов фосфора. [c.152]
Следует заметить, что эта реакция эквивалентна восстановлению. Действительно, поскольку атом фосфора имеет низкую электроотрицательность (2,1 по шкале Полинга), то в производных фосфора степень окисления связанного с ним углерода равна нулю, что находится в согласии с результатами гидролиза таких соединений. [c.225]
В земной коре в соответствии с его устойчивой степенью окисления фосфор содержится в основном в виде фосфатов (V). Наиболее [c.365]
Когда элемент образует несколько рядов соединений, соответствующих различным степеням окисления, после названия соединения в скобках дается указание либо на валентность катиона (римской цифрой), либо на число атомов галогена, кислорода, серы или кислотного остатка в молекуле соединения (прописью). Например, железо хлористое (П1), фосфор хлористый трех), марганца окись (дву). При этом обозначение валентности дается обычно для менее характерных валентных состояний. Например, для меди в случае двухвалентного состояния указание на валентность опускается, одновалентная же медь обозначается так медь иодистая (I). [c.9]
Элементы группы 5А проявляют самые разнообразные свойства, от сильно неметаллических у азота до явно металлических у висмута. Азот и фосфор обнаруживают степени окисления от -Ь 5 до — 3. Фосфор, не столь электроотрицательный, как азот, чаще, чем азот, встречается в состояниях с положительными степенями окисления. Важнейшим источником азота служит земная атмосфера, в которой он существует в виде молекул N2- Наиболее важным промышленным процессом связывания N2 в соединения является процесс получения аммиака по методу Габера. Другой важный промышленный процесс, процесс Оствальда, используется для превращения МНз в азотную кислоту НМОз-Это сильная кислота и одновременно хороший окислитель. Соединения азота применяются как важные сельскохозяйственные удобрения. [c.330]
Белый фосфор — огнеопасное и чрезвычайно ядовитое вещество. Он легко загорается (возможно самовоспламенение), температура воспламенения 40 °С. Его легко зажечь, дотронувшись до него пробиркой с горячей водой. Горение сопровождается разбрызгиванием, попадание брызг горящего фосфора на кожу приводит к исключительно тяжелым ожогам. Отравление белым фосфором может происходить и через кожу, так как фосфор растворим в жировой ткани. Прн постоянном воздействии малых количеств фосфора происходит хроническое отравление организма, сопровождающееся разрушением костей. Сильно ядовиты также соединения фосфора низких степеней окисления. [c.413]
Внешний электронный слой атома фосфора содержит 5 электронов (3s 3p ). В соединениях соответственно проявляются степени окис-лепи.ч — -5, — -3 и —3. Высокие степени окисления предопределяют преимущественно ковалентный тип связи фосфора с другими элементами. В воде фосфор не растворяется и с ней не реагирует. На воздухе фосфор горит с образованием оксида фосфора (V) [c.125]
Не может, так как оба исходных вещества содержат азот и фосфор в максимальной степени окисления и пи одно из веществ не может быть окислено дальше. Здесь возможна лишь реакция обмена [c.227]
Все эти ионы имеют тетраэдрическое или искаженно тетраэдрическое строение. Учитывая различие в электроотрицательностях атомов, можно считать, что степень окисления фосфора в указанном ряду изменяется от —3 до +5. [c.412]
Фосфор имеет электронную конфигурацию [Ке]35 3р . Подобно азоту, он проявляет степени окисления, начиная от — 3 и кончая + 5. Благодаря более низкой электроотрицательности фосфор чаще, чем азот, встречается в положительных состояниях окисления. Более того, соединения, в которых фосфор имеет степень окисления + 5, не являются сильными окислителями, как соответствующие соединения азота. Соединения, в которых фосфор находится в состоянии окисления — 3, гораздо более сильные восстановители, чем соответствующие соединения азота. [c.321]
Здесь наблюдается постепенный переход ог типично основных оксидов натрия и магния к амфотерным, или промежуточным (алюминия), и к кислотным оксидам фосфора, серы и хлора. Этот пе-ре.ход сопровождается понышепием окислительного числа эле.мен-тов, образующих оксиды. То же наблюдается у оксидов одного и того же элемента в разных степенях окисления. Так, например, в ряду [c.126]
В каких пределах может изменяться степень окисления фосфора [c.94]
От какого элемента — от фосфора к сере или наоборот — будут смещаться электроны при образовании соединения между этими элементами Выведите формулу такого соединения между ними, в котором более электроположительный элемент проявляет максимальную степень окисления. [c.94]
Мышьяк и сурьма по большинству химических свойств напоминают фосфор. Например, оба эти элемента образуют га.погениды состава МХ3 и МХ5, структура и химические свойства которых близки соответствующим галогенидам фосфора. Соединения этих элементов с кислородом также очень сходны с соответствующими соединениями фосфора, однако они не так легко достигают своей высшей степени окисления. Так, при горении мышьяка в кислороде образуется продукт формулы А540й, а не А540,о- Высший оксид мышьяка можно получить окислением А540б каким-либо сильным окислителем, например азотной кислотой [c.327]
Определение степени окисления элемента в какой-либо молекуле сводится к простой арифметической операции, так как сумма степеней окисления атомов всех элементов, входящих в состав молекулы, равна нулю. Например, необходимо определить степень окисления фосфора в фосфорной кислоте Н3РО4. Поскольку у кислорода степень окисления —2, а у водорода -Ь1, то для нулевой суммы у фосфора степень окисления должна быть + 5[3 (-f 1) + 1 (+ 5) + 4 (- 2) = 0]. [c.89]
Для установления степени окисления элементов в соединениях можно пользоваться таблицей электроотрицательностей элементов (см. разд. 4.4.1). При этом следует иметь в виду, что при образовании хи.мической связи электроны смещаются к атому более электроотрицательного элемента. Так, относительная электроотрицательность фосфора равна 2,2, а йода 2,6, Поэтому в соединении PI3 общие электроны смещены к атома.м йода, и степеш окисления фосфора и йода равны соответственно Ч-З и -1. Однако в нитриде йода I3N степени окисления азота и йода равны -3 и -fl, поскольку электроотрицате,льность азота (3,07) выше элекроотрицательности йода. [c.262]
Алгебраическая сумма всех зарядов на атомах (или алгебраическая сумма произведений чисел атомов на их степень окисления), входящих в состав молекулы, равна нулю. Очевидно, чт неизвестная степень окисления одного из атомов в молекуле может быть определена с помощью подобного равенства. Так, исходя из формулы гидроксиламина NHjOH, в молекулу которого входят три атома водорода ( + 3) и один атом кислорода (—2), нетрудно сделат . вывод, что для сохранения электронейтральности молекулы атом азота должен иметь степень окисления —1. Рассуждая подобным же образом, мы найдем, что степень окисления фосфора в [c.141]
Одна[ко понятие степень окпсления очень полезно для классификации веществ и при состап.ленпи химических уравнений. Так, например, определив степень окисления фосфора в соедшгениях (НР «Оз) , НзР 04 и Н4Р2 07, мы видим, что эти соединения являются родственными и должны сильно отличаться по свойствам от соединения Н3Р+Ю3, в котором степень окисления фосфора другая. Особенно широко используется понятие степень- окисления при изучении окислительно-восстановительных реакций. [c.45]
Из фосфорных кислот, которые содержат фосфор в высшей степени окисления +5, наибольшее практическое значение имеют ортофосфорная и полифосфорные кислоты. Общая формула фосфорной и полифосфорных кислот пРгОб-/ гН20. Этих кислот (и их солей — фосфатов) известно очень много. По структуре полмфос-форные кислоты подразделяются на цепочечные и кольцевые. [c.418]
Каков тип химической связи в соединениях, формулы которых а) РНд б) Кз в) РСЦ г) СздРа Какова степень окисления фосфора и связанного с ним элемента в каждом из этих соединений [c.94]
Магнетитовая руда (магнитный железняк). Содержит железо в виде магнетита Рез04 (78,4% Ре), который можно рассматривать как состоящий из окс ов железа П и Ш ГеО РегОз. Степень окисления магнетита, то есть соотношение в нем оксидов железа, характеризуется отношением Геовщ РеО. Для чистого магнетита оно авно 2. В рудах, за счет окисления оксида железа (П), оно повышается до 7 и выше. Подобные руды называются мартитом. В наиболее распространенных рудах содержание железа составляет 50—60%, обычно они содержат серу и фосфор и трудно восстанавливаются. [c.51]
В соответствии с устойчивой степенью окисления фосфор находится в земной коре в основном в виде фосфатов (V). Среди последних наиболее распространены минералы фосфорит Саз(РО02, гидроксил-апатит Саб(Р04)з(0Н), фторапатит Сав(Р04)аР- Фосфор входит в состав животных организмов. Гидроксилапатиты составляют минеральную часть зубов и костей, а сложные органические производные фосфора входят в состав клеток мозга и нервов. [c.408]
В соответствии с полярностью связей в тригалогенидах фосфора они гидролизуются с образованием кислородных соединений фосфора и соответствующих галогеноводородов. Пентагалогениды дают при гидролизе фосфорилгалогениды. Экзотермич-ные реакции гидролиза РВгз и РСЬ дают фосфоновую кислоту, а в определенных условиях и другие кислоты фосфора в низших степенях окисления. Тригалогениды фосфора используются как апротонные растворители с хорошей сольватирующей способностью. [c.538]
С точки зрения критериев, обсуждавшихся в начале данной главы, висмут следует считать скорее металлом, чем неметаллом. Висмут обычно обнаруживает степень окисления + 3 и мало склонен проявлять высшее состояние окисления + 5, столь обычное для фосфора. Наиболее распространенным оксидом висмута является В120з. Это вещество нерастворимо в воде или в основном растворе, но растворяется в кислом растворе. Поэтому его относят к основным ангидридам. Как мы уже знаем, оксиды металлов характеризуются тем, что ведут себя как основные ангидриды. [c.327]
Поскольку для большинства неметаллов возможны и положительные, и отрицательные степени окисления, то для некоторых из них осуществляются реакции самоокисления — самовосстановления (диспропорционирования). Диспро-порционироваиие неметаллов протекает в водных средах и характерно для неметаллов промежуточной окислительной и восстановительной активности. Так, диспропорционируют фосфор, сера, селен, хлор, например [c.339]
Пниктогениды. К пниктогенидам относятся нитриды, фосфиды, арсениды и стибиды — соединения со степенью окисления элемента V главной подгруппы —3. В силу более высокой электроотрицательности и наименьшего радиуса атома азота среди нниктогенидов нитриды по своему составу и свойствам отличаются от производных фосфора, мышьяка и сурьмы, которые имеют и меньшее практическое значение. [c.342]
Соединения водорода. По значению своей электроотрицательности водород близок к фосфору (см. табл. 4.2). Поэтому следовало бы ожидать образования гидридов (соединений со степенью окисления водорода -1) многих металлов, кремния и бора. На самом деле известны солеобразные гидриды для щелочных и щелочноземельных элементов (твердые LiH, СаНг и др.), ковалентные (газообразные Sih5, ВгНе) и металлоподобные. В последнем случае еще не ясно, являются ли они индивидуальными соединениями d- и /-элементов с водородом, или это твердые растворы. [c.344]
chem21.info
Ph4, степень окисления фосфора и водорода в нем
Общие сведения о фосфине и степени окисления в Ph4
Брутто-формула – PH3 (строение молекулы показано на рис. 1). Молярная масса фосфина равна 34,00 г/моль.
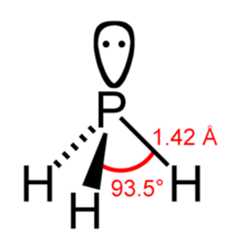
Рис. 1. Строение молекулы фосфина с указанием валентного угла и длины химической связи.
При низких температурах образует твердый кларат 8PH3×46H2O. Плотность – 1,5294 г/л. Температура кипения – (-87,42oC), плавления – (-133,8oC).
В ОВР является сильным восстановителем, окисляется концентрированной серной и азотной кислотами, йодом, кислородом, пероксидом водорода, гипохлоритом натрия. Донорные свойства выражены значительно слабее, чем у аммиака.
Ph4, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав фосфина, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Фосфин – это тривиальное название гидрида фосфора, а, как известно, степень окисления водорода в гидридах равна (+1). Для нахождения степени окисления фосфора примем её значение за «х» и определим его при помощи уравнения электронейтральности:
x + 3×(+1) = 0;
x + 3 = 0;
x = -3.
Значит степень окисления фосфора в фосфине равна (-3):
P-3H+13.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Очень нужно! Определить степень окисления фосфора след. соединений: h4PO4;P2O5;h5P2O7.
Степень окисления определить достаточно легко. Нужно помнить что:1) молекула всегда электронейтральна, т. е. в ней количество плюсов = количеству минусов.
2) у многих химических элементов степень окисления одна во всех соединениях. Например у кислорода практически всегда в сложных веществах степень ок-я равна -2. У водорода чаще всего +1. Для металлов степень окисления можно посмотреть в верхней строчке таблицы растворимости. Там же можно найти и степень окисления неметаллов, входящих в состав бескислородных кислот — сульфид-ион -2, фторид-, хлорид-, бромид- и иодид-ионы -1.
Теперь собственно ваши примеры.
1)Фосфорная кислота. В таблице растворимости находим водород, у него заряд +1. У кислорода, как говорилось выше, -2. Ищем степень ок-я фосфора, помня, что в молекуле кол-во +=кол-ву -. Водорода в молекуле 3, кислорода 4. Значит, уже есть три плюса водорода (3*(+1)) на восемь минусов кислорода (4*(-2)). Не хватает пяти плюсов, их даст фосфор.
Проверяйте: 8 плюсов (+3+5)= 8 минусов (4*(-2))
Итог: водород (+1), фосфор (+5), кислород (-2).
2) Оксид фосфора. У кислорода, как говорилось выше, -2. Ищем степень ок-я фосфора, помня что в молекуле кол-во +=кол-ву -. Фосфора в молекуле 2, кислорода 5. Значит, есть десять минусов кислорода (5*(-2)). Значит, плюсов должно быть десять. Их делим на два атома фосфора, Значит у фосфора степень ок-я равна +5
Проверяйте: 10 плюсов (2*(+5))= 10 минусов (5*(-2))
Итог: фосфор (+5), кислород (-2).
3) Пирофосфорная кислота. В таблице растворимости находим водород, у него заряд +1. У кислорода, как говорилось выше, -2. Ищем степень ок-я фосфора, помня что в молекуле кол-во +=кол-ву -. Водорода в молекуле 4, кислорода 7. Значит, уже есть четыре плюса водорода (4*(+1)) на четырнадцать минусов кислорода (7*(-2)). Не хватает ещё 10 плюсов. Их дадут два атома фосфора. Их делим на два атома фосфора, Значит у фосфора степень ок-я равна +5
Проверяйте: 14 плюсов (4*(+1)+2*(+5))= 14 минусов (7*(-2))
Итог: водород (+1), фосфор (+5), кислород (-2).
Ещё два примерчика от меня
1) КНСО3
По таблице растворимости смотрим калий- (+1), водород (+1). Кислород – (-2).
Считаем: (+1)+(+1) + х — количество плюсов, 3*(-2)=-6 – т. е. минусов будет 6.
2+х=6 Значит, степень ок-я углерода в гидрокарбонате калия (+4).
2) бромид железа (!!!) – ГеВч3
У железа степень ок-я может быть (+2) и (+3). Степень ок-я брома в бромидах (по таблице растворимости) (-1). Кол-во плюсов (+х) должно быть равно кол-ву минусов. Ионов брома исходя из формулы – три. Значит, и минусов будет три, т. к. (3*(-1)).
Значит, степень ок-я железа должна быть (+3).
Надеюсь, это поможет вам в дальнейшем самостоятельно определять степень ок-я в любых веществах. Удачи!
otvet.mail.ru
Степень — окисление — фосфор
Степень — окисление — фосфор
Cтраница 1
Степень окисления фосфора зависит от температуры в зоне горения и от скорости диффузии кислорода к поверхности жидкого фосфора. Чтобы обеспечить полноту сгорания и исключить возможность образования низших оксидов фосфора, процесс ведут при температуре 1000 — 1400 С и двукратном избытке воздуха. [1]
Определите степень окисления фосфора в таких соединениях: фосфорная кислота, фосфин, фосфорный ангидрид, фосфат кальция, фосфид магния. [2]
Исходя из степени окисления фосфора в соединениях РН3, Н3РО4, Н3РО3, определите, какое из них является только окислителем, только восстановителем и какое может проявляться как окислительные, так и восстановительные свойства. [3]
Бинарное соединение, степень окисления фосфора равна — III. [4]
Соединения фосфора, в которых степень окисления фосфора равна 1, 3, являются сильными восстановителями. К ним относится фосфористая кислота НзРОз и ее соли и фосфорноватистая кислота Н3РО2 и ее соли. [5]
Соединения фосфора, в которых степень окисления фосфора равна 1, 3, являются сильными восстановителями. К ним относится фосфористая кислота НзРОз и ее соли и фосфорноватистая кислота НзРСЬ и ее соли. [6]
В каких пределах может изменяться степень окисления фосфора. [7]
В каких пределах может изменяться степень окисления фосфора. Приведите примеры соответствующих соединений, а также примеры реакций, в которых степень окисления фосфора: а) увеличивается; б) уменьшается; в) увеличивается и уменьшается одновременно; г) не изменяется. [8]
Все соединения фосфора с полярной связью, в которых степень окисления фосфора равна III, 1 и — III, являются восстановителями. [9]
Как видно, в реаультате реакции происходит окисление гипофосфита ( степень окисления фосфора возрастает с 1 до 3) и восстановление ионов № 2 до металлического никеля и ионов Н из воды до газообразного водорода. [10]
Как видно, в результате реакции происходит окисление гипофос-фита ( степень окисления фосфора возрастает с 1 До 3), восстановление ионов Ni2 до металлического никеля и ионов Н из воды до газообразного водорода. [11]
В HPU2 фосфор находится в низшей положительной степени окисления ( 3), число атомов кислорода и особенно водорода меньше степени окисления фосфора. Следовательно, НРО2 называют метафосфористой кислотой. [12]
Хлористые соединения фосфора, обыкновенно не действующие на углеводороды, действуют на воду весьма сильно; результатом этого действия бывает выделение соляной кислоты и образование гидратных степеней окисления фосфора. Мы можем сказать, что здесь из воды уходит водный остаток НО и вместо него встает в соединение с водородом хлор. [13]
Применение кислой смеси изопропа-нол-20 % — ный раствор Nh4 — раствор СС13СООН ( 1000 г в 1 л) — вода ( 70: 0 4: 4: 25 6) позволяет разделить ионы со степенью окисления фосфора 5, но приводит к частичному гидролизу цоли-фосфатов. [14]
Вместе с тем понятие степень окисления очень полезно для классификации веществ и при составлении химических уравнений. Так, степени окисления фосфора в соединениях НР 5Оэ, Н3Р 50 и HtPJ Cb одинаковы, значит эти соединения сходны по строению и должны сильно отличаться по свойствам от соединения НзР 3Оз, в котором степень окисления фосфора другая. Особенно широко используется понятие степень окисления при подборе стехиометрических коэффициентов в уравнениях окислительно-восстановительных реакций. [15]
Страницы: 1 2
www.ngpedia.ru
Какая степень окисления у фосфора?
Фосфор может существовать в виде простого вещества – неметалла, а как известно, степень окисления неметаллов в элементарном состоянии равна нулю.
При нагревании фосфор окисляет почти все металлы, образуя фосфиды, в которых его степень окисления равна (-3): , .
Для фосфора характерны степени окисления (+1) (), (+3) (, ) и (+5) (, , , ) (ответ на вопрос «какая степень окисления у фосфора»).
Для того, чтобы найти определить степень окисления каждого элемента в предложенных соединениях воспользуемся алгоритмом, предполагающим составление уравнение электронейтральности.
Итак, в состав фосфата натрия входят атомы натрия, фосфора и кислорода. Степень окисления натрия постоянна и равна (+1). Кислород, во всех веществах, кроме пероксидов и фторида кислорода проявляет степень окисления равную (-2). Для того, чтобы определить степень окисления фосфора, примем её значение за «x». Тогда, уравнение электронейтральности примет следующим образом:
Аналогичным образом выясним степени окисления элементов, входящих в состав других веществ: , , , .
ru.solverbook.com
