Основания (химия, 8 класс) – формулы и свойства реакций
Один из классов сложных неорганических веществ – основания. Это соединения, включающие атомы металла и гидроксильную группу, которая может отщепляться при взаимодействии с другими веществами.

Строение
Основания могут содержать одну или несколько гидроксо-групп. Общая формула оснований – Ме(ОН)х. Атом металла всегда один, а количество гидроксильных групп зависит от валентности металла. При этом валентность группы ОН всегда I. Например, в соединении NaOH валентность натрия равна I, следовательно, присутствует одна гидроксильная группа. В основании Mg(OH)2 валентность магния – II, Al(OH)3 валентность алюминия – III.
Количество гидроксильных групп может меняться в соединениях с металлами с переменной валентностью. Например, Fe(OH)2 и Fe(OH)3. В таких случаях валентность указывается в скобках после названия – гидроксид железа (II), гидроксид железа (III).
Физические свойства
Характеристика и активность основания зависит от металла. Большинство оснований – твёрдые вещества белого цвета без запаха. Однако некоторые металлы придают веществу характерную окраску. Например, CuOH имеет жёлтый цвет, Ni(OH)2 – светло-зелёный, Fe(OH)3 – красно-коричневый.
Рис. 1. Щёлочи в твёрдом состоянии.
Виды
Основания классифицируются по двум признакам:
- по количеству групп ОН – однокислотные и многокислотные;
- по растворимости в воде – щёлочи (растворимые) и нерастворимые.
Щёлочи образуются щелочными металлами – литием (Li), натрием (Na), калием (K), рубидием (Rb) и цезием (Cs). Кроме того, к активным металлам, образующим щёлочи, относят щелочноземельные металлы – кальций (Ca), стронций (Sr) и барий (Ba).
Эти элементы образуют следующие основания:- LiOH;
- NaOH;
- KOH;
- RbOH;
- CsOH;
- Ca(OH)2;
- Sr(OH)2;
- Ba(OH)2.
Все остальные основания, например, Mg(OH)2, Cu(OH)2, Al(OH)3, относятся к нерастворимым.
По-другому щёлочи называются сильными основаниями, а нерастворимые – слабыми основаниями. При электролитической диссоциации щёлочи быстро отдают гидроксильную группу и быстрее вступают в реакцию с другими веществами. Нерастворимые или слабые основания менее активные, т.к. не отдают гидроксильную группу.
Рис. 2. Классификация оснований.
Особое место в систематизации неорганических веществ занимают амфотерные гидроксиды. Они взаимодействуют и с кислотами, и с основаниями, т.е. в зависимости от условий ведут себя как щёлочь или как кислота. К ним относятся Zn(OH)2, Al(OH)3, Pb(OH)2, Cr(OH)3, Be(OH)2 и другие основания.
Получение
Основания получают различными способами. Самый простой – взаимодействие металла с водой:
Ba + 2H2O → Ba(OH)2 + H2.
Щёлочи получают в результате взаимодействия оксида с водой:
Na2O + H2O → 2NaOH.
Нерастворимые основания получаются в результате взаимодействия щелочей с солями:
CuSO4 + 2NaOH → Cu(OH)2↓+ Na2SO4.
Химические свойства
Основные химические свойства оснований описаны в таблице.
|
Реакции |
Что образуется |
Примеры |
|
С кислотами |
Соль и вода. Нерастворимые основания взаимодействуют только с растворимыми кислотами |
Cu(OH)2↓ + H2SO4 → CuSO4 +2H2O |
|
Разложение при высокой температуре |
Оксид металла и вода |
2Fe(OH)3 → Fe2O3 + 3H2O |
|
С кислотными оксидами (реагируют щёлочи) |
Соль |
NaOH + CO2 → NaHCO3 |
|
С неметаллами (вступают щёлочи) |
Соль и водород |
2NaOH + Si + H2O → Na2SiO3 +H2↑ |
|
Обмена с солями |
Гидроксид и соль |
Ba(OH)2 + Na2SO4 → 2NaOH + BaSO4↓ |
|
Щелочей с некоторыми металлами |
Сложная соль и водород |
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ |
С помощью индикатора проводится тест на определение класса основания. При взаимодействии с основанием лакмус становится синим, фенолфталеин – малиновым, метилоранж – жёлтым.
Рис. 3. Реакция индикаторов на основания.
Что мы узнали?
Из урока 8 класса химии узнали об особенностях, классификации и взаимодействии оснований с другими веществами. Основания – сложные вещества, состоящие из металла и гидроксильной группы ОН. Они делятся на растворимые или щёлочи и нерастворимые. Щёлочи – более агрессивные основания, быстро реагирующие с другими веществами. Основания получают при взаимодействии металла или оксида металла с водой, а также в результате реакции соли и щёлочи. Основания реагируют с кислотами, оксидами, солями, металлами и неметаллами, а также разлагаются при высокой температуре.
Тест по теме
Оценка доклада
Средняя оценка: 4.5. Всего получено оценок: 210.
obrazovaka.ru
Основания. Составление формул.
Схема образования гидроксида натрия:
Na+ + H-O-H > NaOH + H+;
Уравнение реакции: 2Na + 2HOH = 2NaOH + H2
OH— — гидроксид-ион является сложным ионом.
Название основания = Гидроксид + Название металла в родительном падеже + С.О. римскими цифрами
Ca(OH)2 – гидроксид кальция
Fe(OH)2 – гидроксид железа (II)
Fe(OH)3 – гидроксид железа (III)
Дай название веществам: Ba(OH)2, KOH , Al(OH)3, Zn(HO)2. Воспользуйся тренажером. (Оценка за тренажер не входит в итоговую оценку. Нажми на ссылку ответь на вопросы и закрой страницу с тестами.)
Порядок составления формул оснований
При составлении формулы конкретного основания, необходимо в таблице растворимости найти ион металла, для которого составляем формулу, и в соответствии с зарядом этого иона металла составить, формулу основания:
-
Если заряд иона металла «+», то с ионом металла связанна только одна гидроксогруппа OH—, например гидроксид натрия Na+OH;
-
Если «2+», то две Ca2+(OH)2.
Вопрос:
Заряд иона алюминия «3+» (Al3+) сколько гирдроксогупп связанно с алюминием в гидроксиде алюминия?
Запомни:
Оксиду металла соответствует основание: Ca > CaO > Ca(OH)2. Такие оксиды называют основные оксиды. СаО — основный оксид.
Составим основания из оксидов: Na2O , FeO , Fe2O3
|
Na+2O > Na+OH— |
Fe2+O > Fe+2(OH)2 |
Fe23+O3 > Fe3+(OH)3 |
Составь:
-
Основания из оксидов: ZnO , Li2O , MgO
-
* * *
.
osievskaja.narod.ru
Тема 19. Основания. | 8 класс
Часть I
1. Признаки оснований:
— сложные вещества;
— состоят из простых ионов металлов (кромеNh5+) и сложных гидроксид — ионов ОН-;
— общая формула оснований: Мn+(ОН)n, где n — заряд иона, равный с. о. металла.
2. Способ образования названий оснований.
3. с. о. металла +n ← Не путать! → заряд иона n+
с. о. атомов в гидроксид-ионе (O-2Н+)- ← Не путать! → заряд гидроксид-иона ОН-
4. Каждому основанию соответствует свой оксид металла. Дополните таблицу «Основания и соответствующие им оксиды».
5. Щёлочи изменяют окраску индикаторов. Дополните таблицу «Изменение окраски индикатора в щелочной среде».
6.
Классификация оснований
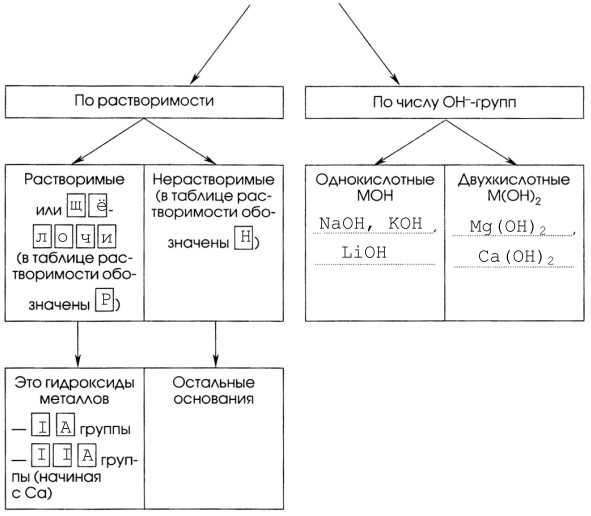
Часть II
1. Поиграйте в «крестики-нолики». Покажите выигрышный путь, который составляют формулы щелочей.
Впишите в соответствующие столбцы формулы и названия всех приведённых выше оснований.
Распределите все приведённые выше основания по другому признаку.
2. Составьте формулы оснований и соответствующих им оксидов металлов для следующих ионов:
1) Ag+ AgOH → Ag2O
2) Pb2+ Pb(OH)2 → PbO
3) Fe3+ Fe(OH)3 → Fe2O3
3. В пробирках А и Б находятся известковая вода и раствор гидроксида натрия. Какие качественные реакции необходимо провести, чтобы определить содержимое каждой из пробирок?
1) Пропускаем сначала углекислый газ, пробирка с щёлочью мутнеет.
2) В другую пробирку капаем раствор лакмуса, она синеет.
Ответ. Углекислый газ и лакмус.
4. Определите заряды ионов металлов и степени окисления элементов в основаниях.
5. Запишите в таблицу «Области применения некоторых оснований» формулы веществ.
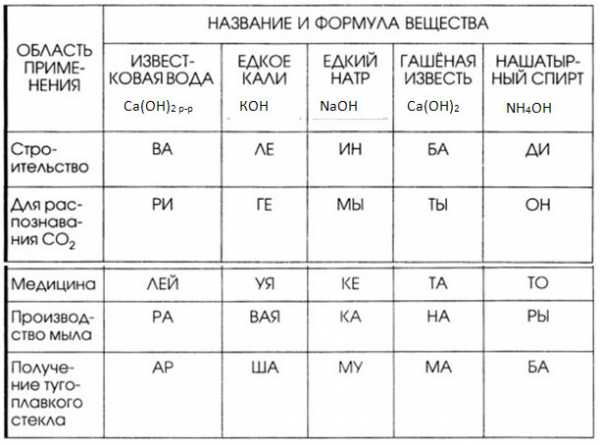
Установите соответствие между веществом и областями его применения. Из слогов, соответствующих правильным ответам, вы составите название насыщенного водного раствора гидроксида бария (II): баритовая вода.
6. Вычислите количество вещества, которое составляют 196 г гидроксида калия. Сколько ионов каждого вида будет содержать эта порция щёлочи?

7. Рассчитайте массу 2,5 кмоль гидроксида бария. Сколько ионов каждого вида будет содержать эта порция щёлочи?

superhimik.ru
Соединения неорганической химии: основания. Формулы
Итак, неорганическая химия — раздел химии, который связан с изучением способностей реагировать и свойств всех элементов периодической системы химических элементов и их соединений.
Этот раздел изучает все соединения элементов, кроме органических веществ, основой которых является углерод (исключением являются какие-либо простейшие соединения, относящиеся к неорганической химии).

В чем же тогда разница между неорганическими и органическими соединениями, содержащими углерод? Химия неорганических соединений изучает элементы и образованные ими простые или сложные вещества. Основной ее задачей является разработка способов создания новых технологических достижений. Также именно она обеспечивает образование материалов передовых достижений науки и всей современности. В 2013 году было известно около 500 тысяч неорганических веществ.
Основополагающим принципом неорганической химии является Периодический закон Д. И. Менделеева и его система химических элементов.
Итак, классы неорганических веществ следующие: оксиды, основания, кислоты и соли.
Оксиды
Поговорим об оксидах. Оксид — бинарное соединение, на первом месте которого стоит какой-либо элемент, а на втором — кислород. Оксиды могут быть солеобразующими и несолеобразующими. Солеобразующие оксиды, в свою очередь, делятся на основные, кислотные и амфотерные.
Основной оксид — бинарное соединение кислорода с металлом, степень окисления которого равна I или II. Кислотные оксиды — бинарные соединения с неметаллами и металлами со степенью окисления IV-VII. Амфотерные оксиды (с изменчивыми свойствами из-за условий, в которых находятся) — оксиды металлов со степенью окисления III и IV и исключения — ZnO, BeO, SnO, PbO.
Основания
Далее идут основания. Формула состоит из металла, стоящего на первом месте, и гидроксильной группы — (OH). Количество зависит от валентности металла. Самая интересная группа веществ — основания. Формула может рассказать о них многое.
Основания могут быть растворимыми (щелочами) и нерастворимыми.
Каждому основанию соответствует определенный оксид. Формулы оксидов и оснований связаны. В результате определены такие группы оснований:
- Основные гидроксиды — это основание с формулой, содержащей металл степени окисления +1 и +2. Он проявляет основные свойства.
- Кислотные гидроксиды — основание с формулой, содержащей в себе металл степени окисления +5 и +6. Такие оксиды проявляют кислотные свойства.
- Амфотерные гидроксиды — основание с формулой, которая содержит в себе металл со степенью окисления +3, +4, +2 (в некоторых частных случаях). Амфотерные гидроксиды могут проявлять и кислотные, и основные свойства. Это зависит от условий, в которых находится металл.
Иногда гидроксидом называют воду. Часто гидроксидами называют амфотерные или же основные основания.

Получают основания путем взаимодействиях металлов из группы щелочных и щелочноземельных (IA и IIA групп).
Главным химическим свойством нерастворимых оснований является разложение на оксид и воду.
Кислоты
Кислоты — соединения неорганической химии, которые состоят из водорода, который стоит на первом месте, и кислотного остатка. В зависимости от содержания или не содержания кислорода в кислоте, она может быть кислородсодержащей и безкислородной. По количеству атомов водорода, стоящих на первой месте, она может быть одноосновной, двухосновной, трехосновной и многоосновной. Классификаций очень много, но эти — основные. Формулы оснований и кислот связаны. Похож их процесс диссоциации, и они содержат в себе сильные и слабые электролиты.
Соли
Остались только соли. Соли — неорганические соединения, состоящие из металла на первом месте, и кислотного остатка — на втором. Основная классификация солей — это деление на средние, кислые, основные и комплексные соли.

Делая вывод, нужно сказать, что неорганическая химия — отправная точка в познании этой точной науки.
fb.ru
Названия и формулы оснований
Названия и формулы основанийОснованиями называются соединения, которые состоят из атома металла и гидроксогрупп (OH—).
Например, NaOH, Mg(OH)2, La(OH)3, Ca(OH)2. ОН— – это гидроксид-ион, заряд его равен -1. Число гидроксид-ионов в основании определяется степенью окисления металла.
С позиций теории электролитической диссоциации, основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы.
Классификация.Число гидроксогрупп в молекуле основания определяет его кислотность. В зависимости от числа протонов, которые может присоединить основание, различают
1) однокислотные (NaOH, КОН, NH4OH),
2) двухкислотные (Ca(OH)2, Sr(OH)2, Ва(OH)2 ),
3) трехкислотные (La(OH)3, Bi(OH)3 ) и т.д. основания
Номенклатура. Название основания составляется из слов
«гидроксид» + название металла в родительном падеже:
КОН – гидроксид калия, Ва(ОH)2 – гидроксид бария, La(OH)3 – гидроксид лантана.
Если металл образует несколько гидроксидов, то указывают степень его окисления римской цифрой в скобках. Например, Fe(ОН)2 – гидроксид железa (II), Bi(OH)3 – гидроксид висмута (III). Haзвание основания составляют и так: к слову гидроксид добавляют приставки, которые показывают количество гидроксогрупп в основании. Например, Са(ОН)2 – дигидроксид кальция, Вi(ОН)3 – тригидроксид висмута.
Для некоторых оснований часто используют тривиальные названия NaOH – едкий натр, KOH – едкое кали, Ca(OH)2 – гашеная известь, Ba(OH)2 – едкий барит.
Остатки оснований. Положительно заряженные группы атомов (положительные ионы), которые остаются после отрыва от молекулы основания одной или нескольких гидроксогрупп, называются остатками основания. Величина положительного заряда остатка основания определяется числом оторвавшихся гидроксогрупп.
В табл.17приведены формулы и названия некоторых оснований иихостатков.
Таблица 17. Названия и формулы некоторых оснований и их остатков (по номенклатуре ИЮПАК).
| Формула основания | Название основания | Остаток основанияяяяяяяя | Название остатка |
| NaОН | Гидроксид натрия | Na+ | Натрий-ион |
| Mg(ОН)2 | Гидроксид магния | MgOH+ | Гидроксомагний — ион |
| Mg2+ | Магний –ион | ||
| Bi(OH)3 | Гидроксид висмута (III) | Bi(OH) | Дигидроксовисмут (III)-ион |
| Bi(OH)2+ | Гидроксовисмут (III)-ион | ||
| Bi3+ | Висмут (III)-ион | ||
| Mn (OH)2 | Гидроксид марганца (II) | MnOH+ | Гидроксомарганец (II) – ион |
| Mn2+ | Марганец (II) – ион |
Дата добавления: 2015-07-25; просмотров: 126 | Нарушение авторских прав
Названия и формулы оксидов | Получение и свойства оксидов | Номенклатура. | Амфотерные гидроксиды | Названия и формулы солей | Получение и свойства солей | Генетическая связь между основными классами неорганических соединений |
mybiblioteka.su — 2015-2018 год. (0.006 сек.)
mybiblioteka.su
Все формулы основания прямоугольной трапеции
1. Формула длины оснований прямоугольной трапеции через среднюю линию
a — нижнее основание
b — верхнее основание
m — средняя линия
Формулы длины оснований :
2. Формулы длины оснований через боковые стороны и угол при нижнем основании
a — нижнее основание
b — верхнее основание
c , d — боковые стороны
α — угол при нижнем основании
Формулы длины оснований :
3. Формулы длины оснований трапеции через диагонали и угол между ними
a — нижнее основание
b — верхнее основание
c — боковая сторона под прямым углом к основаниям
d1 , d2 — диагонали трапеции
α , β — углы между диагоналями
Формулы длины оснований :
4. Формулы длины оснований трапеции через площадь
a — нижнее основание
b — верхнее основание
c — боковая сторона под прямым углом к основаниям
h — высота трапеции
Формулы длины оснований :
Формулы площади произвольной трапеции
Формулы площади равнобедренной трапеции
Формула периметра трапеции
Все формулы по геометрии
www-formula.ru
