Соли — классификация, получение и свойства » HimEge.ru
 Общая формула соли МnAcm, где М – металл, Ас – кислотный остаток, n – число атомов металла, равное заряду иона кислотного остатка, m – число ионов кислотного остатка, равное заряду иона металла.
Общая формула соли МnAcm, где М – металл, Ас – кислотный остаток, n – число атомов металла, равное заряду иона кислотного остатка, m – число ионов кислотного остатка, равное заряду иона металла.
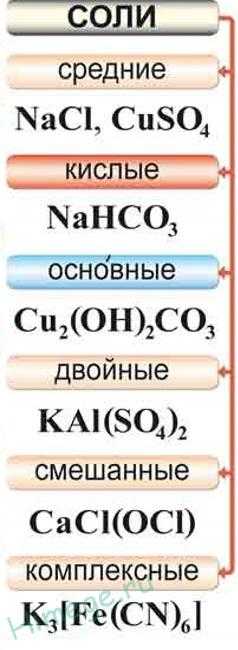
Средними солями называют продукты полного замещения атомов водорода в молекуле кислоты атомами металла или полного замещения гидроксогрупп в молекуле основания кислотными остатками.
Например, H3PO4 – Na3PO4;
Cu(OH)2 – CuSO4.
Кислыми солями называют продукты неполного замещения атомов водорода в молекулах многоосновных кислот атомами металла.
Например, H2SO4 – NaHSO4,
H3PO4 – Na2HPO4 – NaH2PO4.
Основными солями называют продукты неполного замещения гидроксогрупп в многокислотных основаниях кислотными остатками.
Fe(OH)3 – Fe(OH)2Cl – FeOHCl2.
Кислые соли вступают в реакции с щелочами с образованием средних солей.
KHCO3 + KOH = K2CO3 + H2O
Некоторые кислые соли, например, угольной кислоты разлагаются под действием более сильных кислот:
KHCO3 + HCl = KCl + CO2 + H2O
Основные соли вступают в реакции с кислотами:
Cu(OH)Cl + HCl = CuCl2 + H2O
Свойства комплексных солей (способы разрушения комплексных солей)
1) Комплексные соли реагируют с сильными кислотами, продукты реакции зависят от соотношения между реагентами. При действии избытка сильной кислоты получается две средних соли и вода. При действии недостатка сильной кислоты получается средняя соль активного металла, амфотерный гидроксид и вода, например:
K3[Al(OH)6] + 3HCl = 3KCl + Al(OH)3↓ + 3H2O
K3[Al(OH)6] + 6HClизб = 3KCl + AlCl3 + 6H2O
K2[Zn(OH)4] + 2HBr = 2KBr + Zn(OH)2↓ + 2H2O
K2[Zn(OH)4] + 4HBr изб = 2KBr + ZnBr2 + 4H2O
K3[Cr(OH)6] + 6HNO3 изб. = 3KNO3 + Cr(NO3)3 + 6H2O
2) При нагревании комплексные соли теряют воду:
K[Al(OH)4] = KAlO2 + 2H2O
K3[Cr(OH)6] = KCrO2 + 2H2O + 2KOH
3) При действии углекислого газа, сернистого газа или сероводорода получается соль активного металла и амфотерный гидроксид:
Na[Al(OH)4
K3[Cr(OH)6]+ 3SO2 = 3KHSO3 + Cr(OH)3↓
Na[Al(OH)4] + H2S = NaHS + Al(OH)3↓+ H2O
4) При действии солей, образованных катионами Fe3+, Al3+ и Cr3+ происходит взаимное усиление гидролиза, получается два амфотерных гидроксида и соль активного металла:
3Na[Al(OH)4] + FeCl3 = 3Al(OH)3↓ + Fe(OH)3↓ + 3NaCl
K3[Cr(OH)6] + Al(NO3)3 = Al(OH)3↓ + Cr(OH)3↓+ 3KNO3
himege.ru
Химия
СОЛИ
Оглавление:
1. Определение
2. Классификация
3. Электролитическая
диссоциация
5. Важнейшие химические свойства
6. Специфические свойства
7. Задания
8. Ответы
|
Соли – |
КЛАССИФИКАЦИЯ
По химическому составу соли классифицируют на средние, кислые, основные и двойные.
Отдельным типом солей являются комплексные соли
(соли с комплексными катионами или анионами) . В формулах этих солей
комплексный ион заключён в квадратные скобки.
Комплексные ионы
— это сложные ионы, состоящие из ионов элемента (комплексообразователя)
и связанных с ним нескольких молекул или ионов (лигандов).
Примеры комплексных
солей приведены ниже.
а) С комплексным анионом:
K2[PtCl]4
— тетрахлороплатинат(II)
калия,
K2[PtCl]6
— гексахлороплатинат(IV)
калия,
б) С комплексным катионом:
[Cr(NH3)6]Cl3 — хлорид гексаамминхрома (III),
[Ag(NH3)2]Cl
— хлорид диамминсеребра (I)
[Cu(NH3)4]SO4
— сульфат тетраамминмеди
(II)
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Растворимые соли при растворении в воде
диссоциируют на катионы металлов и анионы кислотных остатков.
NaCl → Na+ +
Cl—
K2SO4 → 2K+
+ SO42-
Al(NO3)3 → Al3+ + 3NO3—
ВАЖНЕЙШИЕ СПОСОБЫ ПОЛУЧЕНИЯ СОЛЕЙ
1. Металл + неметалл = соль
2Fe + 3Cl2
= 2FeCl3
2. Металл + кислота = соль + водород
Zn + 2HCl
= ZnCl2 + H2↑
3. Металл + соль = другой металл + другая соль
(согласно электрохимическому ряду напряжений металлов)
Fe + CuSO4 = Cu + FeSO4
4. Кислота + основный (амфотерный) оксид = соль
+ вода
3H2SO4+Al2O3=Al2(SO
5. Кислота + основание = соль + вода
H2SO4
+ 2NaOH = Na2SO4
+ 2H2O
При неполной нейтрализации многоосновной кислоты основанием
получают кислую соль:
H2SO4
+ NaOH = NaHSO4
+ H2O
При неполной нейтрализации многокислотного основания кислотой
получают основную соль:
Zn(OH)2
+ HCl = ZnOHCl +
H2O
6. Кислота + соль = другая кислота + другая соль
(для этой реакции используют более сильную кислоту)
AgNO3 + HCl = AgCl + HNO3
BaCl2 + H2SO4
= BaSO4 + 2HCl
7. Основный (амфотерный) оксид + кислота = соль
+ вода
CaO + 2HCl = CaCl2 +H
2O
8. Основный оксид + кислотный оксид = соль
Li2O+CO2 = Li2CO3
9. Кислотный оксид + основание = соль + вода
SO3 + 2NaOH = Na2SO4
+ H2O
10. Щёлочь + соль = основание + другая соль
CuSO4 + 2NaOH
= Cu(OH)2
+ Na2SO4
11. Реакция обмена между солями: соль(1) + соль
(2) = соль(3) + соль(4)
NaCl + AgNO3 =Na NO3
+ AgCl
12. Кислые соли могут быть получены
действием избытка кислоты на средние соли и оксиды:
Na2SO4
+ H2SO4
= 2NaHSO4
Li2O
+ 2H2SO4
= 2LiHSO4 + H2O
13. Основные соли получают при осторожном
добавлении небольших количеств щелочей к растворам средних солей:
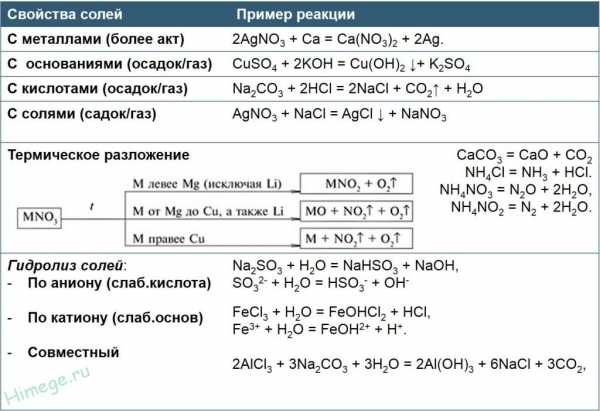
ВАЖНЕЙШИЕ ХИМИЧЕСКИЕ СВОЙСТВА
1. Соль + щёлочь = другая соль + другое
основание
CuCl2 + 2KOH = 2KCl + Cu(OH)2
2. Соль + кислота = другая соль + другая кислота
BaCl2 +
H2SO4
= BaSO4 + 2HCl
3. Соль(1) + соль (2) = Соль(3) + соль(4)
Na2SO4 + BaCl2
=2NaCl + BaSO4
4. Соль + металл = другая соль + другой металл
(согласно электрохимическому ряду напряжений металлов)
Zn + Pb(NO3)2
= Pb + Zn(NO3)2
5. Некоторые соли разлагаются при нагревании
CaCO3 = CaO + CO2
KNO3 = KNO
2
+ O2
СПЕЦИФИЧЕСКИЕ ХИМИЧЕСКИЕ СВОЙСТВА
Специфические химические свойства солей зависят от того, какой катион и какой анион образуют данную соль.
|
Специфические свойства солей по катиону |
Специфические свойства солей по аниону |
|
Ag+ + Cl— = AgCl↓ белый творожистый осадок Cu2+ + 2OH— = Cu(OH)2↓ синий осадок Ba2+ + SO42- = BaSO4↓ белый мелкокристаллический осадок Fe Al3+ + 3OH— = Al(OH)3↓ белый желеобразный осадок Ca2+ + CO32- = CaCO3↓ белый осадок |
Ag+ + Cl— = AgCl↓ белый творожистый осадок Ba2+ + SO42- = BaSO4↓ белый мелкокристаллический осадок 2H+ + SO32- = H2O + SO2↑ газ с резким запахом 2H+ + CO32- = H2O + CO2↑ газ без запаха 3Ag+ + PO43- = Ag3PO4↓ жёлтый осадок 2H+ + S2- = H2S↑ газ с неприятным запахом тухлых яиц |
ЗАДАНИЯ
Задание 1. Из приведённого перечня выберите
соли, назовите их, определите тип.
1) КNO2
2)
LiOH 3) CaS 4) CuSO4 5) P2O5
6) Al(OH)2Cl 7) NaHSO3 8) H2SO4
Задание 2. С какими из перечисленных веществ
может реагировать а) BaCl2 б)
CuSO4 в)
Na2CO3?
1)Na2O 2)HCl 3)H2O 4) AgNO3 5)HNO3
6)Na2SO4 7)BaCl2 8)Fe
9)Cu(OH)2 10) NaOH
ОТВЕТЫ.
Наверх
novschool31.narod.ru
Что такое соль? Формула, свойства соли (химия) :: ashanet.ru
Для того чтобы ответить на вопрос, что такое соль, обычно долго задумываться не приходится. Это химическое соединение в повседневной жизни встречается достаточно часто. Об обычной поваренной соли и говорить не приходится. Подробное внутреннее строение солей и их соединений изучает неорганическая химия.
Определение соли
Четкий ответ на вопрос, что такое соль, можно найти в трудах М. В. Ломоносова. Такое имя он присвоил хрупким телам, которые могут растворяться в воде и не воспламеняются под воздействием высоких температур или открытого огня. Позднее определение выводили не из их физических, а из химических свойств данных веществ.
Школьные учебники неорганической химии дают достаточно ясное понятие того, что такое соль. Так называются продукты замещения химической реакции, при которой атомы водорода кислоты в соединении замещаются на металл. Примеры типичных соединений солей: NaCL, MgSO4. Легко увидеть, что любую эту запись можно разделить на две половины: в левой составляющей формулы всегда будет записан металл, а в правой – кислотный остаток. Стандартная формула соли выглядит следующим образом:
MenmКислотный остатокmn.
Физические свойства соли
Химия, как точная наука, вкладывает в название того или иного вещества всю возможную информацию о его составе и возможностях. Так, все наименования солей в современной интерпретации состоят из двух слов: одна часть имеет название металлического составляющего в именительном падеже, вторая — содержит описание кислотного остатка.
Эти соединения не имеют молекулярного строения, поэтому при обычных условиях они представляют собой твердые кристаллические вещества. Многие соли обладают кристаллической решеткой. Кристаллы этих веществ тугоплавки, поэтому для их плавления нужны очень высокие температуры. Например, сульфид бария плавится при температуре около 2200о С.
По растворимости соли делятся на растворимые, малорастворимые и нерастворимые. Примером первых могут служить хлорид натрия, нитрат калия. К малорастворимым относят сульфит магния, хлорид свинца. Нерастворимые – это карбонат кальция. Информация о растворимости того или иного вещества содержится в справочной литературе.
Рассматриваемый продукт химической реакции обычно не имеет запаха и обладает разным вкусом. Предположение о том, что все соли соленые — ошибочно. Чистый соленый вкус имеет только один элемент этого класса – наша старая знакома поваренная соль. Существуют сладкие соли бериллия, горькие – магния и безвкусные – например, карбонат кальция (мел обыкновенный).
Большинство данных веществ бесцветно, но среди них имеются и такие, которые имеют характерные окрасы. Например, железа (II) сульфат отличается характерным зеленым цветом, калия перманганат – фиолетовый, а кристаллы хромата калия – ярко-желтые.
Классификация соли
Химия разделяет все виды неорганических солей на несколько основных признаков. Соли, получающиеся при полном замещении водорода в кислоте, называют нормальными или средними. Например, сульфат кальция.
Соль, которая является производной от реакции неполного замещения, называется кислой или основной. Примером такого образования может быть реакция гидросульфата калия:
Основная соль получается при такой реакции, в которой гидроксогруппа не полностью замещается на кислотный остаток. Вещества данного вида могут быть образованны теми металлами, чья валентность равна двум или больше. Типичная формула соли этой группы может быть выведена из такой реакции:
Нормальные, средние и кислые химические соединения образуют классы солей и являются стандартной классификацией этих соединений.
Двойная и смешанная соль
Химия неорганических веществ показывает, что данный продукт может быть образован двумя металлами и одной кислотой. В этом случае кислота должна иметь основность больше или равной 2. Такое соединение называют двойная соль. Химические соли этой группы – алюмокалиевые квасцы, их еще называют сульфат калия-алюминия.
Примером смешанной является кальциевая соль соляной и хлорноватистой кислоты: CaOCl2.
Номенклатура
Соли, образованные металлами с переменной валентностью, имеют дополнительное обозначение: после формулы в скобках пишут римскими цифрами валентность. Так, существует сульфат железа FeSO4 (II) и Fe2 (SO4)3 (III). В названии солей имеется приставка гидро-, если в ее составе существуют незамещенные атомы водорода. Например, гидрофосфат калия обладает формулой K2HPO4 .
Свойства солей в электролитах
Теория электролитической диссоциации дает собственное толкование химическим свойствам. В свете этой теории соль может быть определена как слабый электролит, который в растворенном виде диссоциирует (распадается) в воде. Таким образом, раствор соли можно представить как комплекс положительных отрицательных ионов, причем первые – это не атомы водорода Н+, а вторые – не атомы гидроксогруппы ОН—. Ионов, которые присутствовали бы во всех видах растворов солей, не существует, поэтому какими-либо общими свойствами они не обладают. Чем меньше заряды ионов, образующих раствор соли, тем лучше они диссоциируют, тем лучше электропроводимость такой жидкой смеси.
Растворы кислых солей
Кислые соли в растворе распадаются на сложные отрицательные ионы, представляющие собой кислотный остаток, и простые анионы, являющиеся положительно заряженными частицами металла.  Например, реакция растворения гидрокарбоната натрия ведет к распаду соли на ионы натрия и остаток НСО3—.
Например, реакция растворения гидрокарбоната натрия ведет к распаду соли на ионы натрия и остаток НСО3—.
Полная формула выглядит таким образом: NaHCO3 = Na+ + HCO3—,HCO3 — = H+ + CO32-.
Растворы основных солей
Диссоциация основных солей ведет к образованию анионов кислоты и сложных катионов, состоящих из металлов и гидроксокрупп. Эти сложные катионы, в свою очередь, также способны распадаться в процессе диссоциации. Поэтому в любом растворе соли основной группы присутствуют ионы ОН— . Например, диссоциация хлорида гидроксомагния протекает следующим образом: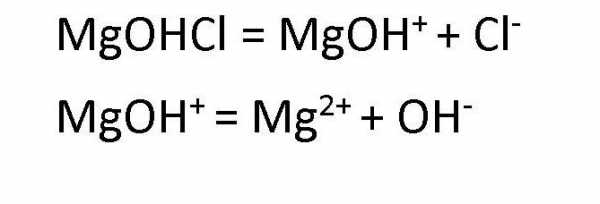
Распространение солей
Что такое соль? Этот элемент является одним из самых распространенных химических соединений. Всем известны поваренная соль, мел (карбонат кальция) и прочее. Среди солей карбонатной кислоты самым распространенным является карбонат кальция. Он является составной частью мрамора, известняка, доломита. А еще карбонат кальция — основа для формирования жемчуга и кораллов. Это химическое соединение является неотъемлемой составляющей для формирования твердых покровов у насекомых и скелетов у хордовых животных.
Поваренная соль известна нам с детства. Врачи предостерегают от ее чрезмерного употребления, но в умеренных количествах она крайне необходима для осуществления жизненных процессов в организме. А нужна она для поддержания правильного состава крови и вырабатывания желудочного сока. Физрастворы, неотъемлемая часть инъекций и капельниц, есть не что иное, как раствор поваренной соли.
ashanet.ru
Методическая разработка по химии «Алгоритм составления названий и формул солей»
Методическая разработка:
«Алгоритм составления названий и формул солей».
При изучении химии в 8 классе учащиеся сталкиваются с затруднениями в названии химических веществ и составления формул химических соединений. Для лучшего усвоения данного материала им помогут «Алгоритмы» — краткая запись последовательности действий.
При составлении названий и формул солей необходимо знать состав и название кислот, и соответственно название кислотных остатков, входящих в эти кислоты. Для удобства, они указаны в данной разработке.
Названия кислот и кислотных остатков этих кислот, образующих соли.
—
HCl соляная кислота Cl хлорид
—
HF фтороводородная кислота F фторид
—
HBr бромоводородная кислота Br бромид
—
HI иодоводородная кислота I иодид
2-
h3S сероводородная кислота S сульфид
2-
h3SO3 сернистая кислота SO3 сульфит
2-
h3SO4 серная кислота SO4 сульфат
—
HNO3 азотная кислота NO3 нитрат
—
HNO2 азотистая кислота NO2 нитрит
2-
h3CO3 угольная кислота CO3 карбонат
2-
h3SiO3 кремниевая кислота SiO3 силикат
3-
h4PO4 фосфорная кислота PO4 фосфат
АЛГОРИТМ СОСТАВЛЕНИЯ НАЗВАНИЙ СОЛЕЙ.
Соли – сложные химические соединения, состоящие из ионов металла, связанного с ионами кислотного остатка.
При составлении названия соли, совершаются поочередно следующие шаги:
1. Называется кислотный остаток, который стоит в формуле соли в конце.
2. Называется металл ( в родительном падеже). Он записан перед кислотным остатком.
3. Если заряд металла переменный, в скобках указывается валентность металла.
ПРИМЕР:
CuSO4 сульфат меди (II) NaCl хлорид натрия
АЛГОРИТМ СОСТАВЛЕНИЯ ФОРМУЛ СОЛЕЙ.
1. Записываем химические символы металла и кислотного остатка, образующих соль. Металл записываем перед кислотным остатком.
2. Над хим. элементами указываем заряды ионов металла и кислотного остатка.
3. Находим Наименьшее Общее Кратное между зарядами ионов.
4. НОК делим поочередно: на заряд металла и заряд кислотного остатка.
5. Ставим полученные при расчете индексы справа, внизу возле химических элементов. Если кислотных остатков несколько, заключаем его в скобки. Индекс ставиться за скобками.
ПРИМЕР:
Нитрат железа (III)
1. Fe NO3
2. 3+ _
Fe NO3
3. 3
3+ —
Fe NO3
4. 3 : 3 = 1 , 3 :1 = 3
5. Fe(NO3)3
Сульфат алюминия
1. Al SO4
2. 3+ 2-
Al SO4
3. 6
3+ 2-
Al SO4
4. 6 :3 = 2 , 6 :2 = 3
5. Al2(SO4)3
infourok.ru
