Гидроксид фосфора — формула, свойства
Существует три класса сложных неорганических соединений: оксиды, гидроксиды (к ним относятся кислоты и основания), а также соли. Многие металлы и неметаллы могут образовывать оксиды, гидроксиды, а также входить в состав кислотных остатков. Так, фосфор включается в кислотный остаток РО4. Существует несколько разновидностей оксида фосфора. Соответственно, есть различные его гидроксиды, которые из этих оксидов формируются. Высший гидроксид фосфора — это фосфорная кислота. В данной статье мы рассмотрим физические и химические свойства указанного элемента и его соединений, а также расскажем о его распространенности в природе и других интересных фактах.
Физические свойства фосфора
Он может существовать в разнообразных вариациях. Фосфор — вещество, которое состоит из одного химического элемента. Его атомы не объединяются в молекулы. Формула фосфора — Р. Однако в зависимости от строения кристаллической решетки, данный элемент может существовать в виде трех веществ.
Самым распространенным является белый фосфор — он обладает воскообразной структурой и высокой токсичностью. Температура плавления данного вещества составляет сорок четыре градуса по Цельсию, а кипения — двести восемьдесят градусов. При трении данного материала он очень быстро возгорается, поэтому режут его, только поместив в водную среду. Если на протяжении длительного времени нагревать его при температуре двести пятьдесят градусов по шкале Цельсия, он превращается в красный фосфор. Это вещество представлено в виде порошка буро-красного цвета. Красный фосфор, в отличие от белого, не является ядовитым.
Самой устойчивой формой существования данного элемента можно назвать черный фосфор, который по некоторым внешним признакам похож на металл: имеет своеобразный блеск, обладает высокой твердостью, электро- и теплопроводностью.
С точки зрения химии
Фосфор — химический элемент, который находится в пятой группе и третьем периоде в таблице Менделеева. Из этого можно сделать вывод, что валентность его равняется пяти. Кроме того, из периодической системы можно увидеть, что элемент фосфор имеет атомную массу, равную тридцати одному грамму на моль. Это значит, что 1 моль вещества будет весить 31 один грамм. Рассматривая химические свойства фосфора, мы поговорим о его реакциях с простыми, а также сложными соединениями.
Взаимодействие с простыми веществами
Первое, на что нужно обратить внимание, — окисление фосфора. Это его реакция с кислородом. В результате может быть образовано два различных вещества — все будет зависеть от пропорций указанных компонентов.
Первый вариант — из четырех молей фосфора и трех молей кислорода образуется два моля триоксида фосфора. Записать подобное химическое взаимодействие можно с помощью следующего уравнения: 4Р + 3О2 = 2Р2О3.
Второй вариант — это образование из четырех молей фосфора и пяти молей кислорода двух молей пентаоксида фосфора. Выразить данную реакцию можно с помощью следующего уравнения: 4Р + 5О2 = 2Р2О5.
При обеих химических реакциях происходит значительное выделение света. Кроме того, фосфор может взаимодействовать с такими простыми веществами, как металлы, галогены (фтор, йод, бром, хлор), сера. Данный химический элемент способен проявлять как восстановительные, так и окислительные свойства. Примером взаимодействия с галогенами может служить хлорирование. Оно происходит в два этапа. Первый — образование двух молей трихлората фосфора из двух молей рассматриваемого неметалла и трех молей хлора. Данное взаимодействие может быть выражено с помощью такого уравнения: 2Р +3Cl2= 2PCl3.
Второй этап данного процесса заключается в присоединении атомов хлора к уже полученному трихлорату фосфора. Так, при добавлении к одному молю последнего такого же объема хлора образуется один моль пентахлората фосфора. Записываем уравнение данной реакции таким образом: PCl3 + Cl2 = PCl5.
Закономерности взаимодействия фосфора с металлами можно рассмотреть на таком примере. Если взять три моля калия и один моль фосфора, получим один моль фосфида калия. Записать такого рода процесс можно при помощи следующего уравнения реакции: 3К + Р = К3Р.
Взаимодействие со сложными веществами
К сложным химическим соединениям, с которыми способен вступать в реакцию фосфор, относятся кислоты и соли. Опишем по порядку особенности контакта рассматриваемого элемента с данными группами химических веществ.
Фосфор и кислоты
Среди всех прочих особенно выделяется взаимодействие фосфора и азотной кислоты. Для проведения подобного рода реакции необходимо взять следующие компоненты: фосфор в количестве трех молей, пять молей нитратной кислоты, а также воду — два моля. В результате такого химического взаимодействия получим следующие продукты: фосфорную кислоту и оксид нитрогена. Записывается уравнение данной реакции следующим образом: 3Р + 5HNO3 + 3Н2О = 3Н3РО4 + 5NO.
Фосфор и соли
Подобного рода химические взаимодействия можно рассмотреть на примере реакции рассматриваемого неметалла с сульфатом купрума. Для проведения данного процесса необходимо взять два моля фосфора, пять молей сульфата меди, восемь молей воды. В результате взаимодействия данных веществ получим следующие химические соединения: сульфатную кислоту в количестве пять молей, чистую медь — столько же, а также фосфорную кислоту — два моля. Записать данный процесс можно в виде такого уравнения: 2Р + 5CuSO4 + 8Н2О = 5H2SO4 + 5Cu + 2Н3РО4.
Получение данного неметалла
В промышленности рассматриваемое вещество добывают из такого химического соединения, как фосфат кальция. Для этого осуществляется следующая химическая реакция: смешивают указанную соль с песком (оксидом кремния) и углеродом в молярных пропорциях 1:3:5, в результате получают силикат кальция, фосфор и чадный газ в молярном соотношении 3:2:5.
Соединения фосфора и их свойства
Самым распространенным из соединений рассматриваемого неметалла является гидроксид фосфора. Он может быть нескольких видов в зависимости от оксида, из которого формируется. Получить гидроксид фосфора можно при помощи проведения химической реакции между его оксидом и водой. Благодаря таким реакциям образуются разнообразные виды веществ. Так, из триоксида можно получить гидроксид (3), а из пентаоксида — гидроксид фосфора (5). Данные вещества обладают кислотными свойствами и способны, в свою очередь, вступать в реакции с металлами, солями, основаниями и др.
Высший гидроксид фосфора — это фосфорная кислота. Она является кислородосодержащей и трехосновной. Ее формула — Н3РО4.
Основные химические свойства
Гидроксид фосфора, формула которого приведена выше, способен реагировать как с простыми, так и со сложными веществами. Рассмотрим эти процессы подробнее.
Реакции фосфорной кислоты с металлами
Как и другие химические соединения данного класса, гидроксид фосфора способен вступать во взаимодействие с металлами. Во время данного процесса происходит реакция замещения, при которой атомы металлов вытесняют атомы гидрогена, тем самым образуя соль и водород, выделяющийся в воздух в виде газа с неприятным запахом. Для того чтобы данная реакция могла осуществиться, металл должен быть расположен левее водорода в электрохимическом ряду активности. То есть такие вещества, как медь, серебро и другие им подобные, не способны реагировать с фосфорной кислотой, так как в связи со своей низкой химической активностью они не смогут вытеснить атомы гидрогена из их соединений.
В качестве примера рассмотрим алюминий. При добавлении двух молей этого элемента к двум молям гидроксида фосфора мы получим фосфат алюминия и водород в количестве 2 и 3 молей соответственно. Уравнение данной реакции записывается следующим образом: 2Al + 2Н3РО4 = 2AlPO4 + 3Н2.
Взаимодействие с основаниями
Гидроксид фосфора, как и многие другие кислоты, может вступать в химические реакции с основаниями. Такие процессы называются реакциями обмена. В их результате формируется новый гидроксид, а также новая кислота. Подобного рода реакции могут осуществляться, только если один из получаемых продуктов является нерастворимым в воде, то есть выпадает в осадок, испаряется в виде газа либо является водой или очень слабым электролитом.
Фосфорная кислота и соли
В данном случае также происходит реакция обмена. В ее результате можно получить новую кислоту и соль. Для того чтобы осуществилась такого рода реакция, тоже должно соблюдаться правило, которое было описано чуть выше.
Применение фосфора и его соединений в промышленности
В первую очередь соединения данного химического элемента используют для изготовления смеси, которая наносится на боковую поверхность спичечных коробков. Также смесью с содержанием фосфора обрабатываются и сами головки спичек. Пентаоксид рассматриваемого неметалла широко применяется в качестве осушителя газов. Также он используется в химической промышленности для того, чтобы получить гидроксид фосфора, формула и свойства которого были рассмотрены выше. Кроме того, его используют при изготовлении стекла.
Пентаоксид рассматриваемого неметалла широко применяется в качестве осушителя газов. Также он используется в химической промышленности для того, чтобы получить гидроксид фосфора, формула и свойства которого были рассмотрены выше. Кроме того, его используют при изготовлении стекла.
Гидроксид фосфора также находит применение во многих отраслях промышленности. Прежде всего, он используется при изготовлении удобрений. Это связано с тем, что для растений фосфор просто жизненно необходим. Поэтому существует ряд разнообразных удобрений, которые изготавливаются на основе соединения рассматриваемого неметалла. Для этих целей используются такие вещества, как фосфат кальция. Соль применяют в качестве удобрения в молотом виде. Кроме того, для этого используют обыкновенный и двойной суперфосфат. В качестве удобрения могут служить также аммофос и нитроаммофос. Кроме всего вышеперечисленного, соли либо гидроксид фосфора используются в качестве реагента для определения наличия в растворе соединений серебра. Так, добавляют вещество, в состав которого входит кислотный остаток РО4, к раствору. Если в последнем присутствуют соли либо гидроксид серебра, выпадет осадок насыщенно-желтого цвета. Это фосфат аргентума, имеющий такую химическую формулу: AgNO3.
Строение атома фосфора
Как известно, все атомы состоят из ядра и электронов, вращающихся вокруг него. В ядре содержатся протоны и нейтроны. Электроны имеют отрицательный заряд, протоны — положительный, а нейтроны — нулевой. Порядковый номер фосфора в таблице Менделеева — пятнадцать. Из этого можно сделать вывод о том, что в его ядре содержатся пятнадцать протонов. Если же атом является нейтральным, а не ионом, то электронов столько же, сколько и протонов. То есть в случае с фосфором их пятнадцать.
Если один из электронов покинет свою орбиту, атом превратится в позитивно заряженный ион, то есть катион. Если же один электрон присоединится, образуется негативно заряженный ион — анион.
В периодической системе химических элементов можно увидеть, что фосфор относится к третьему периоду. Из этого понятно, что вокруг ядра имеется три орбиты, на которых равномерно распределены электроны. На первой расположено два, на второй — восемь электронов, а на третьей — пять.
Распространенность в природе
Массовая доля фосфора в земной коре составляет 0,08%. Он не является очень распространенным в природе химическим элементом. Однако существует целая группа минералов, в состав которых входит фосфор. Это апатиты, а также фосфориты. Самый распространенный из первой группы — фторапатит. Его химическая формула выглядит следующим образом: 3Ca3(PO4)2•CaF2. Он бывает прозрачного, зеленого и бирюзового оттенков. Среди фосфоритов больше всего распространен кальция фосфат, имеющий такую химическую формулу: Са3(РО4)2. Кроме того, соединения фосфора встречаются в составе тканей различных живых организмов.
Роль фосфора и его соединений в природе и организме
Данный химический элемент очень важен для нормального функционирования почти всех органов и их систем. В первую очередь без него невозможна бесперебойная работа почек. Данный элемент принимает участие в обменных процессах организма. Он также способствует скорейшей регенерации тканей. Без него некоторые витамины просто не могут активизироваться, чтобы дать пользу организму — вот почему практически во все витаминные препараты в качестве дополнительного компонента очень часто добавляют фосфор. Кроме того, это один из химических элементов, обеспечивающих нормальную работу сердца. Он, кроме всего вышеперечисленного, участвует в процессе деления клеток, поэтому без данного микроэлемента невозможна жизнь на Земле.
Регуляция водно-солевого баланса — еще одна функция, которую выполняют в организме соединения рассматриваемого в данной статье неметалла. Кроме того, он является одной из главных составляющих костной и мышечной ткани. Большой его процент содержится и в зубах. Помимо всего прочего, стоит также отметить, что фосфор участвует в обеспечении нормальной работы нервной системы. Симптомы недостатка в организме рассматриваемого микроэлемента следующие: повышенная утомляемость, низкая работоспособность, нарушения в работе нервной системы (неврозы, истерия и т.п.), слишком частые простуды, истощение сердечной мышцы, боль в костях и мышцах, очень слабый аппетит. Чтобы избежать такого явления, как недостаток фосфора в организме, необходимо знать, в каких же продуктах он содержится. Прежде всего среди продуктов, богатых рассматриваемым химическим элементом, следует выделить рыбу. Особенно высокая концентрация фосфора наблюдается в таких видах, как осетр, скумбрия, ставрида, тунец, сардина, мойва, минтай, корюшка. Кроме того, рассмотренный в данной статье микроэлемент содержится в крабовом мясе, креветках, а также в молочных продуктах, таких как творог, плавленый сыр, брынза.
Прежде всего среди продуктов, богатых рассматриваемым химическим элементом, следует выделить рыбу. Особенно высокая концентрация фосфора наблюдается в таких видах, как осетр, скумбрия, ставрида, тунец, сардина, мойва, минтай, корюшка. Кроме того, рассмотренный в данной статье микроэлемент содержится в крабовом мясе, креветках, а также в молочных продуктах, таких как творог, плавленый сыр, брынза.
Выводы
Фосфор хоть и не является очень распространенным на планете химическим элементом, но имеет огромное значение как с промышленной, так и с биологической точки зрения. Он и его соединения, в частности, гидроксид фосфора, используются при производстве разного рода продукции. В статье также были описаны свойства гидроксида фосфора (фосфорной кислоты) и особенности его взаимодействия с металлами, основаниями и солями.
fb.ru
Фосфор физические свойства — Справочник химика 21
Главная подгруппа V группы периодической системы химических элементов Д. И. Менделеева включает пять элементов азот N, фосфор Р, мышьяк Аа, сурьму 8Ь и висмут В1. Каждый из этих элементов на внешнем слое имеет 5 электронов (конфигурация С увеличением атомного номера свойства простых веществ, образованных атомами элементов этой подгруппы, закономерно изменяются увеличивается плотность, усиливается окраска, уменьшается электроотрицательность. Азот и фосфор — типичные неметаллы, висмут имеет больше металлических свойств. Мышьяк и сурьма занимают промежуточное положение. Многие их соединения обладают полупроводниковыми свойствами. Физические свойства элементов приведены в таблице 26, свойства простых веществ в таблице 27. [c.118]Физические свойства. Фосфор образует несколько аллотропических видоизменений, отличающихся друг от друга по свойствам белый или желтый, фиолетовый и черный. Различие между отдельными аллотропическими видоизменениями фосфора можно видеть из табл. 148.
Неметаллы образованы с помощью неполярной ковалентной связи. Они могут иметь атомную (алмаз, кремний, рафит, черный фосфор) или молекулярную (кристаллическая сера белый фосфор Р , галогены, в твердом состоянии — иод при и.у, бром Вг при низких температурах) кристаллическую решетку. Поэтому физические свойства неметаллов весьма различны. [c.147]
Чистую ортофосфорную кислоту получают из элементарного фосфора. Способы получения и физические свойства ортофосфорной кислоты описаны в [55]. [c.12]
Простых веществ. Алмаз И графит являются простыми веществами. Оба они состоят только из атомов углерода. Однако графит отличается от алмаза по химическим и особенно по физическим свойствам. Другим примером могут служить две формы фосфора — белый и красный. [c.12]
Физические свойства. Фосфор образует три основные аллотропные модификации белый, красный и черный. Наиболее активным в химическом отношении является белый фосфор. На воздухе самовоспламеняется, в темноте светится. В жидком, растворенном состоянии, а также в парах ниже 1000° С устойчивы четырехатомные молекулы Р4, [c.229]
Фосфор образует целый ряд аллотропных модификаций. Главные из них — белый, красный и черный фосфор. Физические свойства аллотропных модификаций фосфора приведены в таблице 27. При высоких давлениях можно получить еще несколько аморфных модификаций фосфора. [c.125]
Рассмотрение табл. 7-2 показывает, что Менделееву удалось очень точно предсказать физические и химические свойства недостававшего в его системе эле.мента. Этому элементу отводилось место в периодической таблице под кремнием, 81, и над оловом, 8п. Физические свойства германия представляют собой как раз нечто среднее между свойствами кремния и олова. Для предсказания химических свойств экасилиция Менделеев воспользовался также данными о закономерном изменении свойств в триаде фосфор-мышьяк-сурьма (8Ь), являющейся в периодической таблице правым соседом триады кремний-экасилиций-олово.
При нагревании белого фосфора до 380° С в запаянной трубке в присутствии ртути происходит разрыв связей в четырехатомной молекуле и образуется стеклообразное аморфное твердое темносерое вещество, которое при повышении температуры переходит в кристаллический черный фосфор. В зависимости от температуры и давления получены две разновидности черного фосфора, отличающиеся электрическими свойствами [1021]. При нагревании стеклообразного фосфора в запаянной трубке в отсутствие ртути он переходит в красный фосфор [660]. В присутствии следов железа и красного фосфора белый фосфор окрашен в желтый цвет и поэтому его иногда называют желтым фосфором [55]. Условия получения и физические свойства различных модификаций фосфора описаны в работах [55, 258, 292, 315]. Физические свойства модификаций фосфора представлены в табл. 1. [c.8]
Наличие на внешнем уровне пяти электронов обусловливает увеличение неметаллических свойств этих элементов. Первые два элемента этой подгруппы — азот и фосфор — являются типичными неметаллами мышьяк, сурьма, висмут отличаются от азота и фосфора тем, что у них предпоследний энергетический уровень состоит из 18 электронов, они имеют большие радиусы атомов и меньшие значения ионизационного потенциала. В связи с этим у них наблюдается тенденция к усилению металлических свойств у мышьяка и сурьмы проявляются в равной степени как металлические, так и неметаллические свойства, у висмута металлические свойства значительно преобладают над неметаллическими. В табл. 20 приведены некоторые физические свойства элементов подгруппы азота. [c.128]
Физические свойства простых веществ, образованных элементами подгруппы азота, изменяются в той же последовательности, что и у ранее рассмотренных нами подгрупп (см. гл. XI, XII), Так, температура плавления у азота и фосфора составляет соответственно —209,8° и 44,1°, температура кипения —195° и 280° соответ ственно.
По своим химическим и физическим свойствам фосфор является типичным неметаллом. [c.181]
Установлено, что красный фосфор состоит из двух аллотропических видоизменений пурпурового и рубинового, которые можно получить отдельно. Они отличаются друг от друга некоторыми физическими свойствами. В частности, температура воспламенения рубинового фосфора 346°, а пурпурового — около 240°. [c.479]
Физические свойства. Фосфор образует три основные аллотропные модификации белый, красный и черный. Наиболее активным в химическом отношении является белый фосфор. На воздухе самовоспламеняется, в темноте светится. В жидком, растворенном состоянии, а также в парах ниже 1000 °С устойчивы четырехатомные молекулы Р4, имеющие форму тетраэдра. Получают при быстром охлаждении паров фосфора. Ядовит. [c.208]
Физические свойства. Уменьшение неметалличности элемента фосфора по сравнению с азотом сказывается на свойствах его простых веществ. Так, фосфор в отличие от азота имеет несколько аллотропных модификаций белый, красный, черный и др. Белый фосфор — бесцветное и очень ядовитое вещество. Получается конденсацией паров фосфора. Не растворяется в воде, но хорошо растворяется в сероуглероде. При длительном слабом нагревании белый фосфор переходит в красный. [c.118]
Опишите физические свойства белого и красного фосфора. В левом колене сосуда (рис. 25, а), из которого выкачан воздух, сильно нагревается красный фосфор, а правое колено охлаждается. Что накопляется в нем [c.69]
Физические свойства. Уменьшение неметалличности элемента фосфора по сравнению с азотом сказывается на свойствах его простых веществ. Так, фосфор в отличие от азота имеет несколько аллотропных модификаций белый, красный, черный и др.
Физические свойства. Простое вещество фосфор может существовать в виде нескольких аллотропных модификаций. Все они представляют собой твердые вещества кристаллического или аморфного строения. Наиболее известными и устойчивыми модификациями фосфора являются белый, красный и черный фосфор. [c.397]
В каких аллотропических модификациях может находиться фосфор в виде простого вещества Чем отличаются они друг от друга по физическим свойствам и химической активности [c.299]
Черный фосфор получают нагреванием белого фосфора при 200 °С и очень высоком давлении. Он также имеет полимерное строение с углом между связями 99°. По внешнему виду и некоторым физическим свойствам черный фосфор похож на графит. Он проводит электрический ток, жирный на ощупь. Черный фосфор весьма инертен и воспламеняется только при 490 °С. [c.326]
Химические свойства простых веществ. При рассмотрении физических свойств простых веществ подчеркивалось, что они в основном присущи макроскопическим количествам вещества (особенно в конденсированном состоянии). Что же касается химических свойств, то они главным образом определяются свойствами атомов или молекул, поскольку химическое взаимодействие всегда протекает на атомном или молекулярном уровне. Однако реально наблюдаемая химическая активность твердых простых веществ в заметной мере зависит, например, от величины поверхности соприкосновения, ее состояния, структуры кристалла и т.п., т.е. опять-таки от макроскопических характеристик. Так, мелкодисперсный цинк (цинковая пыль) значительно энергичнее взаимодействует с кислотами, чем гранулированный. Например, цинковая пыль восстанавливает азотную кислоту до аммиака, а гранулированный цинк — только до низших оксидов азота. Хорошо известна также способность многих металлов (А1, Ре, Т1, Сг и др.) к пассивации в агрессивных окисляющих средах, хотя сами эти металлы достаточно активны. Кроме того, различные модификации одного и того же простого вещества могут заметно различаться по химической активности (например, белый и красный фосфор). Таким образом, химические свойства простых веществ представляют собой единство атомной, молекулярной и кристаллической форм химической организации со всеми характерными для них особенностями.
Физические свойства. Известно несколько аллотропных видоизменений фосфора белый, красный, черный и др. Образование их объясняется различным расположением атомов относительно друг друга в кристаллических решетках. [c.248]
Физические свойства простых веществ. Для простых веществ — неметаллов характерно разнообразие внешних признаков. При обычных условиях они могут быть газами (водород, кислород, гелий, хлор), жидкостями (бром), твердыми веществами (углерод, сера, фосфор). Большинство металлов ири обычных условиях — твердые кристаллические вещества (за исключением ртути — жидкости) с характерным металлическим блеском. [c.164]
Янг и Томас [2122] провели большое исследование по разработке методов очистки эфиров жирных кислот с низким молекулярным весом. Были испольэованы препараты эфиров фирмы Кальбаум , а также синтезированные из кислоты (или ангидрида) и спирта. Все эти препараты тщательно очищали, после чего проводили сравнение их физических свойств. Предполагалось, что в качестве примесей они содержат спирты, кислоты, воду и гомологи эфиров. Кислоты удаляли многократным встряхиванием с концентрированными водными растворами поташа было показано, что твердый поташ для этой цели мало эффективен. После встряхивания эфир несколько раз промывали водой, за исключением тех случаев, когда соответствующие соединения заметно растворялись в воде. Низшие спирты удалялись главным образом при промывке водой. Перед фракционированием эфир необходимо подвергать сушке. Поташ использовался только для осветления мутных от суспендированной воды эфиров. Окончательное осушение проводили над пятиокисью фосфора, которая связывает воду и остаточные спирты. В тех случаях, когда в эфире содержались значительные количества воды и спирта, пятиокись фосфора шипела и быстро разжижалась. Эфир несколько раз декантировали и добавляли к нему дополнительные количества пятиокиси фосфора, до тех пор пока окись не принимала вида пасты, после чего эфир подвергали фракционированной перегонке. К дистиллату добавляли пятиокись фосфора, и на следующий день эфир приобретал вид студня это явление обычно наблюдается в тех случаях, когда окись фосфора оставляют стоять с сухим, не содержащим спирта эфиром. В заключение эфир вновь перегоняли в сухой атмосфере.
Физические свойства элементарного фосфора [53, 263, 321] [c.8]
Спектральные методы определения фосфора обладают рядом особенностей, связанных с его физическими свойствами. [c.67]
Одинаковы ли физические свойства оксида фосфора и свойства составляющих его простых веществ Ответ поясните. [c.39]
При высоких и сверхвысоких давлениях изменяются физические свойства веществ. Так, в ряде случаев вещества, которые при обычных давлениях являются изоляторами (например, сера), при сверхвысоком давлении становятся полупроводниками. Полупроводники же при 2- 10 —5- 10 Па могут переходить в металлическое состояние. Подобные переходь[ изучены у теллура, иода, фосфора, ряда соединений. Расчеты показывают, что дальнейшее повышение давления металлизует все вещества. Интересные превращения претерпевает иттербий (УЬ), При давлении до 2- 10 Па иттербий — металл, при 2-Ю —4-10 Па — полупроводник, выше 4-10 Па— нова металл. [c.124]
Физические свойства. Фосфор образует несколько аллотропических ви ,о]кзменений. Ва кне/ииими из них являются белый, красный и черный фосфор. [c.214]
Все элементы подгруппы галлия легко вступают в реакцию при комнатной температуре или при нагревании с галогенами, серой, кислородом, фосфором и другими неметаллами. При взаимодействии с металлами они образуют большое число интерметаллкческих соединений и сплавов некоторые нз них обладают ценными физическими свойствами (например, УзОа, МЬзОа проявляют свойства сверхпроводников). [c.169]
Что такое координационное число в кристаллах хлорида натрия, натрия, хло-иона Чему равны координационные числа рида фосфора (V) (P I5), графита и льда в структурах типа Na l (а) и s l (б) Объясните, каким образом тип связи опре-Чем обусловлено различие этих координаци- деляет физические свойства тих твердых онных чисел тел. [c.145]
В зависимости от состава смешиваемых удобрений общее содержание питательных веществ в тукосмеси изменяется от 30 до 60%, Помимо азота, фосфора и калия, смегпанные удобрения могут содержать микроэлементы, гербициды, пестициды, стимуляторы роста и др. Для нейтрализации избыточной кис- i лотности и улучшения физических свойств в тукосмеси часто 1 вводят нейтрализующие добавки извсстляк, доломит, фосфо- j рнтпую или костяную муку и др. [c.340]
Дюшон [135] пришел к заключению, что благоприятное действие коллоидного кремнезема на урожаи культур в песчаной среде при недостаточном содержании фосфорной кислоты, используемой в качестве удобрения, обусловлено главным образом физическими свойствами коллоидной системы и заключается в улучшении физического состояния песчаной почвы и использования имеющегося фосфора. Хэмпл [136] пришел к аналогичному заключению. [c.1033]
Джеффери и Фогель [962] получали нитрил уксусной кислоты с целью изучения его физических свойств из ацетамида и пятиокиси фосфора. Температура кипения составляла 81° (757 мм). (См. таже работу Вальдена [1974].) [c.419]
Джеффери и Фогель [962] получали нитрил бензойной кислоты для изучения его физических свойств путем нагревания 45 г бензамида и 75 г пятиокиси фосфора. Продукт реакции промывали раствором поташа, сушили и перегоняли. Температура кипения составляла 189° (758 мм). [c.423]
Мышьяк существует в четырех аллотропных формах металлической, серой, желтой коричневой. При нагревании его на воздухе образуется трехокись мышьяка AsiO.i, Ппи горении мышьяка выделяется сильный чесночный запах, который не замечается, когда подвергают сублимации чистую трехокись мышьяка. Пары его ядовиты. По своим физическим свойствам. мышьяк похож на металл однако характер взаимодействия его с кис,тородсодержащими кислотами заставляет- отнести его к неметаллам. Подобно фосфору устойчивая. молекула мышьяка содержит четыре атома. В группе периодической системы элементов, в которой находится мышьяк, первые члены ее, азот и фосфор, не имеют основных свойств. Находящиеся ниже. мышьяка сурьма и висмут обладают определенным металли-ческ И г, а их трехвалентные окислы — определенно основным характером. Мышьяк занимает промежуточное положение. [c.163]
Безводный перхлорат магния может абсорбировать влагу в., количествах вплоть до 60% от его собственного вe a , т. е. во много раз больше, чем пятиокись фосфора. Он значительно лучше ее и по своим физическим свойствам не становится клейким и не растекается при применении, уменьшается в объеме при абсорбировании влаги . В противоположность кислым осушителям, [c.155]
chem21.info
Черный фосфор — это… Что такое Черный фосфор?
| Фосфор(P) | |
|---|---|
| Атомный номер | 15 |
| Внешний вид простого вещества | Белый фосфор- белый, восковидный, слегка фосфоресцирующий |
| Свойства атома | |
| Атомная масса (молярная масса) |
30,973762 а. е. м. (г/моль) |
| Радиус атома | 128 пм |
| Энергия ионизации (первый электрон) |
1011,2(10,48) кДж/моль (эВ) |
| Электронная конфигурация | [Ne] 3s2 3p3 |
| Химические свойства | |
| Ковалентный радиус | 106 пм |
| Радиус иона | 35 (+5e) 212 (-3e) пм |
| Электроотрицательность (по Полингу) |
2,19 |
| Электродный потенциал | 0 |
| Степени окисления | 5, 3, -3 |
| Термодинамические свойства простого вещества | |
| Плотность | (белый фосфор)1,82 г/см³ |
| Удельная теплоёмкость | 0,757 Дж/(K·моль) |
| Теплопроводность | (0,236) Вт/(м·K) |
| Температура плавления | 317,3 K |
| Теплота плавления | 2,51 кДж/моль |
| Температура кипения | 553 K |
| Теплота испарения | 49,8 кДж/моль |
| Молярный объём | 17,0 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая |
| Период решётки | 7,170 Å |
| Отношение c/a | n/a |
| Температура Дебая | n/a K |
| P | 15 |
| 30,973762 | |
| 3s²3p³ | |
| Фосфор | |
Фосфор — один из самых распространённых элементов земной коры, его содержание составляет 0,08—0,09 % её массы. В свободном состоянии не встречается из-за высокой химической активности. Образует около 190 минералов, важнейшими из которых являются апатит Ca5(PO4)3F, фосфорит Ca3(PO4)2 и другие. Фосфор содержится во всех частях зелёных растений, ещё больше его в плодах и семенах (см. фосфолипиды). Содержится в животных тканях, входит в состав белков и других важнейших органических соединений (АТФ), является элементом жизни.
История
Схема атома фосфора
Фосфор открыт гамбургским алхимиком Хеннингом Брандом в 1669 году. Подобно другим алхимикам, Бранд пытался отыскать эликсир жизни или философский камень, а получил светящееся вещество. Существуют данные, что фосфор умели получать еще арабские алхимики в XII в. То, что фосфор — простое вещество, доказал Лавуазье.
Происхождение названия
В 1669 Хеннинг Бранд при нагревании смеси белого песка и выпаренной мочи получил светящееся в темноте вещество, названное сначала «холодным огнём». Вторичное название «фосфор» происходит от греческих слов «фос» — свет и «феро» — несу.
Получение
Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и песком при температуре 1500 °С:
- 2Ca3(PO4)2 + 10C + 6SiO2 → 4P + 10CO + 6CaSiO3.
Образующиеся пары белого фосфора конденсируются в приёмнике под водой. Вместо фосфоритов восстановлению можно подвергнуть и другие соединения, например, метафосфорную кислоту:
- 4HPO3 + 12C → 4P + 2H2 + 12CO.
Физические свойства
Элементарный фосфор в обычных условиях представляет собой несколько устойчивых аллотропических модификаций; вопрос аллотропии фосфора сложен и до конца не решён. Обычно выделяют четыре модификации простого вещества — белую, красную, черную и металлический фосфор. Иногда их ещё называют главными аллотропными модификациями, подразумевая при этом, что все остальные являются разновидностью указанных четырёх. В обычных условиях существует только три аллотропических модификации фосфора, а в условиях сверхвысоких давлений — также металлическая форма. Все модификации различаются по цвету, плотности и другим физическим характеристикам; заметна тенденция к резкому убыванию химической активности при переходе от белого к металлическому фосфору и нарастанию металлических свойств.
Белый фосфор
Белый фосфор представляет собой белое вещество (из-за примесей может иметь желтоватый оттенок) с температурой плавления 44,1 °С. По внешнему виду он очень похож на очищенный воск или парафин, легко режется ножом и деформируется от небольших усилий. Отливаемый в инертной атмосфере в виде палочек (слитков), он сохраняется в отсутствии воздуха под слоем очищенной воды или в специальных инертных средах. Химически белый фосфор чрезвычайно активен. Например, белый фосфор медленно окисляется кислородом воздуха уже при комнатной температуре и светится (бледно-зелёное свечение). Явление такого рода свечения вследствие химических реакций окисления называется хемилюминесценцией или устаревшим термином — фосфоресценцией. Белый фосфор не только активен химически, но и весьма ядовит (вызывает поражение костей, костного мозга, некроз челюстей) и легкорастворим в органических растворителях. Летальная доза белого фосфора для взрослого мужчины составляет 0,05—0,1 г. Растворимостью белого фосфора в сероуглероде пользуются для промышленной очистки его от примесей. Плотность белого фосфора из всех его модификаций наименьшая и составляет около 1823 кг/м³.
Жёлтый фосфор
Неочищенный белый фосфор обычно называют «жёлтый фосфор». Сильноядовитое (ПДК 0,03 мг/м³), огнеопасное кристаллическое вещество от светло-жёлтого до тёмно-бурого цвета. Удельный вес 1,83 г/см³, плавится при +34 °C, кипит при +280 °C. В воде не растворяется, на воздухе легко окисляется и самовоспламеняется. Горит с выделением густого белого дыма — мелких частичек декаоксида тетрафосфора P4O10[1]. Несмотря на то, что в результате реакции между фосфором и водой (4Р + 6Н2О → РН3 + 3Н3РО2) выделяется ядовитый газ фосфин (РН3), для тушения фосфора используют воду в больших количествах (для снижения температуры очага возгорания и перевода фосфора в твердое состояние) или раствор сульфата меди (медного купороса), после гашения фосфор засыпают влажным песком. Для предохранения от самовозгорания желтый фосфор хранится и перевозится под слоем воды (раствора хлорида кальция).
Красный фосфор
Красный фосфор, также называемый фиолетовым фосфором, — это более термодинамически стабильная модификация элементарного фосфора. Впервые он был получен в 1847 году в Швеции австрийским химиком А. Шрёттером при нагревании белого фосфора при 500 °С в атмосфере угарного газа (СО) в запаянной стеклянной ампуле.
Красный фосфор имеет формулу (Р4)n и представляет собой полимер со сложной структурой. В зависимости от способа получения и степени дробления красного фосфора, имеет оттенки от пурпурно-красного до фиолетового, а в литом состоянии — тёмно-фиолетовый с медным оттенком металлический блеск. Химическая активность красного фосфора значительно ниже, чем у белого; ему присуща исключительно малая растворимость. Растворить красный фосфор возможно лишь в некоторых расплавленных металлах (свинец и висмут), чем иногда пользуются для получения крупных его кристаллов. Так, например, немецкий физико-химик И. В. Гитторф в 1865 году впервые получил прекрасно построенные, но небольшие по размеру кристаллы (фосфор Гитторфа). На воздухе красный фосфор воспламеняется при высоких температурах (при переходе в белую форму во время возгонки), и у него полностью отсутствует явление хемолюминесценции. Ядовитость его в тысячи раз меньше, чем у белого, поэтому он применяется гораздо шире, например, в производстве спичек. Плотность красного фосфора также выше, и достигает 2400 кг/м³ в литом виде. При хранении на воздухе красный фосфор в присутствии влаги постепенно окисляется, образуя гигроскопичный оксид, поглощает воду и отсыревает («отмокает»), образуя вязкую фосфорную кислоту; поэтому его хранят в герметичной таре. При «отмокании» — промывают водой от остатков фосфорных кислот, высушивают и используют по назначению.
Чёрный фосфор
Чёрный фосфор — это наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Впервые чёрный фосфор был получен в 1914 году американским физиком П. У. Бриджменом из белого фосфора в виде чёрных блестящих кристаллов, имеющих высокую (2690 кг/м³) плотность. Для проведения синтеза чёрного фосфора Бриджмен применил давление в 2·109 Па (20 тысяч атмосфер) и температуру около 200 °С. Начало быстрого перехода лежит в области 13 000 атмосфер и температуре около 230 °С.
Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, и с полностью отсутствующей растворимостью в воде или органических растворителях. Поджечь чёрный фосфор можно, только предварительно сильно раскалив в атмосфере чистого кислорода до 400 °С. Удивительным свойством чёрного фосфора является его способность проводить электрический ток и свойства полупроводника. Температура плавления чёрного фосфора 1000 °С под давлением 18·105 Па.
Металлический фосфор
При 8,3·1010 Па чёрный фосфор переходит в новую, ещё более плотную и инертную металлическую фазу с плотностью 3,56 г/см³, а при дальнейшем повышении давления до 1,25·1011 Па — ещё более уплотняется и приобретает кубическую кристаллическую решётку, при этом его плотность возрастает до 3,83 г/см³. Металлический фосфор очень хорошо проводит электрический ток.
Химические свойства
Химическая активность фосфора значительно выше, чем у азота. Химические свойства фосфора во многом определяются его аллотропной модификацией. Белый фосфор очень активен, в процессе перехода к красному и чёрному фосфору химическая активность резко снижается. Белый фосфор на воздухе светится в темноте, свечение обусловлено окислением паров фосфора до низших оксидов.
В жидком и растворенном состоянии, а также в парах до 800 °С фосфор состоит из молекул Р4. При нагревании выше 800 °С молекулы диссоциируют: Р4 = 2Р2. При температуре выше 2000 °С молекулы распадаются на атомы.
Взаимодействие с простыми веществами
Фосфор легко окисляется кислородом:
- 4P + 5O2 → 2P2O5,
- 4P + 3O2 → 2P2O3.
Взаимодействует со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства:
с металлами — окислитель, образует фосфиды:
- 2P + 3Ca → Ca3P2.
- 2P + 3Mg → Mg3P2.
с неметаллами — восстановитель:
- 2P + 3S → P2S3,
- 2P + 3Cl2 → 2PCl3.
Не взаимодействует с водородом.
Взаимодействие с водой
Взаимодействует с водой, при этом диспропорционирует:
- 4Р + 6Н2О → РН3 + 3Н3РО2 (фосфатная кислота).
Взаимодействие со щелочами
В растворах щелочей диспропорционирование происходит в большей степени:
- 4Р + 3KOH + 3Н2О → РН3 + 3KН2РО2.
Восстановительные свойства
Сильные окислители превращают фосфор в фосфорную кислоту:
- 3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO;
- 2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O.
Реакция окисления также происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
- 6P + 5KClO3 → 5KCl + 3P2O5
Применение
Фосфор является важнейшим биогенным элементом и в то же время находит очень широкое применение в промышленности. Красный фосфор применяют в производстве спичек. Его вместе с тонко измельчённым стеклом и клеем наносят на боковую поверхность коробка. При трении спичечной головки в состав который входят хлорат калия и сера, происходит воспламенение.
Элементарный фосфор
Пожалуй, первое свойство фосфора, которое человек поставил себе на службу, — это горючесть. Горючесть фосфора очень велика и зависит от аллотропической модификации.
Наиболее активен химически, токсичен и горюч белый («жёлтый») фосфор, потому он очень часто применяется (в зажигательных бомбах и пр.).
Красный фосфор — основная модификация, производимая и потребляемая промышленностью. Он применяется в производстве спичек, взрывчатых веществ, зажигательных составов, топлив, а также противозадирных смазочных материалов.
Соединения фосфора в сельском хозяйстве
Фосфор (в виде фосфатов) — один из трёх важнейших биогенных элементов (NPK), участвует в синтезе АТФ. Большая часть производимой фосфорной кислоты идёт на получение фосфорных удобрений — суперфосфата, преципитата, аммофоски и др.
Соединения фосфора в промышленности
Фосфаты широко используются:
- в качестве комплексообразователей (средства для умягчения воды),
- в составе пассиваторов поверхности металлов (защита от коррозии, например, т. н. состав «мажеф»),
Фосфатные связующие
Способность фосфатов формировать прочную трёхмерную полимерную сетку используется для изготовления фосфатных и алюмофосфатных связок
Биологическая роль соединений фосфора
Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Са3(РО4)3·CaF2. В состав зубной эмали входит фторапатит. Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. Суточная потребность человека в фосфоре 800-1500 мг. При недостатке фосфора в организме развиваются различные заболевания костей.
Токсикология элементарного фосфора
- Красный фосфор практически нетоксичен. Пыль красного фосфора, попадая в легкие, вызывает пневмонию при хроническом действии.
- Белый фосфор очень ядовит, растворим в липидах. Смертельная доза белого фосфора — 50-150 мг. Попадая на кожу, белый фосфор дает тяжелые ожоги.
Острые отравления фосфором проявляются жжением во рту и желудке, головной болью, слабостью, рвотой. Через 2-3 суток развивается желтуха. Для хронических форм характерны нарушение кальциевого обмена, поражение сердечно-сосудистой и нервной систем. Первая помощь при остром отравлении — промывание желудка, слабительное, очистительные клизмы, внутривенно растворы глюкозы. При ожогах кожи обработать пораженные участки растворами медного купороса или соды. ПДК паров фосфора в воздухе 0,03 мг/м3.
Токсикология соединений фосфора
Некоторые соединения фосфора (фосфин) очень токсичны. Боевые отравляющие вещества зарин, зоман, табун являются соединениями фосфора.
Примечания
- ↑ В. Шретер, К.-Х. Лаутеншлегер, Х. Бибрак и др. Химия = Chemie. — М.: Химия, 1989. — С. 351. — ISBN 5-7245-0360-3
См. также
- Категория:Соединения фосфора
Ссылки
Wikimedia Foundation. 2010.
dic.academic.ru
|
1. Расположен в 5 группе, в главной подгруппе 2. На внешнем энергетическом уровне содержится 5 электронов, 3s23p3. 3. СО: -3, +3, +5 В свободном состоянии не встречается из-за своей химической активности, образует около 190 минералов, важнейшими из которых являются апатит Ca5(PO4)3F, фосфорит Ca3(PO4)2 и флюорит CaF2. Фосфор содержится во всех частях зеленых растений, еще больше его в плодах и семенах. Содержится в животных тканях, входит в состав белков и других важнейших органических соединений, является элементом жизни. |
Фосфор может существовать в виде большого числа аллотропных модификаций, в настоящее время их насчитывается 11, но все многообразие видов можно свести к трем: белый, красный и черный фосфор. Белый фосфор имеет молекулярную решетку, в узлах которой находятся тетраэдрические молекулы Р4. Это очень реакционноспособное, мягкое воскообразное вещество бледно-желтого цвета, с неприятным чесночным запахом, растворимое в сероуглероде и бензоле, нерастворимое в жидкой воде, с водяным паром образует газовую смесь. Очень ядовито. Воспламеняется при трении, обладает уникальной способностью светиться в темноте за счет медленного окисления. Температура плавления 44 °С. В лаборатории его хранят под слоем воды. Красный фосфор Красный фосфор менее активен, чем белый, нерастворим в воде и сероуглероде, не светится в темноте, абсолютно безвреден. Аморфный. Черный фосфор. Это самая устойчивая модификация фосфора. По внешним признакам черный фосфор напоминает металл, имеет металлический блеск, обладает электропроводностью, теплопроводностью, довольно твердый. Имеет АКР. Наименее активный из всех модификаций. Красный и черный фосфор получают из белого фосфора. |
Фосфор – типичный неметалл, может быть окислителем и восстановителем. Химическая активность фосфора значительно выше, чем у азота. Химические свойства фосфора во многом определяются его аллотропной модификацией. Белый фосфор очень активен, в процессе перехода к красному и черному фосфору химическая активность резко снижается. I. Взаимодействие с простыми веществами 1.Фосфор легко окисляется кислородом: 4P + 5O2 = 2P2O5, 4P + 3O2 = 2P2O3. 2.Взаимодействует со многими простыми веществами – галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства: а) с металлами – окислитель, образует фосфиды: 2P + 3Ca = Ca3P2. б) с неметаллами – восстановитель : 2P + 3S = P2S3, 2P + 3Cl2 = 2PCl3. Не взаимодействует с водородом. II. Взаимодействие со сложными веществами 1.Взаимодействует с водой, при этом диспропорционирует: 4Р + 6Н2О = РН3 + 3Н3РО2 (фосфорноватистая к-та). 2.Взаимодействие со щелочами В растворах щелочей диспропорционирование происходит в большей степени: 4Р + 3KOH + 3Н2О = РН3 + 3KН2РО2 . III. Восстановительные свойства 1.Сильные окислители превращают фосфор в фосфорную кислоту: 3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO; 2P + 5H2SO4 = 2H3PO4 + 5SO2 + 2H2O. 2.Реакция окисления также происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль: 6P + 5KClO3 = 5KCl + 3P2O5. |
1. Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и песком при температуре 1500 °С: 2Ca3(PO4)2 + 10C + 6SiO2 = 4P + 10CO + 6CaSiO3. Образующиеся пары белого фосфора конденсируются в приемнике под водой. 2.Вместо фосфоритов восстановлению можно подвергнуть и другие соединения, например, метафосфорную кислоту: 4HPO3 + 12C = 4P + 2H2 + 12CO. |
flatik.ru
Строение атома фосфора. 2. Аллотропия фосфора. 3. Физические свойства. 4. Химические свойства. 5. Получение. 6. Применение. 7. Биологическое значение фосфора.
РЕШЕНИЕ
1Фото
2. Аллотропия — существование двух и более простых веществ одного и того же химического элемента, различных по строению и свойствам — так называемых аллотропных модификаций или форм.
Белый фосфор— желтовато-белое вещество (из-за примесей, по мягкости напоминает воск. Очень активное вещество; а светится, потому что уже при комнатной температуре окисляется кислородом из воздуха. Очень ядовитые и вонючие вещество.
Жёлтый фрсфор — то просто неочищенный белый фрсфор. Цвет — от желтого до коричневого. Так же активен, так же, как и белый фософр, на воздухе самовоспламеняется.
Красный фосфор — менее активное вещество, чем белый или желтый фосфор, меньше растворим в воде, на воздухе не самовоспламеняется и не светится. Менее ядовит.
Чёрный фосфор — чёрное вещество с металлическим блеском, на ощупь — жирный, внешне очень похож на графит. Чёрный фосфор даже проводит электрический ток, что обычно характерно для металлов. При определенном давлении он может переходить в модификацию, которую так и называют — металлический фосфор.
3. Самым распространенным является белый фосфор — он обладает воскообразной структурой и высокой токсичностью. Температура плавления данного вещества составляет сорок четыре градуса по Цельсию, а кипения — двести восемьдесят градусов. При трении данного материала он очень быстро возгорается, поэтому режут его, только поместив в водную среду. Если на протяжении длительного времени нагревать его при температуре двести пятьдесят градусов по шкале Цельсия, он превращается в красный фосфор. Это вещество представлено в виде порошка буро-красного цвета. Красный фосфор, в отличие от белого, не является ядовитым. Самой устойчивой формой существования данного элемента можно назвать черный фосфор, который по некоторым внешним признакам похож на металл: имеет своеобразный блеск, обладает высокой твердостью, электро- и теплопроводностью.
4. Химические свойства фосфора во многом определяются его аллотропной модификацией. Белый фосфор очень активен, в процессе перехода к красному и чёрному фосфору химическая активность снижается. Белый фосфор в воздухе при окислении кислородом воздуха при комнатной температуре излучает видимый свет, свечение обусловлено фотоэмиссионной реакцией окисления фосфора. 1)Фосфор легко окисляется кислородом.
2)Взаимодействует со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства, с металлами — окислитель, образует фосфиды.
3)Сильные окислители превращают фосфор в фосфорную кислоту.
4) Взаимодействует с водяным паром при температуре выше 500 °С, протекает реакция диспропорционирования с образованием фосфина и фосфорной кислоты:8P+12h3O➡5Ph4+3h4PO4.
5. Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре около 1600 °С:
2Ca3+(PO4)2+10C+6SiO2➡P4+10CO+6CaSi3.
6. Красный фосфор — основная модификация, производимая и потребляемая промышленностью. Он применяется в производстве спичек, взрывчатых веществ, зажигательных составов, различных типов топлива, а также противозадирных смазочных материалов, в качестве газопоглотителя в производстве ламп накаливания.
7. Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Са3(РО4)3·Ca(OH)2. В состав зубной эмали входит фторапати. Обмен фосфорных соединений регулируется гормонами и витамином D. При недостатке фосфора в организме развиваются различные заболевания костей.
funnychemistry.ru
Фосфор — WiKi
Фо́сфор (от др.-греч. φῶς — свет и φέρω — несу; φωσφόρος — светоносный; лат. Phosphorus) — химический элемент 15-й группы (по устаревшей классификации — главной подгруппы пятой группы) третьего периода периодической системы Д. И. Менделеева; имеет атомный номер 15. Элемент входит в группу пниктогенов. Фосфор — один из распространённых элементов земной коры: его содержание составляет 0,08—0,09 % её массы. Концентрация в морской воде 0,07 мг/л[5]. В свободном состоянии не встречается из-за высокой химической активности. Образует около 190 минералов, важнейшими из которых являются апатит Ca5(PO4)3(F,Cl,OH), фосфорит и другие. Фосфор входит в состав важнейших биологических соединений — фосфолипидов. Содержится в животных тканях, входит в состав белков и других важнейших органических соединений (АТФ, ДНК), является элементом жизни.
| Внешний вид простого вещества | |
|---|---|
|
Белый, красный и фиолетовый фосфор |
|
| Свойства атома | |
| Название, символ, номер | Фосфор/ Phosphorus (P), 15 |
| Атомная масса (молярная масса) |
30,973762(2)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Ne] 3s2 3p3 |
| Радиус атома | 128 пм |
| Химические свойства | |
| Ковалентный радиус | 106 пм |
| Радиус иона | 35 (+5e) 212 (-3e) пм |
| Электроотрицательность | 2,19 [2] (шкала Полинга) |
| Электродный потенциал | 0 |
| Степени окисления | 5, 3, 1, 0, −1, −3[3] |
| Энергия ионизации (первый электрон) |
1011,2(10,48) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | (белый фосфор)1,82 г/см³ |
| Температура плавления | 44,15 °C (317,3 K) |
| Температура кипения | 279,85 °C (553 K) |
| Уд. теплота плавления | 2,51 кДж/моль |
| Уд. теплота испарения | 49,8 кДж/моль |
| Молярная теплоёмкость | 21,6[4] (ромбич.) Дж/(K·моль) |
| Молярный объём | 17,0 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая, объёмноцентрированная |
| Параметры решётки | 18,800 Å |
| Прочие характеристики | |
| Теплопроводность | (300 K) (0,236) Вт/(м·К) |
| Номер CAS | 7723-14-0 |
История
Фосфор открыт гамбургским алхимиком Хеннигом Брандом в 1669 году. Подобно другим алхимикам, Бранд пытался отыскать философский камень, а получил светящееся вещество. Бранд сфокусировался на опытах с человеческой мочой, так как полагал, что она, обладая золотистым цветом, может содержать золото или нечто нужное для его добычи. Первоначально его способ заключался в том, что сначала моча отстаивалась в течение нескольких дней, пока не исчезнет неприятный запах, а затем кипятилась до клейкого состояния. Нагревая эту пасту до высоких температур и доводя до появления пузырьков, он надеялся, что, сконденсировавшись, они будут содержать золото. После нескольких часов интенсивных кипячений получались крупицы белого воскоподобного вещества, которое очень ярко горело и к тому же мерцало в темноте. Бранд назвал это вещество phosphorus mirabilis (лат. «чудотворный носитель света»). Открытие фосфора Брандом стало первым открытием нового элемента со времён античности.
Несколько позже фосфор был получен другим немецким химиком — Иоганном Кункелем.
Независимо от Бранда и Кункеля фосфор был получен Р. Бойлем, описавшим его в статье «Способ приготовления фосфора из человеческой мочи», датированной 14 октября 1680 года и опубликованной в 1693 году.
Более усовершенствованный способ получения фосфора был опубликован в 1743 году Андреасом Маргграфом.
Существуют данные, что фосфор умели получать ещё арабские алхимики в XII в.
То, что фосфор — простое вещество, доказал Лавуазье.
Происхождение названия
В 1669 году Хеннинг Бранд при нагревании смеси белого песка и выпаренной мочи получил светящееся в темноте вещество, названное сначала «холодным огнём». Вторичное название «фосфор» происходит от греческих слов «φώς» — свет и «φέρω» — несу. В древнегреческой мифологии имя Фосфор (или Эосфор, др.-греч. Φωσφόρος) носил страж Утренней звезды.
Получение
Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре около 1600 °С:
- 2Ca3(PO4)2+10C+6SiO2→P4+10CO+6CaSiO3{\displaystyle {\mathsf {2Ca_{3}(PO_{4})_{2}+10C+6SiO_{2}\rightarrow P_{4}+10CO+6CaSiO_{3}}}}
Образующиеся пары фосфора конденсируются в приёмнике под слоем воды в аллотропическую модификацию в виде белого фосфора. Вместо фосфоритов для получения элементарного фосфора можно восстанавливать углём и другие неорганические соединения фосфора, например, в том числе, метафосфорную кислоту:
- 4HPO3+10C→P4+2h3O+10CO{\displaystyle {\mathsf {4HPO_{3}+10C\rightarrow P_{4}+2H_{2}O+10CO}}}
Физические свойства
Элементарный фосфор при нормальных условиях существует в виде нескольких устойчивых аллотропических модификаций. Все существующие аллотропные модификации фосфора пока (2016 г.) до конца не изучены. Традиционно различают четыре его модификации: зеленовато-белый, красный, чёрный и металлический фосфор. Иногда их ещё называют главными аллотропными модификациями, подразумевая при этом, что все остальные описываемые модификации являются смесью этих четырёх. При стандартных условиях устойчивы только три аллотропических модификации фосфора (например, белый фосфор термодинамически неустойчив (квазистационарное состояние) и переходит со временем при нормальных условиях в красный фосфор). В условиях сверхвысоких давлений термодинамически устойчива металлическая форма элемента. Все модификации различаются по цвету, плотности и другим физическим и химическим характеристикам, особенно по химической активности. При переходе состояния вещества в более термодинамически устойчивую модификацию снижается химическая активность, например, при последовательном превращении белого фосфора в красный, потом красного в чёрный (металлический).
 Аллотропные модификации фосфора (белый, красный, чёрный, металлический)
Аллотропные модификации фосфора (белый, красный, чёрный, металлический)
Белый фосфор
Белый фосфор представляет собой белое вещество (из-за примесей может иметь желтоватый оттенок). По внешнему виду он очень похож на очищенный воск или парафин, легко режется ножом и деформируется от небольших усилий.
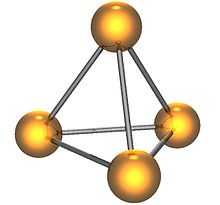 Молекула белого фосфора
Молекула белого фосфора
Белый фосфор имеет молекулярную кристаллическую решётку, формула молекулы белого фосфора — P4, причём атомы расположены в вершинах тетраэдра[6]. Отливаемый в инертной атмосфере в виде палочек (слитков), он сохраняется в отсутствии воздуха под слоем очищенной воды или в специальных инертных средах.
Плохо растворяется в воде[6], но легкорастворим в органических растворителях. Растворимостью белого фосфора в сероуглероде пользуются для промышленной очистки его от примесей. Плотность белого фосфора из всех его модификаций наименьшая и составляет около 1823 кг/м³. Плавится белый фосфор при 44,1 °C. В парообразном состоянии происходит диссоциация молекул фосфора.
Химически белый фосфор чрезвычайно активен. Например, он медленно окисляется кислородом воздуха уже при комнатной температуре и светится (бледно-зелёное свечение). Явление такого рода свечения вследствие химических реакций окисления называется хемилюминесценцией (иногда ошибочно фосфоресценцией). При взаимодействии с кислородом белый фосфор горит даже под водой[7].
Белый фосфор не только активен химически, но и весьма ядовит: летальная доза белого фосфора для взрослого человека составляет 0,05—0,15 г[4], а при хроническом отравлении поражает кости, например, вызывает омертвение челюстей[4]. При контакте с кожей легко самовоспламеняется, вызывая серьёзные ожоги[8][9].
Под действием света, при нагревании до не очень высоких температур в безвоздушной среде[6], а также под действием ионизирующего излучения[10] белый фосфор превращается в красный фосфор.
Жёлтый фосфор
Неочищенный белый фосфор обычно называют «жёлтый фосфор». Сильно ядовитое (ПДК в атмосферном воздухе 0,0005 мг/м³), огнеопасное кристаллическое вещество от светло-жёлтого до тёмно-бурого цвета. Удельный вес 1,83 г/см³, плавится при +43,1 °C, кипит при +280 °C. В воде не растворяется, на воздухе легко окисляется и самовоспламеняется. Горит ослепительным ярко-зеленым пламенем с выделением густого белого дыма — мелких частичек декаоксида тетрафосфора P4O10[11].
Так как фосфор реагирует с водой лишь при температуре свыше 500 градусов по Цельсию, то для тушения фосфора используют воду в больших количествах (для снижения температуры очага возгорания и перевода фосфора в твердое состояние) или раствор сульфата меди (медного купороса), после гашения фосфор засыпают влажным песком. Для предохранения от самовозгорания жёлтый фосфор хранится и перевозится под слоем воды (раствора хлорида кальция)[12].
Красный фосфор
Красный фосфорКрасный фосфор — это более термодинамически стабильная модификация элементарного фосфора. Впервые он был получен в 1847 году в Швеции австрийским химиком А. Шрёттером при нагревании белого фосфора при 500 °С в атмосфере угарного газа (СО) в запаянной стеклянной ампуле.
Красный фосфор имеет формулу Рn и представляет собой полимер со сложной структурой. В зависимости от способа получения и степени дробления, красный фосфор имеет оттенки от пурпурно-красного до фиолетового, а в литом состоянии — тёмно-фиолетовый с медным оттенком, имеет металлический блеск. Химическая активность красного фосфора значительно ниже, чем у белого; ему присуща исключительно малая растворимость. Растворить красный фосфор возможно лишь в некоторых расплавленных металлах (свинец и висмут), чем иногда пользуются для получения крупных его кристаллов. Так, например, немецкий физико-химик И. В. Гитторф в 1865 году впервые получил прекрасно построенные, но небольшие по размеру кристаллы (фосфор Гитторфа). Красный фосфор на воздухе не самовоспламеняется, вплоть до температуры 240—250 °С (при переходе в белую форму во время возгонки), но самовоспламеняется при трении или ударе, у него полностью отсутствует явление хемилюминесценции. Нерастворим в воде, а также в бензоле, сероуглероде и других веществах, растворим в трибромиде фосфора. При температуре возгонки красный фосфор превращается в пар, при охлаждении которого образуется в основном белый фосфор.
Ядовитость его в тысячи раз меньше, чем у белого, поэтому он применяется гораздо шире, например, в производстве спичек (составом на основе красного фосфора покрыта тёрочная поверхность коробков). Плотность красного фосфора также выше, и достигает 2400 кг/м³ в литом виде. При хранении на воздухе красный фосфор в присутствии влаги постепенно окисляется, образуя гигроскопичный оксид, поглощает воду и отсыревает («отмокает»), образуя вязкую фосфорную кислоту; поэтому его хранят в герметичной таре. При «отмокании» — промывают водой от остатков фосфорных кислот, высушивают и используют по назначению.
Чёрный фосфор
Чёрный фосфор — это наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Впервые чёрный фосфор был получен в 1914 году американским физиком П. У. Бриджменом из белого фосфора в виде чёрных блестящих кристаллов, имеющих высокую (2690 кг/м³) плотность. Для проведения синтеза чёрного фосфора Бриджмен применил давление в 2·109 Па (20 тысяч атмосфер) и температуру около 200 °С. Начало быстрого перехода лежит в области 13 000 атмосфер и температуре около 230 °С.
Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, и с полностью отсутствующей растворимостью в воде или органических растворителях. Поджечь чёрный фосфор можно, только предварительно сильно раскалив в атмосфере чистого кислорода до 400 °С. Чёрный фосфор проводит электрический ток и имеет свойства полупроводника. Температура плавления чёрного фосфора 1000 °С под давлением 1,8·106 Па.
Металлический фосфор
При 8,3·1010 Па чёрный фосфор переходит в новую, ещё более плотную и инертную металлическую фазу с плотностью 3,56 г/см³, а при дальнейшем повышении давления до 1,25·1011 Па — ещё более уплотняется и приобретает кубическую кристаллическую решётку, при этом его плотность возрастает до 3,83 г/см³. Металлический фосфор очень хорошо проводит электрический ток.
Химические свойства
Химическая активность фосфора значительно выше, чем у азота. Химические свойства фосфора во многом определяются его аллотропной модификацией. Белый фосфор очень активен, в процессе перехода к красному и чёрному фосфору химическая активность снижается. Белый фосфор в воздухе при окислении кислородом воздуха при комнатной температуре излучает видимый свет, свечение обусловлено фотоэмиссионной реакцией окисления фосфора.
В жидком и растворенном состоянии, а также в парах до 800 °С фосфор состоит из молекул Р4. При нагревании выше 800 °С молекулы диссоциируют: Р4 = 2Р2. При температуре выше 2000 °С молекулы распадаются на атомы.
Взаимодействие с простыми веществами
Фосфор легко окисляется кислородом:
- 4P+5O2→2P2O5{\displaystyle {\mathsf {4P+5O_{2}\rightarrow 2P_{2}O_{5}}}} (с избытком кислорода)
- 4P+3O2→2P2O3{\displaystyle {\mathsf {4P+3O_{2}\rightarrow 2P_{2}O_{3}}}} (при медленном окислении или при недостатке кислорода)
Взаимодействует со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства:
с металлами — окислитель, образует фосфиды:
- 2P+3Ca→Ca3P2{\displaystyle {\mathsf {2P+3Ca\rightarrow Ca_{3}P_{2}}}}
фосфиды разлагаются водой и кислотами с образованием фосфина
с неметаллами — восстановитель:
- 2P+3S→P2S3{\displaystyle {\mathsf {2P+3S\rightarrow P_{2}S_{3}}}}
- 2P+5Cl2→2PCl5{\displaystyle {\mathsf {2P+5Cl_{2}\rightarrow 2PCl_{5}}}}
С водородом фосфор практически не соединяется. Однако разложением некоторых фосфидов водой по реакции, например:
- Ca3P2+6h3O→2Ph4+3Ca(OH)2{\displaystyle {\mathsf {Ca_{3}P_{2}+6H_{2}O\rightarrow 2PH_{3}+3Ca(OH)_{2}}}}
может быть получен аналогичный аммиаку фосфористый водород (фосфин) — РH3
Взаимодействие с водой
Взаимодействует с водяным паром при температуре выше 500 °С, протекает реакция диспропорционирования с образованием фосфина и фосфорной кислоты:
- 8P+12h3O→>500oC 5Ph4+3h4PO4{\displaystyle {\mathsf {8P+12H_{2}O{\xrightarrow {>500^{o}C}}\ 5PH_{3}+3H_{3}PO_{4}}}}
Реакция взаимодействия красного фосфора и воды с образованием ортофосфорной кислоты и водорода. Реакция протекает при температуре 700-900 °C. Катализатором могут выступать: платина, медь, титан, цирконий.[1]
- 2P+8h3O→700−900oC,kat 2h4PO4+5h3{\displaystyle {\mathsf {2P+8H_{2}O{\xrightarrow {700-900^{o}C,kat}}\ 2H_{3}PO_{4}+5H_{2}}}}
Взаимодействие со щелочами
В холодных концентрированных растворах щелочей также медленно протекает реакция диспропорционирования[13]:
- 4P+3KOH+3h3O→ τ Ph4+3Kh3PO2{\displaystyle {\mathsf {4P+3KOH+3H_{2}O{\xrightarrow {\ \tau \ }}PH_{3}+3KH_{2}PO_{2}}}}
Восстановительные свойства
Сильные окислители превращают фосфор в фосфорную кислоту:
- 3P+5HNO3+2h3O→3h4PO4+5NO{\displaystyle {\mathsf {3P+5HNO_{3}+2H_{2}O\rightarrow 3H_{3}PO_{4}+5NO}}}
- 2P+5h3SO4→2h4PO4+5SO2+2h3O{\displaystyle {\mathsf {2P+5H_{2}SO_{4}\rightarrow 2H_{3}PO_{4}+5SO_{2}+2H_{2}O}}}
Реакция окисления фосфора происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
- 6P+5KClO3→5KCl+3P2O5{\displaystyle {\mathsf {6P+5KClO_{3}\rightarrow 5KCl+3P_{2}O_{5}}}}
Изотопы
Известно более 20 изотопов фосфора (с массовым числом от 24 до 47). Природный изотоп 31P стабилен. Из радиоактивных изотопов наиболее долгоживущие: 30P (T1/2 = 2,5 мин), 32P (T1/2 = 14,26 сут) и 33P (T1/2 = 25,34 сут).[14].
Применение
Фосфор является важнейшим биогенным элементом и в то же время находит очень широкое применение в промышленности. Красный фосфор применяют в производстве спичек. Его вместе с тонко измельчённым стеклом и клеем наносят на боковую поверхность коробки. При трении спичечной головки, в состав которой входят хлорат калия и сера, происходит воспламенение.
Элементарный фосфор
Пожалуй, первое свойство фосфора, которое человек поставил себе на службу, — это горючесть. Горючесть фосфора очень велика и зависит от аллотропической модификации.
Наиболее активен химически, токсичен и горюч белый («жёлтый») фосфор, потому он очень часто применяется (в зажигательных бомбах и пр.).
Красный фосфор — основная модификация, производимая и потребляемая промышленностью. Он применяется в производстве спичек, взрывчатых веществ, зажигательных составов, различных типов топлива, а также противозадирных смазочных материалов, в качестве газопоглотителя в производстве ламп накаливания.
Соединения фосфора в сельском хозяйстве
Фосфор (в виде фосфатов) — один из трёх важнейших биогенных элементов, участвует в синтезе АТФ. Большая часть производимой фосфорной кислоты идёт на получение фосфорных удобрений — суперфосфата, преципитата, аммофоски и др.
Соединения фосфора в промышленности
Фосфаты широко используются:
Фосфатные связующие
Способность фосфатов формировать прочную трёхмерную полимерную сетку используется для изготовления фосфатных и алюмофосфатных связок.
Биологическая роль соединений фосфора
Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Са3(РО4)2·Ca(OH)2. В состав зубной эмали входит фторапатит. Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. При недостатке фосфора в организме развиваются различные заболевания костей.
Суточная потребность в фосфоре составляет:
- для взрослых 1,0—2,0 г
- для беременных и кормящих женщин 3—3,8 г
- для детей и подростков 1,5—2,5 г
При больших физических нагрузках потребность в фосфоре возрастает в 1,5—2 раза.
Усвоение происходит эффективнее при приеме фосфора вместе с кальцием в соотношении 3:2 (P:Ca).
Некоторые источники[15]:
Токсикология элементарного фосфора
- Красный фосфор практически нетоксичен (токсичность ему придают примеси белого фосфора). Пыль красного фосфора, попадая в легкие, вызывает пневмонию при хроническом действии.
- Белый фосфор очень ядовит, растворим в липидах. Смертельная доза белого фосфора — 50—150 мг. Попадая на кожу, тлеющий белый фосфор даёт тяжелые ожоги.
Острые отравления фосфором проявляются жжением во рту и желудке, головной болью, слабостью, рвотой. Через 2—3 суток развивается желтуха. Для хронических форм характерны нарушение кальциевого обмена, поражение сердечно-сосудистой и нервной систем. Первая помощь при остром отравлении — промывание желудка, слабительное, очистительные клизмы, внутривенно растворы глюкозы. При ожогах кожи обработать пораженные участки растворами медного купороса или соды. ПДК паров фосфора в воздухе производственных помещений — 0,03 мг/м³, временно допустимая концентрация в атмосферном воздухе — 0,0005 мг/м³, ПДК в питьевой воде — 0,0001 мг/дм³[17] .
Токсикология соединений фосфора
Некоторые соединения фосфора (фосфин) очень токсичны. Ввиду высокой (ЛД50 15-100 мг/кг) и чрезвычайно высокой (<15 мг/кг) токсичности большинство фосфорорганических соединений (ФОС) используются в качестве пестицидов (инсектициды, акарициды, зооциды и т. д.) или боевых отравляющих веществ. Примером боевых отравляющих веществ являются — зарин, зоман, табун, V-газы.
ФОС проявляют свойства веществ нервно-паралитического действия. Токсичность фосфорорганических соединений обусловлена ингибированием фермента ацетилхолинэстеразы, вследствие чего развивается головная боль, тошнота, головокружение, сужение зрачков (миоз), затруднение дыхания (отдышка), возникает слюнотечение, понижается артериальное давление, возникают конвульсии, проявляется паралитическое воздействие, кома, и как следствие может быстро возникнуть летальный исход. Эффективным антидотом при отравлении ФОС является атропин.
Опасность для здоровья
Рейтинг NFPA 704:
Фосфор относится к 1-му классу опасности.
Примечания
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047-1078. — DOI:10.1351/PAC-REP-13-03-02.
- ↑ Phosphorus: electronegativities (англ.). WebElements. Проверено 15 июля 2010.
- ↑ Sulfur and Phosphorus Compounds (англ.). Проверено 27 января 2010. Архивировано 22 августа 2011 года.
- ↑ 1 2 3 Редкол.:Зефиров Н. С. (гл. ред.). Химическая энциклопедия: в 5 т. — Москва: Большая Российская энциклопедия, 1999. — Т. 5. — С. 145.
- ↑ J.P. Riley and Skirrow G. Chemical Oceanography V. 1, 1965
- ↑ 1 2 3 Ходаков Ю. В., Эпштейн Д. А., Глориозов П. А. § 30. Фосфор // Неорганическая химия. Учебник для 9 класса. — 7-е изд. — М.: Просвещение, 1976. — С. 62—65. — 2 350 000 экз.
- ↑ Горение белого фосфора под водой — видеоопыт в Единой коллекции цифровых образовательных ресурсов
- ↑ Kemal T. Saracoglu, Ahmet H. Acar, Tamer Kuzucuoglu, Sezer Yakupoglu. White phosphorus burn (англ.) // The Lancet. — 2010. — Vol. 376, no. 9734. — P. 68. — DOI:10.1016/S0140-6736(10)60812-4.
- ↑ Chou TD, Lee TW, Chen SL, Tung YM, Dai NT, Chen SG, Lee CH, Chen TM, Wang HJ. The management of white phosphorus burns (англ.) // Burns. — 2001. — Vol. 27, iss. 5. — P. 492-497. — DOI:10.1016/S0305-4179(01)00003-1. — PMID 11451604.
- ↑ Радиационная химия // Энциклопедический словарь юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М.: Педагогика, 1990. — С. 200. — ISBN 5-7155-0292-6.
- ↑ В. Шретер, К.-Х. Лаутеншлегер, Х. Бибрак и др. Химия = Chemie. — М.: Химия, 1989. — С. 351. — ISBN 5-7245-0360-3.
- ↑ Химическая энциклопедия / Редкол.: Зефиров Н.С. и др.. — М.: Большая Российская энциклопедия, 1998. — Т. 5. — 783 с. — ISBN 5-85270-310-9.
- ↑ Лидин Р.А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- ↑ Данные приведены по Audi G., Bersillon O., Blachot J., Wapstra A. H. The NUBASE evaluation of nuclear and decay properties // Nuclear Physics A. — 2003. — Т. 729. — С. 3—128. — DOI:10.1016/j.nuclphysa.2003.11.001. — Bibcode: 2003NuPhA.729….3A.
- ↑ USDA
- ↑ Буланов Ю. Б. Химический состав продуктов. Пищевая ценность.
- ↑ УНИАН — здоровье — Что происходит с фосфором?
Ссылки
ru-wiki.org
Фосфор его физические и химические свойства Строение
 Фосфор, его физические и химические свойства
Фосфор, его физические и химические свойства
 Строение атома ФОСФОР Его положение в Периодической системе История открытия Фосфор в природе Фосфор в организме Круговорот в природе Белый фосфор Черный и красный фосфор Химические свойства Получение Применение
Строение атома ФОСФОР Его положение в Периодической системе История открытия Фосфор в природе Фосфор в организме Круговорот в природе Белый фосфор Черный и красный фосфор Химические свойства Получение Применение
 В 1669 Хеннинг Бранд при нагревании смеси белого песка и выпаренной мочи получил светящееся в темноте вещество, названное сначала «холодным огнём» . Вторичное название «фосфор» происходит от греческих слов: «фос» -свет, «феро» — несу. Phosphorus- Светоносный. Лавуазье определил фосфор, как новый химический элемент!
В 1669 Хеннинг Бранд при нагревании смеси белого песка и выпаренной мочи получил светящееся в темноте вещество, названное сначала «холодным огнём» . Вторичное название «фосфор» происходит от греческих слов: «фос» -свет, «феро» — несу. Phosphorus- Светоносный. Лавуазье определил фосфор, как новый химический элемент!
 Р заряд ядра= +15 31 P Электронная конфигурация: 1 s 2 2 р6 3 s 2 3 p 3 (стационарное) стационарное Р (возбужденное) 1 s 2 2 p 6 3 s 1 3 p 3 3 d 1 Р* Типичные степени окисления Примеры -3 0 +3 +5 PH 3 P 4 P 2 O 3 P 2 O 5
Р заряд ядра= +15 31 P Электронная конфигурация: 1 s 2 2 р6 3 s 2 3 p 3 (стационарное) стационарное Р (возбужденное) 1 s 2 2 p 6 3 s 1 3 p 3 3 d 1 Р* Типичные степени окисления Примеры -3 0 +3 +5 PH 3 P 4 P 2 O 3 P 2 O 5
 Устойчивая степень окисления в соединениях +V. Шкала степеней окисления фосфора:
Устойчивая степень окисления в соединениях +V. Шкала степеней окисления фосфора:
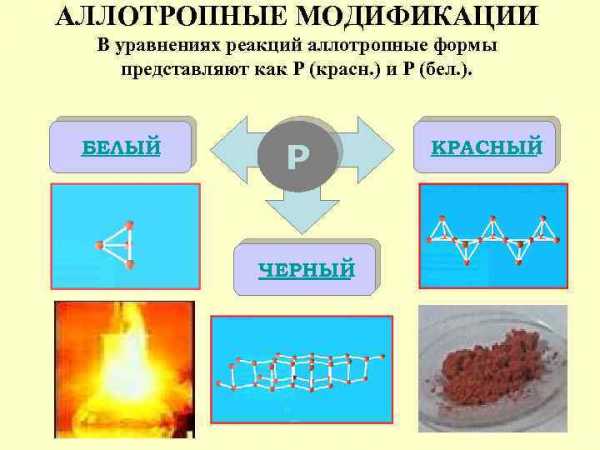 АЛЛОТРОПНЫЕ МОДИФИКАЦИИ В уравнениях реакций аллотропные формы представляют как Р (красн. ) и Р (бел. ). БЕЛЫЙ Р ЧЕРНЫЙ КРАСНЫЙ
АЛЛОТРОПНЫЕ МОДИФИКАЦИИ В уравнениях реакций аллотропные формы представляют как Р (красн. ) и Р (бел. ). БЕЛЫЙ Р ЧЕРНЫЙ КРАСНЫЙ
 БЕЛЫЙ ФОСФОРP 4 Молекулы P 4 имеют форму тетраэдра. Это легкоплавкое t(пл)=44, 1 о. С, t(кип)=275 о. С, мягкое, бесцветное воскообразное вещество. Хорошо растворяется в сероуглероде и ряде других органических растворителей. Ядовит, воспламеняется на воздухе, светится в темноте. Хранят его под слоем воды. Применяется в производстве Н 3 РO 4 и красного фосфора, как реагент в органических синтезах, раскислитель сплавов, зажигательное средство. Горящий фосфор следует гасить песком (но не водой!). Чрезвычайно ядовит.
БЕЛЫЙ ФОСФОРP 4 Молекулы P 4 имеют форму тетраэдра. Это легкоплавкое t(пл)=44, 1 о. С, t(кип)=275 о. С, мягкое, бесцветное воскообразное вещество. Хорошо растворяется в сероуглероде и ряде других органических растворителей. Ядовит, воспламеняется на воздухе, светится в темноте. Хранят его под слоем воды. Применяется в производстве Н 3 РO 4 и красного фосфора, как реагент в органических синтезах, раскислитель сплавов, зажигательное средство. Горящий фосфор следует гасить песком (но не водой!). Чрезвычайно ядовит.
 КРАСНЫЙ ФОСФОР Существует несколько форм красного фосфора Их структуры окончательно не установлены. Известно, что они являются атомными веществами с полимерной кристаллической решеткой. Их температура плавления 585 -600 о. С, цвет от темно-корчневого до красного и фиолетового. Не ядовит. Применяется как реагент (более безопасный, чем белый фосфор) в неорганическом синтезе, наполнитель ламп накаливания, компонент намазки коробка при изготовлении спичек.
КРАСНЫЙ ФОСФОР Существует несколько форм красного фосфора Их структуры окончательно не установлены. Известно, что они являются атомными веществами с полимерной кристаллической решеткой. Их температура плавления 585 -600 о. С, цвет от темно-корчневого до красного и фиолетового. Не ядовит. Применяется как реагент (более безопасный, чем белый фосфор) в неорганическом синтезе, наполнитель ламп накаливания, компонент намазки коробка при изготовлении спичек.
 ЧЕРНЫЙ ФОСФОР Черный фосфор имеет слоистую атомную кристаллическую решетку. По внешнему виду похож на графит, но является полупроводником. Не ядовит.
ЧЕРНЫЙ ФОСФОР Черный фосфор имеет слоистую атомную кристаллическую решетку. По внешнему виду похож на графит, но является полупроводником. Не ядовит.
 Фосфор в организме человека 1500 граммов Кости и зубы 1400 граммов (90%) Мозг и нервы 12 граммов Мышцы 130 граммов АТФ — аденозинтрифосфорная кислота (носитель энергии). Фосфор участвует в передаче наследственных свойств (ДНК и РНК).
Фосфор в организме человека 1500 граммов Кости и зубы 1400 граммов (90%) Мозг и нервы 12 граммов Мышцы 130 граммов АТФ — аденозинтрифосфорная кислота (носитель энергии). Фосфор участвует в передаче наследственных свойств (ДНК и РНК).
 назад Из апатитов и фосфоритов в электрической печи: Са 3(РО 4)2+5 С+3 Si. O 2 3 Ca. Si. O 3+2 P+5 CO P+5 +5 e P 2 C 0 -2 e C+2 5
назад Из апатитов и фосфоритов в электрической печи: Са 3(РО 4)2+5 С+3 Si. O 2 3 Ca. Si. O 3+2 P+5 CO P+5 +5 e P 2 C 0 -2 e C+2 5
 Р+5 Р 0 восстановитель Р-3 окислитель I. Фосфор – окислитель: При реакции с активными металлами: 3 Ca + 2 P = Ca 3 P 2 фосфид кальция Фосфиды разлагаются водой: Сa 3 P 2 + 6 H 2 O = 3 Ca(OH)2 + 2 PH 3↑ фосфин С водородом фосфор не взаимодействует. II. Фосфор – восстановитель: 1. При реакции с другими неметаллами: 4 P + 5 O 2 = 2 P 2 O 5 + Q – белый фосфор горит под водой Красный фосфор сгорает менее энергично 2 P + 5 Cl 2 = 2 PCl 5 + Q 2. В реакции со сложными веществами –окислителями: 3 P + 5 HNO 3(конц) + 2 H 2 O = 3 H 3 PO 4 + 5 NO 6 P + 5 KCl. O 3 = 3 P 2 O 5 + 5 KCl
Р+5 Р 0 восстановитель Р-3 окислитель I. Фосфор – окислитель: При реакции с активными металлами: 3 Ca + 2 P = Ca 3 P 2 фосфид кальция Фосфиды разлагаются водой: Сa 3 P 2 + 6 H 2 O = 3 Ca(OH)2 + 2 PH 3↑ фосфин С водородом фосфор не взаимодействует. II. Фосфор – восстановитель: 1. При реакции с другими неметаллами: 4 P + 5 O 2 = 2 P 2 O 5 + Q – белый фосфор горит под водой Красный фосфор сгорает менее энергично 2 P + 5 Cl 2 = 2 PCl 5 + Q 2. В реакции со сложными веществами –окислителями: 3 P + 5 HNO 3(конц) + 2 H 2 O = 3 H 3 PO 4 + 5 NO 6 P + 5 KCl. O 3 = 3 P 2 O 5 + 5 KCl
 При взаимодействии со щелочами образуется фосфин PH 3: 2 Р + 2 Na. OH + H 2 O = Na 2 HPO 3 + PH 3
При взаимодействии со щелочами образуется фосфин PH 3: 2 Р + 2 Na. OH + H 2 O = Na 2 HPO 3 + PH 3

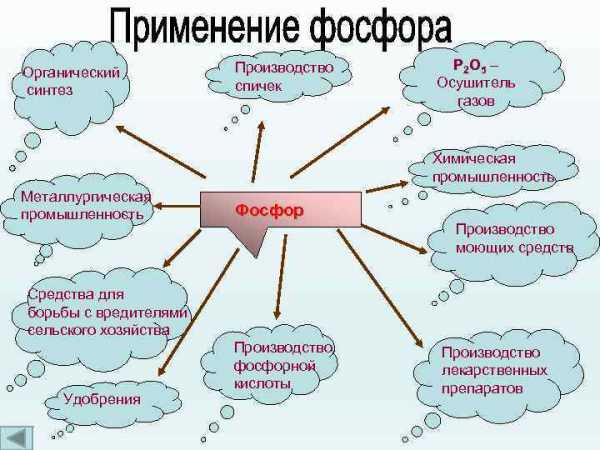 Органический синтез Производство спичек Р 2 О 5 – Осушитель газов Химическая промышленность Металлургическая промышленность Фосфор Производство моющих средств Средства для борьбы с вредителями сельского хозяйства Удобрения Производство фосфорной кислоты Производство лекарственных препаратов
Органический синтез Производство спичек Р 2 О 5 – Осушитель газов Химическая промышленность Металлургическая промышленность Фосфор Производство моющих средств Средства для борьбы с вредителями сельского хозяйства Удобрения Производство фосфорной кислоты Производство лекарственных препаратов
 Фосфин РН 3. • Бинарное соединение, степень окисления фосфора равна – III. Бесцветный газ с неприятным запахом. Молекула имеет строение незавершенного тетраэдра [: Р(Н)3] (sр3 -гибридизация). Мало растворим в воде, не реагирует с ней (в отличие от NH 3). Сильный восстановитель, сгорает на воздухе, окисляется в HNO 3 (конц. ). Присоединяет HI. Применяется для синтеза фосфорорганических соединений. Сильно ядовит.
Фосфин РН 3. • Бинарное соединение, степень окисления фосфора равна – III. Бесцветный газ с неприятным запахом. Молекула имеет строение незавершенного тетраэдра [: Р(Н)3] (sр3 -гибридизация). Мало растворим в воде, не реагирует с ней (в отличие от NH 3). Сильный восстановитель, сгорает на воздухе, окисляется в HNO 3 (конц. ). Присоединяет HI. Применяется для синтеза фосфорорганических соединений. Сильно ядовит.
 Уравнения важнейших реакций:
Уравнения важнейших реакций:
present5.com
