это… Циклоалканы: получение, формула, химические и физические свойства
Циклоалканы — это углеводороды, которые в своем составе имеют замкнутые структуры. Рассмотрим особенности данных соединений, их области применения.
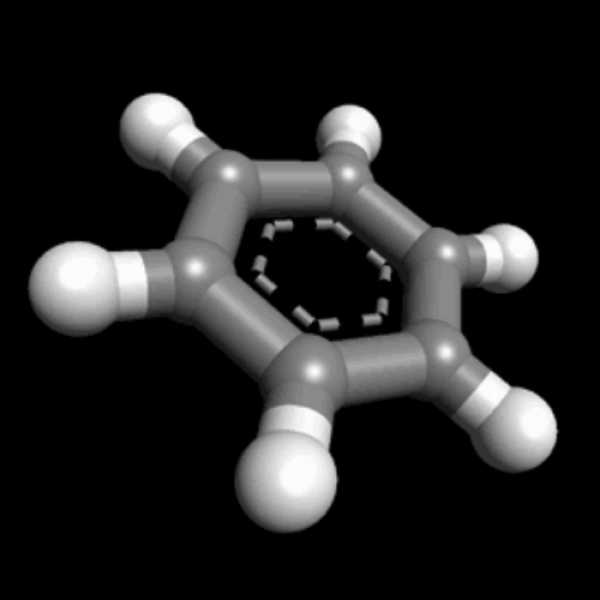
Особенности класса
Что собой представляют циклоалканы? Формула класса Cnh3n свидетельствует о недостатке атомов водорода. Подобная ситуация предполагает два развития сценария. Либо в структуре должна присутствовать двойная связь, либо в молекуле содержится замкнутая структура. Какое строение имеют циклоалканы? Формула их соответствует второму случаю, то есть наличию в молекуле замкнутой структуры. Именно специфика строения обуславливает особенности физических и химических свойств данного класса углеводородов.
Сколько различных циклоалканов соответствует составу С4Н8? Чтобы найти ответ на этот вопрос, необходимо проанализировать те виды изомерии, которые характерны для циклоалканов. Два изомера с таким качественным и количественным составом могут иметь циклическое строение: циклобутан, метилциклопропан. Подобный вариант называют изомерией боковой цепи.
Так как циклоалканы — это межклассовые изомеры непредельных олефинов, можно рассмотреть формулы веществ, в составе которых есть двойная связь. В таком виде могут существовать две структуры: бутен-1 и бутен-2. Отвечая на вопрос о том, сколько различных циклоалканов может существовать для предложенной формулы, необходимо рассмотреть не только циклоалканы, но и алкены. Только в этом случае можно будет представить правильный ответ.
Итак, циклоалканы — это углеводороды, которые имеют как минимум два вида изомерии.
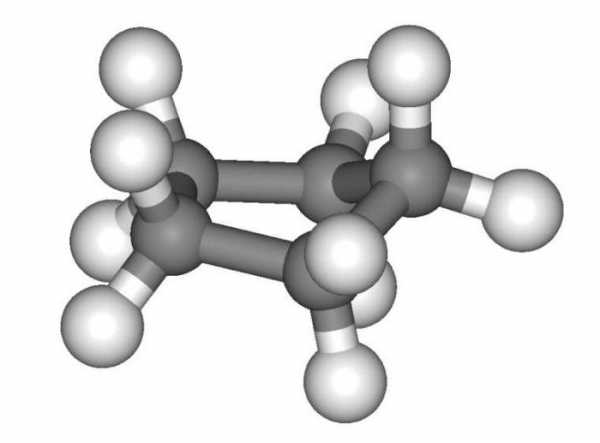
Особенности номенклатуры
Названия конкретных углеводородов циклического состава дают в полном соответствии с международной номенклатурой. Для основы используют количество углеродов в замкнутой цепи. Далее, учитывают атомы, имеющиеся в боковой цепи. Например, метилциклопропан. Циклоалканы — это соединения, в которых атомы углерода находятся в sp3 гибридном состоянии, аналогично предельным углеводородам. Подобная особенность определяет основные способы получения и характерные свойства данного класса.
Варианты получения циклоалканов
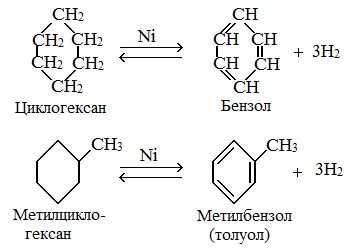
Как можно получить циклоалканы? Примеры основных реакций свидетельствуют о том, что есть несколько вариантов их образования. Например, циклогексан образуется путем гидрирования ароматического бензола. Соединения с тремя, четырьмя атомами углерода в цикле можно получить путем отщепления галогенов из молекул дигалогенпроизводных алканов. Также циклоалканы получают при пиролизе солей дикарбоновых органических кислот. Нагревание без присутствия воздуха приводит к образованию циклопентана и циклогексана.

Химические свойства
По химическим свойствам нафтены схожи с предельными углеводородами. Для них свойственны реакции с галогенами по типу замещения. Кроме того, представители нафтенов вступают в химическое взаимодействие с азотной кислотой. Циклоалканы устойчивы к концентрированной серной кислоте. С хлорсерной кислотой и олеумом реакция также возможна: в итоге образуется оксид серы (4).
Нафтены, имеющие в молекулах по 5 и 6 атомов углерода, считаются химически стойкими соединениями. Но при воздействии на них бромидом или хлоридом алюминия, происходит их изомеризация, сопровождающаяся сужением либо расширением исходного цикла.
Изомеризация
Например, в процессе изомеризации, циклогексан образует метилциклопентан. В нефти были обнаружены разнообразные производные циклопентана и циклогексана, остальные представители нафтенов в ней практически отсутствуют.
Отличительными особенностями средних циклов считают способность образовывать такие конформации, в которых некоторые углеродные атомы направлены не наружу, а внутрь цикла. Подобные связи именуют интранулярными, а те, что находятся внутри кольца, именуют экстранулярными связями.
Например, для циклодекана в максимально выгодной конформации предполагается шесть интранулярных и четырнадцать экстранулярных водородных атомов. Это подразумевает неравноценность группировок СН2, что отражается на повышении энергии связи, способствует улучшению химических свойств данного соединения.
Для углеводородов, обладающих от 12 и более углеродными атомами, характерна конформационная подвижность. Так как по связи С-С возможно свободное вращение, для подобных соединений не предполагается существования транс- и цис-форм.
Цикланы (нафтены) могут содержаться с природной нефти в пределах от 25 до 75 процентов. Количественное содержание их зависит от утяжеления фракции. В масляных фракциях, которые имеют высокие температуры кипения, происходит повышение количества ароматических структур. Особенно много нафтенов выявлено в эмбенских и бакинских нефтях.
В количественном соотношении показатели составляют до 80 процентов. Выявлена зависимость между типами нефти и распределением циклоалканов по фракциям. Менее термодинамически стойкими считают моноциклические углеводороды, которые обладают длинной боковой алкильной цепочкой. Распределение Cnh3n по типам структур напрямую связано с температурами, используемыми при перегонке нефти.
Например, моноциклические нафтены не обнаруживаются при диапазоне температур 300-350 градусов по Цельсию, а бициклические соединения пропадают при превышении показателя температур в 400 градусов по Цельсию.
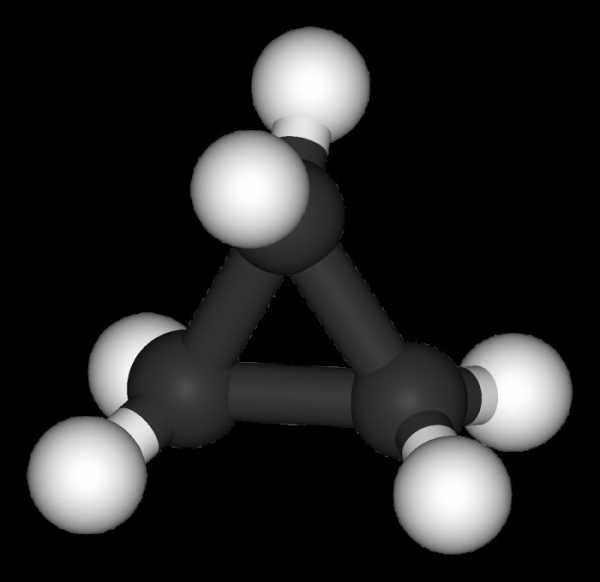
Характеристика циклопропана
С3Н6 является простейшим представителем нафтенов. Это газообразное вещество, имеющее незначительную растворимость в воде. Среди основных химических свойств, характерных для данного органического соединения, выделим каталитическое гидрирование. Продуктом такого взаимодействия будет предельный углеводород пропан. Кроме того, циклопропан, аналогично иным углеводородам, взаимодействует с кислородом воздуха, образуя углекислый газ, пары воды, достаточное количество энергии.
Особенности представителей данного класса
Если сравнивать температуры кипения представителей класса циклоалканов с показателями для алканов, имеющих аналогичное число углеродных атомов, то они будут немного выше. Причина заключается в циклическом строении данного класса. Плотность нафтенов больше показателя для алканов, но немного уступает аренам.
Чтобы понять, сколько различных циклоалканов соответствуют одной формуле, необходимо составить варианты изомеров не только циклического вида, но и с прямым скелетом, в составе которго есть двойная связь. При присутствии в молекуле заместителей в виде углеводородных радикалов, происходит снижение температуры плавления циклоалкана.
Если проанализировать физические и химические свойства данного класса углеводородов, можно выполнить условное подразделение веществ на соединения с малыми циклами (три-четыре), стандартными (пять, шесть, семь), средними (от восьми до двенадцати), а также с большими циклами (от двенадцати углеродов).
Сферы использования
Поговорим о том, каково основное применение циклоалканов. Нафтены применяют в медицине. Например, циклопропан является наркотическим препаратом. Циклопентан считается хорошим растворителем, он востребован в органическом синтезе. Циклогексан необходим в химической реакции синтеза нейлона, капрона (получении полиамидных волокон), кроме того, он востребован для получения бензена. Насыщенные алканы и циклоалканы обладают незначительной реакционной способностью. Объяснить данный факт можно незначительной полярностью связи С-С. Помимо этого, существенное количество циклоалканов применяется в химической промышленности.
Заключение
Смеси нафтенов и отдельные углеводороды применяют для изготовления смазочных средств. Представители данного класса углеводородов способны улучшать эксплуатационные характеристики дизельного топлива. Например, добавка циклоалканов существенно повышает октановое число, повышает вязкость, увеличивает теплоту сгорания двигателя. Именно поэтому циклоалканы не выделяют из продуктов нефтепереработки, а оставляют в составе бензиновой фракции.
Концентраты нафтенов применяют в виде органических растворителей. Циклоалканы со средними значениями молекулярных масс востребованы в производстве синтетических моющих средств. Достаточное количество нафтенов идет и в качестве топлива, так как при их сгорании выделяется немалое количество тепла.
fb.ru
Циклоалканы
В отличии от остальных предельных углеводородов, в молекулах которых все углеродные атомы образуют открытые цепи, имеются углеводороды с замкнутыми цепями (циклами). Так, например, при действии на 1,5-дихлорпентан активным металлом цепь углеродных атомов замыкается и образуется циклический углеводород циклопентан:
Известны циклопарафины, молекулы которых состоят из трех, четырех и шести атомов углерода:
У циклопарафинов возможна изомерия. Например, молекулярной формуле C6H12 соответствует насколько веществ-изомеров; изомерия этих соединений связана с наличием боковых углеводородных цепей.
Общая формула циклопарафинов CnH2n.
Нахождение в природе
Циклопарафины главным образом находятся в составе некоторых нефтей. Отсюда и другое название циклопарафинов — нафтены. Пяти- и шестичленные циклопарафины были впервые выделены из нефти и изучены профессором Московского университета В. В. Морковниковым.
Получение
Как уже было сказано, в лаборатории циклопарафины получают из дигалогенопроизводных предельных углеводородов, действуя на них активными металлами. Циклопарафины можно выделить из нефти.
Физические свойства
Циклопропан и циклобутан при нормальных условиях — газы, а циклопентан и циклогексан — жидкости. Циклопарафины в воде практически не растворяются.
Химические свойства
У циклопарафинов, как и у предельных углеводородов, все связи насыщены, однако, в отличие от последних, они способны к реакциям присоединения. Это объясняется тем, что связи между атомами углерода в цикле могут разорваться. В результате образуются свободные связи, способные присоединять атомы водорода и других элементов. Соединения с малыми циклами легче вступают в реакции присоединения, что их аналоги с большими циклами. Так, например, реакция гидрирования (присоединение водорода) происходит при различной температуре у разных циклопарафинов. Для соединений с большими циклами характерны реакции замещения. В этом отношении они сходны с парафинами. Циклопарафины подвергаются и реакциям дегидрирования(отщепления водорода).
Применение
Из циклопарафинов практическое значение имеют циклогексан, митилциклогексан и некоторые другие. В процессе ароматизации нефти эти соединения превращаются в ароматические углеводороды — в бензол, толуол и другие вещества, которые широко используют для синтеза красителей, медикаментов и т.д. Циклопропан применяют для наркоза.
Другие заметки по химии
edu.glavsprav.ru
Физические свойства циклоалканов
В обычных условиях циклопропан и циклобутан — газы; циклоалканы, содержащие от 5 до 11 атомов углерода в цикле, — жидкости; последующие представители — твердые вещества.
Температуры кипения и плавления циклоалканов выше по сравнению с константами соответствующих алканов. Практически не растворимы вводе.
Строение циклоалканов
Циклоалканы представляют собой в определенной степени жесткие структуры.
Для циклоалканов характерны следующие виды напряжений:
1 ) торсионное (Пи гцеровское) напряжение — связано со взаимодействием химических связей в заслоненной или частично заслоненной конформациях;
2) напряжение Ван-дер-Ваальса — обусловлено взаимным отталкиванием заместителей при сближении на расстояние, близкое сумме их вандерваальсовых радиусов;
3) угловое (Байеровское) напряжение — присуще отдельным циклоалканам и связано с отклонением валентных углов между углерод-углеродными связями в цикле от нормального (тетраэдрического) значения.
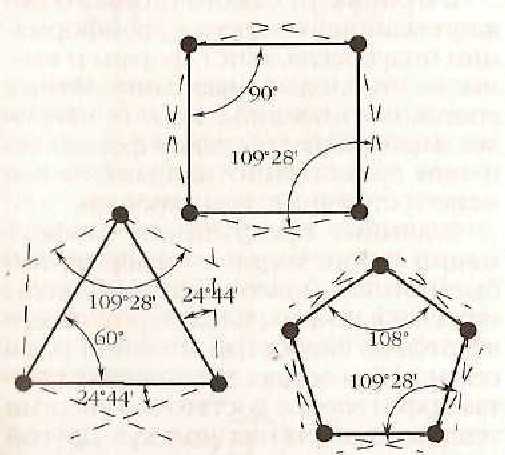
Теория напряжения циклов была предложена немецким химиком-органиком А. Байером в 1885 г. Согласно этой теории циклоалканы представляют собой плоские многоугольники. Единственным фактором, определяющим прочность цикла, считалось напряжение, вызванное отклонением внутренних валентных углов цикла по сравнению с тетраэдрическим углом.
Если рассматривать форму циклоалканов в виде простых геометрических фигур, имеющих плоское строение, то можно отметить, что при переходе от одного никла к другому происходит изменение валентного угла. Чем значительнее отклонение, тем выше угловое напряжение и менее устойчив цикл.
В соответствии с вышеприведенным, трехчленный цикл менее устойчив, чем четырехчленный, а последний — менее устойчив, чем пятичленный. Эти представления подтверждались накопленным к тому времени экспериментальным материалом. Однако для шестичленного цикла экспериментальные данные вступали в противоречия с теорией. Шестичленные циклы (внутренний угол 120′ ). имеющие значительное отклонение валентных углов, оказались устойчивее пятичленных, в которых внутренние углы наиболее близки к тетраэдрическим.
Причиной несоответствия теории Байера с экспериментальным материалом явилось ошибочное представление о плоском строении циклов. В действительности же циклоалканы (исключая циклопропан) не имеют плоского строения.
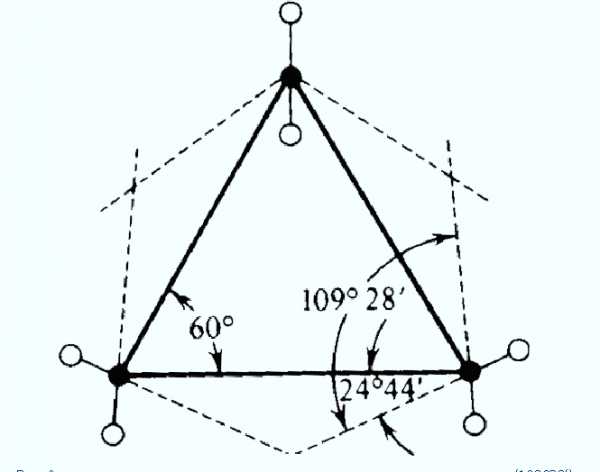
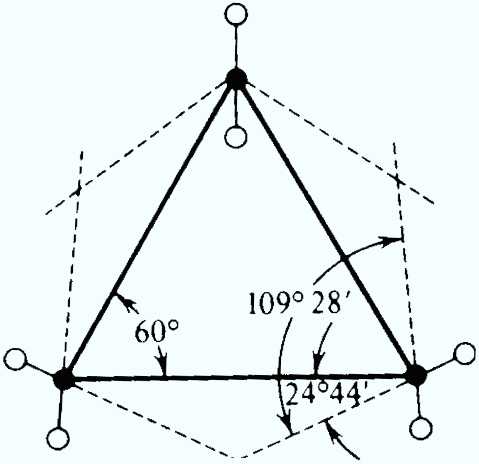
Пространственное строение циклоалканов определяется разной конформационной подвижностью углеродных атомов, зависящей от числа звеньев в цикле. Молекула любого циклоалкана стремится принять в пространстве такую форму (конформацию), в которой сумма углового, торсионного и вандерваальсового напряжений была бы минимальной. Наиболее жесткую структуру имеет циклопропан. В соответствии с правилами геометрии три точки всегда лежат в одной плоскости. Именно поэтому молекула циклопропана имеет плоское строение. Атомы водорода в данной молекуле находятся в заслоненной конформации, что и обуславливает сильное торсионное напряжение. Свободное вращение относительно углерод-углеродных связей невозможно. Внутренние валентные углы в молекуле циклопропана сильно отклонены от тетраэдрнческого значения, в результате чего и возникает большое угловое напряжение. Искажение валентных углов при гибридизации орбиталей углеродных атомов должно составлять а = ( 109°28′ — 60°):2 = 24*44′. В действительности в молекуле циклопропана валентный угол равен 106″. Согласно квантовохимическим представлениям изменение угла является результатом изменения гибридизации атомов углерода. Гибридизация орбиталей в молекуле циклопропана ближе к гибридизации алкенов, чем к гибридизации алканов (промежуточное положение).
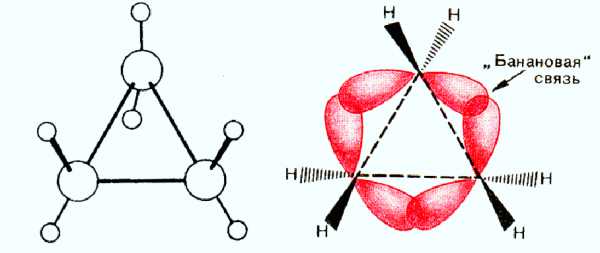
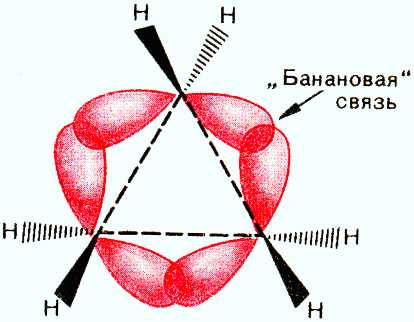
Вследствие взаимного отталкивания электронных облаков углерод-углеродных связей максимальная электронная плотность перекрывающихся орбиталей атомов углерода в молекуле циклопропана расположена не по прямой, соединяющей центры связываемых атомов, а за пределами треугольника молекулы.
Образующиеся связи называют «банановыми» или т-(греч. «тау») связями. Они занимают промежуточное положение между g и r-связями. Образование т-связей выгодно, так как валентные углы увеличиваются до 106е (вместо теоретически рассчитанных 60°) и снижается угловое напряжение молекулы.
Четырехчленный цикл, в отличие от трехчленного, все же обладает незначительной гибкостью. Валентные углы искажены меньше, чем в трехчленном цикле, несколько ниже и угловое напряжение. Один из углеродных атомов циклобутана выходит из плоскости трех атомов на угол 25-30′, что приводит к уменьшению торсионного напряжения цикла.
В пятичленном цикле практически отсутствует угловое напряжение (отклонение внутренних валентных углов от тетраэдрического составляет менее 1°). Однако в плоском пятичленном цикле связи С-H находятся в заслонен ной конформации, что обуславливает значительное торсионное напряжение. Каждый из пяти углеродных атомов циклопентана, стремясь уменьшить торсионное напряжение в цикле, поочередно выходит из плоскости, в которой расположены четыре оставшихся атома углерода. Кольцо находится в непрерывном волнообразном движении — псевдовращения. Эта неплоская осциллирующая структура называется конформацией «конверта». В конформации «конверта» угловое напряжение увеличивается, однако это в полной мере компенсируется снижением торсионного напряжения молекулы.
Если представить шестичленный НИ ICI плоским, то его внутренние валентные углы должны быть равными 120е. Это обусловило бы значительное угловое напряжение. Следует отметить, что в плоской структуре появляются взаимодействия, связанные с заслонением С-H-связей, то есть торсионное напряжение.
Однако же циклогексан не является плоской структурой и существует без углового напряжения, так как все валентные углы в нем тетраэдрические.
До недавнего времени считали, что наиболее устойчивыми структурами циклогексана являются две изомерные конформации, взаимопревращающиеся друг в друга за счет поворота вокруг с-связей без их разрыва: «кресла» С (от англ. chair— кресло) и «ванны» В (от англ. tor—лодка). Более устойчивой является конформация «кресла», так как лишена торсионного напряжения (все атомы углерода и водорода находятся в заторможенной конформации). В конформации «ванны» происходит заслонение связей, расположенных вдоль двух параллельных боковых сторон молекулы, что обуславливает торсионное напряжение.
В настоящее время с помощью физико-химических методов исследования установлено, что циклогексан может существовать в различных конформациях: «кресло», твист-форш (искаженная ванна), «полукресло», «ванна». Второй по устойчивости является твист-форма. Она образуется в результате «скручивания» конформации «ванны» в продольном направлении, что уменьшает напряжение в цикле.
В обычных условиях преобладающая часть молекул циклогексана (99,9 %) существует в конформации «кресла». В результате вращения вокруг углерод-углеродных связей одна конформация «кресла» переходит в другую, энергетически равноценную, форму кресла. Такой процесс называют инверсией цикла. Две конформации «кресла» могут взаимно превращаться как с промежуточным образованием конформации «ванны», конформации, так и без прохождения через конформацию «ванны».
Изучая пространственное строение циклогексана, было установлено, что шесть С-Н связей расположены вдоль оси симметрии молекулы, а другие шесть — под углом 109*28*. Связи, параллельные оси симметрии, называют аксиальными (обозначают символом «а»), а рас положенные радиально — называют экваториальными (обозначают символом «е»). Каждый атом углерода имеет одну аксиальную, а другую экваториальную связь С—Н. При инверсии никла (-100 ООО раз в секунду при 25 С) все экваториально связанные атомы водорода становятся аксиальными, а все аксиально-связанные — экваторнальными. Взаимопревращения в циклогексане протекают настолько быстро, что все атомы водорода циклогексана становятся эквивалентными.
worldofscience.ru
Химические свойства циклоалканов | Химия онлайн
Химические свойства циклоалканов сильно зависят от размера цикла, определяющего его устойчивость.
Трех- и четырехчленные циклы (малые циклы), являются насыщенными, но, несмотря на это резко отличаются от всех остальных предельных углеводородов. Валентные углы в циклопропане и циклобутане значительно меньше нормального тетраэдрического угла 109°28’, свойственного sp3-гибридизованному атому углерода.
Это приводит к большой напряженности таких циклов и их стремлению к раскрытию под действием реагентов. Поэтому циклопропан, циклобутан и их производные вступают в реакции присоединения, проявляя характер ненасыщенных соединений. Легкость реакций присоединения уменьшается с уменьшением напряженности цикла в ряду:
циклопропан > циклобутан >> циклопентан.
Наиболее устойчивыми являются 6-членные циклы, в которых отсутствуют угловое и другие виды напряжения.
В циклах (начиная с С5) угловое напряжение снимается благодаря неплоскому строению молекул. Поэтому для циклоалканов (С5 и выше) вследствие их устойчивости характерны реакции, в которых сохраняется циклическая структура, т.е. реакции замещения.
Реакции присоединения (малые циклы (n=3,4)) — сходство с алкенами
1. Гидрирование
Циклопропан, циклобутан довольно легко присоединяют водород, образуя соответствующие нормальные алканы.
2. Галогенирование
Малые циклы (С3 — С4) способны присоединять бром (хотя реакция и идет труднее, чем с пропеном или бутеном). С алкенами реакция идет при комнатной температуре, для циклоалканов необходимо нагревание.
3. Гидрогалогенирование
В реакцию присоединения с галогеноводородами опять де вступают только малые циклы при нагревании.
Присоединение к гомологам циклопропана происходит по правилу Марковникова.
Реакции замещения (обычные циклы (n=5-7)) – сходство с алканами
1. Галогенирование
Хлорирование циклогексана.
2. Нитрование
Нитрование циклогексана.
data-ad-layout=»in-article»
data-ad-format=»fluid»
data-ad-client=»ca-pub-1238801750949198″
data-ad-slot=»7124337789″>
Реакции отщепления (обычные циклы (n=5-7)) – сходство с алканами
1. Дегидрирование
Эти соединения, подобно алканам, вступают в реакции дегидрирования.
Дегидрирования циклогексана (реакция Зелинского-Казанского) и его алкильных производных.
Реакции окисления
1. Реакция горения
2. Окисление в присутствии катализатора.
При действии сильных окислителей (например, 50%-ной азотной кислоты) на циклогексан в присутствии катализатора образуется адипиновая (гександиовая) кислота.
Сравнение свойств
Столь резкое отличие в свойствах циклоалканов в зависимости от размеров цикла приводит к необходимости рассматривать не общий гомологический ряд циклоалканов, а отдельные их ряды по размерам цикла.
Например, в гомологический ряд циклопропана входят: циклопропан С3Н6, метилциклопропан С4Н8, этилциклопропан С5Н10 и т.д.
Циклоалканы
himija-online.ru
Строение, получение и свойства циклоалканов
Циклоалканы (циклопарафины) – органические насыщенные соединения, атомы углерода в молекулах которых, соединяясь образуют циклы. Общая формула – CnH2n . Строение, получение и свойства циклоалканов отличаются от свойств нормальных алканов с тем же числом углеродных атомов.
В молекулах циклоалканов углеродные атомы связаны между собой σ – связями. Устойчивость циклопарафинов, т.е. прочность С-С связей возрастает с увеличением количества атомов углерода, образующих цикл. Циклы делят на малые (С3, С4) и обычные (C5 – С7).
В качестве представителя малого цикла рассмотрим циклопропан:
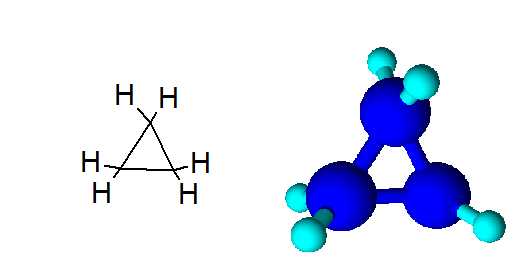
- Молекула циклопропана представляет собой плоский цикл, образованный тремя атомами углерода; атомы водорода при этом расположены вне его плоскости и занимают энергетически невыгодное («заслоненное») положение, что способствует увеличению «напряженности» цикла и его неустойчивости.
- Валентные углы в плоском равностороннем треугольнике принимают значение равное 60°. А для sp3-гибридизованного атома углерода это значение соответствует 109,5°. В случае молекулы циклопропана, sp3-гибридизованные орбитали атомов углерода перекрываются между собой вне прямой, соединяющей ядра атомов. Образующиеся σ-связи с подобным способом перекрывания называют «банановыми». Их свойства обладают сходными чертами с π-связями, например, вступают в реакции присоединения.
В отличие от трехчленных циклов, устойчивость пяти- и шестичленных циклических алканов на столько высока, что они не способны к разрыву.
В качестве представителя обычного цикла рассмотрим циклогексан.
Для молекулы циклогексана не характерно плоское строение, напротив — ей присуще несколько форм — конформаций. Наиболее выгодной с энергетической точки зрения являются конформации кресла (более устойчива) и ванны. Валентные углы образованные гибридными орбиталями атомов углерода в цикле равны 109,5°, атомы водорода у соседних атомов углерода расположены относительно друг друга в положении энергетически выгодном.
Тетраэдрическое расположение связей вокруг каждого атома углерода способствует большей устойчивости обычных циклов по сравнению с малыми. Для них возможны реакции замещения и невозможны реакции присоединения.
Физические свойства циклоалканов
При обычных условиях циклоалканы закипают и плавятся при более высоких температурах, по сравнению с соответствующими алканами. С увеличением размера цикла, температуры кипения и плавления растут. Циклоалканы С3 — С4 представляют собой газы, С5 — С16 — жидкости, C17 и более — твердые вещества. Растворимость циклических алканов в воде очень низка.
Получение циклоалканов
- Переработка нефти (получают циклогексан и его производные)
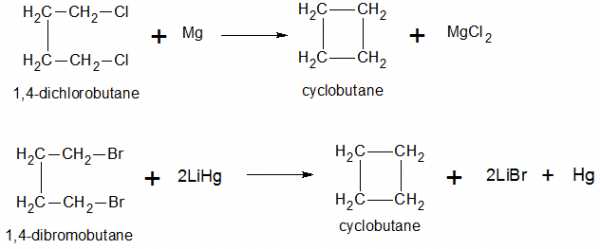
- Реакция отщепления.
При отщеплении от дигалогенпроизводных алканов двух атомов галогена получают трех- и четырехчленные циклоалканы:
- Реакция пиролиза солей дикарбоновых кислот.
Методом Ружичка получают циклогексан и циклопентан. Метод основан на воздействии высоких температур без доступа воздуха на соли дикарбоновых кислот.
- Реакция гидрирования ароматических углеводородов в присутствии катализатора каталитического.
При нагревании бензола или его гомологов и водорода в присутствии никелиевого катализатора получают циклогексан или его производные:
Химические свойства циклоалканов
Устойчивость, а, следовательно, и реакционная активность малых и обычных циклов сильно различаются.
Малые циклы, такие как циклопропан и циклобутан проявляют склонность к реакциям присоединения, тогда как для обычных циклов (циклопентан и циклогексан) более характерны реакции замещения.
1. Реакции присоединения
- Галогенирование:
- Гидрогалогенирование:
- Гидрирование:
- Расщепление серной кислотой:
- Взаимодействие с сильными карбоновыми кислотами:
2. Реакции замещения (радикальный механизм)
- Галогенирование при действии ультрафиолета:
3. Реакция дегидрирования
В присутствии катализатора ведет к образованию бензола:
4. Реакция окисления
Как малые, так и обычные циклы при окислении сильными окислителями (например, 50%-ной азотной кислоты, перманганат натрия, бихромат калия) раскрываются с образованием двухосновных карбоновых кислот:
5. Перегруппировка (сужение или расширение цикла)
Применение циклоалканов

zadachi-po-khimii.ru
Свойства циклоалканов | Дистанционные уроки
28-Ноя-2012 | Нет комментариев | Лолита Окольнова
Циклоалканы — интересные вещества. С одной стороны, они насыщенные, т.к. связь С-С — одинарная, с другой стороны, общая формула у них как у алкенов — Cnh3n. Помимо этого, внутри гомологического ряда есть вещества, имеющие немного разные химические свойства…
Общая формула циклоалканов:
СnH2n
n = числу атомов углерода.
Название углеводородов строятся из двух частей.
Первая часть «говорит» о том, что это циклические соединения — «цикло-«, вторая — название самого алкана по количеству атомов углерода, с традиционным для алканов окончанием -ан.
Изомерия циклоалканов
Структурная и межклассовая — циклоалканы изомерны алкенам
(есть еще пространственная, но в школьном курсе ее не затрагивают)
Химические свойства циклоалканов:
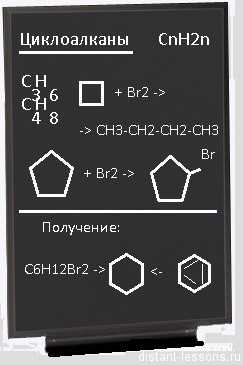
Вот тут-то мы и поговорим о «внутренних противоречиях»:
первые члены гомологического ряда — циклопропан (с меньшим количеством атомов углерода уже не может быть) и циклобутан имеют довольно маленькие углы между связями — у циклопропана — 60°, у циклобутана — 90°. (Для сравнения — у алканов — 109°28’, у алкенов — 120) Поэтому эти соединения неустойчивы в цикле — при первой же возможности они становятся производными алканов:
Гидрирование: C3H6 + h3 = C3H8 — реакция похожа на реакции алкенов
Галогенирование:
Гидрогалогенирование — аналогично.
Циклоалканы с большим количеством атомов углерода вступают в реакции замещения:
Это реакция замещения — характерная реакция алканов
Реакции окисления: цикл разрывается и по концам образуется группа -COOH:
C5h20 + [O] → HOOC-(Ch3)3-COOH
(циклопропан и циклобутан устойчивы к окислению)
Горение: все как обычно — все органические веществ сгорают с образованием CO2 и h3O:
Сnh3n + 3n\2 O2 = nCO2 + nh3O
В общем, если подвести итог, то картина такая:
- циклоалканы с небольшим числом атомов углерода: 3 и 4 вступают в реакции присоединения с раскрытием цикла;
- циклоалканы с большим числом атомов углерода вступают в реакции замещения
Получение циклоалканов:
- из линейных соединений — алканов:
Запомните правило — циклизация любых линейных соединений состоит из этапов:
1) активация цепи с двух концов: Сh3Cl — Ch3 — Ch3Cl
2) замыкание в цикл дегалогенированием: Сh3Cl — Ch3 — Ch3Cl + Zn = C3H6 + ZnCl2
- из ароматических соединений гидрированием: С6H6 +3h3 = С6h22
- в ЕГЭ это вопрос А13 и А14 — Строение и свойства углеводородов
- в ГИА (ОГЭ) это B2 — Первоначальные сведения об органических веществах: предельных и непредельных углеводородах
Категории: |
Обсуждение: «Свойства циклоалканов»
(Правила комментирования)distant-lessons.ru
Химические свойства циклоалканов
Важнейшей особенностью, отличающей алициклические соединения от алифатических соединений является наличие цикла.
Циклоалканы сильно отличаются между собой по устойчивости цикла: наименее устойчивы трехчленные и наиболее устойчивы пяти- и шестичленные циклы.
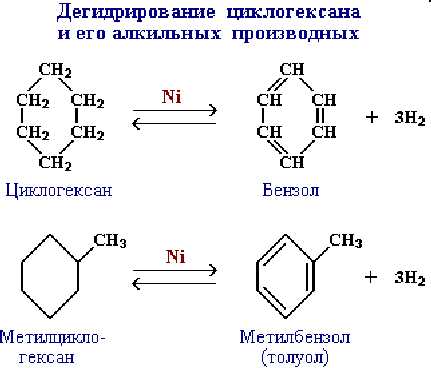
Реакции гидрирования и дегидрирования
При каталитическом гидрировании трех-, четырех- и пятичленные циклы разрываются с образованием алканов. Особенно легко идет эта реакция в случае циклопропана и его гомологов. Пятичленный цикл разрывается только при высоких температурах.
(циклопентан) + H2 ––300ºC,Pd CH3–CH2–CH2–CH2–CH3(пентан)
Соединения с шестичленными циклами при нагревании с катализаторами гидрирования дегидрируются и превращаются в ароматические углеводороды:
Реакции галогенирования
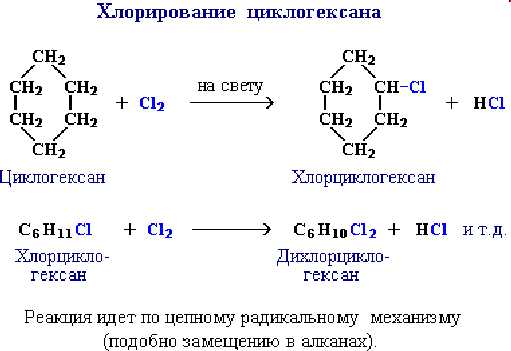
Реакции циклоалканов с галогенами происходят в различных направлениях в зависимости от величины цикла и природы галогена.
Галогенирование циклопропана
Реакция взаимодействия циклопропана с бромом сопровождаются разрывом циклов и присоединением атомов брома:
При взаимодействии циклопропана с хлором происходит реакция замещения:
Галогенирование циклобутана
Большая устойчивость циклобутана по сравнению с циклопропаном проявляется в том, что он присоединяет бром труднее – лишь при повышенных температурах:
+ Br2 → BrCH2—CH2—CH2—CH2Br
Хлор при взаимодействии с циклобутаном вступает в реакцию замещения:
CH2 – CH2 CH2 – CH-Cl CH2 — CH
| | + Cl2 → | | → | ||
CH2 – CH2 CH2 – CH2 — HCl CH2 — CH
Галогенирование циклопентана и циклогексана
При взаимодействии циклопентана и циклогексана с галогенами реакция не сопровождается разрывом цикла, а приводит к реакциям замещения:
Реакции гидрогалогенирования
Циклопропан и его гомологи реагируют с галогеноводородами с разрывом цикла:
При взаимодействии гомологов цикропропана с галогеноводородами реакция протекает по правилу Марковникова:
Циклобутан присоединяет HBrаналогично циклопропану, но только при нагревании.
Циклопентан, циклогексан и высшие цилкоалканы с галогеноводородами не реагируют.
Взаимодействие с кислотами
Взаимодействие с серной кислотой
Циклопропановый цикл раскрывается при взаимодействии с серной кислотой с образованием н-пропилсульфата:
CH2
∕ \ + H2SO4 → CH3 – CH2 – CH2 – OSO3H
H2C – CH2
н-пропилсульфат
Взаимодействие с трифторуксусной кислотой
Циклопропановый цикл раскрывается при взаимодействии с сильными карбоновыми кислотами. С гомологами циклопропана реакция протекает в соответствии и правилом Марковникова:
CH2
∕ \ + CF3—COOH → CH3 – CH2 – CH – OCOCF3
R — HC – CH2 |
R
Циклобутан взаимодействует с кислотами аналогично, но труднее, чем циклопропан.
Циклопентан, циклогексан и высшие циклоалканы кислотами не расщепляются.
Окисление циклоалканов
Циклоалканы довольно стойки к действию окислителей. Однако, при повышенных температурах, под действием сильных окислителей (KMnO4,K2Cr2O7) происходит разрыв цикла с образованием двухосновных кислот с тем же числом атомов углерода в молекуле:
Перегруппировки циклоалканов
Для циклоалканов и их производных характерны реакции сужения и расширения циклов. Эти реакции являются каталитическими и протекают в присутствии кислот Льюиса:
Перегруппировки, приводящие к сужению цикла
AlCl3
→ —CH3
Перегруппировки, приводящие к расширению цикла
ось симметрии II III I
Двенадцать связей C–H, которые имеются у циклогексана в конформации «кресла», делятся на два типа. Шесть связейнаправлены радиально от кольца к периферии молекулы и называются экваториальными связями (e- связи), остальные шесть связей направлены параллельно друг другу и оси симметрии и называются аксиальными (a- связи). Три аксиальные связи направлены в одну сторону от плоскости цикла, а три – в другую (имеется чередование: вверх-вниз).»
Аналогично можно рассчитать отклонения валентных углов и для других циклов:
|
Циклы |
Отклонения валентных углов |
Разница между теплотой сгорания на группу СН2 данного цикла и ненапряженного циклогексана (кДж/моль) | |
|
вычисленные по Байеру |
фактические | ||
|
Циклопропан (С3) |
+24044 |
+24044 |
38,50 |
|
Циклобутан (С4) |
+9044 |
+9044 |
27,40 |
|
Циклопентан (С5) |
+0044 |
+0044 |
5,40 |
|
Циклогексан (С6) |
— 5016 |
00 |
0 (как у гексана) |
|
Циклогептан (С7) |
— 9033 |
00 |
3,78 |
|
Циклооктан (С8) |
— 12046 |
00 |
5,46 |
|
Циклононан (С9) |
— 15016 |
00 |
5,50 |
|
Циклодекан (С10) |
— 17016 |
00 |
4,60 |
|
Циклы с С12 и более |
0 – 1,70 | ||
Согласно полученным расчетам по Байеру, напряжение циклов уменьшается от трехчленного (наиболее напряженного и менее устойчивого) к пятичленному, а затем вновь возрастает. Исходя из этого Байер сделал вывод, что наиболее устойчивым должен быть циклопентан, затем циклогексан, а остальные циклы должны быть значительно менее устойчивыми.
Однако теория Байера оказалась в противоречии со многими экспериментальными данными.
Было установлено, что шестичленный цикл прочнее пятичленного; не наблюдается увеличения напряжения и в циклах с большим числом атомов углерода.
Несостоятельность теории Байера заключалась в том, что он считал все циклы плоскими, а угловое напряжение рассматривал как единственный фактор, определяющий устойчивость циклов.
В настоящее время установлено, что:
все циклы, за исключением трехчленного, не имеют плоскостного строения;
в циклических соединениях существуют следующие типы напряжений, повышающие внутреннюю энергию циклов:
Напряжение угловое (ангулярное) или байеровское напряжение.
Этот тип напряжения обусловлен отклонением валентных углов от нормального валентного угла (109028 ).
Напряжение заслонения или торсионное напряжение.
Этот тип напряжения, связанный с конформационным состоянием молекул, обусловлен отклонением атомов или групп атомов от наиболее выгодной заторможенной конформации.
Напряжение Ван-дер-Ваальса.
Этот тип напряжения возникает в результате взаимного отталкивания атомов или групп атомов, находящихся у соседних атомов углерода, связанных σ-связью.
Напряжение трансаннулярное (напряжение Прелога).
Этот тип напряжения возникает в результате взаимодействия атомов или групп атомов, расположенных не у соседних, а у отдаленных друг от друга атомов углерода цикла. Например, в циклах, содержащих 8-12 атомов углерода.
Естественно, что все указанные типы напряжений приводят к увеличению внутренней энергии системы. Поэтому любое алициклическое соединение стремится принять такую пространственную конфигурацию, при которой число всех этих типов напряжений было бы наименьшим, т.е. чтобы внутренняя энергия системы была минимальной.
Экспериментальная количественная оценка степени напряженности (устойчивости) циклических систем была сделана на основе исследований теплот сгорания, являющихся мерой внутренней энергии соответствующих циклоалканов.
Результаты этих исследований показали, что теплота сгорания в расчете на одну группу СН2 является наименьшей для циклогексана и не отличается от таковой в углеводородах нормального строения. Это свидетельствует об отсутствии напряжения в шестичленном цикле.
Если напряжение в этом цикле принять за нуль, то наибольший избыток энергии в расчете на одну группу СН2 по сравнению с циклогексаном имеют циклопропан (38,5 кДж/моль) и циклобутан (27,4 кДж/моль), что свидетельствует о наличии в этих циклах больших напряжений.
Небольшое напряжение имеется в циклопентане (5,4 кДж/моль), циклогептане (3,7 кДж/моль) и в циклах , содержащих С8 – С11 (4,2-5,8 кДж/моль).
Макроциклы с числом атомов углерода С12 и более приближаются по своей устойчивости к циклогексану (0-1,7 кДж/моль).
studfiles.net
