Более высокая концентрация — вещество
Более высокая концентрация — вещество
Cтраница 1
Более высокие концентрации вещества резко тормозят процесс нитрификации, причем фаза I процесса при дозе 100 мг. [2]
Это приводит к понижению чувствительности определения при более высоких концентрациях вещества в зоне, а также к значительным колебаниям в количестве образующегося окрашенного производного. Следовательно, концентрация проявителя должна быть достаточной для того, чтобы наиболее полно произошло превращение соединения в окрашенное производное при высокой концентрации соединения в зоне. [4]
Ионы окисленной формы вещества диффундируют из слоев с более высокой концентрацией вещества в слой, прилегающий к поверхности ртутной капли. Диффундирующие ионы металла восстанавливаются. Скорость диффузии вещества на поверхность электрода пропорциональна разности концентраций вещества внутри раствора и у поверхности ртутной капли. Как только приложенное напряжение окажется величиной достаточно высокой, концентрация окисленной формы вещества у поверхности электродов станет практически величиной, равной нулю. Разность концентраций вблизи электрода и в глубине раствора является величиной постоянной и равной концентрации вещества в глубине раствора. Скорость диффузии поэтому будет постоянна. [6]
Это обусловлено явлением отдыха адсорбента, постепенным проникновением элюирующего растворителя в менее доступные поры, а также работой десорбционной линии при более высоких концентрациях вещества и меньших скоростях тока элюата. [8]
Возникающие кристаллические зародыши с чрезвычайно малыми размерами и, следовательно, большой удельной поверхностью могут быть равновесны или устойчивы только в растворе с более высокой концентрацией вещества, чем равновесное насыщение над крупными кристаллами. Поэтому новая кристаллическая фаза может возникать лишь при некотором пересыщении раствора, что легко доказать простыми рассуждениями. [9]
Водно-спиртовые и водно-гликолевые растворы ( смеси из спирта, пропиленгликоля, глицерина, воды), а также спиртовые и гликолевые растворы очень часто применяются для улучшения растворимости действующих веществ, и, соответственно, дают возможность применения более высокой концентрации вещества. Эти растворы оказывают подсушивающий эффект, в некоторых случаях смягчающее действие. Растворители и их смеси в данных составах могут также применяться для повышения стабильности некоторых веществ. [10]
Прк температуре Т, находящейся выше температуры плавления кристаллов А, но ниже температуры плавления кристаллов В, начиная от 100 % А и вплоть до состава х, система однофазна. При
При более высоких концентрациях веществ термофильный режим сбраживания осадка оказывается менее устойчивым по сравнению с мезофильным. [12]
Значения рабочих параметров для данного разделения приведены в табл. 10.13. Из этой таблицы видно, что колонку эффективно использовали при различных скоростях газового потока, причем верхнюю и нижнюю секции колонки использовали в одинаковой степени. Значения величины ВЭТТ для данного разделения приведены в табл. 10.14. Из этой таблицы видно, что величина ВЭТТ увеличивается с увеличением массовой скорости подачи в колонку разделяемой смеси. Это увеличение обусловлено, вероятно, более высокой концентрацией веществ в колонке. [13]
Отклонение электрохимических систем от идеального состояния происходит главным образом из-за неподчинения законам идеального состояния электролитов. Причиной этих отклонений является в первую очередь наличие сил межнонного и ион-дпполыюго взаимодействия. Очевидно, что в растворах, содержащих нейтральные молекулы, когда отсутствуют кулоновские силы взаимодействия, отклонения от идеальности будут наблюдаться при более высоких концентрациях вещества, чем в электролитах. В электролитах силы межионного взаимодействия возрастают в результате появления тальнодействующих электростатических взаимодействий, что обуслозапвает их существенное отличие от молекулярных растворов. Поэтому значения коэффициентов активности для растворов нейтральных молекул с увеличением концентрации изменяются значительно меньше, чем в растворах электролитов. Дальние взаимодействия в разбавленных растворах в основном сводятся к появлению сил притяжения между противоположно заряженными ионами и сил отталкивания между одноименно заряженными ионами. При возрастании концентрации силы притяжения приводят к образованию ионных пар пли ассоцпатов, в результате чего уменьшается число ионов в единице объема. В высококопцентри-рованных растворах, когда отношение числа ионов в единице объема к числу молекул растворителя превышает границу полной сольватации ( К. П. Мищенко и А. М. Сухотин), начинается конкуренция между ионами разных сортов за обладание молекулами растворителя, ибо за границей полной сольватации не хватает молекул растворителя для нормального заполнения координационных сфер ионов. Это приводит к еще большему отклонению состояния электролита от идеального. Наконец, при очень больших концентрациях следует учитывать и силы отталкивания. [14]
При количественном определении веществ в зонах хроматограмм для проявления последних обычно используют растворы реагентов относительно низкой концентрации. Это делают намеренно, чтобы понизить фон, который создается на бумаге вследствие окраски самого реагента и может постепенно развиваться во времени. При этом обнаружение зон разделяемых компонентов на хроматограмме облегчается за счет сохранения контраста между окраской зон и окраской фона. В итоге это приводит к понижению чувствительности определения при более высоких концентрациях вещества в зоне и, что гораздо важнее, к значительным колебаниям в количестве производного, образующегося в этих условиях. [15]
Страницы: 1
www.ngpedia.ru
4. Свойства разбавленных Растворов
Растворомназывают гомогенную систему, состоящую из нескольких компонентов, т.е. образованную из двух или более индивидуальных веществ. По определению Гиббса:раствор — это фаза переменного состава. Условно состав раствора подразделяют нарастворитель(компонент, присутствующий в системе в относительно большем количестве) ирастворенное вещество(другие компоненты). Раствор будетидеальным, если образование его не сопровождается уменьшением или увеличением его объема, а также выделением или поглощением тепла. Идеальные растворы подчиняются закону Рауля (см. ниже) при всех концентрациях и всех температурах.Реальныерастворы в связи с явлениями ассоциации, диссоциации, сольватации и др. не обладают упомянутыми выше свойствами. Но в состоянии сильного разбавления, а также, если они образованы сходными по химическому составу и физическим свойствам веществами, приближаются к идеальным, поэтому, к ним можно с некоторым приближением применять количественные закономерности, описывающие состояние идеальных растворов.
Здесь рассматриваются только растворы, в которых растворителем является жидкость (чаще всего вода), а растворенными веществами – газы, жидкости или твердые вещества. Состав раствора характеризуется количеством растворенного вещества (веществ) в единице количества раствора или растворителя.
Осмос–самопроизвольное движение молекул растворителя через полупроницаемую мембрану, разделяющую растворы разной концентрации, из раствора меньшей концентрации в раствор с более высокой концентрацией, что приводит к разбавлению последнего. В качестве полупроницаемой мембраны, через маленькие отверстия которой могут селективно проходить только небольшие по объему молекулы растворителя и задерживаются крупные или сольватированные молекулы или ионы, часто служит целлофановая пленка – для высокомолекулярных веществ, а для низкомолекулярных – пленка из ферроцианида меди. Процесс переноса растворителя (осмос) можно предотвратить, если на раствор с большей концентрацией оказать внешнее гидростатическое давление (в условиях равновесия это будет так называемое
=CRT, (4.1)
где С – молярная концентрация вещества, моль/кг;
R– универсальная газовая постоянная, Дж/моль · К.
Величина осмотического давления пропорциональна числу молекул (в общем случае числу частиц) одного или нескольких веществ, растворенных в данном объеме раствора, и не зависит от их природы и природы растворителя. В растворах сильных или слабых электролитов общее число индивидуальных частиц увеличивается вследствие диссоциации молекул, поэтому в уравнение для расчета осмотического давления необходимо вводить соответствующий коэффициент пропорциональности, называемый изотоническим коэффициентом.
=iCRT, (4.2)
где i – изотонический коэффициент, рассчитываемый как отношение суммы чисел ионов и непродиссоциировавших молекул электролита к начальному числу молекул этого вещества.
Так, если степень диссоциации электролита, т.е. отношение числа молекул, распавшихся на ионы, к общему числу молекул растворенного вещества, равна и молекула электролита распадается при этом наnионов, то изотонический коэффициент рассчитывается следующим образом:
i= 1 + (n– 1), (i> 1). (4.3)
Явление осмоса имеет большое значение для растительных и животных организмов, поскольку оболочки их клеток по отношению к растворам многих веществ обладают свойствами полупроницаемой мембраны. В чистой воде клетка сильно набухает, в ряде случаев вплоть до разрыва оболочки, а в растворах с высокой концентрацией солей, наоборот, уменьшается в размерах и сморщивается из-за большой потери воды. Поэтому при консервировании пищевых продуктов к ним добавляется большое количество соли или сахара. Клетки микроорганизмов в таких условиях теряют значительное количество воды и гибнут.
Осмотическое давление обеспечивает движение воды в растениях за счет различия осмотических давлений между клеточным соком корней растений (5-20 бар) и почвенным раствором, дополнительно разбавляемом при поливе. Осмотическое давление обусловливает в растении подъем воды от корней до вершины. Таким образом, клетки листьев, теряя воду, осмотически всасывают ее из клеток стебля, а последние берут ее из клеток корня.
Растворимость газов в жидкостяхизменяется в широких пределах и зависит не только от природы газа и растворителя, но и от давления и температуры. Количество растворенного газа пропорционально давлению его паров над раствором (закон Генри). Растворимость газов уменьшается при увеличении температуры и присутствии в растворе других веществ.
Равновесие между жидкостью и паром является динамическим – между ними происходит непрерывный обмен молекулами (частицами), причем количество этих молекул, проходящих через единицу поверхности раздела обеих фаз в условиях равновесия, одинаково (в обоих направлениях).
Согласно закону Рауля относительное понижение давления пара растворителя (А) над раствором зависит только от мольной доли растворенного в жидкости вещества (В), то есть определяется числом частиц вещества В в единице объема, но не зависит от свойств растворенного вещества:
, (4.4)
где NВ– мольная доля вещества В в растворе, определяемая по формуле
, (4.5)
где n– количество моль вещества;
 –давление
насыщенного пара над чистым растворителем;
–давление
насыщенного пара над чистым растворителем;
РА– давление пара растворителя над раствором (при той же температуре).
Закон Рауля выполняется для идеальных и сильно разбавленных растворов.
РА=
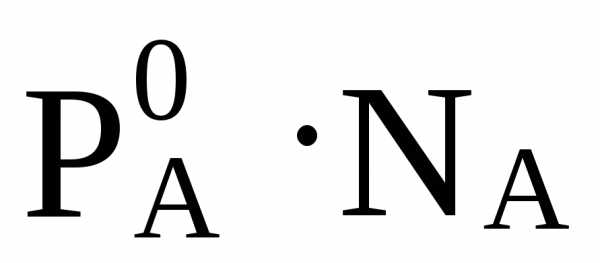 (при Т =const), (4.6)
(при Т =const), (4.6)
где NA– мольная доля вещества А в растворе, определяемая по формуле
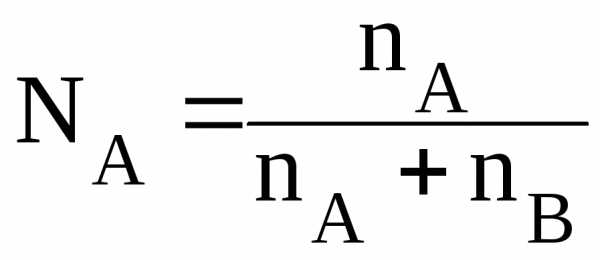 . (4.7)
. (4.7)
Приведенное уравнение (4.6) показывает, что давление пара растворителя над реальным раствором прямо пропорционально мольной доле растворителя в этом растворе.
При решении задач, связанных с испарением конденсированной фазы чистого вещества, можно использовать следующее уравнение:
(4.8)
где Р1и Р2– давление паров при абсолютных температурах Т1и Т2соответственно;
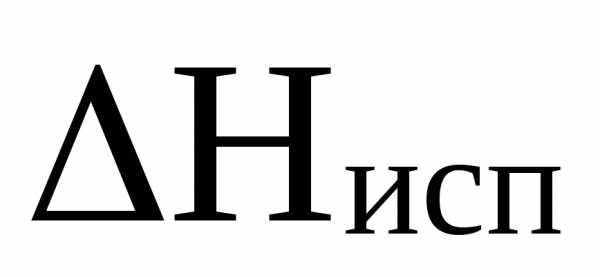 –мольная теплота
испарения (парообразования), считающаяся
постоянной в данном температурном
интервале;
–мольная теплота
испарения (парообразования), считающаяся
постоянной в данном температурном
интервале;
R– универсальная газовая постоянная.
Жидкость кипитпри той температуре, при которой давление насыщенного пара над ней достигает внешнего давления. С ростом в ней концентрации растворенного нелетучего вещества давление пара растворителя над раствором понижается и раствор кипит при более высокой температуре, чем чистый растворитель.Повышение (изменение) температуры кипенияот Т0для чистого растворителя до Т для разбавленных растворов рассчитывают с помощью следующего уравнения:
Ткип= Т – То= Кэ·Сm,в, (4.9)
где Ткип– повышение температуры кипения раствора, К;
Кэ– эбулиоскопический коэффициент, К · кг · моль– 1;
Сm, В– моляльная концентрация вещества В, моль/кг.
Из уравнения (4.9) видно, что Кэ=Ткип.при Сm, В= 1 моль/ кг. Повышение температуры кипения зависит от концентрации раствора, т.е. от числа частиц в единице объема, но не зависит от типа и свойств этих частиц.
Эбулиоскопический коэффициент зависит только от природы растворителя и определяется следующим образом:
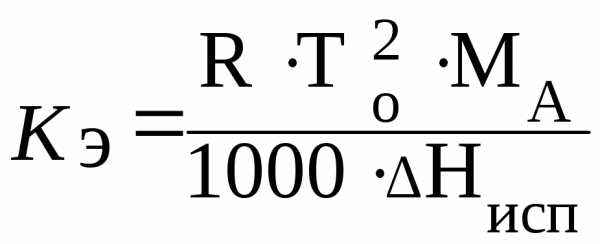 ,(4.10)
,(4.10)
где МА– молярная масса растворителя; г/моль;
Нисп– мольная теплота испарения чистого растворителя.
Поскольку 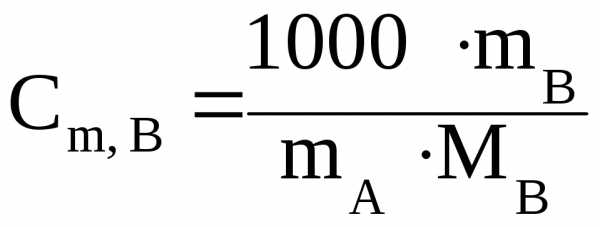 , (4.11)
, (4.11)
где mB– масса растворенного вещества В, г;
М В– молярная масса растворенного вещества В, г/моль;
mA– масса растворителя, г,
то уравнение (4.9) с учетом уравнения (4.11) можно записать:
. (4.12)
Полученное уравнение (4.12) можно использовать для определения неизвестной молярной массы растворенного вещества В по экспериментально найденному значению Ткип.
Для расчетов повышения температуры кипения растворов слабых или сильных электролитов необходимо использовать понятие об изотоническом коэффициенте i, приведенном в разделе об осмотическом давлении (см. уравнение 4.3). Тогда уравнение (4.9) принимает следующий вид:
Ткип= КЭ·i· Сm, В. (4.13)
Растворы замерзаютпри более низкой температуре, чем чистый растворитель, что является следствием понижения давления пара растворителя над раствором. Для разбавленных растворовпонижение температурызамерзанияот Т0для чистого растворителя до Т для раствора зависит от количественного состава раствора:
Тзам= Т0– Т = Кк· Сm, В, (4.14)
где Тзам– понижение температуры замерзания раствора, К;
Кк– криоскопический коэффициент, К · кг · моль– 1;
Сm, В– моляльная концентрация вещества В, моль/кг.
Из уравнения (4.14) следует, что Тзам= Ккпри Сm, В= 1 моль/кг и понижение температуры замерзания раствора определяется только числом частиц в единице его объема, но не зависит от природы этих частиц.
Значение Ккможно рассчитать по формуле:
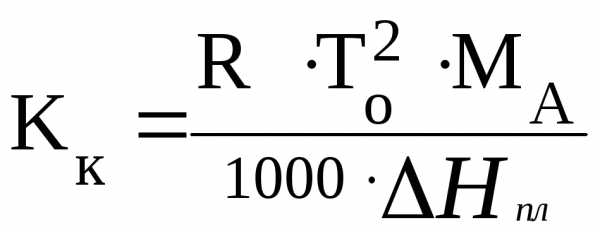 , (4.15)
, (4.15)
где МА– молярная масса растворителя А, г/моль;
Н пл– мольная теплота плавления чистого растворителя.
Если в массе растворителя mАнаходится масса растворенного вещества В, то
, (4.16)
где mB– масса растворенного вещества В, г;
М В– молярная масса растворенного вещества В, г/моль;
mA– масса растворителя, г.
Тогда уравнение (4.14) можно записать:
(4.17)
Уравнение (4.17) можно использовать при экспериментальном определении и расчете молярной массы неизвестного вещества по понижению температуры замерзания его раствора в известном растворителе.
Если растворенное вещество распадается в растворе на ионы, то увеличение числа частиц за счет диссоциации его молекул учитывается через введение изотонического коэффициента i(см. уравнение 4.3):
Т зам= Кк·i· Сm, В. (4.18)
Пример
Водный раствор спирта, содержащий 0,17 г спирта и 20 г воды, замерзает при температуре – 0,354 0С. Рассчитать молярную массу спирта, если криоскопический коэффициент для воды равен 1,86о С · кг · моль–1.
Решение
Для решения воспользуемся уравнением (1.60):
г/моль.
Ответ. М сп= 46 г/моль.
Первый закон Коновалова (применим как для идеальных, так и для отклоняющихся от закона Рауля растворов):насыщенный пар над равновесным ему раствором из двух жидкостей относительно богаче тем компонентом, добавление которого к системе повышает общее давление пара (или снижает температуру кипения).Поэтому при испарении раствора пар обогащен более летучим компонентом, а жидкость – менее летучим. На различиях в составах раствора и равновесного с ним пара основан метод разделения смесей (в основном органических жидкостей) путем ректификации. Повторяя операции испарения – конденсации, можно получить чистые компоненты. На практике это реализуется в ректификационных колонках.
Для растворов, значительно отклоняющихся от закона Рауля, на кривых зависимости давления пара над раствором от состава раствора часто имеется точка максимума или минимума. В экстремальных точках состав пара совпадает с составом жидкости(второй закон Коновалова). Такие смеси называютсяазеотропными,разделить их перегонкой (ректификацией) нельзя.
Для сильно различающихся по своей природе и по этой причине практически несмешивающихсяжидкостей давление пара каждого компонента над смесью равно давлению пара чистого компонента. Тогда полное давление пара равно сумме давлений насыщенного пара обоих компонентов в чистом состоянии (при этой же температуре):
Р = РА+ РВ. (4.19)
Однако температура кипения такой смеси ниже температур кипения каждой из индивидуальных жидкостей. Это свойство используется для перегонки с водяным паром путем барботирования его через не смешивающуюся с водой жидкость с последующей конденсацией выходящих паров. Перегонка с водяным паром позволяет отгонять высококипящие жидкости при температуре ниже 100 оС.
studfiles.net
Следствия из закона Рауля
Из закона Рауля вытекают два важных следствия:
1) Растворы кипят при более высокой температуре чем чистый растворитель;
2) Растворы замерзают при более низкой температуре чем чистый растворитель.
Рассмотрим их более подробно.
Кипение является физическим процессом перехода жидкости в газообразное состояние или пар, при котором пузырьки газа образуются по всему объему жидкости.
Жидкость закипает, когда давление ее насыщенного пара становится равным внешнему давлению. Если внешнее давление (например, атмосферное) не изменяется, а сама жидкость является индивидуальным и химически чистым веществом, то кипение ее в открытом подогреваемом сосуде происходит при постоянной температуре до тех пор, пока полностью не исчезнет жидкая фаза.
Так при атмосферном давлении равном 101,325 кПа температура кипения очищенной (дистиллированной) воды равна 100оС или 373,16K.
Если же в Н2О растворить какое-нибудь нелетучее вещество, то давление ее насыщенного пара понизится. Чтобы получившийся раствор закипел, необходимо нагреть его до температуры выше, чем 373,16K, т.к., только при таких условиях давление насыщенного пара растворителя снова станет равным атмосферному.
Замерзание или кристаллизация представляет собой физическое явление, сопровождающееся превращением жидкости в твердое вещество. Причем кристаллические структуры образуются во всем объеме жидкости.
Процесс замерзания начинается, если давление насыщенного пара над жидкостью становится равным давлению насыщенного пара над ее твердыми кристалликами.
Если внешнее (атмосферное) давление остается постоянным, а жидкость не содержит посторонних примесей, то в процессе кристаллизации температура охлаждаемой жидкости будет оставаться постоянной до тех пор, пока жидкая фаза полностью не превратится в твердую.
При атмосферном давлении равном 101,325 кПа дистиллированная вода замерзает при 0оС (273,16K). Давление насыщенного пара воды надо льдом и жидкостью в этом случае равно 613,3 Па.
Для водного раствора давление насыщенного пара растворителя при 0оС будет меньше чем 613,3 Па, а надо льдом остается неизменным. Опущенный в такой раствор лед будет быстро таять, вследствие конденсации над ним избыточного количества пара.
Лишь при понижении температуры снова можно уравнять давление насыщенного пара над жидкой и твердой фазой и вызвать процесс кристаллизации.
Опытным путем было установлено, что повышение температуры кипения (tкип.) и понижение температуры замерзания раствора (tзам.) по сравнению с чистым растворителем прямо пропорционально моляльной концентрации растворенного вещества. Математически это можно записать следующим образом:
tкип. р-ра –tкип. р-теля =tкип.=Em
tзам. р-теля–tзам. р-ра =tзам.=Km
где m – моляльная концентрация растворенного вещества; E и K – соответственно, эбуллиоскопическая (лат. ebbulio – выкипаю) и криоскопическая (греч. «криос» — холод) константы, значения которых зависят только от природы растворителя (табл. 7).
Таблица 7.ЭбуллиоскопическиеEи криоскопическиеKконстанты некоторых растворителей (град/моль)
|
Растворитель |
Е |
K |
|
1. Вода |
0,516 |
1,86 |
|
2. Этиловый спирт |
1,23 |
— |
|
3. Бензол |
2,57 |
5,12 |
|
4. Уксусная кислота |
3,1 |
3,9 |
|
5. Анилин |
3,69 |
5,87 |
Эбуллиоскопическая и криоскопическая константы растворителя показывают на сколько градусов повышается температура кипения и понижается температура замерзания раствора, полученного при растворении в одном килограмме растворителя одного моля неэлектролита (m = 1 моль/кг).
Для определения значений EиKсперва опытным путем определяютDtкип. иDtзам.сильно разбавленных растворов (m<< 1), а затем полученные данные пересчитывают или экстраполируют для растворов сm= 1 моль/кг.
Значения EиKможно рассчитать и теоретически с помощью соотношения Вант-Гоффа:
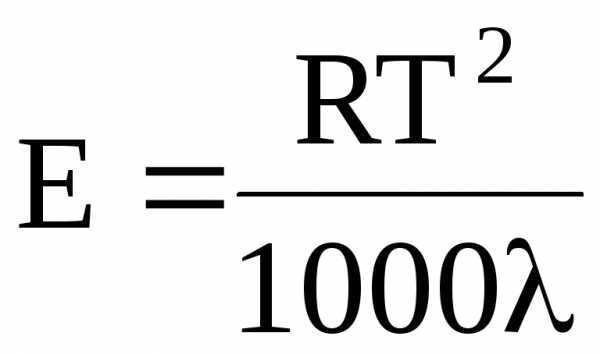
где R – универсальная газовая постоянная; T – температура кипения растворителя; — удельная теплота испарения растворителя.
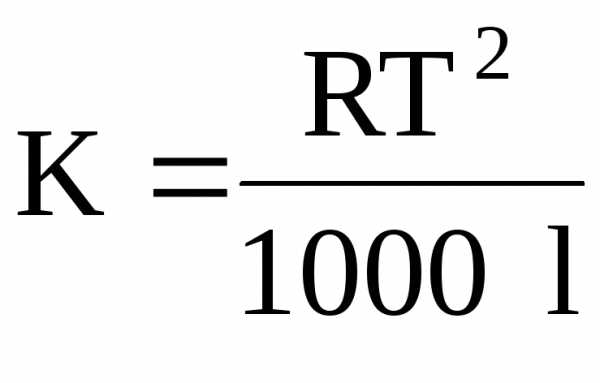
где T – температура плавления растворителя; l – удельная теплота плавления растворителя.
Таким образом, растворы разных по своей природе веществ, но с одинаковой моляльной концентрацией будут кипеть и замерзать при одной и той же температуре.
Следует обратить внимание на важное отличие раствора от чистого растворителя. Если последний кипит и замерзает при постоянной температуре, то растворы делают это в интервале температур, т.е. в процессе их выкипания температура все время повышается, а при замерзании – уменьшается. Это связано с тем, что удаление из жидкой фазы растворителя в виде пара или твердых кристаллов приводит к увеличению моляльной концентрации раствора, т.к. растворенное вещество в процессе кипения и замерзания в неизменном количестве остается в жидкой фазе (вплоть до ее полного выкипания или замерзания), а масса жидкого растворителя уменьшается.
При практических измерениях температуры замерзания или кипения раствора фиксируют момент появления в нем первых твердых кристаллов (для tзам.) или пузырьков газа (для tкип.).
Свойство растворов понижать температуру замерзания позволяет использовать их в роли хладоносителей.
Так, растворы некоторых органических и неорганических веществ используют в качестве антифризов для охлаждения двигателей внутреннего сгорания при работе их в самых разных климатических условиях.
Понижение температуры замерзания растворов имеет большое значение для живых организмов. Так, жидкость в их клетках представляет собой раствор различных неорганических и органических веществ. Его температура замерзания лежит ниже 0оС (273,16 K), поэтому клетки не погибают в условиях переохлаждения.
Благодаря данному явлению растения сохраняются в зимний период. Причем, чем выше концентрация веществ в клеточной жидкости, тем более низкие внешние температуры может переносить растение.
При этом для понижения температуры замерзания раствора в охлаждаемых клетках усиливается процесс гидролиза более высокомолекулярных соединений до низкомолекулярных (например, углеводов – до глюкозы).
studfiles.net
Способы выражения состава растворов
Состав любого раствора может быть выражен как качественно, так и количественно. Обычно при качественной оценке раствора применяют такие понятия, как насыщенный,ненасыщенный,пересыщенный(илиперенасыщенный),концентрированныйиразбавленныйраствор.
Насыщенным называется раствор, в котором содержится максимально возможное при данных условиях (t, р) количество растворённого вещества. Насыщенный раствор часто находится в состоянии динамического равновесия с избытком растворённого вещества, при котором процесс растворения и процесс кристаллизации (выпадения вещества из раствора) протекают с одинаковой скоростью.
Для приготовления насыщенного раствора растворение вещества необходимо вести до образования осадка, не исчезающего при длительном хранении.
Ненасыщеннымназывается раствор, который содержит вещества меньше, чем его может раствориться при данных условиях.
Перенасыщенныерастворы содержат в себе по массе больше растворённого вещества, чем его может раствориться в данных условиях. Образуются перенасыщенные растворы при быстром охлаждении насыщенных растворов. Они неустойчивы и могут существовать ограниченное время. Очень быстро лишнее растворённое вещество выпадает в осадок, а раствор превращается в насыщенный.
Следует отметить, что при изменении температуры насыщенный и ненасыщенный растворы могут легко обратимо превращаться друг в друга. Процесс выделения твёрдого вещества из насыщенного раствора при понижении температуры называется кристаллизацией. Кристаллизация и растворение играют огромную роль в природе: приводят к образованию минералов, имеют большое значение в атмосферных и почвенных явлениях. На основе кристаллизации в химии распространён метод очистки веществ, который называется перекристаллизацией.
Для приблизительного количественного выражения состава раствора используют понятия концентрированный и разбавленный растворы.
Концентрированнымназывается раствор, в котором масса растворённого вещества соизмерима с массой растворителя, т.е. не отличается от него более чем в 10 раз.
Если же масса растворённого вещества более чем в десять раз меньше массы растворителя, такие растворы называются разбавленными.
Однако следует помнить, что деление растворов на концентрированные и разбавленные условно, и чёткой границы между ними нет.
Точный количественный состав растворов выражают при помощи массовой доли растворённого вещества,его молярной концентрации, а также некоторыми другими способами.
Массовая доля растворённого вещества (w) – это безразмерная физическая величина, равная отношению массы растворённого вещества к общей массе раствора, т.е.
Обычно выражается в долях единицы или в процентах. Массовая доля, выраженная в %, называется процентной концентрацией. Она показывает, какая масса вещества растворена в 100 г раствора.
Молярная концентрация (С) или молярность – это величина, равная отношению количества растворённого вещества к объему раствора (в литрах),т.е.
Молярностьизмеряется в моль/л и показывает, сколько моль вещества растворено в одном литре раствора. Молярность обозначается обычно буквой М. Если в одном литре раствора содержится 1 моль вещества, то такой раствор называетсяодномолярным(1М), если 0,1 моль вещества –децимолярным(0,1М), если 0,01 моль вещества –сантимолярным(0,01М), если 0,001 моль вещества –миллимолярным(0,001М).
Титром (Т) называется отношение массы вещества в граммах к объёму раствора в мл,т.е.
Титр имеет размерность г/мл, он показывает, сколько грамм вещества растворено в 1 мл раствора.
Моляльная концентрация или моляльность (m) – это величина, равная отношению количества растворённого вещества к массе растворителя, выраженной в кг, т.е.
Моляльность имеет размерность моль/кг и показывает, какое количество вещества растворено в 1 кг растворителя.
Мольная доля (Х) – это величина, равная отношению количества растворённого вещества к общему количеству вещества в растворе:
Мольная доля – это безразмерная величина и измеряется в долях единицы или в %.
Молярная концентрация химического эквивалента вещества (С) или нормальная концентрация – это величина, равная отношению количества химического эквивалента растворённого вещества к объему раствора (в литрах),т.е.
Молярная концентрация химического эквивалента веществаизмеряется в моль/л и показывает, сколько моль эквивалента вещества растворено в одном литре раствора. Она обозначается обычно буквой н. Если в одном литре раствора содержится 1 моль химического эквивалента вещества, такой раствор называетсяоднонормальным(1н), если 0,1 моль вещества –децинормальным(0,1н), если 0,01 моль вещества –сантинормальным(0,01н), если 0,001 моль вещества –миллинормальным(0,001н).
studfiles.net
РАСТВОРЫ
РАСТВОРЫ, однофазные системы, состоящие из двух или более компонентов. По своему агрегатному состоянию растворы могут быть твердыми, жидкими или газообразными. Так, воздух – это газообразный раствор, гомогенная смесь газов; водка – жидкий раствор, смесь нескольких веществ, образующих одну жидкую фазу; морская вода – жидкий раствор, смесь твердого (соль) и жидкого (вода) веществ, образующих одну жидкую фазу; латунь – твердый раствор, смесь двух твердых веществ (меди и цинка), образующих одну твердую фазу. Смесь бензина и воды не является раствором, поскольку эти жидкости не растворяются друг в друге, оставаясь в виде двух жидких фаз с границей раздела. Компоненты растворов сохраняют свои уникальные свойства и не вступают в химические реакции между собой с образованием новых соединений. Так, при смешивании двух объемов водорода с одним объемом кислорода получается газообразный раствор. Если эту газовую смесь поджечь, то образуется новое вещество – вода, которая сама по себе раствором не является. Компонент, присутствующий в растворе в большем количестве, принято называть растворителем, остальные компоненты – растворенными веществами.
Однако иногда бывает трудно провести грань между физическим перемешиванием веществ и их химическим взаимодействием. Например, при смешивании газообразного хлороводорода HCl с водой H2O образуются ионы H3O+ и Cl–. Они притягивают к себе соседние молекулы воды, образуя гидраты. Таким образом, исходные компоненты – HCl и H2O – после смешивания претерпевают существенные изменения. Тем не менее ионизация и гидратация (в общем случае – сольватация) рассматриваются как физические процессы, происходящие при образовании растворов.
Одним из важнейших типов смесей, представляющих собой гомогенную фазу, являются коллоидные растворы: гели, золи, эмульсии и аэрозоли. Размер частиц в коллоидных растворах составляет 1–1000 нм, в истинных растворах ~0,1 нм (порядка размера молекул).
Основные понятия. Два вещества, растворяющиеся друг в друге в любых пропорциях с образованием истинных растворов, называют полностью взаиморастворимыми. Такими веществами являются все газы, многие жидкости (например, этиловый спирт – вода, глицерин – вода, бензол – бензин), некоторые твердые вещества (например, серебро – золото). Для получения твердых растворов необходимо сначала расплавить исходные вещества, затем смешать их и дать затвердеть. При их полной взаиморастворимости образуется одна твердая фаза; если же растворимость частичная, то в образовавшемся твердом веществе сохраняются мелкие кристаллы одного из исходных компонентов.
Если два компонента образуют одну фазу при смешивании только в определенных пропорциях, а в других случаях возникают две фазы, то они называются частично взаиморастворимыми. Таковы, например, вода и бензол: истинные растворы получаются из них только при добавлении незначительного количества воды к большому объему бензола или незначительного количества бензола к большому объему воды. Если же смешать равные количества воды и бензола, то образуется двухфазная жидкая система. Нижний ее слой – это вода с небольшим количеством бензола, а верхний – бензол с малой примесью воды. Известны также вещества, совсем не растворяющиеся одно в другом, например, вода и ртуть. Если два вещества лишь частично взаиморастворимы, то при данных температуре и давлении существует предельное количество одного вещества, которое способно образовать истинный раствор с другим в равновесных условиях. Раствор с предельной концентрацией растворенного вещества называют насыщенным. Можно приготовить и так называемый пересыщенный раствор, в котором концентрация растворенного вещества даже больше, чем в насыщенном. Однако пересыщенные растворы неустойчивы, и при малейшем изменении условий, например при перемешивании, попадании частичек пыли или добавлении кристалликов растворяемого вещества, избыток растворенного вещества выпадает в осадок.
Всякая жидкость начинает кипеть при той температуре, при которой давление ее насыщенного пара достигает величины внешнего давления. Например, вода под давлением 101,3 кПа кипит при 100 С потому, что при этой температуре давление водяного пара как раз равно 101,3 кПа. Если же растворить в воде какое-нибудь нелетучее вещество, то давление ее пара понизится. Чтобы довести давление пара полученного раствора до 101,3 кПа, нужно нагреть раствор выше 100 С. Отсюда следует, что температура кипения раствора всегда выше температуры кипения чистого растворителя. Аналогично объясняется и понижение температуры замерзания растворов.
Закон Рауля. В 1887 французский физик Ф.Рауль, изучая растворы различных нелетучих жидкостей и твердых веществ, установил закон, связывающий понижение давления пара над разбавленными растворами неэлектролитов с концентрацией: относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества. Из закона Рауля следует, что повышение температуры кипения или понижение температуры замерзания разбавленного раствора по сравнению с чистым растворителем пропорционально молярной концентрации (или мольной доле) растворенного вещества и может быть использовано для определения его молекулярной массы.
Раствор, поведение которого подчиняется закону Рауля, называется идеальным. Наиболее близки к идеальным растворы неполярных газов и жидкостей (молекулы которых не меняют ориентации в электрическом поле). В этом случае теплота растворения равна нулю, а свойства растворов можно прямо предсказать, зная свойства исходных компонентов и пропорции, в которых они смешиваются. Для реальных растворов сделать такое предсказание нельзя. При образовании реальных растворов обычно выделяется или поглощается тепло. Процессы с выделением тепла называются экзотермическими, а с поглощением – эндотермическими.
Те характеристики раствора, которые зависят в основном от его концентрации (числа молекул растворенного вещества на единицу объема или массы растворителя), а не от природы растворенного вещества, называют коллигативными. Например, температура кипения чистой воды при нормальном атмосферном давлении равна 100 С, а температура кипения раствора, содержащего 1 моль растворенного (недиссоциирующего) вещества в 1000 г воды, составляет уже 100,52 С независимо от природы этого вещества. Если же вещество диссоциирует, образуя ионы, то температура кипения увеличивается пропорционально росту общего числа частиц растворенного вещества, которое благодаря диссоциации превышает число молекул вещества, добавленных в раствор. Другими важными коллигативными величинами являются температура замерзания раствора, осмотическое давление и парциальное давление паров растворителя.
Концентрация раствора – это величина, отражающая пропорции между растворенным веществом и растворителем. Такие качественные понятия, как «разбавленный» и «концентрированный», говорят только о том, что раствор содержит мало или много растворенного вещества. Для количественного выражения концентрации растворов часто используют проценты (массовые или объемные), а в научной литературе – число молей или химических эквивалентов (см. ЭКВИВАЛЕНТНАЯ МАССА) растворенного вещества на единицу массы или объема растворителя либо раствора. Чтобы не возникало путаницы, следует всегда точно указывать единицы измерения концентрации. Рассмотрим следующий пример. Раствор, состоящий из 90 г воды (ее объем равен 90 мл, поскольку плотность воды равна 1г/мл) и 10 г этилового спирта (его объем равен 12,6 мл, поскольку плотность спирта равна 0,794 г/мл), имеет массу 100 г, но объем этого раствора равен 101,6 мл (а был бы равен 102,6 мл, если бы при смешивании воды и спирта их объемы просто складывались). Процентную концентрацию раствора можно рассчитать по-разному:
или
или
Единицы концентраций, используемые в научной литературе, основаны на таких понятиях, как моль и эквивалент, поскольку все химические расчеты и уравнения химических реакций должны основываться на том, что вещества вступают в реакции между собой в определенных соотношениях. Например, 1 экв. NaCl, равный 58,5 г, взаимодействует с 1 экв. AgNO3, равным 170 г. Ясно, что растворы, содержащие по 1 экв. этих веществ, имеют совершенно разные процентные концентрации.
Молярность (M или моль/л) – число молей растворенного веществ, содержащихся в 1 л раствора.
Моляльность (м) – число молей растворенного вещества, содержащихся в 1000 г растворителя.
Нормальность (н.) – число химических эквивалентов растворенного вещества, содержащихся в 1 л раствора.
Мольная доля (безразмерная величина) – число молей данного компонента, отнесенное к общему числу молей растворенного вещества и растворителя. (Мольный процент – мольная доля, умноженная на 100.)
Наиболее распространенная единица – молярность, но при ее расчете следует учитывать некоторые неоднозначности. Например, чтобы получить 1M раствор данного вещества, растворяют в заведомо небольшом количестве воды точную его навеску, равную мол. массе в граммах, и доводят объем раствора до 1 л. Количество воды, необходимое для приготовления данного раствора, может слегка различаться в зависимости от температуры и давления. Поэтому два одномолярных раствора, приготовленных в разных условиях, в действительности имеют не совсем одинаковые концентрации. Моляльность вычисляется исходя из определенной массы растворителя (1000 г), которая не зависит от температуры и давления. В лабораторной практике гораздо удобнее отмеривать определенные объемы жидкостей (для этого существуют бюретки, пипетки, мерные колбы), чем взвешивать их, поэтому в научной литературе концентрации чаще выражают в молях, а моляльность обычно применяют только при особо точных измерениях.
Нормальность используется для упрощения расчетов. Как мы уже говорили, вещества взаимодействуют друг с другом в количествах, соответствующих их эквивалентам. Приготовив растворы разных веществ одинаковой нормальности и взяв равные их объемы, мы можем быть уверены в том, что они содержат одно и то же количество эквивалентов.
В тех случаях, когда трудно (или нет необходимости) делать различие между растворителем и растворенным веществом, концентрацию измеряют в мольных долях. Мольные доли, как и моляльности, не зависят от температуры и давления.
Зная плотности растворенного вещества и раствора, можно пересчитать одну концентрацию в другую: молярность в моляльность, мольную долю и наоборот. Для разбавленных растворов данного растворенного вещества и растворителя эти три величины пропорциональны друг другу.
Растворимость данного вещества – это его способность образовывать растворы с другими веществами. Количественно растворимость газа, жидкости или твердого тела измеряется концентрацией их насыщенного раствора при данной температуре. Это важная характеристика вещества, помогающая понять его природу, а также влиять на ход реакций, в которых это вещество участвует.
Газы. В отсутствие химического взаимодействия газы смешиваются друг с другом в любых пропорциях, и в этом случае говорить о насыщении нет смысла. Однако при растворении газа в жидкости существует некая предельная концентрация, зависящая от давления и температуры. Растворимость газов в некоторых жидкостях коррелирует с их способностью к сжижению. Наиболее легко сжижаемые газы, например NH3, HCl, SO2, более растворимы, чем трудно сжижаемые газы, например O2, H2 и He. При наличии химического взаимодействия между растворителем и газом (например, между водой и NH3 или HCl) растворимость увеличивается. Растворимость данного газа изменяется с природой растворителя, однако порядок, в котором располагаются газы в соответствии с увеличением их растворимости, остается примерно одинаковым для разных растворителей.
Процесс растворения подчиняется принципу Ле Шателье (1884): если на систему, находящуюся в равновесии, оказывается какое-либо воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, что оказанное воздействие уменьшится. Растворение газов в жидкостях обычно сопровождается выделением тепла. При этом, в соответствии с принципом Ле Шателье, растворимость газов уменьшается. Это уменьшение тем заметнее, чем выше растворимость газов: такие газы имеют и бóльшую теплоту растворения. «Мягкий» вкус кипяченой или дистиллированной воды объясняется отсутствием в ней воздуха, поскольку его растворимость при высокой температуре весьма мала.
С ростом давления растворимость газов увеличивается. Согласно закону Генри (1803), масса газа, который может раствориться в данном объеме жидкости при постоянной температуре, пропорциональна его давлению. Это свойство используется для приготовления газированных напитков. Углекислый газ растворяют в жидкости при давлении 3–4 атм.; в этих условиях в данном объеме может раствориться в 3–4 раза больше газа (по массе), чем при 1 атм. Когда емкость с такой жидкостью открывают, давление в ней падает, и часть растворенного газа выделяется в виде пузырьков. Аналогичный эффект наблюдается при открывании бутылки шампанского или выходе на поверхность подземных вод, насыщенных на большой глубине углекислым газом.
При растворении в одной жидкости смеси газов растворимость каждого из них остается такой же, как и в отсутствие других компонентов при таком же давлении, как в случае смеси (закон Дальтона).
Жидкости. Взаимная растворимость двух жидкостей определяется тем, насколько сходно строение их молекул («подобное растворяется в подобном»). Для неполярных жидкостей, например углеводородов, характерны слабые межмолекулярные взаимодействия, поэтому молекулы одной жидкости легко проникают между молекулами другой, т.е. жидкости хорошо смешиваются. Напротив, полярные и неполярные жидкости, например вода и углеводороды, смешиваются друг с другом плохо. Каждой молекуле воды нужно сначала вырваться из окружения других таких же молекул, сильно притягивающими ее к себе, и проникнуть между молекулами углеводорода, притягивающими ее слабо. И наоборот, молекулы углеводорода, чтобы раствориться в воде, должны протиснуться между молекулами воды, преодолевая их сильное взаимное притяжение, а для этого нужна энергия. При повышении температуры кинетическая энергия молекул возрастает, межмолекулярное взаимодействие ослабевает и растворимость воды и углеводородов увеличивается. При значительном повышении температуры можно добиться их полной взаимной растворимости. Такую температуру называют верхней критической температурой растворения (ВКТР).
В некоторых случаях взаимная растворимость двух частично смешивающихся жидкостей увеличивается при понижении температуры. Этот эффект наблюдается в том случае, когда при смешивании выделяется тепло, обычно в результате химической реакции. При значительном понижении температуры, но не ниже точки замерзания, можно достичь нижней критической температуры растворения (НКТР). Можно предположить, что все системы, имеющие НКТР, имеют и ВКТР (обратное не обязательно). Однако в большинстве случаев одна из смешивающихся жидкостей кипит при температуре ниже ВКТР. У системы никотин–вода НКТР равна 61 С, а ВКТР составляет 208 C. В интервале 61–208 C эти жидкости ограниченно растворимы, а вне этого интервала обладают полной взаимной растворимостью.
Твердые вещества. Все твердые вещества проявляют ограниченную растворимость в жидкостях. Их насыщенные растворы имеют при данной температуре определенный состав, который зависит от природы растворенного вещества и растворителя. Так, растворимость хлорида натрия в воде в несколько миллионов раз выше растворимости нафталина в воде, а при растворении их в бензоле наблюдается обратная картина. Этот пример иллюстрирует общее правило, согласно которому твердое вещество легко растворяется в жидкости, имеющей с ним сходные химические и физические свойства, но не растворяется в жидкости с противоположными свойствами.
Соли обычно легко растворяются в воде и хуже – в других полярных растворителях, например в спирте и жидком аммиаке. Однако растворимость солей тоже существенно различается: например, нитрат аммония обладает в миллионы раз большей растворимостью в воде, чем хлорид серебра.
Растворение твердых веществ в жидкостях обычно сопровождается поглощением тепла, и в соответствии с принципом Ле Шателье их растворимость должна увеличиваться при нагревании. Этот эффект можно использовать для очистки веществ методом перекристаллизации. Для этого их растворяют при высокой температуре до получения насыщенного раствора, затем раствор охлаждают и после выпадения растворенного вещества в осадок профильтровывают. Есть вещества (например, гидроксид, сульфат и ацетат кальция), растворимость которых в воде с ростом температуры уменьшается.
Твердые вещества, как и жидкости, тоже могут растворяться друг в друге полностью, образуя гомогенную смесь – истинный твердый раствор, аналогичный жидкому раствору. Частично растворимые друг в друге вещества образуют два равновесных сопряженных твердых раствора, составы которых изменяются с температурой.
Коэффициент распределения. Если к равновесной системе двух несмешивающихся или частично смешивающихся жидкостей добавить раствор какого-либо вещества, то оно распределяется между жидкостями в определенной пропорции, не зависящей от общего количества вещества, в отсутствие химических взаимодействий в системе. Это правило получило название закона распределения, а отношение концентраций растворенного вещества в жидкостях – коэффициента распределения. Коэффициент распределения примерно равен отношению растворимостей данного вещества в двух жидкостях, т.е. вещество распределяется между жидкостями соответственно его растворимостям. Это свойство используется для экстракции данного вещества из его раствора в одном растворителе с помощью другого растворителя. Еще одним примером его применения является процесс экстракции серебра из руд, в состав которых оно часто входит вместе со свинцом. Для этого в расплавленную руду добавляют цинк, который не смешивается со свинцом. Серебро распределяется между расплавленным свинцом и цинком, преимущественно в верхнем слое последнего. Этот слой собирают и отделяют серебро дистилляцией цинка.
Произведение растворимости (ПР). Между избытком (осадком) твердого вещества MxBy и его насыщенным раствором устанавливается динамическое равновесие, описываемое уравнением
Константа равновесия этой реакции равна
и называется произведением растворимости. Она постоянна при данных температуре и давлении и является величиной, на основании которой рассчитывают растворимость осадка и изменяют ее. Если в раствор добавить соединение, диссоциирующее на ионы, одноименные с ионами малорастворимой соли, то в соответствии с выражением для ПР растворимость соли уменьшается. При добавлении же соединения, реагирующего с одним из ионов, она, напротив, увеличится.
О некоторых свойствах растворов ионных соединений см. также ЭЛЕКТРОЛИТЫ.
ЛИТЕРАТУРА
Шахпаронов М.И. Введение в молекулярную теорию растворов. М., 1956 Реми И. Курс неорганической химии, тт. 1–2. М., 1963, 1966
studfiles.net
Виды растворов
2
РАСТВОРЫ
Растворы однородные смеси двух или большого числа веществ (компонентов), которые равномерно распределены в виде отдельных атомов, ионов, молекул.
Различают истинные, коллоидные растворы и суспензии.
Истинные растворы характеризуются прозрачностью, имеют малые размеры растворённых частиц, легко проходят через биологические мембраны. В зависимости от концентрации солей существует три типа растворов: изотонические; гипертонические; гипотонические;
1. И з о т о н и ч е с к и е р а с т в о р ы имеют одинаковую концентрацию солей, как и в плазме крови, и такое же осмотическое давление.
К ним относят растворы, имеющие концентрацию солей 0,9%.
Одним из таких растворов является физиологический раствор — это раствор хлорида натрия — NaCl 0,9%. В таком растворе в клетку и из клетки молекулы воды будут перемещаться в равном количестве в обе стороны.
С кл = С раствор С – концентрация солей
Н2 0
В этом растворе клетка сохраняет все жизненно важные функции, осуществляя процессы дыхания, размножения, обмена веществ.
Применение физиологического раствора.
Вводят физраствор через рот, внутривенно, внутримышечно, подкожно, в прямую кишку:
при некоторых заболеваниях – тяжелые длительные поносы, холера, неукротимая рвота, обширные ожоги хлорид натрия выделяется из организма в больших количествах, чем обычно. Также его много теряется с потом при работе в горячих цехах. В таких случаях в организме возникает его недостаточность, что сопровождается развитием ряда болезненных явлений: спазмы, судороги, нарушения кровообращения, угнетение ЦНС;
при интоксикациях, кровопотерях, обезвоживании, высокой температуре
для промывания глаз, носовой полости.
натрий хлористый является составной частью растворов применяющихся в качестве кровозамещающих (плазмозамещающих) жидкостей.
2. Г и п е р т о н и ч е с к и й р а с т в о р (2%, 5%, 10%, 15%) — это раствор в котором концентрация солей выше, чем в плазме крови.
К ним относятся растворы, содержащие более 0,9% солей. Если клетку поместить в такой раствор, то вода из клетки поступает в окружающую среду, при этом падает в клетке тургорное (осмотическое) давление, содержимое клетки сжимается, она теряет форму, происходит обезвоживание. Это явление называется — плазмолиз
. С кл < С раствор
Н2 0
Явление плазмолиза обратимое, если поместить клетку в гипотонический раствор, то в таком растворе она восстановит объем и форму Н2 0 клетка
Применяют гипертонический раствор для:
полосканий горла, для ванн, обтираний;
назначают при запорах для опорожнения кишечника.
в виде компрессов и примочек применяются при лечении гнойных ран, раны очищаются от гноя;
2 – 5% растворы используют для промывания желудка при отравлении нитратом серебра;
внутривенно используют при отёке лёгких и внутренних кровотечениях.
3. Г и п о т о н и ч е с к и й р а с т в о р, это раствор, имеющий меньшую концентрацию солей, чем в плазме крови. К ним относят ди — бидистиллированную воду, талую воду ледников. Если клетку поместить в гипотонический раствор, то в нее из раствора будет поступать вода, осмотическое давление возрастает, клетка набухает. Это явление получило название – деплазмолиз.
С кл > С раствор
Н2 0
Животные клетки, в таком растворе быстро разрушаются т.к. мембрана не выдерживает высокого осмотического давления и разрывается. Это явление называется цитолиз. Частные случаи цитолиза – разрушение эритроцитов крови – гемолиз, при этом гемоглобин выходит в плазму крови и окрашивает ее в красный цвет, такая кровь называется лаковой.
Растительные клетки в таком растворе обычно только набухают, т.к. имеют кроме цитоплазматической мембраны плотную клеточную стенку – целлюлозную оболочку. Но, если растительные клетки длительно находятся в гипотоническом растворе, то и они разрушаются.
Применяют гипотонические растворы в качестве растворителей для водорастворимых лекарственных препаратов. Путём пиноцитоза в клетки поступают питательные вещества из кровяного русла, гормоны, ферменты, лекарственные вещества.
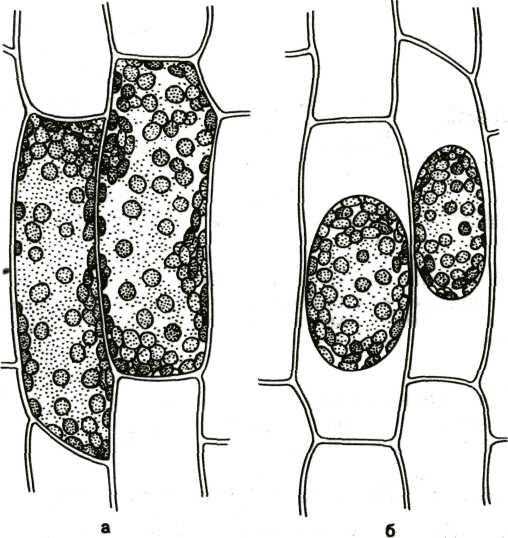
а) клетки листа элодеи б) плазмолиз в клетках листа элодеи (в 10% растворе хлорида натрия)
Суспензии, или взвеси,— мутные жидкости, частицы которых размером более 0,2 мкм. При отстаивании взвешенные частицы оседают.
Коллоидные растворы. Если частицы имеют промежуточные размеры от 0,1 до 0,001 мкм, т. е. слишком велики, чтобы образовать истинный раствор, но и слишком малы, чтобы выпасть в осадок, возникает коллоидный раствор (греч. со11а— клей). Поскольку диаметр белковых молекул превышает 0,001 мкм, белки образуют коллоидные растворы и вся протоплазма представляет собой коллоид. В коллоидных растворах на поверхностях частиц создаются огромные суммарные площади
Молекулы воды, водородными связями прочно соединены с молекулами белков. Мельчайшие частицы веществ, окружённых молекулами воды, образуют коллоидные растворы – это цитоплазма, кариоплазма, межклеточные жидкости. В коллоидном растворе различают непрерывную фазу – дисперсионную среду (вода) и коллоидные частицы – дисперсную фазу. Коллоидной частицей протоплазмы чаще всего являются молекулы белка, т.к. их размеры соответствуют размерам коллоидных частиц.
Вокруг белка в коллоидном растворе образуются водные или с о л ь в а т н ы е (от лат. solvare — распускать) оболочки. Сольватная связанная вода прочно удерживается коллоидными частицами белков. Молекулы воды, создавая оболочки вокруг белков, препятствуют образованию крупных частиц. Такое состояние называется д и с п е р с н ы м (рассеянным, раздробленным).
Дисперсность (степень раздробленности) обратно пропорциональна размерам коллоидных частиц
d
=
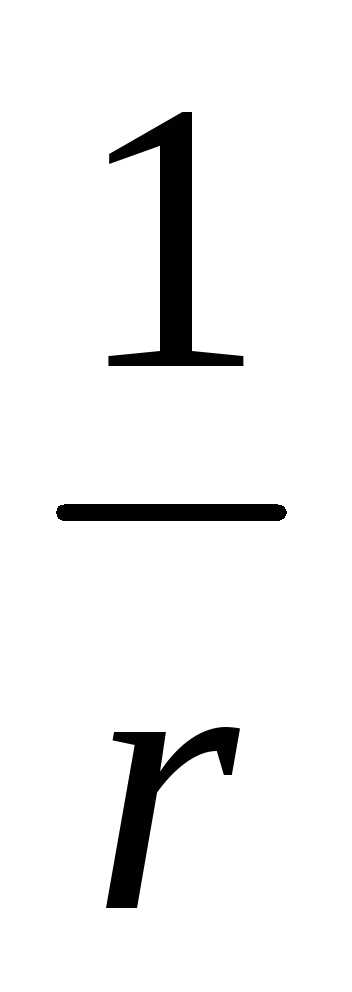 ,
где d—
дисперсность,
r
– размер коллоидной частицы.
,
где d—
дисперсность,
r
– размер коллоидной частицы.
Коллоидные частицы как бы взвешены в дисперсионной среде, где создаётся огромная поверхность, на которой происходит оседание, адсорбция веществ поступающих в клетку и течение разнообразных биохимических реакций.
Коллоидные растворы бывают в двух состояниях: в виде золя (растворённый) и геля (студень, более вязкий).
Гели дисперсные системы. В состоянии гель вытянутые белковые молекулы, соприкасаясь, друг с другом образуют остов из сетки, заполненный жидкостью.
Золи коллоидные р-ры с частицами, которые свободно перемещаются. Когда белковые молекулы (коллоидные частицы) расходятся, коллоид переходит в золь.
Эти процессы обратимы и в клетке совершаются непрерывно. При сокращении мышцы золь быстро переходит в гель и наоборот. При образовании псевдоподий у амёбы наблюдается переход геля в золь.
Такой переход из одного состояния в другое можно наблюдать на растворе желатина, который при нагревании — жидкий (золь), а при остывании становится студнеобразным (гель).
Коллоидное состояние определяет вязкость. Вязкость повышается, а дисперсность уменьшается, например, при повреждении клеток, размеры коллоидных частиц укрупняются, за счёт набухания и их агрегации.
ФИЗИКО—ХИМИЧЕСКИЕ СВОЙСТВА ПРОТОПЛАЗМЫ
ПОНЯТИЕ О ДИСПЕРСНЫХ СИСТЕМАХ, КОЛЛОИДНОЕ И КРИСТАЛЛИЧЕСКОЕ СОСТОЯНИЕ ПРОТОПЛАЗМЫ
Протоплазма характеризуется рядом физико-химических свойств. Это обусловлено тем, что она представляет собой сложное соединение коллоидных растворов белка и других органических веществ с истинными растворами солей и ряда неорганических соединений. Протоплазма представляет собой устойчивый гидрофильный коллоид. Коллоидным состоянием протоплазмы обусловлена ее вязкость. У большинства клеток консистенция цитоплазматического матрикса превышает вязкость воды не более чем в 5—10 раз, но в ряде случаев может быть значительно выше. Вязкость протоплазмы зависит от обменных процессов в клетках. Так, она повышается при повреждении клетки, а в яйцеклетках — после оплодотворения. Во время деления клетки обнаруживается ритмичное изменение вязкости протоплазмы. Вязкость крови меняется в зависимости от физиологического и патологического состояния организма.
Раньше единственным физическим состоянием протоплазмы считалось коллоидное. Но в последнее время обнаружено, что ряд клеточных структур представляют собой жидкие кристаллы. Жидкие кристаллы в отличие от настоящих, имеющих правильное чередование, Составляющих их молекул в трех измерениях обладают упорядоченностью лишь в двух измерениях. Жидкие, кристаллы занимают промежуточное положение между жидкостями и кристаллами. С одной стороны, они как жидкости обладают текучестью, могут сливаться друг с другом, с другой — подобно кристаллам, отличаются анизотропией, т. е. их прочность, электропроводность и ряд других свойств неодинаковы в разных направлениях. Особенности жидких кристаллов важны для понимания ряда процессов жизнедеятельности: у них иногда проявляется способность к движению, они нередко делятся почкованием. По-видимому, жидкокристаллическое состояние ряда клеточных структур обеспечивает их большую лабильность (подвижность, изменчивость).
Большой способностью к образованию жидких кристаллов обладают липиды. Жидкокристаллическая структура обнаружена в сперматозоидах, эритроцитах, клетках нервной системы и нервных волокон, палочках и колбочках сетчатки глаза.
studfiles.net
Лекция 05 СЖД- Растворы
Мчедлидзе Манана Тамазиевна, 02.11.2007,p.7of7
Лекция № 5. Фазовые равновесия. Растворы неэлектролитов.
Фазовые равновесия.
На прошлой лекции мы рассмотрели химическое равновесие, константу равновесия, ее связь с т.д. величинами и факторы, влияющие на сдвиг равновесия.
Хим. равновесие является динамическим, т.е. сбалансированы два противоположных процесса. Еще одним примером динамического равновесия может служить человек, идущий вверх по спускающемуся вниз эскалатору.
Динамическое равновесия реализуется, когда сбалансированы два противоположных процесса. Динамическое равновесие м.б. физическимихимическим. В качестве примера физического равновесия служат фазовые равновесия, которые устанавливаются между различными фазами системы. Дадим определение фазы.
Фаза– гомогенная часть гетерогенной системы (часть, имеющая одинаковый состав и свойства во всех точках, отделенная от других частей поверхностями раздела). Если мы имеем систему, состоящую из осадка и раствора, то это двухфазная система т.—ж. Аналогично можно рассмотреть систему ж.—пар. Если скорость испарения равна скорости конденсации, то система находится в динамическом равновесии.
Существуют три физических состояния вещества – твердое, жидкое и газообразное. Фазовый переход– переход из одной фазы в другую.
Компонентсистемы – такая составная часть системы, которая является химически однородным веществом, может быть выделена из системы и может существовать в изолированном состоянии в течение длительного времени. НапримерNa+иCl–не могут быть компонентами . Компонентами в растворе хлорида натрия являютсяNaClи вода. Системы по количеству компонентов можно разделить на однокомпонентные системы, двухкомпонентные, трехкомпонентные, многокомпонентные.
Диаграммы состояния– графическое изображение всех возможных состояний термодинамической системы в пространстве основных параметров состояния (Т, р, состав). Они показывают условия существования той или иной фазы.
Рассмотрим диаграмму состояния воды.
При обычных условиях вода существует в виде кристаллов (лед), жидкости и газа (пар). Каждая из этих фаз воды устойчива только при определенных сочетаниях температуры и давления. Например, если при атмосферном давлении повысить температуру до 100 °С, то вода закипит и превратится в пар (газ). Если давление будет ниже атмосферного, переход жидкости в пар будет проходить при более низкой температуре. При некоторых низких давлениях вода кипит и при комнатной температуре. Если давление выше атмосферного, то вода закипит при температуре выше 100 °С. Лед плавится при температуре 0 °С и атмосферном давлении, но при изменении давления изменяется и температура плавления льда.
Области фазовой диаграммы соответствуют одной фазе. Линии соответствуют условиям фазового равновесия. ВТ – кривая плавления, ТС – кривая кипения ( при давлении 1 атм Ткип=373 К), АТ – кривая сублимации. Точка С – критическая температура – выше этой точки пары воды не могут быть превращены в жидкость никаким повышением давления. Пар и жидкость перестают быть различимы.
Т– тройная точка – в равновесии находятся лед, вода и пар.
Изменяя температуру или давление можно изменять состояние вещества. Пусть точка 1. изображает твердое состояние вещества при давлении выше тройной точки. При нагревании вещества при постоянном давлении тело будет последовательно переходить из твердого в жидкое и газообразное состояние. Если будем нагревать вещество при давлении ниже тройной точки, то вещество будет переходить в пар без предварительного образования жидкости – возгонка ( сублимация)
Особые свойства воды: при увеличении давления Тпл уменьшается, при увеличении давления происходит разрушение водородных связей, и происходит образование более плотной жидкой фазы (обычно наоборот – при увеличении давления образуется более плотная твердая фаза).
ST–кривая переохлаждения – вода находится в метастабильном состоянии.
Дать диаграмму СО2 (Фримантл 1-с.287)
Двухкомпонентные системы.
Раствор–гомогеннаясистема, состоящая из двух или более компонентов, состав которой может непрерывно изменяться в некоторых пределах без скачкообразного изменения её свойств. Раствор состоит из растворителя и растворенного вещества, равномерно распределенного в растворителе в виде молекул или ионов. Подрастворителемобычно понимают то вещество, которое находится в том же агрегатном состоянии, что и раствор в целом. Если агрегатное состояние веществ, составляющих раствор одинаковое, то растворителем называют то из них, котороепреобладаетв данной системе. Например, в 5% растворе сахара в воде сахар является растворенным веществом, а вода – растворителем. В целом понятия «растворитель» и «растворенное вещество» имеют до некоторой степени условный характер. Например, в концентрированных растворах различие между растворителем и растворимым веществом менее очевидно. Для 50%-ного раствора этанола и воды оба понятия становятся равноправными, а для раствора, в котором 95% спирта и 5% воды, вода должна быть растворенным веществом. Но для растворов электролитов вода всегда является растворителем, даже если ее и очень мало. Поэтому понятия «растворитель» и «растворенное вещество» целесообразно использовать в применении к разбавленным (неконцентрированным) растворам.
Раствор может иметь любое агрегатное состояние; соответственно их разделяют на твердые, жидкие и газообразные (последние обычно называют газовыми смесями). {Обычно компоненты раствора разделяют на растворитель и растворенное вещество. Как правило, растворителем считают компонент, присутствующий в растворе в преобладающем количестве. С термодинамической точки зрения это деление компонентов раствора не имеет смысла и носит поэтому условный характер.}
Одной из важнейших характеристик раствора является его состав, описываемый с помощью понятия концентрация раствора. Ниже дается определение наиболее распространенных способов выражения концентрации./
Молярная концентрацияС– число молейnВрастворенного вещества в одном литре раствора.
Нормальная концентрацияN– число молей эквивалентов растворенного вещества (равное числу молейnВ, умноженному на фактор эквивалентности f) в одном литре раствора.
Моляльная концентрацияm – число молей растворенного вещества в одном килограмме растворителя.
Процентная концентрацияω– число граммов растворенного вещества в 100 граммах раствора.ω=mв-ва/mр-ра*100%.
Образование раствора
Образование раствора является сложным физико-химическим процессом. Процесс растворения всегда сопровождается увеличением энтропии системы; при образовании растворов часто имеет место выделение либо поглощение теплоты. Теория растворов должна объяснять все эти явления. Исторически сложились два подхода к образованию растворов – физическая теория, основы которой были заложены в XIX веке, и химическая, одним из основоположников которой был Д.И.Менделеев. Физическая теориярастворов рассматривает процесс растворения как распределение частиц растворенного вещества между частицами растворителя, предполагая отсутствие какого-либо взаимодействия между ними. Единственной движущей силой такого процесса является увеличение энтропии системы ΔS; какие-либо тепловые или объемные эффекты при растворении отсутствуют (ΔН = 0, ΔV = 0; такие растворы принято называть идеальными).Химическая теориярассматривает процесс растворения как образование смеси неустойчивых химических соединений переменного состава, сопровождающееся тепловым эффектом и изменением объема системы (контракцией), что часто приводит к резкому изменению свойств растворенного вещества (так, растворение бесцветного сульфата меди СuSО4в воде приводит к образованию окрашенного раствора, из которого выделяется не СuSО4, а голубой кристаллогидрат СuSО4·5Н2О). Современная термодинамика растворов основана на синтезе этих двух подходов.
В общем случае при растворении происходит изменение свойств и растворителя, и растворенного вещества, что обусловлено взаимодействием частиц между собой по различным типам взаимодействия: Ван-дер-Ваальсового (во всех случаях), ион-дипольного (в растворах электролитов в полярных растворителях), специфических взаимодействий (образование водородных или донорно-акцепторных связей). Учет всех этих взаимодействий представляет собой очень сложную задачу. Очевидно, что чем больше концентрация раствора, тем интенсивнее взаимодействие частиц, тем сложнее структура раствора. Поэтому количественная теория разработана только для идеальных растворов, к которым можно отнести газовые растворы и растворы неполярных жидкостей, в которых энергия взаимодействия разнородных частиц EA-Bблизка к энергиям взаимодействия одинаковых частиц EA-Aи EB-B. Идеальными можно считать также бесконечно разбавленные растворы, в которых можно пренебречь взаимодействием частиц растворителя и растворенного вещества между собой. Свойства таких растворов зависят только от концентрации растворенного вещества, но не зависят от его природы.
Растворение – физико-химический процесс, он включает в себя переход из одной фазы в другую (ф.п.) и сольватацию (взаимодействие веществ с растворителем).
DH =DHф.п.+DHсольв.
DS =DSф.п. +DSсольв
При растворении кристаллических веществ в жидкостях DHф.п. > 0,DSф.п. > 0. Сольватация – процесс экзотермический (DHсольв < 0), поэтому теплота растворения м.б. различного знака. Сольватация – упорядочение системы, происходит упорядочение частиц, поэтомуDSсольв < 0 (оно невелико по абсолютному значению, поэтому растворение обычно сопровождается увеличением энтропии.
При сольватации происходит изменение свойств растворенных веществ. Так, например, безводный сульфат меди бесцветен, а раствор имеет голубую окраску.
Образующиеся сольваты или гидраты могут быть настолько прочными, что при выделении растворенного вещества из раствора растворитель входит в состав растущего кристалла в химически связанном виде. Такие вещества называются кристаллогидратами.
Na2SO4·10H2O – глауберова соль
CuSO4·5H2O– медный купорос
Объемныеэффекты растворения: 1л С2Н5ОН + 1л Н2О → 1,93 л (25 С)
Смеси, процесс образования которых не сопровождается объемными и тепловыми эффектами, называются идеальными растворами.
Растворимость
Процесс растворения связан с диффузией, т. е. с самопроизвольным распределением частиц одного вещества между частицами другого. При внесении растворяемого вещества в растворитель процесс растворения идет самопроизвольно (G < 0)и раствор остается ненасыщенным, т. е. в раствор может переходить еще некоторое количество вещества. Когда энтальпийный и энтропийный факторы процесса станут одинаковыми, т. е.G= 0, система окажется в состоянии истинного равновесия. Раствор становится насыщенным, в такой системе неопределенно долго могут сосуществовать без каких-либо изменений раствор и избыток растворяемого вещества.
При избытке растворяемого вещества одновременно с переходом частиц тв. вещ-ва в раствор происходит обратный процесс – кристаллизация. С течением времени между этими процессами устанавливается подвижное равновесие, при котором в единицу времени растворяется столько вещества, сколько выделяется его из раствора: осадок ↔ растворенное вещество. При равновесии концентрация растворенного вещества не изменяется – этонасыщенныйраствор, в нем содержится предельное для данной температуры количество растворенного вещества. Концентрация растворенного вещества в насыщенном растворе – мера растворимости в-ва при данных условиях, величина постоянная. Итак,растворимость– концентрация насыщенного раствора при данной температуре.
Можно получить и пересыщенный раствор, т. е. такой, концентрация вещества в котором выше концентрации вещества в насыщенном растворе (при данных температуре и давлении). Пересыщенные растворы можно приготовить осторожным и медленным охлаждением насыщенных при высокой температуре растворов, напр. солей Na2S2O3Ch4COONa. Пересыщенный раствор – системы, находящаяся в кажущемся равновесииG>0. Встряхивание или внесение в него кристаллов того же вещества вызывает кристаллизацию – система переходит в состояние истинного равновесия.
Растворимость– концентрация в насыщенном растворе.
Растворимость определяется тремя факторами:
природа вещества
агрегатное состояние
внешние условия (Т,р)
Растворимость м.б. ограниченная – вода –эфир, Pb-Zn(ж),LiCl–KCl(ж) и неограниченная спирт-вода, отсутствие растворимости.
Растворимость газов в газах
Газообразное состояние вещества характеризуется слабым взаимодействием между частицами и большими расстояниями между ними. Поэтому газы смешиваются в любых соотношениях. Газовые смеси описываются законом Дальтона:
Общее давление газовой смеси равно сумме парциальных давлений всех входящих в неё газов.
Растворимость газов в жидкостях
Растворимость газов в жидкостях зависит от ряда факторов: природы газа и жидкости, давления, температуры, концентрации растворенных в жидкости веществ (особенно сильно влияет на растворимость газов концентрация электролитов).
Наибольшее влияние на растворимость газов в жидкостях оказывает природа веществ. Так, в 1 литре воды при t = 18 °С и P = 1 атм. растворяется 0.017 л. азота, 748.8 л. аммиака или 427.8 л. хлороводорода. Аномально высокая растворимость газов в жидкостях обычно обусловливается их специфическим взаимодействием с растворителем – образованием химического соединения (для аммиака) или диссоциацией в растворе на ионы (для хлороводорода). Газы, молекулы которых неполярны, растворяются, как правило, лучше в неполярных жидкостях – и наоборот.
Поскольку растворимость характеризует истинное равновесие для определения влияния температуры и давления можно использовать принцип Ле-Шателье, влияние Т и р определяется знакомН иV.
Р-рение газов всегда сопровождается выделениемтеплоты (из-за сольватации молекул), поэтому приповышении температуры растворимость понижается.
При р-рении газов в жидкостях Vуменьшается => повышение давления увеличивает растворимость (Зависимость растворимости газов от давления выражается законом Генри – Дальтона):
Растворимость газа в жидкости прямо пропорциональна его давлению над жидкостью.
(III.7)
Здесь С – концентрация раствора газа в жидкости, k – коэффициент пропорциональности, зависящий от природы газа. Закон Генри – Дальтона справедлив только для разбавленных растворов при малых давлениях, когда газы можно считать идеальными. Газы, способные к специфическому взаимодействию с растворителем, данному закону не подчиняются.
Растворимость твердых веществ в жидкостях.
На растворимости твердых веществ давлениезначительно не сказывается (так какV0). Влияние становится ощутимым лишь при очень высоких давлениях. Например, лишь при давлении порядка 109Па растворимость нитрата аммония в воде снижается (Vр > 0) почти вдвое.
Температуравлияет на растворимость твердых веществ по-разному, что определяется, как сказано выше, знаком и величиной теплового эффекта растворения. Температурную зависимость растворимости твердых веществ часто выражают графически в видекривых растворимости(рис. 2.23). Растворимость рубидияRbNO3 и хлората калия КClO3 при нагревании от 0 до 100 «С увеличивается в несколько раз (процесс растворения протекает споглощением теплоты). Для кристаллогидрата сульфата иттербияYb2(SO4)3*8Н20 теплота гидратации преобладает над теплотой разрушения кристаллической решетки и процесс растворения экзотермичен, поэтому растворимость его при повышении температуры снижается. УYCl3*7h3Oрастворимость не зависит от Т, т.к. у него практически нулевой эффект растворения.
Коллигативные свойства растворов (не зависят от природы, а только от количества вещества)
В результате образования раствора изменяются свойства не только растворенного вещества, но и растворителя. Для разбавленных растворов эти изменения м.б. разбиты на два типа: зависящиеот природы растворенного вещества ( изменение цвета, объема) и от неене зависящие. Во втором случае изменения свойств вызвано уменьшением концентрации молекул самого растворителя при распределении в нем другого вещества.
Растворы неэлектролитов.
Свойства растворов рассматривают на примере разбавленных растворов, при образовании которых тепловой и объемный эффекты равны 0 (идеальные растворы). В таких растворах частица находятся на большом расстоянии друг от друга и силами взаимного влияния можно пренебречь.
Понижение давления пара вызвано тем, что поверхность раствора, в отличие от поверхности растворителя частично занято частицами нелетучего растворенного вещества. Это приводит к уменьшению числа молекул растворителя, испаряющихся в единицу времени; число же молекул растворителя, переходящего из газа в раствор, остается без изменения. Однако основную роль играют силы сольватационного взаимодействия. Они значительно прочнее сил сцепления между молекулами растворителя, чем и объясняется переход меньшего числа молекул растворителя в газовую фазу.
Рассмотрим двухкомпонентный идеальный раствор. Пусть давление насыщенного пара растворителя и растворенного вещества: Р01 и Р02 соответственно. Мольные доли: Х1 и Х2. Если растворенное вещество является нелетучим, то Р02=0. Тогда общее давление пара равно парциальному давлению пара растворителя: Р=Р1= Р01*Х1.Общее давление насыщенного пара раствора определяется только парциальным давлением пара летучего компонента.
т. е. давление насыщенного пара растворителя над раствором равно произведению его давления над чистым растворителем на мольную долю растворителя(первый закон Рауля, 1887 г.).
Уравнению (2.55) можно придать несколько иной вид. Так как хI = 1 – х2(где х2— мольная доля растворенного вещества), то
р1= р01(1-х2)= р01–р01х2или р01–р1= р01х2
р01–р1/ р01= х2
Относительное понижение давления насыщенного пара над раствором равно мольной доле растворенного вещества.
Любая жидкость начинает кипеть при температуре, при которой давление ее насыщенного пара достигает величины внешнего давления. Т кип – Т, при которой давление пара= 101,3 кПа.Вода кипит при 100 С, т.к. давление в этой точке на фазовой диаграмме равно 1 атм. По закону Рауля если ввести в р-р нелетучий компонент давление пара понизится. Теперь уже надо нагреть р-р выше 100 с, чтобы довести давление до 1 атм.
Т зам – Т, при которой давление пара вода = давлении е пара льда = 613 Па.
Температура кипения раствора.
Р-р, содержащий нелетучее вещество обладает меньшей летучестью, чем чистый растворитель. Поэтому его кипение начинается при более высокой Т, чем кипение чистого растворителя.
Т=Тр-р–Тр-ль=Есm, сm–моляльность растворенного вещества, Е –эбулиоскопическая постоянная р-ля.
Дать диаграмму.
Температура замерзания раствора.
Кристаллы растворителя будут находиться в равновесии с раствором только тогда, когда давление насыщенного пара над кристаллами и над раствором одинаково. Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, температура, отвечающая этому условию, всегда будет более низкой, чем температура замерзания чистого растворителя. При этом понижение температуры замерзания раствора ΔTзамне зависит от природы растворенного вещества и определяется лишь соотношением числа частиц растворителя и растворенного вещества.
Можно показать, что понижение температуры замерзания раствора ΔTзампрямо пропорционально моляльной концентрации раствора:
Второй закон Рауля: Повышение Ткип и понижение Тзам р-ра пропорциональны числу частиц растворенного вещества и не зависят от его природы.
Осмотическое давление
Если разделить два раствора с различной концентрацией полупроницаемой перегородкой, пропускающей молекулы растворителя, но препятствующей переходу частиц растворённого вещества, будет наблюдаться явление самопроизвольного перехода растворителячерез мембрану из менее концентрированного раствора в более концентрированный – осмос. Осмотические свойства раствора количественно характеризуются величиной осмотического давления. Давление, которое необходимо приложить к раствору, чтобы предотвратить перемещение растворителя в раствор через мембрану, разделяющую раствор и чистый растворитель, есть осмотическое давлениеπ. Осмотическое давление идеальных растворов линейно зависит от температуры и молярной концентрации раствора С и может быть рассчитано по уравнению (III.16):
(III.16)
Уравнение (III.16) есть т.н. принцип Вант-Гоффа:
осмотическое давление идеального раствора равно тому давлению, которое оказывало бы растворенное вещество, если бы оно, находясь в газообразном состоянии при той же температуре, занимало бы тот же объем, который занимает раствор.
Осмос играет важнейшую роль в процессах жизнедеятельности животных и растений, поскольку клеточная плазматическая мембрана является полупроницаемой. Осмос обусловливает поднятие воды по стеблю растений, рост клеткии многие другие явления.
Рассмотрим роль осмоса в водном режиме растительной клетки. Осмотическое давление жидкости, контактирующей с клеткой, может быть больше, меньше либо равно осмотическому давлению внутриклеточной жидкости. Соответственно выделяют гипертонические,гипотоническиеиизотоническиерастворы.
Если клетка находится в контакте с гипертоническим раствором, вода выходит из неё путём осмоса через плазматическую мембрану. Протопласт (живое содержимое клетки) при этом уменьшается в объёме, сморщивается и в конце концов отстаёт от клеточной стенки. Этот процесс называют плазмолизом. Процесс плазмолиза обычно обратим.
Если клетку поместить в чистую воду или гипотонический раствор, вода путём осмоса поступает в клетку; протопласт при этом увеличивается в объёме и оказывает давление на сравнительно жёсткую клеточную стенку. Этот процесс называется тургором. Тургорное давление препятствует дальнейшему поступлению воды в клетку. Именно тургорное давление поддерживает стебли растений в вертикальном положении, придаёт растениям прочность и устойчивость.
Изотонические растворы не оказывают влияния на водный режим клетки.
У животных клеток нет клеточной стенки, поэтому они более чувствительны к осмотическому давлению жидкости, в которой находятся. Животные клетки имеют систему защиты, основанную на осморегуляции; организм животного стремится поддерживать осмотическое давление всех тканевых жидкостей на постоянном уровне. Например, осмотическое давление крови человека – 800 000 Н/м2. Такое же осмотическое давление имеет 0,9 %-ный раствор хлорида натрия. Физиологический раствор, изотоничный крови, широко применяется в медицине.
В технике применяют обратный осмос, происходящий при приложении к раствору давления, превышающего осмотическое. тогда через полунепроницаемую мембрану выдавливается чистый растворитель (для очистки сточных вод и опреснения морской воды).
Если мы будем рассматривать растворы электролитов, то понятно, что при растворении их в воде количество частиц увеличивается за счет электролитической диссоциации. Поэтому в уравнения следствий из закона Рауля вводят коэффициент, учитывающий увеличение концентрации. Это изотонический коэффициент (i).
Ткип =iЕсm,Тзам=iKсm,=iсRT
iувеличивается по мере разбавления раствора, имея пределом целое число, равное числу ионов, возникающих при диссоциации.NaCl(i→2),AlCl3 (i→4)
Определение молекулярной массы растворенного вещества. Измеряя изменение температур кипения (эбулиоскопия) и отвердевания (криоскопия) или измеряя осмотическое давление можно определить молярную массу вещества.
studfiles.net
