Строение атома азота (N), схема и примеры
Общие сведения о строении атома азота
Порядковый номер равен 7. Заряд ядра равен +7. Атомный вес – 14,007а.е.м. В природе встречаются два изотопа азота: 14N — 99,635 % и 15N — 0,365 % (в скобках указано их процентное соотношение).
Электронное строение атома азота
Атом азота имеет две оболочки, как и все элементы, расположенные во втором периоде. Номер группы –V – свидетельствует о том, что на внешнем электронном уровне атома азота находится 5 валентных электронов.
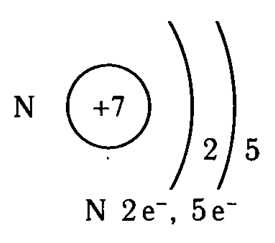
Рис. 1. Схематичное строение атома азота.
Электронная конфигурация основного состояния записывается следующим образом:
1s22s22p3.
Азот – элемент p-семейства. Энергетическая диаграмма для валентных электронов в невозбужденном состоянии выглядит следующим образом:
Возбужденного состояния нет. По числу неспаренных электронов можно сказать, что азот в соединениях проявляет валентность III. Однако, валентность так же определяется по номеру группы (V), следовательно, азот может проявлять две валентности – III и V.
Рис. 2. Пространственное изображение строения атома азота.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Азот – формула, электронная конфигурация, характеристика строения (химия, 9 класс)
Азот экспериментальным путем был обнаружен шотландским химиком Д. Резерфордом в 1772 году. В природе азот находится в основном в свободном состоянии и является одной из главных составляющих воздуха. Каковы же физические и химические свойства азота?

Общая характеристика
Азот – химический элемент V группы периодической системы Менделеева, атомный номер 7, атомная масса 14, формула азота – N2. Перевод названия элемента – «безжизненный» – может относится к азоту как к простому веществу. Однако азот в связанном состоянии является одним из главных элементов жизни, входит в состав белков, нуклеиновых кислот, витаминов и т.д.
Рис. 1. Электронная конфигурация азота.
Азот – элемент второго периода, не имеет возбужденных состояний, так как атом не имеет свободных орбиталей. Но этот химический элемент может проявлять в основном состоянии валентность не только III, но и IV за счет образования ковалентной связи по донорно-акцепторному механизму с участием неподеленной электронной пары азота. Степень окисления, которую может проявлять азот, изменяется в широких пределах от -3 до +5.
при изучении строения молекулы азота необходимо помнить, что химическая связь осуществляется за счет трех общих пар p-электронов, орбитали которых направлены по осям x, y, z.
Химические свойства азота
В природе азот встречается в виде простого вещества – газа N2 (объемная доля в воздухе 78%) и в связанном состоянии. В молекуле азота атомы связаны прочной тройной связью. Энергия этой связи составляет 940 кДж/моль. При обычной температуре азот может взаимодействовать только с литием (Li3 N). После предварительной активизации молекул путем нагревания, облучения или действием катализаторов азот вступает в реакции с металлами и неметаллами. Азот может вступать в реакции с магнием, кальцием или, например, алюминием:
3Mg+N2=Mg3N2
3Ca+N2=Ca3N2
2Al+N2=2AlN
Особенно важен синтез аммиака из простых веществ – азота и водорода в присутствии катализатора (губчатое железо):N 2+3H2=2NH3+Q. Аммиак – бесцветный газ с резким запахом. Он хорошо растворим в воде, что в значительной степени обусловлено образованием водородных связей между молекулами аммиака и воды, а также реакцией присоединения к воде по донорно-акцепторному механизму. Слабощелочная реакция раствора обусловлена наличием в растворе ионов OH- (в небольшой концентрации, так как степень диссоциации гидроксида аммония очень мала – это слабое растворимое основание).
Рис. 2. Аммиак.
Из шести оксидов азота – N2O, NO, N2O3, NO2, N2O4, N2O5, где азот проявляет степень окисления от +1 до +5, два первых – N2O и NO – несолеобразующие, остальные вступают в реакцию с образованием солей.
Азотную кислоту, самое важное соединение азота, в промышленности получают из аммиака в
- окисление аммиака на платиновом катализаторе:
4NH3 +5O2=4NO+6H2O
- окисление NO до NO2 кислородом воздуха:
2NO+O2=2NO2
- поглощение NO2 водой в избытке кислорода:
4NO2 +2H2O+O2=4HNO3
Азот также может реагировать при высоких температурах и давлении (в присутствии катализатора) с водородом:
N2+3H2=2NH3
Рис. 3. Азотная кислота.
Применение азота
Основное применение азот находит в качестве исходного продукта для синтеза аммиака, а также для производства азотной кислоты, минеральных удобрений, красителей, взрывчатых веществ и других азотосодержащих соединений. Жидкий азот используют в охладительных системах. Для придания стали большей твердости, увеличения износостойкости, коррозионной стойкости и теплостойкости ее поверхность насыщают азотом при высоких температурах. Такая сталь выдерживает нагревание до 500 градусов без потери своей твердости.
Что мы узнали?
Азот – бесцветный газ без запаха, цвета и вкуса. В школьном курсе химии изучаются его основные свойства, а также способность вступать в реакцию с металлами и неметаллами при нормальных условиях, а также под действием катализаторов.
Тест по теме
Оценка доклада
Средняя оценка: 4.4. Всего получено оценок: 47.
obrazovaka.ru
| ||||||||||
Электронная конфигурация азота — Справочник химика 21
Определите число и форму орбиталей молекулы азота. Постройте приближенную энергетическую диаграмму уровней молекулы и приведите ее электронную конфигурацию. [c.9]
Простое вещество. Электронная конфигурация молекулы азота N2. [c.344]
Элементы главной подгруппы V группы — азот Ы, фосфор Р, мышьяк Аз, сурьма 8Ь, висмут 81. Согласно электронным конфигурациям их атомов [c.343]
Постройте энергетическую диаграмму орбиталей и приведите электронные конфигурации основного состояния молекулы азота и молекулярных ионов и NT. [c.60]
Приведите электронную конфигурацию атома азота. [c.94]
Молекула азота Ыа имеет электронную конфигурацию (см. стр. 91) [c.389]
Дать сравнительную характеристику атомов элементов подгруппы азота, указав а) электронные конфигурации б) валентные возможности в) наиболее характерные степени окисленности. [c.228]
Аналогичное поведение обнаруживается и у элементов группы VA, но граница между металлами и неметаллами в этой группе проходит ниже. Азот и фосфор являются неметаллами, химия их ковалентных соединений и возможные состояния окисления определяются наличием пяти валентных электронов в конфигурации Азот и фосфор чаще всего имеют степени окисления — 3, -Ь 3 и +5. Мыщьяк As и сурьма Sb-семи-металлы, образующие амфотерные оксиды, и только висмут обладает металлическими свойствами. Для As и Sb наиболее важным является состояние окисления + 3. Для Bi оно единственно возможное, если не считать степеней окисления, проявляемых в некоторых чрезвычайно специфических условиях. Висмут не может терять все пять валентных электронов требуемая для этого энергия слишком велика. Однако он теряет три бр-электро-на, образуя ион Bi .
Электронные оболочки. Наиболее простой способ — запись по электронным оболочкам. При этом указываются заряд ядра и количество электронов на каждой электронной оболочке по мере увеличения ее номера. Например, для атома азота и его иона N+ электронная конфигурация по оболочкам выглядит так [c.63]
Теория поля лигандов. В теории поля лигандов учитывают электронные конфигурации лигандов и изменение этих конфигураций при комплексообразовании (координировании). В этой теории в соответствии с методом МО комплекс рассматривается как единое целое, в котором отдельные атомы нли молекулы теряют свои индивидуальные черты. Например, комплекс [Со(МНз)вР+ представляется в виде скелета из шести ядер азота, 18 ядер водорода и ядра кобальта, в поле которых движутся 84 электрона. [c.49]
Энергетическое различие 2s- и 2/ -орбиталей в периоде увеличивается от I к VIII группе (см. рис. И). Поэтому приведенная последовательность молекулярных орбиталей характерна для двухатомных молекул элементов начала периода вплоть до N2. Так, электронная конфигурация молекулы азота в основном состоянии имеет вид [c.54]
СПЕКТРОСКОПИЧЕСКАЯ НОМЕНКЛАТУРА. Для краткости вместо того, чтобы говорить, например, атом водорода имеет один электрон на ls-орбитали , говорят водород Is (читается один- -один). Аналогично электронная конфигурация азота сокращенно обозначается ls 2s 2p , показывая, что два электрона находятся на ls-орбитали, два — на 25-орбитали и три — на 2р-орбиталях. Эту сокращенную номенклатуру иногда называют спектроскопической номенклатурой . При таком написании электронной конфигурации элемента орбитали обычно перечисляются в порядке увеличения квантовых чисел п и Z), а не в порядке последовательного заполнения орбиталей- [c.22]
Электронная конфигурация представлена как совокупность всех предшествующих электронов, показанных на схеме ниже символа данного элемента. Так, электронная конфигурация азота 1 2р , а скандия [c.127]
Интересная проблема возникает при попытке записать льюисову структурную формулу молекулы распространенного загрязнителя воздуха моноксида азота, N0, Для этой молекулы не удается построить конфигурацию с замкнутыми оболочками, потому что в ней нечетное число валентных электронов. Действительно, в N0 11 валентных электронов, пять из которых первоначально принадлежали атому азота, а щесть-атому кислорода. Таким образом, в молекуле N0 аюм азота или атом кислорода будет окружен только семью, а не восемью электронами. Поскольку азот-менее электроотрицательный элемент, чем кислород, следует ожидать, что неполное окружение должно быть именно у этого атома. Следовательно, наилучшей структурой N0 должна быть такая [c.468]
В. молекуле N0 — на один электрон больше, который располагается в единственном числе на разрыхляющей орбитали тг-типа. Это приводит к уменьшению порядка связи, по сравнению с порядком связи в молекуле азота, до 2,5. Поскольку порядок связи уменьшился, то энергия связи уменьшилась, а это привело к тому, что расстояние между атомами в молекуле увеличилось до 115 пм. Электронная конфигурация молекулы [c.129]
Электронная конфигурация атома азота ls 2s 2p отвечает следующему распределению электронов по квантовым ячейкам [c.105]
Таким образом, между двумя атомами кислорода в молекуле О2 имеется двойная связь. Чтобы каждый атом азота в молекуле N2 приобрел электронную конфигурацию благородного газа, должна осуществляться тройная связь [c.467]
Азот. В молекуле азота, N2, все связывающие орбитали, энергетические уровни которых изображены на рис. 12-8, оказываются заполненными. Молекула N2 имеет электронную конфигурацию [c.526]
Зти ионы и eют такую же электронную конфигурацию, как атом азота (см. рис. 1.34). При соединении нонов С и 0+ образуется тройная связь, аналогичная связи в молекуле N2. Очевидно, тройная связь более прочна, чем двойная система с тройной связью обладает более низкой энергией. Выделение энергии при образовании третьей связи с избытком компенсирует ее затраты на перенос электрона от более электроотрицательного кислорода к угле- [c.95]
Эту электронную конфигурацию можно интерпретировать следующим образом. Три занятые а-орбитали соответствуют двум парам электронов (одна из них преимущественно локализована у атома углерода, вторая — около атома азота) и одной о-связи между атомами углерода и, ислорода. Дважды вырожденный л, -уровень соответствует образованию двух я-связей. Молекула СО характеризуется очень большой энергией диссоциации (1069 кДж/моль), высоким значением силовой постоянной связи (ксо= 1860 Н/м) и малым межъ-ядерным расстоянием (0,1128 нм). Электрический момент диполя молек лы СО незначителен ( х = 0,04 Кл м) при этом эффективный заряд на атоме углерода отрицательный, а на атоме кислорода — положительный. [c.405]
Особый интерес представляет сродство к электрону элементов группы 5А. В основном состоянии атомы элементов группы 5А обладают электронной конфигурацией пБ пр пр пр. Другими словами, в соответствии с правилом Гунда все валентные р-ор-битали этих атомов наполовину заполнены электронами, спины которых ориентированы в одинаковом направлении. Присоединение электрона к такой довольно устойчивой конфигурации энергетически невыгодно, и действительно, сродство к электрону азота близко к нулю или даже несколько положительно (см. разд. 6.6, ч. 1). Значения сродства к электрону для других элементов группы 5А отрицательны, но все же присоединение электрона к любому элементу группы 5А приводит к выделению значительно меньшей энергии, чем для элементов группы 6А или 7А. Наличие устойчивой, наполовину заполненной электронной подоболочки ответственно также за относительно высокие значения энергии ионизации элементов группы 5А, особенно в случае азота, который имеет более высокий потенциал ионизации, чем кислород. [c.314]
Электронные оболочки и подоболочки. Этот метод записи электронных конфигураций используют наиболее часто. Номер электронной оболочки (главное квантовое число) указывают цифрой, а тип подоболочки (орбитальное квантовое число) — буквой 8, р,(1 или /. Количество электронов указывается цифрой справа вверху у символа подоболочки. Для атома и иона азота данная запись имеет следующий вид [c.63]
Эти ионы имеют такую же электронную конфигурацию, как атом азота (см. рис. 1.33). При соединении ионов С и О образуется тройная связь, аналогичная связи в молекуле N2. Очевидно, что тройная связь более прочна, чем двойная система с тройной связью обладает более низкой энергией. Выделение энергии при образовании третьей связи с избытком компенсирует ее затраты на перенос электрона от более электроотрицательного кислорода к углероду, и можно считать, что в молекуле СО, как и в N2, имеется тройная связь. Поэтому физические свойства оксида углерода и азота весьма близки [c.102]
Фосфор имеет электронную конфигурацию [Ке]35 3р . Подобно азоту, он проявляет степени окисления, начиная от — 3 и кончая + 5. Благодаря более низкой электроотрицательности фосфор чаще, чем азот, встречается в положительных состояниях окисления. Более того, соединения, в которых фосфор имеет степень окисления + 5, не являются сильными окислителями, как соответствующие соединения азота. Соединения, в которых фосфор находится в состоянии окисления — 3, гораздо более сильные восстановители, чем соответствующие соединения азота. [c.321]
Учитывая, что молекула азота диамагнитна, дать ее электронную конфигурацию на основе метода ВС и метода МО. Сколько связей в молекуле Nj и каков их характер [c.146]
Какова электронная конфигурация атомов элементов группы азота [c.84]
Молекула ВЫ содержит 8 электронов, ее электронная конфигурация отвечает формальному образованию двух связей. Молекулы ВО, С0+ и СЫ содержат по 9 электронов, что соответствует порядку связей 2,5. Отсюда межъядерные расстояния в этих молекулах короче, а энергии диссоциации больше, чем в молекуле ВЫ. Тройная связь (одна о- и две я-связи) осуществляется в молекулах СО, Ы0+ и СЫ, которые изоэлектронны молекуле азота. [c.191]
Атом азота, обладающий электронной конфигурацией 15 25 2р , имеет три р-орбитали, расположенные во взаимно перпендикулярных направлениях — по осям х, у и г. Предположим, что два атома азота приближаются друг к другу, двигаясь [c.94]
Электронная конфигурация представлена совокупностью всех электронов, введенных в диаграмму до символа данного элемента. Так, электронная конфигурация азота 1з 28 2р , а скандия 1з 25 2р 35 3рЧ8 3с1. [c.118]
На основании этого устойчивой электронной конфигурацией азота будет конфигурация Не)2зЧр]с2р1 2р1, Конфигурация (Не)25 2р 2р1 соответствует возбужденному состоянию азота, его энергия на 230 кДж/моль больше. Спаривание электронов с противоположными спинами на 2р-орбиталях начинается в атоме кислорода его конфигурация имеет вид Не)2з 2р12р12р. Неон имеет иолнос 5 >ю заполненный набор р-орбиталей, в котором нет неспаренных электронов. [c.54]
Ниже записаны различные электронные конфигурации атома азота N(7 = 7). Укажите, какие из этих конфигураций соответствуют возбужденному основному или запрещенному (недопусгимому) состоянию. [c.410]
Молекула Конфигурация [КК((У25)Ца 2вУ л2р = п2ру) х X (а2р 2]. Терм Все 14 электронов молекулы азота спарены, и молекула диамагнитна избыток в шесть связывающих электронов соответствует представлению о тройной связи. Молекула N3 поэтому наиболее стабильна из всех гомонуклеарных двухатомных молекул Do(N2) = 9,759 эВ, л,(Ыг) = 1,08758 10-1 (1,08758 А). Тройную связь в N2 можно обозначить символом Высокая стабильность [c.79]
Число ковалентных связей, которые может образовать данный атом (ковалентность атома), определяется числом неспарепных электронов. Например, атом углерода в состоянии 2з2р имеет четыре неспаренных электрона и может образовать четыре ковалентные связи. Атом азота имеет электронную конфигурацию внешнего слоя 25 2р и имеет три неспарениых 2р-электрона и, следовательно, является трехковалентным элементом. Положительный ион азота в состоянии 2з2р имеет четыре неспаренных электрона и может образовать четыре ковалентные связи (например, в ионе КН ). [c.11]
Приведенную электронную конфигурацию можно интерпретировать следующим образом. Три занятые а-орбитали соответствуют двум парам электронов (одна из них преимущественно локализована у атома углерода, вторая — около атома азота) и одной а-связи между атомами углерода и кислорода. Дважды вырожденный -уровень соответствует образованию двух я-связей. Молекула СО характеризуется очень большой энергией диссоциации (1066 кдж1моль), высоким значением силовой постоянной связи (/гсо=18,6) и малым межъядерным [c.459]
Атом с номером 7, азот, имеет 3 неспаренных элеюрона на внешнем уровне. Суммарный спин +3/2. Электронная конфигурация ls 2s 2p [c.42]
В качестве примера определения геометрической конфигурации молекул, содержащих неэквивалентные электронные пары рассмотрим строение молекулы аммиака NHз. В данной молекуле азот (электронная конфигурация 7N… 25 2р 2р 2р ) и три атома водорода ( И 1з ) образуют за счет (1 + 1)-взаимодействий 3 поделенные электронные пары. Четвертая — неподеленная электронная пара принадлежала атому азота и до образования связей. Таким образом, на электронной оболочке азота в молекуле NHз находятся 4 электронные пары. Если бы все эти пары были эквивалентными, то они распо.пагались бы [c.134]
Если на -подуровне могут быть только два электрона (с противоположными спинами), то уже на р-подуровне их число может достигать шести. Поэтому возникает вопрос, каким образом ориентированы спины электтнов. Так, для атома азота (электронная конфигурация li 2r2 ) два электрона на первом уровне, пять-на втором) возможны два следующих варианта [c.31]
Хроматоскопия молекул, содержащих азот в различных электронных конфигурациях и галогены, а также серу и другие элементы, с помощью соответствующих полуэмпирических атом-аТомных потенциалов (структурных вопросов и выяснению связанных с ними свойств, [c.202]
Второй период образует атомы от до Ne. В направлении — Ке растет эффективный заряд ядра, в связи с чем уменьшаются размеры атомов (см. Гшах), возрастает потенциал ионизации и осуществляется, начиная с В, переход к неметаллам. Потенциал ионизации отражает не только рост в ряду —Ке, но и особенности электронных конфигураций потенциал ионизации у бора ниже, чем у бериллия. Это указывает на упрочнение заполненных нодоболочек ( у бериллия). Более высокий потенциал ионизации азота по сравнению с кислородом указывает на повышенную прочность конфигурации р , в которой каждая орбиталь занята одним / -электроном. Аналогичные соотношения наблюдаются и в следующем периоде у соседей Mg—А1 и Р—5. У атомов второго периода отрыв электрона с внутреннего Ь -слоя требует такого высокого ПИ (75,62 эВ уже у лития), что в химических и оптических процес—сах участвуют только внешни электроны. Сродство к электрону в ряду Ы—Р имеет тенденцию к возрастанию. Но у берилжя оболочка заполнена, и сродство к электрону эндотермично так же, как и у гелия (1л ). Обладая самым высоким потенциалом ионизации ю всех неметаллов и высоким сродством к электрону, фтор является наиболее электроотрицательным элементом в периодической системе. Для атома неона СЭ (Ке)=—0,22 эВ. Оболочка з р атома Ке, электронный октет, характеризуется суммарным нулевым спином и нулевым орбитальным моментом (терм 5о). Все это, вместе с высоким потенциалом ионизации и отрицательным сродством к электрону, обусловливает инертность неона. Такая же з р конфигурация внешнего слоя характерна для вСех элементов нулевой группы. Исследования последних лет показывают, что 1 п, Хе,Кг и Аг дают химические соединения со фтором и кислородом. Очевидно, что з р конфигурация не влечет как непременное следствие химической инертности. Все атомы со спаренными электронами (терм о) — диамагниты (Не, Ве, Ке и т. д.). Конфигурации внешнего электронного слоя у атомов 2-го и 3-го периодов, стоящих в одних и тех же группах, одинаковы, чем объясняется близость химических свойств элементов, стоящих в одних и тех же группах (сравните Ка иЬ1 в табл. 5). Но наблюдается и различие элементы второго периода обладают постоянной валентностью, а третьего — переменной. Это связано с тем, что у атомов третьего периода есть вакантные -состояния в третьем квантовом слое, а во втором слое таких соединений нет. [c.62]
chem21.info
Электронная конфигурация.
Электронная конфигурация элемента это запись распределения электронов в его атомах по оболочкам, подоболочкам и орбиталям. Электронная конфигурация обычно записывается для атомов в их основном состоянии. Электронная конфигурация атома, у которого один или несколько электронов находятся в возбужденном состоянии, называется возбужденной конфигурацией. Для определения конкретной электронной конфигурации элемента в основном состоянии существуют следующие три правила: Правило 1: принцип заполнения. Согласно принципу заполнения, электроны в основном состоянии атома заполняют орбитали в последовательности повышения орбитальных энергетических уровней. Низшие по энергии орбитали всегда заполняются первыми.
Пример
Водород; атомный номер = 1; число электронов = 1
Этот единственный в атоме водорода электрон должен занимать s-орбиталь К-обо-лочки, поскольку из всех возможных орбиталей она имеет самую низкую энергию (см. рис. 1.21). Электрон на этой s-орбитали называется ls-электрон. Водород в основном состоянии имеет электронную конфигурацию Is1.
Правило 2: принцип запрета Паули. Согласно этому принципу, на любой орбитали может находиться не более двух электронов и то лишь в том случае, если они имеют противоположные спины (неодинаковые спиновые числа).
Пример
Литий; атомный номер = 3; число электронов = 3
Орбиталь с самой низкой энергией-это 1s-орбиталъ. Она может принять на себя только два электрона. У этих электронов должны быть неодинаковые спины. Если обозначать спин +1/2 стрелкой, направленной вверх, а спин —1/2 стрелкой, направленной вниз, то два электрона с противоположными (антипараллельными) спинами на одной орбитали схематически можно представить записью (рис. 1.27)
На одной орбитали не могут находиться два электрона с одинаковыми (параллельными) спинами:
Третий электрон в атоме лития должен занимать орбиталь, следующую по энергии за самой низкой орбиталью, т.е. 2в-орбиталь. Таким образом, литий имеет электронную конфигурацию Is22s1.
Правило 3: правило Гунда. Согласно этому правилу, заполнение орбиталей одной подоболочки начинается одиночными электронами с параллельными (одинаковыми по знаку) спинами, и лишь после того, как одиночные электроны займут все орбитали, может происходить окончательное заполнение орбиталей парами электронов с противоположными спинами.
Пример
Азот; атомный номер = 7; число электронов = 7 Азот имеет электронную конфигурацию ls22s22p3. Три электрона, находящиеся на 2р-подоболочке, должны располагаться поодиночке на каждой из трех 2р-орбиталей. При этом все три электрона должны иметь параллельные спины (рис. 1.22).
В табл. 1.6 показаны электронные конфигурации элементов с атомными номерами от 1 до 20.
Таблица 1.6. Электронные конфигурации основного состояния для элементов с атомным номером от 1 до 20
Оглавление:
www.himikatus.ru
Азот электронная конфигурация молекулы — Справочник химика 21
Простое вещество. Электронная конфигурация молекулы азота N2. [c.344]
Определите число и форму орбиталей молекулы азота. Постройте приближенную энергетическую диаграмму уровней молекулы и приведите ее электронную конфигурацию. [c.9]
Эту электронную конфигурацию можно интерпретировать следующим образом. Три занятые а-орбитали соответствуют двум парам электронов (одна из них преимущественно локализована у атома углерода, вторая — около атома азота) и одной о-связи между атомами углерода и, ислорода. Дважды вырожденный л, -уровень соответствует образованию двух я-связей. Молекула СО характеризуется очень большой энергией диссоциации (1069 кДж/моль), высоким значением силовой постоянной связи (ксо= 1860 Н/м) и малым межъ-ядерным расстоянием (0,1128 нм). Электрический момент диполя молек лы СО незначителен ( х = 0,04 Кл м) при этом эффективный заряд на атоме углерода отрицательный, а на атоме кислорода — положительный. [c.405]
Молекула азота Ыа имеет электронную конфигурацию (см. стр. 91) [c.389]
Справа выписано число неспаренных внешних электронов и формулы соответствующих водородных соединений. Валентность, согласно изложенному, должна равняться этому числу неспаренных электронов. Мы видим, что в полном соответствии с опытными данными водород, литий, фтор и натрий — одновалентны, кислород — двухвалентен, азот — трехвалентен. Атомы инертных газов гелия и неона не образуют молекул, так как все их электроны спарены, поэтому их валентность равна нулю. Противоречие мы наблюдаем лишь для атомов Ве, В, С, для которых возможны и другие валентности (указанные в скобках). Но это противоречие только кажущееся и объясняется тем, что мы привыкли считать, что свободные атомы, образуя химическую связь, обязательно сохраняют строение своих электронных оболочек. Но не существует никаких причин, по которым это должно быть только так атом, образуя связь, уже не является свободным, и его электронная конфигурация может и должна — в большей или меньшей степени) измениться. Поэтому необходимо принимать во снимание те изменения энергии, которые могут возникнуть при образовании химической связи. [c.71]
Энергетическое различие 2s- и 2/ -орбиталей в периоде увеличивается от I к VIII группе (см. рис. И). Поэтому приведенная последовательность молекулярных орбиталей характерна для двухатомных молекул элементов начала периода вплоть до N2. Так, электронная конфигурация молекулы азота в основном состоянии имеет вид [c.54]
Постройте энергетическую диаграмму орбиталей и приведите электронные конфигурации основного состояния молекулы азота и молекулярных ионов и NT. [c.60]
В. молекуле N0 — на один электрон больше, который располагается в единственном числе на разрыхляющей орбитали тг-типа. Это приводит к уменьшению порядка связи, по сравнению с порядком связи в молекуле азота, до 2,5. Поскольку порядок связи уменьшился, то энергия связи уменьшилась, а это привело к тому, что расстояние между атомами в молекуле увеличилось до 115 пм. Электронная конфигурация молекулы [c.129]
Теория поля лигандов. В теории поля лигандов учитывают электронные конфигурации лигандов и изменение этих конфигураций при комплексообразовании (координировании). В этой теории в соответствии с методом МО комплекс рассматривается как единое целое, в котором отдельные атомы нли молекулы теряют свои индивидуальные черты. Например, комплекс [Со(МНз)вР+ представляется в виде скелета из шести ядер азота, 18 ядер водорода и ядра кобальта, в поле которых движутся 84 электрона. [c.49]
Запишите электронную конфигурацию молекулы азота и укажите порядок связи в ней. [c.202]
Приведенную электронную конфигурацию можно интерпретировать следующим образом. Три занятые а-орбитали соответствуют двум парам электронов (одна из них преимущественно локализована у атома углерода, вторая — около атома азота) и одной а-связи между атомами углерода и кислорода. Дважды вырожденный -уровень соответствует образованию двух я-связей. Молекула СО характеризуется очень большой энергией диссоциации (1066 кдж1моль), высоким значением силовой постоянной связи (/гсо=18,6) и малым межъядерным [c.459]
Ожидаемые электронные конфигурации молекул азота, окиси углерода и кислорода [c.92]
Зти ионы и eют такую же электронную конфигурацию, как атом азота (см. рис. 1.34). При соединении нонов С и 0+ образуется тройная связь, аналогичная связи в молекуле N2. Очевидно, тройная связь более прочна, чем двойная система с тройной связью обладает более низкой энергией. Выделение энергии при образовании третьей связи с избытком компенсирует ее затраты на перенос электрона от более электроотрицательного кислорода к угле- [c.95]
Электронная конфигурация молекулы азота. . . ……и [c.146]
Эти ионы имеют такую же электронную конфигурацию, как атом азота (см. рис. 1.33). При соединении ионов С и О образуется тройная связь, аналогичная связи в молекуле N2. Очевидно, что тройная связь более прочна, чем двойная система с тройной связью обладает более низкой энергией. Выделение энергии при образовании третьей связи с избытком компенсирует ее затраты на перенос электрона от более электроотрицательного кислорода к углероду, и можно считать, что в молекуле СО, как и в N2, имеется тройная связь. Поэтому физические свойства оксида углерода и азота весьма близки [c.102]
Металлохромный индикатор является комплексоном, т. е. образует внутрикомплексные соединения с металлами. Это свойство красителю придает комплексообразующая (хелатная) группировка, подключенная в систему сопряженных связей красителя. В таблице хелатные группировки в молекулах индикаторов выделены пунктирной линией а—д). Каждая группировка состоит из двух отдельных групп, расположенных в молекуле таким образом, чтобы мог образоваться с катионом металла пяти- или шестичленный хелат. Одной из групп обычно является гидроксил, атом водорода которого замещается металлом, другой — атомы азота или кислорода, участвующие в образовании хелата своей неподеленной парой электронов. При координации пара электронов смещается в сторону катиона металла, вызывая изменение всей электронной конфигурации молекулы красителя и соответственно этому изменение окраски. Обычно окраска хелата меняется в пределах кислотно-основ-ных изменений цвета красителя и чаще всего соответствует окраске его протонированной формы. [c.7]
Таким образом, между двумя атомами кислорода в молекуле О2 имеется двойная связь. Чтобы каждый атом азота в молекуле N2 приобрел электронную конфигурацию благородного газа, должна осуществляться тройная связь [c.467]
В качестве примера определения геометрической конфигурации молекул, содержащих неэквивалентные электронные пары рассмотрим строение молекулы аммиака NHз. В данной молекуле азот (электронная конфигурация 7N… 25 2р 2р 2р ) и три атома водорода ( И 1з ) образуют за счет (1 + 1)-взаимодействий 3 поделенные электронные пары. Четвертая — неподеленная электронная пара принадлежала атому азота и до образования связей. Таким образом, на электронной оболочке азота в молекуле NHз находятся 4 электронные пары. Если бы все эти пары были эквивалентными, то они распо.пагались бы [c.134]
Электронная конфигурация молекулы в значительной мере определяет характер ее валентных сил. Интересный пример к этом отношении представляет собой азот. Известно, что самый низкий энергетический уровень молекулярного азота отвечает электронной конфигурации, соответствующей нулевой валентности. Следующий [c.56]
Молекула ВЫ содержит 8 электронов, ее электронная конфигурация отвечает формальному образованию двух связей. Молекулы ВО, С0+ и СЫ содержат по 9 электронов, что соответствует порядку связей 2,5. Отсюда межъядерные расстояния в этих молекулах короче, а энергии диссоциации больше, чем в молекуле ВЫ. Тройная связь (одна о- и две я-связи) осуществляется в молекулах СО, Ы0+ и СЫ, которые изоэлектронны молекуле азота. [c.191]
При этом имеется в виду, что оба кислородных атома, связанных только с азотом, равноценны, они находятся на одинаковом расстоянии от атома азота и несут каждый по половинному заряду электрона, т. е. четвертая связь азота разделена поровну между двумя атомами кислорода. При таком написании атомы в молекуле имеют устойчивые электронные конфигурации внешних уровней у кислорода и азота — восьмиэлектронные, а у водорода — двухэлектронные. [c.59]
За счет отданных электронных пар возникает стабильная группировка вокруг центрального атома. Например, атом цинка имеет электронную конфигурацию 2, 8, 18, 2. Два внешних электрона могут быть удалены, образуя ион цинка 2п+ +, с конфигурацией 2, 8, 18, 0. Эта конфигурация является стабильной сама по себе. Цинк может образовывать комплексный ион с аммиаком— [2п (NHз)4] + +. Электронная конфигурация молекулы аммиака Н Й Н. Из четырех пар электронов, окружающих азот, Н [c.26]
Молекула Конфигурация [КК((У25)Ца 2вУ л2р = п2ру) х X (а2р 2]. Терм Все 14 электронов молекулы азота спарены, и молекула диамагнитна избыток в шесть связывающих электронов соответствует представлению о тройной связи. Молекула N3 поэтому наиболее стабильна из всех гомонуклеарных двухатомных молекул Do(N2) = 9,759 эВ, л,(Ыг) = 1,08758 10-1 (1,08758 А). Тройную связь в N2 можно обозначить символом Высокая стабильность [c.79]
Азот. В молекуле азота, N2, все связывающие орбитали, энергетические уровни которых изображены на рис. 12-8, оказываются заполненными. Молекула N2 имеет электронную конфигурацию [c.526]
Из этих формул видно, что в молекуле водорода благодаря объединению двух электронов в пару каждый из атомов приобретает конфигурацию благородного газа — гелия. В молекуле НС1 атом водорода имеет конфигурацию гелия, а атом хлора — электронную конфигурацию ближайшего к нему благородного газа — аргона. В молекуле аммиака связь обеспечивается тремя электронными парами, при этом атом азота принимает конфигурацию благородного газа неона, а водород — гелия. Связь такого типа называется геомеополярной, или ковалентной. Отметим, что электронные пары, обеспечи- [c.153]
В молекуле СО осуществляется так называемая семиполярная связь. Электрон атома кислорода переходит к атому углерода, в результате чего электронные конфигурации обоих ионов (С и 0+) делаются подобными электронным конфигурациям атомов азота, в результате между ними возникают три валентные связи. [c.336]
Учитывая, что молекула азота диамагнитна, дать ее электронную конфигурацию на основе метода ВС и метода МО. Сколько связей в молекуле Nj и каков их характер [c.146]
Из приведенной схемы видно, что в молекуле хлора образуется только одна общая пара электронов, у азота — три. Причем каждый атом достигает электронной конфигурации атома благородного газа. [c.63]
На пространственную конфигурацию молекул влияют внешние атомные орбитали, имеющие неподеленную пару электронов. В качестве примера рассмотрим конфигурацию молекулы ННз. Внешний уровень атома азота имеет строение [c.52]
Хроматоскопия молекул, содержащих азот в различных электронных конфигурациях и галогены, а также серу и другие элементы, с помощью соответствующих полуэмпирических атом-аТомных потенциалов (структурных вопросов и выяснению связанных с ними свойств, [c.202]
Поэтому при образовании молекулы азота обобществляются три пары электронов (тройная связь N=N1. Атом кислорода, электронная конфигурация которого ls 2s 2p, должен иметь два спаренных электрона на одной из трех 2р-орбиталей. Таким оЬразом, он обладает лишь двумя неспаренными электронами, которые участвуют в образовании химической связи. Вследствие этого в молекуле кислорода общими являются две пары электронов (двойная связь 0=0). [c.37]
Для молекул с двумя валентными электронами вид ЛМО мало отличается от канонического типа. Для четырехэлектронных молекул вместо сг-СЕ1Язывающей и ст-антисвязывающей канонических МО возникают две эквивалентные ЛМО, форма которых соответствует орбиталям неподеленных электронных пар каждого атома Они обозначаются ет/ и ет/. Вид ЛМО хорошо объясняет неустойчивость или вообще отсутствие связи в таких молекулах, как Вез. Связывающая ЛМО (т-типа возникает в шестиэлектронной молекуле (рис. 10.7 — (тЬ). Электронная конфигурация 10-электронных молекул в формализме ЛМО представлена двумя несвязьшающими орбиталями неподеленных электронных пар а1 к а1 ч тремя эквивалентными связывающими ЛМО Ь. Напомним, что при использовании канонических МО тройная связь в молекуле азота определяется (Зст,) (1я ) -электронной конфигурацией, т. е. включает одну сг- [c.383]
chem21.info
Азот. Рабочие материалы
Дополнительные сочиненияВ ходе урока вы получите представление о теме «Азот». Познакомитесь с азотом как простым веществом, аммиаком, азотной кислотой и нитратами. Будут рассмотрены химические и физические свойства этих веществ, строение их молекул, реакции с другими веществами. Кроме того, будут перечислены способы получения этих веществ промышленным и лабораторным способом, их применение в различных отраслях. Рассмотрите свойства и применение закиси азота и царской водки (соединение из трех частей соляной кислоты и одной части азотной).
Тема: Основные металлы и неметаллы
Урок: Азот
1. Электронное строение атома азота
Химический элемент азот расположен во втором периоде 5 группы, главной подгруппы. Электронная конфигурация атома азота – 1s22s22p3. На валентном энергетическом уровне атома азота нет вакантных орбиталей. Следовательно, электронная пара 2s-подуровня не может быть распарена. См. Рис. 1. Поэтому азот не может быть 5-ти валентным. Максимальная валентность азота в соединениях равна 4. При этом 3 связи образуются по обменному механизму, а одна – по донорно-акцепторному. Азот проявляет степени окисления от -3 до +5.
Рис. 1
Примеры веществ с различной степенью окисления см. рис. 2.
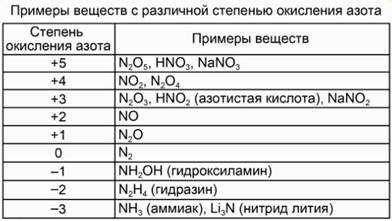
Рис. 2
2. Азот – простое вещество
Для азота нехарактерна аллотропия. Он образует одно простое вещество, N2. Это молекулярное вещество, с ковалентной неполярной связью. Связь образована при помощи трёх общих электронных пар, тройная связь – одна сигма и 2 пи-связи. Тройная связь очень прочная. Это обуславливает низкую реакционно способность молекулярного азота.
Физические свойства
Азот – это газ без цвета и запаха, плохо растворим в воде, немного легче воздуха. Азот вступает в реакцию с некоторыми веществами, но условия проведения реакций очень жесткие (высокие температура и давление, использование катализатора). В обычных условиях азот взаимодействует только с литием, образуя нитрид лития.
6Li + N2 = 2Li3N, гидролизом которого можно получить аммиак.
Li3N + h3O = 3LiOH + Nh4&
dp-adilet.kz
