Хром. Степени окисления хрома
Степени окисления у хрома
Введение
Степень окисления (СО) – это условное обозначение в химии, служащее для того, чтобы определять заряд атома у какого-либо химического элемента (или группы элементов). Без степеней окисления не решается ни одна задача, не составляется ни одно уравнение, но самое главное – без них мы не можем чётко определить свойства элемента и то, какую роль он будет играть в различных соединениях.
Знаменательно, что периодическая система (ПС) Д.И. Менделеева сгруппирована гениальнейшим образом: все элементы разделены по периодам, группам, подгруппам, их порядковые номера также соответствуют определённым показателям. Благодаря этому нам не приходится заучивать качества каждого химического элемента (ХЭ) наизусть, потому что легко можно найти его в таблице и определить всё, что требуется. Однако даже в таком случае некоторые люди, забывая школьные знания по курсу химии (или пренебрегая ими когда-то), вынуждены вернуться к изучению данной темы подробнее.
Итак, для начала необходимо сформировать верные объективные представления о хроме (Cr), разобраться с его положением в ПС, а затем можно будет приступить к наиболее важной части – практике.
Хром – Cr, положение в таблице Менделеева, физические и химические свойства
Хром – это твёрдое вещество, металл, блестящий, серебристо-белого (или голубоватого) цвета. Он достаточно ломкий, но при этом имеет несравненный плюс по сравнению со многими другими металлами – устойчивость к заражению коррозией; именно поэтому он является важным компонентом при производстве нержавеющей стали, а также используется для нанесения на поверхность других металлов, более склонных к коррозии. Хром обладает плохой тепло- и электропроводностью.
ХЭ располагается в VI группе, 4 периоде, носит порядковый номер 24 и обладает атомной массой равной 52 г/моль. Благодаря пассивированию хром не взаимодействует с серной ( H2SO4) и азотной (HNO3) кислотами, проявляет устойчивость в воздухе.
Это амфотерный металл – значит, он может растворяться как в кислотах, так и в щелочах. Элемент растворяется в сильных разбавленных кислотах (например, соляная кислота HCl), в нормальных условиях (н.у.) взаимодействует только с фтором (F). При нагревании хром может осуществлять взаимодействие с элементами VII группы (галогены), кислородом O2, бором B, азотом N2, серой S2, кремнием Si. Если раскалить Cr, то способен вступить в реакцию с водяными парами.
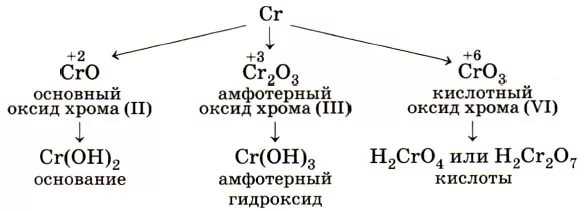
Теперь поговорим непосредственно о том, какие степени окисления бывают у данного ХЭ: он может приобретать СО +4, +6, а также +2 в безвоздушном пространстве, +3 – в пространстве с воздухом. Хром, как любой другой металл, является сильным восстановителем.
Вещества с различными степенями окисления
- +2. Когда Cr приобретает СО +2, вещество демонстрирует основные и очень сильные восстановительные свойства. К примеру, оксид хрома (II) – CrO, гидроксид хрома – Cr(OH)2, множество солей. Синтезируются соединения этого элемента с фтором(CrF2), хлором(CrCl2) и так далее.
- +3. Эти вещества обладают амфотерными свойствами, могут быть разных цветов (но преимущественно зелёного H2O). Для примера приведём оксид Cr2O3 (это зеленоватый порошок, который не растворяется в ), Cr(OH)3, хромиты NaCrO2.
- +4. Такие соединения встречаются очень редко: они не образуют солей, кислот, с ними почти не производятся какие-либо работы. Но из известных веществ существуют оксид CrO2, тетрагалогенид CrF4, CrCl4.
- +6. Хром с СО +6, образуя соли, имеет кислотный характер, очень ядовитый, гидроскопичный, а также имеющий сильные окислительные свойства. Примеры: CrO3 (имеет вид кристаллов красного цвета), K2CrO4, H2CrO4, H2Cr2O7. Элемент способен образовывать два вида гидроксидов (уже перечислены).
Как определять СО в сложных веществах
С правилом «крест-накрест» вы наверняка уже знакомы. А что, если соединение имеет, например, целых три элемента?
В этом случае мы смотрим на последний элемент вещества, определяем его степень окисления и умножаем на коэффициент, находящийся справа (конечно, если он есть). Мысленно отделяем последний элемент (с уже определённой степенью окисления) от двух других элементов. Нам требуется, чтобы СО двух первых и последнего элементов в сумме была равна нулю.
Рассмотрим пример:
Степени окисления в следующих формулах попробуйте расставить сами:
- Na2CrO4;
- BaCrO4;
- Fe(CrO2)2;
- Cr2O7;
- H2CrO 4.
Хром – один из самых интересных химических элементов, соединения с которым – штука сложная, но необходимая для понимания. Будет замечательно, если данные примеры помогут разобраться со столь кропотливой темой.
Редакция «Учисьучись.рф»
xn--h1aa0abgczd7be.xn--p1ai
Характеристика и качества хрома
Хром (Cr), химический элемент VI группы периодической системы Менделеева. Относится к переходным металлом с атомным номером 24 и атомной массой 51,996. В переводе с греческого, название металла означает «цвет». Такому названию металл обязан разнообразной цветовой гамме, которая присуща его различным соединениям.

Физические характеристики хрома
Металл обладает достаточной твердостью и хрупкостью одновременно. По шкале Мооса твердость хрома оценивается в 5,5. Этот показатель означает, что хром имеет максимальную твердость из всех известных на сегодня металлов, после урана, иридия, вольфрама и бериллия. Для простого вещества хрома характерен голубовато-белый окрас.
| Атомный номер | 24 |
| Атомная масса | 51,996 |
| Плотность, кг/м³ | 7190 |
| Температура плавления, °С | 1856 |
| Теплоемкость, кДж/(кг·°С) | 0,46 |
| Электроотрицательность | 1,6 |
| Ковалентный радиус, Å | 1,18 |
| 1-й ионизац. потенциал, эв | 6,76 |
Металл не относится к редким элементам. Его концентрация в земной коре достигает 0,02% масс. долей. В чистом виде хром не встречается никогда. Он содержится в минералах и рудах, которые являются главным источником добычи металла. Хромит (хромистый железняк, FeO*Cr 2O3) считается основным соединением хрома. Еще одним достаточно распространенным, однако менее важным минералом, является крокоит PbCrO4.
Металл легко поддается плавке при температуре 19070С (21800К или 34650F). При температуре в 26720С – закипает. Атомная масса металла составляет 51,996 г/моль.
Хром является уникальным металлом благодаря своим магнитным свойствам. В условиях комнатной температуры ему присуще антиферромагнитное упорядочение, в то время, как другие металлы обладают им в условиях исключительно пониженных температур. Однако, если хром нагреть выше 370С, физические свойства хрома изменяются. Так, существенно меняется электросопротивление и коэффициент линейного расширения, модуль упругости достигает минимального значения, а внутреннее трение значительно увеличивается. Такое явление связано с прохождением точки Нееля, при которой антиферромагнитные свойства материала способны изменяться на парамагнитные. Это означает, что первый уровень пройден, и вещество резко увеличилось в объеме.
Строение хрома представляет собой объемно-центрированную решетку, благодаря которой металл характеризуется температурой хрупко-вязкого периода. Однако, в случае с данным металлом, огромное значение имеет степень чистоты, поэтому, величина находится в пределах -500С — +3500С. Как показывает практика, раскристаллизированный металл не имеет никакой пластичности, но мягкий отжиг и формовка делают его ковким.
Химические свойства хрома
Атом имеет следующую внешнюю конфигурацию: 3d54s1. Как правило, в соединениях хром имеет следующие степени окисления: +2, +3, +6, среди которых наибольшую устойчивость проявляет Сr 3+.Кроме этого существуют и другие соединения, в которых хром проявляет совершенно иную степень окисления, а именно: +1, +4, +5.
Металл не отличается особой химической активностью. Во время нахождения хрома в обычных условиях, металл проявляет устойчивость к влаге и кислороду. Однако, данная характеристика не относится к соединению хрома и фтора – CrF3, которое при воздействии температур, превышающих 6000С, взаимодействует с парами воды, образуя в результате реакции Сr2О3, а также азотом, углеродом и серой.
Во время нагревания металлического хрома, он взаимодействует с галогенами, серой, кремнием, бором, углеродом, а также некоторыми другими элементами, в результате чего получаются следующие химические реакции хрома:
Cr + 2F2 = CrF4 (с примесью CrF5)
2Cr + 3Cl2 = 2CrCl3
2Cr + 3S = Cr2S3
Хроматы можно получить, если нагреть хром с расплавленной содой на воздухе, нитратами или хлоратами щелочных металлов:
2Cr + 2Na2CO3 + 3O2 = 2Na2CrO4 + 2CO2.
Хром не обладает токсичностью, чего нельзя сказать о некоторых его соединениях. Как известно, пыль данного металла, при попадании в организм, может раздражать легкие, через кожу она не усваивается. Но, поскольку в чистом виде он не встречается, то его попадание в человеческий организм является невозможным.
Трехвалентный хром попадает в окружающую среду во время добычи и переработки хромовой руды. В человеческий организм попадание хрома вероятно в виде пищевой добавки, используемой в программах по похудению. Хром с валентностью, равной +3, является активным участником синтеза глюкозы. Ученые установили, что излишнее употребление хрома особого вреда человеческому организму не наносит, поскольку не происходит его всасывание, однако, он способен накапливаться в организме.
Соединения, в котором участвует шестивалентный металл, являются крайне токсичными. Вероятность их попадания в человеческий организм появляется во время производства хроматов, хромирования предметов, во время проведения некоторых сварочных работ. Попадание такого хрома в организм чревато серьезными последствиями, так как соединения, в которых присутствует шестивалентный элемент, представляют собой сильные окислители. Поэтому, могут вызвать кровотечение в желудке и кишечнике, иногда с прободением кишечника. При попадании таких соединений на кожу возникают сильные химические реакции в виде ожогов, воспалений, возникновения язв.
В зависимости от качества хрома, которое необходимо получить на выходе, существует несколько способов производства металла: электролизом концентрированных водных растворов оксида хрома, электролизом сульфатов, а также восстановлением оксидом кремния. Однако, последний способ не очень популярен, так как при нем на выходе получается хром с огромным количеством примесей. Кроме того, он также является экономически невыгодным.
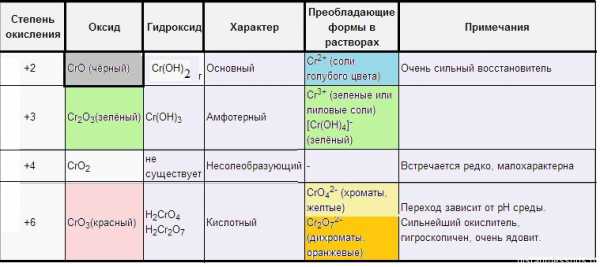
| Степень окисления | Оксид | Гидроксид | Характер | Преобладающие формы в растворах | Примечания |
| +2 | CrO (чёрный) | Cr(OH)2 (желтый) | Основный | Cr2+ (соли голубого цвета) | Очень сильный восстановитель |
|
+3 |
Cr2O3 (зелёный) | Cr(OH)3 (серо-зеленый) | Амфотерный |
Cr3+ (зеленые или лиловые соли) |
|
| +4 | CrO2 | не существует | Несолеобразующий | — |
Встречается редко, малохарактерна |
| +6 | CrO3 (красный) |
h3CrO4 |
Кислотный |
CrO42- (хроматы, желтые) |
Переход зависит от рН среды. Сильнейший окислитель, гигроскопичен, очень ядовит. |
mining-prom.ru
Химические свойства
«Национальный исследовательский Томский политехнический Университет»

Институт природных ресурсов Геоэкология и геохимия
РЕФЕРАТ
Хром
по дисциплине:
Химия
Выполнил:
студент группы 2Г41 Ткачева Анастасия Владимировна 29.10.2014
Проверил:
преподаватель Стась Николай Федорович
Томск 2014
Положение в периодической системе
Хром — элемент побочной подгруппы 6-ой группы 4-го периода периодической системы химических элементов Д. И. Менделеева с атомным номером 24. Обозначается символом Cr(лат. Chromium). Простое вещество хром — твёрдый металлголубовато-белого цвета. Хром иногда относят к чёрным металлам.
Строение атома
+17 Cl )2 )8 )7 — схема строения атома
1s2s2p3s3p- электронная формула
Атом располагается в III периоде, и имеет три энергетических уровня
Атом располагается в VII в группе, в главной подгруппе – на внешнем энергетическом уровне 7 электронов
Свойства элемента
Физические свойства
Хром — белый блестящий металл с кубической объемно-центрированной решеткой, а = 0,28845 нм, отличающийся твердостью и хрупкостью, с плотностью 7,2 г/см3, один из самых твердых чистых металлов (уступает только бериллию, вольфраму и урану), с температурой плавления 1903 град. И с температурой кипения около 2570 град. С. На воздухе поверхность хрома покрывается оксидной пленкой, которая предохраняет его от дальнейшего окисления. Добавка углерода к хрому еще больше увеличивает его твердость.
Хром при обычных условиях – инертный металл, при нагревании становится довольно активным.
Взаимодействие с неметаллами
При нагревании выше 600°С хром сгорает в кислороде:
4Cr + 3O2 = 2Cr2O3.
С фтором реагирует при 350°С, с хлором – при 300°С, с бромом – при температуре красного каления, образуя галогениды хрома (III):
2Cr + 3Cl2 = 2CrCl3.
С азотом реагирует при температуре выше 1000°С с образованием нитридов:
2Cr + N2 = 2CrN
или 4Cr + N2 = 2Cr2N.
Сера при температуре выше 300°С образует сульфиды от CrS до Cr5S8, например:
2Cr + 3S = Cr2S3.
Реагирует с бором, углеродом и кремнием с образованием боридов, карбидов и силицидов:
Cr + 2B = CrB2 (возможно образование Cr2B, CrB, Cr3B4, CrB4),
2Cr + 3C = Cr2C3 (возможно образование Cr23C6, Cr7B3),
Cr + 2Si = CrSi2 (возможно образование Cr3Si, Cr5Si3, CrSi).
С водородом непосредственно не взаимодействует.
Взаимодействие с водой
В тонкоизмельченном раскаленном состоянии хром реагирует с водой, образуя оксид хрома (III) и водород:
2Cr + 3H2O = Cr2O3 + 3H2
Взаимодействие с кислотами
В электрохимическом ряду напряжений металлов хром находится до водорода, он вытесняет водород из растворов неокисляющих кислот:
Cr + 2HCl = CrCl2 + H2;
Cr + H2SO4 = CrSO4 + H2.
В присутствии кислорода воздуха образуются соли хрома (III):
4Cr + 12HCl + 3O2 = 4CrCl3 + 6H2O.
Концентрированная азотная и серная кислоты пассивируют хром. Хром может растворяться в них лишь при сильном нагревании, образуются соли хрома (III) и продукты восстановления кислоты:
2Cr + 6H2SO4 = Cr2(SO4)3 + 3SO2 + 6H2O;
Cr + 6HNO3 = Cr(NO3)3 + 3NO2 + 3H2O.
Взаимодействие с щелочными реагентами
В водных растворах щелочей хром не растворяется, медленно реагирует с расплавами щелочей с образованием хромитов и выделением водорода:
2Cr + 6KOH = 2KCrO2 + 2K2O + 3H2.
Реагирует с щелочными расплавами окислителей, например хлоратом калия, при этом хром переходит в хромат калия:
Cr + KClO3 + 2KOH = K2CrO4 + KCl + H2O.
Восстановление металлов из оксидов и солей
Хром – активный металл, способен вытеснять металлы из растворов их солей: 2Cr + 3CuCl2 = 2CrCl3 + 3Cu.
Свойства простого вещества
Устойчив на воздухе за счёт пассивирования. По этой же причине не реагирует с серной и азотной кислотами. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами.
Синтезированы соединения хрома с бором (бориды Cr2B, CrB, Cr3B4, CrB2, CrB4 и Cr5B3), с углеродом (карбиды Cr23C6, Cr7C3 и Cr3C2), c кремнием (силициды Cr3Si, Cr5Si3 и CrSi) и азотом (нитриды CrN и Cr2N).
Соединения Cr(+2)
Степени окисления +2 соответствует основный оксид CrO (чёрный). Соли Cr2+ (растворы голубого цвета) получаются при восстановлении солей Cr3+ или дихроматов цинком в кислой среде («водородом в момент выделения»):
2Cr→2Cr
Все эти соли Cr2+ — сильные восстановители вплоть до того, что при стоянии вытесняют водород из воды. Кислородом воздуха, особенно в кислой среде, Cr2+ окисляется, в результате чего голубой раствор быстро зеленеет.
Коричневый или желтый гидроксид Cr(OH)2 осаждается при добавлении щелочей к растворам солей хрома(II).
Синтезированы дигалогениды хрома CrF2, CrCl2, CrBr2 и CrI2
Соединения Cr(+3)
Степени окисления +3 соответствует амфотерный оксид Cr2O3 и гидроксид Cr(OH)3 (оба — зелёного цвета). Это — наиболее устойчивая степень окисления хрома. Соединения хрома в этой степени окисления имеют цвет от грязно-лилового (ион [Cr(H2O)6]3+) до зелёного (в координационной сфере присутствуют анионы).
Cr3+ склонен к образованию двойных сульфатов вида MICr(SO4)2·12H2O (квасцов)
Гидроксид хрома (III) получают, действуя аммиаком на растворы солей хрома (III):
Cr+3NH+3h3O→Cr(OH)↓+3NH
Можно использовать растворы щелочей, но в их избытке образуется растворимый гидроксокомплекс:
Cr+3OH→Cr(OH)↓
Cr(OH)+3OH→[Cr(OH)]
Сплавляя Cr2O3 со щелочами получают хромиты:
Cr2O3+2NaOH→2NaCrO2+h3O
Непрокаленный оксид хрома(III) растворяется в щелочных растворах и в кислотах:
Cr2O3+6HCl→2CrCl3+3h3O
При окислении соединений хрома(III) в щелочной среде образуются соединения хрома(VI):
2Na[Cr(OH)]+3HO→2NaCrO+2NaOH+8HO
То же самое происходит при сплавлении оксида хрома (III) со щелочью и окислителями, или со щелочью на воздухе (расплав при этом приобретает жёлтую окраску):
2Cr2O3+8NaOH+3O2→4Na2CrO4+4h3O
Соединения хрома (+4)[
При осторожном разложении оксида хрома(VI) CrO3 в гидротермальных условиях получают оксид хрома(IV) CrO2, который является ферромагнетикоми обладает металлической проводимостью.
Среди тетрагалогенидов хрома устойчив CrF4, тетрахлорид хрома CrCl4 существует только в парах.
Соединения хрома (+6)
Степени окисления +6 соответствует кислотный оксид хрома (VI) CrO3 и целый ряд кислот, между которыми существует равновесие. Простейшие из них — хромовая H2CrO4 и двухромовая H2Cr2O7. Они образуют два ряда солей: желтые хроматы и оранжевые дихроматы соответственно.
Оксид хрома (VI) CrO3 образуется при взаимодействии концентрированной серной кислоты с растворами дихроматов. Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую H2CrO4, дихромовую H2Cr2O7 и другие изополикислоты с общей формулой H2CrnO3n+1. Увеличение степени полимеризации происходит с уменьшением рН, то есть увеличением кислотности:
2CrO+2H→Cr2O+h3O
Но если к оранжевому раствору K2Cr2O7 прилить раствор щёлочи, как окраска вновь переходит в жёлтую так как снова образуется хромат K2CrO4:
Cr2O+2OH→2CrO+HO
До высокой степени полимеризации, как это происходит у вольфрама и молибдена, не доходит, так как полихромовая кислота распадается на оксид хрома(VI) и воду:
h3CrnO3n+1→h3O+nCrO3
Растворимость хроматов примерно соответствует растворимости сульфатов. В частности, желтый хромат бария BaCrO4 выпадает при добавлении солей бария, как к растворам хроматов, так и к растворам дихроматов:
Ba+CrO→BaCrO↓
2Ba+CrO+h3O→2BaCrO↓+2H
Образование кроваво-красного малорастворимого хромата серебра используют для обнаружения серебра в сплавах при помощи пробирной кислоты.
Известны пентафторид хрома CrF5 и малоустойчивый гексафторид хрома CrF6. Также получены летучие оксигалогениды хрома CrO2F2 и CrO2Cl2 (хромилхлорид).
Соединения хрома(VI) — сильные окислители, например:
K2Cr2O7+14HCl→2CrCl3+2KCl+3Cl2↑+7h3O
Добавление к дихроматам перекиси водорода, серной кислоты и органического растворителя (эфира) приводит к образованию синего пероксида хрома CrO5L (L — молекула растворителя), который экстрагируется в органический слой; данная реакция используется как аналитическая.
studfiles.net
химия — Стр 21
Фтор имеет аномально низкую температуру кипения (плавления). Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1)[8].
[править]Химические свойства
Самый активный неметалл, бурно взаимодействует почти со всеми веществами кроме, разумеется, фторидов в высших степенях окисления и редких исключений — фторопластов, и с большинством из них — с горением и взрывом. К фтору при комнатной температуре устойчивы некоторые металлы за счет образования плотной плёнки фторида, тормозящей реакцию со фтором — Al, Mg, Cu, Ni. Контакт фтора с водородом приводит к воспламенению и взрыву даже при очень низких температурах (до −252°C). В атмосфере фтора горят даже вода иплатина:
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
Фтор также способен окислять в электрическом разряде кислород, образуя фторид кислорода OF2 и диоксидифторид O2F2.
Во всех соединениях фтор проявляет степень окисления −1. Чтобы фтор проявлял положительную степень окисления, требуется создание эксимерных молекул или иные экстремальные условия. Это требует искусственной ионизации атомов фтора[9].
[править]Хранение
Фтор хранят в газообразном состоянии (под давлением) и в жидком виде (при охлаждении жидким азотом) в аппаратах из никеля и сплавов на его основе (монель-металл), из меди,алюминия и его сплавов, латуни, нержавеющей стали (это возможно потому, что эти металлы и сплавы покрываются непреодолимой для фтора пленкой фторидов[10]).
[править]Применение
[править]Применение в химии
Газообразный фтор используется для получения:
гексафторида урана UF6 из UF4, применяемого для разделения изотопов урана для ядерной промышленности.
трёхфтористого хлора ClF3 — фторирующий агент и мощный окислитель ракетного топлива
шестифтористой серы SF6 — газообразный изолятор в электротехнической промышленности
фторидов металлов (например, W и V), которые обладают некоторыми полезными свойствами
фреонов — хороших хладагентов
тефлонов — химически инертных полимеров
гексафтороалюмината натрия — для последующего получения алюминия электролизом
различных соединений фтора
[править]Ракетная техника
Основная статья: Соединения фтора в ракетной технике
Соединения фтора и сам фтор применяются в ракетной технике как окислители ракетного топлива.
[править]Применение в медицине
Основная статья: Соединения фтора в медицине
Фторированные углеводороды (напр. перфтордекалин) применяются в медицине как кровезаменители. Существует множество лекарств, содержащих фтор в структуре (фторотан, фторурацил и др.).
[править]Биологическая и физиологическая роль
Фтор является жизненно необходимым для организма элементом. В организме человека фтор, в основном, содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариес и флюороз(крапчатость эмали) и остеосаркома, соответственно[11].
Малое содержание фтора разрушает эмаль за счет вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фторидов (натрия и/или олова) или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1-2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30-50% [12].
Предельно допустимая концентрация связанного фтора[13] в воздухе промышленных помещениях равна 0,0005 мг/литр воздуха.
Хром
[править]
Материал из Википедии — свободной энциклопедии
Для термина «Chrome» см. другие значения.
Запрос «Cr» перенаправляется сюда; см. также другие значения.
|
24
| |||||
|
Внешний вид простого вещества | |||||
|
Твёрдый металл голубовато-белого цвета | |||||
|
Свойства атома | |||||
|
Имя, символ, номер |
Хром / Chromium (Cr), 24 | ||||
|
Атомная масса (молярная масса) |
51,9961 а. е. м. (г/моль) | ||||
|
Электронная конфигурация |
[Ar] 3d5 4s1 | ||||
|
Радиус атома |
130 пм | ||||
|
Химические свойства | |||||
|
Ковалентный радиус |
118 пм | ||||
|
Радиус иона |
(+6e)52 (+3e)63 пм | ||||
|
Электроотрицательность |
1,66 (шкала Полинга) | ||||
|
Электродный потенциал |
-0.74 | ||||
|
Степени окисления |
6, 3, 2, 0 | ||||
|
Энергия ионизации (первый электрон) |
652,4 (6,76) кДж/моль (эВ) | ||||
|
Термодинамические свойства простого вещества | |||||
|
Плотность (при н. у.) |
7,19 г/см³ | ||||
|
Температура плавления |
2130 K | ||||
|
Температура кипения |
2945 K | ||||
|
Теплота плавления |
21 кДж/моль | ||||
|
Теплота испарения |
342 кДж/моль | ||||
|
Молярная теплоёмкость |
23,3[1] Дж/(K·моль) | ||||
|
Молярный объём |
7,23 см³/моль | ||||
|
Кристаллическая решётка простого вещества | |||||
|
Структура решётки |
кубическая объёмноцентрированая | ||||
|
Параметры решётки |
2,885 Å | ||||
|
Температура Дебая |
460 K | ||||
|
Прочие характеристики | |||||
|
Теплопроводность |
(300 K) 93,9 Вт/(м·К) | ||||
|
24 |
Хром |
|
Cr 51,996 | |
|
3d54s1 | |
Хром — элемент побочной подгруппы 6-ой группы 4-го периода периодической системы химических элементовД. И. Менделеева, с атомным номером 24. Обозначается символом Cr (лат. Chromium). Простое вещество хром (CAS-номер: 7440-47-3) — твёрдый металл голубовато-белого цвета.
|
Содержание [убрать]
|
[править]История
В 1766 году в окрестностях Екатеринбурга был обнаружен минерал, который получил название «сибирский красный свинец», PbCrO4. Современное название — крокоит. В 1797 французский химик Л. Н. Воклен выделил из него новый тугоплавкийметалл (скорее всего Воклен получил карбид хрома).
[править]Происхождение названия
Название элемент получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
[править]Нахождение в природе
Хром является довольно распространённым элементом (0,02 масс. долей, %). Основные соединения хрома — хромистый железняк (хромит) FeO·Cr2O3. Вторым по значимости минералом является крокоит PbCrO4.
[править]Месторождения
Самые большие месторождения хрома находятся в ЮАР (1 место в мире), Казахстане, России, Зимбабве, Мадагаскаре. Также есть месторождения на территории Турции, Индии, Армении[2], Бразилии, на Филиппинах[3].
Главные месторождения хромовых руд в РФ известны на Урале (Донские и Сарановское).
Разведанные запасы в Казахстане составляют свыше 350 миллионов тонн (2 место в мире)[3].
[править]Геохимия и минералогия
Среднее содержание хрома в различных изверженных породах резко непостоянно. В ультраосновных породах (перидотитах) оно достигает 2 кг/т, в основных породах (базальтах и др.) — 200 г/т, а в гранитах десятки г/т. Кларк хрома в земной коре 83 г/т. Он является типичным литофильным элементом и почти весь заключен в минералах типа хромшпинелидов. Хром вместе с железом, титаном, никелем, ванадием и марганцем составляют одно геохимическое семейство.
Различают три основных минерала хрома: магнохромит (Mn, Fe)Cr2O4, хромпикотит (Mg, Fe)(Cr, Al)2O4 и алюмохромит (Fe, Mg)(Cr, Al)2O4. По внешнему виду они неразличимы и их неточно называют «хромиты». Состав их изменчив:
Cr2O3 18—62 %,
FeO 1—18 %,
MgO 5—16 %,
Al2O3 0,2 — 0,4 (до 33 %),
Fe2O3 2 — 30 %,
примеси TiO2 до 2 %,
V2O5 до 0,2 %,
ZnO до 5 %,
MnO до 1 %; присутствуют также Co, Ni и др.
Собственно хромит, то есть FeCr2O4 сравнительно редок. Помимо различных хромитов, хром входит в состав ряда других минералов — хромовой слюды (фуксита), хромового хлорита, хромвезувиана, хромдиопсида, хромтурмалина, хромового граната (уваровита) и др., которые нередко сопровождают руды, но сами промышленного значения не имеют. В экзогенных условиях хром, как и железо, мигрирует в виде взвесей и может накапливаться в глинах. Наиболее подвижной формой являются хроматы.
[править]Получение
Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 (хромит железа). Из него получают феррохром восстановлением в электропечах коксом (углеродом):
Феррохром применяют для производства легированных сталей.
Чтобы получить чистый хром, реакцию ведут следующим образом:
1) сплавляют хромит железа с карбонатом натрия (кальцинированная сода) на воздухе:
2) растворяют хромат натрия и отделяют его от оксида железа;
3) переводят хромат в дихромат, подкисляя раствор и выкристаллизовывая дихромат;
4) получают чистый оксид хрома восстановлением дихромата натрия углём:
5) с помощью алюминотермии получают металлический хром:
6) с помощью электролиза получают электролитический хром из раствора хромового ангидрида в воде, содержащего добавку серной кислоты. При этом на катодах совершаются в основном 3 процесса:
восстановление шестивалентного хрома до трехвалентного с переходом его в раствор;
разряд ионов водорода с выделением газообразного водорода;
разряд ионов, содержащих шестивалентный хром, с осаждением металлического хрома;
[править]Физические свойства
В свободном виде — голубовато-белый металл с кубической объемно-центрированной решеткой, а = 0,28845 нм. При температуре 39 °C переходит из парамагнитного состояния вантиферромагнитное (точка Нееля).
Хром имеет твердость по шкале Мооса 5.[4] Очень чистый хром достаточно хорошо поддаётся механической обработке.
[править]Химические свойства
[править]Характерные степени окисления
Для хрома характерны степени окисления +2, +3 и +6. (см. табл.) Практически все соединения хрома окрашены[5].
-
Степень окисления
Оксид
Гидроксид
Характер
Преобладающие формы в растворах
Примечания
+2
CrO (чёрный)
Cr(OH)2
Основный
Cr2+ (соли голубого цвета)
Очень сильный восстановитель
+3
Cr2O3(зелёный)
Cr(OH)3
Амфотерный
Cr3+ (зеленые или лиловые соли) [Cr(OH)4]— (зелёный)
+4
CrO2
не существует
Несолеобразующий
—
Встречается редко, малохарактерна
+6
CrO3(красный)
H2CrO4 H2Cr2O7
Кислотный
CrO42- (хроматы, желтые) Cr2O72- (дихроматы, оранжевые)
Переход зависит от рН среды. Сильнейший окислитель, гигроскопичен, очень ядовит.

Диаграмма Пурбе для хрома
[править]Простое вещество
Устойчив на воздухе за счёт пассивирования. По этой же причине не реагирует с серной и азотной кислотами. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами.
Синтезированы соединения хрома с бором (бориды Cr2B, CrB, Cr3B4, CrB2, CrB4 и Cr5B3), с углеродом (карбиды Cr23C6, Cr7C3 и Cr3C2), cкремнием (силициды Cr3Si, Cr5Si3 и CrSi) и азотом (нитриды CrN и Cr2N).
[править]Соединения Cr(+2)
Степени окисления +2 соответствует основный оксид CrO (чёрный). Соли Cr2+ (растворы голубого цвета) получаются при восстановлении солей Cr3+ или дихроматов цинком в кислой среде («водородом в момент выделения»):
Все эти соли Cr2+ — сильные восстановители вплоть до того, что при стоянии вытесняют водород из воды[6]. Кислородом воздуха, особенно в кислой среде, Cr2+ окисляется, в результате чего голубой раствор быстро зеленеет.
Коричневый или желтый гидроксид Cr(OH)2 осаждается при добавлении щелочей к растворам солей хрома(II).
Синтезированы дигалогениды хрома CrF2, CrCl2, CrBr2 и CrI2
[править]Соединения Cr(+3)
Степени окисления +3 соответствует амфотерный оксид Cr2O3 и гидроксид Cr(OH)3 (оба — зелёного цвета). Это — наиболее устойчивая степень окисления хрома. Соединения хрома в этой степени окисления имеют цвет от грязно-лилового (ион [Cr(H2O)6]3+ до зелёного (в координационной сфере присутствуют анионы).
Cr3+ склонен к образованию двойных сульфатов вида MICr(SO4)2·12H2O (квасцов)
Гидроксид хрома (III) получают, действуя аммиаком на растворы солей хрома (III):
Можно использовать растворы щелочей, но в их избытке образуется растворимый гидроксокомплекс:
Сплавляя Cr2O3 со щелочами получают хромиты:
Непрокаленный оксид хрома(III) растворяется в щелочных растворах и в кислотах:
При окислении соединений хрома(III) в щелочной среде образуются соединения хрома(VI):
То же самое происходит при сплавлении оксида хрома (III) со щелочью и окислителями, или со щелочью на воздухе (расплав при этом приобретает жёлтую окраску):
[править]Соединения хрома (+4)
При осторожном разложении оксида хрома(VI) CrO3 в гидротермальных условиях получают оксид хрома(IV) CrO2, который является ферромагнетиком и обладает металлической проводимостью.
Среди тетрагалогенидов хрома устойчив CrF4, тетрахлорид хрома CrCl4 существует только в парах.
[править]Соединения хрома (+6)
Степени окисления +6 соответствует кислотный оксид хрома (VI) CrO3 и целый ряд кислот, между которыми существует равновесие. Простейшие из них — хромовая H2CrO4 и двухромовая H2Cr2O7. Они образуют два ряда солей: желтые хроматы и оранжевые дихроматы соответственно.
Оксид хрома (VI) CrO3 образуется при взаимодействии концентрированной серной кислоты с растворами дихроматов. Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую H2CrO4, дихромовую H2Cr2O7 и другие изополикислоты с общей формулой H2CrnO3n+1. Увеличение степени полимеризации происходит с уменьшением рН, то есть увеличением кислотности:
Но если к оранжевому раствору K2Cr2O7 прилить раствор щёлочи, как окраска вновь переходит в жёлтую так как снова образуется хромат K2CrO4:
До высокой степени полимеризации, как это происходит у вольфрама и молибдена, не доходит, так как полихромовая кислота распадается на оксид хрома(VI) и воду:
Растворимость хроматов примерно соответствует растворимости сульфатов. В частности, желтый хромат бария BaCrO4 выпадает при добавлении солей бария как к растворам хроматов, так и к растворам дихроматов:
Образование кроваво-красного малорастворимого хромата серебра используют для обнаружения серебра в сплавах при помощи пробирной кислоты.
Известны пентафторид хрома CrF5 и малоустойчивый гексафторид хрома CrF6. Также получены летучие оксигалогениды хрома CrO2F2 и CrO2Cl2 (хромилхлорид).
Соединения хрома(VI) — сильные окислители, например:
Добавление к дихроматам перекиси водорода, серной кислоты и органического растворителя (эфира) приводит к образованию синего пероксида хрома CrO5L (L — молекула растворителя), который экстрагируется в органический слой; данная реакция используется как аналитическая.
[править]Применение
Хром — важный компонент во многих легированных сталях (в частности, нержавеющих), а также и в ряде других сплавов. Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование). Хром применяется для производства сплавов: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности.
[править]Биологическая роль и физиологическое действие
Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. У животных хром участвует в обмене липидов, белков (входит в состав ферментатрипсина), углеводов. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
В чистом виде хром довольно токсичен, металлическая пыль хрома раздражает ткани лёгких. Соединения хрома(III) вызывают дерматиты. Соединения хрома(VI) приводят к разным заболеваниям человека, в том числе и онкологическим. ПДК хрома(VI) в атмосферном воздухе 0,0015 мг/м³.
[править]Интересные факты
Основанный на реальных событиях фильм «Эрин Брокович» режиссёра Стивена Содерберга рассказывает о крупном судебном процессе, связанном с загрязнением окружающей среды шестивалентным хромом, в результате которого у многих людей развились серьёзные заболевания.[7]
Цинк
studfiles.net
Элемент хром | Дистанционные уроки
06-Ноя-2012 | комментариев 5 | Лолита Окольнова
За счет большого количества валентных электронов образует большое количество окрашенных соединений.
Электронное строение атома

Как видно из схемы, у d-элемента хрома наблюдается такое явление как «провал электрона» — один электрон с s-орбитали перескакивает на d-орбиталь.
«Провал» электрона — переход электрона с внешнего энергетического уровня на более низкий, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций.
Соответственно, возможные степени окисления хрома:
+6, +4, +3 и +2.
Свойства простого вещества
Хром — типичный металл — блестящий, бело-голубого цвета. Довольно часто встречающийся элемент в минералах земли.
Это малоактивный металл, т.к. на воздухе он покрывается оксидной пленкой
- Взаимодействие с неметаллами:
2Сr + 3F2 = 2CrF3
4Cr + 3O2 = 2Cr2O3 - Взаимодействие с водой (при нагревании):
2Cr + 3h3O = Cr2O3 + 3h3 - Взаимодействие с кислотами
— при н.у. это пассивный металл, ни с серной, ни с азотной кислотой не взаимодействует
— с разбавленной соляной и серной кислотами образует соли хрома (II): Сr + 2HCl = CrCl2 + h3
Оксиды хрома
СrO — оксид хрома (II), (черного цвета) — основной оксид.
Сr(OH)2 — желто-коричневого цвета, быстро окисляется до Cr2O3 или Сr(Oh4).
СrO + 2HCl = CrCl2 + h3O (cоли — голубого цвета)
Cr2O3 — оксид хрома (III), (зеленого цвета) — амфотерный оксид.
Сr2O3 + 2NaOH = 2NaCrO2 + h3O
Cr2O3 + 6HCl = 2CrCl3 + 3h3OСr(OH)3 — амфотерный гидроксид, серо-зеленого цвета.
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Соли Cr(3+) — зеленого цвета
СrO3 — оксид хрома (VI), кислотный оксид, красного цвета.
Образует кислоты: HCrO4 — хромовая кислота и h3Cr2O7 — дихромовая кислота. Это сильные кислоты-окислители.
CrO4(2-) — хроматы — желтого цвета
Сr2O7(2-) — бихроматы — оранжевого цвета
В зависимости от среды (кислой или щелочной) — хроматы и бихроматы переходят друг в друга:
Итого соединения d- элемента хрома, их свойств и цветов можно выразить схемой:
Отсюда, кстати, и название элемента: «хром» — это «цвет»!
У d- элемента — хрома свойства веществ меняются следующим образом:
- вещества, в которых хром в низшей степени окисления, проявляют металлические (основные) свойства;
- в средней степени окисления (+3) — амфотерные;
- вещества с хромом в высшей степени окисления проявляют кислотные свойства.
Категории: |
Обсуждение: «Элемент Хром»
(Правила комментирования)distant-lessons.ru
Cr2O3, степень окисления хрома и кислорода в нем
Общие сведения об оксиде хрома (III) и степени окисления в Cr2O3
Брутто-формула – Cr2O3. Молярная масса – 151,99 г/моль. Температура плавления – 2340oC, кипения – около 3000oC.
Рис. 1. Оксид хрома (III). Внешний вид.
Не реагирует с водой. Химически пассивный, не реагирует с кислотами, щелочами в растворе, гидратом аммиака. Проявляет амфотерные свойства при высокой температуре; реагирует со щелочами, дисульфатом калия. Восстанавливается типичными металлами в жестких условиях, реагирует с сильными окислителями.
Cr2O3, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав оксида хрома (III), сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Степень окисления кислорода в оксидах всегда равна ( — 2). Для нахождения степени окисления хрома примем её значение за «х» и определим его при помощи уравнения электронейтральности:
2×х + 3× (-2)= 0;
2х – 6 = 0;
2х = 6;
x = +3.
Степень окисления хрома в оксиде хрома (III) равна (+3):
Cr+32O-23.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Хром — это… Что такое Хром?
| Внешний вид простого вещества | |
|---|---|
|
Твёрдый металл голубовато-белого цвета |
|
| Свойства атома | |
| Имя, символ, номер |
Хром / Chromium (Cr), 24 |
| Атомная масса (молярная масса) |
51,9961 а. е. м. (г/моль) |
| Электронная конфигурация |
[Ar] 3d5 4s1 |
| Радиус атома |
130 пм |
| Химические свойства | |
| Ковалентный радиус |
118 пм |
| Радиус иона |
(+6e)52 (+3e)63 пм |
| Электроотрицательность |
1,66 (шкала Полинга) |
| Электродный потенциал |
-0.74 |
| Степени окисления |
6, 3, 2, 0 |
| Энергия ионизации (первый электрон) |
652,4 (6,76) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) |
7,19 г/см³ |
| Температура плавления |
2130 K |
| Температура кипения |
2945 K |
| Теплота плавления |
21 кДж/моль |
| Теплота испарения |
342 кДж/моль |
| Молярная теплоёмкость |
23,3[1] Дж/(K·моль) |
| Молярный объём |
7,23 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки |
кубическая |
| Параметры решётки |
2,885 Å |
| Температура Дебая |
460 K |
| Прочие характеристики | |
| Теплопроводность |
(300 K) 93,9 Вт/(м·К) |
Хром — элемент побочной подгруппы шестой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 24. Обозначается символом Cr (лат. Chromium). Простое вещество хром (CAS-номер: 7440-47-3) — твёрдый металл голубовато-белого цвета.
История
В 1766 году в окрестностях Екатеринбурга был обнаружен минерал, который получил название «сибирский красный свинец», PbCrO4. Современное название — крокоит. В 1797 французский химик Л. Н. Воклен выделил из него новый тугоплавкий металл (скорее всего Воклен получил карбид хрома).
Происхождение названия
Название элемент получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
Нахождение в природе
Хром является довольно распространённым элементом (0,02 масс. долей, %). Основные соединения хрома — хромистый железняк (хромит) FeO·Cr2O3. Вторым по значимости минералом является крокоит PbCrO4.
Месторождения
Самые большие месторождения хрома находятся в ЮАР (1 место в мире), Казахстане, России, Зимбабве, Мадагаскаре. Также есть месторождения на территории Турции, Индии, Армении[2], Бразилии, на Филиппинах[3].
Главные месторождения хромовых руд в РФ известны на Урале (Донские и Сарановское).
Разведанные запасы в Казахстане составляют свыше 350 миллионов тонн (2 место в мире)[3].
Геохимия и минералогия
Среднее содержание хрома в различных изверженных породах резко непостоянно. В ультраосновных породах (перидотитах) оно достигает 2 кг/т, в основных породах (базальтах и др.) — 200 г/т, а в гранитах десятки г/т. Кларк хрома в земной коре 83 г/т. Он является типичным литофильным элементом и почти весь заключен в минералах типа хромшпинелидов. Хром вместе с железом, титаном, никелем, ванадием и марганцем составляют одно геохимическое семейство.
Различают три основных минерала хрома: магнохромит (Mn, Fe)Cr2O4, хромпикотит (Mg, Fe)(Cr, Al)2O4 и алюмохромит (Fe, Mg)(Cr, Al)2O4. По внешнему виду они неразличимы и их неточно называют «хромиты». Состав их изменчив:
- Cr2O3 18—62 %,
- FeO 1—18 %,
- MgO 5—16 %,
- Al2O3 0,2 — 0,4 (до 33 %),
- Fe2O3 2 — 30 %,
- примеси TiO2 до 2 %,
- ZnO до 5 %,
- MnO до 1 %; присутствуют также Co, Ni и др.
Собственно хромит, то есть FeCr2O4 сравнительно редок. Помимо различных хромитов, хром входит в состав ряда других минералов — хромовой слюды (фуксита), хромового хлорита, хромвезувиана, хромдиопсида, хромтурмалина, хромового граната (уваровита) и др., которые нередко сопровождают руды, но сами промышленного значения не имеют. В экзогенных условиях хром, как и железо, мигрирует в виде взвесей и может накапливаться в глинах. Наиболее подвижной формой являются хроматы.
Получение
Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 (хромит железа). Из него получают феррохром восстановлением в электропечах коксом (углеродом):
Феррохром применяют для производства легированных сталей.
Чтобы получить чистый хром, реакцию ведут следующим образом:
1) сплавляют хромит железа с карбонатом натрия (кальцинированная сода) на воздухе:
2) растворяют хромат натрия и отделяют его от оксида железа;
3) переводят хромат в дихромат, подкисляя раствор и выкристаллизовывая дихромат;
4) получают чистый оксид хрома восстановлением дихромата натрия углём:
5) с помощью алюминотермии получают металлический хром:
6) с помощью электролиза получают электролитический хром из раствора хромового ангидрида в воде, содержащего добавку серной кислоты. При этом на катодах совершаются в основном 3 процесса:
- восстановление шестивалентного хрома до трехвалентного с переходом его в раствор;
- разряд ионов водорода с выделением газообразного водорода;
- разряд ионов, содержащих шестивалентный хром, с осаждением металлического хрома;
Физические свойства
В свободном виде — голубовато-белый металл с кубической объемно-центрированной решеткой, а = 0,28845 нм. При температуре 39 °C переходит из парамагнитного состояния в антиферромагнитное (точка Нееля).
Хром имеет твердость по шкале Мооса 5.[4] Очень чистый хром достаточно хорошо поддаётся механической обработке.
Химические свойства
Характерные степени окисления
Для хрома характерны степени окисления +2, +3 и +6. (см. табл.) Практически все соединения хрома окрашены[5].
| Степень окисления | Оксид | Гидроксид | Характер | Преобладающие формы в растворах | Примечания |
|---|---|---|---|---|---|
| +2 | CrO (чёрный) | Не существует | Основный | Cr2+ (соли голубого цвета) | Очень сильный восстановитель |
| +3 | Cr2O3(зелёный) | Cr(OH)3 | Амфотерный | Cr3+ (зеленые или лиловые соли) [Cr(OH)4]— (зелёный) |
|
| +4 | CrO2 | не существует | Несолеобразующий | — | Встречается редко, малохарактерна |
| +6 | CrO3(красный) | H2CrO4 H2Cr2O7 |
Кислотный | CrO42- (хроматы, желтые) Cr2O72- (дихроматы, оранжевые) |
Переход зависит от рН среды. Сильнейший окислитель, гигроскопичен, очень ядовит. |
Простое вещество
Устойчив на воздухе за счёт пассивирования. По этой же причине не реагирует с серной и азотной кислотами. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами.
Синтезированы соединения хрома с бором (бориды Cr2B, CrB, Cr3B4, CrB2, CrB4 и Cr5B3), с углеродом (карбиды Cr23C6, Cr7C3 и Cr3C2), c кремнием (силициды Cr3Si, Cr5Si3 и CrSi) и азотом (нитриды CrN и Cr2N).
Соединения Cr(+2)
Степени окисления +2 соответствует основный оксид CrO (чёрный). Соли Cr2+ (растворы голубого цвета) получаются при восстановлении солей Cr3+ или дихроматов цинком в кислой среде («водородом в момент выделения»):
Все эти соли Cr2+ — сильные восстановители вплоть до того, что при стоянии вытесняют водород из воды[6]. Кислородом воздуха, особенно в кислой среде, Cr2+ окисляется, в результате чего голубой раствор быстро зеленеет.
Коричневый или желтый гидроксид Cr(OH)2 осаждается при добавлении щелочей к растворам солей хрома(II).
Синтезированы дигалогениды хрома CrF2, CrCl2, CrBr2 и CrI2
Соединения Cr(+3)
Степени окисления +3 соответствует амфотерный оксид Cr2O3 и гидроксид Cr(OH)3 (оба — зелёного цвета). Это — наиболее устойчивая степень окисления хрома. Соединения хрома в этой степени окисления имеют цвет от грязно-лилового (ион [Cr(H2O)6]3+ до зелёного (в координационной сфере присутствуют анионы).
Cr3+ склонен к образованию двойных сульфатов вида MICr(SO4)2·12H2O (квасцов)
Гидроксид хрома (III) получают, действуя аммиаком на растворы солей хрома (III):
Можно использовать растворы щелочей, но в их избытке образуется растворимый гидроксокомплекс:
Сплавляя Cr2O3 со щелочами получают хромиты:
Непрокаленный оксид хрома(III) растворяется в щелочных растворах и в кислотах:
При окислении соединений хрома(III) в щелочной среде образуются соединения хрома(VI):
То же самое происходит при сплавлении оксида хрома (III) со щелочью и окислителями, или со щелочью на воздухе (рассплав при этом приобретает жёлтую окраску):
Соединения хрома (+4)
При осторожном разложении оксида хрома(VI) CrO3 в гидротермальных условиях получают оксид хрома(IV) CrO2, который является ферромагнетиком и обладает металлической проводимостью.
Среди тетрагалогенидов хрома устойчив CrF4, тетрахлорид хрома CrCl4 существует только в парах.
Соединения хрома (+6)
Степени окисления +6 соответствует кислотный оксид хрома (VI) CrO3 и целый ряд кислот, между которыми существует равновесие. Простейшие из них — хромовая H2CrO4 и двухромовая H2Cr2O7. Они образуют два ряда солей: желтые хроматы и оранжевые дихроматы соответственно.
Оксид хрома (VI) CrO3 образуется при взаимодействии концентрированной серной кислоты с растворами дихроматов. Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую H2CrO4, хромат K2CrO4:
До высокой степени полимеризации, как это происходит у вольфрама и молибдена, не доходит, так как полихромовая кислота распадается на оксид хрома(VI) и воду:
Растворимость хроматов примерно соответствует растворимости сульфатов. В частности, желтый хромат бария BaCrO4 выпадает при добавлении солей бария как к растворам хроматов, так и к растворам дихроматов:
Образование кроваво-красного малорастворимого хромата серебра используют для обнаружения серебра в сплавах при помощи пробирной кислоты.
Известны пентафторид хрома CrF5 и малоустойчивый гексафторид хрома CrF6. Также получены летучие оксигалогениды хрома CrO2F2 и CrO2Cl2 (хромилхлорид).
Соединения хрома(VI) — сильные окислители, например:
Добавление к дихроматам перекиси водорода, серной кислоты и органического растворителя (эфира) приводит к образованию синего пероксида хрома CrO5L (L — молекула растворителя), который экстрагируется в органический слой; данная реакция используется как аналитическая.
Применение
Хром — важный компонент во многих легированных сталях (в частности, нержавеющих), а также и в ряде других сплавов. Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование). Хром применяется для производства сплавов: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности.
Биологическая роль и физиологическое действие
Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
В чистом виде хром довольно токсичен, металлическая пыль хрома раздражает ткани лёгких. Соединения хрома(III) вызывают дерматиты. Соединения хрома(VI) приводят к разным заболеваниям человека, в том числе и онкологическим. ПДК хрома(VI) в атмосферном воздухе 0,0015 мг/м³.
Интересные факты
- Основанный на реальных событиях фильм «Эрин Брокович» режиссёра Стивена Содерберга рассказывает о крупном судебном процессе, связанном с загрязнением окружающей среды шестивалентным хромом, в результате которого у многих людей развились серьёзные заболевания.[7]
См. также
Примечания
Ссылки
| Электрохимический ряд активности металлов | |
|---|---|
|
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2, W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au |
dic.academic.ru