Что такое ОВР в современной химии?
Поговорим о том, что такое ОВР в неорганическом и органическом синтезе.
Определение процесса
Под окислительно-восстановительными реакциями подразумевают такие процессы, в результате которых будет меняться степень окисления у двух или более химических элементов в сложных или простых веществах.

Что такое окисление
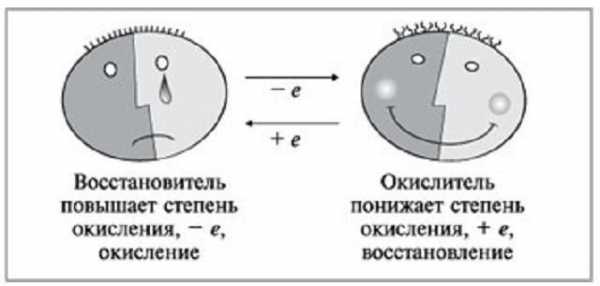
Под окислением подразумевается такая химическая реакция, в процессе которой атом либо определенный ион отдает электроны, при этом понижая свою первоначальную степень окисления. Данный процесс характерен для металлов.
Что такое восстановление
Под процессом восстановления подразумевается химическое превращение, в результате которого будет снижаться степень окисления у иона либо простого вещества, при этом происходит присоединение электронов. Данная реакция характерна для неметаллов и кислотных остатков.
Характеристика восстановителя
Рассматривая вопрос о том, что такое ОВР, нельзя обойти вниманием такое понятие, как «восстановитель».
Под ним подразумевается нейтральная молекула или заряженный ион, который в результате химического взаимодействия будет отдавать другому иону либо атому электрон, при этом повышая свою степень окисления.
Определение окислителя
Рассуждая над тем, что такое ОВР, также важно упомянуть и такой термин, как «окислитель». Под ним принято подразумевать такие ионы либо нейтральные атомы, которые при химическом взаимодействии будут принимать отрицательные электроны от других атомов или нейтральных частиц. При этом его первоначальная степень окисления будет понижаться.
Типы ОВР
Рассуждая над тем, что такое ОВР, необходимо отметить о тех разновидностях данных процессов, которые чаще всего рассматриваются в неорганическом и органическом синтезе.
Межмолекулярные взаимодействия предполагают такие процессы, при которых атомы и восстановителя, и окислителя располагаются в разных исходных веществах, вступающих во взаимодействие. В качестве примера подобного типа превращения можно привести взаимодействие между оксидом марганца (4) и раствором соляной кислоты, в результате которого образуется газообразный хлор, хлорид двухвалентного марганца, а также вода.
В рассматриваемом химическом процессе в качестве восстановителя предстают анионы хлора, окисляющиеся по мере взаимодействия. Катион марганца (со степенью окисления +4) проявляет в реакции окислительные способности, принимая два электрона, восстанавливается.
Внутримолекулярное взаимодействие представляет собой такие химические превращения, по мере которых и атомы восстановителя, и атомы окислителя первоначально являются одним исходным веществом, а после завершения превращения они оказываются в различных продуктах реакции.
В качестве примера такого типа реакции можно представить разложение хлората калия. При нагревании данное вещество будет превращаться в хлорид калия и кислород. Окислительные свойства будут характерны для аниона хлората, который, принимая пять электронов в реакции, будет восстанавливаться, превращаясь в хлорид.
При этом анион кислорода будет проявлять восстановительные свойства, окисляясь до молекулярного кислорода. Так что такое ОВР в данном случае? Это процесс передачи электронов между ионами, приводящий к образованию двух продуктов реакции.
Также к данному виду химических превращений, происходящих с изменением степеней окисления у элементов, первоначально находящихся в одной формуле, относится процесс разложения нитрита аммония. Азот, стоящий в катионе аммония, имея степень окисления -3, в ходе процесса отдает шесть электронов и окисляется до молекулярного азота. А тот азот, который входит в состав нитрита, принимает шесть электронов, при этом является восстановителем, а в ходе реакции он окисляется.
Что такое ОВР в химии? Определение, рассмотренное нами выше, свидетельствует о том, что это превращения, связанные с изменениями у нескольких элементов степеней окисления.
Самоокисление и восстановление (диспропорция) предполагает такие процессы, при протекании которых в качестве восстановителя и окислителя выступает один исходный атом, который будет увеличивать, и одновременно уменьшать свою степень окисления после завершения взаимодействия. Рассуждая над тем, что такое ОВР в химии, примеры подобных превращений можно найти даже в курсе химии средней школы. Разложение сульфита калия при нагревании приводит к образованию двух солей этого металла: сульфида и сульфата. Сера со степенью окисления +4 проявляет и восстановительные, и окислительные свойства, повышая и понижая показатели степени окисления.
Чтобы понять, что означает ОВР в химии, назовем еще один вид таких химических превращений. Контрпропорционирование предполагает такие процессы, в результате которых атомы восстановителя и окислителя находятся в составе разных исходных компонентов, но в правой части они образуют один продукт реакции. Например, при взаимодействии оксида серы (4) с сероводородом будет образовываться сера и вода. Ион серы со степенью окисления +4 будет принимать четыре электрона, а ион серы с показателем -2 лишается двух электронов. В итоге оба они превращаются в простое вещество, у которого степень окисления равна нулю.

Заключение
Рассматривая вопрос о том, что такое ОВР в химии, отметим, что это многочисленные превращения, благодаря которым функционируют живые организмы, происходят разнообразные природные процессы и явления. Для того чтобы расставить в таких уравнениях коэффициенты, нужно составить электронный баланс.
fb.ru
Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) – это реакции, в которых происходит изменение степени окисления элементов, образующих молекулы реагирующих веществ.
Так как изменение степени окисления атома может произойти только в результате присоединения или отдачи электронов, то окислительно-восстановительные реакции можно определить как реакции, в которых происходит переход электронов от одних атомов к другим.
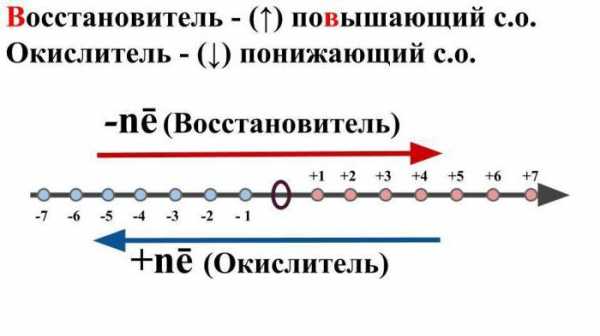
Атомы, молекулы или ионы, отдающие электроны, называются восстановителями, а сам процесс отдачи электронов называется окислением. При окислении степень окисления элемента повышается.
Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями, а процесс присоединения электрона называется восстановлением. При восстановлении степень окисления элемента понижается.
Уравнения, которые выражают процессы окисления и восстановления, называются электронными уравнениями. Окисление всегда сопровождается восстановлением, а восстановление – окислением.
В процессе ОВР восстановитель окисляется, а окислитель – восстанавливается.
Признаки окислительно-восстановительных реакций:
- когда в ней участвуют или в результате ее образуются простые вещества – металлы и неметаллы;
- когда в результате реакции изменяется состав ионов, входящих в состав реагирующих веществ;
- в большинстве случаев, когда число исходных веществ не равно числу продуктов реакции.
Окислительно-восстановительные реакции подчиняются не только закону сохранения массы, но и закону сохранения электрического заряда, согласно которому число электронов, отданных в данной реакции восстановителем, должно равняться числу электронов, присоединенных окислителем.
Поэтому расстановку коэффициентов в уравнениях окислительно — восстановительных реакций осуществляют с таким расчетом, чтобы наступил баланс по электронам.
Автор: Метельский А.В.
Источник: Метельский А.В., Химия в Экзаменационных вопросах и ответах, Минск, изд. «Беларуская энцыклапедыя», 1999 год
Дата в источнике: 1999 год
mplast.by
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ — это… Что такое ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ?
- ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
- ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ, химические реакции, сопровождающиеся переходом электронов от одного вещества (восстановителя) к другому (окислителю). Присоединение электронов называется восстановлением, отдача — окислением. Окислительно-восстановительные реакции протекают, например, при брожении, дыхании, в доменном процессе.
Современная энциклопедия. 2000.
Смотреть что такое «ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ» в других словарях:
окислительно-восстановительные реакции — – химические реакции, сопровождающиеся изменением степеней окисления химических элементов, входящих в состав реагентов. Словарь по аналитической химии [3] … Химические термины
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ — сопровождаются изменением степени окисления атомов, входящих в состав реагирующих веществ, напр.:HCl+5O3+3h3S+4O3 ??HCl 1+3h3S+6O4 вещество, в котором понижается степень окисления атома, т. е. он приобретает электроны (здесь Cl в HClO3),… … Большой Энциклопедический словарь
Окислительно-восстановительные реакции — Окислительно восстановительные реакции, ОВР, редокс (от англ. redox ← reduction oxidation окисление восстановление) это встречно параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав… … Википедия
окислительно-восстановительные реакции — сопровождаются изменением степени окисления атомов, входящих в состав реагирующих веществ, например: . Вещество, в котором понижается степень окисления атома, то есть он приобретает электроны (здесь Cl в HClO3), называется окислителем; если… … Энциклопедический словарь
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ — (р ции окисления восстановления) происходят с изменением степени окисления атомов, входящих в состав реагирующих в в. При окислении в в степень окисления элементов возрастает, при восстановлении понижается. Первоначально окислением называли… … Химическая энциклопедия
Окислительно-восстановительные реакции — в организме, биохимические процессы, при которых происходит перенос электрона или атома водорода (иногда с сопровождающими его атомами или группами) от одной молекулы (окисляемой) к другой (восстанавливаемой). О. в. р. катализируются… … Большая советская энциклопедия
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ — хим. реакции, сопровождающиеся изменением степени окисления атомов, входящих в состав реагирующих в в. В во, в к ром понижается степень окисления атома, т. е. он приобретает электроны (здесь С1 в НСlO3), наз. окислителем; если повышается степень… … Естествознание. Энциклопедический словарь
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ — класс хим. реакций, осуществляющихся за счёт полного или частичного перехода электронов от одних атомов к другим. Отдача электронов наэ. окислением, присоединение электронов восстановлением. Простой пример О. в. р. восстановление меди из её… … Большой энциклопедический политехнический словарь
внутримолекулярные окислительно-восстановительные реакции — – окислительно восстановительные реакции, которые протекают, когда окисляющиеся и восстанавливающиеся атомы находятся в одном веществе. К данному типу относятся реакции диспропорционирования, реакции изомеризации. Общая химия : учебник / А. В.… … Химические термины
Окислительно-восстановительная реакция — Окислительно восстановительные реакции это химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом окислителем и атомом… … Википедия
Книги
- Окислительно-восстановительные реакции. Практикум по химии. 8-11 классы, Асанова А., Стрельникова Е.. Предлагаемое пособие содержит все необходимые сведения для того, чтобы научиться составлять уравнения окислительно-восстановительных реакций, успешно подготовиться к сдаче ЕГЭ или ОГЭ. В… Подробнее Купить за 124 руб
- Окислительно-восстановительные реакции: практикум по химии. 8-11 классы. ФГОС, Асанова Лидия Ивановна, Стрельникова Елена Николаевна. Предлагаемое пособие содержит все необходимые сведения для того, чтобы научиться составлять уравнения окислительно-восстановительных реакций, успешно подготовиться к сдаче ЕГЭ или ОГЭ. В… Подробнее Купить за 116 руб
- Химия. Тесты. 8 класс. Изменения, происходящие с веществами. Растворение. Растворы. Реакции ионного обмена и окислительно-восстановительные реакции. ФГОС, Рябов Михаил Алексеевич. Данное пособие полностью соответствует федеральному государственному образовательному стандарту (второго поколения). Пособие включает тесты, охватывающие две темы учебника О. С. Габриеляна… Подробнее Купить за 107 грн (только Украина)
dic.academic.ru
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ — это… Что такое ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ?
(р-ции окисления-восстановления) происходят с изменением степени окисления атомов, входящих в состав реагирующих в-в. При окислении в-в степень окисления элементов возрастает, при восстановлении — понижается.
Первоначально окислением называли только р-ции в-в с кислородом, восстановлением — отнятие кислорода. С введением в химию электронных представлений понятие О.-в. р. было распространено на р-ции, в к-рых кислород не участвует.
В неорг. химии О.-в. р. формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого (окислителя), напр.:
При этом окислитель восстанавливается, а восстановитель окисляется. При протекании р-ций в гальванич. элементе переход электронов осуществляется по проводнику, соединяющему электроды элемента, и изменение энергии Гиббса DG в данной р-ции м. б. превращено в полезную работу. В отличие от р-ций ионного обмена О.-в. р. в водных р-рах протекают, как правило, не мгновенно.
При О.-в. р. атомы в высшей степени окисления являются только окислителями, в низшей — только восстановителями; атомы в промежут. степени окисления в зависимости от типа р-ции и условий ее протекания м. б. окислителями или восстановителями. Многие О.-в. р.-каталитические (см. Окислительно-восстановительный катализ).
По формальным признакам О.-в. р. разделяют на межмол. (напр., 2SO2 + O2 SO3) и внутримол., напр.:
Последняя р-ция представляет собой самоокисление-самовосстановление (см.
Диспропорционирование).
О.-в. р. часто сопровождаются высоким энерговыделением, поэтому их используют для получения теплоты или электрич. энергии. Наиб. энергичные О.-в. р. протекают при взаимод. восстановителей с окислителями в отсутствие р-рителя; в р-рах такие р-ции м. б. невозможны вследствие окислит.-восстановит. взаимод. одного или обоих реагентов с р-рителем. Так, в водном р-ре нельзя непосредственно провести р-цию 2Na + F
22NaF, поскольку натрий и фтор бурно взаимод. с водой. На окислит.-восстановит. св-ва ионов сильно влияет комплексообразование, напр.: комплекс [Co2+(CN)6]4-, в отличие от гидратир. иона Со 2+, является сильным восстановителем.
В случае О.-в. р. в орг. химии использование обобщенной концепции окисления-восстановления и понятия о степени окисления часто малопродуктивно, особенно при нез-начит. полярности связей между атомами, участвующими в р-ции. В орг. химии окисление рассматривают обычно как процесс, при к-ром в результате перехода электронов от орг. соед. к окислителю возрастает число (или кратность) кислородсодержащих связей (С Ч О, N Ч О, S Ч О и т. п.) либо уменьшается число водородсодержащих связей (С Ч Н, N ЧН, S ЧН и т. п.), напр.: RCHO RCOOH; R
Используют также подход, при к-ром атомам С в молекуле приписывают разл. степени окисления в зависимости от числа связей, образованных с элементом более электроотрицательным, чем водород. В этом случае функцией, производные можно расположить в порядке возрастания их степени окисления. Так, насыщ. углеводороды относят к нулевой группе (приблизит, степень окисления Ч 4), R2C = = CR2, ROH, RCl и RNH2— к первой (- 2), RCCR, R2CO и R2CCl2 — ко второй (0), RCOOH, RCCC1, RCONH2 и RССl3 -к третьей (+2), RCN, CCl4 и СО 2 -к четвертой (+ 4). Тогда окисление-процесс, при к-ром соед. переходит в более высокую категорию, восстановление — обратный процесс.
Механизмы О.-в. р. весьма разнообразны; р-ции могут протекать как по гетеролитическому, так и по гомолитич. механизму. Во мн. случаях начальная стадия р-ции — процесс одноэлектронного переноса. Окисление обычно протекает по положениям с наиб, электронной плотностью, восстановление — по положениям, где электронная плотность минимальна.
В орг. химии используют широкий ряд восстановителей и окислителей, что позволяет выбрать реагент, обладающий селективностью (т. е. способностью действовать избирательно на определенные функц. группы), а также получать продукты в требуемой степени окисления. Напр., борогид-рид Na восстанавливает кетоны или альдегиды до спиртов, не реагируя с амидами и сложными эфирами; LiAlH4 восстанавливает все эти соед. до спиртов. Среди окислителей высокой селективностью обладают, напр., комплекс СгО 3 с пиридином, с высоким выходом окисляющий спирты в кетоны, не затрагивая кратные связи С Ч С, а также SeO2, окисляющий кетоны и альдегиды до a-дикарбонильных соединений.
Селективность О.-в. р. может быть обеспечена и в катали-тич. процессах; напр., в зависимости от катализатора и условий р-ций ацетиленовые углеводороды можно селективно гидрировать до этиленовых или насыщ. углеводородов (см. Гидрирование). Электрохим. восстановление СО 2 до СО в водной среде в присут. никелевого комплекса 1, 4, 8, 11-тетраазациклотетрадекана позволяет проводить желаемый процесс при более низких потенциалах и одновременно подавлять электролиз воды с образованием Н 2. Эта р-ция имеет ключевое значение для превращения СО 2 через СО в разнообразные орг. в-ва.
Каталитич. О.-в. р. играют важную роль в пром-сти, напр.:
О.-в. р. широко распространены в природе и используются в технике. В основе жизни лежат О.-в. р., происходящие при фотосинтезе, дыхании, транспорте электронов; они же обеспечивают осн. часть энергопотребления человечества за счет сжигания орг. топлива. Получение металлов, извлечение энергии взрыва основано на О.-в. р.
Лит.: Хомченко Г. П., Севастьянова К. И., Окислительно-восстановительные реакции, 2 изд., М., 1980; Кери Ф., Сандберг Р., Углубленный курс органической химии, пер. с англ., кн. 2, М., 1981, с. 119-41, 308-43; Марч Дж., Органическая химия, пер. с англ., т. 4, М., 1988, с. 259-341; ТурьяиЯ. И., Окислительно-восстановительные реакции и потенциалы в аналитической химии, М., 1989; Тодрес 3. В., Электронный перенос в органической и металлоорганической химии, в сб.: Итоги науки и техники. Сер. Органическая химия, т. 12, М., 1989. С. И. Дракин, З. В. Тодрес.
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.
dic.academic.ru
Окислительно-восстановительные реакции — это что такое?
Превращение одних веществ в другие с образованием новых соединений называется химической реакцией. Понимание этого процесса имеет огромное значение для жизнедеятельности людей, ведь с его помощью можно получать огромное количество нужных и полезных веществ, которые встречаются в природе в малых количествах или вообще не существуют в натуральном виде. Среди самых важных разновидностей выделяют окислительно-восстановительные реакции (сокращенно ОВР или редокс). Они характеризуются изменением степеней окисления атомов или ионов.
Процессы, протекающие во время реакции
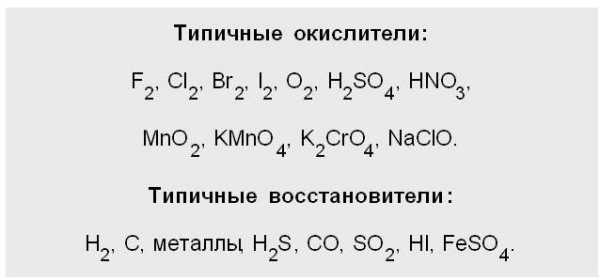
Во время реакции проходят два процесса – окисление и восстановление. Первый из них характеризуется отдачей электронов восстановителями (донорами) с повышением их степени окисления, второй – присоединением электронов окислителями (акцепторами) с понижением степени окисления. В качестве восстановителей чаще всего выступают металлы и соединения неметаллов в низшей степени окисления (сероводород, аммиак). Типичными окислителями являются галогены, азот, кислород, а также вещества, в составе которых есть элемент в высшей степени окисления (азотная или серная кислота). Отдавать или присоединять электроны могут атомы, ионы, молекулы.
До 1777 года существовала гипотеза, что при окислении происходит потеря невидимого горючего вещества, называемого флогистоном. Однако созданная А. Лавуазье теория горения убедила ученых, что окисление происходит при взаимодействии с кислородом, а восстановление — под действием водорода. Только спустя время выяснилось, что не только водород и кислород могут влиять на окислительно-восстановительные реакции.
Окисление
Процесс окисления может происходить в жидкой и газообразной фазе, а также на поверхности твердых веществ. Особую роль играет электрохимическое окисление, происходящее в растворах или расплавах на аноде (электроде, присоединенном к положительному полюсу источника питания). Например, при расплавлении фторидов посредством электролиза (разложения вещества на составные элементы на электродах) получается самый сильный неорганический окислитель – фтор.

Другой классический пример окисления – горение в атмосфере воздуха и чистом кислороде. К этому процессу способны различные вещества: металлы и неметаллы, органические и неорганические соединения. Практическое значение имеет горение топлива, которое в основном представляет собой сложные смеси углеводородов с небольшими количествами кислорода, серы, азота и других элементов.
Классический окислитель – кислород
Простое вещество или химическое соединение, в котором атомы присоединяют электроны, называется окислителем. Классический пример такого вещества – кислород, превращающийся после реакции в оксиды. Но также окислителем в окислительно-восстановительных реакциях является озон, восстанавливающийся до органических веществ (например, кетонов и альдегидов), пероксиды, гипохлориты, хлораты, азотная и серная кислоты, оксид марганца и перманганат. Несложно заметить, что во всех этих веществах содержится кислород.
Другие распространенные окислители
Однако окислительно-восстановительной реакцией является не только процесс, протекающий с участием кислорода. Вместо него окислителем могут выступать галогены, хром и даже катионы металлов и ион водорода (если в результате реакции превращается в простое вещество).
Какое количество электронов будет принято, во многом зависит от концентрации окислителя, а также от активности взаимодействующего с ним металла. Например, при реакции концентрированной азотной кислоты с металлом (цинком) может быть принято 3 электрона, а при взаимодействии тех же веществ при условии, что кислота будет находиться в очень разбавленном виде, уже 8 электронов.
Самые сильные окислители
Все окислители различаются по силе своих свойств. Так, ион водорода обладает невысокой окислительной способностью, тогда как атомарный хлор, образующийся в растворе царской водки (смеси азотной и соляной кислот в соотношении 1:3), способен окислить даже золото и платину.

Аналогичными свойствами обладает концентрированная селеновая кислота. Это делает ее уникальной среди прочих органических кислот. В разбавленном виде она не способна взаимодействовать с золотом, но все равно остается более сильной, чем серная кислота, и может даже окислять другие кислоты, например, соляную.
Другим примером сильного окислителя является перманганат калия. Он успешно взаимодействует с органическими соединениями и способен разрывать прочные углеродные связи. Также высокой активность обладают оксид меди, озонид цезия, надпероксид цезия, а еще дифторид, тетрафторид и гексафторид ксенона. Их окислительная способность обусловлена высоким электродным потенциалом при реакции в разбавленном водном растворе.
Однако есть вещества, у которых этот потенциал еще выше. Среди неорганических молекул самым сильным окислителем является фтор, но он не способен воздействовать на инертный газ ксенон без дополнительного подвода тепла и давления. Зато с этим успешно справляются с гексафторид платины, дифтордиоксид, дифторид криптона, дифторид серебра, соли двухвалентного серебра и некоторые другие вещества. За уникальные способности к окислительно-восстановительным реакциям их относят к очень сильным окислителям.
Восстановление
Первоначально термин «восстановление» был синонимом раскисления, то есть лишения вещества кислорода. Однако со временем слово приобретало новое значение, под ним подразумевалось извлечение металлов из содержащих их соединений, а также любые химические превращения, при которых электроотрицательная часть какого-либо вещества заменяется положительно заряженным элементом, например, водородом.
Сложность осуществления процесса во многом зависит от химического сродства элементов в соединении. Чем оно слабее, тем легче осуществляется реакция. Обычно сродство слабее в эндотермических соединениях (при их образовании поглощается тепло). Их восстановление происходит достаточно просто. Яркий тому пример — взрывчатые вещества.
Для того чтобы пошла реакция с участием экзотермических соединений (образующихся с выделением тепла), нужно приложить сильный источник энергии, например, электрический ток.
Стандартные восстановители
Самый древний и распространенный восстановитель – уголь. Он смешивается с рудными окислами, при накаливании из смеси выделяется кислород, соединяющийся с углеродом. В итоге образуется порошок, гранулы или сплав металла.

Другой обыкновенный восстановитель – водород. С его помощью также можно добывать металлы. Для этого окислы забиваются в трубку, через которую пропускают струю водорода. В основном такой метод применяют к меди, свинцу, олову, никелю или кобальту. Можно применить его и для железа, но восстановление будет неполным и образуется вода. Та же проблема наблюдается при попытках воздействия водородом на окислы цинка, к тому же она усугубляется летучестью металла. Калий и некоторые другие элементы вообще не восстанавливаются с помощью водорода.
Особенности реакций в органической химии
В процессе восстановления частица принимает электроны и тем самым снижает окислительное число одного из своих атомов. Однако определить сущность реакции по изменению степени окисления удобно при участии неорганических соединений, тогда как в органической химии окислительное число вычислить сложно, оно часто имеет дробное значение.
Чтобы ориентироваться в окислительно-восстановительных реакциях с участием органических веществ, нужно запомнить следующее правило: восстановление происходит, когда соединение отдает атомы кислорода и приобретает атомы водорода, и наоборот, окисление характеризуется присоединением кислорода.
Процесс восстановления имеет важное практическое значение для органической химии. Именно он лежит в основе каталитической гидрогенизации, применяемой для лабораторных или промышленных целей, в частности, очистки веществ и систем от примесей углеводородов и кислорода.
Реакция может протекать как при низких показателях температуры и давления (до 100 градусов Цельсия и 1-4 атмосфер соответственно), так и при высоких (до 400 градусов и нескольких сотен атмосфер). Для производства органических веществ требуются сложные приборы, обеспечивающие подходящие условия.
В качестве катализаторов при этом используют активные металлы платиновой группы или недрагоценные никель, медь, молибден и кобальт. Последний вариант более экономичен. Восстановление происходит за счет одновременной сорбции субстрата и водорода с облегчением реакции между ними.

Реакции восстановления протекают и внутри человеческого организма. В одних случаях они могут быть полезными и даже жизненно важными, в других — приводить к серьезным негативным последствиям. Например, азотсодержащие соединения в организме преобразуются в первичные амины, которые, среди прочих полезных функций, составляют белковые вещества, являющиеся строительным материалом тканей. В то же время при употреблении продуктов, окрашенных при помощи анилина, образуются токсичные соединения.
Виды реакций
Какие реакции окислительно-восстановительные, становится понятно, если посмотреть на наличие изменений степеней окисления. Но внутри этого типа химических превращений есть свои разновидности.
Так, если во взаимодействии участвуют молекулы разных веществ, в одно из которых входит атом-окислитель, а в другое восстановитель, реакция считается межмолекулярной. Уравнение окислительно-восстановительной реакции при этом может быть таким:
Fe + 2HCl = FeCl2 + H2.
Из уравнения видно, что степени окисления меняются у железа и водорода, при этом они входят в состав разных веществ.
Но бывают и внутримолекулярные окислительно-восстановительные реакции, при которых в химическом соединении один атом окисляется, а другой восстанавливается, и получаются новые вещества:
2Н2О = 2Н2 + О2.
Более сложный процесс происходит, когда один и тот же элемент выступает донором и акцептором электронов и образует несколько новых соединений, в которые входит в разных степенях окисления. Такой процесс называется дисмутацией или диспропорционированием. Его примером может служить следующее превращение:
4KClO3 = KCl + 3KClO4.
Из приведенного уравнения окислительно-восстановительной реакции видно, что бертолетова соль, в которой хлор находится в степени окисления +5, разлагается на две составляющие – хлорид калия со степенью окисления хлора -1 и перхлорат с окислительным числом +7. Получается, что один и тот же элемент одновременно повысил и понизил свою степень окисления.
Обратной процессу дисмутации является реакция конпропорционирования или репропорционирования. В ней два соединения, в составе которых есть один и тот же элемент в разных степенях окисления, реагируют между собой с образованием нового вещества с единым окислительным числом:
SO2 +2H2S = 3S + 2H2O.
Как видно из приведенных примеров, в некоторых уравнениях перед веществом стоят цифры. Они показывают количество молекул, участвующих в процессе и называются стехиометрическими коэффициентами окислительно-восстановительных реакций. Чтобы составленное уравнение было правильным, нужно знать, как их расставить.
Метод электронного баланса
Баланс при окислительно-восстановительных реакциях всегда сохраняется. Это означает, что окислитель принимает ровно столько электронов, сколько было отдано восстановителем. Чтобы правильно составить уравнение окислительно-восстановительной реакции, нужно следовать такому алгоритму:
- Определить степени окисления элементов до реакции и после нее. Например, в реакции между азотной кислотой и фосфором в присутствии воды получается ортофосфорная кислота и оксид азота: HNO3 + P + H2O = H3PO4 + NO. У водорода во всех соединениях степень окисления +1, а у кислорода -2. У азота до начала реакции окислительное число равно +5, а после ее протекания +2, у фосфора – 0 и +5 соответственно.
- Отметить элементы, в которых окислительное число изменилось (азот и фосфор).
- Составить электронные уравнения: N+5 + 3e = N+2; Р0 — 5е = Р+5.
- Уравнять количество принятых электронов, подобрав наименьшее общее кратное число и вычислив множитель (цифры 3 и 5 являются делителями для числа 15, соответственно множитель для азота равен 5, а для фосфора 3): 5N+5+ (3 х 5)e = 5N+2; 3Р0 — 15е = 3Р+5.
- Сложить полученные полуреакции в соответствии с левой и правой частями: 5N+5 + 3Р0 = 5N+2 — 15е = 3Р+5. Если на этом этапе все сделано правильно, электроны сократятся.
- Переписать уравнение полностью, проставив коэффициенты согласно электронному балансу окислительно-восстановительной реакции:5HNO3 + 3P + H2O = 3H3PO4 + 5NO.
- Проверить, везде ли количество элементов до и после реакции остается одинаковым, и в случае необходимости добавить коэффициенты перед другими веществами (в данном примере не уравнялось количество водорода и кислорода, чтобы уравнение реакции выглядело правильно, нужно добавить коэффициент перед водой): 5HNO3 + 3P + 2H2O = 3H3PO4 + 5NO.
Такой несложный метод позволяет правильно расставить коэффициенты и не допустить путаницы.
Примеры реакций
Наглядным примером окислительно-восстановительной реакции может служить взаимодействие марганца с концентрированной серной кислотой, протекающее по следующей схеме:
Mn + 2H2SO4 = MnSO4 + SO2 + 2 h3O.
Окислительно-восстановительная реакция протекает с изменением степеней окисления марганца и серы. До начала процесса марганец находился в несвязанном состоянии и имел нулевую степень окисления. Но при взаимодействии с серой, входящей в состав кислоты, он повысил степень окисления до +2, таким образом выступив донором электронов. Сера, напротив, сыграла роль акцептора, понизив степень окисления с +6 до +4.

Однако существуют и такие реакции, в которых марганец выступает акцептором электронов. Например, это взаимодействие его оксида с соляной кислотой, протекающее по реакции:
MnO2+4HCl = MnCl2+Cl2+2 h3O.
Окислительно-восстановительная реакция в этом случае протекает с понижением степени окисления марганца с +4 до +2 и повышением степени окисления хлора с -1 до 0.
Раньше большое прикладное значение имело окисление оксида серы оксидом азота в присутствии воды, при котором получалась 75%-ная серная кислота:
SO2 + NO2 + H2O = NO + h3So4.

Окислительно-восстановительная реакция раньше осуществлялась в специальных башнях, и итоговый продукт назывался башенным. Сейчас этот метод далеко не единственный в производстве кислоты, так как существуют и другие современные способы, например, контактный с использованием твердых катализаторов. Но получение кислоты методом окислительно-восстановительной реакции имеет не только промышленное, но и историческое значение, поскольку именно такой процесс самопроизвольно произошел в воздухе Лондона в декабре 1952 года.
Антициклон тогда принес непривычно холодную погоду, и горожане стали использовать очень много угля для обогрева жилища. Поскольку этот ресурс после войны был некачественным, в воздухе сконцентрировалось большое количество диоксида серы, который прореагировал с влагой и оксидом азота в атмосфере. В результате этого явления увеличилась смертность младенцев, пожилых людей и страдающих респираторными заболеваниями. Событию дали название Великого смога.

Таким образом, окислительно-восстановительные реакции имеют большое практическое значение. Понимание их механизма позволяет лучше осознавать природные процессы и добиваться получения новых веществ в лабораторных условиях.
fb.ru
Окислительно-восстановительные реакции — WiKi
Окисли́тельно-восстанови́тельные реа́кции (ОВР), также редокс (сокр. англ. redox, от reduction-oxidation — восстановление-окисление) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления и не более 2 атомов, входящих в состав реагирующих веществ (или ионов веществ), реализующимся путём перераспределения электронов между атомом-окислителем (акцептором) и атомом-восстановителем (донором).
Историческая справка
Издавна ученые полагали, что окисление — это потеря флогистона (особого невидимого горючего вещества), а восстановление — его приобретение. Но, после создания А. Лавуазье в 1777 году кислородной теории горения к началу XIX века, химики стали считать окислением взаимодействие веществ с кислородом, а восстановлением их превращения под действием водорода. Тем не менее в качестве окислителя могут выступать и другие элементы, например
- Fe+2HCl→FeCl2+h3↑{\displaystyle {\mathsf {Fe+2HCl\rightarrow FeCl_{2}+H_{2}\uparrow }}}
В этой реакции окислитель — ион водорода[1] — H+, а железо выступает в роли восстановителя.
В соответствии с электронно-ионной теорией окисления-восстановления, разработанной Л. В. Писаржевским в 1914 г., окисление — процесс отщепления электронов от атомов или ионов элемента, который окисляется; Восстановлением называется процесс присоединения электронов к атомам или ионам элемента, каковой восстанавливается. Например, в реакции
- Zn0+Cl02→Zn+2Cl−12{\displaystyle {\mathsf {{\stackrel {0}{\mbox{Zn}}}+{\stackrel {0}{\mbox{Cl}}}_{2}\rightarrow {\stackrel {+2}{\mbox{Zn}}}{\stackrel {-1}{\mbox{Cl}}}_{2}}}}
атом цинка теряет два электрона, то есть окисляется, а молекула хлора присоединяет их, то есть восстанавливается.
Описание
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.[2]
Окисление
Окисление — процесс отдачи электронов с увеличением степени окисления.
При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части (см. Свободные радикалы). При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель (сам процесс называется окислением):
- восстановитель — e− ↔ сопряжённый окислитель.
Несвязанный, свободный электрон является сильнейшим восстановителем.
Восстановление
Восстановле́ние — процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель (сам процесс называют восстановлением):
- окислитель + e− ↔ сопряжённый восстановитель.
Окислительно-восстановительная пара
Окислитель и его восстановленная форма, либо восстановитель и его окисленная форма составляет сопряжённую окислительно-восстановительную пару, а их взаимопревращения являются окислительно-восстановительными полуреакциями.
В любой окислительно-восстановительной реакции принимают участие две сопряжённые окислительно-восстановительные пары, между которыми имеет место конкуренция за электроны, в результате чего протекают две полуреакции: одна связана с присоединением электронов, то есть восстановлением, другая — с отдачей электронов, то есть окислением.
Виды окислительно-восстановительных реакций
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
- h3S+Cl2→S+2HCl{\displaystyle {\mathsf {H_{2}S+Cl_{2}\rightarrow S+2HCl}}}
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
- 2h3O→2h3+O2{\displaystyle {\mathsf {2H_{2}O\rightarrow 2H_{2}+O_{2}}}}
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
- h3O+Cl2→HCl+HOCl{\displaystyle {\mathsf {H_{2}O+Cl_{2}\rightarrow HCl+HOCl}}}
Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления:
- SO2+2h3S→3S+2h3O{\displaystyle {\mathsf {SO_{2}+2H_{2}S\rightarrow 3S+2H_{2}O}}}
Примеры
Окислительно-восстановительная реакция между водородом и фтором
- H02+F02→2H+1F−1{\displaystyle {\mathsf {{\stackrel {0}{\mbox{H}}}_{2}+{\stackrel {0}{\mbox{F}}}_{2}\rightarrow 2{\stackrel {+1}{\mbox{H}}}{\stackrel {-1}{\mbox{F}}}}}}
Разделяется на две полу-реакции:
1) Окисление:
- h30−2e−→2H+{\displaystyle {\mathsf {{\mbox{H}}_{2}^{0}-2{\mbox{e}}^{-}\rightarrow 2{\mbox{H}}^{+}}}}
2) Восстановление:
- F20+2e−→2F−{\displaystyle {\mathsf {{\mbox{F}}_{2}^{0}+2{\mbox{e}}^{-}\rightarrow 2{\mbox{F}}^{-}}}}
- h30−2e−→2H+{\displaystyle {\mathsf {{\mbox{H}}_{2}^{0}-2{\mbox{e}}^{-}\rightarrow 2{\mbox{H}}^{+}}}}
- S2−−2e−→S0↓{\displaystyle {\mathsf {{\mbox{S}}^{2-}-2{\mbox{e}}^{-}\rightarrow {\mbox{S}}^{0}\downarrow }}}
- Al0−3e−→Al3+{\displaystyle {\mathsf {{\mbox{Al}}^{0}-3{\mbox{e}}^{-}\rightarrow {\mbox{Al}}^{3+}}}}
- Fe2+−e−→Fe3+{\displaystyle {\mathsf {{\mbox{Fe}}^{2+}-{\mbox{e}}^{-}\rightarrow {\mbox{Fe}}^{3+}}}}
- 2Hal−−2e−→Hal20{\displaystyle {\mathsf {2{\mbox{Hal}}^{-}-2{\mbox{e}}^{-}\rightarrow {\mbox{Hal}}_{2}^{0}}}}
Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
- O20+4e−→2O2−{\displaystyle {\mathsf {{\mbox{O}}_{2}^{0}+4{\mbox{e}}^{-}\rightarrow 2{\mbox{O}}^{2-}}}}
- Mn7++5e−→Mn2+{\displaystyle {\mathsf {{\mbox{Mn}}^{7+}+5{\mbox{e}}^{-}\rightarrow {\mbox{Mn}}^{2+}}}}
- Mn4++2e−→Mn2+{\displaystyle {\mathsf {{\mbox{Mn}}^{4+}+2{\mbox{e}}^{-}\rightarrow {\mbox{Mn}}^{2+}}}}
- Cr6++6e−→Cr0{\displaystyle {\mathsf {{\mbox{Cr}}^{6+}+6{\mbox{e}}^{-}\rightarrow {\mbox{Cr}}^{0}}}}
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а атомы или ионы, которые отдают электроны — восстановителями.
Для нахождения пропорции веществ, вступающих в химическую реакцию, часто требуется уравнять ОВР. Уравнивание ОВР сводится к нахождению стехиометрических коэффициентов (то есть, количества молей каждого соединения). Стехиометрические коэффициенты могут принимать только значения целых величин от 1 и выше, дробные стехиометрические коэффициенты допускаются лишь в некоторых случаях записи термохимических уравнениях из курса физической химии. Различают два методы уравнивания ОВР: метод полуреакций и метод электронного баланса. Метод электронного баланса более прост и используется в случае протекания реакции в газообразной среде (например, процессы горения или термического разложения соединений). Метод полуреакций более сложен и используется в случае протекания реакции в жидкой среде. Метод полуреакций оперирует не свободными атомами и одноатомными ионами, а реально существующими в растворе частицами, образовавшимися в результате процессов растворения и/или диссоциации реагирующих веществ. Оба метода занимают важное место в базовом курсе общей и неорганической химии, изучаемом студентами различных учебных заведений[3].
Примечания
- ↑ В этом, как и во многих других случаях водород рассматривают как помещенный в VII группе периодической системы химических элементов над галогенами-окислителями.
- ↑ Несущественно, переходят ли электроны с одного атома на другой вполне (ионная связь) или же только более или менее оттягиваются (полярная ковалентная связь). Поэтому в данном случае мы будем говорить об отдаче или присоединении электронов независимо от действительного типа валентной связи. В общем, окислительно-восстановительные процессы можно определить как реакции, связанные с переходом электронов от одних атомов к другим. То есть валентности [ковалентных молекулярных соединений] в этих реакциях выступают как степени окисления. Более строго, в узком смысле под степенью окисления имеется ввиду в том числе и валентности.
- ↑ ОВР методом полуреакций. Химия и химическая технология в жизни (10.07.2013).
Литература
- Хомченко Г. П., Севастьянова К. И., Окислительно-восстановительные реакции, 2 изд., М., 1980;
- Кери Ф., Сандберг Р., Углубленный курс органической химии, пер. с англ., кн. 2, М., 1981, с. 119-41, 308-43;
- Марч Дж., Органическая химия, пер. с англ., т. 4, М., 1988, с. 259—341;
- Турьяи Я. И., Окислительно-восстановительные реакции и потенциалы в аналитической химии, М., 1989;
- Тодрес 3. В., Электронный перенос в органической и металлоорганической химии, в сб.: Итоги науки и техники. Сер. Органическая химия, т. 12, М., 1989. С. И. Дракин, З. В. Тодрес.
ru-wiki.org
Окислительно-восстановительные реакции — это… Что такое Окислительно-восстановительные реакции?
Окисли́тельно-восстанови́тельные реа́кции, ОВР, редокс (от англ. redox ← reduction-oxidation — окисление-восстановление) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Описание
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.
Окисление
Окисление — процесс отдачи электронов, с увеличением степени окисления.
При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части (см. Свободные радикалы). При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
- окислитель + e− ↔ сопряжённый восстановитель.
Восстановление
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель:
- восстановитель — e− ↔ сопряжённый окислитель.
Несвязанный, свободный электрон является сильнейшим восстановителем.
Окислительно-восстановительная пара
Окислитель и его восстановленная форма, либо восстановитель и его окисленная форма составляет сопряжённую окислительно-восстановительную пару, а их взаимопревращения являются окислительно-восстановительными полуреакциями.
В любой окислительно-восстановительной реакции принимают участие две сопряжённые окислительно-восстановительные пары, между которыми имеет место конкуренция за электроны, в результате чего протекают две полуреакции: одна связана с присоединением электронов, т.е. восстановлением, другая — с отдачей электронов, т.е. окислением.
Виды окислительно-восстановительных реакций
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
- Н2S + Cl2 → S + 2HCl
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
- 2H2O → 2H2 + O2
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
- Cl2 + H2O → HClO + HCl
Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления, например:
- NH4NO3 → N2O + 2H2O
Примеры
Окислительно-восстановительная реакция между водородом и фтором
Разделяется на две полуреакции:
1) Окисление:
2) Восстановление:
Окисление, восстановление
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов — окисление. При окислении степень окисления повышается:
Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а которые отдают электроны — восстановителями.
См. также
Ссылки
dvc.academic.ru
