Характерные химические свойства азота и фосфора.
Химические свойства азота
Химический элемент азот образует только одно простое вещество. Данное вещество является газообразным и образовано двухатомными молекулами, т.е. имеет формулу N2. Не смотря то, что химический элемент азот имеет высокую электроотрицательность, молекулярный азот N2 является крайне инертным веществом. Обусловлен данный факт тем, что в молекуле азота имеет место крайне прочная тройная связь (N≡N). По этой причине практически все реакции с азотом протекают только при повышенных температурах.
Взаимодействие азота с металлами
Единственное вещество, которое реагирует с азотом в обычных условиях – литий:
Интересным является тот факт, что с остальными активными металлами, т.е. щелочными и щелочноземельными, азот реагирует только при нагревании:
Взаимодействие азота с металлами средней и низкой активности (кроме Pt и Au) также возможно, однако требует несравнимо более высоких температур.
А также растворами кислот, например: |
Взаимодействие азота с неметаллами
Азот реагирует с водородом при нагревании в присутствии катализаторов. Реакция является обратимой, поэтому для повышения выхода аммиака в промышленности процесс ведут при высоком давлении:
Как восстановитель азот реагирует со фтором и кислородом. Со фтором реакция идет при действии электрического разряда:
С кислородом реакция идет под действием электрического разряда или при температуре более 2000 оС и является обратимой:
Из неметаллов азот не реагирует с галогенами и серой.
Взаимодействие азота со сложными веществами
В рамках школьного курса ЕГЭ можно считать, что азот не реагирует ни с какими сложными веществами кроме гидридов активных металлов:
Химические свойства фосфора
Существует несколько аллотропных модификаций фосфора., в частности белый фосфор, красный фосфор и черный фосфор.
Белый фосфор образован четырехатомными молекулами P4, не является устойчивой модификацией фосфора. Ядовит. При комнатной температуре мягкий и подобно воску легко режется ножом. На воздухе медленно окисляется, и из-за особенностей механизма такого окисления светится в темноте (явление хемилюминесценции). Даже при слабом нагревании возможно самопроизвольное воспламенение белого фосфора.
Из всех аллотропных модификаций белый фосфор наиболее активен.
Красный фосфор состоит из длинных молекул переменного состава Pn. В некоторых источниках указывается то, что он имеет атомное строение, но корректнее все-таки считать его строение молекулярным. Вследствие особенностей строения является менее активным веществом по сравнению с белым фосфором, в частности в отличие от белого фосфора на воздухе окисляется значительно медленнее и для его воспламенения требуется поджиг.
Черный фосфор состоит из непрерывных цепей Pn и имеет слоистую структуру схожую со структурой графита, из-за чего и внешне похож на него. Данная аллотропная модификация имеет атомное строение. Самый устойчивый из всех аллотропных модификаций фосфора, наиболее химически пассивен. По этой причине, рассмотренные ниже химические свойства фосфора следует относить прежде всего к белому и красному фосфору.
Взаимодействие фосфора с неметаллами
Реакционная способность фосфора является более высокой, чем у азота. Так, фосфор способен гореть после поджига при обычных условиях, образуя кислотный оксид Р2O5:
а при недостатке кислорода оксид фосфора (III):
Реакция с галогенами также протекает интенсивно. Так, при хлорировании и бромировании фосфора в зависимости от пропорций реагентов образуются тригалогениды или пентагалогениды фосфора:
Ввиду существенно более слабых окислительных свойства йода по сравнению с остальными галогенами, возможно окисление фосфора йодом только до степени окисления +3:
В отличие от азота фосфор с водородом не реагирует.
Взаимодействие фосфора с металлами
Фосфор реагирует при нагревании с активными металлами и металлами средней активности образуя фосфиды:
| Фосфиды активных металлов подобно нитридам гидролизуются водой: А также водными растворами кислот-неокислителей: |
Взаимодействие фосфора со сложными веществами
Фосфор окисляется кислотами окислителями, в частности, концентрированными азотной и серной кислотами:
Следует знать, что белый фосфор реагирует с водными растворами щелочей. Однако, ввиду специфичности умение записывать уравнения таких взаимодействий на ЕГЭ по химии пока еще не требовалось.
| Тем не менее, тем, кто претендует на 100 баллов, для собственного спокойствия, можно запомнить следующие особенности взаимодействия фосфора с растворами щелочей на холоду и при нагревании.
На холоду взаимодействие белого фосфора с растворами щелочей протекает медленно. Реакция сопровождается образованием газа с запахом тухлой рыбы — фосфина и соединения с редкой степенью окисления фосфора +1: При взаимодействии белого фосфора с концентрированным раствором щелочи при кипячении выделяется водород и образуется фосфит: |
scienceforyou.ru
С чем реагирует азот?
Молекула может быть и донором, и акцептором электронной пары. Донорные свойства сернистого газа обусловлены присутствием в его молекуле неподеленной электронной пары и проявляются в способности образовывать комплексные соединения, например . В зависимости от природы металла и условий синтеза молекула может присоединяться к атому металла через атом серы или атом кислорода и действовать как концевой или мостиковый () лиганд. Акцепторные свойства сернистого газа связаны с наличием у серы вакантных d-орбиталей, способных принимать пару электронов от основания, например амина. Это лежит в основе обратимой реакции обесцвечивания фуксина — трифенилметанового красителя, содержащего аминогруппы. При кипячении раствора аддукт фуксин разрушается, и раствор приобретает прежнюю окраску.Из простых веществ диоксид серы взаимодействует лишь с кислородом (с образованием триоксида), водными растворами йода и брома, т.е. не образует соединений с азотом.Азот довольно инертное соединение, а потому при комнатной температуре и нормальном давление взаимодействует (с чем реагирует азот) лишь с литием. Нагревание реакционной смеси позволяет ему вступает в реакции и с другими активными металлами. Изменяя условия, можно получить соединения этого неметалла с , , , , и другими веществами.
ru.solverbook.com
Азот | Химия свойства элементов
Общие сведения и методы получения
Азот (N) — при обычных условиях бесцветный газ, не имеющий запаха. Основная составляющая атмосферного воздуха (78,2 % по объему), открыт во второй половине XVIII в., по предложению Лавуазье назван азотом.
Азот —неотъемлемая часть живых организмов. Неорганических соединений, содержащих азот, в природе встречается мало, за исключением так называемой чилийской селитры NaN03. Общее содержание аю-та в земной коре, атмосфере и гидросфере составляет 0,04 %.
Чистый азот в лабораторных условиях обычно получают или термическим разложением его соединений, например нитрата аммония, или пропуская воздух в замкнутом пространстве над раскаленной медью. При этом медь, окисляясь, поглощает весь кислород. Наряду с азотом в газовой фазе остается около 1 % аргона.
Для технических целей азот получают сжижением и фракционированной перегонкой жидкого воздуха, которая основана на разнице температур кипения кислорода (—182,972 °С) и азота (—195,812 °С). При перегонке из жидкого воздуха преимущественно испаряется азот, а оставшийся воздух становится все более насыщенным кислородом. Жидкий азот поставляют потребителю в сосудах Дюара, газообразный — в баллонах.
Физические свойства
Атомные характеристики. Атомный номер 7, атомная масса 14,0067 а. е.м., атомный объем 13,70-10_3 м3/моль. Атомный радиус азота (ковалеит-ный) 0,062 нм. Конфигурация внешних электронных оболочек атома 2s22p3. Азот состоит из двух стабильных изотопов 14 N и 15 N, процентное содержание которых соответственно 99,635 и 0,365 %- Кроме того, известны четыре искусственных радиоактивных изотопа 12 N, l3N, ieN, 17N, период полураспада которых 0,0125; 606; 7,4; 4,14 с соответственно.
При атмосферном давлении и температуре ниже —237,4 °С стабильна а-фаза N2, имеющая кубическую решетку; при 21 К период решетки а = 0,5667 нм. При —237,4 «С происходит полиморфное превращение а=г±В с ДЯ=8,2 кДж/кг. Фаза й обладает гексагональной кристаллической решеткой; при 50 К периоды решетки a = 0,4036 нм, с — 0,6630 нм.
Химические свойства
Высшая степень окисления азота +5, низшая —3. Известна степень окисления азота, равная +2, +4.
В нормальных условиях азот очень инертен, так как состоит из двухатомных молекул N2, между атомами которых существует тройная электронная связь; межатомное расстояние 0,10945 нм. Тройная связь обеспечивает большую устойчивость молекулы азота. Даже при нагреве газа до 2700—3000 °С диссоциация молекул весьма незначительна. Заметное расщепление молекулы азота на атомы происходит под воздействием тлеющего электрического разряда. Атомарный азот химически очень активен. Так, прн комнатной температуре он взаимодействует со ртутью, а также с серой и фосфором. Молекулярный азот практи»
чески не взаимодействует ни с металлами, ни с металлоидами. Исключение составляет только литий. Образование соединения L’i3N медленно протекает в атмосфере азота уже при комнатной температуре.
Имеется несколько соединений азота с водородом. Одно из наиболее практически важных — аммиак. В настоящее время аммиак синтезируют непосредственным переводом свободного азота воздуха в связанное состояние по реакции: N2+3H2**2NH3. Большую роль в процессе синтеза аммиака играют катализаторы — чистое железо, оксид алюминия, оксид калия. Аммиак представляет собой бесцветный газ с очень характерным запахом, хорошо растворимый в воде. При О «С в одном объеме воды растворяется до 1200 объемов газа.
Из других соединений азота с водородом следует отметить гидра-зин N2h5 —бесцветную жидкость с температурой кипения 113,34 °С. Гидразин является хорошим восстановителем. При его горении в атмосфере воздуха или кислорода выделяется большое количество тепла. Гидразин и все его производные сильно ядовиты.
Азидоводород, или азидоводородная кислота, HN3 — бесцветная жидкость с температурой кипения 36 «С. Азидоводород и его соли — азиды — взрывоопасны.
С кислородом азот образует ряд оксидов. Оксид с участием одновалентного азота N20 представляет собой бесцветный газ со слабым запахом, малорастворимый в воде, не реагирующий ии с водой, ни с кислотами, ни со щелочами.
Оксид NO с участием двухвалентного азота представляет собой бесцветный газ с температурой кипения —151,72 °С и затвердевания —163,62 «С.
Диоксид N02 —бурый ядовитый газ, легко сгущается в красноватую жидкость с температурой кипения 20,8 °С и затвердевания — 11 °С. N02 является очень энергичным окислителем, многие вещества могут гореть в атмосфере N02. Оксид, образованный трехвалентным азотом, N2O3, иначе азотистый ангидрид, представляет собой темно-сииюю жидкость, уже при низких температурах разлагающуюся на смесь N0 и N02.
Оксид, образованный пятивалентным азотом, N205, называемый азотным ангидридом, в обычных условиях представляет собой белые кристаллы, постепенно разлагающиеся на N02 и 02. Это очень сильный окислитель, при взаимодействии с которым воспламеняются многие органические вещества. Раствор N2O5 в воде дает азотную кислоту HN03, принадлежащую к числу наиболее сильных кислот; в разбавленных растворах она полностью распадается на иоиы Н+ и N0^».
Соединения азота с электроположительными элементами, главным образом металлами, называются нитридами. Те нитриды, которые по составу можно рассматривать как продукты замещения водорода в аммиаке, например Li3N, Zn3N2 и др., в большинстве случаев разлагаются при воздействии воды с выделением аммиака. Переходные металлы IV— VIA подгрупп образуют с азотом тугоплавкие нитриды, очень стойкие к термическому и другим видам воздействия, находящие широкое применение в технике.
Области применения
Азот, добываемый в промышленности, широко используется в сельском хозяйстве в виде азотсодержащих удобрений, в химической промышленности для синтеза соединений с широким спектром физико-химических свойств.
Чистый азот используют также в качестве нейтральной атмосферы при обработке металлов, а также для упрочнения поверхности изделий
из стали, сплавов титана и т. д. путем диффузионного насыщения, в результате которого образуются нитридные фазы (азотирование). Соединения азота широко применяются в технике в качестве различных тра-вителей иа базе азотной кислоты, а также горючих смесей на базе различных азотводородных соединений. Аммиак является исходным сырьем для производства различных видов азотсодержащих удобрений, азотной кислоты, карбанида и других веществ.
Ряд соединений азота — нитридов тугоплавких металлов — находят применение* технике при создании твердых и упрочнении жаропрочных сплавов.
Азот широко используется в сельском хозяйстве. 5.2.
ibrain.kz
Что такое азот? Масса азота. Молекула азота
Неметаллический элемент 15-й группы [Va] периодической таблицы – азот, 2 атома которого, соединяясь, образуют молекулу, – бесцветный, без запаха и вкуса газ, составляющий большую часть атмосферы Земли и являющийся составной частью всего живого.
История обнаружения
Газ азот составляет около 4/5 земной атмосферы. Он был выделен в ходе ранних исследований воздуха. В 1772 году шведский химик Карл-Вильгельм Шееле первым продемонстрировал, что такое азот. По его мнению, воздух представляет собой смесь двух газов, один из которых он назвал «огненным воздухом», т. к. тот поддерживал горение, а другой – «нечистым воздухом», потому что он оставался после того, как первый расходовался. Это были кислород и азот. Примерно в то же время азот был выделен шотландским ботаником Даниэлем Резерфордом, который первым опубликовал свои выводы, а также британским химиком Генри Кавендишем и британским священнослужителем и ученым Джозефом Пристли, который разделил с Шееле первенство открытия кислорода. Дальнейшие исследования показали, что новый газ входит в состав селитры, или нитрата калия (KNO3), и, соответственно, он был назван нитрогеном («рождающим селитру») французским химиком Шапталем в 1790 г. Азот был впервые отнесен к химическим элементам Лавуазье, чье объяснение роли кислорода в горении опровергло теорию флогистона – популярное в XVIII в. ошибочное представление о горении. Неспособность этого химического элемента поддерживать жизнь (по-гречески ζωή) стала причиной того, что Лавуазье назвал газ азотом.

Возникновение и распространение
Что такое азот? По распространенности химических элементов он занимает шестое место. Атмосфера Земли на 75,51 % по весу и на 78,09 % по объему состоит из этого элемента и является основным его источником для промышленности. В атмосфере также содержится небольшое количество аммиака и солей аммония, а также оксиды азота и азотная кислота, образующиеся во время гроз, а также в двигателях внутреннего сгорания. Свободный азот найден во многих метеоритах, вулканических и шахтных газах и некоторых минеральных источниках, на солнце, в звездах и туманностях.
Азот также встречается в минеральных отложениях нитрата калия и натрия, но для удовлетворения потребностей человека их недостаточно. Другим материалом, богатым этим элементом, является гуано, которое можно найти в пещерах, где много летучих мышей, или в сухих местах, посещаемых птицами. Также азот содержится в дожде и почве в виде аммиака и солей аммония, а в морской воде в виде ионов аммония (NH4+), нитритов (NO2—) и нитратов (NO3—). В среднем он составляет около 16 % сложных органических соединений, таких как белки, присутствующих во всех живых организмах. Естественное его содержание в земной коре составляет 0,3 части на 1000. Распространенность в космосе – от 3 до 7 атомов на атом кремния.
Крупнейшими странами-производителями азота (в виде аммиака) в начале XXI века были Индия, Россия, США, Тринидад и Тобаго, Украина.

Коммерческое производство и использование
Промышленное производство азота основано на фракционной перегонке сжиженного воздуха. Температура его кипения равна -195,8 °С, что на 13 °С ниже, чем у кислорода, который таким образом отделяется. Азот также может быть получен в больших масштабах путем сжигания углерода или углеводородов в воздухе и отделения полученного диоксида углерода и воды из остаточного азота. В малых масштабах чистый азот производится путем нагревания азида бария Ba(N3)2. Лабораторные реакции включают нагрев раствора нитрита аммония (NH4NO2), окисление аммиака водным раствором брома или нагретым оксидом меди:
- NH4++NO2—→N2+2H2O.
- 8NH3+3Br2→N2+6NH4++6Br—.
- 2NH3+3CuO→N2+3H2O+3Cu.
Элементарный азот может быть использован в качестве инертной атмосферы для реакций, требующих исключения кислорода и влаги. Находит применение и жидкий азот. Водород, метан, окись углерода, фтор и кислород – единственные вещества, которые при температуре кипения азота не переходят в твердое кристаллическое состояние.
В химической промышленности этот химический элемент используется для предотвращения окисления или другой порчи продукта, как инертный разбавитель химически активного газа, для удаления тепла или химических веществ, а также в качестве ингибитора пожара или взрыва. В пищевой промышленности газ азот применяется для предотвращения порчи продуктов, а жидкий – для сушки замораживанием и в системах охлаждения. В электротехнической промышленности газ предотвращает окисление и другие химические реакции, создает давление в оболочке кабеля и защищает электродвигатели. В металлургии азот используется при сварке и пайке, предотвращая окисление, обуглероживание и обезуглероживание. Как неактивный газ его применяют в производстве пористой резины, пластмассы и эластомеров, он служит в качестве пропеллента в аэрозольных баллончиках, а также создает давление жидкого топлива в реактивных самолетах. В медицине быстрое замораживание жидким азотом используется для сохранения крови, костного мозга, тканей, бактерий и спермы. Он нашел применение и в криогенных исследованиях.

Соединения
Большая часть азота используется в производстве химических соединений. Тройная связь между атомами элемента настолько сильна (226 ккал на моль, вдвое больше, чем у молекулярного водорода), что молекула азота с трудом вступает в другие соединения.
Основным промышленным методом фиксации элемента является процесс Хабера-Боша для синтеза аммиака, разработанный во время Первой мировой войны, чтобы уменьшить зависимость Германии от чилийской селитры. Он включает прямой синтез NH3 – бесцветного газа с резким, раздражающим запахом – непосредственно из его элементов.
Большая часть аммиака превращается в азотную кислоту (HNO3) и нитраты – соли и сложные эфиры азотной кислоты, кальцинированную соду (Na2CO3), гидразин (N2H4) – бесцветную жидкость, используемую в качестве ракетного топлива и во многих промышленных процессах.
Азотная кислота является другим основным коммерческим соединением данного химического элемента. Бесцветная, высококоррозионная жидкость используется в производстве удобрений, красителей, лекарственных средств и взрывчатых веществ. Нитрат аммония (NH4NO3) – соль аммиака и азотной кислоты – является наиболее распространенным компонентом азотных удобрений.

Азот + кислород
С кислородом азот образует ряд оксидов, в т. ч. закись азота (N2O), в которой его валентность равна +1, окись (NO) (+2) и двуокись (NO2) (+4). Многие оксиды азота чрезвычайно летучи; они являются главными источниками загрязнения в атмосфере. Закись азота, также известная как веселящий газ, иногда используется в качестве анестезирующего средства. При вдыхании она вызывает мягкую истерию. Оксид азота быстро реагирует с кислородом с образованием коричневого диоксида, промежуточного продукта в производстве азотной кислоты и мощного окислителя в химических процессах и ракетном топливе.
Также используются некоторые нитриды, образованные соединением металлов с азотом при повышенных температурах. Нитриды бора, титана, циркония и тантала имеют специальные применение. Одна кристаллическая форма нитрида бора (BN), например, по твердости не уступает алмазу и плохо окисляется, поэтому используется в качестве высокотемпературного абразива.
Неорганические цианиды содержат группу CN—. Цианистый водород, или синильная кислота HCN, является крайне неустойчивым и чрезвычайно токсичным газом, который применяется для фумигации, концентрации руды, в других промышленных процессах. Дициан (CN)2 используется в качестве промежуточного химического вещества и для фумигации.
Азиды представляют собой соединения, которые содержат группу из трех атомов азота -N3. Большинство их неустойчиво и очень чувствительно к ударам. Некоторые из них, такие как азид свинца Pb(N3)2, используются в детонаторах и капсюлях. Азиды, подобно галогенам, охотно взаимодействуют с другими веществами и образуют множество соединений.
Азот входит в состав нескольких тысяч органических соединений. Большинство из них являются производными от аммиака, цианистого водорода, циана, закиси или азотной кислоты. Амины, аминокислоты, амиды, например, получены из аммиака или тесно связаны с ним. Нитроглицерин и нитроцеллюлоза – сложные эфиры азотной кислоты. Нитриты получают из азотистой кислоты (HNO2). Пурины и алкалоиды являются гетероциклическими соединениями, в которых азот замещает один или несколько атомов углерода.

Свойства и реакции
Что такое азот? Это бесцветный газ без запаха, который конденсируется при -195,8 °С в бесцветную, маловязкую жидкость. Элемент существует в виде молекул N2, представляемых в виде :N:::N:, у которых энергия связи, равная 226 ккал на моль, уступает только окиси углерода (256 ккал на моль). По этой причине энергия активации молекулярного азота очень высока, поэтому в обычных условиях элемент относительно инертен. Кроме того, высокостабильная молекула азота в значительной степени способствует термодинамической неустойчивости многих азотсодержащих соединений, в которых связи, пусть и достаточно сильные, но уступают связям молекулярного азота.
Относительно недавно и неожиданно была открыта способность молекул азота служить в качестве лигандов в комплексных соединениях. Наблюдение того, что некоторые растворы комплексов рутения могут поглощать атмосферный азот, привело к тому, что вскоре может быть найден более простой и лучший способ фиксации этого элемента.
Активный азот можно получить путем пропускания газа низкого давления через высоковольтный электрический разряд. Продукт светится желтым светом и гораздо охотнее вступает в реакции, чем молекулярный, с атомарным водородом, серой, фосфором и различными металлами, а также способен разлагать NO до N2 и O2.
Более ясное представление о том, что такое азот, можно получить благодаря его электронной структуре, которая имеет вид 1s22s22p3. Пять электронов внешних оболочек слабо экранируют заряд, в результате чего эффективный ядерный заряд ощущается на расстоянии ковалентного радиуса. Атомы азота относительно невелики и обладают высокой электроотрицательностью, располагаясь между углеродом и кислородом. Электронная конфигурация включает три полузаполненные внешние орбитали, позволяющие образовывать три ковалентные связи. Поэтому атом азота должен обладать чрезвычайно высокой реакционной способностью, образуя с большинством других элементов стабильные бинарные соединения, особенно когда другой элемент существенно отличается электроотрицательностью, придающей значительную полярность связям. Когда электроотрицательность другого элемента ниже, полярность придает атому азота частичный отрицательный заряд, что освобождает его неразделенные электроны для участия в координационных связях. Когда другой элемент более электроотрицателен, частично положительный заряд азота существенно ограничивает донорные свойства молекулы. При малой полярности связи, вследствие равной электроотрицательности другого элемента, множественные связи превалируют над одиночными. Если несоответствие атомных размеров препятствует образованию множественных связей, то образованная простая связь, вероятно, будет относительно слабой, и соединение будет неустойчивым.
Аналитическая химия
Часто процент азота в газовой смеси может быть определен путем измерения ее объема после поглощения других компонентов химическими реагентами. Разложение нитратов серной кислотой в присутствии ртути высвобождает окись азота, которая может быть измерена в виде газа. Азот высвобождается из органических соединений, когда они сгорают над окисью меди, а свободный азот может быть измерен в виде газа после поглощения других продуктов сгорания. Хорошо известный метод Кьельдаля по определению содержания рассматриваемого нами вещества в органических соединениях заключается в разложении соединения концентрированной серной кислотой (в случае необходимости содержащей ртуть, или ее оксид, а также различные соли). Таким образом азот преобразуется в сульфат аммония. Добавление гидроксида натрия высвобождает аммиак, который собирают обычной кислотой; остаточное количество непрореагировавшей кислоты затем определяется титрованием.

Биологическое и физиологическое значение
Роль азота в живой материи подтверждает физиологическую активность его органических соединений. Большинство живых организмов не может использовать этот химический элемент непосредственно и должно иметь доступ к его соединениям. Поэтому фиксация азота имеет огромное значение. В природе это происходит в результате двух основных процессов. Одним из них является действие электрической энергии на атмосферу, благодаря чему молекула азота и кислорода диссоциируют, что позволяет свободным атомам образовать NO и NO2. Двуокись затем вступает в реакцию с водой: 3NO2+H2O→2HNO3+NO.
HNO3 растворяется и приходит на Землю с дождем в виде слабого раствора. Со временем кислота становится частью комбинированного азота почвы, где нейтрализуется, образуя нитриты и нитраты. Содержание N в культивируемых почвах, как правило, восстанавливается благодаря внесению удобрений, содержащих нитраты и аммонийные соли. Выделения животных и растений и их разложение возвращает соединения азота в почву и воздух.
Другим основным процессом естественной фиксации является жизнедеятельность бобовых. Благодаря симбиозу с бактериями эти культуры способны превращать атмосферный азот непосредственно в его соединения. Некоторые микроорганизмы, такие как Azotobacter Chroococcum и Clostridium pasteurianum, способны фиксировать N самостоятельно.
Сам газ, будучи инертным, безвреден, за исключением случая, когда им дышат под давлением, и он растворяется в крови и других жидкостях тела в более высоких концентрациях. Это вызывает наркотический эффект, а если давление снижается слишком быстро, избыток азота выделяется в виде пузырьков газа в различных местах организма. Это может вызвать боль в мышцах и суставах, обмороки, частичный паралич и даже смерть. Эти симптомы называются декомпрессионной болезнью. Поэтому те, кто вынужден дышать воздухом в таких условиях, должны очень медленно снижать давление до нормального, чтобы избыток азота выходил через легкие без образования пузырьков. Лучшей альтернативой является использование для дыхания смеси кислорода и гелия. Гелий гораздо менее растворим в жидкостях организма, и опасность уменьшается.
Изотопы
Азот существует в виде двух стабильных изотопов: 14N (99,63 %) и 15N (0,37 %). Они могут быть разделены с помощью химического обмена или путем термической диффузии. Масса азота в виде искусственных радиоактивных изотопов находится в пределах 10-13 и 16-24. Наиболее стабильный период полураспада, равный 10 минутам. Первая искусственно индуцированная ядерная трансмутация была произведена в 1919 г. британским физиком Эрнестом Резерфордом, который, бомбардируя азот-14 альфа-частицами, получил ядра кислорода-17 и протоны.
Свойства
Напоследок перечислим основные свойства азота:
- Атомный номер: 7.
- Атомная масса азота: 14,0067.
- Температура плавления: -209,86 °C.
- Точка кипения: -195,8 °C.
- Плотность (1 атм, 0 °С): 1,2506 г азота на литр.
- Обычные состояния окисления: -3, +3, +5.
- Конфигурация электронов: 1s22s22p3.
fb.ru
Азот — Мегаэнциклопедия Кирилла и Мефодия — статья
Азо́т (лат. Nitrogenium — рождающий селитры), N (читается «эн»), химический элемент второго периода VA группы периодической системы, атомный номер 7, атомная масса 14, 0067. В свободном виде — газ без цвета, запаха и вкуса, плохо растворим в воде. Состоит из двухатомных молекул N
NaNO2 + NH4Cl = NaCl + N2 + 2H2O.
Можно также нагревать твердый нитрит аммония:
NH4NO2 = N2 + 2H2O.
Плотность газообразного азота при 0 °C 1, 25046 г/дм3, жидкого азота (при температуре кипения) — 0, 808 кг/дм3. Газообразный азот при нормальном давлении при температуре –195, 8 °C переходит в бесцветную жидкость, а при температуре –210, 0 °C — в белое твердое вещество. В твердом состоянии существует в виде двух полиморфных модификаций: ниже –237, 54 °C устойчива форма с кубической решеткой, выше — с гексагональной.
Критическая температура азота –146, 95 °C, критическое давление 3, 9МПа, тройная точка лежит при температуре –210, 0 °C и давлении 125, 03 гПа, из чего следует, что азот при комнатной температуре ни при каком, даже очень высоком давлении, нельзя превратить в жидкость.
Теплота испарения жидкого азота 199, 3 кДж/кг (при температуре кипения), теплота плавления азота 25, 5 кДж/кг (при температуре –210 °C).
Энергия связи атомов в молекуле N2 очень велика и составляет 941, 6 кДж/моль. Расстояние между центрами атомов в молекуле 0, 110 нм. Это свидетельствует о том, что связь между атомами азота тройная. Высокая прочность молекулы N2 может быть объяснена в рамках метода молекулярных орбиталей. Энергетическая схема заполнения молекулярных орбиталей в молекуле N2 показывает, что электронами в ней заполнены только связывающие σ- и π-орбитали. Молекула азота немагнитна (диамагнитна).
Из-за высокой прочности молекулы N2процессы разложения различных соединений азота (в том числе и печально знаменитого взрывчатого вещества гексогена) при нагревании, ударах и т. д. приводят к образованию молекул N2. Так как объем образовавшегося газа значительно больше, чем объем исходного взрывчатого вещества, гремит взрыв.Химически азот довольно инертен и при комнатной температуре реагирует только с металлом литием с образованием твердого нитрида лития Li3N. В соединениях проявляет различные степени окисления (от –3 до +5). С водородом образует аммиак NH3. Косвенным путем (не из простых веществ) получают гидразин N2H4 и азотистоводородную кислоту HN3. Соли этой кислоты — азиды. Азид свинца Pb(N3)2 разлагается при ударе, поэтому его используют как детонатор, например, в капсюлях патронов.Известно несколько оксидов азота. С галогенами азот непосредственно не реагирует, косвенными путями получены NF3, NCl3, NBr3 и NI3, а также несколько оксигалогенидов (соединений, в состав которых, кроме азота, входят атомы и галогена, и кислорода, например, NOF3).Галогениды азота неустойчивы и легко разлагаются при нагревании (некоторые — при хранении) на простые вещества. Так, NI3 выпадает в осадок при сливании водных растворов аммиака и иодной настойки. Уже при легком сотрясении сухой NI3 взрывается:
2NI3 = N2 + 3I2.
Азот не реагирует с серой, углеродом, фосфором, кремнием и некоторыми другими неметаллами.
При нагревании азот реагирует с магнием и щелочноземельными металлами, при этом возникают солеобразные нитриды общей формулы М3N2, которые разлагаются водой с образованием соответствующих гидроксидов и аммиака, например:
Са3N2 + 6H2O = 3Ca(OH)2 + 2NH3.
Аналогично ведут себя и нитриды щелочных металлов. Взаимодействие азота с переходными металлами приводит к образованию твердых металлоподобных нитридов различного состава. Например, при взаимодействии железа и азота образуются нитриды железа состава Fe2N и Fe4N. При нагревании азота с ацетиленом C2H2 может быть получен цианистый водород HCN.
В промышленности газ азот используют главным образом для получения аммиака. Как химически инертный газ азот применяют для обеспечения инертной среды в различных химических и металлургических процессах, при перекачке горючих жидкостей. Жидкий азот широко используют как хладагент, его применяют в медицине, особенно в косметологии. Важное значение в поддержании плодородия почв имеют азотные минеральные удобрения.- Справочник азотчика. М., 1969.
- Химическая энциклопедия / Гл. ред. И. Л. Кнунянц. М., 1988. Т. 1.
- Некрасов Б. В. Основы общей химии. М., 1973.
- Проблемы фиксации азота. Неорганическая и физическая химия. М., 1982.
megabook.ru
характеристика, химические свойства, физические свойства, соединения, место в природе.
АЗОТ, N (лат. Nitrogenium * а. nitrogen; н. Stickstoff; ф. azote, nitrogene; и. nitrogeno), — химический элемент V группы периодической системы Менделеева, атомный номер 7, атомная масса 14,0067. Открыт в 1772 английским исследователем Д. Резерфордом.
Свойства азота
При обычных условиях азот — газ без цвета и запаха. Природный азот состоит из двух стабильных изотопов: 14N (99,635%) и 15N (0,365%). Молекула азота двухатомная; атомы связаны ковалентной тройной связью NN. Диаметр молекулы азота, определённый разными способами, 3,15-3,53 А. Молекула азота очень устойчива — энергия диссоциации 942,9 кДж/моль.
Молекулярный азот
Константы молекулярного азота: f плавления — 209,86°С, f кипения — 195,8°С; плотность газообразного азота 1,25 кг/ м3, жидкого — 808 кг/м3.
Характеристика азота
В твёрдом состоянии азот существует в двух модификациях: кубической а-форме с плотностью 1026,5 кг/м3 и гексагональной b-форме с плотностью 879,2 кг/м3. Теплота плавления 25,5 кДж/кг, теплота испарения 200 кДж/кг. Поверхностное натяжение жидкого азота в контакте с воздухом 8,5•10-3 Н/м; диэлектрическая проницаемость 1,000538. Растворимость азота в воде (см3 на 100 мл Н2О): 2,33 (0°С), 1,42 (25°С) и 1,32 (60°С). Внешняя электронная оболочка атома азота состоит из 5 электронов. Степени окисления азота меняются от 5 (в N2О5) до -3 (в NH3).
Соединение азота
Азот при нормальных условиях может реагировать с соединениями переходных металлов (Ti, V, Mo и др.), образуя комплексы либо восстанавливаясь с образованием аммиака и гидразина. С такими активными металлами, как литий, кальций, магний, азот взаимодействует при нагревании до сравнительно невысоких температур. С большинством других элементов азот реагирует при высокой температуре и в присутствии катализаторов. Хорошо изучены соединения азота с кислородом: N2О, NO, N2О5. С водородом азот соединяется только при высокой температуре и в присутствии катализаторов; при этом образуется аммиак NH3. С галогенами азот непосредственно не взаимодействует; поэтому все галогениды азота получают только косвенным путём, например фтористый азот NF3 — при взаимодействии фтора с аммиаком. С серой также не происходит непосредственного соединения азота. При взаимодействии раскалённого кокса с азотом образуется циан (CN)2. При действии на обычный азот электрических разрядов, а также при электрических разрядах в воздухе может образоваться активный азот, представляющий собой смесь молекул и атомов азота, обладающих повышенным запасом энергии. Активный азот весьма энергично взаимодействует с кислородом, водородом, парами серы, фосфором и некоторыми металлами.
Азот — один из самых распространённых элементов на Земле, причём основная его масса (около 4•1015 т) сосредоточена в свободном состоянии в атмосфере. Ежегодно при вулканической деятельности в атмосферу выделяется 2•106 т азота. Незначительная часть азота концентрируется в литосфере (среднее содержание в литосфере 1,9•10-3%). Природные соединения азота — хлористый аммоний и различные нитраты (селитры). Нитриды азота могут образовываться только при высоких температурах и давлениях, что, по-видимому, имело место на самых ранних стадиях развития Земли. Крупные скопления селитры встречаются только в условиях сухого пустынного климата (Чили, Индия, Египет, Испания и др.). Небольшие количества связанного азота находятся в каменном угле (1-2,5%) и нефти (0,02-1,5%), а также в водах рек, морей и океанов. Азот накапливается в почвах (0,1 %) и живых организмах (0,3%). Азот входит в состав белковых молекул и многих естественных органических соединений.
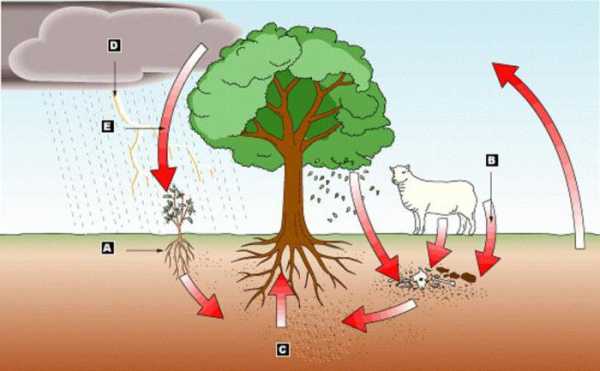
Круговорот азота в природе
В природе осуществляется круговорот азота, который включает цикл молекулярного атмосферного азота в биосфере, цикл в атмосфере химически связанного азота, круговорот захоронённого с органическим веществом поверхностного азота в литосфере с возвратом его обратно в атмосферу. Азот для промышленности ранее добывался целиком из месторождений природных селитр, число которых в мире весьма ограничено. Особенно крупные залежи азота в виде азотнокислого натрия находятся в Чили; добыча селитры в отдельные годы составляла более 3 млн. т.
Применение азота
Азот получают главным образом разделением предварительно сжиженного воздуха, который затем подвергается разгонке. Основная часть получаемого азота используется для производства аммиака, который затем перерабатывается на азотную кислоту, удобрения, взрывчатые вещества. Свободный азот применяют во многих отраслях промышленности как инертную среду при разнообразных химических и металлургических процессах. Жидкий азот находит применение в различных холодильных установках. Ведутся работы по использованию жидкого азота для замораживания неустойчивых пород (главным образом глинистых) при проходке шахтных стволов, в качестве безопасного энергоносителя для шахтных машин, а также для борьбы с рудничными пожарами, где применение азота позволяет резко снизить содержание кислорода в очаге пожара. При разработке нефтяных месторождений закачиванием азота в нефтяные пласты эффективно вытесняют нефть после заводнения. Азот используется также для поддержания давления в скважинах при бурении.
www.mining-enc.ru
это что за вещество? Типы и свойства азота
Азот — это всем известный химический элемент, который обозначается буквой N. Этот элемент, пожалуй, основа неорганической химии, его начинают подробно изучать еще в 8 классе. В данной статье мы рассмотрим данный химический элемент, а также его свойства и типы.
История открытия химического элемента
Азот — это элемент, который впервые был представлен знаменитым французским химиком Антуаном Лавуазье. Но за звание первооткрывателя азота борются многие ученые, среди них и Генри Кавендиш, Карл Шееле, Даниэль Резерфорд.
Генри Кавендиш в результате опыта первым выделил химический элемент, но так и не понял, что он получил простое вещество. О своем опыте он сообщил Джозефу Пристли, который тоже проделывал ряд исследований. Вероятно, Пристли тоже удалось выделить этот элемент, но ученый не смог понять, что именно он получил, поэтому не заслужил звание первооткрывателя. Карл Шееле одновременно с ними проводил те же исследования, но не пришел к нужному выводу.
В том же году Даниэль Резерфорд сумел не только получить азот, но и описать его, опубликовать диссертацию и указать основные химические свойства элемента. Но даже Резерфорд так до конца и не понял, что он получил. Однако именно его считают первооткрывателем, потому что он был ближе всех к разгадке.

Происхождение названия азота
С греческого «азот» переводится как «безжизненный». Именно Лавуазье трудился над правилами номенклатуры и решил так назвать элемент. В 18 веке про этот элемент было известно лишь то, что он не поддерживает ни реакций горения, ни дыхания. Поэтому данное название приняли.
В латинском языке азот называется «нитрогениум», что в перевод означает «рождающий селитру». Из латинского языка и появилось обозначение азота — буква N. Но само название во многих странах не прижилось.
Распространенность элемента
Азот — это, пожалуй, один из самых распространенных элементов на нашей планете, он занимает четвертое место по распространенности. Элемент также найден в солнечной атмосфере, на планетах Уран и Нептун. Из азота состоят атмосферы Титана, Плутона и Тритона. Помимо этого, атмосфера Земли состоит на 78-79 процентов из этого химического элемента.
Азот играет важную биологическую роль, ведь он необходим для существования растений и животных. Даже тело человека содержит от 2 до 3 процентов этого химического элемента. Входит в состав хлорофилла, аминокислот, белков, нуклеиновых кислот.

Жидкий азот
Жидкий азот — это бесцветная прозрачная жидкость, является одним из агрегатных состояний химического вещества. Жидкий азот широко используется в промышленности, строительстве и медицине. Он используется при заморозке органических материалов, охлаждения техники, а в медицине для удаления бородавок (эстетическая медицина).
Жидкий азот не токсичен, а также не взрывоопасен.
Молекулярный азот
Молекулярный азот — это элемент, который содержится в атмосфере нашей планеты и образует большую ее часть. Формула молекулярного азота — N2. Такой азот вступает в реакции с другими химическими элементами или веществами только при очень высокой температуре.
Физические свойства
При нормальных условиях химический элемент азот — это газ, который не имеет запаха, цвета, а также практически не растворим в воде. Азот жидкий по своей консистенции напоминает воду, такой же прозрачный и бесцветный. У азота есть еще одно агрегатное состояние, при температуре ниже -210 градусов он превращается в твердое тело, образует много больших белоснежных кристаллов. Поглощает кислород из воздуха.
Химические свойства
Азот относится к группе неметаллов и перенимает свойства у других химических элементов из этой группы. Как правило, неметаллы не являются хорошими проводниками электричества. Азот образует различные оксиды, например NO (моноокисид). NO или окись азота является мышечным релаксантом (вещество, которое значительно расслабляет мускулатуру и при этом не оказывает никакого вреда и иных влияний на организм человека). Оксиды, где содержится больше атомов азота, например N2O — это веселящий газ, чуть-чуть сладковатый на вкус, который используется в медицине как анестезирующее средство. Однако уже оксид NO2 не имеет никакого отношения к первым двум, ведь это довольно вредный выхлопной газ, который содержится в выхлопах автомобилей и серьезно загрязняет атмосферу.
Азотная кислота, которую образуют атомы водорода, азота и три атома кислорода, является сильной кислотой. Ее широко используют в производстве удобрений, в ювелирном деле, органическом синтезе, военной промышленности (производство взрывчатых веществ, ракетного топлива и синтеза отравляющих веществ), производстве красителей, лекарств и др. Азотная кислота очень вредна для организма человека, на коже оставляет язвы и химические ожоги.
Люди ошибочно полагают, что углекислый газ — это азот. На самом деле, по своим химическим свойствам элемент реагирует лишь с небольшим количеством элементов при нормальных условиях. А углекислый газ — это оксид углерода.

Применение химического элемента
Азот в жидком состоянии применяют в медицине для лечения холодом (криотерапии), а также в кулинарии как хладагент.
Этот элемент также нашел широкое применение в промышленности. Азот — это газ, который взрыво- и пожаробезопасен. Помимо этого, он препятствует гниению и окислению. Сейчас азот используют в шахтах с целью создания взрывобезопасной среды. Газообразный азот применяют в нефтехимии.
В химической промышленности без азота обойтись очень нелегко. Его используют для синтеза различных веществ и соединений, например некоторых удобрений, аммиака, взрывчатых веществ, красителей. Сейчас большое количество азота используют для синтеза аммиака.
В пищевой промышленности это вещество зарегистрировано как пищевая добавка.

Смесь или чистое вещество?
Даже ученые первой половины 18 века, которым удалось выделить химический элемент, думали, что азот — это смесь. Но существует большая разница между этими понятиями.
Чистое вещество имеет целый комплекс постоянных свойств, таких как состав, физические и химические свойства. А смесь — это соединение, в которое входит два или больше химических элемента.
Сейчас мы знаем, что азот — это чистое вещество, так как он является химическим элементом.

При изучении химии очень важно понять, что азот является основой всей химии. Он образует различные соединения, которые всем нам встречаются, это и веселящий газ, и бурый газ, и аммиак, и азотная кислота. Недаром химия в школе начинается именно с изучения такого химического элемента, как азот.
fb.ru
