Вопрос№62. Цинк. Общая характеристика. Амфотерность гидроксида. Комплексные соединения. Ферменты. Применение в животноводстве.
Цинк — элемент побочной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 30. Обозначается символом Zn. Простое вещество цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
Физические свойства
В чистом виде — довольно пластичный серебристо-белый металл. Обладает гексагональной решеткой с параметрами а = 0,26649 нм, с = 0,49468 нм. При комнатной температуре хрупок, при сгибании пластинки слышен треск от трения кристаллитов (обычно сильнее, чем «крик олова»). При 100—150 °C цинк пластичен.
Химические свойства
Типичный амфотерный металл. Стандартный электродный потенциал −0,76 В, в ряду стандартных потенциалов расположен до железа.
На воздухе цинк покрывается тонкой пленкой оксида ZnO. При сильном нагревании сгорает с образованием амфотерного белого оксида ZnO:
2Zn + O2 = 2ZnO.
Оксид цинка реагирует как с растворами кислот:
ZnO + 2HNO3 = Zn(NO3)2 + h3O
так и щелочами:
ZnO + 2NaOH = Na2ZnO2 + Н2О,
Цинк обычной чистоты активно реагирует с растворами кислот:
Zn + 2HCl = ZnCl2 + h3↑,
Zn + h3SO4(разб.) = ZnSO4 + h3↑
и растворами щелочей:
Zn + 2NaOH + 2h3O = Na2[Zn(OH)4] + h3↑,
образуя гидроксоцинкаты. С растворами кислот и щелочей очень чистый цинк не реагирует. Взаимодействие начинается при добавлении нескольких капель раствора сульфата меди CuSO4.
При нагревании цинк реагирует с галогенами с образованием галогенидов ZnHal2. С фосфором цинк образует фосфиды Zn3P2 и ZnP2. С серой и ее аналогами — селеном и теллуром — различные халькогениды, ZnS, ZnSe, ZnSe2 и ZnTe. Сульфид цинка используется для синтеза люминофоров временного действия и разного рода люминесцентов на базе смеси ZnS и CdS. Люминофоры на базе сульфидов цинка и кадмия, так же применяются в электронной промышленности для изготовления светящихся гибких панелей и экранов в качестве электролюминофоров и составов с коротким временем высвечивания.
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует. Нитрид Zn3N2 получают реакцией цинка с аммиаком при 550—600 °C.
Гидрокси́д ци́нка — амфотерный гидроксид, имеющий формулу Zn(OH)2. Находит широкое применение в различных отраслях химии.
Получение
Химические свойства
Вопрос№63. Ртуть. Свойства ртути и ее соединений. Соединения ртути как лекарственные препараты.
Ртуть — элемент побочной подгруппы второй группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 80. Обозначается символом Hg. Простое вещество ртуть — переходный металл, при комнатной температуре представляет собой тяжёлую серебристо-белую жидкость, пары которой чрезвычайно ядовиты. Ртуть — один из двух химических элементов (и единственный металл), простые вещества которых при нормальных условиях находятся в жидком агрегатном состоянии.
Получение
Ртуть получают сжиганием киновари (Сульфида ртути(II)). Этот способ применяли алхимики древности. Уравнение реакции горения киновари: HgS+O2→Hg+SO2
Химические свойства
При нагревании до 300 °C ртуть вступает в реакцию с кислородом: 2Hg + O2 → 2HgO Образуется оксид ртути(II) красного цвета. Эта реакция обратима: при нагревании выше 340 °C оксид разлагается до простых веществ. Реакция разложения оксида ртути исторически является одним из первых способов получения кислорода.
При нагревании ртути с серой образуется сульфид ртути(II).
Ртуть не растворяется в растворах кислот, не обладающих окислительными свойствами, но растворяется в царской водке и азотной кислоте, образуя соли двухвалентной ртути. При растворении избытка ртути в азотной кислоте на холоде образуется нитрат Hg2(NO3)2.
Соединения ртути
Ртуть и её соединения применяются в технике, химической промышленности, медицине. Желтый оксид ртути(II) входит в состав глазной мази и мазей для лечения кожных заболеваний. Красный оксид ртути(II) применяется для получения красок. Хлорид ртути(I), который называется каломель, используется в пиротехнике, а также в качестве фунгицида. В ряде стран каломель используется в качестве слабительного. Токсическое действие каломели проявляется особенно тогда, когда после приема её внутрь не наступает слабительное действие и организм долгое время не освобождается от этого препарата. Хлорид ртути(II), который называется сулема, является очень токсичным. Сулема применялась в медицине как дезинфицирующее средство, в технике она используется для обработки дерева, получения некоторых видов чернил, травления и чернения стали. В сельском хозяйстве сулема применяется как фунгицид. Амидохлорид ртути (белый преципитат ртути) входит в состав некоторых мазей. В ветеринарии амидохлорид ртути применяется как средство против паразитарных заболеваний кожи. Нитрат ртути(II) применяется для отделки меха и получения других соединений этого металла. Токсичность нитрата ртути(II) примерно такая же, как и токсичность сулемы. Многие органические соединения ртути используются в качестве пестицидов и средств для обработки семян. Отдельные органические соединения ртути применяются как диуретические средства.
studfiles.net
Амфотерные соединения | Дистанционные уроки
05-Дек-2014 | комментария 4 | Лолита Окольнова
и их свойства

Автор статьи — Саид Лутфуллин
Химия – это всегда единство противоположностей.
Посмотрите на периодическую систему.
Некоторые элементы (почти все металлы, проявляющие степени окисления +1 и +2) образуют основные оксиды и гидроксиды. Например, калий образует оксид K2O, и гидроксид KOH. Они проявляют основные свойства, например взаимодействуют с кислотами.K2O + HCl → KCl + h3O
Некоторые элементы (большинство неметаллов и металлы со степенями окисления +5, +6, +7) образуют кислотные оксиды и гидроксиды. Кислотные гидроксиды – это кислородсодержащие кислоты, их называют гидроксидами, потому что в строении есть гидроксильная группа, например, сера образует кислотный оксид SO3 и кислотный гидроксид H2SO4 (серную кислоту):
Такие соединения проявляют кислотные свойства, например они реагируют с основаниями:
h3SO4 + 2KOH → K2SO4 + 2h3O
А есть элементы, образующие такие оксиды и гидроксиды, которые проявляют и кислотные, и основные свойства. Это явление называется амфотерностью. Таким оксидам и гидроксидам и будет приковано наше внимание в этой статье. Все амфотерные оксиды и гидроксиды — твердые вещества, нерастворимые в воде.
Для начала, как определить является ли оксид или гидроксид амфотерным? Есть правило, немного условное, но все-таки пользоваться им можно:
Амфотерные гидроксиды и оксиды образуются металлами, в степенях окисления +3 и +4, например (Al2O3, Al(OH)3, Fe2O3, Fe(OH)3)
И четыре исключения: металлы Zn, Be
, Pb, Sn образуют следующие оксиды и гидроксиды: ZnO, Zn(OH)2, BeO, Be(OH)2, PbO, Pb(OH)2, SnO, Sn(Наиболее часто встречающиеся амфотерные оксиды (и соответствующие им гидроксиды): ZnO, Zn(OH)2, BeO, Be(OH)2, PbO, Pb(OH)2, SnO, Sn(OH)2, Al2O3, Al(OH)3, Fe2O3, Fe(OH)3, Cr2O3, Cr(OH)3.
Свойства амфотерных соединений запомнить не сложно: они взаимодействуют с кислотами и щелочами.
- с взаимодействием с кислотами все просто, в этих реакциях амфотерные соединения ведут себя как основные:
Оксиды:
Al2O3 + 6HCl → 2AlCl3 + 3H 2O
ZnO + H2SO4 → ZnSO4 + H2O
BeO + HNO3 → Be(NO3)2 + H2O
Точно так же реагируют гидроксиды:
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
Pb(OH)2 + 2HCl → PbCl2 + 2H2O
- С взаимодействием со щелочами немного сложнее. В этих реакциях амфотерные соединения ведут себя как кислоты, и продукты реакции могут быть различными, все зависит от условий.
Или реакция происходит в растворе, или реагирующие вещества берутся твердые и сплавляются.
Разберем на примере гидроксида цинка. Как уже говорилось ранее, амфотерные соединения взаимодействуя с основными, ведут себя как кислоты. Вот и запишем гидроксид цинка Zn(OH)2
2KOH(тв.) + H2ZnO2(тв.) (t,сплавление)→ K2ZnO2 + 2H2O
Полученное вещество K2ZnO2 называется метацинкат калия (или просто цинкат калия). Это вещество – соль калия и гипотетической «цинковой кислоты» H2ZnO2 (солями такие соединения называть не совсем правильно, но для собственного удобства мы про это забудем). Только гидроксид цинка записывать вот так: H2ZnO2 – нехорошо. Пишем как обычно Zn(OH)2, но подразумеваем (для собственного удобства), что это «кислота»:
2KOH(тв.) + Zn(OH)2(тв.) (t,сплавление)→ K2ZnO2 + 2H2O
С гидроксидами, в которых 2 группы ОН, все будет так же как и с цинком:
Be(OH)2(тв.) + 2NaOH(тв.) (t,сплавление)→ 2H2O + Na2BeO2 (метабериллат натрия, или бериллат)
Pb(OH)2(тв.) + 2NaOH(тв.) (t,сплавление)→ 2H2O + Na2PbO2 (метаплюмбат натрия, или плюмбат)
С амфотерными гидроксидов с тремя группами OH (Al(OH)3, Cr(OH)3, Fe(OH)3) немного иначе.
Разберем на примере гидроксида алюминия: Al(OH)3, запишем в виде кислоты: H3AlO3, но в таком виде не оставляем, а выносим оттуда воду:
H3AlO3 – H2O → HAlO2 + H2O.
Вот с этой «кислотой» (HAlO2) мы и работаем:
HAlO2 + KOH → H2O + KAlO2 (метаалюминат калия, или просто алюминат)
Но гидроксид алюминия вот так HAlO2 записывать нельзя, записываем как обычно, но подразумеваем там «кислоту»:
Al(OH)3(тв.) + KOH(тв.) (t,сплавление)→ 2H2O + KAlO2(метаалюминат калия)
То же самое и с гидроксидом хрома:
Cr(OH)3 → H3CrO3 → HCrO2
Cr(OH)3(тв.) + KOH(тв.) (t,сплавление)→ 2H2O + KCrO2(метахромат калия,
НО НЕ ХРОМАТ, хроматы – это соли хромовой кислоты).
С гидроксидами содержащими четыре группы ОН точно так же: выносим вперед водород и убираем воду:
Sn(OH)4 → H4SnO4 → H2SnO3
Pb(OH)4 → H4PbO4 → H2PbO3
Следует помнить, что свинец и олово образуют по два амфотерных гидроксида: со степенью окисления +2 (Sn(OH)2, Pb(OH)2), и +4 (Sn(OH)4, Pb(OH)4).
И эти гидроксиды будут образовывать разные «соли»:
|
Степень окисления |
+2 |
+4 |
||
|
Формула гидроксида |
|
|
|
|
|
Формула гидроксида в виде кислоты |
H2SnO2 |
H2PbO2 |
H2SnO3 |
H2PbO3 |
|
Соль (калиевая) |
K2SnO2 |
K2PbO2 |
K2SnO3 |
K2PbO3 |
|
Название соли |
станнИТ |
блюмбИТ |
метастаннАТ |
метаблюмбАТ |
Те же принципы, что и в названиях обычных «солей», элемент в высшей степени окисления – суффикс АТ, в промежуточной – ИТ.
Такие «соли» (метахроматы, метаалюминаты, метабериллаты, метацинкаты и т.д.) получаются не только в результате взаимодействия щелочей и амфотерных гидроксидов. Эти соединения всегда образуются, когда соприкасаются сильноосновный «мир» и амфотерный (при сплавлении). То есть точно так же как и амфотерные гидроксиды со щелочами будут реагировать и амфотерные оксиды, и соли металлов, образующих амфотерные оксиды (соли слабых кислот). И вместо щелочи можно взять сильноосновный оксид, и соль металла, образующего щелочь (соль слабой кислоты).
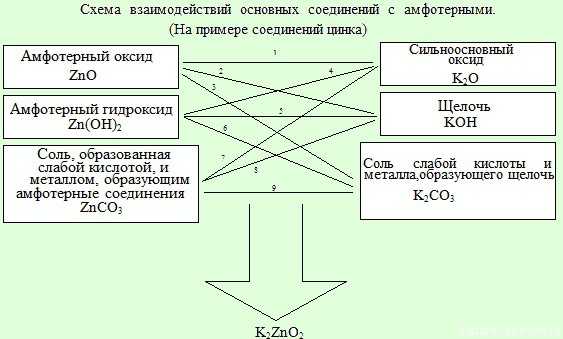
-
Взаимодействия:
Запомните, реакции, приведенные ниже, протекают при сплавлении.
-
Амфотерного оксида с сильноосновным оксидом:
-
ZnO(тв.) + K2O(тв.) (t,сплавление)→ K2ZnO2 (метацинкат калия, или просто цинкат калия)
-
Амфотерного оксида со щелочью:
ZnO(тв.) + 2KOH(тв.) (t,сплавление)→ K2ZnO2 + H2O↑
-
Амфотерного оксида с солью слабой кислоты и металла, образующего щелочь:
-
ZnO(тв.)+ K2CO3(тв.) (t,сплавление)→ K2ZnO2 + CO2↑
-
Амфотерного гидроксида с сильноосновным оксидом:
-
Zn(OH)2(тв.) + K2O(тв.) (t,сплавление)→ K2ZnO2 + H2O↑
-
Амфотерного гидроксида со щелочью:
-
Zn(OH)2(тв.) + 2KOH(тв.) (t,сплавление)→ K2ZnO2 + 2H2O↑
-
Амфотерного гидроксида с солью слабой кислоты и металла, образующего щелочь:
-
Zn(OH)2(тв.) + K2CO3(тв.) (t,сплавление)→ K2ZnO2 + CO2↑ + H2O↑
-
Соли слабой кислоты и металла, образующего амфотерные соединение с сильноосновным оксидом:
-
ZnCO3(тв.) + K2O(тв.) (t,сплавление)→ K2ZnO2 + CO2↑
-
Соли слабой кислоты и металла, образующего амфотерные соединение со щелочью:
-
ZnCO3(тв.) + 2KOH(тв.) (t,сплавление)→ K2ZnO2 + CO2↑ + H2O↑
-
Соли слабой кислоты и металла, образующего амфотерные соединение с солью слабой кислоты и металла, образующего щелочь:
ZnCO3(тв.)+ K2CO3(тв.) (t,сплавление)→ K2ZnO2 + 2CO2↑
Ниже представлена информация по солям амфотерных гидроксидов, красным помечены наиболее встречающиеся в ЕГЭ.
|
Оксид |
Гидроксид |
Гидроксид в виде кислоты |
Кислотный остаток |
Соль |
Название соли |
|
BeO |
Be(OH)2 |
H2BeO2 |
BeO22- |
K2BeO2 |
Метабериллат (бериллат) |
|
ZnO |
Zn(OH)2 |
H2ZnO2 |
ZnO22- |
K2ZnO2 |
Метацинкат (цинкат) |
|
Al2O3 |
Al(OH)3 |
HAlO2 |
AlO2— |
KAlO2 |
Метаалюминат (алюминат) |
|
Fe2O3 |
Fe(OH)3 |
HFeO2 |
FeO2— |
KFeO2 |
Метаферрат (НО НЕ ФЕРРАТ) |
|
SnO |
Sn(OH)2 |
H2SnO2 |
SnO22- |
K2SnO2 |
СтаннИТ |
|
PbO |
Pb(OH)2 |
H2PbO2 |
PbO22- |
K2PbO2 |
БлюмбИТ |
|
SnO2 |
Sn(OH)4 |
H2SnO3 |
SnO32- |
K2SnO3 |
МетастаннАТ (станнат) |
|
PbO2 |
Pb(OH)4 |
H2PbO3 |
PbO32- |
K2PbO3 |
МетаблюмбАТ (плюмбат) |
|
Cr2O3 |
Cr(OH)3 |
HCrO2 |
CrO2— |
KCrO2 |
Метахромат (НО НЕ ХРОМАТ) |
В ЕГЭ это называют «растворением гидроксида алюминия (цинка, бериллия и т.д.) щелочи». Это обусловлено способностью металлов в составе амфотерных гидроксидов в присутствии избытка гидроксид-ионов (в щелочной среде) присоединять к себе эти ионы. Образуется частица с металлом (алюминием, бериллием и т.д.) в центре, который окружен гидроксид-ионами. Эта частица становится отрицательно-заряженной (анионом) за счет гидроксид-ионов, и называться этот ион будет гидроксоалюминат, гидроксоцинкат, гидроксобериллат и т.д.. Причем процесс может протекать по-разному металл может быть окружен разным числом гидроксид-ионов.
Мы будем рассматривать два случая: когда металл окружен четырьмя гидроксид-ионами, и когда он окружен шестью гидроксид-ионами.
Запишем сокращенное ионное уравнение этих процессов:
Al(OH)3 + OH— → Al(OH)4—
Образовавшийся ион называется Тетрагидроксоалюминат-ион. Приставка «тетра-» прибавляется, потому что гидроксид-иона четыре. Тетрагидроксоалюминат-ион имеет заряд -, так как алюминий несет заряд 3+, а четыре гидроксид-иона 4-, в сумме получается -.
Al(OH)3 + 3OH— → Al(OH)63-
Образовавшийся в этой реакции ион называется гексагидроксоалюминат ион. Приставка «гексо-» прибавляется, потому что гидроксид-иона шесть.
Прибавлять приставку, указывающую на количество гидроксид-ионов обязательно. Потому что если вы напишете просто «гидроксоалюминат», не понятно, какой ион вы имеете в виду: Al(OH)4— или Al(OH)63-.
При взаимодействии щелочи с амфотерным гидроксидом в растворе образуется соль. Катион которой – это катион щелочи, а анион – это сложный ион, образование которого мы рассмотрели ранее. Анион заключается в квадратные скобки.
Al(OH)3 + KOH → K[Al(OH)4] (тетрагидроксоалюминат калия)
Al(OH)3 + 3KOH → K3[Al(OH)6] (гексагидроксоалюминат калия)
Какую именно (гекса- или тетра-) соль вы напишете как продукт – не имеет никакого значения. Даже в ответниках ЕГЭ написано: «…K3[Al(OH)6] (допустимо образование K[Al(OH)4]». Главное не забывайте следить, чтобы все индексы были верно проставлены. Следите за зарядами, и имейте ввиду, что сумма их должна быть равна нулю.
Кроме амфотерных гидроксидов, со щелочами реагируют амфотерные оксиды. Продукт будет тот же. Только вот если вы запишете реакцию вот так:
Al2O3 + NaOH → Na[Al(OH)4]
Al2O3 + NaOH → Na3[Al(OH)6]
Но эти реакции у вас не уравняются. Надо добавить воду в левую часть, взаимодейтсиве ведь происходит в растворе, воды там дотаточно, и все уравняется:
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
Al2O3 + 6NaOH + 3H2O → 2Na3[Al(OH)6]
Помимо амфотерных оксидов и гидроксидов, с растворами щелочей взаимодействуют некоторые особо активные металлы, которые образуют амфотерные соединения. А именно это: алюминий, цинк и бериллий. Чтобы уравнялось, слева тоже нужна вода. И, кроме того, главное отличие этих процессов – это выделение водорода:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑
2Al + 6NaOH + 6H2O → 2Na3[Al(OH)6] + 3H2↑
В таблице ниже приведены наиболее распространенные в ЕГЭ примеры свойства амфотерных соединений:
|
Амфотерное вещество |
Соль |
Название соли |
Реакции |
|
Al Al2O3 Al(OH)3 |
Na[Al(OH)4] |
Тетрагидроксоалюминат натрия |
Al(OH)3 + NaOH → Na[Al(OH)4] Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4] 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ |
|
Na3[Al(OH)6] |
Гексагидроксоалюминат натрия |
Al(OH)3 + 3NaOH → Na3[Al(OH)6] Al2O3 + 6NaOH + 3H2O → 2Na3[Al(OH)6] 2Al + 6NaOH + 6H2O → 2Na3[Al(OH)6] + 3H2↑ |
|
|
Zn ZnO Zn(OH)2 |
K2[Zn(OH)4] |
Тетрагидроксоцинкат натрия |
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4] ZnO + 2NaOH + H2O → Na2[Zn(OH)4] Zn + 2NaOH + 2H2O → Na2[Zn(OH)4]+ H2↑ |
|
K4[Zn(OH)6] |
Гексагидроксоцинкат натрия |
Zn(OH)2 + 4NaOH → Na4[Zn(OH)6] ZnO + 4NaOH + H2O → Na4[Zn(OH)6] Zn + 4NaOH + 2H2O → Na4[Zn(OH)6]+ H2↑ |
|
|
Be BeO Be(OH)2 |
Li2[Be(OH)4] |
Тетрагидроксобериллат лития |
Be(OH)2 + 2LiOH → Li2[Be(OH)4] BeO + 2LiOH + H2O → Li2[Be(OH)4] Be + 2LiOH + 2H2O → Li2[Be(OH)4]+ H2↑ |
|
Li4[Be(OH)6] |
Гексагидроксобериллат лития |
Be(OH)2 + 4LiOH → Li4[Be(OH)6] BeO + 4LiOH + H2O → Li4[Be(OH)6] Be + 4LiOH + 2H2O → Li4[Be(OH)6]+ H2↑ |
|
|
Cr2O3 Cr(OH)3 |
Na[Cr(OH)4] |
Тетрагидроксохромат натрия |
Cr(OH)3 + NaOH → Na[Cr(OH)4] Cr2O3 + 2NaOH + 3H2O → 2Na[Cr(OH)4] |
|
Na3[Cr(OH)6] |
Гексагидроксохромат натрия |
Cr(OH)3 + 3NaOH → Na3[Cr(OH)6] Cr2O3 + 6NaOH + 3H2O → 2Na3[Cr(OH)6] |
|
|
Fe2O3 Fe(OH)3 |
Na[Fe(OH)4] |
Тетрагидроксоферрат натрия |
Fe(OH)3 + NaOH → Na[Fe(OH)4] Fe2O3 + 2NaOH + 3H2O → 2Na[Fe(OH)4] |
|
Na3[Fe(OH)6] |
Гексагидроксоферрат натрия |
Fe(OH)3 + 3NaOH → Na3[Fe(OH)6] Fe2O3 + 6NaOH + 3H2O → 2Na3[Fe(OH)6] |
Полученные в этих взаимодействиях соли реагируют с кислотами, образуя две другие соли (соли данной кислоты и двух металлов):
2Na3[Al(OH)6] + 6H2SO4 → 3Na2SO4 + Al2(SO4)3 + 12H2O
Вот и все! Ничего сложного. Главное не путайте, помните что образуется при сплавлении, что в растворе. Очень часто задания по этому вопросу попадаются в B части.
Еще на эту тему:
Обсуждение: «Амфотерные соединения»
(Правила комментирования)distant-lessons.ru
Амфотерные металлы — список и свойства
Простые вещества сходные с металлическими элементами по структуре и ряду химических и физических параметров называют амфотерными, т.е. это те элементы, проявляющие химическую двойственность. Надо отметить, что это не сами металли, а их соли или оксиды. К, примеру, оксиды некоторых металлов могут обладать двумя свойствами, при одних условиях они могут проявлять свойства присущие кислотам, в других, они ведут себя как щелочи.
К основным амфотерным металлам относят алюминий, цинк, хром и некоторые другие.
Термин амфотерность был введен в оборот в начале XIX века. В то время химические вещества разделяли на основании их сходных свойств, проявляющиеся при химических реакциях.

Что такое амфотерные металлы
Список металлов, которые можно отнести амфотерным, достаточно велик. Причем некоторые из них можно назвать амфотерными, а некоторые – условно.
Перечислим порядковые номера веществ, под которыми они расположены в Таблице Менделеева. В список входят группы с 22 по 32, с 40 по 51 и еще много других. Например, хром, железо и ряд других можно с полным основанием называть основными, к последним можно отнести и стронций с бериллием.
Кстати, самым ярким представителем амфорных металлов считают алюминий.
Именно его сплавы в течение длительного времени используют практически во всех отраслях промышленности. Из него делают элементы фюзеляжей летательных аппаратов, кузовов автомобильного транспорта, и кухонную посуду. Он стал незаменим в электротехнической промышленности и при производстве оборудования для тепловых сетей. В отличии от многих других металлов алюминий постоянно проявляет химическую активность. Оксидная пленка, которая покрывает поверхность металла, противостоит окислительным процессам. В обычных условиях, и в некоторых типах химических реакций алюминий может выступать в качестве восстановительного элемента.
Этот металл способен взаимодействовать с кислородом, если его раздробить на множество мелких частиц. Для проведения операции такого рода необходимо использование высокой температуры. Реакция сопровождается выделением большого количества тепловой энергии. При повышении температуры в 200 ºC, алюминий вступает в реакцию с серой. Все дело в том, что алюминий, не всегда, в нормальных условиях, может вступать в реакцию с водородом. Между тем, при его смешивании с другими металлами могут возникать разные сплавы.
Еще один ярко выраженный металл, относящийся к амфотерным – это железо. Этот элемент имеет номер 26 и расположен между кобальтом и марганцем. Железо, самый распространенный элемент, находящийся в земной коре. Железо можно классифицировать как простой элемент, имеющий серебристо-белый цвет и отличается ковкостью, разумеется, при воздействии высоких температур. Может быстро начинать коррозировать под воздействием высоких температур. Железо, если поместить его в чистый кислород полностью прогорает и может воспламениться на открытом воздухе.
Такой металл обладает способностью быстро переходить в стадию корродирования при воздействии высокой температуры. Помещенное в чистый кислород железо полностью перегорает. Находясь на воздухе металлическое вещество, быстро окисляется вследствие чрезмерной влажности, то есть, ржавеет. При горении в кислородной массе образуется своеобразная окалина, которая называется оксидом железа.
Свойства амфотерных металлов
Они определены самим понятием амфотерности. В типовом состоянии, то есть обычной температуре и влажности, большая часть металлов представляет собой твердые тела. Ни один металл не подлежит растворению в воде. Щелочные основания проявляются только после определенных химических реакций. В процессе прохождения реакции соли металла вступают во взаимодействие. Надо отметить что правила безопасности требуют особой осторожности при проведении этой реакции.
Соединение амфотерных веществ с оксидами или самими кислотами первые показывают реакцию, которая присуща основаниями. В тоже время если их соединять с основаниями, то будут проявляться кислотные свойства.
Нагрев амфотерных гидроксидов вынуждает их распадаться на воду и оксид. Другими словами свойства амфотерных веществ весьма широки и требуют тщательного изучения, которое можно выполнить во время химической реакции.
Свойства амфотерных элементов можно понять, сравнив их с параметрами традиционных материалов. Например, большинство металлов имеют малый потенциал ионизации и это позволяет им выступать в ходе химических процессов восстановителями.
Амфотерные — могут показать как восстановительные, так и окислительные характеристики. Однако, существуют соединения которые характеризуются отрицательным уровнем окисления.
Абсолютно все известные металлы имеют возможность образовывать гидроксиды и оксиды.
Всем металлам свойственна возможность образования основных гидроксидов и оксидов. Кстати, металлы могут вступать в реакцию окисления только с некоторыми кислотами. Например, реакция с азотной кислотой может протекать по-разному.
Амфотерные вещества, относящиеся к простым, обладают явными различиями по структуре и особенностям. Принадлежность к определенному классу можно у некоторых веществ определить на взгляд, так, сразу видно что медь – это металл, а бром нет.
Как отличить металл от неметалла
Главное различие заключается в том, что металлы отдают электроны, которые находятся во внешнем электронном облаке. Неметаллы, активно их притягивают.
Все металлы являются хорошими проводниками тепла и электричества, неметаллы, такой возможности лишены.
Основания амфотерных металлов
В нормальных условиях это вещества не растворяются в воде и их можно спокойно отнести к слабым электролитам. Такие вещества получают после проведения реакции солей металла и щелочи. Эти реакции довольно опасны для тех, кто их производит и поэтому, например, для получения гидроксида цинка в емкость с хлоридом цинка медленно и аккуратно, по капле надо вводить едкий натр.
Вместе тем, амфотерные — взаимодействуют с кислотами как основания. То есть при выполнении реакции между соляной кислотой и гидроксидом цинка, появится хлорид цинка. А при взаимодействии с основаниями, они ведут себя как кислоты.
Оцените статью:Рейтинг: 0/5 — 0 голосов
prompriem.ru
Цинк и его соединения
Цинк — металл серебристо-белого цвета. В соединениях проявляет только одну степень окисления +2; соединения цинка неокрашены.
Нормальный окислительно-восстановительный потенциал в кислой среде системы Zn2+ / Zn равен -0,76 в, а в щелочной среде системы ZnO22- / Zn равен -1,22 в. Поэтому цинк растворяется в разбавленных кислотах и щелочах
Zn + 2НCl ZnCl2 + H2
Zn + H2SO4(разб) ZnSO4 + H2
Zn + 2NaOH + 2H2O Na2[Zn(OH)4] + H2
Цинк не разлагает воду, т.к. в водном растворе он быстро покрывается защитной пленкой оксида, которая предохраняет его от коррозии.
Цинк — сильный восстановитель и вытесняет менее активные металлы (стоящие справа в ряду напряжений) из растворов их солей.
Zn + CuSO4 ZnSO4 + Cu
Оксид цинка проявляет амфотерный характер, растворяясь как в кислотах, так и в растворах щелочей:
ZnO + H2SO4 ZnSO4 + h3O
ZnO + 2NaOH + H2O Na2[Zn(OH)4]
При нагревании комплексный тетрагидроксицинкат-анион дегидратируется:
[Zn(OH)4]2- ZnO22- + 2H2O
Гидроксид цинка также проявляет амфотерные свойства. Он нерастворим в воде, но растворяется в кислотах и щелочах;
Zn(OH)2 + 2HCl ZnCl2 + 2H2O
Zn(OH)2 + 2NaOH Na2[Zn(OH)4]
Ион Zn2+ является энергичным комплексообразователем с координационным числом 4. В отличие от гидроксида алюминия гидроксид цинка растворяется в водном растворе аммиака:
Zn(OH)2 + 2NH3 [Zn(NH3)4](OH)2
Похожие статьи:
poznayka.org
Химические свойства цинка и его соединений :: SYL.ru
Цинк является типичным представителем группы металлических элементов и обладает всем спектром их характеристик: металлическим блеском, пластичностью, электро- и теплопроводностью. Однако химические свойства цинка несколько отличаются от основных реакций, присущих большинству металлов. Элемент при определенных условиях может вести себя как неметалл, например, реагировать со щелочами. Такое явление называется амфотерностью. В нашей статье мы изучим физические свойства цинка, а также рассмотрим типичные реакции, характерные для металла и его соединений.
Положение элемента в периодической системе и распространение в природе
Металл располагается в побочной подгруппе второй группы периодической системы. В нее, кроме цинка, входят кадмий и ртуть. Цинк относится к d-элементам и находится в четвертом периоде. В химических реакциях его атомы всегда отдают электроны последнего энергетического уровня, поэтому в таких соединениях элемента, как оксид, средние соли и гидроксид, металл проявляет степень окисления +2. Строением атома объясняются все физико-химические свойства цинка и его соединений. Общее содержание металла в почве составляет примерно 0,01вес. %. Он входит в состав минералов, например, таких как галмей и цинковая обманка. Так как содержание цинка в них невысокое, сначала горные породы подвергаются обогащению, которое проводится в шахтных печах. Большинство цинксодержащих минералов представляют собой сульфиды, карбонаты и сульфаты. Это соли цинка, химические свойства которых лежат в основе процессов их переработки, например, таких как обжиг.

Получение металла
Реакция жесткого окисления карбоната или сульфида цинка приводит к получениюего оксида. Процесс происходит в кипящем слое. Это специальный метод, основанный на тесном контакте мелкоизмельченного минерала и струи горячего воздуха, движущейся с большой скоростью. Далее оксид цинка ZnO восстанавливают коксом и удаляют образовавшиеся пары металла из сферы реакции. Еще один способ получения металла, основанный на химических свойствах цинка и его соединений – это электролиз раствора сульфата цинка. Он представляет собой окислительно-восстановительную реакцию, проходящую под действием электрического тока. Металл высокой чистоты при этом осаждается на электроде.
Физическая характеристика
Голубовато-серебристый, при обычных условиях хрупкий металл. В интервале температур от 100° до 150° цинк становится гибким и его можно прокатывать в листы. При нагревании выше 200° металл становится необычайно хрупким. Под действием кислорода воздуха куски цинка покрываются тонким слоем оксида, а при дальнейшем окислении он превращается в гидроксокарбонат, который играет роль протектора и препятствует дальнейшему взаимодействию металла с кислородом воздуха. Физические и химические свойства цинка взаимосвязаны. Рассмотрим это на примере взаимодействия металла с водой и кислородом.

Жесткое окисление и реакция с водой
При сильном нагревании на воздухе цинковые стружки сгорают голубым пламенем, при этом образуется оксид цинка.
2Zn + O₂ → 2ZnO
Он проявляет амфотерные свойства. В парах воды, разогретых до температуры красного каления, металл вытесняет водород из молекул Н2О, кроме этого, образуется оксид цинка. Химические свойства вещества доказывают его способность взаимодействовать как с кислотами, так и со щелочами.
Окислительно-восстановительные реакции с участием цинка
Так как элемент в ряду активности металлов стоит перед водородом, он способен вытеснять его из молекул кислот.
Продукты реакции между цинком и кислотами будут зависеть от двух факторов:
- вида кислоты
- ее концентрации
Разбавленная серная кислота, которая не проявляет ярко выраженных окислительных свойств, реагирует с металлом по схеме:
H₂SO₄ + Zn = ZnSO₄ + H₂↑
Таким же образом протекают реакции элемента с фосфорной и разбавленной серной кислотами. Химические свойства, реакции цинка с нитратной кислотой имеют свои особенности. Разбавленный раствор азотной кислоты средней концентрации и цинк взаимодействуют между собой с образованием оксида азота (II), воды и средней соли – нитрата цинка. Концентрированная нитратная кислота с металлом реагируют таким образом, что в продуктах можно обнаружить оксид азота (IV), среднюю соль и воду.

Очень разбавленный раствор азотной кислоты и цинк в качестве восстановителя взаимодействуют между собой с образованием нитрата цинка, воды и нескольких возможных продуктов: аммиака, свободного азота или оксида азота (I).
Химические свойства цинка
Уравнения реакций взаимодействия металла с растворами щелочей являются подтверждением его амфотерных свойств. В продуктах обнаруживаются комплексные соли — тетрагидроксоцинкаты и водород.
Zn + 2NaOH + 2H2O = Na2 [Zn(OH)4] + H2
Сплавляя твердую щелочь и металл, получают соли другого вида – цинкаты. Побочным продуктом такого процесса также будет газообразный водород.
Zn + 2KOH = K2ZnO2 + H2
Металл активно взаимодействует с галогенами, например, хлором, бромом или йодом, а также с азотом, серой и углеродом. В результате образуются средние соли – нитриды, сульфиды или карбиды.
В ряду активности металлов цинк располагается до водорода и, следовательно, является активным металлом. Однако он уступает по своим свойствам щелочным и щелочноземельным металлам.
Использование цинка в гальванических элементах
Химические свойства цинка лежат в основе принципа действия различных видов гальванических приборов. Марганцево-цинковый элемент является наиболее распространенным в технике. Он работает благодаря прохождению окислительно-восстановительной реакции между металлом и диоксидом марганца. Из них изготавливаются оба электрода и помещаются внутрь прибора. Действующее вещество — хлорид аммония — имеет вид пасты, или же им пропитываются пористые пластины, вставленные между катодом и анодом. Воздушно-цинковый элемент представлен отрицательным цинковым электродом – катодом. Анод — это угольно- графитовый стержень, заполненный воздухом. В качестве электролита используют растворы хлорида аммония или едкого натрия.

Оксид цинка
Белый пористый порошок, желтеющий при нагревании и возвращающий свой первоначальный цвет при охлаждении – это окись металла. Химические свойства оксида цинка, уравнения реакций его взаимодействия с кислотами и щелочами подтверждают амфотерный характер соединения. Так, вещество не может реагировать с водой, но взаимодействует как с кислотами, так и со щелочами. Продуктами реакций будут средние соли (в случае взаимодействия с кислотами) или комплексные соединения – тетрагидроксоцинкаты.
Оксид цинка применяют в производстве белой краски, которую называют цинковыми белилами. В дерматологии вещество входит в состав мазей, присыпок и паст, оказывающих на кожу противовоспалительное и подсушивающее действие. Большая же часть производимого оксида цинка применяется в качестве наполнителя для резины. Продолжая изучать химические свойства цинка и его соединений, рассмотрим гидроксид Zn(OH)2.

Амфотерный характер гидроксида цинка
Белый осадок, выпадающий под действием щелочи на растворы солей металла – это основание цинка. Соединение быстро растворяется под действием кислот или щелочей. Первый тип реакции заканчивается образованием средних солей, второй – цинкатов. В твердом виде выделены комплексные соли – гидроксоцинкаты. Особенностью гидроксида цинка является его способность растворяться в водном растворе аммиака с образованием гидроксида тетраамминцинка и воды. Основание цинка является слабым электролитом, поэтому как его средние соли, так и цинкаты в водных растворах поддаются гидролизу, то есть их ионы взаимодействуют с водой и образуют молекулы гидроксида цинка. Растворы таких солей металла, как хлорид или нитрат, будут иметь кислую реакцию вследствие накопления избытка ионов водорода.
Характеристика сульфата цинка
Рассмотренные нами ранее химические свойства цинка, в частности, его реакции с разбавленной сульфатной кислотой, подтверждают образование средней соли – сернокислого цинка. Это бесцветные кристаллы, нагревая которые до 600° и выше, можно получить оксосульфаты и трехокись серы. При дальнейшем нагревании сернокислый цинк преобразуется в оксид цинка. Соль растворима в воде и глицерине. Вещество выделяют из раствора при температуре до 39°C в виде кристаллогидрата, формула которого ZnSO4×7H2O. В этом виде его называют цинковым купоросом.

В интервале температур 39°-70° получают шестиводную соль, а выше 70° в составе кристаллогидрата остается только одна молекула воды. Физико-химические свойства сульфата цинка позволяют применять его в качестве отбеливателя при изготовлении бумаги, в виде минерального удобрения в растениеводстве, как подкормку в рационе домашних животных и птицы. В текстильной промышленности соединение используют в производстве вискозной ткани, в окрашивании ситца.
Сернокислый цинк входит также в состав раствора электролита, применяемого в процессе гальванического покрытия слоем цинка железных или стальных изделий диффузным способом или методом горячего оцинкования. Слой цинка в течение длительного времени защищает такие конструкции от коррозии. Учитывая химические свойства цинка, нужно отметить, что в условиях высокой солености воды, значительных колебаний температуры и влажности воздуха оцинкование не дает желаемого эффекта. Поэтому в промышленности нашли широкое применение сплавы металла с медью, магнием и алюминием.
Применение сплавов, содержащих цинк
Для транспортировки многих химических веществ, например, аммиака, по трубопроводам, необходимы особые требования к составу металла, из которого изготовлены трубы. Они изготавливаются на основе сплавов железа с магнием, алюминием и цинком и обладают высокой антикоррозионной устойчивостью к действию агрессивной химической среды. Кроме этого, цинк улучшает механические свойства сплавов и нивелирует вредное влияние таких примесей, как никель и медь. В процессах промышленного электролиза широкое применение получили сплавы меди и цинка. Для транспортировки продуктов нефтепереработки используют танкеры. Они построены из алюминиевых сплавов, содержащих, кроме магния, хрома и марганца, большую долю цинка. Материалы такого состава обладают не только высокими антикоррозионными свойствами и повышенной прочностью, но еще и криогенной стойкостью.
Роль цинка в организме человека
Содержание Zn в клетках составляет 0,0003%, поэтому его относят к микроэлементам. Химические свойства, реакции цинка и его соединений играют важную роль в обмене веществ и поддержании нормального уровня гомеостаза, как на уровне клетки, так и всего организма в целом. Ионы металла входят в состав важных ферментов и других биологически активных веществ. Например, известно, о серьезном влиянии цинка на формирование и функции мужской половой системы. Он входит в состав кофермента гормона тестостерона, отвечающего за фертильность семенной жидкости и формирование вторичных половых признаков. Небелковая часть еще одного важнейшего гормона — инсулина, вырабатываемого бета-клетками островков Лангерганса поджелудочной железы, также содержит микроэлемент. Иммунный статус организма тоже напрямую связан с концентрацией в клетках ионов Zn+2, которые находятся в гормоне тимуса – тимулине и тимопоэтине. Высокая концентрация цинка регистрируется в структурах ядра – хромосомах, содержащих дезоксирибонуклеиновую кислоту и участвующих в передаче наследственной информации клетки.

В нашей статье мы изучили химические функции цинка и его соединений, а также определили его роль в жизнедеятельности организма человека.
www.syl.ru
Амфотерные оксиды. Химические свойства, способ получения
Амфотерные оксиды (имеющие двойственные свойства) – это в большинстве случаев оксиды металлов, которые обладают небольшой электроотрицательностью. В зависимости от внешних условий проявляют либо кислотные, либо оксидные свойства. Образуются эти оксиды переходными металлами, которые обычно проявляют следующие степени окисления: ll, lll, lV.
Примеры амфотерных оксидов: цинка оксид (ZnO), хрома оксид lll (Cr2O3), алюминия оксид (Al2O3), олова оксид ll (SnO), олова оксид lV (SnO2), свинца оксид ll (PbO), свинца оксид lV (PbO2), титана оксид lV (TiO2), марганца оксид lV (MnO2), железа оксид lll (Fe2O3), бериллия оксид (BeO).
Реакции, характерные для амфотерных оксидов:
1. Эти оксиды могут реагировать с сильными кислотами. При этом образуются соли этих же кислот. Реакции такого типа являются проявлением свойств основного типа. Например: ZnO (оксид цинка) + h3SO4 (соляная кислота) → ZnSO4 (сульфат цинка) + h3O (вода).
2. При взаимодействии с сильными щелочами амфотерные оксиды и гидроксиды проявляют кислотные свойства. При этом двойственность свойств (то есть амфотерность) проявляется в образовании двух солей.
В расплаве при реакции с щелочью образуется соль средняя обычная, например:
ZnO (оксид цинка) + 2NaOH (гидроксид натрия) → Na2ZnO2 (обычная средняя соль) + h3O (вода).
Al2О3 (оксид алюминия) + 2NaOH (гидроксид натрия) = 2NaAlO2 + h3O (вода).
2Al(OH)3 (алюминия гидроксид) + 3SO3 (оксид серы) = Al2(SO4)3 (алюминия сульфат) + 3h3O (вода).
В растворе амфотерные оксиды при реакции с щелочью образуют комплексную соль, например: Al2O3 (алюминия оксид) + 2NaOH (гидроксид натрия)+ 3h3O (вода) + 2Na(Al(OH)4) (комплексная соль тетрагидроксоалюминат натрия).
3. Каждый металл любого амфотерного оксида имеет свое координационное число. Например: для цинка (Zn) — 4, для алюминия (Al) — 4 или 6, для хрома (Cr) — 4 (редко) или 6.
4. Амфотерный оксид не реагирует с водой и не растворяется в ней.
Какие реакции доказывают амфотерность металла?
Условно говоря, амфотерный элемент может проявлять свойства как металлов, так и неметаллов. Подобная характерная особенность присутствует у элементов А-групп: Be (бериллий), Ga (галлий), Ge (германий), Sn (олово), Pb, Sb (сурьма), Bi (висмут) и некоторые другие, а также многие элементы Б-групп — это Cr (хром), Mn (марганец), Fe (железо), Zn (цинк), Cd (кадмий) и другие.
Докажем следующими химическими реакциями амфотерность химического элемента цинка (Zn):
1. Zn(OH)2 (цинка гидроксид) + N2O5 (пентаоксид диазота) = Zn(NO3)2 (нитрат цинка) + h3O (вода).
ZnO (оксид цинка) + 2HNO3 (азотная кислота) = Zn(NO3)2 (нитрат цинка) + h3O (вода).
б) Zn(OH)2 (цинка гидроксид) + Na2O (натрия оксид) = Na2ZnO2 (диоксоцинкат натрия)+ h3O (вода).
ZnO (оксид цинка) + 2NaOH (гидроксид натрия) = Na2ZnO2 (диоксоцинкат натрия) + h3O (вода).
В том случае, если элемент с двойственными свойствами в соединении имеет следующие степени окисления, его двойственные (амфотерные) свойства наиболее заметно проявляются в промежуточной стадии окисления.
Как пример можно привести хром (Cr). Этот элемент имеет следующие степени окисления: 3+, 2+, 6+. В случае +3 основные и кислотные свойства выражаются приблизительно в одинаковой степени, в то время как у Cr +2 преобладают основные свойства, а у Cr +6 — кислотные. Вот реакции, доказывающие данное утверждение:
Cr+2 → CrO (оксид хрома +2), Cr(OH)2 → CrSO4;
Cr+3 → Cr2O3 (оксид хрома +3), Cr(OH)3 (хрома гидроксид) → KCrO2 или же хрома сульфат Cr2(SO4)3;
Cr+6 → CrO3 (оксид хрома +6), h3CrO4 → K2CrO4.
В большинстве случаев амфотерные оксиды химических элементов со степенью окисления +3 существуют в мета-форме. Как пример, можно привести: метагидроксид алюминия (хим. формула AlO(OH) и метагидроксид железа (хим. формула FeO(OH)).
Как получают амфотерные оксиды?
1. Наиболее удобный метод их получения заключается в осаждении из водного раствора с использованием гидрата аммиака, то есть слабого основания. Например:
Al(NO3)3 (нитрат алюминия) + 3(h3OxNh4) (водный раствор аммиака гидрата) = Al(OH)3 (амфотерный оксид) + 3Nh5NO3 (реакция выполняется при двадцати градусах тепла).
Al(NO3)3 (нитрат алюминия) + 3(h3OxNh4) (водный раствор гидрата аммиака) = AlO(OH) (амфотерный оксид) + 3Nh5NO3 + h3O (реакция осуществляется при 80 °C)
При этом в обменной реакции этого типа в случае избытка щелочей гидроксид алюминия не будет осаждаться. Это происходит по причине того, что алюминий переходит в анион из-за своих двойственных свойств: Al(OH)3 (алюминия гидроксид) + OH− (избыток щелочей) = [Al(OH)4]− (анион гидроксида алюминия).
Примеры реакций данного типа:
Al(NO3)3 (нитрат алюминия) + 4NaOH(избыток гидроксида натрия) = 3NaNO3 + Na(Al(OH)4).
ZnSO4 (сульфат цинка) + 4NaOH(избыток гидроксида натрия) = Na2SO4 + Na2(Zn(OH)4).
Соли, которые при этом образуются, относятся к комплексным соединениям. Они включают в себя следующие анионы комплексные: (Al(OH)4)− и еще (Zn(OH)4)2−. Вот так называются эти соли: Na(Al(OH)4) — натрия тетрагидроксоалюминат, Na2(Zn(OH)4) — натрия тетрагидроксоцинкат. Продукты взаимодействия алюминиевых или цинковых оксидов с щелочью твердой называются по-другому: NaAlO2 — натрия диоксоалюминат и Na2ZnO2 — натрия диоксоцинкат.
fb.ru
Амфотерные оксиды и гидроксиды. Детальные поурочные планы
Дополнительные сочиненияЭто занятие мы посвятим изучению амфотерных оксидов и гидроксидов. На нем мы поговорим о веществах, имеющих амфотерные (двойственные) свойства, и особенностях химических реакций, которые протекают с ними. Но сначала повторим, с чем реагируют кислотные и основные оксиды. После рассмотрим примеры амфотерных оксидов и гидроксидов.
Тема: Введение
Урок: Амфотерные оксиды и гидроксиды
1. Характеристика амфотерных соединений
Рис. 1. Вещества, проявляющие амфотерные свойства
Основные оксиды реагируют с кислотными оксидами, а кислотные оксиды – с основаниями. Но существуют вещества, оксиды и гидроксиды которых в зависимости от условий, будут реагировать и с кислотами и с основаниями. Такие свойства называются амфотерными.
Вещества, обладающие амфотерными свойствами приведены Рис.1.. Это соединения, образованные бериллием, цинком, хромом, мышьяком, алюминием, германием, свинцом, марганцем, железом, оловом.
Примеры их амфотерных оксидов приведены в таблице 1.
|
Амфотерные оксиды |
|
|
Формула |
Названия |
|
BeO |
Оксид берия (II) |
|
ZnO |
Оксид цинка |
|
Al2O3 |
Оксид алюминия |
|
Cr2O3 |
Оксид хрома III) |
|
As2O3 |
Оксид мышьяка (III) |
|
GeO |
Оксид германия (II) |
|
PbO2 |
Оксид свинца (IV) |
|
MnO2 |
Оксид марганца (IV) |
|
Fe2O3 |
Оксид железа (III) |
|
SnO |
Оксид олова (II) |
2. Химические свойства амфотерных оксидов цинка и алюминия
Рассмотрим амфотерные свойства оксидов цинка и алюминия. На примере их взаимодействия с основными и кислотными оксидами, с кислотой и щелочью.
— Взаимодействие с основными оксидами и основаниями:
ZnO + Na2O → Na2ZnO2 (цинкат натрия). Оксид цинка ведет себя как кислотный.
ZnO + 2NaOH → Na2ZnO2+ h3O
— Взаимодействие с кислотными оксидами и кислотами. Проявляет свойства основного оксида.
3ZnO + P2O5 → Zn3(PO4)2 (фосфат цинка)
ZnO + 2HCl → ZnCl2 + h3O
Аналогично оксиду цинка ведет себя и оксид алюминия:
— Взаимодействие с основными оксидами и основаниями:
Al2O3 + Na2O → 2NaAlO2 (метаалюминат натрия). Оксид алюминия ведет себя как кислотный.
Al2O3 + 2NaOH → 2NaAlO2+ h3O
— Взаимодействие с кислотными оксидами и кислотами. Проявляет свойства основного оксида.
Al2O3 + P2O5 → 2AlPO4(фосфат алюминия)
Al2O3 + 6HCl → 2AlCl3 + 3h3O
Рассмотренные реакции происходят при нагревании, при сплавлении. Если взять растворы веществ, то реакции пойдут несколько иначе.
3. Химические свойства амфотерных оксидов цинка и алюминия в растворах
ZnO + 2NaOH + h3O → Na2[Zn(OH)4] (тетрагидроксоцинкат натрия) Al2O3 + 2NaOH + 3h3O → 2Na[Al(OH)4] (тетрагидроксоалюминат натрия)
В результате этих реакций получаются соли, которые относятся к комплексным.
Рис. 2. Минералы на основе оксида алюминия
Оксид алюминия.
Оксид алюминия чрезвычайно распространенное на Земле вещество. Он составляет основу глины, бокситов, корунда и других минералов. Рис.2.
В результате взаимодействия этих веществ с серной кислотой, получается сульфат цинка или сульфат алюминия.
ZnO + h3SO4 → ZnSO4 + h3O
Al2O3 + 3h3SO4→ Al2 (SO4)3 + 3h3O
4. Химические свойства амфотерных гидроксидов цинка и алюминия
Реакции гидроксидов цинка и алюминия с оксидом натрия происходят при сплавлении, потому что эти гидроксиды твердые и не входят в состав растворов.
Zn(OН)2 +2 Na2O → Na2ZnO2 + Н2О соль называется цинкат натрия.
2Al(OН)3 + Na2O → 2NaAlO2 + 3Н2О соль называется метаалюминат натрия.
Рис. 3. Гидроксид алюминия
Реакции амфотерных оснований со щелочами характеризует их кислотные свойства. Данные реакции можно проводить как при сплавлении твердых веществ, так и в растворах. Но при этом получатся разные вещества, т. е. продукты реакции зависят от условий проведения реакции: в расплаве или в растворе.
Zn(OH)2 + 2NaOH тв. Na2ZnO2 + 2Н2О
Al(OH)3 + NaOH тв. NaAlO2+ 2h3O
Zn(OH)2 + NaOH раствор → Na2[Zn(OH)4] Al(OH)3 + NaOH раствор → Na[Al(OH)4] тетрагидроксоалюминат натрия Al(OH)3 + 3NaOH раствор→ Na3[Al(OH)6] гексагидроксоалюминат натрия.
Получается тетрагидроксоалюминат натрия или гексагидроксоалюминат натрия зависит от того, сколько щелочи мы взяли. В последней реакции щелочи взято много и образуется гексагидроксоалюминат натрия.
5. Химические свойства амфотерных цинка и алюминия
Элементы, которые образуют амфотерные соединения, могут сами проявлять амфотерные свойства.
Zn + 2NaOH + 2h3O → Na2[Zn(OH)4] + Н2&
dp-adilet.kz
