Алканы — Органическая химия
Алканы или алифатические насыщенные углеводороды — соединения с открытой (нециклічним) цепью, в молекулах которых атомы углерода соединены между собой σ-связью. Атом углерода в алканах находятся в состоянии sp3-гибридизации.Алканы образуют гомологический ряд, в котором каждый член отличается на постоянную структурную единицу -CH2-, что называется гомологической разностью. Простейший представитель — метан CH4.
- Общая формула алканов: CnH2n+2
Изомерия
Начиная с бутана C4H10 для алканов характерна структурная изомерия. Количество структурных изомеров возрастает с увеличением числа углеродных атомов в молекуле алканов. Так, для пентана C5H12 известно три изомеры, для октана C8H18 — 18, для декана C10H22 — 75.
Для алканов кроме структурной существует конформационная изомерия и начиная с гептана — енантіомерія:
Номенклатура IUPAC
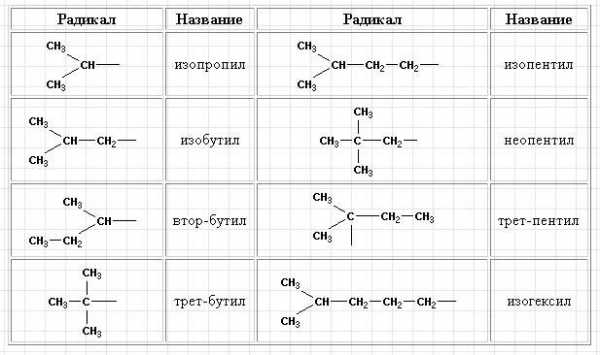
В названиях алканов используют префиксы н-, втор-, изо, трет-, нео:
- н- означает нормальную (нерозгалужену) строение углеводородного цепи;
- втор- применяется только для вторичного бутила;
- трет- означает алкил третичной структуры;
- изо разветвления на конце цепи;
- нео используется для алкілу с четвертичным атомом углерода.
Номенклатура разветвленных алканов построена основана на следующих основных правилах:
- Для построения названия выбирают длинную цепь атомов углерода и нумеруют его арабскими цифрами (локантами), начиная с конца, ближе к которому находится заместитель, например:
- Если одна и та же алкільна группа встречается более одного раза, то в названии перед ней ставят помножуючі приставки ди- (перед гласной ди-), три-, тетра- и т. п. и обозначают цифрой каждый алкил отдельно, например:
Необходимо заметить, что для сложных остатков (групп) применяются помножуючі префиксы вроде бис-, трис-, тетракіс- прочее.
- Если в боковых ответвлениях главной цепи размещены различные алкіли-заместители, то их переразовують по алфавиту (при этом помножуючі приставки ди-, тетра- и т. п, а также префиксы н-, втор-, трет- не принимают во внимание), например:

- Если возможны два или более вариантов длиннейшей цепи, то выбирают тот, который имеет максимальное количество боковых разветвлений.
- Названия сложных алкильных групп строятся по тем же принципам, что и названия алканов, но нумерация цепи алкілу всегда автономна и начинается с того атома углерода, имеющего свободную валентность, например:
- При использовании в названии такой группы ее берут в скобки и в алфавитном порядке учитывается первая буква названия всей:
Промышленные методы добычи
1. Извлечения алканов газа. Природный газ состоит главным образом из метана и небольших примесей этана, пропана, бутана. Газ под давлением при пониженных при пониженных температурах разделяют на соответствующие фракции.
2. Извлечения алканов из нефти. Сырую нефть очищают и подвергают переработке (розгонка, фракціювання, крекинг). Из продуктов переработки получают смеси или индивидуальные соединения.
3. Гидрирование угля (метод Ф. Бергіуса, 1925 г.). Каменный или бурый уголь в автоклавах при 30 МПа в присутствии катализаторов (оксиды и сульфиды Fe, Mo, W, Ni) в среде углеводородов гидрированные и превращаются в алканы, так называемое моторное топливо:
nC + (n+1)H2 = CnH2n+2
4. Оксосинтеза алканов (метод Ф. Фишера — Г. Тропша, 1922 г.). По методу Фишера — Тропша алканы получают из синтез-газа. Синтез-газ представляет собой смесь CO и H2 с различным соотношением. Его получают из метана одной из реакций, которые происходят при 800-900°C в присутствии оксида никеля NiO, нанесенного на Al2O3:
CH4 + H2O ⇄ CO + 3H2
CH4 + CO2 ⇄ 2CO + 2H2
2CH4 + O2 ⇄ 2CO + 4H2
Алканы получают по реакции (температура около 300°C, катализатор Fe-Co):
nCO + (2n+1)H2 → CnH2n+2 + nH2O
Образованная смесь углеводородов, состоящая в основном из алканов строения (n=12-18), называют «синтином».5. Сухая перегонка. В относительно небольших количествах алканы получают при помощи сухой перегонки или нагрева угля, сланцев, древесины, торфа без доступа воздуха. Примерный состав полученной смеси при этом составляет 60% водорода, 25% метана и 3-5% этилена.
Лабораторные методы добывания
1. Получение из галогеналкілів
1.1. Взаимодействие с металлическим натрием (Вурц, 1855 г.). Реакция состоит во взаимодействии щелочного металла с галогеналкілом и применяется для синтеза высших симметричных алканов:
2CH3-I + 2Na ⇄ CH3-CH3 + 2NaI
В случае участия в реакции двух разных галогеналкілів образуется смесь алканов:
3CH3-I + 3CH3CH2-I + 6Na → CH3-CH3 + CH3CH2CH3 + CH3CH2CH2CH3 + 6NaI
1.2 Взаимодействие с літійдіалкілкупратами. Метод (иногда называют реакцией Е. Коре — Х. Хауса) заключается во взаимодействии реакционноспособных літійдіалкілкупратів R 2CuLi с галогеналкілами. Сначала происходит взаимодействие металлического лития с галогеналканом в среде эфира. Далее соответствующий алкіллітій реагирует с галогенідом меди(I) с образованием растворимого літійдіалкілкупрату:
CH3Cl + 2Li → CH3Li + LiCl
2CH3Li + CuI → (CH3)2CuLi + LiI
При взаимодействии такого літійдіалкілкупрату с соответствующим галогеналкілом образуется конечное соединение:
(CH3)2CuLi + 2CH3(CH2)6CH2-I → 2CH3(CH2)6CH2-CH3 + LiI + CuI
Метод позволяет достичь выхода алканов почти 100% при применении первичных галогеналкілів. При их вторичной или третичной строении выход составляет 30-55%. Природа алкільної составляющей в літійдіалкілкупраті мало влияет на выход алкану.
1.3 Восстановление галогеналкілів.
CH3I + H2 → CH4 + HI (катализатор Pd)
CH3CH2I + 2H → CH3CH3 + HI
CH3I + HI → CH4 + I2
Метод имеет препаративне значение, часто используют сильный восстановитель — йодоводень.2. Получение из солей карбоновых кислот.
2.1 Электролиз солей (Кольбе, 1849 г.). Реакция Кольбе заключается в электролизе водных растворов солей карбоновых кислот:
R-COONa ⇄ R-COO— + Na+
На аноде анион карбоновой кислоты окисляется, образуя свободный радикал, и легко декарбоксилюється или отщеплять CO2. Алкильные радикалы далее вследствие рекомбинации превращаются в алканы:
R-COO— → R-COO• + e—
R-COO• → R• + CO2R• + R• → R-R
Препаративный метод Кольбе считается эффективным при наличии соответствующих карбоновых кислот и невозможности применить другие методы синтеза.
2.2 Сплавления солей карбоновых кислот со щелочью. Соли щелочных металлов карбоновых кислот при славленні с щелочью образуют алканы:
CH3CH2COONa + NaOH → Na2CO3 + CH3CH3
3. Восстановление кислородсодержащих соединений (спиртов, кетонов, карбоновых кислот). Восстановителями выступают вышеупомянутые соединения. Чаще всего применяют йодоводень, который способен восстанавливать даже кетоны:
R-OH + 2HI → R-H + I2 + H2O
CH3-CO-CH3 + 4HI → CH3-CH2-CH2 + 2I2 + H2O
В препаративному плане часто используют восстановление карбонильных соединений Е. Клемменсеном и М. Кіжнером.CH3-CH=CH2 + H2 → CH3-CH2-CH3(катализатор Pt, Ni)
CH≡CH + 2H2 → CH3-CH3(катализатор Pt, Ni)
Реакции гидрирования показывают генетическую связь между насыщенными и ненасыщенными соединениями и возможность их взаимного перехода друг в другие.
Физические свойства
Первые четыре представителя алканов от метана до бутана (C1-C4) — газы, от пентана до пентадекану (C5-C15 — жидкости, от гексадекану (C16) — твердые вещества. Увеличения их молекулярных масс приводит к увеличению температур кипения и плавления, при чем алканы с разветвленной цепью кипят при более низкой температуре, чем алканы нормального строения. Это объясняется меньшей вандерваальсівською взаимодействием между молекулами разветвленных углеводородов в жидком состоянии. Температура плавления четных гомологов выше по сравнению с температурой соответственно для нечетных. Алканы гораздо легче за воду, неполярные и трудно поляризуются, однако растворимы в большинстве неполярных растворителей, благодаря чему сами могут быть растворителем для многих органических соединений.
chemiday.com
5. Алканы
Алканами
называются углеводороды с открытой
цепью, имеющие общую формулу CnH2n+2
и содержащие только простые
углерод-углеродные связи. Алканы образуют
гомологический ряд, в котором каждый
член отличается от предыдущего на
постоянную структурную единицу (CH
Таблица 5.1
Гомологический ряд алканов. Число структурных изомеров
|
Число атомов |
Название, формула |
Число изомеров | |
|
1 |
Метан |
СН4 |
1 |
|
2 |
Этан |
C2H6 |
1 |
|
3 |
Пропан |
C3H8 |
1 |
|
4 |
Бутан |
С4Н10 |
2 |
|
5 |
Пентан |
С5Н12 |
3 |
|
6 |
Гексан |
С6Н14 |
5 |
|
7 |
Гептан |
С7Н16 |
9 |
|
8 |
Октан |
С8Н18 |
18 |
|
9 |
Нонан |
С9Н20 |
35 |
|
10 |
Декан |
С10Н22 |
75 |
Изомеры — это соединения, имеющие одинаковый состав, но различное строение и вследствие этого разные физико-химические свойства.
Существуют структурные и пространственные изомеры (стереоизомеры).
Структурные изомеры — это соединения, имеющие одинаковый состав, но различную последовательность связывания атомов.
Пространственными изомерами называются соединения, в которых одинаковые состав и способ связывания атомов, но различное расположение атомов в пространстве.
Первые три члена гомологического ряда не имеют изомеров. Число структурных изомеров последующих гомологов, начиная с бутана, растет очень быстро с увеличением атомов углерода в молекуле (см. табл. 5.1). Эмпирической формуле С4Н10 соответствуют два структурных изомера, а формуле С5Н10 – три
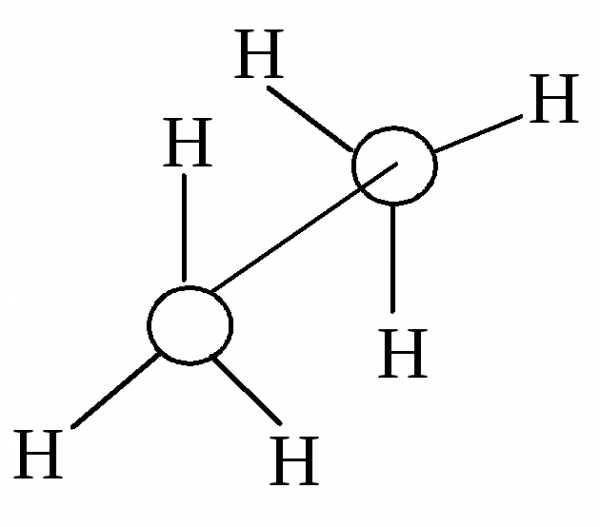
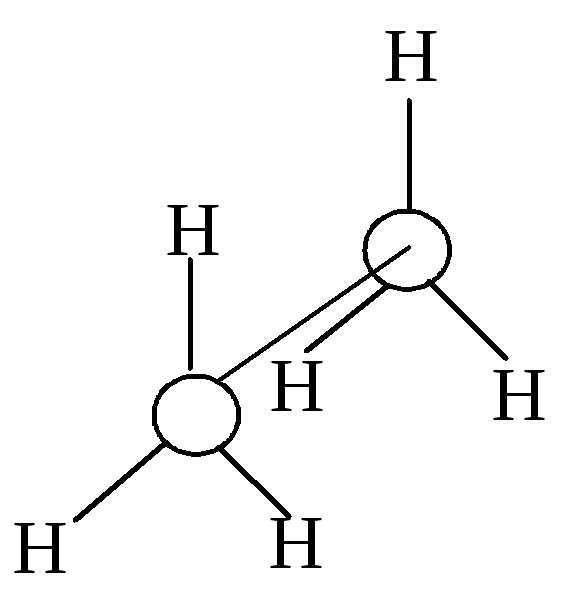
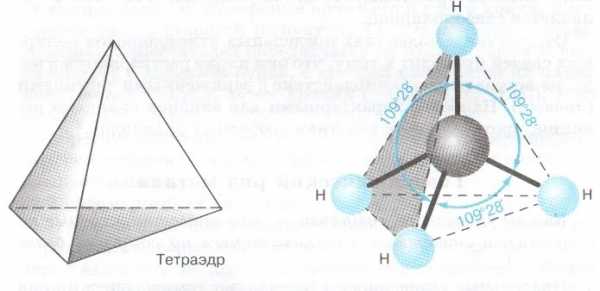
Атом углерода в метане находится в sp3 — гибридном состоянии. Гибридные орбитали имеют большую степень направленности, чем негибридизованные s— и р— орбитали, и в результате большего перекрывания с орбиталями соседнего атома дают более прочные -связи; sp3-гибридные орбитали эквивалентны, направлены к вершинам правильного тетраэдра, угол между орбиталями 109,5, это обеспечивает минимальное отталкивание между ними. Экспериментальные данные подтверждают: метан имеет тетраэдрическую структуру, все связи углерод — водород одинаковой длины — 10.910-2 нм. Для разрыва CH связи в метане требуется 102 ккал/моль (427103 Дж/моль).
В молекуле этана -связь между атомами углерода Н3ССН3 обладает цилиндрической симметрией. Поэтому в молекуле этана две метильные группы вращаются вокруг углерод — углеродной связи почти свободно.
Различные расположения групп и атомов в пространстве, возникающие в результате поворота одного атома относительно другого вдоль линии связи, соединяющей эти атомы, называются конформациями.
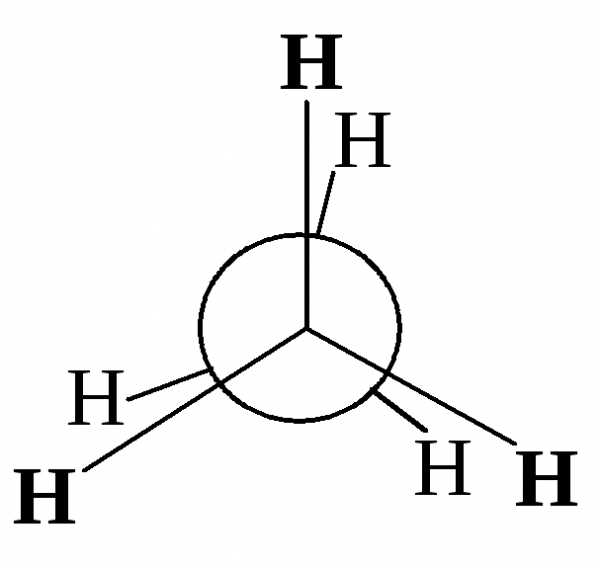
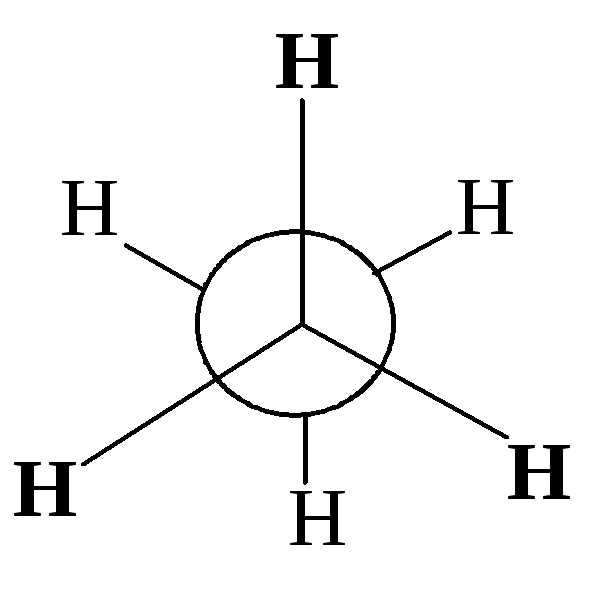
Однако вращение одной метильной группы относительно другой не совсем свободно. Потенциальная энергия молекулы минимальна для заторможенной конформации II, при вращении метильной группы она возрастает и достигает максимума для заслонённой конформации I. Избыток энергии заслонённой конформации по сравнению с заторможенной называют энергией торсионного напряжения. Для молекулы этана эта энергия равна 13·103 Дж/моль (рис. 1.1).
|
|
|
|
|
|
|
Заслоненная конформация этана (I) |
Заторможенная конформация этана (II) |
Считают, что избыток энергии появляется вследствие отталкивания электронных облаков углерод-водородных связей в тот момент, когда они проходят мимо друг друга. Поскольку при комнатной температуре энергия некоторых столкновений молекул может достигать 86·103 Дж/моль, то барьер в 13·103 Дж/моль легко преодолевается. Вращение в этане рассматривают как свободное.
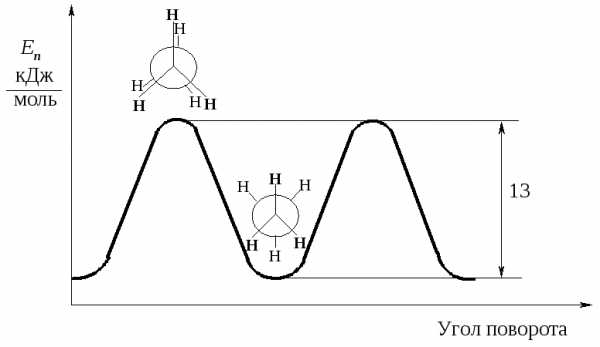
Рис. 5.1. Энергетический профиль вращения групп CH3 в молекуле этана вокруг связи углерод-углерод
Конформации, соответствующие энергетическим минимумам, называют конформационными изомерами или конформерами. В более сложных молекулах число конформеров может быть достаточно большим.
studfiles.net
Дз 2 2 4 выполнение упражнений на составление структурных формул изомеров и названий алканов по систематической международной номенклатуре (июпак) 1 цели
ДЗ 2.2.4
Выполнение упражнений на составление структурных формул изомеров и названий алканов по систематической международной номенклатуре (ИЮПАК).
1. Цели.
закрепить знание понятий «углеводороды», «изомеры», «гомологи», «алканы», «радикал»;
научить студентов самостоятельно определять принадлежность углеводородов к алканам по молекулярным и структурным формулам;
сформировать умения составлять структурные формулы по названиям, называть углеводороды по формулам;
проверить как усвоены знания о номенклатуре и изомерии алканов.
Развивающие: развивать умения анализировать, сравнивать, переводить вербальную информацию в визуальную знаковую систему, и наоборот;
Воспитательные: способствовать формированию научного мировоззрения.
Рекомендуемая литература:
Саенко О. Е. Химия. Учебник для колледжей. Ростов на Дону, 2008.
Габриелян О. С. Химия. Учебник для студентов среднего профессионального образования. –М.:Академия, 2008.
Кузьменко Н.Е., Еремин В.В., Попков В.А. Химия. Для школьников старших классов и поступающих в вузы. – М.: ОНИКС 21 век: Мир и образование, 2002. – С. 177–236.
Урок № 49
Устный опрос по теме: Алканы
Вопросы к теме:
Какие органические вещества называются углеводородами?
Какие углеводороды называются предельными и почему?
Дайте определение «алканы». Какова их общая формула?
Что такое гомологический ряд и гомологи?
Приведите состав и названия первых десяти представителей гомологического ряда метана.
Дайте определение «радикал». Объясните, как строятся их названия.
Что такое изомерия и изомеры?
Какие типы изомерии характерны для алканов?
Какой тип гибридизации в молекулах алканов?
Охарактеризуйте одинарную связь (вид связи, угол, длину).
Что значит первичные, вторичные, третичные и четвертичные атомы углерода?
Повторите!
Алгоритм 1. Номенклатура алканов
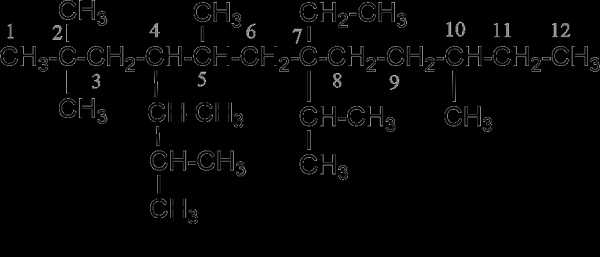
Задание 1. Назвать вещество по систематической номенклатуре:
Решение:
1. Выбрать главную цепь (наиболее длинная цепь углеродных атомов):
2. Пронумеровать атомы углерода в главной цепи с того конца, к которому ближе стоит заместитель (углеводородный радикал):
Последовательно назвать:
1) номер углеродного атома, с которым связан радикал;
2) радикал;
3) углеводород, которому соответствует длинная цепь: 2-метилбутан.
Задание 2. Составить структурную формулу углеводорода по его названию «2,3-диметилпентан».
Решение:
Анализируем название углеводорода, начиная с конца слова.
1. «Пентан» – в главной цепи находится пять атомов углерода:
2. «Диметил» – в состав углеводорода входят два радикала CH3.
3. «2, 3-» – радикалы находятся у 2-го и 3-го углеродных атомов:
4. Дописать недостающие атомы водорода, соблюдая четырехвалентность атома углерода:
Алгоритм 2. Гомологи и изомеры
Задание 3. Для 2,2,3-триметилпентана составить формулы двух гомологов и двух изомеров.
Решение:
1. Составить формулу исходного вещества, используя задание 2 алгоритма 1:
2. Составить формулы г о м о л о г о в, сохраняя строение (разветвление 2,2,3-триметил-). Для этого уменьшить главную цепь на группу СН2 (гомологическая разность) – пример а или увеличить главную цепь на СН2 – пример б:
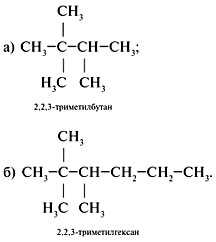
3. Составляя формулы и з о м е р о в, изменить строение, сохраняя состав исходного углеводорода (C8H18), примеры в, г:
Домашнее задание №3
Задания для самостоятельного решения
Задание 1. Какие из приведенных ниже формул отвечают предельным углеводородам: С4Н8, С8Н:8, С6Н6, С3Н8, С20Н42, С11Н22?
Задание
2. Напишите
структурные формулы следующих алканов:
а) 2,3-диме-
тилпентан; б) З-метил-3-этилпентан;
в) 2,3,4-триметил-З-изопропил-
гексан; г)
2,2,4,6-тетраметилгептан; д)
2-метил-3,3-диэтилоктан.
Задание 3. Назовите предельные углеводороды:
Задание 4. Составьте структурную формулу 2,4,5,5-тетраметил-3-этилоктана. Укажите все первичные, вторичные, третичные и четвертичные углеродные атомы. Составьте для этого вещества два гомолога и два изомера, назовите их.
Задания повышенного уровня сложности:
Задание 1. Напишите формулу 2,5-диметил-3,4-диэтилгексана. Приведите формулу его изомера, в молекуле которого содержатся три третичных атома углерода.
Задание 2. В молекуле алкана имеются только первичные и третичные атомы углерода. Первичных атомов в два раза больше, чем третичных. Напишите формулу такого алкана.
gigabaza.ru
Предельные углеводороды
Алканы
Алканы образуют гомологический ряд, каждое химическое соединение которого по составу отличается от последующего и предыдущего на одинаковое число атомов углерода и водорода – CH2, а вещества, входящие в гомологический ряд, называются гомологами. Гомологический ряд алканов представлен в таблице 1.
Таблица 1. Гомологический ряд алканов.
| Название вещества | Структурная формула |
|---|---|
|
Метан |
CH4 |
|
Этан |
C2H6 |
|
Пропан |
C3H8 |
|
Бутан |
C4H10 |
|
Пентан |
C5H12 |
|
Гексан |
C6H14 |
|
Гептан |
C7H16 |
|
Октан |
C8H18 |
|
Нонан |
C9H20 |
|
Декан |
C10H22 |
В молекулах алканов выделяют первичные (т.е. связанные одной связью), вторичные (т.е. связанные двумя связями), третичные (т.е. связанные тремя связями) и четвертичные (т.е. связанные четырьмя связями) атомы углерода.
C1H3 – C2H2 – C1H3 (1 – первичные, 2- вторичные атомы углерода)
CH3 –C3H(CH3) – CH3 (3- третичный атом углерода)
CH3 – C4(CH3)3 – CH3 (4- четвертичный атом углерода)
Изомерия
Для предельных углеводородов характерны структурная изомерия (изомерия углеродного скелета). Так, у пентана имеются следующие изомеры:
CH3-CH2-CH2-CH2-CH3 (пентан)
CH3 –CH(CH3)-CH2-CH3 (2-метилбутан)
CH3-C(CH3)2-CH3 (2,2 – диметилпропан)
Для алканов, начиная с гептана, характерна оптическая изомерия.
Строение
Атомы углерода в предельных углеводородах находятся в sp3 –гибридизации. Рассмотрим это на примере метана – CH4. Молекула метана в общем виде соответствует формуле AB4. Центральный атом – атом углерода, атомы водорода – лиганды.
6С 1s22s22p2
Основное состояние
Чтобы принять четыре атома водорода, атому углерода необходимо перейти в возбужденное состояние:
1H 1s1
В гибридизацию вступают все валентные электроны углерода, следовательно, атом углерода находится в sp3-гибридизации. Углы между связями в молекулах алканов 109,5.
Физические свойства
При обычных условиях С1-С4 – газы, С5-С17 – жидкости, начиная с С18 – твердые вещества. Алканы практически нерастворимы в воде, но, хорошо растворимы в неполярных растворителях, например, в бензоле.
Получение
Алканы получают из природных источников – природного газа (80-90% — метан, 2-3% — этан и другие предельные углеводороды), угля, торфа, древесины, нефти и горного воска.
Выделяют лабораторные и промышленные способы получения алканов. В промышленности алканы получают из битумного угля (1) или по реакции Фишера-Тропша (2):
nC + (n+1)H2 = CnH2n+2 (1)
nCO + (2n+1)H2 = CnH2n+2 + H2O (2)
К лабораторным способам получения алканов относят: гидрирование непредельных углеводородов при нагревании и в присутствии катализаторов (Ni, Pt, Pd) (1), взаимодействием воды с металлоорганическими соединениями (2), электролизом карбоновых кислот (3), по реакциям декарбоксилирования (4) и Вюрца (5) и другими способами.
R1-C≡C-R2 (алкин) → R1-CH=CH-R2 (алкен) → R1-CH2 – CH2 -R2 (алкан) (1)
R-Cl + Mg → R-Mg-Cl + H2O → R-H (алкан) + Mg(OH)Cl (2)
CH3COONa↔ CH3COO— + Na+
2CH3COO— → 2CO2↑ + C2H6 (этан) (3)
CH3COONa + NaOH → CH4 + Na2CO3 (4)
R1-Cl +2Na +Cl-R2 →2NaCl + R1-R2 (5)
Химические свойства
При обычных условиях алканы химически инертны — не реагируют ни с кислотами, ни со щелочами. Это объясняется высокой прочностью -связей С-С и С-Н. Неполярные связи С-С и С-Н способны расщепляться только гомолитически под действием активных свободных радикалов. Поэтому алканы вступают в реакции, протекающие по механизму радикального замещения. При радикальных реакция в первую очередь замещаются атомы водорода у третичных, затем у вторичных и первичных атомов углерода.
Галогенирование. При взаимодействии алканов с хлором и бромом при действии УФ-излучения или высокой температуры образуется смесь продуктов от моно- до полигалогензамещенных алканов:
CH4 + Cl2 = CH3Cl + HCl (хлорметан)
CH3Cl +Cl2 = CH2Cl2 + HCl (дихлорметан)
CH2Cl2 +Cl2 = CHCl3 + HCl (трихлорметан)
CHCl3 +Cl2 = CCl4 + HCl (тетрахлорметан)
Нитрование (реакция Коновалова). При действии разбавленной азотной кислоты на алканы при 140С и небольшом давлении протекает радикальная реакция:
CH3-CH3 +HNO3 = CH3-CH2-NO2 (нитроэтан) + H2O
Крекинг – радикальный разрыв связей С-С. Протекает при нагревании и в присутствии катализаторов. При крекинге высших алканов образуются алкены, при крекинге метана и этана образуется ацетилен:
С8H18 = C4H10 (бутан)+ C3H8 (пропан)
2CH4 = C2H2 (ацетилен) + 3H2↑
Окисление. При мягком окислении метана кислородом воздухха могут быть получены метанол, муравьиный альдегид или муравьиная кислота. На воздухе алканы сгорают до углекислого газа и воды:
CnH2n+2 + (3n+1)/2 O2 = nCO2 + (n+1)H2O
Примеры решения задач
ru.solverbook.com
10 класс. Химия. Алканы — Алканы. Строение молекул, номенклатура, физические свойства
Комментарии преподавателя
В таблице представлены некоторые представители ряда алканов и их радикалы.
|
Формула |
Название |
Название радикала |
|
Ch5 |
метан |
— Ch4 метил |
|
C2H6 |
этан |
— C2H5 этил |
|
C3H8 |
пропан |
— C3H7 пропил |
|
C4h20 |
бутан |
— C4H9 бутил |
|
C4h20 |
изобутан |
изобутил |
|
C5h22 |
пентан |
пентил |
|
C5h22 |
изопентан |
изопентил |
|
C5h22 |
неопентан |
неопентил |
|
C6h24 |
гексан |
гексил |
|
C7h26 |
гептан |
гептил |
|
C10h32 |
декан |
децил |
Тренажёр «Гомологический ряд алканов»
Из таблицы видно, что эти углеводороды отличаются друг от друга количеством групп — СН2 -.Такой ряд сходных по строению, обладающих близкими химическими свойствами и отличающихся друг от друга числом данных групп называется гомологическим рядом. А вещества, составляющие его называются гомологами.
Гомологи – вещества сходные по строению и свойствам, но отличающиеся по составу на одну или несколько гомологических разностей (- СН2 -)
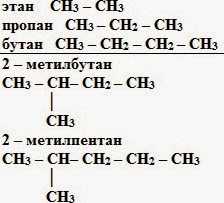
Углеродная цепь — зигзаг (если n ≥ 3)
σ – связи (свободное вращение вокруг связей)
длина (-С-С-) 0,154 нм
энергия связи (-С-С-) 348 кДж/моль
Все атомы углерода в молекулах алканов находятся в состоянии sр3-гибридизации
угол между связями С-C составляет 109°28′, поэтому молекулы нормальных алканов с большим числом атомов углерода имеют зигзагообразное строение (зигзаг). Длина связи С-С в предельных углеводородах равна 0,154 нм (1нм=1*10-9м).
Образование молекулы метана
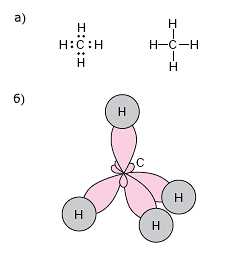
а) электронная и структурная формулы;
б) пространственное строение
Тренажёр «Состав и строение алканов»
4. Изомерия – характерна СТРУКТУРНАЯ изомерия цепи с С4
Один из этих изомеров (н-бутан) содержит неразветвленную углеродную цепь, а другой — изобутан — разветвленную (изостроение).
Атомы углерода в разветвленной цепи различаются типом соединения с другими углеродными атомами. Так, атом углерода, связанный только с одном другим углеродным атомом, называется первичным, с двумя другими атомами углерода – вторичным, с тремя – третичным, с четырьмя – четвертичным.
С увеличением числа атомов углерода в составе молекул увеличиваются возможности для разветвления цепи, т.е. количество изомеров растет с ростом числа углеродных атомов.

Сравнительная характеристика гомологов и изомеров
1. Свою номенклатуру имеют радикалы (углеводородные радикалы)
|
Алкан — ан Сnh3n+2 |
Радикал (R) — ил Сnh3n+1 |
||
|
ФОРМУЛА |
НАЗВАНИЕ |
ФОРМУЛА |
НАЗВАНИЕ |
|
метан |
метил |
||
|
этан |
этил |
||
|
пропан |
пропил |
||
|
изопропил (втор-пропил) |
|||
|
бутан |
н — бутил |
||
|
втор-бутил |
|||
|
изобутан (2 – метилпропан) |
изобутил (перв-изобутил) |
||
|
трет-бутил |
|||
|
неопентан (2,2-диметилпропан) |
нео-пентил |
||
2. Число одинаковых заместителей указывают при помощи множительных приставок:
два – «ди»
три – «три»
четыре – «тетра»
пять – «пента»
шесть – «гекса»
семь – «гепта»
восемь – «окта»
девять – «нано»
Для названия предельных углеводородов применяют в основном систематическую(международная номенклатура IUPAC) и рациональную номенклатуры.
I. По рациональной номенклатуре алканы рассматривают как производные простейшего углеводорода — метана, в молекуле которого один или несколько водородных атомов замещены на радикалы. Эти заместители (радикалы) называют по старшинству (от менее сложных к более сложным). Если эти заместители одинаковые, то указывают их количество. В основу названия включают слово «метан»:
II. Систематическая номенклатура
Правила систематической номенклатуры:
1. В формуле молекулы алкана выбираем главную цепь — самую длинную.
2. Затем эту цепь нумеруем с того конца, к которому ближе расположен заместитель (радикал). (Если заместителей несколько, то поступают так, чтобы цифры, указывающие их положение,
www.kursoteka.ru
Алканы Алкены Алкины Арены
9
АЛКАНЫ (общая формула СnH2n+2; атом углерода – в SP3 гибридизации)
1. Основные положения теории химического строения А.М. Бутлерова
Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называется ее химическим строением и отражается одной структурной формулой (формулой строения).
Химическое строение можно устанавливать химическими методами. (В настоящее время используются также современные физические методы).
Свойства веществ зависят от их химического строения.
По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы — предвидеть свойства.
Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга.
Теория Бутлерова явилась научным фундаментом органической химии и способствовала быстрому ее развитию. Опираясь на положения теории, А.М. Бутлеров дал объяснение явлению изомерии, предсказал существование различных изомеров и впервые получил некоторые из них.
НОМЕНКЛАТУРА это система правил, позволяющих дать однозначное название каждому индивидуальному веществу.
В настоящее время общепринятой является систематическая номенклатура ИЮПАК (IUPAC – International Union of the Pure and Applied Chemistry – Международный союз теоретической и прикладной химии).
Наряду с систематическими названиями используются также тривиальные (обыденные) названия.
Для применения номенклатуры ИЮПАК необходимо знать названия и строение определенных фрагментов молекул – органических радикалов.
Органические соединения описывают с помощью молекулярных формул, представляющих собой линейную запись символов элементов в определенной последовательности с указанием числа атомов посредством численного индекса справа внизу. Структурная формула определяет последовательность атомов в молекуле с учетом структурной изомерии (скелетной, положения, цепь–цикл, функциональной).
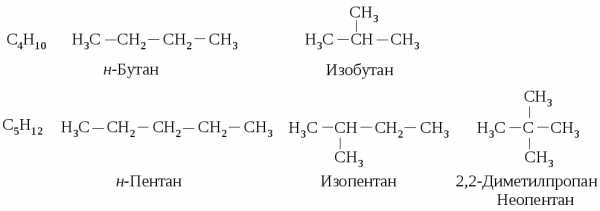
Скелетная изомерия отражает строение углеводородной цепи (скелета):
|
Линейный пентан СН3— СН2-СН2-СН2-СН3 1 2 3 4 5 |
Изомер пентана СН3-СН-СН2-СН3 xxxxСН3 |
Изомер пентана СН3 СН3 – С- СН3 СН3 |
|
пентан |
2-метилбутан |
2,2-диметилпропан |
Используя названия разветвленных радикалов, приведенных в таблице.
При замыкании углеводородной цепи в цикл с потерей двух атомов водорода образуются моноциклоалканы с общей формулой CnH2n. Циклизация начинается с C3, названия образуются от Cn с префиксом цикло:
Е н 20-22 10-12 5-5.5 0 ~ 2 ккал/моль
Неустойчивость плоских циклов вызвана значительной деформацией валентных углов. При сохранении тетраэдрических валентных углов в sp3 гибридизации (С-С-Н = 109о28,) для циклогексана C6H12возможны две устойчивые конформации: в форме кресла (а) и в форме ванны (б):
========================================================
АЛКЕНЫ И АЛКИНЫ
Алкены (олефины) – ненасыщенные ациклические углеводороды с одной двойной связью, общая формула гомологического ряда CnH2n. Название образуется от углеводорода с наиболее длинной цепью, содержащей двойную связь, с добавлением суффикса -ен. Цифрой указывается положение двойной связи. В табл. 12.3 приведены первые четыре алкена, число изомеров которых увеличивается не только из-за изомерии скелета, но также изомерии положения двойной связи и геометрической изомерии (цис-транс). Названия одновалентных радикалов получают добавлением -ил к названию соответствующего углеводорода.

Алкены ациклического ряда CnH2n.
Полиалкены бывают трех типов:
С изолированными двойными связями
CH2=CH—CH2—CH2—CH=CH2 1,5-гексадиен
С сопряженными двойными связями
CH2=CH-CH=CH2 1,3-бутадиен (используется при получении полимеров)
В полиалкенах с сопряженными (чередующимися) двойными связями происходит делокализация π-электронов. Соединения с двойными связями легко полимеризуются.
Алкины (ацетиленовые углеводороды) содержат тройную связь. Общая формула алкина с одной тройной связью CnH2n–2. Название образуется от соответствующего углеводорода с добавлением суффикса -ин. В табл. 12.4 приведены первые пять алкинов.

АРЕНЫ
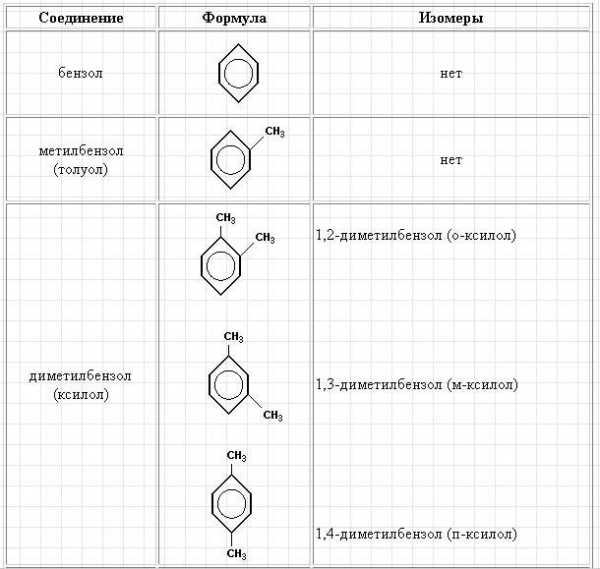
Арены (ароматические углеводороды) составляют многочисленный класс циклических углеводородов с делокализованными π-электронами. Эта делокализация обусловлена сопряженными двойными связями. Поэтому моноциклические арены изображаются шестиугольником с чередующимися простыми и двойными связями или шестиугольником с внутренней окружностью, символизирующей делокализацию π-электронов.
|
|
|
Ароматические соединения. |
Моноциклические арены называют бензоидными. Одновалентные радикалы (арилы) называют
В таблице приведены некоторые моноциклические арены и их ди- и тризамещенные производные. Видно, что последние могут иметь не более трех изомеров.
studfiles.net
Насыщенные углеводороды (алканы) — Углеводороды — Органическая химия — Химия
Насыщенные углеводороды (алканы)
Метан
Простейшая органическое вещество — метан — имеет молекулярную формулу .Структурная формула метана:
Электронная формула метана:
Молекула метана имеет форму тетраэдра: в центре — атом Углерода, в вершинах — атомы Водорода, соединения направлены к вершинам тетраэдра под углом .
Физические свойства метана. Газ без цвета и запаха, легче воздуха, малорастворим в воде.
Распространение метана в природе. В природе метан образуется при гниении растительных остатков без доступа воздуха.
Метан является основной составной частью природного газа.
Получение метана.
1) С натрий ацетата:
2) Синтезом из углерода и водорода (400-500 и повышенное давление):
3) С алюминий карбида:
Химические свойства метана.
1) Горение:
— при достаточном количестве кислорода образуется углекислый газ и вода:
— при недостаточном количестве кислорода образуется угарный газ и вода:
— или углерод и вода:
Смесь метана с воздухом взрывоопасна.
2) Термическое разложение без доступа кислорода на углерод и водород: .
3) Взаимодействие метана с галогенами, в частности хлором, проходит по цепным вільнорадикальним механізмом.
В молекулах хлора под действием света происходит разрыв связей и образуются свободные радикалы хлора:
По типу эта реакция относится к реакциям замещения.
В результате хлорирования могут образовываться хлорметан , дихлорметан , трихлорметан (хлороформ) , тетрахлорметан (четыреххлористый карбон) .
Применение метана. Метан в больших количествах расходуется в качестве топлива. Из него получают водород, ацетилен, сажу. Он используется в органических синтезах, в частности, для получения формальдегида, метанола, муравьиной кислоты и других синтетических продуктов.
Гомологический ряд алканов
Гомологический ряд метана имеет несколько названий: алканы,или насыщенные вуглеводни, парафини. Состав молекул всех членов гомологического ряда может быть выражен одной общей формуле. Для алканов это формула .Представители гомологического ряда алканов
Изомерия. Изомерия — это явление, при котором вещества одинакового состава имеют различную пространственную структуру и, соответственно, свойства.
Изомеры имеют одинаковый состав, но разное строение.
По заместительной номенклатуре основой для названия служит один карбонний цепьюг, а все остальные фрагменты молекулы рассматриваются как заместительи. Заместителями могут быть свободные радикалы, образованные алканами.
Радикалы, образованные алканами
| Алкан | Радикал | ||
| Формула | Название | Формула | Название |
| Метан | Метил | ||
| Этан | Этил | ||
| C3H8 | Пропан | Пропил | |
| Бутан | Бутил | ||
Чтобы дать название ізомерови, нужно:
— выделить цепь с наибольшим количеством атомов Углерода — главный цепьюг, посчитать в ней количество атомов Углерода; соответствующее название углеводорода будет основой названия изомерам;
— определить, к какому по счету атома Карбона прикрепляется радикал. Это значение будет записано цифрой в начале названия;
— определить название радикала с числом атомов Углерода в нем.
Потом дописываются атомы Водорода.
Например:
2, 3-диметилгексан
Физические свойства алканов. При обычных условиях первые четыре члена гомологического ряда алканов — газы. Нормальные алканы от пентана до гептадекану — жидкости, начиная с и выше — твердые вещества.
По мере увеличения числа атомов в цепи, т.е. с ростом относительной молекулярной массы, возрастают температуры кипения и плавления алканов.
Алканы практически нерастворимы в воде, потому что их молекулы малополярні и не взаимодействуют с молекулами воды, но хорошо растворяются в неполярных органических растворителях, таких как бензен, тетрахлорметан. Жидкие алканы легко смешиваются друг с другом.
Получение алканов.
1) Гидрирование (присоединение водорода) непредельных углеводородов:
2) Реакция Вурца, что служит для увеличения карбонного цепи:
или
Химические свойства алканов.
1) Не вступают в реакции присоединения.
2) Горят:
3) Разлагаются при нагревании:
4) Вступают в реакции галогенування (реакции замещения):
5) При нагревании и под действием катализаторов происходит крекинг — гомолітичний разрыв С-С связей. При этом образуются алканы и низшие алканы, например:
6) При дегідруванні метана и этилена образуется ацетилен :
na-uroke.in.ua