Абсолютная и относительная масса атомов и молекул
Масса атомов и молекул, выраженная в граммах или килограммах (г, кг), называется абсолютной (обозначается m).
На практике пользоваться абсолютными массами атомов и молекул часто оказывается неудобно, прежде всего из-за их величины (например, m(С)= 1,993•10-26 кг), поэтому, наряду с абсолютными, пользуются относительными массами атомов и молекул, т.е. массами определенными относительно 1/12 части массы атома углерода 12С, принятой за единицу и называемой атомной единицей массы (а.е.м.).
Абсолютная масса атомной единицы массы:
m(а.е.м.)= 1/12 m(С)=1/12•1,993•10-26кг = 1,66•10-27 кг= 1,66•10-24 г
Относительной атомной массой (Аr) (r – от «relative» — относительный) химического элемента называется число, показывающее во сколько раз данный атом тяжелее 1/12 части атома
Значение Аr приведены в таблице химических элементов Д.И.Менделеева.
Относительной молекулярной массой (Мr) вещества называется число, показывающее во сколько раз данная молекула тяжелее 1/12 атома 12С.
Из формул (1) и (2) следует, что Аr и Mr величины безразмерные.
Из формул (1) и (2) вытекает также связь между абсолютной и относительной массами атома и молекулы:
m(атома) = Ar • 1,66•10-27 кг
m(молекулы) = Мr • 1,66•10-27 кг
Масса молекулы равна сумме масс атомов, из которых молекула состоит
Мr = ∑ Ar
Например, Мr (О2) = 2 Ar (O)
= 2•16=32,Мr (H2O) = 2 Ar (H) + Ar (O) = 2•1 + 16=18,
Мr (Н2SO4) = 2 Ar (H) + Ar (S) + 4Ar (O) = 2•1+32+ 4•16=98.
При определении Мr ионных соединений (солей, кислот и щелочей) структурной единицей вещества условно считается молекула.
Относительная молекулярная масса кристаллогидрата:
Мr (кристаллогидрата)=Мr(безводной соли) +n Mr(H2O)
Например:
Мr(Na2SO4•10H2O) = Мr (Na2SO4) + 10•Мr(H2O) = 142 + 10•18 =322
Допускается также выражение относительной атомной и молекулярной масс в а.е.м.
Например:
Мr(O2) = 32 а.е.м., Мr(H2O) = 18 а.е.м., Мr(Н2SO4) = 98 а.е.м.
Ar — одна из основных характеристик химического элемента.
Мr — одна из основных характеристик вещества.
Похожие статьи:
poznayka.org
Масса атомов и молекул
Для измерения масс атомов и молекул в физике и химии принята единая система измерения. Эти величины измеряются в относительных единицах.
Атомная единица массы (а.е.м.) равна 1/12 массы m атома углерода 12С (m одного атома 12С равна 1,993Ч10-26кг).
Относительная атомная масса элемента (Ar) — это безразмерная величина, равная отношению средней массы атома элемента к 1/12 массы атома 12С. При расчете относительной атомной массы учитывается изотопный состав элемента. Величины Ar определяют по таблице Д.И. Менделеева
Абсолютная масса атома (m) равна относительной атомной массе, умноженной на 1 а.е.м. Например, для атома водорода абсолютная масса определяется следующим образом:
m (H) = 1,008Ч1,661Ч10-27 кг = 1,674Ч10-27 кг
Относительная молекулярная масса соединения (M r) — это безразмерная величина, равная отношению массы m молекулы вещества к 1/12 массы атома 12С:
Относительная молекулярная масса равна сумме относительных масс атомов, входящих в состав молекулы. Например:
М r (C2H6) = 2Ч A r (C) + 6ЧA r (H) = 2Ч12 + 6 = 30.
Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на 1 а.е.м.
www.examen.ru
1.3.2. Атомная и молекулярная массы
Одной из важнейших характеристик атомов является его масса.
Абсолютной называется масса атома, выраженная в килограммах (граммах).
Абсолютная масса атома (maтома) величина чрезвычайно малая. Так, атом легкого изотопа водорода (протия) имеет массу 1,66 · 10–27 кг.
m(Н)= 1,66 · 10–27 кг, m(Н)= 1,66 · 10–24 г,
атом одного из изотопов кислорода имеет массу 2,67 · 10–26 кг,
m(О)= 2,67 · 10–26 кг, m(О) = 2,67 · 10–23 г,
атом изотопа углерода 12С имеет массу 1,99 · 10–26 кг,
В практических расчётах пользоваться такими величинами крайне неудобно. Поэтому обычно пользуются значениями не абсолютных масс атомов, а значениями относительных атомных масс.
Относительная атомная масса обозначается Ar, индекс r – начальная буква английского слова relative, что значит относительный.
В качестве единицы для измерения масс атомов и молекул принята атомная единица массы (а.е.м.).
Атомная единица массы (а.е.м.) представляет собой 1/12 часть массы атома изотопа углерода 12С, т.е.
а.е.м. = 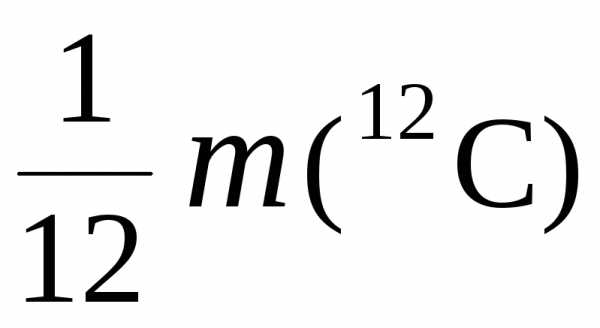 =
=
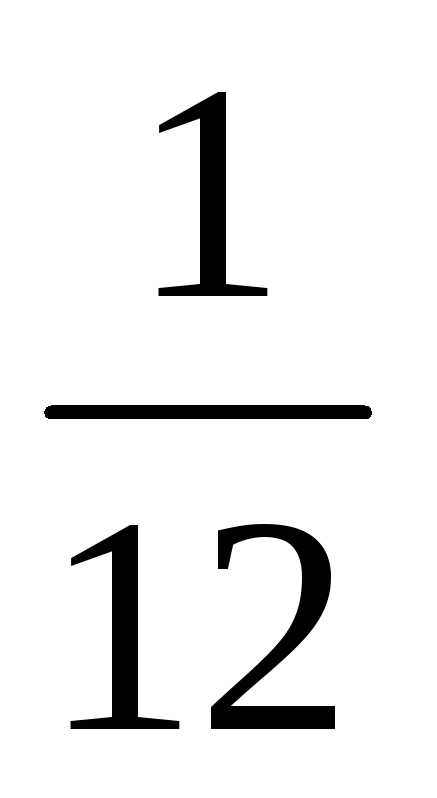 · 1,99 · 10–26
кг =
· 1,99 · 10–26
кг = 
Относительная атомная масса показывает, во сколько раз масса атома данного элемента больше 1/12 части массы атома изотопа углерода 12С, т. е. атомной единицы массы.
Относительная атомная масса является безразмерной величиной, но допускается обозначение ее величины в атомных единицах массы (а.е.м.). Например:
Таким образом, значение относительной атомной массы элемента водорода равно 1,001 или, округленно,
Аr(Н) ≈ 1 а.е.м, а кислорода – Аr(O) = 15,999 ≈ 16 а.е.м.
Значения величин относительных атомных масс элементов приведены в периодической системе Д.И. Менделеева. Эти величины представляют собой усредненное значение массы атома какого-либо элемента с учетом существующих в природе изотопов этого элемента и их количества. Для обычных расчетов следует пользоваться округленными значениями относительных атомных масс элементов (см. табл. 4 приложения).
Аналогично понятиям абсолютная масса атома и относительная атомная масса можно сформулировать понятия абсолютная масса молекулы и относительная молекулярная масса.
Абсолютная масса молекулы (m)мол. – масса молекулы химического вещества, выраженная в килограммах (граммах).
Относительная молекулярная масса (Мr) (или просто молекулярная масса) – масса молекулы, выраженная в атомных единицах массы.
Зная химическую формулу соединения, можно легко определить значение его молекулярной массы, которая определяется как сумма значений атомных масс всех элементов, входящих в состав молекулы вещества.
Например, относительная молекулярная масса серной кислоты Мr(Н2SO4) будет складываться из двух значений относительных атомных масс элемента водорода, одной относительной атомной массы элемента серы и четырех относительных атомных масс элемента кислорода:
Мr(Н2SO4) = 2Аr (Н) + Аr (S) + 4Аr(O) = 2·1 + 32 + 4·16 = 98.
Таким образом, значение молекулярной массы серной кислоты равно 98 или 98 а.е.м.
Молекулярная масса (относительная молекулярная масса) показывает, во сколько раз масса молекулы данного вещества больше 1/12 части массы атома углерода 12С.
В приведенном выше примере значение молекулярной массы серной кислоты равно 98 а.е.м., то есть молекула серной кислоты имеет массу в 98 раз большую, чем 1/12 часть массы атома углерода 12 С.
studfiles.net
Относительная атомная и молекулярная массы — Науколандия
Атомы имеют очень маленький размер и очень маленькую массу. Если выражать массу атома какого-нибудь химического элемента в граммах, то это будет число перед которым находится более двадцати нулей после запятой. Поэтому измерять массу атомов в граммах неудобно.
1/12 часть массы атома углерода называют атомной единицей массы (а. е. м.).
Относительной атомной массой является величина, равная отношению реальной массы атома конкретного химического элемента к 1/12 реальной массы атома углерода. Это безразмерная величина, так как делятся две массы.
Ar = mат. / (1/12)mугл.
Однако абсолютная атомная масса равна относительной по значению и имеет единицу измерения а.е.м.
То есть относительная атомная масса показывает, во сколько раз масса конкретного атома больше 1/12 атома углерода. Если у атома Ar = 12, значит его масса в 12 раз больше 1/12 массы атома углерода, или, другими словами, в нем 12 атомных единиц массы. Такое может быть только у самого углерода (C). У атома водорода (H) Ar = 1. Это значит, что его масса равна массе 1/12 части от массы атома углерода. У кислорода (O) относительная атомная масса равна 16 а.е.м. Это значит, что атом кислорода в 16 раз массивнее 1/12 атома углерода, в нем 16 атомных единиц массы.
Самый легкий элемент — это водород. Его масса примерно равна 1 а.е.м. У самых тяжелых атомов масса приближается к 300 а.е.м.
Обычно для каждого химического элемента его значение абсолютной массы атомов, выраженных через а. е. м. округляют.
Значение атомных единиц массы записаны в таблице Менделеева.
Для молекул используется понятие относительной молекулярной массы (Mr). Относительная молекулярная масса показывает, во сколько раз масса молекулы больше 1/12 массы атома углерода. Но поскольку масса молекулы равна сумме масс составляющих ее атомов, то относительную молекулярную массу можно найти, просто сложив относительные массы этих атомом. Например, в молекулу воды (H2O) входят два атома водорода с Ar = 1 и один атом кислорода с Ar = 16. Следовательно, Mr(Н2O) = 18.
Ряд веществ имеет немолекулярное строение, например металлы. В таком случае их относительную молекулярную массу считают равной их относительной атомной массе.
В химии важным является величина, которая называется массовая доля химического элемента в молекуле или веществе. Она показывает, какая часть относительной молекулярной массы приходится на данный элемент. Например, в воде на водород приходится 2 доли (так как два атома), а на кислород 16. То есть, если смешать водород массой 1 кг и кислород массой 8 кг, то они прореагируют без остатка. Массовая доля водорода равна 2/18 = 1/9, а массовая доля кислорода 16/18 = 8/9.
scienceland.info
Абсолютная масса — атом — Большая Энциклопедия Нефти и Газа, статья, страница 1
Абсолютная масса — атом
Cтраница 1
Абсолютная масса атома чрезвычайно мала, поэтому ее обычно выражают в относительных единицах. [2]
Абсолютная масса атома чрезвычайно мала, поэтому ее обычно выражают в атомных единицах массы ( а. [3]
Как вычисляется абсолютная масса атомов и молекул. [4]
Чему равна абсолютная масса атома: а) золота, б) кальция, в) меди, г) свинца, д) магния, е) брсма, ж) кремния. [5]
Следует четко различать понятия абсолютная масса атома и грамм-атом. Атомы элементов ничтожно малы, и даже миллион самых тяжелых атомов невозможно взвесить на самых чувствительных весах. Однако легко отвесить на весах не только 1 грамм-атом, но даже стотысячную долю его. [6]
Следует четко различать понятия абсолютная масса атома и грамм-атом. Атомы элементов ничтожно малы, и даже миллион самых тяжелых атомов невозможно взвесить на еамых чувствительных весах. Однако легко отвесить на весах не только 1 грамм-атом, но даже стотысячную долю его. [7]
Расчет приведенной массы предполагает знание абсолютных масс атомов. [8]
За единицу атомных масс принимается 1 / 12 часть абсолютной массы атома углерода С. [9]
Частное от деления абсолютной массы молекулы соединения или элемента на одну двенадцатую часть абсолютной массы атома изотопа углерода С, Сумма атомных масс всех элементов молекулы. [10]
Например, относительная атомная масса меди 64 ( округленно) означает, что атом меди в 64 раза тяжелее 1 1а части абсолютной массы атома углерода. [11]
Например, относительная молекулярная масса воды 18 ( ок-ругленно) означает, что молекула воды в 18 раз тяжелее х / 1а части абсолютной массы атома углерода. [12]
Относительная молекулярная масса вещества Мг — это число, которое показывает, во сколько раз абсолютная масса молекулы данного вещества больше 1 / 12 части абсолютной массы атома углерода С. [13]
Электрон в 1837 раз легче атома водорода. Абсолютная масса атома водорода 1 67 10 — 24 г, масса электрона 9 1 10 — 28 г. В природе нет такой частицы, заряд которой был бы меньше заряда электрона. [15]
Страницы: 1 2
www.ngpedia.ru
Формула молекулярной массы элемента в химии
Определение и формула молекулярной массы
Массы атомов и молекул очень малы, поэтому в качестве единицы измерения удобно выбрать массу одного из атомов и выражать массы остальных атомов относительно нее. Именно так и поступал основоположник атомной теории Дальтон, который составил таблицу атомных масс, приняв массу атома водорода за единицу.
До 1961 года в физике за атомную единицу массы (а.е.м. сокращенно) принимали 1/16 массы атома кислорода 16О, а в химии – 1/16 средней атомной массы природного кислорода, который является смесью трех изотопов. Химическая единица массы была на 0,03% больше, чем физическая.
В настоящее время за в физике и химии принята единая система измерения. В качестве стандартной единицы атомной массы выбрана 1/12 часть массы атома углерода 12С.
1 а.е.м. = 1/12 m(12С) = 1,66057×10-27 кг = 1,66057×10-24 г.
Относительная атомная и молекулярная масса элемента
При расчете относительной атомной массы учитывается распространенность изотопов элементов в земной коре. Например, хлор имеет два изотопа 35Сl (75,5%) и 37Сl (24,5%).Относительная атомная масса хлора равна:
Ar(Cl) = (0,755×m(35Сl) + 0,245×m(37Сl)) / (1/12×m(12С) = 35,5.
Из определения относительной атомной массы следует, что средняя абсолютная масса атома равна относительной атомной массе, умноженной на а.е.м.:
m(Cl) = 35,5 ×1,66057×10-24 = 5,89×10-23 г.
Относительная молекулярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы, например:
Mr(N2O) = 2×Ar(N) + Ar(O) = 2×14,0067 + 15,9994 = 44,0128.
Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на а.е.м.
Число атомов и молекул в обычных образцах веществ очень велико, поэтому при характеристике количества вещества используют специальную единицу измерения – моль.
Моль – это количество вещества, которое содержит столько же частиц (молекул, атомов, ионов, электронов), сколько атомов углерода содержится в 12 г изотопа 12С.
Масса одного атома 12С равна 12 а.е.м., поэтому число атомов в 12 г изотопа 12С равно:
NA = 12 г / 12 × 1,66057×10-24 г = 1/1,66057×10-24 = 6,0221×10-23.
Таким образом, моль вещества содержит 6,0221×10-23 частиц этого вещества.
Физическую величину NA называют постоянной Авогадро, она имеет размерность [NA] = моль-1. Число 6,0221×10-23 называют числом Авогадро.
Молярная масса вещества
Легко показать, что численные значения молярной массы М и относительной молекулярной массы Mr равны, однако первая величина имеет размерность [M] = г/моль, а вторая безразмерна:
M = NA × m (1 молекулы) = NA × Mr × 1 а.е.м. = (NA ×1 а.е.м.) × Mr = × Mr.
Это означает, что если масса некоторой молекулы равна, например, 44 а.е.м., то масса одного моля молекул равна 44 г.
Постоянная Авогадро является коэффициентом пропорциональности, обеспечивающим переход от молекулярных отношений к молярным.
Примеры решения задач
ru.solverbook.com
Закон зквивалентов. Абсолютная масса атома, молекулы | Задачи 18
Задание 18.
Исходя из молярной массы углерода и воды, определите абсолютную массу атома углерода и молекулы воды в граммах.
Решение:
Моль – это количество вещества, в котором содержится число частиц любого определённого сорта равное постоянной Авогадро (6,02 . 1023). Молярная масса вещества – это масса одного моля, выраженная в граммах
(г/моль) и численно равная его относительной молекулярной (атомной) массе, выраженной в атомных единицах массы (а. е. м. ). Так как атомная масса углерода и молекулярная масса воды соответственно равны 12 и 18 а. е.м., то их молярные массы равны: М(С) = 12 г/моль; М(Н2О) = 18 г/моль. Исходя из того, что 1 моль любого вещества содержит 6,02 . 1023 частиц (атомов или молекул). Рассчитаем массу атома углерода и массу молекулы воды, получим:
- m = M/NA; m = 12/6,02 . 1023 = 2 . 10-23 г; m = 18/6,02 . 1023 = 3 . 10-23 г.
Ответ: 2,0 . 10-23 г; 3,0 . 10-23 г.
Задание 19.
На нейтрализацию 9,797 г ортофосфорной кислоты израсходовано 7,998 г NаОН. Вычислите количество вещества эквивалента, молярную массу эквивалента и основность Н3РО4 в этой реакции. На основании расчета напишите уравнение реакции.
Решение:
М(H3PO4) = 98 г/моль; М(NaOH) = 40 г/моль; МЭ(NaOH) = 40 г/моль.
Согласно закону эквивалентов массы (объёмы) реагирующих веществ m1 и m2 пропорциональны их молярным массам (объёмам):
Количество вещества эквивалента равно:
Э = МЭ(H3PO4)/ М(H3PO4) = 49/98 = 0,5 моль.
Основность кислоты определяем делением молекулярной массы на молярную массу эквивалента , получим: М(H3PO4)/ МЭ(H3PO4) = 98/49 = 2. Исходя из того, что основность кислоты равна 2, то количество вещества эквивалента кислоты равно 0,5 моль (1/2 = 0,5).
Уравнение реакции имеет вид:
H3PO4 + 2NaOH = Na2HPO4 + 2h3O
Ответ: 0,5 моль; 49 г/моль; 2.
buzani.ru
