Урок химии в 9 классе на тему:»Теория электролитической диссоциации»
9 класс
Тема: Теория электролитической диссоциации.
(слайд 2)
Изучив тему, следует
знать:
Основные положения теории электролитической диссоциации. Кислоты, основания и соли с точки зрения ТЭД. Условия течения реакций ионного обмена до конца.
(слайд 3. далее возврат к слайду 2 и по плану с помощью гиперссылки)
уметь:
Писать уравнения диссоциации кислот, оснований и солей. Определять реакции ионного обмена, идущие до конца, составлять уравнения реакций в молекулярном и ионном виде.
Оснащенность: компьютерная презентация «Теория электролитической диссоциации», таблица растворимости кислот, солей и оснований, дидактические материалы.
План проведения занятий
Организационный момент
2. Мотивация занятия
Растворы широко применяются в различных сферах деятельности человека. Они имеют большое значение для живых организмов Сложные физико-химические процессы в организмах человека, животных и растений протекают в растворах. В различных производственных и биологических процессах большую роль играют растворы электролитов. Свойства этих растворов объясняет теория электролитической диссоциации. Знание ТЭД является основой для изучения свойств неорганических и органических соединений, для глубокого понимания механизмов химических реакций в растворах электролитов.
3. Объяснение нового материала
План лекции:
1. Основные положения теории электролитической диссоциации
2. Кислоты, основания и соли с точки зрения ТЭД
3. Условия течения реакций ионного обмена до конца
4. Диссоциация воды. Водородный показатель
1. Основные положения теории электролитической диссоциации(слайд 4.)
В первой половине 19 в. М. Фарадей ввел понятие об электролитах и неэлектролитах.
Электролиты – вещества, водные растворы или расплавы которых проводят электрических ток.
Неэлектролиты – вещества, водные растворы или расплавы которых не проводят электрический ток
(слайд 5.)
К электролитам относятся соли, кислоты, основания. В молекулах этих веществ имеются ионные или ковалентные сильно полярные химические связи.
(слайд 6.)
К неэлектролитам относятся вещества, в молекулах которых имеются ковалентные неполярные или малополярные связи. Например, кислород, водород, многие органические вещества – глюкоза, сахароза, бензол, эфиры и др.
Для объяснения электропроводности растворов и расплавов солей, кислот, оснований шведский ученый С. Аррениус создал теорию электролитической диссоциации (1887 г.). Представления о диссоциации электролитов получили развитие в работах русских химиков И.А.Каблукова и В.А. Кистяковского. Они применили к объяснению процесса электролитической диссоциации химическую теорию растворов Д.И. Менделеева.
Основные положения ТЭД:
1. Молекулы электролитов при растворении в воде или расплавлении распадаются на ионы. Процесс распада молекул электролитов на ионы в растворе или расплаве называется электролитической диссоциацией (или ионизацией)
Ионы – это атомы или группы атомов, имеющие положительный или отрицательный заряд (Na+ , S2-, NO3— и др.)
Положительно заряженные ионы – катионы, отрицательно заряженные ионы – анионы.
К катионам относятся ион водорода Н+, ион аммония NH4+, ионы металлов – Na+, Cu2+ , Al3+ и др.
К анионам относятся гидроксид – ион ОН— , ионы кислотных остатков – Cl—SO42- , PO43- и др.
2. Диссоциация – процесс обратимый. Это значит, что одновременно идут два противоположных процесса: распад молекул на ионы (диссоциация, ионизация) и соединение ионов в молекулы (ассоциация, моляризация).
Диссоциацию молекул электролитов выражают уравнениями, в которых вместо знака равенства ставят знак обратимости (↔).
Например,
Mg(NO3)2 ↔ Mg2+ + 2NO3—
Каждая молекула нитрата магния диссоциирует на ион магния и два нитрат – иона. Следовательно, в результате диссоциации одной молекулы Mg(NO
Общая сумма зарядов катионов и зарядов анионов равна нулю, т.к. молекула электролита нейтральна.
3. Ионы и атомы одних и тех же элементов отличаются друг от друга по строению и свойствам.
4. Ионы вступают во взаимодействие друг с другом – реакции ионного обмена.
(слайд 8-9.)
Механизм электролитической диссоциации
Причины и механизм диссоциации электролитов объясняются теорией растворов Д.И. Менделеева и природой химической связи. Как известно, электролитами являются вещества с ионной или ковалентной сильно полярной связями.
При растворении в воде ионных соединений, например хлорида натрия NaCl, дипольные молекулы воды ориентируются вокруг ионов натрия и хлорид-ионов. При этом положительные полюсы молекул воды притягиваются к хлорид-ионам Cl—, отрицательные полюсы — к положительным ионам натрия Na +.
В результате этого взаимодействия между молекулами растворителя и ионами электролита притяжение между ионами в кристаллической решетке вещества ослабевает. Кристаллическая решетка разрушается, и ионы переходят в раствор. Эти ионы в водном растворе находятся не в свободном состоянии, а связаны с молекулами воды, т.е. являются гидратированными ионами.
При растворении в воде веществ с полярной ковалентной связью происходит взаимодействие дипольных молекул воды с дипольными молекулами электролитов. Например, при растворении в воде хлороводорода, изменяется характер связи в молекуле HCl: сначала связь становится более полярной, а затем переходит в ионную. Результатом процесса является диссоциация электролита и образование в растворе гидратированных ионов.
Таким образом, главной причиной диссоциации в водных растворах является гидратация ионов. В водных растворах все ионы находятся в гидратированном состоянии. Для простоты в химических уравнениях ионы изображают без молекул воды: H
(слайд 10.)
Степень электролитической диссоциации. Сильные и слабые электролиты.
В водных растворах некоторые электролиты полностью распадаются на ионы. Другие электролиты распадаются на ионы частично, часть их молекул остается в растворе в недиссоциированном виде. Для количественной характеристики электролитической диссоциации введено понятие степени электролитической диссоциации, обозначаемое греческой буквой α.
Степень электролитической диссоциации — число, показывающее, какая часть молекул распалась на ионы.
α = число молекул, распавшихся на ионы / общее число растворенных молекул
(слайд 11.)
Степень диссоциации зависит от природы растворяемого вещества и растворителя, концентрации раствора, температуры и других факторов.
При уменьшении концентрации электролита, т.е. при разбавлении раствора, степень диссоциации увеличивается, т.к. увеличивается расстояние между ионами в растворе.
При повышении температуры степень диссоциации, как правило, увеличивается.
В зависимости от степени диссоциации электролиты делятся на сильные и слабые.
(слайд 12.)
Сильные электролиты – это такие электролиты, которые в водных растворах полностью диссоциируют на ионы, т.е. их степень диссоциации равна 1 (100%).
К сильным электролитам относятся:
1) соли,
2) сильные кислоты (HClO4, HClO3, HNO3, H2SO4, HCl, HBr, HI и др.)
3) щелочи (NaOH, KOH, LiOH, Ba(OH)
(слайд 13.)
Слабые электролиты – это такие электролиты, которые в водных растворах не полностью диссоциируют на ионы, т.е. их степень диссоциации меньше 1 (100%), в большинстве случаев она стремится к нулю. К слабым электролитам относятся:
1) cлабые кислоты ( H3PO4, H2S, H2SO3, H2SiO3, H2CO3, HCN, HNO2, HF, CH3COOH и др.)
2) нерастворимые в воде основания (Cu(OH)2, Fe(OH)3 и др.)
3) гидроксид аммония
4) вода
(слайд 14.)
Для характеристики слабых электролитов применяют константу диссоциации КД.
Константа диссоциации характеризует способность слабого электролита диссоциировать на ионы.
Чем > константа диссоциации, тем легче электролит распадается на ионы. Для слабого электролита константа диссоциации – постоянная величина при данной температуре.
2. Кислоты, основания и соли с точки зрения ТЭД
(слайд 15.)
Кислоты – электролиты, которые при диссоциации образуют только один вид катионов – катионы водорода Н+
Составим уравнение электролитической диссоциации сильных кислот:
HCl ↔ H+ + Cl—
H2SO4 ↔ 2H+ + SO42-
Слабые многоосновные кислоты диссоциируют ступенчато. Число ступеней зависит от основности слабой кислоты Hx(Ac), где х – основность кислоты. Например,
H2CO3 ↔ H
HCO3— ↔ H+ + CO32-
К1 > K2
Растворы кислот имеют некоторые общие свойства, которые, согласно ТЭД, объясняются присутствием в их растворах гидратированых ионов водорода Н+ (Н3О+).
(слайд 16.)
Основания — электролиты, которые при диссоциации образуют только один вид анионов — гидроксид-ионы ОН—.
Составим уравнение диссоциации сильных оснований (щелочей)
NaOH ↔ Na+ + OH—
Ba(OH)2 ↔ Ba2+ + 2OH—
Слабые многокислотные основания диссоциируют ступенчато. Число ступеней диссоциации определяется кислотностью слабого основания Ме(ОН)у , где у- кислотность основания.
Например,
Fe(OH)2 ↔ FeOH+ + OH—
FeOH+ ↔ Fe2+ + OH—
К1 > K2
Основания имеют некоторые общие свойства. Общие свойства оснований обусловлены присутствием гидроксид-ионов ОН—.
(слайд 17.)
Амфотерные гидроксиды – это слабые электролиты, которые при диссоциации образуют одновременно катионы водорода Н+ и гидроксид-анионы ОН— , т.е. диссоциируют по типу кислоты и по типу основания.
Составим уравнение электролитической диссоциации гидроксида цинка Zn(OH)2 без учета её ступенчатого характера
2H+ + ZnO22- ↔ H2ZnO2 = Zn(OH)2 ↔ Zn2+ + 2OH—
по типу кислоты по типу основания
(слайд 18.)
Средние (нормальные) соли – сильные электролиты, образующие при диссоциации катионы металла и анионы кислотного остатка.
K2CO3 ↔ 2K+ + CO32-
Al2(SO4)3 ↔ 2Al3+ + 3SO42-
(слайд 19.)
Кислые соли – сильные электролиты, диссоциирующие на катион металла и сложный анион, в состав которого входят атомы водорода и кислотный остаток.
Например,
NaHCO3 ↔ Na+ + HCO3— (α = 1)
Сложный анион (гидрокарбонат-анион) частично диссоциирует:
НСО3— ↔ Н+ + СО32- (α << 1)
(слайд 20.)
Основные соли – электролиты, которые при диссоциации образуют анионы кислотного остатка и сложные катионы, состоящие из атомов металла и гидроксогрупп ОН—.
Например,
Fe(OH)2Cl ↔ Fe(OH)2+ + 2Cl— (α = 1)
Сложный катион FeOH 2+ частично диссоциирует по уравнениям, для обоих ступеней диссоциации α << 1:
Fe(OH)2+ ↔ FeOH 2+ + OH—
FeOH 2+ ↔ Fe3+ + OH—
3. Условия течения реакций ионного обмена до конца
(слайд 21.)
Так как молекулы электролитов в растворах распадаются на ионы, то и реакции в растворах электролитов происходят между ионами.
Реакции, протекающие между ионами, называются ионными реакциями.
(слайд 22.)
Условия течения реакций обмена между сильными электролитами в водных растворах до конца:
1) образование малорастворимых веществ (осадки)
2) образование газообразных или летучих веществ
3) образование малодиссоциирующих веществ — слабых электролитов
Далее по гиперссылке
(слайд 23-25.)
Рассмотрим эти случаи
1. Реакции с образованием малорастворимых веществ, выпадающих в осадок
AgNO3 + HCl → AgCl↓ + HNO3
Ag+ + NO3— + H+ + Cl— → AgCl↓ + H+ + NO3—
Ag+ + Cl— → AgCl↓
2. Реакции, протекающие с образованием газообразных или летучих веществ
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
2Na++ CO32- + 2H+ + 2Cl— → 2Na+ + 2Cl— + CO2↑ + H2O
CO32- + 2H+ → CO2↑ + H2O
3. Реакции, идущие с образованием малодиссоциирующих веществ (слабых электролитов)
NaOH + HCl → NaCl + H2O
Na+ + OH— + H+ + Cl— → Na+ + Cl— + H2O
OH— + H+ → H2O
(слайд 26.)
Если исходными веществами реакций обмена являются сильные электролиты, которые при взаимодействии не образуют малорастворимых или малодиссоциирующих веществ, то такие реакции не протекают.
Например,
2NaCl + Ca(NO3)2 ≠ 2NaNO3 + CaCl2
4. Диссоциация воды. Водородный показатель
(слайд 27.)
Вода – слабый амфотерный электролит. Уравнение диссоциации воды имеет вид:
H2O ↔ H+ + OH—
При 250С [Н+] = [ОН—] = 10-7 моль/л.
Произведение концентраций ионов водорода и гидроксид-ионов называется ионным произведением воды (К н2о)
К н2о – величина постоянная, и при температуре 25
К н2о = 10-7 ∙ 10-7 = 10-14
(слайд 28.)
Ионное произведение воды дает возможность для любого водного раствора вычислить концентрацию гидроксид-ионов, если известна концентрация ионов водорода, и наоборот.
Среду любого водного раствора можно охарактеризовать концентрацией ионов водорода Н+ или гидроксид-ионов ОН—.
Водородным показателем рН называется отрицательный десятичный логарифм концентрации ионов водорода
(слайд 29.)
В водных растворах различают три типа сред: нейтральную, щелочную и кислую. Нейтральная среда – это среда, в которой концентрация ионов водорода равна концентрации гидроксид-ионов
[Н+] = [ОН—] = 10-7 моль/л.
Щелочная среда – это среда, в которой концентрация ионов водорода меньше концентрации гидроксид-ионов
[Н+] < [ОН—] [Н+] < 10-7 моль/л.
Кислая среда – это среда, в которой концентрация ионов водорода больше концентрации гидроксид-ионов
[Н+] > [ОН—] [Н+] > 10-7 моль/л.
(слайд 30.)
Существуют различные методы измерения рН. Качественно характер среды водных растворов определяют с помощью индикаторов. На практике применяют индикаторы: лакмус, метилоранж, фенолфталеин, универсальный индикатор. (См. таблицу)
Величина рН имеет большое значение в химических и биологических процессах. Поэтому определение рН очень важно в технике, сельском хозяйстве, медицине. Изменение рН крови или желудочного сока является медицинским тестом в медицине. Отклонение рН от нормы даже на 0,01 единицы свидетельствует о патологических процессах в организме. Постоянство концентраций ионов водорода Н+ является одной из важных констант внутренней среды живых организмов.
5. Закрепление изученного материала
(приложение 1.)
! Обратите внимание, что ответы во всех тестовых заданиях следует объяснить на основании теоретических знаний или написанием соответствующих уравнений.
Вариант 1
Выберите один правильный вариант ответа или дополните предложение.
Ответы во всех тестовых заданиях следует объяснить на основании теоретических знаний или написанием соответствующих уравнений.
1. Неэлектролитами являются оба вещества в паре
1) гидроксид бария (р-р) и азотная кислота
2) серная кислота и сульфат натрия (р-р)
3) этиленгликоль (р-р) и метанол
4) этанол и хлорид кальция (р-р)
2. Сумма всех коэффициентов в сокращенном ионном уравнении реакции между растворами хлорида кальция и карбоната натрия равна______
3. Сокращенное ионное уравнение реакции Cu2+ + 2OH— → Cu(OH)2↓ соответствует взаимодействию веществ:
а) CuSO4 и Fe(OH)2
б) CuCl2 и NaOH
в) CuO и Ba(OH)2
г) CuO и H2O
___________________________________________________________________________________
Вариант №2
Выберите один правильный вариант ответа или дополните предложение.
Ответы во всех тестовых заданиях следует объяснить на основании теоретических знаний или написанием соответствующих уравнений.
1. Лампочка прибора для испытания веществ на электрическую проводимость загорится при погружении электродов в водный раствор
1) сахарозы
2) хлорида натрия
3) глицерина
4) этанола
2. Напишите полное и сокращенное ионные уравнения реакции между растворами хлорида бария и нитрата серебра:
а) полное ионное уравнение ____________________
б) сокращенное ионное уравнение ______________
3. Сокращенное ионное уравнение реакции NH4+ + OH— → NH3↑ + H2O соответствует взаимодействию веществ:
а) NH4Cl и Ca(OH)2
б) NH4Cl и H2O
в) NH3 и H2O
г) NH3 и HCl
Вариант №3
Выберите один правильный вариант ответа или дополните предложение.
Ответы во всех тестовых заданиях следует объяснить на основании теоретических знаний или написанием соответствующих уравнений.
1. Лампочка прибора для испытания на электрическую проводимость загорится при погружении электродов в оба вещества:
1) ацетон и глюкозу (р-р)
2) гидроксид калия (расплав) и гексан
3) серную кислоту (р-р) и карбонат кальция
4) хлорид натрия (р-р) и ацетат калия (р-р)
2. Напишите полное и сокращенное ионные уравнения реакций между растворами гидроксида бария и хлорида меди (II)
а) полное ионное уравнение ____________________
б) сокращенное ионное уравнение ______________
3. Сокращенное ионное уравнение реакции: Al3+ + 3OH— → Al(OH)3↓ соответствует взаимодействию
1) хлорида алюминия с водой
2) алюминия с водой
3) хлорида алюминия со щелочью
4) алюминия со щелочью
___________________________________________________________________________________
Вариант №4
Выберите один правильный вариант ответа или дополните предложение.
Ответы во всех тестовых заданиях следует объяснить на основании теоретических знаний или написанием соответствующих уравнений.
1. Лампочка прибора для испытания веществ на электрическую проводимость загорится при погружении электродов в
1) водные растворы сахарозы и глицерина
2) водные растворы хлорида натрия и уксусной кислоты
3) ацетон и крахмальный клейстер
4) глицерин и NaOH (р-р)
2. Сумма всех коэффициентов в полном ионном уравнении реакции между растворами хлорида железа (III) и нитрата серебра равна ______________.
3. Сокращенное ионное уравнение реакции: Ba2+ + SO42- → BaSO4↓ соответствует взаимодействию веществ
а) BaO и H2SO4
б) Ba и H2SO4
в) BaCO3 и K2SO4
г) Ba(NO3)2 и Na2SO4
Вариант №5
Выберите один правильный вариант ответа или дополните предложение.
Ответы во всех тестовых заданиях следует объяснить на основании теоретических знаний или написанием соответствующих уравнений.
1. К электролитам относятся все вещества группы:
1) растворы гидроксида натрия, хлорида натрия, соляная кислота
2) гидроксид железа (III), уксусная кислота, метанол
3) хлорид бария (р-р), крахмал, серная кислота
4) растворы глюкозы, мыла, карбонат кальция
2. Суммы всех коэффициентов в полном и сокращенном ионных уравнениях реакции между гидроксидом натрия и сульфатом магния равны
1) 10 и 3
2) 12 и 6
3) 10 и 4
4) 12 и 4
3. Сокращенное ионное уравнение реакции: 2Н+ + СО32- → Н2О + СО2↑ соответствует взаимодействию:
1) азотной кислоты с карбонатом кальция
2) сероводородной кислоты с карбонатом калия
3) соляной кислоты с карбонатом кальция
4) серной кислоты с оксидом углерода (IV)
___________________________________________________________________________________
Вариант №6
Выберите один правильный вариант ответа или дополните предложение.
Ответы во всех тестовых заданиях следует объяснить на основании теоретических знаний или написанием соответствующих уравнений.
1. В уравнении реакции оксида алюминия с серной кислотой сумма коэффициентов перед формулами сильных электролитов равна
1) 5
2) 6
3) 3
4) 4
2. Сумма всех коэффициентов в полном и сокращенном ионных уравнениях реакции между хлоридом бария и сульфатом меди (II) равны
1) 7 и 7
2) 9 и 3
3) 12 и 6
4) 9 и 7
3. Сокращенное ионное уравнение реакции: SiO32- + 2H+ → H2SiO3↓ соответствует взаимодействию
1) оксида кремния (IV) с водой
2) оксида кремния (IV) с серной кислотой
3) силиката натрия с серной кислотой
4) силиката кальция с серной кислотой
Вариант №7
Выберите один правильный вариант ответа или дополните предложение.
Ответы во всех тестовых заданиях следует объяснить на основании теоретических знаний или написанием соответствующих уравнений.
1. Лампочка прибора для испытания веществ на электрическую проводимость не загорится при погружении электродов в
1) водный раствор сахарозы
2) водный раствор хлорида натрия
3) муравьиную кислоту (р-р)
4) расплав гидроксида натрия
2. Суммы всех коэффициентов в полном и сокращенном ионных уравнениях реакции между азотной кислотой и гидроксидом бария равны
1) 10 и 3
2) 12 и 3
3) 10 и 4
4) 12 и 4
3. Сокращенное ионное уравнение реакции: Zn2+ + 2OH— → Zn(OH)2↓ соответствует взаимодействию веществ:
1) ZnSO4 и Fe(OH)3
2) ZnCl2 и NaOH
3) Zn и KOH
4) ZnO и H2O
___________________________________________________________________________________
Вариант №8
Выберите один правильный вариант ответа или дополните предложение.
Ответы во всех тестовых заданиях следует объяснить на основании теоретических знаний или написанием соответствующих уравнений.
1. Слабым электролитом является:
1) гидроксид бария
2) хлорид кальция
3) соляная кислота
4) угольная кислота
2. Суммы всех коэффициентов в полном и сокращенном ионных уравнениях реакции между пропионовой кислотой и гидроксидом калия равны
1) 10 и 3
2) 6 и 4
3) 7 и 3
4) 12 и 4
3. Сокращенное ионное уравнение реакции: 2Н+ + СО32- → Н2О + СО2↑ соответствует взаимодействию
1) соляной кислоты с карбонатом магния
2) сероводородной кислоты с карбонатом калия
3) серной кислоты с карбонатом калия
4) азотной кислоты с оксидом углерода (IV)
Вариант №9
Выберите один правильный вариант ответа или дополните предложение.
Ответы во всех тестовых заданиях следует объяснить на основании теоретических знаний или написанием соответствующих уравнений.
1. Неэлектролитами являются все вещества группы
1) этанол, хлорид калия (р-р), сульфат бария
2) растительное масло, гидроксид калия (расплав), ацетат натрия
3) раствор сахарозы, глицерин, оксид серы (IV)
4) растворы сульфата натрия, глюкозы, уксусная кислота
2. Суммы всех коэффициентов в полном и сокращенном ионных
уравнениях реакции между уксусной кислотой и гидроксидом лития равны
1) 10 и 3
2) 7 и 3
3) 6 и 4
4) 12 и 4
3. Сокращенное ионное уравнение реакции: Ba2+ + SO42- → BaSO4↓ соответствует взаимодействию:
1) оксида бария с серной кислотой
2) гидроксида бария с серной кислотой
3) гидроксида бария с сульфатом меди (II)
4) нитрата бария с сульфатом натрия
__________________________________________________________________________________
Вариант №10
Выберите один правильный вариант ответа или дополните предложение.
Ответы во всех тестовых заданиях следует объяснить на основании теоретических знаний или написанием соответствующих уравнений.
1. Лампочка прибора для испытания веществ на электрическую проводимость не загорится при погружении электродов в
1) расплав гидроксида калия
2) водный раствор сульфата натрия
3) муравьиную кислоту (р-р)
4) водный раствор этанола
2. Суммы всех коэффициентов в полном и сокращенном ионных уравнениях реакции между уксусной кислотой гидроксидом бария равны
1) 10 и 3
2) 12 и 3
3) 10 и 4
4) 12 и 4
3. Сокращенное ионное уравнение реакции: Ca2+ + CO32- → CaCO3↓ соответствует взаимодействию:
1) оксида кальция с оксидом углерода (IV)
2) гидроксида кальция с оксидом углерода (IV)
3) хлорида кальция с карбонатом натрия
4) карбоната кальция с угольной кислотой (изб)
www.metod-kopilka.ru
Презентация » Кислоты» 9 класс, тема » Теория электролитической диссоциации»
Инфоурок › Химия › Презентации › Презентация » Кислоты» 9 класс, тема » Теория электролитической диссоциации»Описание презентации по отдельным слайдам:
1 слайд Описание слайда:
Описание слайда:
Кислоты Дидактический материал к урокам химии Учитель химии шк. №1692 Дёмина С.К.
2 слайд Описание слайда:
Описание слайда:
Состав кислот HxR Кислоты – сложные вещества, состоящие из атомов водорода, способных замещаться на металл, и кислотного остатка.
3 слайд Описание слайда:
Описание слайда:
Классификация кислот HxR одноосновные двухосновные трехосновные HCl; HNO3; h3SO4; h3CO3; h4PO4; h4BO3 HBr h3S кислородосодержащие бескислородные h3SO4; HNO3; h3SiO3; h3S; HCl; HF
4 слайд Описание слайда:
Описание слайда:
Кислоты – электролиты Кислоты – электролиты, при диссоциации которых в качестве катиона образуется катион H. HCl H + Cl h3SO4 Н + HSO4 HSO4 H + SO4 h4PO4 3H + PO4 + + — + — — + 2- + 3-
5 слайд Описание слайда:
Описание слайда:
Изменение окраски индикаторов Лакмус + H розовый Метилоранж + H красный + +
6 слайд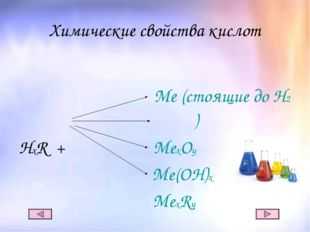 Описание слайда:
Описание слайда:
Химические свойства кислот Me (стоящие до Н2) HxR + МеxOy Ме(ОН)х МехRy
7 слайд Описание слайда:
Описание слайда:
Взаимодействие кислот с Металлами 2HCl + Zn ZnCl2 + h3 2H + + Zn0 Zn2+ + h30 2Al + 3h3SO4 Al2(SO4)3 + 3h3
8 слайд Описание слайда:
Описание слайда:
Взаимодействие кислот с оксидами металлов CuO + h3SO4 CuSO4 + h3O CuO + 2H+ Cu2+ + h3O
9 слайд Описание слайда:
Описание слайда:
Взаимодействие с основаниями (реакция нейтрализации) Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2h3O OH- + H+ = h3O Fe(OH)3 + 3HCl = FeCl3 + 3h3O
10 слайд Описание слайда:
Описание слайда:
Взаимодействие с солями Реакция идет, если выделяется газ или выпадает осадок Na2CO3 + 2HCl = 2NaCl + h3O + CO2 CO32- + 2H+ = h3O + CO2 BaCl2 + h3SO4 = BaSO4 + 2HCl Ba2+ + SO42- = BaSO4
11 слайд Описание слайда:
Описание слайда:
Получение кислот Бескислородные: h3 + Cl2 = 2HCl h3 + S = h3S Кислородосодержащие: P2O5 + 3h3O = 2h4PO4 SO3 + h3O = h3SO4
12 слайд Описание слайда:
Описание слайда:
Специфические свойства кислот Концентрированные HNO3, h3SO4 при взаимодействии с металлами не выделяют h3. Cu + 2h3SO4 (конц.) = CuSO4 + SO2 + 2h3O Pb + 4HNO3 (конц.) = Pb(NO3)2 + 2NO2 + 2h3O
13 слайд Описание слайда:
Описание слайда:
Проверь себя! Напишите уравнения реакций, которые осуществимы. Na + HCl Ca + h4PO4 Al+ h3SO4 MgO + h3SO4 NaCl + HCl Fe(OH)3 + HNO3 Fe2O3 + h3SO4 Li2O + h4PO4 Cu + HCl Na2CO3 + HCl
14 слайд Описание слайда:
Описание слайда:
Успехов в изучении химии!
Найдите материал к любому уроку,
указав свой предмет (категорию), класс, учебник и тему:
Выберите категорию: Все категорииАлгебраАнглийский языкАстрономияБиологияВсемирная историяВсеобщая историяГеографияГеометрияДиректору, завучуДоп. образованиеДошкольное образованиеДругоеДругойЕстествознаниеИЗО, МХКИзобразительное искусствоИностранные языкиИнформатикаИскусствоИспанский языкИсторияИстория РоссииИстория Средних вековИтальянский языкКлассному руководителюКультурологияЛитератураЛитературное чтениеЛогопедияМатематикаМировая художественная культураМузыкаМХКНачальные классыНемецкий языкОБЖОбществознаниеОкружающий мирОсновы безопасности жизнедеятельностиПриродоведениеРелигиоведениеРисованиеРусский языкСоциальному педагогуТехнологияУкраинский языкФизикаФизическая культураФилософияФинский языкФранцузский языкХимияЧерчениеЧтениеШкольному психологуЭкология
Выберите класс: Все классыДошкольники1 класс2 класс3 класс4 класс5 класс6 класс7 класс8 класс9 класс10 класс11 класс
Выберите учебник: Все учебники
Выберите тему: Все темы
также Вы можете выбрать тип материала:
Общая информация
Номер материала: ДВ-450899
Похожие материалы
Вам будут интересны эти курсы:
Оставьте свой комментарийinfourok.ru
Теория электролитической диссоциации — 9 класс (Урок проведён по технологии “Критического мышления”)
1Теория электролитической диссоциации — 9 класс
(Урок проведён по технологии “Критического мышления”)
Цели урока:
1. Сформировать основные понятия: электролиты, неэлекторлиты, электролитическая диссоциация, катионы, анионы.
2. Дать представление о механизме электролитической диссоциации.
3. Привести учащихся к умению создавать проблемные ситуации и видеть пути их решения.
4. Обучать аргументировано защищать свою точку зрения.
5. Развитие коммуникативных способностей.
Оборудование: прибор для проверки проводимости водных растворов электролитов.
Водные растворы: дистиллированная вода, кристаллы поваренной соли, раствор соляной кислоты, раствор щелочи, водный раствор спирта.
План урока
I. Стадия “Вызова”
Вступление
Мы приступаем к изучению проводимости растворов некоторых классов веществ. Электрический ток в металлах и растворах некоторых веществ вы изучали в курсе 7-го класса. Новый материал запоминается легче, если он нанизывается на уже полученные знания. Поэтому сейчас предстоит работа с извлечением этого материала из памяти.
а) Стадия “ Вызова”
Расчертите листок на три части и подпишите графы.
Я знаю
Хочу узнать
Что узнал?
В течение 5-ти минут каждый из вас заполнит графу, отвечая на вопросы: см. задание №1.
б) Перескажите друг другу ваши записи. (15 мин.)
в) Выделите ключевые понятия по теме “Электрический ток” в электролитах и в растворах щелочей, кислот, солей.
г) Какая информация у вас осталась неполной?
Заполните 2-ю графу.
Как правило, 80% учащихся осознают проблему в том, что открытие вопроса остаётся на пункте: №6. Как возникают заряжённые частицы в одном растворе этих веществ?
Ввозникает ещё одна проблема — откуда у веществ с молекулярной решёткой в растворе появляются ионы.
Демонстрация опыта и заполнение таблицы.
См. задание №2.
II. Стадия “Осмысление”
См. опорный конспект.
Идёт работа с текстом и его маркировка.
V — уже известно
+ абсолютно новое, неожиданное;
— противоречит твоим представлениям;
? хочется узнать что-то больше.
На данной стадии идёт соотношение уже известного с тем, “что узнал”. Происходит структурная организация информации в памяти. Можно спросить, у кого были значки, и какие?
III. Стадия “размышления” (рефлексия)
Учащиеся должны попробовать выразить информацию, которую получили своими словами. (Работа с графой №3 — «Что узнал?»).
Выяснили, какие новые понятия они увидели в тексте. (Эти пояснения записываем в 3-ю колонку).
Рассказать о механизме диссоциации веществ с ионным типом связи.
Рассказать о механизме диссоциации веществ с ковалентным типом связи.
Домашнее задание: § 1. Выучить понятия, знать механизм диссоциации. Ответить на вопрос: процесс растворения физический или химический. Подобрать доказательства в пользу каждого процесса.
Задание № 1
Электрический ток в металлах и в растворах щелочей, кислот, солей
Прочти следующие вопросы:
1. На какие частицы распадаются при растворении в воде вещества?
2. Какие два рода электрических зарядов существуют в природе?
3. На какие две группы делятся вещества по способности проводить электрические заряды?
4. Что представляет собой электрический ток в водных растворах солей, кислот, щелочей?
5. Как называют растворы этих веществ?
6. Как возникают заряженные частицы в водном растворе этих веществ?
Очень кратко запиши свои ответы в первой колонке таблицы № 1.
Задание №2
Демонстрационный опыт
Исследовать электрическую проводимость веществ с различным типом связи.
ЦЕЛЬ: Установить на какие частицы (молекулы, ионы) распадаются при растворении вещества с различным типом связи.
ИНСТРУКЦИЯ
1. Внимательно прочитайте задание и цель исследован
weburok.com
Урок по химии в 9 классе по теме «Теория электролитической диссоциации»
Учитель химии: Мухамеденова С.А.КГУ «СОШ №15»
Урок по химии в 9 классе по теме «Теория электролитической диссоциации»
Цель: Систематизировать знания учащихся по теме ТЭД.
Задачи:
— Отработать основные понятия и положения по теме «ТЭД».
— Развитие умений объяснять свойства веществ на основе их строения. Составлять схемы диссоциации электролитов на ионы, умений работать с компьютером и интерактивной доской.
— Воспитание самостоятельности, ответственности, уверенности в себе.
Оборудование: компьютеры, интерактивная доска, электронная презентация.
План
1. Оргмомент. Проверка готовности к уроку.
1.1. Сообщение темы урока и его задач (слайды 1,2).
1.2. Краткая информация об авторах ТЭД (слайд 3).
1.3. Заготовка таблицы-кластера (слайд 4).
2. Стадия вызова: прием «мозговой штурм» — 2-3 мин.
Мы с вами знакомились с некоторыми понятиями и положениями ТЭД в 8 классе. Работая в парах, вспомните, какие понятия теории вам известны? Занесите их в таблицу
(заслушиваются ответы ребят, вспоминаются понятия «электролиты», «неэлектролиты», «электролитическая диссоциация»).
3. Стадия осмысления:
3.1. Самостоятельная работа с текстом, расположенном на рабочем столе компьютера «Текст» (см. ниже).
Задание: Изучить текст в течение 5-7 минут. Занести новые понятия в графу 1 таблицы.
Ответить на вопросы к тексту.
3.2. Задание: Озвучить видеоролик «Механизм ЭД», используя материал текста (на подготовку дается 1-2 минуты, назначаются рецензенты).
Проверка заполнения графы 1 кластера – беседа.
Ответы на вопросы к тексту – беседа.
3.3. Задание: составить на интерактивной доске схемы диссоциации кислот, солей, оснований (слайды 5,6,7 ), дать определение им как электролитам.
3.4. Объяснение ступенчатой диссоциации многоосновных кислот с помощью интерактивной доски (слайд 8).
Ребята самостоятельно с помощью интерактивной доски составляют формулы и схему ступенчатой диссоциации гидросульфата натрия и гидроксохлорида магния.
3.5. Выполнение заданий (слайды 9,10) – первичная проверка.
З.6. Слайд 11 : Показать на схеме, куда будут двигаться ионы в электрическом поле.
3.7. Слайд 12: Что общего у изображенных веществ? Определите силу каждого из веществ как электролита. Какую величину мы используем для определения силы электролита?
3.8. Слайд 13: Составьте на интерактивной доске формулу для расчета степени электролитической диссоциации.
4. Стадия рефлексии:
4.1. Работа с кластером.
Попытаемся, используя материал урока сформулировать некоторые положения ТЭД (слайд 14).
4.2. Фронтальная работа по выполнению задач
5. Д/з (слайд 16):
Всем: №2,3,4 стр.156 — письменно.
*Задача: Определить количество вещества и число ионов натрия, образующихся при диссоциации 2 молей ортофосфата натрия. Считать, что степень диссоциации соли 100%.
6. Поставим себе оценку за работу на уроке (выполнение заданий на слайде 17 «Найди ошибку»).
«ТЕКСТ»
В процессе электролитической диссоциации (распаде электролитов на ионы) большую роль играют молекулы воды. Между атомами водорода и кислорода имеются расположенные под углом около 1050 ковалентные сильнополярные связи. Поэтому молекулы воды полярны и представляют собой диполи: При растворении в воде веществ с ионной связью, например хлорида натрия, молекулы воды притягиваются своими отрицательными полюсами к положительно заряженным ионам натрия, а положительными полюсами – к отрицательно заряженным хлорид-ионам. В результате связь между ионами ослабляется, и кристаллическая решетка разрушается (рис.1). Таким образом, все ионы в растворе связаны с молекулами воды. Такие ионы называются гидратированными, а процесс их образования гидратацией. Положительно заряженные ионы называются катионами, а отрицательно заряженные – анионами.
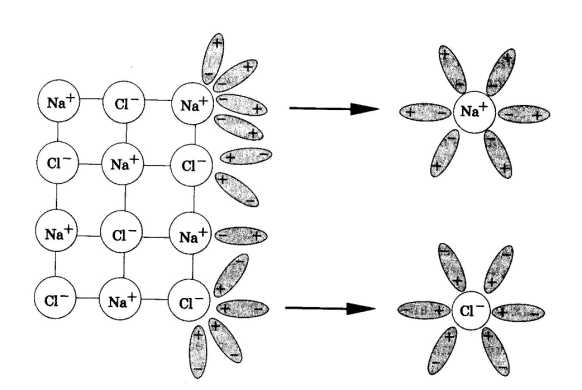
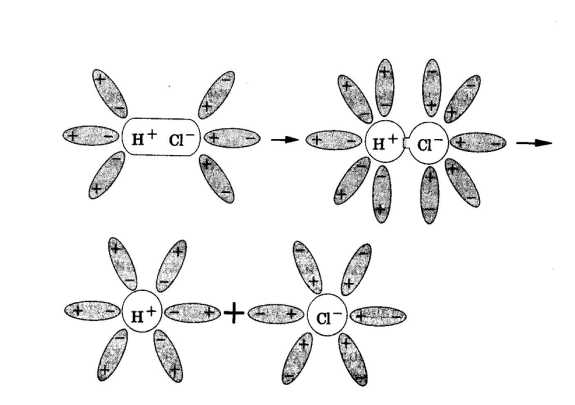
Рис.1. Диссоциация NaCl Рис.2. Диссоциация HCl
При растворении в воде веществ с ковалентной сильнополярной связью, например хлороводорода, происходит изменение характера химической связи. Под влиянием полярных молекул воды ковалентная полярная связь превращается в ионную. Затем ионная связь разрывается и в раствор переходят гидратированные ионы водорода (Н3О+-ион гидроксония) и хлорид-ионы (рис.2).
При расплавлении электролитов усиливаются колебательные движения частиц за счет увеличения их энергии, что приводит к ослаблению связи между ними. В результате чего разрушается кристаллическая решетка.
Для количественной характеристики ЭД используют понятие степень ЭД (α), которая равна отношению числа молекул, распавшихся на ионы к общему числу растворенных молекул. Она измеряется в долях от единицы или в %.
В зависимости от значения степени ЭД электролиты бывают:
— сильные (α →100%): HCl, HNO3, h3SO4, HВr, HI, щелочи, почти все соли;
— слабые (α →0%): h3S, h3CO3, h3SO3, h3SiO3, органические кислоты, нерастворимые основания , гидроксид аммония.
Вопросы:
1. Как вы думаете, будут ли электролиты диссоциировать на ионы при растворении их в керосине?
2. Назовите основные причины диссоциации электролитов на ионы при растворении их в воде и расплавлении.
3. В чем отличие диссоциации веществ с ковалентной полярной связью от диссоциации веществ с ионной связью?
infourok.ru
9 класс. Химия. Электролитическая диссоциация — Электролитическая диссоциация
Комментарии преподавателя
Сванте Аррениус
В 1887 году шведский физико — химик Сванте Аррениус, исследуя электропроводность водных растворов, высказал предположение, что в таких растворах вещества распадаются на заряженные частицы – ионы, которые могут передвигаться к электродам – отрицательно заряженному катоду и положительно заряженному аноду.
Это и есть причина электрического тока в растворах. Данный процесс получил название электролитической диссоциации (дословный перевод – расщепление, разложение под действием электричества). Такое название также предполагает, что диссоциация происходит под действием электрического тока. Дальнейшие исследования показали, что это не так: ионы являются толькопереносчиками зарядов в растворе и существуют в нем независимо от того, проходит черезраствор ток или нет. При активном участии Сванте Аррениуса была сформулирована теория электролитической диссоциации, которою часто называют в честь этого ученого. Основная идея данной теории заключается в том, что электролиты под действием растворителя самопроизвольно распадаются на ионы. И именно эти ионы являются носителями заряда и отвечают за электропроводность раствора.
Электрический ток — это направленное движение свободных заряженных частиц. Вы уже знаете, что растворы и расплавы солей и щелочей электропроводны, так как состоят не из нейтральных молекул, а из заряженных частиц – ионов. При расплавлении или растворении ионы становятся свободными переносчиками электрического заряда.
Процесс распада вещества на свободные ионы при его растворении или расплавлении называют электролитической диссоциацией.
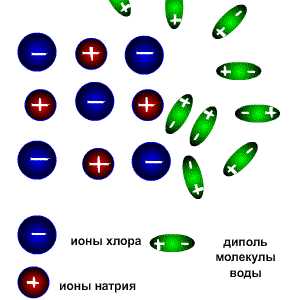
Рис. 1. Схема распада на ионы хлорида натрия
Сущность процесса электролитической диссоциации солей
Сущность электролитической диссоциации заключается в том, что ионы становятся свободными под влиянием молекулы воды. Рис.1. Процесс распада электролита на ионы отображают с помощью химического уравнения. Запишем уравнение диссоциации хлорида натрия и бромида кальция. При диссоциации одного моля хлорида натрия образуются один моль катионов натрия и один моль хлорид — анионов. NaCl⇄Na+ + Cl—
При диссоциации одного моля бромида кальция образуется один моль катионов кальция и два моля бромид — анионов.
CaBr2⇄Ca2+ + 2Br—
Обратите внимание: так как в левой части уравнения записана формула электронейтральной частицы, то суммарный заряд ионов должен быть равен нулю.
Вывод: при диссоциации солей образуются катионы металла и анионы кислотного остатка.
Сущность процесса электролитической диссоциации щелочей
При диссоциации одного моля гидроксида калия образуются один моль катионов калия и один моль гидроксид-анионов. KOH⇄K+ + OH—
При диссоциации одного моля гидроксида бария образуются один моль катионов бария и два моля гидроксид — анионов. Ba(OH)2⇄Ba2+ + 2 OH—
Вывод: при электролитической диссоциации щелочей образуются катионы металла и гидроксид — анионы.
Нерастворимые в воде основания практически не подвергаются электролитической диссоциации, так как в воде они практически нерастворимы, а при нагревании – разлагаются, так что расплав их получить не удается.
Сущность процесса электролитической диссоциации кислот
Рис. 2. Строение молекул хлороводорода и воды
Рассмотри процесс электролитической диссоциации кислот. Молекулы кислот образованы ковалентной полярной связью, а значит, кислоты состоят не из ионов, а из молекул.
Возникает вопрос – как же тогда кислота диссоциирует, т. е как в кислотах образуются свободные заряженные частицы? Оказывается, ионы образуются в растворах кислот именно при растворении.
Рассмотрим процесс электролитической диссоциации хлороводорода в воде, но для этого запишем строение молекул хлороводорода и воды. Рис.2.
Обе молекулы образованы ковалентной полярной связью. Электронная плотность в молекуле хлороводорода смещена к атому хлора, а в молекуле воды – к атому кислорода. Молекула воды способна оторвать катион водорода от молекулы хлороводорода, при этом образуется катион гидроксония Н3О+.
В уравнении реакции электролитической диссоциации не всегда учитывают образование катиона гидроксония – обычно говорят, что образуется катион водорода.
Тогда уравнение диссоциации хлороводорода выглядит так:
HCl⇄H+ + Cl—
При диссоциации одного моля хлороводорода образуются один моль катиона водорода и один моль хлорид — анионов.
Ступенчатая диссоциация серной кислоты
Рассмотри процесс электролитической диссоциации серной кислоты. Серная кислота диссоциирует ступенчато, в две стадии.
I–я стадия диссоциации
На первой стадии отрывается один катион водорода и образуется гидросульфат-анион.
H2SO4⇄H+ + HSO4—
гидросульфат-анион.
II — я стадия диссоциации
На второй стадии происходит дальнейшая диссоциация гидросульфат — анионов. HSO4—⇄H+ + SO42-
Эта стадия является обратимой, то есть, образующиеся сульфат — ионы могут присоединять к себе катионы водорода и превращаться в гидросульфат — анионы. Это показано знаком обратимости.
Существуют кислоты, которые даже на первой стадии диссоциируют не полностью – такие кислоты являются слабыми. Например, угольная кислота Н2СО3.
Теперь мы можем объяснить, почему температура кипения раствора электролита будет выше, чем температура кипения раствора неэлектролита.
При растворении молекулы растворенного вещества взаимодействуют с молекулами растворителя, например – воды. Чем больше частиц растворенного вещества находится в одном объеме воды, тем будет выше его температура кипения. Теперь представим, что в одинаковых объемах воды растворили равные количества вещества-электролита и вещества — неэлектролита. Электролит в воде распадется на ионы, а значит – число его частиц будет больше, чем в случае растворения неэлектролита. Таким образом, наличие свободных частиц в электролите объясняет, почему температура кипения раствора электролита будет выше, чем температура кипения раствора неэлектролита.
Источники
http://www.youtube.com/watch?v=gsT5mrag9ww
источник презентации — http://ppt4web.ru/khimija/ehlektroliticheskaja-dissociacija2.html
Конспект http://interneturok.ru/ru/school/chemistry/9-klass
www.kursoteka.ru
Конспект урока для 9 класса «Электролитическая диссоциация» — VEKOR.RU
Учебный проект по химии в 9 классе «Электролитическая диссоциация»
Аннотация:
Проект реализуется в рамках химии темы «Теория электролитической диссоциации» и рассчитан на учащихся 8 класса, изучающих химию по учебнику «Химия-8» О.С. Габриеляна. Он включает в себя исследовательский и информационный блоки.
На основе изучения информационных ресурсов Internet учащиеся составляют опорные конспекты для изучения основ теории электролитической диссоциации.
Самостоятельно исследуют проводимость электрического тока растворов различных веществ. Приобретенные практические знания, умения и навыки позволяют ответить на проблемные вопросы и вопросы учебной темы, доступно и наглядно представлять достаточно сложный теоретический материал и связать его с практической деятельностью человека.
Настоящий проект направлен на поиск новых методов, идей при решении задач и интеграцию разделов школьного курса химии.
Тема проекта: Электролитическая диссоциация
Темы, необходимые для создания проекта:
История химии, типы химических реакций, свойства классов неорганических соединений, строение атомов, ионов, виды химической связи, типы кристаллических решеток.
Дидактические цели проекта:
Углубить и систематизировать знания о веществах и химических реакциях с точки зрения теории электролитической диссоциации.
Иметь представление об электролитах, электролитической диссоциации, реакциях ионного обмена.
Закрепить знания о зависимости свойств веществ от их состава и строения (свойства ионов определяют свойства электролитов).
С целью патриотического воспитания познакомиться с ролью русских ученых в создании теории электролитической диссоциации.
Методические задачи проекта:
Научиться записывать уравнения химических реакций в молекулярном, полном и сокращенном виде.
Закрепить знания свойств веществ основных классов неорганических соединений.
Научиться обрабатывать и обобщать полученную информацию в результате проведенных опытов и экспериментов.
Продолжить формирование навыков обращения с химическими реактивами и оборудованием.
Ожидаемые приращения в компетентностях учащихся:
На начало проекта учащиеся знают вещества основных классов неорганических соединений, их свойства, строение атома, виды химической связи, типы кристаллических решеток; могут составлять формулы бинарных соединений, писать уравнения химических реакций, определять признаки химических реакций и писать уравнения химических реакций.
Однако еще не знают причины проводимости электрического тока растворами веществ, механизма электролитической диссоциации, не могут писать ионные уравнения, не знают условий протекания реакций между электролитами до конца.
В ходе выполнения проекта у учащихся формируется представление об электролитах, электролитической диссоциации веществ с различным видом химической связи и типом кристаллической решетки, степени диссоциации, диссоциации кислот, щелочей и солей, реакций между электролитами, навыки составления уравнений химических реакций в молекулярном и ионном полном и сокращенном видах. Продолжается формирование практических навыков пользования химическими реактивами и оборудованием, персональным компьютером и навыков поиска информации в Internet. Во время работы формируются навыки представления результатов работы в виде таблиц, графиков, применение информационных технологий для презентации полученных результатов, навыки коммуникативного взаимодействия, грамотность информационно-поисковой работы, умения составить литературный обзор полученной информации. В ходе работы над проектом формируются навыки планирования работы, обобщения, сравнения, рефлексии и самоанализа своей деятельности.
Проблемные вопросы учебной темы:
Каков механизм электролитической диссоциации веществ с различным типом химической связи?
Почему растворы кислот, щелочей и солей обладают характерными для данного класса химическими свойствами?
В чем причина разницы свойств ионов и простых веществ натрия и хлора?
Каковы условия протекания реакций между электролитами?
Самостоятельные исследования учащихся: выполнение эксперимента по исследованию электропроводности растворов хлорида натрия, соляной и уксусной кислот, зависимость степени диссоциации уксусной кислоты от концентрации ее растворов, проведение химических реакций между электролитами, поиск информации в Internet, самостоятельная работа с учебником.
Проект соответствует следующим пунктам тематического учебного плана школьного курса химии:
Электролитическая диссоциация, диссоциация кислот, щелочей и солей, реакции ионного обмена, химические свойства веществ основных классов неорганических соединений, окислительно-восстановительные реакции.
Предметные области:
Русский язык, литература, математика, информационные технологии, история, химия, биология, ОБЖ.
Время выполнения проекта: 6 академических часов.
Техническое оснащение:
Кабинет информатики, компьютеры, мультимедийный проектор, принтер, доступ к Интернету.
Оформление результатов проекта: Для решения дидактических целей и решения методических задач, формирования запланированных компетентностей, учитывая возраст учащихся – это восьмиклассники, которые первый год изучают предмет, учителем выбран учебно-ролевой проект, который проведен в виде урока – ролевой игры с показом мультимедийной презентации. Ребята этого класса больше любят представлять себя в роли героев, кроме того, они с удовольствием выполняют слайды. Этот урок был проведен при обобщении и систематизации знаний учащихся в конце изучения темы «Теория электролитической диссоциации», после чего следовала контрольная работа, результаты которой показали верность выбранного типа проекта. Мультимедийная презентация, созданная детьми, может использоваться для самостоятельного изучения темы «Электролитическая диссоциация» будущими восьмиклассниками в последующие годы.
В работе над проектом учитель консультирует, помогает, направляет, координирует деятельность учащихся.
Ведущая деятельность учащихся: Поисковая и исследовательская.
Вначале изучения темы на первом вводном уроке для представления проблемы проекта учащимся был представлен основополагающий вопрос, в котором заключалась неясно сформулированная цель.
Основополагающий вопрос:
Дождливый день. На остановке троллейбуса люди складывают зонтики и заходят в салон. Вот один из них поставил ногу на ступеньку и тут же отпрянул: «Ой, током бьет!» Как же ток добрался до пассажира?
Так как школьники не раз испытали на себе действие электрического тока при включении с мокрыми руками таких электроприборов как электропаяльник, кипятильник, утюг и чайник в электрическую розетку было решено изучить подробно этот вопрос. Поскольку класс небольшой организовали 3 группы по 4 человека «Историки», «Исследователи-теоретики», «Экспериментаторы» и 2 ученика оставили для оформления общей мультимедийной презентации несмотря на то, что каждая группа представляет отчет с показом слайдов.
Первичным мотивом учащихся в работе над проектом был эксперимент, поставленный учителем «Электропроводность поваренной соли в твердом и растворенном состоянии». При пропускании электрического тока через твёрдую поваренную соль электрическая лампочка прибора не загорается, а при пропускании тока через раствор – загорается.
Каждая группа определила себе цель. «Историки» решили изучить вопрос возникновения теории электролитической диссоциации, её основные положения. «Исследователи-теоретики» — как происходит диссоциация веществ с различным типом химической связи на примере поваренной соли и соляной кислоты, а «Экспериментаторы» изучить электролитическую диссоциацию, проделав опыты по электропроводимости, изменению степени электролитической диссоциации в зависимости от концентрации раствора на примере уксусной кислоты.
Вначале предполагалось проектный продукт создать в виде мультимедийной презентации, однако после некоторого времени предложением учащихся было завершение изучения темы провести урок в виде ролевой игры.
Считаю, что урок – ролевая игра, которую затем провели, достиг цели проекта. Урок показал, что учащиеся хорошо усвоили тему. Контрольная работа, проведенная после изучения этой темы, подтвердила данный результат.
Ход урока
-
Организационная часть.
-
Основная часть.
Учитель: Ребята, сегодня мы проведем урок в виде учебно-ролевой игры по теме «Электролитическая диссоциация». Он потребует от вас знаний как по химии, так и других учебных предметов. Для проведения урока мы с вами заранее определили группы:
«Историки»
«Исследователи-теоретики»
«Экспериментаторы».
-
Выступление групп и обсуждение сообщений, оценивание работы каждой группы. Выбор слайдов для общей презентации.
-
Заключительная часть. Выставление оценок.
-
Домашнее задание.
Историки
Еще на заре изучения электрических явлений ученые заметили, что ток могут проводить не только металлы, но и растворы. Но не всякие. Так, водные растворы поваренной соли и других солей, растворы сильных кислот и щелочей хорошо проводят ток. Растворы уксусной кислоты, углекислого и сернистого газа проводят его намного хуже. А вот растворы спирта, сахара и большинства других органических соединений вовсе не проводят электрический ток. Английский физик Майкл Фарадей еще в 30-е годы XIX века, изучая закономерности прохождения электрического тока через растворы, ввел термины «электролит», «электролиз», «ион», «катион», «анион». Электролит – вещество, раствор которого проводит электрический ток. Происходит это в результате направленного движения в растворе заряженных частиц – ионов.
Причина появления в растворах заряженных частиц была совершенно непонятной. Само название «электролит» (от греч. lysis – разрушение, растворение) предполагало, что ионы появляются в растворе при пропускании через него электрического тока.
Растворы всех веществ можно разделить на две группы: электролиты -проводят электрический ток, неэлектролиты — проводниками электрического тока не являются. Это деление является условным, потому что все растворы веществ проводят электрический ток, все они в той или иной мере растворяются в воде и распадаются на катионы (положительно заряженные ионы) и анионы (отрицательно заряженные ионы). Следует различать настоящие и потенциальные электролиты.
Настоящие электролиты находятся в виде ионов уже в индивидуальном состоянии, т.е. до того, как они будут расплавлены или переведены в раствор. К настоящим электролитам относятся все соли, которые в твёрдом состоянии образуют ионную кристаллическую решётку (например, хлорид натрия, поваренная соль — NaCl, K2SO4 – сульфат калия, фторид калия — KF и т.д.)
Потенциальные электролиты в индивидуальном состоянии ионов не содержат, но образуют их при переходе вещества в раствор. К ним относятся вещества, состоящие из молекул с сильно полярными связями (например, соляная кислота HCl).
К неэлектролитам относится большая часть органических соединений, например, диэтиловый эфир, бензол, глюкоза, сахароза, этиловый спирт.
Заряженные частицы появляются только в растворах и расплавах веществ.
Классическая теория электролитической диссоциации, которая объясняет появление ионов в растворах, была создана
Рис. 1.
Молекула воды полярна и
представляет собой диполь
Молекулы воды являются дипольными, т.е. один конец молекулы заряжен отрицательно, другой — положительно. Молекула отрицательным полюсом подходит к иону натрия, положительным — к иону хлора; окружают ионы со всех сторон и вырывают из кристалла, причём, только с его поверхности Рис. 2.
Механизм растворения хлорида натрия в воде:
а – ориентация молекул воды на поверхности кристалла NaCl и отрыв иона Na+;
б – гидратация (окружение молекулами воды) ионов Na+ и Сl–
«Электролитическая диссоциация – это процесс распада электролита на ионы при растворении его в воде или расплавлении».
Уравнение диссоциации можно записать следующим образом: NaCl Na+ + Cl- При растворении в воде соляной кислоты (в молекулах HCl cвязь между атомами ковалентная сильнополярная) происходит изменение характера химической связи. Под влиянием полярных молекул воды ковалентная полярная связь превращается в ионную. Образовавшиеся ионы остаются связанными с молекулами воды – гидратированными. Если растворитель неводный, то ионы называют сольватированными. Рис. 3.
Диссоциация молекул HСl на ионы в водном растворе
Электролитическую диссоциацию вызывает не только вода, но и неводные полярные растворители, такие как жидкий аммиак и жидкий диоксид серы. Однако именно для воды характерно свойство ослаблять электростатическое притяжение между ионами в решётке выражено особенно ярко.
Свободные ионы, оказавшиеся в водном растворе, окружаются полярными молекулами воды: вокруг ионов образуется гидратная оболочка, т.е. протекает процесс гидратации. В результате диссоциации в растворе появляются ионы, которые дают возможность появления у раствора или расплава электропроводимости. Ионы резко отличаются по своим физическим и химическим свойствам от нейтральных атомов. Например, атомы Na реагируют с водой, а катионы Na+ – нет; хлор – сильный окислитель и ядовит, а анионы Cl– не являются окислителем и не ядовиты. Цвет ионов при гидратации может измениться. Например, негидратированные ионы меди бесцветны (безводный CuSO4), а гидратированные – голубые.
Сила электролитов. Силу электролитов можно охарактеризовать с помощью степени диссоциации.
Степень диссоциации электролита — это частное от деления числа продиссоциированных молекул к общему числу молекул электролита, введённого в раствор. Α = Nдисс/N Степень диссоциации потенциальных электролитов изменяется в пределах 0
vekor.ru
«Теория электролитической диссоциации» (9 класс)
тема: Теория электролитической диссоциации.
Цель определяют учащиеся: узнать….определить….
знать:
Основные положения теории электролитической диссоциации. Кислоты, основания и соли с точки зрения ТЭД.
уметь:
Писать уравнения диссоциации кислот, оснований и солей.
Оснащенность: компьютерная презентация «Теория электролитической диссоциации», таблица растворимости кислот, солей и оснований, дидактические материалы.
План – конспект урока
Организационный момент
2. Мотивация урока.
Растворы широко применяются в различных сферах деятельности человека. Они имеют большое значение для живых организмов Сложные физико-химические процессы в организмах человека, животных и растений протекают в растворах. В различных производственных и биологических процессах большую роль играют растворы электролитов. Свойства этих растворов объясняет теория электролитической диссоциации. Знание ТЭД является основой для изучения свойств неорганических и органических соединений, для глубокого понимания механизмов химических реакций в растворах электролитов.
3. Объяснение нового материала
План лекции:
1. Основные положения теории электролитической диссоциации
2. Кислоты, основания и соли с точки зрения ТЭД
1. Основные положения теории электролитической диссоциации
(слайд 2.)
В первой половине 19 в. М. Фарадей ввел понятие об электролитах и неэлектролитах.
Электролиты – вещества, водные растворы или расплавы которых проводят электрических ток.
Неэлектролиты – вещества, водные растворы или расплавы которых не проводят электрический ток
(слайд 3.)
К электролитам относятся соли, кислоты, основания. В молекулах этих веществ имеются ионные или ковалентные сильно полярные химические связи.
(слайд 4.)
К неэлектролитам относятся вещества, в молекулах которых имеются ковалентные неполярные или малополярные связи. Например, кислород, водород, многие органические вещества – глюкоза, сахароза, бензол, эфиры и др.
(слайд 5-6.)
Для объяснения электропроводности растворов и расплавов солей, кислот, оснований шведский ученый С. Аррениус создал теорию электролитической диссоциации (1887 г.). Представления о диссоциации электролитов получили развитие в работах русских химиков И.А.Каблукова и В.А. Кистяковского. Они применили к объяснению процесса электролитической диссоциации химическую теорию растворов Д.И. Менделеева.
Основные положения ТЭД: (учебник)
1. Молекулы электролитов при растворении в воде или расплавлении распадаются на ионы. Процесс распада молекул электролитов на ионы в растворе или расплаве называется электролитической диссоциацией (или ионизацией)
Ионы – это атомы или группы атомов, имеющие положительный или отрицательный заряд (Na+ , S2-, NO3— и др.)
Положительно заряженные ионы – катионы, отрицательно заряженные ионы – анионы.
К катионам относятся ион водорода Н+, ион аммония NH4+, ионы металлов – Na+, Cu2+ , Al3+ и др.
К анионам относятся гидроксид – ион ОН— , ионы кислотных остатков – Cl—SO42- , PO43- и др.
2. Диссоциация – процесс обратимый. Это значит, что одновременно идут два противоположных процесса: распад молекул на ионы (диссоциация, ионизация) и соединение ионов в молекулы (ассоциация, моляризация).
Диссоциацию молекул электролитов выражают уравнениями, в которых вместо знака равенства ставят знак обратимости (↔).
Например,
Mg(NO3)2 ↔ Mg2+ + 2NO3—
Каждая молекула нитрата магния диссоциирует на ион магния и два нитрат – иона. Следовательно, в результате диссоциации одной молекулы Mg(NO3)2 образуется три иона.
Общая сумма зарядов катионов и зарядов анионов равна нулю, т.к. молекула электролита нейтральна.
3. Ионы и атомы одних и тех же элементов отличаются друг от друга по строению и свойствам.
4. Ионы вступают во взаимодействие друг с другом – реакции ионного обмена.
(слайд 7-10.)
Механизм электролитической диссоциации
Причины и механизм диссоциации электролитов объясняются теорией растворов Д.И. Менделеева и природой химической связи. Как известно, электролитами являются вещества с ионной или ковалентной сильно полярной связями.
При растворении в воде ионных соединений, например хлорида натрия NaCl, дипольные молекулы воды ориентируются вокруг ионов натрия и хлорид-ионов. При этом положительные полюсы молекул воды притягиваются к хлорид-ионам Cl—, отрицательные полюсы — к положительным ионам натрия Na+.
В результате этого взаимодействия между молекулами растворителя и ионами электролита притяжение между ионами в кристаллической решетке вещества ослабевает. Кристаллическая решетка разрушается, и ионы переходят в раствор. Эти ионы в водном растворе находятся не в свободном состоянии, а связаны с молекулами воды, т.е. являются гидратированными ионами.
При растворении в воде веществ с полярной ковалентной связью происходит взаимодействие дипольных молекул воды с дипольными молекулами электролитов. Например, при растворении в воде хлороводорода, изменяется характер связи в молекуле HCl: сначала связь становится более полярной, а затем переходит в ионную. Результатом процесса является диссоциация электролита и образование в растворе гидратированных ионов.
Таким образом, главной причиной диссоциации в водных растворах является гидратация ионов. В водных растворах все ионы находятся в гидратированном состоянии. Для простоты в химических уравнениях ионы изображают без молекул воды: H+, Mg2+, NO3— и т.д.
2. Кислоты, основания и соли с точки зрения ТЭД
(слайд 11-12.)
Кислоты – электролиты, которые при диссоциации образуют только один вид катионов – катионы водорода Н+
Составим уравнение электролитической диссоциации сильных кислот:
HCl ↔ H+ + Cl—
H2SO4 ↔ 2H+ + SO42-
Слабые многоосновные кислоты диссоциируют ступенчато. Число ступеней зависит от основности слабой кислоты Hx(Ac), где х – основность кислоты. Например,
H2CO3 ↔ H+ + HCO3—
HCO3— ↔ H+ + CO32-
К1 > K2
Растворы кислот имеют некоторые общие свойства, которые, согласно ТЭД, объясняются присутствием в их растворах гидратированых ионов водорода Н+ (Н3О+).
(слайд 13.)
Основания — электролиты, которые при диссоциации образуют только один вид анионов — гидроксид-ионы ОН—.
Составим уравнение диссоциации сильных оснований (щелочей)
NaOH ↔ Na+ + OH—
Ba(OH)2 ↔ Ba2+ + 2OH—
Слабые многокислотные основания диссоциируют ступенчато. Число ступеней диссоциации определяется кислотностью слабого основания Ме(ОН)у , где у- кислотность основания.
Например,
Fe(OH)2 ↔ FeOH+ + OH—
FeOH+ ↔ Fe2+ + OH—
К1 > K2
Основания имеют некоторые общие свойства. Общие свойства оснований обусловлены присутствием гидроксид-ионов ОН—.
(слайд 14.)
Средние (нормальные) соли – сильные электролиты, образующие при диссоциации катионы металла и анионы кислотного остатка.
K2CO3 ↔ 2K+ + CO32-
Al2(SO4)3 ↔ 2Al3+ + 3SO42-
Кислые соли – сильные электролиты, диссоциирующие на катион металла и сложный анион, в состав которого входят атомы водорода и кислотный остаток.
Например,
NaHCO3 ↔ Na+ + HCO3— (α = 1)
Сложный анион (гидрокарбонат-анион) частично диссоциирует:
НСО3— ↔ Н+ + СО32- (α << 1)
5. Закрепление изученного материала
(приложение 1.)
Вариант 1
Выберите один правильный вариант ответа.
1. Неэлектролитами являются оба вещества в паре
1) гидроксид бария (р-р) и азотная кислота
2) серная кислота и сульфат натрия (р-р)
3) этиленгликоль (р-р) и метанол
4) этанол и хлорид кальция (р-р)
2. Составить уравнение диссоциации гидроксида кальция и гидрокарбоната натрия.
Вариант №2
Выберите один правильный вариант ответа.
1. Лампочка прибора для испытания веществ на электрическую проводимость загорится при погружении электродов в водный раствор:
1) сахарозы
2) хлорида натрия
3) глицерина
4) этанола
2. Напишите уравнение диссоциации хлорида бария и серной кислоты.
Рефлексия по целеполаганию.
Я узнал(а), что ….
Я понял(а), что ….
д\з п.1-2 р\т по разделу.
Вариант №3
Выберите один правильный вариант ответа или дополните предложение.
Ответы во всех тестовых заданиях следует объяснить на основании теоретических знаний или написанием соответствующих уравнений.
1. Лампочка прибора для испытания на электрическую проводимость загорится при погружении электродов в оба вещества:
1) ацетон и глюкозу (р-р)
2) гидроксид калия (расплав) и гексан
3) серную кислоту (р-р) и карбонат кальция
4) хлорид натрия (р-р) и ацетат калия (р-р)
2. Напишите полное и сокращенное ионные уравнения реакций между растворами гидроксида бария и хлорида меди (II)
а) полное ионное уравнение ____________________
б) сокращенное ионное уравнение ______________
3. Сокращенное ионное уравнение реакции: Al3+ + 3OH— → Al(OH)3↓ соответствует взаимодействию
1) хлорида алюминия с водой
2) алюминия с водой
3) хлорида алюминия со щелочью
4) алюминия со щелочью
___________________________________________________________________________________
Вариант №4
Выберите один правильный вариант ответа или дополните предложение.
Ответы во всех тестовых заданиях следует объяснить на основании теоретических знаний или написанием соответствующих уравнений.
1. Лампочка прибора для испытания веществ на электрическую проводимость загорится при погружении электродов в
1) водные растворы сахарозы и глицерина
2) водные растворы хлорида натрия и уксусной кислоты
3) ацетон и крахмальный клейстер
4) глицерин и NaOH (р-р)
2. Сумма всех коэффициентов в полном ионном уравнении реакции между растворами хлорида железа (III) и нитрата серебра равна ______________.
3. Сокращенное ионное уравнение реакции: Ba2+ + SO42- → BaSO4↓ соответствует взаимодействию веществ
а) BaO и H2SO4
б) Ba и H2SO4
в) BaCO3 и K2SO4
г) Ba(NO3)2 и Na2SO4
Вариант №5
Выберите один правильный вариант ответа или дополните предложение.
Ответы во всех тестовых заданиях следует объяснить на основании теоретических знаний или написанием соответствующих уравнений.
1. К электролитам относятся все вещества группы:
1) растворы гидроксида натрия, хлорида натрия, соляная кислота
2) гидроксид железа (III), уксусная кислота, метанол
3) хлорид бария (р-р), крахмал, серная кислота
4) растворы глюкозы, мыла, карбонат кальция
2. Суммы всех коэффициентов в полном и сокращенном ионных уравнениях реакции между гидроксидом натрия и сульфатом магния равны
1) 10 и 3
2) 12 и 6
3) 10 и 4
4) 12 и 4
3. Сокращенное ионное уравнение реакции: 2Н+ + СО32- → Н2О + СО2↑ соответствует взаимодействию:
1) азотной кислоты с карбонатом кальция
2) сероводородной кислоты с карбонатом калия
3) соляной кислоты с карбонатом кальция
4) серной кислоты с оксидом углерода (IV)
___________________________________________________________________________________
Вариант №6
Выберите один правильный вариант ответа или дополните предложение.
Ответы во всех тестовых заданиях следует объяснить на основании теоретических знаний или написанием соответствующих уравнений.
1. В уравнении реакции оксида алюминия с серной кислотой сумма коэффициентов перед формулами сильных электролитов равна
1) 5
2) 6
3) 3
4) 4
2. Сумма всех коэффициентов в полном и сокращенном ионных уравнениях реакции между хлоридом бария и сульфатом меди (II) равны
1) 7 и 7
2) 9 и 3
3) 12 и 6
4) 9 и 7
3. Сокращенное ионное уравнение реакции: SiO32- + 2H+ → H2SiO3↓ соответствует взаимодействию
1) оксида кремния (IV) с водой
2) оксида кремния (IV) с серной кислотой
3) силиката натрия с серной кислотой
4) силиката кальция с серной кислотой
Вариант №7
Выберите один правильный вариант ответа или дополните предложение.
Ответы во всех тестовых заданиях следует объяснить на основании теоретических знаний или написанием соответствующих уравнений.
1. Лампочка прибора для испытания веществ на электрическую проводимость не загорится при погружении электродов в
1) водный раствор сахарозы
2) водный раствор хлорида натрия
3) муравьиную кислоту (р-р)
4) расплав гидроксида натрия
2. Суммы всех коэффициентов в полном и сокращенном ионных уравнениях реакции между азотной кислотой и гидроксидом бария равны
1) 10 и 3
2) 12 и 3
3) 10 и 4
4) 12 и 4
3. Сокращенное ионное уравнение реакции: Zn2+ + 2OH— → Zn(OH)2↓ соответствует взаимодействию веществ:
1) ZnSO4 и Fe(OH)3
2) ZnCl2 и NaOH
3) Zn и KOH
4) ZnO и H2O
___________________________________________________________________________________
Вариант №8
Выберите один правильный вариант ответа или дополните предложение.
Ответы во всех тестовых заданиях следует объяснить на основании теоретических знаний или написанием соответствующих уравнений.
1. Слабым электролитом является:
1) гидроксид бария
2) хлорид кальция
3) соляная кислота
4) угольная кислота
2. Суммы всех коэффициентов в полном и сокращенном ионных уравнениях реакции между пропионовой кислотой и гидроксидом калия равны
1) 10 и 3
2) 6 и 4
3) 7 и 3
4) 12 и 4
3. Сокращенное ионное уравнение реакции: 2Н+ + СО32- → Н2О + СО2↑ соответствует взаимодействию
1) соляной кислоты с карбонатом магния
2) сероводородной кислоты с карбонатом калия
3) серной кислоты с карбонатом калия
4) азотной кислоты с оксидом углерода (IV)
Вариант №9
Выберите один правильный вариант ответа или дополните предложение.
Ответы во всех тестовых заданиях следует объяснить на основании теоретических знаний или написанием соответствующих уравнений.
1. Неэлектролитами являются все вещества группы
1) этанол, хлорид калия (р-р), сульфат бария
2) растительное масло, гидроксид калия (расплав), ацетат натрия
3) раствор сахарозы, глицерин, оксид серы (IV)
4) растворы сульфата натрия, глюкозы, уксусная кислота
2. Суммы всех коэффициентов в полном и сокращенном ионных
уравнениях реакции между уксусной кислотой и гидроксидом лития равны
1) 10 и 3
2) 7 и 3
3) 6 и 4
4) 12 и 4
3. Сокращенное ионное уравнение реакции: Ba2+ + SO42- → BaSO4↓ соответствует взаимодействию:
1) оксида бария с серной кислотой
2) гидроксида бария с серной кислотой
3) гидроксида бария с сульфатом меди (II)
4) нитрата бария с сульфатом натрия
__________________________________________________________________________________
Вариант №10
Выберите один правильный вариант ответа или дополните предложение.
Ответы во всех тестовых заданиях следует объяснить на основании теоретических знаний или написанием соответствующих уравнений.
1. Лампочка прибора для испытания веществ на электрическую проводимость не загорится при погружении электродов в
1) расплав гидроксида калия
2) водный раствор сульфата натрия
3) муравьиную кислоту (р-р)
4) водный раствор этанола
2. Суммы всех коэффициентов в полном и сокращенном ионных уравнениях реакции между уксусной кислотой гидроксидом бария равны
1) 10 и 3
2) 12 и 3
3) 10 и 4
4) 12 и 4
3. Сокращенное ионное уравнение реакции: Ca2+ + CO32- → CaCO3↓ соответствует взаимодействию:
1) оксида кальция с оксидом углерода (IV)
2) гидроксида кальция с оксидом углерода (IV)
3) хлорида кальция с карбонатом натрия
4) карбоната кальция с угольной кислотой (изб)
infourok.ru
