Закон Пруста . Краткая история химии. Развитие идей и представлений в химии
Успех Лавуазье показал химикам, что применение количественных измерений может помочь понять суть химических реакций. Метод количественных измерений был использован, в частности, при исследовании кислот.
Кислоты образуют естественную группу веществ, обладающих рядом характерных свойств. Они химически активны, реагируют с такими металлами, как цинк, олово или железо, которые при растворении в кислотах выделяют водород. Кислоты имеют кислый вкус, вызывают характерные изменения цветов некоторых красителей и т. д.
Кислотам противостоит группа веществ, называемых основаниями. (Сильные основания получили название щелочей.) Эти вещества имеют горький вкус, химически активны, меняют цвета красителей, но на противоположные по сравнению с кислотами и т. д. Растворы кислот нейтрализуют растворы оснований. Другими словами, смесь кислоты и основания, взятых в определенном соотношении, не проявляет свойств ни кислоты, ни основания.
Реакции нейтрализации заинтересовали немецкого химика Иеремию Веньямина Рихтера (1762—1807). Начав их изучение, он измерил точные количества различных кислот, необходимых для нейтрализации определенных количеств того или иного основания, и наоборот. Результаты измерений показали, что, проводя реакцию нейтрализации, нельзя пользоваться приемами повара, который в соответствии со своим вкусом может увеличить или уменьшить количество того или иного компонента; в данном случае необходимы определенные и постоянные количества веществ.
Рихтер изложил свои взгляды в книге «Стехиометрия, или искусство измерения химических элементов», которая вышла в трех частях в 1792—1794 гг.
Здесь речь шла об эквивалентном (соединительном) весе — постоянном весе одного химического вещества, реагирующего с другим веществом, также имеющим постоянный вес. Таким образом, Рихтеру принадлежит формулировка закона эквивалентов.
Вскоре после опубликования работ И. Рихтера два французских химика вступили в яростный спор о том, присуща ли такая определенность только реакциям кислотно-основной нейтрализации или химическим процессам вообще. В принципе вопрос стоял так: если какое-либо соединение состоит из двух (трех или четырех) элементов, всегда ли соотношение этих двух элементов постоянно? Меняются ли эти соотношения в зависимости от способа получения соединения? Одним из споривших химиков был К. Л. Бертолле, который, как мы упоминали выше, совместно с Лавуазье разработал современную химическую терминологию (см.
Французский химик Жозеф Луи Пруст (1754—1826), который работал в Испании, придерживался противоположного мнения. С помощью тщательных анализов Пруст в 1799 г. показал, например, что карбонат меди характеризуется определенным весовым соотношением меди, углерода и кислорода вне зависимости от того, каким способом эта соль получена в лаборатории или каким способом выделена из природных источников. Соединение всегда содержит 5.3 части меди, 4 части кислорода и 1 часть углерода.
Более того, Пруст установил, что постоянство соотношений компонентов наблюдается и в ряде других соединений. Он сформулировал общее правило, согласно которому все соединения содержат элементы в строго определенных пропорциях (а не в любых сочетаниях) вне зависимости от условий получения этих соединений. Это правило называется законом постоянства состава, или иногда законом Пруста. (Пруст также показал, что Бертолле, пытаясь доказать, что состав определенных соединений меняется в зависимости от метода их получения, пришел к ошибочным выводам из-за неточности анализов и использования недостаточно чистых исходных соединений.)
Это правило называется законом постоянства состава, или иногда законом Пруста. (Пруст также показал, что Бертолле, пытаясь доказать, что состав определенных соединений меняется в зависимости от метода их получения, пришел к ошибочным выводам из-за неточности анализов и использования недостаточно чистых исходных соединений.)
В первые годы девятнадцатого столетия стало совершенно очевидно, что Пруст прав. Закон постоянства состава был уточнен и стал краеугольным камнем химии [37].
И тем не менее с момента открытия закона Пруста существовали серьезные сомнения в его справедливости. В конце концов, почему закон постоянства состава всегда должен быть справедлив? Почему какое-то соединение всегда должно содержать 4 части x и 1 часть y, и почему оно не может содержать, например, 4.1 или 3.9 части x и 1 часть y? Если допустить, что материя является сплошной (а не дискретной), то понять это трудно. Почему элементы не могут смешиваться в несколько иных пропорциях?
А как будет обстоять дело, если материя дискретна — состоит из атомов? Предположим, соединение образуется в результате связывания одного атома x с другим атомом y и никак иначе. (Такая комбинация атомов впоследствии получила название «молекула» от латинского moles — небольшая масса.) Если предположить, что вес атома
x в 4 раза больше, чем вес атома y, то в этом случае соединение содержит точно 4 части x и 1 часть y.
(Такая комбинация атомов впоследствии получила название «молекула» от латинского moles — небольшая масса.) Если предположить, что вес атома
x в 4 раза больше, чем вес атома y, то в этом случае соединение содержит точно 4 части x и 1 часть y.
Чтобы это соотношение изменилось, атом у должен соединиться с таким количеством x, которое чуть больше или чуть меньше одного атома x. Поскольку еще со времен Демокрита атом считался неделимой частицей материи, было нелогично предполагать, что от него можно «отколоть маленький кусочек» или что к нему можно присоединить малую долю второго атома.
Другими словами, если признать атомное строение материи, то из этого положения закон постоянства состава вытекает как естественное следствие. Более того, поскольку справедливость закона постоянства состава — неоспоримый факт, то, следовательно, атомы действительно являются неделимыми частицами.
Proust Joseph | Пруст Жозеф Луи: закон постоянства состава химических соединений: VIKENT.
 RU
RU Французский химик.
В 1806 году на основе изучения химических реакций, Жозеф Луи Пруст открыл закона постоянства состава химических соединений.
«В 1806 г. Наполеон установил континентальную блокаду, чтобы подорвать экономику Англии и ослабить мощь основного противника Франции. В связи с этим во Франции стала обнаруживаться нехватка таких товаров, как хлопок, ром, кофе и сахар, доставлявшихся из колоний морским путём. Требовалось срочно заменить эти заморские товары продуктами из отечественного сырья.
Прусту, который незадолго до этого разработал метод получения виноградного сахара (глюкозы), предложили по приказу Наполеона сто тысяч франков за «организацию производства виноградного сахара». Однако учёный отказался от этого соблазнительного предложения, сославшись на плохое состояние здоровья, хотя в то время он очень нуждался в деньгах.
Материальное положение Пруста улучшилось лишь в 1816 г., когда он был избран членом Парижской Академии наук.
Самым выдающимся научным достижением Пруста было открытие закона постоянства состава. Тем самым он внёс существенный вклад в создание атомно-молекулярногоучёния в первой половине XIX в. Его работа отвечала потребности развивающейся химической промышленности в рациональной технологии, важным условием создания которой является знание количественных отношений при химических превращениях. Ещё в Испании Пруст проводил интенсивные исследования свойств и состава соединенийразличных металлов: олова (1800 и 1805 гг.), меди (1799, 1801, 1804 гг.), железа и никеля (1803 г.), сурьмы (1804 г.), кобальта, серебра и золота (1806 г.).
При этом он обнаружил, что при определении количественного состава оксидов этих металлов многие его современники допускали значительные ошибки: неправильно принимали за оксиды некоторые другие соединения, так как не обращали достаточного внимания на их качественный состав. Они определяли лишь содержание металла в соединении, а всё остальное без достаточных оснований считали кислородом.
Естественно, что на основании таких результатов получались данные, показывающие, что содержание кислорода в оксидах одного и того же металла изменяется постепенно. На основании точных экспериментов Пруст доказал, что многие соединения представляют собой не оксиды, а гидрооксиды. Он также показал, что различные оксиды одного и того же металла имеют вполне определённый состав, который изменяется не плавно, а скачкообразно. […]
Аналогичные результаты были получены им ранее при анализах сульфидов и хлоридов (1799 г.). Они показали всеобщность открытого Прустом закона постоянных отношений, который учёный сформулировал так: «Всегда неизменные отношения, эти постоянные признаки, характеризующее истинные соединения, как искусственно полученные, так и природные; одним словом, это постоянство природы (pondus naturae), так хорошо виденное
Шталем, всё это, я утверждаю, подвластно химику не более, чем закон избирательности, который управляет всеми реакциями соединения».
Биографии великих химиков / Под ред. Карла Хайнинга, М., «Мир», 1981 г., с. 86-87.
формулировка, примеры, значение. Основные законы химии. Закон состава постоянства вещества. Закон сохранения массы вещества
Один из основных законов химии, открытый в 1799 г. Ж. Л. Прустом; согласно этому закону определённое химически чистое соединение независимо от способа его получения состоит из одних и тех же хим. элементов, имеющих постоянные состав и свойства,… … Большая политехническая энциклопедия
закон постоянства состава — pastoviųjų santykių dėsnis statusas T sritis fizika atitikmenys: angl. law of constant proportions; law of definite composition vok. Gesetz der konstanten Gewichtsverhältnisse, n; Gesetz der konstanten Proportionen, n; Gesetz der konstanten… … Fizikos terminų žodynas
закон постоянства состава — закон паёв … Cловарь химических синонимов I
ПОСТОЯНСТВА СОСТАВА ЗАКОН: каждое химическое соединение независимо от способа его получения, состоит из одних и тех же элементов, причем отношения их масс постоянны. Строго применим к газообразным и жидким соединениям. Состав кристаллических… … Большой Энциклопедический словарь
Строго применим к газообразным и жидким соединениям. Состав кристаллических… … Большой Энциклопедический словарь
ПОСТОЯНСТВА СОСТАВА ЗАКОН: каждое химическое соединение, независимо от способа его получения, состоит из одних и тех же элементов, причем отношения их масс постоянны. Строго применим к газообразным и жидким соединениям. Состав кристаллических… … Энциклопедический словарь
В каждом определенном хим. соед., независимо от способа его получения, соотношения масс составляющих элементов постоянны. Сформулирован в нач. 19 в. Ж. Прустом: Соединение есть привилегированный продукт, которому природа дала постоянный состав.… … Химическая энциклопедия
Один из основных законов химии: каждое определённое химическое соединение, независимо от способа его получения, состоит из одних и тех же элементов, причём отношения их масс постоянны, а относительные количества их атомов выражаются… … Большая советская энциклопедия
Один из осн. законов химии, заключающийся в том, что каждое хим. соединение, независимо от способа его получения, состоит из одних и тех же хим. элементов, соединённых друг с другом в одних и тех же отношениях (по массе). П. с. з. был установлен… … Большой энциклопедический политехнический словарь
соединение, независимо от способа его получения, состоит из одних и тех же хим. элементов, соединённых друг с другом в одних и тех же отношениях (по массе). П. с. з. был установлен… … Большой энциклопедический политехнический словарь
Каждое химическое соединение, независимо от способа его получения, состоит из одних и тех же элементов, причём отношения их масс постоянны. Строго применим к газообразным и жидким соединениям. Состав кристаллических соединений может быть и… … Энциклопедический словарь
Каждое хим. соединение, независимо от способа его получения, состоит из одних и тех же элементов, причём отношения их масс постоянны. Строго применим к газообразным и жидким соединениям. Состав кристаллич. соед. может быть и неременным (см.… … Естествознание. Энциклопедический словарь
Данный урок посвящен изучению закона постоянства состава вещества. Из материалов урока вы узнаете, кто открыл этот закон.
I. Открытие закона постоянства состава вещества
К основным законам химии относится закон постоянства состава:
Всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
Атомно-молекулярное учение позволяет объяснить закон постоянства состава. Поскольку атомы имеют постоянную массу, то и массовый состав вещества в целом постоянен.
Закон постоянства состава впервые сформулировал французский ученый-химик Ж.Пруст в 1808 г.
Он писал: «От одного полюса Земли до другого соединения имеют одинаковый состав и одинаковые свойства. Никакой разницы нет между оксидом железа из Южного полушария и Северного. Малахит из Сибири имеет тот же состав, как и малахит из Испании. Во всем мире есть лишь одна киноварь».
В этой формулировке закона, как и в приведенной выше, подчеркивается постоянство состава соединения независимо от способа получения и места нахождения.
Чтобы получить сульфид железа (II) FeS, мы смешиваем железо и серу в соотношении 7:4.
Если смешать их в другой пропорции, например 10:4, то химическая реакция произойдет, но 3 г железа в реакцию не вступит. Почему наблюдается такая закономерность? Известно, что в сульфиде железа (II) на каждый один атом железа приходится один атом серы
. Следовательно, для реакции нужно брать вещества в таких массовых соотношениях, чтобы сохранялось соотношение атомов железа и серы (1:1). Поскольку численные значения атомных масс
Fe, S и их относительных атомных масс A r
(Fe), A r
(S)совпадают, можно записать: A r
(Fe) : A r
(S) = 56:32 = 7:4.
Следовательно, для реакции нужно брать вещества в таких массовых соотношениях, чтобы сохранялось соотношение атомов железа и серы (1:1). Поскольку численные значения атомных масс
Fe, S и их относительных атомных масс A r
(Fe), A r
(S)совпадают, можно записать: A r
(Fe) : A r
(S) = 56:32 = 7:4.
Отношение 7:4 сохраняется постоянно, в каких бы единицах массы ни выражать массу веществ (г, кг, т, а.е.м.). Большинство химических веществ обладает постоянным составом.
Развитие химии показало, что наряду с соединениями постоянного состава существуют соединения переменного состава.
Вещества, имеющие переменный состав существуют, их назвали в честь Бертолле – бертоллидами.
Бертоллиды
— соединения переменного состава, не подчиняющиеся законам постоянных и кратных отношений. Бертоллиды являются нестехиометрическими бинарными соединениями переменного состава, который зависит от способа получения. Многочисленные случаи образования бертоллидов открыты в металлических системах, а также среди оксидов, сульфидов, карбидов, гидридов и др. Например, оксид ванадия(II) может иметь в зависимости от условий получения, состав от V0,9 до V1,3.
Многочисленные случаи образования бертоллидов открыты в металлических системах, а также среди оксидов, сульфидов, карбидов, гидридов и др. Например, оксид ванадия(II) может иметь в зависимости от условий получения, состав от V0,9 до V1,3.
По предложению Н.С. Курнакова первые названы дальтонидами (в память английского химика и физика Дальтона), вторые — бертоллидами (в память французского химика Бертолле, предвидевшего такие соединения). Состав дальтонидов выражается простыми формулами с целочисленными стехиометрическими индексами, например Н 2 О, НCl, ССl 4 , СO 2 . Состав бертоллидов изменяется и не отвечает стехиометрическим отношениям.
В связи с наличием соединений переменного состава в современную формулировку закона постоянства состава следует внести уточнение.
Cостав соединений молекулярной структуры, т.е. состоящих из молекул, — является постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
II. Решение задач
На основе закона постоянства состава можно производить различные расчёты.
Задача №1
В каких массовых отношениях соединяются химические элементы в серной кислоте, химическая формула которой H 2 SO 4 ?
Решение:
Ar(H)=1, Ar(S)=32, Ar(O)=16.
Определим массовые отношения этих элементов в формуле H 2 SO 4
m(H) : m(S) : m(O) = 2Ar(H) : Ar(S) : 4Ar(O) = 2: 32: 64 = 1: 16: 32
Таким образом, чтобы получить 49 г серной кислоты (1+16+32=49), необходимо взять 1 г — Н, 16 г — S и 32 г — О.
Задача №2
Водород соединяется с серой в массовых отношениях 1: 16. Используя данные об относительных атомных массах этих элементов, выведите химическую формулу сероводорода.
Решение:
Используя ПСХЭ найдём относительные атомные массы химических элементов:
Ar(H)=1, Ar(S)=32.
Обозначим количество атомов водорода в формуле — х, а серы — у: Н х S у
m(H) : m(S) = хAr(H) : уAr(S)= х1: у32 = (2*1) : (1*32) = 2: 32 = 1: 16
Следовательно, формула сероводорода Н 2 S
Задача №3
Выведите формулу сульфата меди, если массовые отношения в нём меди, серы и кислорода соответственно равны 2:1:2?
Решение:
Используя ПСХЭ найдём относительные атомные массы химических элементов:
Ar(Cu)=64, Ar(S)=32, Ar(O)=16.
Обозначим количество атомов меди в формуле — х, серы — у, а кислорода — z: Cu x S y O z
m(Cu) : m(S) : m(O) = хAr(Cu) : уAr(S) : zAr(O) = x64: y32: z16 = (1*64) : (1*32) : (4*16) = 64:32:64 = 2:1:2
III. Контрольные задачи
№1. Применяя сведения об относительных атомных массах химических элементов, вычислите массовые отношения элементов в угольной кислоте, химическая формула которой H 2 CO 3 .
№2. Определите массу кислорода, реагирующего без остатка с 3 г водорода, если водород и кислород в данном случае соединяются соответственно в соотношении 1: 8?
№3. Углерод и кислород в углекислом газе соединяются в массовых отношениях 3: 8.
Выведите химическую формулу углекислого газа
№4. Определите массу водорода, реагирующего без остатка с 48 г кислорода, если водород и кислород в данном случае соединяются в соотношеннии 1:8.
Химия относится к разряду точных наук, и наряду с математикой и физикой устанавливает закономерности существования и развития материи, состоящей из атомов и молекул. Все процессы, протекающие как в живых организмах, так и среди объектов неживой природы, имеют в своей основе явления превращения массы и энергии. вещества, изучению которого будет посвящена эта статья, и лежит в основе протекания процессов в неорганическом и органическом мире.
Все процессы, протекающие как в живых организмах, так и среди объектов неживой природы, имеют в своей основе явления превращения массы и энергии. вещества, изучению которого будет посвящена эта статья, и лежит в основе протекания процессов в неорганическом и органическом мире.
Атомно-молекулярное учение
Чтобы понять суть законов, управляющих материальной действительностью, нужно иметь представление о том, из чего она состоит. По словам великого российского ученого М. В. Ломоносова «Во тьме должны пребывать физики и, особенно, химики, не зная внутреннего частиц строения». Именно он в 1741 году, сначала теоретически, а затем и подтвердив опытами, открыл законы химии, служащие основой для изучения живой и неживой материи, а именно: все вещества состоят из атомов, способных образовывать молекулы. Все эти частицы находятся в непрерывном движении.
Открытия и ошибки Дж. Дальтона
Спустя 50 лет идеи Ломоносова стал развивать английский ученый Дж. Дальтон. Ученый выполнил важнейшие расчеты по определению атомных масс химических элементов. Это послужило главным доказательством таких предположений: массу молекулы и вещества можно вычислить, зная атомный вес частиц, входящих в её состав. Как Ломоносов, так и Дальтон считали, что, независимо от способа получения, молекула соединения всегда будет иметь неизменный количественный и качественный состав. Первоначально именно в таком виде был сформулирован закон постоянства состава вещества. Признавая огромный вклад Дальтона в развитие науки, нельзя умолчать о досадных ошибках: отрицании молекулярного строения простых веществ, таких как кислород, азот, водород. Ученый считал, что молекулы есть только у сложных Учитывая огромный авторитет Дальтона в научных кругах, его заблуждения негативно повлияли на развитие химии.
Это послужило главным доказательством таких предположений: массу молекулы и вещества можно вычислить, зная атомный вес частиц, входящих в её состав. Как Ломоносов, так и Дальтон считали, что, независимо от способа получения, молекула соединения всегда будет иметь неизменный количественный и качественный состав. Первоначально именно в таком виде был сформулирован закон постоянства состава вещества. Признавая огромный вклад Дальтона в развитие науки, нельзя умолчать о досадных ошибках: отрицании молекулярного строения простых веществ, таких как кислород, азот, водород. Ученый считал, что молекулы есть только у сложных Учитывая огромный авторитет Дальтона в научных кругах, его заблуждения негативно повлияли на развитие химии.
Как взвешивают атомы и молекулы
Открытие такого химического постулата, как закон постоянства состава вещества, стало возможным благодаря представлению о сохранении массы веществ, вступивших в реакцию и образовавшихся после нее. Кроме Дальтона, измерение атомных масс проводил И. Берцелиус, составивший таблицу атомных весов химических элементов и предложивший современное их обозначение в виде латинских букв. В настоящее время массу атомов и молекул определяют с помощью Результаты, полученные в данных исследованиях, подтверждают существующие законы химии. Ранее ученые использовали такой прибор, как масс-спектрометр, но усложненная методика взвешивания явилась серьёзным недостатком в спектрометрии.
Берцелиус, составивший таблицу атомных весов химических элементов и предложивший современное их обозначение в виде латинских букв. В настоящее время массу атомов и молекул определяют с помощью Результаты, полученные в данных исследованиях, подтверждают существующие законы химии. Ранее ученые использовали такой прибор, как масс-спектрометр, но усложненная методика взвешивания явилась серьёзным недостатком в спектрометрии.
Почему так важен закон сохранения массы веществ
Сформулированный М. В. Ломоносовым выше названный химический постулат доказывает тот факт, что во время реакции атомы, входящие в состав реагентов и продуктов, никуда не исчезают и не появляются из ничего. Их количество сохраняется без изменения до и после Так как масса атомов константна, данный факт логически приводит к закону сохранения массы и энергии. Более того, ученый декларировал эту закономерность, как всеобщий принцип природы, подтверждающий взаимопревращение энергии и постоянство состава вещества.
Идеи Ж. Пруста как подтверждение атомно-молекулярной теории
Обратимся к открытию такого постулата, как закон постоянства состава. Химия конца 18 — начала 19 века — наука, в рамках которой велись научные споры между двумя французскими учеными, Ж. Прустом и К. Бертолле. Первый утверждал, что состав веществ, образовавшихся в результате химической реакции, зависит главным образом от природы реагентов. Бертолле был уверен, что на состав соединений — продуктов реакции влияет еще и относительное количество взаимодействующих между собой веществ. Большинство химиков в начале исследований поддержали идеи Пруста, который сформулировал их следующим образом: состав сложного соединения всегда постоянный и не завит от того, каким способом оно было получено. Однако дальнейшее исследование жидких и твердых растворов (сплавов) подтвердило мысли К. Бертолле. К этим веществам закон постоянства состава был неприменим. Более того, он не действует для соединений с ионными кристаллическими решетками. Состав этих веществ зависит от методов, которыми их добывают.
Состав этих веществ зависит от методов, которыми их добывают.
Каждое химическое вещество, независимо от способа его получения, имеет постоянный качественный и количественный состав. Эта формулировка характеризует закон постоянства состава вещества, предложенный Ж. Прустом в 1808 году. В качестве доказательств он приводит следующие образные примеры: малахит из Сибири имеет такой же состав, как и минерал, добытый в Испании; в мире есть только одно вещество киноварь, и не имеет значения, из какого месторождения она получена. Таким образом Пруст подчеркивал постоянство состава вещества, независимо от места и способа его добычи.
Не бывает правил без исключений
Из закона постоянства состава следует, что при образовании сложного соединения химические элементы соединяются друг с другом в определённых весовых соотношениях. Вскоре в химической науке появились сведения о существовании веществ, имеющих переменный состав, который зависел от способа получения. Русский ученый М. Курнаков предложил назвать эти соединения бертоллидами, например оксид титана, нитрид циркония.
У этих веществ на 1 весовую часть одного элемента приходится различное количество другого элемента. Так, в бинарном соединении висмута с галлием на одну весовую часть галлия приходится от 1,24 до 1,82 части висмута. Позже химики установили, что, кроме соединения металлов друг с другом, вещества, не подчиняющиеся закону постоянства состава, есть в таком как оксиды. Бертоллиды характерны также для сульфидов, карбидов, нитридов и гидридов.
Роль изотопов
Получив в свое распоряжение закон постоянства вещества, химия как точная наука смогла увязать весовую характеристику соединения с изотопным содержанием элементов, образующих его. Вспомним, что изотопами считают атомы одного химического элемента с одинаковыми протонными, но различными нуклонными числами. Учитывая наличие изотопов, понятно, что весовой состав соединения может быть переменным при условии постоянства элементов, входящих в это вещество. Если элемент увеличивает содержание какого-либо изотопа, то и весовой состав вещества тоже изменяется. Например, обычная вода содержит 11 % водорода, а тяжелая, образованная его изотопом (дейтерием), — 20 %.
Например, обычная вода содержит 11 % водорода, а тяжелая, образованная его изотопом (дейтерием), — 20 %.
Характеристика бертоллидов
Как мы уже выяснили ранее, законы сохранения в химии подтверждают основные положения атомно-молекулярной теории и являются абсолютно верными для веществ постоянного состава — дальтонидов. А бертоллиды имеют границы, в которых возможно изменение весовых частей элементов. Например, в оксиде четырёхвалентного титана на одну весовую часть металла приходится от 0,65 до 0,67 части кислорода. Вещества непостоянного состава не их кристаллические решетки состоят из атомов. Поэтому химические формулы соединений лишь отражают границы их состава. У различных веществ они разные. Температура также может влиять на интервалы изменения весового состава элементов. Если два химических элемента образуют между собой несколько веществ — бертоллидов, то для них также неприменим и закон кратных отношений.
Из всех вышеприведенных примеров сделаем вывод: теоретически в химии присутствуют две группы веществ: с постоянным и переменным составом. Наличие в природе этих соединений служит прекрасным подтверждением атомно-молекулярного учения. А вот сам закон постоянства состава уже не является доминирующим в химической науке. Зато он наглядно иллюстрирует историю её развития.
Наличие в природе этих соединений служит прекрасным подтверждением атомно-молекулярного учения. А вот сам закон постоянства состава уже не является доминирующим в химической науке. Зато он наглядно иллюстрирует историю её развития.
ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
Закон сохранения массы
Закон сохранения массы можно сформулировать так:
«масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции».
Открытие данного закона приписывают М.В. Ломоносову (1748 г. и подтвержден экспериментально им самим в 1756 г.), хотя он сам не приписывал себе авторство. В зарубежной литературе открытие данного закона приписывают А. Лавуазье (1789 г.)
Данный закон верен с большой точностью для всех химических реакций, так как дефект массы несоизмеримо мал
После открытия специальной теории относительности, масса приобрела новые свойства:
1. Масса объекта зависит от его внутренней энергии. При поглощении энергии масса растет, при ее выделении масса уменьшается. Особенно ощутимо изменение массы при ядерных реакциях. При химических реакциях изменение массы пренебрежительно мало – при тепловом эффекте реакции 100 кДж/моль изменение массы составит ~10 -9 г/моль, при нагревании железного утюга на 200° его масса возрастает на величину Δm/m~10 -12
Особенно ощутимо изменение массы при ядерных реакциях. При химических реакциях изменение массы пренебрежительно мало – при тепловом эффекте реакции 100 кДж/моль изменение массы составит ~10 -9 г/моль, при нагревании железного утюга на 200° его масса возрастает на величину Δm/m~10 -12
2. Масса не является аддитивной величиной, т.е масса системы не равна сумме масс её составляющих, например аннигиляция электрона и позитрона, частиц имеющую массу покоя на фотоны, не имеющих массу покоя, масса дейтерия не равна сумме масс протона и нейтрона и т.д.
Из вышесказанного следует, что закон сохранения массы тесно связан с законом сохранения энергии, что объясняется специальной теорией относительности и выполняется с таким же ограничением — надо учитывать обмен системы энергией с внешней средой.
Закон эквивалентов
Открыт в результате химических опытов И. Рихтера в 1791-1798 гг
Первоначальная формулировка закона эквивалентов (термин «эквивалент» ввёл в 1767 г. Г. Кавендиш) была следующей: «Если одно и то же количество какой-либо кислоты нейтрализуется различными количествами двух оснований, то эти количества эквивалентны и нейтрализуются одинаковым количеством любой другой кислоты».
Г. Кавендиш) была следующей: «Если одно и то же количество какой-либо кислоты нейтрализуется различными количествами двух оснований, то эти количества эквивалентны и нейтрализуются одинаковым количеством любой другой кислоты».
Проще говоря, химические соединения взаимодействуют не в произвольных, а в строго определённых количественных соотношения.
Однако, данный закон открыл вопрос о постоянстве состава вещества. Виднейший ученный того времени Клод Луи Бертолле предложил в 1803 г. теорию химического сродства, по средствам сил притяжения и зависящего от плотности вещества и его количества. Он отстаивал предположение о том, что элементный состав вещества может изменяться в некоторых пределах в зависимости от условий, в которых оно было получено. Постоянные отношения в соединениях, по Бертолле, могут иметь место лишь в случаях, когда при образовании таких соединений произошло значительное изменение плотности и, следовательно, сил сцепления. Так, газообразные водород и кислород соединяются в воду в постоянных отношениях, потому что вода — жидкость, обладающая значительно большей плотностью, чем исходные газы. Но если изменение плотности и сцепления при образовании соединения незначительно, образуются вещества переменного состава в широких границах отношений составных частей. Границами для образования таких соединений служат состояния взаимного насыщения составных частей. Учение Бертолле, отвергающее постоянство пропорций в химических соединениях было встречено с явным недоверием несмотря на высокий научный авторитет Бертолле. Однако большинство химиков-аналитиков, в том числе таких, как Клапрот и Вокелен, не решились открыто выступить с опровержением утверждений Бертолле. Лишь один, малоизвестный в то время мадридский химик Пруст не постеснялся выступить с критикой взглядов Бертолле и указать на его экспериментальные ошибки и неправильные выводы. После появления первой критической статьи Пруста (1801 г.) Бертолле счел нужным ответить последнему, отстаивая свои положения. Завязалась интересная и исторически весьма важная полемика, продолжавшаяся несколько лет (до 1808 г.) И хотя доводы Пруста, по-видимому, не вполне убедили Бертолле, который еще в 1809 г.
Но если изменение плотности и сцепления при образовании соединения незначительно, образуются вещества переменного состава в широких границах отношений составных частей. Границами для образования таких соединений служат состояния взаимного насыщения составных частей. Учение Бертолле, отвергающее постоянство пропорций в химических соединениях было встречено с явным недоверием несмотря на высокий научный авторитет Бертолле. Однако большинство химиков-аналитиков, в том числе таких, как Клапрот и Вокелен, не решились открыто выступить с опровержением утверждений Бертолле. Лишь один, малоизвестный в то время мадридский химик Пруст не постеснялся выступить с критикой взглядов Бертолле и указать на его экспериментальные ошибки и неправильные выводы. После появления первой критической статьи Пруста (1801 г.) Бертолле счел нужным ответить последнему, отстаивая свои положения. Завязалась интересная и исторически весьма важная полемика, продолжавшаяся несколько лет (до 1808 г.) И хотя доводы Пруста, по-видимому, не вполне убедили Бертолле, который еще в 1809 г. признавал возможность существования соединений переменного состава, все химики встали на точку зрения Пруста, которому принадлежит, таким образом, заслуга экспериментального установления закона постоянства состава химических соединений.
признавал возможность существования соединений переменного состава, все химики встали на точку зрения Пруста, которому принадлежит, таким образом, заслуга экспериментального установления закона постоянства состава химических соединений.
Закон постоянства состава
Закон постоянства состава (постоянных отношений) открыл французкий ученый Жозеф Луи Пруст. И который стал одним из главных химических законов.
Закон постоянства состава — любое определенное химически чистое соединение, независимо от способа его получения, состоит из одних и тех же химических элементов, причём отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами.
Закон постоянства состава и стехиометричность соединений долгое время считались незыблемыми. Однако в начале XX в. И. С. Курнаков на основании своих исследований пришел к выводу о существовании нестехиометрических соединений, т. е. характеризующихся переменным составом. Еще Д. И. Менделеев (1886 г. ) на основе собственных наблюдений и накопившихся к тому времени многочисленных экспериментальных данных пришел к выводу, о наличие веществ с непостоянным составом и что эти соединения являются настоящими химическими соединениями, лишь находящимися в состоянии диссоциации. Н. С. Курнаков отмечал, что было бы ошибкой считать соединения переменного состава чем-то редким и исключительным. Соединения постоянного состава Н. С. Курнаков назвал дальтонидами
в честь Д. Дальтона, широко применявшего атомно-молекулярную теорию к химическим явлениям. Нестехиометрические соединения были названы в честь К. Бертолле бертоллидами.
По его представлениям, бертоллиды — это своеобразные химические соединения переменного состава, формой существования которых является не молекула, а фаза, то есть химически связанный огромный агрегат атомов. Классическая теория валентности не применима для соединений бертоллидного типа, поскольку они характеризуются переменной валентностью, изменяющейся непрерывно, а не дискретно, Перечисление синтезированных и известных соединений говорит о том, что большинство из них относятся к бертоллидному типу.
) на основе собственных наблюдений и накопившихся к тому времени многочисленных экспериментальных данных пришел к выводу, о наличие веществ с непостоянным составом и что эти соединения являются настоящими химическими соединениями, лишь находящимися в состоянии диссоциации. Н. С. Курнаков отмечал, что было бы ошибкой считать соединения переменного состава чем-то редким и исключительным. Соединения постоянного состава Н. С. Курнаков назвал дальтонидами
в честь Д. Дальтона, широко применявшего атомно-молекулярную теорию к химическим явлениям. Нестехиометрические соединения были названы в честь К. Бертолле бертоллидами.
По его представлениям, бертоллиды — это своеобразные химические соединения переменного состава, формой существования которых является не молекула, а фаза, то есть химически связанный огромный агрегат атомов. Классическая теория валентности не применима для соединений бертоллидного типа, поскольку они характеризуются переменной валентностью, изменяющейся непрерывно, а не дискретно, Перечисление синтезированных и известных соединений говорит о том, что большинство из них относятся к бертоллидному типу. В принципе любое твердое соединение, кроме веществ с молекулярной решеткой, является соединением переменного состава.
В принципе любое твердое соединение, кроме веществ с молекулярной решеткой, является соединением переменного состава.
Бертоллиды, по Курнакову, представляют собой твердые растворы неустойчивых в свободном состоянии химических соединений постоянного состава. Охарактеризовав таким образом соединения постоянного и переменного состава, Курнаков пришел к выводу, что и Пруст, и Бертолле были правы в своих утверждениях.
Однако простоты состав многих бертоллидов записывают как постоянный. Например, состав оксида железа(II) записывают в виде FeO (вместо более точной формулы Fe 1-x O).
©2015-2019 сайт
Все права принадлежать их авторам. Данный сайт не претендует на авторства, а предоставляет бесплатное использование.
Дата создания страницы: 2017-10-25
Всякое вещество – от самого
простого
до самого сложного – имеет три различные,
но взаимосвязанные стороны:
свойство, состав, строение…
Б.М.Кедров
Цели
.
Дидактическая
– рассмотреть понятия
«химический элемент», «сложное вещество», а
также состав сложных веществ, его постоянство,
что обозначает химическая формула вещества,
назначение коэффициентов и индексов.
Психологическая
– вызвать интерес к
предмету, выработать умения логически
рассуждать, грамотно выражать свои мысли.
Воспитательная
– развивать умения работать
коллективно, оценивать ответы своих товарищей.
Оборудование . Кристаллическая решетка сульфида железа(II), модели молекул воды, индивидуальные карточки для проверки домашнего задания, таблички-анаграммы для химической разминки, шкала для определения эмоционального состояния ученика.
ХОД УРОКА
В начале и в конце урока проводится
психологическая разминка . Ее цель –
определить эмоциональное состояние учащихся. У
каждого ученика на внутренней стороне обложки
тетради приклеена табличка с шестью лицами –
шкала для определения эмоционального состояния
(рис. 1). Каждый ученик ставит галочку под той
рожицей, чье выражение отражает его настроение.
1). Каждый ученик ставит галочку под той
рожицей, чье выражение отражает его настроение.
УЧИТЕЛЬ . Было бы замечательно, если бы к концу урока каждому удалось переместить галочку хотя бы на одну клетку влево. Для этого нужно задуматься над вопросами: может ли человек полюбить неинтересный ему учебный предмет? Что для этого нужно сделать?
Статья опубликована при поддержке мобильного онлайн переводчика «m-translate.ru ». Удобный и быстрый онлайн перевод с десятка языков, тысячи направлений перевода. Не требует установки, перевод слов, предложений и текстов, бесплатно. Чтобы начать пользоваться сервисом онлайн перевода перейдите на сайт: http://www.m-translate.ru/.
Химическая разминка
.
УЧЕНИК
. Вася и Петя любят составлять и
разгадывать слова-анаграммы (обычно
фантастические), в которых порядок букв
переставлен. Попробуйте разгадать некоторые из
химических анаграмм.
Переставив буквы в каждом слове, надо получить
название химического элемента.
Леодруг
– без этого элемента в печке не будет
огня,
сликодор
– без этого элемента не проживете и
десяти минут,
цинвес
– у этого элемента действительно
большой удельный вес,
мникрей
– этот элемент ищите среди камней,
орребес
– блестит, а не золото.
УЧИТЕЛЬ.
Если вы легко справились с
этим заданием, скажите себе: «Я – умница».
Проверка домашнего задания по теме
«Химические знаки».
Повторить знаки
химических элементов и значения их
относительных атомных масс. Обратить внимание на
различие массы атома (в атомных единицах массы) и
относительной атомной массы (безразмерной
величины) на их общий признак – одинаковое
численное значение. Затем провести фронтальную
самостоятельную работу по индивидуальным
карточкам в течение 5–10 мин.
Карточка 1
. Назовите элементы по их
химическим знакам: N, S, Ag, Al, O, I.
Карточка 2
. Напишите химические знаки
элементов: железо, водород, натрий, бром, цинк,
хлор.
УЧИТЕЛЬ.
Сегодня мы познакомимся с
одним из основных законов химии – это закон
постоянства состава вещества. Мне хочется, чтобы
вы за строгой формулировкой закона увидели
живого, трудолюбивого и любознательного
человека из Франции – Жозефа Луи Пруста. Он в
течение семи лет исследовал множество веществ,
чтобы доказать утверждение, которое в
современной формулировке умещается в три
строчки. Об этом очень красиво сказал в своих
стихах его земляк, малоизвестный у нас
французский поэт Арман Сюлли-Прюдом, лауреат
Нобелевской премии, современник Д.И.Менделеева.
УЧЕНИЦА
«Взор химика пытлив, ему порядок мил,
Среди своих реторт, мензурок и приборов,
Таких загадочных для любопытных взоров,
Стремится он постичь капризы тайных сил.
Он многое из них уже установил,
Следя за их игрой, участник их раздоров,
И скоро он велит, властитель этих споров,
Признать и чтить закон, который он открыл.
Завидую тебе, взыскательный ученый,
Чьи зоркие глаза мир видят обнаженный,
Как в день творения, исток всех прочих дней.
Веди ж меня в загадочное царство!
Я верю: только в нем отыщется лекарство
От всех бесчисленных печалей и скорбей».
УЧИТЕЛЬ.
Чтобы получить сульфид
железа(II), мы смешивали железо и серу в
соотношении 7:4. Если смешать их в другой
пропорции, например 10:4, то химическая реакция
произойдет, но 3 г железа в реакцию не вступит.
Почему наблюдается такая закономерность?
Известно, что в сульфиде железа(II) на каждый один
атом железа приходится один атом серы
(демонстрация
кристаллической решетки, рис. 2). Следовательно,
для реакции нужно брать вещества в таких
массовых соотношениях, чтобы сохранялось
соотношение атомов железа и серы (1:1). Поскольку
численные значения атомных масс
Fe, S и их
относительных атомных масс A r
(Fe), A r
(S)
совпадают, можно записать:
A r
(Fe):A r
(S)
= 56:32 = 7:4.
Отношение 7:4 сохраняется постоянно, в каких бы
единицах массы ни выражать массу веществ
(г, кг, т, а. е.м.). Большинство химических веществ
обладает постоянным составом.
е.м.). Большинство химических веществ
обладает постоянным составом.
Закон постоянства состава веществ
был
открыт французским ученым Прустом в 1808 г. Вот как
этот закон звучал в его изложении: «От одного
полюса Земли до другого соединения имеют
одинаковый состав и одинаковые свойства. Никакой
разницы нет между оксидом железа из Южного
полушария и Северного. Малахит из Сибири имеет
тот же состав, как и малахит из Испании. Во всем
мире есть лишь одна киноварь».
Современная формулировка закона
:
каждое химически чистое вещество с молекулярным
строением независимо от места нахождения и
способа получения имеет один и тот же постоянный
качественный и количественный состав.
Учащиеся записывают определение в тетрадь.
Затем они выполняют самостоятельную работу
.
Текст заданий заранее написан на доске. Двое
учащихся решают задачи на обратной стороне
доски, остальные решают в тетрадях. После
выполнения работы ученики обмениваются
тетрадями, происходит взаимопроверка. Учитель
может выборочно проверить некоторые тетради.
Учитель
может выборочно проверить некоторые тетради.
Вариант 1
. Для получения сульфида железа(II)
взяли 3,5 г железа и 4 г серы. Какое вещество
останется неизрасходованным и какова его масса?
Вариант 2
. Чтобы получить сульфид железа(II),
взяли 15 г железа и 8 г серы. Какое вещество взято в
избытке и какова масса этого избытка?
УЧИТЕЛЬ.
А сейчас послушайте
выступление о знаменитом споре между
французскими учеными Ж.Л.Прустом и К.Л.Бертолле,
который длился около 10 лет на страницах
французских журналов в начале XIX в.
УЧЕНИК.
Да, спор двух французских
химиков длился с 1799 по 1809 г., а затем был продолжен
химиками Англии, Швеции, Италии, России и других
стран. Этот спор можно с полным правом назвать
первой научной дискуссией такого масштаба и по
времени возникновения, и по стратегической
важности обсуждаемых проблем. Эта дискуссия
определила пути развития химии на столетия
вперед.
В 1799 г. профессор Королевской лаборатории в
Мадриде, француз по происхождению, Жозеф Луи
Пруст опубликовал статью «Исследования меди». В
статье подробно освещены анализы соединений
меди и сделан вполне обоснованный вывод, что
химически индивидуальное соединение всегда,
независимо от способа его образования, обладает
постоянным составом. К такому же выводу Пруст
пришел и позже, в 1800–1806 гг., исследуя химические
соединения свинца, кобальта и других металлов.
В
статье подробно освещены анализы соединений
меди и сделан вполне обоснованный вывод, что
химически индивидуальное соединение всегда,
независимо от способа его образования, обладает
постоянным составом. К такому же выводу Пруст
пришел и позже, в 1800–1806 гг., исследуя химические
соединения свинца, кобальта и других металлов.
В 1800–1803 гг. английский химик Джон Дальтон
обосновал этот закон теоретически, установив
атомное строение молекул и наличие определенных
атомных масс элементов. Чисто теоретически
Дальтон пришел к открытию еще одного основного
закона химии – закона кратных отношений,
находящегося в единстве с законом постоянства
состава.
В то же самое время профессор Нормальной школы в
Париже Клод Луи Бертолле, уже знаменитый химик,
опубликовал ряд статей, в которых отстаивал
вывод о том, что состав химических соединений
зависит от способа их получения и часто бывает не
постоянным, а переменным. Бертолле выступил
против законов Пруста и Дальтона, аргументируя
это все новыми и новыми опытами по получению
сплавов, твердых оксидов металлов. Он
воспользовался и данными самого Пруста, указав
на то, что в природных сульфидах и оксидах
металлов содержится избыток серы и кислорода по
сравнению с полученными в лаборатории.
Он
воспользовался и данными самого Пруста, указав
на то, что в природных сульфидах и оксидах
металлов содержится избыток серы и кислорода по
сравнению с полученными в лаборатории.
Развитие химии показало, что обе стороны были
правы. Точка зрения Пруста и Дальтона для химии
1800-х гг. была понятна, конкретна и почти очевидна.
Пруст и Дальтон заложили основы атомно-
молекулярного учения о составе и строении
химических соединений. Это была магистральная
линия развития химии. Точка зрения Бертолле была
практически неприемлема для тогдашней химии, т.
к. она отражала химизм процессов, изучение
которых началось в основном лишь
с 1880-х гг. И только будущее показало, что и
Бертолле был прав!
По предложению академика Н.С.Курнакова вещества
постоянного состава были названы дальтонидами (в
честь английского химика и физика Дальтона), а
вещества переменного состава – бертоллидами (в
память о французском химике Бертолле). (Более
подробно об этом можно прочитать в работах . )
)
УЧИТЕЛЬ.
Подведем итоги сообщения.
Во-первых, известны вещества немолекулярного
строения с переменным составом. Во-вторых, закон
постоянства состава веществ справедлив для
веществ молекулярного строения. В-третьих,
существует категория веществ молекулярного
строения, для которых закон постоянства состава
неверен. Это полимеры, с ними мы познакомимся на
уроках химии позднее.
Что же подразумевается под количественным и
качественным составами веществ? На основе закона
Пруста можно записать химические формулы
веществ при помощи химических знаков.
Рассмотрим в качестве примера состав молекулы
воды. Она состоит из атомов водорода и кислорода
(качественный состав), причем по массе в воде
содержится водорода – 11,19%, а кислорода – 88,81%
(количественный состав). Есть несколько способов
выражения состава воды.
1-й способ
. В состав молекулы воды входят два
атома водорода и один атом кислорода (используем
слова).
2-й
способ
. Эту же мысль можно выразить рисунком
(используем условные обозначения):
Эту же мысль можно выразить рисунком
(используем условные обозначения):
3-й способ
. Формула воды –
Н 2 О (используем
химические знаки и индексы).
Индекс
показывает количество атомов
данного элемента в молекуле.
Итак, состав дальтонидов выражается простыми
формулами с целочисленными стехиометрическими
индексами, например
Н 2 О, НСl, СН 4 . Состав
бертоллидов непостоянен, у них дробные
стехиометрические индексы. Так, оксид титана(II)
ТiO в действительности имеет состав от
ТiO 0,7
до ТiO 1,3 .
Ответьте мне на вопрос: что показывает
коэффициент? (Ответ учащихся: число молекул
данного вещества.)
Рассмотрим пример: 3Н 2 О. Какое количество
молекул воды отображает эта запись? Сколько
атомов водорода в одной молекуле воды, в трех
молекулах воды? Сколько атомов кислорода в одной
молекуле воды, в трех молекулах воды?
(Демонстрация моделей молекул воды.) Читаем
формулу: «три-аш-два-о».
Демонстрация увеличенного рисунка 15 на с. 24
учебника «Химия-8» , представляющего запись: 3CuCl 2 ,
5Al 2 O 3 , 3FeCl 2 .
24
учебника «Химия-8» , представляющего запись: 3CuCl 2 ,
5Al 2 O 3 , 3FeCl 2 .
УЧИТЕЛЬ.
Как прочитать формулы
указанных веществ? Сколько молекул данного
вещества отображает химическая формула? Сколько
атомов каждого элемента входит в одну молекулу
данного вещества? Сколько атомов каждого
элемента в трех (пяти) молекулах данного
вещества?
Химическая формула
– это условная
запись состава вещества посредством химических
знаков и индексов.
Ученики записывают определение в тетрадь.
Беседа с учащимися по вопросам.
1. Кем и когда был открыт закон постоянства
состава веществ?
2. Дайте определение этого закона.
3. В чем состояла суть спора между химиками
Прустом, Дальтоном и Бертолле?
4. Что отображает химическая формула вещества?
5. Что показывают коэффициент и индексы в
химической формуле?
6. Есть ли разница в составе веществ, имеющих
формулы: СО и СО 2 , Н 2 О и Н 2 О 2 ?
7. Используя химические знаки, индексы и
коэффициенты, запишите обозначения
двух молекул воды,
трех молекул оксида азота (если известно, что в
молекуле оксида азота на один атом азота
приходится два атома кислорода),
трех молекул сероводорода (в его молекуле на два
атома водорода приходится один атом серы),
четырех молекул оксида фосфора (в каждой
молекуле этого оксида на два атома фосфора
приходится пять атомов кислорода).
Ученики делают записи в тетради, один ученик – на
обратной стороне доски. Проверка: обмен
тетрадями с соседом по парте, сверка по ответу на
доске, анализ ошибок.
Задание на дом.
Учебник «Химия-8» , § 9,
с. 22–23; § 10, с. 24–25. Двум учащимся дается задание
подготовить небольшие сообщения по биографии
Пруста.
Итоги урока
. Объявить оценки за урок
отвечавшим ученикам, поблагодарить всех за
работу на уроке. Провести оценку эмоционального
состояния по шкале (см. рис. 1). Учитель еще раз
напоминает вопросы, над которыми необходимо
подумать для эффективной работы на уроках.
ЛИТЕРАТУРА
1. Соловейчик С.Л.
Час ученичества. М.:
Педагогика, 1986.
2. Леенсон И.А.
Химические элементы и
химические законы. Рабочая тетрадь. М.: Изд-во
гимназии «Открытый мир», 1995.
3. Кузнецов В.И., Рахимбекова X.
Дискуссии в
развитии науки и диалоговая форма обучения.
Химия в школе, 1991, № 6.
4. Кузнецов В.И.
Эволюция представлений об
основных законах химии. М.: Наука, 1967.
М.: Наука, 1967.
5. Рудзитис Г.Е., Фельдман Ф.Г.
Химия-8. М.:
Просвещение, 1991.
Краткая история химии. Развитие идей и представлений в химии.
Более того, Пруст установил, что постоянство соотношений компонентов наблюдается и в ряде других соединений. Он сформулировал общее правило, согласно которому все соединения содержат элементы в строго определенных пропорциях (а не в любых сочетаниях) вне зависимости от условий получения этих соединений. Это правило называется законом постоянства состава, или иногда законом Пруста. (Пруст также показал, что Бертолле, пытаясь доказать, что состав определенных соединений меняется в зависимости от метода их получения, пришел к ошибочным выводам из-за неточности анализов и использования недостаточно чистых исходных соединений. )
В первые годы девятнадцатого столетия стало совершенно очевидно, что Пруст прав. Закон постоянства состава был уточнен и стал краеугольным камнем химии [37].
И тем не менее с момента открытия закона Пруста существовали серьезные сомнения в его справедливости. В конце концов, почему закон постоянства состава всегда должен быть справедлив? Почему какое-то соединение всегда должно содержать 4 части x и 1 часть y, и почему оно не может содержать, например, 4. 1 или 3. 9 части x и 1 часть y? Если допустить, что материя является сплошной (а не дискретной), то понять это трудно. Почему элементы не могут смешиваться в несколько иных пропорциях?
В конце концов, почему закон постоянства состава всегда должен быть справедлив? Почему какое-то соединение всегда должно содержать 4 части x и 1 часть y, и почему оно не может содержать, например, 4. 1 или 3. 9 части x и 1 часть y? Если допустить, что материя является сплошной (а не дискретной), то понять это трудно. Почему элементы не могут смешиваться в несколько иных пропорциях?
А как будет обстоять дело, если материя дискретна — состоит из атомов? Предположим, соединение образуется в результате связывания одного атома x с другим атомом y и никак иначе. (Такая комбинация атомов впоследствии получила название «молекула» от латинского moles — небольшая масса. ) Если предположить, что вес атома x в 4 раза больше, чем вес атома y, то в этом случае соединение содержит точно 4 части x и 1 часть y.
Чтобы это соотношение изменилось, атом у должен соединиться с таким количеством x, которое чуть больше или чуть меньше одного атома x. Поскольку еще со времен Демокрита атом считался неделимой частицей материи, было нелогично предполагать, что от него можно «отколоть маленький кусочек» или что к нему можно присоединить малую долю второго атома.
Другими словами, если признать атомное строение материи, то из этого положения закон постоянства состава вытекает как естественное следствие. Более того, поскольку справедливость закона постоянства состава — неоспоримый факт, то, следовательно, атомы действительно являются неделимыми частицами.
Конспект урока по химии на тему «Закон сохранения массы веществ. Закон постоянства состава веществ. Вещества молекулярного и немолекулярного строения» 11 класс
Урок № 2
Тема: «Закон сохранения массы веществ. Закон постоянства состава веществ. Вещества молекулярного и немолекулярного строения».
Цель: повторить основные законы стехиометрии – закон сохранения массы веществ и закон постоянства состава веществ.
Задачи:
Образовательные:
Углубить знания учащихся о законе сохранения массы веществ, дать краткие сведения об истории открытия закона и научной деятельности ученых в этой области, рассмотреть значимость этого закона в химии.

Повторить закон постоянства состава веществ и научить применять для решения задач.
Развивающие:
Развивать познавательный интерес к предмету.
Создать условия для овладения приемами изучения состава веществ.
Формировать умение проводить поиск, обработку и систематизацию информации.
Воспитательные:
Воспитывать толерантные отношения в группе, классе.
Тип урока: изучение нового материала.
Методы: словесный, наглядный, практический.
Ход урока:
Орг.момент.
Взаимное приветствие, проверка готовности к уроку, отметка отсутствующих.
Проверка домашнего задания.
Стр.6
22 протона содержит ядро атома Титана, так как порядковый номер его 22.

Речь идет о Железе. Порядковый номер 26, электронов 26, нейтронов 30. 26 56Fe.
Атом урана: протонов – 92, нейтронов 143; атом калия: протонов – 19, нейтронов- 22, атом стронция: протонов 38, нейтронов – 52.
Актуализация опорных знаний. Вводный контроль знаний.
Дайте ответы на следующие вопросы:
Что называется химическими реакциями? Химическими реакциями называются явления, при которых одни вещества, обладающие определенным составом и свойствами, превращаются в другие вещества — с другим составом и другими свойствами. При этом в составе атомных ядер изменений не происходит.
Что называется реагентами и продуктами реакции? Продукты реакции — это те вещества, которые получаются в результате реакции.
Соответственно, реагенты — вещества, вступающие в реакцию.
Что называют химическим уравнением? Химическим уравнением (уравнением химической реакции) называют условную запись химической реакции с помощью химических формул, числовых коэффициентов и математических символов.
Что показывают коэффициенты в уравнении химической реакции? Коэффициенты в уравнении химической реакции показывают не только число молекул каждого вещества, но и соотношение количеств веществ, участвующих в реакции.
4.Изучение нового материала.
Давайте рассмотрим реакции между метаном и кислородом. В этой реакции метан и кислород – реагенты, а диоксид углерода и вода – продукты.
СН4 + 2О2 = СО2 + 2Н2О
Изготовим пластилиновые модельки реагентов, похожие на те, что изображены на рисунке:
Получатся модельки одной молекулы метана и двух молекул кислорода. Мы можем разобрать эти модельки на отдельные «атомы» и тут же собрать из них модельки продуктов. Для этого нам не потребуется никаких других деталей – только те атомы, которые мы взяли из одной “молекулы” метана и двух “молекул” кислорода.
Мы можем разобрать эти модельки на отдельные «атомы» и тут же собрать из них модельки продуктов. Для этого нам не потребуется никаких других деталей – только те атомы, которые мы взяли из одной “молекулы” метана и двух “молекул” кислорода.
Разумеется, масса всех пластилиновых «атомов» при этом не изменилась, хотя перед нами теперь лежат уже совсем другие «молекулы» – диоксида углерода и воды.
Этот простой опыт иллюстрирует один из важнейших законов природы – ЗАКОН СОХРАНЕНИЯ МАССЫ. Новые вещества не получаются из ничего и не могут обратиться в ничто. Масса (вес) реагентов всегда в точности равна массе (весу) продуктов химической реакции. Этот фундаментальный закон впервые открыл русский ученый М.В.Ломоносов. Немного позже французский химик А.Лавуазье пришел к тем же выводам и независимо от Ломоносова сформулировал тот же закон.
Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции
Когда мы разбирали пластилиновые модельки реагентов СН4 и О2, чтобы собрать модельки продуктов СО2 и Н2О, нам не потребовалось что-либо изменять в атомах. Разве что самую малость: к атому углерода в молекуле СО2 атомы кислорода прикрепляются не так, как до этого прикреплялись атомы водорода.
Разве что самую малость: к атому углерода в молекуле СО2 атомы кислорода прикрепляются не так, как до этого прикреплялись атомы водорода.
Значит, изменения коснулись только «внешней поверхности» атома. Там, как мы знаем, в настоящем атоме находится валентная электронная оболочка. Точно так же в химических реакциях изменения касаются только внешних электронов, а вся внутренняя «начинка» атома, находящаяся под его валентной оболочкой, остается неизменной.
Задача: Аэронавты погрузили на воздушный шар 2 кг продуктов и отправились в полет. Как изменилась масса воздушного шара с аэронавтами после того, как все продукты были съедены?
Работа в группах. А сейчас я предлагаю Вам небольшие задачи. Обсудите их в группах и через минуту докажите справедливость закона сохранения массы.
1 группа
Масса золы, полученной при сжигании дров гораздо меньше массы исходных веществ. Объясните, не противоречит ли этот факт закону сохранения массы веществ?
Объясните, не противоречит ли этот факт закону сохранения массы веществ?
Дополнительная информация!
При сжигании дров органические вещества, входящие в состав дерева превращаются в водяной пар и углекислый газ.
2 группа
Горящая свеча тает, оставляя лишь маленькую лужицу парафина. Объясните, не противоречит ли это закону сохранения массы веществ.
Дополнительная информация!
При горении парафина образуются летучие водяные пары и углекислый газ.
3 группа
Объясните, не противоречит ли закону сохранения массы веществ, что масса проржавевшего ведра может оказаться больше, чем масса такого же нового ведра?
Дополнительная информация!
Ржавчина образуется при взаимодействии железа с кислородом воздуха и влагой.
4 группа
Можно ли при сжигании 100 кг угля (С) получить углекислого газа (СО2) больше, чем 100 кг? За счет чего масса углекислого газа больше массы использованного угля?
Дополнительная информация!
При горении вещества присоединяют кислород.
Закон постоянства состава веществ был открыт французским ученым Прустом в 1808 г. Вот как этот закон звучал в его изложении: «От одного полюса Земли до другого соединения имеют одинаковый состав и одинаковые свойства. Никакой разницы нет между оксидом железа из Южного полушария и Северного. Малахит из Сибири имеет тот же состав, как и малахит из Испании. Во всем мире есть лишь одна киноварь».
Современная формулировка закона: каждое химически чистое вещество с молекулярным строением независимо от места нахождения и способа получения имеет один и тот же постоянный качественный и количественный состав.
А сейчас послушайте выступление о знаменитом споре между французскими учеными Ж.Л.Прустом и К.Л.Бертолле, который длился около 10 лет на страницах французских журналов в начале XIX в.
Да, спор двух французских химиков длился с 1799 по 1809 г., а затем был продолжен химиками Англии, Швеции, Италии, России и других стран. Этот спор можно с полным правом назвать первой научной дискуссией такого масштаба и по времени возникновения, и по стратегической важности обсуждаемых проблем. Эта дискуссия определила пути развития химии на столетия вперед.
Этот спор можно с полным правом назвать первой научной дискуссией такого масштаба и по времени возникновения, и по стратегической важности обсуждаемых проблем. Эта дискуссия определила пути развития химии на столетия вперед.
В 1799 г. профессор Королевской лаборатории в Мадриде, француз по происхождению, Жозеф Луи Пруст опубликовал статью «Исследования меди». В статье подробно освещены анализы соединений меди и сделан вполне обоснованный вывод, что химически индивидуальное соединение всегда, независимо от способа его образования, обладает постоянным составом. К такому же выводу Пруст пришел и позже, в 1800–1806 гг., исследуя химические соединения свинца, кобальта и других металлов.
В 1800–1803 гг. английский химик Джон Дальтон обосновал этот закон теоретически, установив атомное строение молекул и наличие определенных атомных масс элементов. Чисто теоретически Дальтон пришел к открытию еще одного основного закона химии – закона кратных отношений, находящегося в единстве с законом постоянства состава.
В то же самое время профессор Нормальной школы в Париже Клод Луи Бертолле, уже знаменитый химик, опубликовал ряд статей, в которых отстаивал вывод о том, что состав химических соединений зависит от способа их получения и часто бывает не постоянным, а переменным. Бертолле выступил против законов Пруста и Дальтона, аргументируя это все новыми и новыми опытами по получению сплавов, твердых оксидов металлов. Он воспользовался и данными самого Пруста, указав на то, что в природных сульфидах и оксидах металлов содержится избыток серы и кислорода по сравнению с полученными в лаборатории.
Развитие химии показало, что обе стороны были правы. Точка зрения Пруста и Дальтона для химии 1800-х гг. была понятна, конкретна и почти очевидна. Пруст и Дальтон заложили основы атомно-
молекулярного учения о составе и строении химических соединений. Это была магистральная линия развития химии. Точка зрения Бертолле была практически неприемлема для тогдашней химии, т. к. она отражала химизм процессов, изучение которых началось в основном лишь
с 1880-х гг. И только будущее показало, что и Бертолле был прав!
И только будущее показало, что и Бертолле был прав!
По предложению академика Н.С.Курнакова вещества постоянного состава были названы дальтонидами (в честь английского химика и физика Дальтона), а вещества переменного состава – бертоллидами (в память о французском химике Бертолле).
На основании этого закона состав веществ выражается химической формулой с помощью химических знаков и индексов. Например, Н2О, СН4, С2Н5ОН и т.п.
Закон постоянства состава справедлив для веществ молекулярного строения. Наряду с веществами, имеющими постоянный состав, существуют вещества переменного состава. К ним относятся соединения, в которых чередование нераздельных структурных единиц (атомов, ионов) осуществляется с нарушением периодичности.
В связи с наличием соединений переменного состава современная формулировка закона постоянства состава содержит уточнения:
Состав соединений молекулярного строения, то есть состоящих из молекул, является постоянным независимо от способа получения.
Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
5. Выводы по уроку:
В чем сущность закона сохранения массы веществ?
Закон сохранения массы веществ заключается в том, что масса вступивших веществ в реакцию равна массе веществ образованных.Какое значение имеет закон сохранения массы веществ?
Слово учителя:
Уравнение реакции отражает материальный баланс вступивших в реакцию веществ (реагентов) и образовавшихся продуктов.
6. Закрепление.
Почему масса железной окалины больше массы железа? Какие вещества могут входить в состав окалины? (В состав окалины входят железо и кислород.)
Почему масса золы меньше массы сгоревшей древесины? (Углекислый газ, вода испаряются.)
Анализ уравнения реакции:
2Н2О → 2Н2 + О2
2*(1*2+16) = 2*2 + 2*16
7. Домашнее задание.
Домашнее задание.
Параграф 2, упр 3-4.
Жозеф-Луи Пруст | Французский химик
Жозеф-Луи Пруст , известный также как Луис Пруста , (родился 26 сентября, 1754, Анжер , Франция-умер 5 июля 1826, Анже), французский химик , который доказал , что относительные количества любого заданного чистого химического соединения «S составные элементы остаются неизменными независимо от источника соединения. Это известно как закон Пруста или закон определенных пропорций (1793 г.), и это фундаментальный принцип аналитической химии . Пруст также провел важные прикладные исследования в области металлургии , взрывчатых веществ и химии пищевых продуктов.
Образование и жизнь
Сын аптекаря, Пруст готовился к тому же занятию, сначала со своим отцом в Анже, а затем в Париже, где он также изучал химию у Илера-Мартена Руэля. В 1776 году Пруст был назначен фармацевтом в больнице Сальпетриер в Париже. Однако это положение было недолгим, поскольку в 1778 году Пруст оставил аптеку, чтобы занять должность профессора химии в недавно созданном Seminario Patriótico Vascongado в Вергаре, Испания . Эта школа была созданием Real Sociedad Económica Vascongada de Amigos del País, первого и наиболее важного из «просвещенных» провинциальных обществ Испании.
Эта школа была созданием Real Sociedad Económica Vascongada de Amigos del País, первого и наиболее важного из «просвещенных» провинциальных обществ Испании.
В 1780 году Пруст вернулся в Париж, где он преподавал химию в Музее, частном учебном заведении, основанном научным импресарио Жаном-Франсуа Пилатром де Розье. В рамках этой ассоциации Пруст участвовал в аэростатических экспериментах, кульминацией которых стало восхождение на воздушном шаре с Пилатром 23 июня 1784 года в Версале в присутствии королевского двора.
В 1786 году Пруст вернулся в Испанию, чтобы преподавать химию сначала в Мадриде, а затем в 1788 году в Королевской артиллерийской школе в Сеговии . Школа была основана в 1764 году в рамках программы правительства Карла III, чтобы поставить Испанию в один ряд с северными европейскими странами в отношении военной подготовки. Кафедра Пруста (и связанная с ней школа химии и металлургии) была предложена в 1784 году для ознакомления курсантов артиллерии с новейшей соответствующей научной подготовкой. Из-за отсталости Испании в науке приходилось искать опытных инструкторов за границей. Пруста рекомендовал не меньше, чем великий французский химик Антуан-Лоран Лавуазье .
Из-за отсталости Испании в науке приходилось искать опытных инструкторов за границей. Пруста рекомендовал не меньше, чем великий французский химик Антуан-Лоран Лавуазье .
Фактически Пруст не занимал свое кресло до 1792 года из-за сочетания бюрократической неэффективности и собственных высоких требований к лабораторному оборудованию. Когда он наконец был готов, его лаборатория, несомненно, была одной из лучших в Европе, и Пруст, вероятно, проделал большую часть своей практической и аналитической химии там. Однако трудности с военными властями привели к тому, что Пруст в 1799 году перешел на кафедру химии в Мадриде.
В 1798 году Пруст женился на Анне Роуз Шатлен Добин, французской жительнице Сеговии. Они вернулись во Францию в 1806 году при невыясненных обстоятельствах и поселились в Краоне, недалеко от Анжера. После смерти жены в 1817 году Пруст переехал в Анже, где в 1820 году приобрел аптеку своего больного брата Иоахима. Хотя Пруст вернулся во Францию в стесненных обстоятельствах, его научный авторитет был признан. Он был избран во Французскую академию наук, чтобы сменить Луи Бернара Гайтона де Морво в 1816 году; он стал кавалером Почетного легиона в 1819 году; и он получил пенсию от Людовика XVIII в 1820 году.
Хотя Пруст вернулся во Францию в стесненных обстоятельствах, его научный авторитет был признан. Он был избран во Французскую академию наук, чтобы сменить Луи Бернара Гайтона де Морво в 1816 году; он стал кавалером Почетного легиона в 1819 году; и он получил пенсию от Людовика XVIII в 1820 году.
Пруст наиболее известен как химик-аналитик, особенно за его формулировку закона определенных пропорций. Суть закона Пруста состоит в том, что химические вещества действительно объединяются, образуя небольшое количество соединений , каждое из которых характеризуется компонентами, которые соединяются в фиксированных весовых пропорциях. Формулировка Пруста и экспериментальная демонстрация этого закона касались исключительно бинарных неорганических соединений, таких как оксиды, сульфиды и сульфаты металлов. Он считал, что большинство металлов образуют два различных оксида в постоянных пропорциях, которые он назвал минимальным и максимальным, и они, в свою очередь, способны образовывать две отдельные серии соединений. Что касается сульфидов, Пруст утверждал, что существует только один сульфид на каждый металл, за исключением железа .
Что касается сульфидов, Пруст утверждал, что существует только один сульфид на каждый металл, за исключением железа .
Хотя положения закона, привлекшие внимание европейских химиков, впервые появились во французских журналах, начиная с 1797 года, Пруст сформулировал закон к 1793 году и опубликовал его к 1795 году в испанских журналах. Закон определенной пропорции Пруста имел предшественников в химии 18-го века и параллель во французской минералогии 18-го века. Современником формулировки Пруста была доктрина фиксированных минеральных видов во французской минералогии, которая определялась в терминах фиксированной кристаллической формы и постоянного химического состава .
Закон определенных пропорций Пруста подвергся критике в 1803 году выдающимся французским химиком. Клод-Луи Бертолле , который усовершенствовал свою собственную теорию химического сродства в 1801 году, чтобы предположить, что химическая комбинация не обязательно ограничивается определенными пропорциями насыщения. Противоречие происходило во французских научных журналах и состояло из статьи или двух каждый год от каждого главного героя. В основе разногласий лежало определение химического соединения. По традиции Бертолле считал растворы химическими комбинациями; действительно, они были парадигматическими для его концепции континуумасочетания пропорций. Он назвал некоторые комбинации растворов в различных пропорциях (например, сульфиды металлов) и считал их настоящими соединениями. Напротив, Пруст резко различал эти и свои собственные настоящие бинарные соединения в фиксированных пропорциях.
Противоречие происходило во французских научных журналах и состояло из статьи или двух каждый год от каждого главного героя. В основе разногласий лежало определение химического соединения. По традиции Бертолле считал растворы химическими комбинациями; действительно, они были парадигматическими для его концепции континуумасочетания пропорций. Он назвал некоторые комбинации растворов в различных пропорциях (например, сульфиды металлов) и считал их настоящими соединениями. Напротив, Пруст резко различал эти и свои собственные настоящие бинарные соединения в фиксированных пропорциях.
Что в конечном итоге разрешило спор в пользу Пруста, так это влияние химической теории атома (1801 г.) английского химика.Джон Далтон . Атомная теория Дальтона дала простую теоретическую основу для закона определенных пропорций, особенно после того, как шведский химикЙенс Якоб Берцелиус установил концептуальную связь между законом Пруста и теорией Дальтона в 1811 году.
Другое исследование
Традиционные повествования в истории химии сосредоточены исключительно на аналитической работе Пруста. Однако на самом деле его карьера поддерживалась более практической химической деятельностью. Например, контекст самого раннего утверждения Пруста о том, что объединение веществ образует два различных соединения в максимальных и минимальных пропорциях, пришел из его исследования литья пушек; в частности, это касалось отношения олова к меди в двух сплавах бронзы . В смежной области прикладной химии Пруст опубликовал наиболее полные на тот момент экспериментальные исследования пороха.. Он также провел важные исследования в области химии питания, предложив методы производства различных пищевых добавок.
Однако на самом деле его карьера поддерживалась более практической химической деятельностью. Например, контекст самого раннего утверждения Пруста о том, что объединение веществ образует два различных соединения в максимальных и минимальных пропорциях, пришел из его исследования литья пушек; в частности, это касалось отношения олова к меди в двух сплавах бронзы . В смежной области прикладной химии Пруст опубликовал наиболее полные на тот момент экспериментальные исследования пороха.. Он также провел важные исследования в области химии питания, предложив методы производства различных пищевых добавок.
Закон постоянства состава: формулировка, примеры, значение
Одно и то же химическое соединение имеет постоянный состав, вне зависимости от места и способа получения образца. К такому выводу одним из первых пришел основатель современной химии, французский ученый А. де Лавуазье. Он сумел определить состав воды, воздуха, органических веществ, считал, что частицы входят в состав веществ в определенных пропорциях. Позже другим химиком из Франции Ж. Л. Прустом был сформулирован закон постоянства состава. Оба исследователя немало сил приложили, чтобы отстоять свои идеи в споре с научным сообществом.
Позже другим химиком из Франции Ж. Л. Прустом был сформулирован закон постоянства состава. Оба исследователя немало сил приложили, чтобы отстоять свои идеи в споре с научным сообществом.
Химические элементы, соединяясь друг с другом в разных соотношениях, образуют множество веществ. Каждое из них характеризуется определенным набором атомов и соотношением их масс. Но до конца XVIII столетия многие ученые считали иначе. Проблема для них заключалась в неточности количественных методик. К тому же позиции атомно-молекулярных воззрений в то время были зыбкими, господствовала теория флогистона — мифического элемента. В установление количественного состава вещества значительный вклад внесли:
- А. де Лавуазье;
- М. В. Ломоносов;
- Ж. Л. Пруст;
- Д. Дальтон.
Заслуга Ж. Л. Пруста заключается в том, что он усовершенствовал количественные методы Лавуазье, строго им следовал. Ученый предложил закон постоянства состава, сохранения соотношений элементов в образцах соединений. Работу в этом направлении Пруст начал еще в конце XVIII века, но признание его труды получили только в 1808 году. Джон Дальтон примерно в это же время ввел представление об атомах и массах этих частиц, кратных соотношениях.
Работу в этом направлении Пруст начал еще в конце XVIII века, но признание его труды получили только в 1808 году. Джон Дальтон примерно в это же время ввел представление об атомах и массах этих частиц, кратных соотношениях.
Биография Ж. Л. Пруста
Ученый, предложивший закон постоянства состава, появился на свет 26 сентября 1754 года на западе Франции. Отец Жозефа Луи был аптекарем в городе Анже. Он и приобщил сына к опытам с химическими веществами. Юноша продолжил обучение в Париже, где познакомился с Лавуазье и его научными идеями. В 1776 году Пруст опубликовал свои первые серьезные труды в области химии. С 1799 по 1806 год ученый руководил лабораторией в Мадриде. Во Францию Пруст вернулся в 1806 году. После краткого пребывания в Париже Жозеф Луи отправился в родные места. В 1808–1816 годах получили признание его труды в области изучения состава веществ, в том числе глюкозы. В 1817-м он вышел в отставку и жил в одиночестве до конца своих дней (1826). Пруст был одним из выдающихся ученых своего времени, Рыцарем Почетного легиона, членом Королевской академии наук Неаполя.
карбоната натрия. В двух разных химических реакциях получаем соединение, формула которого NaCl. И в первом, и во втором случае вещество содержит 39,33% натрия и 60,66% хлора.
Значение открытия постоянства состава
В начале XIX века в теоретической химии утвердились законы, которые соединяют вещества, описывают их соотношения. Изучали качественные и количественные характеристики многие ученые, предложившие универсальные формулировки. Основополагающими были идеи М. В. Ломоносова о сохранении массы в химических превращениях. Установленный Ж. Л. Прустом закон постоянства состава также имеет большое значение для науки и практики. На основании этой закономерности формулу воды записывают только в виде H2O, а состав серной кислоты – H2SO4. Но закон Пруста не имеет такого всеобъемлющего характера, как учение Ломоносова. Поэтому его формулировку уточнили после открытия изотопов. Так называют атомы одного и того же элемента, имеющие разную массу. Соотношение частиц в составе образца является постоянной величиной, но только при условии неизменного изотопного состава. Например, массовый состав водорода и кислорода в обычной и тяжелой воде отличается. Вторая жидкость содержит изотоп водорода — дейтерий. Масса тяжелой воды больше, чем обычной.
Установленный Ж. Л. Прустом закон постоянства состава также имеет большое значение для науки и практики. На основании этой закономерности формулу воды записывают только в виде H2O, а состав серной кислоты – H2SO4. Но закон Пруста не имеет такого всеобъемлющего характера, как учение Ломоносова. Поэтому его формулировку уточнили после открытия изотопов. Так называют атомы одного и того же элемента, имеющие разную массу. Соотношение частиц в составе образца является постоянной величиной, но только при условии неизменного изотопного состава. Например, массовый состав водорода и кислорода в обычной и тяжелой воде отличается. Вторая жидкость содержит изотоп водорода — дейтерий. Масса тяжелой воды больше, чем обычной.
Современные взгляды на состав вещества
В соответствии с формулировкой Пруста соотношение масс атомов, составляющих определенное вещество, носит постоянный характер, не зависит от способа получения образца. В начале XX столетия при изучении сплавов металлов были открыты соединения с переменным составом. В этом случае единице веса одного химического элемента могут соответствовать различные массы другого элемента. Например, в соединениях таллия с висмутом на единицу массы первого приходится от 1,2 до 1,8 единицы веса второго элемента. Такие примеры можно найти среди интерметаллических веществ, оксидов, соединений серы, азота, углерода, водорода с металлами. Следовательно, законы, открытые Прустом и Дальтоном, справедливы полностью только в отношении тех веществ, что имеют молекулярное строение. К ним относятся многие кислоты, оксиды, гидриды. Качественная и количественная структура подобных соединений является постоянной. Например, состав воды в атмосфере, Мировом океане, ледниках и живых организмах отражает формула H2O.
В этом случае единице веса одного химического элемента могут соответствовать различные массы другого элемента. Например, в соединениях таллия с висмутом на единицу массы первого приходится от 1,2 до 1,8 единицы веса второго элемента. Такие примеры можно найти среди интерметаллических веществ, оксидов, соединений серы, азота, углерода, водорода с металлами. Следовательно, законы, открытые Прустом и Дальтоном, справедливы полностью только в отношении тех веществ, что имеют молекулярное строение. К ним относятся многие кислоты, оксиды, гидриды. Качественная и количественная структура подобных соединений является постоянной. Например, состав воды в атмосфере, Мировом океане, ледниках и живых организмах отражает формула H2O.
Материалы по теме:
Закон постоянной пропорции Пруста
Закон постоянной композиции, открытый Йозефом Прустом, также известен как закон определенных пропорций. Он отличается от закона кратных пропорций, хотя оба они вытекают из закона сохранения массы Лавуазье. Французский химик Жозеф Пруст сформулировал этот закон следующим образом: «Химическое соединение всегда содержит одни и те же элементы, соединенные вместе в одной и той же пропорции по массе. »
Французский химик Жозеф Пруст сформулировал этот закон следующим образом: «Химическое соединение всегда содержит одни и те же элементы, соединенные вместе в одной и той же пропорции по массе. »
Джозеф Пруст
Жозеф Пруст — французский химик, наиболее известный своими аналитическими способностями.Однажды его порекомендовал на должность профессора химии в Королевской артиллерийской школе Сеговии не кто иной, как Антуан Лавуазье! Его эксперименты с неорганическими бинарными соединениями — в основном сульфатами, сульфидами и оксидами металлов — привели его к формулировке закона постоянного состава. Закон был впервые опубликован в статье об оксидах железа в 1794 году.
Жозеф Луи Пруст (1754-1826)
Закон Пруста подвергся критике со стороны уважаемого французского химика Клода-Луи Бертолле, который не согласился с тем, что химическая комбинация ограничивается определенными пропорциями насыщения.Путаница была вызвана определением химической комбинации; Бертолле классифицировал растворы как химические соединения, в то время как Пруст старался отличать их от настоящих бинарных соединений.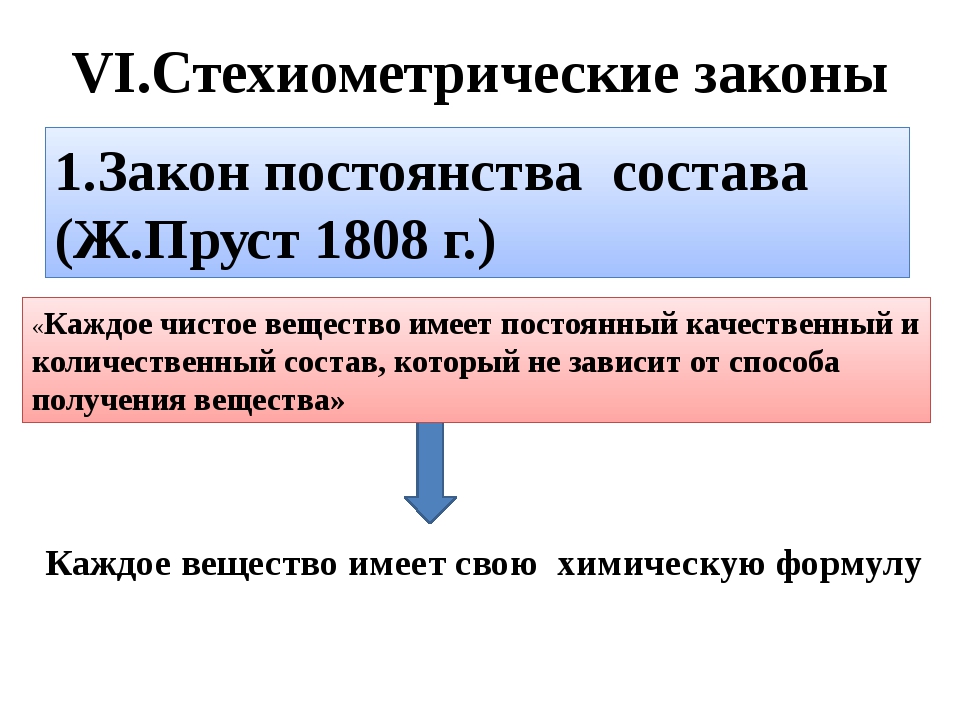 Конфликт продолжался до тех пор, пока Джон Дальтон, английский химик, не выступил с атомной теорией, которая поддерживала закон Пруста. Шведский химик Йонс Якоб Берцелиус установил связь между законом Пруста и теорией Дальтона в 1811 году.
Конфликт продолжался до тех пор, пока Джон Дальтон, английский химик, не выступил с атомной теорией, которая поддерживала закон Пруста. Шведский химик Йонс Якоб Берцелиус установил связь между законом Пруста и теорией Дальтона в 1811 году.
Например, чистая вода, полученная из различных источников, таких как река, колодец, родник, море и т. д., всегда содержит водород и кислород вместе в соотношении 1:8 по массе. Точно так же диоксид углерода (CO 2 ) можно получить различными способами, например,
.- Сжигание углерода
- Нагрев известняка
- Нанесение разбавленной HCl на кусочки мрамора
Каждый образец CO 2 содержит углерод и кислород в соотношении 3:8.
Пример \(\PageIndex{1}\): восстановление оксида меди
Когда 1,375 г оксида меди восстанавливают при нагревании в токе водорода, масса оставшейся меди равна 1.098 г. В другом эксперименте 1,179 г меди растворяют в азотной кислоте, и полученный нитрат меди превращается в оксид меди при прокаливании. Масса образовавшегося оксида меди составляет 1,476 г. Покажите, что эти результаты иллюстрируют закон постоянной пропорции.
Раствор
Первый эксперимент
- Оксид меди = 1,375 г
- Осталось меди = 1,098 г
- Наличие кислорода = 1,375 — 1,098 = 0,277 г
\[ \text{Процент кислорода в CuO} = \dfrac{(0.277)(100\%)}{1,375} = 20,15\%\]
Второй эксперимент
- Медь взята = 1,179 г
- Образовавшийся оксид меди = 1,476 г
- Наличие кислорода = 1,476 — 1,179 = 0,297 г
\[ \text{Процент кислорода в CuO} = \dfrac{(0,297)(100\%)}{1,476} = 20,12\%\]
Процент кислорода приблизительно (в пределах значащих цифр) одинаков в обоих вышеперечисленных случаях. Так иллюстрируется закон постоянного состава.
Авторы и ссылки
Закон определенных пропорций или закон Пруста ~ ChemistryGod
Закон определенных пропорций также известен как закон определенного состава или закон постоянного состава, или просто закон Пруста.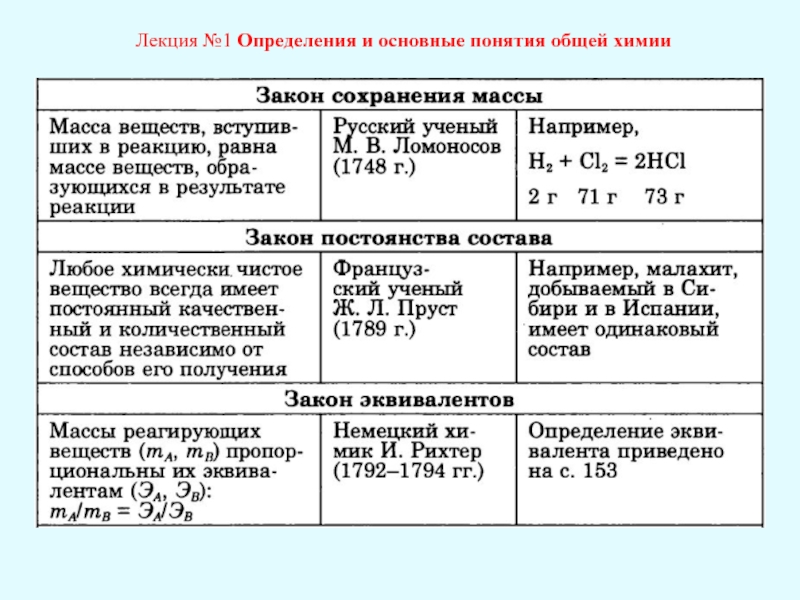 Это один из основных законов химии и часть законов химических соединений. В 1794 году французский химик Жозеф Пруст предложил этот закон. В то время знания о химических соединениях не были полностью сформированы, и ему противостояли многие известные химики того времени.Но позже оказалось, что они ошибались. Закон определенных пропорций был позже расширен Джоном Дальтоном, когда Дальтон предложил закон кратных пропорций.
Это один из основных законов химии и часть законов химических соединений. В 1794 году французский химик Жозеф Пруст предложил этот закон. В то время знания о химических соединениях не были полностью сформированы, и ему противостояли многие известные химики того времени.Но позже оказалось, что они ошибались. Закон определенных пропорций был позже расширен Джоном Дальтоном, когда Дальтон предложил закон кратных пропорций.
Заявление
Закон гласит, что данное химическое соединение всегда содержит элементы в одних и тех же пропорциях по массе.
Объяснение с примерами
Согласно закону, элементы в химическом соединении всегда имеют фиксированный состав по массе. Это верно независимо от источника или метода получения этого химического соединения.Рассмотрим молекулу воды H 2 O. Итак, вода — это химическое соединение, поскольку она состоит из более чем одного элемента. Любая молекула воды состоит из 2 атомов водорода и одного атома кислорода, причем оба элемента всегда находятся в одинаковых пропорциях по массе. Массовая доля водорода и кислорода в воде составляет 11,11 % водорода и 88,89 % кислорода. Эти проценты верны для всех молекул воды во Вселенной.
Массовая доля водорода и кислорода в воде составляет 11,11 % водорода и 88,89 % кислорода. Эти проценты верны для всех молекул воды во Вселенной.
Наблюдение Пруста
Закон определенных пропорций был крупнейшим достижением Пруста в его научной карьере. Пруст работал с двумя образцами карбоната меди CuCO 3 . Один был синтетическим, а другой естественным. Он сравнил оба образца и обнаружил, что оба имеют одинаковый состав присутствующих в нем элементов. Таким образом, из этого наблюдения он сделал вывод, что элементы в химическом соединении всегда сочетаются в одних и тех же фиксированных пропорциях, независимо от источника химического вещества.Он также изучил два оксида олова и два оксида железа, чтобы доказать этот закон.
| CU% 0 | C% | O% | Натуральный образец | 51. 35 35 | 9.74 | 38.91 |
| Синтетический образец | 51,35 | 9,74 | 38,91 |
Дополнительные примеры
Рассмотрим хорошо известный углекислый газ CO -2.Углекислый газ является конечным продуктом клеточного дыхания почти всех живых организмов на этой планете. Он также высвобождается в результате антропологической деятельности, что является причиной глобального потепления. CO 2 от клеточного дыхания и от антропологической деятельности одинаков. В каждом случае CO 2 содержит 27,27 % углерода и 72,73 % кислорода.
Рассмотрим еще один пример этилового спирта (C 2 H 6 O). 1 молекула этилового спирта содержит 2 атома углерода, 6 атомов водорода и 1 атом кислорода, а их массовые соотношения равны 52.18 %, 13,04 % и 34,78 %. Эти проценты универсальны для всех молекул этанола.
Ограничение закона Пруста
Закон определенных пропорций или закон Пруста не имеет универсальной силы. Есть некоторые исключения, которые обсуждаются ниже.
Есть некоторые исключения, которые обсуждаются ниже.
- Закон не выполняется, когда в соединении присутствует изотоп. Изотопы — это вариант элемента с одинаковым атомным номером, но разной атомной массой из-за наличия дополнительных нейтронов.Рассмотрим пример дейтерия (он же тяжелый водород). Дейтерий представляет собой изотоп водорода с атомной массой 2 а.е.м., а его оксид (оксид дейтерия, D 2 O) называется тяжелой водой. Соотношение элементов в обычной воде и тяжелой воде различно. Таким образом, закон определенных пропорций не работает.
- Нестехиометрические соединения также не подчиняются закону Пруста. В нестехиометрических соединениях соотношение элементов колеблется в определенных пределах. Классический пример — оксид железа, идеальная формула которого — FeO.Но из-за кристаллографических вакансий атомы Fe могут варьироваться от 0,83 до 0,95 на каждый атом O. Из-за этого изменения пропорции элементов (Fe, O) будут меняться, и закон Пруста снова не работает.

- Многие полимеры (например, белки, углеводы) не имеют фиксированного состава. Эти соединения также нарушают закон.
Пример
Рассмотрим два химических образца. мы не знаем, состоят ли они из одного и того же соединения или из разных. Но мы знаем, что оба образца содержат водород и кислород как свои единственные элементы.Образец 1 содержит 10 г водорода и 80 г кислорода. Образец 2 содержит 4 г водорода и 64 г кислорода. Определите, является ли соединение в обоих образцах одинаковым или нет.
Во-первых, нам нужно рассчитать массовый процент (или долю) в обоих образцах. Если проценты совпадают, это одно и то же соединение.
Для образца 1,
Для образца 2,
Как мы видим, процентное содержание отличается, значит, это разные соединения. Поскольку процентное содержание H и O совпадает с молекулой воды, в образце 1 содержится вода (H 2 O).Точно так же образец 2 содержит перекись водорода (H 2 O 2 ).
Ассоциированные статьи
Закон определенных пропорций: определение и примеры — видео и расшифровка урока
Закон определенных пропорций
Вы когда-нибудь хотели приготовить больше еды, чем требуется по рецепту? Допустим, у вас есть рецепт шоколадного торта, которым можно накормить четырех человек, но вы собираетесь на вечеринку по случаю дня рождения, на которой будет восемь гостей. Вам нужно будет удвоить рецепт, что также означает, что вам нужно будет удвоить количество яиц, сахара, муки, масла, молока и шоколада для рецепта.Количество каждого ингредиента удвоится, но пропорции останутся прежними. Мы можем подумать об этом принципе при определении Закона определенных пропорций , который гласит, что любое химическое соединение всегда будет содержать фиксированное соотношение элементов по массе.
Французский ученый по имени Жозеф Пруст проводил эксперименты, подтверждающие этот закон, с конца 1700-х до начала 1800-х годов. Закон определенных пропорций также иногда называют законом Пруста.
Примеры закона определенных пропорций
Возьмем, например, соединение воду.Каким бы ни был источник воды, ее состав состоит из двух атомов водорода и одного атома кислорода.
На этом рисунке показано, что вода из любого источника всегда состоит из двух атомов водорода и одного атома кислорода. Если мы посчитаем молекулярную массу воды, то получим 18 г/моль. В 1 моле воды содержится 2 грамма водорода и 16 грамм кислорода. По весу у нас есть процентное содержание 11% водорода и 89% кислорода в одном моле воды.Это соответствует соотношению водорода к кислороду в воде 1:8.
Закон определенных пропорций показывает, что независимо от количества воды, будь то 2 моля или 54 грамма, отношение количества водорода к кислороду по весу всегда будет таким же, как яйцо:сахар: соотношение масла в шоколадном торте должно быть всегда , чтобы сохранить постоянный вкус.
На этот раз давайте посмотрим на другое соединение, состоящее из трех атомов, такое как этиловый спирт, который состоит из 2 атомов углерода, 6 атомов водорода и одного атома кислорода.
По рисунку мы можем рассчитать процентное содержание каждого элемента в этиловом спирте по весу, и у нас получается 52% углерода, 13% водорода и 35% кислорода по весу. Согласно закону определенных пропорций, процентное содержание углерода, водорода и кислорода по весу в этиловом спирте всегда будет одинаковым, независимо от количества.
закон Пруста
закон пруста — ˈprüsts существительное Употребление: обычно пишется с большой буквы P Этимология: по J.Л. Пруст: закон определенных пропорций … Полезный словарь английского языка
Пруст, Жозеф-Луи — ▪ Французский химик Введение, также известный как Луи Пруст, родился 26 сентября 1754 г., Анже, Франция умер 5 июля 1826 г., Анже Французский химик, доказавший, что относительные количества любого данного чистого химического соединения составные элементы остаются… … Universalium
Закон определенных пропорций — В химии закон определенных пропорций, иногда называемый законом Пруста, гласит, что химическое соединение всегда содержит точно такое же соотношение элементов по массе. Эквивалентным утверждением является закон постоянной композиции, который… … Wikipedia
Эквивалентным утверждением является закон постоянной композиции, который… … Wikipedia
Пруст , Жозеф Луи — (1754–1826) французский химик Пруст родился в семье аптекаря в Анже на северо-западе Франции. Он учился в Париже и стал главным аптекарем в больнице Сальпетриер. В 1789 году он отправился в Мадрид, чтобы стать директором Королевской лаборатории… … Ученые
Пруст, Жозеф-Луи — (1754 1826) химик Наиболее известный благодаря установлению химического закона определяющих пропорций, который иногда называют законом Пруста, Жозеф Луи Пруст родился в Анже.В 1784 году он сопровождал Жана-Франсуа Пилатра де Розье в подъеме на воздушном шаре.… … Франция. Справочник от Ренессанса до наших дней
закон определенных пропорций — закон определенных пропорций def (ə )nət prə pȯr shənz na утверждение в химии: каждое определенное соединение всегда содержит одни и те же элементы в одних и тех же массовых соотношениях * * * любое соединение всегда содержит одни и те же элементы в … Медицинский словарь
Пруст, Марсель — родился 10 июля 1871, Отёй, близ Парижа, Франция умер в ноябре. 18 ноября 1922 года, Париж Французский писатель. Родился в богатой семье, изучал право и литературу. Его социальные связи позволили ему стать наблюдательным завсегдатаем самого эксклюзивного рисунка… … Универсалиум
18 ноября 1922 года, Париж Французский писатель. Родился в богатой семье, изучал право и литературу. Его социальные связи позволили ему стать наблюдательным завсегдатаем самого эксклюзивного рисунка… … Универсалиум
Пруст (значения) — Имя Пруст может относиться к: * Жозефу Прусту (1754—1826), французскому химику, автору закона определенных пропорций * Антонину Прусту (1832—1905), французскому журналисту и политику * Марсель Пруст (1871 ndash;1922), французский писатель … Википедия
Пруст, Марсель — (1871 1922) писатель Марсель Пруст, автор многотомного романа À la recherche du temps perdu («В поисках утраченного времени», также известного как «Воспоминания о прошлом»; 1913 22), романа, одно из лучших достижений в мире… … Франция.Справочник от Ренессанса до наших дней
закон — 1. Принцип или правило. 2. Констатация факта, описывающая последовательность или отношение явлений, которое неизменно при данных условиях. СМОТРИТЕ ТАКЖЕ: принцип, правило, теорема. [В ВИДЕ. lagu] Александр л. утверждает, что толчкообразный нистагм усиливается, когда… … Медицинский словарь
СМОТРИТЕ ТАКЖЕ: принцип, правило, теорема. [В ВИДЕ. lagu] Александр л. утверждает, что толчкообразный нистагм усиливается, когда… … Медицинский словарь
Закон Пруста | История науки
1801 – Англия
«Общее давление смеси газов равно сумме парциальных давлений каждого из газов в смеси»
Парциальные давления газов:
Дальтон заявил, что давление смеси газов равно сумме давлений газов в смеси.При нагревании газы расширяются, и он понял, что каждый газ действует независимо от другого.
Каждый газ в смеси газов оказывает давление, равное давлению, которое он оказал бы, если бы он присутствовал в контейнере один; это давление называется парциальным давлением.
Закон парциальных давлений Дальтона способствовал развитию кинетической теории газов.
Его метеорологические наблюдения подтвердили, что причиной дождя является падение температуры, а не давления, и он открыл «точку росы» и что поведение водяного пара согласуется с поведением других газов.
Он показал, что газ может растворяться в воде или диффундировать через твердые предметы.
Различная растворимость газов
Кроме того, его эксперименты по определению растворимости газов в воде, которые неожиданно для Дальтона показали, что каждый газ отличается своей растворимостью, привели его к предположению, что, возможно, газы состоят из разных «атомов» или неделимых частиц. , каждый из которых имел разную массу.
При дальнейшем изучении своей диссертации он понял, что она не только объясняет различную растворимость газов в воде, но также объясняет «сохранение массы», наблюдаемое во время химических реакций, а также комбинации, в которые, по-видимому, входят элементы. при образовании соединений — потому что атомы просто «перестраивались», а не создавались и не разрушались.
В своих экспериментах он заметил, что чистый кислород не поглощает столько водяного пара, сколько чистый азот. Он пришел к выводу, что атомы кислорода больше и тяжелее атомов азота.
‘ Почему вода не допускает в своей массе все виды газа одинаково? …. Я почти убежден, что это обстоятельство зависит от веса и числа первичных частиц нескольких газов ’
В статье, прочитанной в Манчестерском обществе 21 октября 1803 года, Дальтон пошел дальше:
‘ Исследование относительного веса первичных частиц тел, насколько мне известно, является предметом совершенно новым; В последнее время я занимаюсь этим расследованием с замечательным успехом ’
Дальтон описал, как он пришел к разным весам для основных единиц каждого элементарного газа — другими словами, к весу их атомов или атомному весу.
Дальтон заметил, что когда элементы соединяются, образуя соединение, они всегда делают это в фиксированных пропорциях, и продолжал утверждать, что атомы каждого элемента объединяются, образуя соединения в очень простых соотношениях, и поэтому вес каждого атома можно переработать из-за веса каждого элемента, входящего в соединение — идея закона множественных пропорций.

Когда кислород и водород объединялись для получения воды, на каждый 1 грамм водорода использовалось 8 граммов кислорода.Если бы кислород состоял из большого количества одинаковых атомов кислорода и водорода из большого количества атомов водорода, все одинаковые, а при образовании воды из кислорода и водорода два типа атомов сталкивались бы и слипались, образуя большое количество частиц воды (молекул) — затем, поскольку вода имеет такую же отличительную идентичность, как водород или кислород, из этого следует, что все молекулы воды идентичны, состоят из фиксированного числа атомов кислорода и фиксированного числа атомов водорода.
Дальтон понял, что водород — самый легкий газ, и поэтому присвоил ему атомный вес 1.Из-за веса кислорода, который соединяется с водородом в воде, он сначала присвоил кислороду атомный вес 8,
. В методе Дальтона был основной изъян, потому что он не осознавал, что атомы одного и того же элемента могут соединяться. Он предположил, что соединение атомов, молекула, имеет только один атом каждого элемента. Только когда итальянский ученый АМАДЕО АВОГАДРО представил идею использования молекулярных пропорций , он смог правильно рассчитать атомный вес.
Только когда итальянский ученый АМАДЕО АВОГАДРО представил идею использования молекулярных пропорций , он смог правильно рассчитать атомный вес.
В своей книге 1808 года «Новая система химической философии» он резюмировал свои убеждения, основанные на ключевых принципах: атомы одного и того же элемента идентичны; разные элементы имеют разные атомы; атомы не создаются и не разрушаются; все состоит из атомов; химическое изменение — это просто перетасовка атомов; а соединения состоят из атомов соответствующих элементов. Он опубликовал таблицу известных атомов и их веса (хотя некоторые из них были немного неверными), основанную на водороде, имеющем массу, равную единице.
Тем не менее, основная идея атомной теории Дальтона — что у каждого элемента есть атомы уникального размера — оказалась абсолютно правильной.
Если бы все атомы кислорода имели определенный вес, уникальный для кислорода, а атомы водорода все имели бы определенный вес, уникальный для водорода, то фиксированное число атомов кислорода и фиксированное число атомов водорода объединялись бы для образования фиксированного веса воды. молекулы. Поэтому каждая молекула воды должна содержать одинаковую массу атомов кислорода по отношению к атомам водорода.
молекулы. Поэтому каждая молекула воды должна содержать одинаковую массу атомов кислорода по отношению к атомам водорода.
Вот причина «закона фиксированных пропорций». Неважно, сколько воды задействовано — всегда действуют одни и те же факторы — атомы кислорода в одной молекуле воды весят в 8 раз больше, чем атомы водорода.
Дальтон ошибочно предположил, что элементы будут соединяться в соотношении один к одному в качестве базового принципа, превращаясь только в «множественные пропорции» (например, из монооксида углерода, CO, в диоксид углерода, CO 2 ) при определенных условиях. Каждая молекула воды (H 2 O) на самом деле содержит два атома водорода и один атом кислорода.Атом кислорода на самом деле в 16 раз тяжелее атома водорода. Это не влияет на рассуждения Дальтона.
Закон фиксированных пропорций выполняется, потому что соединение состоит из большого количества идентичных молекул, каждая из которых состоит из фиксированного числа атомов каждого составного элемента.
Несмотря на то, что споры о справедливости тезиса Дальтона продолжались десятилетиями, фундамент для изучения современной атомной теории был заложен и с постоянным уточнением постепенно принимался.
A_New_System_of_Chemical_Philosophy
ВРЕМЕННАЯ ЛИНИЯ
АТОМ
Связанные статьи
<< вверху страницы
(PDF) Понимание Закона о желании Marcel Prust of Desire
Понимание Прута Пруста Марселя
из
Desire
47
Начальная инверсия
Начальная инверсия
Bourgeois против Aristocracy
в
Заказать
напряженность между социальные классы
его тирне.Хотя рассказчик
часто посещает местную знать, он по-прежнему сохраняет свой буржуазный статус.
До их встречи
в
салоне рассказчик уже заметил
различные детали
из
обыденность Маркиза сквозь вуайеристский взгляд. Из
наблюдательного пункта
из
из окна
из
собственной квартиры он увидел
маркиза, выходящего из резиденции Германтов. Во время салона
Во время салона
рассказчик представляет себя
маркизу
в очень неловкой
манере, но очевидного контакта не происходит. Тем не менее, рассказчик знает, что его видели; таким образом, взгляд переворачивается. Затем маркиз уходит в отставку,
, и рассказчик начинает подробный рассказ, который приведет к удивительному открытию:
trouve
à
l’être las et souriant que
j’ai
devant moi.On dirait que
c’est
une femme! J’avais compris, c’en était une!
C’en
était une.
4
Хотя рассказчик
Narnes, что он видит, эти впечатления создают
подозрений
в
Reader’s
разум относительно сексуальной ориентации и пола
из
маркиз, особенно с учетом употребления
из
неопределенного артикля женского рода
«пе.На самом деле формулируя описание, рассказчик подтверждает
определение. С его точки зрения, гомосексуал — это женщина или, что еще лучше,
С его точки зрения, гомосексуал — это женщина или, что еще лучше,
извращенец, запертый в теле
мужчины, что усложняет задание
of
любой общепринятый признак пола.Здесь риторический прием
накопления
служит для объединения
постыдных черт и привычек. Начало
из
Это раздел
Этот раздел
Harkens Назад к названию
эссе
эссе:
RACE MAUDITE PUISQUE CE QUI EST LOL ELLE L’IDÉAL DE LA BEARE BEARE
ET ‘
L’Aliment
du désir est aussi l’objet de la honte et la peur du
châtiment, et
qu’elle
est obligée de vivre jusque sur les bancs
du tribunal com Christ devetus viente où
5
Через множественные бинарные оппозиции этот отрывок изображает существование гомосексуалиста как полную ложь. Его желания не соответствуют принятым социальным нормам. Следовательно, гомосексуал
вынужден жить на границах
, подчеркивая идею Батлера
из
зон
из
существования.
В
этом случае
нечестивец занимает скамью в ожидании суда
Христа.
Кроме того, Пруст заменяет обычные родовые местоимения
нейтральным «оно», тем самым ссылаясь на расу или коллективное «оно».
До
далее.
усложняют дела,
в
Французском языке местоимение «elle» заменяет
la race.
Таким образом,
на
многочисленных уровнях, язык заставляет линии
из
пола быть размытыми.
Почему важен закон определенных пропорций Пруста?
Почему важен закон определенных пропорций Пруста?
Пруст показал, что карбонат меди (меди II) всегда имел 5.3 части меди на 1 часть углерода на 4 части кислорода. Эти эксперименты привели к Закону Определенной Пропорции, который позволяет нам с уверенностью знать, что любое химическое соединение всегда состоит из одного и того же соотношения элементов .
Почему важен закон кратных пропорций?
Тщательное изучение действительных числовых значений этих пропорций привело Дальтона к предложению его закона кратных пропорций. Это был важный шаг к атомной теории, которую он предложил позднее в том же году, и она заложила основу для химических формул соединений.
О чем говорит нам закон определенных пропорций?
Закон определенных пропорций, утверждение, что каждое химическое соединение содержит фиксированные и постоянные пропорции (по массе) составляющих его элементов .
Кто предложил закон определенных пропорций?
химик Джозеф Пруст
Французский химик Жозеф Пруст предложил закон определенного состава или пропорций, основанный на его опытах, проведенных между 1798 и 1804 годами по элементному составу воды и карбоната меди. В 1806 году Пруст обобщил свои наблюдения в том, что сейчас называется законом Пруста.
В 1806 году Пруст обобщил свои наблюдения в том, что сейчас называется законом Пруста.
Что такое закон кратных пропорций легкое определение?
Закон кратных пропорций, утверждение, что когда два элемента соединяются друг с другом, образуя более одного соединения, веса одного элемента, которые соединяются с фиксированным весом другого, находятся в отношении небольших целых чисел .
Что такое закон кратных пропорций на примере?
Закон кратной пропорции гласит, что когда два элемента объединяются, образуя более одного соединения , масса одного элемента, которая соединяется с фиксированной массой другого элемента, всегда будет отношением целых чисел.
