Валентность хрома (Cr), формулы и примеры
Общие сведения о валентности хрома
Хром в виде простого вещества – серовато-белый блестящий металл. Имеет структуру объемно-центрированной кубической решетки.Плотность – 7,2 г/см3. Температуры плавления и кипения равны 1890oС и 2680oС, соответственно.
Валентность хрома в соединениях
Хром находится в четвертом периоде в VIB группе Периодической таблицы Д.И. Менделеева. Порядковый номер равен 24. В ядре атома хрома содержится 24 протона и 28 нейтронов (массовое число равно 52). В атоме хрома есть четыре энергетических уровня, на которых находятся 24 электрона (рис. 1).

Рис. 1. Строения атома хрома.
Электронная формула атома хрома в основном состоянии имеет следующий вид:
1s22s22p63s23p63d54s1.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Наличие шести неспаренных электронов свидетельствует о том, что хром в своих соединениях может проявлять валентность IV (CrVIO3, CrVICl6, CrIVO2Cl6, K2CrVI2O7 и т.д.).
Известно, что для хрома также характерны валентности II (CrIIO, CrII(OH)2, CrIICl2) и III(CrIII2O3, CrIII(OH)3, KCrIIIO2, CrIIICl3).
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Соединения хрома
Оксид хрома(II) и гидроксид хрома(II) имеют основной характер
Cr(OH)+2HCl→CrCl+2HO
Соединение хрома(II)-сильные восстановители; переходят в соединение хрома(III) под действием кислорода воздуха.
2CrCl+ 2HCl → 2CrCl+ H
4Cr(OH)+O+ 2HO→4Cr(OH)
Оксид хрома(III) CrO- зеленый, нерастворимый в воде порошок. Может быть получен при прокаливании гидроксида хрома(III) или дихроматов калия и аммония:
2Cr(OH)-→CrO+ 3HO
4KCrO-→ 2CrO + 4KCrO + 3O
(NH)CrO-→ CrO+ N+ HO
С концентрированными растворами кислот и щелочей взаимодействует с трудом:
Сr2О3 + 6 КОН + 3Н2О = 2К3[Сr(ОН)6]
Сr2О3 + 6НСl = 2СrСl3 + 3Н2О
Гидроксид хрома (III) Сr(ОН)3 получают при действии щелочей на на растворы солей хрома (III):
СrСl3 +3КОН = Сr(ОН)3↓ + 3КСl
Гидроксид хрома (III) представляет собой осадок серо – зеленого цвета, при получении которого, щелочь надо брать в недостатке. Полученный таким образом гидроксид хрома (III), в отличие от соответствующего оксида легко взаимодействует с кислотами и щелочами, т.е. проявляет амфотерные свойства:
Сr(ОН)3 + 3НNО3 = Сr(NО3)3 + 3Н2О
Сr(ОН)3 + 3КОН = К 3[Сr(ОН)6](гексагидроксохромит К)
При сплавлении Сr(ОН)3 со щелочами получаются метахромиты и ортохромиты:
Cr(OH)3 + KOH = KCrO2(метахромит К) + 2H2O
Cr(OH)3 + KOH = K3CrO3(ортохромит К)+ 3H2O
Соединения хрома(VI).
Оксид хрома (VI) — СrО3 – темно – красное кристаллическое вещество, хорошо растворимо в воде – типичный кислотный оксид. Этому оксиду соответствует две кислоты:
СrО3 + Н2О = Н2СrО4 (хромовая кислота – образуется при избытке воды)
СrО3 + Н2О =Н2Сr2О7 (дихромовая кислота – образуется при большой концентрации оксида хрома (3)).
Оксид хрома (6) – очень сильный окислитель, поэтому энергично взаимодействует с органическими веществами:
Окисляет также иод, серу, фосфор, уголь:
При нагревании до 2500С оксид хрома (6) разлагается:
Оксид хрома (6) можно получить при действии концентрированной серной кислоты на твердые хроматы и дихроматы:
Хромовая и дихромовая кислоты.
Хромовая и дихромовая кислоты существуют только в водных растворах, образуют устойчивые соли, соответственно хроматы и дихроматы. Хроматы и их растворы имеют желтую окраску, дихроматы – оранжевую.
Хромат — ионы СrО42- и дихромат – ионы Сr2О72- легко переходят друг в друга при изменении среды растворов
В кислой среде раствора хроматы переходят в дихроматы:
В щелочной среде дихроматы переходят в хроматы:
При разбавлении дихромовая кислота переходит в хромовую кислоту:
Зависимость свойств соединений хрома от степени окисления.
|
Степень окисления |
+2 |
+3 |
+6 |
|
Оксид |
СrО |
Сr2О3 |
СrО3 |
|
Характер оксида |
основной |
амфотерный |
кислотный |
|
Гидроксид |
Сr(ОН)2 |
Сr(ОН)3 – Н3СrО3 |
Н2СrО4 Н2Сr2О7 |
|
Характер гидроксида |
основной |
амфотерный |
кислотный |
|
→ ослабление основных свойств и усиление кислотных→ | |||
Окислительно – восстановительные свойства соединений хрома.
Реакции в кислотной среде.
В кислотной среде соединения Сr+6 переходят в соединения Сr+3 под действием восстановителей: H2S, SO2, FeSO4
Реакции в щелочной среде.
В щелочной среде соединения хрома Сr+3 переходят в соединения Сr+6 под действием окислителей: J2, Br2, Cl2, Ag2O, KClO3, h3O2, KMnO4:
studfiles.net
Какая степень окисления у хрома?
Хром может существовать в виде простого вещества – металла, а степень окисления металлов в элементарном состоянии равна нулю, так как распределение электронной плотности в них равномерно.Степени окисления (+2) и (+3) хром проявляет в оксидах (, ), гидроксидах (, ), галогенидах (, ), сульфатах (, ) и др. соединениях.
Для хрома также характерна степень окисления (+6): , , (ответ на вопрос «какая степень окисления у хрома»).
Для того, чтобы найти определить степень окисления серы в составе предложенных соединений воспользуемся алгоритмом, предполагающим составление уравнение электронейтральности.
Итак, в состав хромата калия входят атомы калия, хрома и кислорода. Кислород, во всех веществах, кроме пероксидов и фторида кислорода проявляет степень окисления равную (-2). Калий имет постоянную степень окисления (+1). Для того, чтобы определить степень окисления хрома, примем её значение за «x». Тогда, уравнение электронейтральности примет следующим образом:
Аналогичным образом выясним степень окисления хрома в оставшихся соединениях: , , , .
ru.solverbook.com
Соединения хрома в степени окисления
Атомы металлических элементов в отличие от неметаллических обладают значительно большими размерами атомных радиусов. Поэтому атомы металлических элементов сравнительно легко отдают валентные электроны. Вследствие этого они обладают способностью образовывать положительно заряженные ионы, а в соединениях проявляют только положительную степень окисления. Многие металлические элементы, например медь Си, железо Ре, хром Сг, титан Т1, проявляют в соединениях разную степень окисления. [c.94]Если амфотерный элемент имеет в соединениях несколько степеней окисления, то амфотерные свойства наиболее ярко проявляются для промежуточной степени окисления. Например, у хрома известны три степени окисления-( +II), ( + 111) и ( + У1). Для Сг » кислотные и основные свойства выражены в равной степени, тогда как у Сг» наблюдается преобладание основных свойств, а у Сг преобладание кислотных свойств [c.99]
Соединения хрома. В соединениях с кислородом хром проявляет ( степени окисления +6, -f 3 и +2. Из них наиболее устойчивы в обыч-1 ных условиях соединения со степенью окисления, равной трем. В этой же степени окисления хром входит большей частью и в природные соединения (хромистый железняк). Соединения хрома низшей сте- пени окисления (+2) легко окисляются, а соединения высшей степе- ни окисления (+6) все являются окислителями. [c.142]
Соединения Сг (Ш). У хрома степень окисления +3 является наиболее устойчивой. Координационное число хрома (П1) равно шести, [c.607]
Окисление железа (И) в железо (III) может быть осуществлено в щелочной среде большинством окислителей и кислородом воздуха, а в кислой среде — азотной и хлорной кислотами и кислородом воздуха. Ионы марганца окисляются различными окислителями, образуя окрашенные анионы различных степеней окисления марганца. Восстановители в кислой среде восстанавливают соединения марганца, хрома, железа и висмута из их высших степеней окисления до соединений низших степеней окисления, Bi -ионы могут восстанавливаться до металлического состояния.
Характерная степень окисления +6. Наряду с этим хром дает устойчивые соединения со степенью окисления +3, молибден — иногда +4. В других степенях окисления (+1, +2, +4, +5) хром и его аналоги образуют неустойчивые соединения. Некоторые свойства элементов приведены в табл. 22.1. [c.376]
В противоположность хрому, шестивалентные Мо и даже в кислой среде могут быть восстановлены только сильными восстановителями. В частности, при действии водоро/ а в момент выделения последовательно образуются различно окрашенные соединення низших степеней окисления. [c.373]
Соединения железа, хрома, висмута низших степеней окисления способны окисляться, а соединения высших степеней окисления—восстанавливаться. [c.36]
Степени окисления тех элементов побочных подгрупп, соединения которых наиболее часто применяются в химической практике, слестепени окисления +6 и +3), марганец (+7, +6, +-4, +2) железо (+3, +2), кобальт, никель (+2, гораздо реже +3), медь (+2, +1), цинк (+2), [c.7]
Элементы подгруппы хрома в своих соединениях проявляют степени окисления от — -2 до +6. Сверху вниз в подгруппе устойчивость соединений с более высокими степенями окисления металлов увеличивается. [c.316]
Элементы подгруппы хрома проявляют также степени окисления +5, +4, -+-3, 4-2. Но наиболее типичны соединения высшей степени окисления, которые во многом весьма похожи на соответствующие соединения серы. С водородом элементы подгруппы хрома соединений не образуют. [c.195]
Элементы подгруппы хрома проявляют также степени окисления 4-5, +4, — -3, -1-2, Но наиболее типичны соединения высшей степени окисления, которые во многом [c.253]
Отсюда видно, что хром может проявлять в соединениях различные степени окисления — от +1 до +6 из них наиболее устойчивы соединения хрома со степенями окислениями +2, +3, +6. Таким образом, в образовании химических связей участвует не только электрон внешнего уровня, но и пять электронов -подуровня второго снаружи уровня. [c.254]
Наиболее устойчивыми являются соединения со степенью окисления хрома -З. Соединения же хрома (И) являются сильными восстановителями и легко окис/яют-ся, при этом Сг+ превращается в Сг+ Сг+ —1ё=Сг . Например, гидроксид хрома (И) легко окисляется кислородом воздуха до гидроксида хрома И1) [c.320]
Исследования, проведенные в нашей стране, позволили впервые в мировой практике предложить способ биохимической очистки соединений шестивалентного хрома (хроматов и бихроматов), а также хлоратов и перхлоратов. Метод основан на способности специально выведенных микроорганизмов использовать соединения хрома при окислении органических веществ, содержащихся в сточных водах. При этом в нейтральной или слабощелочной среде происходит восстановление ионов шестивалентного хрома до трехвалентного, который осаждается в виде гидроокиси, а хлораты и перхлораты восстанавливаются до практически безвредных хлоридов. Степень очистки достигает 99,4%, остаточное содержание хрома в стоках не превышает 0,4 мг/л. Технологическая схема включает усреднение производст- [c.57]
Действие окислителей и восстановителей. Сильные окислители окисляют трехвалентный хром и двухвалентные Ре++, N1++, Со и Мп++ до соединений высшей степени окисления. Так, окисление трехвалентного хрома в хромат осуществляется в щелочной среде хлором, бромом, перекисями, гипохлоритами, двуокисью свинца и марганца. [c.184]
Интересно отметить, что хром в металлическом состоянии имеет металлическую валентность 6, соответствующую степени окисления + 6, характерной для хроматов и бихроматов, а не более низкой степени окисления -ЬЗ, характерной для солей хрома металлы марганец,, железо, кобальт и никель тоже имеют металлическую валентность 6, хотя почти все эти элементы образуют соединения со степенями окисления + 2 и -ЬЗ. Ценные физические свойства переходных металлов обусловлены высокой металлической валентностью этих элементов. [c.494]
Соединения молибдена и хрома в степени окисления +6 в отличие от соединений хрома в той же степени окисления являются очень слабыми окислителями и могут быть восстановлены сил
www.chem21.info
§1. Степени окисления, электронные конфигурации, координационные числа и геометрия соединений хрома.
Следуя общим тенденциям заполнения d-подуровня при движении по периоду для элементов VI группы нужно было бы предположить конфигурацию валентных электронов в основном состоянии (n-1)d4ns2. В атоме хрома выигрыш энергии, вызванный стабилизацией наполовину заполненного подуровня и полным отсутствием дестабилизирующего вклада энергии спаривания, оказывается больше энергии, которую необходимо затратить на переход одного из s-электронов на d-подуровень. Это приводит к «перескоку» («провалу») электрона, т.к. известно, что электроны с параллельными спинами испытывают меньшее взаимное отталкивание, чем электроны с противоположными спинами, разность энергий у хрома достигает своего максимума – 3d54s1 (3d44s2). 1
В различных соединениях хром проявляет степени окисления от -4 до +6.
|
Степень окисления |
Электронная конфигурация |
Координационное число |
Геометрия |
Примеры соединений |
|
-4 |
d10 |
4 |
Тетраэдр |
Na4[Cr(CO)4] |
|
-2 |
d8 |
5 |
Тригональная бипирамида |
Na2[Cr(CO)5] |
|
-1 |
d7 |
6 |
Октаэдр |
Na2[Cr2(CO)10] |
|
0 |
d6 |
6 |
Октаэдр |
Cr(CO)6, [Cr(CO)5I]— |
|
+1 |
d5 |
6 |
Октаэдр |
K3[Cr(CN)5NO], [Cr({C5H4N}2)3]+ или [Cr(dipy)3]+ |
|
+2 |
d4 |
4 |
Плоский квадрат Октаэдр |
Cr(CH3COCHCOCH3)2 или Cr(acac)22 K4[Cr(CN)6], CrF2 |
|
+3 |
d3 |
4 6 |
Тетраэдр Октаэдр |
[CrCl4]— [Cr(NH3)6]3+ |
|
+4 |
d2 |
6 |
Октаэдр |
K2[CrF6] |
|
+5 |
d1 |
6 |
Октаэдр |
K2[CrOCl5] |
|
+6 |
d0 |
4 |
Тетраэдр Октаэдр |
CrO42- CrF6 |
§2. Хром (II).
Известно много соединений хрома (II), все они сильные и быстродействующие восстановители. Водные растворы, содержащие ион Cr2+, имеют небесно-голубой цвет. Этот ион очень легко окисляется
Cr3+ + ē → Cr2+ ( Е°= -0,41 В).
Легко окисляются кислородом воздуха:
4[Cr(H2O)6]2++O2+4H+=4[Cr(H2O)6]3++2H2O.
Будет восстанавливать воду с выделением водорода, причем скорость разложения зависит от кислотности раствора.
Высокоспиновые3 октаэдрические комплексы характеризуются большим магнитным моментом (4,7 – 4,9 μВ4). Это свидетельствует о тетрагональном искажении, которое является следствием эффекта Яна-Теллера5 и вызвано наличием одного электрона на eg –орбитали, что приводит к геометрическому искажению и понижению симметрии d4 –комплексов: два аксиальных лиганда находятся на большем расстоянии от атома Cr(II), чем четыре экваториальных. Такая структура обусловливает склонность высокоспиновых комплексов к гидролизу. Помимо аквакомплексов ([Cr(H2O)4(OH)2; [Cr(H2O)6]2+) к высокоспиновым относятся ацетилацетонат (Cr(acac)2) , а также аммиакаты ([Cr(NH3)5Cl]Cl, [Cr(NH3)6]Cl2).
Низкоспиновые6 комплексы хром (II) образует с лигандами сильного поля, например с цианидом K4[Cr(CN)6]. Эти комплексы интенсивно окрашены, их магнитный момент составляет 2,74-3,40 μВ, а связь Cr-L характеризуется существенной долей π-связывания.
Так же для хрома(II) известны и кластерные соединения, простейшее из них – ацетат хрома (II) Cr2(CH3COO)4(H2O)2, выпадающий красный осадок при действии на CrII ацетатов, либо уксусной кислоты:
2CrCl2+4NaCH3COO+2H2O=[Cr2(H2O)2(CH3COO)4]↓+4NaCl
На наличие связи Cr-Cr указывает диамагнетизм этого соединения: в нем нет неспаренных электронов. Поскольку каждый ион Cr2+ содержит четыре неспаренных электрона, связь имеет кратность 4. Именно поэтому расстояние Cr-Cr в ацетате (0,230 нм) оказывается короче, чем в металлическом хроме (0,256 нм). Атомы хрома соединены друг с другом также четырьмя бидентатными мостиковыми ацетатными группами. Координационную сферу каждого атома хрома дополняет молекула воды.
П
 о
методу валентных связей (ВС) четырехкратная
связьCr-Cr
образуется в результате объединения
неспаренных 3d
– электронов двух ионов хрома в четыре
электронные пары, принадлежащие совместно
обоим атомам. Вакантые орбитали ионов
Cr2+
выступают в качестве акцепторов для
образования пяти ковалентных связей с
ацетатными группами и молекулами воды.
В образующейся частице все электроны
спарены, т.е. она является диамагнитной
(см. рис
1 (б)).
При нагревании в вакууме до 120°С ацетат
хрома теряет воду, превращаясь в
коричневый порошок, в котором кластеры
Cr2(CH3COO)4
связаны между собой дополнительным
взаимодействием атомов хрома с атомами
кислорода соседних ацетатных групп
(см. рис
1 (в)).
Образование связи Cr-Cr
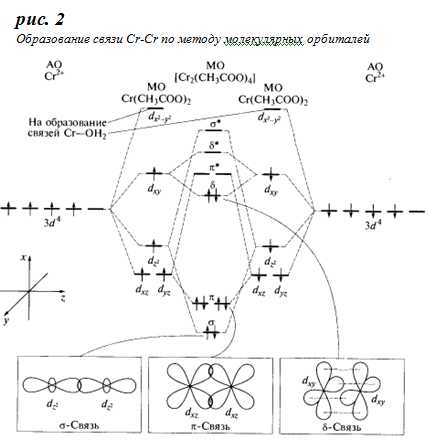
по методу молекулярных орбиталей (МО)
представлено на рис.
2.
Для простоты рассмотрено взаимодействие
двух фрагментов молекулы состава
Cr(CH3COO)2,
каждый из которых имеет форму плоского
квадрата, что видно из расщепления
исходных d—орбиталей
хрома. Из пяти d-орбиталей
каждого фрагмента четыре идут на
образование связи Cr-Cr,
а одна — на образование σ-связи с молекулой
воды. Из восьми d-орбиталей,
предоставленных в общее пользование
двумя атомами хрома, образуются восемь
молекулярных орбиталей (МО) – две из
них σ-типа, четыре – π-типа и две δ-типа.
Электронами заполнены четыре связывающие
МО, что обусловливает образование
четырехкратной связи Cr-Cr.
о
методу валентных связей (ВС) четырехкратная
связьCr-Cr
образуется в результате объединения
неспаренных 3d
– электронов двух ионов хрома в четыре
электронные пары, принадлежащие совместно
обоим атомам. Вакантые орбитали ионов
Cr2+
выступают в качестве акцепторов для
образования пяти ковалентных связей с
ацетатными группами и молекулами воды.
В образующейся частице все электроны
спарены, т.е. она является диамагнитной
(см. рис
1 (б)).
При нагревании в вакууме до 120°С ацетат
хрома теряет воду, превращаясь в
коричневый порошок, в котором кластеры
Cr2(CH3COO)4
связаны между собой дополнительным
взаимодействием атомов хрома с атомами
кислорода соседних ацетатных групп
(см. рис
1 (в)).
Образование связи Cr-Cr
по методу молекулярных орбиталей (МО)
представлено на рис.
2.
Для простоты рассмотрено взаимодействие
двух фрагментов молекулы состава
Cr(CH3COO)2,
каждый из которых имеет форму плоского
квадрата, что видно из расщепления
исходных d—орбиталей
хрома. Из пяти d-орбиталей
каждого фрагмента четыре идут на
образование связи Cr-Cr,
а одна — на образование σ-связи с молекулой
воды. Из восьми d-орбиталей,
предоставленных в общее пользование
двумя атомами хрома, образуются восемь
молекулярных орбиталей (МО) – две из
них σ-типа, четыре – π-типа и две δ-типа.
Электронами заполнены четыре связывающие
МО, что обусловливает образование
четырехкратной связи Cr-Cr.
Благодаря кластерному строению ацетат хрома (II) гораздо более устойчив к окислению, чем простые соли хрома (II). В качестве исходного вещества его используют для синтеза других соединений CrII.
studfiles.net
ХРОМА СЕМЕЙСТВО — это… Что такое ХРОМА СЕМЕЙСТВО?
- ХРОМА СЕМЕЙСТВО
ПОДГРУППА VIB. СЕМЕЙСТВО ХРОМА
ХРОМ, МОЛИБДЕН, ВОЛЬФРАМ
Все три элемента VIB подгруппы хром Cr, молибден Mo, вольфрам W играют большую роль в промышленности, особенно в металлургии и электротехнике. Каждый из этих элементов занимает среднее положение в своем ряду переходных металлов. Элементы имеют, как и следовало ожидать, высокие температуры плавления и кипения; наличие вакантных мест на электронных орбиталях допускает обобществление электронов при образовании связей. Два из трех элементов хром и молибден обладают нетипичной электронной структурой (табл. 13), имея на внешней s-орбитали один электрон (как у Nb из подгруппы VB). Поскольку у этих элементов на внешних d- и s-орбиталях находится всего 6 электронов, все орбитали заполнены наполовину, т.е. по 1 электрону на каждой. При такой электронной конфигурации элемент обладает необычной стабильностью и устойчивостью к окислению. У вольфрама обычное электронное строение, поэтому между молибденом и вольфрамом больше различий в химических свойствах, чем между прами тяжелых элементов в предыдущих семействах (например, Zr и Hf, Nb и Ta). У вольфрама более сильная металлическая связь, чем у молибдена. Все рассматриваемые металлы покрываются пассивирующей оксидной пленкой при хранении на воздухе или в среде кислоты-окислителя. При удалении этой пленки химическим или механическим способом химическая активность металлов существенно возрастает (см. электродные потенциалы в табл. 13). Доказательством этого является выделение водорода при обработке хрома хлороводородной кислотой или даже паром.
Степени окисления. У этих элементов обнаруживается интересное различие в степенях окисления. В соответствующих условиях все элементы способны проявлять положительные степени окисления от II до VI, хотя не все эти степени окисления одинаково стабильны. Максимальная степень окисления VI соответствует номеру группы. У хрома наиболее стабильной является степень окисления III, и только очень сильные окислители окисляют Cr(III) в Cr(VI). В то же время даже слабые окислители окисляют Mo(III) до степеней окисления IV и VI. Голубой ион Cr(II) образуется в растворе при энергичном восстановлении Cr(III), но получить Mo(II) и W(II) довольно трудно. Образующийся W(II) легче окисляется, чем Mo(II). Интересно сопоставить состояние в степени окисления III и стабильность для всех первых членов семейств переходных металлов 22Ti3+, 23V3+, 24Cr3+, 25Mn3+, 26Fe3+, 27Co3+. Ti(III) и V(III) легко окисляются до M(IV) и поэтому являются восстановителями, тогда как Fe(III) и Co(III) легко переходят в M(II) и поэтому проявляют окислительные свойства. И железо(III), и кобальт(III) легко превращают Iв I2, а Co(III) даже выделяет кислород из воды. Ион Cr(III) очень стабилен и не является ни окислителем, ни восстановителем, а Mn(III) может быть окислителем или восстановителем, что подтверждается его способностью и окисляться, и восстанавливаться, образуя Mn(II) и Mn(IV) (реакция автоокисления).
Хром. Спрос на чистый хром невелик. В металлургическом процессе выделения хрома часто используют процесс образования сплава с железом под названием феррохром, который можно непосредственно добавлять в сталь. Для этого хромитную руду Fe(CrO2)2 восстанавливают углем:
Fe(CrO2)2 + 4C -> (Fe + 2Cr) + 4CO Чистый хром получают восстановлением Cr2O3 алюминием или электролизом раствора, содержащего комплексные ионы (например, цианидные) хрома. При выделении хрома электролизом образуется очень твердое и прочное хромовое покрытие, которое используется для получения декоративных и защитных пленок на подготовленных стальных поверхностях. Слой толщиной всего 0,005 мм достаточно эффективен для удвоения срока службы некоторых стальных изделий. Большая часть хрома расходуется в виде феррохрома для производства стали и придания ей повышенной твердости и высокой прочности. Сталь с высоким содержанием Cr, V, W и Ni используют для изготовления брони. Инструментальные и некоторые конструкционные стали содержат много хрома. Хромоникелевые стали, содержащие ХРОМА СЕМЕЙСТВО18% Cr и 8% Ni, часто применяют в химическом аппаратостроении, для изготовления пищевой посуды и коррозионностойких емкостей. Нихромовая и хромелевая проволоки (сплавы NiCr) используются в электротехнической промышленности, сплавы CrCoW отличаются особой твердостью и используются для производства режущего инструмента.
Молибден получают из сульфидной руды MoS2. Руду подвергают обогащению, обжигу до оксида MoO3 и переводят в CaMoO4, прокаливая с CaCO3. Образующееся соединение можно использовать в производстве стали непосредственно без восстановления молибдата. Собственно металл может быть получен из MoO3 восстановлением алюминием или водородом. При прокаливании MoO3 с железом получается ферромолибден. Иногда чистый металл используют в электротехнике для изготовления нитей, трубок, электрообмотки печей и электроконтактов. Много высокомолибденистой стали расходуется на производство автомобилей. Молибден можно использовать вместо W в сплаве с железом. Сталь с добавками Cr:Ni:Mo = 16:25:6 используют для изготовления корпусов и двигателей самолетов и баллистических ракет.
Вольфрам получают из оксида, извлекаемого из предварительно обогащенной руды, содержащей до 60% WO3. Cплавление оксида с основаниями дает водорастворимый вольфрамат типа Na2WO4. При подкислении раствора выделяется осадок h3WO4, который при термической обработке разлагается до WO3. Металлический вольфрам выделяют восстановлением порошка оксида вольфрама алюминием или водородом. Для получения компактной заготовки, пригодной для механической обработки, порошок формуют при высоком давлении и специальной термической обработке с поверхностным плавлением микрочастиц, но без полного плавления вещества. Такой метод («порошковая металлургия») широко распространен в технологиях сложных небольших форм для придания редких свойств изделиям. Получаемый таким способом вольфрам идет также на изготовление нитей накаливания в электрических лампах. Большая часть получаемого вольфрама используется как добавка в стали для придания твердости, упругости, вязкости и жаропрочности. Металл применяют также для изготовления электроконтактов, нагревательных элементов печей, нитей в рентгеновских трубках, для получения высокотвердых материалов, например карбида вольфрама WC.
Реакции. Все эти металлы образуют оксид MVIO3. Оранжево-красный CrO3 образуется из элементов, но обычно его получают при подкислении раствора K2Cr2O7. Оксид сильно отличается от аналогичных оксидов металлов этой группы, он хорошо растворим, разлагается с выделением кислорода, образует многочисленные нестехиометрические оксиды (например, Cr3O8 и Cr2O5), прежде чем образуется Cr2O3. CrO3 хороший окислитель в органической химии.
Если в растворы молибдатов или вольфраматов щелочных металлов (например, Na2MoO4 или Na2WO4) добавить кислоту, то в осадок выпадают кислоты h3MoO4 и h3WO4 cоответственно. При прокаливании таких осадков получают MoO3 и WO3, которые не реагируют с водой с образованием h3MoO4 и h3WO4. В этом CrO3 тоже отличается от упомянутых оксидов, т.к. он является истинным ангидридом (кислотообразующим оксидом), давая с водой кислоты h3CrO4 и h3Cr2O7.
Образование оксидов. Для всех этих металлов известны оксиды в низших степенях окисления. Кроме упомянутых, можно получить оксид хрома(II) CrO при окислении амальгамы Cr-Hg. Оксиды MoO2 и WO2 образуются при восстановлении MoO3 и WO3 водородом; известны также Mo2O5, W4O11 и W2O5. Эти оксиды в действительности имеют более сложное строение. Хром также образует оксид CrO2. При восстановлении молибденовой и вольфрамовой кислот цинком получаются окрашенные в голубой цвет нестехиометрические оксидные соединения, точный состав которых неизвестен.
Амфотерность. Амфотерность рассматриваемых металлов проявляется в том, что они образуют оксоанионы, комплексные соединения и кислоты. Так, CrO3 при действии основания и даже кислоты образует анионные соединения типа K2CrO4 или K2Cr2O7 и h3CrO4 или h3Cr2O7. Соли калия играют важную роль в аналитической химии, являясь окислителями для количественного определения железа, иодид-иона, а также для реакции осаждения яркожелтого хромата свинца. Между кислотами хрома существует равновесие:
2HCrO4+ 2H+ = h3Cr2O7 + h3O
В кислой среде преобладают бихромат-ионы, в щелочной хромат-ионы. h3CrO4 достаточно сильная кислота, диссоциирующая на H+ и HCrО4, но получить NaHCrO4 невозможно, так как в растворе ион HCrO4 димеризуется в Cr2O72(см. уравнение выше). Молибдаты MoO42и вольфраматы WO42 образуются при взаимодействии MO3 с основаниями. При подкислении растворов этих солей происходит полимеризация в результате реакции конденсации (с выделением воды) и образования связей типа МОМ. (Это свойство не наблюдается у больших ионов непереходных элементов и, очевидно, объясняется отсутствием склонности к образованию двойных связей и сильной тенденцией к образованию одинарной связи с окружающими группами ОН.) Такие полисоединения классифицируют по количеству оксометаллических единиц. Если в соединении один и тот же металл координирует анионные группы и входит в их состав, то такие соединения называются изополисоединениями (типа кислоты или соли), например, [[Mo(Mo6O24)]]6 и [[(W12O41)]]10. Если в состав такого иона входят два атома разных элементов, то соединение называется гетерополисоединением (кислота или соль), например, h5[[SiMo12O40]], h4[[AsMo12O40]] и h20[[FeIIMo6O24]]. Структура этих соединений представляет собой цепь MoO6-октаэдров, соединенных по граням со вторым металлическим атомом (Si или As).
Бронзы. При нагревании вольфрамата (например, K2WO4) с W образуется золотисто-желтое твердое вещество, обладающее высокой проводимостью (например, KWO3; можно предположить, что металлический W окислился до степени окисления V. В действительности строение, очевидно, соответствует расположению металлического K в структуре WO3). Такие соединения получили название «бронзы» и характерны также для других металлов и оксидов металлов.
Галогениды. Металлы этой подгруппы различаются по способности образовывать галогениды. Хром не образует MX6, даже CrF6. Молибден образует только MoF6, а вольфрам при прямом синтезе образует WF6, WCl6 и WBr6. Фторид бесцветен, а хлорид и бромид окрашены. Известны также пентагалогениды CrF5 и MoF5. Cr(III) образует гидрат хлорида CrCl3*6h3O, который имеет изомеры (см. ниже). Галогениды других металлов изомеров не имеют. Хром отличается большим многообразием комплексных соединений. Например, молекулы воды и хлорид-ионы как доноры электронных пар способны образовывать с ионом хрома комплексные ионы октаэдрического строения, как в изомерах комплексного гексагидрата трихлорида хрома(III) CrCl3*6h3O: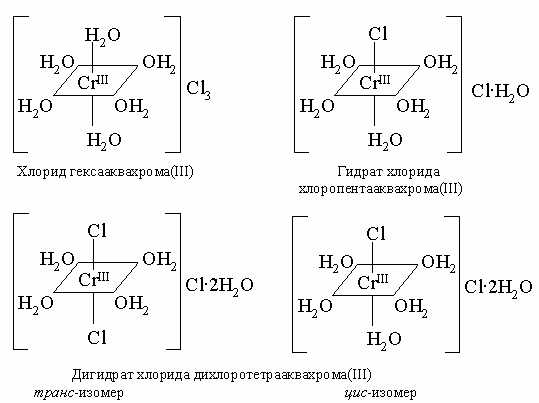
При восстановлении CrCl3 можно получить CrCl2. Молибден образует необычный галогенид состава Mo6Cl12. Можно предполагать, что это изополисоединение [[Mo6Cl8]]Cl4.
При гидролизе галогенидов образуются оксокатионы и соединения типа хромилхлорида CrO2Cl2, но данное соединение обычно получают по реакции K2Cr2O7 с конц. HCl. Хромилхлорид летучее соединение. WX6 и MoX6 гидролизуются, образуя соответственно WO2Cl2 и Mo2OCl2. Такие же соединения получаются при обработке диоксидов хлором. При гидролизе WF6 получается WOF4. Среди галогенидов известны также оксокомплексные соединения типа Na2[[WO3F2]], K2[[MoO2F4]] и Cs[[CrOCl5]]. В последнем соединении реализуется редкая для хрома степень окисления V.
Сульфиды. Металлы в реакциях с серой образуют сульфиды различного состава, например Cr3S4, Cr2S3 и CrS, при этом возможно образование нестехиометрических сульфидов. MoS2 встречается в природе в виде молибденита. Известен тиовольфрамат-ион WS24, который при подкислении превращается в WS3.Энциклопедия Кольера. — Открытое общество. 2000.
- ВАНАДИЯ СЕМЕЙСТВО
- МАРГАНЦА СЕМЕЙСТВО
Смотреть что такое «ХРОМА СЕМЕЙСТВО» в других словарях:
Семейство Баптистины — Астероид Баптистина в 61 мм телескоп Семейство Баптистины группа астероидов, образовавшаяся в момент разрушения родительского астероида диаметром до 170 км при столкновении с другим крупны … Википедия
Семейство комет Крейца — Околосолнечная комета Крейца с хорошо заметным хвостом, направляющаяся к Солнцу. Фотография спутника SOHO Околосолнечные кометы Крейца (англ. Kreutz Sungrazers) семейство околосолнечных комет, названное в честь астронома Генриха Крейца, который… … Википедия
ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ — простейшая форма материи, которая может быть идентифицирована химическими методами. Это составные части простых и сложных веществ, представляющие собой совокупность атомов с одинаковым зарядом ядра. Заряд ядра атома определяется числом протонов в … Энциклопедия Кольера
Хром — Для термина «Chrome» см. другие значения. Запрос «Cr» перенаправляется сюда; см. также другие значения. 24 Ванадий ← Хром → Марганец … Википедия
Горная порода — (Rock) Горная порода это совокупнность минералов, образующая самостоятельное тело в земной коре, вследстие природных явлений Группы горных пород, магматические и метаморфические горные породы, осадочные и метасоматические горные породы, строение… … Энциклопедия инвестора
Shewanella oneidensis — ? Shewanella oneidensis Shewanella oneidensis, СЭМ Научная классификация … Википедия
Околосолнечные кометы Крейца — Околосолнечная комета Крейца с хорошо заметным хвостом, направляющаяся к Солнцу. Фотография спутника SOHO Околосолнечные кометы Крейца (англ. … Википедия
ИЖ-2125 — / 21251 … Википедия
МИНЕРАЛЫ И МИНЕРАЛОГИЯ — Минералы твердые природные образования, входящие в состав горных пород Земли, Луны и некоторых других планет, а также метеоритов и астероидов. Минералы, как правило, довольно однородные кристаллические вещества с упорядоченной внутренней… … Энциклопедия Кольера
КВАНТОВЫЕ ГЕНЕРАТОРЫ И УСИЛИТЕЛИ — генераторы и усилители электромагнитных волн, основанные на явлении вынужденного (индуцированного) излучения. Принцип действия квантового генератора СВЧ диапазона, названного мазером (аббревиатура от английских слов Microwave Amplification by… … Энциклопедия Кольера
dic.academic.ru
|
Порядковый номер |
Русское / англ. название |
Химический символ |
Степень окисления |
|
1 |
Водород / Hydrogen |
H |
(+1), (-1) |
|
2 |
Гелий / Helium |
He |
0 |
|
3 |
Литий / Lithium |
Li |
(+1) |
|
4 |
Бериллий / Beryllium |
Be |
(+2) |
|
5 |
Бор / Boron |
B |
(-1), 0, (+1), (+2), (+3) |
|
6 |
Углерод / Carbon |
C |
(-4), (-3), (-2), (-1), 0, (+2), (+4) |
|
7 |
Азот / Nitrogen |
N |
(-3), (-2), (-1), 0, (+1), (+2), (+3), (+4), (+5) |
|
8 |
Кислород / Oxygen |
O |
(-2), (-1), 0, (+1), (+2) |
|
9 |
Фтор / Fluorine |
F |
(-1) |
|
10 |
Неон / Neon |
Ne |
0 |
|
11 |
Натрий / Sodium |
Na |
(+1) |
|
12 |
Магний / Magnesium |
Mg |
(+2) |
|
13 |
Алюминий / Aluminum |
Al |
(+3) |
|
14 |
Кремний / Silicon |
Si |
(-4), 0, (+2), (+4) |
|
15 |
Фосфор / Phosphorus |
P |
(-3), 0, (+3), (+5) |
|
16 |
Сера / Sulfur |
S |
(-2), 0, (+4), (+6) |
|
17 |
Хлор / Chlorine |
Cl |
(-1), 0, (+1), (+3), (+5), (+7), редко (+2) и (+4) |
|
18 |
Аргон / Argon |
Ar |
0 |
|
19 |
Калий / Potassium |
K |
(+1) |
|
20 |
Кальций / Calcium |
Ca |
(+2) |
|
21 |
Скандий / Scandium |
Sc |
(+3) |
|
22 |
Титан / Titanium |
Ti |
(+2), (+3), (+4) |
|
23 |
Ванадий / Vanadium |
V |
(+2), (+3), (+4), (+5) |
|
24 |
Хром / Chromium |
Cr |
(+2), (+3), (+6) |
|
25 |
Марганец / Manganese |
Mn |
(+2), (+3), (+4), (+6), (+7) |
|
26 |
Железо / Iron |
Fe |
(+2), (+3), редко (+4) и (+6) |
|
27 |
Кобальт / Cobalt |
Co |
(+2), (+3), редко (+4) |
|
28 |
Никель / Nickel |
Ni |
(+2), редко (+1), (+3) и (+4) |
|
29 |
Медь / Copper |
Cu |
+1, +2, редко (+3) |
|
30 |
Цинк / Zinc |
Zn |
(+2) |
|
31 |
Галлий / Gallium |
Ga |
(+3), редко (+2) |
|
32 |
Германий / Germanium |
Ge |
(-4), (+2), (+4) |
|
33 |
Мышьяк / Arsenic |
As |
(-3), (+3), (+5), редко (+2) |
|
34 |
Селен / Selenium |
Se |
(-2), (+4), (+6), редко (+2) |
|
35 |
Бром / Bromine |
Br |
(-1), (+1), (+5), редко (+3), (+4) |
|
36 |
Криптон / Krypton |
Kr |
0 |
|
37 |
Рубидий / Rubidium |
Rb |
(+1) |
|
38 |
Стронций / Strontium |
Sr |
(+2) |
|
39 |
Иттрий / Yttrium |
Y |
(+3) |
|
40 |
Цирконий / Zirconium |
Zr |
(+4), редко (+2) и (+3) |
|
41 |
Ниобий / Niobium |
Nb |
(+3), (+5), редко (+2) и (+4) |
|
42 |
Молибден / Molybdenum |
Mo |
(+3), (+6), редко (+2), (+3) и (+5) |
www.consei.ru
