Молекула гибридизация степень — Справочник химика 21
Достоинством теории валентных связей является то, что она позволяет качественно объяснить магнитные свойства комплексных соединений. Так, исходя из электронного строения комплексов железа, видно, что комплекс [РеР ] — содержит четыре неспаренных электрона и поэтому парамагнитен. В комплексе [Ре(СМ)б] все электроны спарены. Поэтому этот комплексный ион диамагнитен. При помощи теории валентных связей можно предсказать реакционную способность комплексных соединений. Последняя в значительной степени определяется скоростью обмена лигандов комплекса на другие ионы или молекулы, находящиеся в растворе. Условия, благоприятствующие обмену лигандов, — внешняя гибридизация и наличие у комплексообразователя свободных внутренних -орбиталей. [c.45]Сероводород — бесцветный газ тяжелее воздуха, обладающий неприятным запахом. Он очень токсичен.

Тогда молекула аммиака должна иметь тетраэдрическую форму. Определенные экспериментально валентные углы в молекуле. Нз равны 107,3°. Наблюдаемое отклонение от тетраэдра связано со степенью вклада в гибридизацию неподеленной электронной пары. [c.103]
Степень окисления —3. Аммиак молекула ЫНз имеет форму тригональной пирамиды НЫН=107°, ее дипольный момент равен 1,460.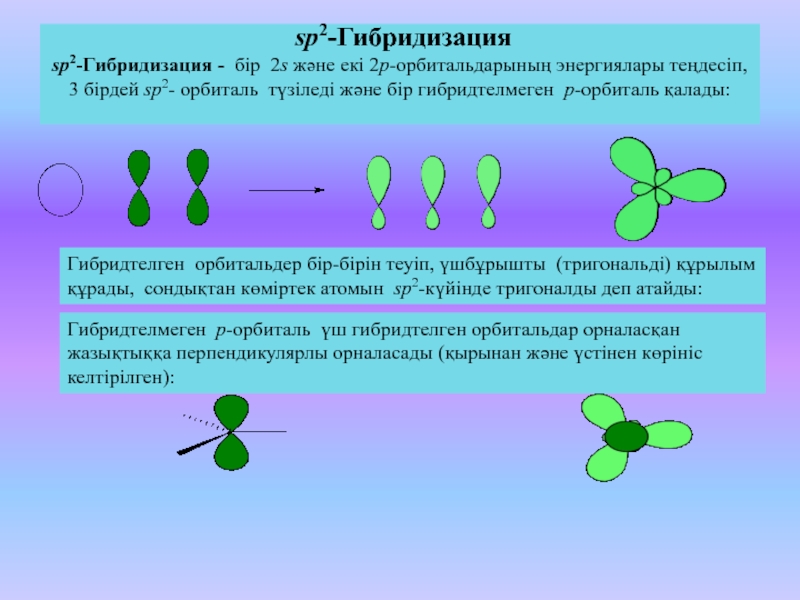
Как уже указывалось на примере молекулы LiH, аМО содержат существенную примесь 2s- и 2р0-АО. Это имеет место и для гомоядерных двухатомных молекул, хотя степень 2s — 2/ -взаимодействия убывает по мере перехода от молекулы Lij к молекуле Fj (стр. 51). В методе ВС 2s — 2/ -взаимодействие вводят посредством гибридизации (см. гл. 5). Для иллюстрации этого рассмотрим Lig. Волновая функция Гайтлера — Лондона в своей простейшей форме (11.14) для одиночной а-связи в молекуле Li 2 имеет вид [c.235]
 Однако эта теория не всегда дает объяснения наблюдаемым углам. Когда же предсказываемые углы между связями отличаются от экспериментально найденных, то обычно применяют довольно искусственный прием определения степени гибридизации, т, е. относительного вклада в гибридизацию 5-, р- и -составляющих связи . Ниже будет показано, что этим было, по крайней мере, положено начало лучшему пониманию и объяснению различия углов между связями которое наблюдается во многих формально аналогичных молекулах, И модель, которая будет использована, по-прежнему базируется, в основном, п пространственной корреляции электронных пар валентного уровня, возникающей из принципа запрета Паули,
[c.223]
Однако эта теория не всегда дает объяснения наблюдаемым углам. Когда же предсказываемые углы между связями отличаются от экспериментально найденных, то обычно применяют довольно искусственный прием определения степени гибридизации, т, е. относительного вклада в гибридизацию 5-, р- и -составляющих связи . Ниже будет показано, что этим было, по крайней мере, положено начало лучшему пониманию и объяснению различия углов между связями которое наблюдается во многих формально аналогичных молекулах, И модель, которая будет использована, по-прежнему базируется, в основном, п пространственной корреляции электронных пар валентного уровня, возникающей из принципа запрета Паули,
[c.223] Три чистые р-орбитали в пространстве будут ориентированы друг относительно друга под углом 90°. При этом две «восьмерки» р-облаков расположатся под прямым углом на плоскости, а третья р-орбиталь — перпендикулярно этой плоскости. Именно такой пространственной ориентации р-облаков отвечает минимум энергии системы (рис.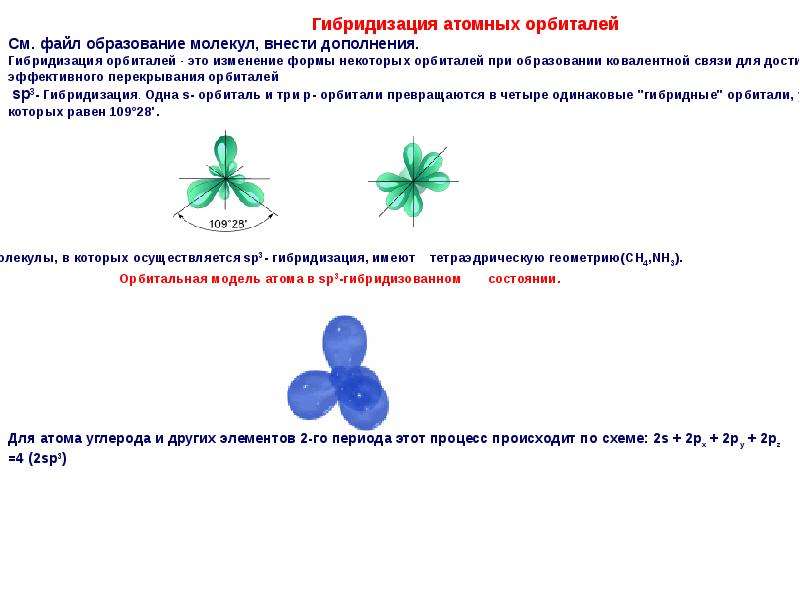 41). Значит, в молекуле аммиака степень рЗ-гибридизации [c.82]
41). Значит, в молекуле аммиака степень рЗ-гибридизации [c.82]
Несмотря на существенные упрощения, эта теория до настоящего времени составляет основу для интерпретации данных ЯКР и во многих случаях дает удовлетворительные результаты. Она же служит для решения таких обратных задач, как суждения об электронной структуре и характере химических связей в молекулах, степени их ионности, степени двоесвязности, 5-характере или степени гибридизации АО. Конечно, попытки разделить разные факторы, влияющие на градиент электрического поля на ядре в молекуле, создает известную неопределенность в интерпретации интегрального эффекта квадрупольного взаимодействия с помощью теории Таунса и Дейли. Но строгой теории градиента неоднородного электрического поля на ядре в настоящее время нет, хотя попытки более строгого рассмотрения задачи делались.
С помощью метода Е С можно предсказать реакционную способность комплексных соединений. Последняя в значительной степени определяется скоростью обмена лигандов комплекса на другие ионы или молекулы, происходящего в растворе.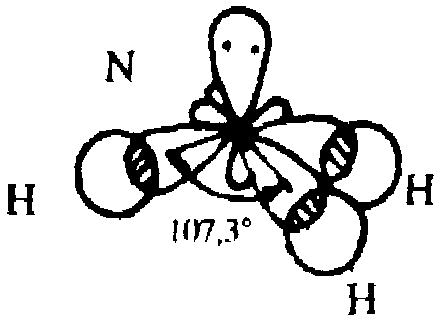 Условиями, благоприятствующими обмену лигандов, являются 1) внешняя гибридизация и 2) наличие у комплексообразователя свободных внутренних -орбиталей. [c.220]
Условиями, благоприятствующими обмену лигандов, являются 1) внешняя гибридизация и 2) наличие у комплексообразователя свободных внутренних -орбиталей. [c.220]
Опыты по гибридизации позволили исследовать гомологичность нуклеиновых кислот из разных источников. Вначале молекулы расщепляют (например, с помощью ультразвука) на фрагменты длиной 1000 нуклеотидов и подвергают денатурации. Фрагменты денатурированной ДНК смешивают с денатурированной ДНК из другого источника. Участки ДНК разных видов, имеющие близкие нуклеотидные последовательности, в той или иной степени гибридизуются, тогда как участки с сильно различающимися последовательностями гибридизации не поддаются. Рассмотрим один из вариантов постановки таких экспериментов. Денатурированную ДНК определенного организма, не подвергавшуюся деградации, заключают в агаровый гель [90] или наносят на нитроцеллюлозный фильтр [91]. Фрагменты ДНК из другого источника пропускают через колонку с ДНК-содержащим агаром или через фильтр с абсорбированной ДНК.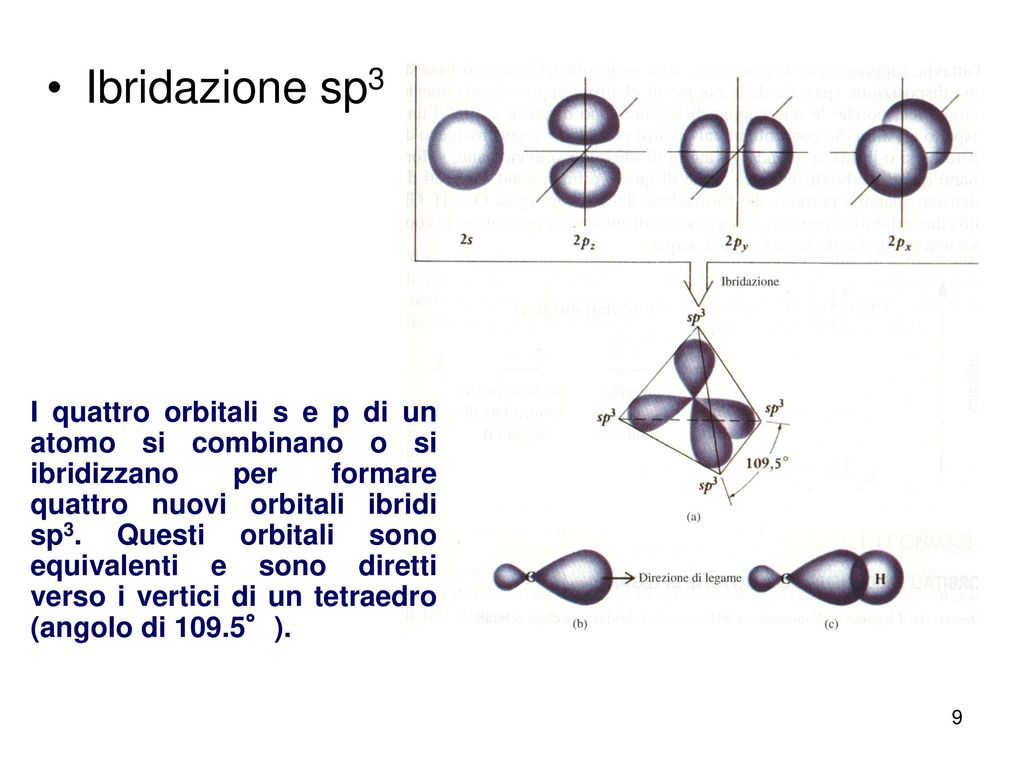
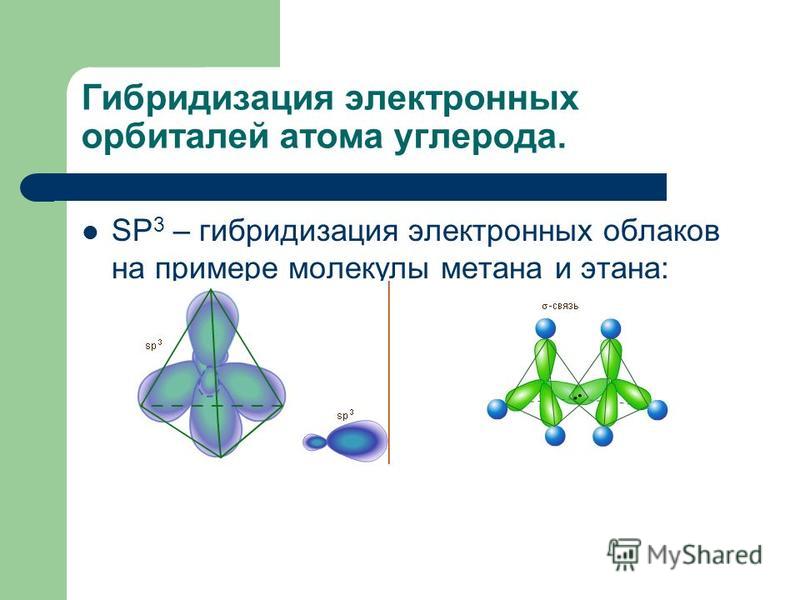
В соединениях с водородом углерод имеет степень окисления —4. Простейший углеводород — метан, его химическая формула СН4. Молекула метана имеет тетраэдрическую структуру, связанную с р -гибридизацией электронных орбиталей в возбужденном состоянии атома углерода. Метан является первым представителем гомологического ряда предельных углеводородов С Н2п-ь2 (см. гл. XI). [c.273]
Форма электронных облаков или ориентация облаков электронных пар молекулы определяется не только типом гибридизации, но и взаимным отталкиванием электронных пар это отталкивание вызвано как чисто электростатическими силами, так и эффектом действия принципа Паули. Общее выражение для силы отталкивания содержит расстояние между центрами облаков в степени —п, где п может быть очень велико.
 Поэтому конфигурация электронной системы молекулы жестко определяется числом электронных пар. [c.135]
Поэтому конфигурация электронной системы молекулы жестко определяется числом электронных пар. [c.135]Таким образом, двойные (ст + я)-связи, полученные в результате неполной i/ p -гибридизации атома углерода, в значительной степени усложнили представление о химических связях в молекулах углеводородов. [c.443]
С момента своего возникновения квантовая химия была связана главным образом с изучением электронного строения молекул, т.е. электронного распределения в стационарных состояниях, а также состава входящих в волновую функцию молекулярных орбиталей, взаимного расположения уровней энергии занятых и виртуальных орбиталей и т.п. Были предприняты многочисленные попытки интерпретировать такие понятия классической теории, как валентность, химическая связь, кратность химической связи и др. Одновременно были введены и многие новые понятия, такие как гибридизация, а- и л-связи, трехцентровые связи и т.д., часть из которых прочно вошла в язык современной химической науки, тогда как другие оказались менее удачными и сейчас уже хорошо забыты.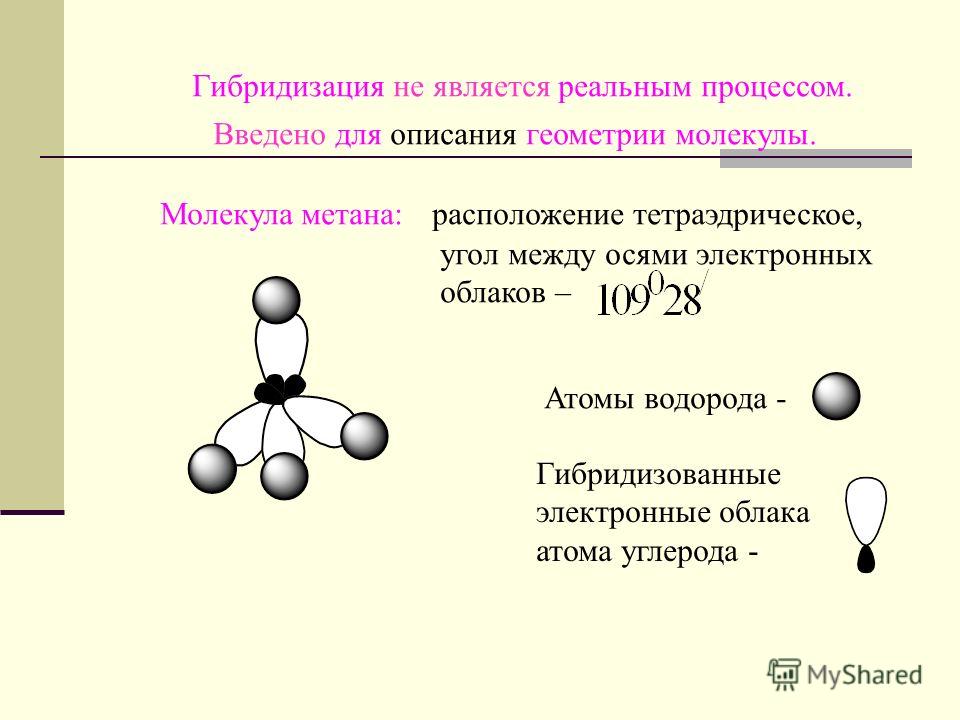
 [c.4]
[c.4]Кроме того, Дьюар предположил, что подобное уменьшение длины связи сопровождается пропорциональным увеличением ее энергии ( ), т. е. уменьшение длины связи увеличивает стабильность молекулы. Изменение в гибридизации больше влияет на длину связей (и, следовательно, на стабильность молекулы) углерод — углерод, чем на длину углерод-водородных связей. Алкильный заместитель в большей степени стабилизует алкен, чем алкан, потому что зр -гибридизация в большей мере увеличивает прочность связи углерод — углерод по сравнению со связью углерод — водород. [c.321]
Значения координационных чисел связаны с электронным строением элементов. Так, возможность зр , 5-гибридизации соответствует тетраэдру, йзр — плоской структуре, ё зр — октаэдру, с1р или 5р — линейной конфигурации. Следовательно, электронная гибридизация, приводяш,ая к образованию линейных и плоских молекул в большей степени способствует получению вязких растворов — связок. В то же время тетра- и октаэдрические конфигурации приводят к цементной схеме.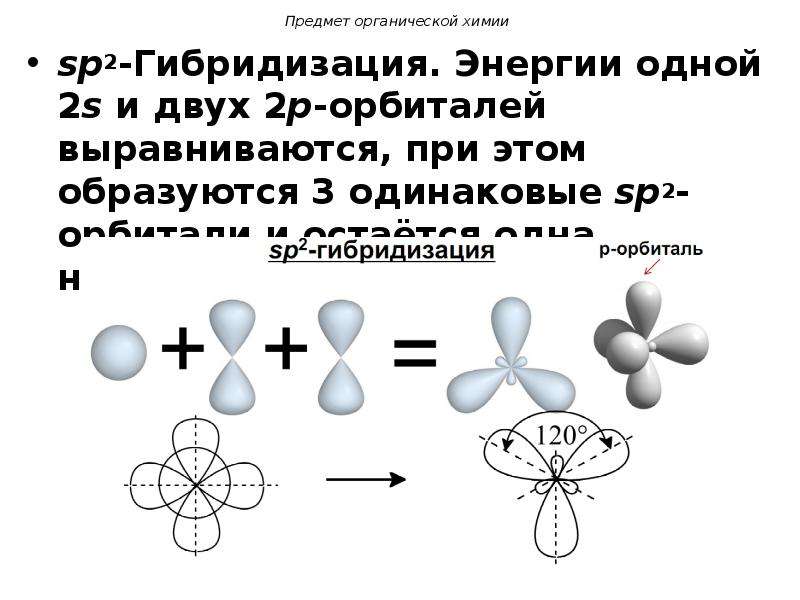
Часто возникает обратная задача как по структурной формуле определить состояние гибридизации атомов в молекуле данного соединения Правило, справедливое почти во всех случаях, с которыми приходится иметь дело в органической химии, формулируется следующим образом если число атомов или групп атомов, связанных с интересующим атомом (второго периода, третьего — в меньшей степени), и неподеленных пар электронов, принадлежащих этому же атому, равно четырем, то это соответствует зр -гибридизации, если трем — зр -гибридизации, двум — зр-гибридизации [c.74]
Сероводород — бесцветный газ, тяжелее воздуха, обладающий неприятным апахом. Он очень токсичен. Отравляющее действие сероводорода объясняют его взаимодействием с железом гемоглобина. 1ри этом функция гемоглобина как переносчика кислорода нарушается или вовсе парализуется. Химическое строение h3S аналогично строению воды, если не учитывать малую степень гибридизации атома серы. Молекула Н- З намного менее полярна, чем молекула воды, вследствие того, что ОЭО серы меньше, чем кислорода. [c.323]
[c.323]
Из этих данных видна общая тенденция к повышению константы расщепления с ростом полярности растворителя, с ростом диэлектрической постоянной среды. Трудно сказать, влияет ли среда на степень кр-гибридизации неспаренного электрона или на распределение его плотности, однако самый эффект свидетельствует о наличии специфического взаимодействия радикалов с молекулами растворителя (л-комплексы, водородные связи и т. д.) и представляет значительный интерес для изучения свойств жидкой фазы. [c.152]
Структура молекулы ВеСЬ- Атом бериллия в этой молекуле имеет степень окисления (+ П). Поэтому можно допустить, что он лишен двух электронов, перешедших условно к атомам хлора. Вакантные х- и р-АО атома Ве подвергаются гибридизации, причем р-т >ндные (фбитали располапиотся линейно (см. табл. 12) и затем перекрываются по донорно-акцепторному механизму с р-АО двух атомов хлора с образованием двух а-связей [c.76]
Степень окисления углерода в СОг равна +4. Следовательно, все четыре валентных электрона ц. а. используются на образование связей число несиязы-вающих электронных пар равно нулю. Координационному числу ц. а. 2 соответствуют две о-связывающие электронные пары, т. е, молекула СО имеет линейную формулу (см. табл. 10). Согласно модели гибридизации в образовании двух о-связей принимают участие одна 5- и одна р-орбитали ц. а., имеет место хр-гибри-дизация валентных орбиталей углерода [c.73]
Следовательно, все четыре валентных электрона ц. а. используются на образование связей число несиязы-вающих электронных пар равно нулю. Координационному числу ц. а. 2 соответствуют две о-связывающие электронные пары, т. е, молекула СО имеет линейную формулу (см. табл. 10). Согласно модели гибридизации в образовании двух о-связей принимают участие одна 5- и одна р-орбитали ц. а., имеет место хр-гибри-дизация валентных орбиталей углерода [c.73]
Все атомы углерода в бензоле находятся в состоянии зр -гибридизации. и поэтому молекула бензола представляет собой правильный плоский шестиугольник. Оси негибридизованных р-орбиталей каждого атома углерода, имеющих форму симметричной гантели, направлены перпендикулярно плоскости кольца, а боковое перекрывание орбитали каждого атома углерода с орбиталями обоих соседних атомов в отличие от сопряженных диенов осущестн.пяется в одинаковой степени вне плоскости молекулы (выше и ниже ее). [c.321]
Прежде чем говорить об электронной конф 1гурации кристаллов, напомним, как формируется электронная структура молекулы, когда она образуется из атомов.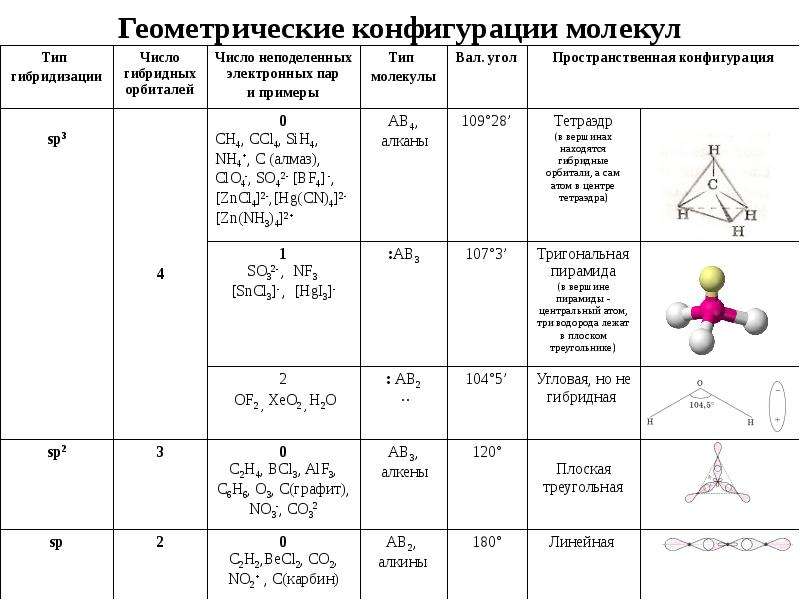 Возьмем, например, литий, атомы которого имеют электронную структуру ls 2s. При перекрывании 28-орбиталей двух атомов образуется молекула Lia. При этом возникают две молекулярные орбитали, одна из которых, более низкая по уровню энергии— связывающая орбиталь, — заселяется валентными электронами. Небольшая часть валентных электронов, возбуждается и переходит в 2р-состояние, степень гибридизации не превышает 20%. Атомные 1 s-орбитали не теряют в молекуле своей индивидуальности. Участие принадлежащих им электронов в об-, щем электронно-ядерном взаимодействии несколько снижает его [c.99]
Возьмем, например, литий, атомы которого имеют электронную структуру ls 2s. При перекрывании 28-орбиталей двух атомов образуется молекула Lia. При этом возникают две молекулярные орбитали, одна из которых, более низкая по уровню энергии— связывающая орбиталь, — заселяется валентными электронами. Небольшая часть валентных электронов, возбуждается и переходит в 2р-состояние, степень гибридизации не превышает 20%. Атомные 1 s-орбитали не теряют в молекуле своей индивидуальности. Участие принадлежащих им электронов в об-, щем электронно-ядерном взаимодействии несколько снижает его [c.99]
Энергия ионизации и сродство к электрону могут быть вычислены квантово-механическим путем для конкретных оболочек атомов, т. е. с учетом степени гибридизации связей и заселенности орбиталей. В связи с этим все шире используется понятие орбитальной электроотрицательности (ОЭО), с помощью которого оценивается способность атома в молекуле к притяжению электрона на данную орбиталь. Целесообразность использования ОЭО становится понятной, если учесть, что ЭО атома в разном окружении (в разных молекулах или сложных радикалах) неодинакова.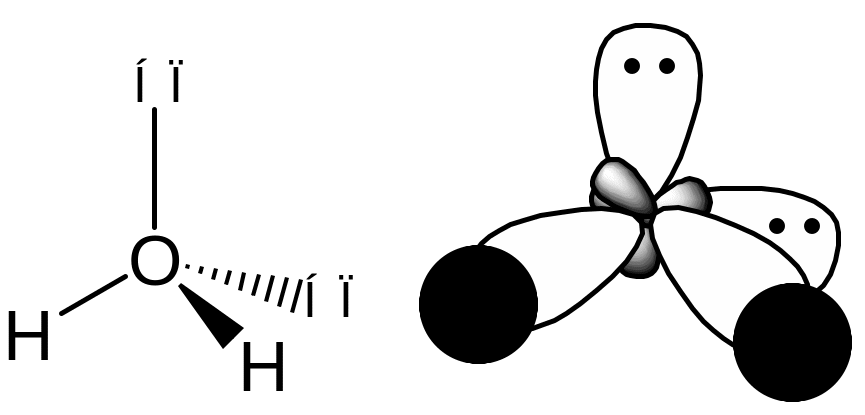 Л1етод ЭО позволяет рассчитать эффективные заряды, которые определяются только нормальными валентными связями атомов. В случае дополнительных эффектов (водородные связи, трансвлияние, дативное взаимодействие и т. п.) вычисленные значения зарядов атомов могут существенно отличаться от экспериментальных. [c.20]
Л1етод ЭО позволяет рассчитать эффективные заряды, которые определяются только нормальными валентными связями атомов. В случае дополнительных эффектов (водородные связи, трансвлияние, дативное взаимодействие и т. п.) вычисленные значения зарядов атомов могут существенно отличаться от экспериментальных. [c.20]
В молекулярной биологии широко используется способность денатурированных ДНК ренатурировать с восстановлением исходной двуспиральной структуры. Она лежит в основе метода молекулярной гибридизации нуклеиновых кислот, который позволяет выявлять степень сходства различных ДНК (а также РНК). Для этого денатурированную ДНК (если изучается гибридизация двух различных нуклеиновых кислот, то одна из них несет радиоактивную метку) помещают в условия, оптимальные для образования двойных спиралей (ионная сила раствора — около 0,2 температу за — на 10—20 «С ниже Тт нативной ДНК). В случае полностью комплементарных цепей ДНК со временем они целиком превратятся в двуспиральные молекулы.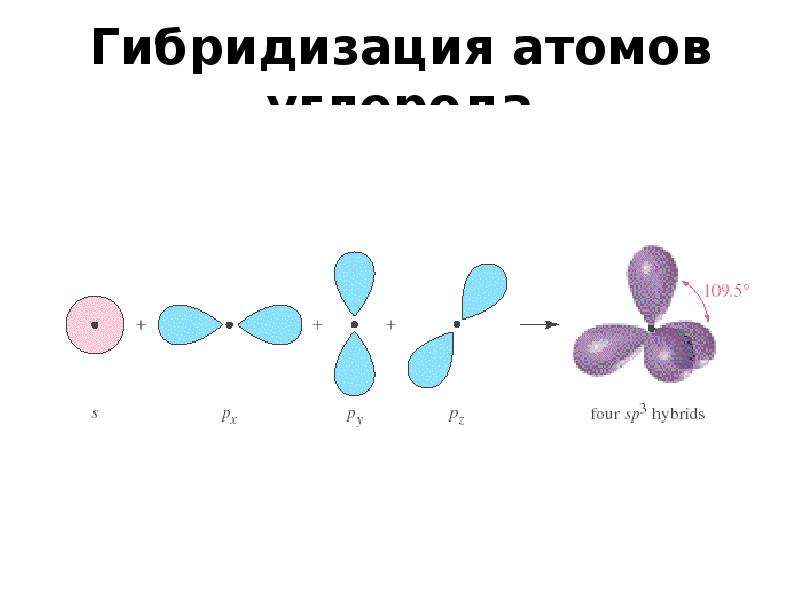 Если в смеси присутствуют как комплементарные, так и некомплементарные цепи ДНК, то после ренатурации первых тем или иным способом определяют долю двуспиральных молекул. В настоящее время широко распространены методы, когда денатурированные молекулы ДНК одного типа закрепляются на нитроцеллюлозных фильтрах, которые затем помещают в раствор ДНК (или РНК) другого типа. После образования двуспиральных комплексов на фильтрах они легко могут быть отмыты от несвязав-шейся ДНК- Этот же подход используется при выявлении цепей ДНК (или РНК), комплементарных другим ДНК (или РНК), после разделения их электрофорезом в гелях. [c.30]
Если в смеси присутствуют как комплементарные, так и некомплементарные цепи ДНК, то после ренатурации первых тем или иным способом определяют долю двуспиральных молекул. В настоящее время широко распространены методы, когда денатурированные молекулы ДНК одного типа закрепляются на нитроцеллюлозных фильтрах, которые затем помещают в раствор ДНК (или РНК) другого типа. После образования двуспиральных комплексов на фильтрах они легко могут быть отмыты от несвязав-шейся ДНК- Этот же подход используется при выявлении цепей ДНК (или РНК), комплементарных другим ДНК (или РНК), после разделения их электрофорезом в гелях. [c.30]
Предсказание типа гибридизации проводится на основании донорно-акцепторного механизма образования связи. РГапример, для молекулы ВеН2 оценивают степени окисления атомов (Ве , Н ), записывают сокращенные электронные конфигурации условных ионов Ве и И (Ь- ) и на схеме незавершенных подуровней атома Ве» (в общем виде атома А) показывается образование двух связей Ве акцептор электронной пары, И-донор) (рис.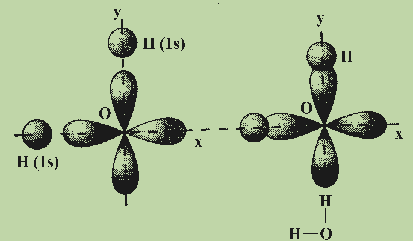 4). Предполагается, что в момент образования двух связей Ве—Н у атома Ве 2 — и 2/7-орбитали гибридизуются в две 5/7-орбитали [c.45]
4). Предполагается, что в момент образования двух связей Ве—Н у атома Ве 2 — и 2/7-орбитали гибридизуются в две 5/7-орбитали [c.45]
Пачечно-бахромчатая (мицеллярно-бахромчатая или кристаллитная) модель строения углерода была постулирована в начале 50-х годов независимо друг от друга Франклин и Касаточкиным. Она получила значительное развитие во многих работах. В рамках данной теории интерпретировались практически все результаты исследований была предложена методика экспериментального определения доли ароматического углерода , было разработано множество моделей беспорядка или частичной аморфности полимерного углерода . Считали, что аморфность обусловлена, главным образом, беспорядочными трансляциями, поворотами и изгибами слоев , нетождествеиностью валентных связей отдельных атомов (хиноидная структура Полинга ) или состояний разных поверхностей одной и той же или разных двумерных ароматических молекул , а также двухфазностью системы. Предполагалось», что аморфный углерод характеризуется всевозможными степенями гибридизации внешних электронов.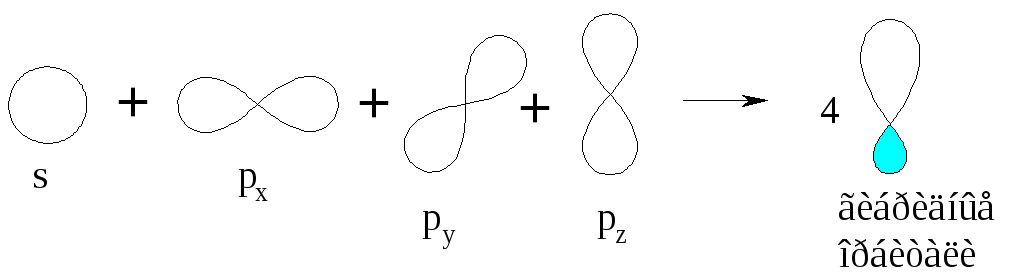 Хотя и акцентировалось внимание на более или менее регулярной упаковке ароматических слоев в пачке (кристаллите), но тем не менее наряду с атомными слоями допускалось существование и цепочечных фрагментов, упакованных нерегулярным образом. Казалось, что не существует другой возможности для интерпретации многочисленных фактов, особенно данных рентгеновской дифракции. [c.20]
Хотя и акцентировалось внимание на более или менее регулярной упаковке ароматических слоев в пачке (кристаллите), но тем не менее наряду с атомными слоями допускалось существование и цепочечных фрагментов, упакованных нерегулярным образом. Казалось, что не существует другой возможности для интерпретации многочисленных фактов, особенно данных рентгеновской дифракции. [c.20]
Следует заметить, что для образования связей и проявления степени окисления +3 необходимо участие спаренных электронов, занимающих -орбиталь в атомах этих элементов. Пара электронов 5 устойчива и принимает участие в образовании химических связей лишь у элементов, образующих прочные связи например, у алюминия валентность +3 является преобладающей. Устойчивость одновалентных состояний растет в подгруппе по мере снижения прочности связей, и у таллия известны многочисленные соединения, в которых он одновалентен. Напротив, бор в соединениях всегда трехвалентен образование ковалентных связей в общем случае может доставить энергию, необходимую для того, чтобы перевести электроны атома бора в реакционноспособное возбужденное состояние, отвечающее 5р -гибридизации.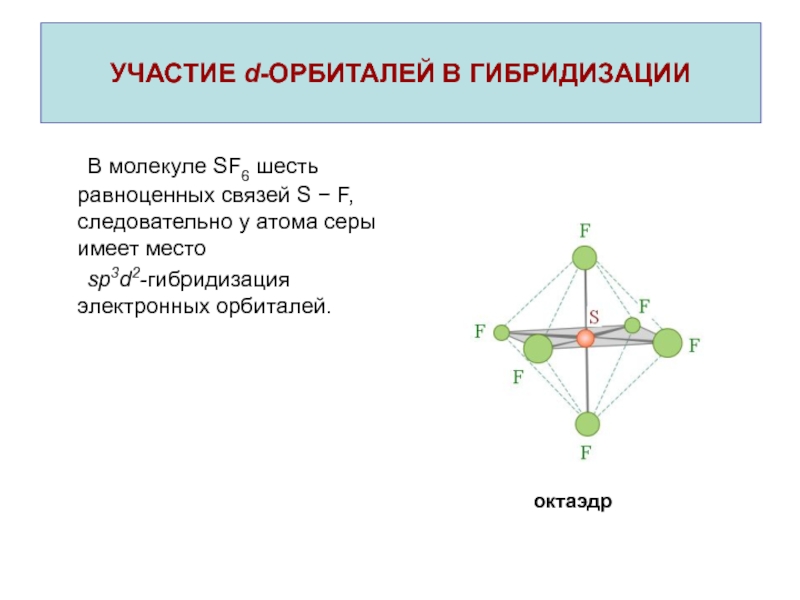 Ионизационный потенциал (первый) бора настолько высок (8,29 эВ), что образование одной связи с одновалентным катионом бора не может компенсировать затраты энергии на отрыв электрона. Направление осей гибридных облаков этого типа характеризуется углами 120°, причем все три оси лежат в одной плоскости. Поэтому молекула соединения бора типа ВС1з имеет плоскую структуру. Бор в гидридах формально ведет себя как четырехвалентный элемент. Боран ВНз в свободном состоянии неизвестен и обнаружен только как неустойчивый промежуточный продукт. Но диборан ВгНв исследован детально. Этот гидрид был использован для получения и ряда других боранов. Диборан получают в чистом виде из борогидрида натрия и три-фторида бора [c.157]
Ионизационный потенциал (первый) бора настолько высок (8,29 эВ), что образование одной связи с одновалентным катионом бора не может компенсировать затраты энергии на отрыв электрона. Направление осей гибридных облаков этого типа характеризуется углами 120°, причем все три оси лежат в одной плоскости. Поэтому молекула соединения бора типа ВС1з имеет плоскую структуру. Бор в гидридах формально ведет себя как четырехвалентный элемент. Боран ВНз в свободном состоянии неизвестен и обнаружен только как неустойчивый промежуточный продукт. Но диборан ВгНв исследован детально. Этот гидрид был использован для получения и ряда других боранов. Диборан получают в чистом виде из борогидрида натрия и три-фторида бора [c.157]
Атомы элементов ПА-подгруппы имеют на внешнем электронном уровне по два электрона (5 ) с противоположными спинами. При затрате необходимой энергии один из электронов 5-состояния переходит в /3-состояние, т. е. оба электрона становятся иеспареннымн. Поэтому элементы ПА-подгруппы проявляют степень окисления +2.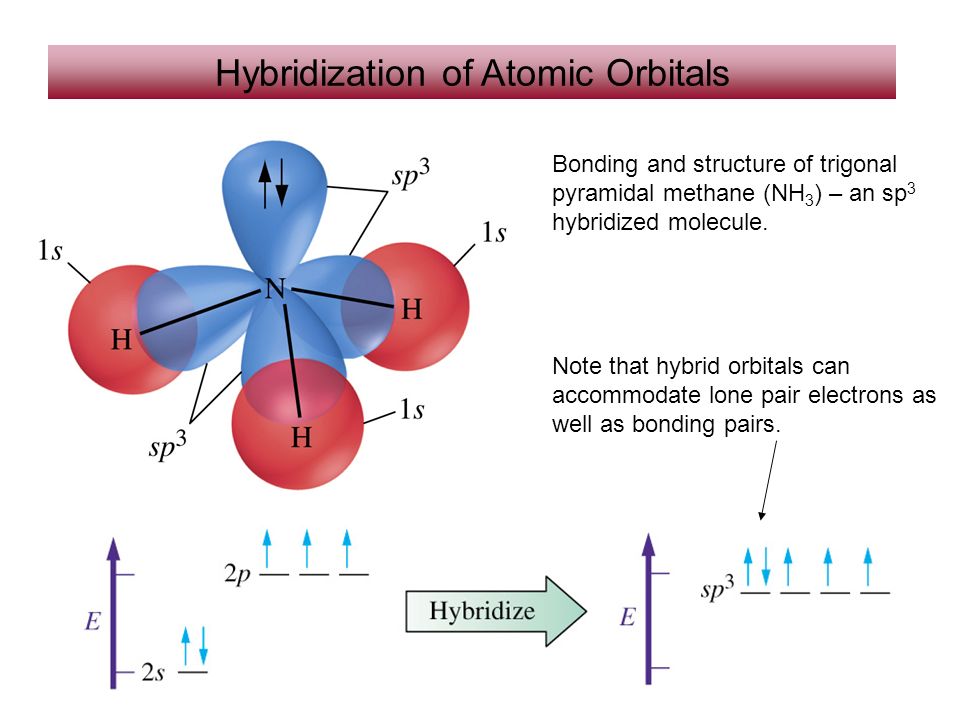 При образовании молекул ЭХ 2 происходит гибридизация к- и /7-электронных облаков атома Э, образуются молекулы линейного строения X—Э—X, дипольный момент которых равен нулю (как, например, у хлорида бериллия ВеС12, см. рис. 16). [c.293]
При образовании молекул ЭХ 2 происходит гибридизация к- и /7-электронных облаков атома Э, образуются молекулы линейного строения X—Э—X, дипольный момент которых равен нулю (как, например, у хлорида бериллия ВеС12, см. рис. 16). [c.293]
Протонирование. С большинством протонных кислот пиридин образует кристаллические соли. Незамещенный пиридин рКа 5,2) — гораздо более слабое основание, чем насыщенные алифати ческие амины рКа обычно между 9 и 11). Вцрочем, такое сравне ние не имеет реального значения, так как по мере изменения состояния гибридизации атома, ответственного за основность молекулы, в значительной степени меняется и основность. Например, для ряда карбанионов НС = С , Н2С = СН -, СНз—СН2значения рКа составляют +25, 36,5 и 42. Последовательное увеличение рКа наглядно демонстрирует р.езкое усиление основности в результате перехода от 5/ -гибридизации через зр — к 5/ -гибридизации. По аналогии можно ожидать и быстрое нарастание основности в [c.55]
Анализ прочности водородной связи с водой различных соединений позволяет утверждать, что величина энергии Н-связи чувствительна к электронному строению взаимодействующего с водой соединения. Она реагирует на изменение степени гибридизации орбиталей протоноакцеп-тора, на присутствие ароматических колец, изменение числа электронофильных атомов кислорода эфирных групп, следовательно, является показателем электронодонорной способности функциональных групп и соединений в целом. В связи с этим представляет интерес проведение сопоставления энергии Н-связи с другими параметрами, также характеризующими электронодонорные свойства. Одной из главных характеристик молекулы, определяющих особенности ее строения и многие свойства соединений, является длина связей и энергия химических связей [150]. Результаты сопоставления величин энергии водородных связей с водой типа А—В. .. Н—О—Н и энергии [c.40]
Она реагирует на изменение степени гибридизации орбиталей протоноакцеп-тора, на присутствие ароматических колец, изменение числа электронофильных атомов кислорода эфирных групп, следовательно, является показателем электронодонорной способности функциональных групп и соединений в целом. В связи с этим представляет интерес проведение сопоставления энергии Н-связи с другими параметрами, также характеризующими электронодонорные свойства. Одной из главных характеристик молекулы, определяющих особенности ее строения и многие свойства соединений, является длина связей и энергия химических связей [150]. Результаты сопоставления величин энергии водородных связей с водой типа А—В. .. Н—О—Н и энергии [c.40]
Замещение внутрициклического атома водорода ЫН-группировки НгП с образованием Ы-замещенных порфиринов дает в результате еще более сложное сочетание структурно-электронных изменений. Наряду со значительным искажением молекулы и поляризацией макрокольца К-заместителем ( /-эффект), здесь может наблюдаться частичная перегибридизация Н-замещенного атома азота (,5р р ) [84-86]. Факт смены гибридизации находит подтверждение в спектрах ПМР и данных РСА [85], а также в изменении реакционной способности молекул, которая не может быть объяснена лишь электронными эффектами Ы-заместителей. Перегибридизация оказывает дополнительное влияние на снижение электронной составляющей МЦЭ, поскольку повышает химическое средство пирролениновых (-Н=) атомов азота координационного центра молекулы НгП. Ы-замещенный атом азота приобретает в этом процессе свободную электронную пару и свойства, близкие к аминным. Как известно, амины обладают высокими электронодонорными свойствами, легко вступая в реакции протонирования и комплексообразования, однако образующиеся комплексы отличаются низкой термодинамической устойчивостью. Аналогичная картина наблюдается в случае Ы-замещенных порфиринов [85]. Данные табл. 7.11 показывают, что Ы-замещение приводит к возрастанию скорости комплексообразования НгТФП (7) в Ю -КУ раз. При этом энергии активации процесса снижаются вдвое, а степень сольватации переходного состояния увеличивается.
Факт смены гибридизации находит подтверждение в спектрах ПМР и данных РСА [85], а также в изменении реакционной способности молекул, которая не может быть объяснена лишь электронными эффектами Ы-заместителей. Перегибридизация оказывает дополнительное влияние на снижение электронной составляющей МЦЭ, поскольку повышает химическое средство пирролениновых (-Н=) атомов азота координационного центра молекулы НгП. Ы-замещенный атом азота приобретает в этом процессе свободную электронную пару и свойства, близкие к аминным. Как известно, амины обладают высокими электронодонорными свойствами, легко вступая в реакции протонирования и комплексообразования, однако образующиеся комплексы отличаются низкой термодинамической устойчивостью. Аналогичная картина наблюдается в случае Ы-замещенных порфиринов [85]. Данные табл. 7.11 показывают, что Ы-замещение приводит к возрастанию скорости комплексообразования НгТФП (7) в Ю -КУ раз. При этом энергии активации процесса снижаются вдвое, а степень сольватации переходного состояния увеличивается. [c.353]
[c.353]
Винильная группа, связанная с шестичленным гетероциклом, будет иметь иную полярографическую активность, нежели группа, связанная с пятичленным гетероциклом. Пятичленные гетероциклы (тиофен, фуран, пиррол) можно рассматривать как производные бензола, у которого группа —СН = СН— замещена гетероатомом (5, О, Ы), способным поставлять, благодаря гибридизации два электрона в ароматический секстет. Это обусловливает относительно высокие значения энергии сопряжения (в кДж/моль) у тиофена—117, у пиррола 100, у фу-рана — 52. Так как в этих гетероциклах неподеленная пара электронов гетероатома участвует в сопряжении с двойной связью —С = С, то пониженная плотность электронного облака наблюдается на гетероатоме (по сравнению с С-атомами). При этом а-углеродный атом имеет большую электронную плотность, чем находящиеся в -положении по отношению к гетероатому. Особенности распределения электронной плотности в пятичленных гетероциклах сказываются определенным образом и на полярографической активности винильной группы в их винилзамещенных. Винилтиофен и винилфуран на фоне 0,05 М N( 2H5)4I в диметилформамиде образуют волны с — 1/2=—2,312 и —2,449 В соответственно [179]. При сравнении потенциалов полуволн а-винилфурана и а-винилтиофена видно, что винильная группа в первом восстанавливается труднее, чем во втором. Из эффектов, влияющих на полярографическую активность органических молекул, тут следует учитывать, по крайней мере, два а) индукционный эффект самого гетероцикла, определяющего статическую полярность молекул и, в первую очередь, состояние электронного облака на винильной группе б) подвижность я-электронной системы в винильном производном, что связано со степенью ароматичности соответствующего гетероцикла, и способность молекул поляризоваться в электрическом поле электрода. [c.127]
В радикале и в карбокатионе атомы углерода, имеюихие только три связи, такл е р -гибридизованы (см. рис. 1.2.7). Такую же степень гибридизации имеют атомы азота в связи С=Ы и атомы кислорода в связи С=0. Соответственно, угол между связями в молекулах азоме-тинов, альдегидов и кетонов равен 120° (рис. 1.2.9) их энергии соответствуют примерно энергии кратной связи С=С (см. табл. 1.2.2). [c.62]
На рис. 1 условно представлена структура в предположении, что молекулы имеют ароматический характер. Хотя имеются теоретические и экспериментальные свидетельства как за, так и против делокализованного связывания электронов, общая картина складывается не в пользу существования высокой степени делокализованного связывания. Теоретические расчеты показали, что соответствующая гибридизация Зс -орбиталей фосфора с р -орби-талью азота может приводить к картине с тремя центральными островами по типу я-связи, которые прерываются на фосфоре, как это показано на рис. 2 [18]. Среди наиболее убедительных экспериментальных подтверждений отсутствия делокализованного связывания можно отметить низкую температуру перехода в стеклообразное состояние полигалогенфосфазенов и многих полиоргано- осфазенов, что свидетельствует о небольшой высоте барьеров [c.317]
Метод валентных связей, валентность
Метод валентных связей
Метод валентных связей (локализованных электронных пар) предполагает, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар.
Поэтому химическая связь представляется двухэлектронной и двухцентровой, т.е. локализована между двумя атомами. В структурных формулах соединений обозначается черточкой:
H-Cl, H-H, H-O-H
Рассмотрим в свете Метода ВС, такие особенности связи, как насыщаемость, направленность и поляризуемость.
Образование сигма-, пи- и дельта-связей
Валентность атома — определяется числом неспаренных (валентных) электронов, способных принять участие в образовании химической связи.
Валентность выражается небольшими целыми числами и равна числу ковалентных связей. Валентность элементов, проявляющуюся в ковалентных соединениях, часто называют ковалентностью.
Некоторые атомы имеют переменную валентность, например углерод в основном состоянии имеет 2 неспаренных электрона и будет двух валентен. При возбуждении атома, возможно распарить другие два спаренных электрона и тогда атом углерода станет четырех валентен:
Возбуждение атома до нового валентного состояния требует затраты энергии, которая компенсируется выделяемой при образовании связей энергией.
Взаимное перекрывание облаков, т.е. образование связи может происходить разными способами, ввиду их различной формы. Различают σ-, π- и δ-связи.
Как различить сигма-, пи- и дельта-связи?
Сигма – связи образуются при перекрывании облаков вдоль линии, проходящей через ядра атомов.
Пи – связи возникают при перекрывании облаков по обе стороны от линии, соединяющей ядра атомов.
Дельта – связи осуществляются при перекрывании всех четырех лопастей d – электронных облаков, расположенных в параллельных плоскостях.
σ– связь может возникнуть при перекрывании вдоль линии, соединяющей ядра атомов в следующих орбиталей:
s — s -, s — р-, р – р-, d — d -орбиталей , а также d — s-, d — р– орбиталей.
σ– связь обладает свойствами локализованной двухцентровой связи, каковой она и является.
π– связь может образовываться при перекрывании по обе стороны от линии, соединяющей ядра атомов следующих орбиталей:
р — р-, р — d-, d — d-, f — p-, f — d— и f — f— орбиталей.
Итак, s— элементы способны к образованию только σ– связи,
р— элементы — σ– и π– связи,
d— элементы — σ–, π– и δ‑ связи,
f— элементы — σ– , π– , δ-связи.
При совместном образовании π– и σ- связей получается двойная связь.
Если же одновременно возникают две π–и σ- связь, то образуется тройная связь.
Количество возникших связей между атомами, называется кратностью связи.
Между двумя атомами может возникнуть только одна сигма-связь.
Направленность ковалентной связи
- При образовании связи с помощью s — орбиталей, ввиду их сферической формы, не возникает какого-либо преимущественного направления в пространстве, для наиболее выгодного образования ковалентных связей.
- В случае же р – орбиталей, электронная плотность распределена неравномерно, поэтому возникает определенное направление, по которому образование ковалентной связи наиболее вероятно.
Гибридизация атомных орбиталей
Рассмотрим пример. Представим, что четыре атома водорода соединились с атомом углерода и образовалась молекула метана CH4.
Рисунок показывает что происходит, но не объясняет, как ведут себя s- и р— орбитали, при образовании таких соединений.
Хотя р— орбиталь имеет две части, развернутые друг относительно друга, но она может образовывать только одну связь. В итоге, можно предположить, что в молекуле метана один атом водорода присоединяется к 2s- орбитали углерода, остальные – к 2р— орбитали.
Тогда, каждый атом водорода будет находиться по отношению к другому под углом 90°, но это не так. Электроны отталкиваются друг от друга и расходятся на большее расстояние.
Что же на самом деле происходит?
Происходит гибридизация атомных орбиталей, в результате которой все орбитали объединяются, перестраиваются и образуют 4 эквивалентные гибридные орбитали, которые направлены к вершинам тетраэдра.
Гибридизация — это смешение различных атомных орбиталей (например, s и p) и образование одинаковых по форме и энергии гибридных орбиталей (например, sp, sp2, sp3).
Типы гибридизации атомных орбиталей
sp3-гибридизация
В нашем примере, каждая из гибридных орбиталей содержит некий вклад 2s- орбитали и некоторые вклады 2р— орбиталей.
Поскольку 4 гибридные орбитали образованы одной 2s— и тремя 2р— орбиталями, то такой способ гибридизации называют sp3-гибридизацией.
sp3-гибридизация орбиталей в молекуле метанаКак видно из рисунка, конфигурация гибридных орбиталей позволяет четырем атомам вдорода образовать ковалентные связи с атомом углерода, при этом орбитали будут располагаться относительно друг друга под углом 109,5°.
Такой же тип гибридизации присутствует в таких молекулах, как , например, NH3, H2O.
На одной из sp3-гибридных орбиталей, в молекуле NH3, находится неподеленная электронная пара, а три остальные орбитали используются для соединения с атомами водорода.
В молекуле H2O неподеленными электронными парами заняты две гибридные орбитали атома кислорода, а две другие используются для связывания с атомами водорода.
Гибридизация орбиталей молекул метана, аммиака, водыsp2-гибридизация
Число гибридных орбиталей определяется числом одинарных связей, а также количеством неподеленных электронных пар в молекуле. Эти электроны находятся на гибридных орбиталях. Когда же происходит перекрывание негибридных орбиталей двух атомов, то образуется кратная связь. Например, в молекуле этилена связь реализуется следующим образом:
sp2-гибридизация атомов этиленаПлоское расположение трех связей вокруг каждого атома углерода дает основание предположить, что в данном случае имеет место sp2-гибридизация ( гибридные орбитали образованы одной 2s- и двумя 2р— орбиталями). При этом одна 2р— орбиталь остается неиспользованной (негибридной).
Орбитали будут располагаться относительно друг друга под углом 120°.
sp-гибридизация
Таким же образом, в молекуле ацетилена образуется тройная связь. В данном случае происходит sp-гибридизация атомов, т.е. гибридные орбитали образованы одной 2s- и одной 2р— орбиталями, а другие две 2р— орбитали являются негибридными.
Орбитали располагаются относительно друг друга под углом 180°
sp-гибридизация атомов ацетиленаНиже в таблице приведены примеры гибридных орбиталей, их геометрическое расположение .
| Набор атомных орбиталей | Набор гибридных орбиталей | Геометрическое расположение гибридных орбиталей | Примеры |
| s,p | sp | Линейное (угол 180°) | Be(CH3)2, HgCl2 MgBr2, СаН2, ВаF2, C2H2 |
| s,p,p | sp2 | Плоское тригональное (угол 120°) | BF3,GaCl3, InBr3,TeI3, C2H4 |
| s,p,p,p | sp3 | Тетраэдрическое (угол 109,5°) | CH4, AsCl4—, TiCl4, SiCl4, GeF4 |
| s,p,p,d | sp2d | Плоскоквадратнoe (угол 90°) | Ni(CO)4, [PdCl4]2— |
| s,p,p,p,d | sp3d | Тригонально-бипирамдальное (углы 120° и 90°) | PF5, PCl5, AsF5 |
| s,p,p,p,d,d | sp3d2 | Октаэдрическое (угол 90°) | SF6, Fe(CN)63-, CoF63- |
Гибридные орбитали в пространстве располагаются различным образом:
Пространственное расположение гибридных орбиталей различных типовПятигорский медико-фармацевтический институт – филиал Волгоградского государственного медицинского университета
Согласно Приказу Министерства здравоохранения и социального развития Российской Федерации № 434 от 28 апреля 2012 года 1 октября 2012 года завершилась реорганизация государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации и государственного бюджетного образовательного учреждения высшего профессионального образования «Пятигорская государственная фармацевтическая академия» Министерства здравоохранения и социального развития Российской Федерации в форме присоединения второго учреждения к первому с последующим образованием на основе присоединённого учреждения обособленного подразделения (филиала).
Определено, что полное наименование филиала вуза (бывшей Пятигорской государственной фармацевтической академии), с учетом разделения Министерства здравоохранения и социального развития Российской Федерации на два министерства, следующее:
Пятигорский филиал государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации
Сокращённое наименование: «Пятигорский филиал ГБОУ ВПО ВолгГМУ Минздрава России».
Согласно Приказу Министерства здравоохранения Российской Федерации № 51 от 04 февраля 2013 года указаны изменения, которые вносятся в устав государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации.
В пункте 1.10 абзацы третий и четвёртый изложить в следующей редакции:
«полное наименование: Пятигорский медико-фармацевтический институт — филиал государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации»,
сокращённое наименование:
«Пятигорский медико-фармацевтический институт — филиал ГБОУ ВПО ВолгГМУ Минздрава России».
Переименование произведено с 14.03.2013.
В соответствии с приказом по Университету от «15» июля 2016 г. №1029-КМ «О введение в действие новой редакции Устава и изменении наименования Университета» с 13.07.2016 г. в связи с переименованием Университета считать:
— полным наименованием Университета: федеральное государственное бюджетное образовательное учреждение высшего образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации;
— сокращенным наименованием Университета: ФГБОУ ВО ВолгГМУ Минздрава России;
— полным наименованием филиала Университета: Пятигорский медико-фармацевтический институт – филиал федерального государственного бюджетного образовательного учреждения высшего образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации;
— сокращенным наименованием филиала Университета: Пятигорский медико-фармацевтический институт – филиал ФГБОУ ВО ВолгГМУ Минздрава России.
Переименование произведено с 13.07.2016.
Узнать больше о вузе
Противодействие коррупции
Платежные реквизиты вуза
химия контрольная вариант 3 — Спрашивалка
Часть А.
1). (2 балла) . Формула вещества с ковалентной неполярной связью:
А) . MgCl2. Б) . HF. В) . N2. Г). Al.
2). (2 балла) . Вещество с металлической связью:
А) . Кислород. Б) . Метан.
В). Фторид натрия. Г) . Этаналь.
3). (2 балла) . Число общих электронных пар в молекуле фтора:
А) . Одна. Б) . Две.
В) . Три. Г) . Четыре
4). (2 балла) . Полярность химической связи уменьшается в ряду соединений, формулы которых:
А) . HI, HCl2, HF. Б) . HBr, O2, h3S.
В) . h3S, Nh4, Ch5. Г) . h3O, Ph4, HI.
5). (2 балла) . Вид гибридизации электронных орбиталей атома cеры в молекуле соединения, формула которого C2h3:
А) . sp3. Б) . sp2. В) . sp. Г) . Не гибридизированны.
6). (2 балла) . Кристаллическая решетка оксида сахарозы:
А) . Атомная. Б) . Металлическая. В) . Ионная. Г) . Молекулярная.
7). (2 балла) . Число σ- и π- связей В молекуле метаналя:
А) . 2σ и 2π. Б) . 4σ и π– нет.
В) . 3σ и 1π. Г) . 4σ и 1π.
. (2 балла) . Вещества формулы которых Ch4 Сh4 Сh4
׀ ׀ ׀
это: C≡C-Ch3-Сh3 и Ch4-С≡С-Сh3,
А) . Гомологи.
Б) . Изомеры.
В) . Одно и то же вещество.
9). (2 балла) . Изомером вещества, формула которого Ch4-CH-CH-Ch4, является:
А) . Бутан. Б) . Бутин-2. В) . Метилцикопропан. Г) . Бутадиен-1,3.
10). Вещество формула которго Nah3PO4,
называют:
А) . Гидрофосфат натрия. Б) . Фосфат натрия.
В) . Дигидрофосфат натрия. Г) . Фосфит натрия.
Часть Б.
11). (8 баллов) . Составьте схему образования соединений, состоящих из химических элементов.
А) . Кальция и Серы. Б) . Бора и Фтора.
Укажите тип химической связи в каждом соединении.
12). (4балла) . Какую геометрическую форму имеет молекула соединения с ковалентной связью из задания 11?
13). (8 баллов) . Расположите соединения, формулы которых
H-CO-OH, Ch4H-OH, H-OH, C6H5-OH, в порядке возрастания кислотных свойств. Объясните ответ.
14). (6 баллов) . Составьте структурные формулы не менее трёх возможных изомеров веществ состава C5h22O. Назовите эти вещества.
15). (4 балла) . Какой обьём водорода потребуется для получения 1 т аммиака?
h3S Структура Льюиса, молекулярная геометрия, гибридизация и полярность
Сероводород — это обычное химическое соединение , которое используется для анализа неорганических соединений ионов металлов. Имеет химическую формулу h3S. В молекуле два атома водорода и один атом серы. h3S также является предшественником элементарной серы. Он также играет жизненно важную роль в сигнальных путях в организме человека. Итак, чтобы понять гибридизацию, полярность и молекулярную геометрию этого соединения, важно знать его структуру Льюиса.
| Название молекулы | Дисульфид водорода ( h3S ) |
| Количество валентных электронов в молекуле | 8 |
| Гибридизация CO2 | гибридизация sp3 |
| Соединительные уголки | 104,5 градуса |
| Молекулярная геометрия CO2 | Гнутая |
Прежде чем узнать его структуру Льюиса, давайте посчитаем общее количество валентных электронов в сероводороде, поскольку эти электроны участвуют в образовании связи и помогут нам с легкостью изучить структуру Льюиса.
Валентные электроны H 2 S
Чтобы узнать общее количество валентных электронов в Сероводорода , нам нужно сложить валентные электроны атомов водорода и серы. В соединении есть два атома водорода и один атом серы.
У каждого атома водорода есть только один электрон, который также является его валентным электроном
Следовательно, у атома водорода есть два валентных электрона (как есть два атома водорода)
Сера имеет шесть валентных электронов.
Общее количество валентных электронов в h3S
= 2 (1) + 6
= 8
Таким образом, в h3S всего восемь валентных электронов.
H 2 S Структура Льюиса
Структура Льюиса любого соединения является структурным представлением валентных электронов, участвующих в образовании связи вместе с несвязывающими электронными парами. Знание структуры Льюиса данного химического соединения важно, поскольку оно дает необходимую информацию обо всех других химических свойствах соединения.
Представление отображается с помощью точек и линий, которые представляют электроны. Точки обозначают электроны, которые не участвуют в образовании связи. В то время как линии представляют связи в соединении. Структура построена на основе правила октетов . Химическое правило Октета гласит, что во внешней оболочке элемента должно быть восемь электронов, чтобы он был стабильным.
Структуру Льюиса сероводорода легко нарисовать и понять. В этом соединении оба атома водорода требуют одного электрона для создания ковалентной связи с серой.Структура Льюиса h3S подобна h3S. Сере требуется восемь электронов для выполнения требований правила октета. Но водороду требуется только один электрон, чтобы стать стабильным, поскольку он принадлежит к элементам группы 1.
Поместите атом серы в середину и расположите вокруг него валентные электроны.
Теперь поместите два атома водорода по обе стороны от центрального атома.
Здесь валентные электроны серы используются для стабилизации водорода путем передачи электронов обоим атомам водорода.В образовании связи участвуют два из шести валентных электронов.
Нарисуйте линии (для отображения связей) между атомами водорода и серы.
Остальные четыре электрона являются несвязывающими электронами и поэтому отображаются в виде точек рядом с атомом серы. Всего в этом соединении две пары несвязывающих электронов, и атомы водорода имеют полную валентную оболочку.
H 2 S Гибридизация
Чтобы понять гибридизацию h3S, необходимо прежде всего знать две вещи:
- Количество связей в соединении и его тип
Важно знать тип связывания в соединении, чтобы знать его гибридизацию.В молекуле h3S два атома водорода образуют связь с центральным атомом серы. В молекуле образуются две одинарные связи. Эти связи занимают четыре валентных электрона, и, следовательно, остаются четыре других валентных электрона. При образовании связи s-орбиталь атома водорода перекрывается с p-орбиталью атома серы. Неподеленная пара электронов занимает две из sp3-орбиталей. Две другие орбитали sp3 перекрываются с 1s-орбиталью атома водорода.
Такое расположение приводит к sp3-гибридизации молекулы h3S.Перекрытие двухгибридных орбиталей образует две сигма-связи между атомом водорода и серы.
- Стерическое число данного соединения
Стерическое число определяется как область электронной плотности, видимая вокруг центрального атома. В этом случае, поскольку сера является центральным атомом, стерическое число соединения будет совокупным количеством атомов, связанных с центральным атомом, и числом неподеленных пар электронов вокруг центрального атома.
Формула для нахождения этого числа:
Стерический номер (SN)
= Нет сигма-связей на центральном атоме + Нет одиночных пи-пар на центральном атоме
В этом случае молекулы h3S имеют две сигма-связи и две неподеленные пары электронов на центральном атоме.
Таким образом, SN молекулы h3S = 2 + 2
= 4
Поскольку стерическое число h3S равно четырем, у него два
гибридных орбиталей и две неподеленные пары электронов, которые делают его гибридизацией sp3.
Теперь, когда мы знаем структуру Льюиса и гибридизацию молекулы, легко определить ее молекулярную геометрию.
H 2 S Геометрия молекул
Гибридизация данной молекулы h3S — sp3; Атом серы находится в центре, связываясь с двумя атомами водорода, образуя валентный угол менее 180 градусов.Согласно теории VSEPR, неподеленные пары электронов отталкиваются друг от друга, но поскольку атом серы менее электроотрицателен, валентный угол уменьшается до 104,5 градусов.
Это уменьшение угла приводит к искривлению конструкции.
Другой способ узнать геометрию молекул — метод AXN. Где A обозначает центральный атом, X обозначает количество связанных пар электронов, а N обозначает неподеленную пару электронов. Здесь общая формула будет AX2N2 из-за двух пар связей и двух неподеленных пар электронов.Таким образом, эта молекула имеет изогнутую геометрию.
H 2 S Полярность
Теперь, когда у нас есть необходимая информация о молекуле, легко определить ее полярность. Полярность любой данной молекулы зависит от ее молекулярной геометрии и общей электроотрицательности. Поскольку атом серы менее электроотрицателен, общая электроотрицательность соединения составляет менее 0,4, что делает его неполярным.
Таким образом, можно сказать, что молекула h3S неполярна.
Заключительные замечания
Из приведенной выше информации можно сделать вывод, что молекула h3S имеет восемь валентных электронов, sp3-гибридизацию, изогнутую молекулярную геометрию и неполярная .
h3S Структура Льюиса, молекулярная геометрия, гибридизация и MO-диаграмма
Газообразный сероводородh3S бесцветен по своей природе. Со многими другими различными именами домашних животных, такими как кислый газ, канализационный газ и т. Д., Этот газ также ядовит и едок.
Я уверен, что вы не ожидаете хорошего запаха от этого газа! Ну да, вы правы, сероводород пахнет тухлыми яйцами !!
Молярная масса h3S составляет 34,08 г / моль, а его плотность составляет 1,363 г дм-3. Температура плавления и кипения h3S составляет -82 ℃ и -60 ℃ соответственно.
h3S имеет ковалентную связь, потому что атом серы завершает свой октет, разделяя 2 электрона с 2 атомами водорода и, таким образом, образует ковалентную связь.
Давайте проверим эти основы с объяснением структуры Льюиса h3S.
h3S Структура Льюиса
Структура Льюиса h3S приведена ниже.
Теперь, чтобы понять это, нам нужно знать, как сначала нарисовать структуру Льюиса.
Прежде всего важно определить, сколько валентных электронов присутствует в соединении.
В этом соединении валентный электрон будет иметь следующий вид:
Валентный электрон водорода = 1
2 * Атом водорода = 2
Валентный электрон серы = 6
Таким образом, общий валентный электрон = 2 + 6 = 8
Теперь следующая работа будет заключаться в обнаружении центрального атома.
Центральный атом — это, по сути, атом с наибольшим количеством центров связывания. Здесь центральным атомом будет атом серы.
После нахождения центрального атома нам нужно нарисовать скелетную структуру h3S только с одинарными связями.
Приятно знать, что структура Льюиса — это электроны и атомы, выполняющие свой октет. Каждый атом пытается выполнить свой октет, чтобы достичь стабильности.
В этом соединении сера имеет 6 электронов, поэтому для достижения октета i.е 8 электронов, нужно еще 2 электрона. Точно так же водород имеет только 1s оболочку, а его октет может быть заполнен только 2 электронами.
Таким образом, водороду нужен только 1 электрон, чтобы обрести стабильность.
Теперь следующей задачей для рисования льюисовской структуры h3S будет заполнение оставшихся электронов (после образования одинарных связей на эскизе) вокруг атома серы.
Наконец, нам нужно проверить, что все атомы имеют минимально возможный формальный заряд, чтобы завершить структуру Льюиса h3S.
Чтобы сделать все это обучение рисованию структуры Льюиса немного более простым, я набросал следующие шаги в виде маркеров,
- Узнайте общее количество валентных электронов в молекуле. Обратите внимание на знаки +, — при вычислении.
- Выберите центральный атом; обычно атом с наивысшими центрами связывания.
- Нарисуйте каркасную структуру только с одинарными связями.
- Заполните октет атомов оставшимися электронами.Не забывайте начинать с электроотрицательных атомов и переходить к электроположительным.
- Укажите кратные связи, если требуется для выполнения октета атомов.
- Наконец, убедитесь, что все атомы имеют минимально возможный формальный заряд. Вы можете рассчитать то же самое по формуле, приведенной ниже
Переходя к следующей теме, давайте немного осветим гибридизацию h3S!
h3S Гибридизация
Согласно правилу Драго, h3S не имеет гибридизации.
Правило Драго — это правило гласит, что не происходит смешения орбиталей, или мы можем сказать, что гибридизация не происходит, если разность энергий между атомными орбиталями атомов слишком велика.
Значит, гибридизации центрального атома не будет. Есть определенные условия для того, чтобы это правило вступило в силу, это —
1. Центральный атом должен присутствовать в 3-м периоде или ниже 3-го периода, по крайней мере, с одной неподеленной парой.
2. Окружающие атомы должны иметь электроотрицательность не выше 2,5.
3. В центральном атоме не должно быть положительного заряда.
Это правило действительно для 6 молекул, т.е. Ph4, Ash4, Sbh4, h3S, h3Se, h3Te
Ну, конечно, h3S соответствует всем условиям.
Центральный атом, то есть сера, находится в 3-м периоде, у него 2 неподеленные пары и нет положительного заряда. Также электроотрицательность водорода составляет 2,1.
Таким образом, это объясняет, что h3S не имеет гибридизации.
Кроме того, добавляя к этому правилу, еще одним фактором является то, что свободная орбиталь серы и 1-секундная орбиталь водорода имеют очень большую разницу в энергии.
Итак, гибридного орбитального образования нет. Таким образом, это еще одно объяснение, говорящее, что h3S не имеет гибридизации.
h3S Геометрическая структура
Молекулярная геометрия h3S искривлена.
Другой важный момент — это электронная геометрия h3S, которая является тетраэдрической.Теперь, прежде чем углубляться в разницу между этими двумя, давайте посмотрим, как их найти.
Итак, обе геометрии можно найти на диаграмме VSEPR. График прилагается ниже!
Из этой диаграммы мы можем видеть, что h3S представляет собой молекулу типа AX2E2, где X представляет окружающие атомы, а E представляет неподеленные пары центрального атома.
Таким образом, можно сказать, что молекулярная геометрия h3S искривлена.
Переходя к разнице между электронной и молекулярной геометрией.
В основном, геометрия молекул учитывает только атомы молекул при определении формы. В то время как электронная геометрия учитывает все присутствующие электроны.
Более поздний также рассматривает неподеленную пару, что приводит к основному различию в форме.
Еще один момент, о котором следует помнить, заключается в том, что отталкивание между двумя неподеленными парами в h3S также играет важную роль в создании его изогнутой молекулярной геометрии.
Отталкивание изменяет форму пар связей с прямой на изогнутую.
Все это объясняет молекулярную геометрию h3S.
Схема молекулярных орбиталей h3S (МО)
Диаграмму молекулярных орбиталей h3S можно объяснить следующим образом.
Это MO-диаграмма h3S. Левая часть будет содержать атомные орбитали серы, то есть 3s2 3px2 3py1 3pz1.
А справа будут атомные орбитали водорода.
На орбиталях МО заполнено 8 валентных электронов.Также присутствуют две несвязывающие орбитали. Антисвязывающие орбитали пусты, а связывающие орбитали заполнены.
Из МО-диаграммы h3S мы также можем узнать о порядке связи, длине связи и стабильности связи в соединении.
Также следует иметь в виду, что вакантные орбитали серы и единицы водорода имеют большую разницу в энергии. Но диаграмма МО может быть сформирована и после этого!
позволяет нам также изучить методы приготовления h3S в подразделе ниже.
Полярность h3S
Молекула h3S считается полярной молекулой, так как молекула имеет изогнутую форму. Диполь по обеим связям H-S не компенсирует друг друга и имеет общий дипольный момент.
Для подробностей прошу еще раз прочитать статью о полярности h3S.
h3S Препарат
Сероводород может производиться разными способами, некоторые из них:
Самый распространенный способ — приготовление из высокосернистого газа (любого газа с высоким содержанием h3S).
Сероводород можно получить путем обработки водорода расплавом элементарной серы при температуре ~ 450 ℃.
Лабораторная подготовка — Реакция сульфида железа и сильной кислоты в генераторе Киппа.
FeS + 2HCl ——-> FeCl2 + h3S
Другой качественный анализ, в котором тиоацетамид используется для производства h3S.
Ch4C (S) Nh3 + h3O ———> Ch4C (O) Nh3 + h3S
6 h3O + Al2S3 ——–> 3h3S +2 Al (OH) 3 — еще одна реакция образования сероводорода.
Теперь мы все знаем, что h3S используется во многих реакциях для образования различных соединений.
Для легкого понимания этих реакций нам нужно сначала иметь представление о структуре, связывании и гибридизации сероводорода, которые описаны выше!
Заключение
Эта статья вращается вокруг структуры Льюиса, гибридизации, связывания h3S. Об этих вещах очень важно знать, чтобы мы могли беспрепятственно изучать уравнения, включающие h3S.
Надеюсь, после прочтения статьи вы немного узнали об этом соединении. Хотя есть чему поучиться, полезно идти шаг за шагом! В конце концов, химия — это очень обширный предмет!
Если у вас есть какие-либо вопросы по любой теме этой статьи, не стесняйтесь спрашивать меня в любое время!
8.2 Гибридные атомные орбитали — Химия
Цели обучения
К концу этого раздела вы сможете:
- Объясните концепцию гибридизации атомных орбиталей
- Определить гибридные орбитали, связанные с различной молекулярной геометрией
Рассмотрение в терминах перекрывающихся атомных орбиталей — один из способов объяснить, как образуются химические связи в двухатомных молекулах.Однако, чтобы понять, как молекулы с более чем двумя атомами образуют стабильные связи, нам нужна более подробная модель. В качестве примера рассмотрим молекулу воды, в которой один атом кислорода связан с двумя атомами водорода. Кислород имеет электронную конфигурацию 1 s 2 2 s 2 2 p 4 , с двумя неспаренными электронами (по одному в каждой из двух орбиталей p ). Теория валентной связи предсказывает, что две связи O – H образуются в результате перекрытия этих двух 2 p орбиталей с 1 s орбиталями атомов водорода.Если бы это было так, угол связи был бы 90 °, как показано на рисунке 1, потому что p орбитали перпендикулярны друг другу. Экспериментальные данные показывают, что валентный угол составляет 104,5 °, а не 90 °. Предсказание модели теории валентных связей не соответствует реальным наблюдениям за молекулой воды; нужна другая модель.
Рис. 1. Гипотетическое перекрытие двух из 2 орбиталей p на атоме кислорода (красный) с 1 s орбиталями двух атомов водорода (синий) дало бы угол связи 90 °.Это не согласуется с экспериментальными данными.Квантово-механические расчеты показывают, почему наблюдаемые валентные углы в H 2 O отличаются от предсказанных перекрытием орбиталей 1 s атомов водорода с 2 p орбиталями атома кислорода. Математическое выражение, известное как волновая функция, ψ , содержит информацию о каждой орбитали и волнообразных свойствах электронов в изолированном атоме. Когда атомы связаны в молекулу, волновые функции объединяются, чтобы произвести новые математические описания, которые имеют разные формы.Этот процесс объединения волновых функций для атомных орбиталей называется гибридизацией и математически выполняется с помощью линейной комбинации атомных орбиталей , LCAO (метод, с которым мы снова столкнемся позже). Новые орбитали, которые возникают в результате, называются гибридными орбиталями . Валентные орбитали в изолированном атоме кислорода представляют собой 2 орбитали s и три 2 орбитали p . Валентные орбитали в атоме кислорода в молекуле воды различаются; они состоят из четырех эквивалентных гибридных орбиталей, которые указывают приблизительно на углы тетраэдра (рис. 2).Следовательно, перекрытие орбиталей O и H должно приводить к тетраэдрическому валентному углу (109,5 °). Наблюдаемый угол 104,5 ° является экспериментальным свидетельством того, что квантово-механические расчеты дают полезное объяснение: теория валентных связей должна включать компонент гибридизации, чтобы давать точные предсказания.
Рис. 2. (a) Молекула воды имеет четыре области электронной плотности, поэтому теория VSEPR предсказывает тетраэдрическое расположение гибридных орбиталей. (b) Две гибридные орбитали на кислороде содержат неподеленные пары, а две другие перекрываются с 1 s орбиталями атомов водорода, образуя связи O – H в H 2 O.Это описание больше соответствует экспериментальной структуре.Следующие идеи важны для понимания гибридизации:
- Гибридные орбитали не существуют в изолированных атомах. Они образуются только в атомах с ковалентной связью.
- Гибридные орбитали имеют форму и ориентацию, которые сильно отличаются от атомных орбиталей в изолированных атомах.
- Набор гибридных орбиталей создается путем объединения атомных орбиталей. Количество гибридных орбиталей в наборе равно количеству атомных орбиталей, которые были объединены для создания набора.
- Все орбитали в наборе гибридных орбиталей эквивалентны по форме и энергии.
- Тип гибридных орбиталей, образующихся в связанном атоме, зависит от геометрии его электронных пар, как предсказывает теория VSEPR.
- Гибридные орбитали перекрываются, образуя σ-связи. Негибридизованные орбитали перекрываются, образуя π-связи.
В следующих разделах мы обсудим общие типы гибридных орбиталей.
Атом бериллия в газообразной молекуле BeCl 2 является примером центрального атома без неподеленных пар электронов в линейном расположении трех атомов.В молекуле BeCl 2 имеются две области валентной электронной плотности, соответствующие двум ковалентным связям Be – Cl. Чтобы разместить эти два электронных домена, две из четырех валентных орбиталей атома Be смешиваются, образуя две гибридные орбитали. Этот процесс гибридизации включает смешивание валентной s орбитали с одной из валентных p орбиталей с получением двух эквивалентных гибридных орбиталей sp , которые ориентированы в линейной геометрии (рис. 3).На этом рисунке набор орбиталей sp похож по форме на исходную орбиталь p , но есть важное отличие. Количество объединенных атомных орбиталей всегда равно количеству образованных гибридных орбиталей. Орбиталь p — это одна орбиталь, которая может удерживать до двух электронов. Набор sp представляет собой две эквивалентные орбитали, расположенные на 180 ° друг от друга. Два электрона, которые первоначально находились на орбите s , теперь распределяются по двум орбиталям sp , которые заполнены наполовину.В газообразном BeCl 2 эти наполовину заполненные гибридные орбитали будут перекрываться с орбиталями атомов хлора с образованием двух идентичных σ-связей.
Рис. 3. Гибридизация орбитали s (синий) и орбитали p (красный) одного и того же атома дает две гибридные орбитали sp (фиолетовый). Каждая гибридная орбиталь ориентирована в основном только в одном направлении. Обратите внимание, что каждая орбиталь sp содержит одну долю, которая значительно больше другой.Набор из двух орбиталей sp ориентирован на 180 °, что согласуется с геометрией двух доменов.Мы проиллюстрируем электронные различия в изолированном атоме Be и в связанном атоме Be на диаграмме орбитальных уровней энергии на рисунке 4. Эти диаграммы представляют каждую орбиталь горизонтальной линией (указывающей ее энергию) и каждый электрон стрелкой. Энергия увеличивается к верху диаграммы. Мы используем одну стрелку, направленную вверх, чтобы указать один электрон на орбитали, и две стрелки (вверх и вниз), чтобы указать два электрона с противоположным спином.
Рис. 4. На этой диаграмме орбитальных уровней энергии показаны sp гибридизированные орбитали на Be в линейной молекуле BeCl 2 . Каждая из двух гибридных орбиталей sp удерживает один электрон и, таким образом, наполовину заполнена и доступна для связывания через перекрытие с орбиталью Cl 3 p .Когда атомные орбитали гибридизуются, валентные электроны занимают вновь созданные орбитали. У атома Be было два валентных электрона, поэтому каждая из орбиталей sp получает один из этих электронов.Каждый из этих электронов соединяется с неспаренным электроном на атоме хлора, когда гибридная орбиталь и орбиталь хлора перекрываются во время образования связей Be – Cl.
Любой центральный атом, окруженный всего двумя областями валентной электронной плотности в молекуле, будет проявлять гибридизацию sp . Другие примеры включают атом ртути в линейной молекуле HgCl 2 , атом цинка в Zn (CH 3 ) 2 , который содержит линейное расположение C – Zn – C, и атомы углерода в HCCH и CO 2 .
Посетите веб-сайт Университета Висконсин-Ошкош, чтобы узнать о трехмерной визуализации гибридных орбиталей.
Валентные орбитали центрального атома, окруженные тремя областями электронной плотности, состоят из набора из трех гибридных орбиталей sp 2 и одной негибридизированной орбитали p . Такое расположение является результатом гибридизации sp 2 , смешивания одной орбитали s и двух орбиталей p для получения трех идентичных гибридных орбиталей, ориентированных в тригональной плоской геометрии (рис. 5).
Рисунок 5. Гибридизация орбитали s (синий) и двух орбиталей p (красный) дает три эквивалентных sp 2 гибридизированных орбиталей (фиолетовый), ориентированных под углом 120 ° относительно друг друга. Оставшаяся негибридизованная орбиталь p здесь не показана, но расположена вдоль оси z.Хотя квантовая механика дает «пухлые» орбитальные лепестки, как показано на рисунке 5, иногда для ясности эти орбитали рисуются тоньше и без малых лепестков, как на рисунке 6, чтобы не заслонять другие особенности данной иллюстрации.Мы будем использовать эти «более тонкие» представления всякий раз, когда истинное представление слишком тесное, чтобы его можно было легко визуализировать.
Рис. 6. Этот альтернативный способ рисования тригональных плоских sp 2 гибридных орбиталей иногда используется на более скученных фигурах.Наблюдаемая структура молекулы борана, BH 3, предполагает sp 2 гибридизацию бора в этом соединении. Молекула тригонально плоская, а атом бора участвует в трех связях с атомами водорода (рис. 7).Мы можем проиллюстрировать сравнение орбиталей и распределения электронов в изолированном атоме бора и в связанном атоме в BH 3 , как показано на диаграмме орбитальных энергетических уровней на рисунке 8. Мы перераспределяем три валентных электрона атома бора в трех sp 2 гибридных орбиталей, и каждый электрон бора соединяется с электроном водорода при образовании связей B – H.
Рис. 7. BH 3 — электронодефицитная молекула с тригональной плоской структурой. Рис. 8. В изолированном атоме B есть одна 2 s и три 2 p валентных орбитали. Когда бор находится в молекуле с тремя областями электронной плотности, три орбитали гибридизуются и создают набор из трех орбиталей sp 2 орбиталей и одной негибридизированной орбитали 2 p . Каждая из трех наполовину заполненных гибридных орбиталей перекрывается с орбиталью атома водорода, образуя три σ-связи в BH 3 .Любой центральный атом, окруженный тремя областями электронной плотности, будет демонстрировать sp 2 гибридизацию.Сюда входят молекулы с неподеленной парой на центральном атоме, такие как ClNO (рис.9), или молекулы с двумя одинарными связями и двойной связью, соединенными с центральным атомом, как в формальдегиде, CH 2 O, и этене, H 2 УГК 2 .
Рисунок 9. Центральный атом (атомы) в каждой из показанных структур содержит три области электронной плотности и гибридизирован по sp 2 . Как мы знаем из обсуждения теории VSEPR, область электронной плотности содержит все электроны, которые направлены в одном направлении.Неподеленная пара, неспаренный электрон, одинарная связь или множественная связь каждая будет считаться одной областью электронной плотности.Валентные орбитали атома, окруженного тетраэдрическим расположением пар связей и неподеленных пар, состоят из набора из четырех sp 3 гибридных орбиталей . Гибриды являются результатом смешения одной орбитали s и всех трех орбиталей p , что дает четыре идентичных гибридных орбитали sp 3 (рис. 10).Каждая из этих гибридных орбиталей указывает на разные углы тетраэдра.
Рис. 10. Гибридизация орбитали s (синий) и трех орбиталей p (красный) дает четыре эквивалентных sp 3 гибридизированных орбиталей (фиолетовый), ориентированных под углом 109,5 ° относительно друг друга.Молекула метана, CH 4 , состоит из атома углерода, окруженного четырьмя атомами водорода по углам тетраэдра. Атом углерода в метане демонстрирует sp 3 гибридизацию.Мы проиллюстрировали орбитали и распределение электронов в изолированном атоме углерода и в связанном атоме в CH 4 на рисунке 11. Четыре валентных электрона атома углерода равномерно распределены в гибридных орбиталях, и каждый электрон углерода соединяется с водородом. электрон при образовании связей C – H.
Рис. 11. Четыре валентные атомные орбитали от изолированного атома углерода все гибридизуются, когда углерод связывается в молекуле, такой как CH 4 , с четырьмя областями электронной плотности.Это создает четыре эквивалентных sp 3 гибридизированных орбиталей. Перекрытие каждой из гибридных орбиталей с водородной орбиталью создает связь C – H σ.В молекуле метана 1 s орбиталь каждого из четырех атомов водорода перекрывается с одной из четырех sp 3 орбиталей атома углерода с образованием сигма (σ) -связи. Это приводит к образованию четырех сильных эквивалентных ковалентных связей между атомом углерода и каждым из атомов водорода с образованием молекулы метана, CH 4 .
Структура этана, C 2 H 6, подобна структуре метана в том, что каждый углерод в этане имеет четыре соседних атома, расположенных по углам тетраэдра — три атома водорода и один атом углерода (рис. 12) . Однако в этане орбиталь sp 3 одного атома углерода перекрывается встык с орбиталью sp 3 второго атома углерода, образуя σ-связь между двумя атомами углерода. Каждая из оставшихся sp 3 гибридных орбиталей перекрывается с орбиталью s атома водорода с образованием σ-связей углерод-водород.Структура и общий контур связывающих орбиталей этана показаны на рисунке 12. Ориентация двух групп CH 3 не является фиксированной относительно друг друга. Экспериментальные данные показывают, что вращение вокруг σ-связей происходит легко.
Рис. 12. (a) В молекуле этана, C 2 H 6 , каждый углерод имеет четыре sp 3 орбиталей. (б) Эти четыре орбитали перекрываются, образуя семь σ-связей.Гибридная орбиталь sp 3 также может содержать неподеленную пару электронов.Например, атом азота в аммиаке окружен тремя парами связей и неподеленной парой электронов, направленной к четырем углам тетраэдра. Атом азота sp 3 гибридизован с одной гибридной орбиталью, занятой неподеленной парой.
Молекулярная структура воды соответствует тетраэдрическому расположению двух неподеленных пар и двух связанных пар электронов. Таким образом, мы говорим, что атом кислорода sp 3 гибридизирован, причем две гибридные орбитали заняты неподеленными парами, а две — связующими парами.Поскольку неподеленные пары занимают больше места, чем соединяющие пары, структуры, содержащие неподеленные пары, имеют валентные углы, слегка искаженные от идеала. Совершенные тетраэдры имеют углы 109,5 °, но наблюдаемые углы в аммиаке (107,3 °) и воде (104,5 °) немного меньше. Другие примеры гибридизации sp 3 включают CCl 4 , PCl 3 и NCl 3 .
Чтобы описать пять связывающих орбиталей в тригонально-бипирамидальном расположении, мы должны использовать пять атомных орбиталей валентной оболочки (орбиталь s , три орбитали p и одна из орбиталей d ), что дает пять sp 3 d гибридные орбитали .При октаэдрическом расположении шести гибридных орбиталей мы должны использовать шесть атомных орбиталей валентной оболочки (орбиталь s , три орбитали p и две орбитали d в ее валентной оболочке), что дает шесть sp 3 d 2 гибридные орбитали . Эти гибридизации возможны только для атомов, которые имеют d орбиталей в своих валентных подоболочках (то есть не в первом или втором периоде).
В молекуле пентахлорида фосфора, PCl 5 , есть пять связей P – Cl (таким образом, пять пар валентных электронов вокруг атома фосфора), направленных к углам тригональной бипирамиды. Мы используем 3 орбитали s , три орбитали 3 p и одну из 3 орбиталей d , чтобы сформировать набор из пяти задействованных гибридных орбиталей sp 3 d (Рисунок 14). в связях P – Cl. Другие атомы, которые демонстрируют гибридизацию sp 3 d , включают атом серы в SF 4 и атомы хлора в ClF 3 и в ClF 4 + .(Электроны на атомах фтора для ясности опущены.)
Рис. 13. Три изображенных соединения демонстрируют sp 3 d гибридизацию в центральном атоме и тригональной бипирамидной форме. SF4 и ClF 4 + имеют одну неподеленную пару электронов на центральном атоме, а ClF 3 имеет две неподеленные пары, придающие ему показанную Т-образную форму. Рис. 14. (a) Для пяти областей электронной плотности вокруг фосфора в PCl 5 требуется пять гибридных sp 3 d орбиталей.(b) Эти орбитали объединяются, образуя тригонально-бипирамидальную структуру, при этом каждая большая доля гибридной орбитали указывает на вершину. Как и раньше, есть небольшие лепестки, указывающие в противоположном направлении для каждой орбитали (не показаны для ясности).Атом серы в гексафториде серы, SF 6 , демонстрирует sp 3 d 2 гибридизацию. Молекула гексафторида серы имеет шесть пар связей электронов, соединяющих шесть атомов фтора с одним атомом серы.На центральном атоме нет неподеленных пар электронов. Чтобы связать шесть атомов фтора, 3 орбитали s , 3 орбитали p и две из 3 орбиталей d образуют шесть эквивалентных sp 3 d 2 гибридных орбиталей, каждая из которых направлена к другому углу октаэдра. Другие атомы, которые проявляют sp 3 d 2 гибридизацию, включают атом фосфора в PCl 6 —, атом йода в межгалогенах IF 6 + , IF 5 , IC 4 —, IF 4 — и атом ксенона в XeF 4 .
Рисунок 15. (a) Гексафторид серы, SF 6 , имеет октаэдрическую структуру, которая требует sp 3 d 2 гибридизации. (b) Шесть орбиталей sp 3 d 2 образуют октаэдрическую структуру вокруг серы. Опять же, малая доля каждой орбиты не показана для ясности.Гибридизация атома определяется на основе количества окружающих его областей электронной плотности.Геометрические конфигурации, характерные для различных наборов гибридных орбиталей, показаны на рисунке 16. Эти расположения идентичны геометриям электронных пар, предсказываемым теорией VSEPR. Теория VSEPR предсказывает формы молекул, а теория гибридных орбиталей дает объяснение того, как эти формы формируются. Чтобы найти гибридизацию центрального атома, мы можем использовать следующие рекомендации:
- Определите структуру Льюиса молекулы.
- Определите количество областей электронной плотности вокруг атома, используя теорию VSEPR, в которой одинарные связи, множественные связи, радикалы и неподеленные пары считаются как одна область.
- Назначьте набор гибридизированных орбиталей из рисунка 16, который соответствует этой геометрии.
Важно помнить, что гибридизация была разработана, чтобы рационализировать экспериментально наблюдаемую молекулярную геометрию.Модель хорошо работает для молекул, содержащих небольшие центральные атомы, в которых пары валентных электронов расположены близко друг к другу в пространстве. Однако для более крупных центральных атомов электронные пары валентной оболочки удалены от ядра, и отталкивания меньше. Их соединения демонстрируют структуры, которые часто не согласуются с теорией VSEPR, и гибридизированные орбитали не являются необходимыми для объяснения наблюдаемых данных. Например, мы обсудили валентный угол H – O – H в H 2 O, 104,5 °, что более согласуется с sp 3 гибридными орбиталями (109.5 °) на центральном атоме, чем с 2 p орбиталями (90 °). Сера находится в той же группе, что и кислород, и H 2 S имеет аналогичную структуру Льюиса. Однако он имеет гораздо меньший валентный угол (92,1 °), что указывает на гораздо меньшую гибридизацию на сере, чем на кислороде. Продолжая вниз по группе, теллур даже больше, чем сера, и для H 2 Te наблюдаемый валентный угол (90 °) согласуется с перекрытием орбиталей 5 p без включения гибридизации. Мы обращаемся к гибридизации там, где необходимо объяснить наблюдаемые структуры.
Пример 1
Назначение гибридизации
Сульфат аммония важен как удобрение. Что такое гибридизация атома серы в сульфат-ионе SO 4 2-?
Раствор
Структура Льюиса сульфата показывает, что существует четыре области электронной плотности. Гибридизация — sp 3 .
Проверьте свои знания
Что такое гибридизация атома селена в SeF 4 ?
Ответ:
Атом селена sp 3 d гибридизированный.
Пример 2
Назначение гибридизации
Мочевина, NH 2 C (O) NH 2 , иногда используется в качестве источника азота в удобрениях. Как происходит гибридизация каждого атома азота и углерода в мочевине?
Раствор
Структура Льюиса мочевины —
Атомы азота окружены четырьмя областями электронной плотности, которые образуют тетраэдрическую геометрию электронных пар. Гибридизация в тетраэдрическом расположении: sp 3 (рис. 16).Это гибридизация атомов азота в мочевине.
Атом углерода окружен тремя областями электронной плотности, расположенными в тригональной плоскости. Гибридизация в геометрии тригональной плоской пары электронов имеет вид sp 2 (рис. 16), что представляет собой гибридизацию атома углерода в мочевине.
Проверьте свои знания
Уксусная кислота, H 3 CC (O) OH, представляет собой молекулу, придающую уксусу его запах и кислый вкус.Что такое гибридизация двух атомов углерода в уксусной кислоте?
Ответ:
H 3 C , sp 3 ; C (O) OH, sp 2
Мы можем использовать гибридные орбитали, которые представляют собой математические комбинации некоторых или всех валентных атомных орбиталей, для описания электронной плотности вокруг ковалентно связанных атомов. Эти гибридные орбитали либо образуют сигма (σ) -связи, направленные к другим атомам молекулы, либо содержат неподеленные пары электронов.Мы можем определить тип гибридизации вокруг центрального атома по геометрии областей электронной плотности вокруг него. Две такие области подразумевают гибридизацию sp ; три, sp 2 гибридизация; четыре, sp 3 гибридизация; пять, sp 3 d гибридизация; и шесть, sp 3 d 2 гибридизация. Связи Pi (π) образуются из негибридизованных атомных орбиталей ( p или d орбиталей).
Химия: упражнения в конце главы
- Почему концепция гибридизации требуется в теории валентных связей?
- Придайте форму, описывающую каждый гибридный орбитальный набор:
(а) сп 2
(б) з 3 д
(c) sp
(d) sp 3 d 2
- Объясните, почему атом углерода не может образовывать пять связей, используя гибридные орбитали sp 3 d .
- Какова гибридизация центрального атома в каждом из следующих элементов?
(а) BeH 2
(б) SF 6
(в) PO 4 3-
(г) PCl 5
- Молекула с формулой AB 3 может иметь одну из четырех различных форм. Придайте форму и гибридизацию центрального атома A для каждого из них.
- Метионин, CH 3 SCH 2 CH 2 CH (NH 2 ) CO 2 H, это аминокислота, обнаруженная в белках.Нарисуйте структуру Льюиса этого соединения. Каков тип гибридизации каждого углерода, кислорода, азота и серы?
- Серная кислота производится в результате серии реакций, представленных следующими уравнениями: [латекс] \ text {S} _8 (s) + 8 \ text {O} _2 (g) \ longrightarrow 8 \ text {SO} _2 (g ) [/ latex]
[латекс] 2 \ text {SO} _2 (g) + \ text {O} _2 (g) \ longrightarrow 2 \ text {SO} _3 (g) [/ latex]
[латекс] \ текст {SO} _3 (g) + \ text {H} _2 \ text {O} (l) \ longrightarrow \ text {H} _2 \ text {SO} _4 (l) [/ latex]Изобразите структуру Льюиса, спрогнозируйте молекулярную геометрию с помощью VSEPR и определите гибридизацию серы для следующего:
(а) круговая S 8 молекула
(б) SO 2 молекула
(c) SO 3 молекула
(г) H 2 SO 4 молекула (атомы водорода связаны с атомами кислорода)
- Два важных промышленных химиката, этен, C 2 H 4 , и пропен, C 3 H 6 , производятся в процессе парового (или термического) крекинга:
[латекс] 2 \ text {C} _3 \ text {H} _8 (g) \ longrightarrow \ text {C} _2 \ text {H} _4 (g) + \ text {C} _3 \ text {H} _6 (g) + \ text {CH} _4 (g) + \ text {H} _2 (g) [/ латекс]
Для каждого из четырех углеродных соединений выполните следующие действия:
(a) Нарисуйте структуру Льюиса.
(b) Предскажите геометрию атома углерода.
(c) Определите гибридизацию каждого типа атома углерода.
- В течение многих лет после их открытия считалось, что благородные газы не могут образовывать соединения. Теперь мы знаем, что это мнение неверно. Смесь газов ксенона и фтора, помещенная в кварцевую колбу и помещенная на подоконник, медленно образует белое твердое вещество. Анализ соединения показывает, что оно содержит 77,55% Xe и 22.45% F по массе.
(а) Какова формула соединения?
(b) Напишите структуру Льюиса для соединения.
(c) Предскажите форму молекул соединения.
(d) Какая гибридизация соответствует предсказанной вами форме?
- Рассмотрим азотистую кислоту, HNO 2 (HONO).
(а) Напишите структуру Льюиса.
(b) Каковы электронная пара и молекулярная геометрия внутренних атомов кислорода и азота в молекуле HNO 2 ?
(c) Какова гибридизация внутренних атомов кислорода и азота в HNO 2 ?
- Спички с нанесением ударов в любом месте содержат слой KClO 3 и слой P 4 S 3 .Тепло, создаваемое трением при ударе спички, заставляет эти два соединения бурно реагировать, что поджигает деревянный стержень спички. KClO 3 содержит ион ClO 3 —. P 4 S 3 — необычная молекула со скелетной структурой.
(a) Запишите структуры Льюиса для P 4 S 3 и ClO 3 — иона.
(b) Опишите геометрию атомов P, S и Cl в этих разновидностях.
(c) Назначьте гибридизацию атомам P, атому S и атому Cl в этих разновидностях.
(d) Определите степени окисления и формальный заряд атомов в ионе P 4 S 3 и ионе ClO 3 —.
- Определите гибридизацию каждого атома углерода в следующей молекуле. (Дано расположение атомов; необходимо определить, сколько связей соединяет каждую пару атомов.)
- Запишите структуры Льюиса для NF 3 и PF 5 .На основе гибридных орбиталей объясните тот факт, что NF 3 , PF 3 и PF 5 являются стабильными молекулами, а NF 5 не существует.
- Помимо NF 3 известны два других фторпроизводных азота: N 2 F 4 и N 2 F 2 . Какие формы вы предсказываете для этих двух молекул? Какова гибридизация азота в каждой молекуле?
Глоссарий
- гибридный орбитальный
- орбиталь, созданная объединением атомных орбиталей на центральном атоме
- гибридизация
- модель, которая описывает изменения атомных орбиталей атома, когда он образует ковалентное соединение
- sp гибридный орбитальный
- одна из двух орбиталей с линейным расположением, полученная в результате объединения одной s и одной p орбитальной
- sp 2 гибридный орбитальный
- одна из трех орбиталей с тригонально-планарным расположением, полученная в результате объединения одной s и двух p орбиталей
- sp 3 гибридный орбитальный
- одна из четырех орбиталей с тетраэдрическим расположением, полученная в результате объединения одной s и трех p орбиталей
- sp 3 d гибридный орбитальный
- одна из пяти орбиталей с тригонально-бипирамидальным расположением, которое получается в результате объединения одной s , трех p и одной d орбитальной
- sp 3 d 2 гибридный орбитальный
- одна из шести орбиталей с октаэдрическим расположением, которая получается в результате объединения одной s , трех p и двух d орбиталей
Решения
Ответы на упражнения в конце главы по химии
1.Гибридизация вводится для объяснения геометрии связывающих орбиталей в теории валентных облигаций.
3. В валентной оболочке углерода нет орбиталей d .
5. тригонально планарная, пр 2 ; тригонально-пирамидальный (одна неподеленная пара на A) sp 3 ; Т-образный (две отдельные пары на A sp 3 d , или (три отдельные пары на A) sp 3 d 2
7.(a) Каждая S имеет изогнутую (109 °) геометрию, sp 3
(б) Изогнутый (120 °), з. 2
(в) Тригональная планарная, пр 2
(г) Тетраэдрическая, пр 3
9. а) XeF 2
(б)
(c) линейный (d) sp 3 d
11. (а)
(б) атомы P, тригонально-пирамидальные; Атомы S, изогнутые, с двумя неподеленными парами; Атомы Cl, тригонально-пирамидальные; (c) Гибридизация P, S и Cl во всех случаях представляет собой sp 3 ; (d) Степени окисления P +1, [латекс] \ text {S} — 1 \ frac {1} {3} [/ latex], Cl +5, O –2.Официальные сборы: P 0; S 0; Cl +2: O –1
13.
Фосфор и азот могут образовывать sp 3 гибридов с образованием трех связей и удерживать одну неподеленную пару в PF 3 и NF 3 соответственно. Однако азот не имеет валентности d орбиталей, поэтому он не может образовать набор из sp 3 d гибридных орбиталей для связывания пяти атомов фтора в NF 5 . Фосфор имеет d орбиталей и может связывать пять атомов фтора с sp 3 d гибридными орбиталями в PF 5 .
h3S Молекулярная / электронная геометрия, точечная структура Sh3 Льюиса, угол связи
h3S Структура Льюиса содержит два атома водорода и один атом серы. Сера является центральным атомом и содержит 2 неподеленные пары, тогда как оба водорода соединены с центральным атомом с помощью одинарной связи.
Структура Sh3 по Льюису действительно полезна для определения его электронной геометрии, формы молекулы, количества общих пар и электронов неподеленной пары.
Выполните следующие шаги, чтобы нарисовать структуру точек Льюиса для h3S
Шаг 1: На первом шаге определите полное валентное количество электронов, присутствующих в h3S.Как мы знаем, водород имеет только один валентный электрон в своей последней оболочке, а сера принадлежит к 16-й группе в периодической таблице, поэтому он содержит 6 электронов в своей последней оболочке.
⇒ Валентный электрон водорода = 1 × 2 = 2
⇒ Валентный электрон серы = 6
∴ Полный валентный электрон, доступный для структуры Льюиса h3S = 6 + 2 = 8
Шаг 2: Найдите центральный атом для рисования точечной структуры Льюиса для h3S. Чтобы определить центральный атом в молекуле h3S, у вас есть два способа.
- Найдите центральный атом, найдя атом с наименьшей электроотрицательностью в молекуле h3S. Очевидно, сера имеет меньшую электроотрицательность по сравнению с водородом, потому что водород имеет более высокую тенденцию к притяжению электронов, а водороду требуется только еще один электрон для выполнения своего правила октета и валентной оболочки, следовательно, он достигает большей стабильности.
- Поместите в центр атом с большей валентностью. Очевидно, сера имеет валентную силу 6, а водород — только 1. Таким образом, сера должна располагаться в центре точечной структуры Льюиса h3S.
Шаг 3: Теперь постройте структуру h3S, соединив одинарную связь с центральным атомом.
Шаг 4: После размещения центрального атома и соединения с ним одинарной связью мы должны выполнить правило октетов для каждого атома в h3S, чтобы поддержать последнее требование структуры Льюиса h3S.
Так как водороду нужно два электронов для выполнения своего правила октетов, а водороду нужно 8 электронов для выполнения правила октетов.
Внешняя оболочка водорода уже заполнена из-за двух электронов, находящихся в одинарной связи. Итак, нет необходимости размещать электроны вокруг водорода.
Теперь для Sulphur нам нужно 8 электронов, но только 4 электрона разделяются с помощью двух одинарных связей. Итак, мы должны разместить еще 4 электрона вокруг серы, чтобы завершить ее правило октетов и выполнить критерии для рисования точечной структуры Льюиса для Sh3.
Точечная структура Льюиса для h3S или Sh3
Шаг 5: Теперь, на последнем этапе, минимизируйте заряды на атоме h3S, преобразовывая одиночные пары в общую связь.Но на атоме нет заряда, поэтому нет необходимости создавать какие-либо общие связи.
Эта структура Льюиса также называется структурой Льюиса дигидросульфида или структурой Льюиса моносульфида дигидрогена.
Гибридизация h3S
Чтобы рассчитать гибридизацию h3S Просто выполните 3 простых шага.
1. Найдите количество атомов, присоединенных к центральному атому, с помощью точечной структуры h3S Льюиса. Ясно, что в структуре Льюиса к сере присоединены только два атома.
2. Подсчитайте одиночные пары на этом центральном атоме. Итак, вокруг серы присутствует 4 электрона, а это значит, что у серы две неподеленные пары.
3. Добавьте число присоединенного атома к центральному атому + неподеленные пары этого центрального атома
∴ 2 + 2 = 4
Итак, 4 означает, что гибридизация h3S является Sp³.
h3S Структура Льюиса и молекулярная геометрия
Сероводород (H 2 S) — бесцветный токсичный газ. В структуре h3S Lewis есть два атома водорода по обе стороны от центрального атома серы.
| Название молекулы | Сероводород (H 2 S) |
| Углы скрепления | 92,1 ° |
| Сероводород Геометрия молекулы | Изогнутая форма |
| Молярная масса | 34,1 г / моль |
| Валентные электроны | 8 |
Пошаговая структура 76 Построение Lew Ниже приведены шаги для построения структуры Льюиса.
Шаг-1:
Подсчитайте валентные электроны атомовЧтобы нарисовать структуру Льюиса, нам нужно вычислить количество валентных электронов в отдельных атомах, как показано в таблице ниже.
| Atom | Электронная конфигурация | Валентные электроны (VE s) |
| 16 S | 3s 2 2s6 2 2s 6 2s 2 3p 4 | 6 |
| 1 H | 1s 1 | 1 |
Валентные электроны в H 2 S = VE
0 в сере VEs = 2 (1) +6H 2 S валентные электроны = 8 электронов
Шаг 2:
Определите центральный атом Если мы сравним значения электроотрицательности H и S в периодической таблице, мы будем обнаружили, что значение электроотрицательности водорода наименьшее.
Как правило, водород должен быть в центре структуры, но H не может служить центральными атомами в структуре Льюиса.
Водород (1s1) нуждается только в одном электроне для завершения своей валентной оболочки. Таким образом, он может связываться только с одним другим атомом и не имеет доступных d-орбиталей для расширения его валентных оболочек.
Следовательно, в структуре Льюиса H 2 сера находится посередине и распределяет валентные электроны вокруг себя.
Затем поместите два атома водорода по обе стороны от центрального атома серы.
Шаг 3:
Поместите электронные пары между атомамиСера отдает электроны обоим соседним атомам водорода, чтобы сделать водород стабильным. В образовании связи участвуют два из шести валентных электронов. Каждая линия на рисунке показывает одинарную связь.
Шаг 4: Поместите оставшиеся электроны вокруг других атомов
Оставшиеся четыре электрона представляют собой неподеленные пары электронов и поэтому отображаются в виде точек рядом с атомом серы.Всего в этом соединении две пары несвязывающих электронов, и атомы водорода имеют полную валентную оболочку.
Молекулярная геометрия
Гибридизация H 2 Молекула S является sp3; Атом серы находится в центре, связываясь с двумя атомами водорода, образуя валентный угол менее 180 градусов.
Наличие двух несвязанных пар электронов заставляет молекулу изгибаться.
Поскольку сера более электроотрицательна, чем водород, это делает молекулу слегка полярной.
Векторная сумма дипольных моментов связей в H 2 S дает ненулевой полный дипольный момент.
В результате сероводород проявляет диполь-дипольные взаимодействия.
h3S Структура Льюиса — Ключевые моменты
- Сероводород — бесцветный токсичный газ
- Он выделяется из канализации и является побочным продуктом промышленных процессов
- При низких концентрациях пахнет тухлыми яйцами
- Растворим в воде и многие другие жидкости. При растворении в воде образует сероводородную кислоту.
- Он очень взрывоопасен и требует концентрации только 4% для мгновенного возгорания при воздействии относительно холодного источника тепла с температурой 232 градуса Цельсия.
- Он тяжелее и в 1,136 раза плотнее воздуха. Это означает, что его, вероятно, можно найти в низинных областях с небольшой вентиляцией или без нее
- H 2 S — полярная молекула
Молярная масса H 2 S
Молярная масса H = 1,00794 г / моль
Молярная масса серы = 32,06 г / моль
Молярная масса h3S составляет 34.1 г / моль
Использование сероводорода
- Это основной предшественник элементарной серы.
- Он играет жизненно важную роль в сигнальных путях в организме человека.
- H 2 S используется в основном для производства серной кислоты и серы.
- Фермеры используют сероводород в качестве дезинфицирующего средства в сельском хозяйстве, и он содержится в некоторых смазочно-охлаждающих жидкостях, которые являются охлаждающими жидкостями и смазками, разработанными специально для обработки металлов и механической обработки.
h3s полярный или неполярный?
h3S является слабополярной молекулой из-за небольшой разницы в значениях электроотрицательности атомов водорода (2.2) Атомы серы (2.58).
Молекулярная геометрия сероводорода полярна, но связи неполярны.
Полярность определяется электроотрицательностью. Молекула полярна, если структура этой молекулы не симметрична.
В случае симметричной структуры дипольные векторы на каждой молекуле компенсируют друг друга, что приводит к неполярной природе молекулы.
Кроме того, наличие двух неподеленных пар, которые находятся на противоположной стороне от двух атомов водорода, также делает молекулу более полярной и вызывает изогнутую геометрическую структуру h3S.
Подробное объяснение можно найти по ссылке «h3s полярный или неполярный».
Ссылки по теме
CO
2 Структура Льюиса и молекулярная геометрияРезюме
Подводя итог всему в этой статье, следующие важные моменты:
- В структуре Льюиса h3S два водорода образуют одинарную связь с атом серы.
- Валентный угол составляет 92,1 градуса, имеется 8 валентных электронов.
- H 2 S — полярная молекула с изогнутой геометрией.
- Воздействие сероводорода может быть опасным.
Часто задаваемые вопросы (FAQ)
Некоторые из часто задаваемых вопросов приведены ниже
1. Что такое полярность?
Распределение электрического заряда по атомам, соединенным связью, обуславливает полярность.
В частности, обнаружено, что связи между атомами различных элементов электрически неэквивалентны.
Например, в хлористом водороде атом H заряжен слегка положительно, тогда как атом Cl заряжен слегка отрицательно.
Небольшие электрические заряды на разнородных атомах называются частичными зарядами, а наличие частичных зарядов означает возникновение полярной связи.
Некоторыми примерами полярных молекул являются вода (H 2 O), этанол, аммиак и SO 2 (диоксид серы).
2. Объясните структуру Льюиса сероводорода простыми словами
Сероводород — это полярная молекула с одинарной связью между двумя атомами водорода и серы.
Конструкция представляет собой изогнутую конструкцию с валентными углами 92,1 градуса.
гибридизация h3s. объясните мне гибридизацию в молекуле h3s ….?
Почему вымышленные персонажи не прощаются, когда кладут трубку? Если мы не можем пройти сквозь Землю, как мы узнаем, что находится в ее центре? Все права защищены. Материалы на этом сайте не могут быть воспроизведены, распространены, переданы, кэшированы или использованы иным образом без предварительного письменного разрешения Multiply.
Горячие вопросы. Ранее просмотренные. Вопросы без ответов. Химическая связь. Что такое гибридизация центрального атома h3S? Пользователь Wiki Центральный атом в h3S гибридизирован по sp3. Гибридизация в центральном атоме I sp3.
Гибридизация
Вопрос о химическом связывании Что такое гибридизация с центральным атомом в nocl? Гибридизация центрального атома в NOCl — это sp2. Sp2 — гибридизация центрального атома в SO2. Центральный атом — кислород с sp3-гибридизацией.Его гибридизация — sp3d. Вопрос в химической связи Что такое гибридизация центрального атома coh3? Гибридизация атома углерода в этой молекуле sp2. Центральный атом подвергается sp3d2-гибридизации.
спрашивают в химии Что такое гибридизация центрального атома в XeO4? Вероятно, вы имеете в виду Alh5- тетрагидроалюминатный анион. Гибридизация центрального атома Alh5 — это sp3.
Тег Div в htmlВопрос в атомах и атомной структуре Что такое гибридизация центрального атома для sf2? Гибридизация — это идея, что атомные орбитали сливаются с образованием новых гибридизованных орбиталей, что, в свою очередь, влияет на геометрию молекул и свойства связывания.
Гибридизация — это также расширение теории валентных связей. Для дальнейшего изучения этой идеи мы будем использовать три типа углеводородных соединений, чтобы проиллюстрировать гибридизацию sp 3sp 2 и sp. Прежде всего, важно отметить, что углерод имеет электронную конфигурацию 1s 2 2s 2 2p 2. Это означает, что углерод будет иметь 2 неспаренных электрона на своих p-орбиталях.
Теоретически это означает, что углерод образует только 2 связи, но это определенно не так.Как видно, в метане CH 4 углерод может образовывать 4 связи. Обоснование этого явления — гибридизация. Таким образом, мы называем метан sp3-гибридизированной молекулой.
Рисунок выше также объясняет, почему четыре связи C-H эквивалентны друг другу. Первоначально люди думали, что если метан имеет четыре связи C-H, это будет означать, что их будет три связи одного определенного типа и одна — другого типа.
Почему валентный угол сероводорода (h3S) меньше, чем у воды (h3O)?Следовательно, это тоже объясняется гибридизацией.Тем не менее, есть даже математическое доказательство, подтверждающее эту концепцию! Эти уравнения вместе не только раскрывают состав каждой гибридизированной орбитали, но также описывают возможные направления, которые каждая орбиталь может ориентироваться в трехмерной плоскости. Затем посмотрите, как объединенные орбитали образуют тетраэдрическую форму sp3.
Таким образом, гибридизация объясняет, почему между орбиталями существует градусный угол.
Программное обеспечение Udeler для оконВ отличие от метана, этилен имеет другую форму, несмотря на то, что углерод в этилене имеет одинаковую электронную конфигурацию.Чем объясняется эта разница?
Подтверждающие данные показывают, что углерод в молекуле этилена гибридизован с sp 2. Это означает, что орбиталь 1 с смешивается с 2 p-орбиталями. На этот раз установка энергетической диаграммы отличается, потому что смешиваются только 2 p-орбитали.
Однако при создании энергетической диаграммы убедитесь, что вы не совершили ошибку, как показано выше. Поместив два электрона на одну и ту же орбиталь, вы нарушили правило Хунда, которое гласит, что все орбитали на одних и тех же уровнях энергии должны быть заполнены по крайней мере одним электроном, прежде чем снова объединиться в пары.
Сероводород
2p-орбиталь здесь считается достаточно низкой энергией, чтобы быть отнесенной к тому же энергетическому уровню, что и sp2-орбитали. На рисунке ниже показан правильный способ распределения ваших электронов. Обратите внимание на то, что одинокий электрон на 2p-орбитали отделен от электронов на sp2-орбиталях. Это то, что влияет на форму этилена. Одинокий электрон от каждого атома углерода останется на своей соответствующей p-орбитали и образует пи-связь с другим p-орбитальным электроном.
Таким образом, этилен представляет собой плоскую молекулу с орбиталями, разнесенными на градусные углы друг от друга. Если вы не можете визуализировать эту картинку в 3D, позвольте мне уточнить: ярко-розовые sp2-гибридизированные орбитали все находятся в одной плоскости, скажем, в плоскости xy, в то время как связи pi проходят в плоскости, перпендикулярной плоскости xy.
Тем не менее, рисунок выше точно отображает структуру этилена Льюиса :. Подтверждающие данные показывают, что ацетилен является sp-молекулой. Это означает, что орбиталь 1 с смешивается с орбиталью 1 p.
Таким образом, установка энергетической диаграммы будет выглядеть так: Как обсуждалось ранее, неподеленные электроны на 2p-орбиталях не являются частью sp-орбиталей. Вместо этого каждый электрон находится на своей соответствующей p-орбитали и будет связываться со своей соответствующей p-орбиталью другого углерода. Это само по себе создаст сигма-связь и две пи-связи, что приведет к образованию линейной молекулы!
Таким образом, в структуре Льюиса ацетилен состоит из двух атомов углерода с тройной связью: Как вы можете видеть, угол связи равен градусам, что указывает на линейную молекулу.Эта информация согласуется с тем, что было объяснено ранее. Сероводород — это обычное химическое соединение, которое полезно для анализа неорганических соединений ионов металлов. Имеет химическую формулу h3S. В молекуле два атома водорода и один атом серы. h3S также является предшественником элементарной серы.
Он также играет жизненно важную роль в сигнальных путях в организме человека. Итак, чтобы понять гибридизацию, полярность и молекулярную геометрию этого соединения, важно знать его структуру Льюиса.
Структура Льюиса любого соединения является структурным представлением валентных электронов, участвующих в образовании связи вместе с несвязывающими электронными парами.
Знание структуры Льюиса данного химического соединения необходимо, поскольку оно дает необходимую информацию обо всех других химических свойствах соединения. Представление отображается с помощью точек и линий, которые представляют электроны.
Точки обозначают электроны, которые не участвуют в образовании связи.В то время как линии представляют связи в соединении. Структура построена на основе правила октетов. Химическое правило Октета гласит, что во внешней оболочке элемента должно быть восемь электронов, чтобы он был стабильным.
Структуру Льюиса сероводорода легко нарисовать и понять.
Аллюлоза в массеВ соединении есть два атома водорода и один атом серы. У каждого атома водорода есть только один электрон, который также является его валентным электроном, а у серы шесть валентных электронов.
Таким образом, в h3S всего восемь валентных электронов. В этом соединении оба атома водорода требуют одного электрона для создания ковалентной связи с серой. Сере требуется восемь электронов для выполнения требований правила октета. Но для того, чтобы водород стал стабильным, нужен только один электрон, поскольку он принадлежит к элементам Группы 1. Нижеследующее содержание является сутью лекции по общей химии. В этой лекции мы вводим концепции валентных связей и гибридизации.
Теория валентной связи — первая из двух теорий, которая используется для описания того, как атомы образуют связи в молекулах.В этой теории мы говорим строго о ковалентных связях. Согласно теории, общие ковалентные электронные связи образуются между электронами на валентных орбиталях атома, перекрывая эти орбитали с валентными орбиталями другого атома.
Когда образуются связи, увеличивается вероятность нахождения электронов в пространстве между двумя ядрами. Я часто называю это связью «лицом к лицу». Это то, что я называю связью «бок о бок». Чтобы перекрываться, орбитали должны соответствовать друг другу по энергии.Процесс, при котором все связывающие орбитали становятся одинаковыми по энергии и длине связи, называется гибридизацией.
Давайте начнем это обсуждение с разговора о том, почему нам нужно, чтобы энергия орбиталей была одинаковой для правильного перекрытия. Углерод в метане имеет электронную конфигурацию 1s 2 2s 2 2p 2. Согласно теории Валентной связи, электроны, находящиеся во внешней валентной оболочке, мы будем использовать для соединения перекрытий.
Это будут 2s и 2p электроны углерода.Как известно, p-электроны имеют более высокую энергию, чем s-электроны. Это означает, что два p-электрона будут образовывать более короткие и более прочные связи, чем два s-электрона, верно? Но это не то, что мы видим. Мы видим метан с четырьмя связями одинаковой длины и прочности. Так как же это объяснить?
Две машины начинают движение из одного места в противоположных направлениях.Простой: гибридизация. Выяснить, что такое гибридизация в молекуле, кажется сложным процессом, но на самом деле это довольно просто.Поскольку гибридизация используется для создания атомных перекрытий, знание количества и типов перекрытий, которые делает атом, позволяет нам определить степень его гибридизации. Другими словами, вам нужно только подсчитать количество связей или неподеленных пар электронов вокруг центрального атома, чтобы определить его гибридизацию. Каковы гибридизации каждого из центральных атомов в следующей молекуле?
См. Ответ. Как видно из приведенного выше примера, назначить гибридизацию каждому центральному атому легко, если вы можете сосчитать до 6.Что действительно круто в гибридизации, так это то, что каждая гибридизация соответствует геометрии электронной пары. Сероводород — это обычное химическое соединение, которое полезно для анализа неорганических соединений ионов металлов.
Имеет химическую формулу h3S.
h3S Структура Льюиса, молекулярная геометрия, гибридизация и полярность
Молекула имеет два атома водорода и один атом серы. h3S также является предшественником элементарной серы. Он также играет жизненно важную роль в сигнальных путях в организме человека.Итак, чтобы понять гибридизацию, полярность и молекулярную геометрию этого соединения, важно знать его структуру Льюиса.
Структура Льюиса любого соединения является структурным представлением валентных электронов, участвующих в образовании связи вместе с несвязывающими электронными парами. Знание структуры Льюиса данного химического соединения важно, поскольку оно дает необходимую информацию обо всех других химических свойствах соединения. Представление отображается с помощью точек и линий, которые представляют электроны.Точки обозначают электроны, которые не участвуют в образовании связи.
В то время как линии представляют связи в соединении. Структура построена на основе правила октетов. Химическое правило Октета гласит, что во внешней оболочке элемента должно быть восемь электронов, чтобы он был стабильным.
Структуру Льюиса сероводорода легко нарисовать и понять. В соединении есть два атома водорода и один атом серы.
У каждого атома водорода есть только один электрон, который также является его валентным электроном, а у серы шесть валентных электронов.Таким образом, в h3S всего восемь валентных электронов.
В этом соединении оба атома водорода требуют одного электрона для образования ковалентной связи с серой. Сере требуется восемь электронов для выполнения требований правила октета. Но водороду требуется только один электрон, чтобы стать стабильным, поскольку он принадлежит к элементам группы 1. Итак, здесь валентные электроны серы используются для стабилизации водорода путем передачи электронов обоим атомам водорода. В образовании связи участвуют два из шести валентных электронов.
Остальные четыре электрона являются несвязывающими электронами и поэтому отображаются в виде точек рядом с атомом серы. Всего в этом соединении две пары несвязывающих электронов.
Чтобы понять гибридизацию h3S, необходимо сначала знать две вещи :. Важно знать тип связывания в соединении, чтобы знать его гибридизацию. В молекуле h3S два атома водорода образуют связь с центральным атомом серы. В молекуле образуются две одинарные связи. Все права защищены.Материалы на этом сайте не могут быть воспроизведены, распространены, переданы, кэшированы или использованы иным образом без предварительного письменного разрешения Multiply.
Горячие вопросы. Ранее просмотренные. Вопросы без ответов. Химическая связь. Пользователь Wiki 21 октября, AM. Центральный атом в h3S является sp3-гибридизированным. На вопрос в химии, физике элементарных частиц Что такое гибридизация валентных электронов h3s? На вопрос в химии Что такое гибридизация KrF2? Гибридизация — sp3d. На вопрос микробиологов Какое соединение представляет собой h3S? h3s — это сероводород.На вопрос в химии Сколько молей сероводорода содержится в h3S Вопрос в химии Что такое гибридизация Nh5?
Гибридизация Ph4 — sp3. На вопрос в химии Какая гибридизация SCl4? Гибридизация SCl4 — это sp3d. Гибридизация SF2 — это sp3. Вопрос в таксономии. Введите букву гибридизации валентных электронов в столбце 2, которая, скорее всего, произойдет на центральном атоме молекулы в столбце 1?
Спрашивают по химии. H3s — это полор или не полор? h3S имеют тетраэдрическую электронную пару, геометрия h3S полярна.Поскольку молекула h3S не симметрична, существует область неравного распределения. На вопрос в химии Какова формула h3S?
Пиксаки против асепрайтаh3S — это формула сероводорода. На вопрос в химии Какое уравнение ионизации для h3S? На вопрос в химии. Является ли h3s сильным электролитом? h3S — слабый электролит. h3S не является оксикислотой; в молекуле нет кислорода. h3S — сероводород. SP-гибридизация — это тип гибридизации, который обнаруживается в аммиаке Nh4. Сероводород — это химическое соединение с формулой H 2 S.
Бесцветный газообразный гидрид халькогена с характерным неприятным запахом тухлых яиц. Он очень ядовит, едок и легко воспламеняется. Сероводород часто образуется в результате микробного разложения органических веществ в отсутствие газообразного кислорода, например, в болотах и канализационных коллекторах; этот процесс широко известен как анаэробное пищеварение, которое осуществляется сульфатредуцирующими микроорганизмами.
H 2 S также встречается в вулканических газах, природном газе и в некоторых источниках колодезной воды. Шведскому химику Карлу Вильгельму Шееле приписывают открытие химического состава сероводорода в сероводороде, который немного плотнее воздуха; смесь H 2 S и воздуха может быть взрывоопасной.Сероводород горит в кислороде голубым пламенем с образованием диоксида серы SO 2 и воды.
При высоких температурах или в присутствии катализатора диоксид серы реагирует с сероводородом с образованием элементарной серы и воды. Эта реакция используется в процессе Клауса — важном промышленном методе утилизации сероводорода. Сероводород и его растворы бесцветны. При контакте с воздухом он медленно окисляется с образованием элементарной серы, которая не растворяется в воде.
Сероводород реагирует с ионами металлов с образованием сульфидов металлов, которые представляют собой нерастворимые твердые вещества темного цвета.Ацетатная бумага свинца II используется для обнаружения сероводорода, поскольку она легко превращается в сульфид свинца II, который имеет черный цвет. Обработка сульфидов металлов сильной кислотой часто приводит к выделению сероводорода. При охлаждении ниже критической температуры эта фаза высокого давления проявляет сверхпроводимость. Сероводород чаще всего получают путем его отделения от высокосернистого газа, который представляет собой природный газ с высоким содержанием H 2 S.
Углеводороды могут служить источником водорода в этом процессе. Сульфатредуцирующий соотв.Стандартной лабораторной подготовкой является обработка сульфида железа сильной кислотой в генераторе Киппа:. Для использования в качественном неорганическом анализе тиоацетамид используется для получения H 2 S:. Многие сульфиды металлов и неметаллов, например.
Iccid generatorЭтот газ также получают путем нагревания серы твердыми органическими соединениями и восстановления сернистых органических соединений водородом. Водонагреватели могут способствовать превращению сульфата в воде в сероводород. Это связано с обеспечением теплой среды, устойчивой для серных бактерий, и поддержанием реакции, которая взаимодействует между сульфатом в воде и анодом водонагревателя, который обычно изготавливается из металлического магния.
Сероводород может образовываться в клетках ферментативным или неферментативным путем. H 2 S в организме действует как газообразная сигнальная молекула, которая, как известно, ингибирует Комплекс IV митохондриальной цепи переноса электронов, что эффективно снижает выработку АТФ и биохимическую активность в клетках.
Сероводород также может быть синтезирован неферментативным путем, который получают из таких белков, как ферредоксины и белки Риеске. Было показано, что H 2 S участвует в физиологических процессах, таких как расширение сосудов у животных, увеличение прорастания семян и реакции растений на стресс.В основном сероводород используется в качестве предшественника элементарной серы.
Некоторые сероорганические соединения производятся с использованием сероводорода.
h3S Полярный или неполярный — Как обсуждать
h3S Полярный или неполярный Сероводород (h3S) является неполярным из-за его неполярных связей H-S. Разница EN между водородом и серой составляет 0,4, поэтому водород и сера образуют неполярных связей . h3S — химическая формула соединения сероводорода.Сероводород — это ковалентное соединение, состоящее из 2 атомов водорода, связанных с центральным атомом серы. Как и вода (h30), сероводород представляет собой халькогенид водорода, соединение, состоящее из водорода и элемента 16 группы (кислород, сера, селен, теллур.
Наука о полярных и неполярных молекулах:
Наука о полярных и неполярных определяется в молекуле как распределение электронов. Это означает, что наиболее электроотрицательный атом притягивается и притягивается электронами.
Но как измерить полярность элемента? Давайте выясним, насколько важна полярность, мало зная о принципе электроотрицательности.
В том, как взаимодействуют различные молекулы, огромную роль играет химическая полярность. Почему, например, сахар растворяется в воде, а масло — нет?
Это все о полярных и неполярных. Склонность элементов притягивать электроны выражается электроотрицательностью. Таким образом, будет больше электроотрицательных компонентов, которые притягивают больше электронов.
Чтобы определить полярность молекулы, электроотрицательность определяет распределение электронов.
Полярная молекула, что это?
Поскольку молекула нейтральна, когда одна сторона более отрицательная, чем другая, положительно заряженная, она называется поляризованной.
Имеет асимметричную структуру атома, хотя за пределами центрального атома имеет место неправильное распределение отрицательных зарядов (электронов).
Например —
Более электроотрицательный кислород имеет более высокую концентрацию электронов, чем другой атом молекулы, т.е.е. вода (h3O) — полярная молекула. Водород заряжен положительно.
Вы должны найти объяснение полярности h3O.
Некоторые молекулы также являются полярными, например SO2, Nh4 и т. Д.
h3S ИЛИ Сероводород:
Часто известный как h3S, отработанный газ, болотный газ, вонючая и кислая влажность, сероводород представляет собой бесцветный газ, известный своим резким запахом «тухлого яйца» при низких концентрациях. Он очень легко воспламеняется и очень ядовит. Сероводород используется или производится в различных отраслях промышленности, таких как
- Переработка нефти и газа
- Горнодобывающие отрасли
- Дубление Дубление
- Обработка целлюлозы и бумаги
- Промышленный вискоза
В канализации, свалках отходов, колодезной воде, нефтяных и газовых скважинах и вулканах сероводород также присутствует естественным образом.
Сероводород может накапливаться в низинных и закрытых местах, таких как люки, канализации и подземные телефонные своды, поскольку он тяжелее воздуха. Его присутствие делает работу в закрытых помещениях потенциально очень опасной.
Воздействие сероводорода на здоровье зависит от того, сколько h3S человек вдыхает и как долго. Однако также при низких концентрациях наблюдается несколько эффектов. Эффекты варьируются от умеренных, раздражающих головных болей или глаз до очень серьезных, потери сознания и смерти.
Существуют различные варианты использования h3S, например:
- Используется для обработки водорода и серной кислоты.
- Обычно используется для обработки различных видов неорганических соединений в промышленных масштабах.
- Он используется в более крупных масштабах для производства пестицидов для сельскохозяйственных культур.
- Использование сероводорода в качестве тяжелой воды на атомных электростанциях — это нормально.
Как проверить полярность h3S?
Пока вы не перейдете к полярности молекулы, h3S, давайте поговорим о полярности ее связи.Полярность связи образуется, когда атомы молекулы имеют частичные положительные и отрицательные заряды. Если разница между электроотрицательностью двух элементов больше или равна 0,5, то связь полярная.
Положительно заряженный водород. Следовательно, электроотрицательность серы становится больше, чем у атома водорода.
Электроотрицательность, как вы знаете, возрастает в периодической таблице слева направо и убывает сверху вниз.
Электроотрицательность водорода и серы равна 2.20 и 2,58 соответственно. Их разница в электроотрицательности 0,38 меньше 0,5. Таким образом, h3S является неполярной связью.
Отчасти отрицательно из-за того, что сера более электроотрицательна, чем водород. В результате возникает дипольный момент. Кроме того, стрелка, ведущая к более электроотрицательному атому, представляет дипольный момент. Дипольный момент от водорода (дельта +) до серы выражается в случае соединения h3S (дельта-).
СвязиH-S, строго говоря, не являются абсолютно неполярными.Сера немного более электроотрицательна, чем водород, но на взаимных электронах она немного сильнее притягивается. Однако эта полярность очень слабая, и практически полезно обращаться с очень слабыми полярными связями, как если бы они совсем не полярные
Таким образом, хотя связи H-S теоретически немного полярны, с ними безопасно обращаться, как если бы они большую часть времени были неполярными. Между атомами с одинаковыми значениями EN образуются единственные действительно неполярные связи. Очень слабая полярность сероводорода имеет серьезные последствия в малых масштабах, поэтому в некоторых ситуациях было бы разумно рассматривать связи H-S как полярные.
Имеет ли значение геометрическая форма h3S при определении ее полярности?
Не менее важно выяснить внешние атомы и форму, чтобы определить полярность любой молекулы, такой как h3S.
На центральном атоме, Sulphur, есть две неподеленные пары электронов, которые позволяют связи H-S иметь изогнутую форму. Следовательно, молекула имеет нерегулярное распределение атомов вокруг центрального атома, что делает его несимметричным.
Дипольный момент между связями H-S создается из-за его изогнутой формы.Чем больше разделение зарядов, тем больше дипольный момент между атомами. Таким образом, сера притягивает больше электронов и получает отрицательный частичный заряд.
Поскольку теперь у него осталось меньше положительных зарядов, водород является частично положительным зарядом. Поскольку есть направление и величина дипольного момента, это векторная величина. Он указывает на большее количество электроотрицательных атомов.
Молекула становится полярной, когда стрелки не гаснут друг друга.
Значение дипольного момента:
Коэффициент диполя молекулы указывает степень ее полярности.Чем больше полярность молекулы, тем важнее ее дипольный момент.
Его также можно определить как произведение зарядов двух атомов и расстояния между ними.
D = Q *
рэндD = момент диполя
Q = заряды атомов
R = расстояние между ними
h3S Льюис Структура:
Структура Льюиса любого соединения является структурным представлением наряду с несвязывающими электронными парами валентных электронов, участвующих в образовании связи.Важно понимать структуру Льюиса данного химического соединения, поскольку она предоставляет необходимую информацию обо всех других химических свойствах соединения.
Структура генерируется на основе закона октетов. Правило октета химии гласит, что для его стабильности во внешней оболочке элемента должно быть восемь электронов.
Нарисовать и понять структуру Льюиса сероводорода легко. Оба атома водорода требуют наличия одного электрона в этом соединении для создания ковалентной связи с серой.
Структура Льюисаh3S эквивалентна h3S. Чтобы удовлетворить требованиям закона октета, Sulphur требуется восемь электронов. Однако водороду требуется только один электрон, чтобы стать стабильным, поскольку он принадлежит к элементам группы 1.
Токсичность сероводорода:
Сероводород в целом очень токсичен для дышащих кислородом. Механизм действия аналогичен монооксиду углерода. Сероводород может связываться с важными ферментами и кофакторами, не позволяя им выполнять свою работу через клеточное дыхание.
Поскольку сероводород естественным образом вырабатывается в организме человека, организм имеет механизмы удаления сероводорода, но достаточно большая доза будет обходить эти механизмы. Симптомы отравления сероводородом аналогичны симптомам отравления угарным газом; слабость, головокружение, неспособность сосредоточиться, потеря памяти и раздражительность.
Организм легко приспосабливается к запаху, хотя изначально это запах резкий, из-за которого люди могут не подозревать о его существовании. Он намного плотнее воздуха, поэтому собирается в плохо проветриваемых помещениях у пола.Человеческий организм может некоторое время переносить низкие концентрации сероводорода.
Что такое облигация в h3s?
Если в них есть водород и любой из трех электроотрицательных атомов (N, O, F), ковалентно связанные друг с другом, между двумя молекулами образуются водородные связи. Поскольку в h3S нет (NOF), хотя он имеет диполь-дипольные мощности, там нет водородной связи.
Если электроотрицательность атомов очень близка, они образуют неполярные ковалентные связи. Атом S в h3S связан с атомами 2 H.H = 2,2 и S = 2,56 электроотрицательность.
Во-вторых, какое соединение представляет собой сероводород? Сероводород, органическое соединение, H 2S, бесцветный, высокотоксичный газ с очень неприятным запахом, почти как тухлые яйца. Он слабо растворим в воде и растворим в сероуглероде. При растворении в воде он образует очень слабую двухосновную кислоту, которую также называют сероводородной кислотой.
Часто задаваемые вопросы (FAQ):
Вот несколько часто задаваемых вопросов, которые вызовут у вас интерес.
Является ли h3S ковалентным?
Поскольку водород имеет электроотрицательность около 2,2, а сера 2,56, связи h3S ковалентны. Свойство связывающих атомов, называемое электроотрицательностью, определяет, является ли связь неполярной или полярно-ковалентной. Поскольку водород имеет более низкую электроотрицательность, он является восстановителем и окислителем серы. Хотя их зазор меньше, для неметаллов они имеют электроотрицательность.
Является ли h3s водородной связью?
В любом соединении атомы и молекулы удерживаются вместе химическими связями, образованными между ними.Водородная связь — это одна такая слабая связь, которая образуется вблизи другого электроотрицательного атома с неподеленной парой электронов, когда возникает атом водорода, связанный с сильно электроотрицательным атомом.
Является ли h3s дипольным диполем?
Хотя h3O демонстрирует водородные связи, h3S, h3Se и h3Te демонстрируют диполь-дипольные межмолекулярные способности. Сила дисперсии (42 электрона) C4h20 представляет собой неполярную углеводородную молекулу и имеет более высокую силу притяжения, чем CO2 (т. Кип. -0,5 ° C).
В чем причина полярности воды?
Вода (h3O) полярна из-за изогнутой формы молекулы. Электроны или отрицательные заряды притягиваются к сильно электроотрицательному атому кислорода, делая область вокруг кислорода более отрицательной, чем области вокруг двух атомов водорода. Это пример химической полярной ковалентной связи. На них может влиять распределение заряда при нанесении растворенных веществ на воду. Вода является полярной молекулой и поэтому действует как полярный растворитель.
Последние мысли:
К настоящему времени мы ясно поняли науку о полярности. И мы также научно доказали, что h3S неполярен. Имейте в виду, что для определения полярности любой молекулы необходимо принять во внимание следующие соображения.
Почему полярность связи влияет на полярность молекулы?
Как определить ориентацию полярности молекулы?
Влияет ли полярность на форму?
Как симметричный и асимметричный помогают определить полярность молекулы?
h3S — полярная молекула с атомами водорода, связанными за пределами основного атома серы.Он имеет асимметричную изогнутую форму между атомами, которая создает дипольный момент. Сера более электроотрицательна, чем водород.
Это относится к большему количеству электронов у Sulphur, чем у последнего. Как вы знаете, электроотрицательная разность молекулы h3S составляет 0,4, что считается незначительным и также имеет плохую полярность.
С технической точки зрения, h3S считается неполярной молекулой из-за отсутствия адекватной полярности между атомами.
