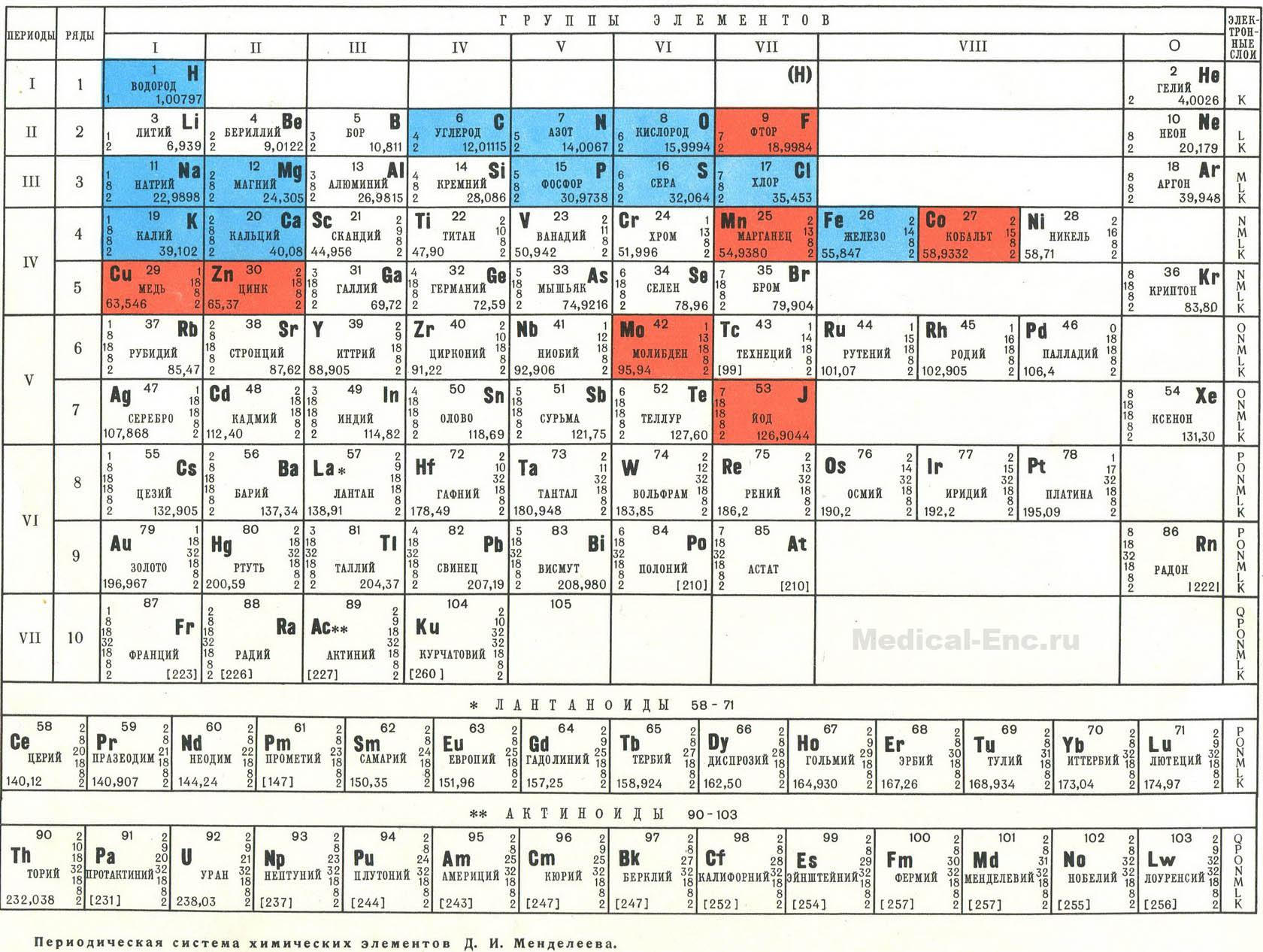
Периодическая система химических элементов Д.И. Менделеева
Периодический закон.
Периодическая система Д.И. Менделеева
1. В каком ряду химических элементов усиливаются металлические свойства соответствующих им простых веществ?
1) калий → натрий → литий
2) сурьма → мышьяк → фосфор
3) углерод → кремний → германий
4) алюминий → кремний → углерод
2. В каком ряду химических элементов усиливаются металлические свойства соответствующих им простых веществ?
1) кислород → фтор → неон
2) кремний → сера → хлор
3) селен → сера → кислород
4) алюминий → магний → натрий
3. Неметаллические свойства фосфора выражены сильнее, чем неметаллические свойства
1) азота
2) кислорода
3) серы
4) кремния
4. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
1)
2)
3)
4)
5. От кислотных к основным меняются
свойства оксидов в ряду
От кислотных к основным меняются
свойства оксидов в ряду
1)
2)
3)
4)
6. Наиболее сильными основными свойствами обладает оксид
1) магния
2) бериллия
3) алюминия
4) натрия
7. Наиболее сильными кислотными свойствами обладает высший оксид
1) фосфора
2) кремния
3) хлора
4) алюминия
8. Атомный радиус химических элементов уменьшается в ряду
1)
2)
3)
4)
9. От основных к кислотным меняются свойства оксидов в ряду
1)
2)
3)
4)
10. Основные свойства оксида магния выражены сильнее, чем основные свойства
1) оксида бериллия
2) оксида натрия
3) оксида кальция
4) оксида калия
11. Неметаллические свойства простых веществ усиливаются в ряду
1) фосфор → кремний → алюминий
2) фтор → хлор → бром
3) селен → сера → кислород
4) азот → фосфор → мышьяк
12. Неметаллические свойства углерода
выражены сильнее, чем неметаллические свойства
Неметаллические свойства углерода
выражены сильнее, чем неметаллические свойства
1) кислорода
2) кремния
3) азота
4) фтора
13. Металлические свойства магния выражены сильнее, чем металлические свойства
1) кальция
2) бериллия
3) калия
4) бария
14. Неметаллические свойства серы выражены сильнее, чем неметаллические свойства
1) селена
2) фтора
3) кислорода
4) хлора
15. В главных подгруппах Периодической системы с увеличением заряда ядра атомов химических элементов
1) усиливаются неметаллические свойства
2) уменьшаются металлические свойства
3) изменяется валентность в водородных соединениях
4) остается постоянной высшая валентность
16. Порядковый номер химического
элемента в Периодической системе Д.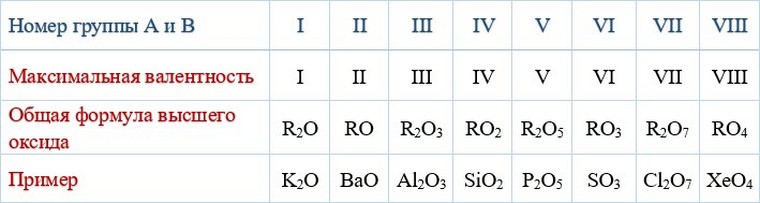 И. Менделеева соответствует:
И. Менделеева соответствует:
1) числу электронов в атоме
2) значению высшей валентности элемента по кислороду
3) числу электронов, недостающих до завершения внешнего электронного слоя
4) числу электронных слоев в атоме
17. Номер периода в Периодической системе химических элементов Д. И. Менделеева равен числу
1) электронов в атоме
2) электронов во внешнем слое атомов
3) недостающих электронов до завершения электронного слоя
4) заполняемых электронных слоев в атоме
18. Амфотерным является высший оксид каждого из химических элементов, имеющих в Периодической системе Д. И. Менделеева порядковые номера
1) 4, 13, 30
2) 6, 11, 16
3) 19, 12, 3
4) 6, 14, 17
19. Кислотные свойства высших оксидов ослабевают в ряду:
1)
2)
3)
4)
20. Номер группы в Периодической
системе химических элементов Д. И. Менделеева соответствует
Номер группы в Периодической
системе химических элементов Д. И. Менделеева соответствует
1) числу электронов в атоме
2) значению высшей валентности элемента по кислороду
3) числу электронов, недостающих до завершения внешнего электронного слоя
4) числу электронных слоев в атоме
21. В подгруппах Периодической системы с увеличением заряда ядра атомов происходит
1) усиление неметаллических свойств элементов
2) уменьшение числа протонов в ядре
3) увеличение радиуса атомов
4) увеличение электроотрицательности
22. Неметаллические свойства усиливаются в ряду
1)
2)
3)
4)
23. В периоде с увеличением атомного номера химического элемента происходит
1) уменьшение заряда ядра атома
2) усиление металлических свойств
3) уменьшение атомного радиуса
4) уменьшение числа валентных электронов
24. В каком ряду элементы расположены
в порядке увеличения их электроотрицательности?
В каком ряду элементы расположены
в порядке увеличения их электроотрицательности?
1) фтор — хлор — бром
2) азот — фосфор — мышьяк
3) кислород — азот — углерод
4) кремний — фосфор — сера
25. В каком ряду элементы расположены в порядке уменьшения их электроотрицательности?
1) азот — кислород — фтор
2) натрий — магний — алюминий
3) бериллий — магний — кальций
4) селен — сера — кислород
26. Валентность элемента в летучем водородном соединении уменьшается в ряду
1)
2)
3)
4)
27. Валентность элемента в высшем оксиде растёт в ряду
1)
2)
3)
4)
28. Высшая степень окисления элемента увеличивается в ряду
1)
2)
3)
4)
29. Валентность элемента в водородном соединении уменьшается в ряду
1)
2)
3)
4)
30. В каком ряду химических элементов
усиливаются неметаллические свойства соответствующих им простых
веществ?
В каком ряду химических элементов
усиливаются неметаллические свойства соответствующих им простых
веществ?
1) алюминий → фосфор → хлор
2) фтор → азот → углерод
3) хлор → бром → иод
4) кремний → сера → фосфор
31. В каком ряду химических элементов усиливаются неметаллические свойства соответствующих им простых веществ?
1) алюминий → фосфор → хлор
2) фтор → азот → углерод
3) хлор → бром → иод
4) кремний → сера → фосфор
32. Во втором периоде, в ряду элементов увеличивается
1) радиус атома
2) число заполненных энергетических уровней
3) электроотрицательность элемента
4) металлический характер простых веществ
33. Во первой группе, в ряду элементов увеличивается
1) электроотрицательность элемента
2) радиус атома
3) валентность элемента в оксиде
4) число валентных электронов
34. Какой из элементов 2-го периода
имеет наибольший радиус атома?
Какой из элементов 2-го периода
имеет наибольший радиус атома?
1)
2)
3)
4)
35. Какой из элементов главной подгруппы V группы имеет наибольшую электроотрицательность?
1)
2)
3)
4)
36. В ряду элементов уменьшается
1) высшая валентность элемента
2) электроотрицательность
3) заряд ядра
4) радиус атома
37. В ряду элементов уменьшается
1) электроотрицательность
2) заряд ядра
3) высшая степень окисления
4) радиус атома
38. Какой из элементов 2-го периода имеет наибольшую электроотрицательность?
1)
2)
3)
4)
39. Какой из элементов 3-го периода имеет самый большой радиус атома?
1)
2)
3)
4)
40. В каком ряду элементы расположены в порядке увеличения валентности в высшем оксиде?
1)
2)
3)
4)
41. В какому ряду элементы расположены
в порядке увеличения валентности в водородном соединении?
В какому ряду элементы расположены
в порядке увеличения валентности в водородном соединении?
1)
2)
3)
4)
42. В каком ряду химических элементов усиливаются неметаллические свойства соответствующих им простых веществ?
1) алюминий → фосфор → хлор
2) фтор → азот → углерод
3) хлор → бром → иод
4) кремний → сера → фосфор
Химия халькогенов. Учебное пособие
Дмитрий Иванович Менделеев открыл периодический закон, согласно которому свойства элементов и образуемых ими изменяются периодически. Данное открытие было графически отображено в таблице Менделеева. По таблице очень хорошо и наглядно видно, как свойства элементов изменяются по периоду, после чего повторяются в следующем периоде.
Для решения задания №2 ЕГЭ по химии нам всего лишь нужно понять и запомнить, какие свойства элементов в каких направлениях изменяются и как.
Всё это отображено на рисунке ниже.
Слева направо растут электроотрицательность, неметаллические свойства, высшие степени окисления и т.д. А металлические свойства и радиусы уменьшаются.
Сверху вниз наоборот: растут металлические свойства и радиусы атомов, а электроотрицательность падает. Высшая степень окисления, соответствующая количеству электронов на внешнем энергетическом уровне, в этом направлении не меняется.
Разберём на примерах.
Пример 1.
В ряду элементов Na→Mg→Al→Si
А) уменьшаются радиусы атомов;
В) увеличивается число электронных слоёв в атомах;
Г) уменьшается высшая степень окисления атомов;
Если посмотреть в таблицу Менделеева, то мы увидим, что все элементы данного ряда находятся в одном периоде и перечислены в том порядке, как они стоят в таблице с лева направо. Что бы ответить на вопрос такого рода нужно просто знать несколько закономерностей изменений свойств в периодической таблице. Так слева направо по периоду металлические свойства падают, неметаллические растут, электроотрицательность растёт, энергия ионизации растёт, радиус атомов уменьшается. По группе сверху вниз металлические и восстановительные свойства растут, электроотрицательность падает, энергия ионизации уменьшается, радиус атомов растёт.
Так слева направо по периоду металлические свойства падают, неметаллические растут, электроотрицательность растёт, энергия ионизации растёт, радиус атомов уменьшается. По группе сверху вниз металлические и восстановительные свойства растут, электроотрицательность падает, энергия ионизации уменьшается, радиус атомов растёт.
Если вы были внимательны, то уже поняли, что в данном случае уменьшаются радиусы атомов. Ответ А.
Пример 2.
В порядке усиления окислительных свойств элементы расположены в ряду:
А. F→O→N
Б. I→Br→Cl
В. Cl→S→P
Г. F→Cl→Br
Как вы знаете, в периодической таблице Менделеева окислительные свойства растут слева направо по периоду и снизу вверх по группе. В варианте Б как раз приведены элементы одной группы в порядке снизу вверх. Значит Б подходит.
Пример 3.
Валентность элементов в высшем оксиде увеличивается в ряду:
А. Cl→Br→I
Б. Cs→K→Li
В. Cl→S→P
Г. Al→C→N
В высших оксидах элементы проявляют свою высшую степень окисления, которая будет совпадать с валентностью. А высшая степень окисления растёт слева направо по таблице. Смотрим: в первом и втором вариантах нам даны элементы, находящиеся в одних группах, там высшая степень окисления и соответственно валентность в оксидах не меняется. Cl→S→P – расположены справа налево, то есть у них наоборот валентность в высшем оксиде будет падать. А вот в ряду Al→C→N элементы расположены слева – направо, валентность в высшем оксиде увеличивается у них. Ответ: Г
А высшая степень окисления растёт слева направо по таблице. Смотрим: в первом и втором вариантах нам даны элементы, находящиеся в одних группах, там высшая степень окисления и соответственно валентность в оксидах не меняется. Cl→S→P – расположены справа налево, то есть у них наоборот валентность в высшем оксиде будет падать. А вот в ряду Al→C→N элементы расположены слева – направо, валентность в высшем оксиде увеличивается у них. Ответ: Г
Пример 4.
В ряду элементов S→Se→Te
А) увеличивается кислотность водородных соединений;
Б) увеличивается высшая степень окисления элементов;
В) увеличивается валентность элементов в водородных соединениях;
Г) уменьшается число электронов на внешнем уровне;
Сразу смотрим на расположение этих элементов в таблице Менделеева. Сера, селен и теллур находятся в одной группе, одной подгруппе. Приведены в порядке сверху вниз. Смотрим еще раз на диаграмму выше. Сверху вниз в периодической таблице растут металлические свойства, растут радиусы, падает электроотрицательность, энергия ионизации и неметаллические свойства, количество электронов на внешнем уровне не меняется.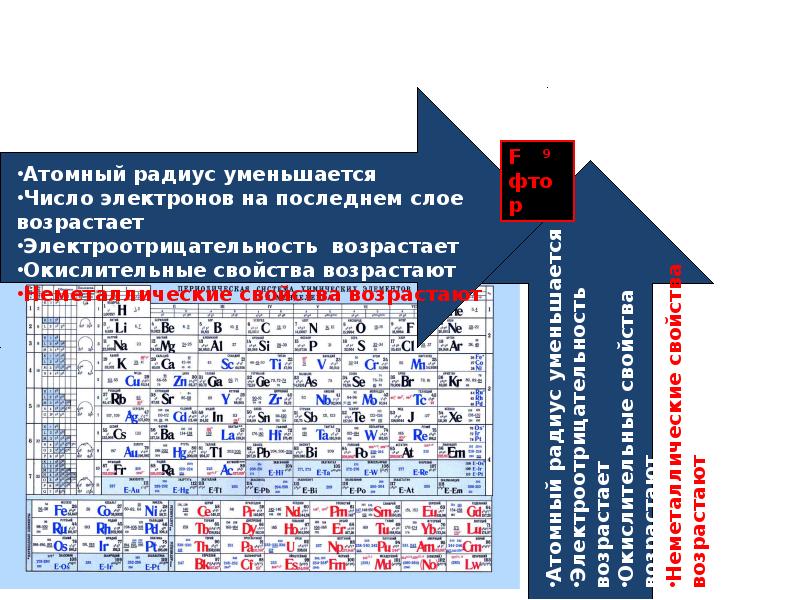 Вариант Г сразу исключаем. Если число внешних электронов не меняется, то валентные возможности и высшая степень окисления тоже не меняется, Б и В — исключаем.
Вариант Г сразу исключаем. Если число внешних электронов не меняется, то валентные возможности и высшая степень окисления тоже не меняется, Б и В — исключаем.
Остаётся вариант А. Проверяем для порядка. По схеме Косселя сила безкислородных кислот возрастает с уменьшением степени окисления элемента и увеличением радиуса его иона. Степень окисления у всех трёх элементов одинаковая в водородных соединениях, а вот радиус сверху вниз растёт, значит и сила кислот растёт.
Ответ – А.
Пример 5.
В порядке ослабления основных свойств оксиды расположены в ряду:
А. Na 2 O→K 2 O→Rb 2 O
Б. Na 2 O→MgO→Al 2 O 3
В. BeO→BaO→CaO
Г. SO 3 →P 2 O 5 →SiO 2
Основные свойства оксидов ослабевают синхронно с ослабление металлических свойств элементов их образующих. А Ме- свойства ослабевают слева направо или снизу вверх. Na, Mg и Al как раз располагаются слева направо. Ответ Б.
которых каждый атом селена связан с двумя другими ковалентными -связями.
Цепочки расположены параллельно друг другу. Между однотипными атомами соседних цепочек имеет место межмолекулярное взаимодействие. Температура плавления и кипения серого Se соответственно равны 219о
С и 685о
С. Фото-
Между однотипными атомами соседних цепочек имеет место межмолекулярное взаимодействие. Температура плавления и кипения серого Se соответственно равны 219о
С и 685о
С. Фото-
проводимость серого селена можно объяснить тем, что под действие падающе-
го света, электроны приобретают энергию, позволяющую им преодолеть не-
большой барьер между валентной зоной и зоной проводимости, что и использу-
ется в фотоэлементах. Электропроводность селена в темноте очень мала, но сильно повышается на свету. Менее устойчивыми модификациями селена яв-
ляются: красный селен, который имеет в своей структуре восьмичленные коль-
ца, как у серы, и черный стекловидный селен, в котором спиральные цепи пе-
репутаны.
Теллур имеет две модификации: аморфную темно-коричневую и сереб-
ристо-серую, со структурой, похожей на структуру серого селена. Температура плавления и кипения Te – 450о С и 990о С.
Простые вещества способны проявлять восстановительные и окис-
лительные свойства.
В ряду S, Se, Te восстановительная способность простых веществ усиливается, а окислительная активность уменьшается.
Реакция S(т.) + h3 Se (г.) = h3 S (г.) + Se (серый) показывает, что сера бо-
лее сильный окислитель, чем селен.
С металлами селен и теллур реагируют при нагревании, образуя селени-
ды и теллуриды.
2Cu + Se = Cu2 Se,
2Ag + Te = Ag2 Te.
Селен и теллур окисляются кислородом с образованием диоксидов
ЭО 2 только при нагревании. На воздухе оба неметалла устойчивы.
При окислении Se и Te концентрированными азотной и серной кислотой получаются селенистая и теллуристая кислоты.
Э + 2h3 SO4 = h3 ЭO3 + 2 SO2 + h3 O
При кипячении в растворах щелочей селен и теллур диспропорционируют.
3Se + 6KOH = 2K2 Se + K2 SeO3 +3h3 O
Соединения селена и теллура
Селениды и теллуриды
Щелочные металлы, медь и серебро образуют селениды и теллуриды нормальной стехиометрии, и их можно рассматривать как соли селено- и тел-
луроводородных кислот. Известны природные селениды и теллуриды:
Известны природные селениды и теллуриды:
Cu2 Se, PbSe ,Cu2 Te, Ag2 Te, PbTe.
Соединения селена и теллура с водородом: h3 Sе и h3 Te – бесцветные токсичные газы с очень неприятным запахом. Растворяются в воде с образова-
нием слабых кислот. В ряду h3 S, h3 Se, h3 Te увеличивается сила кислот изза ослабления связи Н–Э, обусловленного увеличением размера атома. В этом же ряду усиливаются и восстановительные свойства. В водных растворах h3 Se и
h3 Te быстро окисляются кислородом воздуха.
2h3 Se + O2 = 2 Se + 2h3 O.
Оксиды и кислородные кислоты селена и теллура
Диоксиды селена и теллура – кристаллические вещества.
Оксид SeO2 – хорошо растворяется в воде, образуя селенистую кислоту
h3 SeO3 . Оксид TeO2 плохо растворяется в воде. Оба оксида хорошо растворя-
ются в щелочи, например:
SeO2 + 2NaOH = Na2 SeO3 + h3 O
Кислота H 2 SeO 3 – твердое белое вещество.
Теллуристую кислоту описывают формулой TeO 2 . xH 2 O , указываю-
щую на ее переменный состав.
Селенистая и теллуристая кислоты – слабые, теллуристая проявляет амфотерность. Селенистая кислота хорошо растворима, а теллуристая сущест-
вует только в разбавленном растворе.
Селениты и теллуриты похожи на сульфиты. При действии на них сильных кислот получаются селенистая и теллуристая кислоты .
Степень окисления (+4) у селена и теллура устойчива, но сильные окислители могут окислить соединения Se (+4) и Te (+4) до степени окисления
5h3 SeO3 + 2KMnO4 + 3h3 SO4 = 5h3 SeO4 + 2MnSO4 + K2 SO4 +3h3 O
Восстановительные свойства соединений Se (+4) и Te (+4) выражены за-
метно слабее, чем у серы (+4). Поэтому возможны реакции типа: h3 ЭO3 + 2SO2 + h3 O = Э + 2h3 SO4
Этим способом можно выделить осадки красного селена и черного
Селеновая кислота H 2 SeO 4 в чистом виде – это бесцветное твердое ве-
щество, хорошо растворимое в воде. Селеновая кислота по силе близка к
серной. а теллуровая — слабая кислота.
Теллуровая кислота имеет формулу H6 TeO6 . Все шесть водородных
атомов могут быть замещены на атомы металлов, как, например, в солях:
Ag6 TeO6 , Hg3 TeO6 . Это слабая кислота.
Селеновая и теллуровая кислоты медленно действующие, но силь-
ные окислители, более сильные, чем серная кислота.
В концентрированной селеновой кислоте растворяется золото: 2Au + 6 h3 SeO4 = Au2 (SeO4 )3 + 3 SeO2 +6 h3 O
Смесь концентрированных селеновой и соляной кислот растворяет пла-
Pt + 2 h3 SeO4 + 6HCl = h3 + 2 SeO2 +4 h3 O
Триоксид TeO 3 – твердое желтое вещество, не растворяется в воде, раз-
бавленных кислотах и основаниях. TeO3 получают разложением ортотеллуро-
вой кислоты при нагревании.
Триоксид SeO 3 – твердое белое вещество, образованное молекулами
тримера (SeO3 )3 . Триоксид селена хорошо растворяется в воде, обладает силь-
ными окислительными свойствами. SeO3
получают, вытесняя его из селеновой кислоты триоксидом серы.
Галогениды селена и теллура. Известно много галогенидов селена и теллура (ЭF6 , ЭF4 , SeF2 , TeCl2 ), их получают прямым синтезом из простых ве-
Заключение
VIА-подгруппу образуют р-элементы: O, S, Se, Te, Po.
Все они неметаллы, кроме Po.
Общая формула валентных электронов: ns 2 np 4 .
Элементы VIА-подгруппы часто объединяют под общим названием «халь-
когены» , что означает «образующие руды».
Наиболее характерные степени окисления у S, Se, Te: -2, +4, +6.
Минимальная степень окисления (–2) является устойчивой у всех эле-
У серы из положительных степеней окисления более устойчива +6.
У Se, Te – наиболее устойчивой является степень окисления +4.
Сера в природе встречается в виде простого вещества, в виде сульфидных и сульфатных минералов. В сульфидных рудах в незначительных количествах присутствуют селениды и теллуриды.
Простые вещества способны проявлять и окислительные и восстано-
вительные свойства.
В ряду S, Se, Te восстановительные свойства простых веществ усиливается,
а окислительная активность уменьшается.
Сера, селен и теллур реагируют с металлами с образованием сульфидов, се-
ленидов и теллуридов, выступая как окислители.
Сера селен и теллур окисляются кислородом с образованием диоксидов ЭО2 .
В степени окисления (–2) все элементы образуют слабые кислоты типа
Н2 Э.
В ряду h3 S, h3 Se, h3 Te увеличивается сила кислот.
Соединения халькогенов в степени окисления (–2) проявляют восста-
новительные свойства. Они усиливаются при переходе от S к Te.
Все оксиды и гидроксиды халькогенов проявляют кислотные свойства.
Сила кислот возрастает при увеличении степени окисления и падает при пере-
ходе от S к Te.
h3 SO4 и h3 SeO4 – сильные кислоты, кислота h3 TeO6 – слабая.
Кислоты элементов в степени окисления (+4) – слабые, а оксид Te(+4)
проявляет амфотерность.
Оксиды SO2
и SeO2
растворяются в воде. Оксид TeO2
плохо растворяется в воде. Все оксиды хорошо растворяются в щелочи.
Оксид TeO2
плохо растворяется в воде. Все оксиды хорошо растворяются в щелочи.
Триоксиды SO3 и SeO3 хорошо растворимы в воде, а TeO3 не растворим.
Серная кислота – это самая используемая кислота, как в химической прак-
тике, так и в промышленности.
Мировой объем производства h3 SO4 составляет 136 млн.т/год.
Соединения в степени окисления +4 могут быть и окислены, и восстановле-
Для соединений S(+4) более характерны восстановительные свойства.
Восстановительные свойства соединений Se (+4) и Te (+4) выражены
заметно слабее, чем у серы (+4).
Степень окисления (+4) у селена и теллура устойчива, но сильные окислители могут окислить Se (+4) и Te (+4) до степени окисления (+6).
Серная кислота имеет в своем составе два окислителя: ион водорода и
сульфат-ион.
В разбавленной серной кислоте окисление металлов осуществляется за счет водородных ионов.
В концентрированной серной кислоте окислителем выступает сульфат-ион,
который может быть восстановлен до SO2 , S, h3 S в зависимости от силы вос-
становителя.
Селеновая и теллуровая кислоты медленно действующие, но сильные
окислители, более сильные, чем серная кислота.
1. Степин Б.Д., Цветков А.А. Неорганическая химия: Учебник для вузов / Б.Д.
Степин, А.А. Цветков.– М.: Высш. шк., 1994.- 608 с.: ил.
2. Карапетьянц М.Х. Общая и неорганическая химия: Учебник для студентов вузов / М.Х. Карапетьянц, С.И. Дракин. — 4-е изд., стер. — М.: Химия, 2000. —
3. Угай Я.А. Общая и неорганическая химия: Учебник для студентов вузов,
обучающихся по направлению и специальности «Химия» / Я.А. Угай. — 3-е
изд., испр. — М.: Высш. шк., 2007. — 527 с.: ил.
4. Никольский А.Б., Суворов А.В. Химия. Учебник для вузов /
А.Б. Никольский, А.В. Суворов.– СПб: Химиздат, 2001. — 512 с.: ил.
химия, очень надо! как изменяются окислительные свойства в ряду элементов S—Se—Te—Po? ответ пояснить. и получил лучший ответ
Ответ от Џна Александровна Ткаченко[активный]
В подгруппе кислорода с возрастанием атомного номера увеличивается радиус атомов, уменьшается энергия ионизации, характеризующая металлические свойства элементов. Поэтому в ряду 0—S—Se—Te—Ро свойства элементов изменяются от неметаллических к металлическим. В обычных условиях кислород — типичный неметалл (газ) , а полоний — металл, похожий на свинец.
Поэтому в ряду 0—S—Se—Te—Ро свойства элементов изменяются от неметаллических к металлическим. В обычных условиях кислород — типичный неметалл (газ) , а полоний — металл, похожий на свинец.
С увеличением атомного, номера элементов значение электроотрицательности элементов в подгруппе уменьшается. Отрицательная степень окисления становится все менее характерной. Окислительная степень окисления становится все менее характерной. Окислительная активность простых веществ в ряду 02—S-Se—Те снижается. Так, если сера и значительно слабее, селен непосредственно взаимодействует с водородом, то теллур с ним в реакцию не вступает.
По значению электроотрицательности кислород уступает только фтору, поэтому в реакциях со всеми остальными элементами проявляет исключительно окислительные свойства. Сера, селен и теллур по своим свойствам. относятся к группе окислителей-восстановителей. В реакциях с сильными восстановителями проявляют окислительные свойства, а при действии сильных окислителей. они окисляются, то есть проявляют восстановительные свойства.
они окисляются, то есть проявляют восстановительные свойства.
Возможные валентности и степени окисления элементов шестой группы главной подгруппы с точки зрения строения атома.
Кислород, сера, селен, теллур и полоний составляют главную подгруппу VI группы. На внешнем энергетическом уровне атомов элементов данной подгруппы содержится по 6 электронов, которые имеют конфигурацию s2p4 и распределены по ячейкам следующим образом:
Ответ от 2 ответа
[гуру]
Привет! Вот подборка тем с ответами на Ваш вопрос: химия, очень надо! как изменяются окислительные свойства в ряду элементов S—Se—Te—Po? ответ пояснить.
в ряду элементов O- S- Se с увеличением порядкового номера химического элемента электроотрицательность 1)увелич. 2)умен.
O-S-Se — уменьшается
С-N-O-F — увеличивается
Фтор — самый электроотрицательный элемент.
химия, очень надо! как изменяются окислительные свойства в ряду элементов S—Se—Te—Po? ответ пояснить. и получил лучший ответ
Ответ от Џна Александровна Ткаченко[активный]
В подгруппе кислорода с возрастанием атомного номера увеличивается радиус атомов, уменьшается энергия ионизации, характеризующая металлические свойства элементов.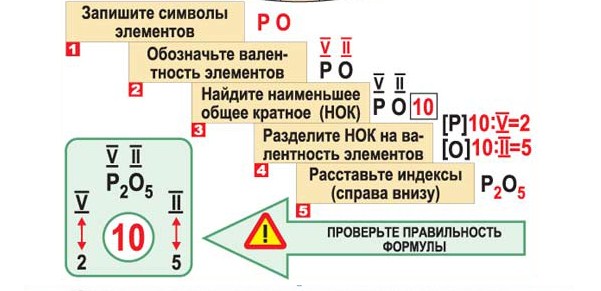 Поэтому в ряду 0—S—Se—Te—Ро свойства элементов изменяются от неметаллических к металлическим. В обычных условиях кислород — типичный неметалл (газ) , а полоний — металл, похожий на свинец.
Поэтому в ряду 0—S—Se—Te—Ро свойства элементов изменяются от неметаллических к металлическим. В обычных условиях кислород — типичный неметалл (газ) , а полоний — металл, похожий на свинец.
С увеличением атомного, номера элементов значение электроотрицательности элементов в подгруппе уменьшается. Отрицательная степень окисления становится все менее характерной. Окислительная степень окисления становится все менее характерной. Окислительная активность простых веществ в ряду 02—S-Se—Те снижается. Так, если сера и значительно слабее, селен непосредственно взаимодействует с водородом, то теллур с ним в реакцию не вступает.
По значению электроотрицательности кислород уступает только фтору, поэтому в реакциях со всеми остальными элементами проявляет исключительно окислительные свойства. Сера, селен и теллур по своим свойствам. относятся к группе окислителей-восстановителей. В реакциях с сильными восстановителями проявляют окислительные свойства, а при действии сильных окислителей. они окисляются, то есть проявляют восстановительные свойства.
они окисляются, то есть проявляют восстановительные свойства.
Возможные валентности и степени окисления элементов шестой группы главной подгруппы с точки зрения строения атома.
Кислород, сера, селен, теллур и полоний составляют главную подгруппу VI группы. На внешнем энергетическом уровне атомов элементов данной подгруппы содержится по 6 электронов, которые имеют конфигурацию s2p4 и распределены по ячейкам следующим образом:
Ответ от 2 ответа
[гуру]
Привет! Вот подборка тем с ответами на Ваш вопрос: химия, очень надо! как изменяются окислительные свойства в ряду элементов S—Se—Te—Po? ответ пояснить.
в ряду элементов O- S- Se с увеличением порядкового номера химического элемента электроотрицательность 1)увелич. 2)умен.
O-S-Se — уменьшается
С-N-O-F — увеличивается
Фтор — самый электроотрицательный элемент.
3.1 Строение атома. Химическая связь
Раздел 3.1 Периодический закон и периодическая система химических элементов Д.Такой характер изменения свойств элементов и их соединений, какой наблюдается при увеличении атомной массы элементов, называется периодическим изменением.
 Свойства всех химических элементов при
увеличении атомной массы изменяются периодически.
Это
периодическое изменение называется периодической
зависимостью свойств элементов и их соединений от величины атомной массы.
Поэтому
Д. И. Менделеев сформулировал открытый им закон так:
Свойства
элементов, а также формы и свойства соединений элементов находятся в
периодической зависимости от величины атомной массы элементов.
Менделеев
расположил периоды элементов друг под другом и в результате составил периодическую систему элементов.
Периодическая
система
– это графическое выражение периодического закона. Каждый элемент занимает
определенное место в периодической системе и имеет свой порядковый номер.
Например:
Структура
периодической системы
Периодическая
система состоит из семи периодов, десяти рядов и восьми групп.
Период – это
последовательность элементов, которая начинается щелочным металлом и
заканчивается благородным газом.
Свойства всех химических элементов при
увеличении атомной массы изменяются периодически.
Это
периодическое изменение называется периодической
зависимостью свойств элементов и их соединений от величины атомной массы.
Поэтому
Д. И. Менделеев сформулировал открытый им закон так:
Свойства
элементов, а также формы и свойства соединений элементов находятся в
периодической зависимости от величины атомной массы элементов.
Менделеев
расположил периоды элементов друг под другом и в результате составил периодическую систему элементов.
Периодическая
система
– это графическое выражение периодического закона. Каждый элемент занимает
определенное место в периодической системе и имеет свой порядковый номер.
Например:
Структура
периодической системы
Периодическая
система состоит из семи периодов, десяти рядов и восьми групп.
Период – это
последовательность элементов, которая начинается щелочным металлом и
заканчивается благородным газом. Исключения: первый период, который начинается водородом; седьмой период, который является
незавершенным.
Периоды
разделяются на малые и большие. Малые периоды состоят из одного горизонтального ряда. Первый,
второй и третий периоды являются малыми. Большие
периоды состоят из двух горизонтальных
рядов. Четвертый, пятый и шестой периоды являются большими. Верхние ряды больших периодов
называются четными, нижние ряды –
нечетными.
В
шестом периоде после лантана находятся
14 элементов, которые похожи по свойствам на лантан и называются лантаноидами.
Они располагаются в нижней части периодической системы.
В
незавершенном седьмом периоде после актиния
находятся 14 элементов, которые похожи по свойствам на актиний и называются актиноидами.
Как и лантаноиды, они располагаются в нижней части периодической системы.
Число элементов в периодах
В каждом периоде
слева направо металлические свойства элементов ослабляются, а неметаллические
свойства усиливаются.
Исключения: первый период, который начинается водородом; седьмой период, который является
незавершенным.
Периоды
разделяются на малые и большие. Малые периоды состоят из одного горизонтального ряда. Первый,
второй и третий периоды являются малыми. Большие
периоды состоят из двух горизонтальных
рядов. Четвертый, пятый и шестой периоды являются большими. Верхние ряды больших периодов
называются четными, нижние ряды –
нечетными.
В
шестом периоде после лантана находятся
14 элементов, которые похожи по свойствам на лантан и называются лантаноидами.
Они располагаются в нижней части периодической системы.
В
незавершенном седьмом периоде после актиния
находятся 14 элементов, которые похожи по свойствам на актиний и называются актиноидами.
Как и лантаноиды, они располагаются в нижней части периодической системы.
Число элементов в периодах
В каждом периоде
слева направо металлические свойства элементов ослабляются, а неметаллические
свойства усиливаются. В
четных рядах больших периодов находятся только металлы.
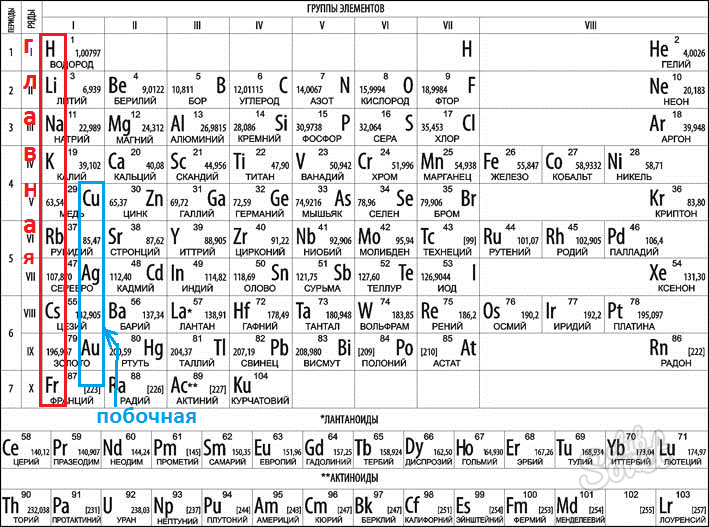
Группа – это
совокупность элементов, которые имеют одинаковую высшую валентность в оксидах и
в других соединениях. Эта валентность равна номеру группы.
Каждая
группа состоит из двух подгрупп: главной и побочной. Главная подгруппа содержит элементы
малых и больших периодов. Побочная
подгруппа содержит элементы только больших периодов.
Например,
рассмотрим 1-ю группу периодической системы:
В главных
подгруппах сверху вниз металлические свойства элементов усиливаются, а неметаллические
свойства ослабевают. Все элементы побочных подгрупп являются металлами.
1. Приведите современную формулировку периодического закона.
Объясните, почему в периодической системе элементов аргон, помещены
соответственно перед калием, хотя имеют бóльшую атомную массу. Как называются
пары таких элементов?
Решение: Свойства элементов и их соединений находятся в периодической зависимости
от заряда ядра атома, или порядкового номера элемента.
В
четных рядах больших периодов находятся только металлы.
Группа – это
совокупность элементов, которые имеют одинаковую высшую валентность в оксидах и
в других соединениях. Эта валентность равна номеру группы.
Каждая
группа состоит из двух подгрупп: главной и побочной. Главная подгруппа содержит элементы
малых и больших периодов. Побочная
подгруппа содержит элементы только больших периодов.
Например,
рассмотрим 1-ю группу периодической системы:
В главных
подгруппах сверху вниз металлические свойства элементов усиливаются, а неметаллические
свойства ослабевают. Все элементы побочных подгрупп являются металлами.
1. Приведите современную формулировку периодического закона.
Объясните, почему в периодической системе элементов аргон, помещены
соответственно перед калием, хотя имеют бóльшую атомную массу. Как называются
пары таких элементов?
Решение: Свойства элементов и их соединений находятся в периодической зависимости
от заряда ядра атома, или порядкового номера элемента. При
увеличении порядкового номера (заряда ядра) в атомах элементов последовательно
увеличивается общее число электронов, а число электронов на внешнем электронном
слое изменяется периодически, что приводит к периодическому изменению свойств
химических элементов.
Положение
элементов в Периодической таблице не зависит от атомной массы
элемента, а зависит от заряда ядра, поэтому Ar+18 помещен перед K+19, Co+27 –
перед Ni +28, Te+52 – перед I+53, Th+90 – перед Pa+91 (хотя аргон, кобальт,
теллур и торий имеют большую массу, чем калий, никель, йод и протактиний соответственно).
Пары
элементов с различным числом протонов и нейтронов, но с одинаковым числом
нуклонов называют изобарами, например
При
увеличении порядкового номера (заряда ядра) в атомах элементов последовательно
увеличивается общее число электронов, а число электронов на внешнем электронном
слое изменяется периодически, что приводит к периодическому изменению свойств
химических элементов.
Положение
элементов в Периодической таблице не зависит от атомной массы
элемента, а зависит от заряда ядра, поэтому Ar+18 помещен перед K+19, Co+27 –
перед Ni +28, Te+52 – перед I+53, Th+90 – перед Pa+91 (хотя аргон, кобальт,
теллур и торий имеют большую массу, чем калий, никель, йод и протактиний соответственно).
Пары
элементов с различным числом протонов и нейтронов, но с одинаковым числом
нуклонов называют изобарами, например
| Число протонов | Число нейтронов | Число нуклонов | |
 Как изменяются свойства гидроксидов
элементов в периодах и группах с увеличением порядкового номера? Почему?
Решение: Металлы могут образовывать и основные, и кислотные, и
амфотерные гидроксиды. При этом с увеличением степени окисления металла (при
движении слева направо в периодической таблице) основной
характер его оксидов и гидроксидов ослабляется, а кислотный усиливается.
Например,
Na2O – основной оксид, NaOH – основание
SO3 –
кислотный оксид, H2SO4 –
кислота
Al2O3 – амфотерный оксид, может
образовывать, как основание (Al(OH)3), так и кислоту HAlO2 или H3AlO3.
Сила оснований слева направо уменьшается, а сверху вниз растет, так
же как металлические свойства растут сверху вниз.
Например,
Cs (цезий) более активный металл, чем К (калий), так как у Cs валентный
электрон находится дальше от ядра, чем у К (калия) и Cs легче отдает электрон
(так как притяжение ядра ослабевает).
Как изменяются свойства гидроксидов
элементов в периодах и группах с увеличением порядкового номера? Почему?
Решение: Металлы могут образовывать и основные, и кислотные, и
амфотерные гидроксиды. При этом с увеличением степени окисления металла (при
движении слева направо в периодической таблице) основной
характер его оксидов и гидроксидов ослабляется, а кислотный усиливается.
Например,
Na2O – основной оксид, NaOH – основание
SO3 –
кислотный оксид, H2SO4 –
кислота
Al2O3 – амфотерный оксид, может
образовывать, как основание (Al(OH)3), так и кислоту HAlO2 или H3AlO3.
Сила оснований слева направо уменьшается, а сверху вниз растет, так
же как металлические свойства растут сверху вниз.
Например,
Cs (цезий) более активный металл, чем К (калий), так как у Cs валентный
электрон находится дальше от ядра, чем у К (калия) и Cs легче отдает электрон
(так как притяжение ядра ослабевает). Если один элемент может иметь разные степени
окисления, то с увеличением степени окисления элемента сила основания
уменьшается, больше проявляется кислотный характер образуемого соединения, например
Cr+2(OH)2
Cr+3(OH)3≡H3CrO3
H2CrO4
основание
амфотерный гидроксид
кислота
основной характер ослабляется, кислотный характер
усиливается
Неметаллы не образуют основные и амфотерные оксиды. Практически
все оксиды неметаллов являются кислотными.
Например,
Na2O – основной оксид, NaOH – основание
SO3 –
кислотный оксид, H2SO4 –
кислота
Al2O3 – амфотерный оксид, может
образовывать, как основание (Al(OH)3), так и кислоту HAlO2 или H3AlO3.
_____________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1.
Если один элемент может иметь разные степени
окисления, то с увеличением степени окисления элемента сила основания
уменьшается, больше проявляется кислотный характер образуемого соединения, например
Cr+2(OH)2
Cr+3(OH)3≡H3CrO3
H2CrO4
основание
амфотерный гидроксид
кислота
основной характер ослабляется, кислотный характер
усиливается
Неметаллы не образуют основные и амфотерные оксиды. Практически
все оксиды неметаллов являются кислотными.
Например,
Na2O – основной оксид, NaOH – основание
SO3 –
кислотный оксид, H2SO4 –
кислота
Al2O3 – амфотерный оксид, может
образовывать, как основание (Al(OH)3), так и кислоту HAlO2 или H3AlO3.
_____________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1. В коком периоде, в какой группе и в какой подгруппе
находятся элементы с порядковыми номерами 14, 29, 52, 56, 78.
2.
Напишите символы, названия и порядковые номера всех
элементов, которые находятся: а) в главной подгруппе четвертой группы; б) в побочной подгруппе второй группы.
3.
Какие элементы главной подгруппы пятой группы
являются элементами малых периодов. Напишите их символы, названия, порядковые
номера.
4.
Напишите формулы оксидов элементов с порядковыми
номерами 16, 21, 25, 48, 76, в которых эти элементы имеют высшую валентность.
5.
Какой элемент имеет более выраженные металлические
свойства: Са (Z = 20) или Ва
(Z = 56). Почему?
6.
Какой элемент имеет более выраженные неметаллические
свойства: Р (Z = 15) или Cl (Z = 17). Почему?
7.
Какой элемент четвертого периода является самым
активным неметаллом. Почему?
8.
Исходя из положения галлия в периодической системе
элементов Д.
В коком периоде, в какой группе и в какой подгруппе
находятся элементы с порядковыми номерами 14, 29, 52, 56, 78.
2.
Напишите символы, названия и порядковые номера всех
элементов, которые находятся: а) в главной подгруппе четвертой группы; б) в побочной подгруппе второй группы.
3.
Какие элементы главной подгруппы пятой группы
являются элементами малых периодов. Напишите их символы, названия, порядковые
номера.
4.
Напишите формулы оксидов элементов с порядковыми
номерами 16, 21, 25, 48, 76, в которых эти элементы имеют высшую валентность.
5.
Какой элемент имеет более выраженные металлические
свойства: Са (Z = 20) или Ва
(Z = 56). Почему?
6.
Какой элемент имеет более выраженные неметаллические
свойства: Р (Z = 15) или Cl (Z = 17). Почему?
7.
Какой элемент четвертого периода является самым
активным неметаллом. Почему?
8.
Исходя из положения галлия в периодической системе
элементов Д.10. Элемент образует высший оксид состава ЭО3. С водородом этот же элемент образует летучее соединение, массовая доля водорода в котором составляет 5,88%. Рассчитайте относительную атомную массу элемента и назовите его.
| 1. Среди всех элементов главной подгруппы I группы элемент литий обладает: | |
| а) наиболее выраженными металлическими свойствами | б) самой маленькой плотностью |
| в) самой большой относительной атомной массой | г) все ответы верны |
2. Гипотетическая формула высшего оксида
115-го элемента периодической системы может иметь вид: Гипотетическая формула высшего оксида
115-го элемента периодической системы может иметь вид:
|
|
| 3. Порядковый номер элемента с наибольшей электроотрицательностью в 4 группе периодической системы: | |
| 4. Сколько энергетических уровней заполнено электронами в ионе калия: | |
| 5. При сгорании 1,86 г органического вещества образовалось 3,96 г углекислого газа и 0,54 г воды. Сколько всего атомов содержит молекула этого соединения, если известно, что его молярная масса меньше 200 г/моль: | |
6. В каких рядах химические элементы
перечислены не в порядке уменьшения их атомных радиусов: В каких рядах химические элементы
перечислены не в порядке уменьшения их атомных радиусов:
|
|
| а) все ответы верны | |
| 7. В порядке возрастания энергии ионизации расположены следующие элементы: | |
| в) все ответы верны | |
| 8. По происхождению (этимологии) названий «лишним» в перечне элементов будет: | |
| 9. Одинаковое по абсолютной величине, но разное по знаку значение степени окисления в летучем водородном соединении и в высшем оксиде имеет элемент: | |
10. Свойства
высших оксидов элементов 3-го периода изменяются следующим образом:
Свойства
высших оксидов элементов 3-го периода изменяются следующим образом:
|
|
| а) амфотерные, основные, кислотные | б) основные, кислотные, амфотерные |
| в) основные, амфотерные, кислотные | г) кислотные, амфотерные, основные |
Периодическая таблица периоды — Справочник химика 21
Редкоземельные элементы обладают очень сходными химическими свойствами, их валентность равна трем.
 По-видимому, все этн элементы необходимо было поместить в один столбец периодической таблицы. Однако ни один из столбцов не был таким длинным, чтобы вместить четырнадцать элементов. Далее, поскольку атомные веса всех редкоземельных элементов очень близки, их следовало поместить в один горизонтальный ряд, другими словами, в один период. В принципе их можно было поместить в шестой период, если предположить, что он длиннее, чем четвертый и пятый, которые в свою [c.104]
По-видимому, все этн элементы необходимо было поместить в один столбец периодической таблицы. Однако ни один из столбцов не был таким длинным, чтобы вместить четырнадцать элементов. Далее, поскольку атомные веса всех редкоземельных элементов очень близки, их следовало поместить в один горизонтальный ряд, другими словами, в один период. В принципе их можно было поместить в шестой период, если предположить, что он длиннее, чем четвертый и пятый, которые в свою [c.104]В 1934 г. Ферми занялся бомбардировкой урана нейтронами в тем, чтобы узнать, нельзя ли получить атомы сг большей массой, чем уран (трансурановые элементы) В то время у урана был наибольший порядковый номер в периодической таблице, но возможно, что у элементов с большими порядковыми номерами слишком короткий период полураспада. [c.175]
Теперь легче объяснить многие факты, изложенные в гл. 7. Структура периодической таблицы, с ее группами и периодами, может рассматриваться как проявление определенной последовательности энергетических уровней атомов (см. рис. 9-2). Элементы одной группы обладают сходными химическими свойствами потому, что они имеют одинаково запол- [c.399]
рис. 9-2). Элементы одной группы обладают сходными химическими свойствами потому, что они имеют одинаково запол- [c.399]
Запишите формулу высшего оксида, формулу летучего водородного соединения (если оно существует) и укажите, пользуясь периодической таблицей, порядковый номер, период, группу, подгруппу и принадлежность к металлам пли неметаллам для следующих элементов а) магний б) кремний в) рений г) рутений [c.35]
Периодическое изменение свойств элементов представлено в периодической таблице современного вида. При расположении элементов в порядке возрастания атомных номеров и группировке на основании общих свойств они образуют семь горизонтальных рядов, называемых периодами. Каждый вертикальный столбец — группа элементов — содержит элементы с близкими свойствами. Группа лития (Ы), состоит, например, из шести элементов. Все эти элементы — крайне реакционноспособные металлы, образующие хлориды и оксиды общей формулы ЭС1 и Э2О соответственно. Так же, как хлорид натрия, все хлориды и оксиды этих элементов — ионные соединения. В противоположность этому группа гелия, расположенная по правому краю таблицы, состоит из крайне инертных элементов (к настоящему времени известны соединения только ксенона и криптона). Элементы группы гелия известны под названием благородные газы. [c.127]
Так же, как хлорид натрия, все хлориды и оксиды этих элементов — ионные соединения. В противоположность этому группа гелия, расположенная по правому краю таблицы, состоит из крайне инертных элементов (к настоящему времени известны соединения только ксенона и криптона). Элементы группы гелия известны под названием благородные газы. [c.127]
Такая периодическая таблица элементов была яснее и нагляднее, чем график, и, кроме того, Менделеев сумел избежать ошибки Ньюлендса, настаивавшего на равенстве периодов. [c.99]
Наиболее устойчивые элементы — благородные газы-располагаются в последовательном ряду элементов с возрастающими порядковыми номерами с интервалами 2, 8, 8, 18, 18 и 32. Зная эти интервалы и наиболее важные сходства в свойствах элементов, можно построить периодическую таблицу, в которой сходные элементы располагаются друг под другом в вертикальных колонках — группах, а химические свойства элементов закономерно изменяются вдоль горизонтальных рядов-периодов. Полную, длиннопериодную форму периодической таблицы можно Представить в компактной, свернутой форме, наглядно иллюстрирующей возможность разбиения всех элементов на три категории типические (непереходные) элементы, для которых характерно значительное изменение свойств внутри периодов переходные металлы, более сходные между собой по свойствам, и внутренние переходные металлы с чрезвычайно близкими свойствами. [c.323]
Полную, длиннопериодную форму периодической таблицы можно Представить в компактной, свернутой форме, наглядно иллюстрирующей возможность разбиения всех элементов на три категории типические (непереходные) элементы, для которых характерно значительное изменение свойств внутри периодов переходные металлы, более сходные между собой по свойствам, и внутренние переходные металлы с чрезвычайно близкими свойствами. [c.323]
Как должна измениться реакционная способность металлов при переходе слева направо по данному ряду (периоду) периодической таблицы (При ответе на этот вопрос полезно сравнить активности натрия, магния и алюминия.) В какой части периодической таблицы расположены наиболее и наименее реакционноспособные металлы [c.151]
Например, в настоящее время установлено, что атомные массы возрастают в такой последовательности Ре, N1, Со, Си в четвертом периоде (ср. с 4-й строкой рис. 7-1), Яи, КЬ, Рс1, Ag в пятом периоде (ср. с 6-й строкой рис. 7-1) и 08, 1г, Р1, Аи в шестом периоде (ср. с 10-й строкой рис. 7-1). Однако N1 по своим свойствам больше напоминает Рё и Р1, чем Со. Кроме того, оказалось, что Те имеет большую атомную массу, чем I, но I несомненно сходен по химическим свойствам с С1 и Вг, а Те сходен с 8 и 8е. Наконец, после открытия благородных газов обнаружилось, что Аг имеет большую атомную массу, чем К, тогда как все остальные благородные газы имеют меньшие атомные массы, чем ближайшие к ним щелочные металлы. Совершенно очевидно, что во всех трех отмеченных случаях нельзя руководствоваться атомными массами при размещении элементов в периодической системе. Поэтому всем элементам периодической системы были приписаны порядковые номера от 1 до 92 (в наше время до 105). (Порядковые номера элементов приблизительно соответствуют возрастанию их атомных масс.) Если расположить элементы в периодической таблице в последовательности возрастания их порядковых номеров, химически сходные элементы образуют в ней вертикальные колонки (семейства или группы).
7-1) и 08, 1г, Р1, Аи в шестом периоде (ср. с 10-й строкой рис. 7-1). Однако N1 по своим свойствам больше напоминает Рё и Р1, чем Со. Кроме того, оказалось, что Те имеет большую атомную массу, чем I, но I несомненно сходен по химическим свойствам с С1 и Вг, а Те сходен с 8 и 8е. Наконец, после открытия благородных газов обнаружилось, что Аг имеет большую атомную массу, чем К, тогда как все остальные благородные газы имеют меньшие атомные массы, чем ближайшие к ним щелочные металлы. Совершенно очевидно, что во всех трех отмеченных случаях нельзя руководствоваться атомными массами при размещении элементов в периодической системе. Поэтому всем элементам периодической системы были приписаны порядковые номера от 1 до 92 (в наше время до 105). (Порядковые номера элементов приблизительно соответствуют возрастанию их атомных масс.) Если расположить элементы в периодической таблице в последовательности возрастания их порядковых номеров, химически сходные элементы образуют в ней вертикальные колонки (семейства или группы). [c.311]
[c.311]
В связи с возможностью достижения новой области устойчивости представляет интерес дальнейшее расширение таблицы периодической системы элементов. На рис. 23-7 показан расширенный вариант периодической таблицы, включающий весь частично заполненный в настоящее время седьмой период и новый восьмой период. В последнем впервые встречаются д-орбитали, 5д. Последовательность заполнения орбиталей 5д, б/ и Id точно предсказать заранее невозможно. Однако проведенные в исследовательском центре Лос-Аламоса расчеты указывают, что после первых одного-двух новых электронов следующие электроны должны последовательно заполнять 5д-орбитали. Соответствующие элементы могут быть названы сверхпереходными металлами. [c.423]
Ковалентные и ионные радиусы уменьшаются при движении слева направо по периодам Периодической таблицы. В первом коротком периоде (11 — Р) заряд ядра атома увеличивается от 3 до 9. Из-за увеличения заряда ядра К-электроны приближаются к ядру и радиус Д -оболочки уменьшается. Влияние этого обстоятельства на электроны -оболочки осложняется тем, что они экранированы от ядра Л -оболочкой и эффективно действующий ядерный заряд оказывается меньше действительного заряда ядра атома. Например, у лития внешний электрон притягивается ядром с зарядом — -3, экранированным двумя электронами. Вследствие чего значение действующего заряда оказывается ближе к +1, чем к +3. У бериллия -электроны экранированы двумя электронами, что приводит к уменьшению действующего на них заряда от +4 приблизительно до +2. Тем не менее при движении по периоду слева направо эффективные заряды ядер увеличиваются, что является причиной постепенного уменьшения атомных радиусов (см. рис. 15.4, б). Радиусы ионов с одинаковыми зарядами (например, M + ) изменяются аналогично. [c.361]
Влияние этого обстоятельства на электроны -оболочки осложняется тем, что они экранированы от ядра Л -оболочкой и эффективно действующий ядерный заряд оказывается меньше действительного заряда ядра атома. Например, у лития внешний электрон притягивается ядром с зарядом — -3, экранированным двумя электронами. Вследствие чего значение действующего заряда оказывается ближе к +1, чем к +3. У бериллия -электроны экранированы двумя электронами, что приводит к уменьшению действующего на них заряда от +4 приблизительно до +2. Тем не менее при движении по периоду слева направо эффективные заряды ядер увеличиваются, что является причиной постепенного уменьшения атомных радиусов (см. рис. 15.4, б). Радиусы ионов с одинаковыми зарядами (например, M + ) изменяются аналогично. [c.361]
В Пределах подгруппы элементов в периодической таблице энтропия простых веществ растет, однако не потому, что она является однозначной функцией массы. В последнем легко убедиться, рассмотрев ход изменения энтропии элементов третьего периода (рис. 2.6). Так, хотя в ряду Na — Аг атомная масса увеличивается, однако м8 претерпевает сложное изменение. Переход от мягкого натрия к твердому кремнию сопровождается уменьшением энтропии, затем опа несколько [c.180]
2.6). Так, хотя в ряду Na — Аг атомная масса увеличивается, однако м8 претерпевает сложное изменение. Переход от мягкого натрия к твердому кремнию сопровождается уменьшением энтропии, затем опа несколько [c.180]
Дальше наступил период совершенствования Периодической системы, в котором участвовали ученые многих стран. Характерно, что сотни вариантов системы, предложенные учеными позже, не носили самостоятельного характера, а были направлены на усовершенствование или модернизацию Периодической системы элементов Менделеева. Слова таблица и периодическая стали в них заклинаниями. Они как бы накладывали табу на другие способы наглядного представления естественного множества химических элементов как системы природы. Правда, у некоторых ученых возникал вопрос а почему только таблица Но это воспринималось как ересь, и отступников ставили на место. А вот в логической корректности словосочетания периодическая таблица никто не усомнился.
 Потрясение ученых, вызванное открытием Д. И. Менделеева, было настолько сильным, что им было не до логико-семантических тонкостей. Хотя в теоретической науке и это важно. Допустимо говорить периодическая сис- [c.60]
Потрясение ученых, вызванное открытием Д. И. Менделеева, было настолько сильным, что им было не до логико-семантических тонкостей. Хотя в теоретической науке и это важно. Допустимо говорить периодическая сис- [c.60]Восьмая группа периодической системы включает в себя три тройки, или триады, металлов (см. периодическую таблицу). Эти элементы стоят в середине длинных периодов и являются связывающими звеньями между четным и нечетным рядом каждого периода [c.160]
Объясните структуру периодической таблицы элементов Д. И. Менделеева. Что такое период, группа элементов Как в них изменяются свойства элементов [c.22]
Атомы третьего и последующих периодов периодической таблицы образуют также связи с -электронами. При этом осуществляется квадратное или октаэдрическое расположение связей,, [c.93]
Большую часть материала, изложенного в данной главе, намного легче понять и запомнить, если руководствоваться некоторыми закономерностями в физических и химических свойствах элементов, связанных с их положением в периодической таблице. Некоторые из наиболее важных закономерностей этого типа иллюстрируются рис. 21.3. Напомним, что электроотрицательность элементов возрастает при перемещении снизу вверх вдоль любой группы и слева направо в любом периоде. Таким образом, неметаллы характеризуются более высокими электроотрицательностями, чем металлы. При перемещении сверху вниз в каждой группе последовательно усиливаются 1 металлические свойства элементов. [c.284]
Некоторые из наиболее важных закономерностей этого типа иллюстрируются рис. 21.3. Напомним, что электроотрицательность элементов возрастает при перемещении снизу вверх вдоль любой группы и слева направо в любом периоде. Таким образом, неметаллы характеризуются более высокими электроотрицательностями, чем металлы. При перемещении сверху вниз в каждой группе последовательно усиливаются 1 металлические свойства элементов. [c.284]
Попробуем теперь использовать Периодическую таблицу для предсказания свойств неизвестных Вам элементов. Для этого воспользуемся тем, что в группе и периоде свойства меняются постепенно. Следовательно, свойства элемента должны представлять из себя нечто среднее между свойствами его ближайших соседей по группе и периоду. Рассчитаем, например, какой тогда будет относительная атомная масса атома Mg [c.89]
Найдите в периодической таблице элемент, принадлежащий к IV периоду и проявляющий одинаковые значения валентности Б своем водородном соединении и в высшем оксиде. [c.36]
[c.36]
Два металла — А и В — принадлежат к одному и тому же периоду и к одной и той же группе. Элемент А образует только один хлорид, а элемент В — два хлорида, в одном из которых он проявляет более высокую валентность, чем это соответствует его положению в периодической таблице. Этот хлорид содержит 52,5% хлора. Назовите эти элементы. [c.161]
При попытке связать электронную конфигурацию атома эле мента с положением в периоди ческой системе видно, что длинная форма периодической таблицы может быть разделена на четыре главные секции, как показано на рис. 3-8. Секция, обозначенная 5, содержит по два элемента каждого периода, секция р содержит по шесть, 1 — по десять, / — по 14 элементов. Это приводит к мысли о связи периодической системы с 5-, р-, д.- и /-состояниями, так как в этих состояниях может находиться соответственно 2, 6, 10 и 14 электронов. [c.98]
Разработанный для молекулы водорода механизм образования химической связи позднее был распространен и на другие молекулы. Рассмотрим образование химической связи в двухатомных молекулах элементов первого и второго периодов периодической таблицы [c.43]
Рассмотрим образование химической связи в двухатомных молекулах элементов первого и второго периодов периодической таблицы [c.43]
Изобразим строение, электронных оболочек оставшихся пяти атомов второго периода периодической таблицы Менделеева [c.51]
Если ограничиться вторым периодом периодической таблицы, то Ь может быть только азотом, а —углеродом или азотом, с — углеродом, кислородом или азотом. Следовательно, существует шесть типов таких соединений. К ним относятся приведенные [c.235]
Во всех остальных группах периодической таблицы наблюдаются аналогичные отклонения в свойствах элементов главных и побочных подгрупп. Это объясняется тем, что в результате разделения периода на два ряда и расположения одного ряда под другим, начиная с четвертого, элементы, находящиеся далеко друг от друга по периоду, попадают в одну группу (главная и побочная подгруппы). [c.24]
Изменение формы высших кислородных кислот неметаллов одной и той же группы объясняется тем, что с возрастанием порядкового номера неметалла увеличивается радиус его атома, а с увеличением радиуса атом может разместить вокруг себя большее число атомов кислорода. Формулы высших кислородных кислот неметаллов приведены в таблице 1. Они размещены в ней так же, как соответствующие элементы в периодической таблице. В кислотах неметаллов II периода, как видно из таблицы 1, к атому неметалла присоединено 3, у неметаллов III и IV периода — 4, а у неметаллов V периода — 6 атомов кислорода. [c.30]
Формулы высших кислородных кислот неметаллов приведены в таблице 1. Они размещены в ней так же, как соответствующие элементы в периодической таблице. В кислотах неметаллов II периода, как видно из таблицы 1, к атому неметалла присоединено 3, у неметаллов III и IV периода — 4, а у неметаллов V периода — 6 атомов кислорода. [c.30]
Почему в IV и V периодах, в отличие от III периода, между сильным основанием (щелочью) и амфотерной гидроокисью в таблице отсутствует слабое основание (Указание сравните таблицу 1 с периодической таблицей.) [c.34]
В приближении водородоподобных электронов, т. е. при замене отталкивания экранированием, можно пользоваться описанными выше квантовыми числами — п, I, т и 5. Рассмотрим порядок заполнения квантовых состояний атомов, находящихся в начале периодической таблицы элементов. Это заполнение происходит так, чтобы соблюдалось требование минимума энергии. Поэтому очевидно, что электрон атома водорода (2=1) занимает состояние 15. У Не (2=2) в то же состояние можно поместить еще один электрон без нарушения принципа Паули из-за насыщенности (антипараллельности) их спинов, т.е. Не (15) . Однако у (2=3) третий электрон уже вынужден из-за принципа Паули занимать другое состояние, а именно Ы(1з)2(25). Таким образом, в первом периоде, соответствующем п = 1, помещается лишь два элемента, а литий начинает второй период. Этот элемент, как и водород, является одновалентным, следующий элемент (2=4) — бериллий — имеет на уровне 25 два электрона, т.е. Ве(15)2(25)2. [c.314]
У Не (2=2) в то же состояние можно поместить еще один электрон без нарушения принципа Паули из-за насыщенности (антипараллельности) их спинов, т.е. Не (15) . Однако у (2=3) третий электрон уже вынужден из-за принципа Паули занимать другое состояние, а именно Ы(1з)2(25). Таким образом, в первом периоде, соответствующем п = 1, помещается лишь два элемента, а литий начинает второй период. Этот элемент, как и водород, является одновалентным, следующий элемент (2=4) — бериллий — имеет на уровне 25 два электрона, т.е. Ве(15)2(25)2. [c.314]
Кислород (2=8) 0(ls)2(2s)2(2p) имеет валентность, равную двум, фтор (2=9) F(ls)2(2s)2(2p)s имеет валентность, равную единице, и неон (2=10) Ne(ls)2 (2s)2(2p) имеет нулевую валентность. Таким образом, неон завершает второй период периодической таблицы, в котором оказывается восемь элементов, что соответствует упомянутому выше правилу Nn — 2n , где Л/ — число элементов в периоде при первом квантовом числе, равном п. Выведем это правило в общем виде. При данном п величина квантового числа I меняется от О до п—1, а каждому значению I отвечает 2/+1 чисел т. От- [c.315]
При данном п величина квантового числа I меняется от О до п—1, а каждому значению I отвечает 2/+1 чисел т. От- [c.315]
В табл. 17.1 представлены гидриды элементов второго и третьего периодов Периодической таблицы. [c.378]
Современные формы периодической таблицы. Периоды и группы. Типические (непереходные) элементы, переходные металлы и внутренние переходные. металлы (лантаноиды и актиноиды). Семейства элементов семи.металлы, щелочные. металлы, щсло июзсмглькыс . сталли и галогены. [c.302]
Типические элементы образуют оксиды, формулы которых можно предсказать на основании положения элементов в периодической таблице например, элементы третьего периода образуют следующие оксиды НагО, МяО, А12О3, ЗЮз, Р2О5 63 и С12О7. Оксиды элементов, находящихся в левой части таблицы, являются сильными основаниями. Для них характерно наличие больщого отрицательного заряда на атомах кислорода, и по типу связи они принадлежат к ионным соединениям. Температуры плавления этих ионных оксидов, как правило, достигают 2000°С, но многие из них разлагаются уже при более низких температурах. Они реагируют с водой с образованием основных растворов [c.321]
Температуры плавления этих ионных оксидов, как правило, достигают 2000°С, но многие из них разлагаются уже при более низких температурах. Они реагируют с водой с образованием основных растворов [c.321]
В каждом периоде периодической таблицы наблюдается общая тенденция к возрастанию энергии ионизации с увеличением порядкового номера элемента. Сродство к электрону оказывается наибольшим у кислорода и галогенов. Атомы с устойчивыми орбитальными конфигурациями.(s , s p , s p ) имеют очень небольшое (часто отрицательное) сродство к электрону. Расстояние между ядрами двух связанных атомов называется длиной связи. Атомный радиус водорода Н равен половине длины связи в молекуле Hj- В каждом периоде периодической таблицы наблюдается в общем закономерное уменьшение атомного радиуса с ростом порядкового номера элемента. Электроотрицательность представляет собой меру притяжения атомом электронов, участвующих в образовании связи с другим атомом. При соединении атомов с си. пьно отличающейся электроотрицательностью происходит перенос электронов и возникает ионная связь атомы с приблизительно одинаковой электроотрицательностью обобществляют электроны, участвующие s сбразовашг. ковалентной связи. Между атомами типа Н и F с умеренной разностью электроотрицательностей образуется связь с частично ионным характером. [c.408]
пьно отличающейся электроотрицательностью происходит перенос электронов и возникает ионная связь атомы с приблизительно одинаковой электроотрицательностью обобществляют электроны, участвующие s сбразовашг. ковалентной связи. Между атомами типа Н и F с умеренной разностью электроотрицательностей образуется связь с частично ионным характером. [c.408]
VI групп, примыкающие к диагонали бор — астат,— типичные полупроводники (т. е. их электрическая проводимость с повышением температуры увеличивается, а не уменьшается). Характерная черта этих элементов — образование амфотерных гидроксидов (с. 151). Наиболее многочисленны d-металлы. В периодической таблице химических элементов Д. И. Менделеева они расположены между S- и р-элементами и получили название переходных металлов. У атомов d-элементов происходит достройка d-орбиталей. Каждое семейство состоит из десяти d-элементов. Известны четыре d-семейства 3d, 4d, 5d, и 6d. Кроме скандия и цинка, все переходные металлы могут иметь несколько степеней окисления. Максимально возможная степень окисления d-металлов +8 (у осмия, например, OsOj). С ростом порядкового номера максимальная степень окисления возрастает от III группы до первого элемента VIII группы, а затем убывает. Эти элементы — типичные металлы. Химия изоэлектронных соединений d-элементов весьма похожа. Элементы разных периодов с аналогичной электронной структурой d-слоев образуют побочные подгруппы периодической системы (например, медь — серебро — золото, цинк — кадмий — ртуть и т. п.). Самая характерная особенность d-элементов — исключительная способность к комплексообра-зованию. Этим они резко отличаются от непереходных элементов. Химию комплексных соединений часто называют химией переходных металлов. [c.141]
Максимально возможная степень окисления d-металлов +8 (у осмия, например, OsOj). С ростом порядкового номера максимальная степень окисления возрастает от III группы до первого элемента VIII группы, а затем убывает. Эти элементы — типичные металлы. Химия изоэлектронных соединений d-элементов весьма похожа. Элементы разных периодов с аналогичной электронной структурой d-слоев образуют побочные подгруппы периодической системы (например, медь — серебро — золото, цинк — кадмий — ртуть и т. п.). Самая характерная особенность d-элементов — исключительная способность к комплексообра-зованию. Этим они резко отличаются от непереходных элементов. Химию комплексных соединений часто называют химией переходных металлов. [c.141]
Обратившись к периодической таблице Кэмбелла, можно увидеть, что в периодах системы по мере увеличения порядкового номера атомный радиус уменьшается. Постепенно прибавляющиеся электроны попадают на орбитали с почти одинаковой энергией. Поэтому увеличивающийся заряд ядра притягивает электронное облако в целом с большей силой. Уменьшение радиуса проявляется сильнее всего в случае, когда на валентную оболочку добавляется вто рой 5-электрон относительно меньше снижается радиус от прп [c.114]
Уменьшение радиуса проявляется сильнее всего в случае, когда на валентную оболочку добавляется вто рой 5-электрон относительно меньше снижается радиус от прп [c.114]
Наиболее иоздиее по времени указание Менделеева по проблеме РЗЭ мы находим в примечании к периодической таблице в восьмом (последнем прижизненном) издании Основ химии , тщательно отредактированном самим автором. Менделеев дает следующую итоговую оценку проблемы РЗЭ Между Ge=140 и Та=183 недостает целого большого периода, ио ряд редких элементов (изучение их не полно) например, Рг=141, Nd=144, Sm=150, Eu = 152, Gd = 160, Но=165 Ег=166, Tu=I71 и Yb=173 представляет, по современным сведениям вес атома, как раз восполняющий этот промежуток, потому в указан ном месте периодическая система элементов представляет собой сво го рода разрыв, требующий новых изысканий [18, с. 367]. [c.90]
При сравнении нуклеофилов, атакующие атомы которых находятся в одном периоде периодической таблицы, нуклео-фильность приблизительно совпадает с порядком основности, хотя основность контролируется термодинамически, а нуклео-фильность — кинетически. Поэтому примерный порядок нуклеофильности следующий ЫН2 >НО->ОН->Н2ЫН>АгО > >NHз>пиpидин>F->h30> 104- есть и другой ряд КзС > >Н2Ы >К0 >р- (см. т. 1, табл. 8.1). Корреляции такого типа лучше всего работают при сравнении нуклеофилов сходной структуры, как, например, в случае серии замещенных фенолятов [259]. [c.76]
Поэтому примерный порядок нуклеофильности следующий ЫН2 >НО->ОН->Н2ЫН>АгО > >NHз>пиpидин>F->h30> 104- есть и другой ряд КзС > >Н2Ы >К0 >р- (см. т. 1, табл. 8.1). Корреляции такого типа лучше всего работают при сравнении нуклеофилов сходной структуры, как, например, в случае серии замещенных фенолятов [259]. [c.76]
В современной периодической таблице Д. И. Менделеева водород расположен в УПА группе под фтором, порядковый номер которого (9) отличается от порядкового номера водорода (1) на 8 его соседом по периоду является элемент УП1А группы Не с порядковым номером (2). Такое расположение отвечает современному физическому смыслу периодичности. Вместе с тем говорить [c.411]
Появляющийся при переходе от фтора к неону Ne (2=10) десятый электрон завершает заполнение энергетических состояний, отвечающих главному квантовому числу п =…. Эта особенность находит о(гражение в периодической таблице, в которой неоном заканчивается. .. период. [c.34]
.. период. [c.34]
Первым потенциалом ионизации называется энергия, необходимая для отрыва от изолированного атома в газообразном состоянии электрона, слабее других связанного с ядром. Второй потенциал ионизации — это энергия, необходимая для удаления второго электрона, и т. д. Энергия ионизации в периодической таблице возрастает слева направо для элементов одного периода, поскольку увеличивается заряд ядра (табл. 4). В столбце табл. 5 она уменьшается сверху вниз из-за увеличения расстояния электрона от ядра. Видно также, что энергия удаления электрона возрастает с числом отры- [c.39]
Однако в те времена многих клавишей не хватало. Было известно 63 элемента из 92 естественно существующих. Многие клавиши издавали фальшивые звуки . Так, Д. И. Менделееву пришлось изменить атомные массы урана и тория, которые тогда принимали равными 116 и 120 (вместо 232 и 240) и атомную массу циркония, принимавшуюся в то время равной 138 (вместо 91). Д. И. Менделеев сумел увидеть (вернее, предвидеть) основной закон, согласно которому многие свойства элементов (валентность, атомные объемы, коэффициенты расширения и др.) изменяются периодически с возрастанием атомной массы элементов. Открытие периодического закона затруднялось из-за его сложности. Размеры периодов не одинаковы. Если в первом периоде (Н, Не) содержится всего два элемента, то во втором (Е1—Ые) — восемь, в третьем (Ма—Аг) — снова восемь, в четвертом (К—Кг)—восемнадцать, в пятом (КЬ—Хе)—тоже восемнадцать, в шестом (Сз—Кп)—тридцать два и, наконец, седьмой период оказывается недостроенным. Отметим, что числа элементов в периодах (2, 8, 8, 18, 18, 32) подчиняются общему закону 2п . При п = это выражение дает 2 при л = 2—8, при я=3—18 и при =4— 32. Кроме того, в середине периодической таблицы элементов находится 14 редкоземельных элементов, многие свойства которых (например, валентность) практически не изменяются, несмотря на увеличение атомной массы Трудность открытия периодического закона заключа лась и в том, что истинной независимой переменной, оп ределяющей свойства элементов, должна быть не масса а число электронов в атоме, т.
И. Менделеев сумел увидеть (вернее, предвидеть) основной закон, согласно которому многие свойства элементов (валентность, атомные объемы, коэффициенты расширения и др.) изменяются периодически с возрастанием атомной массы элементов. Открытие периодического закона затруднялось из-за его сложности. Размеры периодов не одинаковы. Если в первом периоде (Н, Не) содержится всего два элемента, то во втором (Е1—Ые) — восемь, в третьем (Ма—Аг) — снова восемь, в четвертом (К—Кг)—восемнадцать, в пятом (КЬ—Хе)—тоже восемнадцать, в шестом (Сз—Кп)—тридцать два и, наконец, седьмой период оказывается недостроенным. Отметим, что числа элементов в периодах (2, 8, 8, 18, 18, 32) подчиняются общему закону 2п . При п = это выражение дает 2 при л = 2—8, при я=3—18 и при =4— 32. Кроме того, в середине периодической таблицы элементов находится 14 редкоземельных элементов, многие свойства которых (например, валентность) практически не изменяются, несмотря на увеличение атомной массы Трудность открытия периодического закона заключа лась и в том, что истинной независимой переменной, оп ределяющей свойства элементов, должна быть не масса а число электронов в атоме, т. е. заряд ядра. Д. И. Мен делеев, естественно, принял массу за такую переменную так как в механике она в значительной степени опреде ляет движение частиц. Атом был электрифицирован много позднее. Если бы были известны изотопы (атомы с одинаковым зарядом ядра и разными массами, например, водород и тяжелый водород), то, располагая их в ряд по величине массы, вряд ли можно было бы открыть периодический закон. Это удалось потому, что между массовым числом и зарядом ядра имеется определенная связь. Так, в начале таблицы элементов массовое число приблизительно в два раза больше заряда ядра. Атомная масса элемента определяется также его изотопным составом. При расположении элементов по их массовым числам Д. И. Менделееву при составлении таблицы при- [c.312]
е. заряд ядра. Д. И. Мен делеев, естественно, принял массу за такую переменную так как в механике она в значительной степени опреде ляет движение частиц. Атом был электрифицирован много позднее. Если бы были известны изотопы (атомы с одинаковым зарядом ядра и разными массами, например, водород и тяжелый водород), то, располагая их в ряд по величине массы, вряд ли можно было бы открыть периодический закон. Это удалось потому, что между массовым числом и зарядом ядра имеется определенная связь. Так, в начале таблицы элементов массовое число приблизительно в два раза больше заряда ядра. Атомная масса элемента определяется также его изотопным составом. При расположении элементов по их массовым числам Д. И. Менделееву при составлении таблицы при- [c.312]
При движении слева направо по второму и третьему периодам Периодической таблицы наблюдается постепенное изменение свойств от щелочных металлов к галогенам. Четвертый период начи-Пс рпам герим нается также со щелочного (калий) и щелочнотзе-1(1. реходг(г.1х мельного (кальций) металлов. Следующие десять [c.507]
реходг(г.1х мельного (кальций) металлов. Следующие десять [c.507]
Необычные сдвиги основного уровня, вызванные окислением, на границе раздела HfO2/InP
Сначала мы обсудим различия в спектрах в зависимости от глубины зондирования и обработки образцов, начиная с P 2 p , который показывает наиболее систематические различия, затем перейдите к In 3 d и посмотрите, как связь In изменяется по отношению к P. Сделанные интерпретации также подтверждаются дополнительной информацией со спектрами Hf 4 f и S 2 p (см. рис. S1).Затем эти эффекты соотносятся с дополнительными данными из результатов вычислений и компилируются в соответствии с ними.
P 2
p измерения Из рис. 1 видно, что эмиссия P 2 p вокруг объемного пика InP (около 129 эВ, используется в качестве эталона) очень узкая и имеет хорошо выраженную 2 Дублет p , в отличие от широкой эмиссии, связанной с оксидом, при 134 эВ. Однако деконволюция спектров P 2 p вокруг объемного излучения InP осложняется тем фактом, что коэффициент ветвления изменяется от 0. 4 до 0,47, вместо теоретически предсказанного 0,5, когда только один компонент ( i , e , оба пика 2 p 3/2 и 2 p 1/2 ) включен в подгонка эмиссии при 129 эВ. Таким образом, для согласованности вводятся дополнительные компоненты I1 и I2. Следует отметить, что, в частности, I2 не очень надежен из-за лишь незначительного CLS, что приводит к большим изменениям в отношениях интенсивностей, когда сдвиги изменяются даже на +/- 0.05 эВ.
4 до 0,47, вместо теоретически предсказанного 0,5, когда только один компонент ( i , e , оба пика 2 p 3/2 и 2 p 1/2 ) включен в подгонка эмиссии при 129 эВ. Таким образом, для согласованности вводятся дополнительные компоненты I1 и I2. Следует отметить, что, в частности, I2 не очень надежен из-за лишь незначительного CLS, что приводит к большим изменениям в отношениях интенсивностей, когда сдвиги изменяются даже на +/- 0.05 эВ.
P 2p спектры с подобранными пиками. Вертикальные линии были размещены, чтобы проиллюстрировать явное смещение огибающей компонентов O, даже несмотря на то, что B на этих рисунках откалиброван до 128,7 эВ. С левой стороны показаны измерения соответствующих экспериментов с природным оксидом, а с правой стороны – обработанный сульфид. Метка энергии показывает выбранное hν фотонов.
Другие компоненты излучения P 2 p : O1, O2, O3 и O4 необходимы для воспроизведения характеристик излучения около 134 эВ. Обычно считалось, что природный оксид InP вызывает особенности при 134 эВ из-за оксидов, содержащих P, в степени окисления P +5 , таких как InPO 4 . Компоненты в этом BE также были отнесены к In(PO 3 ) 3 или могут быть связаны с разновидностями InPHfO. Здесь мы не наблюдали эмиссию типа P 0 около +1 эВ, которая обычно ассоциируется с чистой связью PP или кластерами P ( e . g . 30,31 ).
Обычно считалось, что природный оксид InP вызывает особенности при 134 эВ из-за оксидов, содержащих P, в степени окисления P +5 , таких как InPO 4 . Компоненты в этом BE также были отнесены к In(PO 3 ) 3 или могут быть связаны с разновидностями InPHfO. Здесь мы не наблюдали эмиссию типа P 0 около +1 эВ, которая обычно ассоциируется с чистой связью PP или кластерами P ( e . g . 30,31 ).
Чтобы предложить обоснованные интерпретации происхождения каждого подобранного компонента, мы обсудим распределение по глубине, из которого возникает каждый компонент. Относительные интенсивности компонентов в спектрах P 2 p перечислены в таблице 1. Кроме того, чтобы понять относительную глубину, с которой возникает компонент, интенсивности пиков были масштабированы с интенсивностью объемного пика соответствующего измерения. Затем полученные значения измерения кинетической энергии (КЭ) при 150 эВ до и после отжига делятся на соответствующие значения измерения КЭ при 300 эВ. Этот анализ обеспечивает пропорциональное увеличение компонента в самых верхних слоях; чем выше значение, тем ближе к внешней поверхности возникает компонент. Все полученные значения для значимых компонентов, кроме B, >1, что означает, что они ближе к поверхности, чем к объему, как и ожидалось. Исключение составляет I2, но его интенсивность настолько мала, что надежный анализ интенсивности для I2 невозможен. Кроме того, если значения для отожженного образца, полученные таким образом, разделить на соответствующие значения до отжига, можно сделать вывод, насколько среднее распределение каждого сигнала по глубине изменилось из-за обработки отжигом.Если бы среднее распределение оставалось на месте без движения среднего положения, последнее отношение оставалось бы единицей, так как расстояние от массы не менялось бы. Этот подход особенно чувствителен к изменениям в самых верхних поверхностных слоях из-за экспоненциальной зависимости сигнала от глубины излучения. Следует отметить, что из-за экспоненциальной зависимости это отношение останется единицей, если имеет место незначительное уширение или смещение конкретного состояния к поверхности и одновременно значительное расширение или смещение к объему.
Этот анализ обеспечивает пропорциональное увеличение компонента в самых верхних слоях; чем выше значение, тем ближе к внешней поверхности возникает компонент. Все полученные значения для значимых компонентов, кроме B, >1, что означает, что они ближе к поверхности, чем к объему, как и ожидалось. Исключение составляет I2, но его интенсивность настолько мала, что надежный анализ интенсивности для I2 невозможен. Кроме того, если значения для отожженного образца, полученные таким образом, разделить на соответствующие значения до отжига, можно сделать вывод, насколько среднее распределение каждого сигнала по глубине изменилось из-за обработки отжигом.Если бы среднее распределение оставалось на месте без движения среднего положения, последнее отношение оставалось бы единицей, так как расстояние от массы не менялось бы. Этот подход особенно чувствителен к изменениям в самых верхних поверхностных слоях из-за экспоненциальной зависимости сигнала от глубины излучения. Следует отметить, что из-за экспоненциальной зависимости это отношение останется единицей, если имеет место незначительное уширение или смещение конкретного состояния к поверхности и одновременно значительное расширение или смещение к объему.
Далее мы представляем эффекты отжига, наблюдаемые в P 2 p , на образце естественного оксида. На левой панели рис. 1 в зависимости от отжига видно увеличение интенсивности I1, что позволяет предположить, что некоторые связи O-P восстанавливаются до химического состояния, связанного с границей раздела, такого как димеры P.Это согласуется с изменениями в распределении I1 и O1 по глубине: распределение I1 по глубине остается относительно постоянным; и . e ., близко к границе раздела, в то время как средняя глубина O1 перемещается ближе к внешней поверхности из-за потери таких частиц P вблизи объемного InP (обратите внимание, что когда мы говорим о движении, это может означать либо диффузию, либо, реконфигурация химических связей по-разному на поверхности и в объеме, приводящая к движению средней глубины данного состояния). Еще одно заметное отличие заключается в том, что интенсивность O4 чрезвычайно увеличилась, и его распределение по глубине смещается к поверхности, в то время как O2 сместился глубже и уменьшился, а O3 остался в своем среднем распределении по глубине и увеличился. Мы отмечаем, что если бы наблюдаемые эффекты были вызваны ростом оксида как «утолщением» без химически индуцированного перераспределения, каждый из компонентов должен был бы наблюдаться движущимся к самой внешней поверхности, поскольку они относятся к глубине объемного сигнала. Однако мы видим эффекты в обоих направлениях без подавления объемной пиковой интенсивности сигнала, что указывает на то, что эффекты действительно обусловлены локальным и, в конечном счете, длительным превращением одного соединения в другое на разных глубинах или, возможно, также перекрестной диффузией различных разновидность.Подытоживая, можно сказать, что в оксидной пленке увеличивается количество высшего компонента БЭ, причем его присутствие, а также увеличение более выражены ближе к поверхности.
Еще одно заметное отличие заключается в том, что интенсивность O4 чрезвычайно увеличилась, и его распределение по глубине смещается к поверхности, в то время как O2 сместился глубже и уменьшился, а O3 остался в своем среднем распределении по глубине и увеличился. Мы отмечаем, что если бы наблюдаемые эффекты были вызваны ростом оксида как «утолщением» без химически индуцированного перераспределения, каждый из компонентов должен был бы наблюдаться движущимся к самой внешней поверхности, поскольку они относятся к глубине объемного сигнала. Однако мы видим эффекты в обоих направлениях без подавления объемной пиковой интенсивности сигнала, что указывает на то, что эффекты действительно обусловлены локальным и, в конечном счете, длительным превращением одного соединения в другое на разных глубинах или, возможно, также перекрестной диффузией различных разновидность.Подытоживая, можно сказать, что в оксидной пленке увеличивается количество высшего компонента БЭ, причем его присутствие, а также увеличение более выражены ближе к поверхности. Компонент O1, скорее всего, представляет собой нестабильную фазу на границе раздела, диссоциирующую на P и O. Эти атомы могут в дальнейшем образовывать связи PP на границе раздела, а также более сильно окисленный PO над этой областью.
Компонент O1, скорее всего, представляет собой нестабильную фазу на границе раздела, диссоциирующую на P и O. Эти атомы могут в дальнейшем образовывать связи PP на границе раздела, а также более сильно окисленный PO над этой областью.
Последствия обработки сульфидом проявляются в виде повышенного объемного выделения после отжига, меньшего разложения O1 в I1, предположительно приписываемого связыванию PP на границе раздела, и отчетливого преобразования всех степеней окисления более однородно в состояние O3 (+4.97 эВ) вместо O4 (+5,30 эВ), особенно вблизи поверхности. Согласованная модель, объясняющая этот эффект, будет обсуждаться после компьютерного анализа CLS моделей межфазных природных оксидов.
In 3
d измерение На рис. 2 видно, что интенсивность компонента B в спектрах In 3 d 3/2 увеличивается по отношению к другим компонентам, когда объемная чувствительность измерения увеличиваются. Таким образом, B прямо интерпретируется как компонент, возникающий из-за эмиссии химического состояния объемного кристалла, и его интенсивность должна изменяться так же, как для P 2 p B, как описано ранее. Дальнейшее обоснование точного положения объемного компонента получено только из-за небольшого изменения положения BE (<0,3 эВ для данного образца). В таблице 2 показаны пропорциональные интегрированные интенсивности сигналов каждого пика для всех измерений.
Дальнейшее обоснование точного положения объемного компонента получено только из-за небольшого изменения положения BE (<0,3 эВ для данного образца). В таблице 2 показаны пропорциональные интегрированные интенсивности сигналов каждого пика для всех измерений.
In 3 d спектры с подобранными пиками. Слева показан образец, обработанный сульфидом, и соответствующие эксперименты. Справа показаны соответствующие спектры образца, обработанного сульфидом.Метка энергии показывает выбранное hν фотонов. Примечательно, что эмиссия I2 наблюдается для всех измерений, но резко увеличивается для нативного + отожженного образца.
Таблица 2 В первых столбцах (в разделе «Интенсивность сигнала») приведены пропорциональные интенсивности подобранных пиков для In 3d 3/2 для каждого измерения. Из рис. 1 и 2 видно, что эмиссия In изменяется гораздо сильнее, чем эмиссия P, из-за отжига. Это согласуется с энергетикой образования связи 32 : конфигурации связи P-O-P и In-O-P сильнее, чем чистый In-O-In.Таким образом, InP является исключением среди различных кристаллов III-V, поскольку часто окисление элементов III группы ( e . g ., In) приводит к более устойчивой оксидной фазе, чем V группы ( e . г ., Ас) окисление 33 .
Это согласуется с энергетикой образования связи 32 : конфигурации связи P-O-P и In-O-P сильнее, чем чистый In-O-In.Таким образом, InP является исключением среди различных кристаллов III-V, поскольку часто окисление элементов III группы ( e . g ., In) приводит к более устойчивой оксидной фазе, чем V группы ( e . г ., Ас) окисление 33 .
Другие компоненты, I1, I2, I3, I4 и O, были введены для учета всех наблюдаемых спектральных характеристик в зависимости от чувствительности поверхности и/или различных обработок. Эти же компоненты соответствуют всем спектрам, хотя мы отмечаем, что некоторые компоненты могут быть отнесены к совершенно разным химическим состояниям или соединениям из-за разной обработки.Изменение не подгоняется как отдельные компоненты из-за конечного разрешения, а скорее принимается во внимание как неоднородное уширение (FWHM) химических состояний ( i . e ., нет отдельного пика, например, для In- S по сравнению с образцом природного оксида из-за близкого расположения существующих пиков). В высшей степени примечательно наблюдение, что, хотя BE пика B тщательно рассматривается и корректируется, I2 с отрицательным CLS сохраняется для каждого из результатов.
В высшей степени примечательно наблюдение, что, хотя BE пика B тщательно рассматривается и корректируется, I2 с отрицательным CLS сохраняется для каждого из результатов.
Для изучения распределения каждой эмиссионной компоненты по глубине значения интенсивности компонентов In 3 d приведены в таблице 2, аналогично P 2 p в таблице 1.
До отжига источник I2 близко к границе объема, в то время как I4, I3 и O располагаются все ближе к внешней поверхности. Однако при отжиге распределение по глубине меняется, так что средняя глубина сигнала I2 смещается ближе к поверхности. Все остальные компоненты, связанные с интерфейсом, остаются практически неизменными с точки зрения распределения по глубине.Пропорциональная объемная интенсивность остается одинаковой до и после отжига, что означает отсутствие значительной чистой сегрегации по направлению к поверхности (что привело бы к более низкой пропорциональной интенсивности сигнала B) или, альтернативно, что имеет место значительное сопутствующее испарение частиц In с поверхности. Компоненты I3 и I4 довольно хорошо сохраняют свое распределение по глубине вблизи объема, что означает, что они, вероятно, связаны с границей раздела объем-собственный оксид. Это также может быть верно для происхождения I2, если есть два перекрывающихся компонента с очень небольшой разницей в BE вокруг положения I2.I3 и O близко совпадают со сдвигами BE, о которых сообщалось ранее для химических состояний оксида In +3 и InPO 4 , соответственно [ e . г . 30,31 ]. Степень окисления In +3 обычно соответствует относительно большой ширине пика, чтобы принять во внимание обычно наблюдаемую неоднородность в связывающей среде аморфного природного оксида 30,31 . Однако в этой работе мы использовали довольно узкую ширину пика из-за явного изменения формы спектра, которое нельзя было описать с помощью одного пика с гауссовским акцентом.Напротив, были введены два отдельных компонента, I3 и I4, а пик O был приспособлен к широкой форме.
Компоненты I3 и I4 довольно хорошо сохраняют свое распределение по глубине вблизи объема, что означает, что они, вероятно, связаны с границей раздела объем-собственный оксид. Это также может быть верно для происхождения I2, если есть два перекрывающихся компонента с очень небольшой разницей в BE вокруг положения I2.I3 и O близко совпадают со сдвигами BE, о которых сообщалось ранее для химических состояний оксида In +3 и InPO 4 , соответственно [ e . г . 30,31 ]. Степень окисления In +3 обычно соответствует относительно большой ширине пика, чтобы принять во внимание обычно наблюдаемую неоднородность в связывающей среде аморфного природного оксида 30,31 . Однако в этой работе мы использовали довольно узкую ширину пика из-за явного изменения формы спектра, которое нельзя было описать с помощью одного пика с гауссовским акцентом.Напротив, были введены два отдельных компонента, I3 и I4, а пик O был приспособлен к широкой форме. Наблюдение трех отдельных компонентов отражает тот факт (обсуждаемый далее в следующем разделе), что одна и та же степень окисления, иногда грубо приписываемая In 3+ , может содержаться в нескольких заметно различающихся соединениях, и точный сдвиг BE диктуется специфические составляющие и связующая среда. Большой сдвиг компонента O от объемного пика обеспечивает дополнительную поддержку положения объемного пика, фиксируя его сдвиг равным 1.2 эВ, так что плечеподобная особенность хорошо подогнана, а изменение интенсивности объемного пика все еще хорошо объясняется как функция поверхностной чувствительности и похожее поведение, как в P 2 p .
Наблюдение трех отдельных компонентов отражает тот факт (обсуждаемый далее в следующем разделе), что одна и та же степень окисления, иногда грубо приписываемая In 3+ , может содержаться в нескольких заметно различающихся соединениях, и точный сдвиг BE диктуется специфические составляющие и связующая среда. Большой сдвиг компонента O от объемного пика обеспечивает дополнительную поддержку положения объемного пика, фиксируя его сдвиг равным 1.2 эВ, так что плечеподобная особенность хорошо подогнана, а изменение интенсивности объемного пика все еще хорошо объясняется как функция поверхностной чувствительности и похожее поведение, как в P 2 p .
Интересно, что эмиссия на отрицательной стороне BE (т.е. компонента I2) сильно увеличивается во время обработки отжигом. Отрицательные CLS в спектрах группы III контактов изолятор / III-V обычно интерпретируются как атомы металла группы III или кластеры / капли и / или заполненные состояния оборванной связи.Интуитивно понятно, что глубина сигнала компонента I2 и ее изменение из-за отжига (таблица 2) предполагает, что происхождение I2 связано с атомами In, оторванными от природного оксида и диффундировавшими в пленку HfO 2 по направлению к поверхности. I3 и I4 кажутся компонентами природного оксида, которые несколько разлагаются во время отжига и, возможно, реконфигурируются в состояния, соответствующие либо компоненту I2, либо компоненту O, который, согласно нашему прямому анализу, интерпретируется как находящийся на границе природного оксида и HfO 2 .
I3 и I4 кажутся компонентами природного оксида, которые несколько разлагаются во время отжига и, возможно, реконфигурируются в состояния, соответствующие либо компоненту I2, либо компоненту O, который, согласно нашему прямому анализу, интерпретируется как находящийся на границе природного оксида и HfO 2 .
Очень похожие тенденции обнаружены для образца, обработанного сульфидом. Однако прирост доли эмиссии B значительно выше (что диктуется аналогичной тенденцией в P 2 p ), а также более существенное уменьшение исходно более высоких компонентов I3 и I4; эти компоненты, вероятно, связаны с местами связывания In-S в области интерфейса и перекрываются с оксидными пиками; пики In-S и естественного оксида предварительно относятся к I3 и I4. Более того, поскольку они значительно уменьшаются из-за отжига, в то время как объемная эмиссия увеличивается, предполагается, что S-содержащая граница раздела превращается в более резкий барьер между InP и HfO 2 , оставляя менее оборванные связи, как описано ниже, и также видно здесь как более интенсивный сигнал B из-за более идеальной реконфигурации под оксидом. Меньшее увеличение I2 и O предполагает также меньшее отделение In для диффузии и/или изменения конфигурации в пленке HfO 2 , что согласуется с более ранней литературой 19 . Некоторое количество In все еще может диффундировать к поверхности от границы раздела, но более ограниченное поступление приведет к гораздо меньшему количеству наблюдаемого In на поверхности, особенно после длительного отжига, поскольку In, скорее всего, также испарится при достижении поверхности. Этот эффект также согласуется со значительно более высоким пропорциональным увеличением сигнала B после отжига.
Меньшее увеличение I2 и O предполагает также меньшее отделение In для диффузии и/или изменения конфигурации в пленке HfO 2 , что согласуется с более ранней литературой 19 . Некоторое количество In все еще может диффундировать к поверхности от границы раздела, но более ограниченное поступление приведет к гораздо меньшему количеству наблюдаемого In на поверхности, особенно после длительного отжига, поскольку In, скорее всего, также испарится при достижении поверхности. Этот эффект также согласуется со значительно более высоким пропорциональным увеличением сигнала B после отжига.
Вычисленные объемные сдвиги оксида и межфазного уровня ядра
Были рассчитаны относительные энергии связи на уровне ядра нескольких распространенных объемных оксидов In и P In 3 d и P 2 p , и результаты представлены в таблице. 3. Результаты расчетов показывают интересные тенденции и устанавливают важные эталонные значения для оксидированных полупроводниковых систем. Относительные энергии связи представлены относительно уровня Ферми (а не уровня вакуума), что является обычной практикой в экспериментах.Энергии связи на уровне ядра In 3 d и P 2 p в InP установлены равными нулю. Следовательно, положительный (отрицательный) CLS означает повышенное (пониженное) BE.
Относительные энергии связи представлены относительно уровня Ферми (а не уровня вакуума), что является обычной практикой в экспериментах.Энергии связи на уровне ядра In 3 d и P 2 p в InP установлены равными нулю. Следовательно, положительный (отрицательный) CLS означает повышенное (пониженное) BE.
Относительные BE или CLS P 2 p в рамках модели полного скрининга (CS) относительно хорошо согласуются с экспериментальными.Однако расхождение больше для ХЛС In 3 d , которые занижены примерно на 1,0–1,2 эВ, если рассматривать электроны In 4 d как валентные электроны. Тем не менее экспериментальная тенденция в CLS In 3 d , показанная в таблице 3, воспроизводится расчетами. Очевидно, что существует множество потенциальных источников ошибок как в расчетах, так и в экспериментах.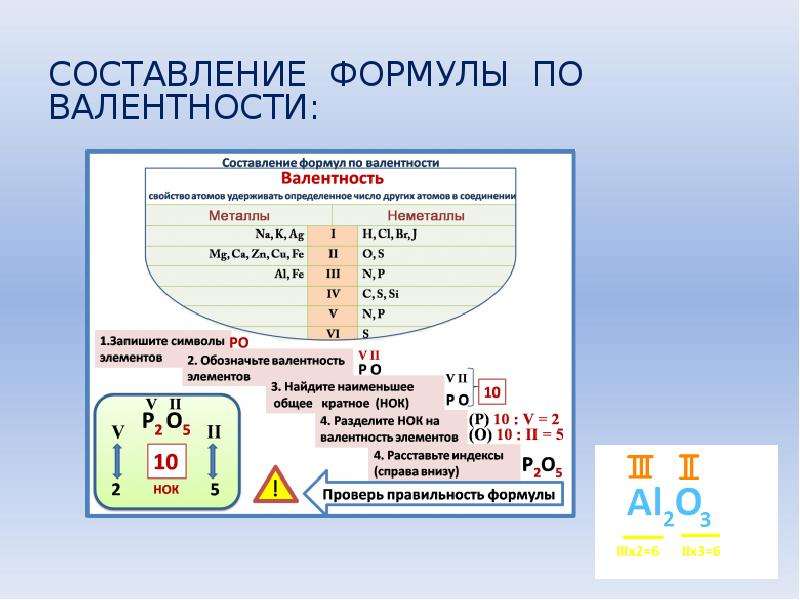 Касательно расчетов, в частности, были протестированы гибридный функционал плотности Хейда-Шкусерии-Эрнзергофа (HSE) 34 и однородный фоновый заряд в качестве замены дополнительного нейтрализующего электрона в расчете полного экранирования 35 .Эти методы существенно не изменили CLS In 3 d или P 2 p . Следует отметить, что CLS обычно рассчитывают для таких систем, как поверхности или примеси, которые можно смоделировать одной геометрической конструкцией. Это значительно повышает точность.
Касательно расчетов, в частности, были протестированы гибридный функционал плотности Хейда-Шкусерии-Эрнзергофа (HSE) 34 и однородный фоновый заряд в качестве замены дополнительного нейтрализующего электрона в расчете полного экранирования 35 .Эти методы существенно не изменили CLS In 3 d или P 2 p . Следует отметить, что CLS обычно рассчитывают для таких систем, как поверхности или примеси, которые можно смоделировать одной геометрической конструкцией. Это значительно повышает точность.
Можно сделать несколько замечаний. P CLS намного больше, чем In CLS. Заряд валентности P сильно связан из-за повышенного заряда ядра (который не компенсируется повышенным электронным отталкиванием), и, следовательно, перенос электронного заряда в ионной связи приводит к большему CLS.Экспериментальные сдвиги на уровне ядра действительно часто интуитивно интерпретируются в терминах переносимого валентного заряда, см. и . г . исх. 36 . Обычно предполагается, что перенос заряда увеличивается с увеличением ионности связи. Следовательно, ионные связи должны вызывать больший перенос заряда, чем ковалентные связи. Атомы In и P теряют электронный заряд в оксидах, что увеличивает энергию связи основных состояний In и P. Однако это, очевидно, не вся история, поскольку модельные ХЛС начального состояния In 3 d (рассчитанные с валентными состояниями In 4 d ) отрицательны, особенно в ионном оксиде In 2 O 3 .CLS часто более количественно интерпретируют в терминах степени окисления, которую иногда даже отождествляют с числом ближайших атомов O, поскольку эта интерпретация справедлива для границ раздела SiO 2 /Si 6 . Однако In и P имеют степени окисления +3 и +5 во всех соединениях, рассмотренных в таблице 3. Кроме того, атомы In и P занимают октаэдрические и тетраэдрические положения соответственно во всех рассмотренных оксидах. Тем не менее, CLS In или P значительно различаются в разных соединениях.
Обычно предполагается, что перенос заряда увеличивается с увеличением ионности связи. Следовательно, ионные связи должны вызывать больший перенос заряда, чем ковалентные связи. Атомы In и P теряют электронный заряд в оксидах, что увеличивает энергию связи основных состояний In и P. Однако это, очевидно, не вся история, поскольку модельные ХЛС начального состояния In 3 d (рассчитанные с валентными состояниями In 4 d ) отрицательны, особенно в ионном оксиде In 2 O 3 .CLS часто более количественно интерпретируют в терминах степени окисления, которую иногда даже отождествляют с числом ближайших атомов O, поскольку эта интерпретация справедлива для границ раздела SiO 2 /Si 6 . Однако In и P имеют степени окисления +3 и +5 во всех соединениях, рассмотренных в таблице 3. Кроме того, атомы In и P занимают октаэдрические и тетраэдрические положения соответственно во всех рассмотренных оксидах. Тем не менее, CLS In или P значительно различаются в разных соединениях. Можно отметить, что CLS становятся больше с увеличением концентрации кислорода. Конфигурация второго ближайшего соседа также изменяется вместе с композицией. Ионизация обычно увеличивает ХЛС по сравнению с модельным ХЛС начального состояния, и этот эффект гораздо сильнее для Р-ХЛС, чем для In-ХЛС. Расхождения между экспериментальными и рассчитанными значениями CLS полного скрининга предположительно могут быть связаны с неполным скринингом в экспериментах.
Можно отметить, что CLS становятся больше с увеличением концентрации кислорода. Конфигурация второго ближайшего соседа также изменяется вместе с композицией. Ионизация обычно увеличивает ХЛС по сравнению с модельным ХЛС начального состояния, и этот эффект гораздо сильнее для Р-ХЛС, чем для In-ХЛС. Расхождения между экспериментальными и рассчитанными значениями CLS полного скрининга предположительно могут быть связаны с неполным скринингом в экспериментах.
CLS примесей In и P в HfO 2 равны −0.18 эВ и 6,17 эВ соответственно. Соответствующие CLS начального состояния составляют 0,17 эВ и 4,19 эВ. Пограничный атом может иметь другую (ближайшую) конфигурацию соседнего атома, чем объемные атомы. Кроме того, интерфейсный диполь может влиять на CLS. Различные модели интерфейса HfO 2 /InP были построены для исследования того, как CLS зависят от атомной среды. Для интерфейсов HfO 2 /GaP и HfO 2 /GaAs 37,38 была введена полукогерентная модель (O10), которая имеет относительно небольшое рассогласование решеток и не показывает интерфейсные состояния в запрещенной зоне. .Несоответствие решеток этой модели можно сохранить относительно небольшим для интерфейса HfO 2 /InP, заменив простой тетрагональный HfO 2 (пространственная группа 137), использованный в работе. 37 в модели O10 с анатазом HfO 2 (телоцентрированный тетрагон; пространственная группа 141) 37,39 . Следует отметить, что ХСН примесных атомов In и P не зависят от выбранной фазы HfO 2 . CLS примесей, рассчитанные для объемной моноклинной структуры основного состояния, практически идентичны рассчитанным для структуры анатаза.Для исследования ХЛС примесных и межфазных атомов было построено девять различных моделей интерфейса HfO 2 /InP на основе модели O10. Часть InP может заканчиваться либо In, либо P, тогда как концентрации In и P варьируются в первом слое части HfO 2 . Из-за этих вариаций существует много различных видов окружения атомов In и P на границе раздела. Первый слой части InP димеризован, и в димеры могут быть вставлены атомы кислорода.
.Несоответствие решеток этой модели можно сохранить относительно небольшим для интерфейса HfO 2 /InP, заменив простой тетрагональный HfO 2 (пространственная группа 137), использованный в работе. 37 в модели O10 с анатазом HfO 2 (телоцентрированный тетрагон; пространственная группа 141) 37,39 . Следует отметить, что ХСН примесных атомов In и P не зависят от выбранной фазы HfO 2 . CLS примесей, рассчитанные для объемной моноклинной структуры основного состояния, практически идентичны рассчитанным для структуры анатаза.Для исследования ХЛС примесных и межфазных атомов было построено девять различных моделей интерфейса HfO 2 /InP на основе модели O10. Часть InP может заканчиваться либо In, либо P, тогда как концентрации In и P варьируются в первом слое части HfO 2 . Из-за этих вариаций существует много различных видов окружения атомов In и P на границе раздела. Первый слой части InP димеризован, и в димеры могут быть вставлены атомы кислорода. Все рассмотренные интерфейсы имеют энергетическую щель, что указывает на то, что полукогерентные интерфейсы являются гибкими в электронном виде.Правилу счета электронов (ECR) могут удовлетворять свободные оборванные связи In и занятые оборванные связи P. CLS полного экранирования атомов P можно классифицировать по ближайшим соседям O ( i . e ., связи O), что показано в таблице 4 (ниже рассматриваются только CLS полного экранирования). Это очень просто и интересно, учитывая, что некоторые атомы интерфейса имеют необычную конфигурацию соседей атомов. Кроме того, относительные смещения валентной зоны варьируются в пределах 1.5 эВ. Надежность классификации предполагает, что тот же принцип можно применять и к разным видам интерфейсов ( e . g ., более размытые интерфейсы). Следует отметить, что понятие «близкий сосед» удобно на практике. С учетом рассчитанных ХПС As 2 p на интерфейсах Al 2 O 3 /GaAs 40 (единственное обнаруженное ранее первоприн интерпретация может быть верна для полупроводников III-V в более общем плане.
Все рассмотренные интерфейсы имеют энергетическую щель, что указывает на то, что полукогерентные интерфейсы являются гибкими в электронном виде.Правилу счета электронов (ECR) могут удовлетворять свободные оборванные связи In и занятые оборванные связи P. CLS полного экранирования атомов P можно классифицировать по ближайшим соседям O ( i . e ., связи O), что показано в таблице 4 (ниже рассматриваются только CLS полного экранирования). Это очень просто и интересно, учитывая, что некоторые атомы интерфейса имеют необычную конфигурацию соседей атомов. Кроме того, относительные смещения валентной зоны варьируются в пределах 1.5 эВ. Надежность классификации предполагает, что тот же принцип можно применять и к разным видам интерфейсов ( e . g ., более размытые интерфейсы). Следует отметить, что понятие «близкий сосед» удобно на практике. С учетом рассчитанных ХПС As 2 p на интерфейсах Al 2 O 3 /GaAs 40 (единственное обнаруженное ранее первоприн интерпретация может быть верна для полупроводников III-V в более общем плане. Следует также отметить, что P CLS не увеличиваются значительно при увеличении числа близких соседей O с четырех.
Следует также отметить, что P CLS не увеличиваются значительно при увеличении числа близких соседей O с четырех.
Однако из таблицы 4 видно, что корреляции между CLS и числом близких соседей атомов индия нет.Это показывает, что модель переноса заряда, выраженная в терминах числа соседей кислорода, в целом неверна, если предположить, что результаты расчетов воспроизводят экспериментальные тенденции. Было показано, что локальный заряд или заряд d атомов переходных металлов приблизительно постоянен в различных «зарядовых состояниях» в некоторых оксидах 41,42 . Однако явления, выраженные в терминах «состояние окисления» или «состояние заряда», в этих случаях реальны 41,42 .
Обнаружена интересная корреляция между составом интерфейсного слоя на границе оксидной части HfO 2 и сдвигом полосы. Максимум валентной полосы оксидной части, по-видимому, уменьшается по сравнению с частью InP с концентрацией атомов P в оксидном интерфейсном слое. Это может быть связано с занятыми оборванными связями P, которые вызывают щелевые состояния. О смещениях полос сообщили Santosh et al . для другой модели O10 (терминированные интерфейсы не рассматривались), похоже, примерно следуют этой тенденции 22 .Смещения полос отражаются также в ХЛС замещающих/примесных атомов In и P в более глубоких слоях HfO 2 . CLS для замещающих In и P в центре части HfO 2 в рамках модели O10 составляют −0,89 эВ и 5,49 эВ. Величины этих CLS меньше рассчитанных для чистого отдельного HfO 2 . Снижение CLS означает, что из-за границы раздела существует смещение полосы, которое снижает CLS в системе интерфейса HfO 2 /InP по сравнению с отдельными объемными фазами HfO 2 и InP.Смещение полосы больше для других моделей интерфейса в интервале 1,5 эВ, увеличивая CLS.
Максимум валентной полосы оксидной части, по-видимому, уменьшается по сравнению с частью InP с концентрацией атомов P в оксидном интерфейсном слое. Это может быть связано с занятыми оборванными связями P, которые вызывают щелевые состояния. О смещениях полос сообщили Santosh et al . для другой модели O10 (терминированные интерфейсы не рассматривались), похоже, примерно следуют этой тенденции 22 .Смещения полос отражаются также в ХЛС замещающих/примесных атомов In и P в более глубоких слоях HfO 2 . CLS для замещающих In и P в центре части HfO 2 в рамках модели O10 составляют −0,89 эВ и 5,49 эВ. Величины этих CLS меньше рассчитанных для чистого отдельного HfO 2 . Снижение CLS означает, что из-за границы раздела существует смещение полосы, которое снижает CLS в системе интерфейса HfO 2 /InP по сравнению с отдельными объемными фазами HfO 2 и InP.Смещение полосы больше для других моделей интерфейса в интервале 1,5 эВ, увеличивая CLS.
Возможно, что между частями HfO 2 и InP присутствует какой-то собственный оксид, и это наиболее реалистичный сценарий для исследованных структур, тем более, что HfO 2 специально выращивался на естественном оксиде на одном из образцов . Два оксида модели InPO 4 , ограниченные областью интерфейса InP, вводятся для расчета CLS для двух когерентных систем с двойным интерфейсом HfO 2 /InPO 4 /InP.Первый модельный оксид (InPO 4 -a) основан на структуре анатаза HfO 2 , в которой каждый второй атомный слой в направлении наибольшего параметра решетки замещен атомами In или P. Однако удвоение длины параметра решетки c приводит к уменьшению полной энергии, поскольку тетраэдры PO 4 могут быть ориентированы по-разному. Вторая модельная структура оксида (InPO 4 -b) может быть релаксирована из орторомбической исходной структуры (за счет несимметричных атомных смещений).Космический номер этой начальной структуры составляет 80.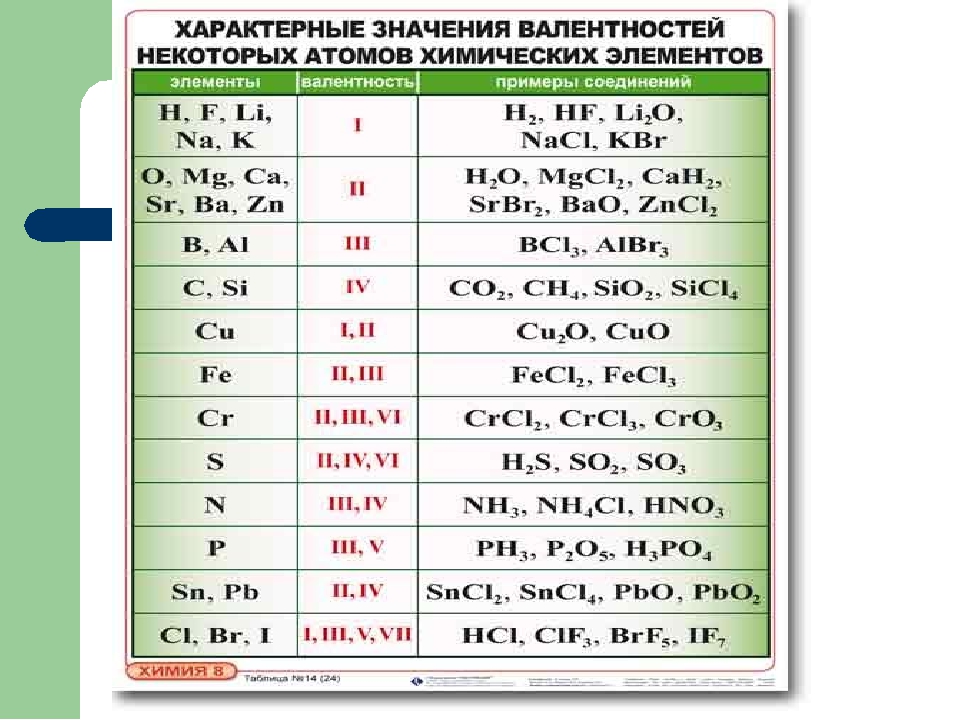 Существует два положения o o Atom Wyckoff (8A) ( x = 0,232; y = 0,301; Z = 0,297; x = 0,778; y = 0,160; z = 0,160). Параметры Вайкоффа z для позиций In и P (4 a ) равны 0,697 и 0,098 соответственно. Полученные оксидные структуры InPO 4 -a и InPO 4 -b могут зависеть от размера выбранной ячейки из-за беспорядка.Используемые структуры рассчитаны для площади интерфейса (2 × 2). Нерелаксированные модельные оксиды состоят из сходных структурных мотивов с различной укладкой. Полная энергия этих оксидов больше, чем полная энергия структуры InPO 4 в основном состоянии. Полные энергии InPO 4 -a и InPO 4 -b составляют 0,17 эВ/атом и 0,09 эВ/атом по отношению к полной энергии основного состояния InPO 4 (орторомбическая решетка, ссылка 43). ).Для сравнения, единственная объемная фаза InPO 4 с квадратной гранью, шеелит 43 , имеет относительную полную энергию 0,10 эВ/атом.
Существует два положения o o Atom Wyckoff (8A) ( x = 0,232; y = 0,301; Z = 0,297; x = 0,778; y = 0,160; z = 0,160). Параметры Вайкоффа z для позиций In и P (4 a ) равны 0,697 и 0,098 соответственно. Полученные оксидные структуры InPO 4 -a и InPO 4 -b могут зависеть от размера выбранной ячейки из-за беспорядка.Используемые структуры рассчитаны для площади интерфейса (2 × 2). Нерелаксированные модельные оксиды состоят из сходных структурных мотивов с различной укладкой. Полная энергия этих оксидов больше, чем полная энергия структуры InPO 4 в основном состоянии. Полные энергии InPO 4 -a и InPO 4 -b составляют 0,17 эВ/атом и 0,09 эВ/атом по отношению к полной энергии основного состояния InPO 4 (орторомбическая решетка, ссылка 43). ).Для сравнения, единственная объемная фаза InPO 4 с квадратной гранью, шеелит 43 , имеет относительную полную энергию 0,10 эВ/атом. Поэтому полные энергии рассматриваемых модельных оксидов не являются нереально высокими. Кроме того, уменьшение площади интерфейса увеличивает общую энергию этих модельных оксидов InPO 4 по сравнению с HfO 2 . Следовательно, неуместно рассматривать полукогерентные интерфейсы InPO 4 /InP на основе модели O10.Массовое полное экранирование P 2 p CLS (состояния In 4 d в ядре) для InPO 4 -a и InPO 4 -b составляет 5,02 эВ и 4,55 эВ соответственно. Соответствующие значения для основного состояния и шеелита InPO 4 составляют 5,21 эВ и 5,27 эВ.
Поэтому полные энергии рассматриваемых модельных оксидов не являются нереально высокими. Кроме того, уменьшение площади интерфейса увеличивает общую энергию этих модельных оксидов InPO 4 по сравнению с HfO 2 . Следовательно, неуместно рассматривать полукогерентные интерфейсы InPO 4 /InP на основе модели O10.Массовое полное экранирование P 2 p CLS (состояния In 4 d в ядре) для InPO 4 -a и InPO 4 -b составляет 5,02 эВ и 4,55 эВ соответственно. Соответствующие значения для основного состояния и шеелита InPO 4 составляют 5,21 эВ и 5,27 эВ.
Оксиды InPO 4 -a и InPO 4 -b могут расти в тонких пленках, если энергия интерфейса для структуры InPO 4 в основном состоянии относительно высока. Суммарная энергия системы двойного интерфейса с тонкой пленкой InPO 4 -a (два двойных слоя оксида In-P) несколько ниже, чем на основе InPO 4 -b [0. 26 эВ на (1 × 1) площадь интерфейса], что указывает на то, что энергия интерфейса относительно низка для структуры InPO 4 -a. Результат также показывает, что относительно значительная разница полной энергии в объеме InPO 4 (~ 0,1 эВ / атом) может быть компенсирована разницей энергии границы раздела в тонких пленках. Предполагается, что выбранные окончания моделей InPO 4 являются энергетически выгодными из-за характерной формы тетраэдра PO 4 , встречающегося во всех фазах InPO 4 (нет разорванных тетраэдров PO 4 ).
26 эВ на (1 × 1) площадь интерфейса], что указывает на то, что энергия интерфейса относительно низка для структуры InPO 4 -a. Результат также показывает, что относительно значительная разница полной энергии в объеме InPO 4 (~ 0,1 эВ / атом) может быть компенсирована разницей энергии границы раздела в тонких пленках. Предполагается, что выбранные окончания моделей InPO 4 являются энергетически выгодными из-за характерной формы тетраэдра PO 4 , встречающегося во всех фазах InPO 4 (нет разорванных тетраэдров PO 4 ).
CLS для систем с двойным интерфейсом были рассчитаны с использованием от двух до четырех двойных слоев оксида In-P. Самые высокие P CLS возникают чуть ниже HfO 2 , в то время как другие слои P в InPO 4 демонстрируют довольно похожие CLS друг с другом. P CLS для интерфейсного слоя непосредственно под HfO 2 и другими слоями InPO 4 составляют 5,03–5,06 эВ и 4,63–4,66 эВ, а для InPO
3–
9 4a – 5,23–5,35 эВ и 4,45–4,65 эВ. и InPO 4 -b соответственно.Собственный оксид и интерфейсные области этой структуры элементарной ячейки показаны на рис. 3. ХЛС очень похожи, хотя разница между объемными ХЛС InPO 4 -a и InPO 4 -b немного больше. Смещение валентной зоны меньше для InPO 4 -a, что снижает CLS для InPO 4 -a. Ориентация тетраэдров PO 4 различна в InPO 4 -a и InPO 4 -b, что может способствовать относительному смещению полос.Таким образом, изгиб зон возможен также без изменения состава межфазных слоев на оксидной и полупроводниковой частях. Результаты указывают на то, что разные CLS In и P могут происходить из химически однородной интерфейсной системы. Таким образом, разные экспериментальные CLS не обязательно происходят из разных оксидных пленок, имеющих e . г ., В 2 О 3 и ИнПО 4 составов.
и InPO 4 -b соответственно.Собственный оксид и интерфейсные области этой структуры элементарной ячейки показаны на рис. 3. ХЛС очень похожи, хотя разница между объемными ХЛС InPO 4 -a и InPO 4 -b немного больше. Смещение валентной зоны меньше для InPO 4 -a, что снижает CLS для InPO 4 -a. Ориентация тетраэдров PO 4 различна в InPO 4 -a и InPO 4 -b, что может способствовать относительному смещению полос.Таким образом, изгиб зон возможен также без изменения состава межфазных слоев на оксидной и полупроводниковой частях. Результаты указывают на то, что разные CLS In и P могут происходить из химически однородной интерфейсной системы. Таким образом, разные экспериментальные CLS не обязательно происходят из разных оксидных пленок, имеющих e . г ., В 2 О 3 и ИнПО 4 составов.
InPO 4 -a и InPO 4 -b структуры между объемным InP и HfO 2 показаны с расчетными значениями CLS нативного оксида P 2p соответствующих структур (эВ).
Почему увеличение степени окисления центрального иона металла в комплексе переходного металла увеличивает энергию расщепления кристаллического поля?
более высокая степень окисления означает, что переходный металл является более электроположительным, поэтому он притягивает к себе на более электронную плотность (по сравнению с металлом с более низкой степенью окисления).
Это означает, что внутри атомных орбиталей #d# имеется на больше отталкиваний, не меньше. С точки зрения теории кристаллического поля это означает, что энергия расщепления кристаллического поля возрастает .»*»# разрыхляющие орбитали, которые увеличивают энергию расщепления.
Это учитывается в теории кристаллического поля.
Что касается доноров #pi#, то они отдают электронную плотность металлическим орбиталям #d_(xy)#, #d_(xz)# и #d_(yz)#, что увеличивает их энергию по сравнению с отсутствием взаимодействия.
При более высокой степени окисления металла в металл поступает больше #pi# от лиганда, поэтому технически это означает, что орбитальные энергии #t_(2g)# увеличиваются , а таким образом энергия расщепления уменьшается.
Теория кристаллического поля этого не объясняет. Таким образом, мы игнорируем это в теории кристаллического поля.
Что касается акцепторов #pi#, то они обычно принимают электронную плотность от металлических орбиталей #d_(xy)#, #d_(xz)# и #d_(yz)#. При более высокой степени окисления металла обратная связь металла с лигандом на 90 467 меньше 90 468, что технически означает, что стабилизирующий эффект обратной связи 90 467 меньше 90 468 , и, таким образом, орбитали #t_(2g)# на 90 467 меньше снижены по энергии и 90 468 энергия расщепления уменьшается.
Это также не учитывается в теории кристаллического поля, и мы игнорируем это до тех пор, пока не введем теорию поля лигандов.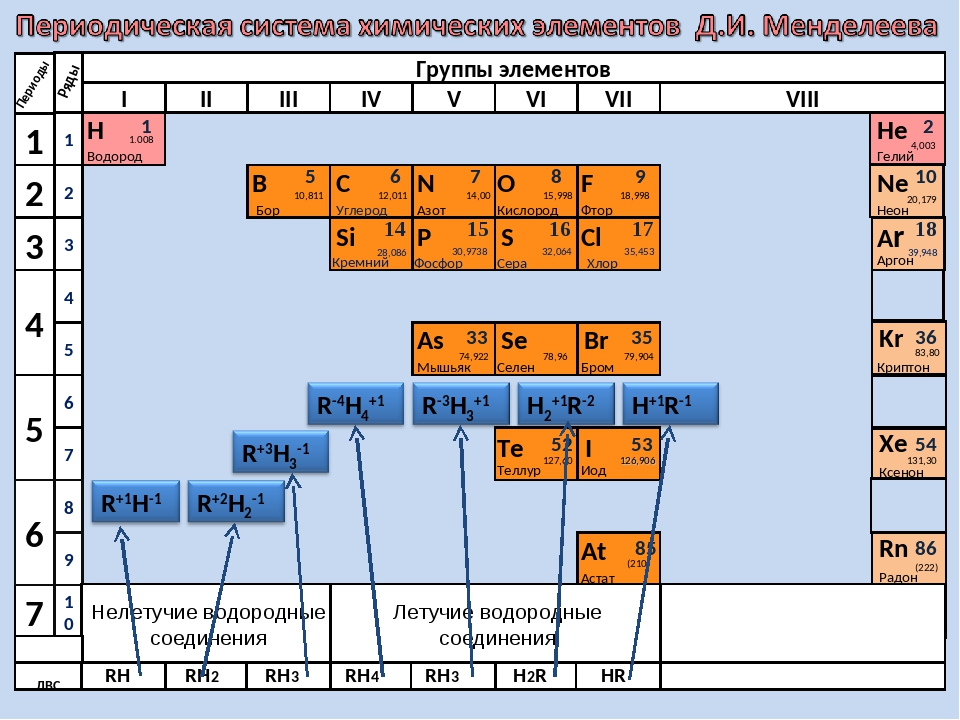
Высокоэнтропийные материалы для катализа: новый рубеж
В 2015 году Мария и коллеги ( 113 ) сообщили об энтропийно-индуцированной стабилизации однофазных многокомпонентных оксидов, в которых Mg, Ni, Zn, Cu и Co распределены в решетке оксида каменной соли случайным образом (рис. 4А). С тех пор исследования раскрывали все более и более экзотические свойства ВЭО.В отличие от ВЭА, в основном имеющих одноместное размещение в ГЦК-структуре, ВЭО имеют независимые катионные и анионные подрешетки, что приводит к увеличению структурного разнообразия ( 114 ). Поэтому, в дополнение к расширенному диапазону настройки состава и структуры, выяснение влияния повышенных энтропийных эффектов на кислородную часть, особенно активацию кислорода решетки, стало основным направлением для катализаторов на основе HEO. Способность создавать и контролировать кислородные дефекты в различных структурах ВЭО особенно полезна для повышения каталитической активности различных реакций окисления.
HEO в качестве катализаторов
HEO со структурой каменной соли и флюорита являются привлекательными мишенями для термокатализа. Модифицированные эффекты Яна-Теллера катионов металлов вызывают искаженные структурные и модифицированные электронные характеристики. Однородное и случайное распределение алиовалентных катионов в решетке оксида способствует активации кислорода решетки в виде дефектов. Однако в экстремальных синтетических условиях, включая повышенные температуры и высокое давление, часто получают объемные образцы с малой площадью поверхности.Парциальное давление кислорода также было продемонстрировано как важный фактор, способствующий образованию HEO ( 37 ). Таким образом, было разработано несколько синтетических стратегий для получения доступа к наноструктурированным HEO для различных каталитических реакций. Селективное окисление бензилового спирта до бензальдегида, бензойной кислоты и бензилбензоата привлекло широкий интерес для получения необходимых промежуточных продуктов для производства лекарств и агрохимикатов.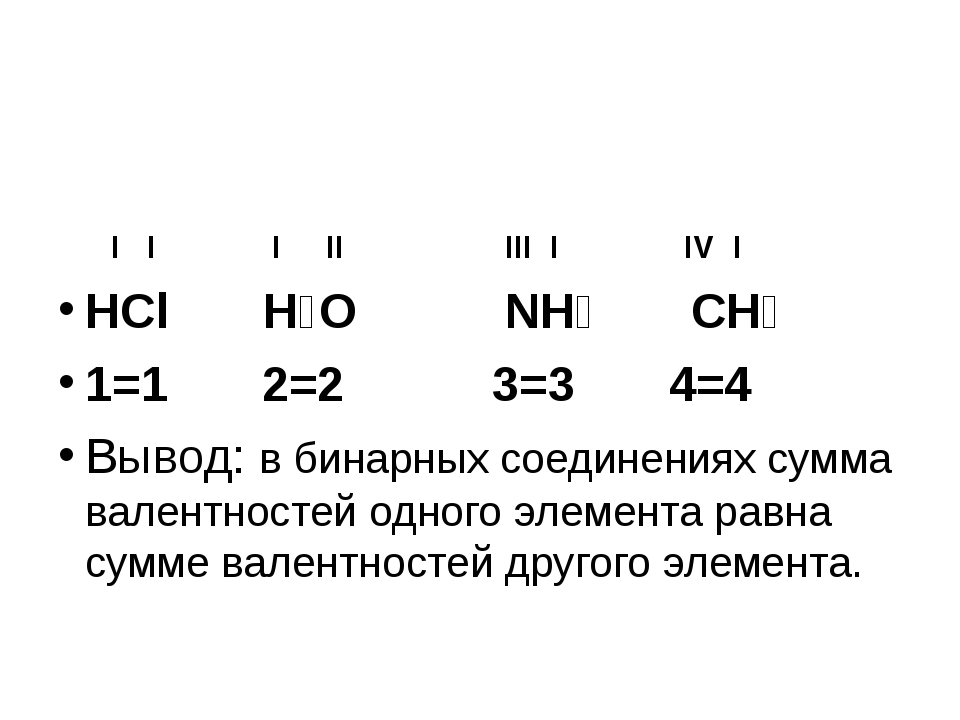 Фэн и др. ( 8 ) обнаружили, что перфорированный пластинчатый катализатор HEO обладает высокой активностью для аэробного окисления бензилового спирта без растворителя.Используя стратегию закрепления и слияния, авторы подготовили каменную соль Co 0,2 Ni 0,2 Cu 0,2 Mg 0,2 Zn 0,2 O HEO с дырчато-пластинчатой структурой. Структурная обратимость между многофазным состоянием при 750°С и однофазным при 900°С контролировалась по соответствующим рентгенограммам, что важно для демонстрации энтропийно-индуцированных переходов. Перфорированный пластинчатый ВЭО применяли для аэробного окисления бензилового спирта в бензойную кислоту и продемонстрировали конверсию до 98% за 2 часа в атмосферных условиях без растворителя.Объемный аналог HEO, а также произвольные одинарные, бинарные, тройные и четверные аналоги проявляли гораздо более низкую активность. Дальнейшие исследования показали, что дырчатый ВЭО способствует образованию кислородных вакансий из-за малого размера домена, случайного замещения нескольких катионов металлов и потребления кислорода при выгорании носителя GO.
Фэн и др. ( 8 ) обнаружили, что перфорированный пластинчатый катализатор HEO обладает высокой активностью для аэробного окисления бензилового спирта без растворителя.Используя стратегию закрепления и слияния, авторы подготовили каменную соль Co 0,2 Ni 0,2 Cu 0,2 Mg 0,2 Zn 0,2 O HEO с дырчато-пластинчатой структурой. Структурная обратимость между многофазным состоянием при 750°С и однофазным при 900°С контролировалась по соответствующим рентгенограммам, что важно для демонстрации энтропийно-индуцированных переходов. Перфорированный пластинчатый ВЭО применяли для аэробного окисления бензилового спирта в бензойную кислоту и продемонстрировали конверсию до 98% за 2 часа в атмосферных условиях без растворителя.Объемный аналог HEO, а также произвольные одинарные, бинарные, тройные и четверные аналоги проявляли гораздо более низкую активность. Дальнейшие исследования показали, что дырчатый ВЭО способствует образованию кислородных вакансий из-за малого размера домена, случайного замещения нескольких катионов металлов и потребления кислорода при выгорании носителя GO. Обогащенные кислородные вакансии на дырчатом HEO приводят к повышенной способности доставки кислорода и более сильной адсорбции на молекулах бензилового спирта по сравнению с объемным аналогом, что приводит к эффективным молекулярным превращениям.Каменная соль MoNiCuZnCoO x также использовалась для окислительного обессеривания оксидов ( 115 ), что является важным процессом для устранения содержания серы в ископаемом топливе. Равномерно диспергированные частицы Мо 6+ и эффективная активация кислорода решетки в ВЭО способствуют повышенной конверсии производных тиофена по сравнению с конверсией бинарных и тройных оксидов на основе Мо. Мезопористые оксиды металлов с настраиваемыми размерами пор, структурой и композиции привлекательны для каталитических применений.Дай и его коллеги ( 116 ) представили простой метод механохимического синтеза мезопористых гибридов CuNiFeCoMgO x — Al 2 O 3 . Прекурсоры металлов, включая изопропоксид алюминия и безводные хлориды металлов, вместе с настраиваемыми мягкими темплатами были введены в процесс шаровой мельницы.
Обогащенные кислородные вакансии на дырчатом HEO приводят к повышенной способности доставки кислорода и более сильной адсорбции на молекулах бензилового спирта по сравнению с объемным аналогом, что приводит к эффективным молекулярным превращениям.Каменная соль MoNiCuZnCoO x также использовалась для окислительного обессеривания оксидов ( 115 ), что является важным процессом для устранения содержания серы в ископаемом топливе. Равномерно диспергированные частицы Мо 6+ и эффективная активация кислорода решетки в ВЭО способствуют повышенной конверсии производных тиофена по сравнению с конверсией бинарных и тройных оксидов на основе Мо. Мезопористые оксиды металлов с настраиваемыми размерами пор, структурой и композиции привлекательны для каталитических применений.Дай и его коллеги ( 116 ) представили простой метод механохимического синтеза мезопористых гибридов CuNiFeCoMgO x — Al 2 O 3 . Прекурсоры металлов, включая изопропоксид алюминия и безводные хлориды металлов, вместе с настраиваемыми мягкими темплатами были введены в процесс шаровой мельницы. Полученный предшественник затем прокаливали, в результате чего образовывалась структура каменной соли HEO, поддерживаемая губчатыми наноструктурами оксида алюминия.Окисление СО проводили для оценки каталитических свойств мезопористого унарного оксида металла – гибридов ВЭО-Al 2 O 3 – Al 2 O 3 . CuO-Al 2 O 3 и HEO-Al 2 O 3 показали наилучшую активность со значениями T 100 220° и 260°C соответственно. При обработке 1000 частей на миллион SO 2 активность CuO-Al 2 O 3 заметно снизилась, тогда как характеристики HEO-Al 2 O 3 практически не изменились.Таким образом, фаза HEO из каменной соли продемонстрировала заметное повышение устойчивости к сере при окислении CO, что имеет жизненно важное значение для промышленных процессов. Хотя катионы металлов, случайно распределенные в решетке HEO, можно рассматривать как структурно эквивалентные, их роли в каталитических реакциях различаются.
Полученный предшественник затем прокаливали, в результате чего образовывалась структура каменной соли HEO, поддерживаемая губчатыми наноструктурами оксида алюминия.Окисление СО проводили для оценки каталитических свойств мезопористого унарного оксида металла – гибридов ВЭО-Al 2 O 3 – Al 2 O 3 . CuO-Al 2 O 3 и HEO-Al 2 O 3 показали наилучшую активность со значениями T 100 220° и 260°C соответственно. При обработке 1000 частей на миллион SO 2 активность CuO-Al 2 O 3 заметно снизилась, тогда как характеристики HEO-Al 2 O 3 практически не изменились.Таким образом, фаза HEO из каменной соли продемонстрировала заметное повышение устойчивости к сере при окислении CO, что имеет жизненно важное значение для промышленных процессов. Хотя катионы металлов, случайно распределенные в решетке HEO, можно рассматривать как структурно эквивалентные, их роли в каталитических реакциях различаются.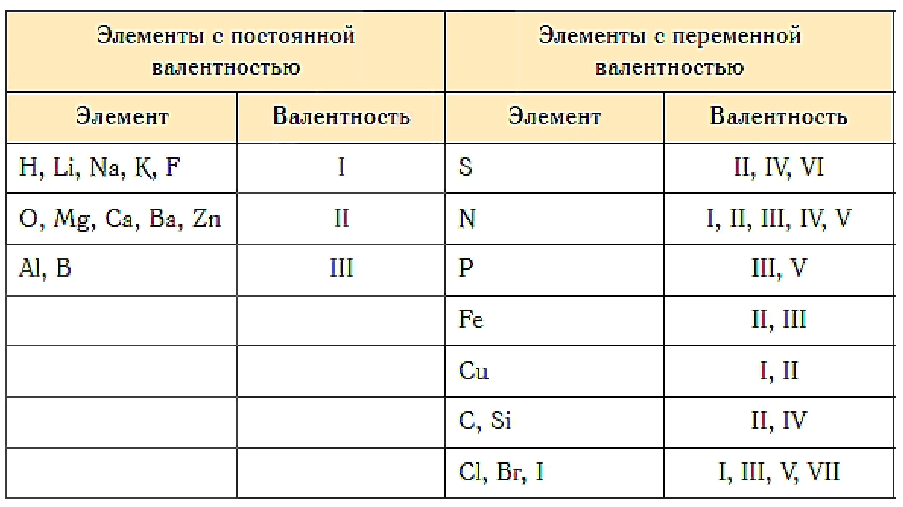 Некоторые функционируют как активные центры, отвечающие за адсорбцию и преобразование молекулярных частиц, в то время как другие действуют как соседние наблюдатели, обеспечивающие электронную или геометрическую регуляцию. Для идентификации активных частиц в каменной соли HEO (Mg 0.2 Co 0,2 Ni 0,2 Cu 0,2 Zn 0,2 O) для окисления CO, Fracchia et al. ( 48 ) использовал Operando Soft XAS для мониторинга эволюции края L 2,3 Cu, Co и Ni в различных атмосферах. В то время как XAS обычно считается объемным методом, режим полного выхода электронов дает возможность исследовать 3d-состояния разновидностей переходных металлов на поверхности и в подповерхностных областях, что особенно полезно для каталитических исследований.Авторы обнаружили, что Cu(II) в HEO может быть восстановлен до Cu(I) CO при температуре выше 130°C (рис. 4C), тогда как Co и Ni остаются неизменными при тех же условиях. Это имеет смысл, так как Cu является наиболее аномальным из пяти элементов, принимая во внимание связанные с размером и структурой и электронные эффекты ( 114 ).
Некоторые функционируют как активные центры, отвечающие за адсорбцию и преобразование молекулярных частиц, в то время как другие действуют как соседние наблюдатели, обеспечивающие электронную или геометрическую регуляцию. Для идентификации активных частиц в каменной соли HEO (Mg 0.2 Co 0,2 Ni 0,2 Cu 0,2 Zn 0,2 O) для окисления CO, Fracchia et al. ( 48 ) использовал Operando Soft XAS для мониторинга эволюции края L 2,3 Cu, Co и Ni в различных атмосферах. В то время как XAS обычно считается объемным методом, режим полного выхода электронов дает возможность исследовать 3d-состояния разновидностей переходных металлов на поверхности и в подповерхностных областях, что особенно полезно для каталитических исследований.Авторы обнаружили, что Cu(II) в HEO может быть восстановлен до Cu(I) CO при температуре выше 130°C (рис. 4C), тогда как Co и Ni остаются неизменными при тех же условиях. Это имеет смысл, так как Cu является наиболее аномальным из пяти элементов, принимая во внимание связанные с размером и структурой и электронные эффекты ( 114 ). Соответственно, центр Cu был идентифицирован как основной активный центр адсорбции и окисления CO. Кроме того, каменная соль HEO проявляла более высокую устойчивость к восстановлению по сравнению с CuO.Это подчеркивает роль повышенной конфигурационной энтропии в стабилизации Cu (II) в кубической структуре, а не в обратном преобразовании к исходной моноклинной структуре. Оксиды флюорита на основе церия также были пересмотрены, чтобы инициировать серию дискуссий, посвященных энтропии. Согласно уравнению свободной энергии Гиббса, повышенный энтропийный вклад при более высоких температурах может компенсировать большую часть энтальпийных эффектов, обеспечивая более высокую стабильность в жестких условиях эксплуатации.Дай и его коллеги ( 117 ) сообщили о механохимической стратегии изготовления гетероструктурированных сверхстабильных катализаторов CuCeO x -HEO. CeO 2 и HEO (MgZnCoCuNiO × ) готовили по отдельности и затем смешивали для измельчения в шаровой мельнице.
Соответственно, центр Cu был идентифицирован как основной активный центр адсорбции и окисления CO. Кроме того, каменная соль HEO проявляла более высокую устойчивость к восстановлению по сравнению с CuO.Это подчеркивает роль повышенной конфигурационной энтропии в стабилизации Cu (II) в кубической структуре, а не в обратном преобразовании к исходной моноклинной структуре. Оксиды флюорита на основе церия также были пересмотрены, чтобы инициировать серию дискуссий, посвященных энтропии. Согласно уравнению свободной энергии Гиббса, повышенный энтропийный вклад при более высоких температурах может компенсировать большую часть энтальпийных эффектов, обеспечивая более высокую стабильность в жестких условиях эксплуатации.Дай и его коллеги ( 117 ) сообщили о механохимической стратегии изготовления гетероструктурированных сверхстабильных катализаторов CuCeO x -HEO. CeO 2 и HEO (MgZnCoCuNiO × ) готовили по отдельности и затем смешивали для измельчения в шаровой мельнице. Под действием высоких температур, вызванных механохимией, Cu и Zn мигрировали из домена HEO в решетку CeO 2 и образовывали твердые растворы CuZnCeO x .Непосредственный отжиг смеси прекурсоров церия и металла приведет только к образованию оксидов металлов, осажденных на поверхности CeO 2 . CuCeO x -HEO продемонстрировал выдающуюся высокотемпературную стабильность, так как после прокаливания при 900°C практически не наблюдалось снижения активности. ВЭО функционирует как стабилизированный резервуар, который обеспечивает большое количество частиц меди, которые мигрируют через границу раздела оксид-оксид и образуют стабильную структуру CuCeO x .Напротив, CuO-CeO 2 показал заметное снижение активности после обработки при 900°C, что свидетельствует о ключевой роли энтропийно-индуцированной перестройки структуры на границе оксид-оксид. Используя аналогичный процесс, Shu et al. ( 9 ) преодолел внутреннее ограничение растворимости поливалентных катионов металлов в структуре флюорита.
Под действием высоких температур, вызванных механохимией, Cu и Zn мигрировали из домена HEO в решетку CeO 2 и образовывали твердые растворы CuZnCeO x .Непосредственный отжиг смеси прекурсоров церия и металла приведет только к образованию оксидов металлов, осажденных на поверхности CeO 2 . CuCeO x -HEO продемонстрировал выдающуюся высокотемпературную стабильность, так как после прокаливания при 900°C практически не наблюдалось снижения активности. ВЭО функционирует как стабилизированный резервуар, который обеспечивает большое количество частиц меди, которые мигрируют через границу раздела оксид-оксид и образуют стабильную структуру CuCeO x .Напротив, CuO-CeO 2 показал заметное снижение активности после обработки при 900°C, что свидетельствует о ключевой роли энтропийно-индуцированной перестройки структуры на границе оксид-оксид. Используя аналогичный процесс, Shu et al. ( 9 ) преодолел внутреннее ограничение растворимости поливалентных катионов металлов в структуре флюорита.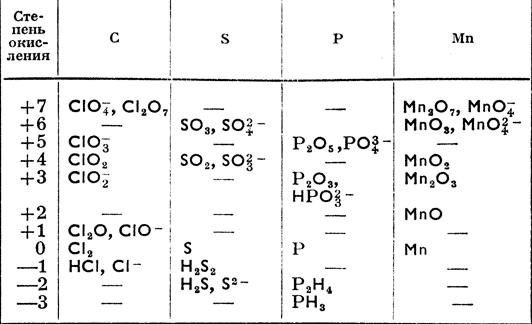 Авторы одновременно вводили 10 мольных % (мол. %) Cu 2+ , 10 мол. % Co 2+ , 10 мол. % Mg 2+ , 10 мол. % Ni 2+ и 10 мол. % Zn . 2+ в решетку CeO 2 , которые способствуют образованию активных форм кислорода, опосредованных вакансиями, а также локальному искажению решетки.Многокомпонентные катализаторы CeO 2 с различными участками поверхности, которые облегчают конкурентную адсорбцию различных газообразных компонентов, позволили эффективно обрабатывать CO-толуол-пропилен и типичные автомобильные выхлопы и продемонстрировали повышенную термическую и гидротермическую стабильность. Оксиды перовскита представляют собой еще один класс катализаторов. привлекательные оксиды из-за присущей им двухцентровой катионной занятости и обычной кислородной нестехиометрии ( 118 ). Оксиды перовскита с высокой энтропией (HEPO), в которых позиции A и B могут быть заполнены различными наборами катионов металлов, обеспечивают гибкие электронные и физико-химические свойства для каталитических применений.
Авторы одновременно вводили 10 мольных % (мол. %) Cu 2+ , 10 мол. % Co 2+ , 10 мол. % Mg 2+ , 10 мол. % Ni 2+ и 10 мол. % Zn . 2+ в решетку CeO 2 , которые способствуют образованию активных форм кислорода, опосредованных вакансиями, а также локальному искажению решетки.Многокомпонентные катализаторы CeO 2 с различными участками поверхности, которые облегчают конкурентную адсорбцию различных газообразных компонентов, позволили эффективно обрабатывать CO-толуол-пропилен и типичные автомобильные выхлопы и продемонстрировали повышенную термическую и гидротермическую стабильность. Оксиды перовскита представляют собой еще один класс катализаторов. привлекательные оксиды из-за присущей им двухцентровой катионной занятости и обычной кислородной нестехиометрии ( 118 ). Оксиды перовскита с высокой энтропией (HEPO), в которых позиции A и B могут быть заполнены различными наборами катионов металлов, обеспечивают гибкие электронные и физико-химические свойства для каталитических применений.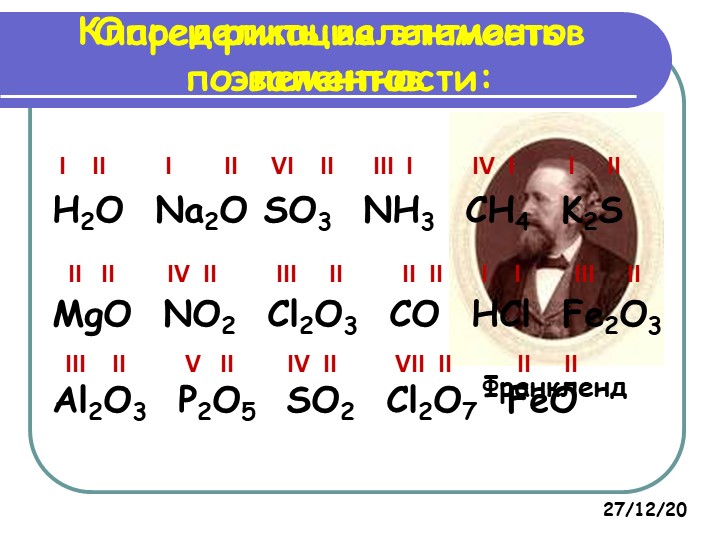 Используя механическое сплавление с последующим высокотемпературным окислением, Edalati et al. ( 119 ) приготовили двухфазный HEPO, состоящий из 60 мол. % моноклинной фазы (AB 2 O 7 ) и 40 мол. % орторомбической структуры (A 6 B 2 17 ), где А представляет собой Ti, Zr и Hf, а В представляет собой Nb и Та. Имея общий состав TiZrHfNbTaO 11 , этот бинарный HEPO имел основную ширину запрещенной зоны 2,9 эВ и демонстрировал хорошее светопоглощение как в ультрафиолетовой, так и в видимой областях, что резко контрастировало с незначительным светопоглощением для отдельного компонента оксида металла.Настраиваемые электронные свойства, полученные из конфигурации d 0 , вместе с повышенным светопоглощением в диапазоне видимого света обеспечивают эффективное фотокаталитическое расщепление воды. В другом исследовании Wang et al. ( 120 ) изготовленная шпинель (Co, Cu, Fe, Mn, Ni) 3 O 4 наночастицы, закрепленные на углеродных нанотрубках, в качестве эффективных щелочных электрокатализаторов OER.
Используя механическое сплавление с последующим высокотемпературным окислением, Edalati et al. ( 119 ) приготовили двухфазный HEPO, состоящий из 60 мол. % моноклинной фазы (AB 2 O 7 ) и 40 мол. % орторомбической структуры (A 6 B 2 17 ), где А представляет собой Ti, Zr и Hf, а В представляет собой Nb и Та. Имея общий состав TiZrHfNbTaO 11 , этот бинарный HEPO имел основную ширину запрещенной зоны 2,9 эВ и демонстрировал хорошее светопоглощение как в ультрафиолетовой, так и в видимой областях, что резко контрастировало с незначительным светопоглощением для отдельного компонента оксида металла.Настраиваемые электронные свойства, полученные из конфигурации d 0 , вместе с повышенным светопоглощением в диапазоне видимого света обеспечивают эффективное фотокаталитическое расщепление воды. В другом исследовании Wang et al. ( 120 ) изготовленная шпинель (Co, Cu, Fe, Mn, Ni) 3 O 4 наночастицы, закрепленные на углеродных нанотрубках, в качестве эффективных щелочных электрокатализаторов OER. Zhai et al. ( 121 ) расширил стратегию смешения катионов на более широкий класс оксидов металлов, поликатионоксидов (PCO), для катализа двухстадийных реакций термохимического расщепления воды (TWS).Во время этого двухэтапного процесса оксиды металлов подвергаются окислительно-восстановительному циклу с выделением кислорода при высоких температурах ( T H ), а затем окисляются при запуске термохимического превращения пара в H 2 при более низких температурах ( Т Л ). Парциальная молярная энтропия и энтальпия играют решающую роль в максимизации термокаталитической конверсии с низкими T H , а также в стабилизации фазы оксида металла. Авторы объединили золь-гель и твердофазные методы для получения (FeMgCoNi)O x PCO с сосуществующими фазами каменной соли и шпинели.Характеристики катализатора (FeMgCoNi)O x превышают характеристики ранее описанных материалов, включая ферриты шпинели, замещенный церий и оксиды перовскита на основе Mn (рис.
Zhai et al. ( 121 ) расширил стратегию смешения катионов на более широкий класс оксидов металлов, поликатионоксидов (PCO), для катализа двухстадийных реакций термохимического расщепления воды (TWS).Во время этого двухэтапного процесса оксиды металлов подвергаются окислительно-восстановительному циклу с выделением кислорода при высоких температурах ( T H ), а затем окисляются при запуске термохимического превращения пара в H 2 при более низких температурах ( Т Л ). Парциальная молярная энтропия и энтальпия играют решающую роль в максимизации термокаталитической конверсии с низкими T H , а также в стабилизации фазы оксида металла. Авторы объединили золь-гель и твердофазные методы для получения (FeMgCoNi)O x PCO с сосуществующими фазами каменной соли и шпинели.Характеристики катализатора (FeMgCoNi)O x превышают характеристики ранее описанных материалов, включая ферриты шпинели, замещенный церий и оксиды перовскита на основе Mn (рис. 4D). Данные XANES для закаленного образца (FeMgCoNi)O x позволяют предположить, что Fe является единственным активным окислительно-восстановительным элементом, в то время как роль других видов-спекторов остается неясной. Динамические взаимодействия на границе между доменами каменной соли и шпинели и локальные эффекты нагрева способствуют термохимическому производству водорода, который может быть интегрирован в крупномасштабные химические инфраструктуры.Строго говоря, (FeMgCoNi)O x не попадает в категорию ВЭМ, так как в нем менее пяти основных компонентов. Тем не менее, энтальпийно-энтропийные корреляции все еще можно использовать в качестве универсального руководства для улучшения каталитических характеристик.
4D). Данные XANES для закаленного образца (FeMgCoNi)O x позволяют предположить, что Fe является единственным активным окислительно-восстановительным элементом, в то время как роль других видов-спекторов остается неясной. Динамические взаимодействия на границе между доменами каменной соли и шпинели и локальные эффекты нагрева способствуют термохимическому производству водорода, который может быть интегрирован в крупномасштабные химические инфраструктуры.Строго говоря, (FeMgCoNi)O x не попадает в категорию ВЭМ, так как в нем менее пяти основных компонентов. Тем не менее, энтальпийно-энтропийные корреляции все еще можно использовать в качестве универсального руководства для улучшения каталитических характеристик. ВЭО в качестве носителей
Превосходная химическая и термическая стабильность и благоприятное образование кислородных дефектов делают ВЭО привлекательными кандидатами в качестве носителей катализаторов. Разновидности благородных металлов различных размеров, от наночастиц до атомных кластеров и отдельных атомов, были закреплены на HEO. В новаторском исследовании Дай и его коллеги ( 122 ) осадили 0,3 мас. % (мас. %) отдельных атомов Pt на каменной соли NiMgCuZnCoO x с помощью метода совместного осаждения. Термическая обработка при 900°C вызывала образование ограниченных поверхностью связей Pt─O─M (M представляет собой Ni, Mg, Cu, Zn и Co). Последующая стадия восстановления с H 2 преобразует связи O─Pt─O─M (Pt 4+ ) в связи Pt─O─M (Pt 2+ ), создавая активные центры для окисления СО.Для PtNiMgCuZnCoO x не наблюдалось потери активности в течение 40 часов при 135°C, что подтверждает привлекательную термическую и химическую стабильность катализаторов на HEO-носителе. После этой работы Дай и его коллеги разработали различные способы синтеза катализаторов на основе благородных металлов, нанесенных на HEO, в мягких условиях эксплуатации. Используя высокую локальную температуру, вызванную шаровой мельницей, авторы включили до 5 мас.% частиц благородных металлов в виде комбинации отдельных атомов и нанокластеров на подложку NiMgCuZnCoO x ( 123 ).
В новаторском исследовании Дай и его коллеги ( 122 ) осадили 0,3 мас. % (мас. %) отдельных атомов Pt на каменной соли NiMgCuZnCoO x с помощью метода совместного осаждения. Термическая обработка при 900°C вызывала образование ограниченных поверхностью связей Pt─O─M (M представляет собой Ni, Mg, Cu, Zn и Co). Последующая стадия восстановления с H 2 преобразует связи O─Pt─O─M (Pt 4+ ) в связи Pt─O─M (Pt 2+ ), создавая активные центры для окисления СО.Для PtNiMgCuZnCoO x не наблюдалось потери активности в течение 40 часов при 135°C, что подтверждает привлекательную термическую и химическую стабильность катализаторов на HEO-носителе. После этой работы Дай и его коллеги разработали различные способы синтеза катализаторов на основе благородных металлов, нанесенных на HEO, в мягких условиях эксплуатации. Используя высокую локальную температуру, вызванную шаровой мельницей, авторы включили до 5 мас.% частиц благородных металлов в виде комбинации отдельных атомов и нанокластеров на подложку NiMgCuZnCoO x ( 123 ). 5 мас.% Ru и Pt при нанесении на носитель HEO проявляли повышенную активность, селективность и высокотемпературную стабильность при селективном гидрировании из CO 2 в CO. Кроме того, Dai и соавт. ) применил сонохимию для изготовления HEPO с большой площадью поверхности для стабилизации катализаторов из благородных металлов для окисления CO . Акустическая кавитация вызывает образование, последовательный рост и имплозивный схлопывание микроскопических пузырьков, генерирующих массивную энергию с локальными температурами выше 5000°C и давлениями, превышающими 2000 атм, в масштабе времени ≤10 −9 с.Возникшие в результате локальные экстремальные условия привели к гомогенному смешению атомов различных металлов и последующему образованию однофазного кристаллического HEPO. Недавний прорыв Ху и его коллег ( 37 ) предоставил четко определенные рекомендации по доступу к наночастицам многоэлементного оксида (MEO). На основе метода карботермического удара авторы систематически изучали влияние температуры, окисления и энтропии на формирование однофазных наночастиц МЭО со структурой каменной соли, флюорита, шпинели и перовскита.
5 мас.% Ru и Pt при нанесении на носитель HEO проявляли повышенную активность, селективность и высокотемпературную стабильность при селективном гидрировании из CO 2 в CO. Кроме того, Dai и соавт. ) применил сонохимию для изготовления HEPO с большой площадью поверхности для стабилизации катализаторов из благородных металлов для окисления CO . Акустическая кавитация вызывает образование, последовательный рост и имплозивный схлопывание микроскопических пузырьков, генерирующих массивную энергию с локальными температурами выше 5000°C и давлениями, превышающими 2000 атм, в масштабе времени ≤10 −9 с.Возникшие в результате локальные экстремальные условия привели к гомогенному смешению атомов различных металлов и последующему образованию однофазного кристаллического HEPO. Недавний прорыв Ху и его коллег ( 37 ) предоставил четко определенные рекомендации по доступу к наночастицам многоэлементного оксида (MEO). На основе метода карботермического удара авторы систематически изучали влияние температуры, окисления и энтропии на формирование однофазных наночастиц МЭО со структурой каменной соли, флюорита, шпинели и перовскита.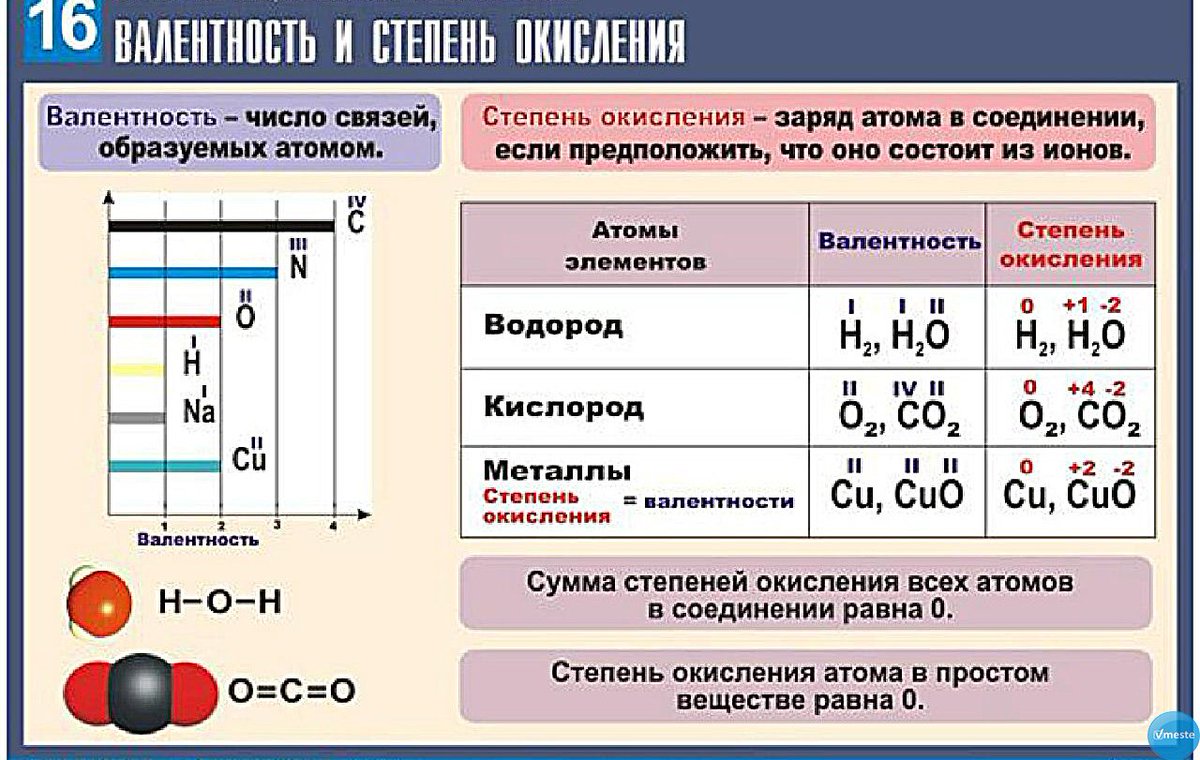 Было показано, что повышение температуры синтеза и парциального давления кислорода, а также включение большего количества катионов металлов способствует образованию однофазных наночастиц МЭО в диапазоне от унарных до десятичных составов. Кроме того, была продемонстрирована эффективная схема проектирования для оптимизации наноструктурированных катализаторов МЭО для сжигания метана. Щелочные металлы, способствующие переносу электронов, переходные металлы 3d-5d, улучшающие окислительно-восстановительные свойства за счет образования кислородных вакансий, и благородный металл Pd, облегчающий активацию метана, были оптимизированы посредством поэтапного процесса скрининга.Оптимальный денарий (Zr,Ce) 0,6 (Mg,La,Y,Hf,Ti,Cr,Mn) 0,3 Pd 0,1 O 2– x Катализатор показал повышенную активность и стабильность по сравнению с PdO x и пятикомпонентные катализаторы (рис. 4E), что объясняется энтропийно-индуцированной стабилизацией Pd в катионном состоянии.
Было показано, что повышение температуры синтеза и парциального давления кислорода, а также включение большего количества катионов металлов способствует образованию однофазных наночастиц МЭО в диапазоне от унарных до десятичных составов. Кроме того, была продемонстрирована эффективная схема проектирования для оптимизации наноструктурированных катализаторов МЭО для сжигания метана. Щелочные металлы, способствующие переносу электронов, переходные металлы 3d-5d, улучшающие окислительно-восстановительные свойства за счет образования кислородных вакансий, и благородный металл Pd, облегчающий активацию метана, были оптимизированы посредством поэтапного процесса скрининга.Оптимальный денарий (Zr,Ce) 0,6 (Mg,La,Y,Hf,Ti,Cr,Mn) 0,3 Pd 0,1 O 2– x Катализатор показал повышенную активность и стабильность по сравнению с PdO x и пятикомпонентные катализаторы (рис. 4E), что объясняется энтропийно-индуцированной стабилизацией Pd в катионном состоянии. Обогащенная библиотека наночастиц МЭО, приготовленных с использованием универсальных протоколов, обещает большой потенциал для создания высокоэффективных катализаторов для расширенных каталитических реакций.Стабилизация атомов благородных металлов на оксидном носителе важна для реализации устойчивых и эффективных каталитических превращений. Однако относительно низкая температура Таммана, точка, при которой частицы благородных металлов начинают вести себя подобно жидкости и мигрируют на поверхность оксида, приводит к спеканию катализаторов и снижению активности ( 125 ). В качестве нетрадиционной стратегии стабилизации повышенный энтропийный вклад гипотетически будет способствовать включению посторонних атомов в основную структуру оксида.Дай и его коллеги ( 31 ) продемонстрировали управляемую энтропией стабилизацию одноатомных катализаторов Pd (SAC) на высокоэнтропийных оксидах флюорита (HEFO). Как показано на рис. 4F, авторы сочетали механическое измельчение с высокотемпературным прокаливанием для получения твердых растворов (Pd y CeZrHfTiLa)O x , в которых Pd образовывал связи Pd–O–M (M = Ce , Zr, Hf, Ti и La) за счет катионного замещения в структуре флюорита.
Обогащенная библиотека наночастиц МЭО, приготовленных с использованием универсальных протоколов, обещает большой потенциал для создания высокоэффективных катализаторов для расширенных каталитических реакций.Стабилизация атомов благородных металлов на оксидном носителе важна для реализации устойчивых и эффективных каталитических превращений. Однако относительно низкая температура Таммана, точка, при которой частицы благородных металлов начинают вести себя подобно жидкости и мигрируют на поверхность оксида, приводит к спеканию катализаторов и снижению активности ( 125 ). В качестве нетрадиционной стратегии стабилизации повышенный энтропийный вклад гипотетически будет способствовать включению посторонних атомов в основную структуру оксида.Дай и его коллеги ( 31 ) продемонстрировали управляемую энтропией стабилизацию одноатомных катализаторов Pd (SAC) на высокоэнтропийных оксидах флюорита (HEFO). Как показано на рис. 4F, авторы сочетали механическое измельчение с высокотемпературным прокаливанием для получения твердых растворов (Pd y CeZrHfTiLa)O x , в которых Pd образовывал связи Pd–O–M (M = Ce , Zr, Hf, Ti и La) за счет катионного замещения в структуре флюорита. Напротив, сегрегированные фазы Pd или PdO появлялись при использовании одинарных, тройных или четвертичных оксидов флюорита в качестве субстрата, подтверждая поведение, вызванное энтропией.Использование коллоидального кремнезема в качестве темплата реализовало построение пористой структуры Pd 1 @HEFO, обнажив значительное количество изолированных атомов Pd на поверхности оксида. Каталитические измерения отражали улучшенную восстанавливаемость поверхности, а обогащенные кислородом вакансии способствуют адсорбции и активации молекулярного кислорода, включая повышенную активность окисления CO. Катализатор Pd 1 @HEFO также продемонстрировал выдающуюся термическую и гидротермическую стабильность при одновременном окислении CO, C 3 H 6 и NO, что указывает на его потенциал для обработки выхлопных газов дизельных двигателей.Чтобы объяснить влияние энтропийных эффектов на изменение взаимодействия металла с подложкой, Дай и его коллеги ( 126 ) исследовали динамическое поведение частиц благородных металлов, нанесенных на HEO.
Напротив, сегрегированные фазы Pd или PdO появлялись при использовании одинарных, тройных или четвертичных оксидов флюорита в качестве субстрата, подтверждая поведение, вызванное энтропией.Использование коллоидального кремнезема в качестве темплата реализовало построение пористой структуры Pd 1 @HEFO, обнажив значительное количество изолированных атомов Pd на поверхности оксида. Каталитические измерения отражали улучшенную восстанавливаемость поверхности, а обогащенные кислородом вакансии способствуют адсорбции и активации молекулярного кислорода, включая повышенную активность окисления CO. Катализатор Pd 1 @HEFO также продемонстрировал выдающуюся термическую и гидротермическую стабильность при одновременном окислении CO, C 3 H 6 и NO, что указывает на его потенциал для обработки выхлопных газов дизельных двигателей.Чтобы объяснить влияние энтропийных эффектов на изменение взаимодействия металла с подложкой, Дай и его коллеги ( 126 ) исследовали динамическое поведение частиц благородных металлов, нанесенных на HEO.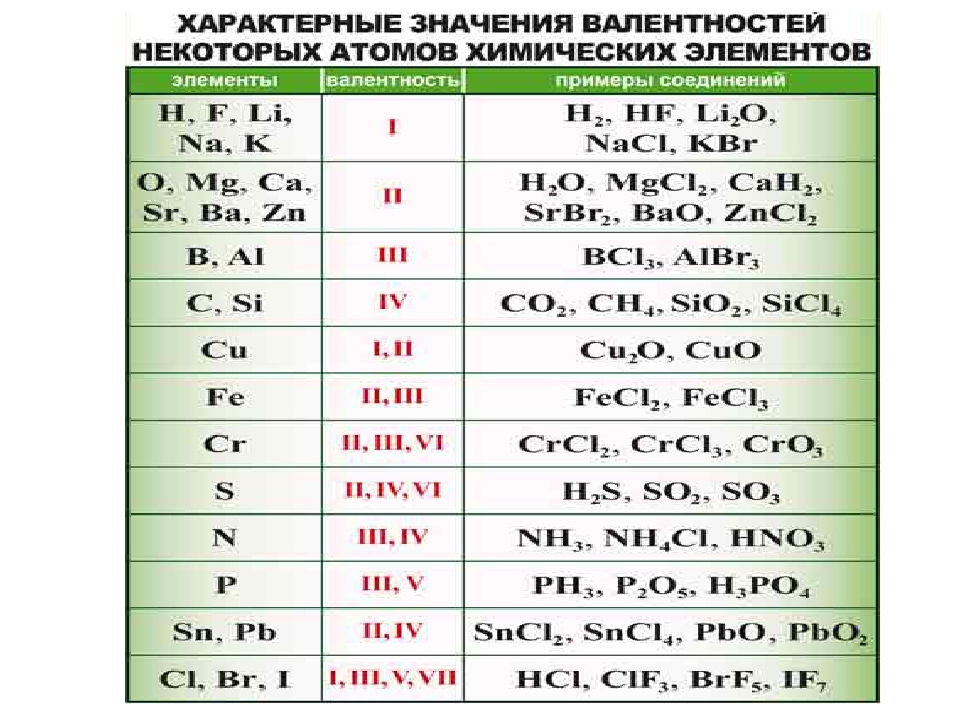 Было выбрано золото, известное своей сильной тенденцией к миграции и агрегации при высоких температурах. В эквимолярную смесь MgO, CoO, NiO, CuO и ZnO стехиометрически добавляли Au (1 мас. %) и затем отжигали при 900°C. Интересно, что Au стало хорошо диспергироваться в виде катионных частиц вдоль формирования фазы моно-HEO каменной соли.Контрольные эксперименты с более низкой температурой отжига (700°C) или меньшим количеством типов оксидов металлов (NiMgO x и NiMgZnO x ) приводят к появлению выделенной фазы Au, что указывает на то, что это неожиданное рассеивание Au в решетка HEO возникла из-за ярко выраженных энтропийных вкладов. Интересно, что для образца Au-HEO наблюдалось обратимое поведение. Золото остается хорошо диспергированным в решетке ВЭО при 900°С с повышенной конфигурационной энтропией, в то время как оно осаждается на поверхности оксида при 700°С, когда энтальпийный эффект берет верх (рис.4G). Обратимая дисперсия и осаждение соединений Au в носителе HEO и из него при различных температурах коррелировали с различными каталитическими характеристиками, поскольку более открытые участки Au вдоль осаждения приводили к лучшей активности окисления CO.
Было выбрано золото, известное своей сильной тенденцией к миграции и агрегации при высоких температурах. В эквимолярную смесь MgO, CoO, NiO, CuO и ZnO стехиометрически добавляли Au (1 мас. %) и затем отжигали при 900°C. Интересно, что Au стало хорошо диспергироваться в виде катионных частиц вдоль формирования фазы моно-HEO каменной соли.Контрольные эксперименты с более низкой температурой отжига (700°C) или меньшим количеством типов оксидов металлов (NiMgO x и NiMgZnO x ) приводят к появлению выделенной фазы Au, что указывает на то, что это неожиданное рассеивание Au в решетка HEO возникла из-за ярко выраженных энтропийных вкладов. Интересно, что для образца Au-HEO наблюдалось обратимое поведение. Золото остается хорошо диспергированным в решетке ВЭО при 900°С с повышенной конфигурационной энтропией, в то время как оно осаждается на поверхности оксида при 700°С, когда энтальпийный эффект берет верх (рис.4G). Обратимая дисперсия и осаждение соединений Au в носителе HEO и из него при различных температурах коррелировали с различными каталитическими характеристиками, поскольку более открытые участки Au вдоль осаждения приводили к лучшей активности окисления CO.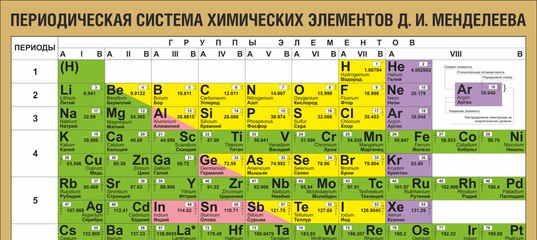 Это исследование исследует динамическое взаимодействие между катализаторами из благородных металлов и лежащим в их основе носителем HEO. Явление саморегенерации прокладывает путь к надежному нанесению катализаторов из благородных металлов для высокотемпературных реакций.Энтропийное конструирование изолированных атомных частиц вместо наноразмерных частиц также предлагает принципиально отличный путь к решению таких проблем, как спекание, коксование и отравление ( 127 ).
Это исследование исследует динамическое взаимодействие между катализаторами из благородных металлов и лежащим в их основе носителем HEO. Явление саморегенерации прокладывает путь к надежному нанесению катализаторов из благородных металлов для высокотемпературных реакций.Энтропийное конструирование изолированных атомных частиц вместо наноразмерных частиц также предлагает принципиально отличный путь к решению таких проблем, как спекание, коксование и отравление ( 127 ). Краткое описание ВЭО для катализа
Введение оксидной решетки экранирует энтропийные взаимодействия между катионами металлов, обеспечивая независимую катионную и анионную стабилизацию. В дополнение к расширенному диапазону состава и структуры, участие форм кислорода в различных формах переключает внимание исследователей на реакции окисления.Использование энтропийных эффектов в HEO для облегчения образования активных форм кислорода в мягких условиях стало основным импульсом. Повышенная конфигурационная энтропия обеспечивает отдельный путь к активации кислорода решетки за счет компенсации энтальпийного прироста. Параллельно металлическая часть функционирует как центр адсорбции малых молекул (CO, CO 2 , CH 4 и H 2 O), ионов (H + и OH — ) и органических соединений. углеводороды. Применение HEO в качестве носителей катализатора обладает теми же преимуществами, что и активация кислорода в решетке, тогда как закрепленные частицы благородных металлов становятся активными центрами.Закрепление отдельных атомов металла на HEO размыло границу между катализатором и носителями катализатора, предоставив концептуально отличную альтернативу надежным SAC.
Параллельно металлическая часть функционирует как центр адсорбции малых молекул (CO, CO 2 , CH 4 и H 2 O), ионов (H + и OH — ) и органических соединений. углеводороды. Применение HEO в качестве носителей катализатора обладает теми же преимуществами, что и активация кислорода в решетке, тогда как закрепленные частицы благородных металлов становятся активными центрами.Закрепление отдельных атомов металла на HEO размыло границу между катализатором и носителями катализатора, предоставив концептуально отличную альтернативу надежным SAC.
 Следовательно, адаптация создания, трансформации и миграции форм активированного кислорода на поверхности и в объеме ВЭО имеет жизненно важное значение для оптимизации соответствующих каталитических свойств.
Следовательно, адаптация создания, трансформации и миграции форм активированного кислорода на поверхности и в объеме ВЭО имеет жизненно важное значение для оптимизации соответствующих каталитических свойств. Точечная диаграмма азота — Как обсудить
Точечная диаграмма азота имеет тройную связь между двумя атомами азота.Азот должен связать себя три раза в соответствии с правилом октета. Таким образом, два атома одного и того же элемента соединены парами на точечной диаграмме азота, потому что азот по своей природе является двухатомной молекулой.
N2 Точечная структура
Три связи выглядят как три параллельные линии между атомами азота. Это тройная связь. Каждое соединение имеет два электрона, по одному от каждого из связанных N атомов. Итак, тройная связь, изображенная тремя параллельными линиями, имеет шесть электронов.
Тройная связь N2 представлена двумя точками и тремя палочками или линиями вокруг каждого N. Это дает каждому ядру октет и делает его стабильным. В структуре азота по Льюису ядра (центры) атомов азота представлены двумя N. Протоны и нейтроны являются твердыми частями молекулы, присутствующей в ядре.
Это дает каждому ядру октет и делает его стабильным. В структуре азота по Льюису ядра (центры) атомов азота представлены двумя N. Протоны и нейтроны являются твердыми частями молекулы, присутствующей в ядре.
Поскольку электроны не являются твердыми телами, интересно использовать точки и линии. На самом деле ядро часто имеет размер горошины на футбольном стадионе по сравнению с электронами в окружающей среде.
Небольшие неполярные соединения имеют тенденцию быть газообразными по своей природе.Они имеют тенденцию иметь очень низкие температуры кипения. Например, чтобы превратить азот в жидкость, его необходимо охладить примерно до -200 °C или -320 °F. Земля не становится такой холодной, а атмосфера продолжает задыхаться в двуокиси азота.
Настройка точечной диаграммы N2
При построении структуры Льюиса N2 удобнее всего рассматривать в терминах точек. Азоту необходимо сформировать три связи, которые представлены одинокими точками слева, справа и внизу от атомов азота на рисунке ниже.
Над каждым N есть пара точек, каждая из которых означает еще два электрона, которые не будут образовывать связь. Чтобы увидеть это, представьте, что вы соединяете одинокие точки, чтобы построить связи между каждым атомом азота. Каждый атом N должен образовывать три связи, чтобы функционировать должным образом.
Резюме
Структура Льюиса N2 состоит из двух атомов азота, которые соединены друг с другом одинаковым образом. Он абсолютно симметричен во всех отношениях. Небольшие симметричные молекулы, как правило, неполярны по своей природе.Структура Льюиса N2 показывает, что молекула N2 полностью симметрична, что подтверждается данными. В результате N2 классифицируется как неполярное химическое вещество.
Определение точечной диаграммы для N2?
Так же, как и с любой другой простой ковалентно связанной молекулой, вы должны проделать эту операцию. Прежде всего, вы должны понимать валентность каждого элемента. Затем вы должны построить модель стержня со связями между атомами, чтобы гарантировать, что валентность каждого атома полностью соответствует (таким образом, N имеет три связи, выходящие из него, а H — только одну).
Затем перерисуйте диаграмму так, чтобы каждая связь была заменена парой электронов — по одному от каждого атома, участвовавшего в этой связи. Наконец, подсчитайте количество электронов, окружающих каждый неводородный атом (включая общие электроны в связях этого атома).
Если число нечетное, вы допустили канцелярскую ошибку. Возможно, вы допустили ошибку, если число больше восьми. Если количество меньше восьми, то включите одинокие пары в достаточном количестве, чтобы получить общее количество до восьми.
Изготовление точечной диаграммы и счет электронов
Общее количество электронов в структуре Льюиса равно сумме валентных электронов на каждом атоме. В структурах Льюиса отсутствуют невалентные электроны.
После определения общего количества доступных электронов электроны должны быть введены в структуру следующим образом:
-
Одинарные связи соединяют атомы первыми.
-
Остается ввести два электрона, если общее количество электронов равно t, а одинарных связей равно n.
 неподеленные пары: одна пара точек на каждый доступный электрон Первоначально неподеленные пары должны быть помещены на внешние атомы (кроме водорода) до тех пор, пока каждый внешний атом не будет иметь восемь электронов в связывающих парах и неподеленных парах. Если вы сомневаетесь, сначала расположите неподеленные пары на более электроотрицательных атомах.
неподеленные пары: одна пара точек на каждый доступный электрон Первоначально неподеленные пары должны быть помещены на внешние атомы (кроме водорода) до тех пор, пока каждый внешний атом не будет иметь восемь электронов в связывающих парах и неподеленных парах. Если вы сомневаетесь, сначала расположите неподеленные пары на более электроотрицательных атомах. -
После вставки одиночных пар атомы (особенно центральные) могут не иметь октета. Неподеленная пара электронов транспортируется, чтобы установить вторую связь между двумя атомами. Атом с неподеленной парой все еще имеет октет; другой атом теперь имеет два дополнительных электрона в своей валентной оболочке.
Структуры Льюиса для многоатомных ионов можно нарисовать таким же образом. Структура Льюиса отрицательного иона должна содержать больше электронов, чем нейтральная молекула. Для записи структуры Льюиса иона необходимо использовать верхний индекс в правом верхнем углу вне скобок.
В отличие от анионов и катионов, связи образуются путем спаривания валентных электронов атомов, которые участвуют в процессе связи, тогда как анионы и катионы образуются путем добавления или отнятия электронов у соответствующих атомов.
Возьмите разницу между двумя числами: числом валентных электронов и числом электронов октета (или 2 электрона для водорода). Количество электронов в связях выражается в процентах. В октетах других атомов оставшиеся электроны размещаются в соответствующих октетах. Был предложен новый, более эффективный способ записи структур Льюиса и резонансных форм.
Электронно-точечные диаграммы
Валентные электроны — это те, которые занимают самый высокий занятый основной энергетический уровень атома.Электроны в валентной оболочке играют большую роль в определении химических характеристик элементов. Например, можно просто определить количество валентных электронов, используя электронную конфигурацию. В следующей таблице вы найдете несколько экземпляров элементов второго периода.
| Элемент | Общее число валентных электронов |
|---|---|
| Азот | 5 валентных электронов |
| Неон | 8 валентных электронов |
| Бериллий | 2 валентных электрона |
| Литий | 1 валентный электрон |
Валентные электроны в каждом случае находятся на втором основном энергетическом уровне.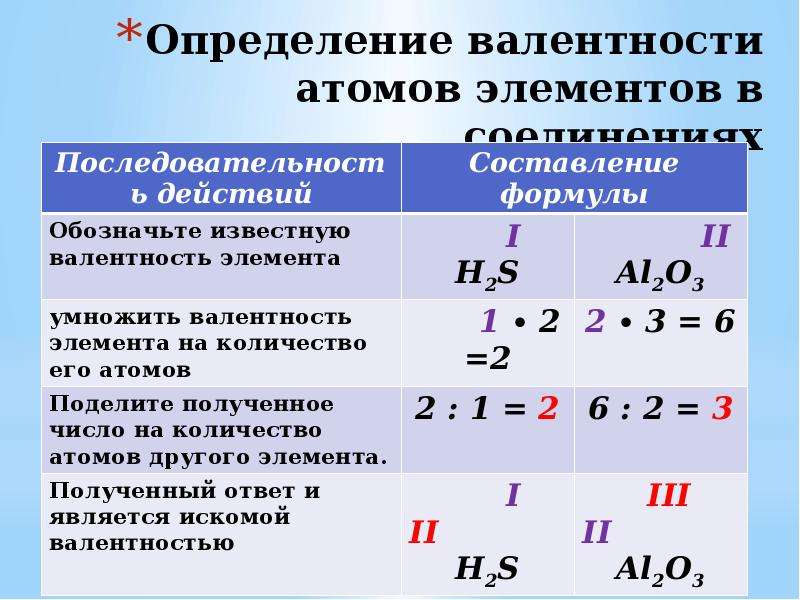 Число валентных электронов увеличивается на один при движении слева направо в течение периода. Элементы s-блока содержат один валентный электрон и два валентных электрона соответственно для элементов группы 1 и группы 2.
Число валентных электронов увеличивается на один при движении слева направо в течение периода. Элементы s-блока содержат один валентный электрон и два валентных электрона соответственно для элементов группы 1 и группы 2.
Число валентных электронов в p-блоке равно номеру группы минус десять в p-блоке. С тремя валентными электронами в группе 13, четырьмя в группе 14 и восемью в группе 18 все становится интереснее. Поскольку у них восемь электронов на внешнем подуровне, благородные газы обладают необычно высокой стабильностью.
При изучении химической связи необходимо отслеживать валентные электроны каждого атома. Валентные электроны атома изображаются на электронно-точечных диаграммах точками, разбросанными вокруг символа элемента.
Резюме
Каждый элемент в репрезентативных группах элементов будет иметь электронную точечную диаграмму, идентичную другим элементам в группе. Хотя некоторые переходные элементы имеют только один или два валентных электрона, у большинства переходных элементов их два.
Валентные электроны атома изображаются с помощью электронных точечных диаграмм. Каждая группа элементов выборки имеет одинаковые точечные диаграммы.
Точечные и перекрестные диаграммы
Валентные электроны отдельных атомов обмениваются во время химической связи. Для атомов и молекул точечная структура Льюиса используется для отслеживания валентных электронов и того, как они могут обмениваться во время связи. Валентные электроны показаны здесь маленькими точками, окружающими символ элемента.
Свойства точечных и перекрестных диаграмм
Одиночные и двойные точки для неспаренных электронов соответственно.Положение точек вокруг символа не имеет значения. В качестве альтернативы спаренные электроны могут быть показаны в виде линии. Связывание основной молекулы можно изобразить графически с помощью точечной и крестообразной диаграммы:
-
На этой диаграмме внешняя оболочка каждого атома показана в виде круга.
-
Ковалентная связь заставляет круги сливаться.

-
Рисунки электронов от одного атома и электронов от другого атома изображаются точками и крестиками соответственно.
-
Cl2, h3O и CO2, которые являются примерами ковалентных соединений, имеют крошечные молекулярные структуры.
-
Термин «простая молекула» относится к таким крошечным молекулам.
-
Точечные и перекрестные диаграммы полезны для представления малых ковалентных соединений.
Правило октета
Пока они окружены восемью электронами, молекулы следуют правилу октета: атомы имеют тенденцию приобретать, терять или делиться электронами по мере необходимости (4 пары электронов).
Электронная структура ковалентно связанных молекул может быть предсказана и представлена с помощью точечной структуры Льюиса и правила октетов. Например, два атома хлора, каждый из которых имеет семь валентных электронов, соединяются вместе, образуя двухатомную молекулу хлора, в которой оба атома хлора окружены восемью электронами из-за совместного использования двух электронов.
Из-за своей простоты и способности обеспечить четкое изображение электрической структуры популярны структуры с точками Льюиса.Давайте рассмотрим другой сценарий. Структура точек Льюиса правильно предсказывает, что атомы азота будут образовывать тройную связь.
Резюме
Несмотря на правильное предположение о существовании двойной связи, диаграмма Льюиса неверно утверждает, что все валентные электроны связаны. Когда дело доходит до двойной связи и неспаренных валентных электронов O2, мы будем исследовать более сложный теоретический метод, называемый теорией молекулярных орбиталей.
Резонанс точечных структур
Для одной и той же молекулы или иона трудно сказать, какие неподеленные пары следует переместить, чтобы образовались двойные или тройные связи.Многоатомные ионы, например, образуются, когда большое количество атомов одного и того же вида окружает основной атом.
В этом случае структура молекулы Льюиса является резонансной структурой и представляет собой резонансную гибридную структуру. Утверждается, что молекула имеет структуру Льюиса, аналогичную смеси этих состояний или некоторой комбинации этих состояний.
Утверждается, что молекула имеет структуру Льюиса, аналогичную смеси этих состояний или некоторой комбинации этих состояний.
Когда азот связан двойной связью с одним из атомов кислорода в NO3, он подчиняется правилу октета. Из-за симметрии молекулы не имеет значения, какой кислород образует двойную связь.Здесь возможны три вероятные резонансные структуры.
На одной и той же молекуле резонансные структуры с наименьшим формальным зарядом обычно вносят больший вклад в общий резонансный гибрид. Положительные заряды на менее электроотрицательных компонентах предпочтительнее, когда требуются формальные заряды.
Резонансная структура показывает не то, что молекула меняет форму, а скорее то, что она работает как среднее из многочисленных форм. Чтобы выразить резонанс в структурах Льюиса, либо нарисуйте каждую форму резонанса с двунаправленными стрелками между ними, либо используйте пунктирные линии для обозначения частичных связей.
Резюме
Для создания резонансных структур для гипервалентных веществ, таких как гексафторид серы, одинарные связи могут быть смещены таким же образом, как и в обычной модели расширенного октета.

О азоте
Азот № 7 — это химический элемент с символом N. Шотландский врач Дэниел Резерфорд открыл и выделил его в 1772 году. Поскольку работа Резерфорда была опубликована первой, хотя Карл Вильгельм Шееле и Генри Кавендиш сделали это примерно в то же время время, ему дают кредит для этого.
В 1790 году французский ученый Жан-Антуан-Клод Шапталь назвал азот из-за его присутствия в азотной кислоте и нитратах. Удушающий газ азот был назван Антуаном Лавуазье и используется во многих языках, включая французский, итальянский, русский, румынский, португальский и турецкий.
Азот — неметалл и самый легкий член группы 15 (пниктогены). Это восьмой по распространенности элемент в Млечном Пути и Солнечной системе. При комнатной температуре и давлении два атома элемента связываются с образованием N2, бесцветного газа без запаха.N2 является наиболее распространенным несвязанным элементом в атмосфере, на его долю приходится 78 процентов.
Азот содержится во всех живых существах, особенно в аминокислотах (и, следовательно, в белках), нуклеиновых кислотах (ДНК и РНК) и аденозинтрифосфате (АТФ). Человеческое тело содержит примерно 3% азота по массе после кислорода, углерода и водорода. Круговорот азота описывает поток азота из атмосферы в биосферу и органические молекулы.
Человеческое тело содержит примерно 3% азота по массе после кислорода, углерода и водорода. Круговорот азота описывает поток азота из атмосферы в биосферу и органические молекулы.
В химии азота преобладает чрезвычайно прочная тройная связь в элементарном азоте (NN), уступающая только монооксиду углерода (CO).Однако при сжигании, взрыве или разложении молекул азота с образованием газообразного азота высвобождается значительное количество зачастую ценной энергии. Синтетический аммиак и нитраты являются важными промышленными удобрениями и загрязняют водные системы.
Резюме
Азот включен во все основные классы лекарств, включая антибиотики. Органические нитраты нитроглицерин и нитропруссид влияют на кровяное давление, метаболизируясь в оксид азота. Многие известные азотосодержащие лекарства, такие как кофе, морфин и амфетамины, воздействуют на рецепторы нейротрансмиттеров животных.
О диаграммах точек Льюиса
Диаграммы, изображающие связи между атомами в молекуле и любыми неподеленными парами электронов в молекуле, известны как структуры Льюиса, которые также известны как точечные диаграммы Льюиса, электронные точечные структуры или LEDS. В химии и физике используются структуры Льюиса.
В химии и физике используются структуры Льюиса.
Для каждой ковалентно связанной молекулы, а также для координационных соединений структура Льюиса может быть нарисована на миллиметровой бумаге. В честь Гилберта Н.Льюиса, впервые описавшего структуру Льюиса в своей статье 1916 года «Атом и молекула», эта структура была названа в его честь.
Добавление линий между атомами для обозначения общих пар в химической связи позволяет использовать структуры Льюиса для дальнейшего развития понятия электронной точечной диаграммы.
Структуры Льюиса изображают каждый атом и его место в структуре молекулы с помощью химического символа, связанного с этим атомом. Линии проводят между атомами, химически или физически связанными друг с другом (вместо линий можно использовать пары точек).Неподеленные пары образованы избыточными электронами в молекуле, и эти неподеленные пары изображаются в виде пар точек, примыкающих к атомам.
Резюме
Элементы основной группы второго периода и выше обычно реагируют, приобретая или теряя электроны, пока они не достигнут электронной конфигурации валентной оболочки, состоящей из целого октета (8) электронов, однако водород (H) может образовывать только связи, в которых два электрона общий.

Использование и ограничения точечных диаграмм азота
Несмотря на свою простоту и происхождение в начале двадцатого века, структуры Льюиса охватывают многие существенные характеристики электрической структуры многих молекулярных систем, в том числе связанные с химической реактивностью.
Поэтому ученые и преподаватели-химики продолжают их использовать. Примеры включают органическую химию, где процессы обычно описываются с использованием основных уравнений, наложенных на кривую-стрелку.
Использование полностью делокализованных молекулярных орбиталей для адекватного описания связи в неорганической и металлоорганической химии делает структуры Льюиса менее важными (хотя они все еще распространены).
Даже неизменное описание Льюиса может вводить в заблуждение или быть неверным для некоторых фундаментальных химических систем.Делать выводы о порядке связей, длинах связей и/или магнитных свойствах из грубых набросков структуры Льюиса для неспаренных электронных соединений (таких как O2, NO и ClO2) ошибочно.
Резюме
Базовая модель Льюиса не может описать ароматичность, поскольку игнорирует это явление. Циклический C6H6 (бензол) подвергается уникальной стабилизации, тогда как циклический C4h5 (циклобутадиен) подвергается уникальной дестабилизации. Самое простое объяснение — теория молекулярных орбиталей.
Часто задаваемые вопросы — Часто задаваемые вопросы
Люди задавали много вопросов о точечной диаграмме азота.Мы обсудили некоторые из них ниже:
Как работают точечные диаграммы?
Как следует из названия, диаграмма Льюиса (также известная как электронная точечная диаграмма, или диаграмма Льюиса, или структура Льюиса) представляет собой иллюстрацию валентных электронов элемента, изображенную серией точек, окружающих символ этого элемента. Количество точек на графике представляет количество валентных электронов в рассматриваемом атоме. Однако общее число электронов остается постоянным.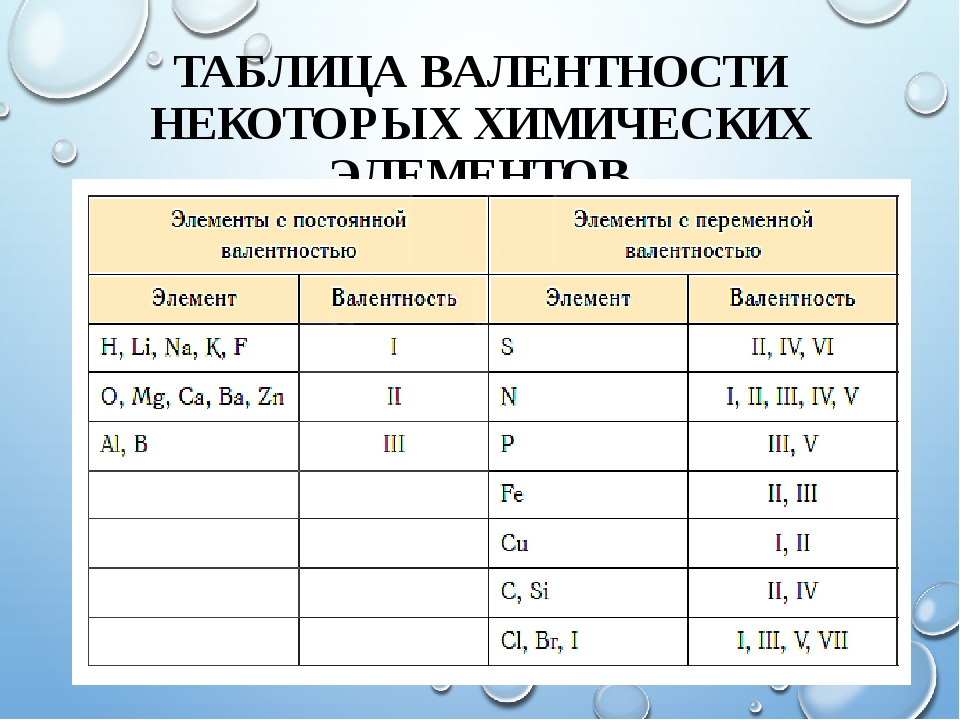
Каков химический состав азота?
Азот — химический элемент с атомным номером 7, встречающийся в природе (у него семь протонов в ядре). Молекулярный азот (N2) — довольно распространенное химическое соединение, состоящее из двух прочно связанных атомов азота.
Каково число электронных пар в N2?
После определения центрального атома и рисунка молекулы N2 мы можем начать маркировку неподеленных пар на атомах .Имейте в виду, что всего во Вселенной существует пять пар электронов. На чертеже уже есть одно соединение, которое было нарисовано. В результате на атомах азота осталось пометить четыре неподеленные пары.
Что из следующего является правильной структурой Льюиса N2?
Тройная связь между двумя атомами азота отличает структуру Льюиса N2. Правило октета гласит, что стабильные атомы азота должны образовывать три связи. В молекуле N2 два атома одного и того же элемента связаны вместе в пару, что делает ее двухатомной.
Что такое электронные диаграммы и как они работают?
Это модель, которая представляет расположение электронов, когда они вращаются вокруг ядра атома, и известна как диаграмма электронной конфигурации. Символически электроны изображаются точками или крестиками и располагаются на энергетических уровнях или «оболочках», окружающих центральное ядро.
Какое число валентностей имеет азот?
Сообщается, что азот имеет либо 3, либо 5 валентных электронов, , и он расположен в верхней части 15-й группы периодической таблицы, где он является наиболее распространенным элементом.
Что такое формула электрон-точка?
Формула электронных точек, представленная точками, указывает количество валентных электронов, присутствующих в элементе. Валентные электроны — это те электроны, которые имеют наибольший энергетический уровень и поэтому называются валентными электронами. В химической периодической таблице элементы группы IA имеют один валентный электрон, тогда как атомы группы IIB имеют два валентных электрона.
Заключение
Органические молекулы, в частности, поддаются более компактному представлению химических структур.Многие, если не все, ковалентные связи могут быть опущены в сокращенных структурных формулировках, при этом нижние индексы представляют количество идентичных групп, связанных с определенным атомом, с использованием нижних индексов. Электрическое расположение азота 2, 5. Следовательно, его внешняя оболочка включает пять электронов. Чтобы завершить октет атомов азота, три электрона от каждого атома являются общими.
Ковалентная связь молекулы азота образуется в результате этого обмена электронами. Хлорид аммония был известен Геродоту, а соединения азота имеют долгую историю.В Средние века они были хорошо известны. Азотная кислота, наряду с другими соединениями азота, такими как соли аммония и нитратные соли, была известна алхимикам как aqua fortis (сильная вода). Соляная кислота и азотная кислота были известны как царская водка (царская вода), потому что они могли растворять золото, самый драгоценный из металлов.

Связанные статьи
Что азот делает для растений Каково вредное воздействие азота на растения? Чрезмерный рост листьев.Одним из основных эффектов азота является увеличение производства хлорофилла. Этот процесс осуществляется путем создания более крупных листовых структур с большей площадью поверхности для фотосинтеза. Горение и концентрирование солей. Замедленный рост корней. загрязнение подземных вод. [Зачем растениям НУЖЕН АЗОТ??] Какой процесс позволяет растениям использовать азот? Фиксация азота,…
Удобрение с низким содержанием азота [Как удобрить ирисы удобрениями с низким содержанием азота весной] Какие удобрения содержат наибольшее количество азота? Богатые азотом удобрения включают нитрат натрия, перьевую муку, кровяную муку, копытную и роговую муку, шерсть, рыбную муку, крабовую муку, аквариумы для животных, гуано летучих мышей, соевую муку, хлопковую муку, рыбную эмульсию, навоз и компост.Конечно, вы можете использовать смесь этих источников азота, в зависимости от того, что у вас есть. Что такое хорошее удобрение, богатое азотом? Аммиак…
Химические удобрения [УДОБРЕНИЯ || ОРГАНИЧЕСКИЕ И НЕОРГАНИЧЕСКИЕ УДОБРЕНИЯ || НАУЧНОЕ ВИДЕО ДЛЯ ДЕТЕЙ] Какие химические вещества используются для производства удобрений? Азот. Из трех основных питательных веществ растениям больше всего нужен азот. Соответствие. Фосфор обычно поступает из каменного фосфата или фосфорита при производстве удобрений. Калий.Вторичные питательные вещества. Микронутриенты. Каковы недостатки использования химических удобрений? Химические удобрения воздействуют на микроорганизмы…
%PDF-1.3 % 102 0 объект > эндообъект внешняя ссылка 102 78 0000000016 00000 н 0000001911 00000 н 0000002136 00000 н 0000002747 00000 н 0000003057 00000 н 0000003123 00000 н 0000003320 00000 н 0000003417 00000 н 0000003513 00000 н 0000003630 00000 н 0000003752 00000 н 0000003864 00000 н 0000004001 00000 н 0000004138 00000 н 0000004307 00000 н 0000004444 00000 н 0000004581 00000 н 0000004718 00000 н 0000004855 00000 н 0000004990 00000 н 0000005251 00000 н 0000005292 00000 н 0000005316 00000 н 0000017784 00000 н 0000017808 00000 н 0000030816 00000 н 0000030840 00000 н 0000043477 00000 н 0000043501 00000 н 0000056981 00000 н 0000057005 00000 н 0000070123 00000 н 0000070147 00000 н 0000082446 00000 н 0000087634 00000 н 0000088019 00000 н 0000088293 00000 н 0000088519 00000 н 0000089107 00000 н 0000089400 00000 н 0000093619 00000 н 0000094011 00000 н 0000094171 00000 н 0000094532 00000 н 0000095101 00000 н 0000103442 00000 н 0000103924 00000 н 0000104746 00000 н 0000105063 00000 н 0000106437 00000 н 0000106981 00000 н 0000107150 00000 н 0000107613 00000 н 0000107690 00000 н 0000107932 00000 н 0000108206 00000 н 0000108875 00000 н 0000109080 00000 н 0000109380 00000 н 0000109616 00000 н 0000109978 00000 н 0000110226 00000 н 0000110321 00000 н 0000110619 00000 н 0000111259 00000 н 0000111389 00000 н 0000112849 00000 н 0000113160 00000 н 0000113356 00000 н 0000113380 00000 н 0000125215 00000 н 0000125239 00000 н 0000137562 00000 н 0000137641 00000 н 0000140316 00000 н 0000154506 00000 н 0000002176 00000 н 0000002725 00000 н трейлер ] >> startxref 0 %%EOF 103 0 объект > /PageLayout /Одностраничный /PageLabels 99 0 R >> эндообъект 104 0 объект > эндообъект 178 0 объект > ручей Hb«a`h«g`P À
.
