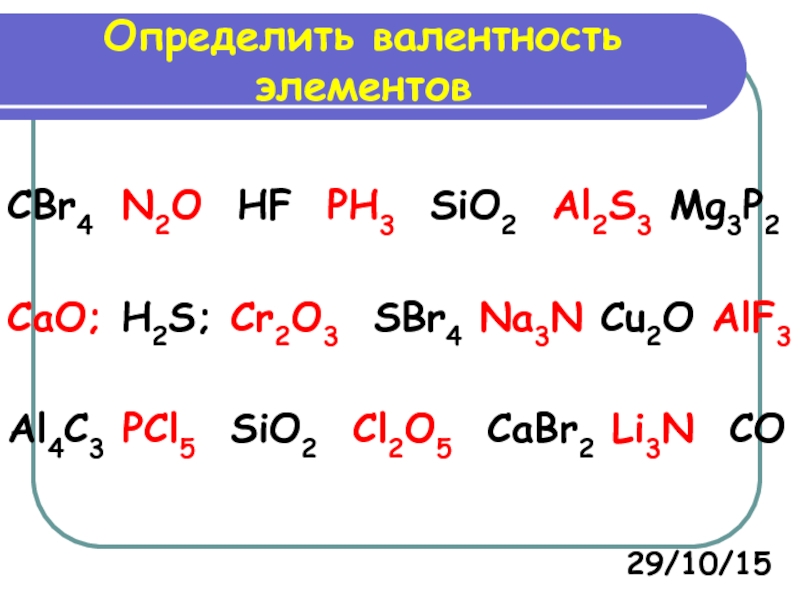
Таблица валентности химических элементов
Понятие валентности химических элементов
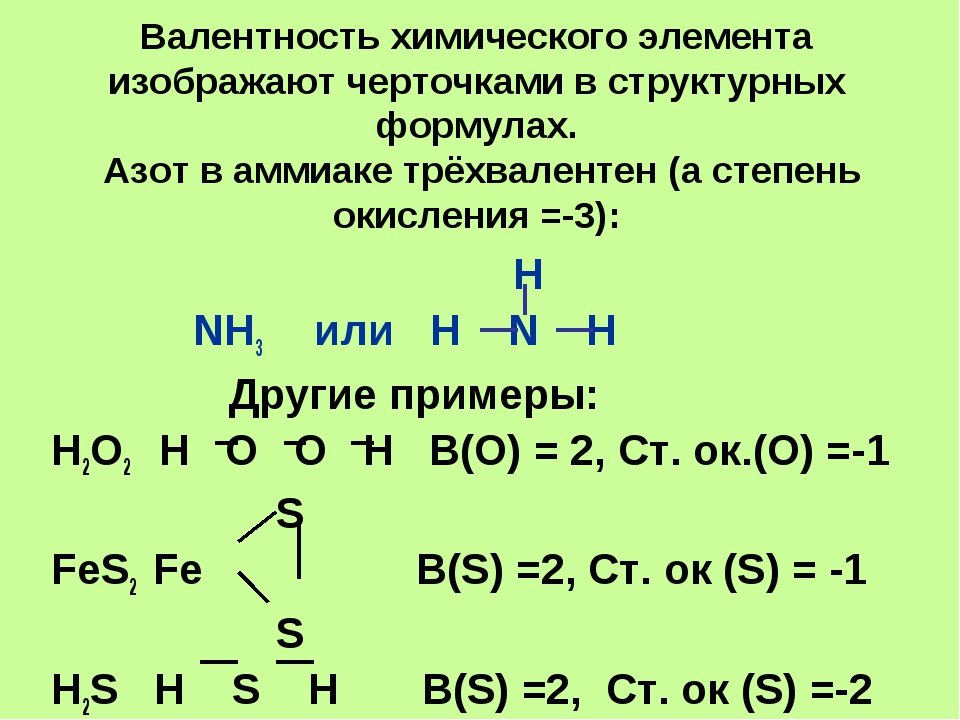
Мерой валентности поэтому может быть число химических связей, образуемых данным атомом с другими атомами. Таким образом, в настоящее время под валентностью химического элемента обычно понимается его способность (в более узком смысле – мера его способности) к образованию химических связей (рис. 1). В представлении метода валентных связей числовое значение валентности соответствует числу ковалентных связей, которые образует атом.
Рис. 1. Схематическое образование молекул воды и аммиака.
Таблица валентности химических элементов
Первоначально за единицу валентности принимали валентность водорода. Валентность другого элемента при этом выражали числом атомов водорода, которые присоединяет к себе или замещает один атом этого элемента (т.н. валентность по водороду). Например, в соединениях состава HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трем, углерода – четырем.
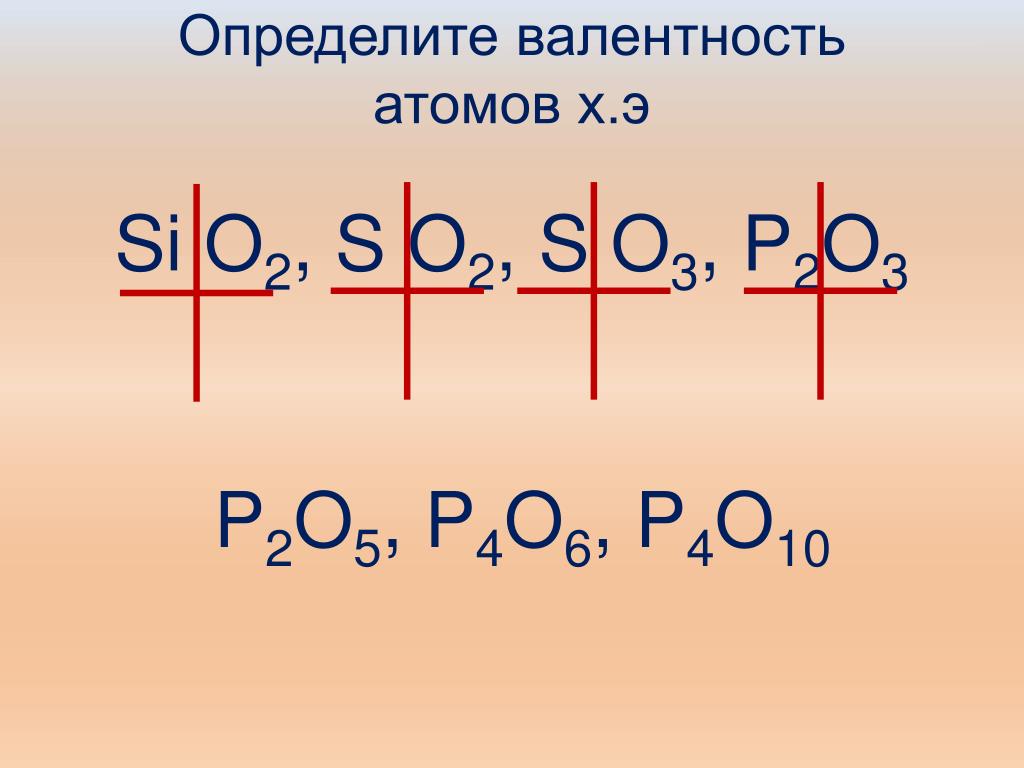
Потом было решено, что определить валентность искомого элемента можно и по кислороду, валентность которого, как правило, равна двум. В этом случае валентность химического элемента рассчитывается как удвоенное число атомов кислорода, которое может присоединить один атом данного элемента (т.н. валентность по кислороду). Например, в соединениях составаN2O, CO, SiO2, SO3валентность по кислороду азота равна единице, углерода – двум, кремния – четырем, серы – шести.
На деле оказалось, что у большинства химических элементов значения валентности в водородных и в кислородных соединениях различны: например, валентность серы по водороду равна двум (H2S), а по кислороду – шести (SO3). Кроме того, большинство элементов проявляют в своих соединениях различную валентность. Например, углерод образует два оксида: монооксид CO и диоксид CO2. В первом из которых валентность углерода равна II, а во втором – четырем. Откуда следует, что охарактеризовать валентность элемента каким-нибудь одним числом, как правило, нельзя.
Высшая и низшая валентности химических элементов
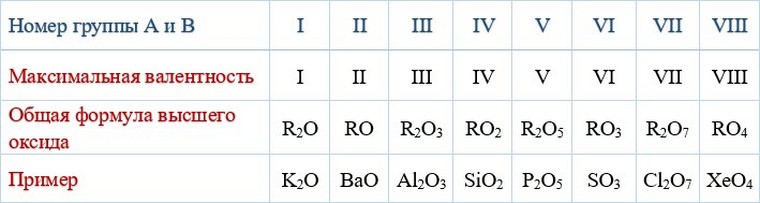
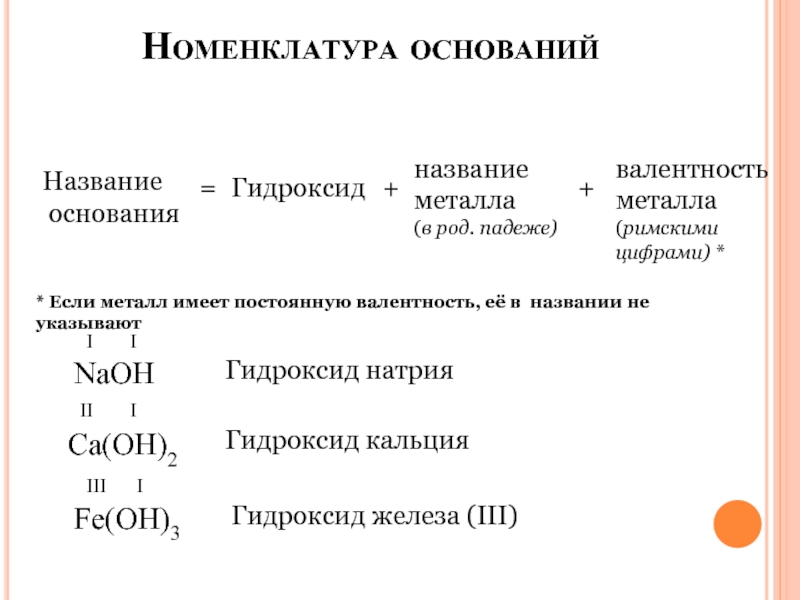
Значения высшей и низшей валентностей химического элемента можно определить при помощи Периодической таблицы Д.И. Менделеева. Высшая валентность элемента совпадает с номером группы, в которой он расположен, а низшая представляет собой разность между числом 8 и номером группы. Например, бром расположен в VIIA группе, значит его высшая валентность равна VII, а низшая – I.
Существуют элементы с т.н. постоянной валентностью (металлы IA и IIA групп, алюминий водород, фтор, кислород), которые в своих соединениях проявляют единственную степень окисления, которая чаще всего совпадает с номером группы Периодической таблицы Д.И. Менделеева, где они расположены).
Элементы, для которых характерны несколько значений валентности (причем не всегда это высшая и низшая валентность) называются переменновалентными. Например, для серы характерны валентности II, IV и VI.
Для того, чтобы легче было запомнить сколько и какие валентности характерны для конкретного химического элемента используют таблицы валентности химических элементов, которые выглядят следующим образом:
|
Порядковый номер |
Русское / англ. |
Химический символ |
Валентность |
|
1 |
Водород / Hydrogen |
H |
I |
|
2 |
Гелий / Helium |
He |
0 |
|
3 |
Литий / Lithium |
Li |
I |
|
4 |
Бериллий / Beryllium |
Be |
II |
|
5 |
Бор / Boron |
B |
III |
|
6 |
Углерод / Carbon |
C |
II, IV |
|
7 |
Азот / Nitrogen |
N |
I, II, III, IV, V |
|
… |
|||
Примеры решения задач
Таблица валентностей химических элементов. Таблица валентности. Стандартные, высшие, низшие, редкие валентности, исключения. Максимальная валентность, минимальная валентность. Версия для печати.Валентность химических элементов – это способность у атомов химических элементов образовывать некоторое число химических связей. Определяется числом электронов атома затраченых на образование химических связей с другим атомом. Справочно: Электронные формулы атомов химических элементов. Считается, что валентность химических элементов определяется группой (колонкой) Периодической таблицы . Действительно, теоретически, это самая распространенная валентность для элемента, но на практике поведение химических элементов значительно сложнее. Причина множественности значений валентности заключается в том, что существуют различные способы (или варианты) заполнения, при которых электронные оболочки стабилизируются. Числовое значение положительной валентности элемента равно числу отданных атомом электронов, а отрицательной валентности – числу электронов, которые атом должен присоединить для завершения внешнего энергетического уровня. В неорганической химии обычно применяется понятие степень окисления, а в органической химии — валентность, так как многие из неорганических веществ имеют немолекулярное строение, а органических — молекулярное..
|
Как определить валентность в органической химии.
 Что такое валентность
Что такое валентность
Образно говоря, валентность — это число «рук», которыми атом цепляется за другие атомы. Естественно, никаких «рук» у атомов нет; их роль играют т. н. валентные электроны.
Можно сказать иначе: валентность — это способность атома данного элемента присоединять определенное число других атомов.
Необходимо четко усвоить следующие принципы:
Существуют элементы с постоянной валентностью (их относительно немного) и элементы с переменной валентностью (коих большинство).
Элементы с постоянной валентностью необходимо запомнить:
Остальные элементы могут проявлять разную валентность.
Высшая валентность элемента в большинстве случаев совпадает с номером группы, в которой находится данный элемент.
Например, марганец находится в VII группе (побочная подгруппа), высшая валентность Mn равна семи. Кремний расположен в IV группе (главная подгруппа), его высшая валентность равна четырем.
Следует помнить, однако, что высшая валентность не всегда является единственно возможной.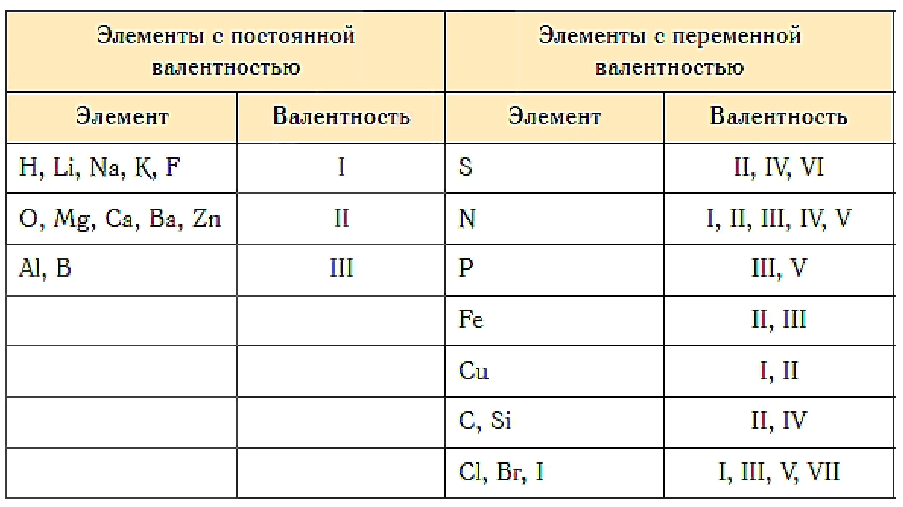 Например, высшая валентность хлора равна семи (убедитесь в этом!), но известны соединения, в которых этот элемент проявляет валентности VI, V, IV, III, II, I.
Например, высшая валентность хлора равна семи (убедитесь в этом!), но известны соединения, в которых этот элемент проявляет валентности VI, V, IV, III, II, I.
Важно запомнить несколько исключений : максимальная (и единственная) валентность фтора равна I (а не VII), кислорода — II (а не VI), азота — IV (способность азота проявлять валентность V — популярный миф, который встречается даже в некоторых школьных учебниках).
Валентность и степень окисления — это не тождественные понятия.
Эти понятия достаточно близки, но не следует их путать! Степень окисления имеет знак (+ или -), валентность — нет; степень окисления элемента в веществе может быть равна нулю, валентность равна нулю лишь в случае, если мы имеем дело с изолированным атомом; численное значение степени окисления может НЕ совпадать с валентностью. Например, валентность азота в N 2 равна III, а степень окисления = 0. Валентность углерода в муравьиной кислоте = IV, а степень окисления = +2.
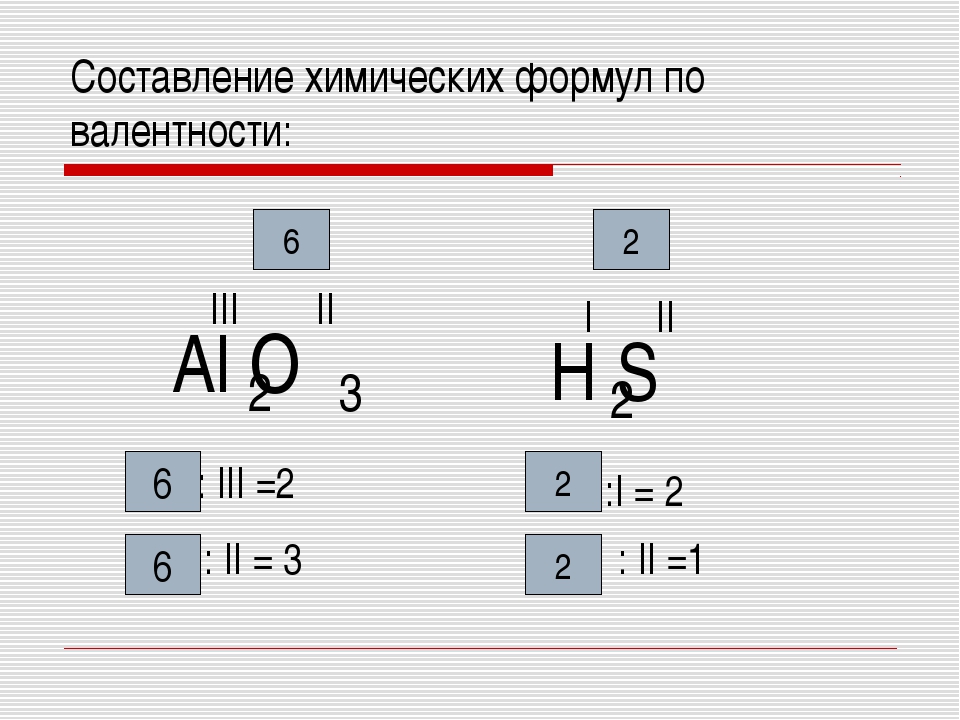
Если известна валентность одного из элементов в бинарном соединении, можно найти валентность другого.
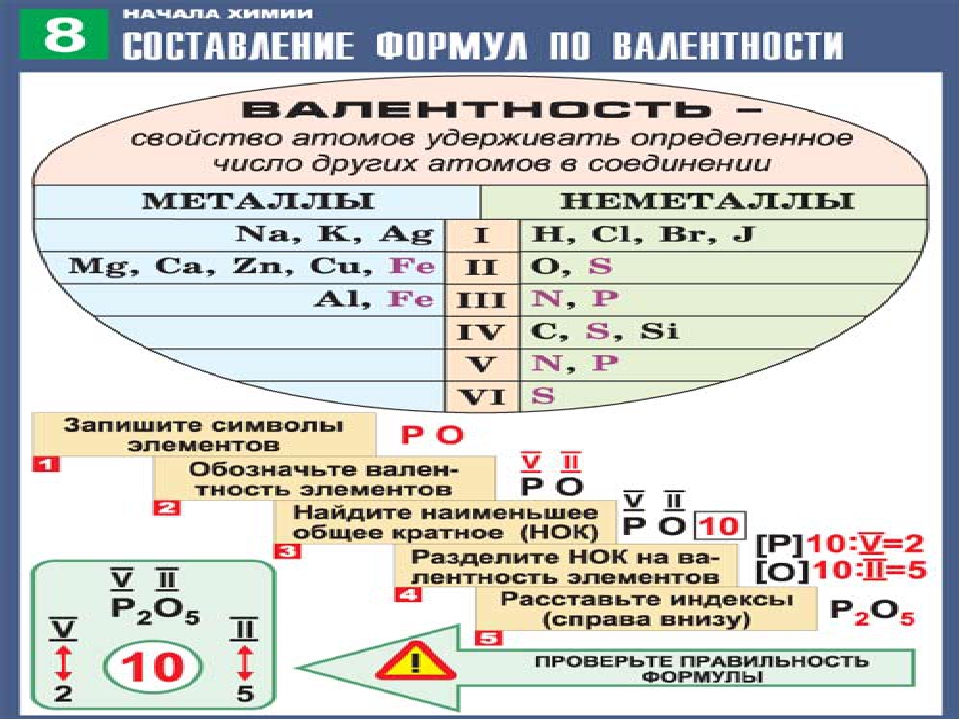
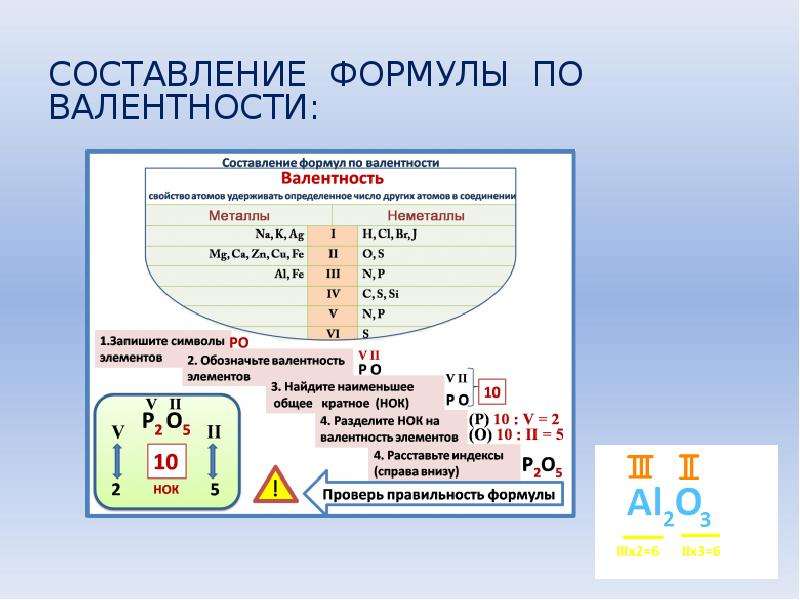
Делается это весьма просто. Запомните формальное правило: произведение числа атомов первого элемента в молекуле на его валентность должно быть равно аналогичному произведению для второго элемента .
Пример 1 . Найти валентности всех элементов в соединении NH 3 .
Решение . Валентность водорода нам известна — она постоянна и равна I. Умножаем валентность Н на число атомов водорода в молекуле аммиака: 1 3 = 3. Следовательно, для азота произведение 1 (число атомов N) на X (валентность азота) также должно быть равно 3. Очевидно, что Х = 3. Ответ: N(III), H(I).
Пример 2 . Найти валентности всех элементов в молекуле Cl 2 O 5 .
Решение . У кислорода валентность постоянна (II), в молекуле данного оксида пять атомов кислорода и два атома хлора. Пусть валентность хлора = Х. Составляем уравнение: 5 2 = 2 Х. Очевидно, что Х = 5. Ответ: Cl(V), O(II).
Пример 3
. Найти валентность хлора в молекуле SCl 2 , если известно, что валентность серы равна II.
Решение . Если бы авторы задачи не сообщили нам валентность серы, решить ее было бы невозможно. И S, и Cl — элементы с переменной валентностью. С учетом дополнительной информации, решение строится по схеме примеров 1 и 2. Ответ: Cl(I).
Зная валентности двух элементов, можно составить формулу бинарного соединения.
В примерах 1 — 3 мы по формуле определяли валентность, попробуем теперь проделать обратную процедуру.
Пример 4 . Составьте формулу соединения кальция с водородом.
Решение . Валентности кальция и водорода известны — II и I соответственно. Пусть формула искомого соединения — Ca x H y . Вновь составляем известное уравнение: 2 x = 1 у. В качестве одного из решений этого уравнения можно взять x = 1, y = 2. Ответ: CaH 2 .
«А почему именно CaH 2 ? — спросите вы. — Ведь варианты Ca 2 H 4 и Ca 4 H 8 и даже Ca 10 H 20 не противоречат нашему правилу!»
Ответ прост: берите минимально возможные значения х и у. В приведенном примере эти минимальные (натуральные!) значения как раз и равны 1 и 2.
«Значит, соединения типа N 2 O 4 или C 6 H 6 невозможны? — спросите вы. — Следует заменить эти формулы на NO 2 и CH?»
Нет, возможны. Более того, N 2 O 4 и NO 2 — это совершенно разные вещества. А вот формула СН вообще не соответствует никакому реальному устойчивому веществу (в отличие от С 6 Н 6).
Несмотря на все сказанное, в большинстве случаев можно руководствоваться правилом: берите наименьшие значения индексов.
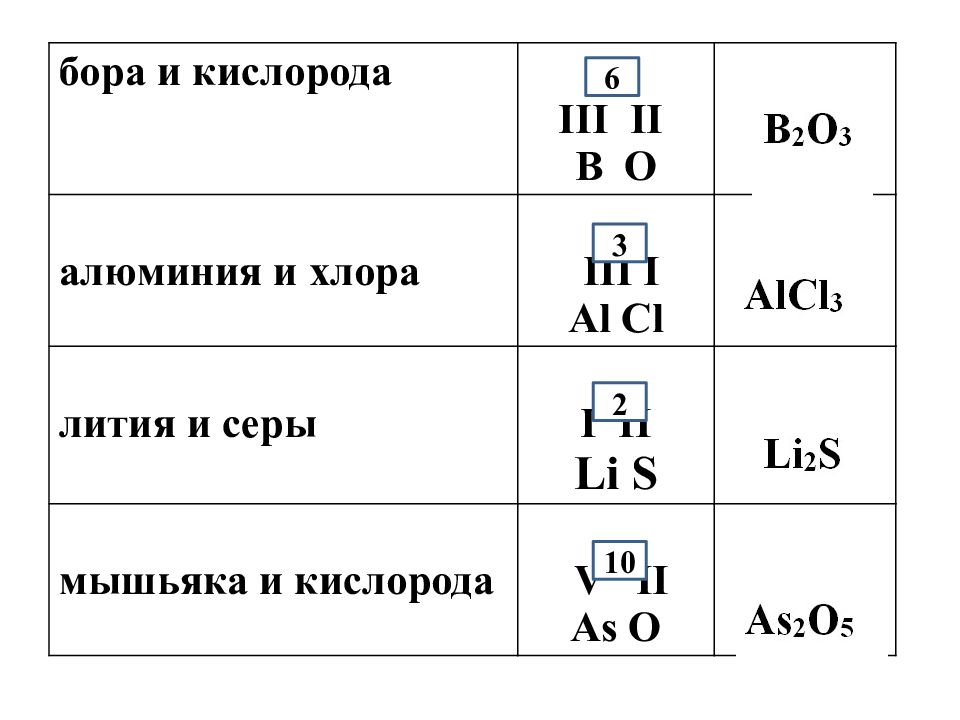
Пример 5 . Составьте формулу соединения серы с фтором, если известно, что валентность серы равна шести.
Решение . Пусть формула соединения — S x F y . Валентность серы дана (VI), валентность фтора постоянна (I). Вновь составляем уравнение: 6 x = 1 y. Несложно понять, что наименьшие возможные значения переменных — это 1 и 6. Ответ: SF 6 .
Вот, собственно, и все основные моменты.
А теперь проверьте себя! Предлагаю пройти небольшой тест по теме «Валентность» .
ОПРЕДЕЛЕНИЕ
Под валентностью
подразумевается свойство атома данного элемента присоединять или замещать определенное число атомов другого элемента.
Мерой валентности поэтому может быть число химических связей, образуемых данным атомом с другими атомами. Таким образом, в настоящее время под валентностью химического элемента обычно понимается его способность (в более узком смысле — мера его способности) к образованию химических связей (рис. 1). В представлении метода валентных связей числовое значение валентности соответствует числу ковалентных связей, которые образует атом.
Рис. 1. Схематическое образование молекул воды и аммиака.
Таблица валентности химических элементов
Первоначально за единицу валентности принимали валентность водорода. Валентность другого элемента при этом выражали числом атомов водорода, которые присоединяет к себе или замещает один атом этого элемента (т.н. валентность по водороду). Например, в соединениях состава HCl, H 2 O, NH 3 , CH 4 валентность по водороду хлора равна единице, кислорода — двум, азота — трем, углерода — четырем.
Потом было решено, что определить валентность искомого элемента можно и по кислороду, валентность которого, как правило, равна двум. В этом случае валентность химического элемента рассчитывается как удвоенное число атомов кислорода, которое может присоединить один атом данного элемента (т.н. валентность по кислороду). Например, в соединениях составаN 2 O, CO, SiO 2 , SO 3 валентность по кислороду азота равна единице, углерода — двум, кремния — четырем, серы — шести.
В этом случае валентность химического элемента рассчитывается как удвоенное число атомов кислорода, которое может присоединить один атом данного элемента (т.н. валентность по кислороду). Например, в соединениях составаN 2 O, CO, SiO 2 , SO 3 валентность по кислороду азота равна единице, углерода — двум, кремния — четырем, серы — шести.
На деле оказалось, что у большинства химических элементов значения валентности в водородных и в кислородных соединениях различны: например, валентность серы по водороду равна двум (H 2 S), а по кислороду — шести (SO 3). Кроме того, большинство элементов проявляют в своих соединениях различную валентность. Например, углерод образует два оксида: монооксид CO и диоксид CO 2 . В первом из которых валентность углерода равна II, а во втором — четырем. Откуда следует, что охарактеризовать валентность элемента каким-нибудь одним числом, как правило, нельзя.
Высшая и низшая валентности химических элементов
Значения высшей и низшей валентностей химического элемента можно определить при помощи Периодической таблицы Д. И. Менделеева. Высшая валентность элемента совпадает с номером группы, в которой он расположен, а низшая представляет собой разность между числом 8 и номером группы. Например, бром расположен в VIIA группе, значит его высшая валентность равна VII, а низшая — I.
И. Менделеева. Высшая валентность элемента совпадает с номером группы, в которой он расположен, а низшая представляет собой разность между числом 8 и номером группы. Например, бром расположен в VIIA группе, значит его высшая валентность равна VII, а низшая — I.
Существуют элементы с т.н. постоянной валентностью (металлы IA и IIA групп, алюминий водород, фтор, кислород), которые в своих соединениях проявляют единственную степень окисления, которая чаще всего совпадает с номером группы Периодической таблицы Д.И. Менделеева, где они расположены).
Элементы, для которых характерны несколько значений валентности (причем не всегда это высшая и низшая валентность) называются переменновалентными. Например, для серы характерны валентности II, IV и VI.
Для того, чтобы легче было запомнить сколько и какие валентности характерны для конкретного химического элемента используют таблицы валентности химических элементов, которые выглядят следующим образом:
Примеры решения задач
ПРИМЕР 1
| Задание | Валентность III характерна для: а)Ca; б) P; в) O; г)Si? |
| Решение | а) Кальций — металл. б) Фосфор — неметалл. Относится к группе химических элементов с переменной валентностью: высшая определяется номером группы в Периодической таблице Д.И. Менделеева, в которой он расположен, т.е. равна V, а низшая -разностью между числом 8 и номером группы, т.е. равна III. Это верный ответ. |
| Ответ | Вариант (б) |
ПРИМЕР 2
| Задание | Валентность III характерна для: а)Be; б) F; в) Al; г)C? |
| Решение | Для того, чтобы дать верный ответ на поставленный вопрос будем рассматривать каждый из предложенных вариантов в отдельности.
а) Бериллий — металл. Характеризуется единственно возможным значением валентности, совпадающим с номером группы в Периодической таблице Д.И. Менделеева, в которой он расположен, т. б) Фтор — неметалл. Характеризуется единственно возможным значением валентности равным I. Ответ неверный. в) Алюминий — металл. Характеризуется единственно возможным значением валентности, совпадающим с номером группы в Периодической таблице Д.И. Менделеева, в которой он расположен, т.е. валентность алюминия равна III. Это верный ответ. |
| Ответ | Вариант (в) |
Для того чтобы научиться составлять химические формулы необходимо выяснить закономерности, согласно которым атомы химических элементов соединяются между собой в определенных соотношениях. Для этого сравним качествен-ный и количественный состав соединений, формулы кото-рых HCl, H 2 O, NH 3 , CH 4 (рис. 12.1)
По качественному составу эти вещества схожи:в состав каждой из молекул входят атомы водорода. Тем не менее их количественный состав неодинаков. Атомы хлора, кислорода, азота, углерода соединены соответственно с одним, двумя, тремя и четырьмя атомами водорода
Эту закономерность подметил еще в начале XI в. Дж. Дальтон. Со временем И. Я. Берцелиус обнаружил, что наиболь-шее количество атомов, соединенных с атомом химического элемента, не превышает определенной величины. В 1858 г. Э. Франкленд назвал «соединительной силой» способность атомов связывать или замещать определенное число других атомов Термин «валентность»
(от лат. valentia —
«сила») предложил в 1868 г. немецкий химик К. Г. Вихельхауз.
Дж. Дальтон. Со временем И. Я. Берцелиус обнаружил, что наиболь-шее количество атомов, соединенных с атомом химического элемента, не превышает определенной величины. В 1858 г. Э. Франкленд назвал «соединительной силой» способность атомов связывать или замещать определенное число других атомов Термин «валентность»
(от лат. valentia —
«сила») предложил в 1868 г. немецкий химик К. Г. Вихельхауз.
Валентность — общее свойство атомов. Она характе-ризует способность атомов химически (валентными си-лами) взаимодействовать друг с другом.
Валентность многих химических элементов определили на основе экспериментальных данных о количественном и качественном составе веществ. За единицу валентности бы-ла принята валентностьатома водорода. Если атом хими-ческого элемента соединен с двумя одновалентными атома-ми, то его валентность равна двум. Если он соединен с тремя одновалентными атомами, то он — трехвалентен и т. д.
Наи-высшее значение валентности химических элементов — VIII
.
Валентность обозначают римскими цифрами. Обозначим валентность в формулах рассмотренных соединений:
Также ученые обнаружили, что немало элементов в раз-ных соединениях проявляют разные значения валентности. То есть существуют химические элементы с постоянной и переменной валентностью.
Можно ли определить валентность по положению хими-ческого элемента в периодической системе? Максимальное значение валентности элемента совпадает с номером группы периодической системы, в которой он размещен. Тем не менее бывают и исключения — азот, кислород, фтор, медь и некото-рые другие элементы. Запомни : номер группы обозначен римской цифрой над соответствующим вертикальным столби-ком периодической системы.
|
Элемент |
Валентность |
Элемент |
Валентность |
|
Водород (Н) |
Кальций (Са) |
||
|
Натрий (Na) |
Барий (Ва) |
||
|
Кислород(O) |
|||
|
Бериллий(Be) |
Алюминий (Al) |
||
|
Магний (Mg) |
|
Элемент |
Валентность |
Элемент |
Валентность |
|
Железо (Fe) |
|||
|
Марганец (Mg) |
|||
|
II, III, VI Материал с сайта |
|||
|
Серебро (Ag) |
Фосфор (P) |
||
|
Золото (Au) |
Мышьяк (As) |
||
|
Углерод (C) |
|||
|
Свинец (Pb) |
Кремний (Si) |
На этой странице материал по темам:
Валентность — это способность химических элементов удерживать определенное количество атомов других элементов. В то же самое время, это число связей, образуемое данным атомом с другими атомами. Определить валентность достаточно просто.
В то же самое время, это число связей, образуемое данным атомом с другими атомами. Определить валентность достаточно просто.
Спонсор размещения P&G Статьи по теме «Как определить валентность» Как доказать амфотерность гидроксидов Как вычислить валентность Как определить химическую формулу
Инструкция
Возьмите на заметку, что обозначается показатель валентности римскими цифрами и ставится над знаком элемента.
Обратите внимание: если формула двухэлементного вещества написана правильно, то,
при умножении числа атомов каждого элемента на его валентность, у всех элементов
должны получиться одинаковые произведения.
Примите к сведению, что валентность атомов одних элементов постоянна, а других — переменна, то есть, имеет свойство меняться. Например, водород во всех соединениях одновалентен, поскольку образует только одну связь. Кислород способен образовывать две связи, являясь при этом двухвалентным. А вот у серы валентность может быть II, IV или VI. Все зависит от элемента, с которым она соединяется. Таким образом, сера — элемент с переменной валентностью.
Все зависит от элемента, с которым она соединяется. Таким образом, сера — элемент с переменной валентностью.
Заметьте, что в молекулах водородных соединений вычислить валентность очень просто.
Водород всегда одновалентен, а этот показатель у связанного с ним элемента будет равняться количеству атомов водорода в данной молекуле. К примеру, в Cah3 кальций будет двухвалентен.
Запомните главное правило определения валентности: произведение показателя валентности атома какого-либо элемента и количества его атомов в какой-либо молекуле всегда равно произведению показателя валентности атома второго элемента и количества его атомов в данной молекуле.
Посмотрите на буквенную формулу, обозначающую это равенство: V1 x K1 = V2 x K2, где V — это валентность атомов элементов, а К — количество атомов в молекуле. С ее помощью легко определить показатель валентности любого элемента, если известны остальные данные.
Рассмотрите пример с молекулой оксида серы SО2. Кислород во всех соединениях двухвалентен, поэтому, подставляя значения в пропорцию: Vкислорода х Кислорода = Vсеры х Ксеры, получаем: 2 х 2 = Vсеры х 2. От сюда Vсеры = 4/2 = 2. Таким образом, валентность серы в данной молекуле равна 2.
От сюда Vсеры = 4/2 = 2. Таким образом, валентность серы в данной молекуле равна 2.
Другие новости по теме:
Химическая формула – это запись, сделанная с использованием общепринятых символов, которая характеризует состав молекулы какого-либо вещества. Например, формула всем известной серной кислоты – h3SO4. Легко можно увидеть, что каждая молекула серной кислоты содержит два атома водорода, четыре атома
Валентность — это способность атома присоединять другие атомные группы и отдельные атомы. Это важное понятие позволяет определить, сколько атомов того или иного вещества входит в формулу, и изобразить молекулу вещества графически. Вам понадобится таблица валентностей Спонсор размещения P&G Статьи
«Знание шрифтов – одно из самых элементарных требований, предъявляемых к сыщику!», — так наставлял когда-то великий Шерлок Холмс своего друга и летописца доктора Ватсона. Аналогично этому, можно смело сказать: «Знание того, как составляются химические формулы – одно из самых элементарных
Химия для каждого школьника начинается с таблицы Менделеева и фундаментальных законов. И уже только потом, уяснив для себя, что же изучает эта сложная наука, можно приступать к составлению химических формул. Для грамотной записи соединения нужно знать валентность атомов, составляющих его. Спонсор
И уже только потом, уяснив для себя, что же изучает эта сложная наука, можно приступать к составлению химических формул. Для грамотной записи соединения нужно знать валентность атомов, составляющих его. Спонсор
Валентность химического элемента — это способность атома присоединять или замещать определенное число других атомов или атомных групп с образованием химической связи. Нужно помнить, что некоторые атомы одного и того же химического элемента могут иметь разную валентность в разных соединениях. Вам
Валентность – один из основных терминов, употребляемых в теории химического строения. Это понятие определяет способность атома образовывать химические связи и количественно представляет собой число связей, в которых он участвует. Спонсор размещения P&G Статьи по теме «Что такое валентность» Что
Со школы или даже раньше каждый знает, всё вокруг, включая и нас самих, состоит их атомов – наименьших и неделимых частиц. Благодаря способности атомов соединяться друг с другом, многообразие нашего мира огромно. Способность эта атомов химического элемента образовывать связи с другими атомами
Способность эта атомов химического элемента образовывать связи с другими атомами
1 Химические элементы расположены в порядке возрастания атомных радиусов в ряду
№2.
ТЕСТ 1.
1. Химические элементы расположены в порядке возрастания атомных радиусов в ряду
1) B,C, N 2) N, P, As 3) Na, Mg, K 4) B, Si, N
2. В атоме железа число свободных 3d – орбиталей равно
1) 0 2) 3 3) 1
3.В ряду химических элементов Li—Be—B—C
1) увеличивается число валентных электронов в атомах
2) уменьшается число валентных электронов в атомах
3) уменьшается число протонов в ядрах атомов
4) увеличивается радиус атомов
4. Наибольшей
восстановительной активностью обладает
Наибольшей
восстановительной активностью обладает
1) Ca 2) K 3) AI 4) Si
5. У какого элемента наиболее выражены металлические свойства
1) Li 2) Fe 3) Na 4) Mg
ТЕСТ 2.
1.Химические элементы расположены в порядке возрастания их атомных радиусов в ряду.
1) K, Rb, Cs 2) Rb, Sr, In 3) AI, Na, Mg 4) O, S, CI
2.В главных подгруппах периодической системы восстановительная способность атомов химических элементов растет с
1) увеличением числа нейтронов в ядре
2) уменьшением радиуса атомов
3) увеличением числа электронов на внешнем энергетическом уровне
4) увеличением радиуса атомов
3.В ряду химических элементов Si—P—S—CI
1) увеличивается число электронных слоев в атомах
2) уменьшается число валентных электронов в атомах
3) уменьшается число протонов в ядрах атомов
4) уменьшается радиус атомов
4.Наибольшей восстановительной активностью обладает
1) Si 2) P 3) S 4)CI
5. Высший оксид состава ЭО образуют все
элементы
Высший оксид состава ЭО образуют все
элементы
1) IV A группы 2) II А группы 3) IV периода 4) II периода
ТЕСТ 3.
1. Химические элементы расположены в порядке возрастания их атомных радиусов в ряду
1) Ga, Ge, As 2) AI, Ga, Ge 3) As, P,Ge 4) Se, As, Ge
2. Водородное соединение, окрашивающее раствор лакмуса в синий цвет, образует
1) углерод 2) азот 3) фтор 4) кислород
3.В ряду химических элементов Be—Mg—Ca—Sr
1) увеличивается число валентных электронов в атомах
2)уменьшается число валентных электронов в атомах
3) уменьшается число протонов в ядрах атомов
4) увеличивается радиус атомов
4.Наименьшую энергию ионизации имеет
1) In 2) TI 3) Ga
5.Высший оксид состава ЭО2 образуют все элементы
1) IV Ф группы 2) II А группы 3) IV периода 4) II периода
ТЕСТ 4.
1.Химические элементы расположены в порядке возрастания их атомных радиусов в ряду
1) Mn, Fe, Co 2) Mn, Cr, Fe 3) AI, Sc, Ti 4) Ni, Cr, Sc
2. В побочных подгруппах периодической
системы восстановительная способность
атомов химических элементов растет с
В побочных подгруппах периодической
системы восстановительная способность
атомов химических элементов растет с
1) увеличением радиуса атомов
2) уменьшением радиуса атомов
3) увеличением числа электронов на внешнем энергетическом уровне
4) увеличением заряда ядра
3.Соединения состава KH2ЭO4 и K2HЭO4 образует элемент
1) хлор 2) сера 3) азот 4) фосфор
4.Наибольшей восстановительной активностью обладает
1) Br 2) As 3) Ga 4) Ge
5. У какого элемента наиболее выражены металлические свойства
1) K 2) Rb 3) Cs 4) Sr
ТЕСТ 5.
1.Химические элементы расположены в порядке возрастания атомных радиусов в ряду
1) Zn, Cd, Ca 2) Br, CI, F 3)In, Sn, Sb 4) Br, Se, As
2. В атоме титана число свободных 3d орбиталей равно
1) о 2) 4 3) 2 4) 3
3.В ряду оксидов SiO2—P2O5—SO3—CI2O7 кислотные свойства 1)возрастают 2) убывают 3) не изменяются 4) сначала уменьшаются, потом увеличиваются
4. Наибольшей восстановительной активностью
обладает
Наибольшей восстановительной активностью
обладает
1) Mn 2) Ca 3) K 4) Rb
5. Соединение состава H2Э2 образует
1) углерод 2) кремний 3) бор 4) азот
ТЕСТ 6.
1.Химические элементы расположены в порядке уменьшения их атомных радиусов в ряду.
1) Pb, Sn, Ge 2) Ga, In, TI 3) K, Rb, Cs 4) Li, Na, Ca
2. в Главных подгруппах периодической системы окислительная способность атомов химических элементов растет при
1) увеличении числа энергетических уровней 2) увеличении числа протонов в ядре 3) уменьшении радиуса атома 4) увеличении числа валентных электронов.
3.В ряду S—P—Si—AI
1) увеличивается число энергетических уровней в атомах
2) усиливаются металлические свойства элементов
3) увеличивается высшая степень окисления элементов
4) ослабевают металлические свойства элементов.
4.Высшая степень окисления в ряду химических элементов
Галлий—германий—мышьяк – селен
1) увеличивается 2) уменьшается 3) не изменяется 4) сначала уменьшается, затем увеличивается
5. Высший
оксид состава Э2О3 образуют
все элементы
Высший
оксид состава Э2О3 образуют
все элементы
1) III А группы 2) IV А группы 3) VI А группы 4) VII А группы
ТЕСТ 7.
1.Химические элементы расположены в порядке уменьшения их атомных радиусов в ряду
1) Ba, Cd, Ra 2) In, Pb, Sb 3) Cs, Na,H 4) Br, Se, As
2.В ряду элементов натрий—магний—алюминий возрастает их
1) атомный радиус 2) восстановительная способность 3) химическая активность 4) электроотрицательность
3.В ряду Mg—Si—P—S
1) увеличивается число энергетических уровней в атомах
2) усиливаются металлические свойства элементов
3) уменьшается высшая степень окисления элементов
4) ослабевают металлические свойства элементов
4. Высшая степень окисления в ряду химических элементов
Индий—олово—сурьма—теллур
1) уменьшается 2) не изменяется 3) увеличивается 4) сначала увеличивается, затем уменьшается
5. У
какого элемента наиболее выражены
металлические свойства
У
какого элемента наиболее выражены
металлические свойства
1) Be 2) AI 3) Ca 4)Sr
ТЕСТ 8.
1.Химические элементы расположены в порядке увеличения атомных радиусов в ряду.
1) Zn, Ca, Cd 2) F, CI, Br 3) In, Sn, Sb 4) As, Se, Br
2. Простые вещества расположены в порядке усиления металлических свойств в ряду
1) Ca, K, AI 2) AI, Ga, Sr 3) Ca, Sc, Ti 4) Cr, Mn, Fe
3.В ряду AI—Si—P—S
1) увеличивается число энергетических уровней в атомах
2) усиливаются металлические свойства элементов
3) уменьшается высшая степень окисления элементов
4) ослабевают металлические свойства элементов
4.Высшая степень окисления в ряду химических элементов
Титан—ванадий—хром—марганец 1) увеличивается 2) уменьшается 3) не изменяется 4) сначала уменьшается, затем увеличивается
5.
Основные свойства оксидов усиливаются
в ряду.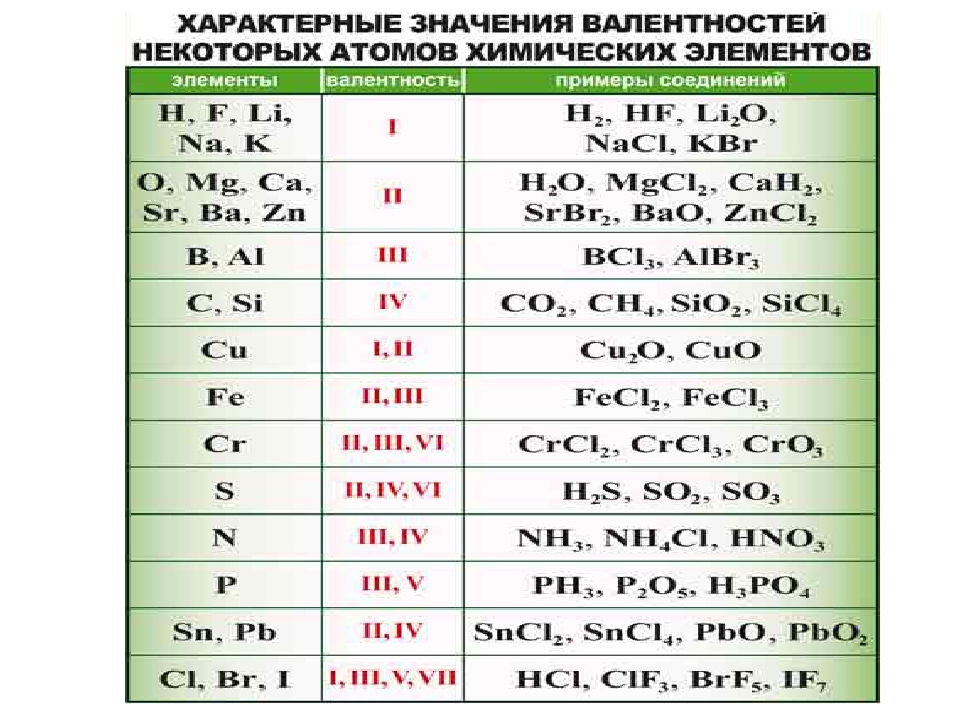
1) Na2O, MgO,AI2O3 2) MgO,AI2O3 3) AI2O3, MgO, Na2O 4) AI2O3, Na2O,MgO
№3. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая, водородная. Способы образования ковалентной связи. Характеристики ковалентной связи: длина и энергия связи. Образование ионной связи.
ТЕСТ 1.
1.В молекуле CO2 химическая связь
1) ионная 2) ковалентная полярная 3) ковалентная неполярная 4) водородная
2. В каком ряду представлены вещества только с ионной связью?
1) SiO2, CaO, Na2SO4 2)HCIO4, CO2, NaBr 3) MgO, NaI, CsO2 4) H2O, AICI3, PbI
3. Число σ – связей в молекуле бромбензола равно
1) 8 2) 6 3) 12 4) 7
4. По
донорно-акцепторному механизму образована
одна из ковалентных связей в соединении
или ионе
По
донорно-акцепторному механизму образована
одна из ковалентных связей в соединении
или ионе
1) NH3 2) (NH4)2S 3) CCI4 4) SiF4
5. Соединениями с ковалентной неполярной и ионной связью являются соответственно
1) O3 u Na3N 2) O2 u NH3 3) O2 u HBr 4) O2 u S8
ТЕСТ 2.
1.Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно
1) NaCI u CI2 2) HCI u O2 3) O3u HF 4) NH3 u H2O
2.Прочность углерод-углеродной связи в ряду
Пропан—пропен—пропин
1) увеличивается 2) сначала увеличивается, затем уменьшается 3) уменьшается 4) не изменяется
3.Число π – связей в молекуле серной кислоты равно
1) 4 2) 2 3) 8 4) 6
4. Химическая
связь в молекуле этана и хлориде лития
соответственно
Химическая
связь в молекуле этана и хлориде лития
соответственно
1) водородная и ковалентная полярная 2) ковалентная слабополярная и ионная 3) ионная и ковалентная неполярная 4) ковалентная неполярная и ковалентная полярная
5.В оксидах металлов связь
1) ковалентная полярная 2) ковалентная неполярная 3) ионная 4) ковалентная слабополярная
ТЕСТ 3.
1.В хлориде натрия химическая связь
1) ионная 2) ковалентная полярная 3) ковалентная неполярная 4) водородная
2.В каком ряду записаны вещества с ионной связью?
1) TiO2, Ca3N2, Na2S 2) KCIO3, C2H2, NaBr 3)CO, NaIO3, C2H5OH 4) H2S, AICI3, NaHCO3
3. Число σ – связей в молекуле этанола равно
1) 6 2) 8 3) 7
4.По донорно-акцепторному механизму образована одна из ковалентных связей в соединении или ионе
1) OH— 2) SO42- 3) H3O+ 4) CaOH+
5. Соединениями
с ковалентной неполярной и ионной
связью являются соответственно
Соединениями
с ковалентной неполярной и ионной
связью являются соответственно
1) N2 u O3 2) N2 u NO 3) N2 u NaCI 4) N2 u CaSO4
ТЕСТ 4.
1.Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно
1) HI u H2 2) HCI u Ca 3) O3 u PH3 4) P4 u H2Se
2.Прочность углерод — углеродной связи в ряду
Этин- этилен- этан
1) увеличивается 2) сначала увеличивается, затем уменьшается 3) уменьшается 4) не изменяется
3.Число π – связей в молекуле оксида углерода (4) равно
1)2 2) 4 3) 1 4) 3
4.Химическая связь в молекулах хлористого метила и азота соответственно
1) водородная и ковалентная полярная
2) ковалентная слабополярная и ионная
3) ковалентная полярная и ковалентная неполярная
4) ионная и ковалентная неполярная
5. В
гидроксосоединениях неметаллов связь
В
гидроксосоединениях неметаллов связь
1) ионная 2) ковалентная слабополярная 3) ковалентная полярная 4) ковалентная неполярная
ТЕСТ 5.
1.В молекуле NH3 химическая связь
1) ионная 2) ковалентная полярная 3) ковалентная неполярная 4) водородная
2.Путем соединения атомов одного и того же химического элемента образуется связь
1) ионная 2) ковалентная полярная 3) ковалентная неполярная 4) водородная
3.Число σ- связей в молекуле этина равно
1) 5 2) 4 3) 3
4.По донорно-акцепторному механизму образована одна из ковалентных связей в соединении или ионе.
1) AI(OH)2+ 2) NH4+ 3)FeOH+ 4) CH4+
5. Соединениями с ковалентной неполярной и ионной связью являются соответственно
1) P4 u N2O 2) P4 u SO3 3) P4 u LiCI
ТЕСТ
6.
1.Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно
1) I2 u H2Те 2) HBr u N2 3) Fe u HF 4) CO u SO2
2.Прочность углерод- углеродной связи в ряду
Этилен — этин – этан
1) увеличивается 2) сначала увеличивается, затем уменьшается 3) уменьшается 4) не изменяется
3.Число π – связей в молекуле фосфорной кислоты равно
1) 8 2) 1 3) 6 4) 2
4.Химическая связь в молекулах водорода и этанола соответственно
1) водородная и ковалентная полярная
2) ковалентная слабополярная и ионная
3) ионная и ковалентная неполярная
4) ковалентная неполярная и ковалентная полярная
5.Соединениями с ковалентной неполярной и ионной связью являются соответственно.
1) CO u O3 2) CaO u SO3 3) NH3 u H2 4) S8 u Li4Si
ТЕСТ 7
1. В
молекуле HCI химическая
связь
В
молекуле HCI химическая
связь
1) ионная 2) ковалентная полярная 3) ковалентная неполярная 4) водородная
2. В каком ряду записаны вещества только с ионной связью?
1) CH3COONa, AI4C3, Na2SO4,AI4C3, Na2SO4 2) KCI, CaH2, NaCI 3) CO, NaIO3, C2H5OH 4) S8 AI(NO3)3, O3
3. Число σ – связей в молекуле циклогексана равно
1) 12 2) 14 3) 18 4) 16.
4.По донорно-акцепторному механизму образована одна из ковалентных связей в соединении.
5.В оксидах неметаллов связь
1) ионная 2) ковалентная слабополярная 3) ковалентная полярная 4) ковалентная неполярная
ТЕСТ 8.
1.Между атомами элементов с порядковыми номерами 11 и 17 возникает связь
1) металлическая 2) ионная 3) ковалентная 4) донорно-акцепторная
2. Атом
химического элемента, образующего с
галогеном соединение с ионной связью,
имеет электронную конфигурацию
Атом
химического элемента, образующего с
галогеном соединение с ионной связью,
имеет электронную конфигурацию
1) 1s22s22p6 2) 1s22s22p63s1 3) 1s22s22p63s23p3 4) 1s22s22p63s23p5
3.Число π – связей в молекуле этена равно
1) 1 2) 4 3) 2 4) 3
4.Химическая связь в хлориде бария и озоне соответственно
1) водородная и ковалентная полярная
2) Ковалентная и слабополярная и ионная
3) ионная и ковалентная неполярная
4) ковалентная неполярная и ковалентная полярная
5. Ковалентная связь образуется за счет
1) неспаренных электронов с противоположными спинами
2) неспаренных электронов с одинаковыми спинами
3) полной передачи электронов внешнего энергетического уровня
4) полной
передачи электронов внешнего и
предвнешнего энергетических уровней.
№4 Электроотрицательность. Степень и окисления и валентность химических элементов.
ТЕСТ 1.
1.Наибольшую электроотрицательность имеет элемент
1) N 2) S 3) Br 4)O
2. Степень окисления – 3 фосфор проявляет в соединении.
1) P2O3 2) P2O5 3) Ca3P2 4) Ca(H2PO4)2
3. Степень окисления азота в ионе NH4+ равна 1) +5 2) +3 3) -3 4) +1
4.Валентность III характерна для
1) Сф 2) P 3) O 4) Si
5.Все элементы в каком ряду могут проявлять степени окисления -1 и +5?
1) Rb, Ca, Li 2) H,Si,F 3) CI, I, Br 4) As, N, Te
ТЕСТ 2
1.Наибольшую степень окисления хром проявляет в соединении
1) K2Cr2O7 2) Cr2O3 3) Cr(OH)2 4) NaCrO2
2. В соединении NH3,
N2O3,
HNO2 степень окисления
азота соответственно равна
В соединении NH3,
N2O3,
HNO2 степень окисления
азота соответственно равна
1) -3, +3, +3 2) +3,+5,+4 3) +4,+3,+1 4) _3, +5,+3
3.Верны ли следующие утверждения?
А.Высшая валентность элемента определяется номером группы
Б.Высшая валентность элемента определяется номером периода
1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны
4.Среди элементов III А группы наиболее электроотрицательным является
1) AI 2) B 3) In 4) Ga
5.Все элементы в каком ряду могут проявлять степень окисления +5?
1) P, N, CI 2) C, Se, F 3) O,B,I 4) Br, As, Sn
ТЕСТ 3.
1.Наибольшую электроотрицательность имеет элемент
1) Na 2) Li 3) Rb 4) K
2. Степень окисления – 3 азот проявляет в соединении
1) N2O3 2) N2O4 3) NaNO3 4) NH4OH
3. Степень
окисления азота в ионе NO2—
равна
Степень
окисления азота в ионе NO2—
равна
1) +5 2) +3 3) -3 4) +4
4.Валентность III характерна для
1) Be 2) F 3) AI 4) C
5. Все элементы в каком ряду проявлять степени окисления -3 и +5?
1) AI, Ca, Li 2) B, Sb, Bi 3) CI, I, Br 4)As, N, P
ТЕСТ 4.
1.Наибольшую степень окисления сера проявляет в соединении
1) KHSO3 2)Na2S 3) H2SO4 4) S8
2. В соединениях (NH4)2HPO4, (NH4)3PO3, Ca3P2 степень окисления фосфора соответственно равна
1) -5, +3, -3 2)+3,+5,-3 3) +5, +3,-3 4)-3,+5,+3
3.Верны ли следующие утверждения?
А.Высшая
валентность элемента определяется
числом неспаренных электронов в
возбужденном состоянии и способностью
элемента образовать связь по донорно-
экцепторному механизму.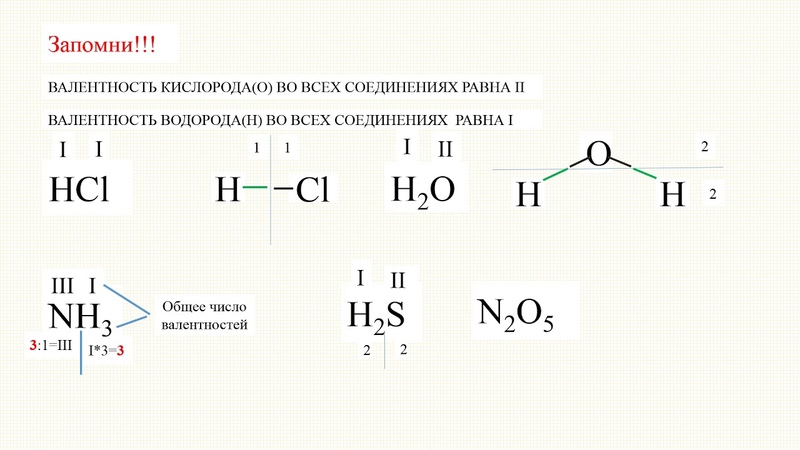
Б.Высшая валентность элемента определяется числом неспаренных электронов.
1) верно только А 2) Верно только Б 3) верны оба утверждения 4) оба утверждения неверны
4.Среди элементов IV группы наиболее электроотрицательным является
1) Si 2) Ge 3) C 4)Sn
5. Все элементы в каком ряду могут проявлять степень окисления -3? 1) Ga, AI, Be 2) C, Se, F 3) S, Br, In 4) P,N,Sb
ТЕСТ 5.
1.Наибольшую электроотрицательность имеет элемент
1) N 2) P 3) As 4)Sb
2.Наибольшую степень окисления железо проявляет в соединении
1) K4[Fe (CN)6] 2) K3[Fe(CN)6] 3)FeO 4) Fe (OH)2
3. Степень окисления – 3 мышьяк проявляет в соединении
1) As2O3 2) Na3AsO4 3) CaAs2 4) As2O5
4. Степень окисления хрома в ионе CrO42- равна
1)+3 2) +4 3) -2 4) +6
5. Валентность
III характерна для
Валентность
III характерна для
1) O 2)In 3) Mg 4) Se
ТЕСТ 6.
1.Наибольшую степень окисления азот проявляет в соединении
1) HNO3 2) Na3N 3)N2O 4) N2H4
2. В соединениях NH4CI, LiCIO4, CI2O степень окисления хлора соответственна равна
1) -1, +7, +3 2) +3,+7,-1 3) -1, +5,-3 4) -1,+7,+1
3.Верны ли следующие утверждения?
А.Высшая валентность элемента определяется его порядковым номером
Б.Высшая валентность элемента определяется числом электронов на внешнем электроном уровне.
1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны
4.Все элементы в каком ряду могут проявлять степень окисления +7?
1) Sb,AI,Be 2) Sn , Te, F 3) CI,Br,I 4) P,N,O
5. Все элементы, в каком ряду могут проявлять степень окисления -2 +6?
TI, Ca, Sn 2) S, Se, Te 3) Si, Sb,Te 4)C,O,P
ТЕСТ
7.
1.Наибольшую электроотрицательность имеет элемент
1) Ca 2) As 3) Se 4) Br
2. Степень окисления – 2 сера проявляет в соединении
1) S8 2) Na2S 3) CaSO4 4) SO2
3/Верны ли следующие утверждения?
А.Каждый химический элемент имеет единственную степень окисления, равную номеру группы.
Б. количество валентных состояний и степеней окисления элемента определяется его природой и положением в периодической системе
1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны.
4.Среди элементов 6 А группы наиболее электроотрицательным является
1) O 2) S 3) Se 4) Te
5.Валентность IV характерна для
1) Сa 2) P 3) O 4)Si
ТЕСТ 8.
1.Наибольшую степень окисления фосфор проявляет в соединении
1) KH2PO3 2) Na3P 3) H3PO4 4) P4
2. Степень окисления фосфора в ионе PO3-3
равна
Степень окисления фосфора в ионе PO3-3
равна
1) +5 2) +3 3) -3 4) -5
3.Верны ли следующие утверждения?
А.Каждый химический элемент имеет единственную степень окисления, равную номеру группы.
Б. Число валентных состояний и степеней окисления элемент может быть разным
1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны
4.Все элементы в каком ряду могут проявлять степень окисления +2?
1) С, Mg, Be 2) Ga, AI, Fe, 3) CI, Br, S 4) P, N, O
5. Какую валентность имеет железо в соединении, которое образуется при взаимодействии с соляной кислотой?
1) 1 2)2 3)3 4) 8
№5 Вещества молекулярного и немолекулярного строения. Зависимость свойств веществ от особенностей их кристаллической решетки.
ТЕСТ 1.
1.Молекулярную кристаллическую решетку имеет соединение
1) H2S 2) NaCI 3)SiO2 4)Cu
2. Молекулярное строение имеет каждое из
соединений:
Молекулярное строение имеет каждое из
соединений:
1) C2H5OH, H2S 2) CaBr2, NO2 3) Ca (OH)2, NH3 4) KNO3, Na2S
3. Наиболее высокую температуру плавления имеет вещество
1) NaCI 2) H2O 3) C2H5OH 4) Cu
4.Вода имеет кристаллическую решетку
1) атомную 2) ионную 3) металлическую 4) молекулярную
5.Термин «молекула» применим к веществам, имеющими кристаллическую решетку
1) ионную 2) атомную 3)молекулярную 4) металлическую
ТЕСТ 2.
1.Молекулярную кристаллическую решетку имеет соединение
1) Na2SO3 2) CaO 3) S8 4)Mg2Si
2. Молекулярное строение имеет имеет каждое из соединений:
1) С6H5ONa, H2Se 2) CH4, NO2 3)BaCI2, NH3 4) NH2CH2COOH, Na2S
3. Наиболее высокую температуру плавления
имеет вещество
Наиболее высокую температуру плавления
имеет вещество
1) NaOH 2) H2S 3) W 4) C2H5ONa
4.Фенол имеет кристаллическую решетку
1) атомную 2) металлическую 3) ионную 4) молекулярную
5.Вещества молекулярного строения характеризуются
1) низкой температурой плавления и кипения
2) непостоянством состава
3) высокой твердостью
4) электропроводностью
ТЕСТ 3
1.Молекулярную кристаллическую решетку имеет соединение
1) (NH4)2SO4 2) NiZn3 3) NO2 4)A4C3
2. Молекулярное строение имеет каждое из соединений: 1) C2H6, K2SO4 2) HBr, KNO2 3) C2H2, N2H4 4) BaO, Na2CO3
3. Наиболее высокую температуру плавления имеет вещество
1) HCI 2)NaOH 3) O2 4) C6H6
4. Иод имеет кристаллическую решетку
Иод имеет кристаллическую решетку
1) ионную 2) атомную 3) молекулярную 4) металлическую
5.Вещества молекулярного строения характеризуются
1) Высокой температурой плавления 2) постоянством состава 3) высокой твердостью 4) электропроводностью
ТЕСТ 4.
1.Молекулярную кристаллическую решетку имеет соединение
1) оксид фосфора (V) 2) хлорид бария 3) алмаз 4) гидроксид калия
2.Молекулярное строение имеет каждое из соединений:
1) H2O, K2SO4 2) C6H12O6, NH3 3) HCI, KNO3 4) BaO, Na2CO3
3.Наиболее высокую температуру плавления имеет вещество
1) HI 2) C12H22O4 3) N2 4) NaOH
4.Стеариновая кислота имеет кристаллическую решетку
А) атомную 2) ионную 3) металлическую 4) молекулярную
5.Вещества молекулярного строения характеризуются
1) высокой температурой плавления 2) низкой температурой кипения 3) твердостью 4) электропроводностью
ТЕСТ 5
1. Молекулярную
кристаллическую решетку имеет соединение
Молекулярную
кристаллическую решетку имеет соединение
1) хлорат калия 2) сульфид натрия 3) сухой лед 4) челийская селитра
2.Немолекулярное строение имеют все неметаллы группы
1) углерод,бор, кремний 2) фтор, бром, йод 3) кислород, сера, азот 4) хлор, фосфор, селен
3.Металлы имеют кристаллическую решетку
1) ионную 2) металлическую 3) молекулярную 4) атомную
4.Термин «молекула» применим к веществу
1) H2O 2) NaCI 3) Na2O2 4) AI4C
5. Вещества молекулярного строения не характеризуются
1) низкой температурой плавления и кипения
2) постоянством состава
3) твердостью
4) невысокой электропроводностью
ТЕСТ 6
1.Молекулярную кристаллическую решетку имеет каждое из соединений
1) фтор и иод 2) оксид углерода (4) и золото 3) бром и железо 4) латунь и сульфат натрия
2.Немолекулярное строение имеет каждое из соединений:
1) H2O, H2SO4 2) I2, CO 3) CaO,AI4C3 4) KNO3, O2
3. Кристаллическая сера, имеет кристаллическую
решетку
Кристаллическая сера, имеет кристаллическую
решетку
1)атомную 2) ионную 3) молекулярную 4) атомно-ионную
4.Термин «молекула» применим к веществу
1) С6H5ONa 2) CH3COONa 3) CH2O 4) NH2CH2COOK
5.Ионную решетку имеет каждое из двух веществ:
1) NaCI, H2S 2) KF, H2O 3) HNO3, Cs2S 4) Na2CO3, K2S
ТЕСТ 7.
1.Атомную кристаллическую решетку имеет каждое из двух веществ:
1) хлорид натрия и алмаз
2) оксид углерода (4) и кремний
3) алмаз и графит
4) оксид кремния (4) и белый фосфор
2.Немолекулярное строение имеет каждое из соединений:
1) Cu, H2S 2) Ag, CO2 3) LiCIO3, N2O 4) CsCI, K3PO3
3. Кварц имеет, кристаллическую решетку
1) ионную 2) молекулярную 3) атомную 4) металлическую
4. Термин
«молекула» не применим к веществу
Термин
«молекула» не применим к веществу
1) Na3N 2) SO2 3) O3 4) P4
5. Ионную кристаллическую решетку имеет каждое из двух веществ:
1) O2, BaSO3 2) CO2, Na2S 3) O3, Cs2S 4) KF, K2O
ТЕСТ 8.
1.К веществам с атомной кристаллической решеткой относятся
1) натрий, фтор, оксид серы (4)
2) свинец, азотная кислота, оксид магния
3) бор, алмаз, карбид кремния
4) хлорид калия, белый фосфор, иод
2. Какие из утверждений верны?
А. Вещества с молекулярной решеткой имеют низкие температуры плавления и низкую электропроводность
Б.Вещества с атомной решеткой пластичны и обладают электрической проводимостью.
1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны
3.Атомную кристаллическую решетку имеет каждое из двух веществ:
1) оксид кремния (4) и оксид углерода (4) 2) графит и оксид кремния (4)
3) хлор и иод 4) хлорид калия и фторид натрия
4. Термин
«молекула» неприменим к веществу
Термин
«молекула» неприменим к веществу
1) H2O2 2) KCI 3) CH3OH 4) C2H6
5. Ионную кристаллическую решетку имеет каждое из двух веществ:
1) S8, KNO3 2) Na2S, KF 3)NaNO2, H2S 4) F2, H2O2
№6. Классификация неорганических веществ.
Классификация и номенклатура органических веществ
ТЕСТ 1.
1.В перечне веществ
А.ВaO Б. CaO В.Na2O Г.SO3 Д.P2O5 Е.CO2
Кислотными оксидами являются
1) АБВ 2) ВГД 3)ГДЕ 4)БГЕ
2.В перечне веществ А.ВaO Б. CaO В.Na2O Г.SO3 Д.P2O5 Е.CO2
Основными оксидами являются
1)АБВ 2) ВГД 3)ГДЕ 4)БГЕ
3. В
перечне веществ
В
перечне веществ
А) ZnO Б)CuO В)FeO Г)Fe2O3 Д)Cr2O3 Е)CrO
Амфотерными оксидами являются
1) АБВ 2)ВГД 3) АГД 4) БГЕ
4.В перечне веществ
А) Fe(OH)3 Б. NaHCO3 В.H2O Г.H2O2 Д.Ca(OH)2 Е. NaOH
Гидроксидами являются
1) АБГ 2)АДЕ 3) БГД 4) ВДЕ
5.В перечне кислот
А) азотистая Б) ортофосфорная В) серная Г) бромоводородная д) азотная Е) сероводородная сильными кислотами являются
1) ВГД 2) АДЕ 3) АБД г) БГЕ
6.В перечне веществ
А) NH4CI Б)KH2PO4 В)[Zn(NH3)4]SO4 Г)NaHS Д)Ca(HCO3)2 Е)CH3NH3CI
Кислыми солями являются
1) АБВ 2) АБД 3) БГД 4) БГЕ
7.Только соли расположены в ряду
1) HCOOH, (C2H5)NH2Br, NaAI(SO4)3 2) NaH2PO3, NaNO3, KCIO3 3)SrBr2, AIOHCI2, HI 4) CaCO3, H2SO4, KHS
8. Основным
оксидом и основной солью соответственно
являются 1) СaO
u CaOHCI
2)ZnO u NaHCO3
3)SO2 u
FeOHCI2 4) BaO
u Na2S
Основным
оксидом и основной солью соответственно
являются 1) СaO
u CaOHCI
2)ZnO u NaHCO3
3)SO2 u
FeOHCI2 4) BaO
u Na2S
9. Основанием и кислой солью соответственно являются
1) HNO3 u NH4AI(SO4)2 2) H2S u NaNO3 3) H2SO3 u CaOHCI 4)KOH u KHCO3
10.Аллотропные модификации кислорода не отличаются
1) физическими свойствами 2) типом химической связи между атомами 3) химическими свойствами 4) числом атомов, входящих в состав молекул
ТЕСТ 2
1.В перечне веществ
А)MgO Б)Na2O В)CO2 Г)CI2O7 Д)CaO Е)CrO3
Кислотными оксидами являются
1) АБВ 2)ВГД 3)АБД 4)ВГЕ
2.В перечне веществ
А) ZnO Б)CuO В) FeO Г)Fe2O3 Д)Cr2O3 Е)CrO
Основными оксидами являются
1)А БВ 2)ВГД 3)ГДЕ 4) БВЕ
3. В
перечне веществ
В
перечне веществ
1) ВеО 2) Сr2O3 3) SO2 4) CrO3 5)Fe2O3 6) NO2
Амфотерными оксидами являются
1) АБВ 2) АБД 3)ГДЕ 4)БГЕ
4.В перечне веществ
А) Mg(OH)2 Б)RbOH В)Be(OH)2 Г)Zn(OH)2 Д)Ba(OH)2 Е)AI(OH)3
Основаниями являются
1) АБГ 2)АДЕ 3)АБД 4)БГЕ
5.В перечне кислот
А) угольная Б) ортофосфорная В) серная Г) хлорная Д) уксусная Е) сероводородная
Слабыми кислотами являются
1) ВГД 2) АДЕ 3)АБД 4) БГЕ
6.В перечне веществ
А) NH4CI Б)CuOHNO3 В)[Cu(NH3)4]SO4 Г)MgOHCI Д)(FeOH)2SO4 Е)CH3NH3CI
Основными солями являются
1) АБВ 2) АБД 3) БГД 4) БГЕ
7. Только соли расположены в ряду
1) СH3COOC2H5, C2H5NH3 · CI, C6H5ONa
2) NH2CH2COONa, CH3OH, CH3OH
3) (C2H5)3NHCI, (HCOO)2Ca, C6H5ONa
4) CH3COOK, (HCOO)2Ca, (CH3)2NH
8. Основным оксидом и основной солью
соответственно являются
Основным оксидом и основной солью
соответственно являются
1)MgO u ZnOHCI 2) SiO2u FeOHCI2 3)BeO u KHCO3 4) CaO u K2S
9.Основанием и кислой солью соответственно являются
1) Ba(OH)2 u NH4AI(SO4)2
2) NaHS u LiOH
3) CaOHCI u NaHSO3
4) KOH u KHCO3
10.Аллотропной модификацией серы не является
1) пластическая 2) коллоидная 3) ромбическая 4) моноклинная
ТЕСТ 3.
1. В перечне веществ
А) NO2 Б)N2O В)CO Г)NO Д)CrO3 Е) SiO2
Кислотными оксидами являются
1) АБВ 2) АДЕ 3) АБД
2.В перечне веществ
А) MgO Б)Na2O В)CO Г)CI2O7 Д)CaO Е)CrO3
Основными оксидами являются
1) АБВ 2)ВГД 3)АБД
3.В перечне веществ
А) BaO Б)ZnO В)AI2O3 Г) K2O Д)Cr2O3 Е)FeO
Амфотерными оксидами являются
1) АГЕ 2) АДЕ 3) БВД 4) БГЕ
4. В перечне веществ
В перечне веществ
А) CH4 Б)H2S В)CH3COOH Г)NH3 Д)H5IO6 Е)K2HPO4
Кислотами являются
1) АБВ 2) БВД 3) БЕД 4) ВДБ
5.В перечне кислот
А)HNO2 Б)H3PO4 В)H2SO4 Г)HBr Д)HNO3 Е)H2S
Сильными кислотами расположены в ряду
1) H2CO3, H3PO4, HAsO4, HNO3
2) HCIO4, H2SeO4, HNO2, H3PO4
3) H2SO3, H2SiO3, H2SO4, H2CrO4
4) HMnO4, H3AsO4, H2BeO2, H2ZnO
7.Химические соединения CaCO3, Ca(HCO3)2, CH3COONa относится к
1) кислотам 2) основаниям 3) солям 4) оксидам
8. Амфотерным
и основными оксидами соответственно
являются
Амфотерным
и основными оксидами соответственно
являются
1) BaO, K2O 2) AI2O3, CaO 3) SO2, Na2O 4) Cr2O3, ZnO
9. Средней и основной солями соответственно являются
1) KNO3 u NH4CI 2)K2SO3 u FeOHCI2 3) (NH4)2S u NaNO3 4) MnSO4 u KHCO3
10.Высший оксид химического элемента с порядковым номером 16 относится к оксидам
1) основным 2) кислотным 3) амфотерным 4) несолеобразующим
ТЕСТ 4.
1.В перечне вещество
А) SiO2 Б) Fe2O3 В) BeO Г)ZnO Д) P2O5 Е)SO2
Кислотными оксидами являются
1) АГЕ 2) АДЕ 3)АБД 4) БГЕ
2.В перечне вещество
А) BaO Б)ZnO В)AI2O3 Г)K2O Д)Cr2O3 Е)FeO
Основными оксидами является
1) АГЕ 2) АДЕ 3) АБД 4)БГЕ
3. В
перечне веществ
В
перечне веществ
А) SiO2 Б) Fe2O3 В)BeO Г)ZnO Д)P2O5 Е)SO2
Амфотерными оксидами являются
1) АГЕ 2) АДЕ 3)АБД 4)БВГ
4.В перечне веществ
А) Mg(OH)2 RbOH Be(OH)2 Zn(OH)2 Ba(OH)2 AI(OH)3
Амфотерными гидроксидами являются
1) АБГ 2)АДЕ 3) АБД 4)ВГЕ
5.В перечне кислот
А) H2CO3 Б)H3PO4 В)H2SO3 Г)HCIO4 Д)CH3COOH Е)HCN
Слабыми кислотами являются
1)ВГД 2)АДЕ 3)АБД 4)БГЕ
6.Только кислоты расположены в ряду
1)HNO3, Ca(NO3)2, NO2
2) KHCO3, Ba(HSO4)2, ZnOHCI
3) HNO2, HNO3, CH3COOH
4) H2S, Na2SO3, SO2
7. Оксиды
металлов со степенью окисления +6 и выше
являя\ются
Оксиды
металлов со степенью окисления +6 и выше
являя\ются
1) несолеобразующими 2) основными 3) амфотерными 4) кислотными
8.Амфотерным и основным оксидами соответственно являются
1) P2O5, Li2O 2) AI2O3,SrO 3) NO2, N2O 4) CrO, ZnO
9.Кислотой и двойной солью соответственно являются
1) HNO3 u NH4AI(SO4)2 2) H2SO3 u CaOHCI 3) H2S u NaNO3 4) H2SO4 u KHCO3
10.Аллотропные модификации углерода отличаются
1) типом гибридизации атома углерода
2) типом химической связи между атомами
3)химическими свойствами
4) числом атомов, входящих в состав молекул
ТЕСТ 5.
1.Только кислоты расположены в ряду
1) KCI, HCI,NaOH 2) NaHCO3, H2SO3, HNO2 3) H2SO4,HI, CH3COOH 4) HCN, KH2PO4, Na2SO4
2. В перечне веществ
В перечне веществ
А) FeO Б)Rb2O В)N2O5 Г)Ag2O Д)SO3 Е)MnO3
Основными оксидами являются
1)АБГ 2) АДЕ 3) АБД 4) БГЕ
3.В перечне веществ
А) NO2 Б) N2O В)CO Г)NO Д)CrO3 Е)SiO2
Несолеобразующими оксидами являются
1)АБВ Б) АДЕ В) АБД Г)БВГ
4. В перечне веществ
А) Сr(OH)3 Б)Fe(OH)2 В)KOH Г)Ca(OH)2 Д)Ba(OH)2 Е)Fe(OH)3
Щелочами являются
1) ВГД 2) АДЕ 3) АБД 4)БГЕ
5.В перечне кислот
А) сернистая Б) хлорная В) азотистая Г) хлорноватистая Д) соляная Е) йодоводородная
Сильными кислотами являются
1) ВГД 2) АДЕ 3) БДЕ 4) БГЕ
6.В перечне веществ
А) (NH4)2HPO4 Б)Ba(OH)2 В)CuCI2 Г)[Cu(NH4)2](OH)2 Д)CaOHCI Е)CH3CONH2
Солями являются
1) АБВ 2)АБД 3)АВД 4)ВДЕ
7. Кислотой
и двойной солью соответственно являются
Кислотой
и двойной солью соответственно являются
1) HNO3 u KNaCI2 2) H2S u NaNO3 3)H2SO3 u CaOHCI 4)H2SO4 u KHCO3
8. Амфотерным и основным оксидами соответственно являются
1) ZnO, Na2O 2) SO3, CaO 3) P2O5 Na2O 4) CI2O3, ZnO
9. Кислосодержащей кислотой и щелочью соответственно являются
1) HNO3 u NH4OH 2) H2SO3 u KOH 3) H2CO3 u Cu(OH)2 4) H2SO4 u KHCO3
10. Безкислородной кислотой и кислой солью соответственно являются
1) HBr u AIOHBr2 2) H2S u Ca(HSO4)2 3) H2S u NaNO3 4) H2SO4 u KHCO3
ТЕСТ 6.
1. Только
кислотные оксиды указаны в ряду
Только
кислотные оксиды указаны в ряду
1) ZnO, CO2, N2O 2) CO, SiO2, SnO2 3)CrO3, N2O3,SiO2 4) N2O5, P2O3, Cs2O
2. К основным гидроксидам относится каждое из двух веществ.
1) Fe(OH)3 u Cu(OH)2 2) Fe(OH)3 u Cr(OH)2 3) Fe(OH)2 u Ca(OH)2 4) Fe(OH)2 u Cr(OH)3
3. Какие из приведенных утверждений верны?
А.Основным оксидам соответствуют основания
Б. Основные оксиды образуют только металлы
1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны
4.В перечне веществ
А) Cr(OH)3 Б) Zn(OH)2 B) KOH Г)Ca(OH)2 Д) Ba(OH)2 Е)Fe(OH)3
Амфотерными гидроксидами являются
1) ВГД 2) АБЕ 3) АБД 4)БГЕ
5. В
перечне кислот
В
перечне кислот
А) сернистая Б) кремниевая В) фтороводородная Г) азотная
Сильными кислотами не являются
1) АБВ 2)АДЕ 3)АБД 4) БГЕ
6.Какие из приведенных утверждений верны?
А.Кислотным оксидам соответствуют кислоты.
Б. Кислотные оксиды образуют только неметаллы
1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны
7.Формулы только основных солей указаны в ряду
1) (CuOH)2SO4 , KHCO3, Na2CrO7
2) CuCI2, NaHSO4, (AIOH)CI2
3) Ca(HCO3)2, ZnS, (FeOH)CI
4) (FeOH)NO3, (CuOH)2CO3, MgOHCI
8.Амфотерным и кислотными оксидами соответственно являются
1) ZnO, BaO 2) AI2O3,SO3 3) AI2O3, Na2O 4) Cr2O3,ZnO
9. Кислосодержащей
кислотой и щелочью соответственно
являются
Кислосодержащей
кислотой и щелочью соответственно
являются
1) HNO3 u Fe(OH)2 2) (HO)2 SO2 u AI(OH)3 3) HOCI u KOH 4) H2SO4 u KHCO3
10. В перечне кислот
А) HNO2 Б)HCOOH В)HCIO3 Г)HI Д) HNO3 Е) H2SO3
Сильными кислотами являются
1) ВГД 2) АДЕ 3)АБД 4)БГЕ
ТЕСТ 7.
1.В перечне кислот
А) H2SO3 Б)H2SiO3 В)HF Г) HNO3 Д)HCIO3 Е) HI
Сильными кислотами не являются
1) АБВ 2)АДЕ 3) АБД 4)БГЕ
2.Только соли расположены в ряду
1) HCOONa, C2H5NH2, Na2SiO3
2) K2CO3, HCOOH, K2SiO3
3) CaBr, AI(OH)2CI, NaI
4) H2SO3, Ba(HSO4)2, LiHS
3. Какие из приведенных утверждений
верны?
Какие из приведенных утверждений
верны?
А.Основным оксидам соответствуют основания Б.Основные оксиды образуют металлы и неметаллы.
1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны
4.основным оксидом и основной солью являются
1) FeO u FeSO4 2) CaO u CaCI2 3) BaO u Ba(NO3)2 4) CaO u (CuOH)2CO3
5.Только соли расположены в ряду
1) СH3COOC2H5, C2H5NH3• CI, C6H5ONa
2) NH2CH2COONa, CH3COH, CH3OH,
3) C2H5COONa, (HCOO)2Ca, C6H5ONa
4) CH3COOK, C6H3(OH)3, (CH3)2NH
6. Кислотным и основными оксидами соответственно являются
1) СO2 u K2O 2)SO3 u AI2O3 3) ZnO u Fe2O3 4) CaO u BaO
7. Основанием и кислой солью соответственно
являются
Основанием и кислой солью соответственно
являются
1) HNO3 u NH4AI(SO4)2 2) H2SO3 u CaOHCI 3) H2S u NaNO3 4) KOH u K2HPO4
8. Средней и основной солями соответственно являются
1) КNO3 u NH4CI 2) (NH4)2S u K[AI(OH)4 3) K2 4) MnSO4 u KHCO3
9.Основанием и комплексной солью соответственно являются
1) Сa(OH)2 u KAI(SO4)2 2) CuOHCI u Na[ AI(OH)4] 3) KOH u K4[Fe (CN)6]
4) NH4CI u NH4OH
10. Только кислотные оксиды указаны в ряду
1)BeO, CO2, N2O 2) CO, SiO2, SO2 3) Mn2O7, P2O3, SiO2 4) N2O5, P2O3, Cs2O
ТЕСТ
8.
1. Из перечисленных ниже веществ:
А) Бутаналь Б) глицерин В) метилформиат Г) фенол Д) этилпропианат Е) метаналь
Альдегидами являются
1) ГЕ 2)ВД 3)АЕ 4)БВ
2.Из перечисленных ниже веществ
А) анилин Б) глицерин В) глицин Г) гуанин Д) аланин Е) стеарин
Аминокислотами являются
1)ГЕ 2)ВД 3)АЕ 4)БВ
3. Из перечисленных ниже веществ
А) бензол Б) гегсин в) циклогексан Г) дивинил Д) пентан Е) пентен
4.Из перечисленных ниже веществ
А) изопропен Б) пропилен В) циклопентан Г) стирол Д) циклогексан
Е) ксилол
Общую формулу CnH2n—2n имеют
1)АВ 2)ВЕ 3)АД 4)БВ
5.Из перечисленных ниже соединений:
А) рибоза Б) манноза В) лактоза Г) Глюкоза Д) целлюлоза Е) гликоген
6.Из перечисленных соединений предельным двухатомным спиртом является
1) пропанол-2 2) этилбензол 3) метилэтаноат 4) 1,2-этандиол
7. Из перечисленных соединений
альдегидом является
Из перечисленных соединений
альдегидом является
1) этаналь 2) метилэтаноат 3) этилацетат 4) диметиламин
8.Этиленгликоль и 1,2- пропандиол являются
1) структурными изомерами 2) одним и тем же веществом 3) геометрическими изомерами 4) гомологами
9.2,2 – диметилпропан и пентан являются
1) структурными изомерами 2) одним и тем же веществом 3) геометрическими изомерами 4) гомологами
10.Название вещества CH3 –C(CH3)2 – COOH по систематической номенклатуре
1) 2,2 – диметилпропановая кислота 2) 2- метилпропановая кислота 3) бутановая кислота 4) 2,2 диметилпропаналь
ТЕСТ 9
1.из перечисленных ниже веществ:
А) Бутанон Б) глицерин В) бутилформиат г) фенол д) этилацетат е) метаналь
Сложными эфирами являются
1) ГЕ 2) ВД 3)АЕ 4)БВ
2.Из перечисленных ниже веществ:
А) нитроглицерин Б) глицерин В) нитробензол Г) толуидин Д) аланин Е)нитрометан
Нитросоединениями являются
1) АВ 2)АГ 3)ВЕ 4) БВ
2. Из перечисленных ниже веществ:
Из перечисленных ниже веществ:
А) нитроглицерин Б) глицерин В) нитробензол Г) толуидин Д) аланин Е) нитрометан
Нитросоединениями являются
1)АВ 2)АГ 3)ВЕ 4) ВД
3.Из перечисленных ниже веществ:
А) бензол Б) гексин В) циклогексан Г) дивинил Д) пентан Е)пентен
Общую формулу CnH2n-2 имеют
1)АВ 2)ВЕ 3)АД 4)БГ
4.Из перечисленных ниже веществ
А) толуол Б) фенол В) циклопентанол Г) стирол Д) циклогексен Е) ксилол
Общую формулу CnH2n-6 имеют
1) АВ 2) ВЕ 3) АД 4) БВ
5.Алканами являются все соединения в ряду
1) C3H8, CH4, C5H12
2) C2H5CH3, C2H4, C5H8
3) CH3CH3, C2H5NH2, (C2H5)3CH
4) C3H8,(CH3)2CHNO2, (C2H5)2CH2
6. Из перечисленных соединений
предельным двухатомным спиртом является
Из перечисленных соединений
предельным двухатомным спиртом является
1) бутанол-2 2) пропиленгликоль 3) этилэтаноат 4) этилбензол
7.Из перечисленных соединений предельным двухатомным спиртом является
1) пропанол-2 2) 1,2 – этандиол 3) бутилацетат 4) ксилол
8. Бутановая и метановые кислоты являются
1) структурными изомерами 2) одним и тем же веществом 3) геометрическими изомерами 4) гомологами
9. 2,3- диметилбутан и гексан являются
1) структурными изомерами 2) одним и тем же веществом 3) геометрическими изомерами 4) гомологами
10. Название вещества CH3-CH2-C(CH3)H- C (C2H5)H по систематической номенклатуре
1) 3-метил-2-этилпентанол-1 2) 2-этил-3-метилпентанол 3) 3-метил-2-этилпентанол-2 4) 3-метил-4-этилпентанол-5
ТЕСТ 10
1.Из перечисленных ниже веществ:
А) СH3OCH3 Б)CH3COCH3 В)C6H5NO2 Г)C3H5(ONO2)3 Д)CH3CH2COOCH3 Е) СH3CH2CHO
Сложными эфирами являются
1)ГД 2)ВД 3)АЕ 4)БВ
2) Из перечисленных ниже веществ:
А) триолеин Б) глицерин В) тринитроглицерин Г) анилин Д) тристеарин Е) формалин
Жирами являются
1)АВ 2)ВЕ 3)АД 4)БВ
3. Из перечисленных ниже веществ:
Из перечисленных ниже веществ:
А) изопрен Б) пропилен В)циклопентан Г)стирол Д) циклогексен Е) ксилол
Общую формулу CnH2n имеют
1) АВ 2)ВЕ 3)АД 4)БВ
4.Аминами являются все соединения в ряду
1) C3H7COONO2, CH3NH2, HCOONa
2) C2H5OCH3, CH3OC2H5, C5H11OH
3) CH3NHC6H5, CH3NH2, (C6H5)2NCH3
4) CH3NH3CI, (CH3)2NH, (C2H5)2NH2Br
5.Из перечисленных ниже веществ
А) пропилен Б) трипинолеин В) полиэтилен Г) бутен Д) ацетилен Е) аллен
Алкенами являются
1) АЕ 2) ВД 3) АГ 4)БЕ
6. Из перечисленных соединений предельным одноатомным спиртом является
1) бутанол-2 2) этилэтаноат 3) 1,2-пропандиол 4) этилбензол
7. Циклогексан и гексен-2 являются
Циклогексан и гексен-2 являются
1) структурными изомерами 2) одним и тем же веществом 3) геометрическими изомерами 4) гомологами
8.Этилацетата и этиловый эфир уксусной кислоты являются
1) структурными изомерами 2) одним и тем же веществом 3) геометрическими изомерами 4) гомологами
9.орто-Ксилол и 1,2 диметилбензол являются
1) структурными изомерами 2) геометрическими изомерами 3) одним и тем же веществом 4) гомологами
10. Соединения, в состав которых входит функциональная группа -NH2, относятся к классу
1) аминов 2) карбоновых кислот 3) альдегидов 4) нитросоединений
№7. Общая характеристика металлов главных подгрупп I-III групп в связи с положением в периодической системе химических элементов Д.И. Менделеева особенностями строения их атомов.
Тест 1.
1.Наиболее легко отдают электроны атомы
1) магния 2) кальция 3) стронция 4) бария
2. При
взаимодействии железа с горячей
концентрированной кислотой образуются
При
взаимодействии железа с горячей
концентрированной кислотой образуются
1) Fe2(SO4)3 u H2 2) Fe2(SO4)3 u SO2 3) FeSO4 u H2 4) FeSO4 u SO2
3.В порядке уменьшения восстановительных свойств металлы расположены в ряду
1) AI, Zn, Ni 2) AI, Na, K 3) Ni, Zn, Mg 4) Ni, Zn, AI
4.Верны ли следующие суждения о щелочных металлах?
А.Щелочные металлы проявляют степень окисления +1
Б.С неметаллами образуют немолекулярные соединения
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
5.В возбужденном состоянии алюминий имеет электронную конфигурацию
1)…3s13p2 2)…3s23p1 3)…3s23p2 4) …3s13p2
Тест 2
1.Железо реагирует к каждым из набора веществ:
1) азот и хлорид магния
2) углерод и соляная кислота
3) водород и гидроксид натрия
4) аргон и разбавленная серная кислота
2. при
взаимодействии железа с соляной кислотой
образуются
при
взаимодействии железа с соляной кислотой
образуются
1) FeCI3 u H2 2) FeCI2 u H2O 3) FeCI3 u H2O 4) FeCI2 u H2
3. В порядке уменьшения восстановительных свойств металлов расположены в ряду
1) Li, Zn, Mg 2) AI, Na, Li 3) Na, AI, Cr 4)Cr, Li, AI
4. Верны ли следующие суждения о щелочных металлах?
А.Щелочные металлы проявляют не только восстановительные свойства
Б.Их гидроксиды являются сильным основаниями
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
5.Степень окисления +3 железо проявляет за счет расположенных на
1) 4s u 3d — подуровнях 2) 4s u 3p-подуровнях 3) 4s u 4p подуровнях 4) 4s u 3s- подуровнях
Тест 3
1.Наиболее легко отдают электроны атомы
1) рубидия 2) кальция 3) стронция 4)цезия
2.Верны ли следующие утверждения о гидроксиде цинка?
А. Гидроксид цинка проявляет только
кислотные свойства.
Гидроксид цинка проявляет только
кислотные свойства.
Б.Гидроксид цинка проявляет только основные свойства
1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны
3.В порядке уменьшения восстановительных свойств металлы расположены в ряду
1) Zn, Cr, AI 2) AI, Cr, Zn 3) Na, Zn, CO 4) Cr, Zn, AI
4. Верны ли следующие суждения о щелочных металлах?
А.При взаимодействии с кислородом преимущественно образуют пероксиды
Б.Их гидроксиды являются щелочами
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
5. Наиболее устойчивыми степенями окисления хрома являются
1) +1, +2 2) +2, +6 3) +3, +6 4) +4,+6
Тест 4
1.Медь реагирует с каждым из набора веществ:
1) азот и хлорид меди 2) кислород и азотная 3) водород и гидроксид натрия 4) аргон и разбавленная серная кислота
2. Алюминий
реагирует с каждым из набора веществ:
Алюминий
реагирует с каждым из набора веществ:
1) азот и хлорид натрия 2) кислород и концентрированная азотная кислота (о.у) 3) соляная кислота и гидроксид натрия 4) аргон и нашатырь
3.Верны ли следующие суждения о меди?
А.Для меди характерны степени окисления +1 и 2
Б. Медь растворяется в разбавленном водном растворе азотной кислоты.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
4.При взаимодействии железа с горячей концентрированной азотной кислотой образуются
1) Fe(NO3)3 u NH4NO3 2) Fe(NO3)3 u NO2 3) Fe(NO3)2 u NO 4) Fe(NO3)2 u NO2
5.При взаимодействии хрома с соляной кислотой образуются
1) CrCI3 u H2 2) CrCI2 u H2O 3) CrCI3 u H2O 4) CrCI2 u H2
ТЕСТ 5
1. Наиболее
легко отдают электроны атомы
Наиболее
легко отдают электроны атомы
1) олова 2) индия 3) алюминия 4) сурьмы
2. Верны ли следующие утверждения об оксиде хрома (6)?
А. Оксид хрома (6) является кислотным оксидом
Б. Оксид хрома (6) является основным оксидом
1) верно только А 2)верно только Б 3) верны оба утверждения 4) оба утверждения неверны
3.В порядке уменьшения восстановительных свойств расположены в ряду
1) Mg, Zn, Au 2) AI, Fe, Zn 3) Na, Zn, Mg 4) Ni, AI, Zn
4. Верны ли следующие суждения о щелочных металлах?
А.Проявляет восстановительные и окислительные свойства.
Б.Их соли не подвергаются гидролизу по катиону.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
5.Наиболее устойчивой степенью окисления меди являются
1) +1 2) +2 3) +3 4)+4
ТЕСТ 6
1.Цинк реагирует с каждым из набора веществ:
1) азот и хлорид натрия 2) кислород и оксид магния 3) соляная кислота и гидроксид натрия 4) аргон и нашатырь
2. Верны
ли следующие утверждения об оксиде
цинка?
Верны
ли следующие утверждения об оксиде
цинка?
А. Оксид цинка является несолеобразующим оксидом
Б. Оксид цинка является амфотерным оксидом
1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны
3.В порядке уменьшения восстановительных свойств металлы расположены в ряду
1) AI, Zn, Ni 2) AI, Na, K 3) Ni, Zn, Mg 4) Ni,Zn, AI
4. Амфотерный гидроксид не образует
1) алюминий 2) железо 3) медь 4) хром
5.Верны ли следующие суждения о металлах 2 а группы?
А.Проявляют степень окисления +2
Б.С неметаллами образуют ионные соединения
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
ТЕСТ 7
1.Наиболее легко отдают электроны атомы
1) магния 2) кальция 3) натрия 4) лития
2.Верны ли следующие утверждения о гидроксиде магния?
А. Гидроксид магния проявляет кислотные свойства
Б. Гидроксид магния проявляет основные
свойства
Гидроксид магния проявляет основные
свойства
1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны
3.В порядке увеличения восстановительных свойств металлы расположены в ряду
1) Li, Zn, Mg 2) AI, Ca, Na 3) Na, AI, Cr 4) Cr, Li, AI
4.Амфотерный гидроксид образует
1) натрий 2) магний 3) калий 4) бериллий
5.Верны ли следующие суждения 2 а группы
А.Катионы металлов проявляют только окислительные свойства
Б. Их соли не подвергаются гидролизу по катиону.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
ТЕСТ 8
1.Медь не взаимодействует с
1) разбавленной серной кислотой 2) концентрированной азотной кислотой 3) концентрированной серной кислотой 4) разбавленной азотной кислотой
2.Верны ли следующие утверждения о гидроксиде хрома (3)?
А.Гидроксид хрома (3) проявляет только кислотные свойства
Б. Гидроксид хрома (3) проявляет как основные,
так и кислотные свойства
Гидроксид хрома (3) проявляет как основные,
так и кислотные свойства
1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны
3.Гидроксид железа (3) образуется при действии растворов щелочей на
1) оксид железа (2) 2) соли железа (2) 3) оксид железа (3) 4) соли железа (3)
4. Амфотерный гидроксид образует
1) медь 2) кальций 3) цинк 4) стронций
5.Верны ли следующие суждения о щелочных металлах?
А. Имеют на внешнем энергетическом уровне один электрон
Б.Образуют при взаимодействии с водородом ионные соединения
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
№8 Общая характеристика неметаллов главных подгрупп 4-7 групп в связи с их положением в периодической системе химических элементов Д.И.Менделеева и особенностями строения их атомов
ТЕСТ 1.
1.Верны ли следующие суждения о неметаллах?
А. Проявляют
только окислительные свойства
Проявляют
только окислительные свойства
Б. Их водородные соединения являются кислотами
1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба суждения неверны
2.Хлор является окислителем и восстановителем в реакции с
1) H2O 2) Fe 3) C2H4 4) C4H6
3. не проявляет степень окисления, равную номеру группы
1) кислород 2) сера 3) селен 4) теллур
4.Окислительные свойства элементов увеличиваются в ряду
1) азот, углерод 2) углерод, кремний 3) кислород, азот 4) хлор, фтор
5.Способность водородных соединений неметаллов образовать межмолекулярную водородную связь по периоду слева направо
5.Способность водородных соединений неметаллов образовывать межмолекулярную водородную связь по периоду слева направо
1) уменьшается 2) не изменяется 3) увеличивается 4) не проявляется
ТЕСТ 2.
1.Верны ли следующие суждения о неметаллах?
А. Проявляют
и восстановительные, и окислительные
свойства
Проявляют
и восстановительные, и окислительные
свойства
Б. Сила бескислородных кислот растет по группе сверху вниз
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
2.Азот не является окислителем в реакции с
1) H2 2) Li 3) O2 4) Ca
3. Не проявляет степень окисления, равную номеру группы
1) хлор 2) фтор 3) бром 4) йод
4.Окислительные свойства элементов увеличиваются в ряду
А) азот, фтор б) фтор, хлор в) азот,фосфор г) хлор, бром
5.Восстановительные свойства элементов увеличиваются в ряду
1) B, O, N 2) Se, O, P 3) C,O,S 4) CI, S, Se
ТЕСТ 3
1.Верны ли следующие суждения о свойствах элемента, электронная конфигурация атома которого 1s22s22p63s23p5?
А. Гидроксид, в котором этот элемент имеет высшую степень окисления, обладает ярко выраженными кислотными свойствами
Б.Степень окисления этого элемента в высшем гидроксиде +5
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
2.Кислород проявляет степени окисления
1) -2, -1, 0, +4, + 6 2) -2, -1,0 3) -2,-1, 0,+6 4) -2,-1,0,+2
3.Не проявляет высшую валентность равную номеру группы
1) теллур 2) сера 3) селен 4) кислород
4.Водородное соединение с ярко выраженными основными свойствами образует
1) кремний 2) азот 3) фтор 4) кислород
5.Способность водородных соединений неметаллов образовывать межмолекулярную водородную связь по группе сверхувниз
1) не проявляется 2) не изменяется 3) увеличивается 4) уменьшается
ТЕСТ 4
1.Фосфор является восстановителем в реакции с
1) O2 2) Li 3) Mg 4) Ca
2.Не проявляет высшую валентность, равную номеру группы
1) хлор 2) йод 3) бром 4) фтор
3.У атомов химических элементов в ряду P—S—CI увеличивается (ются)
1) радиус 2) окислительные свойства 3)восстановительные свойства 4) число неспаренных электронов в основном состоянии
4.Восстановительные свойства элементов увеличиваются в ряду.
1) F,CI,I 2) P,CI, I 3) Se, S, O 4) P,S,CI
5. Кислотные свойства кислородосодержащих кислот по периоду слева направо
1) не проявляются 2) не изменяются 3) увеличиваются 4) уменьшаются
ТЕСТ 5
1.Фосфор является окислителем в реакции с
1) O2 2) Li 3) KCIO3 4) H2SO4
2. Не проявляет высшую ковалентность, равную номеру группы
1) фосфор 2) мышьяк 3) сурьма 4) азот
3.Окислительные свойства элементов увеличиваются в ряду
1) бром, теллур 2) бром, хлор 3) сурьма 4) азот
4.Восстановительные свойства элементов увеличиваются в ряду
1) Ne , Se, S 2) CI, Br, I 3) Se, Br, I 4) CI, S,O
5. Кислотные свойства кислородосодержащих кислот по группе сверху вниз
1) уменьшаются 2) не изменяются 3) увеличиваются 4) не проявляются
ТЕСТ 6
1. Сера является окислителем в реакции с
1) Fe, H2, O2 2) Zn,H2,C 3) F2, Ca, H2 4) H2SO4(конц), HNO3, Ni
2. Окислительные свойства элементов уменьшаются в ряду
1) C,O, N 2) F, O,N 3) O, P, CI 4) CI, P, F
3. Хлор проявляет степени окисления
1) -1,0 2) -1,0,+7 3) -1,0,+1,+3,+5,+7 4) -1,+5,+7
4.Водородное соединение йода проявляет свойства
1) кислоты 2) основания 3) амфотерного соединения 4) не проявляет кислотно-основных свойств
5.С ростом степени окисления элемента сила кислородосодержащих кислот
1) уменьшается 2) не изменяется 3) увеличивается 4) не проявляется
ТЕСТ 7
1.Сера является восстановителем в реакции с
1) Fe, H2, O2 3) F2, Ca, H2
2) Zn, H2, C 4) H2SO4 (Конц ) HNO3, O2
2. Окислительные свойства элементов уменьшаются в ряду
1) I, O, N 2) F, CI, I 3) I, Te, S 4) Br, CI, N
3. Фтор проявляет степени окисления
1) -1, 0, +1, +3, +5, +7 2) -1, 0,+7 3) -1,0 4) -1, +5, +7
4.Восстановительные свойства элементов увеличиваются в ряду
1) В, C, N 2) N, O, P 3) F, O, P 4) CI, S, F
5. Водородное соединение селена проявляет свойства
1) кислоты 2) основания 3) амфотерного соединения 4) не проявляет кислотно-основных свойств
ТЕСТ 8
1.Верны ли следующие суждения о неметаллах?
А.При взаимодействии с металлами проявляют окислительные свойства.
Б. Имеют большую по сравнению с металлами электроотрицательность
1) Верно только А 2)верно только Б 3) верны оба суждения 4) оба суждения неверны
2.Вещество сера является и окислителем, и восстановителем в реакции с
1) H2SO4 2) HNO3 3) KOH 4) O2
3. Окислительные свойства элементов уменьшаются в ряду
1) Si, O, CI 2) CI, P, O 3) I, Te, S 4) Br, Se, As
4. Бром проявляет степени окисления
1) -1, 0,7 2) -1, 0, +1,+3, +5, +7 3) -1,0 4) -1,+5,+7
5.Водородные соединения фосфора проявляет свойства
1) кислоты 2) основания 3) амфотерного соединения 4) не проявляет кислотно-основных свойств
№9 Характерные химические свойства простых веществ металлов: щелочных, щелочноземельных, алюминия, переходных металлов – меди, цинка, хрома, железа. Характерные химические свойства простых веществ – неметаллов:
Тест 1.
1.Кальций взаимодействует с каждым из двух веществ:
1) вода, кислород 2) серная кислота, аргон 3) гидроксид натрия, хлор 4) оксид лития, азот
2.При взаимодействии серы с металлами образуются соединения, в которых ее степень окисления равна
1)+2 2) -2 3)+4 4)+6
3.Реакции разбавленной азотной кислоты с медью соответствует уравнение
1) 3 Сu +8HNO3=3Cu (NO3)2+2NO+4H2O
2) Cu+2HNO3=Cu (NO3)2 +H2
3) Cu +4 HNO3=Cu (NO3)2 + 2NO2+ 2H2O
4) Cu + 10 HNO3=4Cu (NO3)2+NH4NO3+3H2O
4.При взаимодействии элементов II А группы с водородом образуются гидриды общей формулы
1)ЭН4 2) ЭН 3) ЭН2 4)ЭН3
5.Хлор не взаимодействует с каждым из веществ в ряду
1) O2 , P, H2O 2) CH4, FeCI2, CO 3) NaOH, Ca, S 4) SO2, C6H6, CH3COOH
ТЕСТ 2.
1.Химическая реакция возможна между
1) Fe + K3PO4 2) Fe + CuCI2 3) Mg + NaCI 4) Ag + Cu(NO3)2
2. Хлорид меди (2) получают реакцией
1) Сu + CI2 2) Cu + NaCI 3) Cu +HCI 4) CuO + CI2
3.Элементы YА группы с кислородом образуют оксиды общей формулы
1) Э2О5, Э2О3 2) Э2О4, ЭО5 3) Э2О5, Э2О7 4) Э2 О, Э2О3
4.Пара веществ, между которыми происходит химическая реакция, это
1) серебро и сульфат калия (р-р) 2) цинк и хлорид калия (р-р) 3) магний и хлорид олова (р-р) 4) серебро и сульфат меди (р-р)
5.Непосредственно не взаимодействуют
1) углерод и сера 2) железо и углерод 3) кислород и хлор 4) литий и фтор
Тест 3
1.Натрий взаимодействует с каждым из двух веществ:
1)аммиак, неон 2) вода кислород 3) гидроксид натрия, бром 4) оксид калия, азот
2.При взаимодействии азота с активными металлами образуются соединения, в которых его степень окисления равна
1) +2 2) -3 3) +4 4) +5
3. Реакции разбавленной азотной кислоты с магнием соответствует уравнение
1) 3 Mg + 8 HNO3=3Mg (NO3)2+2NO+4H2O
2) Mg +2 HNO3=4Mg (NO3)2+N2O+5H2O
3) 4Mg+10HNO3=4Mg (NO3)2 +N2O +5 H2O
4) 4Mg + 10 HNO3=4Mg (NO3)2+NH4NO3+3H2O
4.При взаимодействии элементов I А группы с водородом образуются гидриды общей формулы
1) ЭН4 2)ЭН 3) ЭН2 4) ЭН3
5.Фосфор не взаимодействует с каждым из веществ в ряду
1) O2, CO, H2 2) KCIO3, HNO3, H2SO4 3) NaOH, Ca, O2 4) Mg, S, F2
ТЕСТ 4.
1. Химическая реакция возможна между
1) Cr +Na3PO4 2) Fe + ZnCI2 3) Na + MgCI2 4) Ag +Hg(NO3)2
2.Хлорид железа (2) получают реакцией
1) Fe+CI 2) Fe + HCIO3 3) Fe + HCI 4) FeO + CI2
3. Элементы YI группы образуют оксиды общей формулы
1) Э2О3 и ЭО3 2) ЭО3 и ЭО 3) Э2О5 и Э2О 4) ЭО2 и ЭО3
4.Реакции концентрированной серной кислоты с медью соответствует уравнение
1) Cu + 2H2SO4=CuSO4 +SO2 + 2H2O
2) Cu + H2SO4= CuSO4 + H2
3) 3Cu + 5 H2SO4= 3CuSO4 + 2 S+5H2O
4) 4Cu + 5 H2SO4= 4CuSO4 + H2S+ 4H2O
5. Непосредственно не взаимодействуют
1) углерод и кремний 2) золото и соляная кислота 3) кислород и сера 4) литий и вода
ТЕСТ 5.
1.Железо взаимодействует с каждым из двух веществ:
1) аммиак, водород 2) соляная кислота, кислород 3) гидроксид натрия, бром 4) оксид серы(6), азот
2.При взаимодействии фосфора с активными металлами образуются соединения, в которых его степень окисления равна
1) +3 2) 0 3) -3 4) +5
3.Реакции разбавленной азотной кислоты с железом соответствует уравнение преимущественно протекающей реакции
1) 3 Fe +8HNO3=3Fe(NO3)2+2NO+4H2O
2) 2 Fe + 6 HNO3 = 2Fe(NO3)3 + 3H2
3) Fe + 4HNO3=Fe(NO3)3 +NO+2H2O
4) Fe + 6HNO3=Fe(NO3)3+3 NO2 + 3H2O
4.При взаимодействии элементов YII А группы с водородом образуются водородные соединения общей формулы
1) ЭН4 2) ЭН 3) ЭН2 4) ЭН3
5.Азот взаимодействует с каждым из веществ в ряду.
1) O2, CO2, H2 2) KCIO3, HNO3, H2SO4 3) NaOH, Ca, O2 4) Mg, H2, O2
ТЕСТ 6
1.Химическая реакция возможна между
1) Сa + ZnCI2 2) Zn + CaCI2 3) Fe + LiCI 4) Pb + Zn(NO3)2
2. Хлорид железа (3) получают реакцией
1) Fe +CI2 2) Fe + HCIO3 3) Fe +HCI 4) FeO+ CI2
3/При взаимодействии элементов II A группы с кислородом образуются оксиды общей формулы
1) Э2О3 2) ЭО 3) ЭО2 4) Э2О
4.Реакции концентрированной серной кислоты с алюминием при (о.у.) соответствует уравнение
1) 2AI + 6 H2SO4= AI2(SO4)3+ 3 SO2 + 6 H2O
2) AI + H2SO4#
3) 2AI + 5 H2SO4=AI2(SO4)3 + 2S + 5 H2O
4) 2AI + 3 H2SO4= AI2(SO4)3 + 3H2
5.Непосредственно не взаимодействуют
1) углерод и вода 2) цинк и соляная кислота 3) кислород и вода 4) литий и сера
ТЕСТ 7.
1.Железо не взаимодействует с каждым из двух веществ:
1) кислород, водород
2) соляная кислота, оксид кальция
3) гидроксид натрия, никель
4) оксид серы(6), углерод
2.При взаимодействии серы с фтором образуется соединение, в котором ее степень окисления равна
1) 0 2)-2 3) +4 4) +6
3.Реакции разбавленной азотной кислоты с цинком соответствует уравнение
1) 3Zn + 8 HNO3=3Zn (NO3)2 + 2 NO+4H2O
2) 5 Zn +12 HNO3= 5 Zn (NO3)2 + N2+6H2O
3) 4Zn + 10 HNO3= 4 Zn (NO3)2 + N2O+5H2O
4) Zn +4HNO3 = Zn
(NO3)2 + 2NO2+2H2O
4.При взаимодействии элементов VI А группы с водородом образуются водородные соединения общей формулы
1)ЭН4 2) ЭН 3)ЭН2 4) ЭН3
5.Кремний не взаимодействует с каждым из веществ в ряду
1) O2, C, Ca 2) NaOH, Mg, F2 3) HCIO4, HNO3, H2SO4 4) Mg, P, O2
ТЕСТ 8.
1. Химическая реакция в растворе возможна между
1) Cu u HCI 2) AI u Mg(NO3)2 3) Fe u K3PO4 4) Zn u FeCI2
2. При сплавлении алюминия с гидроксидом натрия образуется
1) NaAIO2 2) AIH3 3) Na[AI(OH)4] 4) AI2O3
3.В результате реакции кальция с водой образуются
1) CaO u H2 2) Ca(OH)2 u H2 3) CaH2 u O2 4) Ca(OH)2 u O2
4. Реакции концентрированной серной кислоты с железом (при о.у) соответствует уравнение
1) 2Fe + 6 H2SO4=Fe2(SO4)3 + 3 SO2 + 6H2O
2) 2 Fe + 6 H2SO4=Fe2(SO4)3 + 3H2
3) 3Fe +5H2SO4= 3 FeSO4+2S+5 H2O
4) Fe + H2SO4 (КОНЦ) #
5. Верны ли следующие суждения о свойствах кислорода и серы?
А.Максимальная валентность этих элементов в соединениях равна номеру группы
Б. При взаимодействии с водородом кислород и сера проявляют окислительные свойства
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
№10 Характерные химические свойства оксидов: основных, амфотерных, кислотных.
ТЕСТ
1.
1.Оксид серы (6) не взаимодействует
с каждым из веществ в ряду:
1) N2O5, H3PO4 2) CaO, AI2O3 3) H2O, NaOH 4) H2S, K2O
2. С кислотами не реагирует
1) SiO2 2) CaO 3) FeO 4) NiO
3/ C кислотными оксидами реагируют все вещества в группе
1) СaO, Na2O, ZnO 2) Li2O,SO3, BaO 3) SrO, Fe2O3, CO2 4) SiO2, N2O5, AI2O3
4. Амфотерный оксид образуется в реакции
1) 2AI (OH)3=AI2O3+3H2O 2) NH4NO3=N2O+2H2O 3) CaCO3=CaO+CO2 4) S+O2=SO2
5.При взаимодействии с водой образует щелочь
1) Li2O 2) SO3 3) CO2 4) FeO
ТЕСТ 2.
1.Кислотные свойства оксидов увеличиваются в ряду
1) SO2, CO2, NO2 2) CI2O7, SiO2, CO2 3) CI2O7, P2O5,SO3 4) AI2O3, N2O3, N2O5
2/C основаниями не реагирует
1)SiO2 2) SO2 3) Fe2O3 4) BaO
3.Кислотный оксид образуется в реакции
1) Сa(OH)2= CaO+H2O 2) NH4NO3=N2O+2H2O 3) H2SO4=SO3+H2O 4) 2Mg+O2=2MgO
4. Основный оксид образуется в реакции
1) 2AI(OH)=AI2O3+3H2O 2) NH4NO3=N2O+2H2O 3) CaCO3=CaO+CO2 4) S+O2=SO2
5.При взаимодействии с водой образует кислоту
1)Li2O 2)SrO 3) CO2 4)FeO
ТЕСТ 3.
1.Оксид серы (6) взаимодействует с каждым из веществ в ряду
1) N2O5, H3PO4 2) H2O, NaOH 3) N2O5, AI2O3 4) H2SO4, CO
2. С кислотами не реагирует
1) SrO 2)SO3 3) Na2O 4) Fe2O3
3. С кислотными оксидами реагируют все вещества в группе
1) AI2O3, Rb2O, ZnO 2) MgO, SO3,CO 3) SO2, P2O3, CO2 4) K2O, FeO, CrO3
4.Амфотерный оксид образуется в реакции
1) Cu(OH)2=CuO+H2O 2) 2Cu(NO3)2=2 CuO+4NO2+O2
3)AI2(SO4)3=3SO3+2AI2O3
4) 4P+5O2=2P2O5
5.При взаимодействии с водой образует щелочь
1) SO2 2) P2O3 3) NO2 4) BaO
ТЕСТ 4.
1.Кислотные свойства оксидов увеличиваются в ряду
1) СO2, SO2, N2O5 2) CI2O, NO2, CO2 3) SO3, CO2, P2O5 4) P2O, SO2, N2O5
2. С основаниями не реагирует
1) SrO 2) SO3 3) N2O3 4) P2O3
3. Кислотный, оксид образуется в реакции
1) Сu(OH)2=CuO + H2O 2) NH4NO3=N2O+2H2O 3) AI2(SO4)3=3SO3+AI2O3 4) 2Zn+O2=2ZnO
4. Основной оксид, образуется в реакции
1) Сu(OH)2=CuO +H2O 2) 2Zn(NO3)2=2ZnO+4NO2+O2 3) AI2(SO4)3=3SO3 + AI2O3
4) 4P +5O2=2P2O5
5. При взаимодействии с водой образует кислоту
1) KO2 2) P2O3 3) N2O 4) CO
ТЕСТ 5.
1.Оксид кальция не взаимодействует с каждым из веществ в ряду
1) N2O5, H3PO4 2) N2O5, AI2O3 3) K2O, NaOH 4) H2SO4, K2O
2. С кислотами не реагирует
1) ZnO 2) CO 3) K2O 4) Cr2O3
3. С кислотными оксидами реагируют все вещества в группе
1)СrO, CI2O7, Bi2O3 2) MgO, BeO,CaO 3) P2O5, Cr2O3, CO2 4) N2O3, Pb2O, ZnO
4. Амфотерный оксид образуется в реакции
1) S + O2=SO2 2) (NH4)2Cr2O7=Cr2O3+N2+4H2O
3) 4Li + O2=2Li2O 4) Fe(OH)2=FeO + H2O
5. При взаимодействии с водой образует щелочь
1) Na2O 2) SO3 3) CO2 4) Fe2O3
ТЕСТ 6.
1.Основные свойства оксидов увеличиваются в ряду
1) СaO, K2O, AI2O3 2) ZnO, Na2O, Fe2O3 3) Li2O, Na2O, K2O 4) K2O, SrO, MgO
2.С основаниями не реагирует
1)AI2O3 2) K2O 3)NO2 4) P2O5
3.Кислотный оксид образуется в реакции
1)S + O2=SO2 2) 2 Na +O2=Na2O2 3) (NH4)2Cr2O7=Cr2O3+N2+4 H2O 4) 2AI(OH)3=AI2O3+3H2O
4. Основный оксид образуется в реакции
1) S + O2=SO2 2) 4Li + O2= 2Li2O 3) (NH4)2Cr2O7=Cr2O3+N2+4H2O 4) Zn(OH)2=ZnO+H2O
5. При взаимодействии с водой образует кислоту
1) Na2O 2) SO3 3)SnO2 4) Fe2O3
ТЕСТ 7.
1.Оксид алюминия не взаимодействует с каждым из веществ в ряду
1) N2O, Cu 2)N2O5, K2CO3 3) K2O, NaOH 4) H2SO4, Na2O
2. С кислотами не реагирует
1) Ag2O 2) CuO 3) SO3 4) CrO
3/C кислотными оксидами реагируют все вещества в группе
1) Сr2O3, MnO, Bi2O3 2) NO2, BeO, CaO 3) P2O5, Cr2O3, CO2 4) N2O3, Pb2O, ZnO
4.Амфотерный оксид образуется в реакции
1) 2Fe(OH)3=Fe2O3+ 3H2O 2) Na2CO3+SiO2=Na2SiO3+CO2
3) H2CO3=CO2+H2O
4) 4HNO3=2NO2+O2+H2O
5. При взаимодействии с водой образует кислоту
1) SO2 2) K2O 3) NO 4) CaO
№11. Характерные химические свойства оснований и амфотерных гидроксидов. Характерные химические свойства кислот
ТЕСТ 1.
1.При нагревании гидроксида меди (2) образуются
1) Сu u H2O 2) CuO u H2 3) CuO u H2O 4) Cu2O u H2O
2. Гидроксид кальция не взаимодействует с
1) HCI 2) CO2 3) ZnS 4) HNO3
3. Соляная кислота реагирует с каждым из двух веществ:
1) Zn u Ca(OH)2 2) KOH u CO2 3) AgNO3 u Au 4) NaOH u Ag
4. Концентрированная азотная кислота при обычных условиях взаимодействует с
1) магнием 2) гидроксидом натрия 3) железом 4) оксидом магния
5. Гидроксид алюминия реагирует с каждым из двух веществ
1) HCI u Zn 2) NO u H2S 3) KCI u NH3 4) NaOH u HCI
6. Гидроксид цинка реагирует с каждым веществом пары
1) сульфат кальция и оксид серы (6)
2) гидроксид натрия (р-р) и соляная кислота
3) вода и хлорид натрия
4) сульфат бария и гидроксид железа (3)
ТЕСТ 2
1. При нагревании гидроксида алюминия образуются
1) AI2O3 u H2O 2) AI u H2 3) AI u H2O 4) AI2O3 u H2
2.Гидроксид натрия не реагирует с
1) AI(OH)3 2)ZnO 3) H2SO4 4) Ba(OH)2
3, Гидроксид бария не взаимодействует с
1) HNO3 2) SO2 3) FeS 4) H2SO4
4. В результате реакции железа с концентрированной серной кислотой образуется
1) хлор 2) хлорид железа (2) 3) вода 4) хлорид железа (3)
5.Амфотерными являются гидроксиды в ряду
1) NH4OH, Zn(OH)2, Cr(OH)3 2) Fe(OH)3, AI(OH)3, Zn(OH)2 3) Pb(OH)2, Cr(OH)2, NH4(OH) 4) Ca(OH)2, Zn(OH)2, AI(OH)3
6. Химическая реакция невозможна между веществами
1) NaOH u HCI 2) SO2 u H2S 3) CO2 u P2O5 4) NO u CI2
ТЕСТ 3.
1.При нагревании гидроксида железа (3) образуются
1) FeO u H2O 2) Fe2O3 u H2O 3) Fe u H2O 4) Fe u H2
2. Гидроксид натрия взаимодействует с
1) SO3 2) Na2O 3) Mg(OH)2 4) N2O
3. При комнатной температуре концентрированная серная кислота реагирует с каждым из двух веществ:
1) железом и гидроксидом меди (2)
2) магнием и карбонатом калия
3) алюминием и хлоридом натрия
4) оксидом кремния и гидроксидом натрия
4.Хлороводородная (соляная кислота) реагирует с
1) Cu 2)Hg 3) Ag 4) Zn
5. Гидроксид цинка проявляет амфотерные свойства при взаимодействии с
1) HCI u CO2 2) H2SO4 u KOH 3) NaOH u CaO 4) NaOH u KCI
6. Гидроксид калия не реагирует с
1) AI(OH)3 2) ZnO 3) H2SO4 4) Mg(OH)2
ТЕСТ 4
1.При нагревании гидроксида цинка образуются
1) Zn u H2O 2) ZnO u H2 3) Zn, O2 u H2 4) ZnO u H2O
2.Химическая реакция невозможна между веществами
1) Ca(OH)2 u CO2 2) NO2 u H2S 3) CaO u Ba(OH)2 4) SiO2 u KOH
3.Фосфорная кислота не взаимодействует с
1) гидроксидом меди 2) медью 3) оксидом калия 4) гидроксидом кальция
4. Кислота образуется при растворении в воде оксида
1) P2O5 2)K2O 3)SiO2 4) N2O
5.Гидроксид хрома (3) проявляет амфотерные свойства при взаимодействии с
1) HCI u KOH 2) KOH u Na2O 3) HCI u NaCI 4) KOH u Cs2SO4
6. Со всеми перечисленными веществами H2, NaOH, H3PO4 будет реагировать
1) CO2 2) Cr2O3 3) BaO 4) NO
ТЕСТ 5
1.При нагревании гидроксида магния образуются
1) Mg u H2O 2) MgO u H2O 3) Mg u H2 4) MgO u H2
2. Раствор гидроксида натрия реагирует с каждым из веществ, указанных попарно
1)хлоридом железа (3) и углекислым газом
2) оксидом железа (2) и соляной кислотой
3) серной кислотой и карбонатом кальция
4) оксидом цинка и хлоридом калия
3. Ортофосфорная кислота может взаимодействовать с
1) HCI 2) S 3) Cu 4) CaCI2
4. Разбавленная серная кислота реагирует с каждым из двух веществ:
1) Na2SiO3 u HNO3 2) CuS u KNO2 3) Ag u Cu(OH)2 4) Fe u AI2O3
5. Гидроксид цинка проявляет амфотерные свойства при взаимодействии с
1) NaOH u Cs2SO4 2) KOH u Na2O 3) H2SO4 u KOH 4) HCI u CaCI2
6. Со всеми перечисленными веществами H2, KOH, H2SO4 будет реагировать
1) CO2 2) CrO3 3) BaO 4) NO
ТЕСТ 6
1.Гидроксид алюминия реагирует с каждым из веществ ряда
1) NaOH, H2SO4, HNO3 2) SO3, HCI, KNO3 3) K2O, H2SO4, ZnO 4) NaOH, H2SO4, CaCO3
2. При действии избытка гидроксида натрия на раствор нитрата цинка образуется
1) N
Мониторинг обученности учащихся 11 класса (профильный уровень) по теме «Строение атома»
МОНИТОРИНГ ОБУЧЕННОСТИ УЧАЩИХСЯ 11 КЛАССА
(профильный уровень) по теме «Строение атома»
Работа проводится в конце изучения данной темы. Время выполнения работы – 40 минут.
Тесты составлены согласно информации об УМК (учебниках), программах и наполняемости классов общеобразовательного учреждения.
Учебник: Габриелян О.С. и др. – Химия 11 класс. Профильный уровень — М.: Дрофа, 2007
Основные темы, по которым проверяются знания учащихся:
Состав и строение атома.
Изотопы.
Электронные конфигурации атомов.
Валентность и валентные возможности атомов.
Степень окисления.
Периодический закон и периодическая система химических элементов Д.И.Менделеева.
Периодическая система и свойства элементов.
Вычисление массы вещества или объема газа по известной массе, объему вещества, вступающего в реакцию или полученного в результате реакции.
Вычисление объемных отношений газов.
10)Вычисление массы раствора в результате реакции.
11А и 11Б класс. Количество обучающихся – ____, 3 часа в неделю.
Правильный ответ на тест группы А оценивается в 1 балл, всего 10 заданий, группы В – 2 балла, всего 3 задания, группы С – С1 – 3 балла, С2 – 2 балла, С3 – 4 балла.
Оценка «удовлетворительно» — 8 – 15 баллов
«хорошо» — 16 — 21 баллов
«отлично» — 22 – 25 баллов
Литература:
1) Доронькин В.Н., Бережная А.Г., Сажнева Т.В., Февралева В.А. – Тематические тесты для подготовки к ЕГЭ-2013. Базовый и повышенный уровень – изд: Легион, 2013
2) Доронькин В.Н., Бережная А.Г., Сажнева Т.В., Февралева В.А. – Тематические тесты для подготовки к ЕГЭ-2013. Задания высокого уровня сложности. – изд: Легион, 2013
3) Габриелян О.С., Остроумов И.Г., Введенская А.Г. – общая химия в тестах, задачах, упражнениях. 11 класс – учебное пособие для общеобразовательных учреждений. – М.: Дрофа, 2003
Номер задания
Тема
Уровень сложности
А1
Состав и строение атома
Базовый
А2
Изотопы
Базовый
А3
Электронные конфигурации атомов химических элементов
Базовый
А4
Периодическая система химических элементов
Базовый
А5
Изменение радиусов атомов в ПСХЭ
Базовый
А6
Изменение металлических и неметаллических свойств в ПСХЭ
Базовый
А7
Изменение окислительно-восстановительных свойств в ПСХЭ
Базовый
А8
Электроотрицательность
Базовый
А9
Степень окисления
Базовый
А10
Валентность и валентные возможности атомов
Базовый
В1
Степень окисления
Повышенный
В2
Валентность и степень окисления
Повышенный
В3
Вычисление массы вещества или объема газа по известной массе, объему вещества, вступающего в реакцию или полученного в результате реакции.
Повышенный
С1
Вычисление массы вещества или объема газа по известной массе, объему вещества, вступающего в реакцию или полученного в результате реакции.
повышенный
С2
Вычисление объемных отношений газов.
Повышенный
С3
Вычисление массы раствора в результате реакции.
Высокий
Вариант 1
Часть А.
При выполнении теста из предложенных ответов выберите правильный. В бланке ответов, в столбике под номером задания (А1-А10), поставьте цифру, которая соответствует номеру правильного ответа.
Сумма протонов и нейтронов в атоме 65Zn равна:
30 2) 65 3) 35 4) 40
Ядра атомов изотопов различаются числом
Протонов 3) протонов и нейтронов
Нейтронов 4) протонов и электронов
Электронную формулу 1s22s22p63s23p64s2 имеет атом элемента
Ва 2) Mg 3) Ca 4) Sr
Число энергетических слоев и число электронов во внешнем энергетическом слое атомов селена равны соответственно
4, 6 2) 3, 6 3) 4, 7 4) 3, 7
Химические элементы расположены в порядке возрастания их атомных радиусов в ряду
B, C, N 2) N, P, As 3) Na, Mg, K 4) B, Si, N
У какого элемента наиболее выражены металлические свойства
Li 2) Fe 3) Na 4) Na
Наибольшей восстановительной активностью обладает
Са 2) К 3) Al 4) Si
Наибольшую электроотрицательность имеет элемент
N 2) S 3) Br 4) O
Все элементы в каком ряду могут проявлять степени окисления -1 и +5?
Rb, Ca, Li 2) H, Si, F 3) Cl, I, Br 4) As, N, Te
Валентность III характерна для
Са 2) Р 3) О 4) Si
Часть В.
в задании В1 запишите в ответе цифры и буквы под соответствующей римской цифрой.
Для оксотрихлорида фосфора POCl3cоотнесите:
Атом: валентность: степень окисления:
I)фосфор 1) I a) – 2
II) кислород 2) II б) – 1
III) хлор 3) V в) + 5
В задании В2 запишите в ответе цифры выбранных вами ответов под соответствующими буквами.
Установите соответствие между формулой вещества и степень окисления углерода
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ
А) СН4 1) + 4
Б) НСНО 2) + 2
В) ССl4 3) 0
Г) НСООН 4) – 2
5) – 4
Ответом к заданиям B3 является число. Запишите это число
в текст работы без указания единиц измерения.
При взаимодействии с концентрированной серной кислотой 128 г меди выделяется газ объемом _______л (н.у.). (Запишите число с точностью до целых).
Часть С.
При выполнении задания С1 – С3 требуется привести полное решение. Ответы записывайте четко и разборчиво.
К раствору массой 180 г с массовой долей уксусной кислоты 20% прибавили карбонат калия. Вычислите объем (н.у.) выделившегося газа.
Сколько литров воздуха (н.у.) требуется для сжигания 89,6л водорода?
Оксид натрия массой 43,4г растворили в 300 мл воды. Вычислите массовую долю гидроксида натрия в образовавшемся растворе.
Вариант 2
Часть А.
При выполнении теста из предложенных ответов выберите правильный. В бланке ответов, в столбике под номером задания (А1-А10), поставьте цифру, которая соответствует номеру правильного ответа.
Сумма протонов, нейтронов и электронов в атоме 31Р равна
15 2) 16 3) 46 4) 31
Изотопами являются:
1) 39К и 80Kr; 2) 39K и 39Аr; 3) 40K и 40Аr; 4) 39K и 40K
3. Электронная формула 1s22s22p63s23p6 соответствует частице
1) Li+ 2) K+ 3) Cs+ 4) Na+
4. Число энергетических слоев и число электронов во внешнем энергетическом слое атома хрома равны соответственно
1) 4, 2 2) 4, 1 3) 4, 6 4) 4, 5
5. Химические элементы расположены в порядке возрастания их атомных
радиусов в ряду
K, Rb, Cs 2) Rb, Sr, In 3) Al, Na, Mg 4) O, S, Cl
6. Металлические свойства элементов в ряду Ge – As – Se – Br:
1) усиливаются 3) ослабевают
2) не изменяются 4) изменяются периодически
7. Наибольшей восстановительной активностью обладает
1) Si 2) P 3) S 4) Cl
8. Наименьшую электроотрицательность имеет элемент
1) N 2) S 3) Cl 4) O
9. Все элементы в каком ряду могут проявлять степень окисления + 5?
1) P, N, Cl 2) C, Se, F 3) O, B, I 4) Br, As, Sn
10. Верны ли следующие утверждения?
А. Высшая валентность элемента определяется номером группы.
Б. Высшая валентность элемента определяется номером периода.
1) верно только А 3) верны оба утверждения
2) верно только Б 4) оба утверждения неверны
Часть В.
в задании В1 запишите в ответе цифры и буквы под соответствующей римской цифрой.
Для оксидихлорида углерода (фосгена) СОСl2 соотнесите:
Атом: валентность: степень окисления:
I)углерод 1) I а) – 2
II) кислород 2) II б) – 1
III) хлор 3) IV в) + 4
В задании В2 запишите в ответе цифры выбранных вами ответов под соответствующими буквами.
Установите соответствие между формулой вещества и степенью окисления азота.
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ
А) NH4Cl 1) + 2
Б) NO2 2) + 3
B) NO 3) + 4
Г) Al(NO3)3 4) + 5
5) – 2
6) – 3
Ответом к заданиям B3 является число. Запишите это число
в текст работы без указания единиц измерения.
40,5 г алюминия растворили в избытке водного раствора едкого натра. Объем (н.у.) выделившегося газа равен ________л. (Запишите число с точностью до целых).
Часть С.
При выполнении задания С1 – С3 требуется привести полное решение. Ответы записывайте четко и разборчиво.
25 мл 34%-ной соляной кислоты плотностью 1,16 г/мл добавили к оксиду марганца (IV). Какой объем хлора (н.у.) выделится?
Рассчитайте объем воздуха (н.у.) необходимый для полного сжигания сероводорода объемом 8,96 л.
Железо растворили в растворе соляной кислоты объемом 400 мл (ρ=1,1 г/мл) с массовой долей хлороводорода 20%. Определите массовую долю образовавшейся соли в растворе.
Вариант 3
Часть А.
При выполнении теста из предложенных ответов выберите правильный. В бланке ответов, в столбике под номером задания (А1-А10), поставьте цифру, которая соответствует номеру правильного ответа.
Сумма протонов и нейтронов в атоме 40К равна
40 2) 39 3) 20 4) 21
Изотопами являются:
1) 16О и 17О; 2) 37Cl и 40Cа; 3) 23Na и 24Mg; 4) 39K и 80Kr
Химическому элементу соответствует высший оксид состава RO. Электронная конфигурация внешнего энергетического уровня атома этого элемента имеет вид
ns2np1 2) ns2 3) ns2np3 4) ns2np2
число электронов на внешнем энергетическом уровне атома фосфора в возбужденном состоянии равно
3 2) 5 3) 2 4) 4
Химические элементы расположены в порядке возрастания их атомных радиусов в ряду
Ga, Ce, As 2) Al, Ga, Ge 3) As, P, Ge 4) Se, As, Ge
В ряду Na – Mg – Al – Si неметаллические свойства:
Усиливаются 3) ослабевают
Не изменяются 4) изменяются периодически
Наименьшей восстановительной активностью обладает
Ca 2) K 3) Al 4) Si
Наибольшую электроотрицательность имеет элемент
Na 2) Li 3) Rb 4) K
Все элементы в каком ряду могут проявлять степени окисления – 3 и + 5?
Al, Ca, Li 2) B, Sb, Bi 3) Cl, I, Br 4) As, N, P
Валентность III характерна для
Be 2) F 3) Al 4) C
Часть В.
в задании В1 запишите в ответе цифры и буквы под соответствующей римской цифрой.
Для амида муравьиной кислоты (формамида) H – CONH2 соотнесите:
Атом: валентность: степень окисления:
I)углерод 1) I а) – 3
II) кислород 2) II б) – 2
III) азот 3) III в) + 1
4)IV г) + 2
В задании В2 запишите в ответе цифры выбранных вами ответов под соответствующими буквами.
Установите соответствие между формулой вещества и степень окисления углерода
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ
А) СН4 1) + 4
Б) НСНО 2) + 2
В) ССl4 3) 0
Г) НСООН 4) – 2
5) – 4
Ответом к заданиям B3 является число. Запишите это число
в текст работы без указания единиц измерения.
Для реакции 470 г фенола с образованием тринитрофенола потребуется 90%-ный раствор азотной кислоты массой _______г. (Запишите число с точностью до целых).
Часть С.
При выполнении задания С1 – С3 требуется привести полное решение. Ответы записывайте четко и разборчиво.
Какой объем 15%-ного раствора хлороводорода плотностью 1,075 г/мл пойдет на нейтрализацию гидроксида кальция массой 59,2 г?
Рассчитайте объем воздуха (н.у.) необходимый для окисления 5 л оксида углерода (II).
Для полного осаждения ионов железа (III) в виде Fe(OH)3 из раствора массой 100 г с массовой долей хлорида железа (III) 20% необходим раствор гидроксида натрия массой 14,77 г. Определите массовую долю хлорида натрия в растворе.
Вариант 4
Часть А.
При выполнении теста из предложенных ответов выберите правильный. В бланке ответов, в столбике под номером задания (А1-А10), поставьте цифру, которая соответствует номеру правильного ответа.
Сумма протонов и нейтронов в атоме 14С равна
14 2) 12 3) 13 4) 15
Ядра атомов изотопов различаются числом
Протонов 3) протонов и нейтронов
Нейтронов 4) протонов и электронов
Фосфид-иону соответствует электронная формула
1s22s22p63s23p6 3) 1s22s22p6
1s22s22p63s23p4 4) 1s22s22p63s23p2
У атома кальция число электронов на внешнем энергетическом уровне и заряд ядра равны соответственно
4, 20 2) 2, 20 3) 4, 40 4) 2, 40
У атома какого элемента радиус атома наибольший?
Кремния 2) германия 3) олова 4) свинца
У какого элемента наиболее выражены металлические свойства?
K 2) Rb 3) Cs 4) Sr
Наибольшей восстановительной активностью обладает
Br 2) As 3) Ga 4) Ge
Среди элементов IVА группы наиболее электроотрицательным является
Si 2) Ge 3) C 4) Sn
Все элементы в каком ряду могут проявлять степень окисления – 3?
Ga, Al, Be 2) C, Se, F 3) S, Br, In 4) P, N, Sb
Верны ли следующие утверждения?
А. высшая валентность элемента определяется числом неспаренных электронов в возбужденном состоянии и способностью элемента образовывать связь по донорно-акцепторному механизму.
Б. высшая валентность элемента определяется числом неспаренных электронов.
1) верно только А 3) верны оба утверждения
2) верно только Б 4) оба утверждения неверны
Часть В.
в задании В1 запишите в ответе цифры и буквы под соответствующей римской цифрой.
Для оксотрихлорида фосфора POCl3cоотнесите:
Атом: валентность: степень окисления:
I)фосфор 1) I a) – 2
II) кислород 2) II б) – 1
III) хлор 3) V в) + 5
В задании В2 запишите в ответе цифры выбранных вами ответов под соответствующими буквами.
Установите соответствие между формулой вещества и степень окисления азота.
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ
А) HNO3 1) + 2
Б) N2O4 2) + 3
B) (NH4)2CO3 3) + 4
Г) KNO2 4) + 5
5) – 2
6) – 3
Ответом к заданиям B3 является число. Запишите это число
в текст работы без указания единиц измерения.
Объем хлороводорода (н.у.), необходимый для получения 17,7 г хлоропрена при взаимодействии с винилацетиленом, равен _____л. (Запишите число с точностью до десятых).
Часть С.
При выполнении задания С1 – С3 требуется привести полное решение. Ответы записывайте четко и разборчиво.
Оксид меди (II) обработали 80 мл 5%-ного раствора серной кислоты (ρ=1,03 г/мл). определите массу полученной соли.
Какой объем воздуха необходим для окисления оксида серы (IV) объемом 6,72 л?
Для полного растворения оксида меди (II) количеством вещества 2,5 моль использован раствор серной кислоты массой 500 г. Определите массовую долю сульфата меди (II) в полученном растворе.
Вариант 5
Часть А.
При выполнении теста из предложенных ответов выберите правильный. В бланке ответов, в столбике под номером задания (А1-А10), поставьте цифру, которая соответствует номеру правильного ответа.
Число электронов в атоме аргона равно числу электронов в ионе
Р3- 2) Si4+ 3) Mg2+ 4) F—
Изотопами являются:
1) 39К и 80Kr; 2) 39K и 39Аr; 3) 40K и 40Аr; 4) 39K и 40K
Химическому элементу соответствует оксид состава R2О3. Электронная конфигурация внешнего энергетического уровня атома этого элемента имеет вид
ns2np1 2) ns2 3) ns2np3 4) ns2np2
какую электронную конфигурацию имеет атом наиболее активного металла?
…4s24p2 2) …4s1 3) …5s1 4) …5s25p2
Химические элементы расположены в порядке возрастания их атомных радиусов в ряду
Zn, Cd, Ca 2) Br, Cl, F 3) In, Sn, Sb 4) Br, Se, As
В ряду Mg → Si → P → S
Увеличивается число энергетических уровней в атомах
Усиливаются металлические свойства элементов
Уменьшается высшая степень окисления элементов
Ослабевают металлические свойства элементов
В ряду оксидов SiO2 – P2O5 – SO3 – Cl2O7 кислотные свойства
Возрастают 3) не изменяются
Убывают 4) сначала уменьшаются, потом увеличиваются
В ряду В – Al – As – Sr электроотрицательность
Возрастает 3) не изменяется
Уменьшается 4) изменяется периодически
Наибольшую степень окисления железо проявляет в соединении
K4[Fe(CN)6] 2) K3[Fe(CN)6] 3) FeO 4) Fe(OH)2
Валентность III характерна для
О 2) In 3) Mg 4) Se
Часть В.
в задании В1 запишите в ответе цифры и буквы под соответствующей римской цифрой.
Для оксидихлорида углерода (фосгена) СОСl2 соотнесите:
Атом: валентность: степень окисления:
I)углерод 1) I а) – 2
II) кислород 2) II б) – 1
III) хлор 3) IV в) + 4
В задании В2 запишите в ответе цифры выбранных вами ответов под соответствующими буквами.
Установите соответствие между формулой вещества и степень окисления
железа.
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ
А) Fe2O3 1) + 6
Б) NaFeO2 2) + 3
B) K2FeO4 3) + 4
Г) K4[Fe(CN)6] 4) + 2
5) 0
6) – 2
Ответом к заданиям B3 является число. Запишите это число
в текст работы без указания единиц измерения.
Масса бромной воды, массовая доля брома в которой 2%, необходимая для взаимодействия с 1,12 л бутена, равна _____г. (Запишите число с точностью до целых).
Часть С.
При выполнении задания С1 – С3 требуется привести полное решение. Ответы записывайте четко и разборчиво.
Определите объем метана (н.у.), который может быть получен из 18 г карбида алюминия, содержащего 20% примесей.
Рассчитайте объем воздуха (н.у.) необходимый для сжигания 15 л ацетилена.
Определите объем серного газа, который необходимо растворить в воде объемом 300 мл для получения раствора с массовой долей серной кислоты 20%.
Вариант 6
Часть А.
При выполнении теста из предложенных ответов выберите правильный. В бланке ответов, в столбике под номером задания (А1-А10), поставьте цифру, которая соответствует номеру правильного ответа.
Сумма протонов, нейтронов и электронов в атоме 12С равна
14 2) 18 3) 6 4) 12
Электронные конфигурации двух изотопов:
Одинаковы
Различны
Могут быть одинаковы или различны в зависимости от элемента
Отличаются на определенное число электронов
Химический элемент, формула высшего оксида которого R2О7, имеет электронную конфигурацию атома:
1s22s22p63s1 3) 1s22s22p63s23p64s1
1s22s22p63s23p5 4) 1s22s22p3
Число энергетических слоев и число электронов во внешнем энергетическом слое атома мышьяка равны соответственно
4, 6 2) 2, 5 3) 3, 7 4) 4, 5
У какого из элементов радиус атома минимальный
Mg 2) Na 3) Si 4) Al
Наиболее ярко выражены металлические свойства у элемента:
Калия 2) кальция 3) магния 4) натрия
Наиболее сильно выражены окислительные свойства у элемента:
Германия 2) селена 3) брома 4) мышьяка
У атома какого элемента электроотрицательность наибольшая?
Кремния 2) олова 3) германия 4) свинца
Все элементы в каком ряду могут проявлять степени окисления – 2 и + 6?
Tl, Ca, Sn 2) S, Se, Te 3) Si, Sb, Te 4) C, O, P
Максимальная валентность атома серы в возбужденном состоянии равна:
2 2) 4 3) 5 4) 6
Часть В.
в задании В1 запишите в ответе цифры и буквы под соответствующей римской цифрой.
Для амида муравьиной кислоты (формамида) H – CONH2 соотнесите:
Атом: валентность: степень окисления:
I)углерод 1) I а) – 3
II) кислород 2) II б) – 2
III) азот 3) III в) + 1
4)IV г) + 2
В задании В2 запишите в ответе цифры выбранных вами ответов под соответствующими буквами.
Установите соответствие между формулой вещества и степень окисления углерода
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ
А) СН4 1) + 4
Б) НСНО 2) + 2
В) ССl4 3) 0
Г) НСООН 4) – 2
5) – 4
Ответом к заданиям B3 является число. Запишите это число
в текст работы без указания единиц измерения.
Найдите массу осадка, выделяющегося при пропускании 448 л углекислого газа (н.у.) через избыток раствора известкового молока. Ответ____кг. (Запишите число с точностью до целых).
Часть С.
При выполнении задания С1 – С3 требуется привести полное решение. Ответы записывайте четко и разборчиво.
Определите массу фенолята натрия, который образуется при взаимодействии избытка фенола с 50 г 12%-ного раствора гидроксида натрия.
Рассчитайте объем воздуха, необходимый для сжигания 30 л оксида азота (II).
В воде объемом 500 мл растворили металлический натрий массой 34,5 г. Определите массовую долю гидроксида натрия в растворе.
Вариант 7
Часть А.
При выполнении теста из предложенных ответов выберите правильный. В бланке ответов, в столбике под номером задания (А1-А10), поставьте цифру, которая соответствует номеру правильного ответа.
Сумма протонов и нейтронов в атоме 24Mg равна
24 2) 12 3) 30 4) 17
Ядра атомов изотопов различаются числом
Протонов 3) протонов и нейтронов
Нейтронов 4) протонов и электронов
Электронная формула атома химического элемента 1s22s22p63s23p64s23d3. Этот элемент называется:
Ванадий 2) скандий 3) галлий 4) мышьяк
Из данных элементов минимальный радиус атома имеет:
Бор 2) углерод 3) кремний 4) азот
Химические элементы расположены в порядке уменьшения их атомных радиусов в ряду
Ba, Cd, Ra 2) In, Pb, Sb 3) Cs, Na, H 4) Br, Se, As
У какого элемента наиболее выражены металлические свойства
Бериллия 2) алюминия 3) кальция 4) стронция
В главных подгруппах периодической системы окислительная способность атомов химических элементов растет при
Увеличении числа энергетических уровней
Увеличении числа протонов в ядре
Уменьшении радиуса атомов
Увеличении числа валентных электронов
Наибольшую электроотрицательность имеет элемент
Кальций 2) мышьяк 3) селен 4) бром
Верны ли следующие утверждения?
А. каждый химический элемент имеет единственную степень окисления, равную номеру группы.
Б. количество валентных состояний и степеней окисления элемента определяется его природой и положением в периодической системе.
1) верно только А 3) верны оба утверждения
2) верно только Б 4) оба утверждения неверны
10. Валентность IV характерна для
1) Ca 2) P 3) O 4) Si
Часть В.
в задании В1 запишите в ответе цифры и буквы под соответствующей римской цифрой.
Для оксотрихлорида фосфора POCl3cоотнесите:
Атом: валентность: степень окисления:
I)фосфор 1) I a) – 2
II) кислород 2) II б) – 1
III) хлор 3) V в) + 5
В задании В2 запишите в ответе цифры выбранных вами ответов под соответствующими буквами.
Установите соответствие между формулой вещества и степенью окисления азота.
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ
А) NH4Cl 1) + 2
Б) NO2 2) + 3
B) NO 3) + 4
Г) Al(NO3)3 4) + 5
5) – 2
6) – 3
Ответом к заданиям B3 является число. Запишите это число
в текст работы без указания единиц измерения.
Кремний прокипятили в 200 г 40%-ного раствора едкого натра. Приведенный к нормальным условиям объем газообразного продукта реакции равен _____л. (Запишите число с точностью до десятых).
Часть С.
При выполнении задания С1 – С3 требуется привести полное решение. Ответы записывайте четко и разборчиво.
Какая масса йода выделится при взаимодействии 350 г раствора с массовой долей 50% с необходимым количеством хлора?
Рассчитайте объем воздуха (н.у.), необходимый для горения 20л аммиака?
В воде объемом 400 мл растворили металлический кальций массой 6 г. Определите массовую долю гидроксида кальция в растворе.
Вариант 8
Часть А.
При выполнении теста из предложенных ответов выберите правильный. В бланке ответов, в столбике под номером задания (А1-А10), поставьте цифру, которая соответствует номеру правильного ответа.
Одинаковое число протонов и нейтронов содержится в атоме
Железа-56 2) йода-126 3) кобальта-58 4) углерода-12
Изотопами являются:
1) 16О и 17О; 2) 37Cl и 40Cа; 3) 23Na и 24Mg; 4) 39K и 80Kr
Заряд ядра атома элемента + 83. Электронная конфигурация валентных электронов:
…6s26p3 2) 6s25d3 3) 6s24f3 4) 6s26p1
Число энергетических слоев и число электронов во внешнем энергетическом слое атомов цинка равны соответственно
2, 2 2) 4, 1 3) 3, 2 4) 4, 2
Химические элементы расположены в порядке увеличения их атомных радиусов в ряду
Zn, Ca, Cd 2) F, Cl, Br 3) In, Sn, Sb 4) As, Se, Br
Простые вещества расположены в порядке усиления металлических свойств в ряду
Ca, K, Al 2) Al, Ga, Sr 3) Ca, Sc, Ti 4) Cr, Mn, Fe
Основные свойства оксидов усиливаются в ряду
Na2o, MgO, Al2O3 3) Al2O3, MgO, Na2O
MgO, Al2O3, Na2O 4) Al2O3, Na2O, MgO
В каком ряду элементы расположены в порядке возрастания электроотрицательности?
C, Mg, Be 2) Ga, Al, Fe 3) Cl, Br, S 4) P, N, O
Все элементы в каком ряду могут проявлять степень окисления + 2?
Cl, S, Br 2) Ga, Al, Fe 3) C, Mg, Be 4) P, O, C
Чему равна максимальная валентность атома мышьяка?
1 2) 3 3) 5 4) 7
Часть В.
в задании В1 запишите в ответе цифры и буквы под соответствующей римской цифрой.
Для оксидихлорида углерода (фосгена) СОСl2 соотнесите:
Атом: валентность: степень окисления:
I)углерод 1) I а) – 2
II) кислород 2) II б) – 1
III) хлор 3) IV в) + 4
В задании В2 запишите в ответе цифры выбранных вами ответов под соответствующими буквами.
Установите соответствие между формулой вещества и степень окисления углерода
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ
А) СН4 1) + 4
Б) НСНО 2) + 2
В) ССl4 3) 0
Г) НСООН 4) – 2
5) – 4
Ответом к заданиям B3 является число. Запишите это число
в текст работы без указания единиц измерения.
Объем хлороводорода (н.у.), который потребуется для реакции с 186 г анилина, равен ______л. (Запишите число с точностью до десятых).
Часть С.
При выполнении задания С1 – С3 требуется привести полное решение. Ответы записывайте четко и разборчиво.
Определите массу 10%-ного раствора гидроксида натрия, который необходим для реакции с 42,3 г фенола.
Рассчитайте объем воздуха (н.у.), необходимый для каталитического окисления аммиака объемом 5 л.
Железо полностью растворили в растворе соляной кислоты объемом 400 мл (ρ= 1,1 г/мл), с массовой долей хлороводорода 15%. Определите массовую долю образовавшейся соли.
Вариант 9
Часть А.
При выполнении теста из предложенных ответов выберите правильный. В бланке ответов, в столбике под номером задания (А1-А10), поставьте цифру, которая соответствует номеру правильного ответа.
Сумма протонов и нейтронов в атоме 65Zn равна:
30 2) 65 3) 35 4) 40
Ядра атомов изотопов различаются числом
Протонов 3) протонов и нейтронов
Нейтронов 4) протонов и электронов
Электронную формулу 1s22s22p63s23p64s2 имеет атом элемента
Ва 2) Mg 3) Ca 4) Sr
Число энергетических слоев и число электронов во внешнем энергетическом слое атомов селена равны соответственно
4, 6 2) 3, 6 3) 4, 7 4) 3, 7
Химические элементы расположены в порядке возрастания их атомных радиусов в ряду
B, C, N 2) N, P, As 3) Na, Mg, K 4) B, Si, N
У какого элемента наиболее выражены металлические свойства
1)Li 2) Fe 3) Na 4) Na
Наибольшей восстановительной активностью обладает
1)Са 2) К 3) Al 4) Si
Наибольшую электроотрицательность имеет элемент
1)N 2) S 3) Br 4) O
Все элементы в каком ряду могут проявлять степени окисления -1 и +5?
1)Rb, Ca, Li 2) H, Si, F 3) Cl, I, Br 4) As, N, Te
Валентность III характерна для
1)Са 2) Р 3) О 4) Si
Часть В.
в задании В1 запишите в ответе цифры и буквы под соответствующей римской цифрой.
Для оксотрихлорида фосфора POCl3cоотнесите:
Атом: валентность: степень окисления:
I)фосфор 1) I a) – 2
II) кислород 2) II б) – 1
III) хлор 3) V в) + 5
В задании В2 запишите в ответе цифры выбранных вами ответов под соответствующими буквами.
Установите соответствие между формулой вещества и степень окисления углерода
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ
А) СН4 1) + 4
Б) НСНО 2) + 2
В) ССl4 3) 0
Г) НСООН 4) – 2
5) – 4
Ответом к заданиям B3 является число. Запишите это число
в текст работы без указания единиц измерения.
При взаимодействии с концентрированной серной кислотой 128 г меди выделяется газ объемом _______л (н.у.). (Запишите число с точностью до целых).
Часть С.
При выполнении задания С1 – С3 требуется привести полное решение. Ответы записывайте четко и разборчиво.
К раствору массой 180 г с массовой долей уксусной кислоты 20% прибавили карбонат калия. Вычислите объем (н.у.) выделившегося газа.
Сколько литров воздуха (н.у.) требуется для сжигания 89,6л водорода?
Оксид натрия массой 43,4г растворили в 300 мл воды. Вычислите массовую долю гидроксида натрия в образовавшемся растворе.
Вариант 10
Часть А.
При выполнении теста из предложенных ответов выберите правильный. В бланке ответов, в столбике под номером задания (А1-А10), поставьте цифру, которая соответствует номеру правильного ответа.
Сумма протонов, нейтронов и электронов в атоме 31Р равна
2) 16 3) 46 4) 31
2. Изотопами являются:
1) 39К и 80Kr; 2) 39K и 39Аr; 3) 40K и 40Аr; 4) 39K и 40K
3. Электронная формула 1s22s22p63s23p6 соответствует частице
1) Li+ 2) K+ 3) Cs+ 4) Na+
4. Число энергетических слоев и число электронов во внешнем энергетическом слое атома хрома равны соответственно
1) 4, 2 2) 4, 1 3) 4, 6 4) 4, 5
5. Химические элементы расположены в порядке возрастания их атомных
радиусов в ряду
K, Rb, Cs 2) Rb, Sr, In 3) Al, Na, Mg 4) O, S, Cl
6. Металлические свойства элементов в ряду Ge – As – Se – Br:
1) усиливаются 3) ослабевают
2) не изменяются 4) изменяются периодически
7. Наибольшей восстановительной активностью обладает
1) Si 2) P 3) S 4) Cl
8. Наименьшую электроотрицательность имеет элемент
1) N 2) S 3) Cl 4) O
9. Все элементы в каком ряду могут проявлять степень окисления + 5?
1) P, N, Cl 2) C, Se, F 3) O, B, I 4) Br, As, Sn
10. Верны ли следующие утверждения?
А. Высшая валентность элемента определяется номером группы.
Б. Высшая валентность элемента определяется номером периода.
1) верно только А 3) верны оба утверждения
2) верно только Б 4) оба утверждения неверны
Часть В.
в задании В1 запишите в ответе цифры и буквы под соответствующей римской цифрой.
Для оксидихлорида углерода (фосгена) СОСl2 соотнесите:
Атом: валентность: степень окисления:
I)углерод 1) I а) – 2
II) кислород 2) II б) – 1
III) хлор 3) IV в) + 4
В задании В2 запишите в ответе цифры выбранных вами ответов под соответствующими буквами.
Установите соответствие между формулой вещества и степенью окисления азота.
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ
А) NH4Cl 1) + 2
Б) NO2 2) + 3
B) NO 3) + 4
Г) Al(NO3)3 4) + 5
5) – 2
6) – 3
Ответом к заданиям B3 является число. Запишите это число
в текст работы без указания единиц измерения.
40,5 г алюминия растворили в избытке водного раствора едкого натра. Объем (н.у.) выделившегося газа равен ________л. (Запишите число с точностью до целых).
Часть С.
При выполнении задания С1 – С3 требуется привести полное решение. Ответы записывайте четко и разборчиво.
25 мл 34%-ной соляной кислоты плотностью 1,16 г/мл добавили к оксиду марганца (IV). Какой объем хлора (н.у.) выделится?
Рассчитайте объем воздуха (н.у.) необходимый для полного сжигания сероводорода объемом 8,96 л.
Железо растворили в растворе соляной кислоты объемом 400 мл (ρ=1,1 г/мл) с массовой долей хлороводорода 20%. Определите массовую долю образовавшейся соли в растворе.
Вариант 11
Часть А.
При выполнении теста из предложенных ответов выберите правильный. В бланке ответов, в столбике под номером задания (А1-А10), поставьте цифру, которая соответствует номеру правильного ответа.
Сумма протонов и нейтронов в атоме 40К равна
40 2) 39 3) 20 4) 21
Изотопами являются:
1) 16О и 17О; 2) 37Cl и 40Cа; 3) 23Na и 24Mg; 4) 39K и 80Kr
Химическому элементу соответствует высший оксид состава RO. Электронная конфигурация внешнего энергетического уровня атома этого элемента имеет вид
ns2np1 2) ns2 3) ns2np3 4) ns2np2
число электронов на внешнем энергетическом уровне атома фосфора в возбужденном состоянии равно
1)3 2) 5 3) 2 4) 4
Химические элементы расположены в порядке возрастания их атомных радиусов в ряду
1)Ga, Ce, As 2) Al, Ga, Ge 3) As, P, Ge 4) Se, As, Ge
В ряду Na – Mg – Al – Si неметаллические свойства:
Усиливаются 3) ослабевают
Не изменяются 4) изменяются периодически
Наименьшей восстановительной активностью обладает
1)Ca 2) K 3) Al 4) Si
Наибольшую электроотрицательность имеет элемент
1)Na 2) Li 3) Rb 4) K
Все элементы в каком ряду могут проявлять степени окисления – 3 и + 5?
1)Al, Ca, Li 2) B, Sb, Bi 3) Cl, I, Br 4) As, N, P
Валентность III характерна для
1)Be 2) F 3) Al 4) C
Часть В.
в задании В1 запишите в ответе цифры и буквы под соответствующей римской цифрой.
Для амида муравьиной кислоты (формамида) H – CONH2 соотнесите:
Атом: валентность: степень окисления:
I)углерод 1) I а) – 3
II) кислород 2) II б) – 2
III) азот 3) III в) + 1
4)IV г) + 2
В задании В2 запишите в ответе цифры выбранных вами ответов под соответствующими буквами.
Установите соответствие между формулой вещества и степень окисления углерода
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ
А) СН4 1) + 4
Б) НСНО 2) + 2
В) ССl4 3) 0
Г) НСООН 4) – 2
5) – 4
Ответом к заданиям B3 является число. Запишите это число
в текст работы без указания единиц измерения.
Для реакции 470 г фенола с образованием тринитрофенола потребуется 90%-ный раствор азотной кислоты массой _______г. (Запишите число с точностью до целых).
Часть С.
При выполнении задания С1 – С3 требуется привести полное решение. Ответы записывайте четко и разборчиво.
Какой объем 15%-ного раствора хлороводорода плотностью 1,075 г/мл пойдет на нейтрализацию гидроксида кальция массой 59,2 г?
Рассчитайте объем воздуха (н.у.) необходимый для окисления 5 л оксида углерода (II).
Для полного осаждения ионов железа (III) в виде Fe(OH)3 из раствора массой 100 г с массовой долей хлорида железа (III) 20% необходим раствор гидроксида натрия массой 14,77 г. Определите массовую долю хлорида натрия в растворе.
КЛЮЧИ
Часть А и В.
Номер задания
Вариант 1
Вариант 2
Вариант 3
Вариант 4
Вариант 5
Вариант 6
Вариант 7
Вариант 8
Вариант 9
Вариант 10
Вариант 11
А1
2
3
1
1
1
2
1
4
2
3
1
А2
2
4
1
2
4
1
2
1
2
4
1
А3
3
2
2
1
1
2
1
1
3
2
2
А4
1
2
2
2
3
4
4
4
1
2
2
А5
2
1
4
4
4
3
3
2
2
1
4
А6
3
3
1
2
4
1
4
2
3
3
1
А7
2
1
4
3
1
3
3
3
2
1
4
А8
4
2
2
3
2
1
4
4
4
2
2
А9
3
1
4
4
2
2
2
3
3
1
4
А10
2
1
3
1
2
4
4
3
2
1
3
В1
I3в
II2a
III1б
I3в
II2а
III1б
I4г
II2б
III3а
I3в
II2a
III1б
I3в
II2а
III1б
I4г
II2б
III3а
I3в
II2a
III1б
I3в
II2а
III1б
I3в
II2a
III1б
I3в
II2а
III1б
I4г
II2б
III3а
В2
5312
6314
5312
4362
2214
5312
6314
5312
5312
6314
5312
В3
45
50
1050
4,5
400
2
44,8
44,8
45
50
1050
Часть С.
Вариант 1.
С1. Дано: Решение:
m(p-pa CH3COOH)= 180 г 2СН3СООН + К2СО3 = 2СН3СООК + Н2О + СО2
w(CH3COOH) = 20% m(CH3COOH) = m(p-pa) * w = 180 г * 0,2 = 36 г
Найти: n(CH3COOH) = m/M = 36 г/60 г/моль = 0,6 моль
V(CO2) — ? по уравнению реакции n(CO2) = 1/2n(CH3COOH)
= 0,3 моль
V(CO2) = n*Vm = 0,3 моль * 22,4 л/моль = 6,72 л
Ответ: V(CO2) = 6,72 л
С2. Дано: Решение:
V(H2) = 89,6 л 2Н2 + О2 = 2Н2О
Найти: из закона о соотношении газообразных веществ
V(возд.) — ? V(O2) = 1/2V(H2) = 44,8 л
Cодержание кислорода в воздухе φ(О2) = 21%
V(возд.) = V(O2) / φ(O2) = 44,8 л/0,21 = 213,3 л
Ответ: V(возд.) = 213, 3 л
С3. Дано: Решение:
m(Na2O) = 43,4 г Na2O + H2O = 2NaOH
V(H2O) = 300 мл n(Na2O) = m/M = 43,4 г/62 г/моль = 0,7 моль
Найти: по уравнению реакции n(NaOH) = 2n(Na2O) =
w(NaOH) — ? = 1,4 моль
m(NaOH) = n*M = 1,4 моль * 40 г/моль = 56 г
m(p-pa) = m(Na2O) + m(H2O)
ρ(H2O) = 1 г/мл
m(H2O) = 300 г
m(p-pa) = 300 г + 43,4 г = 343,4 г
w = m(в-ва)/m(p-pa) = 56 г/343,4 г = 0,163=16,3%
Ответ: w(NaOH) = 16,3%
Вариант 2.
С1. Дано: Решение:
V(p-pa HCl) = 25 мл 4HCl + MnO2 = MnCl2 + Cl2 + 2H2O
w(HCl) = 34% m(p-pa) = V*ρ = 25 мл * 1,16 г/мл = 29 г
ρ = 1,16 г/мл m(HCl) = m(p-pa) * w(HCl) = 29 г * 0,34 = 9,66 г
Найти: n(HCl) = m/M = 9,66 г/36,5 г/моль = 0,27 моль
V(Cl2) — ? по уравнению реакции n(Cl2) = 1/4n(HCl) =
= 0,675 моль
V(Cl2) = n * Vm = 0,675 моль * 22,4 л/моль =
= 1,51 л
Ответ: V(Cl2) = 1,51 л
С2. Дано: Решение:
V(H2S) = 8,96 л 2H2S + 3O2 = 2SO2 + 2H2O
Найти: из закона о соотношении газообразных веществ
V(возд.) — ? V(O2) = 3/2V(H2S) = 13,44 л
Содержание кислорода в воздухе 21%
V(возд.) = V(O2)/φ(O2) = 13,44 л/0,21 = 64 л
Ответ: V(возд.) = 64 л
С3. Дано: Решение:
V(p-pa HCl) = 400 мл Fe + 2HCl = FeCl2 + H2
w(HCl) = 20% m(p-pa) = V * ρ = 400 мл * 1, 1 г/мл = 440 г
ρ = 1,1 г/мл m(HCl) = m(p-pa) * w(HCl) = 440 г * 0,2 = 88 г
Найти: n(HCl) = m/M = 88 г/36,5 г/моль = 2,41 моль
w(FeCl2) — ? по уравнению реакции n(FeCl2) = n(H2) =
n(Fe) = 1/2n(HCl) = 1,205 моль
m = n * M
m(Fe) = 1,205 моль * 56 г/моль = 67,48 г
m(FeCl2) = 1,205 моль * 127 г/моль = 153,035 г
m(H2) = 1,205 моль * 2 г/моль = 2,41 г
m(p-pa) = m(Fe) + m(p-pa HCl) – m(H2) =
= 67,48 г + 440 г – 2,41 г = 505,07 г
w(FeCl2) = m(FeCl2)/m(p-pa) = 153,035 г/505,07 г
= 0,303 = 30,3%
Ответ: w(FeCl2) = 30,3 %
Вариант 3.
С1. Дано: Решение:
w(HCl) = 15% 2HCl + Ca(OH)2 = CaCl2 + 2H2O
ρ = 1,075 г/мл n(Ca(OH)2) = m/M = 59,2 г/74 г/моль = 0,8 моль
m(Ca(OH)2) = 59,2 г по уравнению реакции n(HCl) = 2n(Ca(OH)2) =
Найти: = 1,6 моль
V(p-pa HCl) — ? m(HCl) = n * M = 1,6 моль * 36,5 г/моль =
= 58,4 г
m(p-pa) = m(HCl) / w(HCl) = 58,4 г/0,15 = 389,33 г
V(p-pa HCl) = m/ρ= 389,33 г/1,075 г/мл=362,17 мл
Ответ: V(p-pa HCl) = 362,17 мл
С2. Дано: Решение:
V(CO) = 5л 2СО + О2= 2CO2
Найти: из закона о соотношении газообразных веществ
V(возд.) — ? V(O2) = ½ V(CO) = 2,5 л
Содержание кислорода в воздухе 21%
V(возд.) = V(O2)/φ(O2) = 2,5 л/0,21 = 11,905 л
Ответ: V(возд.) = 11,905 л
С3. Дано: Решение:
m(p-pa FeCl3) = 100 г FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
w(FeCl3) = 20% m(FeCl3) = m(p-pa) * w = 100 г * 0,2 = 20 г
m(NaOH) = 14,77 г n(FeCl3) = m/M = 20 г/162,5 г/моль = 0,123 моль
Найти: по уравнению реакции n(Fe(OH)3) = n(FeCl3) =
w(NaCl) — ? = 0,123 моль
по уравнению реакции n(NaCl) = 3n(FeCl3) =
= 0,369 моль
m = n * M
m(Fe(OH)3) = 0,123 моль * 107 г/моль = 13,161 г
m(NaCl) = 0,369 моль * 58,5 г/моль = 21,59 г
m(p-pa) = m(p-pa FeCl3) + m(NaOH) – m(Fe(OH)3)
m(p-pa) = 100 г + 14,77 г – 13,161 г = 101,609 г
w(NaCl) = m(NaCl)/m(p-pa) = 21,59 г/101,609 г =
= 0,212 = 21,2%
Ответ: w(NaCl) = 21,2%
Вариант 4.
С1. Дано: Решение:
V(p-pa H2SO4) = 80 мл CuO + H2SO4 = CuSO4 + H2O
ρ = 1,03 г/мл m(p-pa) = V * ρ = 80 мл * 1,03 г/мл = 82,4 г
w(H2SO4) = 5% m(H2SO4) = m(p-pa) * w(H2SO4) =
Найти: = 82,4 г * 0,05 = 4,12 г
m(CuSO4) — ? n(H2SO4) = m/M = 4,12 г/98 г/моль = 0,042 моль
по уравнению реакции n(CuSO4) = n(H2SO4) =
= 0,042 моль
m(CuSO4) = n * M = 0,042 моль * 160 г/моль =
= 6,72 г
Ответ: m(CuSO4) = 6,72 г
С2. Дано: Решение:
V(SO2) = 6,72 л 2SO2 + O2 = 2SO3
Найти: по закону о соотношении газообразных веществ
V(возд.) — ? V(O2) = ½ V(SO2) = 3,36 л
Содержание кислорода в воздухе 21%
V(возд.) = V(O2)/φ(O2) = 3,36 л/0,21 = 16 л
Ответ: V(возд.) = 16 л
С3. Дано: Решение:
n(CuO) = 2,5 моль CuO + H2SO4 = CuSO4 + H2O
m(p-pa H2SO4) = 500 г m(CuO) = n * M = 2,5 моль * 80 г/моль = 200 г
Найти: по уравнению реакции n(CuSO4) = n(CuO) =
w(CuSO4) — ? = 2,5 моль
m(CuSO4) = n * M = 2,5 моль * 160 г/моль =
= 400 г
m(p-pa) = m(CuO) + m(p-pa H2SO4) = 200 г + 500 г
= 700г
w(CuSO4) = m(CuSO4)/m(p-pa) = 400 г/700 г =
= 0,5714 = 57,14%
Ответ: w(CuSO4) = 57,14%
Вариант 5.
С1. Дано: Решение:
m(Al4C3 техн.) = 18 г Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
w(примесей) = 20% w(Al4C3) = 100 – 20 = 80%
Найти: m(Al4C3) = m(Al4C3техн.) * w = 18 г * 0,8 = 14,4г
V(CH4) — ? n(Al4C3) = m/M = 14,4 г/144 г/моль = 0,1 моль
По уравнению реакции n(CH4) = 3n(Al4C3) =
= 0,3 моль
V(CH4) = Vm * n = 22,4 л/моль * 0,3 моль = 6,72 л
Ответ: V(CH4) = 6,72 л
С2. Дано: Решение:
V(C2H2) = 15 л 2С2Н2 + 5О2 = 4CO2 + 2H2O
Найти: по закону о соотношении газообразных веществ
V(возд.) — ? V(O2) = 5/2V(C2H2) = 37,5 л
Содержание кислорода в воздухе 21%
V(возд.) = V(O2)/φ(O2) = 37,5 л/0,21 = 178,57 л
Ответ: V(возд.) = 178,57 л
С3. Дано: Решение:
V(H2O) = 300 мл SO3 + H2O = H2SO4
w(H2SO4) = 20% пусть n(SO3) = x моль
Найти: по уравнению реакций n(H2SO4) = n(SO3) =
V(SO3) — ? = x моль
m = n * M
m(SO3) = 80x г; m(H2SO4) = 98x г
m(p-pa) = m(SO3) + m(H2O)
ρ(H2O) = 1 г/мл
m(H2O) = 300 г
m(p-pa) = 300 г + 80х г
w(H2SO4) = m(H2SO4)/m(p-pa)
0,2 = 98x/300+80x
x = 0,7317 моль
V(SO3) = Vm * n = 22,4 л/моль * 0,7317 моль =
= 16,39 л
Ответ: V(SO3) = 16,39 л
Вариант 6.
С1. Дано: Решение:
m(p-pa NaOH) = 50 г C6H5OH + NaOH = C6H5ONa + H2O
w(NaOH) = 12% m(NaOH) = m(p-pa NaOH) * w(NaOH) =
Найти: = 50 г * 0,12 = 6 г
m(C6H5ONa) — ? n(NaOH) = m/M = 6 г /40 г/моль = 0,15 моль
по уравнению реакций n(C6H5ONa) = n(NaOH)=
= 0,15 моль
m(C6H5ONa) = n * M = 0,15 моль * 116 г/моль =
= 17,4 г
Ответ: m(C6H5ONa) = 17,4 г
С2. Дано: Решение:
V(NO) = 30 л 2NO + O2 = 2NO2
Найти: по закону о соотношении газообразных веществ
V(возд.) — ? V(O2) = 1/2V(NO) = 15 л
Содержание кислорода в воздухе 21%
V(возд.) = V(O2)/φ(O2) = 15 л/0,21 = 71,43 л
Ответ: V(возд.) = 71,43 л
С3. Дано: Решение:
V(H2O) = 500 мл 2Na + 2H2O = 2NaOH + H2
m(Na) = 34,5 г n(Na) = m/M = 34,5 г/23 г/моль = 1,5 моль
Найти: по уравнению реакции n(NaOH) = n(Na) =
w(NaOH) — ? = 1,5 моль
n(H2) = 1/2n(Na) = 0,75 моль
m = n * M
m(NaOH) = 1,5 моль * 40 г/моль = 60 г
m(H2) = 0,75 моль * 2 г/моль = 1,5 г
w(NaOH) = m(NaOH)/m(p-pa)
m(p-pa) = m(Na) + m(H2O) – m(H2)
ρ(H2O) = 1 г/мл
m(H2O) = 500 г
m(p-pa) = 34,5 г + 500 г – 1,5 г = 533 г
w(NaOH) = 60 г/533 г = 0,1126 = 11,26%
Ответ: w(NaOH) = 11,26 %
Вариант 7.
С1. Дано: Решение:
m(p-pa KI) = 350 г 2KI + Cl2 = 2KCl + I2
w(KI) = 50% m(KI) = m(p-pa KI)*w(KI) = 350 г * 0,5 = 175 г
Найти: n(KI) = m/M = 175 г/166 г/моль = 1,054 моль
m(I2) — ? по уравнению реакции n(I2)=1/2n(KI)= 0,527 моль
m(I2) = n * M = 0,527 моль * 254 г/моль=133,858 г
Ответ: m(I2) = 133,858 г
С2. Дано: Решение:
V(NH3) = 20 л 4NH3 + 3O2 = 2N2 + 6H2O
Найти: по закону о соотношении газообразных веществ
V(возд.) — ? V(O2) = 3/4V(NH3) = 15 л
Содержание кислорода в воздухе 21%
V(возд.) = V(O2)/φ(O2) = 15 л/0,21 = 71,43 л
Ответ: V(возд.) = 71,43 л
С3. Дано: Решение:
m(Ca) = 6 г Ca + 2H2O = Ca(OH)2 + H2
V(H2O) = 400 мл n(Ca) = m/M = 6 г/40 г/моль = 0,15 моль
Найти: по уравнению реакции n(Ca(OH)2) = n(Ca) =
w(Ca(OH)2) — ? = 0,15 моль
n(H2) = n(Ca) = 0,15 моль
m = n * M
m(Ca(OH)2) = 0,15 моль * 74 г/моль = 11,1 г
m(H2) = 0,15 моль * 2 г/моль = 0,3 г
ρ(Н2О) = 1 г/мл
m(H2O) = 400 г
m(p-pa) = m(Ca) + m(H2O) – m(H2) = 6г + 400 г –
— 0,3 г = 405,7 г
w(Ca(OH)2) = m(Ca(OH)2)/m(p-pa) =
= 11,1 г/405,7 г = 0,0274 = 2,74%
Ответ: w(Ca(OH)2) = 2,74%
Вариант 8.
С1. Дано: Решение:
m(C6H5OH) = 42,3 г С6Н5ОН + NaOH = C6H5ONa + H2O
w(NaOH) = 10% n(C6H5OH) = m/M = 42,3 г/94 г/моль = 0,45 моль
Найти: по уравнению реакции n(NaOH) = n(C6H5OH) =
m(p-pa NaOH) — ? = 0,45 моль
m(NaOH) = n * M = 0,45 моль * 40 г/моль =
= 18 г
m(p-pa) = m(NaOH)/w = 18 г/0,1 = 180 г
Ответ: m(p-pa) = 180 г
С2. Дано: Решение:
V(NH3) = 5 л 4NH3 + 5O2 = 4NO + 6H2O
Найти: по закону о соотношении газообразных веществ
V(возд.) — ? V(O2) = 5/4V(NH3) = 6,25 л
Содержание кислорода в воздухе 21%
V(возд.) = V(O2)/φ(H2O) = 6,25 л/0,21 = 29,762 л
Ответ: V(возд.) = 29,762 л
С3. Дано: Решение:
V(p-pa HCl) = 400 мл Fe + 2HCl = FeCl2 + H2
ρ(p-pa HCl) = 1,1 г/мл m(p-pa HCl) = V * ρ = 400мл * 1,1 г/мл = 440 г
w(HCl) = 15% m(HCl) = m(p-pa HCl) * w(HCl) = 440 г * 0,15 =
Найти: = 66 г
w(FeCl2) — ? n(HCl) = m/M = 66 г/36,5 г/моль = 1,808 моль
по уравнению реакции n(Fe) = n(FeCl2) =
= n(H2) = 1/2n(HCl) = 0,904 моль
m = n * M
m(Fe) = 0,904 моль * 56 г/моль = 50,624 г
m(FeCl2) = 0,904 моль * 127 г/моль = 114,808 г
m(H2) = 0,904 моль * 2 г/моль = 1,808 г
m(p-pa) = m(Fe) + m(p-pa HCl) – m(H2) =
= 50,624 г + 440 г – 1,808 г = 488,816 г
w(FeCl2) = m(FeCl2)/m(p-pa) = 114,808 г/488,816г
= 0,2349 = 23,49%
Ответ: w(FeCl2) = 23,49%
Вариант 9.
С1. Дано: Решение:
m(p-pa CH3COOH)= 180 г 2СН3СООН + К2СО3 = 2СН3СООК + Н2О + СО2
w(CH3COOH) = 20% m(CH3COOH) = m(p-pa) * w = 180 г * 0,2 = 36 г
Найти: n(CH3COOH) = m/M = 36 г/60 г/моль = 0,6 моль
V(CO2) — ? по уравнению реакции n(CO2) = 1/2n(CH3COOH)
= 0,3 моль
V(CO2) = n*Vm = 0,3 моль * 22,4 л/моль = 6,72 л
Ответ: V(CO2) = 6,72 л
С2. Дано: Решение:
V(H2) = 89,6 л 2Н2 + О2 = 2Н2О
Найти: из закона о соотношении газообразных веществ
V(возд.) — ? V(O2) = 1/2V(H2) = 44,8 л
Cодержание кислорода в воздухе φ(О2) = 21%
V(возд.) = V(O2) / φ(O2) = 44,8 л/0,21 = 213,3 л
Ответ: V(возд.) = 213, 3 л
С3. Дано: Решение:
m(Na2O) = 43,4 г Na2O + H2O = 2NaOH
V(H2O) = 300 мл n(Na2O) = m/M = 43,4 г/62 г/моль = 0,7 моль
Найти: по уравнению реакции n(NaOH) = 2n(Na2O) =
w(NaOH) — ? = 1,4 моль
m(NaOH) = n*M = 1,4 моль * 40 г/моль = 56 г
m(p-pa) = m(Na2O) + m(H2O)
ρ(H2O) = 1 г/мл
m(H2O) = 300 г
m(p-pa) = 300 г + 43,4 г = 343,4 г
w = m(в-ва)/m(p-pa) = 56 г/343,4 г = 0,163=16,3%
Ответ: w(NaOH) = 16,3%
Вариант 10.
С1. Дано: Решение:
V(p-pa HCl) = 25 мл 4HCl + MnO2 = MnCl2 + Cl2 + 2H2O
w(HCl) = 34% m(p-pa) = V*ρ = 25 мл * 1,16 г/мл = 29 г
ρ = 1,16 г/мл m(HCl) = m(p-pa) * w(HCl) = 29 г * 0,34 = 9,66 г
Найти: n(HCl) = m/M = 9,66 г/36,5 г/моль = 0,27 моль
V(Cl2) — ? по уравнению реакции n(Cl2) = 1/4n(HCl) =
= 0,675 моль
V(Cl2) = n * Vm = 0,675 моль * 22,4 л/моль =
= 1,51 л
Ответ: V(Cl2) = 1,51 л
С2. Дано: Решение:
V(H2S) = 8,96 л 2H2S + 3O2 = 2SO2 + 2H2O
Найти: из закона о соотношении газообразных веществ
V(возд.) — ? V(O2) = 3/2V(H2S) = 13,44 л
Содержание кислорода в воздухе 21%
V(возд.) = V(O2)/φ(O2) = 13,44 л/0,21 = 64 л
Ответ: V(возд.) = 64 л
С3. Дано: Решение:
V(p-pa HCl) = 400 мл Fe + 2HCl = FeCl2 + H2
w(HCl) = 20% m(p-pa) = V * ρ = 400 мл * 1, 1 г/мл = 440 г
ρ = 1,1 г/мл m(HCl) = m(p-pa) * w(HCl) = 440 г * 0,2 = 88 г
Найти: n(HCl) = m/M = 88 г/36,5 г/моль = 2,41 моль
w(FeCl2) — ? по уравнению реакции n(FeCl2) = n(H2) =
n(Fe) = 1/2n(HCl) = 1,205 моль
m = n * M
m(Fe) = 1,205 моль * 56 г/моль = 67,48 г
m(FeCl2) = 1,205 моль * 127 г/моль = 153,035 г
m(H2) = 1,205 моль * 2 г/моль = 2,41 г
m(p-pa) = m(Fe) + m(p-pa HCl) – m(H2) =
= 67,48 г + 440 г – 2,41 г = 505,07 г
w(FeCl2) = m(FeCl2)/m(p-pa) = 153,035 г/505,07 г
= 0,303 = 30,3%
Ответ: w(FeCl2) = 30,3 %
Вариант 11.
С1. Дано: Решение:
w(HCl) = 15% 2HCl + Ca(OH)2 = CaCl2 + 2H2O
ρ = 1,075 г/мл n(Ca(OH)2) = m/M = 59,2 г/74 г/моль = 0,8 моль
m(Ca(OH)2) = 59,2 г по уравнению реакции n(HCl) = 2n(Ca(OH)2) =
Найти: = 1,6 моль
V(p-pa HCl) — ? m(HCl) = n * M = 1,6 моль * 36,5 г/моль =
= 58,4 г
m(p-pa) = m(HCl) / w(HCl) = 58,4 г/0,15 = 389,33 г
V(p-pa HCl) = m/ρ= 389,33 г/1,075 г/мл=362,17 мл
Ответ: V(p-pa HCl) = 362,17 мл
С2. Дано: Решение:
V(CO) = 5л 2СО + О2 = 2CO2
Найти: из закона о соотношении газообразных веществ
V(возд.) — ? V(O2) = ½ V(CO) = 2,5 л
Содержание кислорода в воздухе 21%
V(возд.) = V(O2)/φ(O2) = 2,5 л/0,21 = 11,905 л
Ответ: V(возд.) = 11,905 л
С3. Дано: Решение:
m(p-pa FeCl3) = 100 г FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
w(FeCl3) = 20% m(FeCl3) = m(p-pa) * w = 100 г * 0,2 = 20 г
m(NaOH) = 14,77 г n(FeCl3) = m/M = 20 г/162,5 г/моль = 0,123 моль
Найти: по уравнению реакции n(Fe(OH)3) = n(FeCl3) =
w(NaCl) — ? = 0,123 моль
по уравнению реакции n(NaCl) = 3n(FeCl3) =
= 0,369 моль
m = n * M
m(Fe(OH)3) = 0,123 моль * 107 г/моль = 13,161 г
m(NaCl) = 0,369 моль * 58,5 г/моль = 21,59 г
m(p-pa) = m(p-pa FeCl3) + m(NaOH) – m(Fe(OH)3)
m(p-pa) = 100 г + 14,77 г – 13,161 г = 101,609 г
w(NaCl) = m(NaCl)/m(p-pa) = 21,59 г/101,609 г =
= 0,212 = 21,2%
Ответ: w(NaCl) = 21,2%
Валентные электроны второго периода элементы
У элементов второго периода периодической системы внешняя (валентная) электронная оболочка состоит только из [c.75]Правило октета играет очень важную роль при составлении льюисовых структурных формул. Для неметаллических элементов второго периода В, С, N, О, F) исключения из этого правила крайне редки. Нетрудно объяснить, почему это так. Атомы элементов второго периода имеют устойчивые 2s- и 2р-орбитали, и магическое число 8 соответствует завершенной валентной конфигурации 2s»2p . Добавление новых электронов к такой замкнутой оболочке невозможно, потому что следующие доступные для заселения электронами атомные орбитали у элементов второго периода-это расположенные намного выше по энергии 3 -орбитали. [c.475]
На примере Н2 и р2 можно понять, что происходит во многих молекулах, где электронные пары образуют связи, в результате чего каждый атом, приобретает замкнутую электронную оболочку. Для построения замкнутой электронной оболочки атому водорода требуются два электрона, которые заполнят его валентную Ь-орбиталь. Каждому атому элемента второго периода требуется для создания замкнутой электронной оболочки восемь- электронов (восьмерка октет), потому что на 2х- и 2р-орбиталях размещается до восьми электронов (2 «2р ). Это требование получило название правила октета. В примере с молекулой 2 каждый атом Р после образования связи оказывается окруженным восемью электронами. [c.467]
Гибридизация в молекулах аммиака и воды. Мы вкратце обсудили геометрическое строение соединений бериллия, бора и углерода, пользуясь концепцией гибридизации. При дальнейшем движении по периоду вправо мы переходим к соединениям азота и кислорода, геометрия которых уже обсуждалась в рамках чистых р-орбиталей. Такое рассмотрение нельзя признать целиком удовлетворительным, если помнить, что экспериментальные значения валентных углов в молекулах HgN (107°18 ) и Н О (104°ЗГ) больше, чем между чистыми р-орбиталями (90°). С другой стороны, экспериментальные величины гораздо ближе к 109°28 — тетраэдрическому углу при sp -гибридизации связей. Так возникла идея о существовании общей для всех элементов второго периода гибридизации атомных s- и р-орбиталей. В применении к молекулам HgN и HjO это выглядит так, как показано на рис. III. 15. Октет электронов вокруг каждого центрального атома располагается на четырех sp -гибридных орбиталях, причем в моле- [c.183]
Рассмотренные примеры показывают, что атомы обладают разнообразными возможностями для образования ковалентных связей. Последние могут создаваться и за счет неспаренных электронов невозбужденного атома, и за счет неспаренных электронов, появляющихся в результате возбуждения атома ( распаривания электронных пар), и, наконец, по донорно-акцепторному способу. Тем не менее, общее число ковалентных связей, которые способен образовать данный атом, ограничено. Оно определяется общим числом валентных орбита-лей, т. е. тех орбиталей, использование которых для образования ковалентных связей оказывается энергетически выгодным. Квантовомеханический расчет показывает, что к подобным орбиталям принадлежат s- и р-орбитали внешнего электронного слоя и -орбитали предшествующего слоя в некоторых случаях, как мы видели на примерах атомов хлора и серы, в качестве валентных орбиталей могут использоваться и d-орбитали внешнего слоя. Атомы всех элементов второго периода имеют во внешнем электронном слое четыре орбитали при отсутствии (i-орбиталей в предыдущем слое. Следовательно, на валентных орбиталях этих атомов может разместиться не более восьми электронов. Это означает, что максимальная ковалентность элементов второго периода равна четырем. Атомы элементов третьего и последующих периодов могут использовать для образования ковалентных связей не только s- и р-, но также и d-орбитали. Известны соединения d-элементов, в которых в образовании ковалентных связей [c.125]
Проведенный выше обзор валентности элементов второго периода периодической системы позволяет понять причину отличия этих элемеитов от других. Особенно сильно это отличие выражено у трех элементов — азота, кислорода и фтора. Кроме особенностей,. обусловленных малым радиусом атомов и ионов, отличия данных элементов связаны также и с тем, что их внешние электроны находятся во втором слое, в котором имеются только четыре квантовые ячейки. Поэтому данные элементы не могут проявлять высокие валентности, которые известны для их аналогов. [c.83]
Льюисовыми структурами (валентаыми структурами, валентными схемами) называются графические электронные формулы молекул и комплексных ионов, где для обозначения обобществленных между атомами связьшающих электронных пар (связей) используются прямые линии (валентные штрихи), а для обозначения неподеленных пар электронов используются две точки. Для молекул и комплексных ионов, содержащих только элементы первого и второго периодов, наилучшие льюисовы структуры характеризуются тем, что в них каждый атом окружен таким же числом электронов, как атом благородного газа, ближайшего к данному элементу по периодической системе. Это означает, что атом Н должен быть окружен двумя электронами (одна электронная пара, как у Не), а атомы неметаллических элементов второго периода (В, С, К, О, Г) должны быть окружены восемью электронами (четыре электронные пары, как у 1 е). Поскольку восемь электронов образуют замкнутую конфигуращ1Ю 2х 2р , правило записи льюисовых структур требует окружать каждый атом элемента второго периода октетом (восьмеркой) электронов, и поэтому называется правилом октета. [c.501]
ПИЯХ с кислородом, следовательно, можно ожидать, что азот пятивалентен в таких соединениях, как азотная кислота ННОз и азотный ангидрид МоОд. Поскольку, однако, азот является самым типичным неметаллом среди элементов V группы и одним из наиболее характерных неметаллов вообще, связь между атомами азота и кислорода должна носить по преимуществу ковалентный характер. По теории ковалентной связи соединение атомов в. молекулы осуществляется за счет образования общих электронных пар из неспаренных электронов различных атомов. Валентность элементов равна числу неспаренных электронов у атомов соединяющихся элементов. Поскольку же максимальное число неспаренных электронов у атомов элементов второго периода не может превышать четырех, то и максимальная валентность всех элементов этого периода, включая азот, не должна быть выше четырех. [c.78]
Элементы 2-го периода периодической системы имеют только 4 валентных АО (одна 2з- и три 2р-), поэтому их максимальная ковалентность равна 4. Число валентных электронов в атомах элементов, расположенных в периоде левее углерода, меньше числа АО, а в атомах элементов, расположенных правее, наоборот, больше. Поэтому первые могут быть акцепторами, а вторые — донорами электронных пар. В своем обычном валентном состоянии атом углерода имеет 4 неспаренных электрона, что совпадает с числом валентных АО, поэтому связей по донорно-акцептор-ному механизму он не образует. [c.115]
У всех элементов, находящихся в одной и той же подгруппе периодической системы, строение внешних электронных оболочек одинаково, поэтому в свойствах таких элементов наблюдается наибольшее сходство, хотя металлические свойства в группе сверху вниз нарастают. Характер изменения свойств в группах элементов в данном случае определяется главным образом изменением радиусов атомов. Однако необходимо обратить внимание на следующее. При переходе в группе от второго к третьему периоду свойства элементов меняются настолько резко, что объяснить это одним лишь изменением радиуса атома нельзя. Например, кислород бывает только двухвалентным, а сера и все остальные элементы данной подгруппы могут иметь валентность 2, 4 и 6. Для фтора характерна исключительно одновалентность, в то время как хлор и остальные галогены могут быть 1-, 3-, 5- и 7-валентными. Такое изменение свойств при переходе от второго к третьему периоду обусловлено некоторыми особенностями структуры внешних электронных оболочек атомов элементов второго периода, с [c.62]
Говоря современным языком, с каждой из четырех сторон вокруг символа химического элемента можно ассоциировать одну из четырех орбиталей х, Р учетом количества валентных электронов атомы элементов второго периода, например, можно изобразить так [c.465]
Бериллий. В молекуле бериллия, Всг, четыре валентных электрона. Два из них спарены на связывающей молекулярной орбитали а , а два-на разрыхляющей а. Такая электронная конфигурация означает отсутствие эффективного числа связей, что согласуется с опытными данными — в отличие от устойчивых двухатомных молекул элементов второго периода молекула Вб2 не существует. [c.525]
Таким образом, второй период каждого этапа является, с одной стороны, продолжением, а с другой — повторением первого. В этом и заключается суть диалектического повторения, названного Б. М. Кедровым «повторением на новом более высоком уровне». Координатой, определяющей «высоту этого уровня и является последовательный (накопительный) рост числа протонов, нейтронов и электронов в атомах вида (химического элемента). На спиральной модели Системы химических элементов хорошо видна искусственность деления валентных групп на главную и побочную в табличном варианте. В генетически иерархической структуре естественной системы атомов нет предпосылок для этого. [c.170]
Для всех З лементов, кроме элементов подгруппы ЗВ, цинка и кадмия, характерна переменная валентность. У элементов, стоящих в первой половине периодов до подгруппы 7В включительно, максимальная валентность соответствует номеру подгруппы (все -электроны холостые). Во второй половине только для 5 элементов (Ни, Оз, 2п, Сс1 и Hg) осуществляется максимальная валентность, а для 10 элементов она не проявляется или (для элементов подгруппы меди) превышает номер подгруппы. [c.431]
Рассмотрим с этих позиций ковалентность атомов элементов второго и частично третьего периодов периодической системы. В связи с тем, что в образовании химической связи принимают участие главным образом валентные электроны, то нагляднее рассматривать электронные конфигурации только внешних электронных оболочек атомов. [c.120]
Обратимся к элементам, расположенным в периодической системе ниже второго периода. Одна из особенностей этих элементов, отличающая их от элементов второго периода, заключается в том, что у них внешние (валентные) электронные оболочки содержат больше 4 орбиталей, минимум 9 орбиталей в третьем периоде. Вспомним, что на внешней электронной оболочке любого элемента не может быть больше 8 электронов, которые у атома в основном (не возбужденном) состоянии могут занять только 4 орбитали 5 и р. Все остальные орбитали ( , / и т. д.), которые имеются на внешних оболочках атомов элементов, начиная- с третьего периода, будут вакантными. Наличием таких вакантных орбиталей можно объяснить валентности элементов, расположенных ниже второго периода. [c.75]
Первоначальная шкала электроотрицательностей Полинга была выбрана таким образом, чтобы элементам второго периода от углерода до фтора соответствовали значения от 2,5 до 4,0, изменяясь на 0,5 при переходе к каждому следующему элементу. Значения электроотрицательности элементов в этой шкале приведены на рис. 6.9 в виде диаграммы. Размеры кружков на этой диаграмме отвечают относительным радиусам атомов, а расположение элементов приблизительно воспроизводит форму таблицы периодической системы однако положения элементов в пределах периодов смещены так, чтобы соответствовать их значениям электроотрицательностей в указанной шкале. Вследствие этого элементы, принадлежащие к одной группе периодической системы, располагаются на диаграмме не по вертикальным колонкам. Со времени появления первоначальной шкалы Полинга значения энергий разрыва химических связей, на которых она была основана, в результате уточнения подверглись значительным изменениям. Результаты пересчета электроотрицательностей элементов по методу Полинга с подстановкой новых значений энергий связи представлены в табл. 6.5. Общий ход изменения электроотрицательности соответствует тому, чего и можно было ожидать для элементов одного периода или одной группы электроотрицательность возрастает при уменьшении размеров атома. Водород, который, строго говоря, не принадлежит ни к одной из групп, имеет приблизительно такую же электроотрицательность, как бор. Следует также отметить, что электроотрицательность металлов первой, второй и третьей групп возрастает при увеличении числа валентных электронов. В дальнейшем будет показано, каким образом на основании учета этих закономерностей можно судить о характере связи атомов в молекулах. [c.104]
Для того чтобы объяснить эти аномалии, необходимо сделать ряд допущений, некоторые из которых уже были введены и обоснованы ранее. Так, неподеленная пара электронов, которая занимает довольно большую диффузную орбиталь, оказывает большее отталкивающее действие на другие пары электронов, чем связываю щие пары, которые занимают более ограниченные двухцентровые орбитали (рис. 6-3). Валентный уровень атомов элементов второго периода (Т1—Не) заполнен, когда он содержит четыре пары электронов, тогда как валентный уровень атомов элементов третьего н последующих периодов может содержать и более четырех пар электронов. Когда заполненные орбитали соприкасаются, силы Паули возрастают очень быстро, так как они изменяются обратно пропорционально межэлектронному расстоянию в некоторой высокой степени . [c.225]
Рассмотрим электронные конфигурации и валентности элементов второго периода в нормальном и возбужденном состоянии (табл. 9). [c.82]
СВЯЗЬ, а какие являются неподеленными. Неподеленные электроны (либо один, либо пара) составляют часть внешней оболочки только одного атома, а электроны, участвующие в образовании ковалентной связи между двумя атомами, являются частью внешней оболочки обоих этих атомов. Атомы элементов второго периода (В, С, Ы, О, Р) могут максимально иметь восемь валентных электронов] обычно так и происходит, хотя известны случаи, когда число валентных электронов у элемента второго периода равно шести или семи. В тех случаях, когда возможно построение структур обоих типов, т. е. с шестью или семью электронами вокруг атома второго периода, с одной стороны, и с октетом электронов — с другой, реализуются последние структуры, так как обычно они имеют более низкую энергию. Например, этилен имеет структуру [c.27]
В соответствии с методом ВС валентность атома равна числу его одиночных электронов. С этой позиции валентности атомов элементов второго периода системы элементов Д. И.» Менделеева объясняют следующим образом. Первый энергетический уровень заполнен (1х ) и не может внести вклад в валентность атома. Ответственными за образование химических связей у атомов этих элементов являются электроны второго (внешнего) уровня [c.48]
Из спиновой теории валентности вытекает, что образовать ковалентную связь способны только неспаренные электроны. Они и определяют число связей данного атома с другими, а следовательно, и валентность [10, стр. 158]. Рассмотрим валентность элементов второго периода системы элементов, пользуясь табл. 7. [c.90]
В атоме следующего за цинком галлия начинается заполнение 4р-состояния, которое заканчивается в криптоне (2=36) Кг (1) (2) (3) (4s)2(4p) . Таким образом, третий период (Na—Аг) имеет, как и второй, восемь элементов, а четвертый (К—Кг), — восемнадцать. В атомах от S до Си происходит заполнение Зс -оболочки. Атомы с незаполненными оболочками обладают многими общими чертами. Как указывалось, З -оболочка имеет десять мест. При ее незаполненности, т. е. наличии большого числа свободных мест, появляется возможность различного расположения электронов внутри оболочки, и следовательно, возможность изменения валентности. Наибольшая валентность (7) проявляется у марганца, в атоме которого имеется пять З -электронов. При этом все Зс -электроны занимают пять различных -состояний с ненасыщенными спинами, а один из 45-электронов переходит в 4р-состояние. [c.317]
Для элементов, родственных представленным, электронные конфигурации те же, за исключением более высоких значений квантового числа п. Так, сера, родственная кислороду, входящая во второй период, имеет конфигурацию валентных электронов Зз Зр. [c.117]
На валентный электрон в атомах элементов группы 1А (Е1, К, Се) действует эффективный заряд ядра приблизительно одинаковой величины. В случае лития этот заряд несколько меньше, чем для остальных элементов группы 1А, главным образом из-за того, что предшествующий валентному энергетический уровень занят всего двумя электронами. Эта особенность характерна и для других элементов второго периода и отличает их от других элементов соответствующих групп. Обращает на себя внимание большое отличие величин 2эфф для Е и Р, принадлежащих ко второму периоду. Это отличие показывает, насколько слабо экранирование электронами, находящимися на том же энергетическом уровне, что и рассматриваемый электрон именно это обстоятельство и приводит к уменьшению размеров атомов при переходе слева направо вдоль одного периода. [c.97]
Группы нумеруются двояко группы — и р-элементов римскими числами с литерой А , а -элементов — с литерой В . Номер группы соответствует числу внешних или валентных электронов в атоме. Элементы /-типа—лантаноиды (58—71) и актиноиды (90—103)—характеризуются переменной валентностью, первые от двух до четырех, а вторые — от двух до семи (недавно в СССР получены семивалентные соединения нептуния и плутония). Они представля10т два семейства и не отнесены к каким-либо группам. Элементы групп кобальта и никеля, проявляющие валентность от двух до шести, но не выше, включены условно в УИ1В-группу, хотя для этого нет убедительных оснований. Их иногда, вместе с элементами группы железа, называют триадами, так как в каждом периоде (4-, 5- и [c.81]
Самый внещний электрон в атоме каждого элемента третьего периода связан менее прочно, чем самый внешний электрон в атоме соответствующего элемента-аналога из предшествующего периода, потому что электроны с п = Ъ находятся дальше от ядра, чем электроны с п = 2. Вследствие этого первая энергия ионизации для элементов третьего периода (с валентными электронами на уровне п = 3) оказывается меньше, чем у соответствующих элементов второго периода (с п = 2). Когда завершается заполнение 35- и Зр-орбиталей, снова образуется чрезвычайно устойчивая электронная конфигурация благородного газа аргона, Аг. [c.396]
Бор, углерод и азот принадлежат к числу элементов второго периода и имеют сходные размеры. Они отличаются по числу валентных электронов бор обладает тремя валентными электронами, углерод-четырьмя, а азот-пятью. Кремний — элемент третьего периода.-попобно углероду, имеет четыре валентных электрона, но они находятся на один главный энергетический уровень дальше от ядра и характеризуются главным квантовым числом 3, а не 2. Под своими валентными электронами [c.270]
Атом бора имеет три валентных электрона и четыре валентные орбитали. Обычно он использует три орбитали, образуя 5р -гибриды в таких соединениях, как ВРз- Углерод имеет четыре валентных электрона и четыре орбитали. За исключением тех случаев, когда он образует кратные связи, эти орбитали используются для 5р -гибридизации. Атом азота имеет пять валентных электронов и четыре орбитали. Как правило, он образует три связи с другими атомами в структурах с тетраэдрической конфигурацией, а четвертая гибридная 5р -орбиталь у него занята неподеленной электронной парой (разд. 13-3). Углерод и азот способны образовывать двойные и тройные связи в результате я-перекры-вания, обсуждавшегося в разд. 13-4. По сравнению с длиной простой связи длина двойных связей, образуемых этими элементами, сокращается на 13%, а длина тройных связей-на 22%. Прочность кратной связи повыщается благодаря наличию электронов на связывающей молекулярной п-орбитали, возникающей в результате перекрывания атомных я-ор-биталей. Но перекрывание я-типа между орбиталями становится достаточно больщим для возникновения связи только при близком расположении атомов. По этой причине 81 и другие элементы третьего и следующих периодов неспособны образовывать кратные связи. Кремний имеет 10 внутренних электронов по сравнению с 2 в атомах С и N. Отталкивание этих внутренних электронов не позволяет двум атомам 81 сблизиться настолько, насколько это необходимо для достаточного я-перекрывания р-орбиталей и возникновения двойных связей. Несмотря на все попытки химиков синтезировать соединения со связями 81=81 и 81=С, ни одна из них до сих пор не увенчалась успехом. За небольшими исключениями, образование двойных и тройных связей ограничено элементами второго периода, в атомах которых число внутренних электронов не превышает 2. Исключения, к числу которых относятся 8=0, Р=0 и 81=0, объясняются перекрыванием между р- и -орбиталями, этот вопрос будет рассмотрен в разделе, посвященном кремнию. [c.271]
Эта тенденция также ослш евагт при увеличении номера периода. Электроотрицательности у лития и у бериллия (второй период) отличаются сильнее, чем у натрия и магния (третий период). Электроотрицательности у фтора и у хлора (второй и третий периоды) отличаются сильнее, чем у хлора и у брома (третий и четвертый периоды). Следует отметить, чю атомы инертных газов имеют полностью заполненный валентный з ровень, поэтому они не проявляют тенденции оттягивать на себя электроны. Таким образом, сказанное вьипе относится к элементам групп с 1 по 7, но не относится к элементам восьмой группы. Если теперь посмотреть внимательно на расположение элементов в Периодической системе, то станет ясно, почему именно фтор и еет самую высокую электроотрицательность. Огносительная электроотрицатсльиость некоторых химических элементов представлена в ряду на форзаце. [c.52]
Направленность ковалентной связи. Как указано выше, ковалентная связь имеет направленность. Квантовомеханическое объяснение направ.1енности ковалентной связи основано на учете формы различных орбиталей. Здесь отметим, что атомы элементов второго и последующих периодов можно рассматривать как состоящие из остова, содержащего внутренние электронные слои, и внешних (валентных) электронов, которые вносят основной вклад в образование химической связи. Поэтому далее при описании строения молекул принимаем во внимание только орбитали валентных электронов. [c.90]
Мы уже обсуждали (гл. 6) факторы, определяющие форму неорга нических молекул, составленных из атомов переходных элементов. Главным образом это — размер и заряд центрального иона, наличие свободной электронной пары, возможность расширения валентного уровня сверхоктета, являющегося предельным для элементов второго периода, способность к образованию л -связей. стерические требования к группам, связанным с центральным атомом, и, вероятно, важнее всего принцип запрета Паули. Если рассматривать центральный атом со сферической симметрией, характерной для комплексов металлов, не имеющих свободных электронных пар, следует ожидать, и это действительно обнаруживается, правильные формы. Молекулы с координационными числами 2, 3, 4, 5, 6, 7 и 8 характеризуются следующими структура, чи линейной, треугольной, правильной тетраэдрической, тригональной бипирамидой, октаэдрической, пятиугольной бипирамидой и квадратной (архимедовой) антипризмой. Можно сказать, что всякий раз, когда электронный уровень атома переходного элемента, не принимающий участия в связи, будет иметь сферическую симметрию, структура таких комплексов будет правильной, определяемой только координационным числом. Можно вы писать электронные конфигурации, которые приводят к правильным симметричным комплексам. Для наиболее распространенных координационных чисел 6 и 4 имеют место следующие конфигу рации [c.282]
Второй период образует атомы от до Ne. В направлении — Ке растет эффективный заряд ядра, в связи с чем уменьшаются размеры атомов (см. Гшах), возрастает потенциал ионизации и осуществляется, начиная с В, переход к неметаллам. Потенциал ионизации отражает не только рост в ряду —Ке, но и особенности электронных конфигураций потенциал ионизации у бора ниже, чем у бериллия. Это указывает на упрочнение заполненных нодоболочек ( у бериллия). Более высокий потенциал ионизации азота по сравнению с кислородом указывает на повышенную прочность конфигурации р , в которой каждая орбиталь занята одним / -электроном. Аналогичные соотношения наблюдаются и в следующем периоде у соседей Mg—А1 и Р—5. У атомов второго периода отрыв электрона с внутреннего Ь -слоя требует такого высокого ПИ (75,62 эВ уже у лития), что в химических и оптических процес—сах участвуют только внешни электроны. Сродство к электрону в ряду Ы—Р имеет тенденцию к возрастанию. Но у берилжя оболочка заполнена, и сродство к электрону эндотермично так же, как и у гелия (1л ). Обладая самым высоким потенциалом ионизации ю всех неметаллов и высоким сродством к электрону, фтор является наиболее электроотрицательным элементом в периодической системе. Для атома неона СЭ (Ке)=—0,22 эВ. Оболочка з р атома Ке, электронный октет, характеризуется суммарным нулевым спином и нулевым орбитальным моментом (терм 5о). Все это, вместе с высоким потенциалом ионизации и отрицательным сродством к электрону, обусловливает инертность неона. Такая же з р конфигурация внешнего слоя характерна для вСех элементов нулевой группы. Исследования последних лет показывают, что 1 п, Хе,Кг и Аг дают химические соединения со фтором и кислородом. Очевидно, что з р конфигурация не влечет как непременное следствие химической инертности. Все атомы со спаренными электронами (терм о) — диамагниты (Не, Ве, Ке и т. д.). Конфигурации внешнего электронного слоя у атомов 2-го и 3-го периодов, стоящих в одних и тех же группах, одинаковы, чем объясняется близость химических свойств элементов, стоящих в одних и тех же группах (сравните Ка иЬ1 в табл. 5). Но наблюдается и различие элементы второго периода обладают постоянной валентностью, а третьего — переменной. Это связано с тем, что у атомов третьего периода есть вакантные -состояния в третьем квантовом слое, а во втором слое таких соединений нет. [c.62]
Валентный уровень элементов второго периода заполняется четырьмя электронными парами, поэтому для их соединений АХ4, АХзЕ, АХ2Е2 угол связи существенно не отклоняется от значений 109,5°. [c.112]
Кислород — элемент с порядковым номером 8, его относительная атомная масса 15,999ж1 . Находится во втором периоде, в главной подгруппе VI группы. Электронное строение атома кислорода и его валентные возможности рассмотрены выше. [c.355]
Вор входит в главную подгруппу III группы периодической системы элементов и имеет электронную конфигурацию ls 2s 2p под ним расположен алюминий. Во втором периоде при переходе от бора к углероду радиусы ромов уменьшаются, а в IV группе при переходе от углерода к кремнию — увеличиваются. Поэтому радиусы атомов бора и кремния близки. Бор существенно отличается от алюминия и обнаруживает большое сходство с кремнием. Бор образует три ковалентные связи с атомами других элементов. В зависимости от природы последних атом бора может образовать еще одну до-норноакцепторную связь, предоставляя р-орбиталь для электронной пары другого атома. Таким образом, бор в соединениях проявляет валентность, равную трем, или ковалентность, равную четырем. [c.368]
Установлено [liebmanJ. F.,J. hem. Edu ., 50, 831(1973)], что сумма первых потенциалов ионизации для непереходных элементов любого периода, у которых общее число валентных электронов равно восьми, поразительно мало изменяется в пределах периода. Например, для второго периода [c.107]
Понятие электроотрицательности — урок. Химия, 8–9 класс.
Все известные химические элементы можно разделить на металлы и неметаллы.
Металлы — элементы, атомы которых способны отдавать электроны.
Неметаллы — элементы, атомы которых могут принимать электроны.
При взаимодействии металла с неметаллом атом первого теряет электроны, а атом второго их присоединяет.
А что происходит, если взаимодействуют атомы двух неметаллов?
Сравним атомы серы и кислорода:
O8 +8 2e, 6e;
S16 +16 2e, 8e, 6e.
Радиус атома серы больше, валентные электроны слабее связаны с ядром. При образовании связи произойдёт сдвиг электронов от серы к кислороду.
Сравним атомы углерода и кислорода:
O8 +8 2e, 6e;
C6 +6 2е, 4е.
Заряд ядра атома кислорода больше, и притягивать к себе электроны он будет сильнее.
Значит, атомы разных неметаллов притягивают к себе электроны неодинаково.
Способность атомов элементов оттягивать к себе общие электронные пары в химических соединениях называется электроотрицательностью (ЭО).
Так как общие электронные пары образуются валентными электронами, то можно сказать, что электроотрицательность — это способность атома притягивать к себе валентные электроны от других атомов.
Обрати внимание!
Чем больше электроотрицательность, тем сильнее у элемента выражены неметаллические свойства.
Шкала относительной электроотрицательности Полинга
Абсолютные значения ЭО — неудобные для работы числа. Поэтому обычно используют относительную электроотрицательность по шкале Полинга. За единицу в ней принята ЭО лития.
По шкале Полинга наиболее электроотрицательным среди элементов, способных образовывать соединения, является фтор, а наименее электроотрицательным — франций. ЭО франция равна \(0,7\), а ЭО фтора — \(4\). ЭО остальных элементов изменяются в пределах от \(0,7\) до \(4\).
Как правило, неметаллы имеют ЭО больше двух. У металлов значение ЭО меньше двух. Некоторые элементы (B,Si,Ge,As,Te) со значениями электроотрицательности, близкими к \(2\), способны проявлять промежуточные свойства.
Элементы с высокой и низкой электроотрицательностью считаются активными. С высокой — активные неметаллы, с низкой — активные металлы. У первых ЭО близка к \(3\)–\(4\), у вторых — к \(1\).
Изменение электроотрицательности в Периодической системе
С увеличением порядкового номера элементов ЭО изменяется периодически.
В периоде она растёт слева направо при накоплении электронов на внешнем слое.
В группе она убывает сверху вниз при увеличении числа электронных слоёв и увеличении атомных радиусов.
Наибольшей ЭО в каждом периоде обладают самые маленькие атомы с семью внешними электронами — атомы галогенов (инертные газы соединений не образуют).
Наименьшая ЭО в периоде у самого большого атома с одним внешним электроном — атома щелочного металла.
Обрати внимание!
Значения электроотрицательности элементов позволяют определить:
— заряды атомов в соединении;— сдвиг электронов при образовании химической связи.
Установим, как происходит сдвиг электронов при взаимодействии атомов хлора и серы, cеры и кислорода.
Пример:
хлор и сера расположены в третьем периоде. Электроотрицательность по периоду возрастает слева направо. ЭО хлора больше ЭО серы, значит, электроны будут сдвинуты от серы к хлору. Заряд атома серы будет положительным, а хлора — отрицательным:
Sδ+→Clδ−.
Проверим вывод по шкале Полинга. Электроотрицательность хлора равна \(3\), а электроотрицательность серы — \(2,5\). Хлор более электроотрицательный.
Пример:
кислород и сера расположены в шестой А группе. Электроотрицательность по группе сверху вниз уменьшается. ЭО кислорода больше ЭО серы, значит, электроны будут сдвинуты от серы к кислороду. Атом серы имеет положительный заряд, а кислорода — отрицательный:
Sδ+→Oδ−.
По шкале Полинга электроотрицательность кислорода равна \(3,5\), а электроотрицательность серы — \(2,5\). Более электроотрицательный — кислород.
При сравнении ЭО элементов часто используют ряд электроотрицательности, расположив элементы в порядке убывания её значения:
F,O,N,Cl,Br,S,C,P,H,Si,Mg,Li,Na.
Частей Периодической таблицы
Когда элементы объединяются, чтобы сформировать соединения, есть два основных типа соединение, которое может возникнуть. Ионные связи образуются при наличии перенос электронов от одного вида к другому, производя заряженные ионы, которые очень сильно притягиваются друг к другу за счет электростатического взаимодействия, и ковалентных связей , которые возникают, когда атомы делятся электронами для производства нейтральных молекул.В целом металл и неметаллы объединяются с образованием ионных соединений , а неметаллы соединяются с другими неметаллами с образованием ковалентных соединений (молекулы).
Поскольку металлы в периодической таблице расположены левее, они имеют низкую энергию ионизации и низкое сродство к электрону, поэтому они относительно легко теряют электроны и с трудом их получают. Они также имеют относительно мало валентных электронов и могут образовывать ионы (и тем самым удовлетворять правилу октетов) легче, теряя свою валентность электронов с образованием положительно заряженных катионов .
- Металлы основной группы обычно образуют такие же заряды, как и их номер группы: то есть металлы Группы 1А, такие как натрий и калий образуют заряд +1, металлы группы 2А, такие как магний и кальций образуют 2+ зарядов, а металлы группы 3А, такие как в виде алюминия образуют 3+ заряда.
- Металлы, следующие за переходными металлами (в сторону нижняя часть групп 4A и 5A) могут потерять либо свои крайние с и p электронов, образующих заряды, идентичные их номер группы, или они могут потерять всего p электронов, пока сохраняя свои два s электронов, образуя заряды, которые являются номер группы минус два.Другими словами, олово и свинец в Группе 4A может образовывать 4+ или 2+ зарядов, а висмут в группе 5A может образовывать заряды 4+ или 2+. формируют заряд 5+ или 3+.
- Переходные металлы обычно способны образовывать 2+ заряда. теряя валентность с электронов, но также могут терять электроны со своих d орбиталей с образованием других зарядов. Большинство переходных металлов могут образовывать более одного возможного заряда. в ионных соединениях.
Неметаллы находятся правее в таблице Менделеева и имеют высокие энергии ионизации и высокое сродство к электрону, поэтому они относительно легко получают электроны и с трудом теряют их. У них также больше валентных электронов, и они уже близок к полному октету из восьми электронов. Неметаллы набирать электроны до тех пор, пока у них не будет того же количества электронов, что и у ближайший благородный газ (группа 8А), образующий отрицательно заряженных анионов которые имеют заряды, равные номеру группы минус восемь.Это, Неметаллы группы 7А образуют заряды 1, неметаллы группы 6А образуют 2- заряды, а металлы группы 5А образуют 3- заряды. Группа 8А элементы уже имеют восемь электронов в их валентных оболочках и имеют малая тенденция к получению или потере электронов, и с трудом образуют ионные или молекулярные соединения.
Ионные соединения удерживаются вместе в регулярном массиве, называемом кристаллом . решетки за счет сил притяжения между противоположно заряженными катионы и анионы.Эти силы притяжения очень сильны, и поэтому большинство ионных соединений имеют очень высокие температуры плавления. (За Например, хлорид натрия, NaCl, плавится при 80 ° C, а оксид алюминия, Al 2 O 3 , плавится при 2054 ° C.) Ионные соединения: обычно твердые, жесткие и хрупкие. Ионные соединения не проводят электричество, потому что ионы не могут двигаться в твердой фазе, но ионные соединения могут проводить электричество, когда они растворены в вода.
Когда неметаллы объединяются с другими неметаллами, они имеют тенденцию делиться электроны в ковалентных связях вместо образования ионов, что приводит к образование нейтральных молекул. (Имейте в виду, что поскольку водород также неметалл, сочетание водорода с другим неметаллом также будет образовывать ковалентную связь.) Молекулярные соединения могут быть газы, жидкости или твердые вещества с низкой температурой плавления и включают широкий спектр веществ. (См. Галерея молекул для Примеры.)
Когда металлы соединяются друг с другом, обычно описывается соединение. как металлическое соединение (вы уже догадались). В этом модели, каждый атом металла отдает один или несколько своих валентных электронов сделать электронное море , которое окружает все атомы, удерживая вещества вместе за счет притяжения между катионами металлов и отрицательно заряженные электроны. Поскольку электроны в электроне море может свободно перемещаться, металлы очень легко проводят электричество, в отличие от молекулы, где электроны более локализованы.Атомы металлов могут проходят друг мимо друга легче, чем в ионных соединениях (которые удерживаются в фиксированных положениях притяжениями между катионами и анионы), позволяя металлу раскалывать листы или втягивать провод. Различные металлы можно легко комбинировать, чтобы получить . сплавы , физические свойства которых могут сильно отличаться от их составляющие металлы. Сталь представляет собой сплав железа и углерода, которое намного тверже самого железа; хром, ванадий, никель и другие металлы также часто добавляют в железо, чтобы сделать стали различных типы. Латунь — это сплав меди и цинка, который используется в сантехнике, электрических деталях и музыкальных инструментах. Бронза — это сплав меди и олова, который намного тверже, чем медь; когда бронза была открыта древними цивилизациями, она ознаменовала значительный шаг вперед от использования менее прочных каменных орудий.
Кальций — Информация об элементе, свойства и использование
Расшифровка:
Химия в ее элементе: кальций
(Promo)
Вы слушаете Химию в ее элементе, представленную вам Chemistry World , журналом Королевского химического общества.
(Конец промо)
Крис Смит
Привет, добро пожаловать на эту неделю на тему «Химия в ее элементе», я Крис Смит. На этой неделе настала очередь стихии, дающей нам цемент, гипс Парижа, наши собственные кости, твердые зубы и жесткую воду.
Карен Фолдс
Молоко, сыр, йогурт, шпинат, миндаль. Что у всех них общего? Это, конечно, кальций! Но хотя большинство из нас сразу же думает о еде, когда кто-то упоминает кальций (и я лично считаю, что за это отвечает старая реклама молока), на самом деле он играет гораздо большую роль в нашей жизни, чем это.Кальций повсюду вокруг нас. В среднем человек содержит примерно 1 кг кальция, 99% которого хранится в наших костях. Это 5-й по численности элемент в земной коре, широко встречающийся в виде карбоната кальция, более известного как известняк. Это также пятый по распространенности растворенный ион в морской воде.
Кальций был назван в честь латинского термина calx, означающего известь, и представляет собой химически активный серебристый металлический элемент, входящий в группу 2 периодической таблицы. Впервые он был выделен в 1808 году в Англии, когда сэр Хамфри Дэви электролизовал смесь извести и оксида ртути.Сегодня мы получаем кальций путем электролиза расплавленной соли, такой как хлорид кальция. При контакте с воздухом элементарный кальций быстро образует серо-белое оксидно-нитридное покрытие. В отличие от магния, кальций довольно трудно воспламенить, но, однажды зажженный, он горит ярким красным пламенем высокой интенсивности.
Однако соединения кальция гораздо более полезны, чем сам элемент. Литература, относящаяся к 975 году нашей эры, показывает, что Парижский гипс (который представляет собой сульфат кальция) уже тогда использовался для закрепления сломанных костей.Оксид кальция (также известный как известь или негашеная известь) является основным компонентом строительного раствора и цемента. Производство цемента с использованием оксида кальция известно давно; его использовали римляне, а также египтяне, построившие Великую пирамиду в Гизе и гробницу Тутанхамона. Фторид кальция также хорошо известен тем, что он нерастворим и прозрачен в широком диапазоне длин волн, что делает его полезным для изготовления ячеек и окон для инфракрасных и ультрафиолетовых спектрометров.
Наша питьевая вода также содержит ионы кальция, особенно в районах с жесткой водой.Жесткая вода — это термин, используемый для воды с высоким содержанием ионов кальция и магния (2+). Кальций обычно попадает в воду, когда проходит мимо карбоната кальция из известняка и мела или сульфата кальция из других минеральных отложений. Хотя некоторым людям не нравится вкус, жесткая вода, как правило, не вредна для вашего здоровья. Хотя от этого ваш чайник будет пушистым! Интересно, что вкус пива (что-то дорогое моему сердцу), кажется, связан с концентрацией кальция в используемой воде, и утверждается, что хорошее пиво должно иметь концентрацию кальция выше, чем в жесткой водопроводной воде.
Кальций — это так называемый незаменимый элемент, а это означает, что он абсолютно необходим для жизненных процессов. В конце концов, это то, что нам пытались сказать старые рекламные ролики по молочному телевидению. Кальций используется для производства минералов, содержащихся в костях, раковинах и зубах, в процессе биоминерализации. Фосфат кальция (также известный как гидроксиапатит) является минеральным компонентом костей и зубов и является особенно хорошим примером того, как организмы производят «живые» композитные материалы.В самом деле, различные свойства (например, жесткость) костей обусловлены изменением количества органического компонента, в основном волокнистого белка, называемого коллагеном, с которым связан гидроксиапатит. Кость в нашем теле функционирует не только как структурная опора, но и как центральный запас кальция. Таким образом, во время беременности кости, как правило, подвергаются поиску кальция в процессе, называемом деминерализацией. Кость не вечна; Серьезной медицинской проблемой является остеопороз — декальцификация костей.Эта потеря костной массы, которая происходит с возрастом, делает кости более восприимчивыми к разрушению при стрессе, и это происходит в основном у пожилых людей, особенно у женщин.
Ионы кальция также играют решающую роль в высших организмах в качестве внутриклеточного посредника. Потоки Ca2 + запускают действие фермента в клетках в ответ на получение гормонального или электрического сигнала из других частей организма. Кальций также очень важен для свертывания крови. Когда внезапно возникает кровотечение из раны, тромбоциты собираются в ране и пытаются заблокировать кровоток.Кальций, витамин К и белок фибриноген помогают тромбоцитам образовывать сгусток. Если в вашей крови не хватает кальция или одного из этих питательных веществ, для свертывания крови потребуется больше времени, чем обычно.
Способность обнаруживать очень малые количества элемента может быть очень полезной адаптацией для животного, если этот элемент для него важен. Например, раки-отшельники, которые обитают в бывших в употреблении раковинах и по мере роста меняют раковины на более новые, более крупные, обладают способностью распознавать раковины, пригодные для занятия, не только по ощупыванию их, но, по-видимому, также по измерению мельчайшего количества карбоната кальция, которое содержится в них. растворяется в воде вокруг скорлупы.Они могут легко отличить природные раковины, содержащие карбонат кальция, от содержащих кальций аналогов, сделанных из сульфата кальция. Концентрация кальция, обнаруженная крабом-отшельником, составляет порядка 4 частей на миллион или меньше, что является удивительно низким показателем.
Итак, от крепких зубов и костей до пива с хорошим вкусом и обеспечения того, чтобы раки-отшельники нашли свой идеальный дом — вы можете видеть, что кальций действительно является важным элементом.
Крис Смит
Что ж, я чувствую себя как дома со своей жесткой водой, да и местное пиво тоже имеет неплохой вкус, хотя я пережил немало чайников — действительно, Рассел Хоббс, вероятно, обязан своей высокой цене акций просто ко мне.Хорошо, может быть. Это была Карен Фолдс из Стратклайдского университета с историей о кальции. На следующей неделе, если бы вы были элементом, кем бы вы были?
Пэт Бейли
Если бы мне пришлось выбрать человека, который бы представлял золото, я бы подумал, что это мог бы быть амбициозный молодой биржевой маклер, немного кричащий и не очень хорош в установлении отношений. Для гелия — воздушно-сказочная блондинка с немного скрипучим голосом, но со стремлением влиться в аристократию. А для бора? Ну, на первый взгляд, скучный бухгалтер средних лет, может быть, в коричневых вельветовых брюках и твидовом пиджаке.но с неожиданной стороной для него в свободное время — прыжками с парашютом и членом весьма сомнительного общества, которое занимается обменом партнерами.
Крис Смит
А инсайдерскую историю о выходках Борана с Пэт Бейли вы можете узнать в выпуске Chemistry in its Element на следующей неделе. Я Крис Смит, спасибо за внимание и до свидания.
(Промо)
(Окончание промо)
Расчет емкости катионообмена, основной насыщенности и насыщения кальцием
Целью данного информационного бюллетеня является определение емкости катионного обмена почвы, насыщенности основания и насыщения кальцием, а также демонстрация того, как эти значения рассчитываются в отчетах об испытаниях почвы.
Катионообменная емкость (CEC)
Катионообменная емкость (CEC) — это фундаментальное свойство почвы, используемое для прогнозирования наличия и удержания питательных веществ в почве. Это потенциал доступных питательных веществ, а не прямое измерение доступных питательных веществ. ЕКО почвы обычно увеличивается по мере увеличения содержания глины и органического вещества, поскольку катионный обмен происходит на поверхности глинистых минералов, органических веществ и корней. Почвы в Огайо могут охватывать широкий диапазон ЕКО, но обычно составляют от 5 до 25 мг-экв / 100 г почвы (Таблица 1).Значения более 25 мг-экв / 100 г почвы обнаруживаются с тяжелыми глинистыми почвами, органическими или навозными почвами.
| Таблица 1. Связь между текстурой почвы и CEC | |
| Текстура почвы | Типичный CEC (мэкв / 100 г почвы) |
| Пески | 3-5 |
| Суглинки | 10-15 |
| Илистые суглинки | 15-25 |
| Глина и суглинки | 20-50 |
| Органические почвы | 50–100 |
Катионообменная способность определяется как общее количество отрицательных поверхностных зарядов почвы.Обычно он измеряется в коммерческих лабораториях по тестированию почвы путем суммирования катионов (положительно заряженных ионов, которые притягиваются к отрицательным поверхностным зарядам в почве). Обменные катионы включают основные катионы, кальций (Ca 2+ ), магний (Mg 2+ ), калий (K + ) и натрий (Na + ), а также кислотные катионы, такие как водород (H + ), алюминия (Al 3+ ) и аммония (NH 4 + ).
CEC = Основные катионы + Кислотные катионы
(Ca 2+ + Mg 2+ + K + + Na + ) + (H + + Al 3+ + NH 4 + )
На рис. 1 показана почва с низким ЕКО, с небольшим количеством отрицательных зарядов и связанных катионов (слева) и почва с высоким ЕКО, с большим количеством отрицательных зарядов, занятая большим количеством общих катионов (справа).
Базовая насыщенность
Насыщение основанием рассчитывается как процент CEC, занятого катионами оснований. На рис. 2 показаны две почвы с одинаковым CEC, но в почве справа больше основных катионов (синим цветом). Следовательно, у него более высокая базовая насыщенность. Насыщение основанием тесно связано с pH; по мере увеличения насыщения основанием pH увеличивается.
Насыщенность оснований (%) = ( Катионы оснований / CEC ) \ (x \ text {100} \)
Аналогичным образом мы можем рассчитать насыщенность оснований для каждого отдельного катиона оснований.Насыщение основанием кальция рассчитывается как процент CEC, занятого катионами кальция. На Рисунке 2 почва справа содержит в два раза больше катионов кальция (Ca 2+ ), следовательно, более высокое насыщение кальцием.
Насыщение кальция (%) = ( Катионы кальция / CEC ) \ (x \ text {100} \)
Расчет CEC на основе теста почвы
CEC выражается в миллиэквивалентах на 100 граммов почвы (мэкв / 100 г) или в дозе на вес почвы.Вместо веса используются миллиэквиваленты, потому что, когда речь идет об ионном обмене, более полезен заряд.
Итак, как нам взять концентрацию питательных веществ в почвенном тесте (ppm) и преобразовать в заряды (мэкв. / 100 г почвы)? Лаборатории тестирования почвы часто предоставляют эти значения уже в отчете об испытаниях почвы или предоставляют их по запросу. Однако для лучшего понимания взаимосвязей ниже описаны шаги по выполнению этих расчетов.
Шаг 1: Определите эквивалентную массу в граммах каждого катиона основания. Каждый катион основания имеет атомный вес и валентное число (заряд) в периодической таблице элементов. На рис. 3 показаны катионы оснований. Для кальция атомный вес составляет ~ 40 граммов на моль, а заряд равен 2. Мы разделим каждый атомный вес (40) на заряд (2), чтобы вычислить эквивалентный вес в граммах (20). Значение для каждого основного катиона приведено в таблице 2.
Шаг 2.Преобразуйте эквивалентный вес в граммах в заряд на вес почвы (мг-экв / 100 г почвы).
$$ \ text {эквивалент} \ times \ frac {1000 \ text {milliequivalent}} {1 \ text {эквивалент}} \ times \ frac {1} {100 \ text {g почва}} = \ frac {10 \ текст {meq}} {\ text {g почва}} $$
Шаг 3. Умножьте эквивалентный вес в граммах на 10, чтобы перевести его в мг-экв / 100 г почвы. Опять же, для кальция, эквивалентный вес в граммах 20 граммов, умноженный на 10, дает нам 200 мг-экв / 100 г почвы. Это значение мэкв / 100 г почвы используется в качестве коэффициента пересчета для значений концентрации питательных веществ (ppm), полученных при испытании почвы.Значения, выделенные жирным шрифтом в последнем столбце таблицы 2, можно каждый раз использовать в качестве коэффициента преобразования, и они не изменятся.
| Таблица 2. Константы мэкв / 100 г почвы для основных катионов Ca, Mg, K и Na. | ||||
| Катион оснований | Атомный вес | Заряд (валентность) | Грамм Эквивалентный вес (г) | Миллиэквивалент / 100 г почвы |
| Кальций (Ca) | 40 | 2 | 20 | 200 |
| Магний (Mg) | 24 | 2 | 12 | 120 |
| Калий (К) | 39 | 1 | 39 | 390 |
| Натрий (Na) | 23 | 1 | 23 | 230 |
Шаг 4.Преобразуйте концентрацию питательных веществ в почве в заряд. В таблице 3 приведен пример типичных уровней при испытаниях почвы в Огайо (в миллионных долях). Мы можем рассчитать совокупный заряд, который каждый катион занимает на сайтах обмена, взяв значения, вычисленные в таблице 2 (последний столбец), и разделив их на уровни испытаний почвы. Для кальция уровень 2000 ppm в почве, деленный на 200, дает 10,0 мг-экв / 100 г почвы. Это делается для каждого катиона индивидуально.
Шаг 5. Рассчитайте совокупный заряд катионов оснований. Затем мы складываем заряды каждого катиона оснований. В этом примере сумма основных катионов составляет 12,4 мэкв / 100 г почвы (Таблица 3).
Шаг 6. Рассчитайте обменную кислотность, используя pH буфера с эмпирически полученным уравнением преобразования (таблица 3). Если pH почвы больше 7,0, обменная кислотность практически отсутствует, а ЕКО — это просто сумма основных катионов. Почва с буферным pH 6,6 показывает, что кислотные катионы занимают 4,8 мг-экв на 100 грамм почвы.
| Таблица 3. Преобразование значений испытаний почвы (ppm) в мэкв. / 100 г почвы для основных и кислотных катионов для определения CEC. | |||
| Катион оснований | Уровень испытания почвы (ppm) | Миллиэквивалент на 100 г почвы | мэкв / 100 г почвы |
| Кальций (Ca 2+ ) | 2000 | 200 | 10,0 |
| Магний (Mg 2+ ) | 240 | 120 | 2.0 |
| Калий (K + ) | 100 | 390 | 0,26 |
| Натрий (Na + ) | 20 | 230 | 0,09 |
| Итого | 12,4 | ||
| Кислотный катион | Буфер pH | Уравнение преобразования | мэкв / 100 г почвы |
| Обменная кислотность (H + , Al 3 + , NH 4 + ) | 6.6 | 12 х (7,0 — 6,6) | 4,8 |
| * Если значения теста почвы выражены в фунтах на акр, то сначала преобразуйте фунты на акр в ppm, разделив значения теста почвы на 2. | |||
| * * Если pH буфера 7 или выше, то у вас нет обменной кислотности (CEC = сумма основных катионов). | |||
Шаг 7. Рассчитайте CEC, добавив основные катионы и кислотные катионы:
Катионообменная емкость (CEC) = Основные катионы + кислотные катионы $$ = \ text {12.4 + 4.8} $$
= 17,2 мэкв /100 г
С помощью CEC мы можем вычислить следующее (умножив на 100, чтобы получить процент):
Насыщенность оснований (%) = ( Катионы оснований / CEC ) \ (x \ text {100} \)
= ( 12,4 / 17,2) \ (x \ text {100} \)
= 72 %
Насыщение кальция (%) = ( Катионы кальция / CEC ) \ (x \ text {100} \)
= ( 10 /17.2) \ (x \ text {100} \)
= 58 %
Насыщение магнием (%) = ( Катионы магния / CEC ) \ (x \ text {100} \)
= ( 2.0 /17.2) \ (x \ text {100} \)
= 12 %
Резюме
Емкость катионного обмена и насыщенность основаниями являются важными измерениями почвы, которые помогают определить, как почва обрабатывается и удобряется. Хотя стандартные лаборатории по исследованию почвы обычно рассчитывают и сообщают эти значения в отчетах об испытаниях почвы, полезно иметь твердое представление о расчетах ЕКО и базовой насыщенности.
Список литературы
Barker, D., et al. Руководство по агрономии Огайо, 15-е издание .(2017). Бюллетень расширенного обучения Университета штата Огайо 472. agcrops.osu.edu/publications/ohio-agronomy-guide-15th-edition-bulletin-472
Лабарж Г. и Линдси Л. (2012). Интерпретация отчета об испытаниях почвы. Расширение Университета штата Огайо AGF-514. ohioline.osu.edu/factsheet/AGF-514
Havlin, J., et al. Плодородие почвы и удобрения, 8-е издание . 2013. Пирсон, Нью-Джерси. ISBN 13: 9780135033739
Реганольд и Харш. (1985). Выражение катионообменной емкости в миллиэквивалентах на 100 грамм и в единицах СИ. Журнал агрономического образования 14 (2): 84–90.
Плагиоклаз— обзор | ScienceDirect Topics
2.02.4.1 Переход плагиоклаз – шпинель
Стабильность плагиоклаза в условиях верхней мантии впервые была продемонстрирована в экспериментальных исследованиях (CaO – Al 2 O 3 –SiO 2 : Kushiro and Yoder, 1966; CMAS: Гаспарик, 1984; Грин и Хибберсон, 1970; Герцберг, 1978; Кусиро и Йодер, 1966; МакГрегор, 1967; Обата, 1976; О’Хара, 1967), который обнаружил одновариантный переход в этом простом химическом составе между 0.6 и 0,8 ГПа при 900–1200 ° C ( Рисунок 4 ).
Рис. 4. Переход плагиоклаз – шпинель в системе CaO – MgO – Al 2 O 3 –SiO 2 . Ссылки даются в тексте.
Позднее были исследованы более сложные системы (Na 2 O – CMAS: Walter and Presnall, 1994; FeO – CMAS: Gudfinnsson and Presnall, 2000), и хотя эти исследования были в первую очередь направлены на определение температуры солидуса перидотитов (например, , Бейкер и Столпер, 1994; Бейкер и др., 1995; Фаллон и Грин, 1987, 1988; Falloon et al., 1997, 1999; Гудфиннссон и Пресналл, 2000; Жак и Грин, 1980; Такахаши, 1986; Walter and Presnall, 1994), исследователи выделили дивариантное поле, которое характеризуется сосуществованием плагиоклаза и шпинели и демонстрирует непрерывный характер перехода плагиоклаз – шпинель (Green and Falloon, 1998; Green and Hibberson, 1970; Gudfinnsson и др.) Presnall, 2000; Presnall et al., 2002; Walter, Presnall, 1994). Совсем недавно субсолидусные эксперименты в сложной системе TiO 2 -Cr 2 O 3 -Na 2 O-FeO-CMAS количественно ограничили влияние различных валовых составов на место реакции и описали субсолидусный минерал. вариации состава в результате распределения Na и Ca между плагиоклазом и клинопироксеном и распределения Cr, Al между пироксенами и шпинелью (Borghini et al., 2010). В частности, местоположение перехода описывается двумя химическими объемными параметрами: объемным соотношением Na / Ca и объемным X Cr (X Cr = Cr / Cr + Al), который описывает степень обеднения мантия рок. В то время как более высокое содержание Na в совокупной композиции увеличивает стабильность плагиоклаза, следовательно, сдвигая переход в сторону более высокого давления, увеличение содержания Cr в совокупной композиции снижает стабильность плагиоклаза по сравнению со шпинелью. В результате объемные композиции с более высокими нормативными отношениями хромшпинелида / анортита будут приводить к богатым хромом шпинелям и границе выхода плагиоклаза при все более низких давлениях.Имеющиеся экспериментальные данные в сложных системах подтверждают эту тенденцию ( Рисунок 5 ).
Рис. 5. Переход плагиоклаз – шпинель в сложных составах: бледно-голубой: MORB Pyrolite (MPY), Niida and Green (1999); пунктирно-серый: гавайский пиролит — HPY, зеленый и рингвуд (1970); черный: лерцолит в системе CaO-MgO-Al_2O_3-SiO_2 (Lherz) Presnall et al. (1979); красный: плодородный лерцолит (FLZ), Borghini et al. (2010); зеленое яблоко: обедненный лерцолит (DLZ), Borghini et al. (2010); пунктирный окер: фертильный лерцолит с высоким содержанием натрия (HNa-FLZ), Fumagalli et al.(2011). Различные объемные составы различаются объемным соотношением Na / Ca и объемным соотношением X Cr (X Cr = Cr / (Cr + Al): Пресналл и др. (1979) исследовали систему без хрома с наименьшим объемным содержанием Na Отношение O / CaO 2 . FLZ, HNa-FLZ, MPY и HPY имеют одинаковый объемный X Cr , но увеличиваются значения отношения Na 2 O / CaO. Обедненный лерцолит имеет такое же соотношение Na 2 O / CaO FLZ, но выше X Cr .
Экспериментально полученные данные также подтверждаются встречающимися в природе мантийными породами ( Рисунок 1 (b) ).Большинство мелководных ксенолитов мантии содержат как шпинель, так и плагиоклаз (Sen, 1988; Zipfel, Worner, 1992). Полевые исследования перидотитов плагиоклаза из орогенных массивов (Furusho, Kanagawa, 1999; Newman et al., 1999; Ozawa, Takahashi, 1995) документально подтвердили систематическое увеличение содержания анортита от ядра к краю единичных кристаллов плагиоклаза (так называемого « обратного зонирование ‘) и интерпретировал это как результат непрерывной субсолидусной реакции между двумя пироксенами и шпинелью, вызванной прогрессирующей декомпрессией и поднятием перидотитов (Newman et al., 1999; Одзава и Такахаши, 1995).
Одно из основных применений таких экспериментальных результатов связано с тем фактом, что они позволяют оценить историю давления, которому перидотиты подверглись во время их подъема в условиях растяжения. Это позволяет реконструировать историю эксгумации верхней литосферной мантии, как было недавно показано Borghini et al. (2011). Однако наблюдаемые изменения в химическом составе минералов всех сосуществующих фаз в поле стабильности плагиоклаза и непрерывный характер перехода дополнительно предполагают, что в результате условия баланса массы модальные пропорции минералов также должны измениться.Borghini et al. (2010) количественно исследовали прогрессирующее уменьшение модального плагиоклаза с увеличением давления до границы выхода плагиоклаза в плодородном и обедненном валовом составе. Они обнаружили, что содержание модального плагиоклаза варьировалось от 8,8 до 4,8 мас.% При 0,3–0,8 ГПа в составе FLZ и от 5 до 3,2 мас.% При примерно 0,3–0,7 ГПа в DLZ. Эти модальные содержания более чем на 60% ниже, чем количества плагиоклаза, предсказанные простыми термодинамическими моделями, которые обычно используются при моделировании фазовых равновесий в самой верхней части литосферной мантии (например,г., Симон, Подладчиков, 2008; Вуд и Юэн, 1983). С другой стороны, следует также отметить, что модальный плагиоклаз, обнаруженный в экспериментах, вероятно, представляет собой завышенную оценку по сравнению с естественными проявлениями, где перекристаллизация при низком давлении обычно ограничивается дискретными микроструктурными областями между порфирокластическими минералами шпинельной фации (Cannat and Seyler , 1995; Fabries et al., 1998; Hoogerduijn Strating et al., 1993; Montanini et al., 2006; Newman et al., 1999; Obata, 1980; Ozawa and Takahashi, 1995; Rampone et al., 1993, 1995, 2005; Takazawa et al., 1996). С другой стороны, более высокие содержания плагиоклаза ожидаются в природных перидотитах, которые отнесены к реакции расплав – порода. В этих случаях модальное содержание плагиоклаза будет недооценено, что приведет к недооценке влияния мод плагиоклаза на профиль плотности и сейсмические свойства этих пород.
Валентные электроны — химия | Сократик
валентный электрон — это электроны во внешней электронной оболочке атома.6 # конфигурация.
В каждой группе металлов реакционная способность возрастает по мере того, как вы спускаетесь по группе.
Валентные электроны менее тесно связаны и их легче удалить, поскольку они находятся дальше от ядра атома.
НЕМЕТАЛЛЫ
Неметалл имеет тенденцию притягивать дополнительные валентные электроны для достижения полной валентной оболочки.
Он может либо делить электроны с соседним атомом, чтобы образовать ковалентную связь, либо он может удалять электроны из другого атома, чтобы сформировать ионную связь.»-«#, и т.д.).
Для образования ковалентной связи один электрон от галогена и один электрон от другого атома образуют общую пару (например, в # «H – F» # тире обозначает общую пару валентных электронов, один из # «H» # и один из # «F» #).
Внутри каждой группы неметаллов реакционная способность уменьшается сверху вниз, потому что валентные электроны имеют все более высокие энергии, и атомы не получают большой стабильности за счет приобретения электронов.
Фактически, кислород (самый легкий элемент в группе 16) более реакционноспособен, чем хлор, хотя он и не является галогеном, потому что валентные электроны кислорода расположены ближе к ядру (с меньшей энергией).»-» #.
Числа окисления
Числа окисленияЧисло окисления
Часто бывает полезно следить за химическими реакциями, наблюдая за изменениями в окислении. количество атомов в каждом соединении во время реакции. Показатели окисления также играют важную роль. важную роль в систематической номенклатуре химических соединений. По определению окисление число атома — это заряд, который атом имел бы, если бы соединение состояло из ионы.
1. Степень окисления атома равна нулю в нейтральном веществе, содержащем атомы. всего одного элемента. Таким образом, атомы в O 2 , O 3 , P 4 , S 8 , и металлический алюминий имеют степень окисления 0.
2. Степень окисления простых ионов равна заряду иона. Окисление количество натрия в ионе Na + равно +1, например, а степень окисления хлор в ионе Cl — равен -1.
3. Степень окисления водорода равна +1, когда он сочетается с неметаллом как в CH 4 , NH 3 , H 2 O и HCl.
4. Степень окисления водорода равна -1, когда он сочетается с металлом как дюймов LiH, NaH, CaH 2 и LiAlH 4 .
5. Металлы в группе IA образуют соединения (такие как Li 3 N и Na 2 S). в котором атом металла имеет степень окисления +1.
6. Элементы Группы IIA образуют соединения (такие как Mg 3 N 2 и CaCO 3 ), в котором атом металла имеет степень окисления +2.
7. Кислород обычно имеет степень окисления -2. Исключения включают молекулы и многоатомные ионы, которые содержат связи O-O, такие как O 2 , O 3 , H 2 O 2 , и ион O 2 2-.
8.Элементы в группе VIIA часто образуют соединения (такие как AlF 3 , HCl и ZnBr 2 ), в котором неметалл имеет степень окисления -1.
9. Сумма степеней окисления нейтрального соединения равна нулю.
H 2 O: 2 (+1) + (-2) = 0
10. Сумма степеней окисления многоатомного иона равна заряду на ион. Степень окисления атома серы в ионе SO 4 2- должна быть +6, например, потому что сумма степеней окисления атомов в этом ионе должна равно -2.
SO 4 2- : (+6) + 4 (-2) = -2
11. Элементы в нижнем левом углу таблицы Менделеева. с большей вероятностью будут иметь положительную степень окисления, чем те, которые расположены в правом верхнем углу угол стола. Сера имеет положительную степень окисления в SO 2 , для Например, потому что он ниже кислорода в периодической таблице.
СО 2 : (+4) + 2 (-2) = 0
Тенденции в области энергии ионизации | Grandinetti Group
Энергия ионизации атома — это количество энергии , необходимое для удаления электрона из газообразной формы этого атома или иона.
1 st энергия ионизации — Энергия, необходимая для удаления электрона с наивысшей энергией из нейтрального газообразного атома.
Например:
| Na (г) → Na + (г) + е — | I 1 = 496 кДж / моль |
Обратите внимание, что энергия ионизации положительна. Это потому, что требуется энергии для удаления электрона.
2 nd энергия ионизации — Энергия, необходимая для удаления второго электрона из однозарядного газообразного катиона.
Например:
| Na + (г) → Na 2+ (г) + е — | I 2 = 4560 кДж / моль |
Энергия второй ионизации почти в в десять раз больше энергии первой, потому что количество электронов, вызывающих отталкивание, уменьшается.
3 rd энергия ионизации — Энергия, необходимая для удаления третьего электрона из двухзарядного газообразного катиона.
Например:
| Na 2+ (г) → Na 3+ (г) + е — | I 3 = 6913 кДж / моль |
Третья энергия ионизации даже больше второй.
Энергии последовательной ионизации увеличиваются по величине, потому что количество электронов, вызывающих отталкивание, неуклонно уменьшается. Это не плавная кривая. После того, как атом потерял валентные электроны, происходит большой скачок энергии ионизации.Атом, имеющий такую же электронную конфигурацию, что и благородный газ, действительно будет удерживать свои электроны. Таким образом, количество энергии, необходимое для удаления электронов за пределами валентных электронов, значительно превышает энергию химических реакций и связывания. Таким образом, только валентные электроны (, т. Е. , электроны за пределами ядра благородного газа) участвуют в химических реакциях.
Энергии ионизации конкретного атома зависят от среднего расстояния электрона от ядра и эффективного заряда ядра
Эти факторы можно проиллюстрировать следующими тенденциями:
1 st энергия ионизации уменьшается вниз по группе.
Это связано с тем, что электроны с наивысшей энергией в среднем находятся на дальше от ядра. По мере увеличения главного квантового числа размер орбитали увеличивается, и электрон легче удалить.
Примеры:
I 1 (Na)> I 1 (Cs)
I 1 (Cl)> I 1 (I)
1 st энергия ионизации увеличивается за период.
Это связано с тем, что электроны в одной и той же основной квантовой оболочке не полностью экранируют увеличивающийся ядерный заряд протонов.Таким образом, электроны удерживаются более плотно и требуют больше энергии для ионизации.
Примеры:
I 1 (Cl)> I 1 (Na)
Я 1 (S)> Я 1 (Мг)
График зависимости энергии ионизации от атомного номера не идеален, потому что есть исключения из правил, которые легко объяснить.
Заполненные и наполовину заполненные подоболочки показывают небольшое повышение стабильности, так же как заполненные оболочки показывают повышенную стабильность.Итак, при попытке удалить электрон из одной из этих заполненных или наполовину заполненных подоболочек обнаруживается немного более высокая энергия ионизации.
Пример 1:
Я 1 (Ве)> Я 1 (В)
Ионизировать электрон из бериллия труднее, чем из бора, потому что бериллий имеет заполненную s-подоболочку.
Пример 2:
I 1 (N)> I 1 (O)
Азот имеет наполовину заполненную подоболочку «2p», поэтому ионизовать электрон из азота труднее, чем из кислорода.
Какой элемент имеет более высокую энергию ионизации, цинк или галлий?
.

 название
название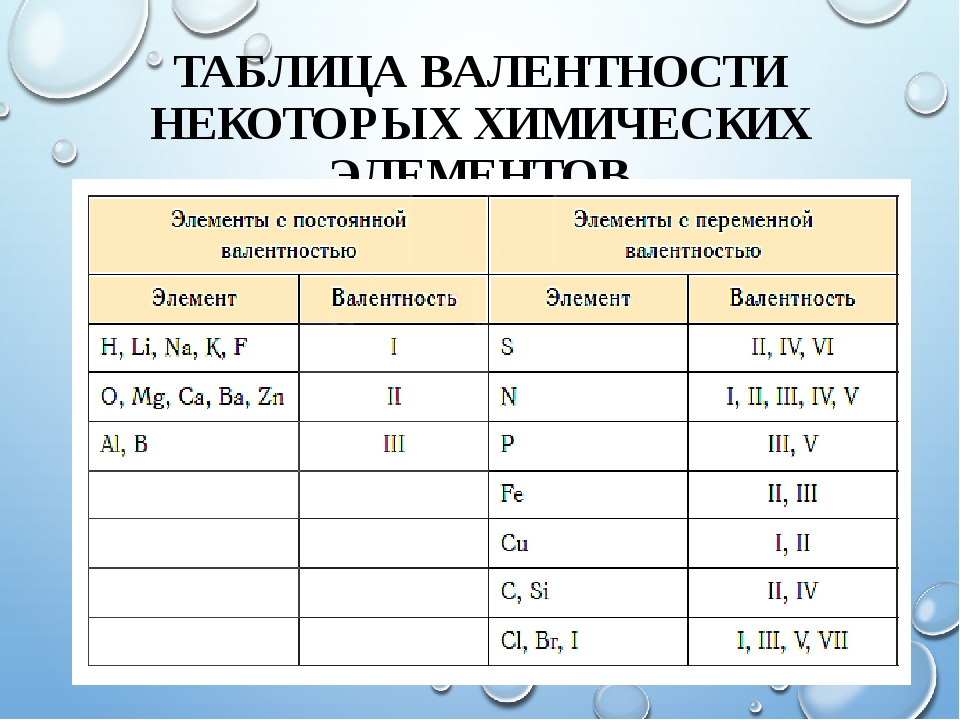 Максимальная и минимальная валентность.
Максимальная и минимальная валентность. 

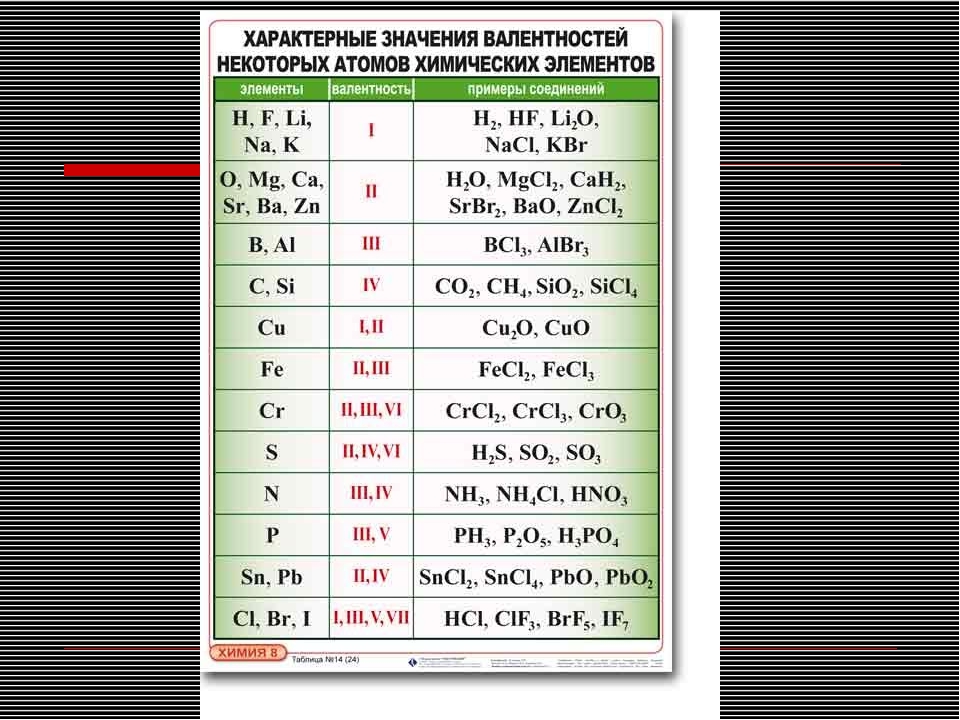



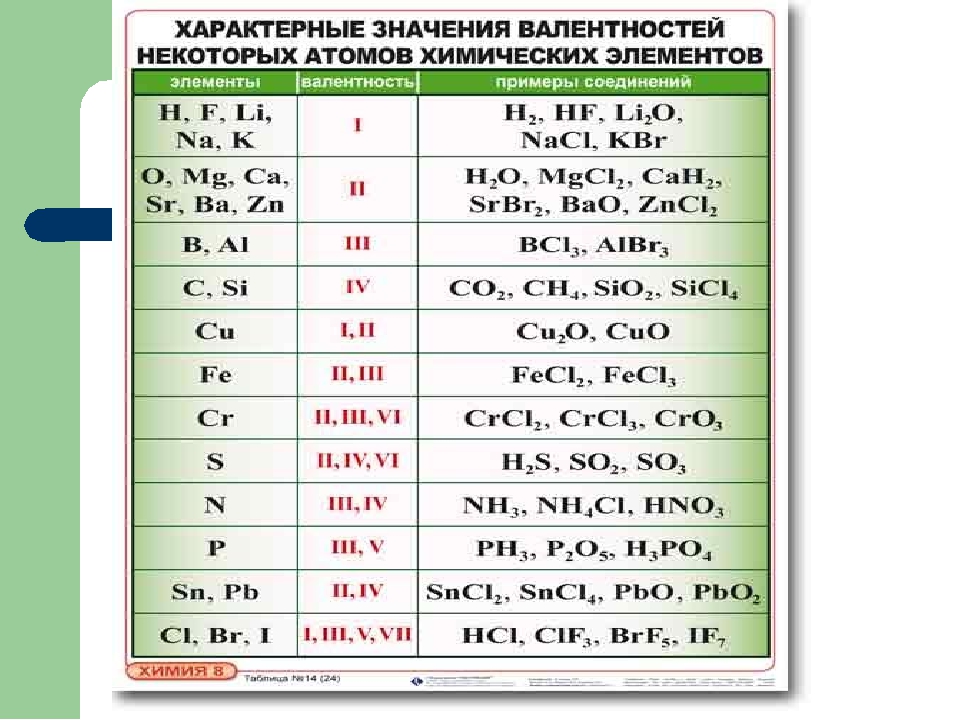
 Характеризуется единственно возможным значением валентности, совпадающим с номером группы в Периодической таблице Д.И. Менделеева, в которой он расположен, т.е. валентность кальция равна II. Ответ неверный.
Характеризуется единственно возможным значением валентности, совпадающим с номером группы в Периодической таблице Д.И. Менделеева, в которой он расположен, т.е. валентность кальция равна II. Ответ неверный.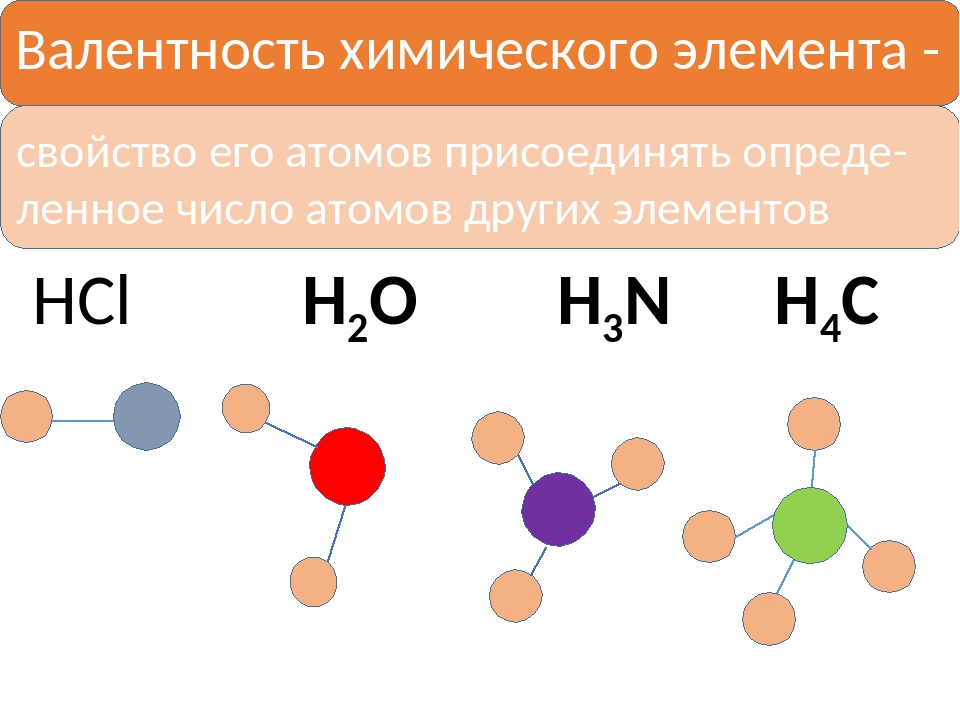 е. валентность бериллия равна II. Ответ неверный.
е. валентность бериллия равна II. Ответ неверный.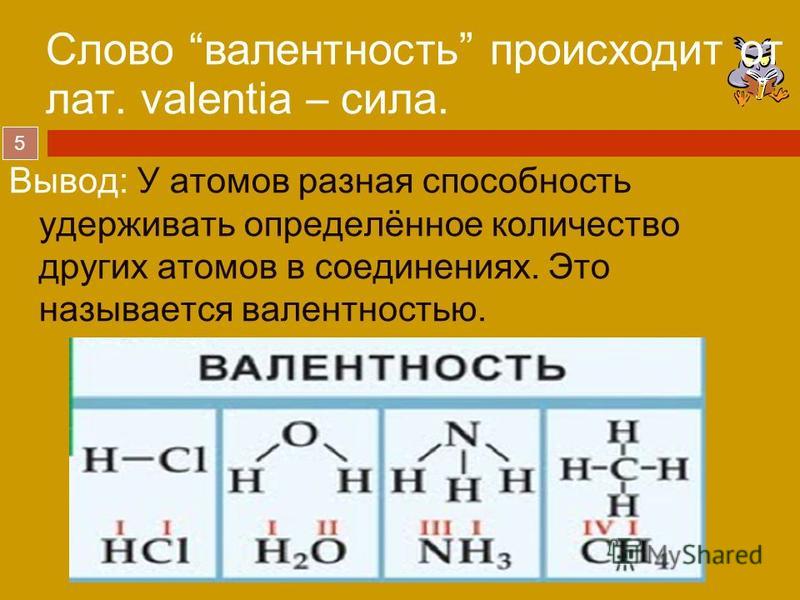 Химические элементы с переменной валентностью
Химические элементы с переменной валентностью