| 1. |
Понятие о скорости реакции
Сложность: лёгкое |
1 |
| 2. |
Закон действия масс
Сложность: лёгкое |
1 |
3.
|
Влияние температуры и катализаторов на скорость химической реакции
Сложность: среднее |
2 |
| 4. |
Гомогенный и гетерогенный катализ
Сложность: среднее |
2 |
5. |
Расчёт скорости реакции
Сложность: сложное |
4 |
| 6. |
Расчёт изменения скорости реакции по закону действия масс
Сложность: сложное |
4 |
7.
|
Расчёт изменения скорости реакции по закону действия масс с твёрдым веществом
Сложность: сложное |
4 |
| 8. |
Расчёт изменения скорости реакции по правилу Вант-Гоффа
Сложность: сложное |
4 |
Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
Как вы работаете?
Вам нужно написать сообщение в WhatsApp . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Как оплатить заказ?Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.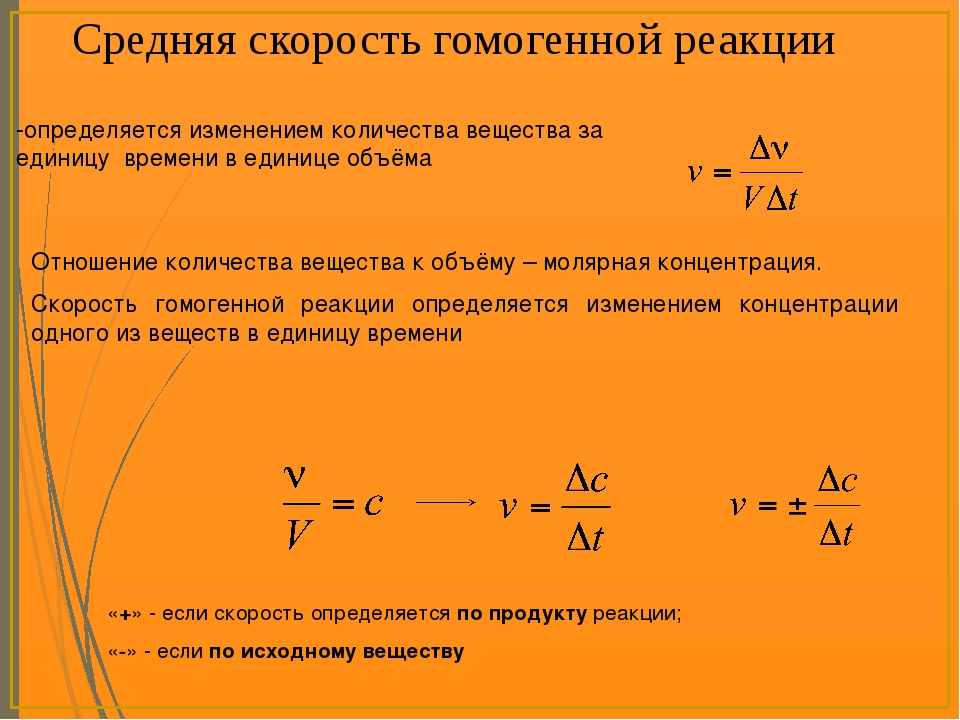
В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Whatsapp или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
Измерение скоростей химических реакций — Справочник химика 21
Во многих случаях результаты измерений скорости химической реакции можно представить, используя тщательно подобранные функ ции температуры и состава реакционной смеси, выраженного через концентрации. Такие выражения не обязательно отражают механизм изучаемой реакции, хотя форма их зачастую прямо или косвенно подтверждает определенный механизм. [c.30] Назвать наиболее распространенные способы измерения скорости химических реакций, используемые в кинетических методах анализа. [c.158]
[c.158]
Суш,ествуют два основных метода измерения скорости химических реакций динамический и статический. Динамический метод может быть пояснен схемой, представленной на рис. XVI. 1. [c.319]
Таким образом, скорость реакции образования воды из элементов сильно зависит от внешних условий. Для возможности количественного изучения этой зависимости необходимо прежде всего уточнить сами единицы измерения. Скорость химической реакции характеризуется изменением концентраций реагирующих веществ (или продуктов реакции) за единицу времени. Концентрацию чаще всего выражают числом молей в литре, время — секундами, минутами и т. д., в зависит мости от скорости данной реакции. [c.122]
Таким образом, для измерения скорости химических реакций могут быть использованы самые разнообразные физические и химические методы исследования. [c.108]
Современная химическая кинетика немыслима без применения разнообразных физико-химических методов исследования. Простые методы измерения скорости химических реакций позволили в свое время развить феноменологическую химическую кинетику. Использование новых методов исследования, позволивших изучать быстропротекающие процессы и лабильные промежуточные продукты, показало, что механизмы химических реакций являются весьма разнообразными и подчас достаточно сложными. Только изучая природу и свойства промежуточных продуктов, удается понять механизмы и закономерности химических реакций и научиться управлять ими. [c.3]
Простые методы измерения скорости химических реакций позволили в свое время развить феноменологическую химическую кинетику. Использование новых методов исследования, позволивших изучать быстропротекающие процессы и лабильные промежуточные продукты, показало, что механизмы химических реакций являются весьма разнообразными и подчас достаточно сложными. Только изучая природу и свойства промежуточных продуктов, удается понять механизмы и закономерности химических реакций и научиться управлять ими. [c.3]
Каталитические методы анализа основаны на измерении скорости химической реакции (см. гл. 23). [c.26]
Каталитические методы анализа — вариант кинетических методов. Они основаны на измерении скорости химической реакции, протекающей в растворе при действии катализатора нередко катализатор является определяемым веществом. Известно много медленных реакций, скорость которых в определенных условиях увеличивается пропорционально концентрации введенного катализатора. Это дает возможность определить количество катализатора по концентрации продуктов реакции, образующихся за определенный промежуток времени. Для таких определений пригодны медленные реакции различных типов, однако наиболее распространены каталитические методы с использованием реакций окисления — восстановления. [c.446]
Это дает возможность определить количество катализатора по концентрации продуктов реакции, образующихся за определенный промежуток времени. Для таких определений пригодны медленные реакции различных типов, однако наиболее распространены каталитические методы с использованием реакций окисления — восстановления. [c.446]
ЧТО ДАЕТ ИЗМЕРЕНИЕ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ [c.327]
На основе таких измерений скорости химической реакции можно получить некоторое представление о том, какими взаимодействиями между молекулами обусловлено ее протекание. Обычный способ записи уравнений химических реакций по существу почти не дает возможности судить о том, как молекулы реагируют друг с другом. Даже для наиболее простых реакций, как, например, [c.223]
Задача кинетического исследования состоит в выяснении влияния таких переменных, как концентрация реагента и температура, на скорость химической реакции. Для измерения Скорости химических реакций используют многие физические и химические методы. Эти методы можно разделить на две группы. [c.381]
Для измерения Скорости химических реакций используют многие физические и химические методы. Эти методы можно разделить на две группы. [c.381]
Кинетический метод был также применен для идентификации пиков анализируемых соединений на основе точного измерения скоростей химических реакций диенов с хлормалеиновым ангидридом. На рис. 7 приведены кинетические данные для реакции изопрена и трансЛ, 3-пентадиена на колонке с хлормалеиновым ангидридом. Кинетические прямые построены на основании изучения реакций с чистыми известными соединениями. Экспериментальные точки соответствуют данным хроматографических опытов, полученным нри анализе неизвестной смеси. Таким образом, на основании хроматографического анализа при двух разных скоростях газа-носителя можно идентифицировать реагирующие соединения на основе скорости их реакции с нелетучим реагентом в реакторе-колонке. [c.36]
Хронопотенциометрические измерения скоростей химических реакций. I. Изучение с программированным током механиз- [c. 151]
151]
При измерении скоростей химических реакций концентрации растворов или газообразных веществ принято выражать в молях на 1 литр, но возможны и другие единицы измерения . Время в зависимости от скорости [c.111]
Скорость химической реакции отнюдь не является однозначной величиной, легко определяемой экспериментально. Для получения результатов, имеющих определенный физический смысл, необходима особая тщательность при постановке и-интерпретации эксперимента. Мы рассмотрим некоторые экспериментальные методы, которые были успешно применены для измерения скоростей химических реакций. Сам исследователь редко может реально оценить успешность своего эксперимента как правило, эксперимент должен пройти проверку временем. Хотя с помощью теории и рассуждения может происходить развитие и модификация выводов, получаемых на основе эксперимента, сам эксперимент можно считать успешным, если данные остаются безупречными. [c.172]
Таким образом, быстрота образования воды из элементов, т. е. скорость реакции, сильно зависит от внешних условий. Для возможности количественного изучения этой зависимости необходимо прежде всего уточнить сами единицы измерения. Скорость химической реакции характеризуется изменением концентраций реагирующих веществ за единицу времени. Концентрацию чаще [c.92]
е. скорость реакции, сильно зависит от внешних условий. Для возможности количественного изучения этой зависимости необходимо прежде всего уточнить сами единицы измерения. Скорость химической реакции характеризуется изменением концентраций реагирующих веществ за единицу времени. Концентрацию чаще [c.92]
Выше было показано, что для определения концентраций катализаторов и других реагирующих веществ необходимо знать скорость индикаторной реакции. Здесь будут рассмотрены существующие и применяющиеся в анализе экспериментальные методы измерения скоростей химических реакций. Подобно тому как в потенциометрическом методе анализа применению индикаторного электрода предшествует по возможности полное изучение его свойств, Б кинетических методах применению определенной индикаторной реакции также должно предшествовать ее подробное изучение и, в частности, выяснение стехиометрии реакции, зависимости скорости реакции от концентрации реагирующих веществ, температуры, присутствия посторонних солей и других факторов. [c.40]
[c.40]
Применение потенциометрического метода измерения скорости химических реакций изучено на реакции окисления тиосульфат-ионов ионами железа (П1), которая катализируется солями меди [c.46]
При полярографическом методе измерения скоростей химических реакций используют зависимость между силой диффузионного тока и концентрацией определяемого вещества. Так, за изменением концентрации хромовой кислоты в процессе ее восстановления можно следить по величине диффузионного полярографического тока [c.46]
Изменение концентрации какого вещества следует взять для измерения скорости химической реакции рассмотрим этот вопрос на конкретном примере окисления иодистого водорода перекисью водорода в водном растворе [c.134]
УСТРОЙСТВО для ТЕРМОМЕТРИЧЕСКОГО ИЗМЕРЕНИЯ СКОРОСТЕЙ ХИМИЧЕСКИХ РЕАКЦИИ НА ОСНОВЕ ТЕРМОЧУВСТВИТЕЛЬНЫХ КВАРЦЕВЫХ РЕЗОНАТОРОВ [c.96]
Известные устройства для термометрического измерения скоростей химических реакций, в которых в качестве датчиков температуры используются термисторы [1—3], обладают существенными недостатками. К числу таких недостатков прежде всего относится присущий термисторам эффект старения, резко снижающий надежность измерения. Чувствительность измерения температуры с помощью термистора не превышает 5.10 К- Дальнейшее увеличение чувствительности связано со значительным усложнением и удорожанием измерительной аппаратуры [4]. Значительная величина мощности, рассеиваемой на термисторе (10 вт) приводит к дополнительной погрешности измерения. Отсюда вытекает необходимость применения для термометрического измерения скоростей химических реакций датчиков, свободных от указанных недостатков. [c.96]
К числу таких недостатков прежде всего относится присущий термисторам эффект старения, резко снижающий надежность измерения. Чувствительность измерения температуры с помощью термистора не превышает 5.10 К- Дальнейшее увеличение чувствительности связано со значительным усложнением и удорожанием измерительной аппаратуры [4]. Значительная величина мощности, рассеиваемой на термисторе (10 вт) приводит к дополнительной погрешности измерения. Отсюда вытекает необходимость применения для термометрического измерения скоростей химических реакций датчиков, свободных от указанных недостатков. [c.96]
Еще не так давно измерения скоростей химических реакций в силу недостаточного развития методов эксперимента и теоретических представлений могли служить лишь вспомогательным средством для воссоздания картины химических взаимодействий. Дальнейшее становление физической химии и смежных областей отчетливо показало, что исследования скоростей реакций и выявление общих закономерностей химических превращений во времени должны занимать одно из центральных мест.
 Обобщение законов скоростей химических реакций, повышение уровня кинетического эксперимента с повсеместным проникновением кинетических исследований вместе с возникновением новых представлений о природе и характере химических превращений способствовали формированию химической кинетики как науки (хотя и являющейся разделом физической химии). [c.8]
Обобщение законов скоростей химических реакций, повышение уровня кинетического эксперимента с повсеместным проникновением кинетических исследований вместе с возникновением новых представлений о природе и характере химических превращений способствовали формированию химической кинетики как науки (хотя и являющейся разделом физической химии). [c.8]Отсюда следует, что химическую кинетику можно рассматривать как науку о закономерностях скоростей химических процессов с учетом их механизмов. Основными методами химической кинетики являются измерения скоростей химических реакций и выяснение зависимости этих скоростей от различных факторов. Кинетика гетерогенных каталитических реакций — это применение законов и методов химической кинетики к исследованию закономерностей гетерогенного катализа в свете его специфики. [c.9]
Важно отметить, что определяемая таким путем скорость реакции ограничивается в значительной степени скоростью самой медленной из последовательных ее составляющих стадий. Это ограничение подобно тому, из-за которого средняя скорость движения автомобиля по шоссе определяется не мощностью его мотора и его максимальной скоростью, а пропускной способностью в узких местах — на переездах, мостах и т. п., где происходит скопление транспорта. В сочетании с другими физическими методами измерения скоростей химических реакций дают возможность установить природу промежуточных превращений и узких мест . [c.166]
Это ограничение подобно тому, из-за которого средняя скорость движения автомобиля по шоссе определяется не мощностью его мотора и его максимальной скоростью, а пропускной способностью в узких местах — на переездах, мостах и т. п., где происходит скопление транспорта. В сочетании с другими физическими методами измерения скоростей химических реакций дают возможность установить природу промежуточных превращений и узких мест . [c.166]
В книге подробно описаны существующие экспериментальные методы измерения скоростей химических реакций (включая быстрые реакции) и методы определения концентрации различных веществ (включая катализаторы) на основании кинетических данных. [c.6]
Чтобы определить концентрацию реагента кинетическим методом, описываемым в этой книге, в большинстве случаев должна быть измерена скорость химической реакции. Для измерения скорости химической реакции концентрация, по крайней мере одного из реактантов или продукта реакции, по которому следят за скоростью реакции, должна быть прослежена как функция времени. Для этого применяется физический или химический метод анализа, позволяющий следить за изменением концентраций реактантов или продуктов реакции во времени. Если выбран химический метод, то реакции должны быть достаточно медленными, а в некоторых случаях может быть [c.15]
Для этого применяется физический или химический метод анализа, позволяющий следить за изменением концентраций реактантов или продуктов реакции во времени. Если выбран химический метод, то реакции должны быть достаточно медленными, а в некоторых случаях может быть [c.15]
После выбора индикаторной реакции следует избрать, сам метод определения концентрации данного вещества-Самый простой способ, казалось бы, должен заключаться в прямом и непосредственном измерении скорости химической реакции, в применении какого-то своеобразного химического спидометра — ведь именно по величине скорости можно судить о концентрации данного вещества в растворе. Однако найти такой химический спидометр нелегко. Известны, пожалуй, только две возможности прямого измерения скорости химической реакции. [c.52]
ИЗМЕРЕНИЕ СКОРОСТЕЙ ХИМИЧЕСКИХ РЕАКЦИЙ [c.401]
Для экспериментального измерения скорости химических реакций необходимо иметь данные о количестве или концентрации [c. 394]
394]
Из определения следует, что единицей измерения скорости химической реакции является 1 моль/с. В дальнейшем для краткости индекс реагента или продукта (А, О) будет опускаться, но из текста ясно, по какому веществу определяется скорость реакции. [c.398]
Небольшие системы реакторов с мешалками непрерывного действия обычно применяют для изучения кинетики химических реакций. Денбиг и Пейдж [3] описывают проточный метод, использованный для исследования химических реакций, когда среднее время пребывания в сосуде составляло от 1 до 4000 секунд. Этот ]четод особенно ценен для исследования довольно быстрых реакций. Метод основан на измерении скорости химической реакции при различных скоростях потока жидкости в условиях стационарных режимов. [c.106]
Лэйдлер, посвятивший ряд своих работ исследованию влияния давления на реакции, протекающие с участием ферментов, писал в своей книге Химическая кинетика действия энзимов [87] Измерение скоростей химических реакций в растворе при различных гидростатических давлениях позволяет получить весьма ценную информацию о природе этих реакций. К несчастью, изучение этих эффектов еще находится в начальной стадии, и даже среди небиологических систем лишь немногие были исследованы с этой точки зрения. Однако имеющиеся ограниченные данные предоставили некоторые интересные сведения . В цитируемой книге и в несколько более ранней монографии Джонсона, Эйринга и Полиссара [88] собран и обобщен практически весь имевшийся к тому времени экспериментальный материал по применению давления для изучения действия ферментов. [c.236]
К несчастью, изучение этих эффектов еще находится в начальной стадии, и даже среди небиологических систем лишь немногие были исследованы с этой точки зрения. Однако имеющиеся ограниченные данные предоставили некоторые интересные сведения . В цитируемой книге и в несколько более ранней монографии Джонсона, Эйринга и Полиссара [88] собран и обобщен практически весь имевшийся к тому времени экспериментальный материал по применению давления для изучения действия ферментов. [c.236]
На наших глазах совершенствуется и техника кинетических методов анализа. Мь1 уже говорили о желательности создания химического спидометра . Ведь пока число способов измерения скорости химических реакций довольно ог- раниченно измеряется в основном скорость тех химических процессов, при которых изменяется окраска раствора. Между тем огромное количество каталитических реакций протекает в растворах без всяких видимых изменений появляются или исчезают вещества неокрашенные. В таких случаях могут оказаться полезными потенциометрические методы измерения концентрации, кондуктометрические, полярографические и многие другие. Уходят в прошлое те времена, когда химик-аналитик с секундомером в руках регистрировал происходящие в растворе изменения. Теперь в его распоряжение предоставлены приборы, автоматически регистрирующие на специальном графике изменение концентрации вещества во времени. Но, может быть, в самом недалеком будущем появятся приборы, выдающие [c.99]
Уходят в прошлое те времена, когда химик-аналитик с секундомером в руках регистрировал происходящие в растворе изменения. Теперь в его распоряжение предоставлены приборы, автоматически регистрирующие на специальном графике изменение концентрации вещества во времени. Но, может быть, в самом недалеком будущем появятся приборы, выдающие [c.99]
Отсутсвуют указания на способ измерения скорости химической реакции [c.73]
Experimental Techniques to Measure Reaction Rates | Chemistry
13.2: Измерение скорости реакции
Поляриметрия находит применение в химической кинетике для измерения концентрации и реакции кинетики оптически активных веществ во время химической реакции. Оптически активные вещества обладают способностью вращать плоскость поляризации проходящего через них света с линейной поляризацией, что называется оптическим вращением. Оптическая активность связана с молекулярной структурой веществ. Нормальный монохроматический свет неполяризован и обладает колебаниями электрического поля во всех возможных плоскостях, перпендикулярных направлению его распространения. Когда неполяризованный свет проходит через поляризатор, возникает линейно поляризованный свет, который поддерживает колебания в одной плоскости.
Нормальный монохроматический свет неполяризован и обладает колебаниями электрического поля во всех возможных плоскостях, перпендикулярных направлению его распространения. Когда неполяризованный свет проходит через поляризатор, возникает линейно поляризованный свет, который поддерживает колебания в одной плоскости.
Поляриметрический прибор определяет направление поляризации света или вращения, производимого оптически активным веществом. В поляриметре поляризованный свет вводится в трубку, содержащую раствор-сигнал реакции, и реакция может быть выполнена без нарушения работы системы. Если образец содержит оптически неактивные вещества, ориентация плоскости поляризованного света не изменится. Свет будет виден на экране анализатора с одинаковой интенсивностью, а угол поворота (ɑ) будет равен нулю градусам.
Однако наличие оптически активных соединений в реагирующей пробе вызывает вращение плоскости проходящего через поляризованный свет. Свет, выходящее наружу, будет менее ярким. Для наблюдения за максимальной яркостью оси анализатора необходимо повернуть по часовой стрелке (декстраторатриаторное) или против часовой стрелки (левиотаторирующее). Направление вращения анализатора зависит от характера вещества. Измеряемое оптическое вращение пропорционально концентрации оптически активных веществ, присутствующих в образце. Анализируя угол измерения вращения в разных временных точках, концентрации оптически активных соединений можно определить как функцию времени.
Для наблюдения за максимальной яркостью оси анализатора необходимо повернуть по часовой стрелке (декстраторатриаторное) или против часовой стрелки (левиотаторирующее). Направление вращения анализатора зависит от характера вещества. Измеряемое оптическое вращение пропорционально концентрации оптически активных веществ, присутствующих в образце. Анализируя угол измерения вращения в разных временных точках, концентрации оптически активных соединений можно определить как функцию времени.
Спектрометрия
Оптические экспериментальные методы, такие как спектрометрия, также часто используются для мониторинга химических реакций и получения количественных данных о кинетике реакции. С помощью спектрометрии свет определенной длины волны проходит через реагирующий образец. Молекулы или соединения (реагент или продукт) внутри образца могут поглощать некоторое количество света, передавая оставшееся количество, которое измеряется детектором. Количество поглощенного света зависит от концентрации интересующей смеси или молекулы. Например, чем выше концентрация вещества, тем больше его поглощение. Из поглощения прибор сможет определить концентрацию интересующей смеси. В реакционной пробе поглощение, измеряемое через определенные промежутки времени, вычисляет концентрацию реагент или продукта в зависимости от времени.
Например, чем выше концентрация вещества, тем больше его поглощение. Из поглощения прибор сможет определить концентрацию интересующей смеси. В реакционной пробе поглощение, измеряемое через определенные промежутки времени, вычисляет концентрацию реагент или продукта в зависимости от времени.
Измерения давления
При реакциях, связанных с газфазными веществами, за реакционной кинетикой следует количественная оценка изменений в количестве молекул газов в зависимости от изменений давления. Экспериментальные настройки газовой фазовой реакции могут быть подключены к манометру, который может измерять давление газообразного реагент или продукта. По мере развития реакции давление реагенты снижается, и (или) давление продуктов увеличивается. Это может быть измерено манометром в зависимости от времени. Используя идеальный закон о газе, концентрация газа пропорциональна ее частичному давлению, можно рассчитать скорость химической реакции.
Как измерить скорость реакции? + Пример
Скорость реакции можно определить либо по скорости потребления реагента, либо по скорости образования продукта.
В следующих двух примерах я покажу вам, как это можно сделать, и приложу к экспериментам соответствующие видео.
Пример 1:
Рассмотрим реакцию металлического магния с водным раствором соляной кислоты.
Реакция следующая:
#Mg(т)+2HCl(водн.)->MgCl_2(водн.)+H_2(г)#
Самый простой способ следить за ходом этой реакции — собрать образовавшийся газообразный водород и рассчитать его количество, например, по объему.
Дифференциальный закон скорости этой реакции можно записать так:
#R=(Дельта[H_2])/(Дельта)#
, поскольку #[H_2]# обратно пропорционально объему (#V#) произведенного водорода, тогда скорость может быть записана как:
#R=(ДельтаV_(H_2))/(Дельта)#
, измеряя объем водорода, образующегося с течением времени, мы можем рассчитать скорость этой реакции.
Подробности в следующем видео:
Лабораторный эксперимент №19: Влияние концентрации на скорость реакции. +])/(Дельтат)#
+])/(Дельтат)#
Подробности в следующем видео:
Химическое исследование AP #11: Закон скорости выцветания кристаллического фиолетового.
Чтобы узнать больше о теории, связанной с этой темой, вы можете посмотреть следующий видеоурок, который является одним из серии из 6 видеороликов:
Химическая кинетика | Скорость реакции и закон скорости.
2.1.2: Измерение скорости реакции — Химия LibreTexts
Метод определения скорости реакции относительно прост.Поскольку скорость реакции основана на изменении во времени, ее необходимо определить из табличных значений или найти экспериментально. По полученным данным можно рассчитать скорость реакции либо алгебраически, либо графически. Далее следует общее руководство и примеры измерения скорости реакции.
Далее следует общее руководство и примеры измерения скорости реакции.
Введение
Легко измерить изменение времени; достаточно секундомера или любого другого устройства для измерения времени. Однако определение изменения концентрации реагентов или продуктов требует более сложных процессов.Изменение концентрации в системе, как правило, может быть получено двумя способами:
- Путем наблюдения за истощением реагента во времени или
- Путем наблюдения за образованием продукта во времени
Методы измерения концентрации
- Для газов , экспериментаторы используют бюретку для измерения изменения объема, производимого в разное время. Затем они связывают эти объемы с изменениями концентрации.
- Химики также могут отбирать небольшие образцы реакционной смеси в разное время и анализировать концентрацию с помощью титрования.
- Дополнительные методы включают использование спектрофотометра для определения концентрации по закону Бера.
 Или более продвинутые методы для очень быстрых реакций используют компьютеры, подключенные к передовой лазерной технологии, такой как лазерный магнитный резонанс (LMR).
Или более продвинутые методы для очень быстрых реакций используют компьютеры, подключенные к передовой лазерной технологии, такой как лазерный магнитный резонанс (LMR).
Для получения дополнительной информации, касающейся измерения скорости реакции, такой как концентрация реагентов, роль катализаторов, характеристики скорости химической реакции.
Измерение реагентов в сравнении с продуктом
Не имеет значения, контролирует ли экспериментатор реагенты или продукты, потому что это не влияет на общую реакцию.Однако, поскольку реагенты уменьшаются во время реакции, а продукты увеличиваются, между двумя скоростями есть разница в знаках. Концентрация реагента уменьшается по мере протекания реакции, что дает отрицательное число для изменения концентрации. Продукты, с другой стороны, увеличивают концентрацию со временем, давая положительное число. Поскольку принято выражать скорость реакции положительным числом, для решения задачи установите общую скорость реакции равной отрицательному значению скорости исчезновения реагента. Общая скорость также зависит от стехиометрических коэффициентов.
Общая скорость также зависит от стехиометрических коэффициентов.
Следует отметить, что процесс измерения концентрации можно значительно упростить, используя различные физические или химические свойства (т. е. разность фаз, восстановительный потенциал и т. д.) реагентов или продуктов, участвующих в реакции, с помощью вышеуказанные методы. Мы подчеркивали важность учета знака реакции для получения положительной скорости реакции. Теперь обратим внимание на важность стехиометрических коэффициентов.
Уникальная средняя скорость реакции
Скорость реакции может отображаться совершенно по-разному в зависимости от того, какой продукт или реагент выбран для мониторинга.
Учитывая реакцию:
\[ aA+bB \rightarrow cC + dD \]
скорость реакции = \( — \dfrac{1}{a}\dfrac{ \Delta [A]}{ \Delta t } = — \dfrac{1}{b} \dfrac{\Delta [B]}{\Delta t} = \dfrac{1}{c}\dfrac{ \Delta [C]}{\Delta t} = \ dfrac{1}{d}\dfrac{ \Delta [D]}{\Delta t} \)
Эту формулу также можно записать в виде:
скорость реакции = \( — \dfrac{1}{a} \) (скорость исчезновения A)
= \( — \dfrac{1}{b} \) (скорость исчезновения B)
= \( \dfrac{1}{c} \) (скорость исчезновения образование C)
= \( \dfrac{1}{d} \) (скорость образования D)
Даже если концентрации A, B, C и D могут изменяться с разной скоростью, существует только одна средняя скорость реакции. Чтобы получить эту уникальную скорость, выберите любую норму и разделите ее на стехиометрический коэффициент. Когда реакция имеет формулу:
Чтобы получить эту уникальную скорость, выберите любую норму и разделите ее на стехиометрический коэффициент. Когда реакция имеет формулу:
\[ C_{R1}R_1 + \dots + C_{Rn}R_n \rightarrow C_{P1}P_1 + \dots + C_{Pn}P_n \]
Общий случай уникальная средняя скорость реакции имеет вид:
скорость реакции = \( — \dfrac{1}{C_{R1}}\dfrac{\Delta [R_1]}{\Delta t} = \dots = — \dfrac {1}{C_{Rn}}\dfrac{\Delta [R_n]}{\Delta t} = \dfrac{1}{C_{P1}}\dfrac{\Delta [P_1]}{\Delta t} = \dots = \dfrac{1}{C_{Pn}}\dfrac{\Delta [P_n]}{\Delta t} \)
Chem4Kids.com: Реакции: Измерение реакций
Ученые любят знать скорости реакций. Им также нравится измерять различные виды ставок. Каждая скорость, которую можно измерить, говорит ученым что-то свое о реакции. Мы собираемся потратить немного времени, чтобы рассмотреть несколько различных показателей скорости реакции.
Скорость прямой реакции: Скорость прямой реакции, когда реагентов объединяются в продуктов .
Скорость обратной реакции: Скорость обратной реакции, когда продукты распадаются на реагенты.
Чистая ставка: Курс вперед минус курс назад.
Средняя скорость: Скорость всей реакции от начала до конца.
Мгновенная скорость: Скорость реакции в один момент времени. Некоторые реакции могут происходить быстро в начале, а затем замедляться. У вас есть одна средняя скорость, но мгновенных ставок могут рассказать вам всю историю.
Ученые измеряют все эти скорости, определяя концентраций молекул в смеси.Если вы узнаете концентрацию молекул в два разных момента времени, вы сможете узнать, в каком направлении движется реакция и с какой скоростью она идет. Даже если концентрации в двух точках измерения равны, ученые все равно чему-то учатся. Если концентрации стабильны в течение двух измерений, реакция находится в точке равновесия.
 Поскольку многие реакции протекают в несколько стадий, необходимо измерять скорость каждой стадии.Всегда будет один шаг, который происходит с самой низкой скоростью. Этот самый медленный шаг называется ограничивающим скорость шагом . Этот ограничивающий скорость этап является единственной реакцией, которая действительно определяет, насколько быстро может протекать общая реакция. Если у вас есть шесть шагов в вашей серии реакций, а третий шаг идет невероятно медленно, это шаг, ограничивающий скорость. Что касается общей реакции, ни одна из других скоростей не имеет значения. Если вы хотите ускорить общую реакцию, сосредоточьтесь на самом медленном шаге.Не забывайте, что если вы ускорите только один шаг, другой шаг может стать новым шагом ограничения скорости. Вы всегда должны понимать, как все этапы участвуют в общей реакции.
Поскольку многие реакции протекают в несколько стадий, необходимо измерять скорость каждой стадии.Всегда будет один шаг, который происходит с самой низкой скоростью. Этот самый медленный шаг называется ограничивающим скорость шагом . Этот ограничивающий скорость этап является единственной реакцией, которая действительно определяет, насколько быстро может протекать общая реакция. Если у вас есть шесть шагов в вашей серии реакций, а третий шаг идет невероятно медленно, это шаг, ограничивающий скорость. Что касается общей реакции, ни одна из других скоростей не имеет значения. Если вы хотите ускорить общую реакцию, сосредоточьтесь на самом медленном шаге.Не забывайте, что если вы ускорите только один шаг, другой шаг может стать новым шагом ограничения скорости. Вы всегда должны понимать, как все этапы участвуют в общей реакции.
Странное пламя на МКС (видео Science@NASA)
7.3 Измерение скорости реакции | Скорость и степень реакции
7.
 3 Измерение скорости реакции (ESCN3)
3 Измерение скорости реакции (ESCN3)
То, как измеряется средняя скорость реакции, будет зависеть от того, что это за реакция, какова являются реагентами и какие образуются продукты.Оглянитесь назад на реакции, которые обсуждались так далеко. Как в каждом случае измеряли среднюю скорость реакции? Следующие примеры даст вам некоторые идеи о других способах измерения средней скорости реакции:
temp textИзмерение объема газа, произведенного в единицу времени (ESCN4)
Объем газа, образующегося в результате реакции, может быть измерен путем сбора газа в шприц (рис. 7.4).
Рисунок 7.4: Метод газового шприца.
По мере образования большего количества газа поршень выталкивается, и объем газа в шприце
можно записать.
Измеряя объем через заданные промежутки времени, мы можем построить график данных (рис. 7.5) и отсюда определить скорость реакции.
Рисунок 7.5: График объема газа, собранного за заданные интервалы времени.
Примеры реакций с образованием газа перечислены ниже:
-
Реакции с образованием газообразного водорода:
Когда металл реагирует с кислотой , выделяется газообразный водород. То водород можно собрать в пробирку.Шина с подсветкой можно использовать для проверки на водород. Звуковые шоу « pop » что водород присутствует.

Например, магний реагирует с серной кислотой с образованием сульфата магния. и водород.
\[\text{Mg}(\text{s}) + \text{H}_{2}\text{SO}_{4}(\text{aq}) \to \text{MgSO}_{4}(\text{водный}) + \text{H}_{2}(\text{g})\]
-
Реакции с образованием диоксида углерода:
Когда карбонат реагирует с кислотой , выделяется углекислый газ. произведено.При пропускании углекислого газа через известковая вода получается известковая вода молочный .
 Горящая шина тоже остановит
сжигание (гасить) в присутствии
\(\text{CO}_{2}\) газ. Это простые тесты на наличие
углекислый газ.
Горящая шина тоже остановит
сжигание (гасить) в присутствии
\(\text{CO}_{2}\) газ. Это простые тесты на наличие
углекислый газ.Например, карбонат кальция реагирует с соляной кислотой с образованием хлорид кальция, вода и углекислый газ.
\[\text{CaCO}_{3}(\text{s}) + 2\text{HCl}(\text{aq}) \to \text{CaCl}_{2}(\text{водный}) + \text{H}_{2}\text{O}(ℓ) + \текст{СО}_{2}(\текст{г})\]
-
Реакции с образованием кислорода:
Перекись водорода разлагается в присутствии оксида марганца(IV) катализатор для получения кислорода и воды.

В эксперименте с цинком и соляной кислотой учащиеся собирают газ в воздушный шар. Не поджигайте газ в воздушном шаре и не позволяйте ему находиться рядом с пламя. Будет взрыв.
Измерение скорости реакции
Цель
Для измерения влияния концентрации на среднюю скорость реакции.{-3}$}\) соляная кислота \((\text{HCl})\)
Две конические колбы, два стакана, два баллона, бунзеновская горелка, щепка деревянная
Метод
Не допускайте попадания соляной кислоты (\(\text{HCl}\)) на руки. Мы
рекомендуется использовать перчатки и защитные очки при работе с
кислоты и обращаться с осторожностью.
Мы
рекомендуется использовать перчатки и защитные очки при работе с
кислоты и обращаться с осторожностью.
-
Маркировка конической колбы A . Взвешивание \(\text{5}\) \(\text{g}\) гранул цинка.
Повторите то же самое со второй конической колбой, но назовите ее B .
-
Маркировка стакана \(\text{1}\) . Налейте \(\text{10}\) \(\text{cm$^{3}$}\) \(\text{HCl}\) в него.
 {3}$}\) \(\text{HCl}\) до этой секунды
стакан.
{3}$}\) \(\text{HCl}\) до этой секунды
стакан. -
Быстро: Налейте жидкость в стакан \(\text{1}\) в коническую колбу A и налейте жидкость в химический стакан. \(\text{2}\) в коническую колбу Б .Плотно прикрепите по одному шарику к каждому коническая колба.
-
Обратите внимание, какой шар наполнился быстрее.

-
Заполните пробирку образовавшимся газом.Светлый только газ в пробирке. Хранить открытый огонь вдали от воздушных шаров.
Уравнение этой реакции:
\(\text{Zn}(\text{s}) + 2\text{HCl}(\text{aq})\) \(\to\) \(\text{ZnCl}_{2}(\text{водн.}) + \text{H}_{2}(\text{g})\)
Результаты
-
В каком стакане был более концентрированный раствор \(\текст{HCl}\)?
-
Какой шар наполнится быстрее?
-
Что произошло, когда вы подожгли газ в пробирке?
Выводы
Более концентрированный раствор привел к более высокой скорости реакции (т. е. в
баллон наполняется газом \(\text{H}_{2}\) быстрее). Тест на
газообразный водород привел бы к громкому хлопку , когда горит
шину помещали рядом с горлышком пробирки.
е. в
баллон наполняется газом \(\text{H}_{2}\) быстрее). Тест на
газообразный водород привел бы к громкому хлопку , когда горит
шину помещали рядом с горлышком пробирки.
Реакции осаждения (ESCN5)
В реакциях, где образуется осадок , количество осадка, образовавшегося в период времени можно использовать как меру скорости реакции.Например, когда натрий тиосульфат реагирует с кислотой, образуется желтый осадок серы. Реакция выглядит следующим образом:
Когда в результате реакции между двумя жидкостями образуется нерастворимое соединение, твердый материал
будет образовываться в жидкости. Это твердое вещество называется осадком.
Это твердое вещество называется осадком.
\(\text{Na}_{2}\text{S}_{2}\text{O}_{3}(\text{водный}) + 2\text{HCl}(\text{водный} )\) \(\к\) \(2\text{NaCl}(\text{водн.}) + \text{SO}_{2}(\text{водн.}) + \text{H}_{2}\text{O}(ℓ) + \текст{С}(\текст{с})\)
Одним из способов оценки средней скорости этой реакции является проведение исследования в
коническую колбу и положить лист бумаги с черным крестом под дно
колба.В начале реакции крест будет хорошо виден при
загляните в колбу (рис.
7.6). Однако по мере протекания реакции и образования большего количества осадка
крест постепенно станет менее четким и, в конце концов, совсем исчезнет.
Измерение времени, которое требуется для этого, даст представление о реакции
ставка. Обратите внимание, что невозможно собрать образующийся \(\text{SO}_{2}\) газ.
в реакции, так как хорошо растворяется в воде.
Обратите внимание, что невозможно собрать образующийся \(\text{SO}_{2}\) газ.
в реакции, так как хорошо растворяется в воде.
Рисунок 7.6: В начале реакции между тиосульфатом натрия и соляной кислоты, если осадок не образовался, крест у хорошо видно дно конической колбы.Как осадок формы меньше его можно увидеть.
Для реакции тиосульфата натрия с соляной кислотой целесообразно разбейте свой класс на группы и поручите им разные эксперименты в это время. точка. Они могут отчитаться перед остальным классом.
Этот эксперимент рекомендуется для неформальной оценки в CAPS.Не забудьте напомнить
учащиеся о процедурах безопасности в лаборатории, особенно при работе с кислотами. {3}$}\) тиосульфата натрия
\(\text{Na}_{2}\text{S}_{2}\text{O}_{3}\) решение.{3}$}\) стеклянные стаканы,
мерные цилиндры, бумага и маркер, секундомер или
таймер
{3}$}\) тиосульфата натрия
\(\text{Na}_{2}\text{S}_{2}\text{O}_{3}\) решение.{3}$}\) стеклянные стаканы,
мерные цилиндры, бумага и маркер, секундомер или
таймер
Метод
Не допускайте попадания соляной кислоты (\(\text{HCl}\)) на руки.Мы рекомендуется использовать перчатки и защитные очки при работе с кислоты и с которыми нужно обращаться осторожно.
Один из способов измерить среднюю скорость этой реакции — поместить кусочек
бумагу с крестом под реакционным стаканом, чтобы увидеть, как долго он
до тех пор, пока крест не будет виден из-за образования серы
осадок. {3}$}\) \(\text{HCl}\).Теперь добавьте это
\(\text{HCl}\) к раствору, который уже находится в
первый стакан (NB: убедитесь, что вы всегда очищаете
мерный цилиндр, которым вы пользовались до того, как использовать его для
другое химическое вещество).
{3}$}\) \(\text{HCl}\).Теперь добавьте это
\(\text{HCl}\) к раствору, который уже находится в
первый стакан (NB: убедитесь, что вы всегда очищаете
мерный цилиндр, которым вы пользовались до того, как использовать его для
другое химическое вещество).
Используя секундомер с секундами, запишите время, которое
для осадка, который образуется, чтобы заблокировать крест.{3}$}\) \(\text{HCl}\), время
реакцию и запишите результаты, как вы это сделали
до.
Продолжите эксперимент, разбавив раствор А, как показано на рисунке. ниже.{3}$}\))
Уравнение реакции между тиосульфатом натрия и соляной кислота:
\(\text{Na}_{2}\text{S}_{2}\text{O}_{3}(\text{водный}) + 2\text{HCl}(\text{водный} )\) \(\to\) \(2\text{NaCl}(\text{водный}) + \text{SO}_{2}(\text{водный}) + \text{H}_{2}\text{O}(ℓ) + \text{S}(\text{s})\)
Результаты
-
Рассчитайте скорость реакции в каждом стакане.
 Помните, что:
Помните, что:
скорость образования продукта = \(\dfrac{ \text{образовавшийся молярный продукт}}{\text{время реакции (с)}}\)
В этом эксперименте вы останавливаете каждый эксперимент, когда образуется примерно такое же количество осадка ( крест блокируется осадком).Так что родственник скорость реакции можно определить с помощью следующих уравнение:
скорость реакции = \(\dfrac{1}{\text{время (с)}}\)
-
Представьте свои результаты на графике.
 Концентрация будет на оси x и
скорость реакции по оси ординат. Обратите внимание, что
оригинальный объем
\(\text{Na}_{2}\text{S}_{2}\text{O}_{3}\) можно использовать как
мера концентрации.
Концентрация будет на оси x и
скорость реакции по оси ординат. Обратите внимание, что
оригинальный объем
\(\text{Na}_{2}\text{S}_{2}\text{O}_{3}\) можно использовать как
мера концентрации. -
Почему было важно сохранить объем \(\text{HCl}\) постоянный?
-
Опишите взаимосвязь между концентрацией и реакцией ставка.

Выводы
Чем выше концентрация реагентов, тем быстрее средний скорость реакции.
Изменение цвета (ESCN6)
В некоторых реакциях изменение цвета говорит нам о том, что реакция идет.Чем быстрее меняется цвет, тем выше скорость реакции.
Например, при титровании этановой кислоты (уксусной кислоты) гидроксидом натрия индикатор
добавляют фенолфталеин. Раствор прозрачен в кислом растворе и
меняется на розовый, когда реакция завершена. Если концентрация основания
увеличилось, изменение цвета произошло бы быстрее (после того, как меньший объем базы был
добавлено), показывая, что более высокая концентрация основания увеличивает скорость реакции. {-}(\текст{вод}) +
\текст{Н}_{2}\текст{О}(ℓ)\]
{-}(\текст{вод}) +
\текст{Н}_{2}\текст{О}(ℓ)\]
Изменения массы (ESCN7)
Для реакции, в результате которой образуется газ, можно измерить массу реакционного сосуда с течением времени. Потеря массы показывает количество газа, которое образовалось и вышло из реакционный сосуд (рис. 7.7).
Рис. 7.7: Изменение массы, указывающее на потерю газа (фото tjmwatson на Фликре).
Если реакционный сосуд запечатан, этот метод не работает.
Рисунок 7.8: a) График зависимости массы образца от времени и b) график зависимости потери массы от времени.
Обратите внимание на разницу между двумя графиками на рис. 7.8. Масса образца будет уменьшаться по мере
протекает реакция. Масса, потерянная из образца, будет увеличиваться по мере протекания реакции.
Потерянный материал (обусловливающий потерю массы) можно собрать и измерить (для
пример с методом газового шприца, как показано на рисунке 7.4).
7.8. Масса образца будет уменьшаться по мере
протекает реакция. Масса, потерянная из образца, будет увеличиваться по мере протекания реакции.
Потерянный материал (обусловливающий потерю массы) можно собрать и измерить (для
пример с методом газового шприца, как показано на рисунке 7.4).
экспериментальных методов измерения скорости реакции | Химия
Скорость реакции можно изучать, определяя изменение концентрации реагентов или продуктов в зависимости от времени.
Изменения концентрации можно измерить экспериментальными методами, такими как поляриметрия, спектроскопия или измерение давления.
В поляриметрии используется плоскополяризованный свет с электрическим полем, ориентированным только вдоль одной плоскости. Он измеряет способность соединений вращать поляризованный свет, что зависит от молекулярной структуры присутствующего соединения.
Рассмотрим гидролиз сахарозы с образованием глюкозы и фруктозы. Поляриметр используется для измерения степени вращения плоскополяризованного света, проходящего через реагирующий раствор сахарозы.Сахароза вызывает вращение по часовой стрелке, тогда как глюкоза и фруктоза вызывают вращение против часовой стрелки.
Поляриметр используется для измерения степени вращения плоскополяризованного света, проходящего через реагирующий раствор сахарозы.Сахароза вызывает вращение по часовой стрелке, тогда как глюкоза и фруктоза вызывают вращение против часовой стрелки.
Путем измерения степени вращения света через заданные промежутки времени можно рассчитать относительные концентрации сахарозы, глюкозы или фруктозы и определить скорость реакции.
Скорость реакции можно также измерить с помощью спектрофотометрических методов, использующих способность реагентов или продуктов поглощать свет с определенной длиной волны. Чем выше концентрация исследуемого вещества, тем интенсивнее будет его светопоглощение.
Например, бесцветный газообразный водород реагирует с фиолетовыми парами йода с образованием бесцветного йодистого водорода. Пары йода поглощают свет в желто-зеленой области и отражают фиолетовый свет.
Во время реакции спектрофотометр измеряет количество света, поглощенного образцом, и анализирует прошедший свет. Таким образом, по мере протекания реакции снижение концентрации паров йода наблюдается по уменьшению поглощения желто-зеленого света.
Таким образом, по мере протекания реакции снижение концентрации паров йода наблюдается по уменьшению поглощения желто-зеленого света.
Используя закон Бера-Ламберта, можно рассчитать интенсивность света, поглощаемого в разные моменты времени, и связать ее с изменениями концентрации.
В качестве альтернативы, если одним из реагентов или продуктов является газ, измерения давления используются для определения скорости реакции путем отслеживания изменений давления.
Например, при разложении перекиси водорода скорость реакции изучается с помощью манометра для контроля давления выделяющегося газообразного кислорода. По мере развития реакции и выделения большего количества газообразного кислорода давление повышается.
Используя уравнение идеального газа, значения давления, зарегистрированные в различные моменты времени, преобразуются в концентрации.Изменение концентрации в зависимости от времени используется для определения скорости реакции.
Для продолжительных реакций образцы или аликвоты можно брать из реакционной смеси через равные промежутки времени. Относительные концентрации затем измеряются с использованием инструментальных методов, таких как газовая хроматография, масс-спектрометрия или титрование, для расчета скорости реакции.
Относительные концентрации затем измеряются с использованием инструментальных методов, таких как газовая хроматография, масс-спектрометрия или титрование, для расчета скорости реакции.
12.1 Скорости химических реакций – Химия 112- Главы 12-17 OpenStax General Chemistry
Цели обучения
К концу этого раздела вы сможете:
- Определение скорости химической реакции
- Вывести выражение скорости из сбалансированного уравнения для данной химической реакции
- Расчет скорости реакции на основе экспериментальных данных
Коэффициент — это мера того, как некоторое свойство изменяется со временем.Скорость — это известная скорость, которая выражает расстояние, пройденное объектом за заданный промежуток времени. Заработная плата – это ставка, которая представляет собой сумму денег, заработанную человеком, работающим в течение определенного периода времени. Точно так же скорость химической реакции является мерой того, сколько реагента потребляется или сколько продукта образуется в результате реакции за данный промежуток времени.
Скорость реакции — это изменение количества реагента или продукта в единицу времени. Таким образом, скорость реакции определяется путем измерения временной зависимости некоторого свойства, которое может быть связано с количеством реагента или продукта.Скорости реакций, которые потребляют или производят газообразные вещества, например, удобно определять путем измерения изменений объема или давления. Для реакций с участием одного или нескольких окрашенных веществ скорость можно контролировать с помощью измерений поглощения света. Для реакций с участием водных электролитов скорость можно измерить по изменению проводимости раствора.
Для реагентов и продуктов в растворе их относительные количества (концентрации) удобно использовать для целей выражения скорости реакции.Если мы измерим концентрацию перекиси водорода, H 2 O 2 , в водном растворе, мы обнаружим, что она медленно меняется с течением времени по мере разложения H 2 O 2 в соответствии с уравнением:
[латекс] 2 \ текст {H} _2 \ текст {O} _2 (водн. ) \; {\ longrightarrow} \; 2 \ текст {H} _2 \ текст {O} (л) \; + \; \ текст {O}_2(г)[/латекс]
) \; {\ longrightarrow} \; 2 \ текст {H} _2 \ текст {O} (л) \; + \; \ текст {O}_2(г)[/латекс]
Скорость разложения пероксида водорода можно выразить через скорость изменения его концентрации, как показано здесь:
[латекс]\begin{array}{r @{{}={}} l} \text{скорость\;разложения\;H}_2\text{O}_2 & — \frac{ \text{изменение\;концентрации\;реагента}}{\text{временной\;интервал}} \\[0.5em] & — \frac{[\text{H}_2\text{O}_2]_{t_2}\;-\;[\text{H}_2\text{O}_2]_{t_1}}{ t_2\;-\;t_1} \\[0.5em] & — \frac{{\Delta}[\text{H}_2\text{O}_2]}{{\Delta}t} \end{array} [/латекс]
Это математическое представление изменения концентрации частиц с течением времени представляет собой выражение скорости реакции. В скобках указаны молярные концентрации, а символ дельта (Δ) указывает на «изменение». Таким образом, [латекс][\текст{Н}_2\текст{О}_2]_{t_1}[/латекс] представляет собой молярную концентрацию перекиси водорода в некоторый момент времени т 1 ; аналогично [латекс][\текст{Н}_2\текст{О}_2]_{t_2}[/латекс] представляет собой молярную концентрацию перекиси водорода в более позднее время t 2 ; Δ[H 2 O 2 ] представляет собой изменение молярной концентрации пероксида водорода за интервал времени Δ t (то есть t 2 — t 1 ). Поскольку концентрация реагента уменьшается по мере протекания реакции, Δ[H 2 O 2 ] является отрицательной величиной; мы ставим знак минус перед выражением, потому что скорость реакции, как принято считать, является положительной величиной. На рис. 1 приведен пример данных, собранных при разложении H 2 O 2 .
Поскольку концентрация реагента уменьшается по мере протекания реакции, Δ[H 2 O 2 ] является отрицательной величиной; мы ставим знак минус перед выражением, потому что скорость реакции, как принято считать, является положительной величиной. На рис. 1 приведен пример данных, собранных при разложении H 2 O 2 .
Для получения табличных результатов этого разложения концентрацию перекиси водорода измеряли каждые 6 часов в течение дня при постоянной температуре 40 °C. Скорость реакции рассчитывали для каждого временного интервала путем деления изменения концентрации на соответствующее приращение времени, как показано здесь для первого 6-часового периода:
[латекс]\frac{-{\Delta}[\text{H}_2\text{O}_2]}{{\Delta}t} = \frac{-(0,500\;\text{моль/л} \;-\;1.000\;\text{моль/л})}{(6. 00\;\text{ч}\;-\;0.{-1}[/латекс]
00\;\text{ч}\;-\;0.{-1}[/латекс]
Такое поведение указывает на то, что реакция постоянно замедляется со временем. Использование концентраций в начале и в конце периода времени, в течение которого скорость реакции изменяется, приводит к расчету средней скорости реакции за этот интервал времени. В любой конкретный момент времени скорость, с которой протекает реакция, известна как ее мгновенная скорость . Мгновенная скорость реакции в «нулевой момент времени», когда реакция начинается, равна ее начальной скорости .Возьмем аналогию с автомобилем, замедляющимся по мере приближения к знаку «стоп». Начальная скорость автомобиля — аналогичная началу химической реакции — будет показанием спидометра в момент, когда водитель начинает нажимать на тормоз ( t 0 ). Несколько мгновений спустя мгновенная скорость в конкретный момент — назовем ее t 1 — будет несколько меньше, о чем свидетельствуют показания спидометра в этот момент времени. Со временем мгновенная скорость будет продолжать падать, пока не достигнет нуля, когда машина (или реакция) остановится.В отличие от мгновенной скорости, средняя скорость автомобиля не указывается спидометром; но его можно рассчитать как отношение пройденного пути ко времени, необходимому для полной остановки транспортного средства (Δ t ). Как и в случае с замедляющимся автомобилем, средняя скорость химической реакции находится где-то между начальной и конечной скоростями.
Со временем мгновенная скорость будет продолжать падать, пока не достигнет нуля, когда машина (или реакция) остановится.В отличие от мгновенной скорости, средняя скорость автомобиля не указывается спидометром; но его можно рассчитать как отношение пройденного пути ко времени, необходимому для полной остановки транспортного средства (Δ t ). Как и в случае с замедляющимся автомобилем, средняя скорость химической реакции находится где-то между начальной и конечной скоростями.
Мгновенная скорость реакции может быть определена одним из двух способов. Если экспериментальные условия позволяют измерять изменения концентрации за очень короткие промежутки времени, то средние скорости, рассчитанные, как описано выше, обеспечивают достаточно хорошее приближение к мгновенным скоростям.В качестве альтернативы можно использовать графическую процедуру, которая, по сути, дает результаты, которые были бы получены, если бы были возможны измерения с короткими временными интервалами. Если построить график зависимости концентрации перекиси водорода от времени, то мгновенная скорость разложения H 2 O 2 в любой момент времени t определяется наклоном прямой линии, касательной к кривой в этот момент времени ( Фигура 2). Мы можем использовать исчисление для оценки наклонов таких касательных линий, но процедура для этого выходит за рамки этой главы.
Мы можем использовать исчисление для оценки наклонов таких касательных линий, но процедура для этого выходит за рамки этой главы.
Скорость реакции в анализе: тест-полоски для анализа мочи
Врачи часто используют одноразовые тест-полоски для измерения количества различных веществ в моче пациента (рис. 3).Эти тест-полоски содержат различные химические реагенты, встроенные в небольшие подушечки в различных местах вдоль полоски, которые изменяют цвет при воздействии достаточных концентраций определенных веществ. В инструкциях по применению тест-полосок часто подчеркивается, что правильное время считывания имеет решающее значение для получения оптимальных результатов. {-}\;{\xrightarrow[\text{катализатор}]{}}\;\ текст{I}_2\;+\;2\текст{H}_2\текст{O}\;+\;\text{O}_2[/latex]
{-}\;{\xrightarrow[\text{катализатор}]{}}\;\ текст{I}_2\;+\;2\текст{H}_2\текст{O}\;+\;\text{O}_2[/latex]
Первое уравнение описывает окисление глюкозы в моче с образованием глюколактона и перекиси водорода.Полученная перекись водорода впоследствии окисляет бесцветный йодид-ион с образованием коричневого йода, который можно обнаружить визуально. Некоторые полоски содержат дополнительное вещество, которое вступает в реакцию с йодом, вызывая более отчетливое изменение цвета.
Две показанные выше тестовые реакции по своей природе очень медленные, но их скорость увеличивается за счет специальных ферментов, встроенных в прокладку тест-полоски. Это пример катализа , тема, обсуждаемая далее в этой главе. Обычной тест-полоске на глюкозу для использования с мочой требуется около 30 секунд для завершения реакции цветообразования.Слишком раннее прочтение результата может привести к выводу, что концентрация глюкозы в образце мочи ниже, чем она есть на самом деле ( ложноотрицательный результат ). Слишком долгое ожидание оценки изменения цвета может привести к ложноположительному результату из-за более медленного (не катализируемого) окисления йодид-иона другими веществами, обнаруженными в моче.
Слишком долгое ожидание оценки изменения цвета может привести к ложноположительному результату из-за более медленного (не катализируемого) окисления йодид-иона другими веществами, обнаруженными в моче.
Скорость реакции может быть выражена в терминах изменения количества любого реагента или продукта и может быть просто получена из стехиометрии реакции. Рассмотрим реакцию, представленную следующим уравнением:
[латекс]2\текст{NH}_3(г)\;{\longrightarrow}\;\текст{N}_2(г)\;+\;3\текст{Н}_2(г)[/латекс]
Стехиометрические коэффициенты, полученные из этого уравнения, могут быть использованы для определения скорости реакции таким же образом, как они используются для соотнесения количества реагентов и продуктов. Соотношение между скоростями реакции, выраженными в единицах образования азота и потребления аммиака, например, составляет:
Соотношение между скоростями реакции, выраженными в единицах образования азота и потребления аммиака, например, составляет:
[латекс]-\;\frac{{\Delta}\text{mol\;NH}_3}{{\Delta}t}\;\times\;\frac{1\;\text{mol\;N }_2}{2\;\text{моль\;NH}_3} = \frac{{\Delta}\text{mol\;N}_2}{{\Delta}t}[/latex]
Мы можем выразить это проще, не указывая единицы измерения стехиометрического фактора:
[латекс]-\;\frac{1}{2}\;\frac{{\Delta}\text{mol\;NH}_3}{{\Delta}t} = \frac{{\Delta}\ text{mol\;N}_2}{{\Delta}t}[/latex]
Обратите внимание, что знак минус был добавлен для учета противоположных знаков двух изменений количества (количество реагента уменьшается, а количество продукта увеличивается).Если реагенты и продукты присутствуют в одном и том же растворе, молярные количества могут быть заменены концентрациями:
[латекс]-\;\frac{1}{2}\;\frac{{\Delta}[\text{NH}_3]}{{\Delta}t} = \frac{{\Delta}[\ text{N}_2]}{{\Delta}t}[/latex]
Точно так же скорость образования H 2 в три раза превышает скорость образования N 2 , потому что три моля H 2 образуются за время, необходимое для образования одного моля N 2 :
[латекс]\frac{1}{3}\;\frac{{\Delta}[\text{H}_2]}{{\Delta}t} = \frac{{\Delta}[\text{N }_2]}{{\Delta}t}[/латекс]
На рис. 4 показано изменение концентрации во времени при разложении аммиака на азот и водород при 1100 °C.{-6}\;M/\text{s}}\;{\приблизительно}\;3[/латекс]
4 показано изменение концентрации во времени при разложении аммиака на азот и водород при 1100 °C.{-6}\;M/\text{s}}\;{\приблизительно}\;3[/латекс]
Таким образом, для химической реакции:
aA + bB → cC + dD
скорость реакции можно выразить как:
[латекс]\text{скорость реакции} = -\frac{1}{a}\;\frac{{\Delta}[A]}{{\Delta}t} = -\frac{1}{b }\;\frac{{\Delta}[B]}{{\Delta}t} = \frac{1}{c}\;\frac{{\Delta}[C]}{{\Delta}t} = \frac{1}{d}\;\frac{{\Delta}[D]}{{\Delta}t}[/latex]
Пример 1
Выражения для относительных скоростей реакций
Первым этапом производства азотной кислоты является сжигание аммиака:
[латекс]4\текст{NH}_3(g)\;+\;5\text{O}_2(g)\;{\longrightarrow}\;4\text{NO}(g)\;+\ ;6\текст{Н}_2\текст{О}(г)[/латекс]
Напишите уравнения, связывающие скорости расходования реагентов и скорости образования продуктов.
Раствор
Учитывая стехиометрию этой гомогенной реакции, скорости расходования реагентов и образования продуктов составляют:
[латекс]-\frac{1}{4}\;\frac{{\Delta}[\text{NH}_3]}{{\Delta}t} = -\frac{1}{5}\; \frac{{\Delta}[\text{O}_2]}{{\Delta}t} = \frac{1}{4}\;\frac{{\Delta}[\text{NO}]}{ {\Delta}t} = \frac{1}{6}\;\frac{{\Delta}[\text{H}_2\text{O}]}{{\Delta}t}[/latex]
Пример 2
Выражения скорости реакции для разложения H 2 O 2
График на рисунке 2 показывает скорость разложения H 2 O 2 во времени:
[латекс] 2 \ текст {H} _2 \ текст {O} _2 \; {\ longrightarrow} \; 2 \ текст {H} _2 \ текст {O} \; + \; \ текст {O} _2 [/ латекс]
На основании этих данных мгновенная скорость разложения H 2 O 2 при т = 11.{-1}[/латекс]
Какова мгновенная скорость производства H 2 O и O 2 ?
Раствор
Используя стехиометрию реакции, мы можем определить, что:
[латекс]-\frac{1}{2}\;\frac{{\Delta}[\text{H}_2\text{O}_2]}{{\Delta}t} = \frac{1} {2}\;\frac{{\Delta}[\text{H}_2\text{O}]}{{\Delta}t} = \frac{{\Delta}[\text{O}_2]} {{\Delta}t}[/латекс]
Следовательно:
[латекс]\frac{1}{2}\;\times\;3. {-1} = \frac{{\Delta}[\text{O}_2]}{{\Delta}t}[/latex]
{-1} = \frac{{\Delta}[\text{O}_2]}{{\Delta}t}[/latex]
и
[латекс]\frac{{\Delta}[\text{O}_2]}{{\Delta}t} = 1.{-1}[/латекс]
Это означает, что если мы знаем скорость изменения одного химического вещества (либо реагента, либо продукта) в реакции, мы сможем рассчитать скорость изменения для всех других химических веществ.
Скорость реакции может быть выражена либо через уменьшение количества реагента, либо через увеличение количества продукта в единицу времени. Соотношения между различными выражениями скорости для данной реакции выводятся непосредственно из стехиометрических коэффициентов уравнения, представляющего реакцию.
- относительные скорости реакции для [латекса]a\text{A}\;{\longrightarrow}\;b\text{B} = -\frac{1}{a}\;\frac{{\Delta}[\ text{A}]}{{\Delta}t} = \frac{1}{b}\;\frac{{\Delta}[\text{B}]}{{\Delta}t}[/latex]
Озон разлагается до кислорода по уравнению [латекс]2\текст{О}_3(г)\;{\longrightarrow}\;3\текст{О}_2(г)[/латекс]. Напишите уравнение, которое связывает выражение скорости этой реакции через исчезновение O 3 и образование кислорода.
В атомной промышленности трифторид хлора используется для получения гексафторида урана, летучего соединения урана, используемого при разделении изотопов урана. Трифторид хлора получают по реакции [латекс]\text{Cl}_2(г)\;+\;3\text{F}_2(г)\;{\longrightarrow}\;2\text{ClF}_3( г)[/латекс]. Напишите уравнение, связывающее выражения скорости этой реакции через исчезновение Cl 2 и F 2 и образование ClF 3 .
Исследование скорости димеризации C 4 H 6 дало данные, представленные в таблице:
[латекс]2\text{C}_4\text{H}_6\;{\longrightarrow}\; \text{C}_8\text{H}_{12}[/latex]
| Время (с) | 0 | 1600 | 3200 | 4800 | 6200 |
| [C 4 H 6 ] ( M ) | 1.00 × 10 −2 | 5,04 × 10 −3 | 3,37 × 10 −3 | 2,53 × 10 −3 | 2,08 × 10 −3 |
| Таблица 1. | |||||
(a) Определите среднюю скорость димеризации между 0 и 1600 с и между 1600 и 3200 с.
(b) Оцените мгновенную скорость димеризации при 3200 с по графику зависимости времени от [C 4 H 6 ].Каковы единицы этой скорости?
(c) Определите среднюю скорость образования C 8 H 12 в 16:00 с и мгновенную скорость образования в 3200 с по скоростям, найденным в частях (a) и (b).
Изучение скорости реакции, представленной как [латекс]2А\;{\longrightarrow}\;В[/латекс], дало следующие данные:
| Время (с) | 0,0 | 5,0 | 10,0 | 15,0 | 20,0 | 25.0 | 35,0 |
| [ А ] ( М ) | 1,00 | 0,952 | 0,625 | 0,465 | 0,370 | 0,308 | 0,230 |
Таблица 2. |
|||||||
(a) Определите среднюю скорость исчезновения A между 0,0 и 10,0 с и между 10,0 и 20,0 с.
(b) Оцените мгновенную скорость исчезновения A в 15.{+}(водный раствор)\;{\longrightarrow}\;3\text{Br}_2(водный раствор)\;+\;3\text{H}_2\text{O}(l)[/latex]
Если скорость исчезновения Br – ( водный раствор ) в конкретный момент реакции составляет 3,5 × 10 −4 M с −1 , то какова скорость появления Br 2 ( aq ) в этот момент?
Глоссарий
- средняя ставка
- скорость химической реакции, вычисляемая как отношение измеренного изменения количества или концентрации вещества к интервалу времени, в течение которого произошло изменение
- начальная ставка
- мгновенная скорость химической реакции при t = 0 с (сразу после начала реакции)
- мгновенная скорость
- скорость химической реакции в любой момент времени, определяемая по наклону линии, касательной к графику зависимости концентрации от времени
- скорость реакции
- мера скорости, с которой протекает химическая реакция
- выражение скорости
- математическое представление, связывающее скорость реакции с изменениями количества, концентрации или давления реагентов или продуктов в единицу времени
Решения
Ответы на упражнения по химии в конце главы
1. Мгновенная скорость — это скорость реакции в любой конкретный момент времени, период времени настолько короткий, что концентрации реагентов и продуктов изменяются на незначительную величину. Начальная скорость – это мгновенная скорость реакции в момент ее начала (поскольку продукт только начинает образовываться). Средняя ставка – это среднее значение мгновенных ставок за период времени.
Мгновенная скорость — это скорость реакции в любой конкретный момент времени, период времени настолько короткий, что концентрации реагентов и продуктов изменяются на незначительную величину. Начальная скорость – это мгновенная скорость реакции в момент ее начала (поскольку продукт только начинает образовываться). Средняя ставка – это среднее значение мгновенных ставок за период времени.
3. [латекс]\text{скорость} = +\frac{1}{2}\;\frac{{\Delta}[\text{CIF}_3]}{{\Delta}t} = -\frac {{\Delta}[\text{Cl}_2]}{{\Delta}t} = -\frac{1}{3}\;\frac{{\Delta}[\text{F}_2]}{ {\Delta}t}[/латекс]
5.а – средняя скорость, 0 – 10 с = 0,0375 моль л –1 с –1 ; средняя скорость, 12 — 18 с = 0,0225 моль л -1 с -1 ; (б) мгновенная скорость, 15 с = 0,0500 моль л -1 с -1 ; (в) средняя скорость образования В = 0,0188 моль л -1 с -1 ; мгновенная скорость образования B = 0,0250 моль л −1 с −1
Скорость реакции — обзор
Скорость реакции — ключевая информация, необходимая для количественного определения химических реакций и описания работы химических реакторов. Удельная скорость одной реакции, в которой участвует компонентов N , определяется как (подробнее см., например, Levenspiel, 1999; Westerterp et al., 1984):
Удельная скорость одной реакции, в которой участвует компонентов N , определяется как (подробнее см., например, Levenspiel, 1999; Westerterp et al., 1984):
(13.1)Qi=1ξidcidti=1,…, N
где Q i — скорость реакции компонента i (кг/м 3 с кмоль/м 3 с), , кмоль/м 3 ), ξ i — стехиометрический коэффициент (равный нулю для инертных веществ или разбавителей).уравнение (13.1) применяется для гомогенной каталитической реакции. В гетерогенном катализе часто для сравнения используется масса или площадь поверхности катализатора, поэтому скорость реакции измеряется как кмоль/кг с, кмоль/м 2 с и т. д. Очевидно, что выбранную масштабную величину следует использовать последовательно для расчет скорости реакции Q i . Скорость реакции может зависеть от температуры и изменения молярной концентрации реагентов. Преобразование, например, для постоянного объема, можно определить как:
(13. 2)Xi=cio-cicio
2)Xi=cio-cicio
, где cio — начальная или исходная концентрация, а X i — конверсия. Скорость реакции может быть указана, например, для реакции обратимой реакции A + B ↔ E + F как: 2 — это постоянная скорость реакции вперед (M 3 / KMOL S), K q EQ — это постоянная равновесия ( K EQ = K 2 / k −2 ), Q – скорость реакции (кмоль/м 3 с).Селективность, например, компонента E , σ E , представляет собой отношение между количеством полученного целевого продукта E и количеством превращенного ключевого реагента, например, A :
(13,4 )σE=cP−cPocAo−cAξAξP
, где cio — исходная концентрация компонентов (кмоль/м 3 ), ξ i — стехиометрический коэффициент.
Модуль Тиле (ϑ), представляющий собой отношение характерного времени поперечной диффузии к характерному времени реакции в мембране, описывается следующим уравнением:
(13.5)ϑ=δ2QiDic¯i
где δ – толщина мембраны, c¯i – средняя концентрация компонента i (кмоль/м 3 ), Q i – скорость реакции ( кмоль/м 3 с), а D i – эффективный коэффициент диффузии в мембранном слое (м 2 /с). Например, для химической реакции первого порядка Q = k 1 c ( k 1 — константа скорости реакции [1/с]), значение ϑ равно:
(13.6)ϑ=k1δ2D=k1Dko.
Экв. (13.6) — известное число га для жидкой фазы, га ( га ≡ ϑ, где k o = D/ δ). Выразим ϑ для цилиндрического пространства. Принимая во внимание уравнение (9.7а) в главе «Диффузия в цилиндрическом мембранном слое» модуль Тиле для цилиндрического пространства может быть выражен следующим образом:
(13.
