Масса молекул. Количество вещества
Недавно мы говорили о размерах молекул и выяснили, что они очень малы. Как вы понимаете, измерять массу молекул в обычных единицах массы, таких как килограммы или граммы, крайне неудобно. Поэтому люди придумали относительную молекулярную массу. Относительная молекулярная (или атомная) масса вещества — это отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода.
Дело
в том, что углерод входит в множество веществ, и по международному соглашению
было решено использовать углеродную шкалу атомных масс. Нетрудно догадаться,
что относительная молекулярная масса — это безразмерная величина, поскольку
она показывает во сколько раз масса данной молекулы (или атома) больше массы
одной двенадцатой атома углерода. Тем не менее, молекулярную массу
условились измерять в атомных единицах массы (а. е. м.).
Относительные массы всех химических элементов измерены с высокой точностью, и их можно найти в таблице Менделеева.
Например, относительная атомная масса водорода равна 1, относительная атомная масса гелия равна 4 и так далее.
Зная атомные массы можно вычислить и молекулярную массу. Например, относительная молекулярная масса соляной кислоты равна
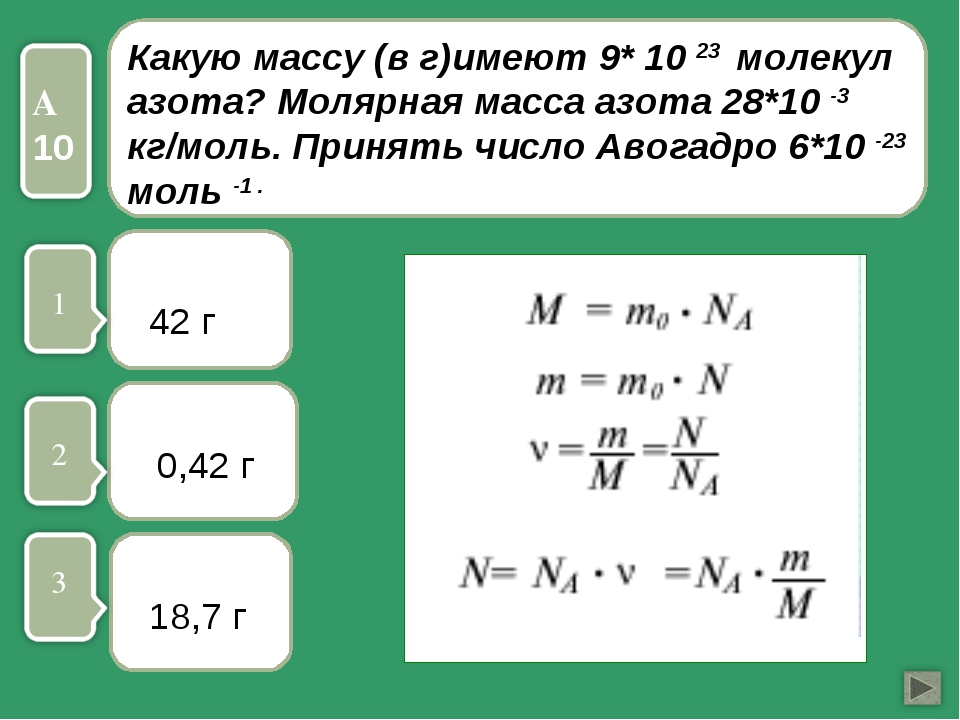
Аналогичным способом можно вычислить массы других молекул. Например, молекула серной кислоты состоит из двух атомов водорода, одного атома серы и четырех атомов кислорода. Таким образом, относительная молекулярная масса серной кислоты равна .
Еще
одно понятие, с которым необходимо ознакомиться при изучении
молекулярно-кинетической теории — это количество вещества. Можно,
конечно, определить количество вещества, как количество молекул, содержащихся в
данном теле. Но, как мы уже убедились, это количество просто огромно для любого
макроскопического тела, поэтому нам снова нужно ввести специальную величину.
1 моль — это количество вещества, в котором содержится столько же молекул или атомов, сколько содержится атомов в 12 г углерода.
Это число было определено Амедео Авогадро еще в 19 веке. Один моль любого вещества содержит 6,02 х 1023 молекул. Это число называется числом Авогадро или постоянной Авогадро.
Таким образом, зная число молекул в теле, можно определить количество вещества:
С постоянной Авогадро связана и другая величина, которая называется молярной массой — это масса данного вещества, взятого в количестве 1 моль.
Исходя из этого, можно заключить, что молярная масса вещества равна .
Как видно из этого уравнения, молярная масса измеряется . Заметим, что массу любого вещества можно представить, как произведение массы молекулы этого вещества и количества молекул, содержащегося в данном веществе:
Тогда можно записать:
Необходимо
отметить, что молярную массу можно также взять из таблицы Менделеева, как и
молекулярную массу. Они численно равны, но следует понимать, что они обозначают
различные величины, а потому измеряются в различных единицах измерения. В
таблице Менделеева молярная масса указана в г/моль, поэтому нельзя забывать
переводить её в кг/моль при решении задач по физике.
Они численно равны, но следует понимать, что они обозначают
различные величины, а потому измеряются в различных единицах измерения. В
таблице Менделеева молярная масса указана в г/моль, поэтому нельзя забывать
переводить её в кг/моль при решении задач по физике.
Пример решения задачи.
Задача 1. Определите массу 3 моль углекислого газа.
Масса и размер молекул
Многие опыты показывают, что размер молекулы очень мал. Линейный размер молекулы или атома можно найти различными способами. Например, с помощью электронного микроскопа, получены фотографии некоторых крупных молекул, а с помощью ионного проектора (ионного микроскопа) можно не только изучить строение кристаллов, но определить расстояние между отдельными атомами в молекуле.
Используя достижения современной экспериментальной техники, удалось определить
линейные размеры простых атомов и молекул, которые составляют около 10-8 см. Линейные размеры сложных атомов и молекул намного больше. Например, размер молекулы
белка составляет 43*10-8 см.
Линейные размеры сложных атомов и молекул намного больше. Например, размер молекулы
белка составляет 43*10-8 см.
Для характеристики атомов используют представление об атомных радиусах, которые дают
возможность приближённо оценить межатомные расстояния в молекулах, жидкостях или
твёрдых телах, так как атомы по своим размерам не имеют чётких границ. То есть
Размер молекулы настолько мал, что представить его можно только с помощью сравнений. Например, молекула воды во столько раз меньше крупного яблока, во сколько раз яблоко меньше земного шара.
Моль вещества
Массы отдельных молекул и атомов очень малы, поэтому в расчётах удобнее использовать не абсолютные значения масс, а относительные.
Относительная молекулярная масса (или
относительная атомная масса) вещества
Мr – это отношение массы молекулы (или атома)
данного вещества к 1/12 массы атома углерода.
Мr = (m0) : (m0C / 12)
где m0 – масса молекулы (или атома) данного вещества, m0C – масса атома углерода.
Относительная молекулярная (или атомная) масса вещества показывает, во сколько раз масса молекулы вещества больше 1/12 массы изотопа углерода С12. Относительная молекулярная (атомная) масса выражается в атомных единицах массы.
Атомная единица массы – это 1/12 массы изотопа углерода С12. Точные измерения показали, что атомная единица массы составляет 1,660*10-27 кг, то есть
1 а.е.м. = 1,660 * 10-27 кг
Относительная молекулярная масса вещества может быть вычислена путём сложения относительных атомных масс элементов, входящих в состав молекулы вещества. Относительная атомная масса химических элементов указана в периодической системе химических элементов Д.И. Менделеева.
В периодической системе Д.И. Менделеева для каждого элемента указана атомная масса,
которая измеряется в атомных единицах массы (а.
Зачем измерять массу молекул и атомов в а.е.м., если есть граммы и килограммы? Конечно, можно использовать и эти единицы измерения, но это будет очень неудобно для записи (слишком много чисел придётся использовать для того, чтобы записать массу). Чтобы найти массу элемента в килограммах, нужно атомную массу элемента умножить на 1 а.е.м. Атомная масса находится по таблице Менделеева (записана справа от буквенного обозначения элемента). Например, вес атома магния в килограммах будет:
m0Mg = 24,305 * 1 a.e.м. = 24,305 * 1,660 * 10-27 = 40,3463 * 10-27 кг
Массу молекулы можно вычислить путём сложения масс элементов, которые входят в состав молекулы. Например, масса молекулы воды (Н 2О) будет равна:
m0Н2О = 2 * m0H + m0O = 2 * 1,00794 + 15,9994 = 18,0153 a. e.м. = 29,905 * 10-27 кг
e.м. = 29,905 * 10-27 кг
Количество вещества принято считать пропорциональным числу частиц. Количество вещества – это физическая величина, характеризующая относительное число молекул и атомов в теле. Единица количества вещества называется молем (моль).
Моль равен количеству вещества системы, в которой содержится столько же молекул, сколько содержится атомов в 0,012 кг углерода С12. То есть, если у нас есть система с каким-либо веществом, и в этой системе столько же молекул этого вещества, сколько атомов в 0,012 кг углерода, то мы можем сказать, что в этой системе у нас 1 моль вещества.
Постоянная Авогадро
Количество вещества
ν = N / NA
где N – количество молекул в данном теле,
NA – количество молекул в 1 моле вещества,
из которого состоит тело.
NA – это постоянная Авогадро. Количество вещества измеряется в молях.
Постоянная Авогадро – это количество молекул или атомов в 1 моле вещества. Эта постоянная получила своё название в честь итальянского химика и физика Амедео Авогадро (1776 – 1856).
В 1 моле любого вещества содержится одинаковое количество частиц.
NA = 6,02 * 1023 моль-1
Молярная масса – это масса вещества, взятого в количестве одного моля:
μ = m0 * NA
где m0 – масса молекулы.
Молярная масса выражается в килограммах на моль (кг/моль = кг*моль-1).
Молярная масса связана с относительной молекулярной массой соотношением:
μ = 10-3 * Mr [кг*моль-1]
Масса любого количества вещества m равна произведению массы одной молекулы m0 на количество молекул:
m = m0N = m0NAν = μν
Количество вещества равно отношению массы вещества к его молярной массе:
ν = m / μ
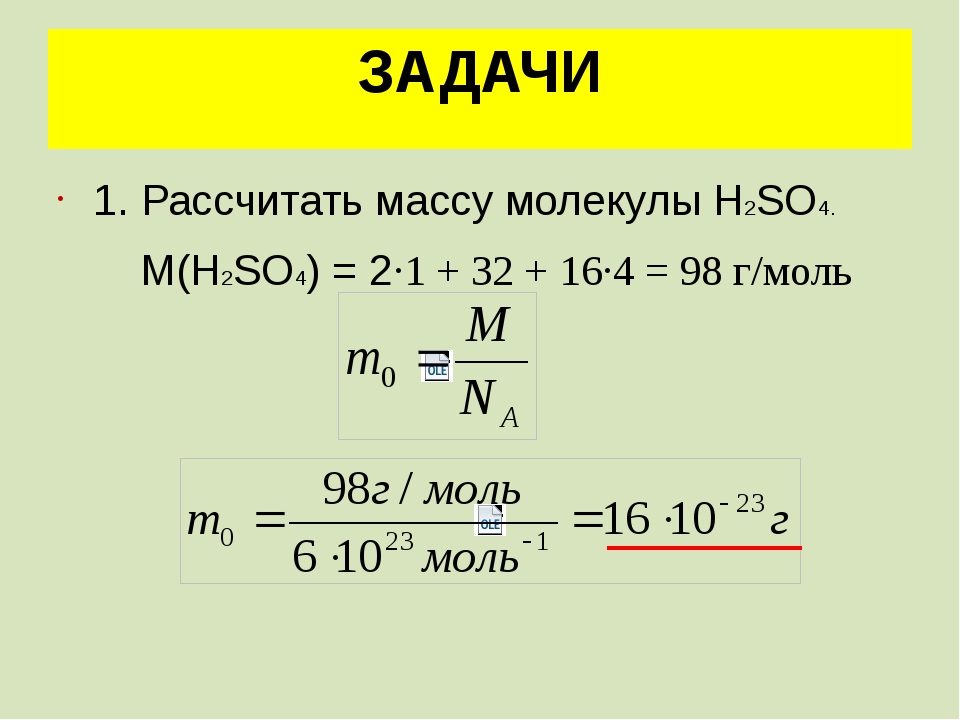
Массу одной молекулы вещества можно найти, если известны молярная масса и постоянная Авогадро:
m0 = m / N = m / νNA = μ / NA
Более точное определение массы атомов и молекул достигается при использовании
масс-спректрометра – прибора, в котором происходит разделение пучком заряженных
частиц в пространстве в зависимости от их массы заряда при помощи электрических
и магнитных полей.
Для примера найдём молярную массу атома магния. Как мы выяснили выше, масса атома магния равна m0Mg = 40,3463 * 10-27 кг. Тогда молярная масса будет:
μ = m0Mg * NA = 40,3463 * 10-27 * 6,02 * 1023 = 2,4288 * 10-2 кг/моль
То есть в одном моле «помещается» 2,4288 * 10-2 кг магния. Ну или примерно 24,28 грамм.
Как видим, молярная масса (в граммах) практически равна атомной массе, указанной для элемента в таблице Менделеева. Поэтому когда указывают атомную массу, то обычно делают так:
Атомная масса магния равна 24,305 а.е.м. (г/моль).Можете посчитать молярную массу для различных элементов и убедиться в правоте этого утверждения. Для расчёта молярной массы можно использовать простой калькулятор, который находится внизу страницы:
Масса молекул (относительная молекулярная масса) | Физика. Закон, формула, лекция, шпаргалка, шпора, доклад, ГДЗ, решебник, конспект, кратко
Тема: Количество вещества
Малые размеры атомов и молекул обусловливают их незначительную массу. Так, масса молекулы кислорода равна 53,5 • 10-27кг, водорода — 3,34 • 10-27 кг, воды — приблизительно 30 • 10-27 кг, что вызывает определенные трудности в расчетах. В связи с этим в молекулярной физике массу молекул часто измеряют в атомных единицах массы (а. е. м.), сравнивая ее с 1/12 массы атома изотопа углерода-12.
Так, масса молекулы кислорода равна 53,5 • 10-27кг, водорода — 3,34 • 10-27 кг, воды — приблизительно 30 • 10-27 кг, что вызывает определенные трудности в расчетах. В связи с этим в молекулярной физике массу молекул часто измеряют в атомных единицах массы (а. е. м.), сравнивая ее с 1/12 массы атома изотопа углерода-12.
Отношение массы молекулы данного вещества m0 к 1/12 массы атома углерода m0C называют относительной молекулярной массой вещества Mr:
Чтобы определить относительную молекулярную массу вещества, необходимо по структурной формуле сложить относительные атомные массы его составляющих. Например, относительная молекулярная масса воды равна 18, поскольку атомные массы водорода и кислорода равны 1 и 16 соответственно. Из формулы воды H2O имеем: 2 x 1 + 16 = 18 а. е. м.
е. м.
Множитель 1/12 введен для того, чтобы относительные молекулярные массы были близки к целым числам. Например, относительная молекулярная масса молекулы кислорода O2 равна приблизительно 32 а. е. м., а молекулы водорода — 2 а. е. м.
Установлено, что атомная единица массы равняется 1,6605655 • 10-27 кг. Поэтому по данному значению можно определить массу любой молекулы:
m0≈ Мr• 1,661 • 10-27 кг.
Масса молекулы воды приблизительно равна: mН2O = 18 • 1,661 • 10-27 кг ≈ 30 • 10-27 кг. Материал с сайта http://worldofschool.ru
Итак, размеры и масса молекул очень маленькие, тем не менее их количество в макроскопическом теле огромное. Например, в 1 г воды приблизительно 3,3 • 1022 молекул. Чтобы упростить расчеты, в физике и химии количество атомов, молекул или других структурных единиц в данном теле принято сравнивать с количеством атомов в 12 г углерода.
Например, в 1 г воды приблизительно 3,3 • 1022 молекул. Чтобы упростить расчеты, в физике и химии количество атомов, молекул или других структурных единиц в данном теле принято сравнивать с количеством атомов в 12 г углерода.
Для измерения массы вещества молекулярная физика использует относительную молекулярную (атомную) массу. Относительные атомные массы всех известных химических элементов приведены в Периодической таблице химических элементов Д. И. Менделеева.
На этой странице материал по темам:-
Формула относительной молекулярной массы физика
Гдз конспект относительная молекулярная масса
Молекулярная физика доклад
-
Почему молекулярная физика использует относительные величины для измерения массы?
-
Что такое относительная молекулярная масса?
Физика.
 10 класс. Основы молекулярно-кинетической теории. Урок 2.
10 класс. Основы молекулярно-кинетической теории. Урок 2.
Физика. 10 класс.
Урок 2.
Размеры и масса молекул.
Свойства и поведение тел, в процессах передачи и превращения энергии, определяются движением взаимодействующих друг с другом частиц, из которых состоит тело: атомов, молекул и ионов. Каков размер этих частиц? Как его измерить? Если высыпать горошины из стакана на стол, то толщина образованного ими на столе слоя окажется равной диаметру горошины. Подобный способ можно использовать для определения размеров частиц вещества. Конечно же, реальная форма частиц вещества не шарообразная, а гораздо более сложная. Но указанный способ позволяет, с известной точностью, оценить размеры частиц вещества. Частицы в жидкости располагаются достаточно плотно (см. рисунок ниже).
Можно считать, что на каждую частицу
вещества приходится объем, равный объему куба, сторона которого равна диаметру
частицы. Тогда, зная плотность жидкости и диаметр частицы вещества, а стало
быть, и объем частицы, можно оценить массу частицы вещества. Оценки размера
и массы молекулы сделаны ниже на рисунках для капли нефти.
Тогда, зная плотность жидкости и диаметр частицы вещества, а стало
быть, и объем частицы, можно оценить массу частицы вещества. Оценки размера
и массы молекулы сделаны ниже на рисунках для капли нефти.
|
Рис. 7. Оценка размера молекулы. |
Рис. 8. Оценка массы молекулы. |
В силу того, что массы частиц вещества
крайне малы, удобно пользоваться не абсолютными, а относительными единицами
массы. Для этого используется так называемая атомная единица массы (а.е.м.),
равная 1/12 массы атома углерода. Массу частицы, измеренную в а.е.м. принято
называть относительной атомной (или молекулярной) массой. Значения относительных
атомных масс приведены в периодической системе химических элементов Д.И. Менделеева.
Относительная молекулярная масса молекулы вещества равна сумме относительных
атомных масс атомов, составляющих данную молекулу. Экспериментально установлено,
что 1 а.е.м. = 1,66· 10-27 кг. В Международной системе
СИ для измерения количества вещества (v) введена специальная единица — моль.
1 моль — это количество вещества, в котором содержится столько же частиц, сколько
атомов содержится в 12 граммах углерода. Постоянная Авогадро численно равна
количеству частиц, содержащихся в 1 моле любого вещества: Na= 6· 1023
моль-1. Масса 1 моля вещества называется молярной массой (М). Численное
значение молярной массы, выраженной в г/моль, равно значению относительной атомной
или молекулярной массы. Количество вещества, постоянная Авогадро, молярная масса,
масса молекулы — эти величины связаны между собой соотношениями,
которые приведены ниже на рисунках.
Часто при решении той или иной задачи важнее знать не число частиц вещества,
а их концентрацию. Концентрация (n) показывает, сколько частиц содержится в
единице объема (чаще всего — в одном кубическом метре) данного вещества.
Экспериментально установлено,
что 1 а.е.м. = 1,66· 10-27 кг. В Международной системе
СИ для измерения количества вещества (v) введена специальная единица — моль.
1 моль — это количество вещества, в котором содержится столько же частиц, сколько
атомов содержится в 12 граммах углерода. Постоянная Авогадро численно равна
количеству частиц, содержащихся в 1 моле любого вещества: Na= 6· 1023
моль-1. Масса 1 моля вещества называется молярной массой (М). Численное
значение молярной массы, выраженной в г/моль, равно значению относительной атомной
или молекулярной массы. Количество вещества, постоянная Авогадро, молярная масса,
масса молекулы — эти величины связаны между собой соотношениями,
которые приведены ниже на рисунках.
Часто при решении той или иной задачи важнее знать не число частиц вещества,
а их концентрацию. Концентрация (n) показывает, сколько частиц содержится в
единице объема (чаще всего — в одном кубическом метре) данного вещества. Ниже на рисунках приведены формулы для массы молекулы mo, молярной
массы M, количества вещества v, числа молекул N и концентрации молекул n. (V — объем вещества).
Ниже на рисунках приведены формулы для массы молекулы mo, молярной
массы M, количества вещества v, числа молекул N и концентрации молекул n. (V — объем вещества).
Основные итоги.
Решите задачу 1. Найдите массу молекулы воды.
Решите задачу 1a. Сколько молекул содержится в 1 см3 воды?
Компания — Компания «Винк» — дистрибуция инженерных пластиков
Одним из проявлений научно-технического прогресса и связанного с ним процесса технического перевооружения современных производств являются разработка и внедрение новых видов конструкционных материалов, главным образом – полимеров. Современные полимерные материалы обладают целым рядом преимуществ по сравнению с традиционными конструкционными материалами, что позволяет увеличивать производительность и срок службы оборудования, следовательно, повышать рентабельность производства, создавать конкурентные преимущества. В некоторых случаях свойства полимеров настолько уникальны, что альтернативы их применению просто не существует, в особенности, если мы говорим о полимерах нового поколения, внедренных в широкую практику в последнее десятилетие.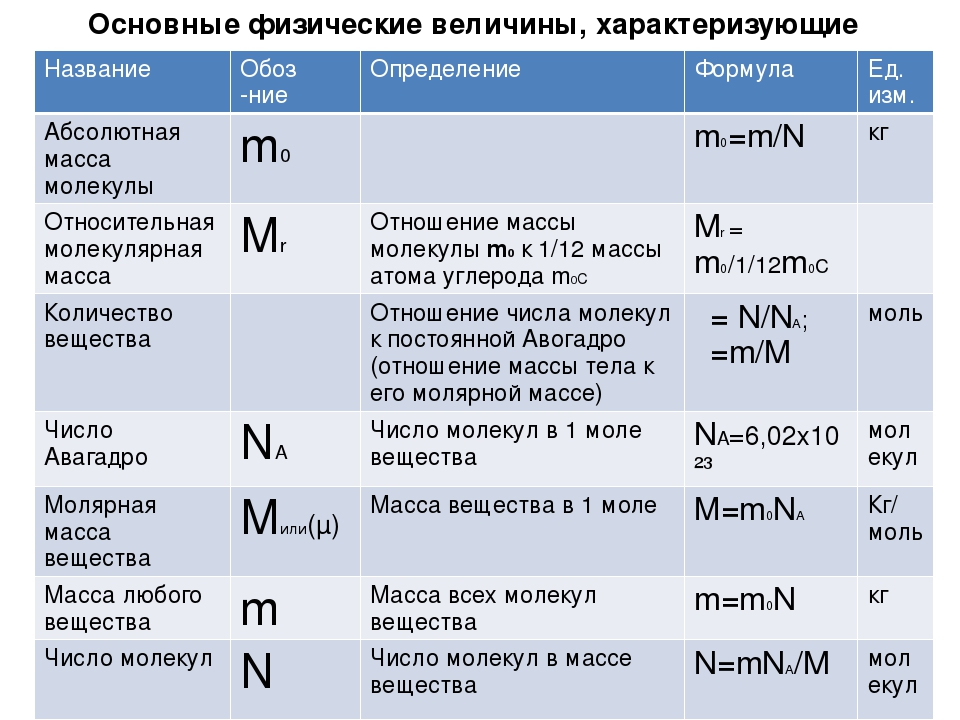
Замещение традиционных материалов
Целью нашей компании является активизация внедрения инженерных пластиков в формах полуфабрикатов (листов, прутков и стержней из полипропилена и полиэтилена, профилей, труб, деталей и комплектующих) в различных отраслях современного производства. Основная задача, которую призван решить данный ресурс – помочь техническим специалистам производственных предприятий разобраться в огромном разнообразии современных полимерных материалов, получить информацию о передовом зарубежном опыте применения пластиковых полуфабрикатов для решения инженерных задач в указанных направлениях, найти оптимальное решение применительно к конкретной актуальной задаче.
Основные направления применения полимерных полуфабрикатов
С момента начала практического применения полимеров (приблизительно полвека назад) объем их потребления рос в геометрической прогрессии, и в дальнейшем эта тенденция сохраниться. В частности, в последнее время в отечественной практике широко применяются следующие виды полуфабрикатов инженерных пластиков:
- Листовой полипропилен, ПВХ листы – для футеровки и изготовления ванн и других видов емкостей промышленного назначения;
- Листовой полиэтилен – для изготовления емкостей хранения, емкостей смешения, реакторов и прочих видов емкостного оборудования, в том числе в пищевом производстве;
- Полипропиленовые трубы и фитинги – для создания промышленных трубопроводов;
- Плиты из сверхвысокомолекулярного полиэтилена (СВМПЭ, PE1000) – для изготовления деталей машин и механизмов, деталей скольжения, для облицовки технологического оборудования, футеровки поверхностей;
- Листы PVDF, листы ПНД и других фторопластов – для изготовления емкостного оборудования для особо агрессивных сред;
- ПВХ фитинги и трубы, трубы из ПВДФ и других фторолефинов (фторопластов) – для создания промышленных трубопроводов.

Более подробно о применении этих и других видов инженерных пластиков в различных отраслях можно узнать в разделе «Решения» нашего сайта.
Единица измерения молярной массы
Единица измерения молярной массы
1 а.е.м. = 1/12 m(12С) = 1,66057×10-27 кг = 1,66057×10-24 г.
Относительная атомная масса элемента (Ar) – это безразмерная величина, равная отношению средней массы атома элемента к 1/12 массы атома 12С. При расчете относительной атомной массы учитывается распространенность изотопов элементов в земной коре. Например, хлор имеет два изотопа 35Сl (75,5%) и 37Сl (24,5%).Относительная атомная масса хлора равна:
Ar(Cl) = (0,755×m(35Сl) + 0,245×m(37Сl)) / (1/12×m(12С) = 35,5.
Из определения относительной атомной массы следует, что средняя абсолютная масса атома равна относительной атомной массе, умноженной на а. е.м.:
е.м.:
m(Cl) = 35,5 ×1,66057×10-24 = 5,89×10-23 г.
Относительная молекулярная масса вещества (Mr) – это безразмерная величина, равная отношению массы молекулы вещества к 1/12 массы атома 12С. Относительная молекулярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы, например:
Mr(N2O) = 2×Ar(N) + Ar(O) = 2×14,0067 + 15,9994 = 44,0128.
Число атомов и молекул в обычных образцах веществ очень велико, поэтому при характеристике количества вещества используют специальную единицу измерения – моль.
Масса одного атома 12С равна 12 а.е.м., поэтому число атомов в 12 г изотопа 12С равно:
NA = 12 г / 12 × 1,66057×10-24 г = 1/1,66057×10-24 = 6,0221×10-23.
Таким образом, моль вещества содержит 6,0221×10-23 частиц этого вещества.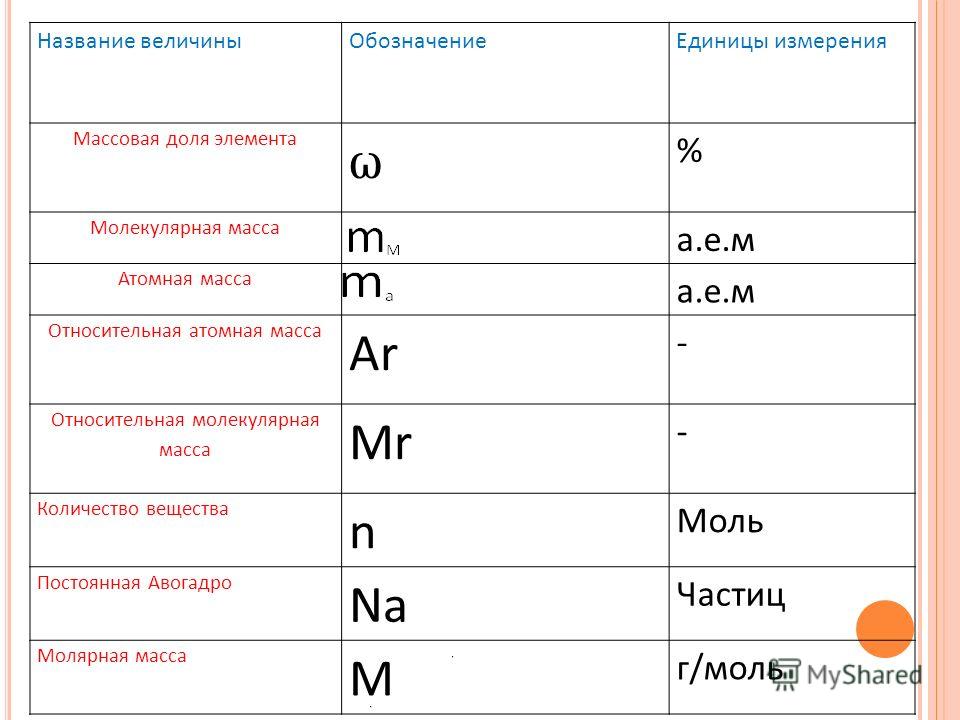
Физическую величину NA называют постоянной Авогадро, она имеет размерность [NA] = моль-1. Число 6,0221×10-23 называют числом Авогадро.
Молярная масса (М) – это масса 1 моль вещества. Легко показать, что численные значения молярной массы М и относительной молекулярной массы Mr равны, однако первая величина имеет размерность [M] = г/моль, а вторая безразмерна:
M = NA × m (1 молекулы) = NA × Mr × 1 а.е.м. = (NA ×1 а.е.м.) × Mr = × Mr.
Это означает, что если масса некоторой молекулы равна, например, 44 а.е.м., то масса одного моля молекул равна 44 г.
Постоянная Авогадро является коэффициентом пропорциональности, обеспечивающим переход от молекулярных отношений к молярным.
Примеры решения задач
МКТ
на главную
Официальный сайт АНО ДО Центра «Логос», г. Глазов
Глазов
http://logos-glz.ucoz.net/
ГОТОВИМСЯ К УРОКУ
Кинематика
Динамика
МКТ
Термодинамика
Электростатика
Электрический ток
Электрический ток в средах
Магнитное поле Электромагнитная индукция
Оптика
Методы познания
Молекулярно-кинетическая теория немного о физике:
Молекулярно-кинетическая теория изучает строение и свойства тел на основе молекулярного строения.
Основные положения МКТ
и их опытное
обоснование.
1. Все вещества (тела) состоят из микрочастиц — молекул, атомов или ионов.
2. Микрочастицы находятся в непрерывном движении.
3. Микрочастицы взаимодействуют друг с другом. Между частицами существуют силы притяжения и отталкивания.
Существование микрочастиц — молекул, атомов и ионов подтверждается непосредственным наблюдением в электронных микроскопах, растворимостью твердых тел в жидкостях, механическим дроблением твердых тел, сжимаемостью и проницаемостью веществ.
Непрерывность движения микрочастиц подтверждается диффузией, броуновским движением, способностью газов неограниченно расширятся и занимать весь предоставленный объем.
О взаимодействии
микрочастиц позволяют утверждать прочность и упругость веществ, способность
жидкостей смачивать некоторые твердые тела, поверхностное натяжение жидкостей и
др.
Масса и размеры атомов и молекул.
Молярная масса — физическая величина, равная отношению массы вещества к количеству вещества.
где M — молярная масса, m — масса вещества, ν — количество вещества.
Молярная масса численно равна массе одного моля вещества.
Единица измерения молярной массы — кг/моль.
где Na = 6,022·1023 моль-1 — постоянная Авогадро,
N- число частиц системы, m0 — масса одной молекулы (для веществ атомарного строения — масса атома).
Масса молекулы равна отношению массы
всего вещества к количеству молекул в веществе или отношению молярной
массы к постоянной Авогадро.
Единица измерения массы молекулы — кг.
Средняя масса молекул 10-23 — 10 -26 кг. Например, масса молекулы воды — 3·10-26 кг.
Размер атома определяется расстоянием от центра ядра до орбит, на которых находятся валентные электроны или расстоянием от центра ядра до внешних заполненных электронных орбит.
Размер молекул — условная величина.
Эффективным диаметром молекулы называют расстояние предельного сближения центров двух молекул. Размеры молекулы порядка 10 -10 м. Например, эффективный диаметр молекулы воды примерно 4·10 -26 м.
Для молекул
(атомов) веществ в твердом и жидком состоянии примерный объем одной молекулы
(атома) равен отношению всего объема вещества к количеству молекул (атомов).
где V0 -объем молекулы или атома.
Взаимодействие молекул и агрегатные состояния.
Межмолекулярное взаимодействие имеет электрическую природу. Молекулы в целом электрически нейтральны, т. к. положительные и отрицательные заряды в них скомпенсированы.
Но электрические поля за пределами молекул существуют и убывают с расстоянием. Посредством этих электрических полей молекулы взаимодействуют друг с другом. Между молекулами действуют одновременно силы притяжения и отталкивания. На малых расстояниях силы отталкивания возрастают быстрее сил притяжения. Зависимость результирующей силы взаимодействия молекул от расстояния между ними представлена на графике:
Расстояние между
молекулами веществ в различных агрегатных состояниях определят степень
взаимодействия молекул и вид теплового движения.
Среднее расстояние между молекулами газа в десятки раз превышает размеры молекул. И поэтому взаимного притяжения между молекулами практически нет. Движение же молекул вещества в газообразном состоянии можно считать движением по инерции: молекулы движутся равномерно и прямолинейно до столкновения в пространстве с другой молекулой, при столкновении они меняют модуль и направление скорости и далее движутся равномерно прямолинейно до следующего столкновения. Так же при столкновении молекулы, состоящие из нескольких атомов могут приобрести и вращательное движение. Следовательно, тепловое движение молекул вещества в газообразном состоянии является поступательным и вращательным.
В жидкостях
молекулы располагаются на расстояниях соизмеримых с размерами самих молекул.
Благодаря взаимодействию молекула некоторое время (время оседлой жизни
молекулы) колеблется в положении равновесия, а затем перескакивает на
другое место, имея тем самым возможность перемещаться по всему объему жидкости. Поэтому тепловое движение молекул вещества в жидком состоянии является
поступательным и колебательным.
Поэтому тепловое движение молекул вещества в жидком состоянии является
поступательным и колебательным.
В твердых телах силы притяжения между молекулами сравнительно велики. Молекулы удерживаются в положениях равновесия и совершают колебательные движения. Следовательно, тепловое движение молекул является колебательным.
Модель идеального газа.
Для объяснения свойств вещества в газообразном состоянии в молекулярно-кинетической теории рассматривается модель идеального газа.
Под моделью идеального газа понимают газ, удовлетворяющий следующим условиям:
— молекулы газа обладают пренебрежимо малым объемом по сравнению с объемом сосуда, в котором находится газ;
— между молекулами отсутствуют силы притяжения и молекулы взаимодействуют только при соударении как абсолютно упругие тела;
— тепловое
равновесие по всему объему достигается мгновенно.
Реальный газ приближается по своим свойствам к модели идеального газа при значительном разрежении. Но существуют газы, которые и при нормальных условиях близки по своим свойствам к модели идеального газа.
Основное уравнение
молекулярно-кинетической теории газов.
Молекулы газа при столкновении со стенками взаимодействуют с ними как упругие тела и передают стенкам свои импульсы. Проекция импульса силы, действующей на стенку со стороны одной молекулы равен
Fx· t = 2m0 · υx
Пусть за время t о стенку ударяется N частиц, тогда они передадут стенке импульс
N · Fx· t = 2m0 · υx· N
Число ударяющих о стенку молекул можно определить через концентрацию частиц и объем сосуда:
Тогда для проекции импульса силы получаем выражение:
По определению давления:
Так как все направления движения частиц равновероятны, то для проекции скорости справедливо равенство:
Основное уравнение молекулярно-кинетической теории:
Это уравнение
устанавливает связь между микро- и макропараметрами.
Уравнение состояния идеального газа.
Давление газа пропорционально концентрации молекул и его абсолютной температуре
где k=1,38 · 10-23Дж/К -постоянная Больцмана, n -концентрация молекул, Т — абсолютная температура.
Используем равенства для концентрации и числа молекул газа
получаем:
где R = 8,31 Дж/(моль·К) — универсальная газовая постоянная
С учетом того, что количество вещества можно определить, зная массу газа и его молярную массу, получаем уравнение состояния идеального газа:
Уравнение состояния идеального газа можно переписать в виде:
где
ρ -плотность газа.
Изопроцессы.
Изопроцесс — процесс, который происходит с данной массой газа при одном неизменном параметре — температуре, давлении, объёме, а так же при отсутствии теплообмена с окружающей средой.
Используя уравнение состояния идеального газа, для заданной массы заданного газа получаем:
Тогда для двух состояний данной массы газа имеет место равенство:
1.Изотермический процесс — процесс протекающий при неизменной температуре.
С учётом того, что температура неизменна, получаем:
или
Закон Бойля-Мариотта: Для данной массы газа при постоянной температуре давление
газа обратно пропорционально его объему.
График изотермического процесса называют изотермой.
2.Изохорный процесс — процесс протекающий при неизменном объёме.
С учётом того, что объём газа не меняется, получаем:
или
Закон Шарля: Для данной массы газа при постоянном объёме давление газа прямо пропорционально его абсолютной температуре.
График изохорного процесса называют изохорой.
3.Изобарный процесс — процесс протекающий при неизменном давлении.
С учётом того, что давление газа не меняется, получаем:
или
Закон Гей-Люссака: Для данной массы газа при постоянном давлении объём газа
прямо пропорционален его абсолютной температуре.
График изобарного процесса называют изобарой.
4. Адиабатный процесс-процесс, происходящий в системе без теплообмена с окружающими телами.
Параметры давления и объёма связаны уравнением Пуассона:
, где γ -показатель адиабаты, .
График адиабатного процесса называют адиабатой.
Расчет молекулярной массы
(из полного курса стехиометрии OLI)
Молекулярная масса – это масса одного моля вещества. Обычно в качестве единиц измерения используются граммы на моль. В
В этом фильме мы показываем, как рассчитать молекулярную массу вещества по атомным массам, указанным на
периодическая таблица. На другой странице мы используем молекулярную массу для преобразования между
макроскопический масштаб (граммы вещества) и микроскопический масштаб (количество молекул этого вещества).
Вычисление текста фильма о молекулярном весе
Мы можем рассчитать молекулярную массу вещества, используя его химическую формулу и периодическую таблицу.
Допустим, мы хотим рассчитать молекулярную массу воды. Молекулярная масса – это сумма атомных массы атомов в молекуле. Мы можем продолжить наш расчет, составив таблицу. Перечислим атомы в молекула вниз слева.Вода содержит водород и кислород. Затем запишем, сколько каждого из этих атомов молекула содержит , что в случае с водой равно 2 и 1.
Затем мы берем атомный вес атомов из периодической таблицы. Для водорода атомный вес равен 1,00794, а для кислорода 15,9994. Так как в молекуле 2 атома водорода, то общий вес водорода в воде 2 раза 1,00794 или 2,01588. Кислорода всего 1, поэтому общий вес кислорода равен 15.9994.
Наконец, мы сложим массы всех атомов, чтобы получить общую молекулярную массу воды, 18,0153 грамма на 1 грамм. крот.
крот.
| Элемент | Атомный вес (г/моль) |
| Ба | 137,327 |
| С | 12.0107 |
| Ca | 40.078 |
| Кр | 51.9961 |
| ЧАС | 1.00794 |
| мг | 24.3050 |
| Н | 14.0067 |
| На | 22.989770 |
| О | 15,9994 |
| п | 30.973761 |
Используйте данные периодической таблицы, показанной выше, чтобы ответить на следующие вопросы.
Моль и молярная масса
Как вы узнали из главы 1 «Введение в химию», массовое число представляет собой сумму количества протонов и нейтронов, присутствующих в ядре атома. Массовое число – это целое число, приблизительно равное числовому значению атомной массы. Хотя массовое число безразмерно, ему присваиваются единицы, называемые атомными единицами массы (а.е.м.) . Поскольку молекула или многоатомный ион представляют собой совокупность атомов, идентичность которых указана в их молекулярной или ионной формуле, мы можем вычислить среднюю атомную массу любой молекулы или многоатомного иона, исходя из ее состава, путем сложения масс составляющих атомов.Средняя масса одноатомного иона такая же, как средняя масса атома элемента, потому что масса электронов настолько мала, что в большинстве расчетов не имеет значения.
Хотя массовое число безразмерно, ему присваиваются единицы, называемые атомными единицами массы (а.е.м.) . Поскольку молекула или многоатомный ион представляют собой совокупность атомов, идентичность которых указана в их молекулярной или ионной формуле, мы можем вычислить среднюю атомную массу любой молекулы или многоатомного иона, исходя из ее состава, путем сложения масс составляющих атомов.Средняя масса одноатомного иона такая же, как средняя масса атома элемента, потому что масса электронов настолько мала, что в большинстве расчетов не имеет значения.
Молекулярные и формульные массы
Молекулярная массаСумма средних масс атомов в одной молекуле вещества, умноженная на ее нижний индекс. вещества – это сумма средних масс атомов в одной молекуле вещества. Он рассчитывается путем сложения атомных масс элементов в веществе, каждое из которых умножается на его нижний индекс (написанный или подразумеваемый) в молекулярной формуле.Поскольку единицами атомной массы являются атомные единицы массы, единицы молекулярной массы также являются атомными единицами массы. Процедура расчета молекулярных масс проиллюстрирована в примере 1.
Процедура расчета молекулярных масс проиллюстрирована в примере 1.
Пример 1
Рассчитайте молекулярную массу этанола, сокращенная структурная формула которого: CH 3 CH 2 OH. Среди множества применений этанол является топливом для двигателей внутреннего сгорания.
Дано: молекула
Требуемый запрос: молекулярная масса
Стратегия:
A Определите количество атомов каждого элемента в молекуле.
B Найдите атомную массу каждого элемента из таблицы Менделеева и умножьте атомную массу каждого элемента на количество атомов этого элемента.
C Сложите массы, чтобы получить молекулярную массу.
Решение:
A Молекулярная формула этанола может быть записана тремя различными способами: CH 3 CH 2 OH (что иллюстрирует наличие этильной группы, CH 3 CH 2 — и -OH группа), C 2 H 5 OH и C 2 H 6 O; все показывают, что этанол имеет два атома углерода, шесть атомов водорода и один атом кислорода.
B Взяв атомные массы из таблицы Менделеева, получим
2 × атомная масса углерода = 2 атома (12,011 а.е.м.) = 24,022 а.е.м.6 × атомная масса водорода = 6 атомов (1,0079 а.е.м.) = 6,0474 а.е.м.1 × атомная масса кислорода = 1 атом (15,9994 а.е.м.) = 15,9994 а.е.м.C Сложение масс дает молекулярную массу:
24,022 а.е.м. + 6,0474 а.е.м. + 15,9994 а.е.м. = 46.069 а.е.м.В качестве альтернативы мы могли бы использовать преобразование единиц измерения, чтобы получить результат за один шаг, как описано в разделе «Основные навыки 2» (раздел 3.7 «Основные навыки 2»):
[2 атома C (12,011 а.е.м. 1 атома С)] + [6 атомов Н (1,0079 а.е.м. 1 атома Н)] + [1 атома O (15,9994 а.е.м. 1 атома О)] = 46,069 а.е.м.Тот же расчет можно выполнить в табличном формате, что особенно полезно для более сложных молекул:
2C(2 атома)(12. 011 а.е.м./атом)=24,022 а.е.м.6H(6 атомов)(1,0079 а.е.м./атом)=6,0474 а.е.м.+1O(1 атом)(15,9994 а.е.м./атом)=15,9994 а.е.м. C2H6Oмолекулярная масса этанола=46,069 а.е.м.
011 а.е.м./атом)=24,022 а.е.м.6H(6 атомов)(1,0079 а.е.м./атом)=6,0474 а.е.м.+1O(1 атом)(15,9994 а.е.м./атом)=15,9994 а.е.м. C2H6Oмолекулярная масса этанола=46,069 а.е.м.
Упражнение
Рассчитайте молекулярную массу трихлорфторметана, также известного как фреон-11, сокращенная структурная формула которого CCl 3 F. До недавнего времени он использовался в качестве хладагента. Структура молекулы фреона-11 следующая:
Ответ: 137.368 а.е.м.
В отличие от молекул, которые имеют ковалентные связи, ионные соединения не имеют легко идентифицируемой молекулярной единицы. Таким образом, для ионных соединений мы используем формулу масса (также называемая эмпирической формулой массы другое название формулы массы) соединения, а не молекулярную массу. Масса формулыСумма атомных масс всех элементов в эмпирической формуле, каждый из которых умножается на его нижний индекс. представляет собой сумму атомных масс всех элементов в эмпирической формуле, каждый из которых умножается на его нижний индекс (записанный или подразумеваемый).Это прямой аналог молекулярной массы ковалентного соединения. Еще раз, единицами являются атомные единицы массы.
представляет собой сумму атомных масс всех элементов в эмпирической формуле, каждый из которых умножается на его нижний индекс (записанный или подразумеваемый).Это прямой аналог молекулярной массы ковалентного соединения. Еще раз, единицами являются атомные единицы массы.
Обратите внимание на шаблон
Атомная масса, молекулярная масса и формула массы имеют одни и те же единицы измерения: атомные единицы массы.
Пример 2
Рассчитайте массу формулы Ca 3 (PO 4 ) 2 , обычно называемого фосфатом кальция. Это соединение является основным источником кальция, содержащегося в коровьем молоке.
Дано: ионное соединение
Запрошено: формула масса
Стратегия:
A Определите количество атомов каждого элемента в эмпирической формуле.
B Найдите атомную массу каждого элемента из таблицы Менделеева и умножьте атомную массу каждого элемента на количество атомов этого элемента.
C Сложите массы, чтобы получить формулу массы.
Решение:
A Эмпирическая формула — Ca 3 (PO 4 ) 2 — показывает, что простейшая электрически нейтральная единица фосфата кальция содержит три иона Ca 2+ и два иона PO 4 302 ионы. Масса формулы этой молекулярной единицы рассчитывается путем сложения атомных масс трех атомов кальция, двух атомов фосфора и восьми атомов кислорода.
B Беря атомные массы из таблицы Менделеева, получаем
3 × атомная масса кальция = 3 атома (40,078 амуатом) = 120,234 а.е.м.2 × атомная масса фосфора = 2 атома (30,973761 амуатом) = 61,947522 а. е.м.8 × атомная масса кислорода = 8 атомов (15,9991 2амуатом) = 8 атомов (15,9991 2амуатом) = 2 атома
е.м.8 × атомная масса кислорода = 8 атомов (15,9991 2амуатом) = 8 атомов (15,9991 2амуатом) = 2 атома
C Сложение масс дает формулу массы Ca 3 (PO 4 ) 2 :
120.234 а.е.м. + 61,947522 а.е.м. + 127,9952 а.е.м. = 310,177 а.е.м.Мы также можем найти формулу массы Ca 3 (PO 4 ) 2 за один шаг, используя преобразование единиц измерения или табличный формат:
[3 атома Ca(40,078 а.е.м.1 атом Ca)]+[2 атома P(30,973761 а.е.м.1 атом P)]+[8 атомов O(15,9994 а.е.м. 1 атом O)]=310,177 а.е.м. 3Ca(3 атома)(40,078 а.е.м./атом)=120,234 а.е.м.2P(2 атома)(30,973761 а.е.м./атом)=61.947522 а.е.м.+8O(8 атомов)(15,9994 а.е.м./атом)=127,9952 а.е.м. Ca3P2O8масса формулы Ca3(PO4)2=310,177 а.е.м.Упражнение
Рассчитайте формулу массы Si 3 N 4 , обычно называемого нитридом кремния. Это чрезвычайно твердый и инертный материал, который используется для изготовления режущих инструментов для обработки твердых сплавов.
Это чрезвычайно твердый и инертный материал, который используется для изготовления режущих инструментов для обработки твердых сплавов.
Ответ: 140,29 а.е.м.
Крот
В главе 1 «Введение в химию» мы описали теорию Дальтона о том, что каждое химическое соединение имеет определенную комбинацию атомов и что отношения чисел атомов присутствующих элементов обычно представляют собой небольшие целые числа.Мы также описали закон кратных пропорций , который утверждает, что отношения масс элементов, образующих ряд соединений, представляют собой небольшие целые числа. Проблема для Дальтона и других ранних химиков состояла в том, чтобы обнаружить количественную связь между числом атомов в химическом веществе и его массой. Поскольку массы отдельных атомов настолько ничтожны (порядка 10 90 239 -23 90 240 г/атом), химики не измеряют массу отдельных атомов или молекул.В лаборатории, например, массы соединений и элементов, используемых химиками, обычно колеблются от миллиграммов до граммов, тогда как в промышленности химические вещества покупаются и продаются в килограммах и тоннах. Поэтому для анализа превращений, происходящих между отдельными атомами или молекулами в ходе химической реакции, процесса, в котором вещество превращается в одно или несколько других веществ с другим составом и свойствами, химикам совершенно необходимо знать, сколько атомов или молекул содержится в измеряемом количестве в лаборатории – данной массе образца.Единицей, обеспечивающей эту связь, является моль (моль). Количество вещества, которое содержит то же количество единиц (например, атомов или молекул), что и число атомов углерода ровно в 12 г изотопно чистого углерода-12., из латинское кротов , что означает «куча» или «куча» (, а не от маленького подземного животного!).
Поэтому для анализа превращений, происходящих между отдельными атомами или молекулами в ходе химической реакции, процесса, в котором вещество превращается в одно или несколько других веществ с другим составом и свойствами, химикам совершенно необходимо знать, сколько атомов или молекул содержится в измеряемом количестве в лаборатории – данной массе образца.Единицей, обеспечивающей эту связь, является моль (моль). Количество вещества, которое содержит то же количество единиц (например, атомов или молекул), что и число атомов углерода ровно в 12 г изотопно чистого углерода-12., из латинское кротов , что означает «куча» или «куча» (, а не от маленького подземного животного!).
Многие знакомые предметы продаются в числовых количествах с необычными названиями. Например, банки с газировкой продаются в упаковках по шесть штук, яйца продаются дюжинами (12), а карандаши часто продаются оптом (12 дюжин, или 144).Листы бумаги для принтера упакованы в пачки по 500 штук, что кажется большим количеством. Однако атомы настолько малы, что даже 500 атомов слишком малы, чтобы их можно было увидеть или измерить с помощью наиболее распространенных методов. Любая легко измеримая масса элемента или соединения содержит чрезвычайно большое количество атомов, молекул или ионов, поэтому для их подсчета требуется чрезвычайно большая числовая единица. Для этой цели используется моль.
Однако атомы настолько малы, что даже 500 атомов слишком малы, чтобы их можно было увидеть или измерить с помощью наиболее распространенных методов. Любая легко измеримая масса элемента или соединения содержит чрезвычайно большое количество атомов, молекул или ионов, поэтому для их подсчета требуется чрезвычайно большая числовая единица. Для этой цели используется моль.
моль определяется как количество вещества, которое содержит число атомов углерода ровно 12 г изотопно чистого углерода-12.Согласно самым последним экспериментальным измерениям, эта масса углерода-12 содержит 6,022142 × 10 23 атомов, но для большинства целей 6,022 × 10 23 обеспечивает достаточное количество значащих цифр. Так же, как 1 моль атомов содержит 6,022 × 10 23 атомов, 1 моль яиц содержит 6,022 × 10 23 яиц. Число в моле называется числом Авогадро. Число единиц (например, атомов, молекул или формульных единиц) в 1 моль: 6,022×1023. , в честь итальянского ученого 19-го века, который впервые предложил соотношение между объемами газов и числа содержащихся в них частиц.
, в честь итальянского ученого 19-го века, который впервые предложил соотношение между объемами газов и числа содержащихся в них частиц.
Непонятно, почему яйца идут дюжинами, а не 10 или 14, или почему пачка бумаги содержит 500 листов, а не 400 или 600. Определение крота, то есть решение основывать его на 12 г углерода -12 — тоже произвольно. Важным моментом является то, что 1 моль углерода — или чего-либо еще, будь то атомы, компакт-диски или дома — всегда имеет одно и то же число объектов: 6,022 × 10 23 .
Обратите внимание на шаблон
У одного крота всегда одинаковое количество предметов: 6.022 × 10 23 .
Чтобы оценить величину числа Авогадро, возьмем моль пенни. Сложенный вертикально моль пенни будет иметь высоту 4,5 × 10 90 239 17 90 240 миль, или почти в шесть раз больше диаметра галактики Млечный Путь. Если бы моль пенни распределить поровну между всем населением Земли, каждый человек получил бы более одного триллиона долларов. Ясно, что моль настолько велика, что ее можно использовать только для измерения очень маленьких объектов, таких как атомы.
Ясно, что моль настолько велика, что ее можно использовать только для измерения очень маленьких объектов, таких как атомы.
Концепция моля позволяет нам подсчитать определенное количество отдельных атомов и молекул путем взвешивания измеримых количеств элементов и соединений. Чтобы получить 1 моль атомов углерода-12, мы должны взвесить 12 г изотопно чистого углерода-12. Однако, поскольку каждый элемент имеет разную атомную массу, моль каждого элемента имеет разную массу, даже если он содержит одинаковое количество атомов (6,022 × 10 23 ). Это аналогично тому факту, что дюжина очень больших яиц весит больше, чем дюжина маленьких яиц, или что общий вес 50 взрослых людей больше, чем общий вес 50 детей.Из-за способа определения моля для каждого элемента количество граммов в моле совпадает с количеством атомных единиц массы в атомной массе элемента. Например, масса 1 моля магния (атомная масса = 24,305 а.е.м.) равна 24,305 г. Поскольку атомная масса магния (24,305 а. е.м.) чуть более чем в два раза превышает массу атома углерода-12 (12 а.е.м.), масса 1 моля атомов магния (24,305 г) чуть более чем в два раза превышает массу 1 моля углерода. -12 (12 г). Точно так же масса 1 моля гелия (атомная масса = 4.002602 а.е.м.) составляет 4,002602 г, что составляет примерно одну треть массы 1 моля углерода-12. Используя концепцию моля, мы можем теперь переформулировать теорию Дальтона: 1 моль соединения образуется путем соединения элементов в количествах, молярные отношения которых представляют собой небольшие целые числа. Например, 1 моль воды (H 2 O) содержит 2 моля атомов водорода и 1 моль атомов кислорода.
е.м.) чуть более чем в два раза превышает массу атома углерода-12 (12 а.е.м.), масса 1 моля атомов магния (24,305 г) чуть более чем в два раза превышает массу 1 моля углерода. -12 (12 г). Точно так же масса 1 моля гелия (атомная масса = 4.002602 а.е.м.) составляет 4,002602 г, что составляет примерно одну треть массы 1 моля углерода-12. Используя концепцию моля, мы можем теперь переформулировать теорию Дальтона: 1 моль соединения образуется путем соединения элементов в количествах, молярные отношения которых представляют собой небольшие целые числа. Например, 1 моль воды (H 2 O) содержит 2 моля атомов водорода и 1 моль атомов кислорода.
Молярная масса
Молярная массаМасса в граммах 1 моль вещества. вещества определяется как масса в граммах 1 моля этого вещества.Один моль изотопно чистого углерода-12 имеет массу 12 г. Для элемента молярная масса — это масса 1 моля атомов этого элемента; для ковалентного молекулярного соединения это масса 1 моль молекул этого соединения; для ионного соединения это масса 1 моля формульных единиц. То есть молярная масса вещества — это масса (в граммах на моль) 6,022 × 10 90 239 23 90 240 атомов, молекул или формульных единиц этого вещества. В каждом случае количество граммов в 1 моль равно количеству атомных единиц массы, которые описывают атомную массу, молекулярную массу или формулу массы соответственно.
То есть молярная масса вещества — это масса (в граммах на моль) 6,022 × 10 90 239 23 90 240 атомов, молекул или формульных единиц этого вещества. В каждом случае количество граммов в 1 моль равно количеству атомных единиц массы, которые описывают атомную массу, молекулярную массу или формулу массы соответственно.
Обратите внимание на шаблон
Молярная масса любого вещества – это его атомная масса, молекулярная масса или формульная масса в граммах на моль.
В периодической таблице атомная масса углерода указана как 12,011 а.е.м.; средняя молярная масса углерода — масса 6,022 × 10 90 239 23 90 240 атомов углерода — поэтому составляет 12,011 г/моль:
| Вещество (формула) | Атомная, молекулярная или формульная масса (а.е.м.) | Молярная масса (г/моль) |
|---|---|---|
| углерод (С) | 12. 011 (атомная масса) 011 (атомная масса) |
12.011 |
| этанол (C 2 H 5 OH) | 46,069 (молекулярная масса) | 46.069 |
| фосфат кальция [Ca 3 (PO 4 ) 2 ] | 310.177 (формула массы) | 310.177 |
Молярная масса встречающегося в природе углерода отличается от массы углерода-12 и не является целым числом, поскольку углерод представляет собой смесь углерода-12, углерода-13 и углерода-14.Один моль углерода по-прежнему содержит 6,022 × 10 23 атомов углерода, но 98,89 % этих атомов составляют углерод-12, 1,11 % – углерод-13, а след (около 1 атома на 10 12 ) — углерод-14. . (Для получения дополнительной информации см. Раздел 1.6 «Изотопы и атомные массы».) Точно так же молярная масса урана составляет 238,03 г/моль, а молярная масса йода составляет 126,90 г/моль. Когда мы имеем дело с такими элементами, как йод и сера, которые встречаются в виде двухатомной молекулы (I 2 ) и многоатомной молекулы (S 8 ), соответственно, молярная масса обычно относится к массе 1 моль атомов элемента — в данном случае I и S, , а не к массе 1 моля молекул элемента (I 2 и S 8 ).
. (Для получения дополнительной информации см. Раздел 1.6 «Изотопы и атомные массы».) Точно так же молярная масса урана составляет 238,03 г/моль, а молярная масса йода составляет 126,90 г/моль. Когда мы имеем дело с такими элементами, как йод и сера, которые встречаются в виде двухатомной молекулы (I 2 ) и многоатомной молекулы (S 8 ), соответственно, молярная масса обычно относится к массе 1 моль атомов элемента — в данном случае I и S, , а не к массе 1 моля молекул элемента (I 2 и S 8 ).
Молярная масса этанола — это масса этанола (C 2 H 5 OH), который содержит 6,022 × 10 23 молекул этанола. Как вы подсчитали в примере 1, молекулярная масса этанола составляет 46,069 а.е.м. Поскольку 1 моль этанола содержит 2 моля атомов углерода (2 × 12,011 г), 6 моль атомов водорода (6 × 1,0079 г) и 1 моль атомов кислорода (1 × 15,9994 г), его молярная масса составляет 46,069 г/ мол. Точно так же формула массы фосфата кальция [Ca 3 (PO 4 ) 2 ] равна 310.177 а.е.м., поэтому его молярная масса составляет 310,177 г/моль. Это масса фосфата кальция, содержащая 6,022 × 10 23 формульных единиц. На рис. 3.1 «Образцы 1 моль некоторых обычных веществ» показаны образцы, которые содержат ровно одну молярную массу нескольких обычных веществ.
Точно так же формула массы фосфата кальция [Ca 3 (PO 4 ) 2 ] равна 310.177 а.е.м., поэтому его молярная масса составляет 310,177 г/моль. Это масса фосфата кальция, содержащая 6,022 × 10 23 формульных единиц. На рис. 3.1 «Образцы 1 моль некоторых обычных веществ» показаны образцы, которые содержат ровно одну молярную массу нескольких обычных веществ.
Рисунок 3.1 Образцы 1 моль некоторых распространенных веществ
Моль является основой количественной химии. Он предоставляет химикам способ легко преобразовать массу вещества в число отдельных атомов, молекул или формульных единиц этого вещества.И наоборот, он позволяет химикам рассчитать массу вещества, необходимую для получения желаемого количества атомов, молекул или формульных единиц. Например, чтобы перевести моли вещества в массу, мы используем соотношение
.Уравнение 3.1
(моль)(молярная масса) → массаили, точнее,
моли (грамм-моль) = граммыИ наоборот, чтобы перевести массу вещества в моли, мы используем
Уравнение 3. 2
2
Обязательно обращайте внимание на единицы измерения при переводе массы в моли.
Рисунок 3.2 «Блок-схема преобразования между массой, числом молей и числом атомов, молекул или формульных единиц» представляет собой блок-схему преобразования между массой; количество родинок; и количество атомов, молекул или формульных единиц. Использование этих преобразований проиллюстрировано в Примере 3 и Примере 4.
Рис. 3.2 Блок-схема преобразования массы; Количество родинок; и количество атомов, молекул или формульных единиц
Пример 3
Для 35,00 г этиленгликоля (HOCH 2 CH 2 OH), который используется в чернилах для шариковых ручек, рассчитать количество
- моль.
- молекулы.
Дано: масса и молекулярная формула
Запрашиваемый: количество молей и количество молекул
Стратегия:
A Используйте молекулярную формулу соединения для расчета его молекулярной массы в граммах на моль.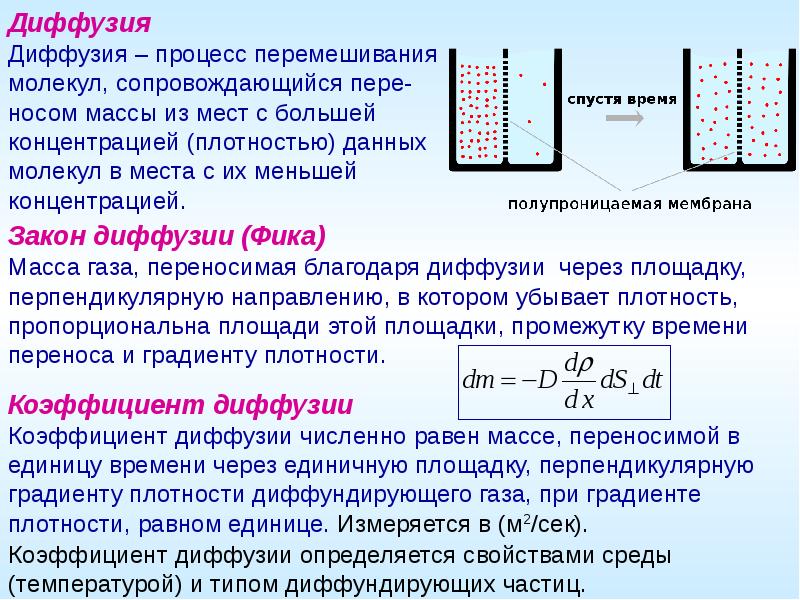
B Преобразование массы в моли путем деления полученной массы на молярную массу соединения.
C Преобразование молей в молекулы путем умножения числа молей на число Авогадро.
Решение:
-
A Молекулярную массу этиленгликоля можно рассчитать по его молекулярной формуле с помощью метода, показанного в примере 1:
2C(2 атома)(12.011 а.е.м./атом)=24,022 а.е.м.6H(6 атомов)(1,0079 а.е.м./атом)=6,0474 а.е.м.+2O(2 атома)(15,9994 а.е.м./атом)=31,9988 а.е.м. C2H6O2молекулярная масса этиленгликоля=62,068 а.е.м.Молярная масса этиленгликоля 62,068 г/моль.
B Количество молей этиленгликоля в 35,00 г можно рассчитать путем деления массы (в граммах) на молярную массу (в граммах на моль):
масса этиленгликоля (г) молярная масса (г/моль) = моли этиленгликоля (моль)Так
35. 00 г этиленгликоля (1 моль этиленгликоля 62,068 г этиленгликоля) = 0,5639 моль этиленгликоля
00 г этиленгликоля (1 моль этиленгликоля 62,068 г этиленгликоля) = 0,5639 моль этиленгликоля
Всегда полезно оценить ответ до того, как вы выполните фактический расчет . В этом случае указанная масса (35,00 г) на меньше молярной массы, поэтому ответ должен быть меньше 1 моль. Вычисленный ответ (0,5639 моль) действительно меньше 1 моль, так что, вероятно, мы не допустили серьезной ошибки в расчетах.
-
C Чтобы рассчитать количество молекул в образце, мы умножаем количество молей на число Авогадро:
молекул этиленгликоля = 0.5639 моль (6,022 × 1023 молекул на 1 моль) = 3,396 × 1023 молекулПоскольку мы имеем дело с чуть более 0,5 моль этиленгликоля, мы ожидаем, что количество присутствующих молекул будет немного больше половины числа Авогадро, или чуть больше 3 × 10 23 молекул, что действительно является кейс.

Упражнение
На 75,0 г CCl 3 F (Хладон-11) рассчитать количество
- моль.
- молекулы.
Ответ:
- 0,546 моль
- 3,29 × 10 23 молекул
Пример 4
Рассчитайте массу 1,75 моль каждого соединения.
- S 2 Cl 2 (обычное название: монохлорид серы; систематическое название: дихлорид дисульфура)
- Ca(ClO) 2 (гипохлорит кальция)
Дано: число молей и молекулярная или эмпирическая формула
Запрашиваемый: масса
Стратегия:
A Рассчитайте молекулярную массу соединения в граммах по его молекулярной формуле (если ковалентная) или эмпирической формуле (если ионная).
B Преобразование молей в массу путем умножения количества молей соединения на его молярную массу.
Решение:
Начнем с вычисления молекулярной массы S 2 Cl 2 и формулы массы Ca(ClO) 2 .
-
A Молярная масса S 2 Cl 2 получается из его молекулярной массы следующим образом:
2S(2 атома)(32.065 а.е.м./атом)=64,130 а.е.м.+2Cl(2 атома)(35,453 а.е.м./атом)=70,906 а.е.м. S2Cl2 молекулярная масса S2Cl2=135,036 а.е.м.Молярная масса S 2 Cl 2 составляет 135,036 г/моль.
B Масса 1,75 моль S 2 Cl 2 рассчитывается следующим образом:
моль S2Cl2 [молярная масса (гмоль)] → масса S2Cl2 (г) 1,75 моль S2Cl2 (135,036 г S2Cl21 моль S2Cl2) = 236 г S2Cl2 -
A Формула массы Ca(ClO) 2 получается следующим образом:
1Ca(1 атом)(40. 078 а.е.м./атом)=40,078 а.е.м.2Cl(2 атома)(35,453 а.е.м./атом)=70,906 а.е.м.+2O(2 атома)(15,9994 а.е.м./атом)=31,9988 а.е.м. Ca(ClO)2масса формулы Ca(ClO)2=142,983 а.е.м.
078 а.е.м./атом)=40,078 а.е.м.2Cl(2 атома)(35,453 а.е.м./атом)=70,906 а.е.м.+2O(2 атома)(15,9994 а.е.м./атом)=31,9988 а.е.м. Ca(ClO)2масса формулы Ca(ClO)2=142,983 а.е.м.
Молярная масса Ca(ClO) 2 142,983 г/моль.
B Масса 1,75 моль Ca(ClO) 2 рассчитывается следующим образом:
моль Ca(ClO)2[молярная масса Ca(ClO)21 моль Ca(ClO)2] = масса Ca(ClO)21,75 моль Ca(ClO)2[142.983 г Ca(ClO)21 моль Ca(ClO)2] = 250 г Ca(ClO)2Поскольку 1,75 моль меньше 2 моль, конечное количество в граммах в обоих случаях должно быть меньше, чем удвоенная молярная масса, которой оно и является.
Упражнение
Рассчитайте массу 0,0122 моль каждого соединения.
- Si 3 N 4 (нитрид кремния), используемые в качестве подшипников и роликов
- (CH 3 ) 3 N (триметиламин), ингибитор коррозии
Ответ:
- 1.
 71 г
71 г - 0,721 г
Резюме
Молекулярная масса и формула массы соединения получаются путем сложения атомных масс атомов, присутствующих в молекулярной формуле или эмпирической формуле, соответственно; единицами измерения обоих являются атомные единицы массы (а.е.м.). моль — это единица, используемая для измерения числа атомов, молекул или (в случае ионных соединений) формульных единиц в данной массе вещества.Моль определяется как количество вещества, которое содержит количество атомов углерода ровно в 12 г углерода-12 и состоит из числа Авогадро (6,022 × 10 23 ) атомов углерода-12. Молярная масса вещества определяется как масса 1 моля этого вещества, выраженная в граммах на моль, и равна массе 6,022 × 10 23 атомов, молекул или формульных единиц этого вещества.
Ключ на вынос
- Для анализа химических превращений необходимо использовать стандартизированную единицу измерения, называемую моль.

Концептуальные проблемы
-
Опишите соотношение между атомной единицей массы и граммом.
-
Правильно ли сказать, что формула этанола равна 46? Почему или почему нет?
-
Если 2 моля натрия полностью реагируют с 1 молем хлора с образованием хлорида натрия, значит ли это, что 2 г натрия полностью реагируют с 1 г хлора с образованием того же продукта? Поясните свой ответ.
-
Постройте блок-схему, чтобы показать, как можно рассчитать количество молей кремния в 37,0 г образца ортоклаза (KAlSi 3 O 8 ), минерала, используемого в производстве фарфора.

-
Постройте блок-схему, чтобы показать, как вы рассчитываете количество молей азота в 22.4 г образца нитроглицерина, содержащего 18,5% азота по массе.
Прежде чем переходить к концептуальным задачам, убедитесь, что вы знакомы с темами, обсуждаемыми в разделе «Основные навыки 2» (раздел 3.7 «Основные навыки 2»).
Ответ
-
A = %N по массе, выраженный в виде десятичной дроби B = 1 молярная масса азота в г г нитроглицерин→×AgN→×Bmol N
Численные задачи
-
Выведите выражение, связывающее число молекул в образце вещества с его массой и молекулярной массой.
-
Рассчитайте молекулярную массу или формульную массу каждого соединения.
- KCl (хлорид калия)
- NaCN (цианид натрия)
- H 2 S (сероводород)
- NaN 3 (азид натрия)
- H 2 CO 3 (угольная кислота)
- K 2 O (оксид калия)
- Al(NO 3 ) 3 (нитрат алюминия)
- Cu(ClO 4 ) 2 [перхлорат меди(II)]
-
Рассчитайте молекулярную массу или формульную массу каждого соединения.

- V 2 O 4 (оксид ванадия(IV))
- CaSiO 3 (силикат кальция)
- BiOCl (оксихлорид висмута)
- CH 3 COOH (уксусная кислота)
- Ag 2 SO 4 (сульфат серебра)
- Na 2 CO 3 (карбонат натрия)
- (CH 3 ) 2 CHOH (изопропиловый спирт)
-
Рассчитайте молярную массу каждого соединения.
-
-
Рассчитайте молярную массу каждого соединения.

-
-
Для каждого соединения напишите сокращенную формулу, назовите соединение и укажите его молярную массу.
-
-
Для каждого соединения напишите сокращенную формулу, назовите соединение и укажите его молярную массу.
-
-
Вычислите количество молей в 5.00 × 10 2 г каждого вещества. Сколько молекул или формульных единиц присутствует в каждом образце?
- CaO (известь)
- CaCO 3 (мел)
- C 12 H 22 O 11 [сахароза (тростниковый сахар)]
- NaOCl (отбеливатель)
- CO 2 (сухой лед)
-
Рассчитайте массу каждого образца в граммах.

- 0,520 моль N 2 O 4
- 1,63 моль C 6 H 4 Br 2
- 4,62 моль (NH 4 ) 2 SO 3
-
Укажите количество молекул или формульных единиц в каждом образце.
- 1,30 × 10 −2 моль SCl 2
- 1,03 моль N 2 O 5
- 0,265 моль Ag 2 Cr 2 O 7
-
Укажите количество молей в каждом образце.
- 9.
 58 × 10 26 молекул Cl 2
58 × 10 26 молекул Cl 2 - 3,62 × 10 27 формульные единицы KCl
- 6,94 × 10 28 формульных единиц Fe(OH) 2
- 9.
-
Растворы йода применяют как антисептические и дезинфицирующие средства. Сколько атомов йода соответствует 11,0 г молекулярного йода (I 2 )?
-
Каково общее количество атомов в каждом образце?
- 0.431 моль Li
- 2,783 моль метанола (CH 3 OH)
- 0,0361 моль CoCO 3
- 1,002 моль SeBr 2 O
-
Каково общее количество атомов в каждом образце?
- 0,980 моль Na
- 2.
 35 моль О 2
35 моль О 2 - 1,83 моль Ag 2 S
- 1,23 моль пропана (C 3 H 8 )
-
Каково общее количество атомов в каждом образце?
- 2,48 г HBr
- 4,77 г CS 2
- 1.89 г NaOH
- 1,46 г SrC 2 O 4
-
Решите, верно каждое утверждение или нет, и объясните свои рассуждения.
- В 0,5 моль Cl 2 молекул больше, чем в 0,5 моль H 2 .
- Один моль H 2 имеет 6.
 022 × 10 23 атомов водорода.
022 × 10 23 атомов водорода. - Молекулярная масса H 2 O составляет 18,0 а.е.м.
- Масса формулы бензола составляет 78 а.е.м.
-
Заполните следующую таблицу.
Вещество Масса (г) Количество молей Количество молекул или формульных единиц Количество атомов или ионов MgCl 2 37.  62
62 AgNO 3 2,84 BH 4 Класс 8.93 × 10 25 К 2 С 7,69 × 10 26 H 2 SO 4 1.  29
29 С 6 Н 14 11,84 HClO 3 2.45 × 10 26 -
Укажите формулу массы или молекулярную массу каждого вещества.

- PbClF
- Cu 2 P 2 O 7
- БиОНО 3
- Tl 2 SeO 4
-
Укажите формулу массы или молекулярную массу каждого вещества.
- MoCl 5
- Б 2 О 3
- УО 2 СО 3
- NH 4 UO 2 AsO 4
Убедитесь, что вы знакомы с темами, обсуждаемыми в разделе «Основные навыки 2» (раздел 3.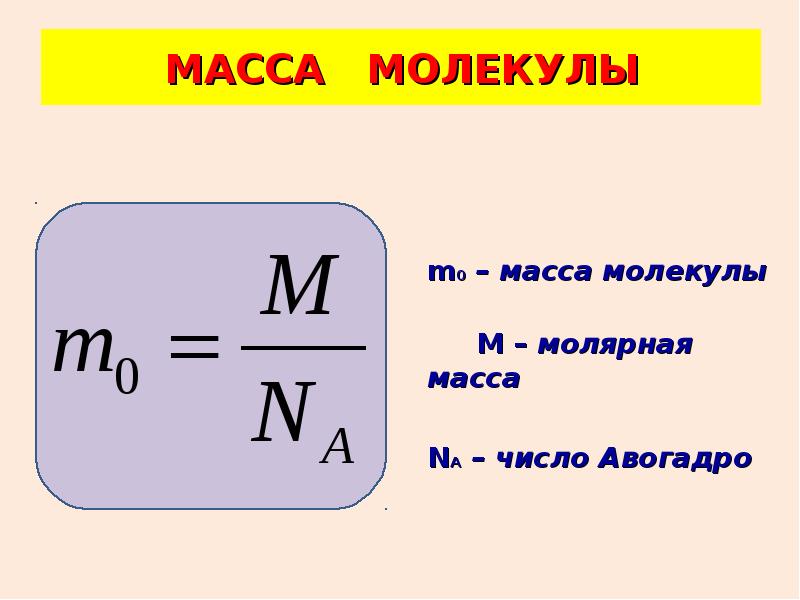 7 «Основные навыки 2»), прежде чем перейти к числовым задачам.
7 «Основные навыки 2»), прежде чем перейти к числовым задачам.
Стехиометрия
Атомная масса
Единицами, в которых выражается масса атома, являются атомные
единицы массы . Когда-то самому легкому атому приписывали
массу 1 а.е.м., а массу любого другого атома выражали в
условия настоящего стандарта. Сегодня атомные единицы массы определяются в
с точки зрения изотопа 12 C, которому присвоена масса
ровно 12.000… а.е.м.
Когда-то самому легкому атому приписывали
массу 1 а.е.м., а массу любого другого атома выражали в
условия настоящего стандарта. Сегодня атомные единицы массы определяются в
с точки зрения изотопа 12 C, которому присвоена масса
ровно 12.000… а.е.м.
Изотопы
Изотопы – это атомы одного и того же элемента с разными количество нейтронов, таких как 20 Ne и 22 Ne изотопы неона или 35 Cl и 37 Cl изотопы хлора.
Атомный вес
Атомный вес элемента является средневзвешенным
атомных масс различных изотопов элемента.
Природный углерод, например, представляет собой смесь двух
изотопы 12 С (98,89 %) и 13 С (1,11 %).
Таким образом, отдельные атомы углерода имеют массу либо 12 000, либо
13.03354 а.е.м. Но средняя масса различных изотопов
углерод 12. 011 аму.
011 аму.
Молекулярный вес
Молекулярная масса соединения представляет собой сумму атомные массы атомов в молекулах, образующих эти соединения.
Пример: молекулярная масса молекулы сахара, обнаруженная в тростниковый сахар представляет собой сумму атомных весов 12 атомов углерода. атомов, 22 атома водорода и 11 атомов кислорода в C 12 H 22 O 11 молекула.
| 12 атомов C = 12(12,011) а.е.м. = | 144,132 а.е.м. |
| 22 атома Н = 22(1,0079) а.е.м. = | 22,174 а.е.м. |
| 11 атомов О = 11(15,9994) а.е.м. = | 175,993 а.е.м. |
| 342,299 а.е.м. |
C 12 H 22 O 11 имеет молекулярную
вес 342,299 а. е.м. Моль C 12 H 22 O 11
будет иметь массу 342.299 граммов. Это количество известно как моляра.
масса , термин, который часто используется вместо терминов атомный
вес или молекулярный вес.
е.м. Моль C 12 H 22 O 11
будет иметь массу 342.299 граммов. Это количество известно как моляра.
масса , термин, который часто используется вместо терминов атомный
вес или молекулярный вес.
Крот
Термин моль буквально означает небольшую массу. это используется как мост между химией на атомном и макроскопический масштаб. Если масса одного атома 12 C равна 12.000 а.е.м., то один моль этих атомов будет иметь массу 12.000 грамм. По определению моль любого вещества содержит столько же элементарных частиц, сколько атомов ровно в 12 граммах 12 C изотоп углерода.
Пример: Один атом 12 C имеет массу 12 а.е.м., и моль этих атомов будет иметь массу 12 граммов.
Моль любых атомов имеет массу в граммах
равно атомному весу элемента. Термин родинка может быть
применительно к любой частице: атомам, молю атомов, молю ионов,
моль электронов или моль молекул.Каждый раз, когда мы используем
термин, мы имеем в виду число частиц, равное числу
атомов ровно в 12 граммах изотопа 12 C
углерод.
Термин родинка может быть
применительно к любой частице: атомам, молю атомов, молю ионов,
моль электронов или моль молекул.Каждый раз, когда мы используем
термин, мы имеем в виду число частиц, равное числу
атомов ровно в 12 граммах изотопа 12 C
углерод.
Постоянная Авогадро
Число Авогадро (или постоянная Авогадро) число элементарных частиц в моле любого вещества Для большинство расчетов, четыре значащие цифры для Авогадро констант достаточно: 6.022 x 10 23 .
Моль любого вещества содержит Число элементарных частиц Авогадро.Это не имеет значения говорим ли мы о моле атомов, моле молекул, моль электронов или моль ионов. По определению, родинка всегда содержит 6,022 х 10 23 элементарных частиц.
Перевод граммов в Кроты
Крот — мощное орудие, позволяющее химикам, вооруженным
не более чем таблица атомных весов и весы для
определить количество атомов, ионов или молекул в образце.
Пример: Рассчитаем количество C 12 H 22 O 11 молекул в фунте тростникового сахара.
Для этого вычисления нам нужны две части информации. Мы нужно знать количество граммов в фунте и молекулярную вес или молярная масса этого сахара. Фунт сахара имеет массу 453,6 г, а один моль этого сахара имеет массу 342,3 г. грамм.
Пара единичных факторов может быть построена из молекулярных веса или молярной массы.
Обращая внимание на единицы измерения во время расчета, легко выбрать правильный коэффициент единицы для преобразования граммов сахара в моли сахара.
Затем мы используем число Авогадро для определения числа C 12 H 22 O 11 молекул в нашем образце.
Что такое масс-спектрометрия? | Институт Броуд
Масс-спектрометрия — это аналитический инструмент, полезный для измерения отношения массы к заряду ( m/z ) одной или нескольких молекул, присутствующих в образце. Эти измерения также часто можно использовать для расчета точной молекулярной массы компонентов пробы. Как правило, масс-спектрометры можно использовать для идентификации неизвестных соединений посредством определения молекулярной массы, для количественного определения известных соединений и для определения структуры и химических свойств молекул.
Эти измерения также часто можно использовать для расчета точной молекулярной массы компонентов пробы. Как правило, масс-спектрометры можно использовать для идентификации неизвестных соединений посредством определения молекулярной массы, для количественного определения известных соединений и для определения структуры и химических свойств молекул.
Как масс-спектрометр совершает такой подвиг? Каждый масс-спектрометр состоит как минимум из следующих трех компонентов:
- Источник ионизации
- Анализатор массы
- Система обнаружения ионов
1.Источник ионизации
Молекулы преобразуются в ионы газовой фазы , чтобы их можно было перемещать и манипулировать внешними электрическими и магнитными полями. В нашей лаборатории мы используем метод, называемый ионизацией наноэлектрораспылением, который чем-то похож на способ окраски автомобилей в промышленных масштабах. Этот метод позволяет создавать положительно или отрицательно заряженные ионы в зависимости от требований эксперимента. Ионизация наноэлектроспреем может напрямую соединить выход мелкомасштабной хроматографической колонки с входом масс-спектрометра.Поток из колонки пропускают через иглу с диаметром на конце 10-15 мкм.
Ионизация наноэлектроспреем может напрямую соединить выход мелкомасштабной хроматографической колонки с входом масс-спектрометра.Поток из колонки пропускают через иглу с диаметром на конце 10-15 мкм.
2. Масс-анализатор
После ионизации ионы сортируются и разделяются в соответствии с отношением массы к заряду ( m/z ). В настоящее время доступно несколько масс-анализаторов, каждый из которых имеет компромиссы, связанные со скоростью работы, разрешающей способностью разделения и другими эксплуатационными требованиями. Конкретные типы, используемые в Broad Institute, обсуждаются в следующем разделе.Масс-анализатор часто работает совместно с системой обнаружения ионов.
3. Система обнаружения ионов
Отделенные ионы затем измеряются и отправляются в систему данных, где отношения m/z хранятся вместе с их относительным содержанием. Масс-спектр — это просто отношение m/z ионов, присутствующих в образце, в зависимости от их интенсивности. Каждый пик в масс-спектре показывает компонент уникального 90 185 m/z 90 186 в образце, а высота пиков обозначает относительное содержание различных компонентов в образце.
Каждый пик в масс-спектре показывает компонент уникального 90 185 m/z 90 186 в образце, а высота пиков обозначает относительное содержание различных компонентов в образце.
Пример масс-спектра
Стехиометрия — Молекулярная масса | Shmoop
Молекулярная масса
Теперь, когда мы знаем все об атомных массах, мы можем перейти к более крупным и лучшим вещам…молекулам. (Может быть, не , а лучше . Мы не хотим оскорбить все атомы.) Если мы знаем атомные массы отдельных атомов, мы можем легко вычислить массу молекулы. Молекулярная масса (иногда называемая молекулярной массой ) — это просто сумма атомных масс в молекуле.
Какова молекулярная масса воды (H 2 O)? Для вычисления молекулярной массы складываем атомную массу двух атомов водорода и одного атома кислорода:
молекулярная масса H 2 O = 2(атомная масса H) + атомная масса O
Где находим атомную массу масса Н и О? Вытащите свою любимую периодическую таблицу. Мы знаем, мы тоже любим периодическую таблицу.
Мы знаем, мы тоже любим периодическую таблицу.
молекулярная масса H 2 O = 2(1,008 а.е.м.) + 16,00 а.е.м. = 18,02 а.е.м.
Из молекулярной массы можно определить молярную массу молекулы.Как следует из названия, молярная масса — это масса (в граммах) одного моля соединения. Нам даже не нужен калькулятор, чтобы вычислить между молекулярной массой и молярной массой… численные значения одинаковы. Молярная масса соединения (в граммах) численно равна его молекулярной массе (в а.е.м.).
Мы только что подсчитали, что молекулярная масса воды составляет 18,02 а.е.м. К счастью для нас (еще раз спасибо гномам-химикам), его молярная масса составляет 18,02 г. Это означает, что 1 моль воды равен 18.02 г.
Давайте посмотрим на это в перспективе. Примерно 1,2 столовые ложки воды равны 18,02 граммам. Эти 18,02 грамма представляют собой один моль воды. Это означает, что каждые 1,2 столовые ложки воды содержат 6,023 x 10 90 239 23 90 240 H 90 109 2 90 110 молекул O. Подумайте об этом в следующий раз, когда выпьете стакан воды. Кто знал, что мы пьем так много молекул?
Подумайте об этом в следующий раз, когда выпьете стакан воды. Кто знал, что мы пьем так много молекул?
Пример задачи
Одним из основных компонентов природного газа является метан (CH 4 ). Сколько молей CH 4 содержится в 4.83 г СН 4?
Метан = CH 4
Прежде всего, нам даны граммы CH 4 и нужно найти моли CH 4 . Это означает, что нам нужен коэффициент преобразования между граммами и молями. Еще раз, периодическая таблица — ваш лучший друг. Нам нужно собрать атомные массы углерода и водорода из таблицы Менделеева, а затем вычислить молекулярную массу CH 4 простым сложением.
Молярная масса CH 4 = атомная масса углерода + 4(атомная масса водорода)
Примечание: мы умножаем на 4, потому что в каждом CH 4 4 атома водорода.
Молярная масса CH 4 = 12,01 г + 4(1,008 г)
Молярная масса CH 4 = 16,04 г
Следовательно, наш коэффициент пересчета:
3 9 Что дает? Зачем нужны два коэффициента преобразования? Мы не знаем. Нам просто нужно использовать коэффициент преобразования, который даст нам правильные единицы в конце. Помните, что если единица появляется выше 90 185 и 90 186 ниже линии дроби, они будут компенсировать друг друга. Нам нужно расположить коэффициент преобразования так, как это позволит нам сделать.
Нам просто нужно использовать коэффициент преобразования, который даст нам правильные единицы в конце. Помните, что если единица появляется выше 90 185 и 90 186 ниже линии дроби, они будут компенсировать друг друга. Нам нужно расположить коэффициент преобразования так, как это позволит нам сделать.
Чтобы решить теперь пишем:
Мы официально мастера молекулярных масс.
Brain Snack
Иеремия Бенджамин Рихтер (1762-1807) (не путать с Энди Рихтером) был первым, кто сформулировал принципы стехиометрии. 4 Он думал, что химию можно рассматривать как еще одну версию прикладной математики. По его собственным словам, «стехиометрия — это наука об измерении количественных пропорций или массовых отношений, в которых химические элементы стоят друг к другу.» Подробнее об этом умном чуваке можно прочитать здесь.
Молярные расчеты
Атомный вес
Атомный вес (или атомная масса ) элемента говорит нам в среднем, сколько весит один атом данного элемента с учетом типичных пропорций изотопов. Например, около 98,9% встречающегося в природе углерода имеет температуру 12 C («Углерод 12»), а около 1,1% составляет 13 C, поэтому углерод имеет атомный вес \begin{equation} 0.989 х 12 + 0,011 х 13 = 12,011. \end{equation} (Этот тип суммы известен как средневзвешенное , вычисление атомных весов на самом деле немного более техническое, чем это, но мы не будем вдаваться в подробности здесь).
Например, около 98,9% встречающегося в природе углерода имеет температуру 12 C («Углерод 12»), а около 1,1% составляет 13 C, поэтому углерод имеет атомный вес \begin{equation} 0.989 х 12 + 0,011 х 13 = 12,011. \end{equation} (Этот тип суммы известен как средневзвешенное , вычисление атомных весов на самом деле немного более техническое, чем это, но мы не будем вдаваться в подробности здесь).
Единицей атомного веса является Дальтон (Да). Некоторые примеры атомных весов приведены ниже.
| Кальций (Ca) |
40.078 |
| Углерод (С) |
12.011 |
| Водород (H) |
1,008 |
| Азот (N) |
14.007 |
| Кислород (O) |
15,999 |
| Фосфор (P) |
30,974 |
| Сера (S) |
32. |
Молекулярный вес
Молекулы состоят из нескольких атомов, например, молекула двуокиси углерода (CO 2 ) состоит из 1 атома углерода и 2 атомов кислорода.Молекулярная масса (или молекулярная масса или относительная молекулярная масса (RMM) ) представляет собой сумму атомных масс всех атомов в молекуле.
Пример 1
Рассчитайте молекулярную массу двуокиси углерода — CO 2 .
Решение
Молекула углекислого газа состоит из 1 атома углерода и 2 атомов кислорода. У углерода атомный вес 12,011, а у кислорода атомный вес 15,999, поэтому молекулярный вес диоксида углерода равен \begin{equation} 1 \times 12.011 + 2 \× 15,999 = 44,009 \text{Да}. \end{уравнение}
Пример 2
Рассчитайте молекулярную массу монокальцийфосфата — Ca(H 2 PO 4 ) 2 .
Решение
Молекула монокальцийфосфата имеет 1 атом кальция и 2 иона дигидрофосфата (H 2 PO 4 ). Нам не нужно слишком беспокоиться о том, что здесь представляет собой ион, мы просто отметим, что обозначение (H 2 PO 4 ) 2 означает, что есть 2 партии H 2 PO 4 для всего 4 атома водорода, 2 атома фосфора и 8 атомов кислорода.Следовательно, молекулярная масса монокальцийфосфата равна \begin{equation} 1 \times 40,078 + 4 \times 1,008 + 2 \times 30,974 + 8 \times 15,999 = 234,05 \text{Да}. \end{уравнение}
Нам не нужно слишком беспокоиться о том, что здесь представляет собой ион, мы просто отметим, что обозначение (H 2 PO 4 ) 2 означает, что есть 2 партии H 2 PO 4 для всего 4 атома водорода, 2 атома фосфора и 8 атомов кислорода.Следовательно, молекулярная масса монокальцийфосфата равна \begin{equation} 1 \times 40,078 + 4 \times 1,008 + 2 \times 30,974 + 8 \times 15,999 = 234,05 \text{Да}. \end{уравнение}
Проверь себя
Тест Numbas на молекулярную массу
Кроты
моль – это количество вещества (в граммах), которое численно равно его молекулярной массе. Например, один моль углерода весит 12,011 грамма, а один моль монокальцийфосфата (Ca(H 2 PO 4 ) 2 ) весит 234.05 грамм. Число молекул вещества в одном моле равно 6,02 $\times$ 10 23 , это число известно как число Авогадро .
Если мы знаем молекулярную массу вещества, мы можем рассчитать, сколько будет весить данное количество молей, используя формулу
\begin{уравнение} \text{молекулярная масса} \times \text{количество молей} = \text{масса вещества (в граммах)}. \end{уравнение}
\end{уравнение}
Пример 3
Хлорид натрия (NaCl) имеет молекулярную массу 58.44. Сколько весят 3 моля хлорида натрия?
Решение
Используя приведенную выше формулу, мы находим, что 3 моля хлорида натрия весят \begin{equation} 58,44 \times 3 = 175,32\text{г}. \end{equation} Мы не ограничены работой с целыми числами для количества молей.
Пример 4
Сколько весят 2,4 моля монофосфата кальция (Ca(H 2 PO 4 ) 2 )?
Решение
Мы видели в примере 2, что монокальцийфосфат имеет молекулярную массу 234.05, поэтому, используя нашу формулу, мы находим, что 2,4 моля монокальцийфосфата весят \begin{equation} 234,05 \times 2,4 = 561,72\text{г}. \end{уравнение}
Если мы знаем массу вещества и молекулярный вес, мы можем вычислить, сколько молей вещества мы имеем, изменив формулу \begin{equation} \text{молекулярная масса} \times \text{число молей} = \text{масса вещества} \end{уравнение} для получения
\begin{уравнение} \frac{\text{масса вещества (в граммах)}}{\text{молекулярная масса}} = \text{количество молей}. \end{уравнение}
\end{уравнение}
Пример 5
Глюкоза (C 6 H 12 O 6 ) имеет молекулярную массу 180,16, сколько молей глюкозы содержится в 45 г?
Решение
Используя нашу измененную формулу, мы находим, что в 45 г содержится \begin{equation} \frac{45}{180,16} = 0,222 \text{ молей} \end{equation} глюкозы.
Формула треугольника
Чтобы запомнить формулы в этом разделе, вы можете использовать формулу треугольника. Чтобы получить формулу из треугольника, закройте значение, которое вы хотите вычислить, и используйте оставшиеся два значения.Если они находятся рядом друг с другом, умножьте их, чтобы получить ответ, если одно находится поверх другого, разделите верхнее на нижнее, чтобы получить ответ.
Проверь себя
Тест Numbas на родинках
Решения
Часто мы хотим растворить вещество, напр. глюкоза в жидкости, напр. воды для приготовления раствора. Когда мы делаем это, нам нужен способ описать, сколько нашего вещества находится в данном объеме жидкости, это известно как концентрация раствора. Существуют разные способы описания концентрации раствора, мы рассмотрим 2 из них.
Существуют разные способы описания концентрации раствора, мы рассмотрим 2 из них.
1) Молярность
Молярность раствора равна числу молей растворенного вещества, деленному на количество литров раствора. Это
\begin{уравнение} \frac{\text{число молей вещества}}{\text{объем жидкости (в литрах)}} = \text{концентрация (в моль/л)}. \end{уравнение}
Если 1 моль вещества растворен в 1 л жидкости (т.е. 1 моль/л), мы называем это 1 молярным (1 М) раствором, если у нас есть 1 моль вещества, растворенного в 2 литрах жидкости (т.е. 0,5 моль/л), это называется 0,5 молярным (0,5 М) раствором и скоро.
2) Массовая концентрация
Массовая концентрация раствора равна массе растворенного вещества, деленной на объем жидкости, использованной для приготовления раствора. Для расчета используем формулу
\begin{уравнение} \frac{\text{масса вещества (в граммах)}}{\text{объем жидкости (в литрах)}} = \text{концентрация (в г/л)}.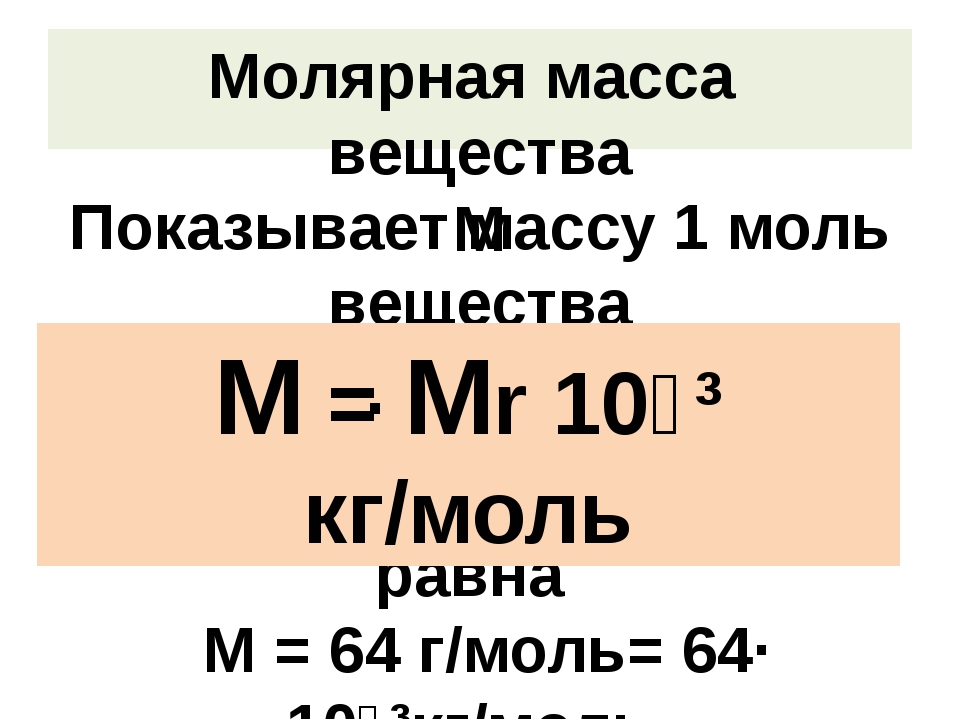 \end{уравнение}
\end{уравнение}
Примечание по единицам концентрации
Иногда для массовой концентрации используются единицы измерения, отличные от г/л, например, мг/100 мл (миллиграммы на 100 миллилитров), и существуют другие способы описания концентрации, отличные от молярности и массовой концентрации. Если вы хотите узнать немного больше о различных способах измерения концентрации раствора, см. Википедия: Концентрация. В этой статье мы будем работать только с г/л при использовании массовой концентрации.Если вы используете другие единицы для массовой концентрации, будьте осторожны при использовании формул в этой статье. В формулах в этой статье используется массовая концентрация в (г/л), поэтому вам придется преобразовать используемые вами единицы в (г/л), чтобы использовать их. Дополнительные сведения о том, как это сделать, см. в разделе, посвященном размерам.
Давайте рассмотрим несколько примеров, касающихся молярности.
Пример 6
7 молей вещества растворяют в 4 литрах жидкости, чтобы получить раствор, какова концентрация раствора в М (моль/л)?
Решение
Используя нашу формулу, мы находим, что концентрация равна \begin{equation} \frac{7}{4} = 1. 75\text{M} \end{equation}, поэтому у нас есть 1,75-молярный раствор.
75\text{M} \end{equation}, поэтому у нас есть 1,75-молярный раствор.
Мы также работаем с единицами измерения, отличными от литров (л), когда имеем дело с жидкостями, такими как миллилитры (мл). Мы должны помнить, что в нашей формуле используется объем жидкости в литрах, поэтому, если нам говорят объем в миллилитрах и мы хотим определить концентрацию, мы сначала должны преобразовать наш объем в миллилитрах в объем в литрах. Дополнительные сведения о том, как это сделать, см. в разделе, посвященном размерам.
Пример 7
Полмоля вещества растворяют в 250 мл жидкости, чтобы получить раствор, какова концентрация раствора в М (моль/л)?
Решение
Наша формула говорит нам, что \begin{equation} \frac{\text{число молей вещества}}{\text{объем жидкости (в литрах)}} = \text{концентрация (в моль/л)} \ end{equation} и мы знаем, что у нас есть 250 мл раствора, поэтому сначала нам нужно определить, сколько это в литрах.В 1 л содержится 1000 мл, поэтому, чтобы получить объем в литрах, мы делим 250 на 1000, чтобы получить \begin{equation} \frac{250}{1000} = 0,25\text{L}. \end{equation} Теперь мы можем рассчитать концентрацию, как и раньше, у нас есть полмоля вещества в 0,25 л жидкости, поэтому концентрация равна \begin{equation} \frac{0,5}{0,25} = 2\text{M }. \end{уравнение}
\end{equation} Теперь мы можем рассчитать концентрацию, как и раньше, у нас есть полмоля вещества в 0,25 л жидкости, поэтому концентрация равна \begin{equation} \frac{0,5}{0,25} = 2\text{M }. \end{уравнение}
Если мы знаем объем раствора и концентрацию, мы можем определить количество молей растворенного вещества, изменив формулу \begin{equation} \frac{\text{число молей вещества}}{\text{ объем жидкости (в литрах)}} = \text{концентрация (в моль/л)}.\end{уравнение}, чтобы получить
\begin{equation} \text{объем жидкости (в литрах)} \times \text{концентрация (в моль/л)} = \text{количество молей вещества}. \end{уравнение}
Пример 8
Сколько молей глюкозы содержится в 3 л 0,5 М раствора?
Решение
Используя нашу формулу, находим, что в 3 л 0,5 М раствора содержится \begin{equation} 3 \times 0,5 = 1,5 \text{ моль} \end{equation} глюкозы.
Пример 9
Сколько молей хлорида натрия содержится в 50 мл 5М раствора?
Решение
В нашей формуле используется объем в литрах, поэтому нам нужно преобразовать 50 мл в объем в литрах. В 1 л 1000 мл, поэтому 50 мл равны \begin{equation} \frac{50}{1000} = 0,05\text{L}. \end{equation} Используя нашу формулу, находим, что количество молей хлорида натрия в растворе равно \begin{equation} 0,05 \times 5 = 0,25 \text{ молей}. \end{уравнение}
В 1 л 1000 мл, поэтому 50 мл равны \begin{equation} \frac{50}{1000} = 0,05\text{L}. \end{equation} Используя нашу формулу, находим, что количество молей хлорида натрия в растворе равно \begin{equation} 0,05 \times 5 = 0,25 \text{ молей}. \end{уравнение}
Более длинный пример:
Пример 10
Глюкоза (C 6 H 12 O 6 ) имеет молекулярную массу 180,16, какую массу глюкозы вам нужно растворить в 500 мл воды, чтобы получить раствор 3M?
Решение
Давайте разобьем этот вопрос на части.Сначала нам нужно знать, сколько молей глюкозы нам нужно, чтобы получить раствор 3M, используя 500 мл воды. В нашей формуле используется объем в литрах, поэтому нам нужно преобразовать 500 мл в объем в литрах, сделав это, мы обнаружим, что 500 мл равны \begin{equation} \frac{500}{1000} = 0,5\text{L}. \end{equation} Чтобы найти количество молей, необходимое для получения раствора 3М из 0,5 л (500 мл) воды, мы используем формулу \begin{equation} \text{объем жидкости (в литрах)} \times \ text{концентрация (в моль/л)} = \text{количество молей вещества}. \end{equation} Подставив наши числа, мы находим, что нам нужно \begin{equation} 0,5 \times 3 = 1,5 \text{ моль} \end{equation} глюкозы. Наконец, чтобы вычислить необходимую нам массу глюкозы, мы используем формулу \begin{equation} \text{молекулярная масса} \times \text{число молей} = \text{масса вещества}. \end{equation} В вопросе нам говорят, что молекулярная масса глюкозы равна 180,16, поэтому, подставив наши числа, мы получим, что нам нужно \begin{equation} 180,16 \times 1,5 = 270,24\text{g} \end{equation } глюкозы.То есть, если мы растворим 270,24 г глюкозы в 500 мл (0,5 л) воды, мы получим 3М раствор.
\end{equation} Подставив наши числа, мы находим, что нам нужно \begin{equation} 0,5 \times 3 = 1,5 \text{ моль} \end{equation} глюкозы. Наконец, чтобы вычислить необходимую нам массу глюкозы, мы используем формулу \begin{equation} \text{молекулярная масса} \times \text{число молей} = \text{масса вещества}. \end{equation} В вопросе нам говорят, что молекулярная масса глюкозы равна 180,16, поэтому, подставив наши числа, мы получим, что нам нужно \begin{equation} 180,16 \times 1,5 = 270,24\text{g} \end{equation } глюкозы.То есть, если мы растворим 270,24 г глюкозы в 500 мл (0,5 л) воды, мы получим 3М раствор.
Давайте также рассмотрим пример, связанный с массовой концентрацией.
Пример 11
318 г карбоната натрия растворяют в 1500 мл воды. Какая концентрация в г/л?
Решение
Нас спрашивают о концентрации в г/л, а наш объем был указан в мл, поэтому сначала мы должны преобразовать 1500 мл в объем в литрах. В 1 л 1000 мл, поэтому 1500 мл равно \begin{equation} \frac{1500}{1000} = 1. 5 \text{ Л}. \end{equation} Подставляем наши числа в формулу \begin{equation} \frac{\text{масса вещества (в граммах)}}{\text{объем жидкости (в литрах)}} = \text{концентрация ( в г/л)} \end{equation} получаем, что концентрация в г/л равна \begin{equation} \frac{318}{1.5} = 212 \text{ г/л}. \end{уравнение}
5 \text{ Л}. \end{equation} Подставляем наши числа в формулу \begin{equation} \frac{\text{масса вещества (в граммах)}}{\text{объем жидкости (в литрах)}} = \text{концентрация ( в г/л)} \end{equation} получаем, что концентрация в г/л равна \begin{equation} \frac{318}{1.5} = 212 \text{ г/л}. \end{уравнение}
Формула треугольников
Чтобы запомнить формулы этого раздела, вы можете использовать формулы треугольников. Чтобы получить формулу из треугольника, закройте значение, которое вы хотите вычислить, и используйте оставшиеся два значения.Если они находятся рядом друг с другом, умножьте их, чтобы получить ответ, если одно находится поверх другого, разделите верхнее на нижнее, чтобы получить ответ. Убедитесь, что вы используете правильный треугольник в зависимости от того, хотите ли вы, чтобы концентрация была в моль/л или г/л!
Проверь себя
Тест Numbas на растворы
Разбавляющие растворы
Если у нас есть раствор заданной концентрации, мы можем добавить больше жидкости (без добавления вещества), чтобы разбавить раствор. Это снижает концентрацию раствора. Например, если у нас есть 500 мл 1М раствора глюкозы в воде, мы можем добавить еще 500 мл воды, чтобы разбавить раствор. Мы можем определить концентрацию разбавленного раствора следующим образом. Формула концентрации раствора: \begin{equation} \frac{\text{число молей вещества}}{\text{объем жидкости (в литрах)}} = \text{концентрация (в моль/л) )}. \end{equation} Мы начали с 500 мл раствора, а затем добавили еще 500 мл воды, так что теперь общий объем жидкости в растворе равен \begin{equation} 500 + 500 = 1000 \text{ мл} \end{equation} что равен 1 л.Нам также необходимо знать, сколько молей глюкозы содержится в растворе. Мы начали с 500 мл 1М раствора и больше не добавляли вещества (глюкозы), поэтому у нас осталось то же количество молей, с которого мы начали. Мы можем рассчитать это по формуле \begin{equation} \frac{\text{число молей вещества}}{\text{объем жидкости (в литрах)}} = \text{концентрация (в моль/л)} , \end{equation} помня, что объем в этой формуле указан в литрах, а не в мл, и что 500 мл = 0.
Это снижает концентрацию раствора. Например, если у нас есть 500 мл 1М раствора глюкозы в воде, мы можем добавить еще 500 мл воды, чтобы разбавить раствор. Мы можем определить концентрацию разбавленного раствора следующим образом. Формула концентрации раствора: \begin{equation} \frac{\text{число молей вещества}}{\text{объем жидкости (в литрах)}} = \text{концентрация (в моль/л) )}. \end{equation} Мы начали с 500 мл раствора, а затем добавили еще 500 мл воды, так что теперь общий объем жидкости в растворе равен \begin{equation} 500 + 500 = 1000 \text{ мл} \end{equation} что равен 1 л.Нам также необходимо знать, сколько молей глюкозы содержится в растворе. Мы начали с 500 мл 1М раствора и больше не добавляли вещества (глюкозы), поэтому у нас осталось то же количество молей, с которого мы начали. Мы можем рассчитать это по формуле \begin{equation} \frac{\text{число молей вещества}}{\text{объем жидкости (в литрах)}} = \text{концентрация (в моль/л)} , \end{equation} помня, что объем в этой формуле указан в литрах, а не в мл, и что 500 мл = 0. 5л. Количество молей, с которого мы начали, равно количеству молей глюкозы в 0,5 л (500 мл) 1 М раствора, что равно \begin{equation} 1 \times 0,5 = 0,5 \text{ моль}. \end{equation} Это означает, что мы начали с 0,5 моль глюкозы в 0,5 л (500 мл) воды, а затем добавили еще 500 мл воды, чтобы разбавить раствор, так что теперь у нас есть 0,5 моль глюкозы в 1 л (1000 мл) воды. Теперь воспользуемся формулой \begin{equation} \frac{\text{число молей вещества}}{\text{объем жидкости (в литрах)}} = \text{концентрация (в моль/л)}.\end{equation}, чтобы найти новую концентрацию, которая равна \begin{equation} \frac{0,5}{1} = 0,5 \text{ M}. \end{equation} Это половина концентрации, с которой мы начали. Как и следовало ожидать, если мы начнем с раствора заданной концентрации, а затем разбавим его, удвоив общий объем жидкости (мы перешли от 500 мл к 1000 мл), не добавляя больше вещества, новая концентрация составит половину концентрации, которую мы началось с.
5л. Количество молей, с которого мы начали, равно количеству молей глюкозы в 0,5 л (500 мл) 1 М раствора, что равно \begin{equation} 1 \times 0,5 = 0,5 \text{ моль}. \end{equation} Это означает, что мы начали с 0,5 моль глюкозы в 0,5 л (500 мл) воды, а затем добавили еще 500 мл воды, чтобы разбавить раствор, так что теперь у нас есть 0,5 моль глюкозы в 1 л (1000 мл) воды. Теперь воспользуемся формулой \begin{equation} \frac{\text{число молей вещества}}{\text{объем жидкости (в литрах)}} = \text{концентрация (в моль/л)}.\end{equation}, чтобы найти новую концентрацию, которая равна \begin{equation} \frac{0,5}{1} = 0,5 \text{ M}. \end{equation} Это половина концентрации, с которой мы начали. Как и следовало ожидать, если мы начнем с раствора заданной концентрации, а затем разбавим его, удвоив общий объем жидкости (мы перешли от 500 мл к 1000 мл), не добавляя больше вещества, новая концентрация составит половину концентрации, которую мы началось с.
Пример 12
20 мл 0,25 М раствора разбавляют добавлением еще 480 мл жидкости, какова новая концентрация в М (моль/л)?
Решение
Мы начали с 20 мл жидкости и добавили еще 480 мл, так что новый объем жидкости равен \begin{equation} 20 + 480 = 500 \text{ мл}. \end{equation} 20 мл равно \begin{equation} \frac{20}{1000} = 0,02 \text{ L} \end{equation}, поэтому количество молей, с которого мы начали, равно \begin{equation} 0,02 \ умножить на 0,25 = 0,005 \text{молей}. \end{equation} Мы не добавляли больше вещества, так что у нас все еще есть 0,005 моля, но теперь оно растворено в 500 мл жидкости. 500 мл равны 0,5 л, поэтому новая концентрация равна \begin{equation} \frac{0,005}{0,5} = 0,01 \text{ М}. \end{уравнение}
\end{equation} 20 мл равно \begin{equation} \frac{20}{1000} = 0,02 \text{ L} \end{equation}, поэтому количество молей, с которого мы начали, равно \begin{equation} 0,02 \ умножить на 0,25 = 0,005 \text{молей}. \end{equation} Мы не добавляли больше вещества, так что у нас все еще есть 0,005 моля, но теперь оно растворено в 500 мл жидкости. 500 мл равны 0,5 л, поэтому новая концентрация равна \begin{equation} \frac{0,005}{0,5} = 0,01 \text{ М}. \end{уравнение}
Примечание
Другой способ задать этот вопрос — сказать следующее:
20мл 0.25М раствор разбавлен до 500мл, какова новая концентрация в М (моль/л)?
«Разбавлено до 500 мл» означает добавление достаточного количества жидкости, чтобы новый объем жидкости составил 500 мл. Таким же образом мы можем вычислить новую концентрацию, но первый шаг определения нового общего объема жидкости (500 мл) уже сделан. Если бы нас попросили приготовить этот раствор, нам нужно было бы рассчитать, сколько жидкости нам нужно добавить, чтобы получить новый общий объем 500 мл. В приведенном выше примере мы начали с 20 мл 0.25M раствор, поэтому, чтобы разбавить его до 500 мл, нам нужно добавить еще \begin{equation} 500 — 20 = 480 \text{ мл} \end{equation} жидкости.
В приведенном выше примере мы начали с 20 мл 0.25M раствор, поэтому, чтобы разбавить его до 500 мл, нам нужно добавить еще \begin{equation} 500 — 20 = 480 \text{ мл} \end{equation} жидкости.
Давайте рассмотрим пример, объединяющий несколько изученных нами идей.
Пример 13
«Исходный» раствор содержал 318 г карбоната натрия (Na 2 CO 3 ) в 1 л раствора. 50 мл исходного раствора разбавляли до 250 мл. Какова концентрация конечного раствора в г/л и М (моль/л). [Требуемые относительные атомные массы (Да): Na 22.990; С 12.011; О 15,999].
Решение
В этом примере нас попросили сделать довольно много вычислений, поэтому давайте разобьем его на несколько более мелких частей. Чтобы рассчитать концентрации в г/л и моль/л после разбавления, нам нужно сначала рассчитать концентрации в г/л и моль/л «исходного» раствора. Начнем с расчета концентрации «исходного» раствора в г/л.
«Исходный» раствор содержит 318 г карбоната натрия, растворенного в 1 л жидкости. Для расчета концентрации в г/л используем формулу \begin{equation} \frac{\text{масса вещества (в граммах)}}{\text{объем жидкости (в литрах)}} = \text{ концентрация (в г/л)}.\end{equation} Подставив наши числа, мы находим, что концентрация «исходного» раствора в г/л равна \begin{equation} \frac{318}{1} = 318 \text{ г/л}. \end{уравнение}
Для расчета концентрации в г/л используем формулу \begin{equation} \frac{\text{масса вещества (в граммах)}}{\text{объем жидкости (в литрах)}} = \text{ концентрация (в г/л)}.\end{equation} Подставив наши числа, мы находим, что концентрация «исходного» раствора в г/л равна \begin{equation} \frac{318}{1} = 318 \text{ г/л}. \end{уравнение}
Далее мы можем рассчитать концентрацию маточного раствора в М (моль/л). Формула для этого: \begin{equation} \frac{\text{число молей вещества}}{\text{объем жидкости (в литрах)}} = \text{концентрация (в моль/л)}. \end{уравнение}
Мы видим, что нам нужно выяснить, сколько молей карбоната натрия (Na 2 CO 3 ) содержится в 318 г.Формула для этого: \begin{equation} \frac{\text{масса вещества (в граммах)}}{\text{молекулярная масса}} = \text{количество молей}. \end{уравнение}
Мы видим, что для этого нам нужно определить молекулярную массу карбоната натрия (Na 2 CO 3 ). Нам сообщили атомные массы каждого из атомов в карбонате натрия (Na 2 CO 3 ), поэтому мы можем сделать это, сложив атомные массы всех атомов, чтобы получить молекулярную массу, которая \begin{ уравнение} 2 \times 22. 990 + 1 \times 12,011 + 3 \times 15,999 = 82,998 \text{ Да}. \end{уравнение}
990 + 1 \times 12,011 + 3 \times 15,999 = 82,998 \text{ Да}. \end{уравнение}
Теперь мы можем использовать это, чтобы определить, сколько молей карбоната натрия содержится в 318 г, используя приведенную выше формулу. Подставляя числа, мы получаем, что \begin{equation} \frac{318}{82,998} = 3,831 \text{ молей на 3 д.п. (десятичные знаки)} \end{уравнение} карбоната натрия в 318г. Теперь мы можем определить концентрацию «исходного» раствора в М (моль/л). Формула \begin{equation} \frac{\text{количество молей вещества}}{\text{объем жидкости (в литрах)}} = \text{концентрация (в моль/л)}.\end{equation} У нас есть 318 г карбоната натрия, растворенного в 1 л жидкости, и мы подсчитали, что в 318 г содержится 3,831 моль карбоната натрия. Подставляя эти числа в формулу, получаем, что концентрация «исходного» раствора в M равна \begin{equation} \frac{3,831}{1} = 3,831 \text{ M}. \end{уравнение}
Давайте подытожим наши расчеты. Мы выяснили, что концентрация «исходного» раствора в г/л составляет \begin{equation} 318 \text{ г/л} \end{equation}, а в M — \begin{equation} 3. 831 \text{ М}. \end{уравнение}
831 \text{ М}. \end{уравнение}
Поскольку мы разбавляем 50 мл «исходного» раствора, нам нужно определить, сколько карбоната натрия содержится в 50 мл раствора, используя рассчитанные нами концентрации. Нам нужно вычислить это количество как в граммах, так и в молях, начнем с граммов. Если мы переформулируем формулу \begin{equation} \frac{\text{масса вещества (в граммах)}}{\text{объем жидкости (в литрах)}} = \text{концентрация (в г/л)} . \end{equation} находим, что
\begin{equation} {\text{объем жидкости (в литрах)}} \times \text{концентрация (в г/л)} = \text{масса вещества (в граммах)}.\end{уравнение}
Итак, 50 мл равно \begin{equation} \frac{50}{1000} = 0,05 \text{ л}, \end{equation}, поэтому в 50 мл исходного раствора содержится \begin{equation} 0,05 \times 318 = 15,9 \text{ г} \end{уравнение} карбоната натрия. Точно так же мы можем определить количество молей карбоната натрия, используя формулу \begin{equation} {\text{объем жидкости (в литрах)}} \times \text{концентрация (в моль/л)} = \text {количество молей вещества}. \end{уравнение}. Подставив наши числа, мы находим, что в 50 мл «исходного» раствора содержится \begin{equation} 0.05 \times 3,831 = 0,192 \text{ моль на 3 д.п.} \end{уравнение} карбоната натрия.
\end{уравнение}. Подставив наши числа, мы находим, что в 50 мл «исходного» раствора содержится \begin{equation} 0.05 \times 3,831 = 0,192 \text{ моль на 3 д.п.} \end{уравнение} карбоната натрия.
Наконец, мы можем определить концентрацию разбавленного раствора. Мы знаем, что 50 мл исходного раствора разбавляют до 250 мл, поэтому конечный объем жидкости составляет 250 мл. Мы выяснили, что в 50 мл исходного раствора содержится 15,9 г (0,192 моля) карбоната натрия, и мы больше не добавляли карбонат натрия, поэтому в нашем разбавленном растворе мы имеем 15,9 г (0,192 моля) карбоната натрия в 250 мл жидкости. .Формула концентрации в г/л: \begin{equation} \frac{\text{масса вещества (в граммах)}}{\text{объем жидкости (в литрах)}} = \text{концентрация (в г/л)}. \end{equation} 250 мл равны 0,25 л, поэтому концентрация разбавленного раствора в г/л равна \begin{equation} \frac{15.9}{0,25} = 63,6 \text{ г/л}. \end{equation} Формула для концентрации в M (моль/л): \begin{equation} \frac{\text{число молей вещества}}{\text{объем жидкости (в литрах)}} = \ text{концентрация (в моль/л)} \end{equation} поэтому концентрация разбавленного раствора в M равна \begin{equation} \frac{0.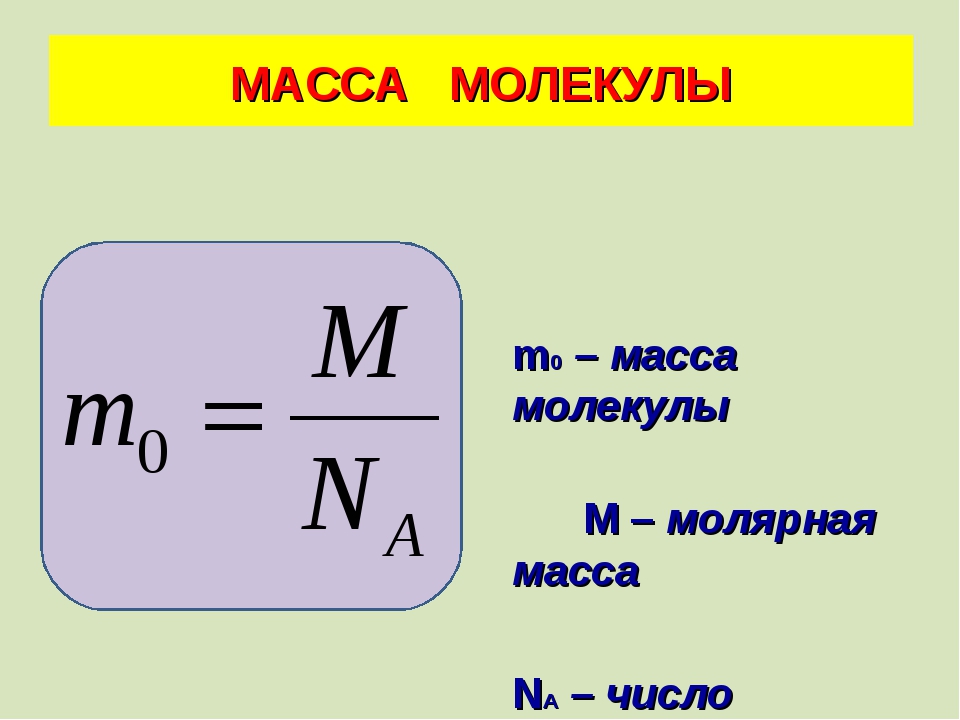 192}{0,25} = 0,766 \text{ M до 3 д.п.} \end{уравнение}
192}{0,25} = 0,766 \text{ M до 3 д.п.} \end{уравнение}
Проверь себя
Тест Numbas на разбавляющих растворах
Проверь себя
Если вы хотите проверить себя по всем темам этой статьи, по следующей ссылке вы найдете все глупые вопросы, сопровождающие эту статью.
Тест Numbas для молярных расчетов
Молярная масса
Молярная масса молекулярных соединений
Первый шаг в определение молярной массы молекулярного соединения состоит в том, чтобы определить молекулярная масса соединения, которая представляет собой средневзвешенную массу встречающиеся в природе молекулы соединения.Это находится путем добавления атомные массы атомов в каждой молекуле.
Молекулярная масса = сумма атомных масс каждого атома в молекуле
Следовательно, молекулярная масса
воды, H 2 O, равна сумме атомных масс двух
атомов водорода и одного атома кислорода, которые можно найти в периодической таблице.
Молекулярная масса H 2 O
= 2(1,00794) + 15.9994 = 18,0153
Обратите внимание, что атомная масса каждого элемента умножается на число атомов этого элемента в молекула соединения.
Количество граммы в молярной массе (граммы на моль) молекулярного соединения одинаковы как его молекулярная масса.
Молярная масса для Ионные соединения
Первый шаг в определение молярной массы ионного соединения заключается в том, чтобы определить его формула массы, которая является средневзвешенное значение массы природной формулы единиц вещества.(Это аналогично атомной массе элемента и молекулярная масса молекулярного вещества.)
Формула массы = сумма атомных масс каждого атома в формульной единице
Формула массы натрия
хлорид равен сумме атомных масс натрия и хлора,
которые можно найти в периодической таблице.

 066
066