Тесты по биологии на тему «Биосинтез белка» (10 класс)
Тематический контроль знаний по теме «Биосинтез белка».
2 вариант
Вопросы на «3» : 1Белок синтезируется на мембранах: а)комплекса Гольджи, б)лизосом, в) вакуолей, г) зернистой эндоплазматической сети
Вопросы на «3»: 1. В процессе биосинтеза белков принимают участие: а) клеточный центр, б) рибосомы, в) вакуоли, в) комплекс Гольджи
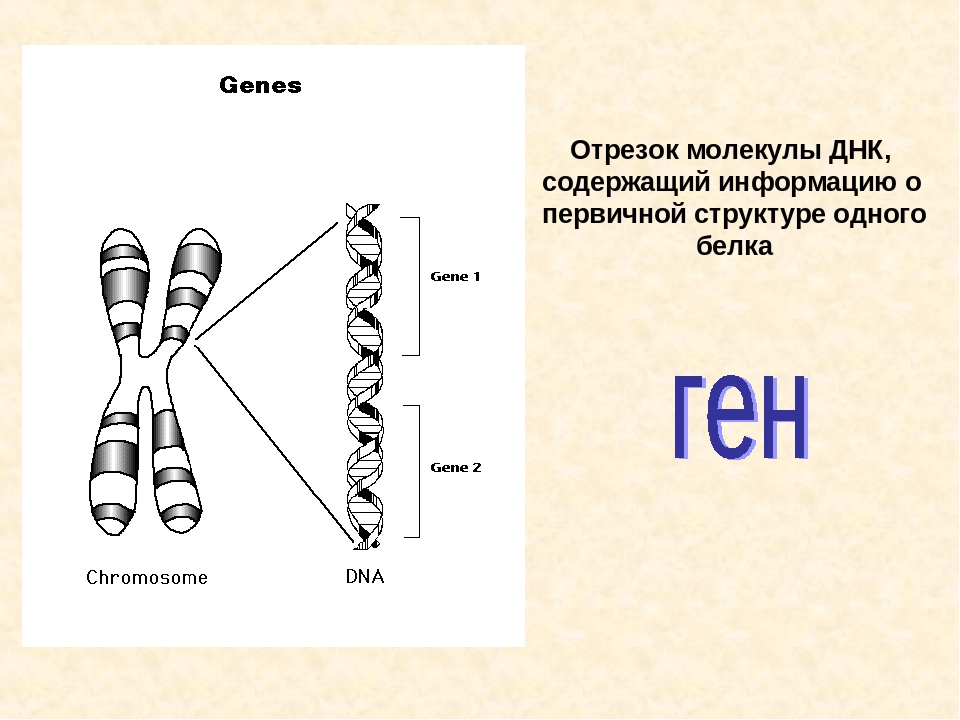
2. Последовательность нуклеотидов участка молекулы ДНК, несущая информацию о первичной структуре одного белка,-это: а) геном ,
б) генотип, в) ген , г) фенотип
2. Участок ДНК, содержащий информацию о структуре одного белка, -это: а) фенотип, б) ген,
в)фермент, г) генотип
3. Каждые три нуклеотида молекулы ДНК образуют:
белок, 2) триплет ,
3) аминокислоту ,4) липид
3. Каждые три нуклеотида молекулы ДНК образуют:
а) витамин, б) фермент
в)кодон, г) аминокислоту
4.
а) универсальность б)специфичность
в)триплетность, г)вырожденность
4. Одну аминокислоту кодирует последовательность из трех нуклеотидов. Этим свойством генетического кода является:
а) универсальность б)специфичность
в)триплетность, г)вырожденность
5.Одни и те же триплеты кодируют одинаковые аминокислоты у всех организмов на Земле. Этим свойством генетического кода является:
а) универсальность б)специфичность
в)триплетность, г)вырожденность
5. Каждая аминокислота зашифрована более чем одним кодоном. Этим свойством генетического кода является:
а)колинеарность, б)специфичность
в)универсальность г)избыточность
6. Конечный нуклеотид одного триплета не может служить началом другого триплета. Этим свойством генетического является:
а)избыточность б)неперекрываемость
в)триплетность
г) универсальность
6. Транскрипция – это:
Транскрипция – это:
А) синтез белка на рибосомах
Б) синтез иРНК на ДНК
В) удвоение ДНК
Г) синтез ДНК на тРНК
7. Процесс переписывания генетической информации с ДНК на иРНК – это:
а)редупликация,б) транскрипция,
в)репликация, г)трансляция
7. С помощью молекул иРНК осуществляется передача наследственной информации:
а) из одной клетки в другую,
б) от родителей потомству,
в) из ядра к рибосоме,
г) из рибосомы в ЭПС
8.В процессе трансляции:
а) из аминокислот образуются белки,
б) из нуклеотидов образуются нуклеиновые кислоты,
в) из моносахаридов синтезируются полисахариды,
г) из жирных кислот образуются жиры
8.Процесс перевода последовательности нуклеотидов иРНК в последовательность аминокислот полипептидной цепи- это:
а) редупликация, б)транскрипция
в)репликация , г) трансляция
9.Трансляция – это:
а) удвоение ДНК
б) синтез иРНК на ДНК
в) синтез белка на рибосомах
г) синтез ДНК на тРНК
9. Процесс синтеза белковой молекулы осуществляется в:
Процесс синтеза белковой молекулы осуществляется в:
а) аппарат Гольджи, б) лизосоме
в)рибосоме, г)ядре
10. Система записи информации о последовательности расположения аминокислот в молекуле белка с помощью аналогичного расположения нуклеотидов в и-РНК ,это: а) трансляция, б) транскрипция, в)генетический код, в) универсальность
10. Перевод последовательности нуклеотидов в молекуле нуклеиновой кислоты в последовательность аминокислот в молекуле белка , это: а) транкрипция, б) матричный синтез,
в) генетический код, г) трансляция
Задание на «4» : Последовательность нуклеотидов фрагмента цепи ДНК:
А-Г-Т-Т-Г-Г-Т-Т-А-Г-А-Г-Г-Т-Т
Определите последовательность нуклеотидов в иРНК, аминокислот в полипептидной цепи. Что произойдет в полипептиде, если в результате мутации во фрагменте гена выпадает третий триплет нуклеотидов? Для выполнения задания используйте таблицу генетического кода.
Задание на «4» : Известно, что все виды РНК синтезируются на ДНК. Определите последовательность нуклеотидов в молекуле тРНК, если последовательность нуклеотидов фрагмента цепи ДНК:
Определите последовательность нуклеотидов в молекуле тРНК, если последовательность нуклеотидов фрагмента цепи ДНК:
Ц-Ц-А-Г-Т-А-Ц-Г-Т-А-Г-Г-А-Ц-Т
Определите кодон иРНК, к которому присоединяется эта тРНК, и аминокислоту, переносимую этой тРНК, если известно, что третий триплет ДНК шифрует её антикодон. Для выполнения задания используйте таблицу генетического кода.
Задание на «5» : . Известно, что все виды РНК синтезируются на ДНК. Определите последовательность нуклеотидов в молекуле тРНК, если последовательность нуклеотидов фрагмента цепи ДНК:
Г-А-Ц-А-Г-Т-Г-Т-А-Г-Ц-А-Т-Ц-Г Определите кодон иРНК, к которому присоединяется эта тРНК, и аминокислоту, переносимую этой тРНК, если известно, что третий триплет ДНК шифрует её антикодон. (Использ. табл. генетического кода.)
Задание на «5» : Последовательность нуклеотидов фрагмента цепи ДНК:
Г-Ц-Т-А-Ц-Г-А-Т-Г-Т-Г-А-Ц-А-Г Определите последовательность нуклеотидов в иРНК, аминокислот в полипептидной цепи.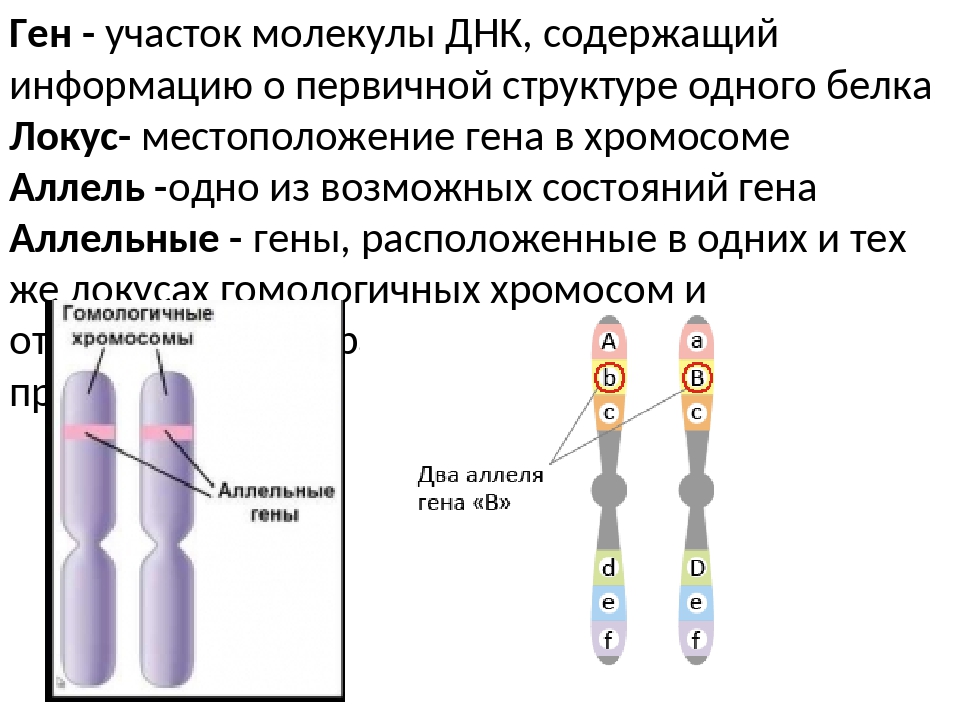 Что произойдет в полипептиде, если в результате мутации во фрагменте гена выпадает третий триплет нуклеотидов? Для выполнения задания используйте таблицу генетического кода.
Что произойдет в полипептиде, если в результате мутации во фрагменте гена выпадает третий триплет нуклеотидов? Для выполнения задания используйте таблицу генетического кода.
Какая часть клетки обеспечивает синтез белков. Синтез белка в клетках мышц
Способность клеток поддерживать высокую упорядоченность своей организации зависит от генетической информации, которая реализуется, сохраняется, воспроизводится или совершенствуется в четырёх генетических процессах: синтезе РНК и белка, репарации ДНК, репликации ДНК и генетической рекомбинации. На долю белков приходится обычно больше половины сухой массы клетки, и синтез их играет главную роль в таких процессах как рост и дифференцировка клеток, поддержание их структуры и функции.
Зависит от совместного действия нескольких классов молекул РНК. Сначала в результате копирования ДНК, несущей информацию о синтезируемом белке, образуется молекула матричной РНК (мРНК). К каждой из 20 аминокислот, из которых строится белок, присоединяется молекула специфической транспортной РНК (тРНК), а к субъединицам рибосомы, на которой происходит синтез, присоединяются некоторые вспомогательные белковые факторы.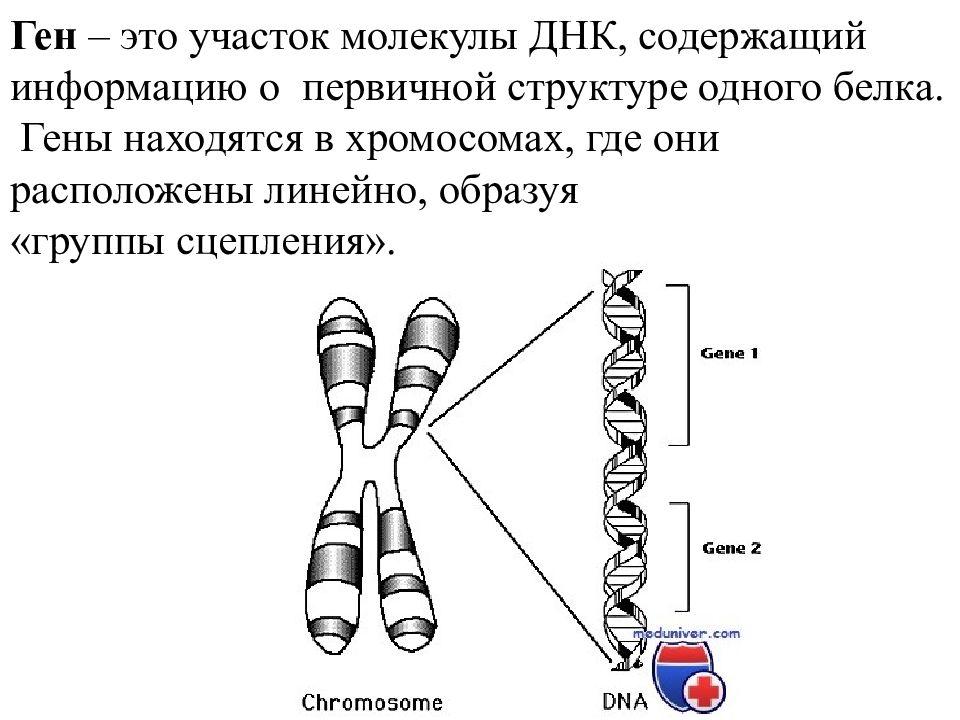
Началом синтеза белка в клетке считается момент, когда эти компоненты объединяются в цитоплазме, образуя функциональную рибосому. По мере того как мРНК шаг за шагом продвигается сквозь рибосому, её нуклеотидная последовательность переводится (транспортируется) в соответствующую последовательность аминокислот, в результате создаётся определённая белковая цепь.
Синтез РНК на ДНК-матрице называется транскрипцией. В результате транскрипции образуются молекулы мРНК, несущие информацию для синтеза белка в клетке, а также транспортные, рибосомные и другие виды молекул РНК, выполняющие структурные и каталитические функции. Синтез этих молекул РНК — копий нуклеотидных последовательностей участков молекулы ДНК — катализируется ферментами, которые называются РНК-полимеразами.
Связь РНК-полимеразы оказывается очень прочной, если РНК-полимераза присоединяется к специфической последовательности ДНК, к так называемому промотору, содержащему старт-сигнал для синтеза РНК, то есть к сайту, с которого этот синтез должен начаться.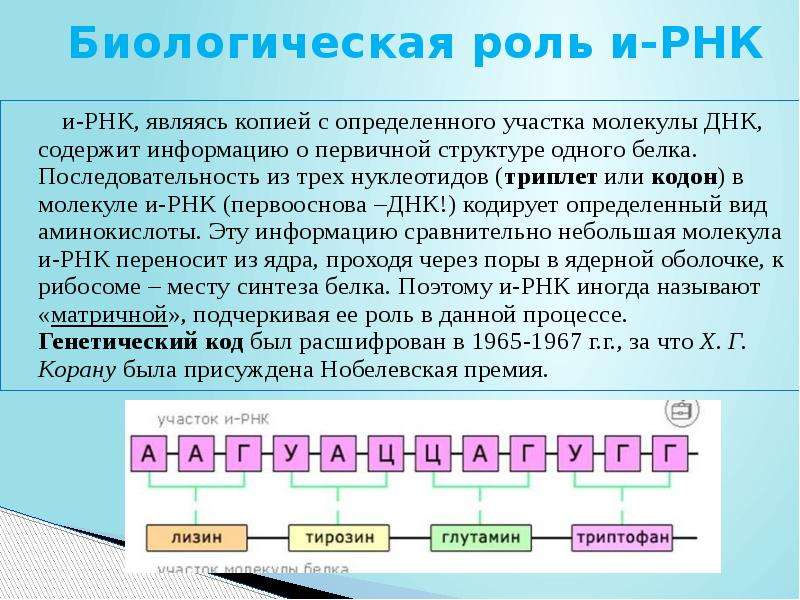
Процесс удлинения цепи РНК продолжается до тех пор, пока фермент не встретит на своём пути еще одну специфическую нуклеотидную последовательность в цепи ДНК, — а именно сигнал терминации транскрипции (стоп-сигнал). Достигнув этой точки, полимераза отделяется и от матричной ДНК, и от вновь синтезированной цепи РНК.
Транскрибируется, как правило, одна из цепей ДНК. Какая из двух цепей будет транскрибироваться, определяется промотором, нуклеотидная последовательность которого ориентирована таким образом, чтобы направить РНК-полимеразу на тот или иной путь.
Известно также, что в определении того, какие участки ДНК будут транскрибироваться РНК-полимеразой, важную роль играют особые белки , регулирующие активность генов. Именно от них в первую очередь и зависит, какие белки будет вырабатывать клетка. Далее, в клетках эукариот большинство РНК-транскриптов ДНК покинут клеточное ядро и перейдут в цитоплазму в виде мРНК, претерпевая существенные изменения — подвергаясь сплайсингу.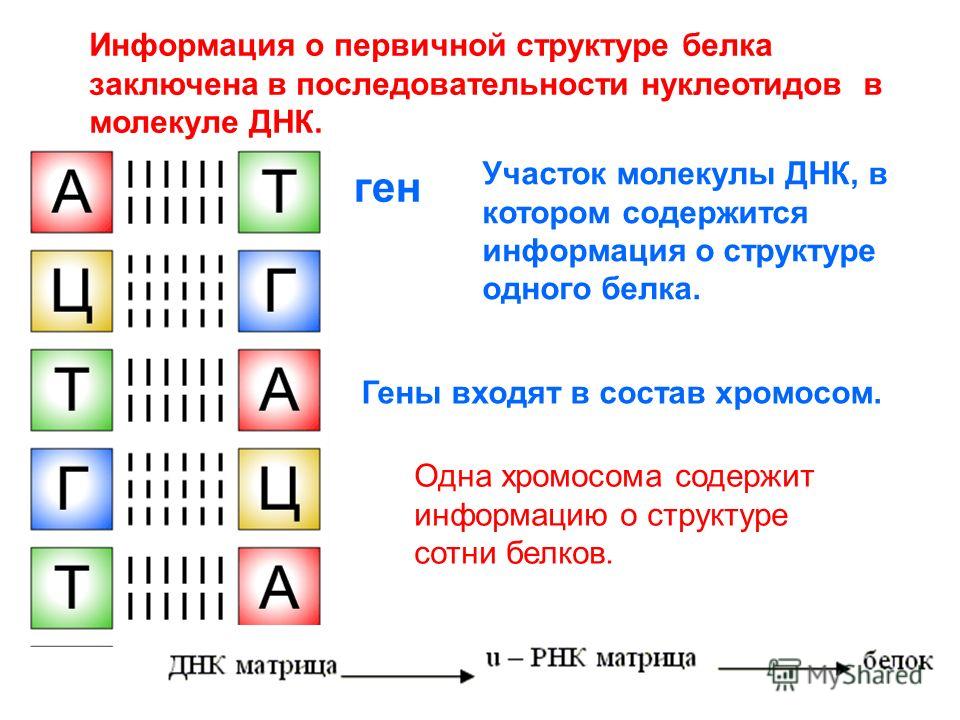
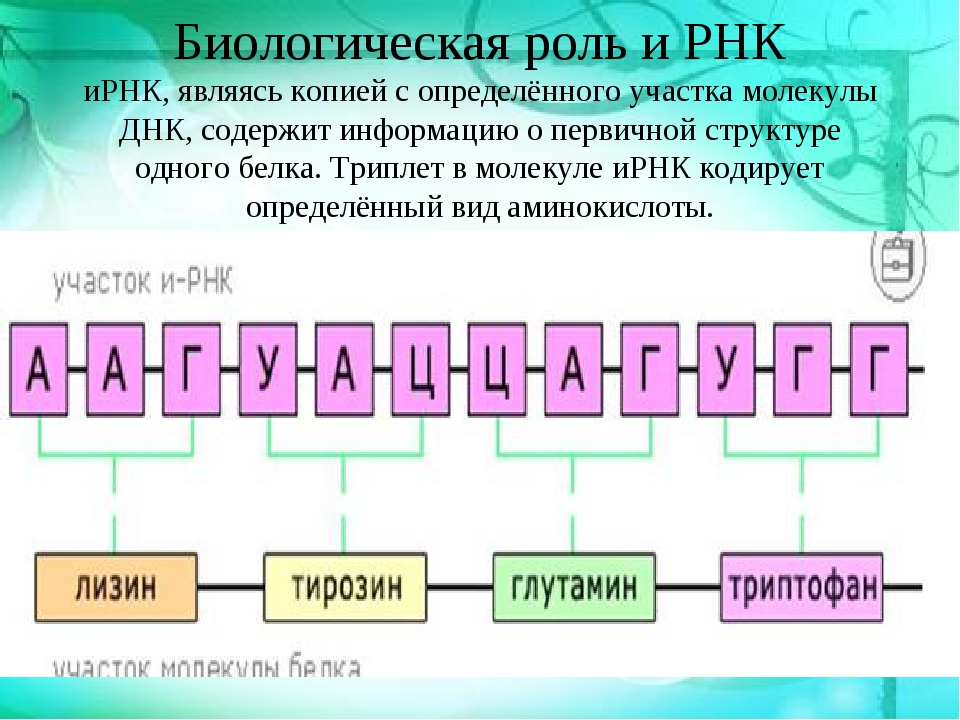
Во всех клетках имеется набор транспортных РНК (тРНК) — небольших молекул, размеры которых колеблются от 70 до 90 нуклеотидов. Эти РНК, присоединяясь одним своим концом к специфическому кодону мРНК, а другим присоединяя аминокислоту, кодируемую данным триплетом, позволяют аминокислотам выстраиваться в порядке, диктуемом нуклеотидной последовательностью мРНК.
Каждая тРНК может переносить только одну из 20 аминокислот, используемых в синтезе белка. Транспортную РНК, переносящую глицин, обозначают как тРНК Gly и т.д. Для каждой из 20 аминокислот имеется один тип тРНК. Важно при этом, что каждая аминокислота ковалентно присоединяется к тРНК, содержащей правильный антикодон — трехнуклеотидную последовательность, комплементарную трехнуклеотидному кодону, определяющему эту аминокислоту в молекулу мРНК. Спаривание кодона с антикодоном позволяет каждой аминокислоте включиться в растущую белковую цепь в том порядке, который диктуется нуклеотидной последовательностью мРНК. Так что генетический код используется для перевода (трансляции) нуклеотидных последовательностей нуклеиновых кислот в аминокислотные последовательности белков.
нить мРНК окрашена красным цветом, рибосомы — синим, растущие полипептидные цепи — зелёным. (Фото Dr Elena Kiseleva).
Присоединяясь одним концом к аминокислоте, а другим спариваясь с кодоном, тРНК переводит последовательность нуклеотидов в последовательность аминокислот. Функция тРНК зависит от трёхмерной структуры её молекулы. В каком именно месте будет присоединена к растущей полипептидной цепи данная аминокислота, зависит не от самой аминокислоты , а от присоединившей её молекулы тРНК. Молекула тРНК ковалентно присоединяется именно к той аминокислоте из всех двадцати аминокислот, которая является её настоящим партнером. Механизм этот связан с участием ферментов, называемых аминоацил-тРНК-синтазами, которые присоединяют аминокислоту к соответствующему набору молекул тРНК. Для каждой из аминокислот имеется своя особая синтетаза (всего таких синтетаз 20): одна присоединяет, например, глицин к тРНК Gly , другая — аланин к тРНК Ala и т.д. Таким образом, молекулы тРНК играют роль конечных адаптаторов, переводящих информацию, заключённую в нуклеотидной последовательности нуклеиновой кислоты, на язык белка.
Для осуществления реакций белкового синтеза требуется сложный каталитический стимул. Растущий конец полипептидной цепи должен определённым образом подстраиваться к молекуле мРНК для того, чтобы каждый последующий кодон мРНК точно соединился с антикодоном тРНК, не проскочив ни на один нуклеотид. В противном случае это приведет к сдвигу последовательности считывания.
Более половины массы рибосомы составляет РНК (рРНК), которая играет ключевую роль в каталитической активности рибосомы. В рибосоме имеются три различных участка, с которыми связывается РНК — один для мРНК и два для тРНК. Из двух последних один участок удерживает молекулу тРНК, присоединённую к растущему концу полипептидной цепи, поэтому его называют пептидил-тРНК — связывающим участком, или Р-участком.
Второй участок служит для удержания только прибывшей молекулы тРНК, нагруженной аминокислотой. Его называют аминоацил-тРНК-связывающим участком, или А-участком. К обоим участкам молекула тРНК прочно прикрепляется лишь в том случае, если её антикодон спаривается с комплементарным ему кодоном мРНК. А- и Р-участки располагаются очень близко друг к другу — так, что две связанные с ними молекулы тРНК спариваются с двумя соседними кодонами в молекуле мРНК.
А- и Р-участки располагаются очень близко друг к другу — так, что две связанные с ними молекулы тРНК спариваются с двумя соседними кодонами в молекуле мРНК.
Процесс наращивания полипептидной цепи на рибосомах может рассматриваться как цикл, слагающийся из трёх отдельных этапов:
- Молекула аминоацил-тРНК связывается со свободным участком рибосомы, примыкающим к занятому Р-участку. Связывание осуществляется путём спаривания нуклеотидов антикодона с тремя нуклеотидами мРНК, находящимися в А-участке.
- На втором этапе происходит отделение карбоксильного конца полипептидной цепи в Р-участке от молекулы тРНК и образуется пептидная связь с аминокислотой, присоединённой молекулой тРНК в А-участке.
- Новая пептидил-тРНК переносится в Р-участок рибосомы, в то время как рибосома продвигается вдоль молекулы мРНК ровно на три нуклеотида.
Процесс транслокации, составляющий третий этап, включает в себя и возвращение свободной молекулы тРНК, отделившейся от полипептидной цепи в Р-участке во время второго этапа цитоплазматического пула тРНК. Поэтому после завершения третьего этапа незанятый А-участок может принять новую молекулу тРНК, нагруженную очередной аминокислотой, то есть цикл может начаться снова.
Поэтому после завершения третьего этапа незанятый А-участок может принять новую молекулу тРНК, нагруженную очередной аминокислотой, то есть цикл может начаться снова.
Весьма энергоёмкий процесс. Образование каждой новой пептидной связи сопровождается расположением четырёх высокоэнергетических фосфатных связей. Две из них расходуются, чтобы нагрузить аминокислотой молекулу тРНК, а две — на сам синтез в цикле реакций, протекающих на рибосоме. При завершении цикла пептидилтранфераза присоединяет к пептидил-тРНК не аминокислоту, а молекулу H 2 O, в силу чего карбоксильный конец растущей полипептидной цепи отделяется от молекулы тРНК — белковая цепь оказывается свободной и поступает в цитоплазму.
Таким образом, вновь сформированная после митотического деления клетка наделена видовой преемственностью наследственного материала, в результате перехода его в процессе деления в равном количестве в обе дочерние клетки. Дочерние клетки продолжают эволюционно закреплённый процесс видового метаболизма, приобретая свойства, характерные для клеточной популяции тканевой принадлежности. Поэтому в короткий промежуток вновь сформированные клетки проходят специализацию (дифференцировку) согласно их основной генетически закреплённой принадлежности. Ряд свойств становятся крайне общими для всех клеток, независимо от того, в какой тканевой системе им приходится выполнять свой жизненный цикл. Для выполнения своих функций клетки наделены рядом высокоспециализированных свойств.
Поэтому в короткий промежуток вновь сформированные клетки проходят специализацию (дифференцировку) согласно их основной генетически закреплённой принадлежности. Ряд свойств становятся крайне общими для всех клеток, независимо от того, в какой тканевой системе им приходится выполнять свой жизненный цикл. Для выполнения своих функций клетки наделены рядом высокоспециализированных свойств.
Источники:
Цитофизиология / Луценко М.Т. // Новосибирск-Благовещенск, 2011.
Биосинтез белков идет в каждой живой клетке. Наиболее активен он в молодых растущих клетках, где синтезируются белки на построение их органоидов, а также в секреторных клетках, где синтезируются белки-ферменты и белки-гормоны.
Основная роль в определении структуры белков принадлежит ДНК. Отрезок ДНК, содержащий информацию о структуре одного белка, называют геном. Молекула ДНК содержит несколько сотен генов. В молекуле ДНК записан код о последовательности аминокислот в белке в виде определенно сочетающихся нуклеотидов. Код ДНК удалось расшифровать почти полностью. Сущность его состоит в следующем. Каждой аминокислоте соответствует участок цепи ДНК из трех рядом стоящих нуклеотидов.
Код ДНК удалось расшифровать почти полностью. Сущность его состоит в следующем. Каждой аминокислоте соответствует участок цепи ДНК из трех рядом стоящих нуклеотидов.
Например, участок Т-Т-Т соответствует аминокислоте лизину, отрезок А-Ц-А — цистину, Ц-А-А — валину н т. д. Разных аминокислот — 20, число возможных сочетаний из 4 нуклеотидов по 3 равно 64. Следовательно, триплетов с избытком хватает для кодирования всех аминокислот.
Синтез белка — сложный многоступенчатый процесс, представляющий цепь синтетических реакций, протекающих по принципу матричного синтеза.
Поскольку ДНК находится в ядре клетки, а синтез белка происходит в цитоплазме, существует посредник, передающий информацию с ДНК на рибосомы. Таким посредником является и-РНК. :
В биосинтезе белка определяют следующие этапы, идущие в разных частях клетки:
- Первый этап — синтез и-РНК происходит в ядре, в процессе которого информация, содержащаяся в гене ДНК, переписывается на и-РНК. Этот процесс называется транскрипцией (от лат.
 «транскриптик» — переписывание).
«транскриптик» — переписывание). - На втором этапе происходит соединение аминокислот с молекулами т-РНК, которые последовательно состоят из трех нуклеотидов — антикодонов, с помощью которых определяется свой триплет-кодон.
- Третий этап — это процесс непосредственного синтеза полипептидных связей, называемый трансляцией. Он происходит в рибосомах.
- На четвертом этапе происходит образование вторич ной и третичной структуры белка, то есть формирование окончательной структуры белка.
Таким образом, в процессе биосинтеза белка образуются новые молекулы белка в соответствии с точной информацией, заложенной в ДНК. Этот процесс обеспечивает обновление белков, процессы обмена веществ, рост и развитие клеток, то есть все процессы жизнедеятельности клетки.
Хромосомы (от греч. «хрома» — цвет, «сома» — тело) — очень важные структуры ядра клетки. Играют главную роль в процессе клеточного деления, обеспечивая передачу наследственной информации от одного поколения к другому.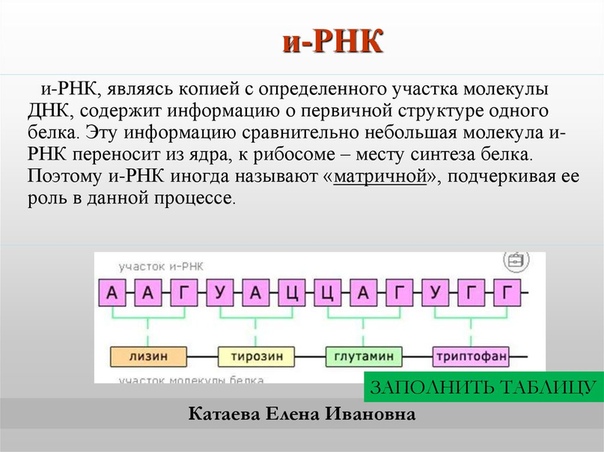 Они представляют собой тонкие нити ДНК, связанные с белками. Нити называются хроматидами, состоящими из ДНК, основных белков (гистонов) и кислых белков.
Они представляют собой тонкие нити ДНК, связанные с белками. Нити называются хроматидами, состоящими из ДНК, основных белков (гистонов) и кислых белков.
В неделящейся клетке хромосомы заполняют весь объем ядра и не видны под микроскопом. Перед началом деления происходит спирализация ДНК и каждая хромосома становится различимой под микроскопом. Во время спирализации хромосомы сокращаются в десятки тысяч раз. В таком состоянии хромосомы выглядят как две лежащие рядом одинаковые нити (хроматиды), соединенные общим участком — центромерой.
Для каждого организма характерно постоянное количество и структура хромосом. В соматических клетках хромосомы всегда парные, то есть в ядре есть две одинаковые хромосомы, составляющие одну пару. Такие хромосомы называют гомологичными, а парные наборы хромосом в соматических клетках называют диплоидными.
Так, диплоидный набор хромосом у человека состоит из 46 хромосом, образуя 23 пары. Каждая пара состоит из двух одинаковых (гомологичных) хромосом.
Особенности строения хромосом позволяют выделить их 7 групп, которые обозначаются латинскими буквами А, В, С, D, Е, F, G. Все пары хромосом имеют порядковые номера.
У мужчин и женщин есть 22 пары одинаковых хромосом. Их называют аутосомы. Мужчина и женщина отличаются одной парой хромосом, которые называют половыми. Они обозначаются буквами — большая X (группа С) и маленькая Y (группа С,). В женском организме 22 пары аутосом и одна пара (XX) половых хромосом. У мужчин — 22 пары аутосом н одна пара (XY) половых хромосом.
В отличие от соматических клеток, половые клетки содержат половинный набор хромосом, то есть содержат по одной хромосоме каждой пары! Такой набор называют гаплоидным. Гаплоидный набор хромосом возникает в процессе созревания клеток.
В синтезе белков из аминокислот можно выделить три этапа.
Первый этап –
транскрипция
–
был описан
в предыдущей теме. Он состоит в образовании
молекул РНК на матрицах ДНК. Для синтеза
белка особое значение имеет синтез
матричных или информационных РНК, так
как здесь записана информация о будущем
белке. Транскрипция протекает в ядре
клеток. Затем с помощью специальных
ферментов, образовавшаяся матричная
РНК перемещается в цитоплазму.
Транскрипция протекает в ядре
клеток. Затем с помощью специальных
ферментов, образовавшаяся матричная
РНК перемещается в цитоплазму.
Второй этап называется рекогниция. Аминокислоты избирательно связываются с своими переносчиками транспортными РНК .
Все т-РНК построены сходным образом. Молекула каждой т-РНК представляет собой полинуклеотидную цепь, изогнутую в виде «клеверного листа». Молекулы т-РНК устроены таким образом, что имеют разные концы, имеющие сродство и с м-РНК (антикодон) и с аминокислотами. Т-РНК имеет в клетке 60 разновидностей.
Для соединения аминокислот с транспортными РНК служит особый фермент т-РНК синтетаза или, точнее, амино-ацил – т-РНК синтетаза.
Третий этап биосинтеза белка называется трансляция. Он происходит на рибосомах. Каждая рибосома состоит из двух частей – большой и малой субъединиц. Они состоят из рибосомных РНК и белков.
Трансляция
начинается с присоединения матричной
РНК к рибосоме. Затем к образовавшемуся
комплексу начинают присоединяться
т-РНК с аминокислотами. Присоединение
это происходит путем связывания
антикодона т-РНК к кодону информационной
РНК на основании принципа комплементарности.
Одновременно к рибосоме могут присоединится
не более двух т-РНК. Далее аминокислоты
соединяются друг с другом пептидной
связью, образуя постепенно полипептид.
После этого рибосома передвигает
информационную РНК ровно на один кодон.
Дальше процесс повторяется снова до
тех пор пока информационная РНК не
закончится. На конце и-РНК находятся
бессмысленные кодоны, которые являются
точками в записи и одновременно командой
для рибосомы, что она должна отделиться
от и-РНК
Затем к образовавшемуся
комплексу начинают присоединяться
т-РНК с аминокислотами. Присоединение
это происходит путем связывания
антикодона т-РНК к кодону информационной
РНК на основании принципа комплементарности.
Одновременно к рибосоме могут присоединится
не более двух т-РНК. Далее аминокислоты
соединяются друг с другом пептидной
связью, образуя постепенно полипептид.
После этого рибосома передвигает
информационную РНК ровно на один кодон.
Дальше процесс повторяется снова до
тех пор пока информационная РНК не
закончится. На конце и-РНК находятся
бессмысленные кодоны, которые являются
точками в записи и одновременно командой
для рибосомы, что она должна отделиться
от и-РНК
Таким образом, можно выделить несколько особенности биосинтеза белков.
1. Первичная структура белков формируется строго на основе данных записанных в молекулах ДНК и информационных РНК,
2. Высшие структуры
белка (вторичная, третичная, четвертичная)
возникают самопроизвольно на основе
первичной структуры.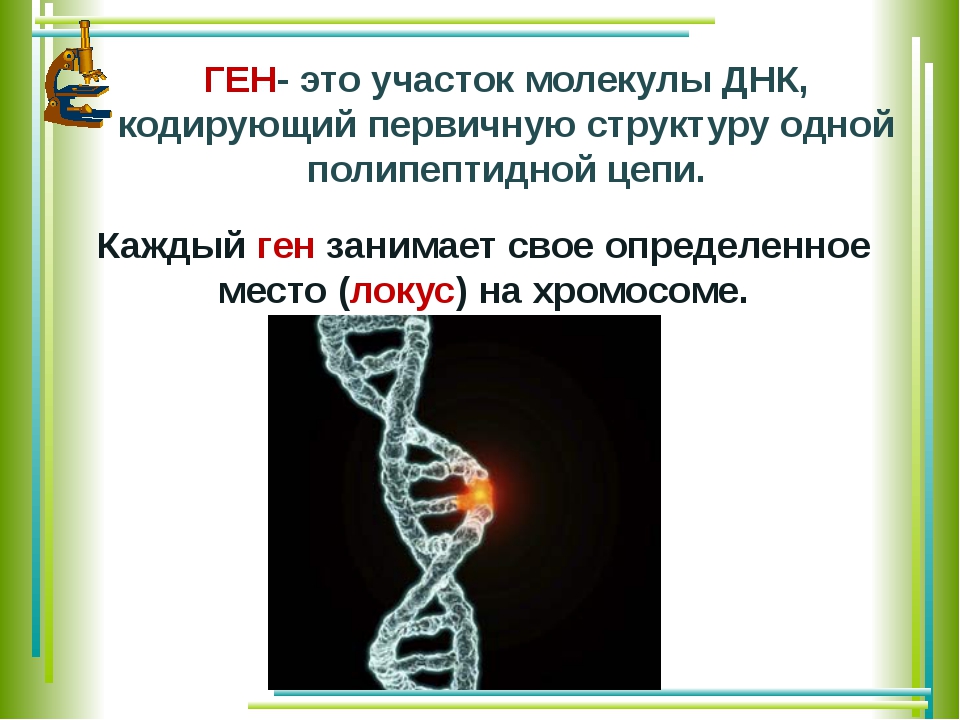
3. В некоторых случаях полипептидная цепь после завершения синтеза подвергается незначительной химической модификации, в результате чего в ней появляются некодируемые аминокислоты, не относящиеся к 20 обычным. Примером такого превращения является белок коллаген, где аминокислоты лизин и пролин превращаются в оксипролин и оксилизин.
4. Синтез белков в организме ускоряется соматотропным гормоном и гормоном тестостероном.
5. Синтез белков очень энергоемкий процесс, требующий огромного количества АТФ.
6. Многие антибиотики подавляют трансляцию.
Метаболизм аминокислот.
Аминокислоты могут использоваться для синтеза различных небелковых соединений. Например, из аминокислот синтезируется глюкоза, азотистые основания, небелковая часть гемоглобина – гем, гормоны – адреналин, тироксин и такие важные соединения, как креатин, карнитин, принимающие участие в энергетическом обмене.
Часть аминокислот подвергается распаду до углекислого газа, воды и аммиака.
Распад начинается
с реакций общих для большинства
аминокислот.
К ним относятся.
1. Декарбоксилирование — отщепление от аминокислот карбоксильной группы в виде углекислого газа.
ПФ (пиридоксальфосфат) – кофермент производное витамина В6.
Так, например, образуется гистамин из аминокислоты гистидина. Гистамин – важное сосудорасширяющее вещество.
2. Дезаминирование — отцепление аминогруппы в виде Nh4 . У человека дезаминирование аминокислот идет окислительным путем.
3. Трансаминирование – реакция между аминокислотами и α-кетокислотами. В ходе этой реакции её участники обмениваются функциональными группами.
Трансаминированию подвергаются все аминокислоты. Этот процесс – главное превращение аминокислот в организме, так как у него скорость значительно выше, чем у двух первых описанных реакций.
Трансаминирование выполняет две основные функции.
1. За счет этих
реакций одни аминокислоты превращаются
в другие. При этом общее количество
аминокислот не меняется но меняется
общее соотношение между ними в организме. С пищей в организм поступают чужеродные
белки, у которых аминокислоты находятся
в иных пропорциях. Путем трансаминирования
происходит корректировка аминокислотного
состава организма.
С пищей в организм поступают чужеродные
белки, у которых аминокислоты находятся
в иных пропорциях. Путем трансаминирования
происходит корректировка аминокислотного
состава организма.
2. Трансаминирование является составной частью процесса косвенного дезаминирования аминокислот – процесса, с которого начинается распад большинства аминокислот.
Схема косвенного дезаминирования.
В результате трансаминирования образуются α-кетокислоты и аммиак. Первые разрушаются до углекислого газа и воды. Аммиак для организма высокотоксичен. Поэтому в организме существуют молекулярные механизмы его обезвреживания.
План-конспект урока : «Синтез белков в клетке»
(Для профильного 10-ого класса, время урока — на 2 часа)
Учитель: Мастюхина Анна Александровна
МОУ «СОШ имени генерала Захаркина И.Г.»
Задача урока:
Образовательная:
изучить
особенности биосинтеза белков в клетке
,
изучить понятия:
ген, генетический код, триплет, кодон, антикодон, транскрипция, трансляция, полисома
; п
родолжить формирование знаний о механизмах биосинтеза белка на примере трансляции; выяснить роль транспортных РНК в процессе биосинтеза белка; раскрыть механизмы матричного синтеза полипептидной цепи на рибосомах.
Развивающая: в целях развития познавательного интереса учащихся заранее подготовить сообщения(«Интересные факты о гене», «Генетический код»,«Транскрипция и трансляция») . Для развития навыков практического труда составит синквейн. В целях развития логического мышления научится решать задачи.
Воспитательная: В целях формирования научного мировоззрения доказать важность и значимость синтеза белков в клетках, а также их жизненную необходимость.
Ф.О.У.Р .: урок.
Тип урока : комбинированный
Вид урока : с презентацией « Синтез белков в клетке » и демонстрацией магнитных моделей.
Оборудование:
презентация «Синтез белков в клетке »; таблица «Генетический код»; Схема «Образование и-РНК по матрице ДНК (транскрипция)»; Схема «Строение т-РНК»; Схема «Синтез белка в рибосом (трансляция)»; Схема «Синтез белка на полисоме»; Карточки с заданиями и кроссворд; магнитные модели.
Методы и методические приемы:
I
. Организация класса.
Организация класса.
На предыдущих уроках мы изучали вещества, называемые нуклеиновыми кислотами. В следствии
чего рассмотрели два их вида: ДНК и РНК, ознакомились с их строением и функциями. Выяснили что в состав каждой из нуклеиновых кислот входят четыре различных азотистых основания, которые соединяются друг с другом по принципу комплементарности. Все эти знания понадобятся нам при изучении сегодняшней новой теме. Итак запишите ее название в своих рабочих тетрадях «Синтез белка в клетке».
II .Изучение нового материала:
1)Актуализация знаний:
Прежде, чем приступить к изучению новой темы, вспомним: что такое обмен веществ (метаболизм):
МЕТАБОЛИЗМ – совокупность всех ферментативных реакций клетки, связанных между собой и с внешней средой, состоящая из пластического
и энергетического обменов.
Давайте составим синквейн, первое слово которого — обмен веществ. (1-обмен веществ
2-пластический, энергетический
3-протекает,поглощает,выделяет
4-совокупность ферментативных реакций клетки
5-метаболизм)
Биосинтез белка
относится к реакциям пластического обмена.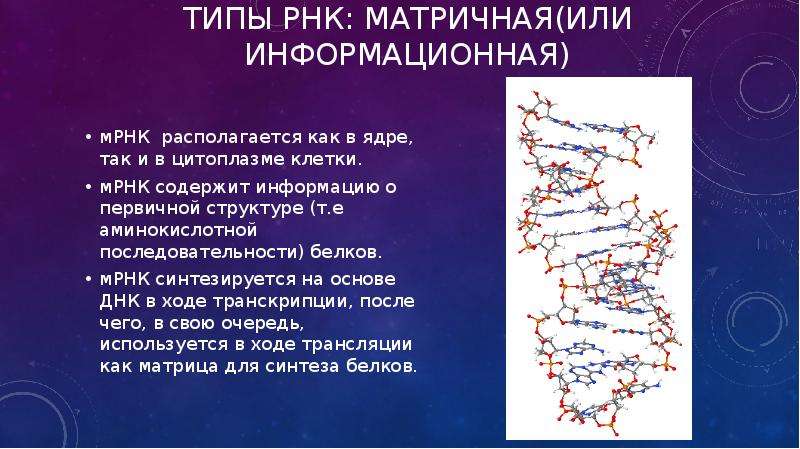
Задание: закончите предложения, вписав недостающие термины.
1. Фотосинтез – это … (синтез органических веществ на свету).
2. Процесс фотосинтеза осуществляется в органеллах клетки – … (хлоропластах).
3. Свободный кислород при фотосинтезе выделяется при расщеплении … (воды).
4. На какой стадии фотосинтеза образуется свободный кислород? На … (световой).
5. В течение световой стадии … АТФ. (Синтезируется.)
6. В темновой стадии в хлоропласте образуется … (первичный углевод – глюкоза).
7. При попадании солнечного счета на хлорофилл происходит … (возбуждение электронов).
8. Фотосинтез происходит в клетках … (зеленых растений).
9. Световая фаза фотосинтеза происходит в …
(тилакоидах).
Световая фаза фотосинтеза происходит в …
(тилакоидах).
10. Темновая фаза происходит в … (любое) время суток.
Важнейшим процессом ассимиляции в клетке является присущих ей белков.
Каждая клетка содержит тысячи белков, в том числе и присущих только данному виду клеток. Так как в процессе жизнедеятельности все белки рано или поздно разрушаются, клетка должна непрерывно синтезировать белки для восстановления своих , органоидов и т. п. Кроме того, многие клетки «изготовляют» белки для нужд всего организма, например клетки желез внутренней секреции, выделяющие в кровь белковые гормоны. В таких клетках синтез белка идет особенно интенсивно.
2)Изучение нового материала:
Синтез белка требует больших затрат энергии.
Источником этой энергии, как и для всех клеточных процессов, является
. Многообразие функций белков определяется их первичной структурой, т.е. последовательностью аминокислот в их молекуле.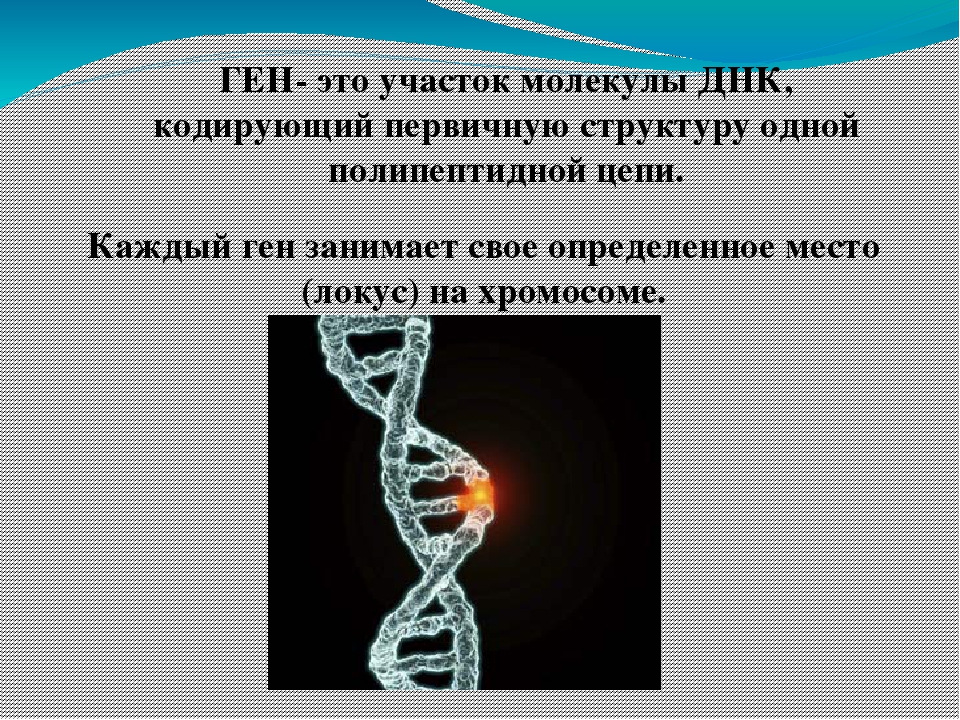 В свою очередь наследственная
о первичной структуре белка заключена в последовательности нуклеотидов в молекуле ДНК. Участок ДНК, в котором содержится информация о первичной структуре одного белка, называется геном. В одной хромосоме находится информация о структуре многих сотен белков.
В свою очередь наследственная
о первичной структуре белка заключена в последовательности нуклеотидов в молекуле ДНК. Участок ДНК, в котором содержится информация о первичной структуре одного белка, называется геном. В одной хромосоме находится информация о структуре многих сотен белков.
Генетический код.
Каждой аминокислоте белка в
соответствует последовательность из трех расположенных друг за другом нуклеотидов — триплет. К настоящему времени составлена карта генетического кода, т. е. известно, какие триплетные сочетания нуклеотидов ДНК соответствуют той или иной из 20 аминокислот, входящих в состав белков (рис. 33). Как известно, в состав ДНК могут входить четыре азотистых основания: аденин (А), гуанин (Г), тимин (Т) и цитозин (Ц). Число сочетаний из 4 по 3 составляет: 43 = 64, т. е. можно закодировать 64 различных аминокислоты, тогда как кодируется только 20 аминокислот. Оказалось, что многим аминокислотам соответствует не один, а несколько различных триплетов — кодонов.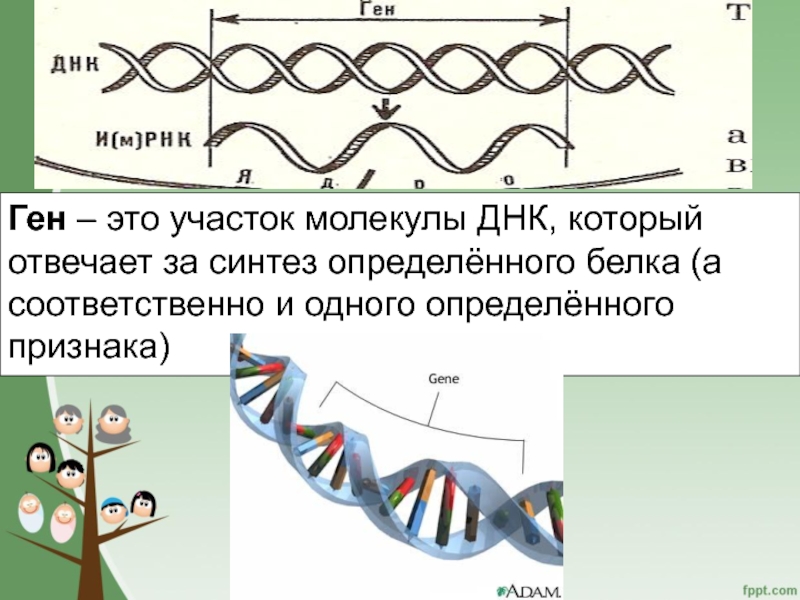
Предполагается, что такое свойство генетического кода повышает надежность хранения и передачи генетической информации при делении клеток. Например, аминокислоте аланину соответствуют 4 кодона: ЦГА, ЦГГ, ЦГТ, ЦГЦ, и получается, что случайная ошибка в третьем нуклеотиде не может отразиться на структуре белка — все равно это будет кодон аланина.
Так как в молекуле ДНК содержатся сотни генов, то в ее состав обязательно входят триплеты, являющиеся «знаками препинания» и обозначающие начало и конец того или иного гена.
Очень важное свойство генетического кода — специфичность, т. е. один триплет всегда обозначает только одну- единственную аминокислоту. Генетический код универсален для всех живых организмов от бактерий до человека.
Транскрипция. Носителем всей генетической информации является ДНК, расположенная в
клетки. Сам же синтез белка происходит в цитоплазме клетки, на рибосомах. Из ядра в цитоплазму информация о структуре белка поступает в виде информационной РНК (и-РНК). Для того чтобы синтезировать и-РНК, участок ДНК «разматывается», деспирализуется, а затем по принципу комплементарности на одной из цепочек ДНК с помощью ферментов синтезируются молекулы РНК (рис. 34). Это происходит следующим образом: против, например, гуанина молекулы ДНК становится цитозин молекулы РНК, против аденина молекулы ДНК — урацил РНК (вспомните, что в РНК в нук- леотиды вместо тимина включен урацил), напротив тимина ДНК — аденин РНК и напротив цитозина ДНК — гуанин РНК. Таким образом, формируется цепочка и-РНК, представляющая собой точную копию второй цепи ДНК (только тимин заменен на урацил). Таким образом, информация о последовательности нуклеотидов какого-либо гена ДНК «переписывается» в последовательность нуклеотидов и-РНК. Этот процесс получил название транскрипции. У прокариот синтезированные молекулы и-РНК сразу жмогут взаимодействовать с рибосомами, и начинается синтез белка. У эукариот и-РНК взаимодействует в ядре со специальными белками и переносится через ядерную оболочку в цитоплазму.
Для того чтобы синтезировать и-РНК, участок ДНК «разматывается», деспирализуется, а затем по принципу комплементарности на одной из цепочек ДНК с помощью ферментов синтезируются молекулы РНК (рис. 34). Это происходит следующим образом: против, например, гуанина молекулы ДНК становится цитозин молекулы РНК, против аденина молекулы ДНК — урацил РНК (вспомните, что в РНК в нук- леотиды вместо тимина включен урацил), напротив тимина ДНК — аденин РНК и напротив цитозина ДНК — гуанин РНК. Таким образом, формируется цепочка и-РНК, представляющая собой точную копию второй цепи ДНК (только тимин заменен на урацил). Таким образом, информация о последовательности нуклеотидов какого-либо гена ДНК «переписывается» в последовательность нуклеотидов и-РНК. Этот процесс получил название транскрипции. У прокариот синтезированные молекулы и-РНК сразу жмогут взаимодействовать с рибосомами, и начинается синтез белка. У эукариот и-РНК взаимодействует в ядре со специальными белками и переносится через ядерную оболочку в цитоплазму.
В цитоплазме обязательно должен быть набор аминокислот, необходимых для синтеза белка. Эти аминокислоты образуются в результате расщепления пищевых белков. Кроме того, та или иная аминокислота может попасть к месту непосредственного синтеза белка, т. е. в рибосому, только прикрепившись к специальной транспортной РНК (т-РНК).
Транспортные РНК.
Для переноса каждого вида аминокислот в рибосомы нужен отдельный вид т-РНК. Так как в состав белков входят около 20 аминокислот, существует столько же видов т-РНК. Строение всех т-РНК сходно (рис. 35). Их молекулы образуют своеобразные структуры, напоминающие по форме лист клевера. Виды т-РНК обязательно различаются по триплету нуклеотидов, расположенному «на верхушке». Этот триплет, получивший название антикодон, по генетическому коду соответствует той аминокислоте, которую предстоит переносить этой Т-РНК. К «черешку листа» специальный фермент прикрепляет обязательно ту аминокислоту, которая кодируется триплетом, комплементарным антикодону.
Трансляция.
В цитоплазме происходит последний этап синтеза белка — трансляция. На тот конец и-РНК, с которого нужно начать синтез белка, нанизывается рибосома (рис. 36). Рибосома перемещается по молекуле и-РНК прерывисто, «скачками», задерживаясь на каждом триплете приблизительно 0,2 с. За это мгновение одна т-РНК из многих способна «опознать» своим антикодоном триплет, на ко-тором находится рибосома. И если антикодон комплементарен этому триплету и-РНК, аминокислота отсоединяется от «черешка листа» и присоединяется пептидной связью к растущей белковой цепочке (рис. 37). В этот момент рибосома сдвигается по и-РНК на следующий триплет, кодирующий очередную аминокислоту синтезируемого белка, а очередная т-РНК «подносит» необходимую аминокислоту, наращивающую растущую цепочку белка. Эта операция повторяется столько раз, сколько аминокислот должен содержать строящийся» белок. Когда же в рибосоме оказывается один лз триплетов, являющийся «стоп-сигналом» между генами, то ни одна т-РНК к такому триплету присоединиться не може:т, так как антикодонов к ним у т-РНК не бывает. В этот момент синтез белка заканчивается. Все описываемые реакции происходят за очень маленькие промежутки времени. Подсчитано, что на синтез довольно крупной молекулы белка уходит всего около двух минут.
В этот момент синтез белка заканчивается. Все описываемые реакции происходят за очень маленькие промежутки времени. Подсчитано, что на синтез довольно крупной молекулы белка уходит всего около двух минут.
Клетке необходима не одна, а много молекул каждого белка. Поэтому как только рибосома, первой начавшая синтез белка на и-РНК, продвинется вперед, за ней на ту же и-РНК нанизывается вторая рибосома, синтезирующая тот же белок. Затем на и-РНК последовательно нанизываются третья, четвертая рибосомы и т. д. Все рибосомы, синтезирующие один и тот же белок, закодированный в данной и-РНК, называются полисомой.
Когда синтез белка окончен, рибосома может найти другую и-РНК и начать синтезировать тот белок, структура которого закодирована в новой и-РНК.
Таким образом, трансляция — это перевод последовательности нуклеотидов молекулы и-РНК в последовательность аминокислот синтезируемого белка.
Подсчитано, что все белки организма млекопитающего могут быть закодированы всего двумя процентами ДНК, содержащимися в его клетках.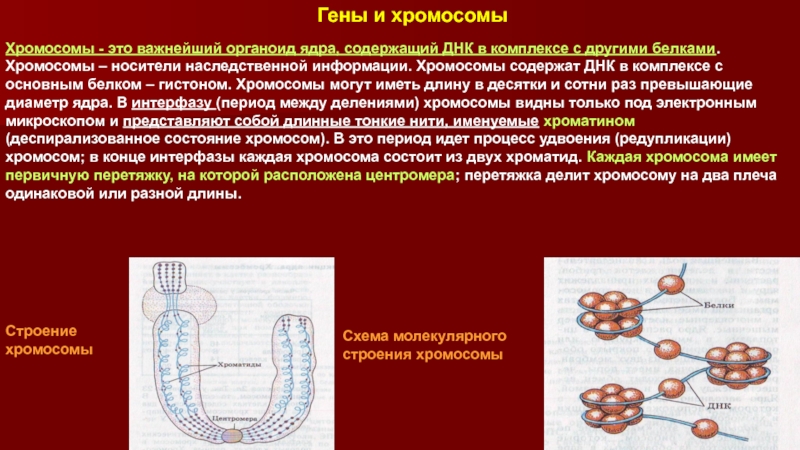 А для чего же нужны остальные 98% ДНК? Оказывается, каждый ген устроен гораздо сложнее, чем считали раньше, и содержит не только тот участок, в котором закодирована структура какого-либо белка, но и специальные участки, способные «включать» или «выключать» работу каждого гена. Вот почему все клетки, например человеческого организма, имеющие одинаковый набор хромосом, способны синтезировать различные белки: в одних клетках синтез белков идет с помощью одних генов, а в других — задействованы совсем иные гены. Итак, в каждой клетке реализуется только часть генетической информации, содержащейся в ее генах.
А для чего же нужны остальные 98% ДНК? Оказывается, каждый ген устроен гораздо сложнее, чем считали раньше, и содержит не только тот участок, в котором закодирована структура какого-либо белка, но и специальные участки, способные «включать» или «выключать» работу каждого гена. Вот почему все клетки, например человеческого организма, имеющие одинаковый набор хромосом, способны синтезировать различные белки: в одних клетках синтез белков идет с помощью одних генов, а в других — задействованы совсем иные гены. Итак, в каждой клетке реализуется только часть генетической информации, содержащейся в ее генах.
Синтез белка требует участия большого числа ферментов. И для каждой отдельной реакции белкового синтеза требуются специализированные ферменты.
IV .Закрепление материала:
Заполните таблицу:
В-1
Биосинтез белка состоит из двух последовательных этапов: транскрипции и трансляции.
Решите задачу 1:
Даны антикодоны тРНК: ГАА, ГЦА, ААА, АЦГ. Используя таблицу генетического кода, определите последовательность аминокислот в молекуле белка, кодоны иРНК и триплеты во фрагменте гена, кодирующего этот белок.
Используя таблицу генетического кода, определите последовательность аминокислот в молекуле белка, кодоны иРНК и триплеты во фрагменте гена, кодирующего этот белок.
Решение:
Кодоны иРНК: ЦУУ – ЦГУ – УУУ – УГЦ.
Последовательность аминокислот: лей – арг – фен – цис.
Триплеты ДНК: ГАА – ГЦА – ААА – АЦГ.
Задание 2
ТГТ-АЦА-ТТА-ААА-ЦЦТ. Определить последовательность нуклеотидов иРНК и последовательность аминокислот в белке, который синтезируется под контролем этого гена.
Ответ: ДНК: ТГТ-АЦА-ТТА-ААА-ЦЦТ
иРНК: АЦА-УГУ-ААУ-УУУ-ГГА
Белок: тре—цис—асп—фен—гли.
В-2
Решите задачу 1:
Дан фрагмент двуцепочечной молекулы ДНК. Воспользовавшись таблицей генетического кода, определите структуру фрагмента белковой молекулы, кодируемой этим участком ДНК:
ААА – ТТТ – ГГГ – ЦЦЦ
ТТТ – ААА – ЦЦЦ – ГГГ.
Решение:
Так как иРНК синтезируется всегда только на одной цепи ДНК, которую на письме принято изображать как верхнюю, то
иРНК: УУУ – ААА – ЦЦЦ – ГГГ;
фрагмент белка, кодируемый верхней цепью: фен – лиз – про – гли.
Задание 2 : участок ДНК имеет следующую последовательность нуклеотидов:
ТГТ-АЦА-ТТА-ААА-ЦЦТ. Определить последовательность нуклеотидов и-РНК и последовательность аминокислот в белке, который синтезируется под контролем этого гена.
Ответ: ДНК: АГГ-ЦЦТ-ТАТ-ГГГ-ЦГА
иРНК: УЦЦ-ГГА-АУА-ЦЦЦ-ГЦУ
Белок: сер—гли—изо—про—ала
А теперь прослушаем интересные сообщения, которые Вы подготовили.
«Интересные факты о гене»
«Генетический код»
«Транскрипция и трансляция»
VI .Подведение итогов урока.
1)Вывод по уроку:
Одним из важнейших процессов, протекающих в клетке, является синтез белков. Каждая клетка содержит тысячи белков, в том числе и присущих только данному виду клеток. Так как в процессе жизнедеятельности все белки рано или поздно
разрушаются, клетка должна непрерывно синтезировать белки для восстановления своих мембран, органоидов и т. п. Кроме того, многие клетки изготовляют белки для нужд всего организма, например клетки желез внутренней секреции, выделяющие в кровь белковые гормоны. В таких клетках синтез белка идет особенно интенсивно. Синтез белка требует больших затрат энергии. Источником этой энергии, как и для всех клеточных процессов, является АТФ.
п. Кроме того, многие клетки изготовляют белки для нужд всего организма, например клетки желез внутренней секреции, выделяющие в кровь белковые гормоны. В таких клетках синтез белка идет особенно интенсивно. Синтез белка требует больших затрат энергии. Источником этой энергии, как и для всех клеточных процессов, является АТФ.
2)Оценить самостоятельную работу учащихся и их работу у доски. Так же оценить активность участников беседы и докладчиков.
V II . Домашнее задание:
Повторить § 2.13.
Разгадайте кроссворд:
1. Специфическая последовательность нуклеотидов, находящихся в начале каждого гена.
2. Переход последовательности нуклеотидов молекулы иРНК в последовательность АК молекулы белка.
3. Знак начала трансляции.
4. Носитель генетической информации, расположенный в клеточном ядре.
5. Свойство генетического кода, повышающее надёжность хранения и передачи генетической информации при делении клеток.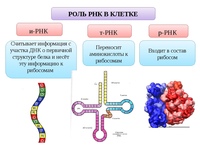
6. Участок ДНК, содержащий информацию о первичной структуре одного белка.
7. Последовательность из трёх расположенных друг за другом нуклеотидов ДНК.
8. Все рибосомы, синтезирующие белок на одной молекуле иРНК.
9. Процесс перевода информации, о последовательности АК в белке с «языка ДНК» на «язык РНК».
10. Кодон, не кодирующий АК, а только показывает, что синтез белка должен быть завершён.
11. Структура, где определяется последовательность АК в молекуле белка.
12. Важное свойство генетического кода, заключающееся в том что, один триплет всегда кодирует только одну АК.
13. «Знак препинания» в молекуле ДНК, указывающий на то, что синтез иРНК нужно прекратить.
14. Генетический код… для всех живых организмов от бактерий до человека.
— до 2 минут
-вступительное слово учителя
-35 минут
-10 минут
-учитель
-у доски 1 ученик
-ученики, записывают в тетради
-учитель
— с места
-слайд 1 и 2
-слайд 3
-слайд 4
-слайд 5
-слайд 6
-слайд 7 и 8
-слайд 9 и 10
-слайд 11 и 12
-слайд 13
-слайд 14
-слайд 15 и16
-слайд 17 и 18
-слайд 19 и 20
-логический переход
-слайд 21
-учитель
-25 минут
-учитель
-учитель
-слайд 22
-учитель
-слайд 23
-слайд 24
-слайд 25
-15 минут
слайд 27
-группа №1
-индивидуально на карточках
-группа № 2
-индивидуально на карточках
-30 минут
-заранее подготовленные
-слайд 29
-10 минут (1 уч.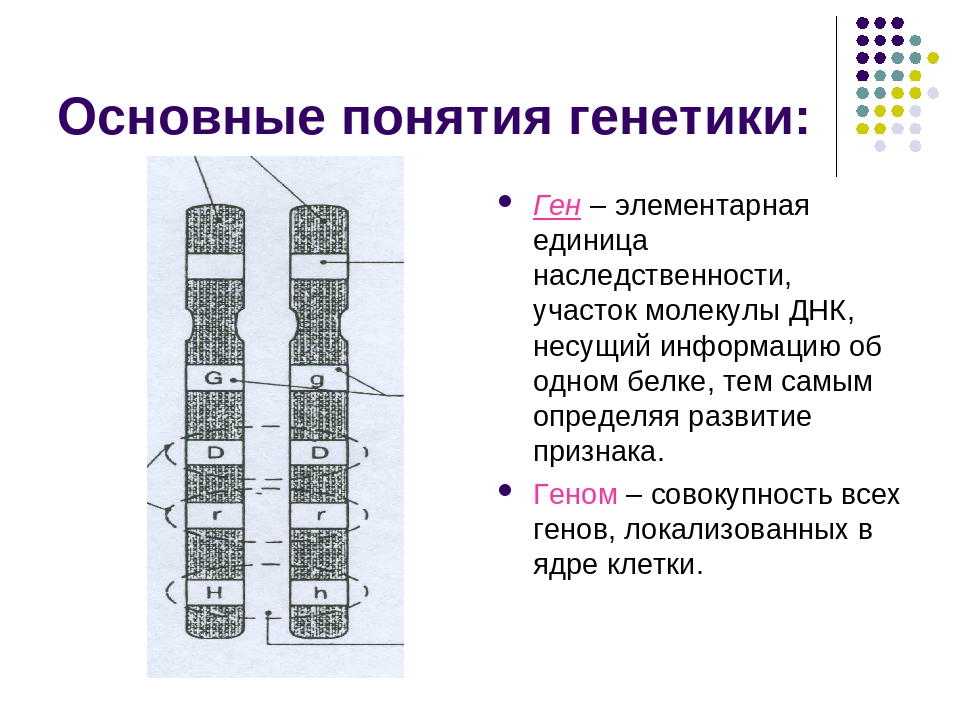 )
)
-10 минут (2 уч.)
-10 минут (3 уч.)
-5 минут
-учитель
-3минуты
-слайд 30
-на карточках
Биосинтез белков идет в каждой живой клетке. Наиболее активен он в молодых растущих клетках, где синтезируются белки на построение их органоидов, а также в секреторных клетках, где синтезируются белки-ферменты и белки-гормоны.
Основная роль в определении структуры белков принадлежит ДНК. Отрезок ДНК, содержащий информацию о структуре одного белка, называют геном . Молекула ДНК содержит несколько сотен генов. В молекуле ДНК записан код о последовательности аминокислот в белке в виде определенно сочетающихся нуклеотидов. Код ДНК удалось расшифровать почти полностью. Сущность его состоит в следующем. Каждой аминокислоте соответствует участок цепи ДНК из трех рядом стоящих нуклеотидов.
Например, участок Т-Т-Т соответствует аминокислоте лизину, отрезок А-Ц-А — цистину, Ц-А-А — валину н т.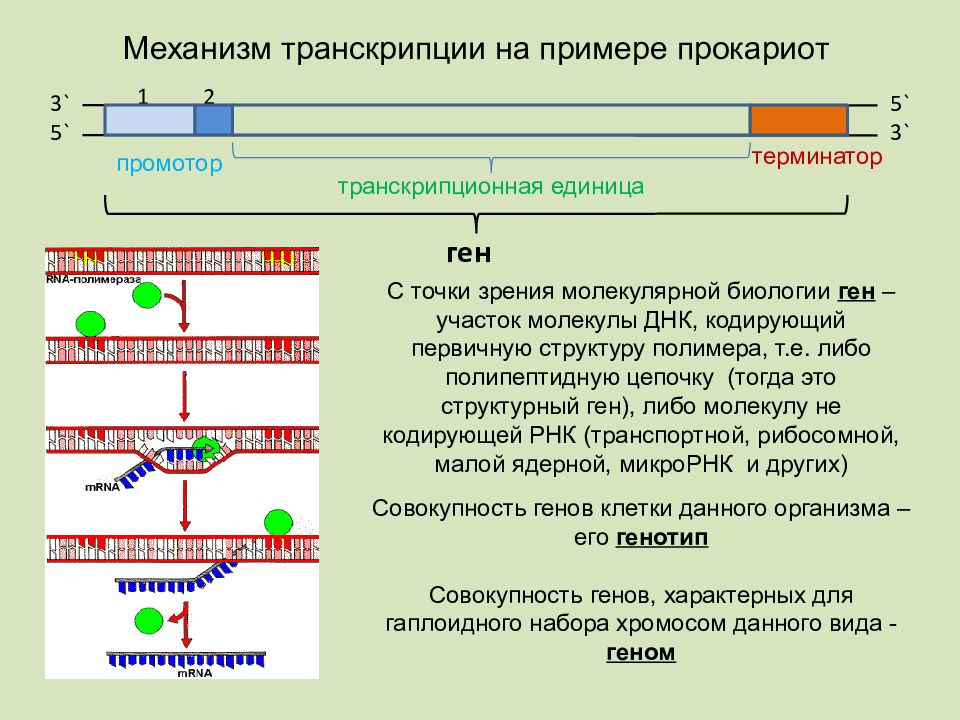 д. Разных аминокислот — 20, число возможных сочетаний из 4 нуклеотидов по 3 равно 64. Следовательно, триплетов с избытком хватает для кодирования всех аминокислот.
д. Разных аминокислот — 20, число возможных сочетаний из 4 нуклеотидов по 3 равно 64. Следовательно, триплетов с избытком хватает для кодирования всех аминокислот.
Синтез белка — сложный многоступенчатый процесс, представляющий цепь синтетических реакций, протекающих по принципу матричного синтеза.
Поскольку ДНК находится в ядре клетки, а синтез белка происходит в цитоплазме, существует посредник, передающий информацию с ДНК на рибосомы. Таким посредником является и-РНК.
В биосинтезе белка определяют следующие этапы, идущие в разных частях клетки:
- Первый этап — синтез и-РНК происходит в ядре, в процессе которого информация, содержащаяся в гене ДНК, переписывается на и-РНК. Этот процесс называется транскрипцией (от лат. «транскриптик» — переписывание).
- На втором этапе происходит соединение аминокислот с молекулами т-РНК, которые последовательно состоят из трех нуклеотидов — антикодон
ов,
с помощью которых определяется свой триплет-кодон.

- Третий этап — это процесс непосредственного синтеза полипептидных связей, называемый трансляцией . Он происходит в рибосомах.
- На четвертом этапе происходит образование вторичной и третичной структуры белка, то есть формирование окончательной структуры белка .
Синтез информационной РНК (и-РНК) происходит в ядре. Он осуществляется по одной из нитей ДНК с помощью ферментов и с учетом принципа комплиментарности азотистых оснований. Процесс переписывания информации, содержащейся в генах ДНК на синтезируемую молекулу и-РНК называется транскрипцией . Очевидно, что информация переписывается в виде последовательности нуклеотидов РНК. Нить ДНК в этом случае выступает в качестве матрицы. В молекулу РНК в процессе ее образования вместо азотистого основания – тимина включается урация.
Г — Ц — А — А — Ц — Т – фрагмент одной из цепочек молекулы ДНК- Ц — Г — У — У — Г — А – фрагмент молекулы информационной РНК.
Молекулы РНК индивидуальны, каждая из них несет информацию об одном гене. Далее молекулы и-РНК выходят из ядра клетки через поры оболочки ядра и направляются в цитоплазму к рибосомам. Сюда же с помощью транспортных РНК (т-РНК) доставляются аминокислоты. Молекула т-РНК состоит из 70–80 нуклеотидов. Общий вид молекулы напоминает лист клевера.
Далее молекулы и-РНК выходят из ядра клетки через поры оболочки ядра и направляются в цитоплазму к рибосомам. Сюда же с помощью транспортных РНК (т-РНК) доставляются аминокислоты. Молекула т-РНК состоит из 70–80 нуклеотидов. Общий вид молекулы напоминает лист клевера.
На «верхушке» листа расположен антикодон
(кодовый триплет нуклеотидов), который соответствует определенной аминокислоте. Следовательно, для каждой аминокислоты существует своя, конкретная т-РНК. Процесс сборки молекулы белка идет в рибосомах и называется трансляцией
. На одной молекуле и-РНК последовательно располагаются несколько рибосом. В функциональном центре каждой рибосомы способны поместиться два триплета и-РНК. Кодовый триплет нуклеотидов – молекулы т-РНК, подошедшей к месту синтеза белка, соответствует триплету нуклеотидов и-РНК, находящемуся в данный момент в функциональном центре рибосомы. Тогда рибосома по цепочке и-РНК делает шаг, равный трем нуклеотидам. Аминокислота отделяется от т-РНК и становится в цепочку мономеров белка.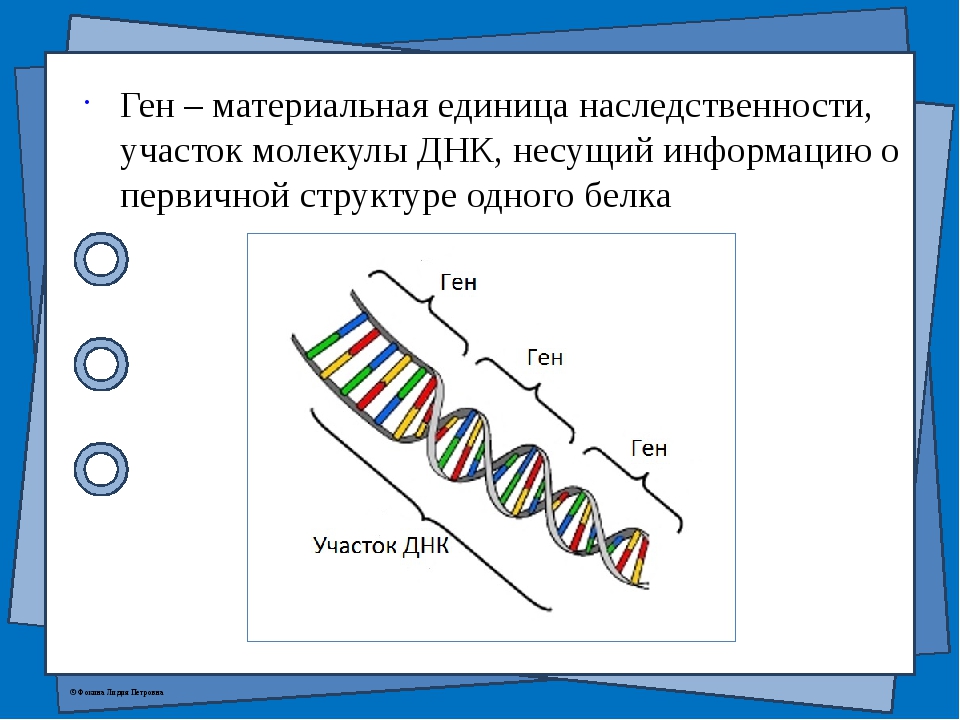 Освободившаяся т-РНК уходит в сторону и через некоторое время может снова соединиться с определенной кислотой, которую будет транспортировать к месту синтеза белка
. Таким образом, последовательность нуклеотидов в триплете ДНК соответствует последовательности нуклеотидов в триплете и-РНК.
Освободившаяся т-РНК уходит в сторону и через некоторое время может снова соединиться с определенной кислотой, которую будет транспортировать к месту синтеза белка
. Таким образом, последовательность нуклеотидов в триплете ДНК соответствует последовательности нуклеотидов в триплете и-РНК.
В сложнейшем процессе биосинтеза белка реализуются функции многих веществ и органоидов клетки.
Таким образом, в процессе биосинтеза белка образуются новые молекулы белка в соответствии с точной информацией, заложенной в ДНК. Этот процесс обеспечивает обновление белков, процессы обмена веществ, рост и развитие клеток, то есть все процессы жизнедеятельности клетки.
Ответы | § 23. Генетический код и его свойства — Биология, 11 класс
1. Что такое ген? Что представляет собой генетический код?
Ген — участок молекулы ДНК, содержащий информацию о первичной структуре определенного белка, рРНК или тРНК.
Генетический код — это система записи информации о первичной структуре белков в виде последовательности нуклеотидов ДНК (мРНК).
2. Охарактеризуйте свойства генетического кода.
Триплетность. Каждая аминокислота кодируется триплетом (кодоном) – сочетанием из трёх последовательно расположенных нуклеотидов.
Неперекрываемость. Один и тот же нуклеотид не может входить одновременно в состав двух соседних триплетов.
Однозначность. Каждый триплет кодирует только одну аминокислоту.
Избыточность (вырожденность). Одна и та же аминокислота может кодироваться несколькими разными триплетами (от 2 до 6). Исключение составляют метионин и триптофан – каждая из этих аминокислот кодируется лишь одним триплетом.
Непрерывность. Между триплетами нет знаков препинания, то есть информация в пределах одного гена считывается непрерывно.
Универсальность. У всех живых организмов одним и тем же триплетам соответствуют одни и те же аминокислоты, что свидетельствует о единстве происхождения живых организмов.
3. Что представляют собой стоп-кодоны? Какую роль играет стартовый кодон АУГ?
Стоп-кодоны – это триплеты, которые не кодируют аминокислоты, а служат сигналами окончания синтеза белка. В иРНК терминирующими кодонами являются УАА, УАГ и УГА, в ДНК им соответствуют АТТ, АТЦ и АЦТ.
Правильное считывание генетического кода обеспечивается только в том случае, если оно начинается со строго определённого пункта. В молекуле иРНК считывание начинается с кодона АУГ, поэтому данный триплет называется стартовым (инициирующим).
4. Почему аминокислота кодируется не одним и не двумя, а тремя последовательно расположенными нуклеотидами?
В состав ДНК и РНК входит по четыре типа нуклеотидов. При этом кодировать необходимо 20 белокобразующих аминокислот. Если бы за одну аминокислоту «отвечал» один нуклеотид, то можно было бы закодировать лишь 4 аминокислоты. Нуклеотидных дуплетов (по два) хватило бы только на 42 = 16 аминокислот. Нетрудно подсчитать, что число возможных комбинаций из четырёх типов нуклеотидов по три составляет 43 = 64. Этого более чем достаточно для кодирования 20 аминокислот, входящих в состав белков.
Нетрудно подсчитать, что число возможных комбинаций из четырёх типов нуклеотидов по три составляет 43 = 64. Этого более чем достаточно для кодирования 20 аминокислот, входящих в состав белков.
5. Молекула мРНК начинается со следующей последовательности нуклеотидов: АУГГУАЦЦУУГГЦАЦ… С какой последовательности аминокислотных остатков начинается белок, закодированный этой мРНК? Для решения используйте таблицу генетического кода (см. табл. 14).
Разобьём мРНК на триплеты и с помощью таблицы генетического кода определим последовательность аминокислотных остатков закодированного белка.
мРНК: АУГ ГУА ЦЦУ УГГ ЦАЦ…
Белок: Мет–Вал–Про–Трп–Гис…
Ответ: белок начинается со следующей последовательности аминокислотных остатков: Мет–Вал–Про–Трп–Гис…
6. Как вы думаете, какое биологическое значение имеет свойство вырожденности генетического кода?
Благодаря свойству вырожденности повышается надёжность воспроизведения генетической информации, т. к. при нарушениях нуклеотидной последовательности ДНК или иРНК (а именно – при определённых заменах нуклеотидов) изменившиеся триплеты могут кодировать те же самые аминокислоты. Например, в иРНК триплет ЦУА кодирует аминокислоту лейцин (Лей), и замена третьего нуклеотида (А) на любой другой, либо замена первого нуклеотида на урацил (У) не приводят к изменению смысла триплета.
к. при нарушениях нуклеотидной последовательности ДНК или иРНК (а именно – при определённых заменах нуклеотидов) изменившиеся триплеты могут кодировать те же самые аминокислоты. Например, в иРНК триплет ЦУА кодирует аминокислоту лейцин (Лей), и замена третьего нуклеотида (А) на любой другой, либо замена первого нуклеотида на урацил (У) не приводят к изменению смысла триплета.
7. Действие некоторых факторов (рентгеновских лучей, ультрафиолетового излучения, определенных химических веществ и др.) или ошибки, иногда возникающие при репликации, могут приводить к изменению последовательности нуклеотидов ДНК. При этом может происходить вставка или выпадение нуклеотидов либо замена одних нуклеотидов на другие. Как вы считаете, какие изменения чаще приводят к нарушению нормального функционирования клеток (и даже к их гибели) — вставки и выпадения или же замены нуклеотидов ДНК? Обоснуйте ответ.
К нарушению нормального функционирования клеток чаще приводят вставки или выпадения нуклеотидов, поскольку такие изменения приводят к сдвигу рамки считывания, из-за чего меняется исходный смысл гена и синтезируется совершенно другой белок (либо внутри гена возникает стоп-кодон и процесс биосинтеза белка обрывается).
Замена одного нуклеотида на другой ведёт к изменению лишь одного кодона без сдвига рамки считывания. Поэтому в синтезируемом белке одна аминокислота может быть заменена на другую, причём не обязательно, поскольку генетический код обладает свойством вырожденности.
Суть происходящего можно объяснить учащимся, проведя аналогию со следующим примером. В предложении ЖИЛ БЫЛ КОТ ТИХ БЫЛ СЕР МИЛ МНЕ ТОТ КОТ заключён определённый смысл. Если произвести замену одной буквы на другую (наподобие замены одного нуклеотида на другой), смысл меняется незначительно, например ЖИВ БЫЛ КОТ ТИХ БЫЛ СЕР… Вставка или выпадение буквы (по аналогии – нуклеотида) приводит к потере смысла (изменению всей первичной структуры белка), например, ЖИБ ЫЛК ОТТ ИХБ ЫЛС ЕРМ…
Присоединяйтесь к Telegram-группе @superresheba_11, делитесь своими решениями и пользуйтесь материалами, которые присылают другие участники группы!Геномика. Информатика для биологов / Хабр
Автор сообщества Фанерозой, биотехнолог, Людмила Хигерович.
На дворе двадцать первый век, стремительными темпами информационные технологии захватывают все больше сфер нашей жизни, включая науку. С каждым годом они все глубже проникают в различные отрасли науки, способствуя их развитию и порождая новые, смежные дисциплины. Таковой, например, является геномика.
Геномика — один из разделов генетики, однако много общего имеет с междисциплинарной биоинформатикой, разделяя с ней предмет и методы исследования. Но прежде, чем мы подробно рассмотрим саму геномику, окунемся в историю ее происхождения.
Точной даты рождения геномика не имеет. Однако ее появление относят к 1980-м годам, незадолго после открытия структуры ДНК и начала распространения методов секвенирования. Некоторые ученые, правда, все же указывают год рождения геномики — 1977, год полной расшифровки генома бактериофага Φ-X179.
Вероятно, тут стоит притормозить и добавить парочку словарных справок под спойлер. Не все наши читатели хорошо знакомы с терминами, а некоторые уже успели позабыть.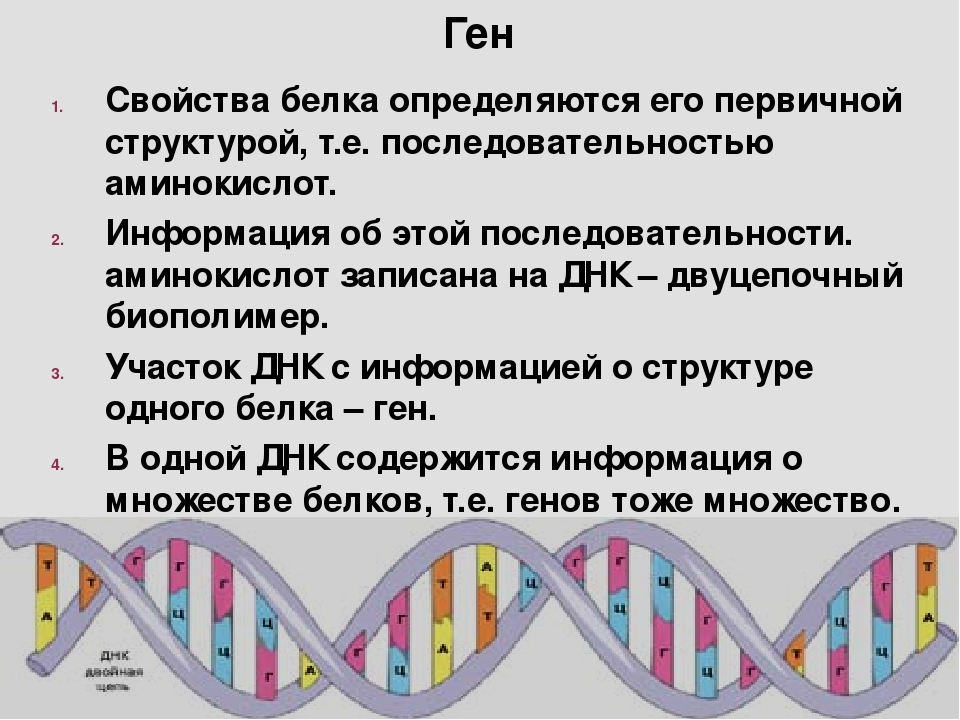
Базовая “буква” генетической информации, основа генетического кода, химически происходящая из азотистого основания. Всего существует 4 нуклеотида — аденин, гуанин, цитозин и тимин. При синтезе РНК тимин замещается на урацил.
Совокупность всего генетического материала организма, особи. В некоторых случаях говорят о геноме популяции или даже вида, имея в виду их совокупное генетическое разнообразие.
Участок ДНК (у некоторых вирусов — РНК), содержащий информацию об определенном полипептиде (аминокислотной цепочке, в перспективе превращающейся в белок), или функциональной РНК (например, транспортной РНК, доставляющей аминокислоты). В классическом понимании, ген — участок ДНК, отвечающий за определенный признак или функцию, однако с открытием полифункциональности белков этот подход устарел.
 В интронах содержатся сигналы начала и конца репликации, точки посадки ферментов и условия разблокировки синтеза определенных веществ (например, лактозный оперон у бактерий, включающийся только при условии недостатка глюкозы и избытка лактозы в среде).
В интронах содержатся сигналы начала и конца репликации, точки посадки ферментов и условия разблокировки синтеза определенных веществ (например, лактозный оперон у бактерий, включающийся только при условии недостатка глюкозы и избытка лактозы в среде).ТранскрипцияПроцесс переноса информации с ДНК на РНК по принципу комплементарности (соответствия нуклеотидов). Синтезированная РНК в дальнейшем “созревает”, превращаясь в матричную или информационную (мРНК/иРНК, становится основой синтеза белка), транспортную (тРНК, переносит аминокислоты к месту синтеза белка), служебную/ферментную (фРНК, РНК-энзимы или рибозимы, катализаторы биохимических реакций), рибосомальную (рРНК, учавствует в образовании субъединиц рибосом), транспортно-матричную (тмРНК, помогает при “застревании” элементов синтеза белка и бактерий и в пластидах), и другие редкие виды.
Трансляция
Процесс синтеза белка путем “прочтения” информации с мРНК и “перевода” ее на “язык” аминокислот.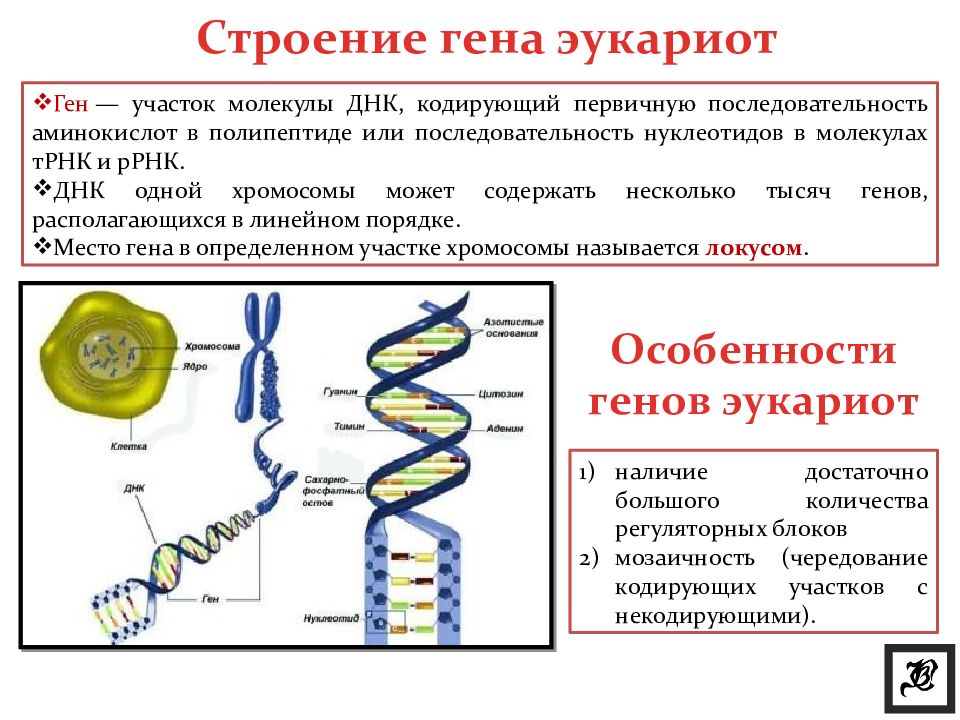 При этом учитывается правило триплетов (кодонов) — одну аминокислоту кодирует последовательность из трех нуклеотидов. Некоторые аминокислоты одновременно кодируют несколько триплетов.
При этом учитывается правило триплетов (кодонов) — одну аминокислоту кодирует последовательность из трех нуклеотидов. Некоторые аминокислоты одновременно кодируют несколько триплетов.
Цепная молекула, состоящая из последовательно соединенных аминокислотных остатков. После синтеза пептиды проходят сложные преобразования — “созревают”, превращаясь в протеины и белки (функциональные молекулы) или соединяясь с другими синтезированными веществами, образуя структурные элементы клетки (например, рибосомы, мембранные порты), а также участвуя в других процессах.
Совокупность всего транскрипционного материала (белков и РНК), формирующих организм и фенотип особи.
 Существуют разные методики и техники секвенирования, и даже способы анализа состава ДНК без разрезания или путем многократного повторения определенных кусочков (полимеразная цепная реакция, или ПЦР-амплификация).
Существуют разные методики и техники секвенирования, и даже способы анализа состава ДНК без разрезания или путем многократного повторения определенных кусочков (полимеразная цепная реакция, или ПЦР-амплификация).Повторение — мать учения. Итак, как мы говорили выше,
геномика — это междисциплинарная область биологии, в которой основное внимание уделяется
структуре, функциям, эволюции, картированию и редактированию геномов. Геном — это полный набор ДНК организма, включая все его гены, а также его иерархическую трехмерную структурную конфигурацию. В отличие от генетики, которая относится к изучению отдельных генов и их роли в наследовании, геномика направлена на коллективную характеристику и количественную оценку всех генов организма, их взаимосвязей и влияния на организм.
Почему геномика — важный раздел науки?
Гены могут управлять производством белков, с помощью ферментов и молекул-мессенджеров. В свою очередь, белки составляют структуры тела, такие как органы и ткани, а также контролируют химические реакции и передают сигналы между клетками. Геномика также включает в себя секвенирование и анализ геномов с использованием высокопроизводительного секвенирования ДНК и биоинформатики для сборки и анализа функции и структуры целых геномов. Достижения в области геномики вызвали революцию в исследованиях, основанных на открытиях, и в системной биологии, чтобы облегчить понимание даже самых сложных биологических систем, таких как мозг.
Геномика также включает в себя секвенирование и анализ геномов с использованием высокопроизводительного секвенирования ДНК и биоинформатики для сборки и анализа функции и структуры целых геномов. Достижения в области геномики вызвали революцию в исследованиях, основанных на открытиях, и в системной биологии, чтобы облегчить понимание даже самых сложных биологических систем, таких как мозг.
Эта область знаний также включает исследования внутригеномных (внутри генома) явлений, таких как эпистаз (влияние одного гена на другой), плейотропия (один ген влияет на более чем один признак), гетерозис (сила гибрида) и другие взаимодействия между локусами и аллелями внутри генома.
Чем больше люди изучали генетический аппарат живых организмов, тем становилось яснее, что усилий одного только человеческого мозга недостаточно для полноценного анализа и расшифровки. Так что как только появилась возможность машинного анализа, биологи с радостью поручили часть своей работы компьютерам. Так зародилась другая междисциплинарная область знаний — биоинформатика.
Так зародилась другая междисциплинарная область знаний — биоинформатика.
Биоинформатика — часть науки, объединяющая в себе генетику, биохимию и молекулярную биологию, математическую статистику и отчасти задевающую краем эволюционную и популяционную биологии, медицину и математическую статистику. Биоинформатики является междисциплинарным полем, которое разрабатывает методы и программные средства для понимания биологических данных, в частности, когда наборы данных являются большими и сложными. Как междисциплинарная область науки, биоинформатика сочетает в себе биологию, информатику, информационную инженерию, математику и статистику для анализа и интерпретации биологических данных. Биоинформатика использовалась для анализа in silico (на компьютере) биологических запросов с использованием математических и статистических методов.
Некоторые соотносят биоинформатику с геномикой, однако они не перекрывают друг друга полностью — скорее, геномика пользуется достижениями биоинформатики, и в то же время сама является инструментом ее пополнения и расширения.
Разделы геномики
За почти пятьдесят лет своего существования геномика значительно расширилась и приобрела внутреннюю структуру — разделилась на несколько направлений, тем не менее, все еще зависящих друг от друга. Деление это весьма условно, многие отделы не просто пересекаются, а значительно перекрывают друг друга.
Геномику подразделяют на следующие направления:
- Структурная геномика
- Функциональная геномика
- Сравнительная геномика
- Музеогеномика
- Когнитивная геномика
- Вычислительная геномика
Структурная геномика
— самый крупный и самый “развитый” раздел. Ее задача — выяснение конечной структуры белка, закодированного в исследуемой последовательности. Это важно при расшифровке генетической информации: мало выяснить, какие основания и как расположены в участке ДНК, гораздо более интересно, во что она транскрибируется.
И этот интерес отнюдь не праздный — состав и структура белка могут многое сказать о его функции и месте в метаболизме.
После синтеза аминокислотная цепочка (первичная структура) “плавает” в цитоплазме, и сворачивается в петли. Когда подходящие участки белка сближаются, в дело вступают молекулярные химические силы — некоторые места “слипаются” под действием сил водородных связей, ионных связей, а также сил Ван-дер-Ваальса, образуя вторичную объемную структуру — альфа-спираль и бета-лист. На этом их преобразование не останавливается — в конечном итоге белок приобретает форму глобулы — плотно свернутого клубка. В таком виде он обычно и существует, выполняя свои функции.
Знание третичной структуры позволяет сделать предположение о функциях белка — это не просто комок аминокислот, глобула устроена так, что у нее есть домены — участки с разным предназначением. Условно их делят на основную часть и функциональную — например, ферментирующая ямка (энзимы и пищеварительные ферменты), “хвост” для закрепления на мембране (кинезины, мембранные белки), участки, “примагничивающиеся” к другим белкам (актино-миозиновый комплекс в мышцах) и т. д.
д.
Этому даже посвящен значительный раздел биоинформатики — он так и называется, предсказание структуры белка (protein structure prediction). Это преимущественно математическое моделирование с опорой на молекулярную биологию и химию. Помимо расшифровки первичной структуры, необходимо учитывать две важные вещи — количество свободной энергии и нахождение глобального минимума энергии. Это звучит, как магическая формула, однако на практике это то, от чего зависит, как и насколько преобразуется и свернется белок. Кроме того, требуются огромные вычислительные мощности для расчета всех возможных вариантов пространственной структурой белка — а это миллионы вариантов для белка длиной в сотню аминокислотных остатков. Круг поиска несколько сужают методы предсказания укладки (альфа-спираль или бета-лист, и участки с повышенной вероятностью “слипания”) и гомологическое (сравнительное) моделирование, основанное на знании о структуре хорошо изученных белков. В то же время его осложняют возможные посттранскрипционные преобразования — белок не просто меняет свою пространственную структуру, но также может распадаться, разрезаться ферментами, сшиваться и приобретать конечные свойства только в четвертичной структуре — в комплексе с другим белком.
Помимо этого, структурная геномика в комплексе с функциональной может предсказывать болезни, возникающие при генетических аномалиях. Так, было выяснено, что мутация в одном из белков мембраны клеток может вызывать иммунитет организма к ВИЧ СПИДу, но при этом ослабляет его перед ОРВИ и лихорадкой западного Нила. Этот же белок отчасти ответственен за тип вашего темперамента — гипертимный ли, флегматичный и т. д. Эта часть соотносится с функциональной геномикой.
Функциональная геномика своей основной задачей ставит прослеживание полного пути реализации генома. Она показывает, как определенный ген превращается в белок, и какой конечный признак в организме от него зависит, чем приближается к протеомике — междисциплинарной отрасли науки, изучающей структуру и функции протеинов и белков в частности. Это весьма сложно в рамках многоклеточного организма, так как один и тот же белок выполняет множество функций. Кроме того, разные белки могут одновременно влиять на один и тот же признак.
Так, например, цвет глаз человека кодируют как минимум 6-8 генов на 2-3 хромосомах. За светлые глаза в основном отвечает мутация гена OCA2. За синий или зелёный цвет отвечает ген EYCL1 хромосомы 19; за коричневый — EYCL2; за коричневый или синий — EYCL3 хромосомы 15. Кроме того, с цветом глаз связаны гены OCA2, SLC24A4, TYR, влияющие на оттенки и переходные цвета. Все эти гены, вернее, их белки, действуют одновременно, благодаря чему найти два одинаковых рисунка радужки почти невозможно. Кроме того, в зависимости от перенесенных заболеваний, питания и выцветания на солнце цвет глаз меняется в течении всей жизни, что еще больше осложняет работу по составлению статистических исследований.
Сравнительная геномика близка к эволюционной биологии и популяционной генетике. Она сравнивает организацию и функционирование генома у разных систематических групп организмов, изучает их принципиальные сходства и различия, и ищет аналогию между ними. Значительную часть составляет поиск гомологий и аналогий у разных организмов с геномом человека — вопрос больше практический, чем праздный.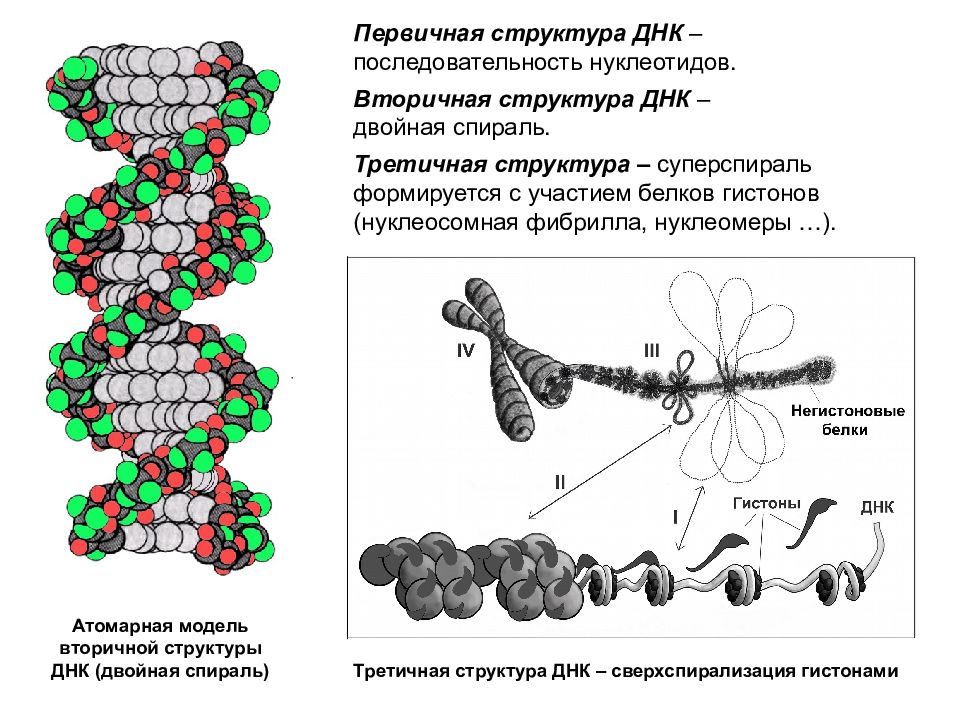 От этого зависит выбор организма для производства лекарственных средств или даже выращивания органов и тканей для трансплантации. Так, многие фармацевтические препараты, а также витамины производят с помощью бактерий, так как их генетический аппарат почти не преобразует конечный продукт, и при этом обладает достаточным функционалом для синтеза. Ну и, конечно, их относительно легко модифицировать и культивировать.
От этого зависит выбор организма для производства лекарственных средств или даже выращивания органов и тканей для трансплантации. Так, многие фармацевтические препараты, а также витамины производят с помощью бактерий, так как их генетический аппарат почти не преобразует конечный продукт, и при этом обладает достаточным функционалом для синтеза. Ну и, конечно, их относительно легко модифицировать и культивировать.
Музеогеномика — во многом схожа со сравнительной. Только специализируется на исследовании генома музейных экспонатов — палеонтологических, зоологических, ботанических и других. Она позволяет установить степень родства вымерших таксономических групп, проследить эволюцию признака у ископаемых растений и даже предположить, какие животные были предыдущими носителями вирусов и прочих паразитов. Кроме того, музеогеномика позволяет проследить токсигенное влияние человека, сравнивая образцы столетней давности с сегодняшними обитателями Земли.
Когнитивная геномика.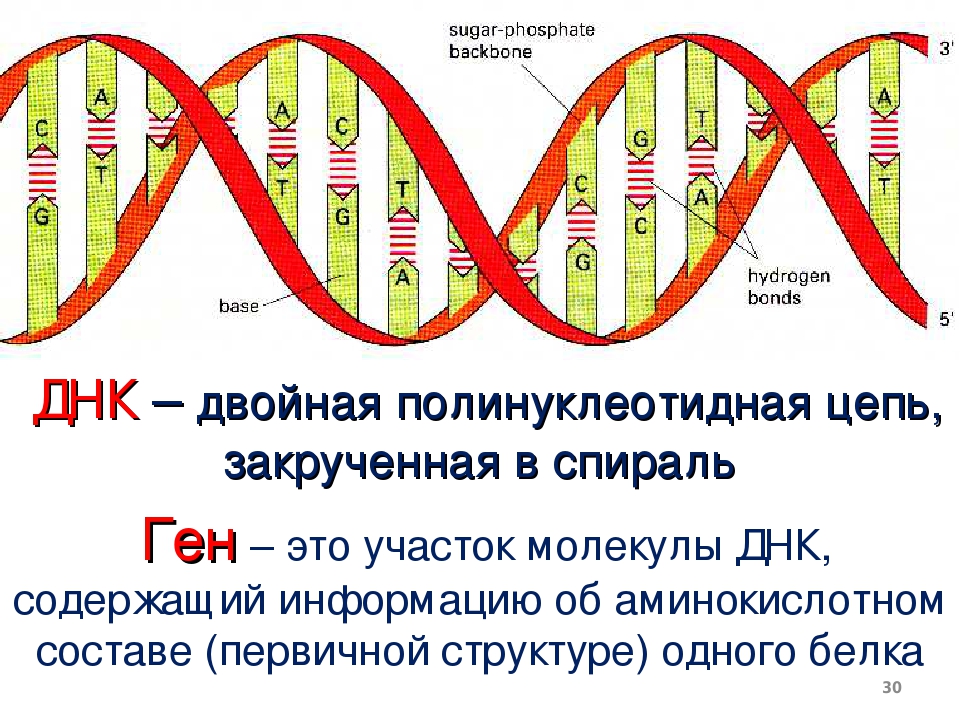 Несколько странное направление в контексте современных исследований. Казалось бы, человечество еще в прошлом веке пережило предрассудки о наследовании характера и умственных способностей и связи этого с внешностью. Однако полностью отрицать влияние генетики на мозговую активность — тоже неправильно. Белковый состав мембран нервных клеток, а также степень и качество миелинизации (образования изолирующих оболочек) оказывает сильное влияние на тип нервной системы и темперамент.
Несколько странное направление в контексте современных исследований. Казалось бы, человечество еще в прошлом веке пережило предрассудки о наследовании характера и умственных способностей и связи этого с внешностью. Однако полностью отрицать влияние генетики на мозговую активность — тоже неправильно. Белковый состав мембран нервных клеток, а также степень и качество миелинизации (образования изолирующих оболочек) оказывает сильное влияние на тип нервной системы и темперамент.
Гиперактивность и повышенная эмоциональность раздражимость детей связана, в том числе с образованием миелиновых оболочек — у детей практически нет изоляции между отдельными нервными клетками, из-за чего возбуждение в одной моментально передается в соседний, и далее по цепочке. Это явление называется иррадиация. Разумеется, она сохраняется и у взрослых, однако значительная ее часть “гасится” изолирующими прослойками.
Темперамент человека зависит от типа нервной системы, что в свою очередь зависит от состава и количества мембранных белков, структура которых закодирована в ДНК — по оценке Вайнбергера, примерно 70% всех генов организма оказывает влияние на нервную систему, в частности на головной мозг. С возрастом, разумеется, на темперамент оказывает влияние опыт, физиологические преобразования и воспитание, что формирует вторичные структуры — характер и личность. Однако базовые параметры так или иначе заложены генетически.
С возрастом, разумеется, на темперамент оказывает влияние опыт, физиологические преобразования и воспитание, что формирует вторичные структуры — характер и личность. Однако базовые параметры так или иначе заложены генетически.
В рамках когнитивной отлично уживаются элементы сравнительной геномики. Ученые сравнивают геномы нескольких видов, чтобы выявить генетические и фенотипические различия между ними. Наблюдаемые фенотипические характеристики, связанные с высшей нервной деятельностью, включают поведение, личность, нейроанатомию и невропатологию. Теория когнитивной геномики основана на элементах генетики, эволюционной биологии, молекулярной биологии, когнитивной психологии, поведенческой психологии и нейрофизиологии.
Но когнитивная геномика не ставит своей задачей узнать, кто родился с большим шансом стать гением, а кто с меньшим. В первую очередь когнитивная геномика работает с выявлением причин патологий высшей нервной деятельности и аномалий мозга, а также исследует возможные способы их лечения или уменьшения. Большинство поведенческих или патологических фенотипов происходят не из-за мутации только одного гена, а из-за сложной генетической основы. Однако есть некоторые исключения из этого правила, такие как болезнь Гентингтона, которая вызвана одним конкретным генетическим заболеванием. На возникновение нейроповеденческих расстройств влияет целый ряд факторов, генетических и негенетических. Методы когнитивной геномики были использованы для изучения генетических причин многих психических и нейродегенеративных расстройств, включая синдром Дауна, большое депрессивное расстройство, аутизм и болезнь Альцгеймера.
Большинство поведенческих или патологических фенотипов происходят не из-за мутации только одного гена, а из-за сложной генетической основы. Однако есть некоторые исключения из этого правила, такие как болезнь Гентингтона, которая вызвана одним конкретным генетическим заболеванием. На возникновение нейроповеденческих расстройств влияет целый ряд факторов, генетических и негенетических. Методы когнитивной геномики были использованы для изучения генетических причин многих психических и нейродегенеративных расстройств, включая синдром Дауна, большое депрессивное расстройство, аутизм и болезнь Альцгеймера.
Вычислительная геномика — самая близкая к биоинформатике часть, родившаяся и развивающаяся одновременно с ней. Так или иначе, ее элементы используют все остальные разделы геномики. Ее основа — вычислительный анализ, позволяющий расшифровать не только отдельные участки или гены, но охватить геном целиком, включая не только последовательность нуклеотидов в ДНК, но и синтезированную на ее основе РНК.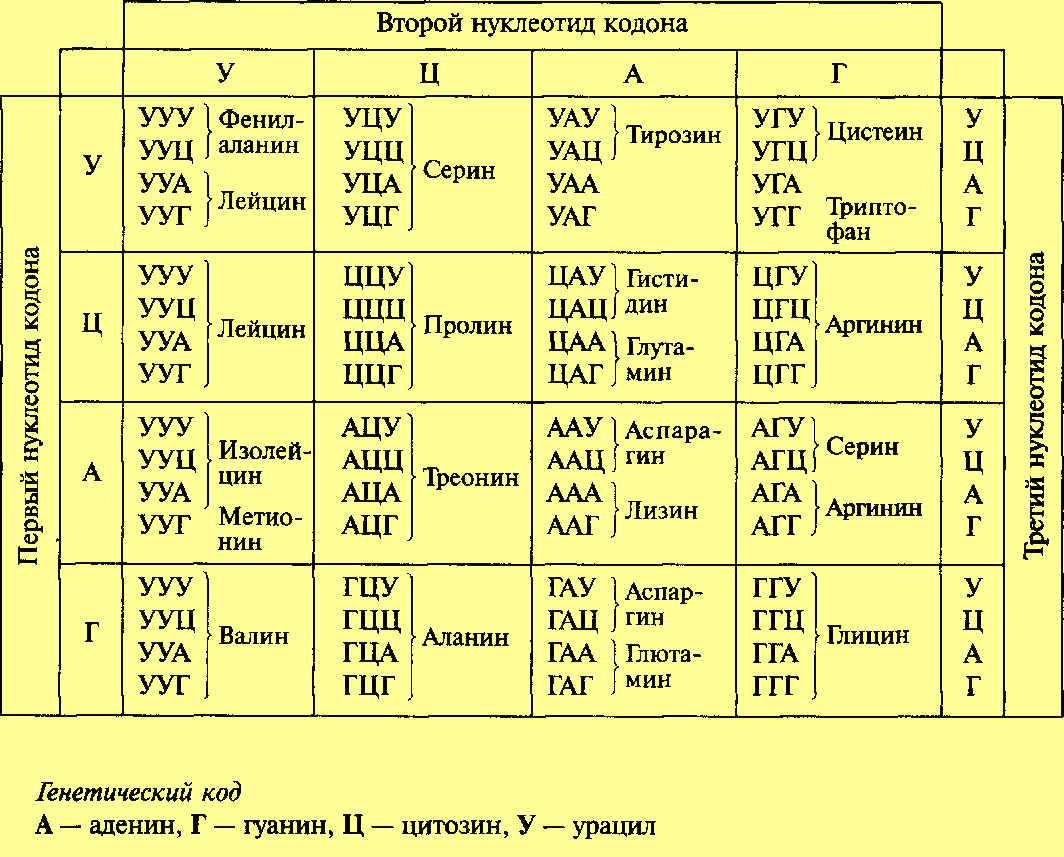
Геномика и Big Data
Геном даже одного простейшего организма состоит из тысяч или даже десятков тысяч пар оснований. Анализ одной только цепочки ДНК из одной хромосомы “вручную” занимает годы, если не десятилетия. Прибавим к этому то, что секвенирование зачастую предполагает разрезание ДНК на маленькие кусочки, и получим еще одну задачку — собрать расшифрованные кусочки в нужном порядке. Эта задача, называемая
генетическим картированием, поистине титаническая. И хоть без человеческого умственного труда все равно не обойтись при финальном сведении данных и написании вывода, то значительную часть аналитического труда выполняет компьютер.
Специально для целей геномики даже были разработаны особые программные и иерархические средства анализа. Так, например, были разработаны специфические «конвейеры» анализа, неоднократно “прогоняющие” одну и ту же последовательность, а затем повторяющие эти же процедуры с другой, в конечном итоге сравнивая полученные результаты и фиксируя сходства и различия. Обычно это используется для идентификации генов-кандидатов (изменения в них могут вызвать онкологию) и однонуклеотидных полиморфизмов (точечных мутаций, характеризующихся многократным, идущим подряд повторением основания на одной из цепей, что вызывает разрыв между цепями).
Обычно это используется для идентификации генов-кандидатов (изменения в них могут вызвать онкологию) и однонуклеотидных полиморфизмов (точечных мутаций, характеризующихся многократным, идущим подряд повторением основания на одной из цепей, что вызывает разрыв между цепями).
Компьютерный анализ также помогает при аннотировании — маркировании генов. Этот процесс необходимо автоматизировать, потому что большинство геномов слишком велики для аннотирования вручную, не говоря уже о необходимости аннотировать как можно больше геномов, поскольку скорость секвенирования перестала быть проблемой. Аннотации стали возможными благодаря тому факту, что гены имеют узнаваемые начальные и конечные области (промоторы и терминаторы, имеющие зачастую схожий или одинаковый состав у разных групп организмов), хотя точная последовательность, обнаруженная в этих областях, может варьироваться между генами.
Для справки!Первое описание комплексной системы аннотации генома было опубликовано в 1995 году командой Института геномных исследований, которая выполнила первое полное секвенирование и анализ генома свободноживущего организма, бактерии Haemophilus influenzae. Оуэн Уайт разработал и построил систему программного обеспечения для идентификации генов, кодирующих все белки, РНК переноса, рибосомных РНК (и других сайтов — функциональных частей), а также для выполнения начальных функциональных назначений. Большинство современных систем аннотации генома работают аналогичным образом, но программы, доступные для анализа геномной ДНК, такие, как программа GeneMark, обучены и используются для поиска генов, кодирующих белок, у Haemophilus influenzae, постоянно меняются и улучшаются.
Оуэн Уайт разработал и построил систему программного обеспечения для идентификации генов, кодирующих все белки, РНК переноса, рибосомных РНК (и других сайтов — функциональных частей), а также для выполнения начальных функциональных назначений. Большинство современных систем аннотации генома работают аналогичным образом, но программы, доступные для анализа геномной ДНК, такие, как программа GeneMark, обучены и используются для поиска генов, кодирующих белок, у Haemophilus influenzae, постоянно меняются и улучшаются.
Кроме аннотирования и анализа отдельного генома, технологии Big data позволяют массово сравнивать геномы особей в популяциях и даже видов. Так появилась, например, вычислительная эволюционная биология. Эволюционная биология — это изучение наследственности, изменчивости и происхождения видов, а также их изменения с течением времени. Информатика помогла эволюционным биологам, позволив исследователям:
- Отслеживать эволюцию большого числа организмов, измеряя изменения в их ДНК, а не только с помощью физической систематики или физиологических наблюдений
- Сравнивать целые геномы, что позволяет изучать более сложные эволюционные события, такие как дупликация генов, горизонтальный перенос генов, а также предсказывать факторы, важные для видообразования бактерий
- Построение сложных вычислительных моделей популяционной генетики для прогнозирования результатов работы системы с течением времени
- Отслеживать и обмениваться информацией о все большем количестве видов и организмов.
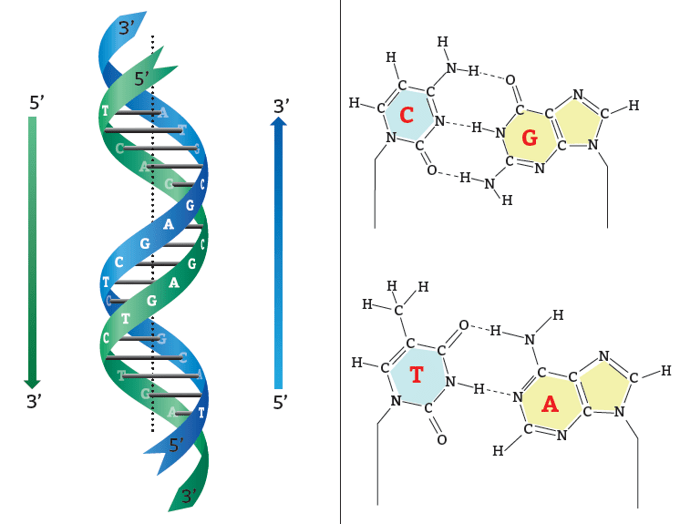
В перспективе это поможет составить более подробное и правдоподобное филогенетическое дерево — т. н. древо жизни, отражающее примерную эволюцию живого.
Для справки!Сейчас существует несколько вариантов филогенетического древа. Хотя древом его назвать теперь сложно — скорее, это куст, причем далеко не всегда имеющий общий корень. Кроме того, эти схемы разнятся в зависимости от того, какой признак мы ставим во главу угла.
Такие сложности возникают потому, что в процессе эволюции ДНК не только усложняется, но и упрощается, теряя “ненужные” участки в ходе делеций или отбора. Кроме того, существует такое явление, как горизонтальный перенос генов — обмен участками генома между генетически неродственными группами. Так, например, значительная часть интронов у бактерий, растений и животных, включая человека, — это следы заражения вирусами, которые потеряли часть своего генома, ответственную за синтез оболочки вируса и репликацию.
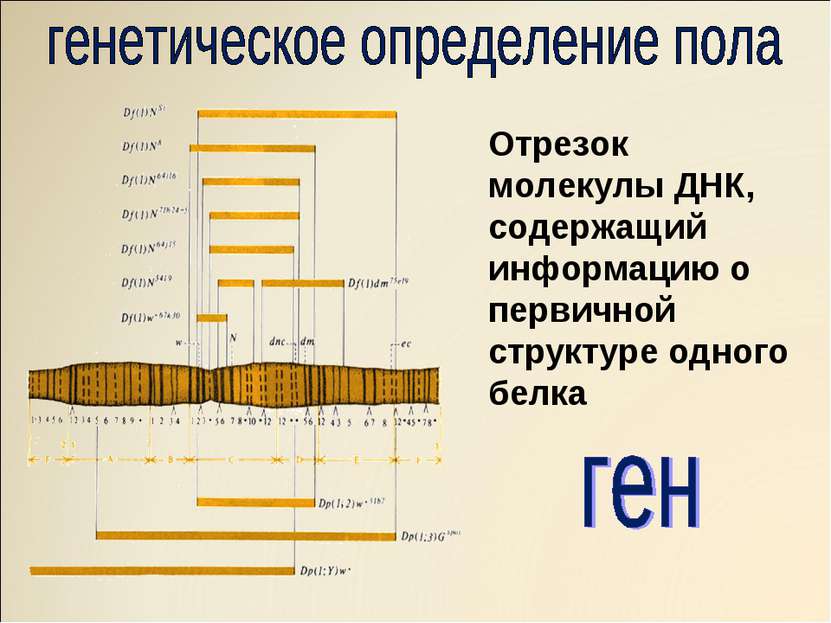
В рамках вычислительной геномики существует также такое понятие, как
Интерактом (Interactome)или сети молекулярного взаимодействия. В двух словах, это совокупность локализаций и взаимодействий конкретной молекулы в рамках одной конкретной клетки. Такая модель также может описывать наборы непрямых взаимодействий между генами. Молекулярные взаимодействия могут происходить между молекулами, принадлежащими к разным биохимическим семействам (белки, нуклеиновые кислоты, липиды, углеводы и т. д.), а также внутри каждого семейства. Когда такие молекулы связаны физическими взаимодействиями, они образуют сети молекулярных взаимодействий, которые обычно классифицируются по природе задействованных соединений. Чаще всего, интерактом относится к сети межбелкового взаимодействия (PPI) (PIN) или ее разновидностям.
Это чрезвычайно сложная схема, реализация которой была бы невозможна без компьютерного моделирования. Она настолько сложна технически и важна практически, что в последнее время выделяется в самостоятельную область биоинформатики.
Биоинформатика для всех
Помимо решения сложных узкопрофильных задач, для которых обычно создаются специальные программные методы, существуют и более широкого спектра сервисы.
Так, есть ряд проектов, призванных помочь любому желающему провести быстрый анализ полученного сиквенса или белка — рано или поздно с такой проблемой сталкивается любой биолог-исследователь.
Первым подобным проектом стал алгоритм Нидлмана — Вунша на основе динамического программирования. Он был создан для того, чтобы сравнить наборы последовательностей аминокислот друг с другом при использовании матриц замен, полученных в более раннем исследовании М. Дейхофф.
Позже появился алгоритм BLAST, который позволяет осуществлять быстрый и оптимизированный поиск в базах данных последовательностей генов. BLAST и его модификации — одни из наиболее широко используемых алгоритмов для этой цели.
Примерно теми же функциями обладают и системы UGENE и DNAStar, однако пользование ими для обычного человека затруднено, к тому же есть платные пакеты с расширенным функционалом. Кроме того, существуют различные сервисы по моделированию возможной структуры белков. Таковым является, например, Google DeepMind.
Кроме того, существуют различные сервисы по моделированию возможной структуры белков. Таковым является, например, Google DeepMind.
На этом мы завершим очередную мини-экскурсию в мир биологической информатики или информативной биологии. Надеемся, что вы сегодня узнали что-то новое и интересное.
Всего хорошего и не болейте!
Список литературы
Solnik, Ray. «The Time Has Come: Analytics Delivers for IT Operations». Data Center Journal. Retrieved 21 June 2016.
Lesk AM (2017). Introduction to Genomics (3rd ed.). New York: Oxford University Press. p. 544.
Dong Xu, Lukasz Jaroszewski, Zhanwen Li, Adam Godzik. AIDA: ab initio domain assembly for automated multi-domain protein structure prediction and domain–domain interaction prediction (англ.) // Bioinformatics. — 2015-07-01. — Vol. 31, iss. 13. — P. 2098—2105.
Plomin, R. & Spinath, F.M. (2004). «Intelligence: Genetics, Genes, and Genomics.» Journal of Personality and Social Psychology, 86(1): 112—129
.
Sulem P., Gudbjartsson D. F., Stacey S. N., et al. Genetic determinants of hair, eye and skin pigmentation in Europeans (англ.) // Nat. Genet.: journal. — 2007. — December (vol. 39, no. 12). — P. 1443—1452.
Blue Eyes Versus Brown Eyes: A Primer on Eye Color Архивировано 8 декабря 2012 года… Eyedoctorguide.com. Retrieved on 2011-12-23.
Gonnet G. H. 2012. Surprising results on phylogenetic tree building methods based on molecular sequences. BMC Bioinformatics, 13:148
Google’s DeepMind predicts 3D shapes of proteins, The Guardian. 2018
Hug, L., Baker, B., Anantharaman, K. et al. A new view of the tree of life. Nat Microbiol 1, 16048 (2016).
Julian Vosseberg, Jolien J. E. van Hooff, Marina Marcet-Houben, Anne van Vlimmeren, Leny M. van Wijk, Toni Gabaldón & Berend Snel. Timing the origin of eukaryotic cellular complexity with ancient duplications // Nature Ecology and Evolution. 2020. DOI: 10.1038/s41559-020-01320-z.
Papanikolaou, N.; Pavlopoulos, G.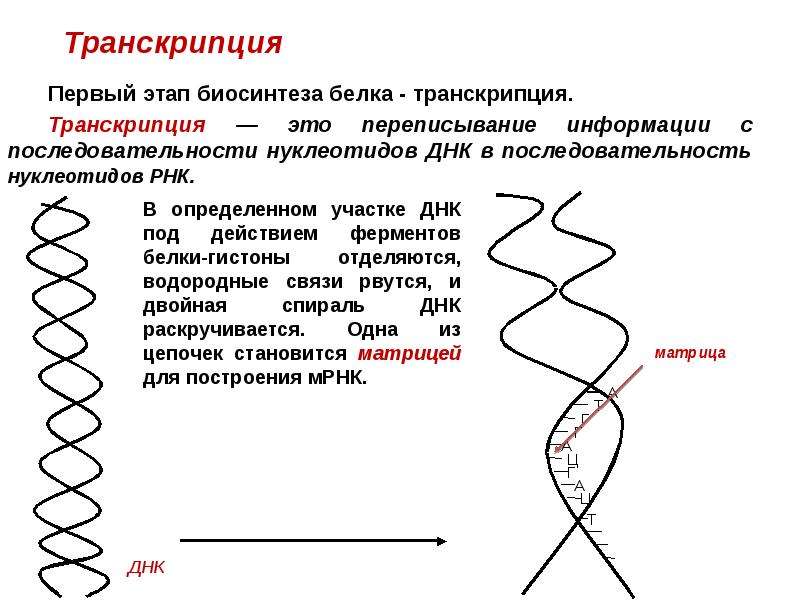 A.; Theodosiou, T.; Iliopoulos, I. Protein-protein interaction predictions using text mining methods (англ.) // Methods: journal. — 2015. — Vol. 74. — P. 47—53.
A.; Theodosiou, T.; Iliopoulos, I. Protein-protein interaction predictions using text mining methods (англ.) // Methods: journal. — 2015. — Vol. 74. — P. 47—53.
Mikhail Fursov, Olga Golosova, Konstantin Okonechnikov. Unipro UGENE: a unified bioinformatics toolkit (англ.) // Bioinformatics. — 2012-04-15. — Vol. 28, iss. 8. — P. 1166—1167.
Wang L, Eftekhari P, Schachner D, Ignatova ID, Palme V, Schilcher N, Ladurner A, Heiss EH, Stangl H, Dirsch VM, Atanasov AG. Novel interactomics approach identifies ABCA1 as direct target of evodiamine, which increases macrophage cholesterol efflux. Sci Rep. 2018 Jul 23;8(1):11061.
Kotlyar M, Pastrello C, Pivetta F, Lo Sardo A, Cumbaa C, Li H, Naranian T, Niu Y, Ding Z, Vafaee F, Broackes-Carter F, Petschnigg J, Mills GB, Jurisicova A, Stagljar I, Maestro R, Jurisica I (2015). «In silico prediction of physical protein interactions and characterization of interactome orphans». Nature Methods. 12 (1): 79–84.
Robson JF, Barker D (October 2015). «Comparison of the protein-coding gene content of Chlamydia trachomatis and Protochlamydia amoebophila using a Raspberry Pi computer». BMC Research Notes. 8 (561): 561.
«Comparison of the protein-coding gene content of Chlamydia trachomatis and Protochlamydia amoebophila using a Raspberry Pi computer». BMC Research Notes. 8 (561): 561.
Dawson WK, Maciejczyk M, Jankowska EJ, Bujnicki JM (July 2016). «Coarse-grained modeling of RNA 3D structure». Methods. 103: 138–56.
13. Наследственная информация и генетический код
13
НАСЛЕДСТВЕННАЯ ИНФОРМАЦИЯ И ГЕНЕТИЧЕСКИЙ КОД
– Каково строение белков?– Почему белки каждого организма отличаются друг от друга?
Такие свойства живых организмов, как самовоспроизведение, наследственность и изменчивость, проявляются, начиная с молекулярного уровня. По этой причине установление принципа передачи наследственной информации потомству стало возможным только после изучения молекулы ДНК.
Для обсуждения
| – | Почему изменение, произошедшее в одном гене клетки, может повториться в генах потомства? |
ДНК и ген. Носителем наследственной информации является молекула ДНК. Информация о первичной структуре белка хранится на соответствующих участках молекулы ДНК, называемых генами. Таким образом, ген (от греч. “genos” — происхождение, род) — это участок ДНК, содержащий информацию о первичной структуре одной молекулы белка.
Носителем наследственной информации является молекула ДНК. Информация о первичной структуре белка хранится на соответствующих участках молекулы ДНК, называемых генами. Таким образом, ген (от греч. “genos” — происхождение, род) — это участок ДНК, содержащий информацию о первичной структуре одной молекулы белка.
Ключевые слова
• триплет• генетический код
Генетический код. В генах хранится информация об очередности аминокислот того или иного синтезируемого белка. Впоследствии эта информация по принципу комплементарности переписывается на и-РНК и передается потомству.
Общая схема кодирования аминокислот на ДНК
Информация о каждой аминокислоте, входящей в состав первичной структуры белка, “записана” на ДНК и РНК в виде комбинации из трех нуклеотидов, называемой триплетом. Способ записи информации о первичной структуре белка в виде определенной последовательности нуклеотидов в молекулах ДНК и и-РНК, называется генетическим кодом.
Деятельность
Рассмотрите таблицу и на основе принципа комплементарности определите триплеты, которые должны быть вместо знаков “?”. Какими триплетами кодируются на и- РНК аминокислоты валин и глутамин?| ДНК | I цепь | TTT | ГТТ | ? | ? | ЦАЦ | ? |
| II цепь | ? | ? | TTA | ЦTT | ? | AAT | |
| и-РНК | УУУ | ? | ААУ | ? | ЦАЦ | УУА | |
| Аминокислоты* | Фен | Вал | Асп | Глу | Цис | Лей | |
* Фен – фенилаланин, Вал – валин, Асп – аспарагин, Глу – глутамин, Цис – цистеин, Лей – лейцин.
– Из скольких триплетов состоит каждый код и скольким аминокислотам он соответствует?
Свойства генетического кода.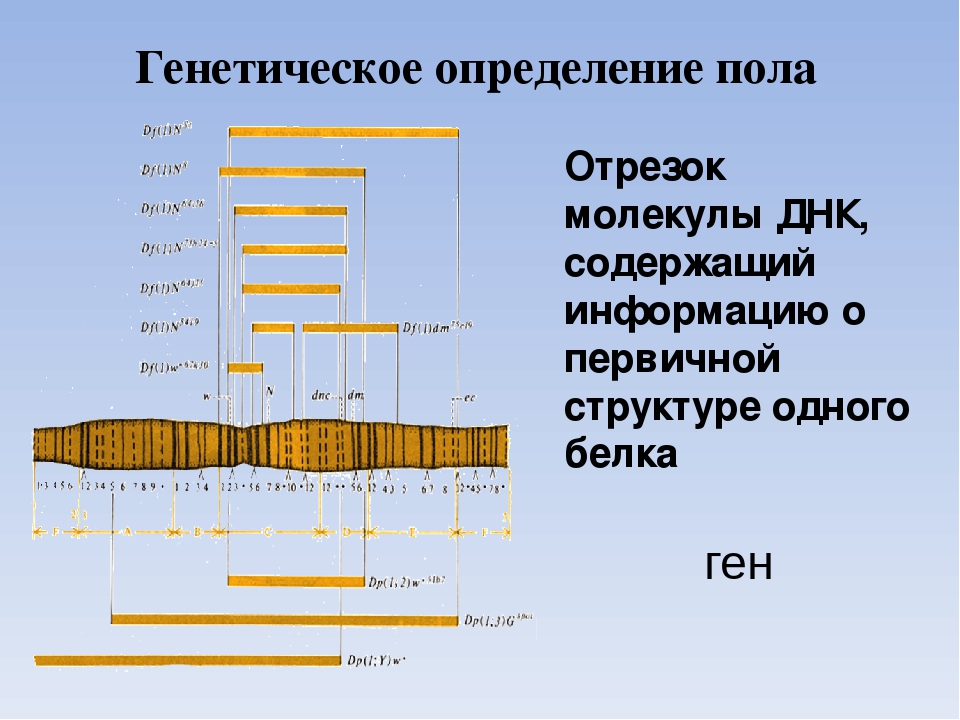 Генетический код обладает рядом особенностей. Так, код триплетен, то есть в кодировании каждой аминокислоты участвуют три нуклеотида.
Генетический код обладает рядом особенностей. Так, код триплетен, то есть в кодировании каждой аминокислоты участвуют три нуклеотида.
В генетическом коде каждой аминокислоте соответствует один триплет, но некоторые аминокислоты могут кодироваться одним или несколькими кодами. В генетическом коде между генами существуют триплеты, разделяющие их и ничего не кодирующие. Во всех живых организмах одинаковым аминокислотам соответствуют одинаковые триплеты.
Запомните
- Длина одного нуклеотида = 3,4 нм
- Размер одного гена = длина одного нуклеотида × n (кол-во нуклеотидов)
- Кол-во аминокислот = кол-во нуклеотидов: 3
- Масса одного гена = кол-во нуклеотидов × массу одного нуклеотида
- Молекулярная масса одного нуклеотида ≈ 300 а.е.м.
- Молекулярная масса одной аминокислоты ≈ 110 а.е.м.
- Соотношение нуклеотидов в молекуле ДНК — А + Г/Т + Ц=1 ПРИМЕНЕНИЕ И ПРОВЕРКА ПОЛУЧЕННЫХ ЗНАНИЙ
- На основании последовательности нуклеотидов в одной цепочке ДНК постройте противоположную цепочку:
1- я цепочка ДНК . ..
..
2- я цепочка ДНК ААА — АЦЦ — АГЦ — АТТ — АТГ — ААГ
Постройте цепь и-РНК соответствующую первой цепочке ДНК. - Мономером ДНК и РНК является:
a) азотистое основание
b) дезоксирибоза или рибоза
c) азотистое основание и остаток ортофосфорной кислоты
е) нуклеотиды - В каком ответе правильно указаны свойства, отличающие молекулу ДНК от молекула РНК?
а) одноцепочечная, в составе имеется дезоксирибоза, является носителем наследственной информации.
в) двуцепочечная, в составе имеется рибоза, переносит наследственную информацию.
c) одноцепочечная, в составе имеется рибоза, переносит наследственную информацию.
d) двуцепочечная, в составе имеется дезоксирибоза, является носителем наследственной информации. - Решите задачи:
- Учитывая, что в состав белка инсулина входит 51 аминокислота, рассчитайте количество нуклеотидов гена, кодирующих этот белок.
- Молекула ДНК содержит 80 000 остатков А, что составляет 16% от общего числа нуклеотидов в молекуле.
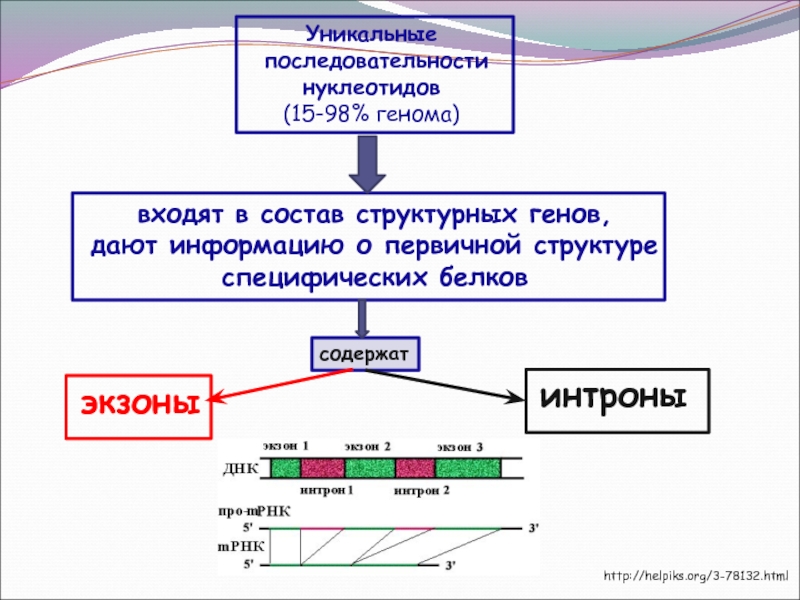 Определите количество остальных нуклеотидов и длину данной молекулы ДНК.
Определите количество остальных нуклеотидов и длину данной молекулы ДНК.
- На основании последовательности нуклеотидов в одной цепочке ДНК постройте противоположную цепочку:
Где синтез белка в клетке. Сущность процесса биосинтеза белка
Совокупность реакций биологического синтеза называется пластическим обменом, или ассимиляцией. Название этого вида обмена отражает его сущность: из простых веществ, поступающих в клетку извне, образуются вещества, подобные веществам клетки.
Рассмотрим одну из важнейших форм пластического обмена – биосинтез белков. Все многообразие свойств белков в конечном счете определяется первичной структурой, т. е. последовательностью аминокислот. Огромное количество отобранных эволюцией уникальных сочетаний аминокислот воспроизводится путем синтеза нуклеиновых кислот с такой последовательностью азотистых оснований, которая соответствует последовательности аминокислот в белках. Каждой аминокислоте в полипептидной цепочке соответствует комбинация из трех нуклеотидов – триплет.
Процесс реализации наследственной информации в биосинтезе осуществляется при участии трех видов рибонуклеиновых кислот: информационной (матричной) – иРНК (мРНК), рибосомальной – рРНК и транспортной – тРНК.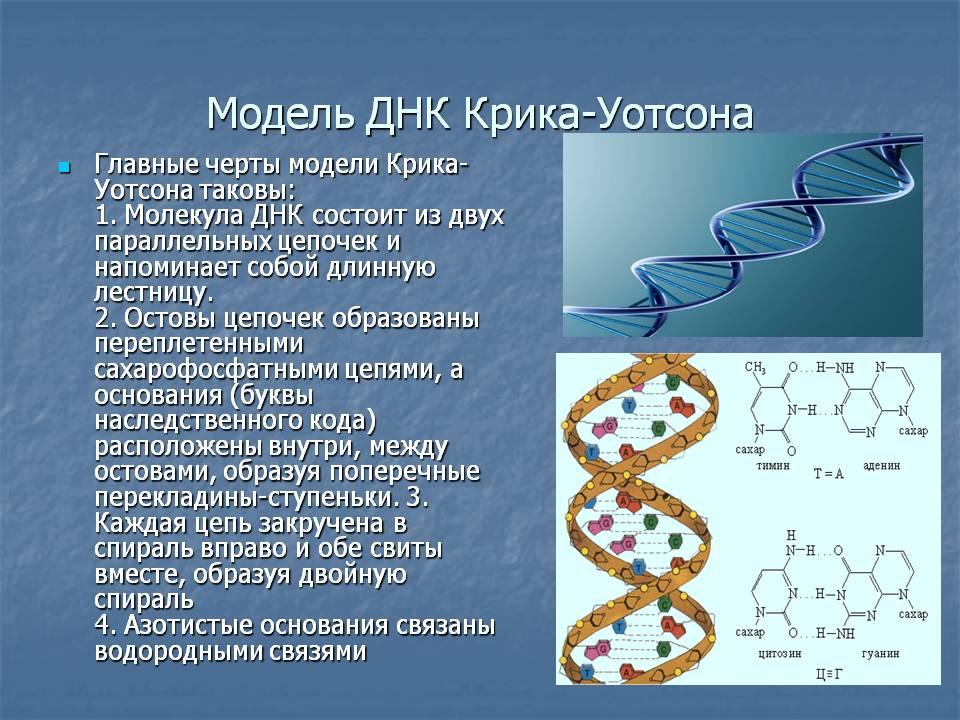 Все рибонуклеиновые кислоты синтезируются на соответствующих участках молекулы ДНК. Они имеют значительно меньшие размеры, чем ДНК, и представляют собой одинарную цепь нуклеотидов. Нуклеотиды содержат остаток фосфорной кислоты (фосфат), пентозный сахар (рибозу) и одно из четырех азотистых оснований – аденин, цитозин, гуанин и урацил. Азотистое основание – урацил – комплементарно аденину.
Все рибонуклеиновые кислоты синтезируются на соответствующих участках молекулы ДНК. Они имеют значительно меньшие размеры, чем ДНК, и представляют собой одинарную цепь нуклеотидов. Нуклеотиды содержат остаток фосфорной кислоты (фосфат), пентозный сахар (рибозу) и одно из четырех азотистых оснований – аденин, цитозин, гуанин и урацил. Азотистое основание – урацил – комплементарно аденину.
Процесс биосинтеза сложный и включает ряд этапов – транскрипцию, сплайсинг и трансляцию.
Первый этап (транскрипция) происходит в ядре клетки: на участке определенного гена молекулы ДНК синтезируется мРНК. Этот синтез осуществляется при участии комплекса ферментов, главным из которых является ДНК-зависимая РНК-полимераза, которая прикрепляется к начальной (инициальной) точке молекулы ДНК, расплетает двойную спираль и, перемещаясь вдоль одной из нитей, синтезирует рядом с ней комплементарную нить мРНК. В результате транскрипции мРНК содержит генетическую информацию в виде последовательного чередования нуклеотидов, порядок которых точно скопирован с соответствующего участка (гена) молекулы ДНК.
Дальнейшие исследования показали, что в процессе транскрипции синтезируется так называемая про-мРНК – предшественник зрелой мРНК, участвующей в трансляции. Про-мРНК имеет значительно большие размеры и содержит фрагменты, не кодирующие синтез соответствующей полипептидной цепи. В ДНК наряду с участками, кодирующими рРНК, тРНК и полипептиды, имеются фрагменты, не содержащие генетической информации. Они получили название интронов в отличие от кодирующих фрагментов, которые называются экзонами. Интроны обнаружены на многих участках молекул ДНК. Так, например, в одном гене – участке ДНК, кодирующем овальбумин курицы, содержится 7 интронов, в гене сывороточного альбумина крысы – 13 интронов. Длина интрона бывает различной – от двухсот до тысячи пар нуклеотидов ДНК. Интроны считываются (транскрибируются) одновременно с экзонами, поэтому про-мРНК значительно длиннее, чем зрелая мРНК. В ядре в про-мРНК специальными ферментами вырезаются интроны, а фрагменты экзона «сращиваются» между собой в строгом порядке.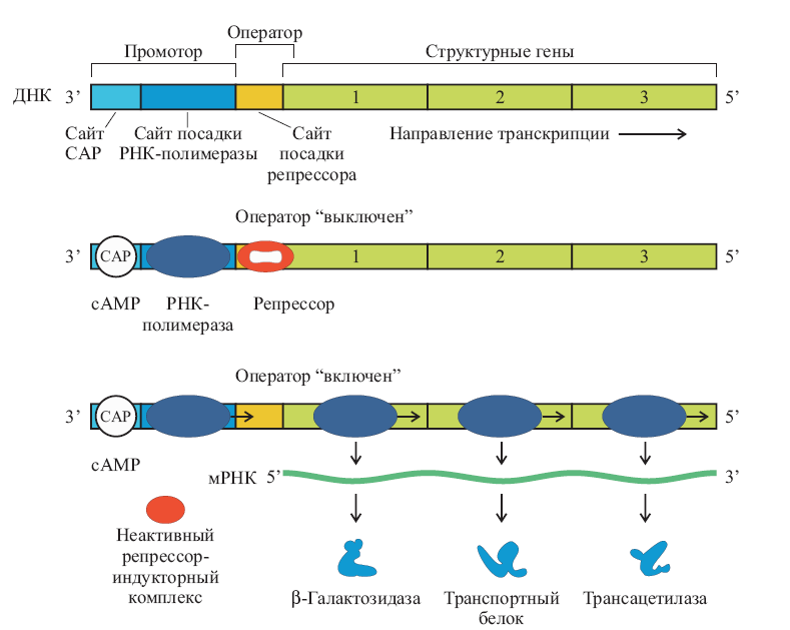 Этот процесс называют сплайсингом. В процессе сплайсинга образуется зрелая мРНК, которая содержит только ту информацию, которая необходима для синтеза соответствующего полипептида, то есть информативную часть структурного гена.
Этот процесс называют сплайсингом. В процессе сплайсинга образуется зрелая мРНК, которая содержит только ту информацию, которая необходима для синтеза соответствующего полипептида, то есть информативную часть структурного гена.
Значение и функции интронов до сих пор еще не совсем выяснены, но установлено, что, если в ДНК считываются только участки экзонов, зрелая мРНК не образуется. Процесс сплайсинга изучен на примере работы гена овальбумина. Он содержит один экзон и 7 интронов. Сначала на ДНК синтезируется про-мРНК, содержащая 7700 нуклеотидов. Затем в про-мРНК число нуклеотидов уменьшается до 6800, затем — до 5600, 4850, 3800, 3400 и т. д. до 1372 нуклеотидов, соответствующих экзону. Содержащая 1372 нуклеотида мРНК выходит из ядра в цитоплазму, попадает на рибосому и синтезирует соответствующий полипептид.
Следующий этап биосинтеза – трансляция – происходит в цитоплазме на рибосомах при участии тРНК.
Транспортные РНК синтезируются в ядре, но функционируют в свободном состоянии в цитоплазме клетки. Одна молекула тРНК содержит 76-85 нуклеотидов и имеет довольно сложную структуру, напоминающую клеверный лист. Три участка тРНК имеют особо важное значение: 1) антикодон, состоящий из трех нуклеотидов, определяющий место прикрепления тРНК к соответствующему комплементарному кодону (мРНК) на рибосоме; 2) участок, определяющий специфичность тРНК, способность данной молекулы прикрепляться только к определенной аминокислоте; 3) акцепторный участок, к которому прикрепляется аминокислота. Он одинаков для всех тРНК и состоит из трех нуклеотидов – Ц-Ц-А. Присоединению аминокислоты к тРНК предшествует ее активация ферментом аминоацил-тРНК-синтетазой. Этот фермент специфичен для каждой аминокислоты. Активированная аминокислота прикрепляется к соответствующей тРНК и доставляется ею на рибосому.
Одна молекула тРНК содержит 76-85 нуклеотидов и имеет довольно сложную структуру, напоминающую клеверный лист. Три участка тРНК имеют особо важное значение: 1) антикодон, состоящий из трех нуклеотидов, определяющий место прикрепления тРНК к соответствующему комплементарному кодону (мРНК) на рибосоме; 2) участок, определяющий специфичность тРНК, способность данной молекулы прикрепляться только к определенной аминокислоте; 3) акцепторный участок, к которому прикрепляется аминокислота. Он одинаков для всех тРНК и состоит из трех нуклеотидов – Ц-Ц-А. Присоединению аминокислоты к тРНК предшествует ее активация ферментом аминоацил-тРНК-синтетазой. Этот фермент специфичен для каждой аминокислоты. Активированная аминокислота прикрепляется к соответствующей тРНК и доставляется ею на рибосому.
Центральное место в трансляции принадлежит рибосомам – рибонуклеопротеиновым органоидам цитоплазмы, во множестве в ней присутствующим. Размеры рибосом у прокариот в среднем 30х30х20 нм, у эукариот – 40х40х20 нм. Обычно их размеры определяют в единицах седиментации (S) – скорости осаждения при центрифугировании в соответствующей среде. У бактерии кишечной палочки рибосома имеет величину 70Sи состоит из двух субчастиц, одна из которых имеет константу 30S, вторая 50S, и содержит 64 % рибосомальной РНК и 36 % белка.
Обычно их размеры определяют в единицах седиментации (S) – скорости осаждения при центрифугировании в соответствующей среде. У бактерии кишечной палочки рибосома имеет величину 70Sи состоит из двух субчастиц, одна из которых имеет константу 30S, вторая 50S, и содержит 64 % рибосомальной РНК и 36 % белка.
Молекула мРНК выходит из ядра в цитоплазму и прикрепляется к малой субчастице рибосомы. Трансляция начинается с так называемого стартового кодона (инициатора синтеза) – А-У-Г-. Когда тРНК доставляет к рибосоме активированную аминокислоту, ее антикодон соединяется водородными связями с нуклеотидами комплементарного кодона мРНК. Акцепторный конец тРНК с соответствующей аминокислотой прикрепляется к поверхности большой субчастицы рибосомы. После первой аминокислоты другая тРНК доставляет следующую аминокислоту, и таким образом на рибосоме синтезируется полипептидная цепь. Молекула мРНК обычно работает сразу на нескольких (5-20) рибосомах, соединенных в полисомы. Начало синтеза полипептидной цепи называют инициацией, рост ее – элонгацией. Последовательность аминокислот в полипептидной цепи определяется последовательностью кодонов в мРНК. Синтез полипептидной цепи прекращается, когда на мРНК появляется один из кодонов-терминаторов – УАА, УАГ или УГА. Окончание синтеза данной полипептидной цепи называется терминацией.
Последовательность аминокислот в полипептидной цепи определяется последовательностью кодонов в мРНК. Синтез полипептидной цепи прекращается, когда на мРНК появляется один из кодонов-терминаторов – УАА, УАГ или УГА. Окончание синтеза данной полипептидной цепи называется терминацией.
Установлено, что в клетках животных полипептидная цепь за одну секунду удлиняется на 7 аминокислот, а мРНК продвигается на рибосоме на 21 нуклеотид. У бактерий этот процесс протекает в два-три раза быстрее.
Следовательно, синтез первичной структуры белковой молекулы – полипептидной цепи – происходит на рибосоме в соответствии с порядком чередования нуклеотидов в матричной рибонуклеиновой кислоте – мРНК. Она не зависит от строения рибосомы.
План-конспект урока
. Домашнее задание:Повторить § 2.13.
Разгадайте кроссворд:
1. Специфическая последовательность нуклеотидов, находящихся в начале каждого гена.
2. Переход последовательности нуклеотидов молекулы иРНК в последовательность АК молекулы белка.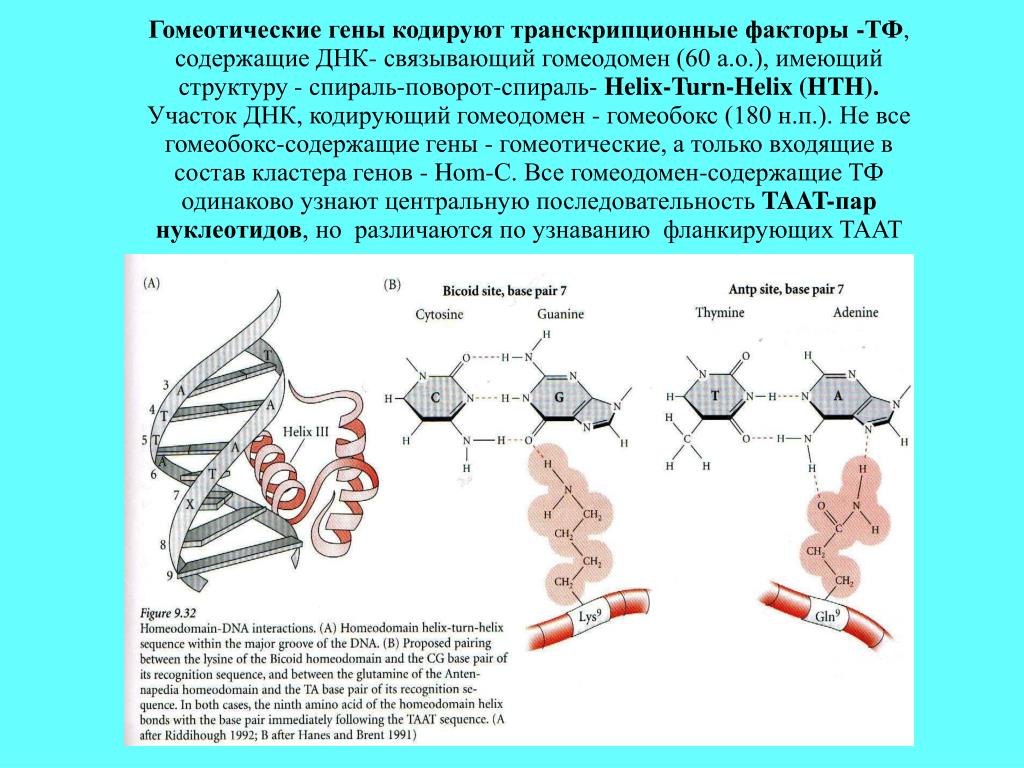
3. Знак начала трансляции.
4. Носитель генетической информации, расположенный в клеточном ядре.
5. Свойство генетического кода, повышающее надёжность хранения и передачи генетической информации при делении клеток.
6. Участок ДНК, содержащий информацию о первичной структуре одного белка.
7. Последовательность из трёх расположенных друг за другом нуклеотидов ДНК.
8. Все рибосомы, синтезирующие белок на одной молекуле иРНК.
9. Процесс перевода информации, о последовательности АК в белке с «языка ДНК» на «язык РНК».
10. Кодон, не кодирующий АК, а только показывает, что синтез белка должен быть завершён.
11. Структура, где определяется последовательность АК в молекуле белка.
12. Важное свойство генетического кода, заключающееся в том что, один триплет всегда кодирует только одну АК.
13. «Знак препинания» в молекуле ДНК, указывающий на то, что синтез иРНК нужно прекратить.
14. Генетический код… для всех живых организмов от бактерий до человека.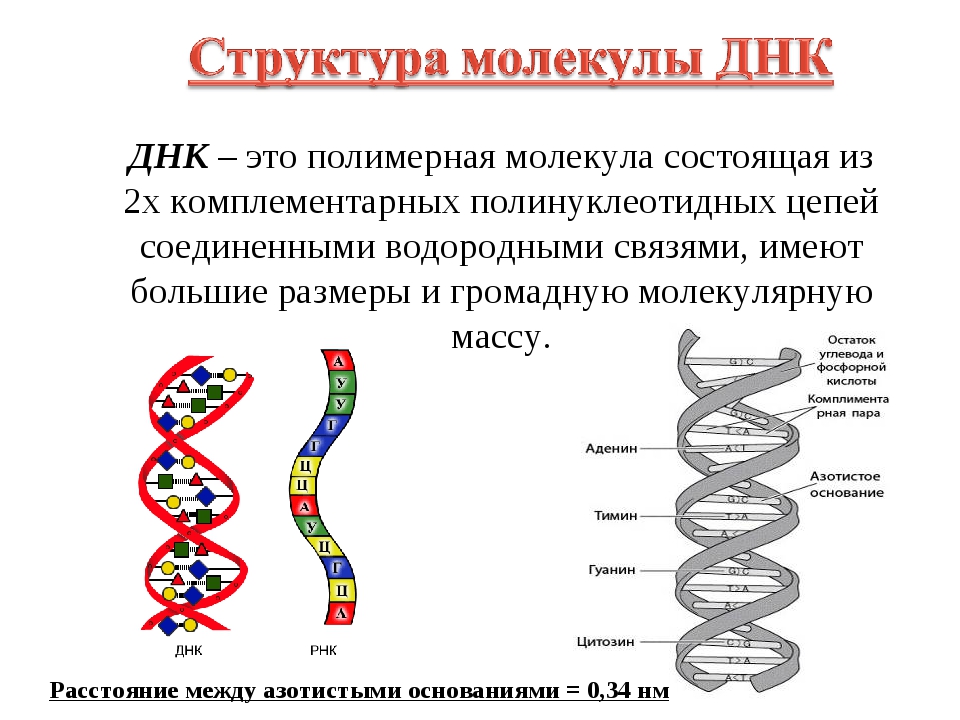
— до 2 минут
-вступительное слово учителя
-35 минут
-10 минут
-учитель
-у доски 1 ученик
-ученики, записывают в тетради
-учитель
— с места
-слайд 1 и 2
-слайд 3
-слайд 4
-слайд 5
-слайд 6
-слайд 7 и 8
-слайд 9 и 10
-слайд 11 и 12
-слайд 13
-слайд 14
-слайд 15 и16
-слайд 17 и 18
-слайд 19 и 20
-логический переход
-слайд 21
-учитель
-25 минут
-учитель
-учитель
-слайд 22
-учитель
-слайд 23
-слайд 24
-слайд 25
-15 минут
слайд 27
-группа №1
-индивидуально на карточках
-группа № 2
-индивидуально на карточках
-30 минут
-заранее подготовленные
-слайд 29
-10 минут (1 уч.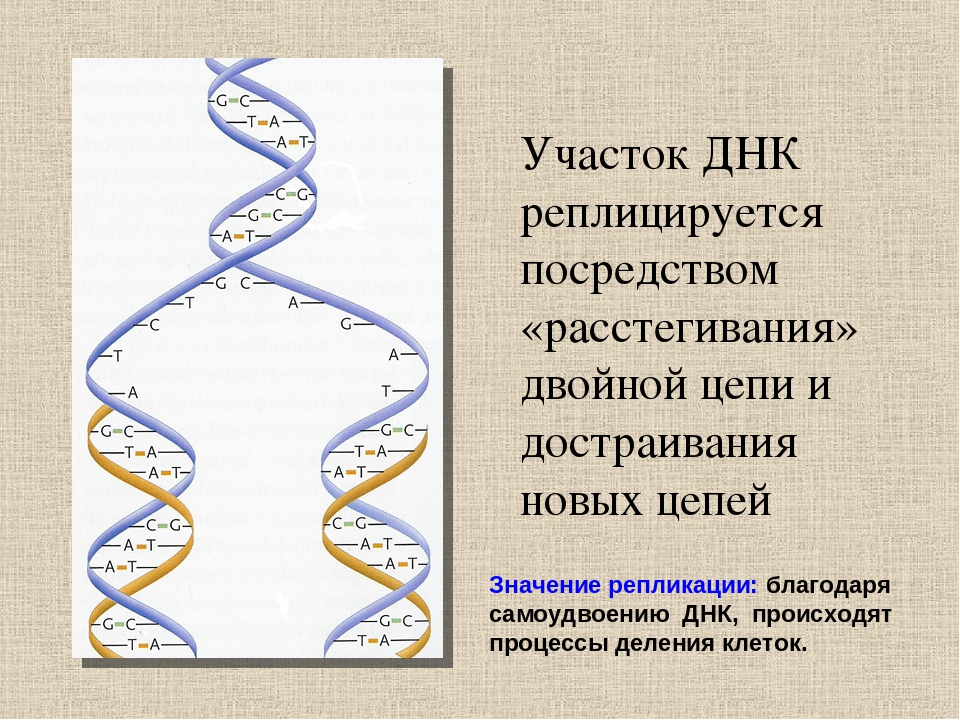 )
)
-10 минут (2 уч.)
-10 минут (3 уч.)
-5 минут
-учитель
-3минуты
-слайд 30
-на карточках
Биосинтез белков идет в каждой живой клетке. Наиболее активен он в молодых растущих клетках, где синтезируются белки на построение их органоидов, а также в секреторных клетках, где синтезируются белки-ферменты и белки-гормоны.
Основная роль в определении структуры белков принадлежит ДНК. Отрезок ДНК, содержащий информацию о структуре одного белка, называют геном. Молекула ДНК содержит несколько сотен генов. В молекуле ДНК записан код о последовательности аминокислот в белке в виде определенно сочетающихся нуклеотидов. Код ДНК удалось расшифровать почти полностью. Сущность его состоит в следующем. Каждой аминокислоте соответствует участок цепи ДНК из трех рядом стоящих нуклеотидов.
Например,
участок Т-Т-Т соответствует аминокислоте
лизину, отрезок А-Ц-А — цистину, Ц-А-А
— валину н т. д. Разных аминокислот —
20, число возможных сочетаний из 4
нуклеотидов по 3 равно 64. Следовательно,
триплетов с избытком хватает для
кодирования всех аминокислот.
д. Разных аминокислот —
20, число возможных сочетаний из 4
нуклеотидов по 3 равно 64. Следовательно,
триплетов с избытком хватает для
кодирования всех аминокислот.
Синтез белка — сложный многоступенчатый процесс, представляющий цепь синтетических реакций, протекающих по принципу матричного синтеза.
Поскольку ДНК находится в ядре клетки, а синтез белка происходит в цитоплазме, существует посредник, передающий информацию с ДНК на рибосомы. Таким посредником является и-РНК. :
В биосинтезе белка определяют следующие этапы, идущие в разных частях клетки:
1.Первый этап — синтез и-РНК происходит в ядре, в процессе которого информация, содержащаяся в гене ДНК, переписывается на и-РНК. Этот процесс называется транскрипцией (от лат. «транскриптик» — переписывание).
2.На втором этапе происходит соединение аминокислот с молекулами т-РНК, которые последовательно состоят из трех нуклеотидов — антикодонов, с помощью которых определяется свой триплет-кодон.
3.Третий
этап — это процесс непосредственного
синтеза полипептидных связей, называемый
трансляцией.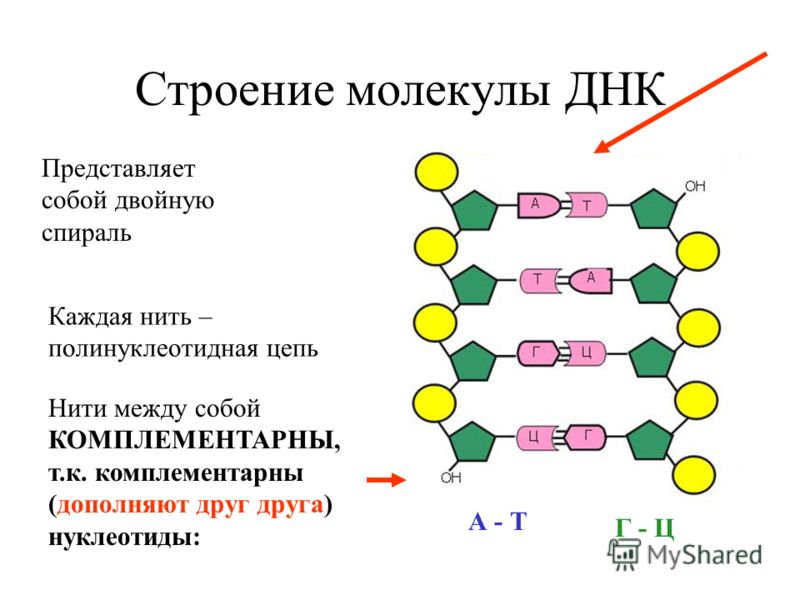 Он происходит в рибосомах.
Он происходит в рибосомах.
4.На четвертом этапе происходит образование вторич ной и третичной структуры белка, то есть формирование окончательной структуры белка.
Таким образом, в процессе биосинтеза белка образуются новые молекулы белка в соответствии с точной информацией, заложенной в ДНК. Этот процесс обеспечивает обновление белков, процессы обмена веществ, рост и развитие клеток, то есть все процессы жизнедеятельности клетки.
Хромосомы (от греч. «хрома» — цвет, «сома» — тело) — очень важные структуры ядра клетки. Играют главную роль в процессе клеточного деления, обеспечивая передачу наследственной информации от одного поколения к другому. Они представляют собой тонкие нити ДНК, связанные с белками. Нити называются хроматидами, состоящими из ДНК, основных белков (гистонов) и кислых белков.
В
неделящейся клетке хромосомы заполняют
весь объем ядра и не видны под микроскопом.
Перед началом деления происходит
спирализация ДНК и каждая хромосома
становится различимой под микроскопом.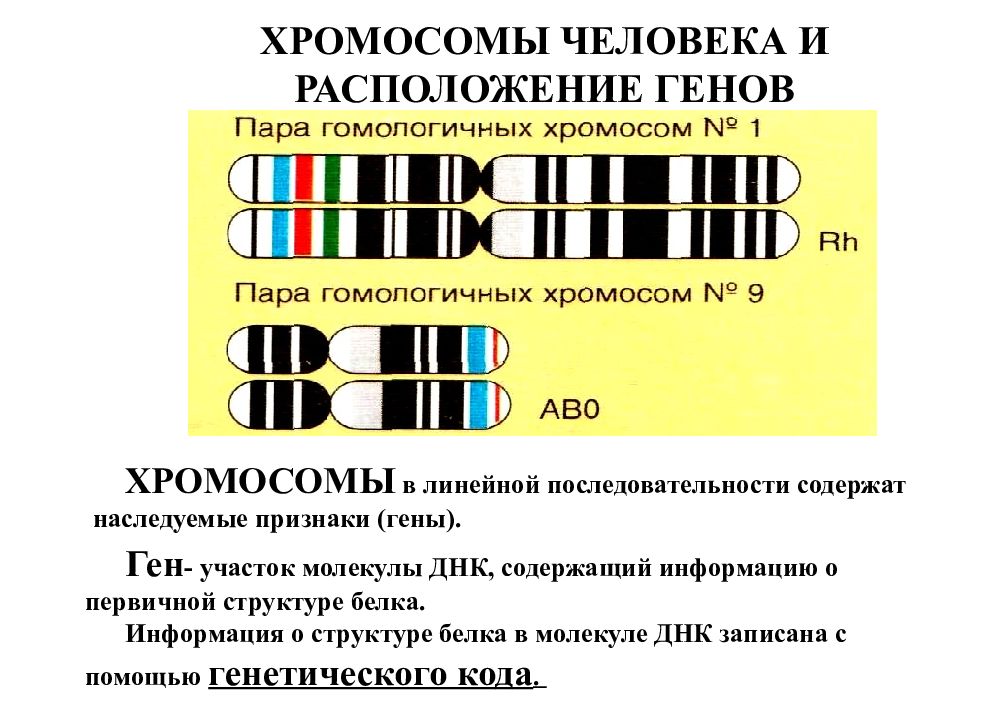 Во время спирализации хромосомы
сокращаются в десятки тысяч раз. В таком
состоянии хромосомы выглядят как две
лежащие рядом одинаковые нити (хроматиды),
соединенные общим участком — центромерой.
Во время спирализации хромосомы
сокращаются в десятки тысяч раз. В таком
состоянии хромосомы выглядят как две
лежащие рядом одинаковые нити (хроматиды),
соединенные общим участком — центромерой.
Для каждого организма характерно постоянное количество и структура хромосом. В соматических клетках хромосомы всегда парные, то есть в ядре есть две одинаковые хромосомы, составляющие одну пару. Такие хромосомы называют гомологичными, а парные наборы хромосом в соматических клетках называют диплоидными.
Так, диплоидный набор хромосом у человека состоит из 46 хромосом, образуя 23 пары. Каждая пара состоит из двух одинаковых (гомологичных) хромосом.
Особенности строения хромосом позволяют выделить их 7 групп, которые обозначаются латинскими буквами А, В, С, D, Е, F, G. Все пары хромосом имеют порядковые номера.
У
мужчин и женщин есть 22 пары одинаковых
хромосом. Их называют аутосомы. Мужчина
и женщина отличаются одной парой
хромосом, которые называют половыми.
Они обозначаются буквами — большая X
(группа С) и маленькая Y (группа С,). В
женском организме 22 пары аутосом и одна
пара (XX) половых хромосом. У мужчин — 22
пары аутосом н одна пара (XY) половых
хромосом.
В
женском организме 22 пары аутосом и одна
пара (XX) половых хромосом. У мужчин — 22
пары аутосом н одна пара (XY) половых
хромосом.
В отличие от соматических клеток, половые клетки содержат половинный набор хромосом, то есть содержат по одной хромосоме каждой пары! Такой набор называют гаплоидным. Гаплоидный набор хромосом возникает в процессе созревания клеток.
Белки играют очень важную роль в жизнедеятельности организмов, выполняют защитные, структурные, гормональные, энергетические функции. Обеспечивают рост мышечной и костной ткани. Белки информируют о строении клетки, о её функциях и биохимических свойствах, входят в состав ценных, полезных организму продуктов питания (яиц, молочных продуктов, рыбы, орехов, бобовых, ржи и пшеницы). Усвояемость такой пищи объясняется биологической ценностью. При равном показателе количества белка легче будет усваиваться тот продукт, чья ценность выше. Дефектные полимеры должны удаляться из организма и заменяться новыми. Этот процесс протекает при синтезе белков в клетках.
Какими бывают белки
Вещества, состоящие только из остатков аминокислот, называются простыми белками (протеинами). В случае необходимости используется их энергетическое свойство, поэтому людям, ведущим здоровый образ жизни, зачастую дополнительно нужен прием протеина. Сложные же белки, протеиды, имеют в своем составе простой белок и небелковую часть. Десять аминокислот в белке являются незаменимыми, это означает, что организм не может синтезировать их самостоятельно, они поступают из пищи, другой же десяток — заменимый, то есть их можно создать из других аминокислот. Так начинается жизненно необходимый для всех организмов процесс.
Основные этапы биосинтеза: откуда берутся белки
Новые молекулы берутся в результате биосинтеза — химической реакции соединения. Существует два основных этапа синтеза белков в клетке. Это транскрипция и трансляция. Транскрипция происходит в ядре. Это считывание с ДНК (дезоксирибонуклеиновой кислоты), которая несет информацию о будущем белке, на РНК (рибонуклеиновую кислоту), которая переносит эту информацию с ДНК в цитоплазму. Происходит это по причине того, что ДНК непосредственно в биосинтезе участия не принимает, она только несет сведения, не имея способности выходить в цитоплазму, где синтезируется белок, и выполняя только функцию носителя генетической информации. Транскрипция же позволяет считать данные с матрицы ДНК на РНК по принципу комплементарности.
Происходит это по причине того, что ДНК непосредственно в биосинтезе участия не принимает, она только несет сведения, не имея способности выходить в цитоплазму, где синтезируется белок, и выполняя только функцию носителя генетической информации. Транскрипция же позволяет считать данные с матрицы ДНК на РНК по принципу комплементарности.
Роль РНК и ДНК в процессе
Итак, запускает синтез белков в клетках цепочка ДНК, которая несет информацию о каком-либо конкретном белке и называется геном. Цепочка ДНК в процессе транскрипции расплетается, то есть её спираль начинает распадаться в линейную молекулу. С ДНК информация должна преобразоваться на РНК. Напротив тимина в данном процессе должен становиться аденин. Цитозин же имеет в качестве пары гуанин, точно так же, как ДНК. Напротив аденина РНК становится урацил, потому как в РНК такого нуклеотида, как тимин, не существует, он заменяется просто урациловым нуклеотидом. С гуанином соседствует цитозин. Напротив аденина становится урацил, а в паре с тимином располагается аденин. Эти молекулы РНК, которые становятся напротив, называются информационными РНК (иРНК). Они способны через поры выходить из ядра в цитоплазму и рибосомы, которые, собственно, и выполняют функцию синтеза белков в клетках.
Эти молекулы РНК, которые становятся напротив, называются информационными РНК (иРНК). Они способны через поры выходить из ядра в цитоплазму и рибосомы, которые, собственно, и выполняют функцию синтеза белков в клетках.
О сложном простыми словами
Теперь же совершается сборка из аминокислотных последовательностей полипептидной цепочки белка. Транскрипцией можно назвать считывание информации о будущем белке с матрицы ДНК на РНК. Это можно определить как первый этап. После того как РНК выходит из ядра, она должна попасть к рибосомам, где происходит второй этап, который называется трансляцией.
Трансляция — это уже переход РНК, то есть перенос информации с нуклеотидов на молекулу белка, когда РНК говорит о том, какая последовательность аминокислот должна быть в веществе. В таком порядке информационная РНК попадает в цитоплазму к рибосомам, которые осуществляют синтез белков в клетке: А (аденин) — Г (гуанин) — У (урацил) — Ц (цитозин) — У (урацил) — А (аденин).
Зачем нужны рибосомы
Для того чтобы произошла трансляция и в результате образовался белок, нужны такие компоненты, как сама информационная РНК, транспортная РНК, а также рибосомы в качестве «фабрики», на которой производится белок. В данном случае функционируют две разновидности РНК: информационная, которая образовалась в ядре с ДНК, и транспортная. Молекула второй кислоты имеет вид клевера. Этот «клевер» присоединяет к себе аминокислоту и несет её к рибосомам. То есть он выполняет транспортировку органических соединений непосредственно к «фабрике» по их образованию.
В данном случае функционируют две разновидности РНК: информационная, которая образовалась в ядре с ДНК, и транспортная. Молекула второй кислоты имеет вид клевера. Этот «клевер» присоединяет к себе аминокислоту и несет её к рибосомам. То есть он выполняет транспортировку органических соединений непосредственно к «фабрике» по их образованию.
Как работает рРНК
Также существуют рибосомальные РНК, которые входят в состав самой рибосомы и выполняют синтез белка в клетке. Получается, что рибосомы являются немембранными структурами, они не имеют оболочек, как, например, ядро или эндоплазматическая сеть, а состоят просто из белков и рибосомальных РНК. Что же происходит, когда последовательность из нуклеотидов, то есть информационная РНК, попадает к рибосомам?
Транспортная РНК, которая находится в цитоплазме, подтягивает к себе аминокислоты. Откуда же взялись аминокислоты в клетке? А образуются они вследствие расщепления белков, которые поступают внутрь с пищей. Эти соединения переносятся током крови к клеткам, где происходит продуцирование необходимых для организма белков.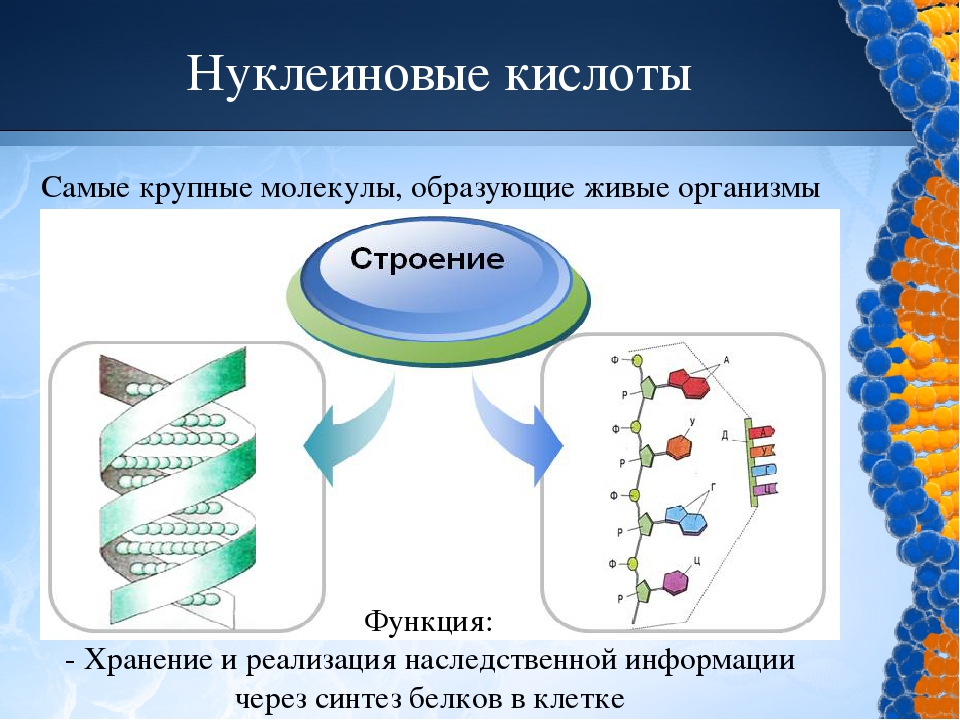
Конечный этап синтеза белков в клетках
Аминокислоты плавают в цитоплазме так же, как и транспортные РНК, и когда происходит непосредственно сборка полипептидной цепи, эти транспортные РНК начинают с ними соединяться. Однако не во всякой последовательности и далеко не любая транспортная РНК может соединиться со всеми видами аминокислот. Существует определенный участок, к которому присоединяется необходимая аминокислота. Второй же участок транспортной РНК называется антикодоном. Этот элемент состоит из трех нуклеотидов, которые комплементарны последовательности нуклеотидов в информационной РНК. Для одной аминокислоты необходимо три нуклеотида. Например, какой-либо условный белок состоит для упрощения из всего лишь двух аминокислот. Очевидно, что в основном белки имеют очень длинную структуру, состоят из многих аминокислот. Цепь А — Г — У называется триплетом, или кодоном, к нему будет присоединяться транспортная РНК в виде клевера, на конце которого будет находиться определенная аминокислота.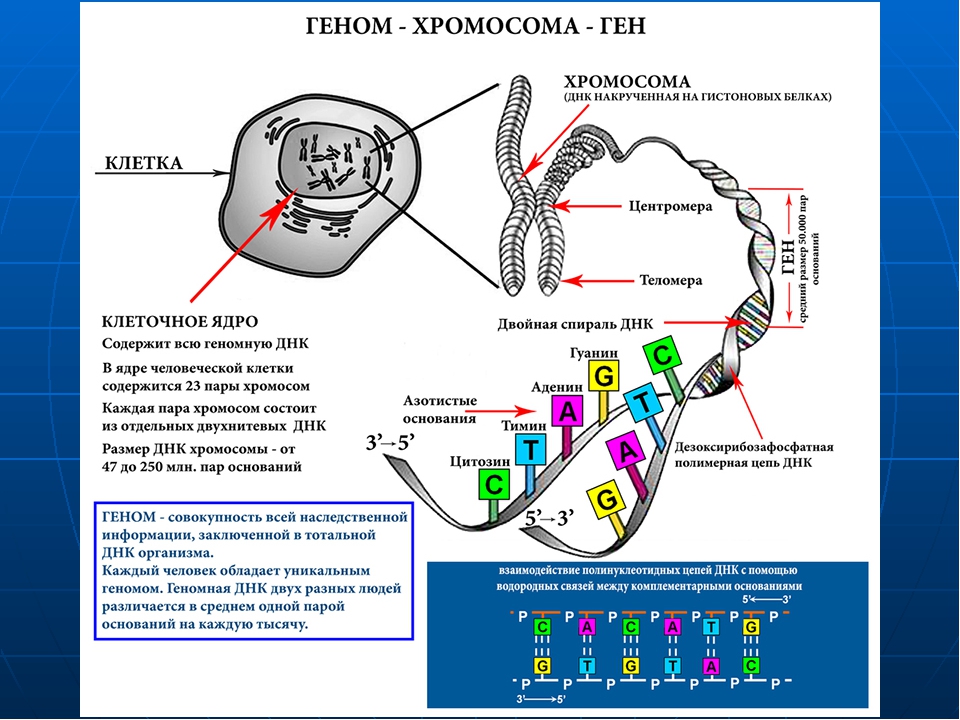 К следующему триплету Ц — У — А будет присоединяться еще одна тРНК, которая будет содержать совершенно другую аминокислоту, комплементарную данной последовательности. В таком порядке будет происходить дальнейшая сборка полипептидной цепочки.
К следующему триплету Ц — У — А будет присоединяться еще одна тРНК, которая будет содержать совершенно другую аминокислоту, комплементарную данной последовательности. В таком порядке будет происходить дальнейшая сборка полипептидной цепочки.
Биологическое значение синтеза
Между двумя аминокислотами, находящимися на концах «клеверов» каждого триплета, образуется пептидная связь. На этом этапе транспортная РНК уходит в цитоплазму. К триплетам присоединяется затем следующая транспортная РНК с другой аминокислотой, которая образует с предыдущими двумя полипептидную цепь. Этот процесс повторяется до момента, когда набирается необходимая последовательность аминокислот. Таким образом происходит синтез белка в клетке, и образуются ферменты, гормоны, кровяные вещества и т. д. Не во всякой клетке образуется любой белок. Каждая клетка может образовать определенный белок. Например, в эритроцитах будет образовываться гемоглобин, а клетками поджелудочной железы будут синтезироваться гормоны и разнообразные ферменты, расщепляющие пищу, которая попадает в организм.
В мышцах же будет образовываться белок актин и миозин. Как видно, процесс синтеза белка в клетках многоэтапен и сложен, что говорит о его значимости и необходимости для всего живого.
Способность клеток поддерживать высокую упорядоченность своей организации зависит от генетической информации, которая реализуется, сохраняется, воспроизводится или совершенствуется в четырёх генетических процессах: синтезе РНК и белка, репарации ДНК, репликации ДНК и генетической рекомбинации. На долю белков приходится обычно больше половины сухой массы клетки, и синтез их играет главную роль в таких процессах как рост и дифференцировка клеток, поддержание их структуры и функции.
Зависит от совместного действия нескольких классов молекул РНК. Сначала в результате копирования ДНК, несущей информацию о синтезируемом белке, образуется молекула матричной РНК (мРНК). К каждой из 20 аминокислот, из которых строится белок, присоединяется молекула специфической транспортной РНК (тРНК), а к субъединицам рибосомы, на которой происходит синтез, присоединяются некоторые вспомогательные белковые факторы.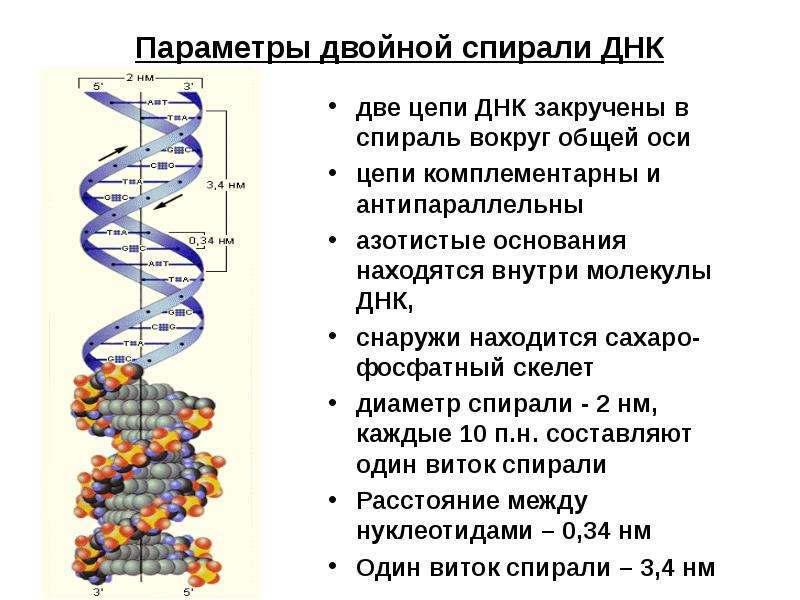
Началом синтеза белка в клетке считается момент, когда эти компоненты объединяются в цитоплазме, образуя функциональную рибосому. По мере того как мРНК шаг за шагом продвигается сквозь рибосому, её нуклеотидная последовательность переводится (транспортируется) в соответствующую последовательность аминокислот, в результате создаётся определённая белковая цепь.
Синтез РНК на ДНК-матрице называется транскрипцией. В результате транскрипции образуются молекулы мРНК, несущие информацию для синтеза белка в клетке, а также транспортные, рибосомные и другие виды молекул РНК, выполняющие структурные и каталитические функции. Синтез этих молекул РНК — копий нуклеотидных последовательностей участков молекулы ДНК — катализируется ферментами, которые называются РНК-полимеразами.
Связь РНК-полимеразы оказывается очень прочной, если РНК-полимераза присоединяется к специфической последовательности ДНК, к так называемому промотору, содержащему старт-сигнал для синтеза РНК, то есть к сайту, с которого этот синтез должен начаться. Реакции, которые из этого вытекают, характеризуются следующим: присоединившись к промотору, РНК-полимераза раскручивает свой участок двойной спирали, обнажая таким образом нуклеотиды на коротком отрезке каждой из двух цепей ДНК. Одна из этих двух разделённых цепей должна стать матрицей для комплементарного спаривания основной ДНК с основаниями поступающих мономеров – рибонуклеозидтрифосфатов. Полимераза соединяет между собой два первых поступающих мономера и тем самым кладёт начало синтезируемой цепи РНК. Затем РНК-полимераза, продвигаясь шаг за шагом вдоль ДНК, раскручивает перед собой спираль ДНК, обнажая всякий раз новый участок матрицы для комплементарного спаривания оснований. Добавляя к растущей цепи РНК по одному нуклеотиду, она постепенно наращивает цепь.
Реакции, которые из этого вытекают, характеризуются следующим: присоединившись к промотору, РНК-полимераза раскручивает свой участок двойной спирали, обнажая таким образом нуклеотиды на коротком отрезке каждой из двух цепей ДНК. Одна из этих двух разделённых цепей должна стать матрицей для комплементарного спаривания основной ДНК с основаниями поступающих мономеров – рибонуклеозидтрифосфатов. Полимераза соединяет между собой два первых поступающих мономера и тем самым кладёт начало синтезируемой цепи РНК. Затем РНК-полимераза, продвигаясь шаг за шагом вдоль ДНК, раскручивает перед собой спираль ДНК, обнажая всякий раз новый участок матрицы для комплементарного спаривания оснований. Добавляя к растущей цепи РНК по одному нуклеотиду, она постепенно наращивает цепь.
Процесс удлинения цепи РНК продолжается до тех пор, пока фермент не встретит на своём пути еще одну специфическую нуклеотидную последовательность в цепи ДНК, — а именно сигнал терминации транскрипции (стоп-сигнал). Достигнув этой точки, полимераза отделяется и от матричной ДНК, и от вновь синтезированной цепи РНК.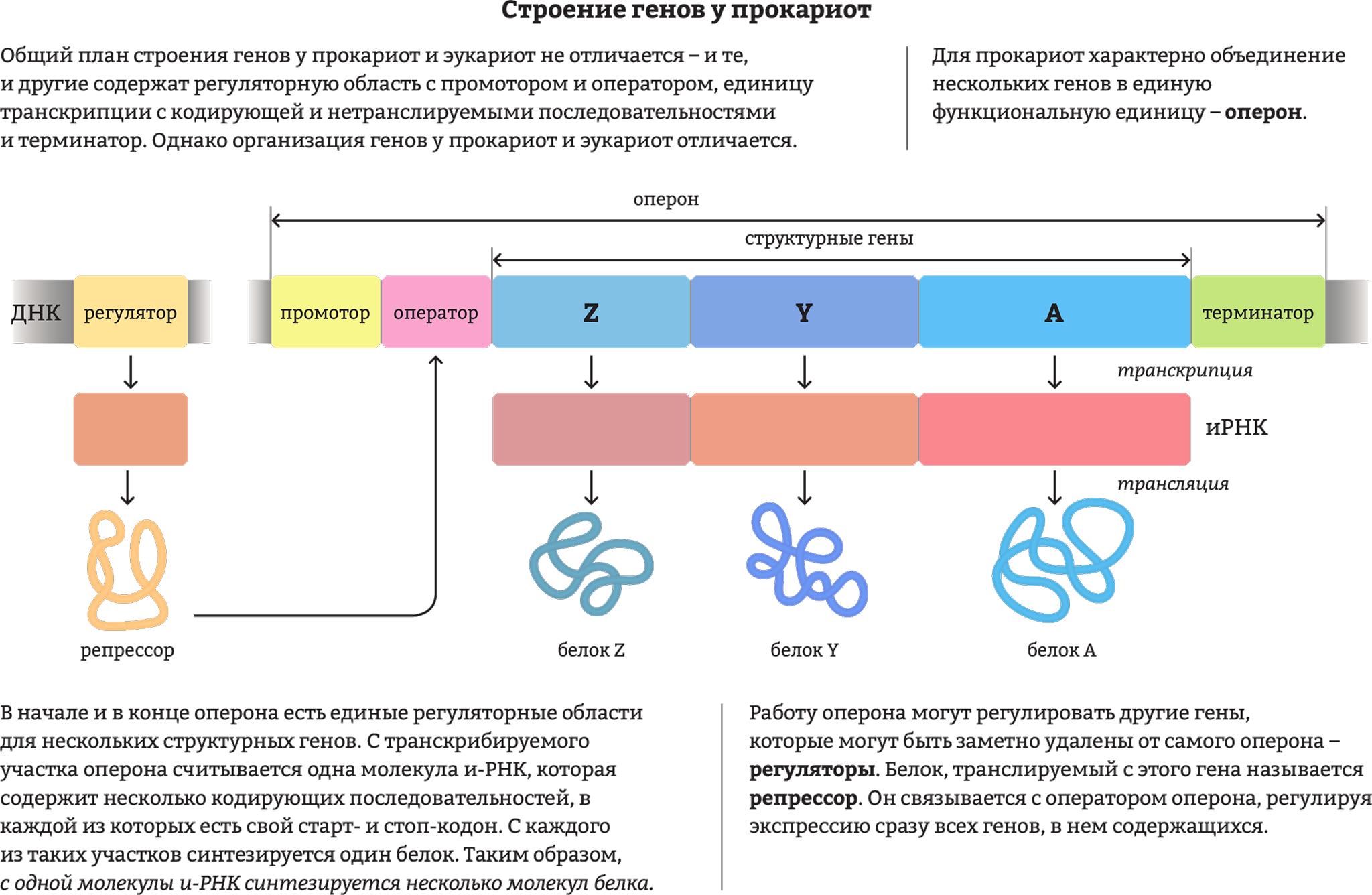 Во время продвижения фермента вдоль матричной цепи в его активном центре образуется двойная спираль РНК-ДНК. Позади молекулы полимеразы, закончившей свою работу синтеза ДНК-РНК, немедленно восстанавливается спираль ДНК-РНК, а РНК вытесняется. Каждая завершенная цепь РНК отделяется от ДНК-матрицы в виде свободной одноцепочечной молекулы, в которой число нуклеотидов колеблется от 70 до 10000.
Во время продвижения фермента вдоль матричной цепи в его активном центре образуется двойная спираль РНК-ДНК. Позади молекулы полимеразы, закончившей свою работу синтеза ДНК-РНК, немедленно восстанавливается спираль ДНК-РНК, а РНК вытесняется. Каждая завершенная цепь РНК отделяется от ДНК-матрицы в виде свободной одноцепочечной молекулы, в которой число нуклеотидов колеблется от 70 до 10000.
Транскрибируется, как правило, одна из цепей ДНК. Какая из двух цепей будет транскрибироваться, определяется промотором, нуклеотидная последовательность которого ориентирована таким образом, чтобы направить РНК-полимеразу на тот или иной путь.
Известно также, что в определении того, какие участки ДНК будут транскрибироваться РНК-полимеразой, важную роль играют особые белки , регулирующие активность генов. Именно от них в первую очередь и зависит, какие белки будет вырабатывать клетка. Далее, в клетках эукариот большинство РНК-транскриптов ДНК покинут клеточное ядро и перейдут в цитоплазму в виде мРНК, претерпевая существенные изменения — подвергаясь сплайсингу.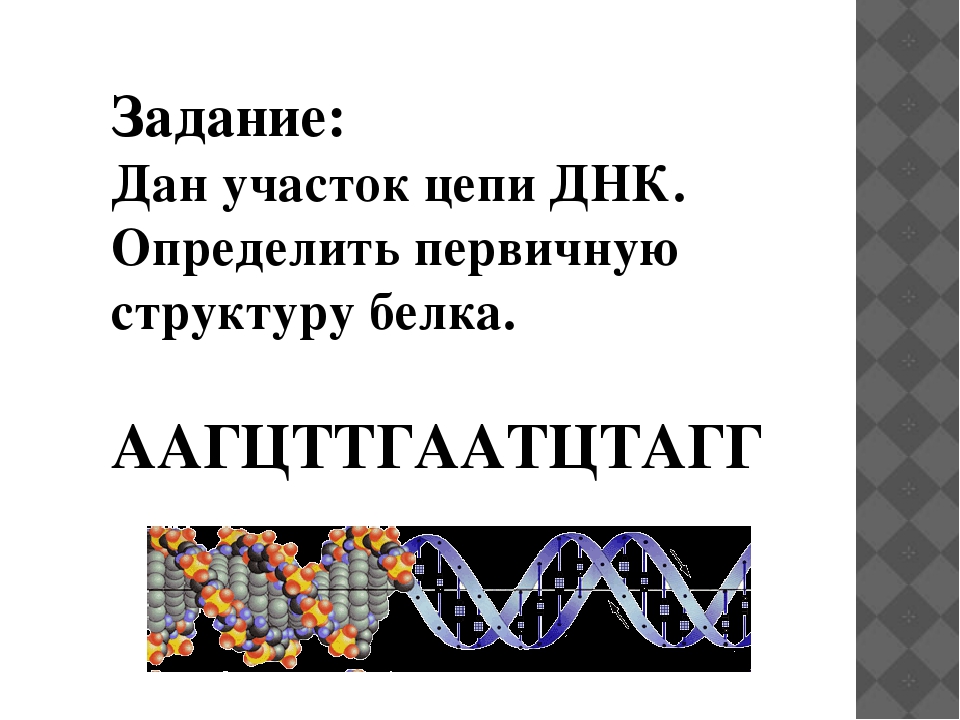
Во всех клетках имеется набор транспортных РНК (тРНК) — небольших молекул, размеры которых колеблются от 70 до 90 нуклеотидов. Эти РНК, присоединяясь одним своим концом к специфическому кодону мРНК, а другим присоединяя аминокислоту, кодируемую данным триплетом, позволяют аминокислотам выстраиваться в порядке, диктуемом нуклеотидной последовательностью мРНК.
Каждая тРНК может переносить только одну из 20 аминокислот, используемых в синтезе белка. Транспортную РНК, переносящую глицин, обозначают как тРНК Gly и т.д. Для каждой из 20 аминокислот имеется один тип тРНК. Важно при этом, что каждая аминокислота ковалентно присоединяется к тРНК, содержащей правильный антикодон — трехнуклеотидную последовательность, комплементарную трехнуклеотидному кодону, определяющему эту аминокислоту в молекулу мРНК. Спаривание кодона с антикодоном позволяет каждой аминокислоте включиться в растущую белковую цепь в том порядке, который диктуется нуклеотидной последовательностью мРНК. Так что генетический код используется для перевода (трансляции) нуклеотидных последовательностей нуклеиновых кислот в аминокислотные последовательности белков.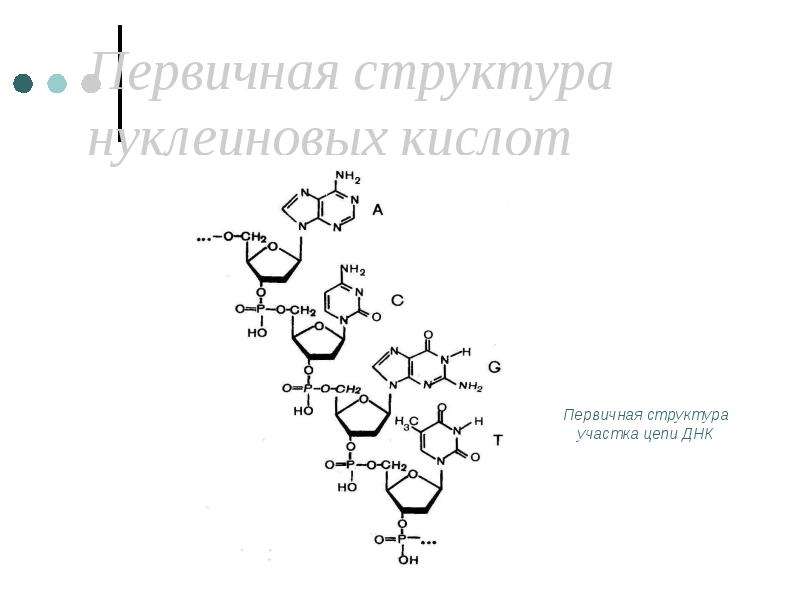
нить мРНК окрашена красным цветом, рибосомы — синим, растущие полипептидные цепи — зелёным. (Фото Dr Elena Kiseleva).
Присоединяясь одним концом к аминокислоте, а другим спариваясь с кодоном, тРНК переводит последовательность нуклеотидов в последовательность аминокислот. Функция тРНК зависит от трёхмерной структуры её молекулы. В каком именно месте будет присоединена к растущей полипептидной цепи данная аминокислота, зависит не от самой аминокислоты , а от присоединившей её молекулы тРНК. Молекула тРНК ковалентно присоединяется именно к той аминокислоте из всех двадцати аминокислот, которая является её настоящим партнером. Механизм этот связан с участием ферментов, называемых аминоацил-тРНК-синтазами, которые присоединяют аминокислоту к соответствующему набору молекул тРНК. Для каждой из аминокислот имеется своя особая синтетаза (всего таких синтетаз 20): одна присоединяет, например, глицин к тРНК Gly , другая — аланин к тРНК Ala и т.д. Таким образом, молекулы тРНК играют роль конечных адаптаторов, переводящих информацию, заключённую в нуклеотидной последовательности нуклеиновой кислоты, на язык белка.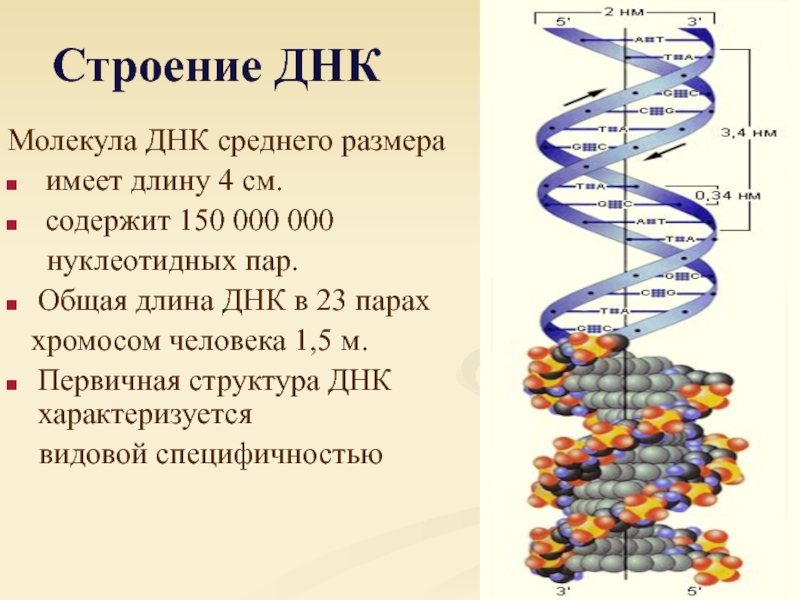
Для осуществления реакций белкового синтеза требуется сложный каталитический стимул. Растущий конец полипептидной цепи должен определённым образом подстраиваться к молекуле мРНК для того, чтобы каждый последующий кодон мРНК точно соединился с антикодоном тРНК, не проскочив ни на один нуклеотид. В противном случае это приведет к сдвигу последовательности считывания.
Более половины массы рибосомы составляет РНК (рРНК), которая играет ключевую роль в каталитической активности рибосомы. В рибосоме имеются три различных участка, с которыми связывается РНК — один для мРНК и два для тРНК. Из двух последних один участок удерживает молекулу тРНК, присоединённую к растущему концу полипептидной цепи, поэтому его называют пептидил-тРНК — связывающим участком, или Р-участком.
Второй участок служит для удержания только прибывшей молекулы тРНК, нагруженной аминокислотой. Его называют аминоацил-тРНК-связывающим участком, или А-участком. К обоим участкам молекула тРНК прочно прикрепляется лишь в том случае, если её антикодон спаривается с комплементарным ему кодоном мРНК.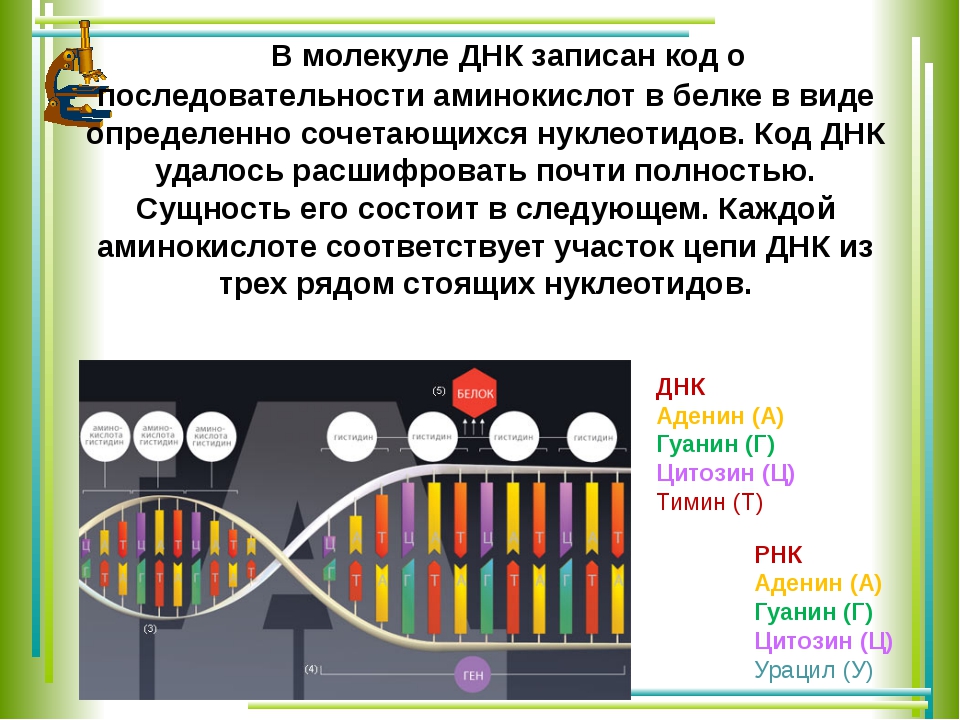 А- и Р-участки располагаются очень близко друг к другу — так, что две связанные с ними молекулы тРНК спариваются с двумя соседними кодонами в молекуле мРНК.
А- и Р-участки располагаются очень близко друг к другу — так, что две связанные с ними молекулы тРНК спариваются с двумя соседними кодонами в молекуле мРНК.
Процесс наращивания полипептидной цепи на рибосомах может рассматриваться как цикл, слагающийся из трёх отдельных этапов:
- Молекула аминоацил-тРНК связывается со свободным участком рибосомы, примыкающим к занятому Р-участку. Связывание осуществляется путём спаривания нуклеотидов антикодона с тремя нуклеотидами мРНК, находящимися в А-участке.
- На втором этапе происходит отделение карбоксильного конца полипептидной цепи в Р-участке от молекулы тРНК и образуется пептидная связь с аминокислотой, присоединённой молекулой тРНК в А-участке.
- Новая пептидил-тРНК переносится в Р-участок рибосомы, в то время как рибосома продвигается вдоль молекулы мРНК ровно на три нуклеотида.
Процесс транслокации, составляющий третий этап, включает в себя и возвращение свободной молекулы тРНК, отделившейся от полипептидной цепи в Р-участке во время второго этапа цитоплазматического пула тРНК. Поэтому после завершения третьего этапа незанятый А-участок может принять новую молекулу тРНК, нагруженную очередной аминокислотой, то есть цикл может начаться снова.
Весьма энергоёмкий процесс. Образование каждой новой пептидной связи сопровождается расположением четырёх высокоэнергетических фосфатных связей. Две из них расходуются, чтобы нагрузить аминокислотой молекулу тРНК, а две — на сам синтез в цикле реакций, протекающих на рибосоме. При завершении цикла пептидилтранфераза присоединяет к пептидил-тРНК не аминокислоту, а молекулу H 2 O, в силу чего карбоксильный конец растущей полипептидной цепи отделяется от молекулы тРНК — белковая цепь оказывается свободной и поступает в цитоплазму.
Таким образом, вновь сформированная после митотического деления клетка наделена видовой преемственностью наследственного материала, в результате перехода его в процессе деления в равном количестве в обе дочерние клетки. Дочерние клетки продолжают эволюционно закреплённый процесс видового метаболизма, приобретая свойства, характерные для клеточной популяции тканевой принадлежности. Поэтому в короткий промежуток вновь сформированные клетки проходят специализацию (дифференцировку) согласно их основной генетически закреплённой принадлежности. Ряд свойств становятся крайне общими для всех клеток, независимо от того, в какой тканевой системе им приходится выполнять свой жизненный цикл. Для выполнения своих функций клетки наделены рядом высокоспециализированных свойств.
Источники:
Цитофизиология / Луценко М.Т. // Новосибирск-Благовещенск, 2011.
Где и каким образом происходит синтез белка. Как происходит синтез белка
Роль белков в клетке и организме
Роль белка в жизни клетки и основные этапы его синтеза. Строение и функции рибосом. Роль рибосом в процессе синтеза белка.
Белки играют исключительно большую роль в процессах жизнедеятельности клетки и организма, им свойственны следующие функции.
Структурная. Входят в состав внутриклеточных структур‚ тканей и органов. Например, коллаген и эластин служат компонентами соединительной ткани: костей‚ сухожилий‚ хрящей; фиброин входит в состав шелка‚ паутины; кератин входит в состав эпидермиса и его производных (волосы‚ рога‚ перья). Образуют оболочки (капсиды) вирусов.
Ферментативная. Все химические реакции в клетке протекают при участии биологических катализаторов — ферментов (оксидоредуктазы, гидролазы, лигазы, трансферазы, изомеразы, и лиазы).
Регуляторная. Например, гормоны инсулин и глюкагон регулируют обмен глюкозы. Белки–гистоны участвуют в пространственной организации хроматина, и тем самым влияют на экспрессию генов.
Транспортная. Гемоглобин переносит кислород в крови позвоночных, гемоцианин в гемолимфе некоторых беспозвоночных, миоглобин — в мышцах. Сывороточный альбумин служит для транспорта жирных кислот‚ липидов и т. п. Мембранные транспортные белки обеспечивают активный транспорт веществ через клеточные мембраны (Na+, К+-АТФаза). Цитохромы осуществляют перенос электронов по электронтранспортным цепям митохондрий и хлоропластов.
Защитная. Например, антитела (иммуноглобулины) образуют комплексы с антигенами бактерий и с инородными белками. Интерфероны блокируют синтез вирусного белка в инфицированной клетке. Фибриноген и тромбин участвуют в процессах свертывания крови.
Сократительная (двигательная). Белки актин и миозин обеспечивают процессы мышечного сокращения и сокращения элементов цитоскелета.
Сигнальная (рецепторная). Белки клеточных мембран входят в состав рецепторов и поверхностных антигенов.
Запасающие белки. Казеин молока, альбумин куриного яйца, ферритин (запасает железо в селезенке).
Белки-токсины. Дифтерийный токсин.
Энергетическая функция. При распаде 1 г белка до конечных продуктов обмена (СО2, Н2О, Nh4, Н2S, SО2) выделяется 17‚6 кДж или 4‚2 ккал энергии.
Биосинтез белков идет в каждой живой клетке. Наиболее активен он в молодых растущих клетках, где синтезируются белки на построение их органоидов, а также в секреторных клетках, где синтезируются белки-ферменты и белки-гормоны.
Основная роль в определении структуры белков принадлежит ДНК. Отрезок ДНК, содержащий информацию о структуре одного белка, называют геном. Молекула ДНК содержит несколько сотен генов. В молекуле ДНК записан код о последовательности аминокислот в белке в виде определенно сочетающихся нуклеотидов
Синтез белка — сложный многоступенчатый процесс, представляющий цепь синтетических реакций, протекающих по принципу матричного синтеза.
В биосинтезе белка определяют следующие этапы, идущие в разных частях клетки:
Первый этап — синтез и-РНК происходит в ядре, в процессе которого информация, содержащаяся в гене ДНК, переписывается на и-РНК. Этот процесс называется транскрипцией (от лат. «транскриптик» — переписывание).
На втором этапе происходит соединение аминокислот с молекулами т-РНК, которые последовательно состоят из трех нуклеотидов — антикодонов, с помощью которых определяется свой триплет-кодон.
Третий этап — это процесс непосредственного синтеза полипептидных связей, называемый трансляцией. Он происходит в рибосомах.
На четвертом этапе происходит образование вторичной и третичной структуры белка, то есть формирование окончательной структуры белка.
Таким образом, в процессе биосинтеза белка образуются новые молекулы белка в соответствии с точной информацией, заложенной в ДНК. Этот процесс обеспечивает обновление белков, процессы обмена веществ, рост и развитие клеток, то есть все процессы жизнедеятельности клетки.
Совокупность реакций биологического синтеза называется пластическим обменом, или ассимиляцией. Название этого вида обмена отражает его сущность: из простых веществ, поступающих в клетку извне, образуются вещества, подобные веществам клетки.
Рассмотрим одну из важнейших форм пластического обмена – биосинтез белков. Все многообразие свойств белков в конечном счете определяется первичной структурой, т. е. последовательностью аминокислот. Огромное количество отобранных эволюцией уникальных сочетаний аминокислот воспроизводится путем синтеза нуклеиновых кислот с такой последовательностью азотистых оснований, которая соответствует последовательности аминокислот в белках. Каждой аминокислоте в полипептидной цепочке соответствует комбинация из трех нуклеотидов – триплет.
Процесс реализации наследственной информации в биосинтезе осуществляется при участии трех видов рибонуклеиновых кислот: информационной (матричной) – иРНК (мРНК), рибосомальной – рРНК и транспортной – тРНК. Все рибонуклеиновые кислоты синтезируются на соответствующих участках молекулы ДНК. Они имеют значительно меньшие размеры, чем ДНК, и представляют собой одинарную цепь нуклеотидов. Нуклеотиды содержат остаток фосфорной кислоты (фосфат), пентозный сахар (рибозу) и одно из четырех азотистых оснований – аденин, цитозин, гуанин и урацил. Азотистое основание – урацил – комплементарно аденину.
Процесс биосинтеза сложный и включает ряд этапов – транскрипцию, сплайсинг и трансляцию.
Первый этап (транскрипция) происходит в ядре клетки: на участке определенного гена молекулы ДНК синтезируется мРНК. Этот синтез осуществляется при участии комплекса ферментов, главным из которых является ДНК-зависимая РНК-полимераза, которая прикрепляется к начальной (инициальной) точке молекулы ДНК, расплетает двойную спираль и, перемещаясь вдоль одной из нитей, синтезирует рядом с ней комплементарную нить мРНК. В результате транскрипции мРНК содержит генетическую информацию в виде последовательного чередования нуклеотидов, порядок которых точно скопирован с соответствующего участка (гена) молекулы ДНК.
Дальнейшие исследования показали, что в процессе транскрипции синтезируется так называемая про-мРНК – предшественник зрелой мРНК, участвующей в трансляции. Про-мРНК имеет значительно большие размеры и содержит фрагменты, не кодирующие синтез соответствующей полипептидной цепи. В ДНК наряду с участками, кодирующими рРНК, тРНК и полипептиды, имеются фрагменты, не содержащие генетической информации. Они получили название интронов в отличие от кодирующих фрагментов, которые называются экзонами. Интроны обнаружены на многих участках молекул ДНК. Так, например, в одном гене – участке ДНК, кодирующем овальбумин курицы, содержится 7 интронов, в гене сывороточного альбумина крысы – 13 интронов. Длина интрона бывает различной – от двухсот до тысячи пар нуклеотидов ДНК. Интроны считываются (транскрибируются) одновременно с экзонами, поэтому про-мРНК значительно длиннее, чем зрелая мРНК. В ядре в про-мРНК специальными ферментами вырезаются интроны, а фрагменты экзона «сращиваются» между собой в строгом порядке. Этот процесс называют сплайсингом. В процессе сплайсинга образуется зрелая мРНК, которая содержит только ту информацию, которая необходима для синтеза соответствующего полипептида, то есть информативную часть структурного гена.
Значение и функции интронов до сих пор еще не совсем выяснены, но установлено, что, если в ДНК считываются только участки экзонов, зрелая мРНК не образуется. Процесс сплайсинга изучен на примере работы гена овальбумина. Он содержит один экзон и 7 интронов. Сначала на ДНК синтезируется про-мРНК, содержащая 7700 нуклеотидов. Затем в про-мРНК число нуклеотидов уменьшается до 6800, затем — до 5600, 4850, 3800, 3400 и т. д. до 1372 нуклеотидов, соответствующих экзону. Содержащая 1372 нуклеотида мРНК выходит из ядра в цитоплазму, попадает на рибосому и синтезирует соответствующий полипептид.
Следующий этап биосинтеза – трансляция – происходит в цитоплазме на рибосомах при участии тРНК.
Транспортные РНК синтезируются в ядре, но функционируют в свободном состоянии в цитоплазме клетки. Одна молекула тРНК содержит 76-85 нуклеотидов и имеет довольно сложную структуру, напоминающую клеверный лист. Три участка тРНК имеют особо важное значение: 1) антикодон, состоящий из трех нуклеотидов, определяющий место прикрепления тРНК к соответствующему комплементарному кодону (мРНК) на рибосоме; 2) участок, определяющий специфичность тРНК, способность данной молекулы прикрепляться только к определенной аминокислоте; 3) акцепторный участок, к которому прикрепляется аминокислота. Он одинаков для всех тРНК и состоит из трех нуклеотидов – Ц-Ц-А. Присоединению аминокислоты к тРНК предшествует ее активация ферментом аминоацил-тРНК-синтетазой. Этот фермент специфичен для каждой аминокислоты. Активированная аминокислота прикрепляется к соответствующей тРНК и доставляется ею на рибосому.
Центральное место в трансляции принадлежит рибосомам – рибонуклеопротеиновым органоидам цитоплазмы, во множестве в ней присутствующим. Размеры рибосом у прокариот в среднем 30х30х20 нм, у эукариот – 40х40х20 нм. Обычно их размеры определяют в единицах седиментации (S) – скорости осаждения при центрифугировании в соответствующей среде. У бактерии кишечной палочки рибосома имеет величину 70Sи состоит из двух субчастиц, одна из которых имеет константу 30S, вторая 50S, и содержит 64 % рибосомальной РНК и 36 % белка.
Молекула мРНК выходит из ядра в цитоплазму и прикрепляется к малой субчастице рибосомы. Трансляция начинается с так называемого стартового кодона (инициатора синтеза) – А-У-Г-. Когда тРНК доставляет к рибосоме активированную аминокислоту, ее антикодон соединяется водородными связями с нуклеотидами комплементарного кодона мРНК. Акцепторный конец тРНК с соответствующей аминокислотой прикрепляется к поверхности большой субчастицы рибосомы. После первой аминокислоты другая тРНК доставляет следующую аминокислоту, и таким образом на рибосоме синтезируется полипептидная цепь. Молекула мРНК обычно работает сразу на нескольких (5-20) рибосомах, соединенных в полисомы. Начало синтеза полипептидной цепи называют инициацией, рост ее – элонгацией. Последовательность аминокислот в полипептидной цепи определяется последовательностью кодонов в мРНК. Синтез полипептидной цепи прекращается, когда на мРНК появляется один из кодонов-терминаторов – УАА, УАГ или УГА. Окончание синтеза данной полипептидной цепи называется терминацией.
Установлено, что в клетках животных полипептидная цепь за одну секунду удлиняется на 7 аминокислот, а мРНК продвигается на рибосоме на 21 нуклеотид. У бактерий этот процесс протекает в два-три раза быстрее.
Следовательно, синтез первичной структуры белковой молекулы – полипептидной цепи – происходит на рибосоме в соответствии с порядком чередования нуклеотидов в матричной рибонуклеиновой кислоте – мРНК. Она не зависит от строения рибосомы.
Главным вопросом генетики является вопрос о синтезе белка. Обобщив данные по строению и синтезу ДНК и РНК, Крик в 1960г. предложил матричную теорию синтеза белков, основанную на 3–х положениях:
1. Комплементарность азотистых оснований ДНК и РНК.
2. Линейная последовательность расположения генов в молекуле ДНК.
3. Передача наследственной информации может происходить только с нуклеиновой кислоты на нуклеиновую или на белок.
С белка на белок передача наследственной информации невозможна. Таким образом матрицей для синтеза белка могут быть только нуклеиновые кислоты.
Для синтеза белка необходимы:
1. ДНК (гены) на которых синтезируются молекулы.
2. РНК – (и-РНК) или (м-РНК), р-РНК, т-РНК
В процессе синтеза белка различают этапы: транскрипции и трансляции.
Транскрипция – перепись (переписывание) информации о нуклеиновом строении с ДНК на РНК (т-РНК, и РНК, р-РНК).
Считывание наследственной информации начинается с определенного участка ДНК, который называется промотором. Промотор расположен перед геном и включает около 80 нуклеотидов.
На наружной цепи молекулы ДНК синтезируется и-РНК (промежуточная) служащая матрицей для синтеза белков и поэтому называется матричной. Она является точной копией последовательности нуклеотидов на цепи ДНК.
В ДНК имеются участки, которые не содержат генетической информации (интроны). Участки ДНК содержащие информацию называются экзонами.
В ядре имеются специальные ферменты, вырезающие интроны, а фрагменты экзона «сращиваются» между собой в строгом порядке в общую нить, этот процесс называется «сплайсингом». В процессе сплайсинга образуется зрелая м-РНК, содержащая информацию, необходимую для синтеза белка. Зрелая и-РНК (матричная РНК) проходит через поры ядерной мембраны и поступает в каналы эндоплазматической сети (цитоплазму) и здесь соединяется с рибосомами.
Трансляция – последовательность расположения нуклеотидов в и-РНК, переводится в строго упорядоченную последовательность расположения аминокислот в молекуле синтезируемого белка.
Процесс трансляции включает 2 этапа: активирование аминокислот и непосредственно синтез белковой молекулы.
Одна молекула м-РНК соединяется с 5-6 рибосомами, образуя полисомы. Синтез белка происходит на молекуле м-РНК, причем рибосомы продвигаются вдоль нее. В этот период находящиеся в цитоплазме аминокислоты активируются специальными ферментами, выделяемыми ферментами, выделяемыми митохондриями причем каждая из них своим специфическим ферментом.
Почти моментально аминокислоты связываются с другим видом РНК – низкомолекулярной растворимой, выполняющий функции переносчика аминокислот к молекуле м-РНК и получившей название транспортной (т-РНК). т-РНК переносит аминокислоты к рибосомам на определенное место, где к этому времени оказывается молекула м-РНК. Затем аминокислоты соединяются между собой пептидными связями и образуется белковая молекула. К концу синтеза белка молекула постепенно сходит с м-РНК.
На одной молекуле м-РНК образуется 10-20 молекул белка, а в некоторых случаях и много больше.
Наиболее неясным в синтезе белков вопрос о том, как т-РНК находит соответствующий участок м-РНК, к которому должна быть присоединена приносимая ею аминокислота.
Последовательность расположения азотистых оснований в ДНК, определяющая размещение аминокислот в синтезируемом белке – генетический код.
Поскольку одна и та же наследственная информация «записана» в нуклеиновых кислотах четырьмя знаками (азотистыми основаниями), а в белках – двадцатью (аминокислотами). Проблема генетического кода сводится к установлению соответствия между ними. Большую роль в расшифровке генетического кода сыграли генетики, физики, химики.
Для расшифровки генетического кода прежде всего необходимо было выяснить какое минимальное число нуклеотидов может определять (кодировать) образование одной аминокислоты. Если бы каждая из 20 аминокислот кодировалась одним основанием, то ДНК должна была бы иметь 20 различных оснований, фактически же их только 4. Очевидно, сочетание двух нуклеотидов также недостаточно для кодирования 20 аминокислот. Оно может кодировать лишь 16 аминокислот 4 2 = 16.
Тогда было предложено, что код включает 3 нуклеотида 4 3 = 64 комбинации и следовательно, способно кодировать более чем достаточное число аминокислот для образования любых белков. Такое сочетание трех нуклеотидов называется триплетным кодом.
Код имеет следующие свойства:
1.Генетический код триплетный (каждая аминокислота кодируется тремя нуклеотидами).
2.Вырожденность – одна аминокислота может кодироваться несколькими триплетами, исключение составляет триптофан и метионин.
3.В кодонах для одной аминокислоты первые два нуклеотида одинаковы, а третий изменяется.
4.Неперекрывающийся – триплеты не перекрывают друг друга. Один триплет не может входить в состав другого, каждый из них самостоятельно кодирует свою аминокислоту. Поэтому в полипептидной цепи рядом могут находиться любые две аминокислоты и возможны какие угодно их сочетания, т.е. в последовательности оснований ABCDEFGHI, первые три основания кодируют 1 аминокислоту (ABC-1), (DEF-2) и т.д.
5.Универсален, т.е. у всех организмов для определенных аминокислот кодоны одинаковы (от ромашки до человека). Универсальность кода свидетельствует о единстве жизни на земле.
6.Коленеарность – совпадение расположения кодонов в и-РНК с порядком расположения аминокислот в синтезирующийся полипептидной цепи.
Кодон – триплет нуклеотидов, кодирующий 1 аминокислоту.
7.Бессмысленный – он не кодирует никакой аминокислоты. Синтез белка на этом месте прерывается.
В последние годы выяснилось, что в митохондриях нарушается универсальность генетического кода, четыре кодона в митохондриях изменили свой смысл, например, кодон УГА – отвечает триптофану вместо «СТОП» — прекращение синтеза белка. АУА – соответствует метионину – вместо «изолейцина».
Открытие новых кодонов у митохондрий может служить доказательством того, что код эволюционировал, и что он не сразу стал таким.
Пусть наследственной информации от гена к молекуле белка можно выразить схематически.
ДНК – РНК – белок
Изучение химического состава клеток показал, что различные ткани одного и того же организма содержат различный набор белковых молекул, хотя они имеют и одинаковое количество хромосом, и одинаковую генетическую наследственную информацию.
Отметим такое обстоятельство: несмотря на наличие в каждой клетке всех генов целого организма, в отдельной клетке работают очень немногие гены – от десятых долей до нескольких процентов от общего числа. Остальные же участки «молчат», они заблокированы специальными белками. Это и понятно, зачем, например, генам гемоглобина работать в нервной клетке? То как клетка диктует, каким генам молчать, а каким работать, следует предполагать, что в клетке имеется какой-то совершенный механизм, регулирующий активность генов определяющий, какие гены в данный момент должны быть активными и каким следует находиться в неактивном (репрессивном) состоянии. Такой механизм по данным французских ученых Ф. Жакобо и Ж. Моно получил название индукции и репрессии.
Индукция – возбуждение белкового синтеза.
Репрессия – подавление белкового синтеза.
Индукция обеспечивает работу тех генов, которые синтезируют белок или фермент, и который необходим на данном этапе жизнедеятельности клетки.
У животных важную роль в процессе регуляции генов играют гормоны клеточные мембраны; у растений – условия внешней среды и другие высокоспециализированные индукторы.
Пример: при добавлении гормона щитовидной железы в среду совершается быстрое превращение головастиков в лягушек.
Для нормальной жизнедеятельности бактерии Е (Coli) необходим молочный сахар (лактоза). Если среда, в которой находятся бактерии, лактозы не содержит, эти гены находятся в репрессивном состоянии (т.е. они не функционируют). Внесенная в среду лактоза является индуктором, включающим в работу гены, отвечающих за синтез ферментов. После удаления лактозы из среды синтез этих ферментов прекращается. Таким образом, роль репрессора может выполнять вещество, которое синтезируется в клетке, и если его содержание превышает норму или оно израсходовано.
В синтезе белка или ферментов участвуют различные типы генов.
Все гены находятся в молекуле ДНК.
По своим функциям они не одинаковы:
— структурные – гены, влияющие на синтез какого-то фермента или белка, расположены в молекуле ДНК последовательно друг за другом в порядке их влияния на ход реакции синтеза или еще можно сказать структурные гены – это гены, которые несут информацию о последовательности аминокислот.
— акцепторные – гены не несут наследственной информации о строении белка, они регулируют работу структурных генов.
Перед группой структурных генов расположен общий для них ген – оператор, а перед ним – промотор . В целом эта функциональная группа называется опереном.
Вся группа генов одного оперона включается в процесс синтеза и выключается из него одновременно. Включение и выключение структурных генов составляет сущность всего процесса регуляции.
Функцию включения и выключения выполняет особый участок молекулы ДНК – ген оператор. Ген оператор является начальной точкой синтеза белка или как говорят «считывания» генетической информации. дальше в той же молекуле на некотором расстоянии расположен ген – регулятор, под контролем которого вырабатывается белок называемый репрессором.
Из всего сказанного видно, что синтез белка происходит очень сложно. Генетическая система клетки, используя механизмы репрессии и индукции, может принимать сигналы о необходимости начала и окончания синтеза того или иного фермента и осуществлять этот процесс с заданной скоростью.
Проблема регуляции действия генов у высших организмов имеет большое практическое значение в животноводстве и медицине. Установление факторов, регулирующих синтез белка, раскрыло бы широкие возможности управления онтогенезом, создания высокопродуктивных животных, а также устойчивых животных к наследственным заболеваниям.
Контрольные вопросы:
1.Назовите свойства генов.
2.Что такое ген?
3.Назовите каково биологическое значение ДНК, РНК.
4.Назовите этапы синтеза белка
5.Перечислите свойства генетического кода.
Биосинтез белков идет в каждой живой клетке. Наиболее активен он в молодых растущих клетках, где синтезируются белки на построение их органоидов, а также в секреторных клетках, где синтезируются белки-ферменты и белки-гормоны.
Основная роль в определении структуры белков принадлежит ДНК. Отрезок ДНК, содержащий информацию о структуре одного белка, называют геном . Молекула ДНК содержит несколько сотен генов. В молекуле ДНК записан код о последовательности аминокислот в белке в виде определенно сочетающихся нуклеотидов. Код ДНК удалось расшифровать почти полностью. Сущность его состоит в следующем. Каждой аминокислоте соответствует участок цепи ДНК из трех рядом стоящих нуклеотидов.
Например, участок Т-Т-Т соответствует аминокислоте лизину, отрезок А-Ц-А — цистину, Ц-А-А — валину н т. д. Разных аминокислот — 20, число возможных сочетаний из 4 нуклеотидов по 3 равно 64. Следовательно, триплетов с избытком хватает для кодирования всех аминокислот.
Синтез белка — сложный многоступенчатый процесс, представляющий цепь синтетических реакций, протекающих по принципу матричного синтеза.
Поскольку ДНК находится в ядре клетки, а синтез белка происходит в цитоплазме, существует посредник, передающий информацию с ДНК на рибосомы. Таким посредником является и-РНК.
В биосинтезе белка определяют следующие этапы, идущие в разных частях клетки:
- Первый этап — синтез и-РНК происходит в ядре, в процессе которого информация, содержащаяся в гене ДНК, переписывается на и-РНК. Этот процесс называется транскрипцией (от лат. «транскриптик» — переписывание).
- На втором этапе происходит соединение аминокислот с молекулами т-РНК, которые последовательно состоят из трех нуклеотидов — антикодон ов, с помощью которых определяется свой триплет-кодон.
- Третий этап — это процесс непосредственного синтеза полипептидных связей, называемый трансляцией . Он происходит в рибосомах.
- На четвертом этапе происходит образование вторичной и третичной структуры белка, то есть формирование окончательной структуры белка .
Синтез информационной РНК (и-РНК) происходит в ядре. Он осуществляется по одной из нитей ДНК с помощью ферментов и с учетом принципа комплиментарности азотистых оснований. Процесс переписывания информации, содержащейся в генах ДНК на синтезируемую молекулу и-РНК называется транскрипцией . Очевидно, что информация переписывается в виде последовательности нуклеотидов РНК. Нить ДНК в этом случае выступает в качестве матрицы. В молекулу РНК в процессе ее образования вместо азотистого основания – тимина включается урация.
Г — Ц — А — А — Ц — Т – фрагмент одной из цепочек молекулы ДНК- Ц — Г — У — У — Г — А – фрагмент молекулы информационной РНК.
Молекулы РНК индивидуальны, каждая из них несет информацию об одном гене. Далее молекулы и-РНК выходят из ядра клетки через поры оболочки ядра и направляются в цитоплазму к рибосомам. Сюда же с помощью транспортных РНК (т-РНК) доставляются аминокислоты. Молекула т-РНК состоит из 70–80 нуклеотидов. Общий вид молекулы напоминает лист клевера.
На «верхушке» листа расположен антикодон (кодовый триплет нуклеотидов), который соответствует определенной аминокислоте. Следовательно, для каждой аминокислоты существует своя, конкретная т-РНК. Процесс сборки молекулы белка идет в рибосомах и называется трансляцией . На одной молекуле и-РНК последовательно располагаются несколько рибосом. В функциональном центре каждой рибосомы способны поместиться два триплета и-РНК. Кодовый триплет нуклеотидов – молекулы т-РНК, подошедшей к месту синтеза белка, соответствует триплету нуклеотидов и-РНК, находящемуся в данный момент в функциональном центре рибосомы. Тогда рибосома по цепочке и-РНК делает шаг, равный трем нуклеотидам. Аминокислота отделяется от т-РНК и становится в цепочку мономеров белка. Освободившаяся т-РНК уходит в сторону и через некоторое время может снова соединиться с определенной кислотой, которую будет транспортировать к месту синтеза белка . Таким образом, последовательность нуклеотидов в триплете ДНК соответствует последовательности нуклеотидов в триплете и-РНК.
В сложнейшем процессе биосинтеза белка реализуются функции многих веществ и органоидов клетки.
Таким образом, в процессе биосинтеза белка образуются новые молекулы белка в соответствии с точной информацией, заложенной в ДНК. Этот процесс обеспечивает обновление белков, процессы обмена веществ, рост и развитие клеток, то есть все процессы жизнедеятельности клетки.
1. Какие функции выполняют в клетке белки?
Ответ. Белки играют исключительно большую роль в процессах жизнедеятельности клетки и организма, им свойственны следующие функции.
1. Структурная. Входят в состав внутриклеточных структур‚ тканей и органов. Например, коллаген и эластин служат компонентами соединительной ткани: костей‚ сухожилий‚ хрящей; фиброин входит в состав шелка‚ паутины; кератин входит в состав эпидермиса и его производных (волосы‚ рога‚ перья). Образуют оболочки (капсиды) вирусов.
2. Ферментативная. Все химические реакции в клетке протекают при участии биологических катализаторов — ферментов (оксидоредуктазы, гидролазы, лигазы, трансферазы, изомеразы, и лиазы).
3. Регуляторная. Например, гормоны инсулин и глюкагон регулируют обмен глюкозы. Белки–гистоны участвуют в пространственной организации хроматина, и тем самым влияют на экспрессию генов.
4. Транспортная. Гемоглобин переносит кислород в крови позвоночных, гемоцианин в гемолимфе некоторых беспозвоночных, миоглобин — в мышцах. Сывороточный альбумин служит для транспорта жирных кислот‚ липидов и т. п. Мембранные транспортные белки обеспечивают активный транспорт веществ через клеточные мембраны. Цитохромы осуществляют перенос электронов по электронтранспортным цепям митохондрий и хлоропластов.
5. Защитная. Например, антитела (иммуноглобулины) образуют комплексы с антигенами бактерий и с инородными белками. Интерфероны блокируют синтез вирусного белка в инфицированной клетке. Фибриноген и тромбин участвуют в процессах свертывания крови.
6. Сократительная (двигательная). Белки актин и миозин обеспечивают процессы мышечного сокращения и сокращения элементов цитоскелета.
7. Сигнальная (рецепторная). Белки клеточных мембран входят в состав рецепторов и поверхностных антигенов.
Запасающие белки. Казеин молока, альбумин куриного яйца, ферритин (запасает железо в селезенке).
8. Белки-токсины. Дифтерийный токсин.
9. Энергетическая функция. При распаде 1 г белка до конечных продуктов обмена (СО2, Н2О, Nh4, Н2S, SО2) выделяется 17‚6 кДж или 4‚2 ккал энергии.
2. Из чего состоят белки?
Ответ. Белки́ — высокомолекулярные органические вещества, состоящие из аминокислот, соединённых в цепочку пептидной связью. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций создают молекулы белков с большим разнообразием свойств.
Вопросы после §26
1. Что такое ген?
Ответ. Ген — материальный носитель наследственной информации, совокупность которых родители передают потомкам во время размножения. В настоящее время, в молекулярной биологии установлено, что гены — это участки ДНК, несущие какую-либо целостную информацию — о строении одной молекулы белка или одной молекулы РНК. Эти и другие функциональные молекулы определяют рост и функционирование организма.
2. Какой процесс называется транскрипцией?
Ответ. Носителем генетической информации является ДНК, расположенная в клеточном ядре. Сам же синтез белка происходит в цитоплазме на рибосомах. Из ядра в цитоплазму информация о структуре белка поступает в виде информационной РНК (иРНК). Для того чтобы синтезировать иРНК, участок двуцепочечной ДНК раскручивается, а затем на одной из цепочек ДНК по принципу комплементарности синтезируется молекула иРНК. Это происходит следующим образом: против, например, Г молекулы ДНК становится Ц молекулы РНК, против А молекулы ДНК – У молекулы РНК (вспомните, что вместо тимина РНК несет урацил, или У), против Т молекулы ДНК – А молекулы РНК и против Ц молекулы ДНК – Г молекулы РНК. Таким образом, формируется цепочка иРНК, представляющая собой точную копию второй (нематричной) цепочки ДНК (только вместо тимина включен урацил). Так информация о последовательности аминокислот в белке переводится с «языка ДНК» на «язык РНК». Этот процесс получил название транскрипции.
3. Где и как происходит биосинтез белка?
Ответ. В цитоплазме происходит процесс синтеза белка, который по-другому называют трансляцией. Трансляция – это перевод последовательности нуклеотидов молекулы иРНК в последовательность аминокислот молекулы белка. С тем концом иРНК, с которого должен начаться синтез белка, взаимодействует рибосома. При этом начало будущего белка обозначается триплетом АУГ, который является знаком начала трансляции. Так как этот кодон кодирует аминокислоту метионин, то все белки (за исключением специальных случаев) начинаются с метионина. После связывания рибосома начинает двигаться по иРНК, задерживаясь на каждом ее участке, который включает в себя два кодона (т. е. 3 + 3 = 6 нуклеотидов). Время задержки составляет всего 0,2 с. За это время молекула тРНК, антикодон которой комплементарен кодону, находящемуся в рибосоме, успевает распознать его. Та аминокислота, которая была связана с этой тРНК, отделяется от «черешка» и присоединяется с образованием пептидной связи к растущей цепочке белка. В тот же самый момент к рибосоме подходит следующая тРНК, антикодон которой комплементарен следующему триплету в иРНК, и следующая аминокислота, принесенная этой тРНК, включается в растущую цепочку. После этого рибосома сдвигается по иРНК, задерживается на следующих нуклеотидах, и все повторяется сначала.
4. Что такое стоп-кодон?
Ответ. Стоп-кодоны (УАА, УАГ или УГА) не кодируют аминокислот, они только лишь показывают, что синтез белка должен быть завершен. Белковая цепочка отсоединяется от рибосомы, выходит в цитоплазму и формирует присущую этому белку вторичную, третичную и четвертичную структуры
5. Сколько видов тРНК участвует в синтезе белков в клетке?
Ответ. Не менее 20 (количество аминокислот) , не более 61 (количество смысловых кодонов). Обычно около 43 тРНК у прокариот. У человека около 50 различных тРНК обеспечивают включение аминокислот в белок.
6. Из чего состоит полисома?
Ответ. Клетке необходима не одна, а много молекул каждого белка. Поэтому как только рибосома, первой начавшая синтез белка на молекуле иРНК, продвигается вперед, тут же на эту иРНК нанизывается вторая рибосома, которая начинает синтезировать такой же белок. На ту же иРНК может быть нанизана и третья, и четвертая рибосома, и т. д. Все рибосомы, синтезирующие белок на одной молекуле иРНК, называются полисомой.
7. Требуют ли процессы синтеза белка затрат энергии? Или, наоборот, в процессах синтеза белка происходит выделение энергии?
Ответ. Как любой синтетический процесс, синтез белка — это эндотермическая реакция и, значит, требует энергозатрат. Биосинтез белка представляет цепь синтетических реакций: 1) синтез и-РНК; 2) соединение аминокислот с т-РНК; 3) «сборку белка». Все эти реакции требуют больших энергетических затрат — до 24,2 ккал/моль. Энергия для синтеза белка обнеспечивается реакцией расщепления АТФ.
Структура белка | Изучайте науку в Scitable
Строительными блоками белков являются аминокислоты, которые представляют собой небольшие органические молекулы, состоящие из альфа (центрального) атома углерода, связанного с аминогруппой, карбоксильной группы, атома водорода и вариабельного компонента, называемого боковой цепью (см. Ниже ). Внутри белка несколько аминокислот связаны между собой пептидными связями , тем самым образуя длинную цепь. Пептидные связи образуются в результате биохимической реакции, которая извлекает молекулу воды, поскольку она соединяет аминогруппу одной аминокислоты с карбоксильной группой соседней аминокислоты.Линейная последовательность аминокислот в белке считается первичной структурой белка.
Белки состоят из набора всего из двадцати аминокислот, каждая из которых имеет уникальную боковую цепь. Боковые цепи аминокислот имеют разный химический состав. Самая большая группа аминокислот имеет неполярные боковые цепи. Некоторые другие аминокислоты имеют боковые цепи с положительным или отрицательным зарядом, тогда как другие имеют полярные, но незаряженные боковые цепи. Химический состав боковых цепей аминокислот имеет решающее значение для структуры белка, потому что эти боковые цепи могут связываться друг с другом, чтобы удерживать длину белка в определенной форме или конформации.Боковые цепи заряженных аминокислот могут образовывать ионные связи, а полярные аминокислоты способны образовывать водородные связи. Гидрофобные боковые цепи взаимодействуют друг с другом посредством слабых ван-дер-ваальсовых взаимодействий. Подавляющее большинство связей, образованных этими боковыми цепями, нековалентны. Фактически, цистеины — единственные аминокислоты, способные образовывать ковалентные связи, что они и делают со своими конкретными боковыми цепями. Из-за взаимодействий боковых цепей последовательность и расположение аминокислот в конкретном белке определяют, где в этом белке происходят изгибы и складки (рис. 1).
Рисунок 1: Взаимосвязь между боковыми цепями аминокислот и конформацией белка
Определяющим признаком аминокислоты является ее боковая цепь (вверху, синий кружок; внизу, все цветные кружки). Когда аминокислоты соединяются серией пептидных связей, они образуют полипептид, другое слово для обозначения белка. Затем полипептид сворачивается в определенную конформацию в зависимости от взаимодействий (пунктирные линии) между его боковыми аминокислотными цепями.
Рисунок 2: Структура белка бактериородопсина
Бактериородопсин — это мембранный белок бактерий, который действует как протонная помпа. Его соответствие важно для его функции. Общая структура белка включает как альфа-спирали (зеленый), так и бета-листы (красный).
Первичная структура белка — его аминокислотная последовательность — управляет складыванием и внутримолекулярным связыванием линейной аминокислотной цепи, что в конечном итоге определяет уникальную трехмерную форму белка. Водородная связь между аминогруппами и карбоксильными группами в соседних областях белковой цепи иногда вызывает определенные паттерны сворачивания. Эти стабильные паттерны сворачивания, известные как альфа-спирали и бета-листов , составляют вторичную структуру белка.Большинство белков содержат несколько спиралей и листов в дополнение к другим, менее распространенным паттернам (рис. 2). Совокупность образований и складок в единой линейной цепи аминокислот, иногда называемой полипептидом , составляет третичную структуру белка. Наконец, четвертичная структура белка относится к тем макромолекулам с множеством полипептидных цепей или субъединиц.Окончательная форма, принятая вновь синтезированным белком, обычно является наиболее энергетически выгодной.Когда белки сворачиваются, они тестируют множество конформаций, прежде чем достичь своей окончательной формы, которая является уникальной и компактной. Сложенные белки стабилизированы тысячами нековалентных связей между аминокислотами. Кроме того, химические силы между белком и его ближайшим окружением способствуют формированию и стабильности белка. Например, белки, которые растворены в цитоплазме клетки, имеют на своей поверхности гидрофильные (водолюбивые) химические группы, тогда как их гидрофобные (водоотталкивающие) элементы имеют тенденцию скрываться внутри.Напротив, белки, которые вставлены в клеточные мембраны, имеют на своей поверхности некоторые гидрофобные химические группы, особенно в тех областях, где поверхность белка подвергается воздействию липидов мембран. Однако важно отметить, что полностью свернутые белки не принимают форму. Скорее, атомы в этих белках остаются способными совершать небольшие движения.
Несмотря на то, что белки считаются макромолекулами, они слишком малы, чтобы их можно было визуализировать даже в микроскоп.Итак, ученые должны использовать косвенные методы, чтобы выяснить, как они выглядят и как сложены. Наиболее распространенным методом исследования структуры белков является рентгеновская кристаллография . С помощью этого метода твердые кристаллы очищенного протеина помещаются в рентгеновский луч, а диаграмма отклоненных рентгеновских лучей используется для прогнозирования положений тысяч атомов внутри протеинового кристалла.
Ген к белку
Ген к белкуОТ ГЕН БЕЛКА
Информационное содержание ДНК находится в форма специфических последовательностей нуклеотидов.
- ДНК диктует синтез белков,
которые являются связями между генотипом и фенотипом.
Симптомы наследственного заболевания отражают неспособность человека синтезировать определенный фермент.
Один ген — один фермент гипотеза, но не все белки являются ферментами, но их синтез зависит от конкретных генов.
Один ген — один белок Гипотеза , но много белков состоят из нескольких полипептидов, каждый из которых имеет свои ген.Таким образом, гипотеза была переформулирована как один ген — гипотеза одного полипептида .
Транскрипция и перевод
два основных процесса, связывающих ген с белком
Мост между ДНК и белком
синтез РНК .
- РНК химически похожа на ДНК,
за исключением того, что он содержит рибозу в качестве сахара и заменителей
азотистое основание урацил для тимина.
Молекула РНК почти всегда состоит из одиночной цепи .
Конкретная последовательность из сотен или тысяч нуклеотидов в каждом гене несет информацию о первичной структуре белка, линейный порядок из 20 возможных аминокислот.
Чтобы перейти от ДНК, записанной на одном химическом языке, к белку, написано в другом, требует двух основных этапов, транскрипции и перевод .
Во время транскрипции , нить ДНК обеспечивает матрицу для синтеза комплементарной цепи РНК.Инжир. 17,2
- Этот процесс используется для синтеза
любой тип РНК из матрицы ДНК.
Транскрипция гена дает матричную РНК ( мРНК ) молекула.
Во время перевода , информация содержится в порядке нуклеотидов в мРНК, используется для определения аминокислотная последовательность полипептида.
- Трансляция происходит на рибосомах .
Базовая механика транскрипции и перевода схожа. у эукариот и прокариот.
Поскольку у бактерий отсутствуют ядра, транскрипция и трансляция невозможны. спаренный.
В эукариотической клетке почти вся транскрипция происходит в ядро и трансляция происходит в основном на рибосомах в цитоплазме.
Кроме того, перед первичной расшифровкой может покинуть ядро модифицируется различными способами в процессе обработки РНК до того, как готовая мРНК будет экспортирована в цитоплазму.
ДНК -> РНК -> белок.
Нуклеотидные триплеты указать аминокислоты
- В тройке код , три
последовательные основания определяют аминокислоту, создавая 43 (64) возможных
кодовые слова. Инжир.
17.3.
Во время транскрипции одна цепь ДНК, матричная цепь , предоставляет шаблон для упорядочивания последовательности нуклеотидов в транскрипте РНК.
Урацил является основанием, дополнительным к аденину.
При трансляции блоки из трех нуклеотидов, кодонов , расшифровываются в последовательность аминокислот. Кодоны читаются в направлении 5 ‘-> 3’ вдоль мРНК.
Каждый кодон указывает, какая из 20 аминокислот будет включены в соответствующее положение вдоль полипептида.
Ниренберг определил первый матч: UUU кодируется для фенилаланина аминокислоты.
- Он создал искусственную молекулу мРНК
полностью из урацила и добавил его в пробирку смесь амино
кислоты, рибосомы и другие компоненты для синтеза белка.
Этот «поли (U)» переведен в полипептид, содержащий единственная аминокислота, фениаланин, в длинной цепи.
К середине 1960-х весь код расшифровано. Инжир 17.4.
- 61 из 64 триплетов — код для аминокислот.
Кодон AUG не только кодирует аминокислоту метионин, но и также указывает на начало перевода.
Три кодона не указывают на аминокислоты, но сигнализируют об окончании перевода.
Для извлечения сообщения из генетического кода необходимо указать правильная отправная точка .
Это устанавливает рамку считывания и последующие кодоны читаются группами по три нуклеотида.
Генетический код должен возникли очень рано в истории жизни
- Генетический код почти универсален,
разделяют организмы от простейших бактерий до самых сложных
растения и животные.
В лабораторных экспериментах гены можно транскрибировать и транслировать после пересадки от одного вида к другому.
Это позволило запрограммировать бактерии на синтез определенных человеческие белки после вставки соответствующих человеческих генов.
Транскрипция ДНК-направленный синтез РНК. Рис 17.6a
- Информационная РНК транскрибируется с
матричная цепь гена.
РНК-полимераза разделяет нити ДНК и связывает Нуклеотиды РНК на 3′-конце растущего полимера, когда они пара оснований вдоль матрицы ДНК.
Гены читаются 3 ‘-> 5’, создавая 5 ‘-> 3’ молекулу РНК.
Конкретные последовательности нуклеотидов вдоль метки ДНК, где ген транскрипция начинается и заканчивается.
РНК-полимераза присоединяется и инициирует транскрипцию на промотор , «вверх по потоку» информации содержащаяся в гене единица транскрипции .Инжир 17.7
Терминатор сигнализирует об окончании транскрипции.
Бактерии имеют один тип РНК-полимеразы который синтезирует все молекулы РНК.
Эукариоты имеют в своем составе три РНК-полимеразы (I, II и III). ядра.
РНК полимераза II используется для синтеза мРНК.
Транскрипция можно разделить на три этапа : инициирование, удлинение и завершение .
Инициирование — Наличие промотора последовательности определяет, какая цепь спирали ДНК является матрицей.
- Внутри промотора находится пусковой
точка для транскрипции гена.
Промотор также включает сайт связывания для РНК-полимеразы. перед начальной точкой.
У эукариот белки, называемые факторами транскрипции, распознают промоторная область, особенно TATA box , и привязка к промотор.
После связывания с промотором РНК-полимераза связывается с факторы транскрипции для создания инициации транскрипции комплекс .
Удлинение — Затем РНК-полимераза начинает транскрипцию. Инжир 17,6b
- По мере движения РНК-полимеразы по
ДНК, она раскручивает двойную спираль и добавляет нуклеотиды к
3 ‘конец растущей пряди.
За точкой синтеза РНК реформируется двойная спираль. и молекула РНК отслаивается.
Один ген может транскрибироваться одновременно несколькими РНК полимеразы за раз. Это помогает клетке производить закодированный белок. в больших количествах.
Прекращение действия — Транскрипция продолжается до тех пор, пока РНК-полимераза не транскрибирует последовательность терминатора в ДНК.
Транскрипция, фильм!
Эукариотические клетки модифицируют РНК после
транскрипция
На 5′-конце молекулы пре-мРНК, добавлена модифицированная форма гуанина, 5 ‘cap, который помогает защитить мРНК от гидролитических ферментов.Инжир 17. 8.
- На 3 ‘конце фермент добавляет
поли (А) хвост .
Он подавляет гидролиз, способствует прикреплению рибосом и экспорт мРНК из ядра.
Сплайсинг РНК . Инжир 17,9
- Большинство эукариотических генов и их РНК
транскрипты имеют длинные некодирующие участки нуклеотидов.
некодирующих сегментов, интронов , лежат между кодирующими областями, экзонов , которые транслируются в аминокислотные последовательности, плюс последовательности лидера и трейлера.
Сплайсинг РНК удаляет интроны и соединяет экзоны для создания мРНК молекула с непрерывной кодирующей последовательностью.
Это сплайсинг осуществляется с помощью сплайсосомы . Инжир 17.10.
Сплайсосомы состоят из множества белков и нескольких маленьких ядерные рибонуклеопротеины ( snRNPs ).
Каждый snRNP имеет несколько белковых молекул и малых ядер. Молекула РНК (мяРНК ).
В этом процессе мяРНК действует как рибозим , РНК молекула, которая функционирует как фермент.
Сплайсинг РНК, по-видимому, выполняет несколько функций.
1. Некоторые интроны содержат последовательности, контролирующие активность генов в каким-то образом.
2. Может регулировать прохождение мРНК из ядра в цитоплазму.
3. Позволяет одному гену кодировать более одного полипептида.
Альтернативный сплайсинг РНК дает два или более разных полипептида, в зависимости от того, какие сегменты рассматриваются как экзоны.Инжир 19.11.
- Белки часто имеют модульную архитектуру
с дискретными структурными и функциональными областями, называемыми доменами .
Инжир
17.11.
Во многих случаях разные экзоны кодируют разные домены белок.
Интроны увеличивают возможность рекомбинации между двумя аллели гена.
Перетасовка экзонов может привести к новым белкам за счет новых комбинаций функций.
Трансляция РНК-направленная синтез полипептида. Рис 17.12.
Трансферная РНК ( тРНК ) (2-мерное изображение Рис. 17.13a; 3-х мерный и обозначение Рис. 17.13b) переносит аминокислоты из пула цитоплазмы в рибосома.
- Рибосома добавляет каждую аминокислоту
переносится тРНК на растущий конец полипептидной цепи.
Во время трансляции каждый тип тРНК связывает кодон мРНК с соответствующая аминокислота.
Каждая тРНК, поступающая на рибосому, несет определенную аминокислоту на одном конце и имеет специфический триплет нуклеотидов, антикодон , с другой.
Кодон за кодоном, тРНК депонируют аминокислоты в установленном порядке и рибосома объединяет их в полипептидную цепь.
молекул тРНК транскрибируются с ДНК-матриц в ядре. Каждая тРНК используется повторно.
Чтобы подобрать назначенную аминокислоту в цитозоль.
Для депонирования аминокислоты на рибосоме.Кому вернитесь в цитозоль, чтобы подобрать еще одну копию этой аминокислоты.
Антикодоны некоторых тРНК распознают более одного кодона. Правила спаривания оснований между третьими основание кодона и антикодон расслаблены (так называемое колебание ).
- В положении качания, U на антикодоне может связываться с A или G в третьей позиции кодона.
Каждая аминокислота соединяется с правильным тРНК аминоацил-тРНК синтетазой . Инжир 17.14. 20 различных синтетаз соответствуют 20 различным аминокислоты.
- Синтетаза катализирует ковалентный связь между ними, образуя аминоацил-тРНК или активированных аминокислота .
Рибосомы облегчают специфическое связывание антикодонов тРНК с мРНК кодоны.
- Каждая рибосома имеет большой и малый
субъединица. Инжир
17.15
Они состоят из белков и рибосомной РНК ( рРНК ), самая распространенная РНК в клетке.
Каждая рибосома имеет сайт связывания для мРНК и три сайта связывания. для молекул тРНК.
Сайт P содержит тРНК, несущую растущий полипептид. цепь.
Сайт A несет тРНК со следующей аминокислотой.
Разряженные тРНК покидают рибосому в сайте E .
РНК является катализатором образования пептидной связи.
Перевод можно разделить на три этапы : Начало , Удлинение , и Терминация
Инициация объединяет мРНК, тРНК с первой аминогруппой. кислота и две рибосомные субъединицы.Инжир 17.17.
- Во-первых, небольшая субъединица рибосомы связывает
с мРНК и специальной инициаторной тРНК, несущей метионин
и присоединяется к стартовому кодону. AUG = кодон инициатора
Факторы инициации приводят к большой субъединице, такой что инициаторная тРНК занимает P-сайт.
Удлинение состоит из серии трехступенчатых циклов, так как каждая аминокислота добавлен к исходному.Инжир 17.18.
- Распознавание кодонов
Образование пептидной связи
Транслокация
Прекращение действия происходит, когда один из трех стоп-кодонов достигает сайта A. Инжир 17.19.
Обычно одна мРНК используется для создания множества копий полипептида. одновременно.
Множественные рибосомы, полирибосомы , могут тянуться вдоль та же мРНК. Инжир 17.20.
Перевод, фильм!
Во время и после синтеза полипептид скручивается и сворачивается в трехмерная форма спонтанно.
Кроме того, для белков может потребоваться посттрансляционных модификаций .
- Это может потребовать добавок, таких как сахар,
липиды или фосфатные группы аминокислот.
Ферменты могут удалять некоторые аминокислоты или расщеплять весь полипептид цепи.
Два или более полипептида могут соединяться с образованием белка.
Рибосомы свободные и связанные.
Свободные рибосомы взвешиваются в цитозоле и синтезируют белки, которые находятся в цитозоле.
Связанные рибосомы прикрепляются к цитозольной стороне эндоплазматическая сеть. Инжир. 17.21.
- Они синтезируют белки эндомембраны.
система, а также белки, секретируемые из клетки.
Трансляция во всех рибосомах начинается в цитозоле, но полипептид предназначенный для эндомембранной системы или на экспорт, имеет особую Сигнальный пептид Область на ведущем конце или рядом с ним.
Частица распознавания сигнала ( SRP ) связывается с сигнальный пептид и прикрепляет его и его рибосому к рецептору белок в мембране ER.
После связывания SRP уходит и синтез белка возобновляется с растущий полипептид, извивающийся через мембрану в цистернальное пространство через белковые поры.
Используются другие виды сигнальных пептидов для нацеливания полипептидов на митохондрии, хлоропласты, ядро, и другие органеллы, не входящие в эндомембранную систему.
В В этих случаях перевод завершается в цитозоле до того, как полипептид импортируется в органеллу.
РНК играет несколько ролей в ячейке: обзор Таблица 17.1.
Сравнение белков синтез у прокариот (рис. 17.22) и эукариоты (рис. 17.25)
- Одно большое отличие состоит в том, что прокариоты
может транскрибировать и транслировать один и тот же ген одновременно.
Новый белок быстро диффундирует к своему рабочему месту.
У эукариот ядерная оболочка разделяет транскрипцию из перевода.
Кроме того, между этими процессы.
Точечные мутации могут влияют на структуру и функцию белка
Мутации изменения в генетическом материале клетки (или вируса).
- Сюда входят крупномасштабные мутации
в которых затронуты длинные сегменты ДНК (например, транслокации,
дупликации и инверсии).
Химическое изменение всего в одной паре оснований гена дает балла. мутация .
Если они возникают в гаметах или клетках, продуцирующих гаметы, они могут передаваться будущим поколениям.
Например, серповидно-клеточная анемия вызывается мутацией одна пара оснований в гене, который кодирует один из полипептидов гемоглобина. Инжир 17.23
Точечная мутация, приводящая к замене пары комплементарные нуклеотиды с другой парой нуклеотидов называют замена пар оснований .Инжир 17.24a.
Некоторые замены пар оснований практически не влияют на белок функция.
Миссенс-мутации — это мутации, которые все еще кодируют амино кислоты, но измените указанную аминокислоту.
Нонсенс-мутации заменяют аминокислотный кодон на стоп кодон, почти всегда приводящий к нефункциональному белку.
Вставки и Удаления — это добавления или потери пар нуклеотидов в гене.Инжир 17.24b.
Они губительно влияют на образующийся белок. чаще, чем замены.
Если эти мутации не встречаются кратно трем, они вызывают мутация сдвига рамки считывания .
Все нуклеотиды после делеции или вставки будут неправильно сгруппированы в кодоны.
Мутации могут происходить во время репликации ДНК, репарации ДНК или ДНК рекомбинация.
Они называются спонтанными мутациями .
Мутагены химические или физические агенты, которые взаимодействуют с ДНК, вызывая мутации.
- Физические агенты включают высокоэнергетические
излучение, такое как рентгеновские лучи и ультрафиолетовый свет.
Это имеет смысл, потому что большинство канцерогенов являются мутагенными и мутагены канцерогены.
Что такое ген?
- Менделирующая концепция гена взглядов
это как дискретная единица наследования, которая влияет на фенотип.
Ген представляет собой конкретную нуклеотидную последовательность вдоль области Молекула ДНК.
Ген — это участок ДНК, конечным продуктом которого является либо полипептид или молекула РНК.
19.1: Полипептиды и белки — Biology LibreTexts
Цели обучения
- Определите или опишите следующее:
- аминокислота
- Группа «Р»
- пептидная связь
- пептид
- полипептид
- первичная структура белка
- вторичная структура белка
- структура третичного белка
- Четвертичная структура белка
- ген
- Опишите, как первичная структура белка или полипептида в конечном итоге определяет его окончательную трехмерную форму.
- Опишите, как порядок нуклеотидных оснований в ДНК в конечном итоге определяет окончательную трехмерную форму белка или полипептида.
Аминокислоты — строительные блоки для белков. Все аминокислоты содержат аминогруппу или группу NH 2 и карбоксильную (кислотную) группу или группу COOH. В белках обычно содержится 20 различных аминокислот, а на молекулу белка часто приходится 300 и более аминокислот. Каждая аминокислота отличается своей группой «R». Группа «R» аминокислоты представляет собой остаток – молекулы, то есть часть, отличную от аминогруппы, кислотной группы и центрального атома углерода.Каждая аминокислота имеет уникальную группу «R», и уникальные химические свойства аминокислоты зависят от свойств ее группы «R» (рисунок \ (\ PageIndex {1} \)).
Рисунок \ (\ PageIndex {1} \) : аминокислот. Состав аминокислоты.Для образования полипептидов и белков аминокислоты соединяются пептидными связями, в которых амино или NH 2 одной аминокислоты связываются с карбоксильной (кислотной) или COOH-группой другой аминокислоты, как показано на (Рисунок \ ( \ PageIndex {2} \) и рисунок \ (\ PageIndex {3} \)).
Рисунок \ (\ PageIndex {2} \) : Пептидные связи. Пептидная связь образуется, когда аминогруппа одной аминокислоты связывается с карбоксильной группой другой аминокислоты.Пептид — это две или более аминокислоты, соединенные вместе пептидными связями, а полипептид — это цепь из многих аминокислот. Белок содержит один или несколько полипептидов. Следовательно, белки представляют собой длинные цепи аминокислот, удерживаемые вместе пептидными связями.
Рисунок \ (\ PageIndex {3} \) : Образование пептидной связи.Пептидная связь образуется, когда аминогруппа одной аминокислоты связывается с карбоксильной группой другой аминокислоты.Фактический порядок аминокислот в белке называется его первичной структурой (рисунок \ (\ PageIndex {4} \)) и определяется ДНК. Как будет показано далее в этом разделе, ДНК разделена на функциональные единицы, называемые генами. Ген представляет собой последовательность дезоксирибонуклеотидных оснований вдоль одной цепи ДНК, которая кодирует функциональный продукт — определенную молекулу информационной РНК, транспортной РНК или рибосомной РНК.Продукт обычно представляет собой информационную РНК (мРНК), и мРНК в конечном итоге приводит к синтезу полипептида или белка. Поэтому обычно говорят, что порядок дезоксирибонуклеотидных оснований в гене определяет аминокислотную последовательность конкретного белка. Поскольку определенные аминокислоты могут взаимодействовать с другими аминокислотами в одном и том же белке, эта первичная структура в конечном итоге определяет окончательную форму и, следовательно, химические и физические свойства белка.
Рисунок \ (\ PageIndex {4} \) : Первичная структура белка или полипептида.Первичная структура белка или полипептида — это фактическая последовательность его аминокислот. Первичная структура определяется порядком дезоксирибонуклеотидных оснований в генах.Вторичная структура белка обусловлена водородными связями, которые образуются между атомом кислорода одной аминокислоты и атомом азота другой. Это придает белку или полипептиду двумерную форму альфа-спирали или бета-складчатого листа (рис. \ (\ PageIndex {5} \)).
Рисунок \ (\ PageIndex {5} \) : Вторичная структура белка или полипептида.(слева) Вторичная структура белка или полипептида обусловлена водородными связями, образующимися между атомом кислорода одной аминокислоты и атомом азота другой. Есть два возможных типа вторичной структуры: альфа-спираль и бета-лист. В случае альфа-спирали водородная связь заставляет полипептид скручиваться в спираль. В случае бета-листа водородная связь позволяет полипептиду складываться вперед и назад, как складчатый лист. (справа) Вторичная структура белка или полипептида обусловлена водородными связями, образующимися между атомом кислорода одной аминокислоты и атомом азота другой.Есть два возможных типа вторичной структуры: альфа-спираль и бета-лист. В случае альфа-спирали водородная связь заставляет полипептид скручиваться в спираль. В случае бета-листа водородная связь позволяет полипептиду складываться вперед и назад, как складчатый лист.В глобулярных белках, таких как ферменты, длинная цепь аминокислот складывается в трехмерную функциональную форму или третичную структуру. Это связано с тем, что определенные аминокислоты с сульфгидрильными или SH-группами образуют дисульфидные (S-S) связи с другими аминокислотами в той же цепи.Другие взаимодействия между R-группами аминокислот, такие как водородные связи, ионные связи, ковалентные связи и гидрофобные взаимодействия, также вносят вклад в третичную структуру (рисунок \ (\ PageIndex {6} \)). В некоторых белках, таких как молекулы антител и гемоглобин, несколько полипептидов могут связываться вместе, образуя четвертичную структуру (рисунок \ (\ PageIndex {7} \)).
Рисунок \ (\ PageIndex {6} \) : Третичная структура белка или полипептида. В глобулярных белках, таких как ферменты, длинная цепь аминокислот складывается в трехмерную функциональную форму или третичную структуру.Это связано с тем, что определенные аминокислоты с сульфгидрильными или SH-группами образуют дисульфидные (S-S) связи с другими аминокислотами в той же цепи. Другие взаимодействия между R-группами аминокислот, такие как водородные связи, ионные связи, ковалентные связи и гидрофобные взаимодействия, также вносят вклад в третичную структуру.Как будет показано далее в этом разделе, во время синтеза белка порядок нуклеотидных оснований в гене транскрибируется в комплементарную цепь мРНК, которая затем транслируется тРНК в правильный порядок аминокислот для этого полипептида или белка.Следовательно, порядок дезоксирибонуклеотидных оснований в ДНК определяет порядок аминокислот в белках. Поскольку определенные аминокислоты могут взаимодействовать с другими аминокислотами, порядок аминокислот для каждого белка определяет его окончательную трехмерную форму, которая, в свою очередь, определяет функцию этого белка (например, с каким субстратом будет реагировать фермент, с какими эпитопами Fab антитела будет сочетаться с рецепторами, с которыми будет связываться цитокин).
Рисунок \ (\ PageIndex {7} \) : Четвертичная структура белка.Четвертичная структура белка обусловлена соединением нескольких полипептидов, как в случае молекул антител. Схематическая диаграмма базовой единицы иммуноглобулина (антитела) Fab Fc тяжелой цепи (состоит из VH, Ch2, шарнира, областей Ch3 и Ch4: от N-конца) легкой цепи (состоит из областей VL и CL: от N-конца) антигена шарнирные области сайта связывания (*) -SS- означают дисульфидные связи. (CC-SA-BY 3.0; Ы_тамбе).Сводка
- Аминокислоты — это строительные блоки для белков.В белках обычно содержится 20 различных аминокислот, а на молекулу белка часто приходится 300 и более аминокислот.
- Все аминокислоты содержат аминогруппу или группу NH 2 и карбоксильную (кислотную) группу или группу COOH.
- Для образования полипептидов и белков аминокислоты соединяются пептидными связями, в которых амино или NH 2 одной аминокислоты связываются с карбоксильной (кислотной) или COOH-группой другой аминокислоты.
- Пептид — это две или более аминокислоты, соединенные вместе пептидными связями; полипептид — это цепь из множества аминокислот; и белок содержит один или несколько полипептидов.Следовательно, белки представляют собой длинные цепи аминокислот, удерживаемые вместе пептидными связями.
- Фактический порядок аминокислот в белке называется его первичной структурой и определяется ДНК.
- Порядок дезоксирибонуклеотидных оснований в гене определяет аминокислотную последовательность конкретного белка. Поскольку определенные аминокислоты могут взаимодействовать с другими аминокислотами в одном и том же белке, эта первичная структура в конечном итоге определяет окончательную форму и, следовательно, химические и физические свойства белка.
- Вторичная структура белка обусловлена водородными связями, которые образуются между атомом кислорода одной аминокислоты и атомом азота другой и придают белку или полипептиду двумерную форму альфа-спирали или бета-складчатого листа. .
- В глобулярных белках, таких как ферменты, длинная цепь аминокислот складывается в трехмерную функциональную форму или третичную структуру. Это связано с тем, что определенные аминокислоты с сульфгидрильными или SH-группами образуют дисульфидные (S-S) связи с другими аминокислотами в той же цепи.Другие взаимодействия между R-группами аминокислот, такие как водородные связи, ионные связи, ковалентные связи и гидрофобные взаимодействия, также вносят вклад в третичную структуру.
- В некоторых белках, таких как молекулы антител, несколько полипептидов могут связываться вместе с образованием четвертичной структуры.
Авторы и указание авторства
2.3: Структура и функции — Белки I
Синтез белков происходит в рибосомах и происходит путем присоединения карбоксильного конца первой аминокислоты к аминоконцу следующей (Рисунок 2.19). Конец белка, который имеет свободную α-аминогруппу, называется аминоконцом или N-концом. Другой конец называется карбоксильным концом или С-концом, поскольку он содержит единственную свободную α-карбоксильную группу. Все другие α-аминогруппы и α-карбоксильные группы связаны с образованием пептида. Рис. 2.19. Связывание аминокислот посредством связей образования пептидных связей, которые соединяют соседние аминокислоты вместе. Белки синтезируются, начиная с аминоконца и заканчивая карбоксильным концом.
Схематично на рисунке 2.18 мы можем видеть, как последовательные R-группы белка расположены в чередующейся ориентации по обе стороны от полипептидной цепи. Подобная организация R-групп не случайна. Стерические затруднения могут возникать, когда последовательные R-группы ориентированы на одной стороне пептидного остова (рис. 2.20)
Первичная структура
Первичная структура является решающим фактором общей конформации белка. Первичная структура любого белка достигла своего текущего состояния в результате мутации и отбора в течение эволюционного времени.Первичная структура белков определяется последовательностью кодирующей ее ДНК в геноме. Области ДНК-специфицирующих белков известны как кодирующие области (или гены).
Последовательности оснований этих областей непосредственно определяют последовательность аминокислот в белках с однозначным соответствием между кодонами (группами из трех последовательных оснований) в ДНК и аминокислотами в кодируемом белке. Последовательность кодонов в ДНК, скопированная в информационную РНК, определяет последовательность аминокислот в белке.(Рисунок 2.21).
Рисунок 2.21 — От РНК к аминокислотам — генетический код WikipediaПорядок, в котором аминокислоты соединяются вместе при синтезе белка, начинает определять набор взаимодействий между аминокислотами, даже когда синтез происходит. То есть полипептид может сворачиваться даже в процессе производства. Порядок структур R-группы и результирующие взаимодействия очень важны, потому что ранние взаимодействия влияют на более поздние взаимодействия. Это потому, что взаимодействия начинают создавать структуры — вторичные и третичные.Если спиральная структура (вторичная структура), например, начинает формироваться, возможности взаимодействия конкретной аминокислоты R-группы могут быть другими, чем если бы спираль не образовалась (рис. 2.22). Взаимодействия R-группы также могут вызывать изгибы в полипептидной последовательности (третичной структуре), и эти изгибы могут создавать (в некоторых случаях) возможности для взаимодействий, которые были бы невозможны без изгиба, или предотвращать (в других случаях) аналогичные возможности взаимодействия.
Вторичная структура
По мере того, как синтез белка прогрессирует, взаимодействия между аминокислотами, близкими друг к другу, начинают происходить, что приводит к возникновению локальных паттернов, называемых вторичной структурой.Эти вторичные структуры включают хорошо известные α-спираль и β-тяжи. Оба были предсказаны Линусом Полингом, Робертом Кори и Германом Брэнсоном в 1951 году. Каждая структура имеет уникальные особенности.
α-спираль
Рисунок 2.22 — α-Спираль. Водородные связи (пунктирные линии) между кислородом карбонила и водородом амина стабилизируют структуру. Изображение Алейи Ким? -Спираль имеет спиральную структуру с 3,6 аминокислотами на оборот спирали (5 витков спирали = 18 аминокислот).Спирали преимущественно правосторонние — только в редких случаях, например, в последовательностях с большим количеством глицинов, могут образовываться левые α-спирали. В α-спирали водородные связи образуются между группами C = O и группами N-H в основной цепи полипептида, которые находятся на расстоянии четырех аминокислот. Эти водородные связи являются основными силами, стабилизирующими α-спираль.
Рисунок 2.23 — α-спирали в белке со структурным доменом лейциновой молнии. Α-Спирали показаны синим и зеленым цветом и связаны с двойной спиралью ДНК коричневого цвета.Мы используем термины «подъем», «повторение» и «шаг» для описания параметров любой спирали. Повторение — это количество остатков в спирали, прежде чем она начнет повторяться. Для α-спирали повторение составляет 3,6 аминокислоты на оборот спирали. Подъем — это расстояние, на которое спираль поднимается с добавлением каждого остатка. Для α-спирали это 0,15 нм на аминокислоту. Шаг — это расстояние между полными витками спирали. Для α-спирали это 0,54 нм. Стабильность α-спирали повышается за счет присутствия аминокислоты аспартата.
Рисунок 2.24 — Скульптура α-спирали за пределами дома, где прошло детство Линуса Полинга, Википедия Рисунок 2.25 — Винтовое колесо Изображение α-спирали. Используется однобуквенный генетический код. Спираль начинается с серина №77 справа и заканчивается лизином №92 справа внизу. Гидрофобные аминокислоты показаны желтым цветом, а ионизирующие аминокислоты — синим. Гидрофобные аминокислоты имеют тенденцию взаимодействовать друг с другом, а не с ионизирующими аминокислотами. Википедияβ-прядь / лист
Фигура 2.26 — β-прядьСпираль — это, конечно, трехмерный объект. Уплощенная форма спирали в двух измерениях — обычное описание β-нити. У β-прядей есть изгибы, а не витки, которые иногда называют складками, как складки на занавеске. β-нити могут быть организованы для образования тщательно организованных структур, таких как листы, бочки и другие конструкции.
β-цепочечные структуры более высокого порядка иногда называют супервторичными структурами), поскольку они включают взаимодействия между аминокислотами, не близкими по первичной последовательности.Эти структуры также стабилизируются водородными связями между карбонильными атомами кислорода и атомами водорода аминогрупп в основной цепи полипептида (рис. 2.28). В структуре более высокого порядка нити могут быть расположены параллельно (ориентация от амино к карбоксилу одинакова) или антипараллельно (ориентация от амино к карбоксилу противоположна друг другу (на рисунке 2.27 направление нити показано стрелкой на ленте). диаграммы).
Обороты
Рисунок 2.27 — Изображения на ленте супервторичных β-листов (A-D) и расположения α-спиралей (E-F) Изображение от Aleia Kimвитков (иногда называемых обратными витками) — это тип вторичной структуры, которая, как следует из названия, вызывает поворот в структуре полипептидной цепи.Повороты в конечном итоге приводят к возникновению третичной структуры, вызывая прерывания во вторичных структурах (α-спирали и β-цепи) и часто служат связующими областями между двумя областями вторичной структуры в белке. Пролин и глицин по очереди играют общие роли, обеспечивая меньшую гибкость (начало поворота) и большую гибкость (облегчение поворота) соответственно.
Рисунок 2.28 — Компоненты β-листа в параллельном расположении. Водородные связи желтого цвета. Изображение Алейи КимСуществует по крайней мере пять типов поворотов, многочисленные вариации каждого из которых приводят к множеству разных поворотов.Пять типов поворотов:
• δ-витки — концевые аминокислоты разделены одной пептидной связью
• γ-витки — разделение двумя пептидными связями
• β-витки — разделение тремя пептидными связями
• α-витки — разделение четырьмя пептидными связями
• π-витки — разделение пятью связями
Из них β-витки являются наиболее распространенной формой, а δ-витки являются теоретическими, но маловероятными из-за стерических ограничений. На рисунке 2.29 изображен β-разворот.
3 10 спиралей
Рисунок 2.29 — β-разворот. R-группы показаны оранжевым цветом, атомы водорода — желтым, атомы углерода — углем, атомы азота — фиолетовым, а атомы кислорода — зеленым. Стабилизирующая водородная связь обозначена пунктирной линией. Image by Aleia KimПомимо α-спирали, β-цепей и различных поворотов, в белках видны и другие регулярные, повторяющиеся структуры, но встречаются гораздо реже. Спираль 3 10 является четвертой по распространенности вторичной структурой в белках, составляя около 10-15% всех спиралей.Спираль получила свое название от того факта, что она содержит 10 аминокислот в 3-х витках. Это правша. Водородные связи образуются между аминокислотами, разнесенными на три остатка. Чаще всего спираль 3 10 появляется на аминовом или карбоксильном конце α-спирали. Как и α-спираль, спираль 3 10 стабилизируется присутствием аспартата в ее последовательности.
Рисунок 2.30 — Вид сверху на 310 Helix. Карбонильные группы выделены красным цветом и направлены вверх. Обратите внимание на почти идеальную 3-кратную симметрию Википедии (Рисунок 2).31 — Резонанс пептидной связи Википедия Рисунок 2.32 — π-спираль Википедияπ-спирали
Рисунок 2.33 — Плоскости (светло-голубые), определяемые характером двойной связи пептидной связи Изображение Алейи Кимπ-спираль можно рассматривать как особый тип α-спирали. Некоторые источники описывают это как α-спираль с дополнительной аминокислотой, застрявшей в ней (рис. 2.32). π-спирали не совсем редки, они встречаются по крайней мере один раз в 15% всех белков. Как и α-спираль, π-спираль является правой, но если α-спираль содержит 18 аминокислот в 5 витках, то π-спираль имеет 22 аминокислоты в 5 витках.π-спирали обычно не растягиваются на очень большие расстояния. Большинство из них имеют длину всего около 7 аминокислот, и последовательность почти всегда находится в середине α-спиральной области.
Участки в Рамачандране
Рисунок 2.34 — Углы вращения ω, ψ и φ в пептиде Изображение Aleia KimВ 1963 году G.N. Рамачандран, Ч. Рамакришнан и В. Сасисекхаран описали новый способ описания структуры белка. Если рассматривать основу полипептидной цепи, она состоит из повторяющегося набора из трех связей.Последовательно (в направлении от амино к карбоксилу) они представляют собой 1) вращающуюся связь (ψ) между α-углеродом и α-карбоксилом, предшествующую пептидной связи (см. ЗДЕСЬ), 2) невращающуюся пептидную связь (ω) между α -карбоксильная и α-аминная группы), и 3) вращающаяся связь (φ) между α-амином и α-углеродом, следующая за пептидной связью (см. ЗДЕСЬ). Обратите внимание на рисунки 2.33 и 2.34, что направление от амино к карбоксилу справа налево.
Присутствие карбонильного кислорода в α-карбоксильной группе позволяет пептидной связи существовать в виде резонансной структуры, что означает, что она некоторое время ведет себя как двойная связь.Двойные связи, конечно, не могут вращаться, но связи по обе стороны от них имеют некоторую свободу вращения. Углы φ и ψ ограничены определенными значениями, потому что некоторые углы приведут к стерическим затруднениям. Кроме того, каждый тип вторичной структуры имеет характерный диапазон значений φ и ψ.
Рисунок 2.35 — Теоретический график Рамачандрана Изображение Пенелопы ИрвингРамачандран и его коллеги выполнили теоретические расчеты энергетической стабильности всех возможных углов от 0 ° до 360 ° для каждого из углов φ и ψ и нанесли результаты на график Рамачандрана (также называемый график φ-ψ), очерчивая области углов, которые теоретически были наиболее устойчивыми (рис.35).
Были идентифицированы три основные области стабильности, соответствующие углам φ-ψ β-тяжей (вверху слева), правым α-спиралям (внизу слева) и левым α-спиралям (вверху справа). Графики предсказанной стабильности удивительно точны по сравнению с углами φ-ψ реальных белков.
Прогноз вторичной структуры
Таблица 2.3 — Относительные тенденции каждой аминокислоты находиться во вторичной структуре. Более высокие значения указывают на большую тенденцию. Изображение Пенелопы Ирвинг
.Сравнивая первичную структуру (аминокислотные последовательности) с известными трехмерными белковыми структурами, можно подсчитать каждый раз, когда аминокислота обнаруживается в α-спирали, β-цепи / листе или витке.Компьютерный анализ тысяч этих последовательностей позволяет определить вероятность появления любой данной аминокислоты в каждой из этих структур. Используя эти тенденции, можно с точностью до 80% предсказать области вторичной структуры в белке, основываясь исключительно на аминокислотной последовательности.
Это видно в таблице 2.3. Наличие в первичной последовательности трех последовательных аминокислот с относительной тенденцией выше единицы является индикатором того, что эта область полипептида находится в соответствующей вторичной структуре.Онлайн-ресурс для прогнозирования вторичных структур под названием PSIPRED доступен ЗДЕСЬ.
Гидрофобность
Таблица 2.4 — Оценка гидропатии
Химический состав R-групп аминокислот влияет на структуры, в которых они чаще всего встречаются. Подмножества их химических свойств могут дать ключ к разгадке структуры, а иногда и клеточного положения. Ярким примером является гидрофобность (склонность к предотвращению образования воды) некоторых R-групп. Учитывая водную среду клетки, такие R-группы вряд ли находятся на внешней поверхности свернутого белка.
Однако это правило не выполняется для областей белка, которые могут быть встроены в липидные бислои мембран клеток / органелл. Это связано с тем, что области таких белков, которые образуют трансмембранные домены, находятся в гидрофобной среде в середине липидного бислоя.
Неудивительно, что сканирование первичных последовательностей на предмет определенных размеров / разнесенных участков гидрофобных аминокислот может помочь идентифицировать белки, обнаруженные в мембранах. В таблице 2.4 показаны значения гидрофобности для R-групп аминокислот.В этом наборе шкала изменяется от положительных значений (гидрофобные) до отрицательных (гидрофильные). График гидропатии KyteDoolittle для мембранного белка протоонкогена RET показан на рисунке 2.36. Две области белка очень гидрофобны, что видно из пиков около аминокислот 5-10 и 630-640. Можно разумно ожидать, что такие области будут располагаться либо внутри свернутого белка, либо быть частью трансмембранных доменов.
Случайные катушки
Фигура 2.36 График гидропатии Кайта-Дулиттла для протоонкогена RET WikipediaНекоторые участки белка не предполагают регулярной, различимой структуры и, как иногда говорят, не имеют вторичной структуры, хотя могут иметь водородные связи. Такие сегменты описываются как находящиеся в случайных спиралях и могут иметь текучесть в своей структуре, что приводит к тому, что они имеют несколько стабильных форм. Случайные катушки можно идентифицировать с помощью спектроскопических методов, таких как круговой дихроизм в Википедии и ядерный магнитный резонанс (ЯМР), при котором наблюдаются отличительные сигналы.См. Также метаморфические белки (ЗДЕСЬ) и белки с внутренней неупорядоченностью (ЗДЕСЬ).
Рисунок 2.37 — Изображение β-шпильки на ленте. Показаны две бирюзовые β-нити, взаимодействующие друг с другом.Надвторичная структура
Другой элемент белковой структуры сложнее классифицировать, поскольку он включает элементы вторичной и третичной структуры. Названные супервторичной структурой (или структурными мотивами), эти структуры содержат множество соседних компонентов вторичной структуры, расположенных определенным образом и проявляющихся во множестве белков.Поскольку существует множество способов создания вторичных структур из разных первичных структур, аналогичные мотивы могут возникать из разных первичных последовательностей. Пример структурного мотива показан на рис. 2.37.
Третичная структура
Рисунок 2.38 — Сворачивание полипептидной цепиБелки отличаются друг от друга последовательностью составляющих их аминокислот. Последовательность аминокислот белка определяет форму белка, поскольку химические свойства каждой аминокислоты являются силами, которые вызывают межмолекулярные взаимодействия, чтобы начать создавать вторичные структуры, такие как α-спирали и β-цепи.Последовательность также определяет повороты и случайные спирали, которые играют важную роль в процессе сворачивания белка.
Поскольку форма важна для функции белка, последовательность аминокислот определяет все свойства, которыми обладает белок. По мере того как синтез белка продолжается, отдельные компоненты вторичной структуры начинают взаимодействовать друг с другом, создавая складки, сближающие аминокислоты, которые не находятся рядом друг с другом в первичной структуре (рис. 2.38). На третичном уровне структуры взаимодействия между R-группами аминокислот в белке, а также между основной цепью полипептида и боковыми группами аминокислот играют роль в сворачивании.
Глобулярные белки
Рисунок 2.39 — Разворачивание (денатурация) белка WikipediaСворачивание приводит к появлению различных трехмерных форм в белках, которые не являются волокнистыми. Эти белки называют глобулярными. Глобулярный белок стабилизируется теми же силами, которые управляют его образованием. К ним относятся ионные взаимодействия, водородные связи, гидрофобные силы, ионные связи, дисульфидные связи и металлические связи. Обработка, такая как нагревание, изменение pH, моющие средства, мочевина и меркаптоэтанол, подавляют стабилизирующие силы и заставляют белок разворачиваться, теряя свою структуру и (обычно) свою функцию (Рисунок 2.39). Благодаря способности тепла и детергентов денатурировать белки, мы готовим пищу и моем руки перед едой — такая обработка денатурирует белки в микроорганизмах на наших руках. У организмов, которые живут в среде с высокой температурой (более 50 ° C), есть белки с измененными стабилизирующими силами — дополнительные водородные связи, дополнительные солевые мостики (ионные взаимодействия) и компактность могут играть роль в предотвращении развертывания этих белков.
Силы стабилизации белка
Прежде чем рассматривать процесс сворачивания, давайте рассмотрим некоторые силы, которые помогают стабилизировать белки.
Водородные связи
Рисунок 2.40 — Водородные связи (пунктирные линии) между двумя молекулами уксусной кислотыВодородные связи возникают в результате частично заряженных атомов водорода, находящихся в ковалентных связях. Это происходит, когда атом, с которым связан водород, имеет большую электроотрицательность, чем сам водород, в результате чего водород имеет частичный положительный заряд, поскольку он не может удерживать электроны близко к себе (рис. 2.40).
Частично заряженный таким образом водород притягивается к атомам, таким как кислород и азот, которые имеют частичный отрицательный заряд из-за большей электроотрицательности и, таким образом, удерживают электроны ближе к себе.Частично положительно заряженные атомы водорода называются донорами, а частично отрицательные атомы, к которым они притягиваются, называются акцепторами. (См. Рисунок 1.30).
Рисунок 2.41 — Водородная связь в жидкой воде ВикипедияОтдельные водородные связи намного слабее ковалентной связи, но вместе они могут оказывать сильное влияние. Рассмотрим жидкую воду, которая содержит огромное количество водородных связей (рис. 2.41). Эти силы помогают воде оставаться жидкой при комнатной температуре. Другие молекулы, в которых отсутствуют водородные связи с молекулярной массой, равной или большей, чем вода, например, метан или диоксид углерода, являются газами при той же температуре.Таким образом, межмолекулярные взаимодействия между молекулами воды помогают «удерживать» воду вместе и оставаться жидкостью. Примечательно, что только при повышении температуры воды до кипения силы водородных связей преодолеваются, что позволяет воде стать полностью газообразной.
Водородные связи являются важными силами в биополимерах, которые включают ДНК, белки и целлюлозу. Все эти полимеры при кипячении теряют свою естественную структуру. Водородные связи между аминокислотами, которые близки друг к другу по первичной структуре, могут давать регулярные повторяющиеся структуры, такие как спирали или складки, в белках (вторичная структура).
Ионные взаимодействия
Ионные взаимодействия являются важными силами, стабилизирующими структуру белка, которые возникают в результате ионизации R-групп в аминокислотах, составляющих белок. К ним относятся карбоксиламинокислоты (ЗДЕСЬ), амино-аминокислоты, а также сульфгидрил цистеина и иногда гидроксил тирозина.
Гидрофобные силы
Гидрофобные силы стабилизируют структуру белка в результате взаимодействий, которые способствуют исключению воды.Неполярные аминокислоты (обычно находящиеся внутри белков) способствуют связыванию друг с другом, и это имеет эффект исключения воды. Исключенная вода имеет более высокую энтропию, чем вода, взаимодействующая с гидрофобными боковыми цепями. Это связано с тем, что вода очень регулярно и четко выравнивается при взаимодействии с гидрофобными молекулами.
Когда вода не может вступать в подобные взаимодействия, она становится гораздо более беспорядочной, чем если бы она могла ассоциироваться с гидрофобными областями.Частично по этой причине гидрофобные аминокислоты находятся во внутренней части белка — поэтому они могут исключать воду и увеличивать энтропию.
Дисульфидные связи
Рисунок 2.42 — Образование дисульфидной связиДисульфидные связи, которые образуются, когда две сульфгидрильные боковые цепи цистеина сближаются, ковалентно соединяют вместе различные участки белка и могут придать большую прочность всей структуре (рисунки 2.42 и 2.43) . Ода структуре белка от Кевина Ахерна Двадцать крошечных аминокислот A определяют белок разными способами Их порядок в пептидной цепи определяет формы, которые приобретают белки И когда они скручиваются, это оставляет меня веселым, потому что это делает структуры вторичными. Это третично, мне сказали, что происходит, когда белок сворачивается. Но сложенные цепи просто страшны. Собранные вместе четвертичные. Они — чудеса природы, это точно. Создание проблем, лечение. Дурак может сочинять пептидные стихи. Но белки происходят из рибоземов. Эти соединенные остатки цистеина иногда называют цистин.Дисульфидные связи — самая сильная из сил, стабилизирующих структуру белка.
Рисунок 2.43 — Цистин — два цистеина, соединенные дисульфидной связьюсилы Ван-дер-Ваальса
силы Ван-дер-Ваальса — это термин, используемый для описания различных слабых взаимодействий, в том числе вызванных притяжением между полярной молекулой и переходным диполем или между двумя временными диполями. Силы Ван-дер-Ваальса являются динамическими из-за флуктуирующего характера притяжения и, как правило, слабы по сравнению с ковалентными связями, но могут быть значительными на очень коротких расстояниях.
Посттрансляционные модификации
Посттрансляционные модификации также могут приводить к образованию ковалентных связей, стабилизирующих белки. Гидроксилирование лизина и пролина в нитях коллагена может привести к сшиванию этих групп, и полученные ковалентные связи помогают укрепить и стабилизировать коллаген.
Складные модели
В настоящее время исследуются две популярные модели сворачивания белков. В первой (модель диффузионного столкновения) процесс начинается с зародышеобразования, за которым следует образование вторичной структуры.Столкновения между вторичными структурами (как в β-шпильке на рис. 2.37) позволяют начать складывание. Напротив, в модели нуклеации-конденсации вторичные и третичные структуры образуются вместе.
Сворачивание белков происходит довольно быстро (от 0,1 до 1000 секунд) и может происходить во время синтеза — аминный конец белка может начать складываться еще до того, как образуется карбоксильный конец, хотя это не всегда так.
Процесс складывания
Фигура 2.44 Энергетическая модель сворачивания сворачивающейся воронки WikipediaПредполагается, что сворачивание белка происходит в энергетическом ландшафте «сворачивающейся воронки», в котором нативное состояние свернутого белка соответствует минимально возможной свободной энергии в условиях среды (обычно водного растворителя), в которой белок растворяется. Как видно на диаграмме (рис. 2.44), энергетическая воронка имеет множество локальных минимумов (провалов), в которых сворачивающийся белок может попасть в ловушку при движении вниз по энергетическому графику. Вероятно, играют роль другие факторы, такие как температура, электрические / магнитные поля и пространственные особенности.
Если внешние силы влияют на локальные минимумы энергии во время складывания, это может повлиять на процесс и конечный продукт. Как скорость автомобиля, едущего по дороге, влияет на безопасность поездки, так и энергетические соображения влияют на процесс складывания и направляют его, что в некоторых случаях приводит к полностью функциональным, правильно сложенным протеинам и ошибкам в других.
Зависание
По мере того, как процесс складывания приближается к минимуму энергии (нижняя часть воронки на Рисунке 2.44), белок может «застрять» в любом из локальных минимумов и не достичь конечного свернутого состояния. Хотя свернутое состояние, как правило, более организовано и, следовательно, имеет меньшую энтропию, чем развернутое состояние, существуют две силы, которые преодолевают уменьшение энтропии и продвигают процесс вперед.
Первый — это величина уменьшения энергии, как показано на графике. Поскольку ΔG = ΔH -TΔS, уменьшение ΔH может преодолеть отрицательное значение ΔS, чтобы сделать ΔG отрицательным и подтолкнуть процесс складывания вперед.Благоприятные (пониженные) энергетические условия возникают с образованием ионных связей, водородных связей, дисульфидных связей и металлических связей во время процесса сворачивания. Кроме того, гидрофобный эффект увеличивает энтропию, позволяя гидрофобным аминокислотам внутри свернутого белка исключать воду, тем самым противодействуя влиянию упорядочения структуры белка, делая ΔS менее отрицательным.
Прогноз структуры
Компьютерные программы очень хороши в предсказании вторичной структуры исключительно на основе аминокислотной последовательности, но с трудом определяют третичную структуру с использованием той же информации.Частично это связано с тем, что вторичные структуры имеют повторяющиеся точки стабилизации на основе геометрии, и любая регулярная вторичная структура (например, α-спираль) очень мало меняется от одной к другой. Однако складчатые структуры имеют огромное количество возможных структур, как показывает парадокс Левинталя.
Спектроскопия
Из-за нашей неспособности точно предсказать третичную структуру на основе аминокислотной последовательности, структуры белков фактически определяются с использованием методов спектроскопии.В этих подходах белки подвергаются различным формам электромагнитного излучения, и способы их взаимодействия с излучением позволяют исследователям определять координаты атомов с разрешением Ангстрема по электронной плотности (см. Рентгеновскую кристаллографию) и тому, как взаимодействуют спины ядер (см. ЯМР).
Парадокс Левинталя
В конце 1960-х Сайрус Левинталь обрисовал масштабы сложности проблемы сворачивания белка. Он указал, что для белка из 100 аминокислот он будет иметь 99 пептидных связей и 198 соображений для углов φ и ψ.Если бы каждая из них имела только три конформации, это привело бы к 3198 различным возможным сверткам или 2,95×1094.
Даже если дать разумное количество времени (одна наносекунда) для каждой возможной складки, потребуется больше времени, чем возраст Вселенной, чтобы выполнить выборку всех из них, что ясно означает, что процесс складывания не происходит путем последовательной случайной выборки. и что попытки определить структуру белка путем случайной выборки были обречены на провал. Левинталь, таким образом, предположил, что сворачивание происходит в результате последовательного процесса, который начинается с события зародышеобразования, которое быстро направляет процесс и мало чем отличается от воронкообразного процесса, изображенного на рисунке 2.44.
Болезни неправильного сворачивания белков
Рисунок 2.45 — Неправильная укладка нормального белка PRPc, индуцированная PRPsc. Изображение Пенелопы Ирвинг. Правильная укладка белков важна для их функции. Отсюда следует, что неправильная укладка белков (также называемая протеопатией) может иметь последствия. В некоторых случаях это может просто привести к неактивному белку. Неправильная упаковка белков также играет роль при многих заболеваниях, таких как коровье бешенство, болезнь Альцгеймера, болезнь Паркинсона и болезнь Крейтцфельда-Якоба.Многие, но не все заболевания неправильной укладки поражают ткани мозга.
Рисунок 2.46 — Коровы с коровьим бешенством теряют способность стоятьНерастворимые отложения
Неправильно свернутые белки обычно образуют агрегаты, называемые амилоидами, которые вредны для тканей, содержащих их, потому что они меняют свой цвет с растворимых на нерастворимые в воде и образуют отложения. Процесс, с помощью которого происходит неправильное свертывание (рис. 2.45), не совсем ясен, но во многих случаях было продемонстрировано, что «затравочный» белок, который неправильно свернут, может вызывать такое же неправильное свертывание в других копиях того же белка.Эти протеины семян известны как прионы, и они действуют как инфекционные агенты, вызывая распространение болезни. Список болезней человека, связанных с неправильной упаковкой белков, длинен и продолжает расти. Ссылка на Википедию ЗДЕСЬ.
Прионы
Рисунок 2.47 — Диффузный амилоидоз в кровеносном сосуде (красные точки) WikipediaПрионы — это инфекционные белковые частицы, вызывающие трансмиссивные губчатые энцефалопатии (TSE), наиболее известной из которых является коровье бешенство. Другие проявления включают болезнь, скрепи, у овец и болезни человека, такие как болезнь Крейтцфельда-Якоба (CJD), фатальная семейная бессонница и куру.Белок, участвующий в этих заболеваниях, — это мембранный белок, называемый PrP. PrP закодирован в геноме многих организмов и содержится в большинстве клеток организма. PrPc — это название, данное структуре PrP, которая является нормальной и не связана с заболеванием. PrPSc — это название неправильно свернутой формы того же белка, которое связано с развитием симптомов заболевания (рис. 2.45).
Неправильно сложен
Неправильно свернутый PrPSc связан с заболеваниями TSE и действует как инфекционная частица.Третья форма PrP, называемая PrPres, может быть обнаружена в TSE, но не заразна. «Res» PrPres указывает на то, что он устойчив к протеазам. Стоит отметить, что все три формы PrP имеют одинаковую аминокислотную последовательность и отличаются друг от друга только способами складывания полипептидных цепей. Наиболее опасно неправильно свернутой формой PrP является PrPSc из-за его способности действовать как инфекционный агент — затравочный белок, который может вызывать неправильную укладку PrPc, тем самым превращая его в PrPSc.
Функция
Фигура 2.48 — Одна модель распространения прионов WikipediaФункция PrPc неизвестна. Мыши, лишенные гена PrP, не имеют серьезных отклонений. У них действительно проявляются проблемы с долговременной памятью, что указывает на функцию PrPc. Стэнли Прусинер, открывший прионы и придумавший этот термин, получил Нобелевскую премию по медицине в 1997 году за свою работу. Я думаю, что если бы я случайно оказался на протеине А, составляющем прион, я бы его скрутил и, ради бога, не дай ему делать ошибки складывания
Амилоиды
Амилоиды — это совокупность неправильно свернутых белковых агрегатов, которые обнаруживаются в организме человека.Вследствие неправильной укладки они нерастворимы и вызывают около двадцати заболеваний человека, включая важные неврологические, связанные с прионами. Заболевания включают (пораженный белок в скобках) — болезнь Альцгеймера (амилоид β), болезнь Паркинсона (α-синуклеин), болезнь Хантингтона (хантингтин), ревматоидный артрит (сывороточный амилоид A), фатальную семейную бессонницу (PrPSc) и другие.
Аминокислотная последовательность играет роль в амилоидогенезе. Полипептиды, богатые глутамином, часто встречаются в прионах дрожжей и человека.Тринуклеотидные повторы важны при болезни Хантингтона. Если последовательность не является фактором, гидрофобная ассоциация между β-листами может играть роль.
Амилоид β
Рисунок 2.49 — HuntingtinAmyloid β — это совокупность небольших белков (36-43 аминокислоты), которые, по-видимому, играют роль в болезни Альцгеймера. (Другим фактором является тау-белок.) Фактически, они являются основными компонентами амилоидных бляшек, обнаруживаемых в головном мозге пациентов, страдающих этим заболеванием, и возникают в результате протеолитического расщепления более крупного гликопротеина-предшественника амилоида, называемого амилоидным предшественником белка, интегральной мембраны. белок нервных клеток, функция которого неизвестна.Эту функцию выполняют две протеазы, β-секретаза и γ-секретаза. Амилоидные β-белки неправильно свернуты и, по-видимому, вызывают неправильную укладку других белков и, таким образом, преципитируют и образуют амилоид, характерный для этого заболевания. Бляшки токсичны для нервных клеток и вызывают деменцию, характерную для этого заболевания.
Считается, что агрегация белков амилоида β во время неправильной укладки приводит к генерации активных форм кислорода и что это является средством, с помощью которого повреждаются нейроны.Неизвестно, какова реальная функция амилоида β. Аутосомно-доминантные мутации в белке приводят к раннему началу заболевания, но это происходит не более чем в 10% случаев. Стратегии лечения заболевания включают ингибирование секретаз, которые генерируют пептидные фрагменты из белка-предшественника амилоида.
Хантингтин
Хантингтин является центральным геном болезни Хантингтона. Белок, сделанный из него, богат глутамином, с 6-35 такими остатками в форме дикого типа.При болезни Хантингтона этот ген мутирует, увеличивая количество глутаминов в мутантном белке до 36–250. Размер белка зависит от количества глутаминов в мутантном белке, но белок дикого типа содержит более 3100 аминокислот. кислоты и молекулярный вес около 350 000 Да. Его точная функция неизвестна, но хантингтин содержится в нервных клетках, причем самый высокий уровень находится в головном мозге. Считается, что он, возможно, играет роль в транспорте, передаче сигналов и защите от апоптоза.Хантингтин также необходим для раннего эмбрионального развития. Внутри клетки хантингтин локализован в основном в микротрубочках и пузырьках.
Тринуклеотидный повтор
Ген хантингтина содержит множество копий последовательности CAG (называемой тринуклеотидными повторами), которая кодирует множество глутаминов в белке. Болезнь Хантингтона возникает, когда при копировании ДНК гена образуются дополнительные копии последовательности CAG. Расширение повторяющихся последовательностей может происходить из-за скольжения полимеразы относительно матрицы ДНК во время репликации.В результате могут быть созданы несколько дополнительных копий тринуклеотидного повтора, в результате чего будут получены белки с различным числом остатков глутамина. Без проблем можно выдержать до 35 повторов. Однако количество повторов может увеличиваться в течение жизни человека по тому же механизму. Люди с 36-40 повторами начинают проявлять признаки болезни, а если их больше 40, болезнь будет присутствовать.
Молекулярные шапероны
Важность правильного сворачивания белков подчеркивается заболеваниями, связанными с неправильным сворачиванием белков, поэтому неудивительно, что клетки расходуют энергию для облегчения правильного сворачивания белков.Клетки используют два класса белков, известных как молекулярные шапероны, для облегчения такого складывания в клетках. Молекулярные шапероны бывают двух видов: шапероны и шаперонины. Примером первой категории является класс белков Hsp70. Hsp означает «белок теплового шока», исходя из того факта, что эти белки впервые были обнаружены в больших количествах в клетках, которые на короткое время подвергались воздействию высоких температур. Hsps помогает клеткам при стрессах, возникающих в результате теплового шока и воздействия окислительных условий или токсичных тяжелых металлов, таких как кадмий и ртуть.Однако они также играют важную роль в нормальных условиях, когда они способствуют правильной укладке полипептидов, предотвращая аберрантные взаимодействия, которые могут привести к неправильной укладке или агрегации. Белки Hsp70 обнаружены почти во всех клетках и используют гидролиз АТФ, чтобы стимулировать структурные изменения формы шаперона, чтобы приспособиться к связыванию белков-субстратов. Связывающий домен Hsp70s содержит структуру β-бочонка, которая обвивает полипептидную цепь субстрата и имеет сродство к гидрофобным боковым цепям аминокислот.Как показано на рисунке 2.50, Hsp70 связывается с полипептидами, когда они выходят из рибосом во время синтеза белка. Связывание субстрата стимулирует гидролиз АТФ, чему способствует другой белок теплового шока, известный как Hsp40. Гидролиз АТФ заставляет Hsp70 принимать закрытую конформацию, которая помогает экранировать открытые гидрофобные остатки и предотвращать агрегацию или локальную неправильную укладку.
После завершения синтеза белка АДФ высвобождается и замещается АТФ, что приводит к высвобождению белка-субстрата, который затем позволяет полипептиду полной длины правильно складываться.
Рисунок 2.50 — Действие Hsp70 (синий), способствующее правильному сворачиванию белка (оранжевый) Изображение Алейи КимПри тепловом шоке
Во время теплового шока или окислительного стресса белки Hsp70 связываются с развернутыми гидрофобными областями белков, аналогичным образом предотвращая их агрегацию и позволяя им правильно складываться. Когда белки повреждены, Hsp70 привлекает ферменты, которые убиквитинируют поврежденный белок, чтобы нацелить их на разрушение в протеасомах. Таким образом, белки Hsp70 играют важную роль не только в том, что белки правильно уложены, но и в том, что поврежденные или нефункциональные белки удаляются путем деградации в протеасоме.
шаперонины
Второй класс белков, участвующих в помощи другим белкам в правильной укладке, известен как шаперонины. Есть две основные категории шаперонинов — класс I (обнаруженный в бактериях, хлоропластах и митохондриях) и класс II (обнаруженный в цитозоле эукариот и архебактерий). Наиболее изученными шаперонинами являются сложные белки GroEL / GroES, обнаруженные в бактериях (рис. 2.51).
Рисунок 2.51 — Вид снизу GroEL (слева) и комплекса GroEL / GroES (справа) WikipediaGroEL / GroES не может отменить агрегированные белки, но, способствуя правильному сворачиванию, он обеспечивает конкуренцию за неправильное сворачивание как процесс и может уменьшить или устраните проблемы, возникающие из-за неправильного складывания.GroEL представляет собой 14-мерное кольцо с двойным кольцом с гидрофобной областью, которое может способствовать складыванию субстратов размером 15-60 кДа. GroES — это индивидуальный гептамер, который связывается с GroEL в присутствии АТФ и действует как прикрытие над GroEL. Гидролиз АТФ шаперонинами вызывает большие конформационные изменения, влияющие на связывание субстратных белков и их укладку. Точно неизвестно, как шаперонины сворачивают белки. Пассивные модели постулируют, что шаперониновый комплекс функционирует инертно, предотвращая неблагоприятные межмолекулярные взаимодействия или накладывая ограничения на пространства, доступные для возникновения складок.Активные модели предполагают, что структурные изменения в комплексе шаперонина вызывают структурные изменения в белке-субстрате.
Расщепление белков
Рисунок 2.52 — 26S протеасома. Активный сайт показан красным WikipediaДругой белковый комплекс, который играет важную роль в динамике продолжительности жизни белков, — это протеасома (рис. 2.52). Протеасомы, обнаруженные у всех эукариот и архей, а также у некоторых бактерий, разрушают ненужные или поврежденные белки путем протеолитической деградации.Протеасомы помогают регулировать концентрацию некоторых белков и разрушать те, которые неправильно свернуты. Путь протеасомной деградации играет важную роль в клеточных процессах, которые включают прохождение клеточного цикла, модуляцию экспрессии генов и ответ на окислительный стресс.
При деградации в протеасоме образуются короткие пептиды длиной от семи до восьми аминокислот. Важную роль играют треониновые протеазы. Распад этих пептидов дает отдельные аминокислоты, облегчая их рециклинг в клетках.Белки нацелены на деградацию в протеасомах эукариот путем присоединения к множеству копий небольшого белка, называемого убиквитином (8,5 кДа — 76 аминокислот). Фермент, катализирующий реакцию, известен как убиквитинлигаза. Образовавшаяся полиубиквитиновая цепь связывается протеасомой, и начинается деградация. Убиквитин получил свое название из-за того, что он повсеместно встречается в эукариотических клетках.
Убиквитин
Рисунок 2.53 — Убиквитин (боковые цепи лизина показаны желтым) WikipediaУбиквитин (Рисунок 2.53) представляет собой небольшой (8,5 кДа) многофункциональный белок, обнаруженный в эукариотических клетках. Обычно он добавляется к белкам-мишеням под действием ферментов убиквитинлигазы (E3 на рисунке 2.54). Могут быть добавлены одна (убиквитинирование) или несколько (полиубиквитинирование) молекул убиквитина. Присоединение убиквитина происходит через боковую цепь одного из семи различных остатков лизина в убиквитине.
Добавление убиквитина к белкам имеет множество эффектов, наиболее известным из которых является нацеливание белка на деградацию в протеасоме.Протеасомное нацеливание наблюдается, когда полиубиквитинирование происходит по лизинам №29 и 48. Полиубиквитинирование или моноубиквитинирование по другим лизинам может приводить к измененному клеточному расположению и измененным межбелковым взаимодействиям. Последние могут влиять на воспаление, перенос эндоцитов, трансляцию и репарацию ДНК.
Рисунок 2.54 — Путь убиквитинирования целевого белка-субстрата Изображение Pehr JacobsonНарушение функции убиквитинлигазы
Паркин — это белок, связанный с болезнью Паркинсона, который при мутации связан с наследственной формой заболевания, называемой аутосомно-рецессивной ювенильной болезнью Паркинсона.Функция белка неизвестна, но он является компонентом системы убиквитинлигазы E3, ответственной за перенос убиквитина от белка E2 к боковой цепи лизина на белке-мишени. Считается, что мутации в паркине приводят к протеасомной дисфункции и, как следствие, неспособности расщеплять белки, вредные для дофаминергических нейронов. Это приводит к гибели или нарушению работы этих нейронов, что приводит к болезни Паркинсона.
Внутренне неупорядоченные белки
Фильм 2.1 — Динамическое движение цитохрома C в растворе Wikipedia
Как видно из множества примеров, описанных в другом месте книги, трехмерная структура белков важна для их функции. Но становится все более очевидным, что не все белки складываются в стабильную структуру. Исследования так называемых внутренне неупорядоченных белков (IDP) за последние пару десятилетий показали, что многие белки являются биологически активными, даже если они не могут складываться в стабильные структуры.Тем не менее, другие белки имеют области, которые остаются развернутыми (области IDP), даже когда остальная часть полипептида складывается в структурированную форму.
Внутренне неупорядоченные белки и неупорядоченные области внутри белков, на самом деле, были известны уже много лет, но рассматривались как аномалия. Только недавно, с осознанием того, что IDP и IDP области широко распространены среди эукариотических белков, было признано, что наблюдаемое нарушение является «особенностью, а не ошибкой».
Фильм 2.2 SUMO-1, белок с внутренне неупорядоченными участками Wikipedia
Сравнение IDP показывает, что у них общие характеристики последовательности, которые, по-видимому, способствуют их неупорядоченному состоянию. То есть так же, как некоторые аминокислотные последовательности могут способствовать сворачиванию полипептида в определенную структуру, аминокислотные последовательности IDP способствуют тому, чтобы они оставались развернутыми. Видно, что области IDP содержат мало гидрофобных остатков и необычно богаты полярными остатками и пролином. Присутствие большого количества заряженных аминокислот в IDP может ингибировать фолдинг за счет отталкивания зарядов, в то время как отсутствие гидрофобных остатков затрудняет формирование стабильного гидрофобного ядра, а пролин препятствует образованию спиральных структур.Наблюдаемые различия между аминокислотными последовательностями в IDP и структурированных белках были использованы для разработки алгоритмов для прогнозирования того, будет ли данная аминокислотная последовательность неупорядоченной.
Какое значение имеют внутренне неупорядоченные белки или области? Тот факт, что это свойство закодировано в их аминокислотных последовательностях, предполагает, что их нарушение может быть связано с их функцией. Гибкая, мобильная природа некоторых IDP-регионов может играть решающую роль в их функции, позволяя переход к складчатой структуре при связывании с белком-партнером или при посттрансляционной модификации.Некоторые ответы можно найти в исследованиях нескольких хорошо известных белков с участками IDP. Области IDP могут увеличивать способность белков, подобных lac-репрессору, перемещаться по ДНК для поиска специфических сайтов связывания. Гибкость IDP также может быть преимуществом во взаимодействии белок-белок, особенно для белков, которые, как известно, взаимодействуют со многими различными белками-партнерами.
Рисунок 2.55 — Денатурация и ренатурация рибонуклеазы ВикипедияНапример, р53 имеет области IDP, которые могут позволить белку взаимодействовать с множеством функциональных партнеров.Сравнение известных функций белков с предсказаниями нарушения в этих белках предполагает, что IDP и области IDP могут непропорционально функционировать в передаче сигналов и регуляции, в то время как более структурированные белки смещены в сторону катализа и транспорта. Интересно, что многие белки, обнаруженные как в рибосомах, так и в сплайсосомах, имеют IDP-области, которые могут играть роль в правильной сборке этих комплексов. Несмотря на то, что ВПЛ не изучались интенсивно в течение очень долгого времени, то немногое, что о них известно, предполагает, что они играют важную и недооцененную роль в клетках.
Метаморфные белки
Другая группа белков, которая недавно изменила наше представление о структуре и функции белков, — это так называемые метаморфные белки. Эти белки способны образовывать более одного стабильного свернутого состояния, начиная с одной аминокислотной последовательности. Хотя это правда, что множественные свернутые конформации не исключаются законами физики и химии, метаморфические белки — относительно новое открытие. Конечно, было известно, что прионные белки способны складываться в альтернативные структуры, но метаморфические белки, по-видимому, могут переключаться между двумя стабильными структурами.Хотя в некоторых случаях метаморфный белок подвергается этому переключению в ответ на связывание другой молекулы, некоторые белки могут выполнять этот переход самостоятельно. Интересный пример — сигнальная молекула лимфотактин. Лимфотактин выполняет две биологические функции, которые выполняются двумя его конформерами — мономерной формой, связывающей рецептор лимфотактина, и димерной формой, связывающей гепарин. Возможно, такое переключение более распространено, чем предполагалось.
Рефолдинг денатурированных белков
Вся информация о фолдинге белка содержится в аминокислотной последовательности белка.Тогда может показаться любопытным, что большинство белков не сворачиваются в свою правильную, полностью активную форму после того, как они были денатурированы +++ и денатурант удален. На самом деле некоторые так и поступают. Хорошим примером является бычья рибонуклеаза (рис. 2.55). Его каталитическая активность очень устойчива к воздействию тепла и мочевины, и попытки денатурировать его не очень хорошо. Однако, если обработать фермент β-меркаптоэтанолом (который разрывает дисульфидные связи) перед обработкой мочевиной и / или нагреванием, активность теряется, что указывает на то, что ковалентные дисульфидные связи помогают стабилизировать общую структуру фермента, а когда они разрываются, денатурация может легко произойти.Когда смесь снова охлаждается до комнатной температуры, со временем некоторая ферментативная активность снова появляется, указывая на то, что рибонуклеаза повторно свернулась в новых условиях.
Интересно, что ренатурация произойдет максимально, если во время процесса в растворе останется небольшое количество β-меркаптоэтанола. Причина этого в том, что β-меркаптоэтанол позволяет восстанавливать (и разрушать) случайные неправильные дисульфидные связи во время процесса сворачивания. Без него эти дисульфидные связи будут препятствовать образованию правильных складок.
Необратимая денатурация
Однако большинство ферментов не ведут себя как бычья рибонуклеаза. После денатурирования их активность не может быть восстановлена до какой-либо значительной степени. Существует не так много способов инактивации РНКазы. Она стабильна в горячем или холодном состоянии, потому что дисульфиды крепко удерживаются. Это может показаться противоречащим идее о том, что информация о сворачивании является неотъемлемой частью последовательности аминокислот в белке.Это не.
Большинство ферментов не восстанавливаются должным образом после денатурации по двум причинам. Во-первых, нормальное сворачивание может происходить по мере образования белков. Взаимодействия между аминокислотами на ранней стадии синтеза не «сбиваются с толку» взаимодействиями с аминокислотами на более поздних этапах синтеза, потому что эти аминокислоты не присутствуют в начале процесса.
Роль шаперонинов
В других случаях процесс сворачивания некоторых белков в клетке зависел от действия белков-шаперонинов (см. ЗДЕСЬ).В отсутствие шаперонинов происходят взаимодействия, которые могут приводить к неправильной укладке, что препятствует правильной укладке. Таким образом, раннее сворачивание и помощь шаперонинов устраняют некоторые потенциальные взаимодействия «неправильного сворачивания», которые могут происходить, если вся последовательность присутствует в момент начала сворачивания.
Четвертичная структура
Четвертый уровень структуры белка — это четвертичная структура. Это относится к структурам, которые возникают в результате взаимодействий между несколькими полипептидами.Единицы могут быть идентичными множественными копиями или могут быть разными полипептидными цепями. Гемоглобин взрослого человека является хорошим примером белка с четвертичной структурой, состоящего из двух идентичных цепей, называемых α, и двух идентичных цепей, называемых β.
Хотя α-цепи очень похожи на β-цепи, они не идентичны. Как α-, так и β-цепи также связаны с одной полипептидной цепью в родственном белке, называемом миоглобином. И миоглобин, и гемоглобин имеют сходство в связывании кислорода, но их поведение по отношению к молекуле значительно различается.Примечательно, что множественные субъединицы гемоглобина (с четвертичной структурой) по сравнению с одиночной субъединицей миоглобина (без четвертичной структуры) вызывают эти различия.
Список литературы
1. https://en.wikipedia.org/wiki/Van_der_W aals_force 105
уровней белковой организации
уровень белковой организации Уровни белковой организации
A 2014 Основы медицины eLAB
Первичная структура белка определяется как аминокислотная последовательность его полипептидной цепи; вторичная структура — это локальное пространственное расположение атомов основной цепи (основной цепи) полипептида; третичная структура относится к трехмерной структуре всей полипептидной цепи; и четвертичная структура представляет собой трехмерное расположение субъединиц в мультисубъединичном белке.В этой серии страниц мы исследуем различные уровни белковой организации. Мы также рассматриваем структуры по-разному — каркас Cα, шарнирный стержень, CPK, лента, заполнение пространства — также цвет используется для выделения различных аспектов аминокислот, структуры и т. Д. По мере того, как вы проходите через этот модуль обратите внимание на эти аспекты.
Этот модуль включает ссылки на KiNG (Kinemage, Next Generation), который отображает трехмерные структуры в анимированном интерактивном формате.Эти «кинемаги» (кинетические изображения) можно вращать, перемещать и масштабировать, а части можно скрывать или показывать. Первоначально кинемаги были реализованы под эгидой Фонда инновационных технологий и Protein Society, а программированием и обслуживанием занимались Дэвид С. Ричардсон и Джейн С. Ричардсон.
Ссылка : «КИНЕМИДЖ: ИНСТРУМЕНТ ДЛЯ НАУЧНОЙ КОММУНИКАЦИИ» Д.К. Ричардсон и Дж. Ричардсон (1992) Protein Science 1: 3-9.Также Trends in Biochem. Sci. (1994) 19: 135-8.
Текст адаптирован из : Demo5_4a.kin
Первичная структура пептида или белка — это линейная последовательность его аминокислот (АК). По соглашению, первичная структура белка читается и записывается от аминоконцевого (N) до карбоксильного (C) конца. Каждая аминокислота соединена со следующей пептидной связью.
В то время как первичная структура описывает последовательность аминокислот, образующих пептидную цепь, вторичная структура относится к локальному расположению цепи в пространстве.В белках было идентифицировано несколько общих вторичных структур. Они будут описаны в следующих разделах и визуализированы с помощью упомянутого ранее программного обеспечения KiNG.
Чтобы загрузить Java-апплет KiNG, просто щелкните здесь. После загрузки этой страницы должен автоматически появиться Java-апплет KiNG. Если вам нужна информация об использовании King, наведите указатель мыши здесь.
Альфа-спираль
Альфа-спираль — это элемент вторичной структуры, в котором аминокислотная цепь расположена по спирали.Связанный выше кинемаг показывает отдельную альфа-спираль, если смотреть с N-концевого конца, чтобы напоминать «спиральное колесо» (см. Рисунок ниже). Атомы O и N главной цепи спирали показаны красными и синими шарами соответственно. Нецелое повторение альфа-спирали на 3,6 остатка на виток означает, что Cα последовательных витков смещены примерно наполовину, что придает основной цепи характерный вид семиконечной звезды на виде с торца. Обратите внимание, что связи Cα-Cβ не направлены радиально от оси спирали, а являются «вертушкой» вдоль линии одного из соседних пептидов, давая боковым цепям асимметричное начало.
Гидрофобные боковые цепи показаны морским зеленым цветом, полярные — небесно-голубым, а заряженные — красным. Их можно включить, установив флажок «side ch». Теперь ВКЛЮЧИТЕ и ВЫКЛЮЧИТЕ различные группы и наборы отображения, щелкнув соответствующее поле кнопки.
Когда вы нажимали на разные типы сайдчейнов, что вы наблюдали? Заметили ли вы, что одна сторона спирали имеет в основном полярные остатки, а другая — в основном гидрофобные? Это типичная спираль глобулярных белков; в своей нативной конфигурации полярные остатки обращены к растворителю, тогда как гидрофобные остатки обращены к внутренней части белка.В меню просмотра в KiNG выберите View2 или View3, чтобы увидеть больше структуры.
На рисунке слева показано представление аминокислотной последовательности в виде спирального колеса, как если бы он смотрел вниз по оси альфа-спирали, перпендикулярной странице. Аминокислотные остатки пронумерованы от ближайшего к самому дальнему и расположены в виде идеальной альфа-спирали с 3,6 остатками на полный оборот. Этот рисунок представляет собой снимок Java-апплета, написанного Эдвардом К. О’Нилом и Чарльзом М. Гришемом (Университет Вирджинии в Шарлоттсвилле, Вирджиния).
В KiNG выберите View4, чтобы увеличить изображение сбоку со спиральными водородными связями (Н-связями) коричневого цвета. Включите «Hbonds» на панели кнопок, чтобы увидеть H-связи коричневым цветом. Щелкните атомы основной цепи на обоих концах одной из Н-связей, чтобы убедиться, что альфа-спиральный образец Н-связи действительно идет от донора NH в остатке i к акцептору O в остатке i-4 (как показано на рисунке). рисунок справа). Проверьте, есть ли у этой альфа-спирали 3,6 остатка за оборот. Если вы измеряете, то подъем на полный оборот равен 5.4 Ангстрем (Â).
Альфа-спирали почти все правосторонние. Чтобы увидеть, что это правша, возьмите правую руку большим пальцем вверх и слегка согните пальцы; пытаясь совместить спираль спирали, медленно двигайтесь в направлении, указанном указателем большого пальца, и изгибайте его вдоль линии пальцев, как будто затягивая винт. Когда это движение совпадает со спиралью позвоночника, если оно выполняется правой рукой, тогда спираль будет правосторонней.
Для измерения углов в фи и фунтах на квадратный дюйм для спирали из примера KiNG включите «Измерение угла и двугранного угла» в раскрывающемся меню «Инструменты».Начните с нажатия на атом углерода карбонила в верхней части, затем следующий N, затем Cα, а затем снова C; в этой точке информационная линия покажет двугранный угол, который является углом фи центральной связи N-Cα этих 4 атомов. Для правосторонней альфа-спирали он должен находиться в диапазоне от -50 до -80 градусов. Щелкните следующий N, и вы получите угол psi, который должен быть в пределах от -25 до -60 градусов. Продолжайте движение вниз по позвоночнику спирали, получая омега (около 180 градусов), фи, фунты на квадратный дюйм и т. Д. Эти спиральные значения фи, фунты на квадратный дюйм находятся в хорошо населенной области в нижнем левом углу графика Рамачандрана (показано справа).
Таким образом, идеальная альфа-спираль имеет следующие свойства:
- Завершает один оборот каждые 3,6 остатка;
- Поднимается примерно на 5,4 Â с каждым поворотом;
- Это правая спираль;
- Он удерживается вместе водородными связями между C = O остатка i и NH остатка i + 4;
- Обычно он слегка изогнут.
Некоторые общие свойства альфа-спиралей:
- Средняя длина альфа-спирали составляет 10 остатков (15 Â в длину), хотя длина альфа-спиралей может составлять от 4 до 40 остатков в стандартном глобулярном белке.
- Все остатки, участвующие в альфа-спирали, имеют одинаковые углы (phi, psi). Эти углы, составляющие приблизительно -60 и -50, взяты из нижнего левого квадранта графика Рамачандрана.
- Некоторые аминокислоты предпочтительны в альфа-спирали. Остатки, такие как Ala, Glu, Leu и Met, имеют высокую тенденцию к участию в спирали, тогда как остатки, такие как Pro и Gly, имеют небольшую такую тенденцию. Особый интерес представляет пролин, который не укладывается в спираль и вносит излом.
- Спираль имеет общий дипольный момент, который представляет собой векторную сумму выровненных дипольных моментов отдельных пептидных связей. Положительный полюс находится на N-конце, а отрицательный полюс — на C-конце. Иногда этот диполь играет функциональную роль.
Некоторые тексты адаптированы из : Kinemage Supplement to Branden & Tooze «Introduction to Protein Structure», Chapter 2 — MOTIFS OF PROTEIN STRUCTURE, Джейн С. и Дэвид К. Ричардсон.
Бета-цепь — это элемент вторичной структуры, в которой белковая цепь почти линейна.Соседние бета-нити могут образовывать водородные связи, образуя бета-лист (также называемый бета-гофрированным листом). Участвующие бета-цепи не являются непрерывными в первичной последовательности и даже не обязательно должны быть близко друг к другу в последовательности, то есть цепи, образующие бета-лист, могут быть разделены в первичной структуре длинными последовательностями аминокислот, которые не являются частью листа. Примерно четверть всех остатков в типичном белке находится в бета-цепях, хотя это количество сильно варьируется между белками
.Чтобы просмотреть бета-версию апплета KiNG Java, щелкните здесь.Kinemage 1 показывает 6-нитевой параллельный бета-лист из домена 1 лактатдегидрогеназы (файл 1LDM). Этот параллельный бета-лист с двойной намоткой является наиболее распространенным паттерном сворачивания, обнаруживаемым в известных белковых структурах. Эта «складка» также известна как «нуклеотид-связывающий домен», потому что большинство примеров связывают мононуклеотид (такой как FMN) или динуклеотид (такой как NAD) около середины одного конца бета-листа. Лактатдегидрогеназа является классическим, впервые обнаруженным примером структуры этого типа и имеет наиболее часто наблюдаемую топологию бета-соединений.
Обратите внимание, что водородные связи в этом параллельном листе наклонены в альтернативных направлениях, а не перпендикулярно прядям, как мы увидим в антипараллельных листах. Перетащите вправо или влево, чтобы лучше увидеть, что лист в целом скручивается. Этот поворот обычно описывается поворотом ориентации пептидных плоскостей (или плоскости Н-связи) по мере продвижения вдоль цепи; по этому определению скрутка бета-листа всегда правосторонняя, хотя и в разной степени. Нажмите на атомы вдоль нити, чтобы определить его направление по номерам остатков, и убедитесь, что все шесть нитей действительно параллельны.Этикетки нитей показывают порядок их последовательности. Обратите внимание, что большинство последовательных пар находятся рядом друг с другом, и что цепочка начинается с середины, перемещается к одному краю, перескакивает обратно к середине и затем перемещается к другому краю. Существует три возможных способа сформировать бета-лист из бета-нити, обсуждаемые ниже.
Типы бета-листов, наблюдаемые в белках
1) Параллельный бета-лист — все склеенные жилы имеют одинаковое направление от N к C. В результате их приходится разделять длинными последовательностями.Водородные связи одинаково удалены.
На рисунке слева показан трехцепочечный параллельный бета-лист из белка тиоредоксина. Три параллельные нити показаны как в карикатурном формате (слева), так и в виде палочек, содержащих атомы основной цепи N, CA, C и O ‘(справа). Водородные связи обозначены стрелками, соединяющими донорный азот и акцепторный атом кислорода. Нити пронумерованы в соответствии с их относительным положением в полипептидной последовательности.
2) Антипараллельный бета-лист — бета-нити проходят в чередующихся направлениях и, следовательно, могут находиться довольно близко на первичной последовательности.Расстояние между последовательными водородными связями чередуется между более короткими и длинными.
На рисунке справа показан трехцепочечный антипараллельный бета-лист из тиоредоксина. Три антипараллельных нити показаны как в карикатурном формате (слева), так и в форме палочек, содержащих атомы основной цепи N, CA, C и O ‘(справа). Водородные связи обозначены стрелками, соединяющими донорный азот и акцепторный атом кислорода. Нити пронумерованы в соответствии с их относительным положением в полипептидной последовательности.
3) Смешанный бета-лист — смесь параллельных и антипараллельных водородных связей. Около 20% всех бета-листов смешаны.
Образцы водородных связей в смешанном бета-листе (рисунок слева). Здесь схематически изображен четырехнитевой бета-лист, содержащий три антипараллельных нити и одну параллельную нить. Водородные связи между антипараллельными нитями показаны красными линиями, связи между параллельными нитями — зелеными линиями.
Некоторые из основных характеристик бета-листов включают:
- Расширенная конформация в бета-цепи составляет около 3.5 Â на остаток, а бета-цепи могут быть удлинены до 35 Â в длину.
- Общая геометрия листа не плоская, а скорее гофрированная, с чередующимися атомами углерода Сα над и под средней плоскостью листа.
- Из-за хиральности аминокислот (L-аминокислоты) все бета-цепи имеют правый поворот, тогда как бета-лист имеет общий левый поворот.
- Так как пряди не обязательно должны быть смежными в последовательности, существует множество возможных способов расположения прядей в листе, эти схемы называются топологиями и могут быть довольно сложными.
Включите боковые цепи в KiNG, чтобы проверить их расположение. Вдоль данной нити боковые цепи чередуются между одной стороной листа (золото) и другой (морем или небом). На соседних нитях чередование совпадает, так что боковые цепи образуют ряды, которые находятся в довольно тесном контакте. На параллельном бета-листе геометрия такова, что боковые цепи с разветвленными бета-углеродными атомами (Val, Ile или Thr) создают весьма благоприятный контакт вдоль ряда; поскольку эти позиции обычно скрыты и гидрофобны, результатом является то, что Val и Ile являются доминирующими остатками, обнаруженными в этих положениях.Краевые нити или самые концы данной нити могут подвергаться воздействию растворителя и часто имеют значительно больше гидрофильных остатков (как, например, здесь в строке 0 или Ser в цепи 3).
Некоторые тексты адаптированы из : «Белковый турист: ДВУСТОРОННИЕ ПАРАЛЛЕЛЬНЫЕ АЛЬФА / БЕТА-БЕЛКИ ИЛИ НУКЛЕОТИДСВЯЗЫВАЮЩИЕ ДОМЕНЫ» Дж. Ричардсон и Д.К. Ричардсон.
Бета-поворот
Повороты обычно происходят, когда белковой цепи необходимо изменить направление, чтобы соединить два других элемента вторичной структуры.Наиболее распространен бета-поворот, в котором изменение направления выполняется в пространстве четырех остатков. Некоторые часто наблюдаемые особенности бета-витков — это водородная связь между C = O остатка i и NH остатка i + 3 (то есть между первым и четвертым остатком поворота) и сильная тенденция к вовлечению глицина и / или пролин. Иногда вы слышите фразу «бета-шпилька», которую можно использовать для описания бета-поворота, соединяющего две антипараллельные бета-нити вместе. Бета витки подразделяются на многочисленные типы в зависимости от деталей их геометрии.
Гамма-повороты — это витки с тремя остатками, которые часто включают водородную связь между C = O остатка i и N-H остатка i + 2.
Случайная катушка
Некоторые участки белковой цепи не образуют регулярной вторичной структуры и не характеризуются каким-либо регулярным рисунком водородных связей. Эти области известны как случайные спирали и находятся в двух местах в белках:
- Концевые ветви — как на N-конце, так и на C-конце белка;
- Петли — Петли — это неструктурированные области между регулярными элементами вторичной структуры.
Случайные спирали могут иметь длину от 4 до 20 остатков, хотя большинство петель не длиннее 12 остатков. Большинство петель подвергаются воздействию растворителя и имеют полярные или заряженные боковые цепи. В некоторых случаях петли играют функциональную роль, но во многих случаях — нет. В результате области петель часто плохо консервативны (т.е. более подвержены изменениям) в процессе эволюции.
Некоторые тексты адаптированы из : «УПРАЖНЕНИЕ 3. ВТОРИЧНЫЕ СТРУКТУРЫ БЕЛКОВ» Ким М. Гернерт и Ким М.Китцлер.
Как мы узнали, порядок AA — это первичная структура, и все остатки в полипептидной цепи имеют одинаковые атомы основной цепи. Различаются боковые цепи (группы R). Определяют ли конкретные присутствующие AA вторичную структуру? Как показано на рисунке, все аминокислоты можно найти во всех элементах вторичной структуры, но некоторые из них более или менее распространены в определенных элементах. Pro и Gly, например, не очень хороши в спиралях, но их предпочитают в бета-поворотах.Если мы сделаем еще один шаг и спросим, определяют ли комбинации 2, 3 или 4 аминокислот вторичную структуру, мы обнаружим более сильную корреляцию, но все же недостаточно сильную, чтобы надежно предсказать третичную структуру.
Белки в изобилии присутствуют во всех организмах и имеют фундаментальное значение для жизни. Разнообразие структуры белков лежит в основе очень широкого спектра их функций: ферментов (биологических катализаторов), хранения, транспорта, мессенджеров, антител, регуляции и структурных белков.
Белки представляют собой линейные гетерополимеры фиксированной длины; то есть один тип белка всегда имеет одинаковое количество и состав АК, но разные белки могут иметь от 100 до более чем 1000 АК. Следовательно, существует большое разнообразие возможных белковых последовательностей. Линейные цепи складываются в определенные трехмерные конформации, которые определяются последовательностью аминокислот и, следовательно, также чрезвычайно разнообразны, от полностью волокнистых до глобулярных. Ковалентные дисульфидные связи могут быть введены между остатками цистеина, расположенными в непосредственной близости в трехмерном пространстве — это обеспечивает жесткость полученной трехмерной структуры.Ленточные диаграммы, подобные показанной здесь, являются обычным способом визуализации белков.
Белковые структуры могут быть определены на атомном уровне с помощью рентгеновской дифракции и нейтронографических исследований кристаллизованных белков, а в последнее время — с помощью спектроскопии ядерного магнитного резонанса (ЯМР) белков в растворе. Однако структуры многих белков остаются неопределенными.
Чтобы просмотреть пример третичной структуры в KiNG, щелкните здесь. Это рибонуклеаза А, фермент, ответственный за деградацию РНК.На изображении изображены все атомы одной половины молекулы (голубой для боковых цепей, коричневый для атомов водорода) и только основная цепь и боковые цепи для другой половины. Альтернативный вид показывает атомы основной цепи и водородные связи (фиолетовый). Нажмите «Анимировать», чтобы переключаться между видами.
Хотя атомы водорода составляют примерно половину атомов в белке, они редко показаны явно, потому что их трудно обнаружить с помощью рентгеновской кристаллографии (из-за низкой электронной плотности), и они очень усложняют картину.Это изображение рибонуклеазы представляет собой совместную структуру дифракции рентгеновских лучей / нейтронов, в которую всегда включены водороды. Даже без атомов H представление об атомах слишком тесно, чтобы быть очень полезным, но это хороший способ понять, откуда начинаются упрощенные версии.
Некоторые тексты адаптированы из : Дополнение Kinemage к Branden & Tooze «Введение в структуру белка», глава 2 — МОТИВЫ СТРУКТУРЫ БЕЛКА, Джейн С. и Дэвид К.Ричардсон.
Сворачивание белка — это физический процесс, с помощью которого линейный полипептид складывается в его характерную и функциональную трехмерную структуру. На сворачивание полипептидной цепи сильно влияет растворимость R-групп AA в воде. Каждый белок существует в виде развернутого полипептида или случайной спирали при трансляции из последовательности мРНК в линейную цепочку аминокислот. У этого полипептида отсутствует какая-либо стабильная (долговечная) трехмерная структура (левая часть соседнего рисунка).Аминокислоты взаимодействуют друг с другом, образуя четко определенную трехмерную структуру, свернутый белок (правая часть рисунка), известный как нативное состояние. Таким образом, вся информация для нативной складки, по-видимому, содержится в первичной структуре (Анфинсен получил за это Нобелевскую премию), а белки самосгибаются (хотя in vivo , сворачиванию полипептидов часто помогают дополнительные молекулы, известные как молекулярные шапероны. ).
Сведение к минимуму количества гидрофобных боковых цепей, подверженных воздействию воды (гидрофобный эффект), является важной движущей силой процесса складывания.Внутримолекулярные водородные связи также способствуют стабильности белка (подумайте об их важности во вторичных структурах). Ионные взаимодействия (притяжение между разноименными электрическими зарядами ионизированных R-групп) также вносят вклад в стабильность третичных структур. Дисульфидные мостики (ковалентные связи) между соседними остатками цистеина также могут стабилизировать трехмерные структуры. Обратите внимание, что дисульфидные связи редко наблюдаются во внутриклеточных белках из-за восстановления внутриклеточной среды.
Правильная трехмерная структура белка важна для его функции, хотя некоторые части функциональных белков могут оставаться развернутыми. Неспособность свернуться в нативную структуру обычно приводит к образованию неактивных белков, но в некоторых случаях неправильно свернутые белки имеют модифицированную или токсичную функциональность (например, прионы и амилоидные фибриллы). В соответствии с их функциональной важностью, трехмерные структуры белков более консервативны во время эволюции, чем первичные аминокислотные последовательности.
Для тех, кто хочет внести свой вклад в науку, играя в игры, я предлагаю вам попробовать FoldIt. Недавно игроки этой игры смогли правильно предсказать структуру ретровирусной протеазы. Тем, кто хочет, чтобы лишние циклы ЦП использовались с пользой, я предлагаю вам проверить Folding @ home.
Четвертичная структура белков представляет собой наиболее сложную степень организации, которая до сих пор считается отдельной молекулой. Чтобы считаться имеющим четвертичную структуру, белок должен иметь две или более пептидных цепей, образующих субъединицы.Субъединицы могут быть разными или одинаковыми и в большинстве случаев расположены симметрично. Обычно белок с двумя субъединицами называется димером; один с тремя субъединицами тример; и один с четырьмя субъединицами — тетрамер.
Изменения в четвертичной структуре могут происходить через конформационные изменения внутри отдельных субъединиц или за счет переориентации субъединиц относительно друг друга. Именно посредством таких изменений, которые лежат в основе кооперативности и аллостеризации «мультимерных» ферментов, многие белки регулируются и выполняют свои физиологические функции.Хорошим примером может служить ДНК-полимераза (см. Изображение) и ионные каналы. Субъединицы удерживаются вместе с помощью одних и тех же типов взаимодействий, которые стабилизируют третичную структуру белков.
Ведутся споры о том, следует ли определять четвертичную структуру для включения пептидов, связанных ковалентными (дисульфидными) связями. В CMB мы будем использовать четвертичную структуру для обозначения только расположения субъединиц, которые не связаны ковалентно, хотя ковалентные дисульфидные связи могут встречаться внутри отдельных субъединиц.
Структура белка | BioNinja
Понимание:
• Последовательность и количество аминокислот в полипептиде являются первичной структурой
Первичная (1º) структура
- Первый уровень структурной организации в белке — это порядок / последовательность аминокислот , составляющих полипептидную цепь
- Первичная структура образована ковалентными пептидными связями между амино и карбоксильные группы соседних аминокислот
- Первичная структура контролирует все последующие уровни организации белка, поскольку она определяет характер взаимодействий между группами R различных аминокислот
Понимание:
• Вторичная структура представляет собой образование α-спиралей и β-складчатых листов, стабилизированных водородными связями
Вторичная (2º) структура
- Вторичная структура — это способ сворачивания полипептида в повторяющуюся структуру с образованием α- спиралей и β-складчатых листов
- Это складывание является результатом водородной связи между аминогруппами и карбоксильными группами несмежных аминокислот
- Последовательности, которые не образуют ни альфа-спирали, ни бета-складчатого листа, будут существовать в виде случайной спирали
- Вторичная структура обеспечивает полипептидную цепь с уровень механической стабильности (из-за наличия водородных связей)
- На рисунках альфа-спирали представлены в виде спиралей (фиолетовый; слева) и бета-гофрированные листы в виде стрелок (синий; справа)
Понимание:
• Третичная структура — это дальнейшее сворачивание полипептида, стабилизируемое взаимодействиями между группами R
Третичная (3º) структура
- Третичная структура — это то, как полипептидная цепь скручивается и поворачивается, образуя сложную молекулярную форму (т.е.е. форма 3D )
- Это вызвано взаимодействиями между группами R ; включая Н-связи, дисульфидные мостики, ионные связи и гидрофобные взаимодействия
- Важны относительные положения аминокислот (например, неполярные аминокислоты обычно избегают воздействия водных растворов)
- Третичная структура может быть важной для функции белка (например, специфичность активного центра ферментов)
Понимание:
• Четвертичная структура существует в белках с более чем одной полипептидной цепью
Четвертичная (4º) структура
- Множественные полипептиды или простетических групп могут взаимодействовать с образованием одного, более крупного, биологически активного белка (четвертичная структура)
- Простетическая группа — это неорганическое соединение, участвующее в структуре белка или функция (например,г. группа гема в гемоглобине)
- Белок, содержащий простетическую группу, называется конъюгированным белком
- Четвертичные структуры могут удерживаться вместе различными связями (аналогично третичной структуре)
Сводка по четырем уровням структуры белка
Глава 2: Структура белка — химия
Глава 2: Структура белка
2.1 Структура и свойства аминокислот
2.2 Образование пептидной связи и структура первичного белка
2.3 Структура вторичного белка
2.4 Супервторичная структура и белковые мотивы
2,5 Структура третичного и четвертичного белка
2.6 Сворачивание, денатурация и гидролиз белков
2.7 Ссылки
2.1 Структура и свойства аминокислот
Белки являются одними из наиболее распространенных органических молекул в живых системах и обладают самым разнообразным набором функций среди всех макромолекул. Белки могут быть структурными, регуляторными, сократительными или защитными; они могут служить для транспортировки, хранения или перепонки; или они могут быть токсинами или ферментами. Каждая клетка живой системы может содержать тысячи различных белков, каждый из которых выполняет уникальную функцию. Их структуры, как и их функции, сильно различаются.Однако все они представляют собой полимеры альфа-аминокислот, расположенные в линейной последовательности и связанные друг с другом ковалентными связями.
Структура альфа-аминокислот
Основными строительными блоками белков являются альфа (α) аминокислоты . Как следует из названия, они содержат функциональную группу карбоновой кислоты и функциональную группу амина. Обозначение альфа используется, чтобы указать, что эти две функциональные группы отделены друг от друга одной углеродной группой.Помимо амина и карбоновой кислоты, альфа-углерод также присоединен к водороду и одной дополнительной группе, которая может различаться по размеру и длине. На схеме ниже эта группа обозначена как R-группа. В живых организмах в качестве строительных блоков белка используются 20 аминокислот. Они отличаются друг от друга только положением R-группы. Основная структура аминокислоты показана ниже:
Рисунок 2.1 Общая структура альфа-аминокислоты
Всего 20 альфа-аминокислот обычно включаются в белковые структуры (рисунок 2.Икс). Различные R-группы имеют разные характеристики в зависимости от природы атомов, включенных в функциональные группы. Есть R-группы, которые преимущественно содержат углерод и водород и очень неполярны или гидрофобны. Другие содержат полярные незаряженные функциональные группы, такие как спирты, амиды и тиолы. Некоторые аминокислоты являются основными (содержащие функциональные аминогруппы) или кислотными (содержащими функциональные группы карбоновых кислот). Эти аминокислоты способны образовывать полные заряды и могут взаимодействовать с ионами.Каждая аминокислота может быть сокращена с использованием трехбуквенного и однобуквенного кода.
Рис. 2.2 Структура 20 альфа-аминокислот, используемых в синтезе белка. R-групп обозначены обведенными / окрашенными участками каждой молекулы. Цвета указывают на определенные классы аминокислот: гидрофобные — зеленый и желтый, гидрофильные полярные незаряженные — оранжевый, гидрофильные кислые — синие, гидрофильные основные — розовые.
Щелкните здесь, чтобы загрузить версию таблицы аминокислот
Неполярные (гидрофобные) аминокислоты
Неполярные аминокислоты в значительной степени можно подразделить на два более конкретных класса: алифатические аминокислоты, аминокислоты и ароматические аминокислоты. алифатические аминокислоты (глицин, аланин, валин, лейцин, изолейцин и пролин) обычно содержат разветвленные углеводородные цепи, от простейших — от глицина до более сложных структур лейцина и валина. Пролин также классифицируется как алифатическая аминокислота, но обладает особыми свойствами, поскольку углеводородная цепь циклизована с концевым амином, создавая уникальную 5-членную кольцевую структуру. Как мы увидим в следующем разделе, посвященном первичной структуре, пролин может значительно изменить трехмерную структуру из-за структурной жесткости кольцевой структуры, когда он включен в полипептидную цепь и обычно находится в областях белка, где возникают складки или повороты.
Ароматические аминокислоты (фенилаланин, тирозин и триптофан), , как следует из их названия, содержат ароматические функциональные группы в своей структуре, что делает их в значительной степени неполярными и гидрофобными из-за высокого содержания углерода / водорода. Однако следует отметить, что гидрофобность и гидрофильность представляют собой скользящую шкалу, и каждая из различных аминокислот может иметь разные физические и химические свойства в зависимости от своей структуры. Например, гидроксильная группа, присутствующая в тирозине, увеличивает его реакционную способность и растворимость по сравнению с фенилаланином.
Метионин, одна из серосодержащих аминокислот обычно классифицируется как неполярные, гидрофобные аминокислоты, поскольку концевая метильная группа создает функциональную группу тиоэфира, которая обычно не может образовывать постоянный диполь внутри молекулы и сохраняет низкую растворимость.
Полярные (гидрофильные) аминокислоты
Полярные гидрофильные аминокислоты можно подразделить на три основных класса: полярные незаряженные, кислотные и основные функциональные группы.В пределах полярного незаряженного класса боковые цепи содержат гетероатомы (O, S или N), которые способны образовывать постоянные диполи в R-группе. К ним относятся гидроксил- и сульфоксилсодержащие аминокислоты, серин, треонин и цистеин и амидосодержащие аминокислоты, глутамин и аспаригин. Две аминокислоты, глутаминовая кислота (глутамат) и аспарагиновая кислота (аспартат) составляют кислые аминокислоты и содержат боковые цепи с функциональными группами карбоновых кислот, способными полностью ионизоваться в растворе.Основные аминокислоты , лизин, аргинин и гистидин содержат функциональные аминогруппы, которые можно протонировать, чтобы нести полный заряд.
Многие из аминокислот с гидрофильными R-группами могут участвовать в активном сайте ферментов. Активный центр — это часть фермента, которая напрямую связывается с субстратом и осуществляет реакцию. Белковые ферменты содержат каталитических групп , состоящих из R-групп аминокислот, которые способствуют образованию и разрушению связей.Аминокислоты, которые играют значительную роль в специфичности связывания активного сайта, обычно не соседствуют друг с другом в первичной структуре, но образуют активный сайт в результате сворачивания при создании третичной структуры, как вы увидите позже в глава.
Белковые структуры, построенные из основных аминокислот, могут состоять из сотен аминокислот. Таким образом, для простоты 20 аминокислот, используемых для синтеза белка, имеют сокращения как трехбуквенного, так и однобуквенного кода (Таблица 2.1). Эти сокращения обычно используются для обозначения белковых последовательностей в биоинформатических и исследовательских целях.
Таблица 2.1 Аббревиатуры α-аминокислот
Мысленный вопрос: Триптофан содержит функциональную группу амина, почему триптофан не является основным?
Ответ: Триптофан содержит индольную кольцевую структуру, которая включает функциональную группу амина. Однако из-за близости и электроноакцепторной природы ароматической кольцевой структуры неподеленная пара электронов на азоте недоступна для принятия протона.Вместо этого они участвуют в образовании связей p- в нескольких различных резонансных структурах, возможных для индольного кольца. На рис. 2.3A показаны четыре возможные резонансные структуры для индола. И наоборот, в структуре имидазольного кольца, обнаруженной в гистидине, есть два атома азота, один из которых участвует в образовании резонансных структур (азот № 1 на рисунке 2.3B) и не может принимать протон, а другой (азот № 3 ), которая имеет неподеленную пару электронов, которая может принять протон.
Рис. 2.3 Сравнение структурной доступности неподеленной пары электронов на азоте для принятия протона в кольцевой структуре индола и иммидизола . (A) Показаны четыре резонансные структуры индольной кольцевой структуры, демонстрирующие, что неподеленная пара электронов на азоте участвует в образовании pi -связей. (B) Кольцевая структура имидазола имеет один азот (1), который участвует в резонансных структурах (не показаны) и не может принимать протон, в то время как второй азот (3) имеет неподеленную пару электронов, доступных для принятия протона. как показано.
Работай самостоятельно:
В приведенном выше примере опишите с помощью химической диаграммы, почему амидные атомы азота, содержащиеся в аспарагине и глутамине, не являются основными.
Альфа-аминокислоты — хиральные молекулы
Если вы изучите структуру альфа-углерода в каждой из аминокислот, вы заметите, что все аминокислоты, за исключением глицина, являются хиральными молекулами (Рисунок 2.4) Хиральная молекула — это молекула, которая не накладывается на свое зеркальное отображение. Как левая и правая руки с большим пальцем и пальцами в одном порядке, но являются зеркальными, а не одинаковыми, к хиральным молекулам прикреплены одни и те же элементы в одном и том же порядке, но они являются зеркальными, а не одинаковыми. Версии хиральных молекул с зеркальным отображением обладают физическими свойствами, которые почти идентичны друг другу, поэтому их очень трудно отличить друг от друга или разделить.Из-за этой природы им дано специальное название стереоизомера — энантиомеры , и фактически сами соединения получили такое же название! Эти молекулы действительно различаются тем, как они вращают простой поляризованный свет, и тем, как они реагируют и взаимодействуют с биологическими молекулами. Молекулы, вращающие свет в правостороннем направлении, называются правовращающими и обозначаются буквой D. Молекулы, которые вращают свет в левом направлении, называются левовращающими и обозначаются буквой L, чтобы отличить один энантиомер от другого.D- и L-формы аланина показаны на рисунке 2.4B.
Хотя большинство аминокислот могут существовать как в левосторонней, так и в правосторонней формах, жизнь на Земле состоит почти исключительно из левосторонних аминокислот. Протеогенные аминокислоты, включенные в белки рибосомами, всегда находятся в L-конформации. Некоторые бактерии могут включать D-аминокислоты в пептиды, не кодируемые рибосомами, но D-аминокислоты в природе используются редко. Интересно, что когда мы обсудим структуру сахаров в главе XX, мы обнаружим, что сахара, которые включены в углеводные структуры, почти исключительно находятся в D-конформации.Никто не знает, почему это так. Однако доктор. Джон Кронин и Сандра Пиццарелло показали, что из аминокислот, которые падают на Землю из космоса на метеоритах, больше находится в L-конформации, чем в D-конформации. Таким образом, то, что мы состоим преимущественно из L-аминокислот, может быть связано с аминокислотами из космоса.
Почему аминокислоты в космосе благоприятствуют L-конформации? Никто точно не знает, но известно, что излучение также может существовать в левосторонней и правосторонней формах. Итак, существует теория под названием гипотеза Боннера , которая предполагает, что преобладающие формы излучения в космосе (т. Е.от вращающейся нейтронной звезды, например) может привести к селективному образованию гомохиральных молекул, таких как L-аминокислоты и D-сахара. Это все еще спекулятивно, но недавние открытия метеоритов делают эту гипотезу гораздо более правдоподобной.
Рисунок 2.4 Хиральность аминокислот. За исключением простейшей аминокислоты, глицина, все другие аминокислоты, которые включены в белковые структуры, имеют хиральную природу. (A) Демонстрирует хиральность структуры основной альфа-аминокислоты при использовании неспецифической R-группы.(B) Пара энантиомеров D- и L-аланина, верхняя диаграмма представляет модель шара и клюшки, а нижняя диаграмма представляет линейную структуру.
Изображение (A) из NASA
Обратите внимание, что обозначения D и L — это особые термины, используемые для того, как молекула вращает простой поляризованный свет. Это не означает абсолютную стереоконфигурацию молекулы. Абсолютная конфигурация относится к пространственному расположению атомов хирального молекулярного объекта (или группы) и его стереохимическому описанию. E.г. R или S , имея в виду Rectus или Sinister соответственно.
Абсолютные конфигурации хиральной молекулы (в чистом виде) чаще всего получают с помощью рентгеновской кристаллографии. Альтернативными методами являются оптическая вращательная дисперсия, колебательный круговой дихроизм, использование реагентов хирального сдвига в протонном ЯМР и визуализации кулоновского взрыва. После получения абсолютной конфигурации назначение R или S основано на правилах приоритета Кана – Ингольда – Прелога, , которые можно просмотреть, перейдя по ссылке и на рисунке 2.5. Все хиральные аминокислоты, кроме цистеина, также находятся в S-конформации. Цистеин содержит атом серы, из-за чего R-группа имеет более высокий приоритет, чем функциональная группа карбоновой кислоты, что приводит к R-конформации для абсолютной стереохимии. Однако цистеин действительно вращает простой поляризованный свет в левовращающем или левовращающем направлении. Таким образом, R- и S-обозначения не всегда соответствуют D- и L-конформации.
Рисунок 2.5 Абсолютная конфигурация определяется обозначениями Rectus (R) и Sinister (S). В системе Кан-Ингольда Прелога для наименования хиральных центров группы, присоединенные к хиральному центру, ранжируются в соответствии с их атомным номером, причем наивысший атомный номер получает наивысший приоритет (A на диаграмме выше), а наименьший атомный номер получает наименьший приоритет (D на диаграмме выше). Затем зритель с самым низким приоритетом направляет его в сторону, чтобы правильно сориентировать молекулу для дальнейшей оценки.Затем отслеживается путь приоритетов №1, №2 и №3 (соответствующих A, B и C выше). Если путь идет по часовой стрелке, хиральному центру присваивается R-обозначение, тогда как если путь идет против часовой стрелки, ему дается S-обозначение.
Изображение из Википедия
Аминокислоты — цвиттерионы
В химии цвиттерион представляет собой молекулу с двумя или более функциональными группами, из которых по крайней мере одна имеет положительный, а другая отрицательный электрический заряд, а общий заряд всей молекулы равен нулю при определенном pH.Поскольку они содержат по крайней мере один положительный и один отрицательный заряд, цвиттерионы также иногда называют внутренними солями . Заряды на различных функциональных группах уравновешивают друг друга, и молекула в целом может быть электрически нейтральной при определенном pH. PH, при котором это происходит, известен как изоэлектрическая точка .
В отличие от простых амфотерных соединений, которые могут образовывать только или катионные или анионные частицы, цвиттерион одновременно имеет оба ионных состояния.Аминокислоты являются примерами цвиттерионов (рис. 2.6). Эти соединения содержат аммонийную и карбоксилатную группы, и их можно рассматривать как возникающие в результате своего рода внутримолекулярной кислотно-основной реакции: аминогруппа депротонирует карбоновую кислоту.
Рис. 2.6 Аминокислоты — это цвиттерионы. Аминокислота содержит как кислотные (фрагмент карбоновой кислоты), так и основные (фрагмент амина) центры. Изомер справа — это цвиттерионная форма.
Поскольку аминокислоты являются цвиттер-ионами, а некоторые из них также содержат потенциал для ионизации в своих R-группах, их состояние заряда in vivo , и, таким образом, их реакционная способность может варьироваться в зависимости от pH, температуры и сольватационного статуса локальных микросреда, в которой они расположены.Таблица стандартных значений pK a для аминокислот показана в таблице 2.1 и может использоваться для прогнозирования состояния ионизации / заряда аминокислот и получаемых ими пептидов / белков. Однако следует отметить, что статус сольватации в микроокружении аминокислоты может изменять относительные значения pK a этих функциональных групп и обеспечивать уникальные реактивные свойства в активных центрах ферментов (таблица 2.1). Более подробное обсуждение эффектов десольватации будет дано в главе XX, посвященной механизмам ферментативных реакций.
Таблица 2.1
Версия для печати значений pKa
Как видно из таблицы 2.1, семь аминокислот содержат R-группы с ионизируемыми боковыми цепями и обычно находятся в активных центрах ферментов. Напомним, что pK a определяется как pH, при котором ионизированная и неионизированная формы ионизируемой функциональной группы в молекуле существуют в равных концентрациях. Таким образом, когда функциональная группа сдвигается выше или ниже ее значения pK — , произойдет сдвиг в концентрациях ионизированных и неионизированных форм, в пользу одного состояния по сравнению с другим.На рис. 2.7 показаны различные R-группы в их неионизированном и ионизированном состояниях и их предпочтительные состояния выше или ниже значения pK a .
Рис. 2.7 Ионизируемые функциональные группы в обычных аминокислотах. Во всех аминокислотах как функциональная группа карбоновой кислоты (C-конец), так и функциональная группа амина (N-конец) способны к ионизации. Кроме того, семь аминокислот (аспарагиновая кислота, глутаминовая кислота, аргинин, гистидин, лизин, тирозин и цистеин) также содержат ионизируемые функциональные группы в своих R-группах.Предпочтительные состояния функциональной группы показаны либо выше, либо ниже их соответствующих значений pK a .
Обычно ионизируемая группа будет благоприятствовать протонированному состоянию в условиях pH ниже ее соответствующих значений pK a и будет благоприятствовать депротонированному состоянию в условиях pH выше ее соответствующего значения pK a . Таким образом, значения pK и могут использоваться для помощи в прогнозировании общих зарядовых состояний аминокислот и их результирующих пептидов / белков в определенной среде.Например, если мы посмотрим на кривую титрования основной аминокислоты, гистидина (рис. 2.8). При достижении каждого pK a состояние заряда аминокислоты изменяется в пользу депротонированного состояния. Таким образом, гистидин будет медленно прогрессировать от общего заряда +2 при очень низком pH (полностью протонированный) до общего заряда -1 при очень высоком pH (полностью депротонирован).
Рис. 2.8 Состояние ионизации гистидина в средах с различным pH. (A) Кривая титрования гистидина от низкого pH до высокого pH.Указывается каждая точка эквивалентности (pK a ). (B) Показывает благоприятное состояние ионизации гистидина после прохождения каждого pK значения .
Изображение адаптировано из L. Van Warren
Дополнительная практика:
Нарисуйте глутаминовую кислоту и спрогнозируйте общее состояние заряда аминокислоты при pH = 1, pH = 3, pH = 7 и pH = 12.
Образование цистеиновой и дисульфидной связи
Цистеин также является уникальной аминокислотой, поскольку эта боковая цепь способна подвергаться обратимой окислительно-восстановительной ( редокс ) реакции с другими остатками цистеина, создавая ковалентную дисульфидную связь в окисленном состоянии (Рисунок 2.9). Вспомните, что когда молекулы окисляются, они теряют электроны, а когда молекулы восстанавливаются, они приобретают электроны. Во время биологических окислительно-восстановительных реакций ионы водорода ( протонов, ) часто удаляются с электронами из молекулы во время окисления и возвращаются во время восстановления. Таким образом, если реакция теряет или набирает протоны, это хороший признак того, что она также теряет или получает электроны и что происходит окислительно-восстановительная реакция.Таким образом, получение или потеря протонов может быть простым способом идентифицировать этот тип реакции.
Дисульфидные связи являются неотъемлемой частью образования трехмерной структуры белков и, следовательно, могут сильно влиять на функцию получаемого белка. В клеточных системах образование / разрыв дисульфидной связи является ферментно-опосредованной реакцией и может использоваться в качестве механизма для контроля активности белка. Дисульфидные связи будут обсуждаться более подробно в разделе 2.xx данной главы и в главе XX.
Рис. 2.9. Цистеин может окисляться с образованием дисульфидных связей. Во время образования дисульфидной связи два цистеина окисляются с образованием молекулы цистина. Это требует потери двух протонов и двух электронов.
назад к началу
2.2 Образование пептидной связи и структура первичного белка
В клеточных системах белки связаны между собой большим ферментным комплексом, который содержит смесь РНК и белков.Этот комплекс называется рибосомой . Таким образом, поскольку аминокислоты связаны друг с другом, чтобы сформировать определенный белок, они расположены в очень определенном порядке, который диктуется генетической информацией, содержащейся в молекуле информационной РНК (мРНК). Этот специфический порядок аминокислот известен как первичная последовательность белка . Механизм трансляции, используемый рибосомой для синтеза белков, будет подробно обсужден в главе XX.В этой главе основное внимание будет уделено химической реакции, происходящей во время синтеза, и физическим свойствам полученных пептидов / белков.
Первичная последовательность белка связана вместе с использованием дегидратационного синтеза (потеря воды), которые объединяют карбоновую кислоту вышележащей аминокислоты с аминогруппой нижележащей аминокислоты с образованием амидной связи (рис. 2.10). ). Точно так же обратная реакция — это гидролиз и требует включения молекулы воды для разделения двух аминокислот и разрыва амидной связи.Примечательно, что рибосома служит ферментом, который опосредует реакции синтеза дегидратации, необходимые для построения белковых молекул, тогда как класс ферментов, называемых протеазами , , необходим для гидролиза белка.
В белковых структурах амидная связь между аминокислотами известна как пептидная связь . Последующие аминокислоты будут добавлены на конце карбоновой кислоты растущего белка.Таким образом, белки всегда синтезируются направленным образом, начиная с амина и заканчивая хвостом карбоновой кислоты. Новые аминокислоты всегда добавляются к хвосту карбоновой кислоты, а не к амину первой аминокислоты в цепи. Направленность синтеза белка определяется рибосомой и известна как синтез N- в C .
Рисунок 2.10 Формирование пептидной связи. Добавление двух аминокислот для образования пептида требует синтеза дегидратации.
Как отмечалось выше в разделе цвиттер-ионов, амидные связи имеют резонансную структуру, которая не позволяет атомной неподеленной паре электронов действовать как основание (рис. 2.11).
Рисунок 2.11 Резонансная структура амида. Во время амидного резонанса неподеленные пары электронов азота участвуют в образовании pi -связи с карбонильным углеродом, образующим двойную связь. Таким образом, амидные атомы азота не являются основными. Кроме того, связь C-N в амидной структуре зафиксирована в пространстве и не может вращаться из-за характера связи pi- .
Изображение В.К. Чанг
Вместо этого они участвуют в образовании связи — с карбонильным углеродом. Кроме того, связь C-N в амидной структуре зафиксирована в пространстве и не может вращаться из-за характера связи pi- . Это создает фиксированные физические положения R-групп в растущем пептиде либо в конформации цис или транс . Поскольку R-группы могут быть довольно объемными, они обычно чередуются по обе стороны от растущей белковой цепи в конформации транс .Конформация цис предпочтительна только с одной конкретной аминокислотой, пролином . Это связано с циклической структурой R-группы пролина и стерическими препятствиями, которые возникают, когда пролин принимает конформацию trans (рис. 2.12). Таким образом, остатки пролина могут иметь большое влияние на трехмерную структуру полученного пептида.
Рисунок 2.12 Конформация Cis и Trans R-групп аминокислот. Верхняя диаграмма отображает конформации цис и транс двух соседних аминокислот, обозначенных как X и Y, которые обозначают любую из 20 аминокислот, за исключением пролина. В конформации trans R-группа из аминокислоты X повернута в сторону и находится на другой стороне молекулы по сравнению с R-группой из аминокислоты Y. Эта конформация дает наименьшее количество стерических препятствий по сравнению с cis конформация, в которой R-группы расположены с одной стороны и в непосредственной близости друг от друга.На нижней диаграмме любая аминокислота X расположена перед остатком пролина. Из-за циклизации пролиновой R-группы с амидным азотом в основной цепи это смещает положение пролиновой R-группы, чтобы быть ближе к R-группе от аминокислоты X, когда она принимает конформацию trans . . Таким образом, пролин отдает предпочтение конформации цис , которая имеет меньшие стерические препятствия.
Белки — очень большие молекулы, содержащие много аминокислотных остатков, связанных вместе в очень определенном порядке.Белки имеют размер от 50 аминокислот до самого большого известного белка, содержащего 33 423 аминокислоты. Макромолекулы, содержащие менее 50 аминокислот, известны как пептиды (рис. 2.13).
Рис. 2.13. Пептиды и белки — это макромолекулы, состоящие из длинных цепочек аминокислот, соединенных вместе амидными связями. Порядок и природа аминокислот в первичной последовательности белка определяют структуру укладки белка на основе окружающей среды белка (то есть, если он находится внутри клетки, он, вероятно, окружен водой в очень полярной среде. , тогда как если белок встроен в плазматическую мембрану, он будет окружен очень неполярными углеводородными хвостами).
Благодаря большому количеству аминокислот, которые могут быть включены в каждое положение в белке, существуют миллиарды различных возможных комбинаций белков, которые можно использовать для создания новых белковых структур! Например, представьте себе трипептид, полученный из этого пула аминокислот. В каждой позиции есть 20 различных опций, которые могут быть включены. Таким образом, общее возможное количество образующихся трипептидов составило бы 20 X 20 X 20 или 20 3 , что равняется 8000 различных вариантов трипептидов! А теперь подумайте, сколько вариантов было бы для небольшого пептида, содержащего 40 аминокислот.Будет 20 40 вариантов или ошеломляющая цифра 1,09 X 10 52 возможных вариантов последовательности! Каждый из этих вариантов может различаться по общей форме белка, поскольку природа боковых цепей аминокислот помогает определить взаимодействие белка с другими остатками в самом белке и с окружающей его средой.
Характер аминокислот по всему белку помогает белку складываться и формировать его трехмерную структуру. Именно эта трехмерная форма требуется для функциональной активности белка (т. Е. форма белка = функция белка ). Для белков, находящихся в водной среде клетки, гидрофобные аминокислоты часто находятся внутри структуры белка, тогда как водолюбивые гидрофильные аминокислоты будут на поверхности, где они могут связываться водородом и взаимодействовать с молекулами воды. Пролин уникален, потому что он имеет единственную R-группу, которая образует циклическую структуру с аминогруппой в основной цепи. Эта циклизация заставляет пролин принимать конформацию цис , а не конформацию транс в основной цепи.Этот сдвиг в структуре часто означает, что пролины представляют собой положения, в которых происходят изгибы или изменения направления внутри белка. Метионин уникален тем, что он служит исходной аминокислотой почти для всех из многих тысяч белков, известных в природе. Цистеины содержат тиоловые функциональные группы и, таким образом, могут окисляться другими остатками цистеина с образованием ковалентных дисульфидных связей в структуре белка (рис. 2.14). Дисульфидные мостики добавляют дополнительную стабильность трехмерной структуре и часто требуются для правильного сворачивания и функционирования белка (рис.2.14).
Рисунок 2.14 Дисульфидные связи. Дисульфидные связи образуются между двумя остатками цистеина в пептидной или белковой последовательности или между различными пептидными или белковыми цепями. В приведенном выше примере изображены две пептидные цепи, которые образуют гормон инсулин. Дисульфидные мостики между двумя цепями необходимы для правильного функционирования этого гормона по регулированию уровня глюкозы в крови.
Изображение предоставлено: CNX OpenStax через Wikimedia Commons
Форма и функции белка
Первичная структура каждого белка приводит к уникальному паттерну сворачивания, который характерен для этого конкретного белка.Таким образом, первичная последовательность — это линейный порядок аминокислот, поскольку они связаны вместе в белковой цепи (рис. 2.15). В следующем разделе мы обсудим сворачивание белка, которое приводит к образованию вторичных, третичных, а иногда и четвертичных белковых структур.
Рис. 2.15. Первичная структура белка представляет собой линейную последовательность аминокислот.
(кредит: модификация работы Национального исследовательского института генома человека)
назад к началу
2.3 Структура вторичного белка
В предыдущем разделе мы отметили жесткость, создаваемую связью CN в амидной связи, когда аминокислоты соединяются друг с другом, и узнали, что это приводит к тому, что R-группы аминокислот благоприятствуют конфромации транс (за исключением пролина, который поддерживает конформацию цис ). Эта жесткость каркаса белка ограничивает потенциал сворачивания и структуру получаемого белка. Однако связи, прикрепленные к α-углероду, могут свободно вращаться и вносить свой вклад в гибкость и уникальные паттерны сворачивания, наблюдаемые внутри белков.Чтобы оценить возможные модели вращения, которые могут возникнуть вокруг α-углерода, обычно измеряются торсионные углы Phi (Φ) и Psi (ψ). Угол кручения Phi (Φ) измеряет вращение вокруг связи α-углерод-азот, оценивая угол между двумя соседними карбонильными атомами углерода, когда вы смотрите прямо вниз по связи α-углерод-азот в плоскость бумаги (рис. 2.16). ). И наоборот, торсионный угол Psi (ψ) измеряет вращение вокруг связи α-углерод-карбонильный углерод, оценивая угол между двумя соседними атомами азота, когда вы смотрите прямо вниз на связь α-углерод-карбонильный углерод (Рисунок 2.16).
Рисунок 2.16 Торсионные углы Phi (Φ) и Psi (ψ). (A) Торсионный угол Phi (Φ) является мерой вращения вокруг связи между α-углеродом и амидным азотом. Он измеряется как угол между двумя карбонильными атомами углерода, примыкающими к связи, показанный на нижней панели. (B) Торсионный угол Psi (ψ) является мерой вращения вокруг связи между α-углеродом и карбонильным углеродом. Он измеряется как угол между двумя атомами азота, примыкающими к связи, показанный на нижней панели.
В то время как связи вокруг α-углерода могут вращаться свободно, предпочтительные торсионные углы ограничены меньшим набором возможностей, поскольку соседние атомы избегают конформаций, которые имеют высокие стерические препятствия, связанные с ними. Г. Рамачандран создал компьютерные модели небольших пептидов для определения стабильных конформаций торсионных углов Phi (Φ) и Psi (ψ). На основе своих результатов он создал так называемый график Рамачандрана, который графически отображает области перекрытия наиболее благоприятных торсионных углов Phi (Φ) и Psi (ψ) (Рисунок 2.17)
Рисунок 2.17 График Рамачандрана. Благоприятный и очень благоприятный торсионные углы Phi (Φ) и Psi (ψ) обозначены желтым и красным соответственно. Указаны углы связи для общих вторичных белковых структур.
Изображение изменено с: J. Cooper
Внутри каждого белка небольшие участки белка могут принимать специфические повторяющиеся паттерны сворачивания. Эти специфические мотивы или узоры называются вторичной структурой .Двумя наиболее распространенными вторичными структурными особенностями являются альфа-спираль и бета-гофрированный лист (рис. 2.18). Внутри этих структур внутримолекулярные взаимодействия, особенно водородная связь между амином основной цепи и карбонильными функциональными группами, имеют решающее значение для поддержания трехмерной формы.
Рис. 2.18. Вторичные структурные особенности в структуре белка. Правая альфа-спираль и бета-складчатый лист являются общими структурными мотивами, обнаруженными в большинстве белков.Они удерживаются вместе за счет водородной связи между амином и карбонильным кислородом в основной цепи аминокислоты.
Изображение изменено из: The School of Biomedical Sciences Wiki
Альфа Спираль
Для альфа-спиральных структур очень распространена правая спираль, тогда как левые спирали очень редки. Это связано с торсионными углами Phi (Φ) и Psi (ψ), необходимыми для получения левой альфа-спиральной структуры.Чтобы получить правильную ориентацию левой спирали, белку придется складываться и скручиваться под множеством неблагоприятных углов. Таким образом, они не очень распространены в природе.
Для правой альфа-спирали каждый виток спирали содержит 3,6 аминокислотных остатка (рис. 2.19). Группы R (вариантные группы) полипептида выступают из -спиральной цепи . Основная цепь полипептида образует повторяющуюся спиральную структуру, которая стабилизируется водородными связями между кислородом карбонила и водородом амина.Эти водородные связи возникают через равные промежутки между одной водородной связью на каждую четвертую аминокислоту и заставляют основную цепь полипептида образовывать спираль. Каждая аминокислота продвигает спираль вдоль своей оси на 1,5 Å. Каждый виток спирали состоит из 3,6 аминокислот; следовательно, шаг спирали 5,4 Å. На спираль приходится в среднем десять аминокислотных остатков. Различные аминокислоты имеют разную склонность к образованию α -спирали. Аминокислоты, которые предпочитают принимать спиральные конформации в белках, включают метионин, аланин, лейцин, глутамат и лизин.Пролин и глицин почти не склонны к образованию спиралей.
Рис. 2.19. Структура правой альфа-спирали. (A) Модель шара и рукояти, вид сбоку. Всего требуется 3,6 аминокислоты, чтобы сформировать один виток α -спирали. Водородная связь между кислородом карбонила и азотом 4-й аминокислоты стабилизирует спиральную структуру. На показанной структуре черные атомы представляют собой альфа-углерод, серый — карбонильные углероды, красный — кислород, синий — азот, зеленый — R-группы и светло-фиолетовый — атомы водорода.(B) Расширенный вид сбоку, линейная структура и модель заполнения пространства (C) Расширенный вид сверху, линейная структура и модель заполнения пространства
Изображение A изменено с: Максим Изображение B и C предоставлено: Генри Якубовски
Ключевые моменты об альфа-спирали:
- Альфа-спираль более компактна, чем полностью вытянутая полипептидная цепь с углами phi / psi 180 o
- В белках среднее количество аминокислот в спирали составляет 11, что дает 3 витка.
- Левая альфа-спираль, хотя и разрешенная при осмотре графика Рамачандрана, наблюдается редко, поскольку аминокислоты, используемые для построения структуры белка, являются L-аминокислотами и смещены в сторону образования правой спирали. Когда все же образуются левые спирали, они часто имеют решающее значение для правильного сворачивания белка, стабильности белка или непосредственно участвуют в формировании активного центра.
Рисунок 2.20 Левосторонняя структура альфа-спирали. На этой диаграмме левая альфа-спираль, показанная желтым цветом, является частью витка шпильки в структуре белка и стабилизирована двумя дисульфидными мостиками, показанными желтым цветом.
Рисунок из: Annavarapu, S., Nanda, V. (2009) BMC Struct Biol 9, 61
- Сердцевина спирали набита плотно. В спирали нет отверстий и пор.
- Все R-группы простираются наружу и от оси спирали. R-группы могут быть гидрофильными или гидрофобными и могут располагаться в определенных положениях на спирали, образуя амфипатические области на белке, или полностью гидрофобные спирали могут также проходить через плазматическую мембрану, как показано на рис. 2.21
Рис. 2.21. Расположение R-групп в альфа-спиральных структурах. R-группы могут быть расположены внутри альфа-спирали для создания амфипатических областей внутри белка, где гидрофильные остатки расположены с одной стороны спирали, а гидрофобные — с другой, как показано на виде сбоку (A) или сверху вниз ( ДО НАШЕЙ ЭРЫ).R-группы также могут быть полностью гидрофобными в альфа-спиралях, охватывающих плазматическую мембрану, как показано на (D).
Рисунок изменен по: Khara, J.S., et al. (2017) Acta Biomat 57: 103-114 и Ryu, H., et al. (2019) Int J Mol Sci 20 (6) 1437
- Некоторые аминокислоты чаще встречаются в альфа-спиралях, чем другие. Вот аминокислоты, которые обычно НЕ обнаруживаются в альфа-спиральных структурах: Gly слишком мал и конформационно гибок, чтобы его можно было найти с высокой частотой в альфа-спиралях, в то время как Pro слишком жесткий и в цис -конформации. Pro часто нарушает спиральную структуру, вызывая изгибы белка. Некоторые аминокислоты с боковыми цепями, которые могут связывать Н-связь ( Ser, Asp, и Asn ) и не слишком долго действуют как конкуренты донора и акцептора Н-связи основной цепи и дестабилизируют альфа спирали. R-группы с ранним ветвлением, такие как Val и Ile, дестабилизируют альфа-спираль из-за стерических взаимодействий объемных боковых цепей с основной цепью спирали.
- Краткое изложение склонности аминокислот к альфа-спиралям (а также к бета-структуре)
- Альфа-кератины, основной компонент волос, кожи, меха, клювов и ногтей, почти полностью представляют собой альфа-спираль.
Jmol: Обновлено Изолированная спираль из антифриза белка Jmol14 (Java) | JSMol (HTML5)
Бета-гофрированный лист:
В β-складчатом листе «складки» образованы водородными связями между атомами в основной цепи полипептидной цепи.Группы R присоединены к атомам углерода и проходят выше и ниже складок складки в конформации trans . Складчатые сегменты выстраиваются параллельно или антипараллельно друг другу, а водородные связи образуются между частично положительным атомом азота в аминогруппе и частично отрицательным атомом кислорода в карбонильной группе остова пептида (рис. 2.21).
Рисунок 2.21 Структура листа с бета-гофрировкой. β-гофрированный лист может быть ориентирован в параллельной или антипараллельной ориентации, как показано на (A) выше, с β-гофрированным листом, представленным красными стрелками.Направление стрелки указывает ориентацию белка, при этом стрелка проходит в направлении от N к C. Водородная связь между карбонилом основной цепи и функциональными аминогруппами основной цепи стабилизировала как антипараллельные (B слева), так и параллельные (B справа) β-складчатые листовые структуры.
Изображение (A) с: Xenoblast Изображение (B) с: Fvasconcellos
Другие мотивы вторичной структуры:
Другие важные вторичные структуры включают витков, петель, шпильки и гибкие линкеры .Существует множество различных классификаций витков в структуре белка, включая α-витков, β-витков, γ-витков, δ-витков и π-витков . β-витки (наиболее распространенная форма) обычно содержат четыре аминокислотных остатка (рис. 2.22). Пролин и глицин обычно встречаются в поворотных мотивах, так как цис-конформация пролина способствует более резким конформационным изгибам, в то время как минимальная боковая цепь глицина позволяет более плотно упаковывать аминокислоты, чтобы способствовать структуре поворота.
Рисунок 2.22. Схема β-витков типа I и II.
Фотография из: Muskid
ω-петля — универсальный термин для более длинных, расширенных или нерегулярных петель без фиксированной внутренней водородной связи. Шпилька — это особый случай поворота, при котором направление основной цепи белка меняется на противоположное и фланкирующие элементы вторичной структуры взаимодействуют. Например, шпилька beta соединяет две антипараллельные β-нити с водородными связями.Иногда повороты обнаруживаются внутри гибких линкеров или петель, соединяющих белковые домены. Линкерные последовательности различаются по длине и обычно богаты полярными незаряженными аминокислотами. Гибкие линкеры позволяют соединительным доменам свободно скручиваться и вращаться для рекрутирования своих партнеров по связыванию через динамику белковых доменов.
назад к началу
2.4 Супервторичная структура и белковые мотивы
Между вторичной структурой и третичной структурой белков находятся более крупные трехмерные особенности, которые были идентифицированы во множестве различных белковых структур.Они известны как супервторичная структура и белок мотивы . Супервторичная структура обычно состоит из двух вторичных структур, связанных между собой витком, и включает спираль-виток-спираль, спираль-петля-спираль, α-α-углы, β-β-углы и β-шпилька-β (рис. 2.23).
Рисунок 2.23 Примеры сверхвторичных структур. (A) β-шпилька-β-структуры характеризуются резким поворотом шпильки, который не нарушает водородные связи двух β-складчатых листовых структур.(B) Предполагаемая спиральная структура белка Taspase1, (C) угловая структура α-α, присутствующая в белке Myoglobin.
Изображение A предоставлено: Isabella Daidone Изображение B: Johannes van den Boom, et al. (2016) PLosONE 11 (3): e0151431
Изображение C изменено с: Belles14104
Белковые мотивы представляют собой более сложные структуры, созданные из вторичных и супервторичных структурных компонентов, которые являются повторяющимися модальностями, визуализированными во многих белковых структурах.
Бета-нити имеют тенденцию закручиваться в правильном направлении, чтобы минимизировать конформационную энергию. Это приводит к образованию интересных структурных мотивов, обнаруженных во многих типах белков. Две из этих структур включают скрученные листы или опоры, а также бета-стволы (рис. 2.24)
Рис. 2.24. Общие структурные мотивы бета-цепей. (A) Скрученный лист для правой руки, вид сверху и сбоку, (B) Вид сбоку бета-ствола и (C) Вид сверху бета-ствола
Автор изображения: Генри Якубовски
Структурные мотивы могут выполнять определенные функции в белках, такие как обеспечение связывания субстратов или кофакторов.Например, складка Россмана отвечает за связывание с кофакторами нуклеотидов, такими как никотинамидадениндинуклеотид (NAD + ) (рис. 2.25). Складка Россмана состоит из шести параллельных бета-нитей, которые образуют протяженный бета-лист. Первые три нити соединены α-спиралями, в результате чего получается структура бета-альфа-бета-альфа-бета. Этот образец дублируется один раз, чтобы получить перевернутый тандемный повтор, содержащий шесть нитей. В целом жилы расположены в порядке 321456 (1 = N-концевой, 6 = C-концевой).Пять многонитевых складок, подобных Россманну, расположены в порядке 32145. Общая третичная структура складки напоминает трехслойный сэндвич, в котором начинка состоит из удлиненного бета-листа, а два ломтика хлеба образованы соединяющимися параллельными альфами. спирали.
Рис. 2.25. Фолд Россмана. (A) Структура никотинамид-адениндинуклеотида (NAD + ) (B) Мультяшная диаграмма складки Россмана (спирали A-F красные и нити 1-6 желтые) из E.coli фермент малатдегидрогеназа. Показано, что кофактор NAD + связывается как молекула, заполняющая пространство. (C) Схематическая диаграмма шестицепочечной складки Россмана.
Изображение изменено с: Boghog
Одной из особенностей складки Россмана является ее специфичность связывания кофакторов. Наиболее консервативный сегмент складок Россмана — это первый бета-альфа-бета сегмент. Поскольку этот сегмент находится в контакте с ADP-частью динуклеотидов, таких как FAD, NAD и NADP, его также называют «ADP-связывающей бета-бета складкой».
Интересно, что подобные структурные мотивы не всегда имеют общего эволюционного предка и могут возникать в результате конвергентной эволюции. Так обстоит дело с TIM Barrel, консервативной белковой складкой, состоящей из восьми α-спиралей и восьми параллельных β-цепей, которые чередуются вдоль пептидного остова. Структура названа в честь триозофосфатизомеразы, консервативного метаболического фермента. Бочки TIM — одна из самых распространенных белковых складок. Одна из самых интригующих особенностей представителей этого класса белков заключается в том, что хотя все они имеют одну и ту же третичную складку, между ними очень мало сходства последовательностей.По крайней мере 15 различных семейств ферментов используют этот каркас для создания соответствующей геометрии активного сайта, всегда на С-конце восьми параллельных бета-цепей цилиндра.
Рисунок 2.26 Ствол TIM. стволов TIM считаются α / β-складками белка, потому что они включают в себя чередующийся паттерн α-спиралей и β-цепей в одном домене. В цилиндре TIM спирали и нити (обычно по 8 каждой) образуют соленоид, который изгибается и замыкается в форме пончика, топологически известного как тороид.Параллельные β-нити образуют внутреннюю стенку бублика (следовательно, β-цилиндр), тогда как α-спирали образуют внешнюю стенку бублика. Каждая β-нить соединяется со следующей соседней нитью в цилиндре через длинную правую петлю, которая включает одну из спиралей, так что раскрашивание ленты N-C на виде сверху (A) происходит в радужном порядке вокруг бочка. Ствол TIM можно также рассматривать как состоящий из 8 перекрывающихся правосторонних супервторичных структур β-α-β, как показано на виде сбоку (B).
Изображение изменено с: WillowW
Хотя ленточная диаграмма TIM Barrel показывает отверстие в центральном ядре белка, боковые цепи аминокислот на этом изображении не показаны (рис. 2.26). Ядро белка на самом деле плотно упаковано, в основном с объемными гидрофобными аминокислотными остатками, хотя необходимо несколько глицинов, чтобы дать пространство для маневрирования сильно ограниченному центру из 8 приблизительных повторов, чтобы соответствовать друг другу. В упаковочных взаимодействиях между цепями и спиралями также преобладает гидрофобность, и разветвленные алифатические остатки валина, лейцина и изолейцина составляют около 40% от общего количества остатков в β-цепях.
По мере того, как наши знания о бесчисленном множестве структурных мотивов, обнаруженных в сокровищнице природы белковых структур, продолжают расти, мы продолжаем понимать, как структура белка связана с функцией, и мы можем лучше охарактеризовать вновь приобретенные последовательности белка, используя in silico технологии.
назад к началу
2,5 Структура третичного и четвертичного белка
Полная трехмерная форма всего белка (или сумма всех вторичных структурных мотивов) известна как третичная структура белка и является уникальной и определяющей особенностью этого белка (Рисунок 2.27). В первую очередь, взаимодействия между группами R создают сложную трехмерную третичную структуру белка. Природа групп R, обнаруженных в задействованных аминокислотах, может противодействовать образованию водородных связей, описанных для стандартных вторичных структур, таких как альфа-спираль. Например, группы R с одинаковыми зарядами отталкиваются друг от друга, а группы с разными зарядами притягиваются друг к другу (ионные связи). Незаряженные неполярные боковые цепи могут образовывать гидрофобные взаимодействия.Взаимодействие между боковыми цепями цистеина может привести к образованию дисульфидных связей.
Рисунок 2.27. Структура третичного белка. Третичная структура белков определяется множеством химических взаимодействий. К ним относятся гидрофобные взаимодействия, ионные связи, водородные связи и дисульфидные связи.
Изображение предоставлено: School of Biomedical Sciences Wiki
Все эти взаимодействия, сильные и слабые, определяют окончательную трехмерную форму белка.Когда белок теряет свою трехмерную форму, он обычно больше не функционирует.
В природе некоторые белки образуются из нескольких полипептидов, также известных как субъединицы, и взаимодействие этих субъединиц образует четвертичную структуру . Слабые взаимодействия между субъединицами помогают стабилизировать общую структуру. Например, инсулин (глобулярный белок) имеет комбинацию водородных и дисульфидных связей, из-за которых он в основном собирается в шар.Инсулин начинается как единый полипептид и теряет некоторые внутренние последовательности во время клеточного процессинга, которые образуют две цепи, удерживаемые вместе дисульфидными связями, как показано на рисунке 2.14. Затем три из этих структур группируются, образуя неактивный гексамер (рис. 2.28). Гексамерная форма инсулина — это способ для организма хранить инсулин в стабильной и неактивной конформации, чтобы он был доступен для высвобождения и реактивации в мономерной форме.
Рисунок 2.28 Гормон инсулина — хороший пример четвертичной структуры. Инсулин вырабатывается и хранится в организме в виде гексамера (единицы из шести молекул инсулина), в то время как активной формой является мономер. Гексамер представляет собой неактивную форму с долгосрочной стабильностью, которая служит средством защиты высокореактивного инсулина, но при этом остается легкодоступным.
Рисунок: Исаак Йонемото
Предсказание паттерна сворачивания белка на основе его первичной последовательности — чрезвычайно сложная задача из-за присущей гибкости аминокислотным остаткам, которые можно использовать для образования различных вторичных признаков.Как описано Fujiwara и др., Классификация SCOP (структурная классификация белков) и SCOPe (расширенная версия) являются основными базами данных, предоставляющими подробные и всесторонние описания всех известных структур белков. Классификация SCOP основана на иерархических уровнях: первые два уровня, семейство и суперсемейство , описывают близкие и дальние эволюционные отношения, тогда как третий, кратное , описывает геометрические отношения и структурные мотивы внутри белка.В рамках схемы складчатой классификации большинство белков отнесено к одному из четырех структурных классов: (1) вся α-спираль, (2) весь β-лист, (3) α / β для белков с дисперсными структурами и (4) α + β для белков с участками, в которых преобладает тот или иной тип паттерна.
На основании их формы, функции и местоположения белки в целом можно охарактеризовать как волокнистые, глобулярные, мембранные или неупорядоченные.
Волокнистые белки
Волокнистые белки характеризуются удлиненными белковыми структурами.Эти типы белков часто объединяются в филаменты или пучки, образуя структурные каркасы в биологических системах. У животных два наиболее распространенных семейства волокнистых белков — это α-кератин и коллаген.
α-кератин
α-кератин — ключевой структурный элемент, из которого состоят волосы, ногти, рога, когти, копыта и внешний слой кожи. Благодаря своей плотно намотанной структуре, он может функционировать как один из самых прочных биологических материалов и находить различное применение у млекопитающих, от хищных когтей до волос для тепла.α-кератин синтезируется путем биосинтеза белка с использованием транскрипции и трансляции, но когда клетка созревает и наполняется α-кератином, она умирает, создавая прочную несосудистую единицу ороговевшей ткани.
Первые последовательности α-кератинов были определены Ханукоглу и Фуксом. Эти последовательности показали, что существует два различных, но гомологичных семейства кератинов, которые были названы кератином типа I и кератином типа II. У человека 54 гена кератина, 28 из которых кодируют тип I, а 26 — тип II. Белки типа I являются кислыми, что означает, что они содержат больше кислых аминокислот, таких как аспарагиновая кислота, в то время как белки типа II являются основными, что означает, что они содержат больше основных аминокислот, таких как лизин. Эта дифференциация особенно важна для α-кератинов, потому что при синтезе его субъединицы димера, спиральной спирали , одна белковая спираль должна относиться к типу I, а другая — к типу II (рис. 2.29). Даже в пределах типа I и II есть кислые и основные кератины, которые особенно дополняют друг друга в каждом организме.Например, в коже человека K5, α-кератин типа II, сочетается в основном с K14, α-кератином I типа, с образованием комплекса α-кератина клеточного слоя эпидермиса.
Димеры Coiled-coil затем собираются в протофиламенты, очень стабильный левосторонний сверхспиральный мотив, который далее мультимеризуется, образуя филаменты, состоящие из множества копий мономеров кератина (рис. 2.29). Основная сила, которая удерживает структуры coiled-coil, связанные друг с другом, — это гидрофобные взаимодействия между аполярными остатками вдоль спиральных сегментов кератина.
Рисунок 2.29. Формирование промежуточной нити. Промежуточные филаменты состоят из супспирального комплекса α-кератина. Первоначально два мономера кератина (A) образуют структуру димера спиральной спирали (B) Два димера спиральной спирали соединяются, чтобы сформировать шахматный тетрамер (C), тетрамеры начинают соединяться вместе (D), в конечном итоге формируя лист из восьми тетрамеров (E ). Затем лист из восьми тетрамеров скручивают в левую спираль, образуя конечную промежуточную нить (E). Электронная микрофотография промежуточной нити показана в верхнем левом углу.
Автор изображения: Правительство США
Коллаген
Волокнистый белок Коллаген является наиболее распространенным белком у млекопитающих, составляя от 25% до 35% всего белка в организме. Он находится преимущественно во внеклеточном пространстве в различных соединительных тканях организма. Коллаген содержит уникальную четвертичную структуру из трех белковых цепей, соединенных вместе, образуя тройную спираль.В основном он находится в фиброзных тканях, таких как сухожилия, связки и кожа.
В зависимости от степени минерализации коллагеновые ткани могут быть жесткими (кость), податливыми (сухожилия) или иметь градиент от жесткого к податливому (хрящ). Его также много в роговице, кровеносных сосудах, кишечнике, межпозвонковых дисках и дентине зубов. В мышечной ткани он служит основным компонентом эндомизия. Коллаген составляет от одного до двух процентов мышечной ткани и составляет 6% веса сильных сухожильных мышц.Фибробласт — это наиболее обычная клетка, вырабатывающая коллаген. Желатин, который используется в пище и промышленности, представляет собой необратимо гидролизованный коллаген. Кроме того, в качестве пищевых добавок используются порошки частично или полностью гидролизованного коллагена. Коллаген имеет множество медицинских применений при лечении костей и кожи.
Название коллаген происходит от греческого ( kólla ), что означает «клей», и суффикса -gen , что означает «производство». Это относится к раннему использованию соединения в процессе кипячения кожи и сухожилий лошадей и других животных для получения клея.
Более 90% коллагена в организме человека относится к типу I. Однако по состоянию на 2011 год было идентифицировано, описано и разделено на несколько групп в соответствии с формируемой ими структурой 28 типов коллагена. Пять наиболее распространенных типов:
- Тип I: кожа, сухожилие, сосудистая сеть, органы, кость (основной компонент органической части кости)
- Тип II: хрящ (основной коллагеновый компонент хряща)
- Тип III: сетчатый (основной компонент ретикулярных волокон), обычно встречается вместе с типом I
- Тип IV: образует базальную пластинку, секретируемый эпителием слой базальной мембраны
- Тип V: поверхности клеток, волосы и плацента
Здесь мы сосредоточимся на уникальных свойствах коллагена типа I.Коллаген I типа имеет необычный аминокислотный состав и последовательность:
.- Глицин содержится почти в каждом третьем остатке.
- Пролин составляет около 17% коллагена.
- Коллаген содержит две необычные производные аминокислоты, не вставленные непосредственно во время трансляции. Эти аминокислоты находятся в определенных местах относительно глицина и посттрансляционно модифицируются разными ферментами, оба из которых требуют витамина С в качестве кофактора (рис. 2.30).
- Гидроксипролин, производный пролина
- Гидроксилизин, полученный из лизина — в зависимости от типа коллагена различное количество гидроксилизинов гликозилировано (в основном с присоединенными дисахаридами).
Рисунок 2.30. Гидроксилирование пролина и лизина во время посттрансляционной модификации коллагена типа I. Ферменты пролилгидроксилаза и лизилгидроксилаза необходимы для гидроксилирования остатков пролина (A) и лизина (B) соответственно. (Примечание: хотя положение 3 показано выше, пролиловые остатки альтернативно могут быть гидроксилированы в положении 4). Ферменты гидроксилазы модифицируют аминокислотные остатки после того, как они были включены в белок в качестве посттрансляционной модификации, и требуют витамина С (аскорбата) в качестве кофактора.(C) Дальнейшая модификация остатков гидроксилизина путем гликозилирования может привести к включению дисахарида (галактоза-глюкоза) в гидрокси-кислород.
Большинство коллагена образуется аналогичным образом. Процесс синтеза коллагена типа I описан ниже и демонстрирует сложность сворачивания и обработки белка (рис. 2.31).
- Внутри ячейки
- Два типа альфа-цепей образуются во время трансляции на рибосомах вдоль шероховатого эндоплазматического ретикулума (RER): альфа-1 и альфа-2 цепи.Эти пептидные цепи (известные как препроколлаген) имеют регистрирующие пептиды на каждом конце и сигнальный пептид.
- Полипептидные цепи высвобождаются в просвет RER.
- Сигнальные пептиды расщепляются внутри RER, и теперь эти цепи известны как про-альфа-цепи.
- Внутри просвета происходит гидроксилирование аминокислот лизина и пролина. Этот процесс зависит от кофактора аскорбиновой кислоты (витамина С).
- Происходит гликозилирование определенных остатков гидроксилизина.
- Тройная альфа-спиральная структура образована внутри эндоплазматического ретикулума из двух цепей альфа-1 и одной цепи альфа-2.
- Проколлаген доставляется в аппарат Гольджи, где он упаковывается и секретируется путем экзоцитоза.
- Вне камеры
- Регистрационные пептиды расщепляются, а тропоколлаген образуется проколлагеновой пептидазой.
- Множественные молекулы тропоколлагена образуют фибриллы коллагена посредством ковалентного сшивания (альдольная реакция) лизилоксидазой, которая связывает остатки гидроксилизина и лизина.Множественные коллагеновые фибриллы образуют коллагеновые волокна.
- Коллаген может быть прикреплен к клеточным мембранам через несколько типов белков, включая фибронектин, ламинин, фибулин и интегрин.
Рисунок 2.31. Синтез коллагена типа I. Полипептидные цепи синтезируются в эндоплазматическом ретикулуме и высвобождаются в просвет, где они гидроксилируются и гликозилируются. Тройная спираль проколлагена формируется и транспортируется через аппарат Гольджи, где подвергается дальнейшей обработке.Проколлаген секретируется во внеклеточный матрикс, где расщепляется на тропоколлаген. Тропоколлаген собирается в коллагеновые фибриллы, где происходит сшивание и водородные связи с образованием конечного коллагенового волокна.
Изображение изменено: E.V. Вонг и Британская энциклопедия
Дефицит витамина С вызывает цингу, серьезное и болезненное заболевание, при котором дефектный коллаген препятствует образованию прочной соединительной ткани. Десны портятся и кровоточат, с потерей зубов; кожа меняет цвет, а раны не заживают.До 18 века это состояние было печально известно среди длительных военных, особенно военно-морских, экспедиций, во время которых участников лишали продуктов, содержащих витамин С.
Аутоиммунное заболевание, такое как красная волчанка или ревматоидный артрит, может поражать здоровые волокна коллагена. Кортизол стимулирует расщепление коллагена до аминокислот, предполагая, что стресс может усугубить эти болезненные состояния.
Многие бактерии и вирусы выделяют факторы вирулентности, такие как фермент коллагеназа, который разрушает коллаген или препятствует его производству.
назад к началу
Глобулярные белки
Глобулярные белки или сферопротеины представляют собой сферические («шарообразные») белки и являются одним из распространенных типов белков. Глобулярные белки в некоторой степени растворимы в воде (образуют коллоиды в воде), в отличие от волокнистых или мембранных белков. Существует несколько классов складок глобулярных белков, поскольку существует множество различных архитектур, которые могут складываться в примерно сферическую форму.
Термин глобин может более конкретно относиться к белкам, включая глобиновую складку. Глобиновая складка представляет собой обычную трехмерную складку в белках и определяет суперсемейство глобиноподобных белков (рис. 2.32). Эта складка обычно состоит из восьми альфа-спиралей, хотя некоторые белки имеют дополнительные продолжения спиралей на концах. Глобиновая складка встречается в одноименных семействах белков глобина: гемоглобинах и миоглобинах, а также в фикоцианинах.Поскольку миоглобин был первым белком, структура которого была решена, глобиновая складка была, таким образом, первой обнаруженной белковой складкой. Поскольку глобиновая складка содержит только спирали, она классифицируется как полностью альфа-белковая складка.
Рисунок 2.32 Глобиновая складка. (A) Пример глобиновой складки, переносящего кислород белка миоглобина (PBD ID 1MBA) из моллюска Aplysia limacina. (B) Структура тетрамерного белка гемоглобина, содержащего в общей сложности четыре глобиновых складки.
Изображение A: Википедия Изображение B: Zephyris
Термин глобулярный белок довольно старый (датируется, вероятно, 19 веком) и сейчас несколько архаичен, учитывая сотни тысяч белков и более элегантный и описательный словарь структурных мотивов. Сферическая структура индуцируется третичной структурой белка. Неполярные (гидрофобные) аминокислоты молекулы связаны внутри молекулы, тогда как полярные (гидрофильные) аминокислоты связаны снаружи, что позволяет диполь-дипольным взаимодействиям с растворителем, что объясняет растворимость молекулы.
В отличие от волокнистых белков, которые выполняют преобладающую структурную функцию, глобулярные белки могут действовать как:
- Ферменты, катализируя органические реакции, происходящие в организме в мягких условиях и с высокой специфичностью. Эту роль выполняют разные эстеразы.
- Посланники, передающие сообщения для регулирования биологических процессов. Эту функцию выполняют гормоны, например, инсулин и т. Д.
- Транспортеры других молекул через мембраны
- Запасы аминокислот.
- Регуляторные роли также выполняются глобулярными белками, а не волокнистыми белками.
- Структурные белки, например актин и тубулин, которые являются глобулярными и растворимыми как мономеры, но полимеризуются с образованием длинных жестких волокон
Многие из белков, которые будут подробно описаны в следующих главах, относятся к этому классу белков.
Мембранные белки
Мембранные белки — это белки, которые являются частью биологических мембран или взаимодействуют с ними.Они включают: 1) интегральные мембранные белки, которые являются частью мембраны или постоянно прикреплены к ней, и 2) периферические мембранные белки, которые временно прикрепляются к мембране через интегральные белки или липидный бислой. Интегральные мембранные белки далее классифицируются как трансмембранные белки, которые проходят через мембрану, или интегральные монотопные белки, которые прикрепляются только к одной стороне мембраны.
Мембранные белки, такие как растворимые глобулярные белки, волокнистые белки и неупорядоченные белки, являются обычными. Обладая символической важностью в медицине, мембранные белки являются мишенью для более 50% всех современных лекарственных препаратов. Подсчитано, что 20–30% всех генов в большинстве геномов кодируют мембранные белки. По сравнению с другими классами белков определение структур мембранных белков остается проблемой в значительной степени из-за сложности создания экспериментальных условий, которые могут сохранить правильную конформацию белка в изоляции от его естественной среды (рис. 2.33).
Мембранные белки выполняют множество функций, жизненно важных для выживания организмов:
- Белки мембранных рецепторов передают сигналы между внутренней и внешней средой клетки.
- Транспортные белки перемещают молекулы и ионы через мембрану. Их можно разделить на категории в соответствии с базой данных классификации транспортеров.
- Мембранные ферменты могут обладать многими видами активности, такими как оксидоредуктаза, трансфераза или гидролаза.
- Молекулы клеточной адгезии позволяют клеткам идентифицировать друг друга и взаимодействовать.Например, белки, участвующие в иммунном ответе.
Рис. 2.33. Схематическое изображение трансмембранных белков. 1. одиночная трансмембранная α-спираль (битопический мембранный белок) 2. политопный трансмембранный α-спиральный белок 3. политопный трансмембранный β-листовой белок. Мембрана представлена светло-коричневым цветом.
Интегральные мембранные белки постоянно прикреплены к мембране. Такие белки можно отделить от биологических мембран только с использованием детергентов, неполярных растворителей или иногда денатурирующих агентов.Их можно классифицировать в зависимости от их отношения к бислою:
.- Интегральные политопные белки — это трансмембранные белки, которые проходят через мембрану более одного раза. Эти белки могут иметь различную трансмембранную топологию. Эти белки имеют одну из двух структурных архитектур:
- белков спирального пучка, которые присутствуют во всех типах биологических мембран;
- бета-стволовых белков, которые обнаруживаются только во внешних мембранах грамотрицательных бактерий, а также в наружных мембранах митохондрий и хлоропластов.
- Битопические белки — это трансмембранные белки, которые проходят через мембрану только один раз. Трансмембранные спирали этих белков имеют значительно отличающиеся распределения аминокислот от трансмембранных спиралей политопных белков.
- Интегральные монотопные белки представляют собой интегральные мембранные белки, которые прикреплены только к одной стороне мембраны и не охватывают весь путь.
Рисунок 2.34 Схематическое изображение различных типов взаимодействия между монотопными мембранными белками и клеточной мембраной. 1. взаимодействие посредством амфипатической α-спирали, параллельной плоскости мембраны (плоская спираль мембраны) 2. взаимодействие посредством гидрофобной петли 3. взаимодействие посредством ковалентно связанного липида мембраны ( липидирование ) 4. электростатическое или ионное взаимодействие с мембранные липиды.
Автор изображения: : Foobar
Белки периферической мембраны временно прикрепляются либо к липидному бислою, либо к интегральным белкам за счет комбинации гидрофобных, электростатических и других нековалентных взаимодействий.Периферические белки диссоциируют после обработки полярным реагентом, например раствором с повышенным pH или высокой концентрацией соли.
Интегральные и периферические белки могут быть посттрансляционно модифицированы с добавлением жирных кислот, диацилглицерина или пренильных цепей или GPI (гликозилфосфатидилинозитол), которые могут быть закреплены в липидном бислое.
Неупорядоченные белки
Внутренне неупорядоченный белок ( IDP ) — это белок, не имеющий фиксированной или упорядоченной трехмерной структуры (Рисунок 2.35). IDP охватывают спектр состояний от полностью неструктурированного до частично структурированного и включают случайные клубки, (предварительно) расплавленные глобулы и большие многодоменные белки, соединенные гибкими линкерами. Они составляют один из основных типов белков (наряду с глобулярными, волокнистыми и мембранными белками).
Рис. 2.35. Конформационная гибкость в белке SUMO-1 (PDB: 1a5r). Центральная часть показывает относительно упорядоченную структуру. Напротив, N- и C-концевые области (левая и правая соответственно) демонстрируют «внутреннее нарушение», хотя короткая спиральная область сохраняется в N-концевом хвосте.Были преобразованы десять альтернативных моделей ЯМР. Элементы вторичной структуры: α-спирали (красные), β-тяжи (синие стрелки).
Автор изображения: Лукаш Козловски
Открытие IDP бросило вызов традиционной парадигме структуры белка, согласно которой функция белка зависит от фиксированной трехмерной структуры. Эта догма была поставлена под сомнение в течение последних двадцати лет из-за растущего числа свидетельств из различных областей структурной биологии, предполагающих, что динамика белков может иметь большое значение для таких систем.Несмотря на отсутствие стабильной структуры, IDP представляют собой очень большой и функционально важный класс белков. В некоторых случаях IDP могут принимать фиксированную трехмерную структуру после связывания с другими макромолекулами. В целом, IDP во многом отличаются от структурированных белков и, как правило, обладают различными свойствами с точки зрения функции, структуры, последовательности, взаимодействий, эволюции и регуляции.
В 1930-1950 годах первые структуры белка были решены с помощью кристаллографии белков.Эти ранние структуры предполагали, что фиксированная трехмерная структура может обычно требоваться для обеспечения биологических функций белков. Утверждая, что белки имеют только одну однозначно определенную конфигурацию, Мирски и Полинг не признали, что работа Фишера поддержала бы их тезис с его моделью «Замок и ключ» (1894). Эти публикации закрепили центральную догму молекулярной биологии в том смысле, что последовательность определяет структуру, которая, в свою очередь, определяет функцию белков.В 1950 году Каруш написал о «конфигурационной адаптивности», что противоречит всем предположениям и исследованиям XIX века. Он был убежден, что белки имеют более одной конфигурации на одном уровне энергии и могут выбирать одну при связывании с другими субстратами. В 1960-х годах парадокс Левинталя предположил, что систематический конформационный поиск длинного полипептида вряд ли приведет к единственной свернутой структуре белка в биологически значимых временных масштабах (то есть от секунд до минут). Любопытно, что для многих (небольших) белков или белковых доменов можно наблюдать относительно быструю и эффективную рефолдинг in vitro .Как указано в «Догме Анфинсена» 1973 года, фиксированная трехмерная структура этих белков уникально кодируется в их первичной структуре (аминокислотной последовательности), является кинетически доступной и стабильной в ряде (близких) физиологических условий и, следовательно, может рассматриваться как нативное состояние таких «упорядоченных» белков.
В последующие десятилетия, однако, многие крупные белковые области не могли быть отнесены к наборам рентгеновских данных, что указывает на то, что они занимают несколько позиций, которые усредняются на картах электронной плотности.Отсутствие фиксированных уникальных положений относительно кристаллической решетки предполагало, что эти области были «неупорядоченными». Ядерно-магнитная резонансная спектроскопия белков также продемонстрировала наличие больших гибких линкеров и концов во многих решенных структурных ансамблях. Сейчас общепринято, что белки существуют как ансамбль подобных структур с некоторыми областями более ограниченными, чем другие. Внутренне неструктурированные белки (IUP) занимают крайний конец этого спектра гибкости, тогда как IDP также включают белки со значительной тенденцией к локальной структуре или гибкими многодоменными сборками.Эти высокодинамичные неупорядоченные области белков впоследствии были связаны с функционально важными явлениями, такими как аллостерическая регуляция и ферментный катализ.
Многие неупорядоченные белки обладают аффинностью связывания со своими рецепторами, регулируемыми посттрансляционной модификацией, поэтому было высказано предположение, что гибкость неупорядоченных белков способствует различным конформационным требованиям для связывания модифицирующих ферментов, а также их рецепторов. Внутреннее нарушение особенно обогащено белками, участвующими в передаче клеточных сигналов, транскрипции и ремоделировании хроматина.
Гибкие линкеры
Неупорядоченные области часто встречаются в виде гибких линкеров или петель, соединяющих домены. Линкерные последовательности сильно различаются по длине, но обычно богаты полярными незаряженными аминокислотами. Гибкие линкеры позволяют соединяющим доменам свободно скручиваться и вращаться, чтобы рекрутировать своих связывающих партнеров через динамику белковых доменов. Они также позволяют своим партнерам по связыванию вызывать более крупномасштабные конформационные изменения с помощью аллостерии на большие расстояния.
Линейные мотивы
Линейные мотивы — это короткие неупорядоченные сегменты белков, которые опосредуют функциональные взаимодействия с другими белками или другими биомолекулами (РНК, ДНК, сахарами и т. Д.).). Многие роли линейных мотивов связаны с клеточной регуляцией, например, с контролем формы клетки, субклеточной локализацией отдельных белков и регулируемым обменом белков. Часто посттрансляционные модификации, такие как фосфорилирование, настраивают сродство (не редко на несколько порядков величины) отдельных линейных мотивов для специфических взаимодействий. В отличие от глобулярных белков IDP не имеют пространственно расположенных активных карманов. Тем не менее, у 80% IDP (~ 3 дюжины), подвергнутых детальной структурной характеристике с помощью ЯМР, есть линейные мотивы, названные PreSMos (предварительно структурированные мотивы), которые являются временными вторичными структурными элементами, примированными для распознавания мишени.В нескольких случаях было продемонстрировано, что эти временные структуры становятся полными и стабильными вторичными структурами, например спиралями, после связывания мишени. Следовательно, PreSMos являются предполагаемыми активными сайтами IDP.
Фальцовка и переплет с сопряжением
Многие неструктурированные белки претерпевают переходы в более упорядоченные состояния при связывании со своими мишенями. Спаренная укладка и связывание могут быть локальными и включать только несколько взаимодействующих остатков, или они могут включать весь домен белка.Недавно было показано, что спаренная укладка и связывание позволяют захоронить большую площадь поверхности, что было бы возможно только для полностью структурированных белков, если бы они были намного больше. Более того, определенные неупорядоченные области могут служить «молекулярными переключателями» в регулировании определенных биологических функций, переключаясь на упорядоченную конформацию при молекулярном распознавании, например, при связывании малых молекул, связывании ДНК / РНК, ионных взаимодействиях.
Нарушение связанного состояния (нечеткие комплексы)
Внутренне неупорядоченные белки могут сохранять свою конформационную свободу, даже если они специфически связываются с другими белками.Структурный беспорядок в связанном состоянии может быть статическим или динамическим. В нечетких комплексах структурная множественность необходима для функционирования, и манипулирование связанной неупорядоченной областью изменяет активность. Конформационный ансамбль комплекса модулируется посредством посттрансляционных модификаций или белковых взаимодействий. Специфичность ДНК-связывающих белков часто зависит от длины нечетких областей, которая варьируется путем альтернативного сплайсинга. Внутренне неупорядоченные белки адаптируют множество различных структур in vivo в соответствии с условиями клетки, создавая структурный или конформационный ансамбль.
Следовательно, их структуры сильно связаны с функциями. Однако только несколько белков полностью неупорядочены в своем естественном состоянии. Нарушение в основном обнаруживается в внутренне неупорядоченных областях (IDR) внутри хорошо структурированного белка. Термин «внутренне неупорядоченный белок» (IDP), следовательно, включает белки, которые содержат IDR, а также полностью неупорядоченные белки.
Наличие и вид белкового нарушения кодируется его аминокислотной последовательностью.В целом, IDP характеризуются низким содержанием объемных гидрофобных аминокислот и высокой долей полярных и заряженных аминокислот, обычно называемой низкой гидрофобностью. Это свойство приводит к хорошему взаимодействию с водой. Кроме того, высокие чистые заряды способствуют беспорядку из-за электростатического отталкивания, возникающего из-за одинаково заряженных остатков. Таким образом, неупорядоченные последовательности не могут в достаточной степени скрыть гидрофобное ядро, чтобы сложиться в стабильные глобулярные белки. В некоторых случаях гидрофобные кластеры в неупорядоченных последовательностях дают ключи для идентификации областей, которые подвергаются сопряженной укладке и связыванию (см. Биологические роли).
Многие неупорядоченные белки обнаруживают области без какой-либо регулярной вторичной структуры. Эти области можно назвать гибкими по сравнению со структурированными петлями. В то время как последние являются жесткими и содержат только один набор углов Рамачандрана, IDP включают несколько наборов углов. Термин гибкость также используется для хорошо структурированных белков, но описывает другое явление в контексте неупорядоченных белков. Гибкость структурированных белков связана с равновесным состоянием, в то время как у IDP это не так.Многие неупорядоченные белки также обнаруживают последовательности низкой сложности, то есть последовательности с избыточным представлением нескольких остатков. Хотя последовательности низкой сложности являются сильным признаком нарушения, обратное не обязательно верно, то есть не все неупорядоченные белки имеют последовательности низкой сложности. Неупорядоченные белки имеют низкое содержание предсказанной вторичной структуры.
назад к началу
2.6 Сворачивание, денатурация и гидролиз белков
Сворачивание белка — это физический процесс, посредством которого белковая цепь приобретает свою естественную трехмерную структуру, конформацию, которая обычно является биологически функциональной, быстрым и воспроизводимым образом (Рисунок 2.36). Это физический процесс, с помощью которого полипептид сворачивается в свою характерную и функциональную трехмерную структуру из случайного клубка. Каждый белок существует в виде развернутого полипептида или случайной спирали при трансляции из последовательности мРНК в линейную цепочку аминокислот. У этого полипептида отсутствует какая-либо стабильная (долговечная) трехмерная структура (левая часть первого рисунка). Поскольку полипептидная цепь синтезируется рибосомой, линейная цепь начинает складываться в свою трехмерную структуру.Сворачивание начинает происходить даже при трансляции полипептидной цепи. Аминокислоты взаимодействуют друг с другом, образуя четко определенную трехмерную структуру, свернутый белок (правая часть рисунка), известный как нативное состояние. Полученная трехмерная структура определяется аминокислотной последовательностью или первичной структурой (догма Анфинсена).
Рисунок 2.36 Белок до и после сворачивания
Автор изображения: DrKjaergaard
Правильная трехмерная структура важна для функционирования, хотя некоторые части функциональных белков могут оставаться развернутыми или, как в случае IDP, оставаться гибкими, поэтому важна динамика белков.Неспособность свернуться в нативную структуру обычно приводит к образованию неактивных белков, но в некоторых случаях неправильно свернутые белки имеют модифицированную или токсичную функциональность. Считается, что несколько нейродегенеративных и других заболеваний являются результатом накопления неправильно свернутых белков, таких как амилоидные фибриллы, обнаруженные у пациентов с болезнью Альцгеймера.
Сворачивание — это спонтанный процесс, который в основном управляется гидрофобными взаимодействиями, образованием внутримолекулярных водородных связей, силами Ван-дер-Ваальса, и ему противостоит конформационная энтропия.Процесс сворачивания часто начинается совместно с трансляцией, так что N-конец белка начинает сворачиваться, в то время как C-концевой участок белка все еще синтезируется рибосомой; однако молекула белка может самопроизвольно складываться во время или после биосинтеза. Хотя эти макромолекулы можно рассматривать как «складывающиеся сами по себе», процесс также зависит от растворителя (вода или липидный бислой), концентрации солей, pH, температуры, возможного присутствия кофакторов и молекулярных шаперонов.Белки будут иметь ограничения на их способность к складыванию из-за ограниченных углов изгиба или возможных форм, как описано в графике Рамачандрана.
Рисунок 2.37 Гидрофобный коллапс. В компактной складке (справа) гидрофобные аминокислоты (показаны черными сферами) схлопываются к центру, чтобы защитить себя от водной среды.
Автор изображения: Tomixdf
Сворачивание белка должно быть термодинамически благоприятным внутри клетки, чтобы реакция была спонтанной.Поскольку известно, что сворачивание белка является спонтанной реакцией, оно должно принимать отрицательное значение свободной энергии Гиббса. Свободная энергия Гиббса при сворачивании белка напрямую связана с энтальпией и энтропией. Для возникновения отрицательного значения ΔG и для того, чтобы сворачивание белка стало термодинамически благоприятным, тогда либо энтальпия, либо энтропия, либо оба условия должны быть благоприятными.
Сведение к минимуму количества гидрофобных боковых цепей, подверженных воздействию воды, является важной движущей силой процесса складывания. Гидрофобный эффект (рис. 2.37) — это явление, при котором гидрофобные цепи белка схлопываются в ядро белка (вдали от гидрофильной среды). В водной среде молекулы воды имеют тенденцию собираться вокруг гидрофобных областей или боковых цепей белка, создавая водные оболочки из упорядоченных молекул воды. Упорядочение молекул воды вокруг гидрофобной области увеличивает порядок в системе и, следовательно, способствует отрицательному изменению энтропии (уменьшению энтропии в системе).Молекулы воды фиксируются в этих водных клетках, что приводит к гидрофобному коллапсу или сворачиванию внутрь гидрофобных групп (рис. 2.38).
Рис. 2.38. Образование клатрата воды. Хлороформ является гидрофобным соединением, поэтому, когда он растворяется в воде с образованием гидрата, гидрофобная гидратация сопровождается отрицательным изменением энтропии из-за повышенного порядка в окружающей воде и положительного изменения теплоемкости, часто вызывая положительное значение ΔG. Подобные водные клетки могут объединяться вокруг гидрофобных белковых остатков перед правильным сворачиванием.
Гидрофобный коллапс возвращает энтропию в систему через разрыв водяных клеток, что освобождает упорядоченные молекулы воды. Множество гидрофобных групп, взаимодействующих внутри ядра глобулярно свернутого белка, вносит значительный вклад в стабильность белка после сворачивания из-за сильно накопленных сил Ван-дер-Ваальса (особенно сил Лондонской дисперсии).Гидрофобный эффект существует как движущая сила в термодинамике только при наличии водной среды с амфифильной молекулой, содержащей большую гидрофобную область. Прочность водородных связей зависит от их окружения; таким образом, водородные связи, заключенные в гидрофобное ядро, вносят больший вклад, чем водородные связи, находящиеся в водной среде, для стабильности нативного состояния.
Шапероны
Молекулярные шапероны представляют собой класс белков, которые помогают в правильном сворачивании других белков in vivo (Рисунок 2.39). Шапероны существуют во всех клеточных компартментах и взаимодействуют с полипептидной цепью, чтобы позволить сформироваться нативной трехмерной конформации белка; однако сами шапероны не включены в окончательную структуру белка, которому они помогают. Шапероны могут способствовать сворачиванию, даже когда возникающий полипептид синтезируется рибосомой. Молекулярные шапероны действуют путем связывания для стабилизации нестабильной в других отношениях структуры белка в его пути фолдинга, но шапероны не содержат необходимой информации, чтобы знать правильную нативную структуру белка, которому они помогают; скорее, шапероны работают, предотвращая неправильные складчатые конформации.
Рисунок 2.39. Вид сверху комплекса бактериальных шаперонов GroES / GroEL, модель
Автор изображения: Википедия
Таким образом, шапероны фактически не увеличивают частоту отдельных шагов, участвующих в пути сворачивания к нативной структуре; вместо этого они работают, уменьшая возможные нежелательные агрегации полипептидной цепи, которые в противном случае могли бы замедлить поиск подходящего промежуточного соединения, и они обеспечивают более эффективный путь для полипептидной цепи, чтобы принять правильные конформации.Шапероны не следует путать с катализаторами сворачивания, которые на самом деле катализируют в противном случае медленные шаги в пути сворачивания. Примерами катализаторов фолдинга являются протеин-дисульфидные изомеразы и пептидил-пролилизомеразы, которые могут участвовать в образовании дисульфидных связей или взаимном превращении между цис- и транс- стереоизомерами соответственно.
Показано, что шапероныимеют решающее значение в процессе сворачивания белка in vivo , потому что они обеспечивают белок с помощью, необходимой для принятия его правильного выравнивания и конформации, достаточно эффективно, чтобы стать «биологически релевантным».Это означает, что полипептидная цепь теоретически может складываться в свою нативную структуру без помощи шаперонов, как продемонстрировали эксперименты по укладке белков, проведенные in vitro ; однако этот процесс оказывается слишком неэффективным или слишком медленным, чтобы существовать в биологических системах; следовательно, шапероны необходимы для сворачивания белка in vivo. Показано, что наряду со своей ролью в содействии формированию нативных структур, шапероны участвуют в различных ролях, таких как транспорт белков, деградация, и даже позволяют денатурированным белкам, подвергшимся воздействию определенных внешних денатурирующих факторов, реорганизовываться в их правильные нативные структуры.
Денатурация белка
Полностью денатурированный белок не имеет ни третичной, ни вторичной структуры, однако последовательность первичного белка остается нетронутой, и белок существует в виде случайной спирали (рис. 2.39). При определенных условиях некоторые белки могут складываться заново; однако во многих случаях денатурация необратима. Клетки иногда защищают свои белки от денатурирующего воздействия тепла с помощью ферментов, известных как белков теплового шока (тип шаперона), , которые помогают другим белкам как в сворачивании, так и в том, чтобы оставаться свернутыми (Рисунок 2.40). Белки теплового шока экспрессируются в ответ на повышенные температуры или другие стрессы. Некоторые белки вообще никогда не сворачиваются в клетках, кроме как с помощью шаперонов, которые либо изолируют отдельные белки, чтобы их укладка не прерывалась взаимодействиями с другими белками, либо помогают разворачивать неправильно свернутые белки, позволяя им повторно складываться в правильную нативную структуру. Эта функция имеет решающее значение для предотвращения риска осаждения в нерастворимые аморфные агрегаты.
Рисунок 2.40 Денатурация белка. На рисунке (1) изображен правильно свернутый интактный белок. На этапе (2) к системе подводится тепло, превышающее порог поддержания внутримолекулярных белковых взаимодействий. На этапе (3) показан развернутый или денатурированный белок. Цветные области денатурированного белка соответствуют окрашенным областям естественно свернутого белка, показанного на (1).
Диаграмма предоставлена: Scurran15
К внешним факторам, участвующим в денатурации белка или нарушении нативного состояния, относятся температура, внешние поля (электрические, магнитные), скученность молекул и даже ограничение пространства, которые могут иметь большое влияние на сворачивание белков.Высокие концентрации растворенных веществ, экстремальные значения pH, механические силы и присутствие химических денатурирующих веществ также могут способствовать денатурации белка. Эти отдельные факторы вместе классифицируются как стрессы. Показано, что шапероны существуют в возрастающих концентрациях во время клеточного стресса и помогают правильному сворачиванию возникающих белков, а также денатурированных или неправильно свернутых.
При некоторых условиях белки не сворачиваются в свои биохимически функциональные формы.Температура выше или ниже диапазона, в котором, как правило, живут клетки, вызовет разворачивание или денатурирование термически нестабильных белков (вот почему кипячение делает яичный белок непрозрачным). Однако термостабильность белков далеко не постоянна; например, были обнаружены гипертермофильные бактерии, которые растут при температурах до 122 ° C, что, конечно, требует, чтобы их полный набор жизненно важных белков и белковых ансамблей был стабильным при этой температуре или выше.
Гидолиз
Гидролиз — это разрушение последовательности первичного белка путем добавления воды для преобразования отдельных мономерных звеньев аминокислот (Рисунок 2.41).
Рисунок 2.41 Гидролиз белков. В реакции гидролиза вода добавляется через амидную связь, включающую группу -ОН с карбонильным углеродом и реформируя карбоновую кислоту. Водород из воды преобразовывает амин.
Белки участвуют во многих клеточных функциях. Белки могут действовать как ферменты, которые увеличивают скорость химических реакций. Фактически, 99% ферментативных реакций внутри клетки опосредуются белками.Таким образом, они являются неотъемлемой частью процессов создания или разрушения клеточных компонентов. Белки также могут действовать как структурный каркас внутри клетки, помогая поддерживать клеточную форму. Белки также могут участвовать в клеточной передаче сигналов и коммуникации, а также в переносе молекул из одного места в другое. В экстремальных обстоятельствах, таких как голодание, белки также могут использоваться в качестве источника энергии внутри клетки.
назад к началу
2.7 источников
OpenStax, Белки. OpenStax CNX. 30 сентября 2016 г. http://cnx.org/contents/bf17f4df-605c-4388-88c2-25b0f000b0ed@2.
Файл: Хиральность руками.jpg. (2017, 16 сентября). Wikimedia Commons, бесплатное хранилище мультимедиа . Получено 17:34, 10 июля 2019 г. с сайта https://commons.wikimedia.org/w/index.php?title=File:Chirality_with_hands.jpg&oldid=258750003.
авторов Википедии. (2019, 6 июля). Цвиттерион. В Википедия, Бесплатная энциклопедия .Получено 21:48, 10 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Zwitterion&oldid=
9721 .авторов Википедии. (2019, 8 июля). Абсолютная конфигурация. В Википедия, Бесплатная энциклопедия . Получено в 15:28, 14 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Absolute_configuration&oldid=
2423
.Структурная биохимия / фермент / активный сайт. (2019, 1 июля). Викиучебники, проект бесплатного учебника . Получено 16:55, 16 июля 2019 г., с сайта https: // en.wikibooks.org/w/index.php?title=Structural_Biochemistry/Enzyme/Active_Site&oldid=3555410.
Структурная биохимия / Белки. (2019, 24 марта). Викиучебники, проект бесплатного учебника . Получено в 19:16, 18 июля 2019 г., с сайта https://en.wikibooks.org/w/index.php?title=Structural_Biochemistry/Proteins&oldid=3529061.
Fujiwara, K., Toda, H., and Ikeguchi, M. (2012) Зависимость аминокислотной склонности α-спирали и β-складки от общего типа белковой складки. BMC Структурная биология 12:18.Доступно по адресу: https://bmcstructbiol.biomedcentral.com/track/pdf/10.1186/1472-6807-12-18
авторов Википедии. (2019, 16 июля). Кератин. В Википедия, Бесплатная энциклопедия . Получено 17:50, 19 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Keratin&oldid=
8340 .авторов Википедии. (2019, 13 июля). Альфа-кератин. В Википедия, Бесплатная энциклопедия . Получено в 18:17, 19 июля 2019 г., с https://en.wikipedia.org/w/index.php? title = Альфа-кератин & oldid =
7410
Инициатива открытого обучения. (2019) Покровные уровни организации. Университет Карнеги Меллон. В анатомии и физиологии. Доступно по адресу: https://oli.cmu.edu/jcourse/webui/syllabus/module.do?context=4348
0020ca6010f804da8baf7ba.
авторов Википедии. (2019, 16 июля). Коллаген. В Википедия, Бесплатная энциклопедия . Получено в 03:42, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Collagen&oldid=9954
.авторов Википедии.(2019, 2 июля). Россманн фолд. В Википедия, Бесплатная энциклопедия . Получено в 16:01, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Rossmann_fold&oldid=8788
.авторов Википедии. (2019, 30 мая). Ствол ТИМ. В Википедия, Бесплатная энциклопедия . Получено в 16:46, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=TIM_barrel&oldid=899459569
.авторов Википедии. (2019, 16 июля). Сворачивание белков. В Википедия, Бесплатная энциклопедия .Получено 18:30, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Protein_folding&oldid=
- 4145 .
авторов Википедии. (2019, 11 июня). Глобулярный белок. В Википедия, Бесплатная энциклопедия . Получено 18:49, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Globular_protein&oldid=0467
.авторов Википедии. (2019, 11 июля). Внутренне неупорядоченные белки. В Википедия, Бесплатная энциклопедия . Получено 19:52, 20 июля 2019 г., с https: // en.wikipedia.org/w/index.php?title=Intrinsically_disordered_proteins&oldid=
2287 .