Тренировочная работа ОГЭ
Используя содержание текста «Что такое система?» и знания школьного курса биологии, ответьте на вопросы и выполните задание в тетради
1) Что является главным условием возникновения системы?
2) Чем с позиции анатомии отличается система «рука» от системы «мышца»?
3) На примере строения цветка докажите, что это система.
ЧТО ТАКОЕ СИСТЕМА?
Все живые и неживые тела (мебель, посуда, приборы, растения, животные), с которыми Вы встречаетесь каждый день, и все вещества (вода, сахар, соль, сода, уксусная кислота и многие другие), из чего-то состоят:
предметы – из определённых деталей, эти детали состоят из веществ, а вещества, в свою очередь, состоят из мельчайших частиц – молекул и атомов. Атомы и молекулы, взаимодействуя друг с другом, образуют новые, более
сложные вещества.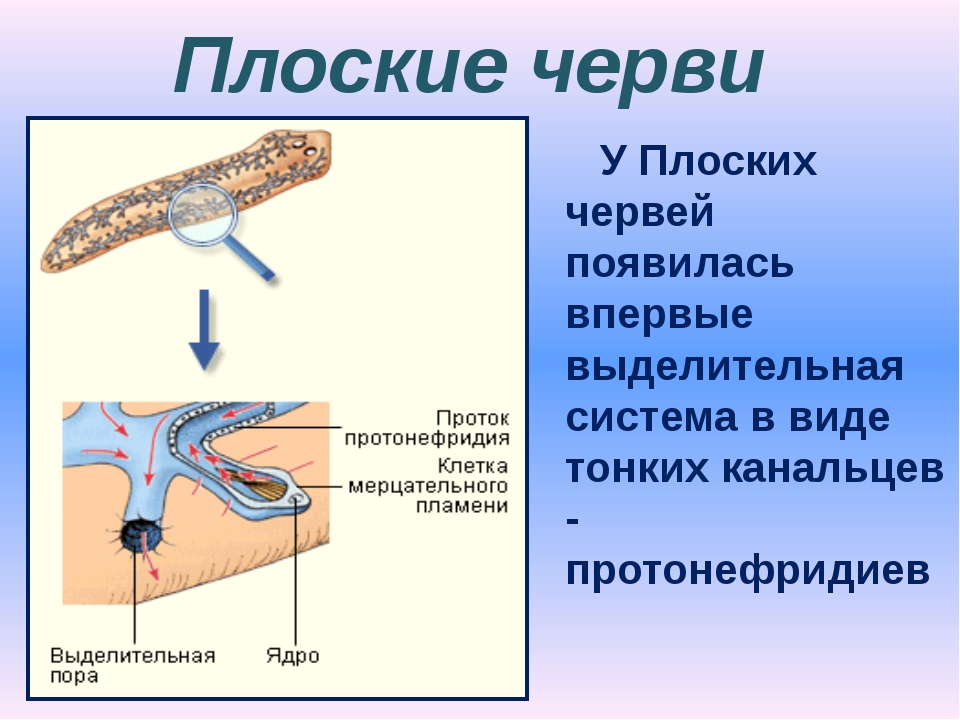
Взаимодействующие между собой части системы называют элементами этой системы. Чем больше взаимодействующих элементов составляют систему, тем она сложнее. Вспомните хотя бы разные конструкторы. Чем больше в них деталей, тем сложнее и длительней будет их сборка.
Детали различных приборов и механизмов, части организмов взаимодействуют между собой. В результате такого взаимодействия приборы нормально работают, а в организме идут процессы жизнедеятельности. И прибор, и организм – это системы, работающие благодаря взаимодействию деталей или органов. Но прибор – это неживая система, а организм – живая. Так как мы изучаем биологию, то нас будут интересовать живые системы, т.е. организмы.
Примером не самой сложной системы в организме может служить рука человека. Она состоит из костей, мышц, связок. Лишённая хотя бы одного из составляющих элементов, рука работать не сможет. Рука является подсистемой (элементом) более сложной системы «человеческий организм».
Глаза и уши, мозг и сердце, кости и мышцы – это элементы системы «человек». Все вместе они удивительно слаженно работают, образуя организм, хотя каждый из органов имеет свои особенности строения. Только взаимодействуя, отдельные органы образуют полноценный организм и обеспечивают его долгую и слаженную работу. Важно понять ещё одну мысль: свойства любой системы отличаются от свойств тех элементов, которые составляют систему. Так, например, лист, отделённый от растения, не способен создавать органические вещества, так как в него не поступает вода из корней. Клетка, лишённая ядра, не способна к размножению. Можно назвать много подобных примеров, чтобы доказать, что система приобретает новые свойства, которых не было у элементов, составляющих данную систему.
Спрятать
Эволюция систем органов хордовых животных — урок. Биология, Животные (7 класс).
В ходе эволюции у хордовых животных появилась нервная трубка, совершенная опорно-двигательная система, состоящая из внутреннего скелета и мускулатуры, произошло усовершенствование органов кровообращения и выделения. Сформировались приспособления для размножения на суше.
Сформировались приспособления для размножения на суше.
От примитивных бесчерепных, обитавших в воде и похожих на современных ланцетников, произошли рыбы.
От одной из групп рыб (похожих кистепёрых) появились первые наземные позвоночные — древние амфибии, а потом — первые рептилии.
Рептилии приспособились к жизни на суше и широко распространились по планете. Они дали начало первым млекопитающим и птицам.
В ходе эволюции происходило постепенное усовершенствование всех систем органов позвоночных животных.
Изменялись покровы тела.
Рис. \(1\). Покровы тела позвоночных
Совершенствовалась опорно-двигательная система. Усложнялись органы движения.
Рис. \(2\). Скелеты позвоночных
Один круг кровообращения (у рыб) разделился на два.
Рис. \(3\). Эволюция кровеносной системы
Эволюция кровеносной системы
Двухкамерное сердце (у рыб) превратилось в трёхкамерное (у амфибий и рептилий), а потом и четырёхкамерное (у птиц и млекопитающих).
Рис. \(4\). Усложнение строения сердца
Постепенно совершенствовались органы дыхания, увеличивалась дыхательная поверхность лёгких — от мешковидных у амфибий до альвеолярных у млекопитающих.
Рис. \(5\). Усложнение органов дыхания
Усовершенствование обмена веществ и терморегуляции привело к формированию у птиц и млекопитающих постоянной температуры тела, т. е. теплокровности.
Совершенствовалась нервная система, в первую очередь в направлении развития головного мозга.
Рис. \(6\). Усложнение головного мозга
Теплокровность, более совершенное строение мозга и сложное поведение, способность размножаться на суше позволили птицам и млекопитающим заселить всю Земле.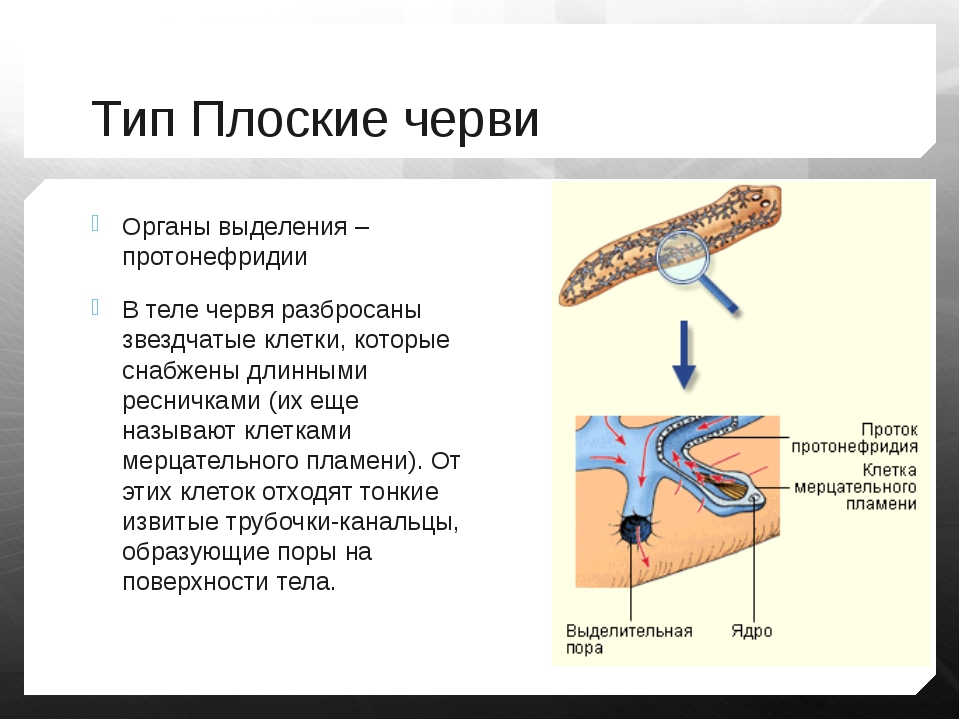
Последним этапом развития животного мира стало появление наиболее высокоразвитых млекопитающих — приматов, к которым относится и человек.
Источники:
Рис. 1. Покровы тела позвоночных. © ЯКласс
Рис. 2. Скелеты позвоночных. https://image.shutterstock.com/image-illustration/vertebrates-animals-backbones-600w-2071875428
Рис. 3. Эволюция кровеносной системы. © ЯКласс
Рис. 4. Усложнение строения сердца. © ЯКласс
Рис. 5. Усложнение органов дыхания. https://image.shutterstock.com/image-vector/comparison-breathing-apparatus-anatomy-vertebrates-600w-272405780
Рис. 6. Усложнение головного мозга. https://image.shutterstock.com/image-illustration/brain-evolution-fishes-human-600w-1108568873
У плоских червей тело. Питание плоских червей
Исходный уровень знаний:
План ответа:
- Общая характеристика Плоских червей
- Внешнее и внутреннее строение Плоских червей
- Размножение Плоских червей
- Классификация Плоских червей, многообразие видов
- Особенности строения и развития червей класса Ресничные на примере Молочной планарии
- Особенности строения и развития червей класса Сосальщики на примере Печеночного сосальщика
- Особенности строения и развития червей класса Ленточные на примере Бычьего цепня и др.

Общая характеристика Плоских червей
Количество видов: около 25 тысяч.
Среда обитания: Обитают повсеместно во влажных средах, включая ткани и органы других животных.
Строение: Плоские черви – это первые многоклеточные животные, у которых в ходе эволюции появились билатеральная симметрия, трехслойность, настоящие органы и ткани.
Билатеральная (двусторонняя) симметрия – это значит, что сквозь тело животного можно провести воображаемую ось симметрии, при этом правая сторона тела будет зеркально похожа на левую.
В ходе зародышевого развития у трехслойных животных закладываются три слоя клеток: наружный – эктодерма , средний – мезодерма, внутренний – энтодерма . Из каждого слоя развиваются определенные органы и ткани:
из эктодермы формируются кожные покровы (эпителий) и нервная система;
из мезодермы – мышечная и соединительная ткани, половая, выделительная системы;
из энтодермы – пищеварительная система.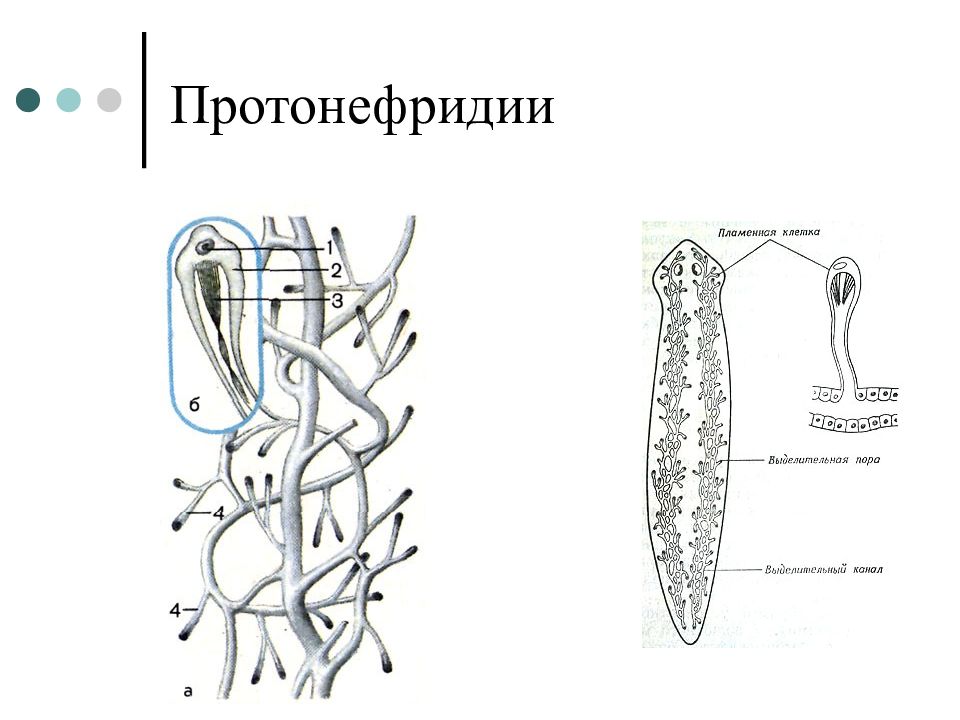
У плоских червей тело сплющено в спино-брюшном направлении, полость тела отсутствует, пространство между внутренними органами заполнено клетками мезодермы (паренхимой).
Пищеварительная система включает рот, глотку и слепозамкнутый кишечник. Поглощение пищи и выделение непереваренных остатков происходит через рот. У ленточных червей пищеварительная система полностью отсутствует, питательные вещества они всасывают всей поверхностью тела, находясь в кишечнике хозяина.
Выделительные
органы – протонефридии
. Они состоят из тонких ветвящихся канальцев, на одном конце которых находятся пламенные (мерцательные) клетки
звездчатой формы, погруженные в паренхиму. Внутрь этих клеток отходит пучок ресничек (мерцательное пламя), движение которых напоминает мерцание пламени (отсюда название клеток). Пламенные клетки захватывают из паренхимы жидкие продукты распада, а реснички гонят их в каналец. Канальцы открываются на поверхности тела выделительной порой, через которую продукты распада удаляются из организма.
Нервная система лестничного типа (ортогон) . Она образована крупным головным парным нервным узлом (ганглием) и отходящими от него шестью нервными стволами: два на брюшной стороне, два на спинной и два по бокам. Нервные стволы соединены между собой перемычками. От ганглия и стволов отходят нервы к органам и коже.
Размножение и развитие:
Плоские черви – гермафродиты. Половые клетки созревают в половых железах (гонадах). Гермафродит имеет как мужские железы – семенники, так и женские – яичники. Оплодотворение – внутреннее, обычно перекрестное, т.е. черви обмениваются семенной жидкостью.
КЛАСС РЕСНИЧНЫЕ ЧЕРВИ
Молочная планария
, маленькое водное животное, взрослая особь имеет длину ~25 мм и ширину ~6 мм, тело плоское, молочно-белое. На переднем конце тела находятся два глаза, отличающие свет от тьмы, а также пара щупалец (органы химического чувства), необходимые для поиска пищи. Двигаются планарии, с одной стороны, благодаря работе ресничек, покрывающих их кожу, с другой стороны, благодаря сокращению мышц кожно-мускульного мешка.
Планарии – хищники, питающиеся мелкими животными. Рот находится на брюшной стороне, ближе к середине тела, от него идет мускулистая глотка, от которой отходит три ветви замкнутого кишечника. Захватив жертву, планария высасывает глоткой её содержимое. В кишечнике происходит переваривание под действием ферментов (кишечное), клетки кишечника способны захватывать и переваривать кусочки пищи (внутриклеточное пищеварение). Непереваренные остатки пищи удаляются через рот.
Размножение и развитие
. Ресничные – гермафродиты. Оплодотворение перекрестное. Оплодотворенные яйца попадают в кокон, который червь откладывает на подводные предметы. Развитие прямое.КЛАСС СОСАЛЬЩИКИ
КЛАСС ЛЕНТОЧНЫЕ ЧЕРВИ
Бычий цепень
– ленточный червь, достигает в длину от 4-х до 12 метров. Тело включает головку с присосками, шейку и стробилу – ленту члеников. Самые молодые членики находятся у шейки, самые старые представляют собой мешочки, заполненные яйцами, находятся на заднем конце, где они отрываются один за другим.
Тело включает головку с присосками, шейку и стробилу – ленту члеников. Самые молодые членики находятся у шейки, самые старые представляют собой мешочки, заполненные яйцами, находятся на заднем конце, где они отрываются один за другим.
Размножение и развитие . Бычий цепень – гермафродит: в каждом его членике имеется один яичник и множество семенников. Наблюдается как перекрестное оплодотворение, так и самооплодотворение. Задние членики, заполненные зрелыми яйцами, открываются, и, с калом, выводятся наружу. Крупный рогатый скот (промежуточный хозяин) может проглотить яйца вместе с травой, в желудке из яиц выходят микроскопические личинки с шестью крючками, которые сквозь стенку кишечника попадают в кровь и разносятся по всему телу животного и заносятся в мышцы. Здесь шестикрючная личинка растет и превращается в
 В желудке человека из финки выходит головка, которая прикрепляется к стенке кишечника. От шейки отпочковываются новые членики – червь растет. Бычий цепень выделяет ядовитые вещества, которые вызывают у человека кишечные расстройства и малокровие.
В желудке человека из финки выходит головка, которая прикрепляется к стенке кишечника. От шейки отпочковываются новые членики – червь растет. Бычий цепень выделяет ядовитые вещества, которые вызывают у человека кишечные расстройства и малокровие.
Развитие свиного цепня имеет сходный характер, его промежуточным хозяином кроме свиньи и кабана может быть и человек, тогда в его мышцах развиваются финки.
Развитие широкого лентеца сопровождается сменой двух промежуточных хозяев: первый – рачок (циклоп), второй – рыба, съевшая рачка. Окончательным хозяином может быть человек или хищник, съевший зараженную рыбу.
Новые понятия и термины: мезодерма, кожно-мускульный мешок, тегумент, гиподерма, редукция, протонефридии (пламенные клетки), ортогон, стробила, ганглий, гонады, гермафродит, прямое и непрямое развитие, окончательный и промежуточный хозяин, мирацидий, церкария, финна, членик, вооруженный и невооруженный цепень.
Литература:
- Билич Г.
 Л., Крыжановский В.А. Биология. Полный курс. В 3-х т. – М.: ООО Издательский дом «Оникс 21 век», 2002
Л., Крыжановский В.А. Биология. Полный курс. В 3-х т. – М.: ООО Издательский дом «Оникс 21 век», 2002 - Пименов А.В., Пименова И.Н. Зоология беспозвоночных. Теория. Задания. Ответы.: Саратов, ОАО издательство «Лицей», 2005.
- Чебышев Н.В., Кузнецов С.В., Зайчикова С.Г. Биология: пособие для поступающих в вузы. Т.2. – М.: ООО «Издательство Новая Волна», 1998.
В частности плоским, круглым и кольчатым. Особое место будет выделено плоским червям. Будут рассмотрены их различные органы и их деятельность. Например, мы разберем, как осуществляется дыхание плоских червей, изучим строение выделительной и репродуктивной систем и т.д. А также будут рассмотрены некоторые их представители.
Разнообразие червей
К типу Черви относится группы многоклеточных животных, у которых вытянутое тело и отсутствует скелет. Места обитания — это, как правило, влажная почва, море и пресные водоемы. По размерам они могут варьироваться от таких, которые можно обнаружить лишь в микроскоп, до крупных форм, длинной в несколько метров.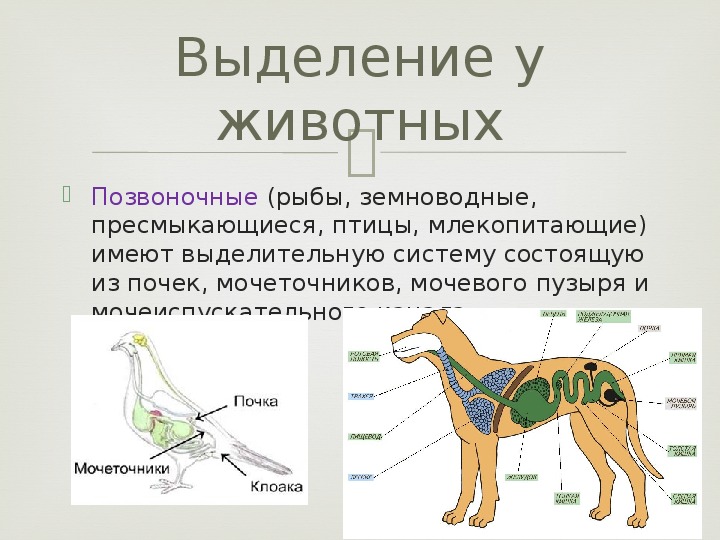 В соответствии с формой тела выделяют: Плоских, Круглых и Кольчатых червей. У всех типов имеется три слоя тела. Зародышевые слои — эктодерма, эндодерма и мезодерма дают начало развитию всем их тканям и органам.
В соответствии с формой тела выделяют: Плоских, Круглых и Кольчатых червей. У всех типов имеется три слоя тела. Зародышевые слои — эктодерма, эндодерма и мезодерма дают начало развитию всем их тканям и органам.
Самые яркие и известные представители плоских червей: планария, свиной и бычий цепни, эхинококки, шистосома и т.д. К известным кольчатым относятся: червь дождевой, малощетинковые черви, пиявки и мизостомиды. Круглые первичноротые представлены всем известными аскаридами, острицами, риштами, трихинеллами и т.д.
Несмотря на разнообразие существующих видов червяков, их типов, особенностей строения, способов репродукции, питания, мест обитания и т.д., существуют немалое количество сходств, характерных для них всех. Например, дыхание плоских червей, разделенное на аэробное и анаэробное, в зависимости от среды обитания, характерно и для других двух типов.
Плоские черви
Система органов плоских червей представлена некоторым количеством основных структурных компонентов, объединенных по общим функциональным признакам и по типу строения. К основным системам относятся: дыхательная, репродуктивная, выделительная, мышечная, нервная и покровная.
К основным системам относятся: дыхательная, репродуктивная, выделительная, мышечная, нервная и покровная.
Ранее к классу ресничных первичноротых приписывали ряды других таксономических элементов, характеризующихся червеобразными формами, отсутствием полостей тела и считающимися беспозвоночными.
Форма тела у любого типа, имеет билатерально-симметрическую форму, в которой выражены головной и хвостовой концы, слегка уплощенные оба конца, однако у крупных видов, уплощение сильно выраженно. Система органов плоских червей для дыхания и кровообращения — отсутствует. Полость в теле не развивается, однако это справедливо для всех представителей, кроме ленточных червей и сосальщиков на определенных жизненных циклах.
Строение покровов тела
Знакомство с мускулатурой
Мышечные ткани плоских червей представлены мускульным мешком, который залегает под эпителием. Он состоит из некоторого количества слоев клеток мышечного типа, которые не разделены на мышцы. Однако некоторая дифференциация наблюдаема в областях глотки и половой системы. Внешняя часть клеток мышечных слоев ориентируются поперек, а внутренние — вдоль задне-передней оси тела. Наружная мускулатура называется кольцевым слоем, а внутренняя — слоем мускулатуры продольного характера.
Однако некоторая дифференциация наблюдаема в областях глотки и половой системы. Внешняя часть клеток мышечных слоев ориентируются поперек, а внутренние — вдоль задне-передней оси тела. Наружная мускулатура называется кольцевым слоем, а внутренняя — слоем мускулатуры продольного характера.
Способы дыхания
Ознакомление с глоткой и кишкой
Всем группам плоских червей свойственно наличие глотки, которая ведет в кишку. Исключение составляют цестодообразные и ленточные червяки. Эта кишка открывается в паренхиму, предназначенную для пищеварения, слепо замыкается и связана с окружающим миром лишь ротовым отверстием. Некоторые крупные турбеллярии имеют в своем наличие анальные поры, однако, это исключение лишь для некоторых субъектов вида. Мелкие формы характеризуются прямым кишечником, а крупные (планария, сосальщик) могут иметь разветвленный. Глотка расположилась на поверхности брюха, часто ее можно обнаружить посреди или ближе к задней части тела. У некоторых групп червей глотка смещается вперед.
Особенности нервной системы и органов чувств
Характеризуя нервную систему плоских первичноротых, стоит отметить, что им характерно наличие нервных узлов, расположенных спереди тела, а также есть ганглии мозга и ответвляющиеся от них нервные столбцы, которые соединяются перемычками. К чувствительным органам относятся отдельные кожные реснички, которые являются отростками клеток нервного типа. Существуют свободноживущие виды, которые имеют особые, чувствительные к свету глазки пигментной природы. Такие органы служат примитивным приспособлением к ощущению равновесия и позволяют видеть, пусть и примитивно.
Система выделения
Червям плоского типа присуща выделительная система, которая принимает вид протонефридий. С их помощью протекает процесс осморегуляции и обмена веществ. Система выделения принимает форму каналов, что ветвятся и объединяются в 1-2 канала. Изначально это клетки звездчатого типа, которые разветвляясь на канальцы, открывают в себе просвет для прохождения пучка жгутиков.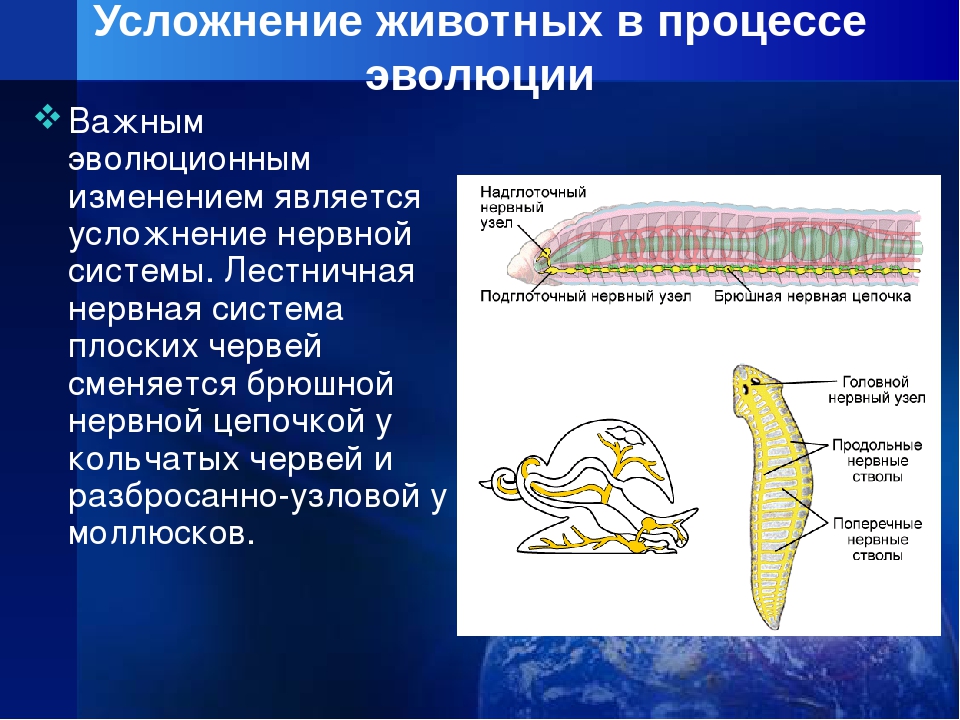 Сливаясь, канальцы образуют более крупную структуру и выводятся в форме выделительных пор на поверхность тела. Подобные системы выделения именуют протонефридиальными. Опасные для жизни червя продукты обмена веществ выводятся вместе с жидкостями через вышеупомянутые протонефридии, а также при помощи специальных клеток паренхимы — атроцитов, которые играют роль «накопительных почек».
Сливаясь, канальцы образуют более крупную структуру и выводятся в форме выделительных пор на поверхность тела. Подобные системы выделения именуют протонефридиальными. Опасные для жизни червя продукты обмена веществ выводятся вместе с жидкостями через вышеупомянутые протонефридии, а также при помощи специальных клеток паренхимы — атроцитов, которые играют роль «накопительных почек».
Репродукция
Данные составные репродуктивно системы формируют сложные, или экзолецитальные, яйца. Общая оболочка может содержать в себе одну яйцеклетку или некоторое количество желточных шаров, выделяемых железами придаточного типа.
Заключение
Подытожив вышенаписанный текст, можно сделать несколько заключений, среди которых самыми значимыми являются: дыхание плоских червей осуществляется поверхностью всего тела, преимущественно плоские червяки относятся к хищникам, имеется мускульный мешок, покров тела представлен тегументом, большинство относятся к гермафродитам и лишь немногие из них раздельнополые.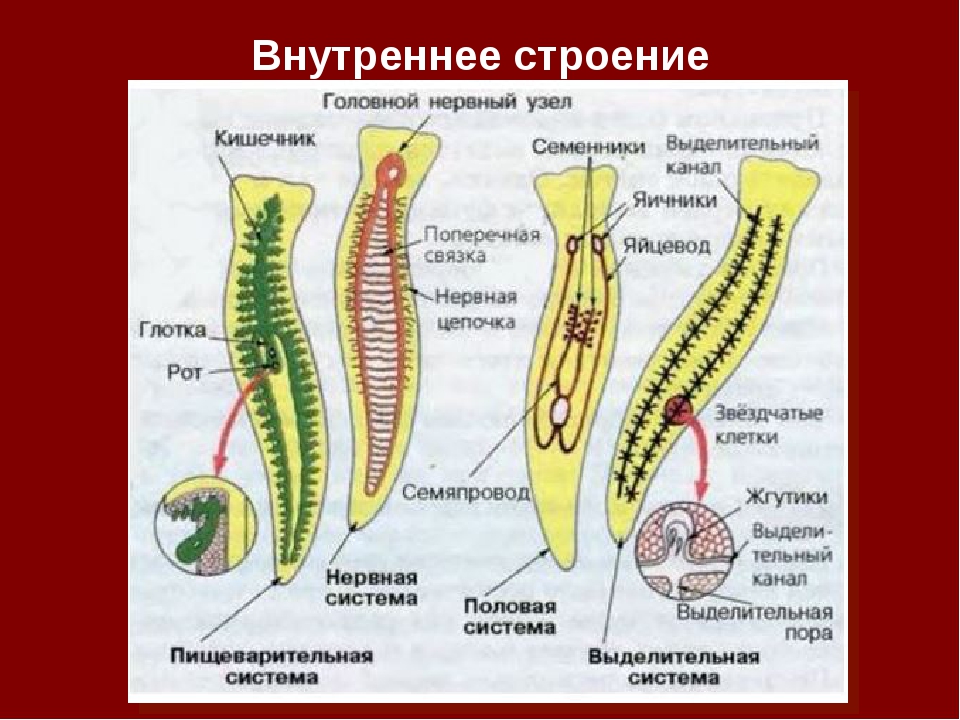
Все черви можно поделить на три типа (плоские, кольчатые, круглые), каждый из которых отличается своими характерными особенностями. Данный тип относится к беспозвоночным животным, лишенным полости тела и обладающим двусторонней симметрией.
Пациенты, которые хотят избавиться от гельминтов, часто спрашивают натуральные препараты с наименьшими побочными эффектами. В таких случаях рекомендую это средство.
Основные признаки типа плоские черви
- пищеварительная;
- нервная;
- половая;
- выделительная.
Данный тип обладает наличием нескольких систем и даже зачатками органов
Кровеносная система
Не имеется, но функцию крови выполняет паренхима, состоящая из соединительных клеток. Именно она и транспортирует питательные вещества в организме.
Пищеварительная система
Довольно упрощенная, состоит из глотки и кишки.
Глотка мощная, может:
- засасывать;
- выворачиваться и обволакивать свою жертву.

Кишка из двух отделов — передний и средний, чаще всего разветвлена. Имеет замкнутое строение, так что все непереваренные отходы выходят через рот. Ротовое отверстие находится ближе к середине тела червя.
Свободные черви в своем большинстве хищники и у них даже бывает своеобразное приспособление захвата жертвы. Эта система наблюдается не у всех классов, у более примитивных червей ее нет. Например, ленточные черви питаются всей поверхностью.
Выделительная система
Выделительная система довольно масштабна и состоит из множества канальцев, которые объединяются и ведут к выделительным порам.
В паренхиме содержатся специальные клетки, которые загоняют вредные вещества в канальцы. Для человека эти продукты выделения очень опасны и токсичны наравне с ядом.
ФАСЦИОЛЕЗ
· Кровяной сосальщик: 1. Шистосома кровяная — Schistosoma haematobium
2. Шистосома Маисоиа — Schistosome mansoni
3. Шистосома японская — Schistosoma japonicum
ШИСТОСОМОЗ
· Описторх (кошачья или сибирская двуустка) — Opisthorchis felineus
ОПИСТОРХОЗ
· Клонорх (китайский сосальщик) — Clonorchis sinensis
КЛОНОРХОЗ
· Парагоним (легочный сосальщик) — Paragonimus westermani
ПАРАГОНИМОЗ
Тип Плоские черви: общая характеристика (PLATHELMINTHES)
В тип Плоские черви входят следующие классы: Ресничные черви (Turbellaria), Сосальщики (Trematoda), Ленточные черви (Cestoda) и др.
1. Тип плоских червей представлен двустороннесимметричными (билатеральными) животными, через тело которых можно провести только одну плоскость симметрии. Двусторонняя симметрия впервые появляется именно в этой группе беспозвоночных.
Плоские черви трехслойны. В процессе онтогенеза у них формируются не два, как у кишечнополостных, а три зародышевых листка. Между эктодермой , образующей покровы, и энтодермой, из которой построен кишечник, у них имеется еще и промежуточный зародышевый листок — мезодерма. Тело их в большинстве случаев вытянуто в длину и сплющено в спинно-брюшном направлении (принимает вид листа, пластинки, ленты).
2
. Важная особенность строения плоских червей — наличие у них кожно-мускульного мешка. Так называется совокупность эпителия и расположенной непосредственно под ним сложной системы мышечных волокон. Эти волокна, нередко распадающиеся на несколько слоев (кольцевые, продольные), одевают под эпителием все тело животного в виде сплошного мешка, а не разбиваются на отдельные мускульные пучки более специального назначения, как у высших билатеральных животных (членистоногих, моллюсков). Сокращением мышечных элементов кожно-мускульного мешка обусловливаются характерные «червеобразные» движения Plathelminthes.
Сокращением мышечных элементов кожно-мускульного мешка обусловливаются характерные «червеобразные» движения Plathelminthes.
3 . Тело плоских червей не имеет полости — это бесполостные, или паренхиматозные, животные: пространство между внутренними органами заполнено соединительной тканью мезодермального происхождения, или паренхимой, содержащей многочисленные клетки. Паренхима занимает все промежутки между органами, и ее роль многообразна. Она имеет опорное значение, служит местом накопления запасных питательных веществ, играет важную роль в процессах обмена и т.д.
5 . Нервная система состоит из парного мозгового ганглия и идущих от него кзади нервных стволов, соединенных кольцевыми перемычками. Особого развития достигают два продольных ствола (боковые или брюшные). У плоских червей формируется центральный регулирующий аппарат нервной системы.
6 . Кровеносная и дыхательная системы отсутствуют.
7
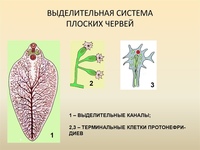
. Впервые появляются специальные органы выделения, построенные по типу так называемых протонефридиев. Они представлены системой разветвленных канальцев, оканчивающихся в паренхиме особой звездчатой клеткой с пучком ресничек. С внешней средой протонефридии сообщаются при помощи специальных экскреторных (выделительных) отверстий.
Они представлены системой разветвленных канальцев, оканчивающихся в паренхиме особой звездчатой клеткой с пучком ресничек. С внешней средой протонефридии сообщаются при помощи специальных экскреторных (выделительных) отверстий.
8. Половая система плоских червей гермафродитна; как правило, формируется сложная система протоков, служащих для выведения половых продуктов, и появляются органы, обеспечивающие возможность внутреннего оплодотворения.
Основные ароморфозы , обеспечившие возникновение и развитие плоских червей, следующие:
Развитие в эмбриогенезе третьего зародышевого листка — мезодермы ;
Возникновение мышечной, соединительной, эпителиальной и нервной тканей;
Возникновение узловой нервной системы, пищеварительной выделительной и репродуктивной систем органов;
Возникновение двусторонней симметрии.
Так же, как и у кишечнополостных, у плоских червей замкнутый кишечник, имеющий лишь одно отверстие: входное, оно же и анальное. Кровеносной и дыхательной систем у плоских червей нет.
Кровеносной и дыхательной систем у плоских червей нет.
Сравнительная характеристика классов плоских червей.
особенности строения
Тело плоских червей имеет четко выраженные ткани всех 4 основных типов, из которых формируются органы и системы органов. Форма тела уплощена в спинно-брюшном направлении, имеет вид листа, пластинки, ленты и тому подобное.
Симметрия двусторонняя (билатеральная ), появилась в процессе эволюции как приспособление к активному образу жизни. В теле уже различают главный и хвостовой конце, спинной и брюшной части.
Зародышевые листки — эктодерма, энтодерма и мезодерма. В процессе зародышевого развития закладывается третий зародышевый листок, который возникает впервые именно в плоских червей. Мезодерма — средний зародышевый слой, свойственный зародышам многоклеточных трехслойных животных.
Полость
тела отсутствует, промежутки между органами заполнены паренхимой. Паренхимы
— рыхлая соединительная ткань, выполняющая различные функции: запасания питательных веществ, их транспортировки, выведение продуктов обмена, поддержание формы тела и др.
Паренхимы
— рыхлая соединительная ткань, выполняющая различные функции: запасания питательных веществ, их транспортировки, выведение продуктов обмена, поддержание формы тела и др.
Особенности процессов жизнедеятельности
Опора осуществляется благодаря клеткам паренхимы и кожно-мышечном мешке.
Движение обеспечивается гладкими мышцами, которые образованы по кольцевым, продольных и диагональных мышечных волокон.
Транспорт веществ по телу происходит путем диффузии. Кровеносная система во всех плоских червей отсутствует.
Выделение
осуществляется с участием выделительной системы.
Появляется в процессе эволюции впервые и построена по типу протонефридиев. Протонефридии —
органы выделения некоторых беспозвоночных животных, которые состоят из канальцев, начинающиеся клетками звездчатой формы, от которых в просвет канальцев направлены реснички. Продукты обмена могут накапливаться в особых клетках паренхимы.
Регуляция функций реализуется с участием нервной системы узлового (ганглионарного) типа, которая разделена на центральную (ЦНС ) то периферийную (ПНС ). ЦНС состоит из головного нервного узла и нервных стволов, соединенных кольцевыми перегородками. ПНС представлена нервными отростками и нервными окончаниями. В плоских червей известны только безусловные рефлексы.
Размножение половое, которое осуществляется половой системой из женских и мужских органов. В большинстве плоских червей половая система гермафродитная. Гермафродитов является организмы, которые имеют одновременно женские и мужские половые органы. Оплодотворение внутреннее, может быть перекрестным или вследствие самооплодотворение.
Регенерация хорошо развита у свободноживущих видов.
Экскреторная система – обзор
Экскреция и осморегуляция
Считается, что экскреторная система платигельминтов функционирует главным образом в осморегуляции, при этом удаление метаболических отходов обычно происходит путем диффузии через наружный слой тела.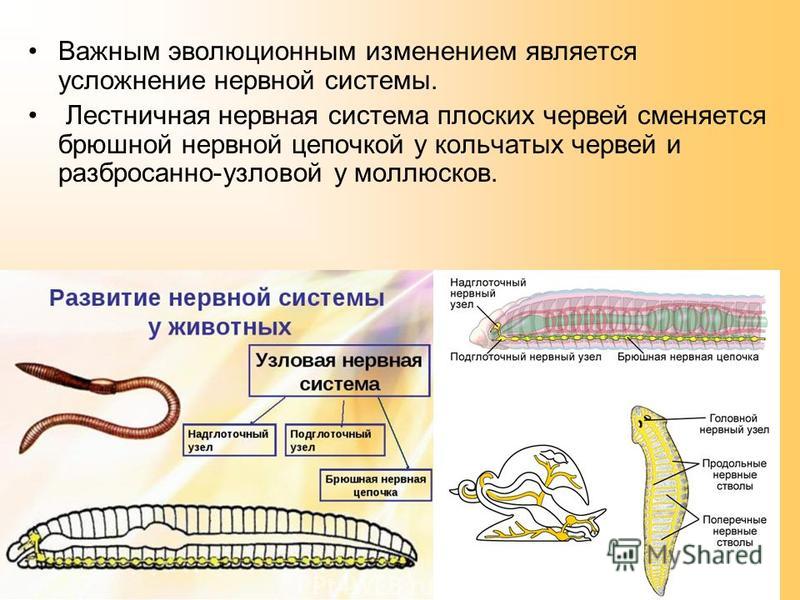 Однако удаление избыточной воды также может быть достигнуто через кишечник, и у свободноживущих видов нередко обнаруживаются экскреторные продукты, хранящиеся в различных тканях. У платигельминтов эта система состоит из ряда протонефридиев и поэтому обычно называется протонефридиальной системой.Он состоит из ряда протонефридиев, соединенных с собирательными трубочками, которые впадают в один или несколько крупных каналов, называемых нефридиодуктами; они либо открываются наружу тела через один или несколько нефридиопоров, либо впадают в общий экскреторный пузырек, который открывается наружу через общий нефридиопор. Все протонефридии состоят, по крайней мере, из одной пламенной луковицы, несущей от двух до многих ресничек, и канальной клетки, а иногда и колпачковой клетки. Rohde (1991) выделил три различных типа протонефридиев.В типе 1, обнаруживаемом только у катенулид, каждая пламенная луковица имеет колпачковую клетку, не имеет канальной клетки и несет только две реснички, корешки которых проходят вдоль собирательной водосливы.
Однако удаление избыточной воды также может быть достигнуто через кишечник, и у свободноживущих видов нередко обнаруживаются экскреторные продукты, хранящиеся в различных тканях. У платигельминтов эта система состоит из ряда протонефридиев и поэтому обычно называется протонефридиальной системой.Он состоит из ряда протонефридиев, соединенных с собирательными трубочками, которые впадают в один или несколько крупных каналов, называемых нефридиодуктами; они либо открываются наружу тела через один или несколько нефридиопоров, либо впадают в общий экскреторный пузырек, который открывается наружу через общий нефридиопор. Все протонефридии состоят, по крайней мере, из одной пламенной луковицы, несущей от двух до многих ресничек, и канальной клетки, а иногда и колпачковой клетки. Rohde (1991) выделил три различных типа протонефридиев.В типе 1, обнаруживаемом только у катенулид, каждая пламенная луковица имеет колпачковую клетку, не имеет канальной клетки и несет только две реснички, корешки которых проходят вдоль собирательной водосливы.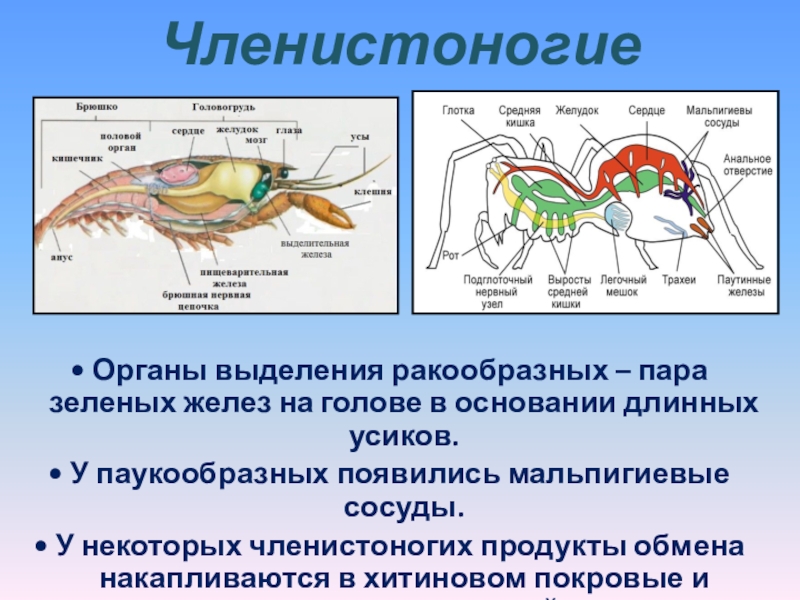 В типе 2, обнаруженном у большинства платигельминтов, а также у многих других типов, включая немертины и гнатосомулиды, каждая пламенная луковица имеет колпачковую клетку и множество ресничек, корешки которых входят в колпачковую клетку; каждая лампочка пламени также связана с ячейкой канала, которую она может использовать совместно с другими лампочками пламени. В типе 3, обнаруженном только у калипторинхов, «далиеллиоидов», темноцефалид и, возможно, также у «тифлофаноидов» и «лецитоэпителианов», каждая пламенная луковица несет несколько ресничек, но не имеет колпачковой клетки; каждая лампочка пламени также связана с ячейкой канала, которую она обычно разделяет с другими лампочками пламени.Во всех случаях пламенная колба связана с фильтрующим аппаратом, называемым водосливом, состоящим из отростков колпачковой и канальной ячейки, окруженных мембраной. Биение ресничек в пламенной луковице втягивает жидкости организма через мембрану водослива в собирательные протоки. Один или два набора протонефридиев присутствуют у всех платигельминтов, за исключением нескольких катенулид, у которых считается, что экскреция происходит исключительно через пищеварительный синцитий.
В типе 2, обнаруженном у большинства платигельминтов, а также у многих других типов, включая немертины и гнатосомулиды, каждая пламенная луковица имеет колпачковую клетку и множество ресничек, корешки которых входят в колпачковую клетку; каждая лампочка пламени также связана с ячейкой канала, которую она может использовать совместно с другими лампочками пламени. В типе 3, обнаруженном только у калипторинхов, «далиеллиоидов», темноцефалид и, возможно, также у «тифлофаноидов» и «лецитоэпителианов», каждая пламенная луковица несет несколько ресничек, но не имеет колпачковой клетки; каждая лампочка пламени также связана с ячейкой канала, которую она обычно разделяет с другими лампочками пламени.Во всех случаях пламенная колба связана с фильтрующим аппаратом, называемым водосливом, состоящим из отростков колпачковой и канальной ячейки, окруженных мембраной. Биение ресничек в пламенной луковице втягивает жидкости организма через мембрану водослива в собирательные протоки. Один или два набора протонефридиев присутствуют у всех платигельминтов, за исключением нескольких катенулид, у которых считается, что экскреция происходит исключительно через пищеварительный синцитий. Протонефридиальная система наиболее развита у пресноводных видов.Действительно, считается, что эта система сыграла важную роль в проникновении платигельминтов в пресноводные места обитания.
Протонефридиальная система наиболее развита у пресноводных видов.Действительно, считается, что эта система сыграла важную роль в проникновении платигельминтов в пресноводные места обитания.
Протонефридиальная система большинства таксонов платигельминтов парная (но пары иногда соединяются медиально), состоящая из двух нефридиодуктов, по одному проходит вдоль латерального края каждой стороны тела; эти протоки соединяются со многими протонефридиями на всем протяжении. Некоторые из катенулид являются исключительными тем, что обладают единственным дорсальным нефридиодуктом, который открывается через одиночное заднее нефридиопор; некоторые просериаты также обладают одним набором протонефридиев, но некоторые обладают тремя наборами протонефридиев.В большинстве групп, не относящихся к неодерматам, два нефридиодукта открываются наружу тела через отдельные нефридиопоры, которые находятся в передней половине тела, как правило, на вентральной поверхности. У большинства темноголовых два нефридиопротока открываются в отдельные мешковидные экскреторные пузырьки, расположенные в передней части тела по обе стороны от глотки, а левый и правый наборы протонефридиев обычно соединяются двумя поперечными протоками, одним на переднем и один в задней части системы.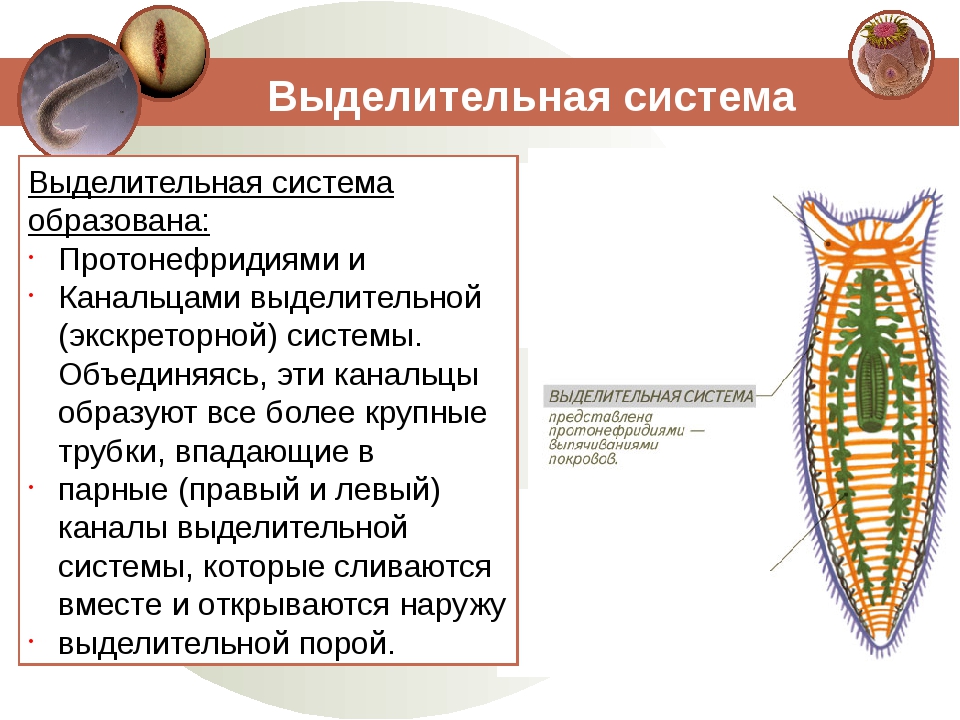 Протонефридиальная система моногеней сходна с таковой у темноцефалид, но передний поперечный проток отсутствует у полиопистокотилей.
Протонефридиальная система моногеней сходна с таковой у темноцефалид, но передний поперечный проток отсутствует у полиопистокотилей.
Aspidogastreans обладают протонефридиальной системой, которая также очень похожа на таковую у темноцефалид, но без поперечных протоков. Протонефридиальная система дигенеев несколько отличается от таковой у аспидогастреан тем, что два нефридиопротока обычно открываются в общий задний экскреторный пузырек. Эта везикула принимает различные формы у разных таксонов; например, он может быть V-образным, Y-образным или I-образным.В отличие от других таксонов платигельминтов, расположение протонефридиев относительно нефридиодуктов является регулярным и последовательным на церкарной стадии дигенеев у особей одного и того же вида, но различается у особей разных таксонов, и, таким образом, эта «формула пламенных клеток» часто значительное таксономическое значение. Большее количество пламенных луковиц и трудность наблюдения большинства элементов протонефридиальной системы в более крепких телах взрослых дигенеев снижают таксономическую полезность расположения пламенных луковиц у взрослых.
Среди ленточных червей амфилиновые обладают протонефридиальной системой, состоящей из сети собирательных трубочек, а не только из двух латеральных нефридиодуктов. Эта сеть впадает в удлиненный экскреторный пузырек, открывающийся наружу через задний нефридиопор. Пламенные луковицы обычно располагаются парами, сгруппированы в группы по всей длине тела. Гирокотилидеевая система также включает два продольных нефридиодукта, соединенных друг с другом рядом вторичных каналов.Основные нефридиодукты открываются в нефридиопор на дорсальной поверхности в передней половине тела. У большинства других групп цестод протонефридиальная система состоит из двух дорсальных и двух вентральных продольных нефридиодуктов, причем вентральные протоки обычно больше в диаметре, чем дорсальные протоки; нефридиодукты соединены с несколькими пламенными луковицами по всей длине тела. Однако некоторые цестоды имеют до 12 продольных протоков. Пары дорсальных и вентральных нефридиодуктов соединяются друг с другом в сколексе, где они могут сильно извиваться.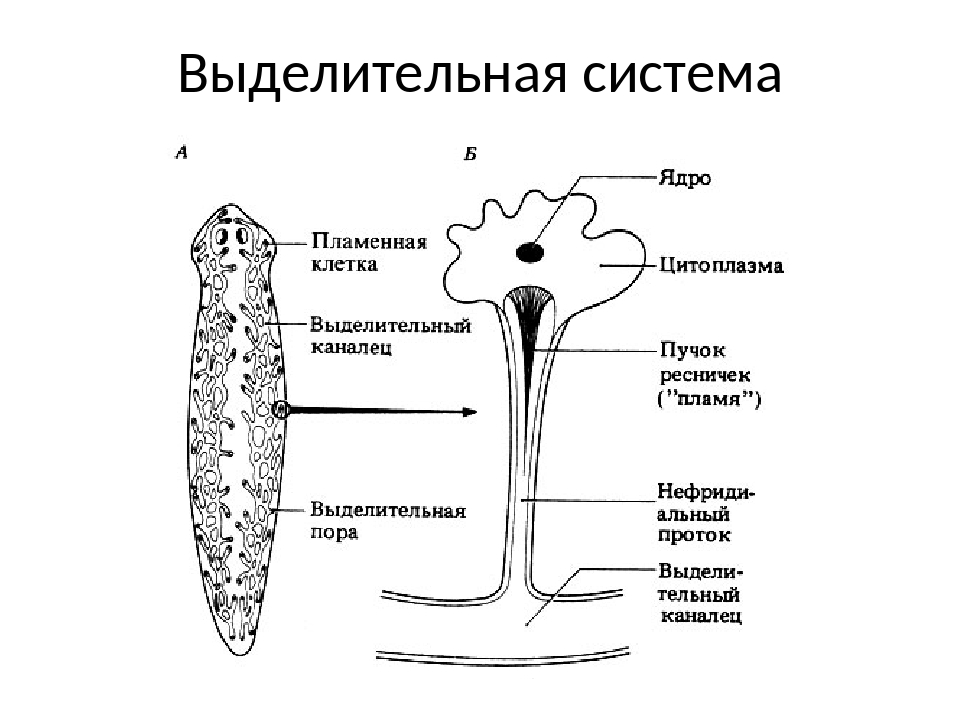 Левый и правый нефридиодукты часто сообщаются друг с другом посредством поперечных выводных протоков, расположенных в заднем конце каждой проглоттиды; это состояние чаще всего встречается у анаполитических видов эвцестод. В некоторых группах продольные сосуды соединяются друг с другом многочисленными латеральными нефридиодуктами, что приводит к сетевому расположению сосудов. В первой сформированной проглоттиде (расположенной на заднем конце стробилы) вентральная пара нефридиодуктов часто впадает в небольшой пузырек на заднем конце этой проглоттиды.Однако, как только эта проглоттида отпадает от стробилы, вентральные сосуды открываются наружу отдельно в заднем конце терминальной проглоттиды стробилы. Rohde (1991) дает полезный обзор эволюции протонефридиальной системы у платигельминтов.
Левый и правый нефридиодукты часто сообщаются друг с другом посредством поперечных выводных протоков, расположенных в заднем конце каждой проглоттиды; это состояние чаще всего встречается у анаполитических видов эвцестод. В некоторых группах продольные сосуды соединяются друг с другом многочисленными латеральными нефридиодуктами, что приводит к сетевому расположению сосудов. В первой сформированной проглоттиде (расположенной на заднем конце стробилы) вентральная пара нефридиодуктов часто впадает в небольшой пузырек на заднем конце этой проглоттиды.Однако, как только эта проглоттида отпадает от стробилы, вентральные сосуды открываются наружу отдельно в заднем конце терминальной проглоттиды стробилы. Rohde (1991) дает полезный обзор эволюции протонефридиальной системы у платигельминтов.
Стволовые клетки и поток жидкости вызывают образование кисты в органе выделения беспозвоночных
Благодарим вас за отправку вашей работы под названием «Стволовые клетки и поток жидкости способствуют образованию кисты в органе выделения беспозвоночных» для рассмотрения по адресу eLife . Ваша статья была положительно оценена Джанет Россант (старший редактор) и тремя рецензентами, один из которых, Юкико Ямасита, является членом нашего Совета редакторов-рецензентов. Другой рецензент, Фридхельм Хильдебрандт, также согласился раскрыть свою личность.
Ваша статья была положительно оценена Джанет Россант (старший редактор) и тремя рецензентами, один из которых, Юкико Ямасита, является членом нашего Совета редакторов-рецензентов. Другой рецензент, Фридхельм Хильдебрандт, также согласился раскрыть свою личность.
Редактор-рецензент и другие рецензенты обсудили свои комментарии до того, как мы приняли это решение, и редактор-рецензент собрал следующие комментарии, чтобы помочь вам подготовить исправленное представление.
В этой рукописи Альварадо и его коллеги представили убедительные доказательства того, что экскреторная система планарий, протонефридия, служит мощной модельной системой для изучения развития почек млекопитающих и таких патологий, как кистозная болезнь почек.Все рецензенты согласились с тем, что это превосходный документ, и он не вызвал серьезных опасений. У них есть несколько конкретных замечаний, с которыми мы предлагаем авторам ознакомиться перед публикацией. Мы решили сообщать все комментарии рецензентов авторам, а не обобщать пункты, подлежащие пересмотру, поскольку они содержат обнадеживающие комментарии и похвалы.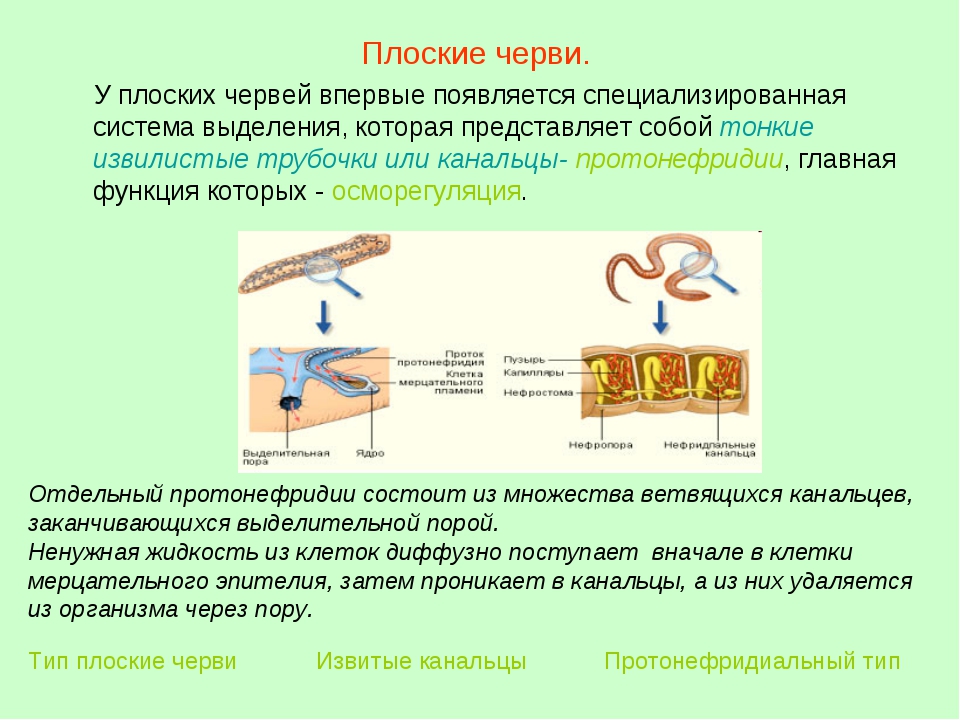
Рецензент #1 :
Эта рукопись Vu et al. дает всестороннюю характеристику выделительной системы планарии.Авторы провели систематический филогенетический анализ и анализ экспрессии примерно 300 переносчиков растворенных веществ (slc), кодируемых геномом планарии, идентифицировав 49, которые экспрессировались в протонефридиях. Путем сопоставления паттернов экспрессии slc относительно известных маркеров экскреторной системы авторы смогли определить шесть различных доменов в этой системе. Поразительно, кластеризация генов slc на основе известной субстратной специфичности и сравнение их доменов экспрессии с доменами, наблюдаемыми в нефронах позвоночных, выявили значительную степень сходства в общей структурно-функциональной организации систем планарий и грызунов.Эти параллели распространяются на мутации, связанные с кистозными заболеваниями почек у людей. Нокдауны RNAi нефринов планарий приводили к ультраструктурным дефектам щелевых диафрагм в клетках пламени планарий и нарушению фильтрации. Нокдауны RNAi гомологов нефроцистина генерировали кистоподобные структуры в протонефридиальных канальцах. Примечательно, что образование этих кист и результирующие осморегуляторные дефекты зависят от пролиферации. Наконец, авторы показывают, что нокдауны генов, необходимых для правильного биения ресничек (и, таким образом, тока жидкости в протоках), также вызывают кисты в экскреторной системе.
Нокдауны RNAi гомологов нефроцистина генерировали кистоподобные структуры в протонефридиальных канальцах. Примечательно, что образование этих кист и результирующие осморегуляторные дефекты зависят от пролиферации. Наконец, авторы показывают, что нокдауны генов, необходимых для правильного биения ресничек (и, таким образом, тока жидкости в протоках), также вызывают кисты в экскреторной системе.
eLife стремится публиковать «авторитетные» статьи, и я не могу придумать лучшего слова для описания поистине впечатляющей работы, представленной здесь авторами. Они убедительно показывают, что осморегуляторная система планарий во многих отношениях аналогична таким системам у позвоночных, обеспечивая модель беспозвоночных, которая может помочь нам понять как эволюцию осморегуляторных систем, так и их патологии. Эта красивая статья устанавливает стандарт того, как такая работа должна проводиться в этом организме, и поможет направлять всю будущую работу над его выделительной системой.
Чтобы усилить воздействие этой статьи, у меня есть лишь несколько незначительных предложений/комментариев, которые авторы, возможно, пожелают рассмотреть перед публикацией:
1) Данные, представленные на рисунке 2, настолько поразительны, что требуют двух отдельных рисунков: один подчеркивает пространственные области, определенные выражением slc (A-H), а другой рисунок подчеркивает структурно-функциональное сохранение с грызуном (J-L). В его нынешнем виде, с уменьшенными панелями для размещения всех данных, эти важные выводы недооценены.
2) Ультраструктурный анализ пламенной клетки NPHS1 (RNAi) показывает потерю щелевых диафрагм, поэтому наблюдаемая потеря ультрафильтрации (теперь декстраны 500 кДа могут поступать в систему) кажется нелогичной. Читателям будет полезно, если авторы прокомментируют, как потеря щелевых диафрагм может привести к потере селективности по размеру.
Рецензент №2 (Фридхельм Хильдебрандт) :
В этой рукописи описывается протонефридиальная выделительная система Schmidtea mediterranea (планарии). В первой части рукописи авторы подробно охарактеризовали экскреторную систему планарий, идентифицируя гены переносчиков растворенных веществ (slc) и картируя их экспрессию, и выявили, что протонефридии планарии структурно и функционально сходны с нефроном позвоночных. Во второй части рукописи авторы сбивали планарии, ортологи человеческих генов, которые в случае мутации вызывают заболевания почек, включая нефротический синдром и нефронофтиз. Авторы показали, сбив планарий NPHS1 и NEPh4 , что клетки пламени планарии являются функциональными гомологами подоцитов позвоночных.Нокдаун ортологов нефроцистина планарии ( NPHP5 , 6 и 8 ) приводил к развитию цистоподобных структур в проксимальных сегментах канальцев. Кроме того, авторы обнаружили, что образование кисты у планарии зависит от избыточной пролиферации протонефридиальных клеток-предшественников и потери функции ресничек как генератора/датчика потока жидкости. Они также были предложены в качестве механизмов заболевания кистозной болезнью почек человека.
В первой части рукописи авторы подробно охарактеризовали экскреторную систему планарий, идентифицируя гены переносчиков растворенных веществ (slc) и картируя их экспрессию, и выявили, что протонефридии планарии структурно и функционально сходны с нефроном позвоночных. Во второй части рукописи авторы сбивали планарии, ортологи человеческих генов, которые в случае мутации вызывают заболевания почек, включая нефротический синдром и нефронофтиз. Авторы показали, сбив планарий NPHS1 и NEPh4 , что клетки пламени планарии являются функциональными гомологами подоцитов позвоночных.Нокдаун ортологов нефроцистина планарии ( NPHP5 , 6 и 8 ) приводил к развитию цистоподобных структур в проксимальных сегментах канальцев. Кроме того, авторы обнаружили, что образование кисты у планарии зависит от избыточной пролиферации протонефридиальных клеток-предшественников и потери функции ресничек как генератора/датчика потока жидкости. Они также были предложены в качестве механизмов заболевания кистозной болезнью почек человека. Основываясь на этих выводах, авторы пришли к выводу, что протонефридии планарии не только имеют структурную и функциональную гомологию, но также имеют общие патологии с человеческим нефроном.В заключение авторы предлагают планарии протонефридум в качестве модельной системы для изучения болезней почек человека.
Основываясь на этих выводах, авторы пришли к выводу, что протонефридии планарии не только имеют структурную и функциональную гомологию, но также имеют общие патологии с человеческим нефроном.В заключение авторы предлагают планарии протонефридум в качестве модельной системы для изучения болезней почек человека.
Работа интересная и данные в целом четкие и качественные. Объем работы по характеристике протонефридиальной выделительной системы планарий огромен и обширен, и он убедителен и окажет влияние на почечное сообщество. Перед публикацией необходимо решить следующие вопросы.
1) Авторы показали, что образование кист зависит от повышенной пролиферации предшественников протонефридиев при нокдауне NPHP8 .Проверяли ли авторы повышенную пролиферацию планарий при нокдауне NPHP5 , NPHP6 , IFT88 , DNAHβ-1 или LRRC6 ?
2) Авторы утверждают, что поток жидкости, который может генерироваться ресничками, важен для функции канальцев, основанной на нокдауне генов подвижных ресничек.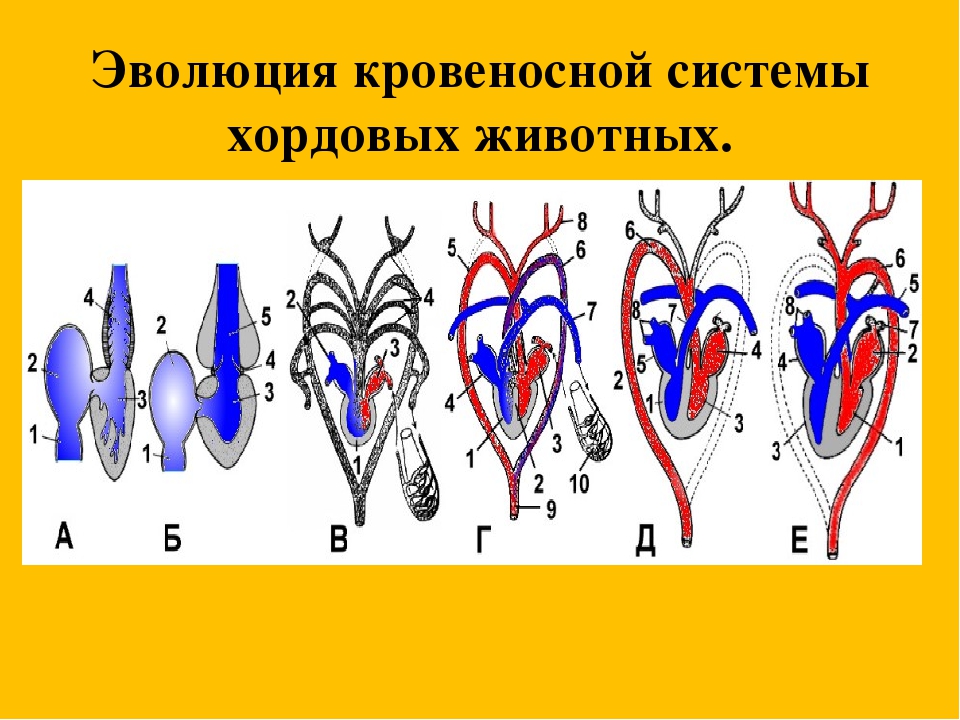 Однако в текущих данных неясно, существует ли поток, управляемый ресничками, в экскреторной системе планарий. Другой возможный сценарий заключается в том, что подвижные реснички в протонефридиях могут играть важную роль в очистке отходов подобно «мукоцилиарному клиренсу» в дыхательной системе.Поэтому в этом обзоре авторам рекомендуется смягчить «поток жидкости, управляемый ресничками» в разделе «Результаты и обсуждение».
Однако в текущих данных неясно, существует ли поток, управляемый ресничками, в экскреторной системе планарий. Другой возможный сценарий заключается в том, что подвижные реснички в протонефридиях могут играть важную роль в очистке отходов подобно «мукоцилиарному клиренсу» в дыхательной системе.Поэтому в этом обзоре авторам рекомендуется смягчить «поток жидкости, управляемый ресничками» в разделе «Результаты и обсуждение».
3) По-видимому, нокдаун либо генов NPNP, либо генов PCD у планарий приводил к протонефридиальным кистам, т. е. к одним и тем же патологиям. Однако у людей NPHP и PCD — совершенно разные сущности и почти взаимоисключающие. В большинстве случаев гены NPHP не влияют на подвижные реснички, а гены PCD не влияют на неподвижные реснички. В связи с этим не исключено, что механизм образования кист у планарий отличается от такового у человека.Кроме того, при NPHP человека кисты возникают в кортикомедуллярных соединениях и в большинстве случаев развиваются из дистальных извитых канальцев. Но протонефральные кисты планарий формируются в проксимальных канальцах. Пожалуйста, обсудите эти вопросы.
Но протонефральные кисты планарий формируются в проксимальных канальцах. Пожалуйста, обсудите эти вопросы.
Ультраструктурные паттерны выводных протоков базальных групп неодерматинов (Platyhelminthes) и новые протонефридиальные признаки базальных цестод | Паразиты и переносчики
Polyopisthocotylea
Chimaericola leptogaster (Chimaericolidae)
Недалеко от кончика ресничек терминальной клетки узкая эпителиальная выстилка проксимальной клетки протока гладкая; в эпителиальной цитоплазме присутствуют мелкие везикулы с переменной электронной плотностью (рис.1а). Присутствуют длинные септированные соединения, соединяющие соседние клетки (рис. 1а). На некотором расстоянии от терминальной клетки просветные поверхности выводных собирательных трубочек несут ламеллы (рис. 1б–е), а пучки ресничек, образующие латеральные пучки ресничек, заходят в просвет протока, где они обычны на всем его протяжении, хотя закономерности в расположении этих пучков нет (рис. 1б, г). Реснички в каждом латеральном пучке ресничек немногочисленны, и на срезах ПЭМ толщиной 50–90 нм наблюдались только 2 реснички (рис.1б, г). Каждая ресничка имеет цилиндрическое базальное тело с коротким прямым волокнистым корешком, погруженным в эпителиальную выстилку выводных протоков (рис. 1б, г). Каждая экскреторная эпителиальная клетка содержит крупное базально расположенное ядро, перинуклеарную цитоплазму со свободными рибосомами, митохондриями и мелкими электронно-прозрачными везикулами (рис. 1г). Небольшое количество инвагинаций базальной плазматической мембраны собирательных трубочек распространяется в эпителиальную цитоплазму (рис. 1д, е). Тонкий слой внеклеточного базального матрикса находится под базальной плазматической мембраной (рис.1д, е). В эпителиальной выстилке выводных протоков отсутствуют полудесмосомы, соединяющие ее с нижележащим внеклеточным матриксом. Соседние клетки соединены септированными соединениями в апикально расположенных участках (рис. 1f). Эпителиальная выстилка основных выводных протоков поддерживается слоем толстого, плотно упакованного внеклеточного матрикса и мышечных волокон (рис.
1б, г). Реснички в каждом латеральном пучке ресничек немногочисленны, и на срезах ПЭМ толщиной 50–90 нм наблюдались только 2 реснички (рис.1б, г). Каждая ресничка имеет цилиндрическое базальное тело с коротким прямым волокнистым корешком, погруженным в эпителиальную выстилку выводных протоков (рис. 1б, г). Каждая экскреторная эпителиальная клетка содержит крупное базально расположенное ядро, перинуклеарную цитоплазму со свободными рибосомами, митохондриями и мелкими электронно-прозрачными везикулами (рис. 1г). Небольшое количество инвагинаций базальной плазматической мембраны собирательных трубочек распространяется в эпителиальную цитоплазму (рис. 1д, е). Тонкий слой внеклеточного базального матрикса находится под базальной плазматической мембраной (рис.1д, е). В эпителиальной выстилке выводных протоков отсутствуют полудесмосомы, соединяющие ее с нижележащим внеклеточным матриксом. Соседние клетки соединены септированными соединениями в апикально расположенных участках (рис. 1f). Эпителиальная выстилка основных выводных протоков поддерживается слоем толстого, плотно упакованного внеклеточного матрикса и мышечных волокон (рис. 1в). Просветные поверхности главных протоков несут пластинки и латеральные пучки ресничек; В просвете протока видны мембраносвязанные включения различной формы и состава (рис.1с, вставка).
1в). Просветные поверхности главных протоков несут пластинки и латеральные пучки ресничек; В просвете протока видны мембраносвязанные включения различной формы и состава (рис.1с, вставка).
Ультраструктура выводных протоков Chimaericola leptogaster ( a – f ) и Calicotyle affinis ( г 5) a Небольшой выводной проток на небольшом расстоянии от терминальной клетки. b Эпителиальная выстилка собирательных трубочек; обратите внимание на поверхностные пластинки и реснички бокового пламени. c Эпителиальная стенка главного выводного протока с включениями в его просвете; обратите внимание на толстый слой внеклеточного матрикса, поддерживающий эпителиальную цитоплазму.Вставка: просветные включения ( масштабная линейка : 1 мкм). d Собирающая трубка; обратите внимание на базально расположенное ядро. e , f Эпителиальная стенка собирательных трубочек с инвагинацией базальной мембраны и соединением перегородки.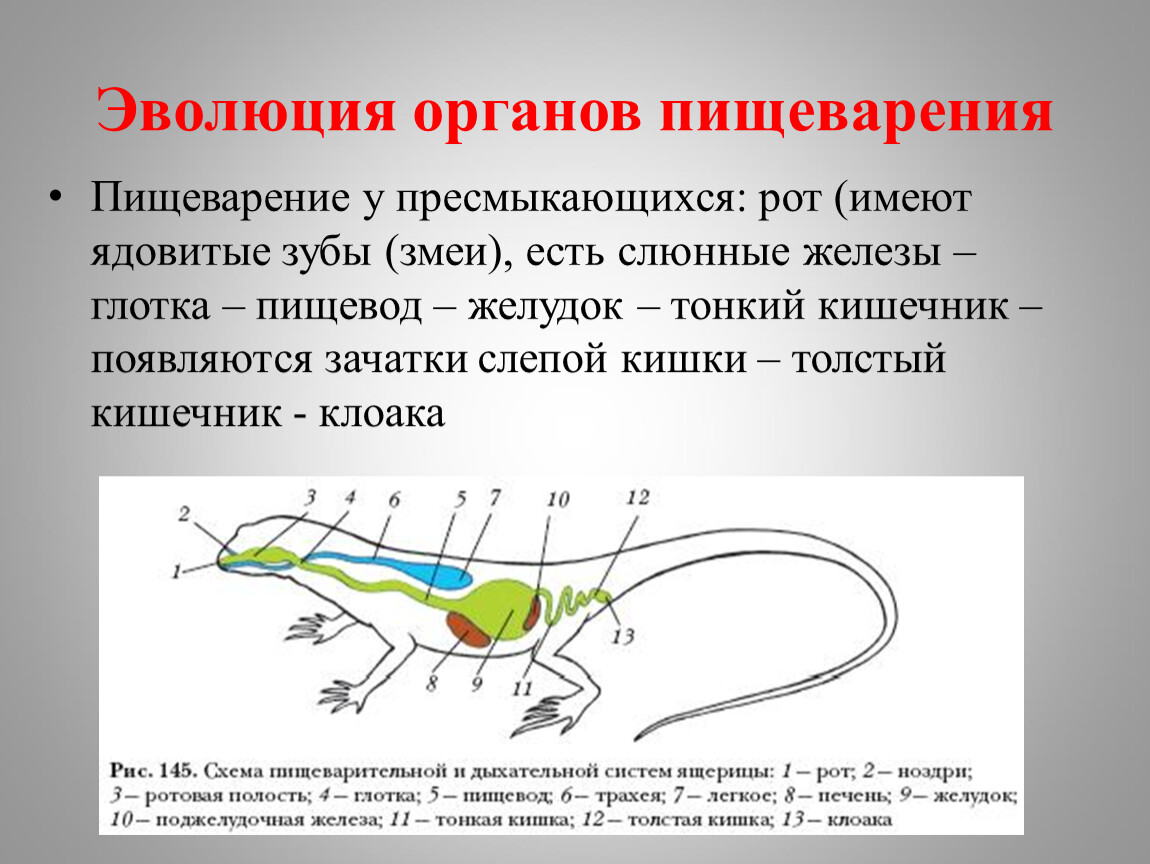 г Эпителиальная цитоплазма терминальной части главного выводного протока с широкими инвагинациями базальной мембраны, заполненными внеклеточным матриксом; обратите внимание на толстый слой внеклеточного матрикса и мышечные волокна вокруг него. h Базально расположенное ядро собирательной трубочки; обратите внимание на инвагинации плазматической мембраны в перинуклеарную цитоплазму. j Эпителиальная стенка главного выводного протока; обратите внимание на поверхностные пластинки, реснички бокового пламени, толстый слой внеклеточного матрикса. Сокращения : bb, базальное тело реснички; в, ресничка; ca, аксонема реснички; dl, просвет протока; ec, эпителиальная цитоплазма; em, внеклеточный матрикс; fr — волокнистый корешок; i — инвагинации базальной мембраны; лин — просветные включения; лм, ламели; м, митохондрия; mf, мышечные волокна; п, ядро; pc, перинуклеарная цитоплазма; sj, перегородочное соединение; ss — гладкая просветная поверхность; v, везикулы
г Эпителиальная цитоплазма терминальной части главного выводного протока с широкими инвагинациями базальной мембраны, заполненными внеклеточным матриксом; обратите внимание на толстый слой внеклеточного матрикса и мышечные волокна вокруг него. h Базально расположенное ядро собирательной трубочки; обратите внимание на инвагинации плазматической мембраны в перинуклеарную цитоплазму. j Эпителиальная стенка главного выводного протока; обратите внимание на поверхностные пластинки, реснички бокового пламени, толстый слой внеклеточного матрикса. Сокращения : bb, базальное тело реснички; в, ресничка; ca, аксонема реснички; dl, просвет протока; ec, эпителиальная цитоплазма; em, внеклеточный матрикс; fr — волокнистый корешок; i — инвагинации базальной мембраны; лин — просветные включения; лм, ламели; м, митохондрия; mf, мышечные волокна; п, ядро; pc, перинуклеарная цитоплазма; sj, перегородочное соединение; ss — гладкая просветная поверхность; v, везикулы
Monopisthocotylea
Calicotyle affinis (Монокотилиды)
То же, что и C. leptogaster просветная поверхность узкого выводного протока гладкая, дистальнее кончика каждого пучка ресничек терминальной клетки. Далее от терминального пламени просветная поверхность собирательных трубочек образует многочисленные тонкие пластинки (рис. 1и). Характерной особенностью как эпителиальной выстилки, так и перинуклеарной цитоплазмы базально расположенного ядра каждой экскреторной клетки является наличие в их цитоплазме многочисленных, глубоких, широких, ветвящихся инвагинаций базальной плазматической мембраны, поддерживаемых внеклеточным матриксом (рис.1г–и). Между этими широкими инвагинациями эпителиальный цитоплазматический матрикс относительно прозрачен, с локальными концентрациями свободных рибосом, митохондрий и электронно-прозрачных везикул разного размера (рис. 1ж, и, к). Перегородочные соединения встречаются в стенках всех выводных собирательных трубочек (рис. 1ж, к). По всей длине различных собирательных трубочек, включая основные протоки, часто можно увидеть одиночные реснички или, реже, три реснички видны на срезах ПЭМ толщиной 50–90 нм (рис.
leptogaster просветная поверхность узкого выводного протока гладкая, дистальнее кончика каждого пучка ресничек терминальной клетки. Далее от терминального пламени просветная поверхность собирательных трубочек образует многочисленные тонкие пластинки (рис. 1и). Характерной особенностью как эпителиальной выстилки, так и перинуклеарной цитоплазмы базально расположенного ядра каждой экскреторной клетки является наличие в их цитоплазме многочисленных, глубоких, широких, ветвящихся инвагинаций базальной плазматической мембраны, поддерживаемых внеклеточным матриксом (рис.1г–и). Между этими широкими инвагинациями эпителиальный цитоплазматический матрикс относительно прозрачен, с локальными концентрациями свободных рибосом, митохондрий и электронно-прозрачных везикул разного размера (рис. 1ж, и, к). Перегородочные соединения встречаются в стенках всех выводных собирательных трубочек (рис. 1ж, к). По всей длине различных собирательных трубочек, включая основные протоки, часто можно увидеть одиночные реснички или, реже, три реснички видны на срезах ПЭМ толщиной 50–90 нм (рис. 1и, к). Каждая ресничка имеет отчетливое базальное тело с коротким прямым волокнистым корешком (рис. 1j). Концевые отделы главных выводных протоков имеют хорошо развитые нижележащие мышечные слои (рис. 1ж). В просвете собирательных и главных протоков наблюдаются мембраносвязанные включения (рис. 1ж, и, к).
1и, к). Каждая ресничка имеет отчетливое базальное тело с коротким прямым волокнистым корешком (рис. 1j). Концевые отделы главных выводных протоков имеют хорошо развитые нижележащие мышечные слои (рис. 1ж). В просвете собирательных и главных протоков наблюдаются мембраносвязанные включения (рис. 1ж, и, к).
Трематоды: Aspidogastrea
Aspidogaster limacoides (Aspidogastridae)
Эпителиальная выстилка клеток первого канала имеет гладкую люминальную поверхность и перегородчатые соединения, простирающиеся между его базальной и люминальной мембранами (рис.2а). Цитоплазма эпителиальных клеток однородно электронно-плотна и содержит большое количество свободных рибосом (рис. 2а). Люминальная поверхность собирательных трубочек приподнята в виде длинных тонких пластинок, а реснички боковых язычков отходят от этой поверхности и проходят в просвет протока (рис. 2б, г). На продольных срезах толщиной 50–90 нм количество ресничек колеблется от 5 до 7 (рис. 2б, г). Каждая цилиарная аксонема возникает из базального тельца и прямых корешковых волокон (рис. 2b).В эпителиальной цитоплазме выводных протоков отмечаются многочисленные свободные рибосомы и электронно-плотные гранулы разного размера (рис. 2д). Перегородчатые соединения между соседними клетками присутствуют во всех выводных протоках и могут образовывать длинную пограничную зону (рис. 2в). Эпителий протоков лежит на тонком внеклеточном матриксе с редкими круговыми мышечными волокнами под ним (рис. 2б, е). Ядра в эпителиальной стенке собирательных трубочек расположены близко к базальной мембране (рис. 2г), в отличие от ядер в основных собирательных трубочках, где ядра занимают более апикальное положение (рис.2е). Просветная поверхность главных выводных протоков расширена пластинками, но боковых пламен не наблюдалось (рис. 2е).
2б, г). Каждая цилиарная аксонема возникает из базального тельца и прямых корешковых волокон (рис. 2b).В эпителиальной цитоплазме выводных протоков отмечаются многочисленные свободные рибосомы и электронно-плотные гранулы разного размера (рис. 2д). Перегородчатые соединения между соседними клетками присутствуют во всех выводных протоках и могут образовывать длинную пограничную зону (рис. 2в). Эпителий протоков лежит на тонком внеклеточном матриксе с редкими круговыми мышечными волокнами под ним (рис. 2б, е). Ядра в эпителиальной стенке собирательных трубочек расположены близко к базальной мембране (рис. 2г), в отличие от ядер в основных собирательных трубочках, где ядра занимают более апикальное положение (рис.2е). Просветная поверхность главных выводных протоков расширена пластинками, но боковых пламен не наблюдалось (рис. 2е).
Ультраструктура экскреторных воздуховодов аспидогастеров лимакоидов ( A — F ) и Multicalyx Elegans ( G — K ) A Эпителиальная стена из соседнего проксимального воздуховода клетка; обратите внимание на гладкую просветную поверхность и септированные соединения.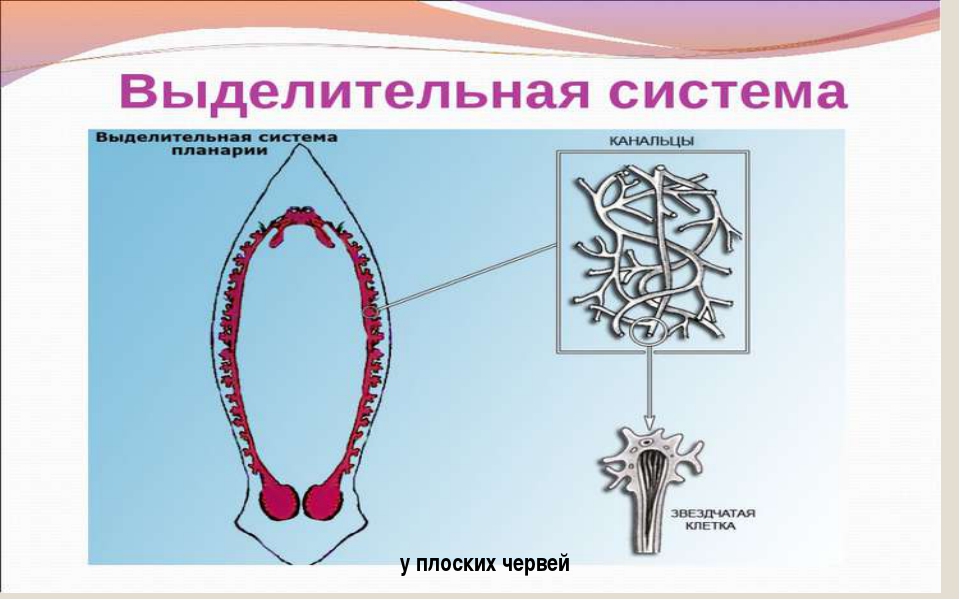 b Эпителиальная выстилка собирательных трубочек с боковым цилиарным пламенем. c Перегородочное соединение в эпителиальной цитоплазме. d Базально расположенное ядро эпителиальной клетки; обратите внимание на ламели и боковое пламя на просветной поверхности. e Электронно-плотные гранулы в эпителиальной цитоплазме собирательных трубочек. f Апикальное положение ядра главного собирательного канальца. г Пластинки и боковое пламя на просветной поверхности. h Длинное базальное тело и слабо выраженные корешковые волокна латеральных пламенных ресничек. i, k Эпителиальная выстилка главного выводного протока; обратите внимание на ядро, миелиноподобные тельца, перегородчатое соединение и глубокие базальные инвагинации. j Собирательный выводной проток с базальным ядром и миелиноподобными тельцами в перинуклеарной цитоплазме. Сокращения : bb, базальное тело реснички; в, ресничка; ca, аксонема реснички; dg, плотные гранулы; ec, эпителиальная цитоплазма; em, внеклеточный матрикс; fr — волокнистый корешок; ft, пламенный пучок; i — инвагинации базальной мембраны; лм, ламели; mb — миелиноподобные тельца; mf, мышечные волокна; п, ядро; sj, перегородочное соединение; ss — гладкая просветная поверхность; v, везикулы
b Эпителиальная выстилка собирательных трубочек с боковым цилиарным пламенем. c Перегородочное соединение в эпителиальной цитоплазме. d Базально расположенное ядро эпителиальной клетки; обратите внимание на ламели и боковое пламя на просветной поверхности. e Электронно-плотные гранулы в эпителиальной цитоплазме собирательных трубочек. f Апикальное положение ядра главного собирательного канальца. г Пластинки и боковое пламя на просветной поверхности. h Длинное базальное тело и слабо выраженные корешковые волокна латеральных пламенных ресничек. i, k Эпителиальная выстилка главного выводного протока; обратите внимание на ядро, миелиноподобные тельца, перегородчатое соединение и глубокие базальные инвагинации. j Собирательный выводной проток с базальным ядром и миелиноподобными тельцами в перинуклеарной цитоплазме. Сокращения : bb, базальное тело реснички; в, ресничка; ca, аксонема реснички; dg, плотные гранулы; ec, эпителиальная цитоплазма; em, внеклеточный матрикс; fr — волокнистый корешок; ft, пламенный пучок; i — инвагинации базальной мембраны; лм, ламели; mb — миелиноподобные тельца; mf, мышечные волокна; п, ядро; sj, перегородочное соединение; ss — гладкая просветная поверхность; v, везикулы
Multicalyx elegans (Multicalycidae)
То же, что и А. limacoides люминальная поверхность эпителиальных клеток, образующих стенку выводных собирательных трубочек M. elegans , отличается наличием пластинок и боковых язычков (рис. 2ж). Ядра каждой эпителиальной клетки как собирательных, так и главных выводных протоков располагаются базально (рис. 2ж, и). Как перинуклеарная, так и общая клеточная цитоплазма содержат, кроме свободных рибосом, мелкие электронно-прозрачные пузырьки и крупные тельца с миелиноподобным электронно-плотным содержимым (рис.2ж, и, к). В каждом продольном разрезе по 4–5 ресничек; они характеризуются длинным базальным телом и слабо выраженными волокнами корешка (рис. 2з). В главных выводных протоках отсутствуют боковые язычки (рис. 2и, л). Септатные соединения проходят вдоль эпителиальной стенки всех выводных протоков, а базальные клеточные мембраны этих протоков образуют глубокие инвагинации в эпителиальную стенку (рис. 2ж, л). Эпителиальную стенку всех выводных протоков окружает тонкий слой внеклеточного матрикса (рис.
limacoides люминальная поверхность эпителиальных клеток, образующих стенку выводных собирательных трубочек M. elegans , отличается наличием пластинок и боковых язычков (рис. 2ж). Ядра каждой эпителиальной клетки как собирательных, так и главных выводных протоков располагаются базально (рис. 2ж, и). Как перинуклеарная, так и общая клеточная цитоплазма содержат, кроме свободных рибосом, мелкие электронно-прозрачные пузырьки и крупные тельца с миелиноподобным электронно-плотным содержимым (рис.2ж, и, к). В каждом продольном разрезе по 4–5 ресничек; они характеризуются длинным базальным телом и слабо выраженными волокнами корешка (рис. 2з). В главных выводных протоках отсутствуют боковые язычки (рис. 2и, л). Септатные соединения проходят вдоль эпителиальной стенки всех выводных протоков, а базальные клеточные мембраны этих протоков образуют глубокие инвагинации в эпителиальную стенку (рис. 2ж, л). Эпителиальную стенку всех выводных протоков окружает тонкий слой внеклеточного матрикса (рис. 2ж, л).
2ж, л).
Честода
Гирокотильная урна (Gyrocotylidea)
Серия продольных срезов терминального протонефридиального пламени G. urna показала, что между внутренними ребрами (отходящими от терминальной клетки) и наружными ребрами (отходящими от клетки проксимального канала) прилегающие мембраны выстланы электронно-плотным материалом, который образует контактные площадки, которые можно идентифицировать как zonulae stickers (рис.3а, вставка). Кроме того, между соседними терминальными и проксимальными клетками терминального органа на срезах на уровне дистального конца пламенного пучка видны септированные соединения (рис. 3б, в).
Рис. 3 Ультраструктура протонефридиального комплекса и выводных протоков Gyrocotyle urna . a Продольный разрез через пламенный пучок; обратите внимание на zonulae stickers между внутренними и внешними ребрами (вставка: масштабная линейка : 0. 5 мкм). b Косой срез дистального конца пучка пламени; обратите внимание на септированные соединения между соседними терминальными и проксимальными клетками. c Концевой пучок пламени с перегородчатым соединением на дистальном конце. d Прилежащая проксимальная ячейка протока. e , f Большой выводной проток; отмечают многочисленные поверхностные микроворсинки, цитоплазматические отростки и септированные соединения. г Эпителиальная стенка малого выводного протока; обратите внимание на короткие поверхностные микроворсинки и перегородчатое соединение. h Люминальная поверхность с микроворсинками; обратите внимание на тонкую электронно-плотную полосу в его центральной области. и Эпителиальная стенка большого выводного протока; обратите внимание на базальный внеклеточный матрикс, поддерживающий базальную мембрану. j , l Эпителиальная стенка самого большого выводного протока с большим латеральным пламенем, двумя отчетливыми зонами эпителиальной цитоплазмы, септированным соединением и толстым слоем внеклеточного матрикса.
5 мкм). b Косой срез дистального конца пучка пламени; обратите внимание на септированные соединения между соседними терминальными и проксимальными клетками. c Концевой пучок пламени с перегородчатым соединением на дистальном конце. d Прилежащая проксимальная ячейка протока. e , f Большой выводной проток; отмечают многочисленные поверхностные микроворсинки, цитоплазматические отростки и септированные соединения. г Эпителиальная стенка малого выводного протока; обратите внимание на короткие поверхностные микроворсинки и перегородчатое соединение. h Люминальная поверхность с микроворсинками; обратите внимание на тонкую электронно-плотную полосу в его центральной области. и Эпителиальная стенка большого выводного протока; обратите внимание на базальный внеклеточный матрикс, поддерживающий базальную мембрану. j , l Эпителиальная стенка самого большого выводного протока с большим латеральным пламенем, двумя отчетливыми зонами эпителиальной цитоплазмы, септированным соединением и толстым слоем внеклеточного матрикса. k Вставленные исчерченные конические корешки ресничек бокового пламени. Сокращения : b, медиальная полоса микроворсинок; bb — базальное тело реснички; cp, цитоплазматический процесс; dl, просвет протока; ec, эпителиальная цитоплазма; em, внеклеточный матрикс; э., внешнее ребро; fr — волокнистый корешок; ft, пламенный пучок; i — инвагинации базальной мембраны; ir, внутреннее ребро; lf, боковое пламя; mf, мышечные волокна; мв, микроворсинки; п, ядро; sj, перегородочное соединение; sr, исчерченный корешок; v, везикулы; za, zonula Adidas
k Вставленные исчерченные конические корешки ресничек бокового пламени. Сокращения : b, медиальная полоса микроворсинок; bb — базальное тело реснички; cp, цитоплазматический процесс; dl, просвет протока; ec, эпителиальная цитоплазма; em, внеклеточный матрикс; э., внешнее ребро; fr — волокнистый корешок; ft, пламенный пучок; i — инвагинации базальной мембраны; ir, внутреннее ребро; lf, боковое пламя; mf, мышечные волокна; мв, микроворсинки; п, ядро; sj, перегородочное соединение; sr, исчерченный корешок; v, везикулы; za, zonula Adidas
Тело клетки проксимального протока расположено под базальной мембраной и имеет большое овоидное ядро с плотными участками периферического и центрального хроматина (рис.3г). Как узкая область перинуклеарной цитоплазмы, так и эпителий протоков имеют гомогенное электронно-плотное содержимое со свободными рибосомами и небольшими электронно-прозрачными везикулами (рис. 3б, г). Эпителиальная стенка мелких выводных протоков характеризуется редкими короткими микроворсинками (длиной ~ 0,2 мкм) на ее просветной поверхности и наличием перегородок, пересекающих эпителиальную выстилку (рис. 3g). Тонкий слой базального внеклеточного матрикса, но под базальной мембраной эпителиальных клеток, образующих эти протоки, отсутствуют мышечные волокна (рис.3г).
3g). Тонкий слой базального внеклеточного матрикса, но под базальной мембраной эпителиальных клеток, образующих эти протоки, отсутствуют мышечные волокна (рис.3г).
Поверхность просвета крупных выводных протоков увеличена за счет многочисленных микроворсинок длиной ~ 1 мкм и с тонкой медиальной электронно-плотной полосой (рис. 3д, е, з, и). Эпителиальные ядра располагаются на некотором расстоянии от эпителиальной выстилки и соединяются с этой выстилкой узкими цитоплазматическими отростками; септированные соединения проникают в цитоплазму эпителия (рис. 3д, е). Плотная эпителиальная цитоплазма содержит многочисленные свободные рибосомы, а мелкие везикулы сосредоточены в базальной области эпителия стенки протока (рис.3и). Базальная плазматическая мембрана эпителиальных клеток протоков обычно поддерживается тонким, плотно упакованным базальным матриксом, под которым находится более толстый слой рыхлого внеклеточного матрикса; мышечные волокна рассеяны вокруг этих протоков неравномерно (рис.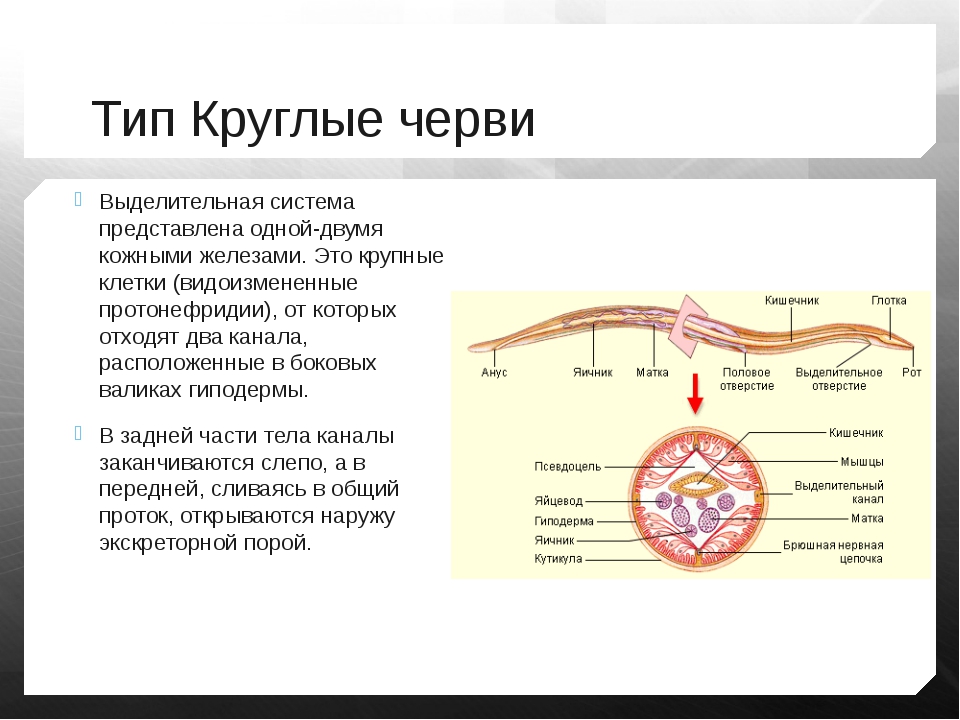 3д, и).
3д, и).
Помимо поверхностных микроворсинок и перегородчатых соединений, в цитоплазме эпителия крупных выводных протоков имеются крупные латеральные пучки ресничек, выступающие в просвет протока (рис. 3к). Такие пучки ресничек могут включать до 50 ресничек.Каждая ресничка имеет длину ~ 12 мкм и вставлена в эпителий протока, где есть длинное базальное тело и хорошо развитые, исчерченные конические изогнутые корешки (рис. 3k). Эпителиальная цитоплазма этих протоков содержит две отчетливые зоны, различающиеся плотностью их цитоплазмы (рис. 3к, м). Плотная цитоплазматическая зона располагается непосредственно под поверхностной плазматической мембраной; она заполнена свободными рибосомами и тонким слоем электронно-плотных телец. В этой зоне видны мелкие везикулы (рис.3к-л). Вторая зона представляет собой бледную цитоплазматическую область, заполненную электронно-прозрачными везикулами разного размера и формы (рис. 3к, м). Существует тонкий слой плотно упакованного базального матрикса, под которым находится широкий слой рыхлого внеклеточного матрикса, отделяющего стенку эпителиального протока от подлежащих мышц (рис. 3l).
3l).
Амфилина листовидная (Amphilinidea)
Наряду с типичным терминальным органом, т.е. сочетанием 2 клеток, терминальная клетка несет пучок ресничек и первую канальцевую клетку; другой необычный тип терминальных клеток присутствует у взрослых A.foliacea (рис. 4а). На продольном срезе этой терминальной клетки в цитоплазму вставлены 6 пучков ресничек (длиной ~ 5 мкм) (рис. 4а). Эти пучки рассредоточены в разных направлениях внутри цитоплазмы клетки (рис. 4а). На диаметре каждого пучка имеется 3–4 реснички (рис. 4b–d). Каждая ресничка пучка прикреплена к цитоплазме терминальной клетки хорошо развитым базальным телом, которое в продольном разрезе имеет расширенные, удлиненные, электронно-плотные боковые края и короткие отростки прямых корешковых волокон (рис.4г). Водослив (фильтрационный аппарат) каждого пучка состоит из одного ряда ребер, соединенных тонкой электронно-плотной оболочкой (рис. 4г). Ребра несут многочисленные длинные внутренние лептотрихи, заполняющие пространство между хохолком и водосливом (рис. 4в, г).
4в, г).
Ультраструктура специальной терминальной клетки и выводных протоков Amphilina foliacea . a Терминальная ячейка с несколькими пламенами разных направлений. b Заякоренная часть пламенных ресничек в цитоплазме терминальной клетки, обратите внимание на расширенные боковые края базальных телец. c Две лампы пламени в терминальной ячейке. d Пламенные луковицы с водосливом, состоящим из одного ряда плотных ребер, соединенных тонкой плотной оболочкой, и многочисленными лептотрихами, заполняющими пространство луковиц. e Ядро выводного протока. f Маленький выводной проток, обратите внимание на поверхностные микроворсинки. g , h Большие выводные протоки с большими базальными инвагинациями, заполненными внеклеточным матриксом. Сокращения : bb, базальное тело реснички; ca, аксонема реснички; ec, эпителиальная цитоплазма; em, внеклеточный матрикс; fr — волокнистый корешок; ft, пламенный пучок; гк, комплекс Гольджи; i — инвагинации базальной мембраны; л, лептотрих; м, митохондрия; мв, микроворсинки; п, ядро; р, ребро; rv, выпущенные везикулы; sp — поверхностные процессы; v, пузырьки
Все малые и большие выводные протоки этого вида не имеют перегородок. Поверхность просвета мелких протоков увеличена за счет коротких грибовидных микроворсинок длиной около 0,1–0,3 мкм (рис. 4f). Их эпителиальная цитоплазма содержит многочисленные свободные рибосомы и круглые электронно-прозрачные пузырьки, а под базальной плазматической мембраной находится тонкий слой внеклеточного матрикса (рис. 4f). На просветной поверхности крупных выводных протоков имеются поверхностные отростки различной величины и формы, на которых иногда можно увидеть короткие микроворсинки (рис. 4ж, з). В эпителиальной стенке и вокруг комплексов Гольджи присутствуют электронно-прозрачные везикулы разного размера (рис.4г, з). Эти везикулы располагаются в непосредственной близости от поверхности просвета, с которой они соединяются, что приводит к выбросу их содержимого в просвет протока (рис. 4ж, з). Базальная мембрана имеет крупные инвагинации, глубоко проникающие в эпителиальную стенку; такие инвагинации заполнены внеклеточным матриксом, окружающим стенку протока (рис. 4g). Во всех выводных протоках видны только крупные внутриэпителиальные ядра (рис.
Поверхность просвета мелких протоков увеличена за счет коротких грибовидных микроворсинок длиной около 0,1–0,3 мкм (рис. 4f). Их эпителиальная цитоплазма содержит многочисленные свободные рибосомы и круглые электронно-прозрачные пузырьки, а под базальной плазматической мембраной находится тонкий слой внеклеточного матрикса (рис. 4f). На просветной поверхности крупных выводных протоков имеются поверхностные отростки различной величины и формы, на которых иногда можно увидеть короткие микроворсинки (рис. 4ж, з). В эпителиальной стенке и вокруг комплексов Гольджи присутствуют электронно-прозрачные везикулы разного размера (рис.4г, з). Эти везикулы располагаются в непосредственной близости от поверхности просвета, с которой они соединяются, что приводит к выбросу их содержимого в просвет протока (рис. 4ж, з). Базальная мембрана имеет крупные инвагинации, глубоко проникающие в эпителиальную стенку; такие инвагинации заполнены внеклеточным матриксом, окружающим стенку протока (рис. 4g). Во всех выводных протоках видны только крупные внутриэпителиальные ядра (рис. 4e).
4e).
Экскреция морфина и биосинтетических предшественников с мочой у мышей
Abstract
Было твердо установлено, что люди выделяют небольшое, но постоянное количество изохинолинового алкалоида морфина с мочой.Неясно, имеет ли он диетическое или эндогенное происхождение. Нет никаких сомнений в том, что простой изохинолиновый алкалоид, тетрагидропапаверолин (THP), обнаружен в мозге человека и грызунов, а также в моче человека. Это предполагает потенциальную биогенетическую связь между обоими алкалоидами. Немеченый THP или [ 1,3,4-D 3 ]-THP вводили внутрибрюшинно мышам и анализировали мочу. Этот потенциальный предшественник активно метаболизируется (96%). Среди обнаруженных метаболитов был связанный с фенолом продукт салутаридин, известный предшественник морфина в растении опийного мака.Синтетический [7D]-салутаридинол, продукт биосинтетического восстановления салутаридина, вводимый внутрибрюшинно живым животным, приводил к образованию [7D]-тебаина, который выводился с мочой. N -CD 3 3 ] -thebaine также вводил и уступил [ N -CD 3 ] -морфин и конгенеры [ N -CD 3 ] -Codeine и [ N -CD 3 ]-орипавин в моче. Эти результаты впервые показывают, что живые животные обладают биосинтетической способностью превращать обычный компонент грызунов, ТНР, в морфин.Морфин и его предшественники обычно не обнаруживаются в тканях или органах, предположительно из-за нарушения метаболизма. Следовательно, может быть обнаружена только та часть изохинолиновых алкалоидов, которая выделяется с мочой в неметаболизированном виде. Анализ мочи с помощью масс-спектрометрии высокого разрешения оказался мощным методом отслеживания эндогенного морфина и его биосинтетических предшественников.
N -CD 3 3 ] -thebaine также вводил и уступил [ N -CD 3 ] -морфин и конгенеры [ N -CD 3 ] -Codeine и [ N -CD 3 ]-орипавин в моче. Эти результаты впервые показывают, что живые животные обладают биосинтетической способностью превращать обычный компонент грызунов, ТНР, в морфин.Морфин и его предшественники обычно не обнаруживаются в тканях или органах, предположительно из-за нарушения метаболизма. Следовательно, может быть обнаружена только та часть изохинолиновых алкалоидов, которая выделяется с мочой в неметаболизированном виде. Анализ мочи с помощью масс-спектрометрии высокого разрешения оказался мощным методом отслеживания эндогенного морфина и его биосинтетических предшественников.
Возникновение эндогенного морфина у млекопитающих вызывает споры на протяжении последних трех десятилетий. Гольдштейн (1–3) и Спектор (4–7) и их коллеги первыми предположили, что морфин встречается у млекопитающих и играет неизвестную роль. Другие группы утверждали, что морфин, обнаруженный у грызунов, имеет пищевое происхождение (8, 9). Четкие ответы относительно присутствия морфина у животных были затемнены неадекватными экспериментами и возможным лабораторным загрязнением морфином. Лишь недавно появилось несколько сообщений об использовании стерильных культур клеток человека и изолированных органов, которые дополнили совокупность доказательств того, что морфин действительно встречается в культурах клеток млекопитающих и человека (10–12). Для подтверждения этих результатов мы использовали тот факт, что морфин выделяется с мочой у человека (13–15) и крыс (7).Присутствие морфина в моче однозначно продемонстрировано с помощью масс-спектрометрии (15), но происхождение экскретируемого морфина до сих пор не выяснено. Если эти следовые количества морфина в моче образуются de novo (а не в результате поступления с пищей), у млекопитающих должен присутствовать биосинтетический аппарат, который катализирует этот многоэтапный путь.
Другие группы утверждали, что морфин, обнаруженный у грызунов, имеет пищевое происхождение (8, 9). Четкие ответы относительно присутствия морфина у животных были затемнены неадекватными экспериментами и возможным лабораторным загрязнением морфином. Лишь недавно появилось несколько сообщений об использовании стерильных культур клеток человека и изолированных органов, которые дополнили совокупность доказательств того, что морфин действительно встречается в культурах клеток млекопитающих и человека (10–12). Для подтверждения этих результатов мы использовали тот факт, что морфин выделяется с мочой у человека (13–15) и крыс (7).Присутствие морфина в моче однозначно продемонстрировано с помощью масс-спектрометрии (15), но происхождение экскретируемого морфина до сих пор не выяснено. Если эти следовые количества морфина в моче образуются de novo (а не в результате поступления с пищей), у млекопитающих должен присутствовать биосинтетический аппарат, который катализирует этот многоэтапный путь.
Целью данного исследования является демонстрация образования de novo бензилизохинолиновых алкалоидов, в основном морфинанового типа, у живых грызунов. Наша экспериментальная стратегия включает введение мышам отдаленных предшественников, меченных и немеченых стабильными изотопами, с последующим анализом мочи мыши с помощью масс-спектрометрии. В прошлом сообщалось о присутствии простого алкалоида тетрагидропапаверолина (THP) (синоним: норлауданозолин) в тканях мозга человека и грызунов, а также в моче (13, 16–22). Это твердо установленное явление приводило в прошлом к предположениям, что THP может быть предшественником эндогенного морфина. Однако экспериментов для проверки этой гипотезы не проводилось.Здесь мы исследуем образование морфина у млекопитающих, анализируя путь биосинтеза в трех точках: во-первых, простые замещенные метаболиты, образующиеся при внутрибрюшинной инъекции; ТДС; во-вторых, продукты сочетания фенола, образованные из ретикулина, 6- O -, 4 ‘ — O -, N -триметилированного тетрагидробензилизохинолина; и в-третьих, поиск соединений морфинана, образующихся после сочетания фенола.
Наша экспериментальная стратегия включает введение мышам отдаленных предшественников, меченных и немеченых стабильными изотопами, с последующим анализом мочи мыши с помощью масс-спектрометрии. В прошлом сообщалось о присутствии простого алкалоида тетрагидропапаверолина (THP) (синоним: норлауданозолин) в тканях мозга человека и грызунов, а также в моче (13, 16–22). Это твердо установленное явление приводило в прошлом к предположениям, что THP может быть предшественником эндогенного морфина. Однако экспериментов для проверки этой гипотезы не проводилось.Здесь мы исследуем образование морфина у млекопитающих, анализируя путь биосинтеза в трех точках: во-первых, простые замещенные метаболиты, образующиеся при внутрибрюшинной инъекции; ТДС; во-вторых, продукты сочетания фенола, образованные из ретикулина, 6- O -, 4 ‘ — O -, N -триметилированного тетрагидробензилизохинолина; и в-третьих, поиск соединений морфинана, образующихся после сочетания фенола.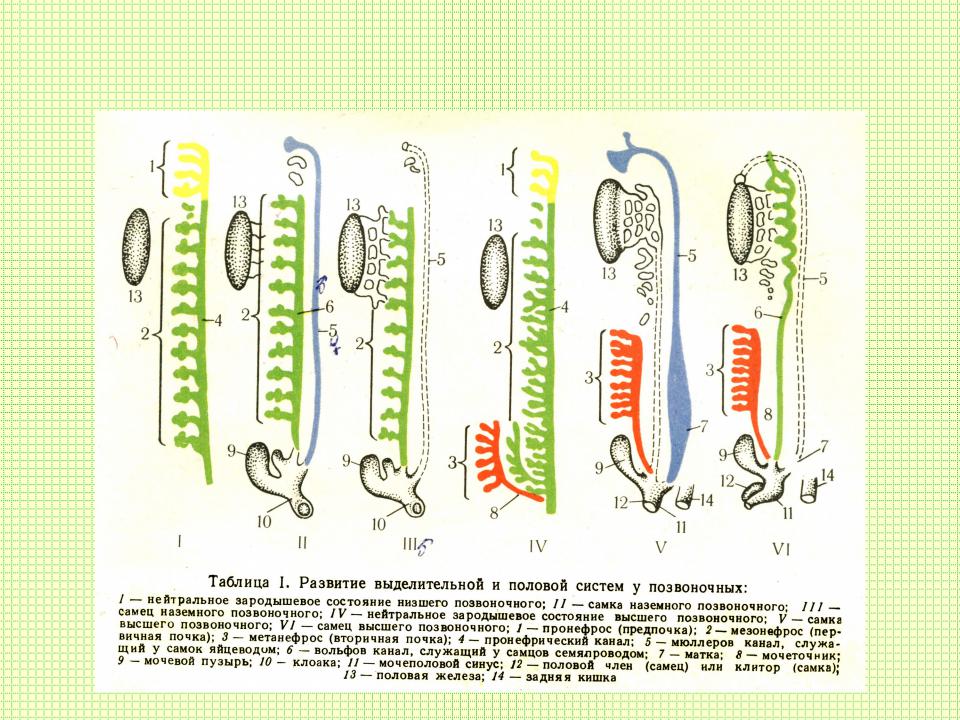 Как было постулировано Бартоном и Коэном (23), ключевым промежуточным продуктом в биосинтезе морфина является пара-орто фенол-сопряженный продукт ( R )-ретикулина.Недавно было показано (24), что этот ключевой этап катализируется зависимыми от цитохрома Р450 человека ферментами, что подтверждает гипотезу о том, что морфин может образовываться у млекопитающих. Затем морфин должен быть образован из пентациклического промежуточного соединения, такого как тебаин. Мы предполагаем, что интермедиаты биосинтеза будут выделяться с мочой подопытных животных. Эти интермедиаты должны быть стабильны в моче млекопитающих, исключены из дальнейшего метаболизма и должны выявлять интермедиаты биосинтеза морфина.
Как было постулировано Бартоном и Коэном (23), ключевым промежуточным продуктом в биосинтезе морфина является пара-орто фенол-сопряженный продукт ( R )-ретикулина.Недавно было показано (24), что этот ключевой этап катализируется зависимыми от цитохрома Р450 человека ферментами, что подтверждает гипотезу о том, что морфин может образовываться у млекопитающих. Затем морфин должен быть образован из пентациклического промежуточного соединения, такого как тебаин. Мы предполагаем, что интермедиаты биосинтеза будут выделяться с мочой подопытных животных. Эти интермедиаты должны быть стабильны в моче млекопитающих, исключены из дальнейшего метаболизма и должны выявлять интермедиаты биосинтеза морфина.
Здесь мы показываем, что THP является первым алкалоидным предшественником морфина у млекопитающих. Биосинтез морфина затем протекает через ( R )-ретикулин с образованием салутаридина, салутаридинола и тебаина, все из которых были обнаружены в моче мышей после инъекции соответствующих предшественников. Инъекция тебаина мышам давала кодеин, орипавин и морфин. Это указывает на наличие раздвоенного пути, обнаруженного ранее в биосинтезе морфина растениями (25). В совокупности эти результаты свидетельствуют о синтезе морфина de novo из THP у млекопитающих.
Инъекция тебаина мышам давала кодеин, орипавин и морфин. Это указывает на наличие раздвоенного пути, обнаруженного ранее в биосинтезе морфина растениями (25). В совокупности эти результаты свидетельствуют о синтезе морфина de novo из THP у млекопитающих.
Результаты
Превращение THP в салутаридин.
Было показано, что культуры клеток нейробластомы человека (SH-SY5Y) трансформируют L-дофа в простые алкалоиды тетрагидробензилизохинолина и морфинана (11). Это свойство культуры клеток нейробластомы не выражено у дифференцированной живой мыши. Инъекция (внутрибрюшинно) L-допа, помеченного как [ кольцо -, 2- 13 C 7 ] или [ кольцо — 13 C 6 ] с ингибитором ДОФА-деразидазы или без него не показали никакого включения в алкалоиды, продуцируемые мышью.Измерения экстрактов головного мозга, печени, почек [20, 40, 60, 90, 120, 180 и 240 мин после инъекции (в/б)] и мочи [24 ч после инъекции (в/б)] проводили с помощью жидкости высокого разрешения.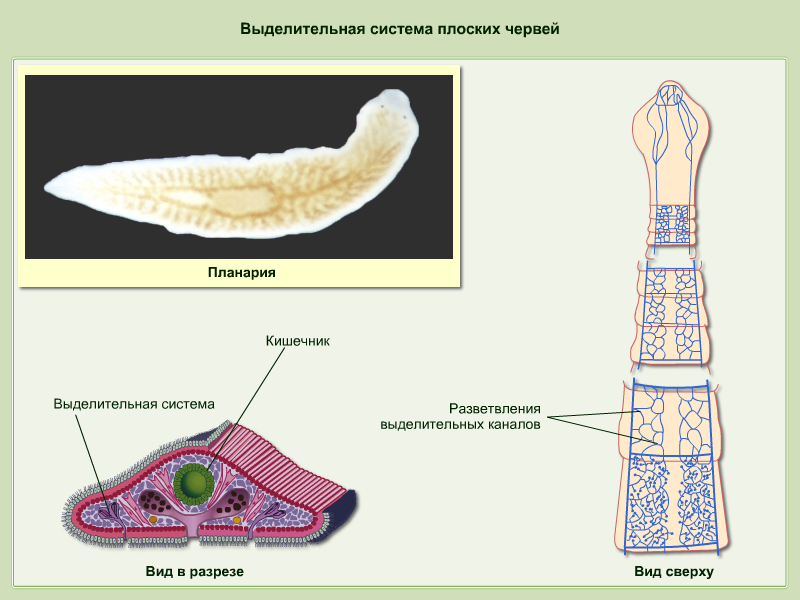 хромато-масс-спектрометрия (ВР-ЖХ-МС) с пределом обнаружения морфина 2 пмоль/г ткани. Ни алкалоидов, ни даже следовых количеств исходной меченой L-дофа обнаружено не было. Сделан вывод, что L-дофа быстро и полностью расщепляется живым животным до соединений, которые не обнаруживаются наиболее чувствительным рутинным прибором МС.
хромато-масс-спектрометрия (ВР-ЖХ-МС) с пределом обнаружения морфина 2 пмоль/г ткани. Ни алкалоидов, ни даже следовых количеств исходной меченой L-дофа обнаружено не было. Сделан вывод, что L-дофа быстро и полностью расщепляется живым животным до соединений, которые не обнаруживаются наиболее чувствительным рутинным прибором МС.
Наличие тетрагидроксилированного тетрагидробензилизохинолинового алкалоида ТНР в тканях головного мозга было убедительно описано (17–21). Региохимия THP с четырьмя фенольными гидроксильными группами предполагает первоначальную связь с морфиновыми алкалоидами. Действительно, эта потенциальная роль предшественника морфина уже предполагалась (13, 17, 21, 23, 26–28), но никогда не проверялась экспериментально. Эта привлекательная гипотеза была исследована, чтобы увидеть, трансформируется ли ТНР живыми мышами в связанный с фенолом предшественник морфина.
Инъекции (внутрибрюшинно) водного раствора 6,1 мкмоль ( R , S )-THP или [1,3,4-D 3 ]-THP одной мыши проводились в течение периода 4 д. Анализ HR-LC-MS показал, что было извлечено только 30% введенного (внутрибрюшинно) алкалоида ( R , S )-THP, из которых большая часть (96%) была идентифицирована как метаболизированный THP, тогда как второстепенная часть часть (4%) выводится в виде неизмененного THP. Введение ( R , S )-ТНР дало в общей сложности 21 отдельный метаболит, выведенный с мочой.Анализ HR-LC-MS мочи мышей позволил определить выделяемые категории алкалоидов: тетрагидробензилизохинолин, тетрагидропротоберберин, апорфин и морфинандиеноновые алкалоиды (рис. 1). Эти четыре типа алкалоидов были проанализированы количественно и качественно (таблица 1).
Анализ HR-LC-MS показал, что было извлечено только 30% введенного (внутрибрюшинно) алкалоида ( R , S )-THP, из которых большая часть (96%) была идентифицирована как метаболизированный THP, тогда как второстепенная часть часть (4%) выводится в виде неизмененного THP. Введение ( R , S )-ТНР дало в общей сложности 21 отдельный метаболит, выведенный с мочой.Анализ HR-LC-MS мочи мышей позволил определить выделяемые категории алкалоидов: тетрагидробензилизохинолин, тетрагидропротоберберин, апорфин и морфинандиеноновые алкалоиды (рис. 1). Эти четыре типа алкалоидов были проанализированы количественно и качественно (таблица 1).
Типы алкалоидов, которые были обнаружены в моче мышей, которым вводили (внутрибрюшинно) ( R , S )-THP.
Таблица 1.Метаболиты, обнаруженные с помощью ВР-ЖХ-МС в моче мышей, которым вводили инъекции (т.р.) с ( R , S )-THP
Особого внимания заслуживает фракция с молекулярной массой m / z 328 . Ключевой интермедиат в биосинтезе морфина, салутаридин, среди других алкалоидов, имеет такую молекулярную массу. Тщательный анализ смеси алкалоидов с помощью HR-LC-MS, содержащей интересующую молекулярную массу, показал присутствие салутаридина/синакутина [ пара-орто фенол-связанного продукта из ( R )- и ( S )- ретикулина соответственно 0.01% от общего извлеченных алкалоидов] с фрагментами ионами м / м 297 и м / м 9 / м 265 от м / Z 328 (рис. 2 A и B ) . Кроме того, [1,3,4-D 3 ]-салютаридин/синакутин с экспериментальной массой m / z 331,17298 и отклонением от теоретического значения -0,6 ppm был обнаружен в моче инъецированных мышей ( ip) с ( R , S )-[1,3,4-D 3 ]-THP (фиг.2 C и D ).
Ключевой интермедиат в биосинтезе морфина, салутаридин, среди других алкалоидов, имеет такую молекулярную массу. Тщательный анализ смеси алкалоидов с помощью HR-LC-MS, содержащей интересующую молекулярную массу, показал присутствие салутаридина/синакутина [ пара-орто фенол-связанного продукта из ( R )- и ( S )- ретикулина соответственно 0.01% от общего извлеченных алкалоидов] с фрагментами ионами м / м 297 и м / м 9 / м 265 от м / Z 328 (рис. 2 A и B ) . Кроме того, [1,3,4-D 3 ]-салютаридин/синакутин с экспериментальной массой m / z 331,17298 и отклонением от теоретического значения -0,6 ppm был обнаружен в моче инъецированных мышей ( ip) с ( R , S )-[1,3,4-D 3 ]-THP (фиг.2 C и D ).
салутаридина ( m / z 328.15431) и [1,3,4-D 3 ]-салутаридина ( m / 9 z 316,15431) при элюировании 7 15,4 мин. ( A ) HR-LC-MS/MS салутаридина/синакутина, обнаруженного в моче мышей, которым вводили (внутрибрюшинно) ( R , S )-THP. ( B ) HR-LC-MS/MS стандарта салутаридина. ( C ) HR-LC-MS [1,3,4-D 3 ]-салутаридин/синакутин, обнаруженный в моче мышей, которым инъецировали (т.р.) с ( R , S )-[1,3,4-D 3 ]-THP. ( D ) HR-LC-MS стандарта салутаридина.
( A ) HR-LC-MS/MS салутаридина/синакутина, обнаруженного в моче мышей, которым вводили (внутрибрюшинно) ( R , S )-THP. ( B ) HR-LC-MS/MS стандарта салутаридина. ( C ) HR-LC-MS [1,3,4-D 3 ]-салутаридин/синакутин, обнаруженный в моче мышей, которым инъецировали (т.р.) с ( R , S )-[1,3,4-D 3 ]-THP. ( D ) HR-LC-MS стандарта салутаридина.
Другие шесть продуктов, связанных с фенолом, из ( R , S )-ретикулина, (+)- и (-)-паллидина ( пара-пара-сочетание , 0,08%, время удерживания 11,5 мин), ( -)- и (+)-коритуберин (соединение орто-орто-, 0,01%, время удерживания 14,9 мин) и (-)- и (+)-изоболдин (соединение орто-пара , 0,07%, время удерживания 17) .1 мин), можно было выделить и идентифицировать в дополнение к салутаридину/синакутину. Обнаружение набора из восьми продуктов, связанных с фенолом, после введения ( R , S )-ТНР было идентичным обнаружению продуктов, связанных с ферментами, связанных с фенолом, как описано в (24). Однако приведенные выше результаты впервые подтверждают образование алкалоидных продуктов, связанных с фенолом, у мышей. Помимо продуктов, связанных с фенолом, два из четырех диметокси-тетрагидропротобербериновых алкалоидов были идентифицированы как корексимин (молекулярная масса m / z 328.15426, 0,1%, время удерживания 13,5 мин) и скулерин (молекулярная масса m / z 328,15429, 0,02%, время удерживания 16,5 мин), которые были получены из ТНР живыми мышами и выведены с мочой. Корексимин и скулерин являются типичными и широко распространенными тетрагидропротобербериновыми алкалоидами, встречающимися в царстве растений.
Однако приведенные выше результаты впервые подтверждают образование алкалоидных продуктов, связанных с фенолом, у мышей. Помимо продуктов, связанных с фенолом, два из четырех диметокси-тетрагидропротобербериновых алкалоидов были идентифицированы как корексимин (молекулярная масса m / z 328.15426, 0,1%, время удерживания 13,5 мин) и скулерин (молекулярная масса m / z 328,15429, 0,02%, время удерживания 16,5 мин), которые были получены из ТНР живыми мышами и выведены с мочой. Корексимин и скулерин являются типичными и широко распространенными тетрагидропротобербериновыми алкалоидами, встречающимися в царстве растений.
Чтобы проверить образование салутаридина с правильной стереохимией, мышам вводили (внутрибрюшинно) ( R )-[ N -CD 3 ]-ретикулин (200 нмоль на мышь) с использованием того же протокола инъекции, что и для THP и связанных с фенолом продуктов выделяли из мочи мышей и анализировали с помощью HR-LC-MS. Как показано на рис. 3, четыре продукта, связанные с фенолом [ N -CD 3 ]-паллидин, [ N -CD 3 ]-коритуберин, [ N -CD 3 ]- салутаридин и [ N -CD 3 ]-изоболдин были разделены и показали одинаковое время удерживания с помощью ВЭЖХ по сравнению со стандартными соединениями. Продукт биосинтеза пара-орто , связанный с фенолом, салутаридин, имел m / z 331,17326 (теория: m / z 331.17317) с отклонением от теоретического значения 0,3 частей на миллион (млн) при концентрации 52 пмоль на мл мочи мыши. Абсолютная конфигурация образовавшегося салутаридина ранее была установлена как (+) (24).
Как показано на рис. 3, четыре продукта, связанные с фенолом [ N -CD 3 ]-паллидин, [ N -CD 3 ]-коритуберин, [ N -CD 3 ]- салутаридин и [ N -CD 3 ]-изоболдин были разделены и показали одинаковое время удерживания с помощью ВЭЖХ по сравнению со стандартными соединениями. Продукт биосинтеза пара-орто , связанный с фенолом, салутаридин, имел m / z 331,17326 (теория: m / z 331.17317) с отклонением от теоретического значения 0,3 частей на миллион (млн) при концентрации 52 пмоль на мл мочи мыши. Абсолютная конфигурация образовавшегося салутаридина ранее была установлена как (+) (24).
Извлеченная хроматограмма полного сканирования метаболитов с m / z 331.17326, обнаруженных в моче мышей, которым вводили (ip) ( R )-[ N -CD 3 . . Анализ HR-LC-MS выявил экскрецию с мочой меченых стабильными изотопами продуктов, связанных с фенолом [ N -CD 3 ]-паллидина, [ N -CD 3 ]-коритуберина, [ N -CD 3 ]-салутаридин и [ N -CD 3 ]-изоболдин.
Трансформация салутаридина в тебаин.
Живые мыши способны трансформировать ТНР и ( R )-ретикулин в салутаридин. Следовательно, у млекопитающих есть путь, ведущий от простых тетраоксигенированных тетрагидробензилизохинолиновых алкалоидов к салутаридину. Этот промежуточный продукт морфинана превращается растениями мака в тебаин (29, 30). Можно предположить, что у млекопитающих существует путь, подобный обнаруженному у мака, который дает тебаин из салутаридина.Предыдущая работа в нашей лаборатории (31) показала, что салутаридин стереоселективно восстанавливается за счет НАДФН до салутаридинола, но не до эписалутаридинола. Мы синтезировали салутаридинол химическим путем, восстанавливая салутаридин в присутствии NaBD 4 , и разделили полученные диастереомеры с помощью ТСХ. [7D]-салутаридинол вводили (внутрибрюшинно) мышам (200 нмоль на мышь) для отслеживания возможного перехода на тебаин. Мочу обрабатывали, избегая кислых условий, и извлеченную фракцию алкалоидов выделяли и подвергали HR-LC-MS. Выделенный алкалоид имел молекулярную массу m / z 313,16556 и состав C 19 H 21 2 HO 3 N, тогда как немеченый, стандартный bain z 312.15934 и элементный состав C 19 H 22 O 3 N. Время удерживания ВЭЖХ составляло 18,13 мин для меченого соединения и 18,16 мин для немеченого стандартного тебаина. Характер фрагментации меченого тебаина, обнаруженный в моче мышей, подвергшихся инъекциям (т.р.) с [7D]-салутаридинолом показан на рис. 4.
Выделенный алкалоид имел молекулярную массу m / z 313,16556 и состав C 19 H 21 2 HO 3 N, тогда как немеченый, стандартный bain z 312.15934 и элементный состав C 19 H 22 O 3 N. Время удерживания ВЭЖХ составляло 18,13 мин для меченого соединения и 18,16 мин для немеченого стандартного тебаина. Характер фрагментации меченого тебаина, обнаруженный в моче мышей, подвергшихся инъекциям (т.р.) с [7D]-салутаридинолом показан на рис. 4.
HR-ЖХ-МС/МС [7D]-тебаина и стандарта тебаина, элюирующийся при 18,1 мин. ( A ) HR-LC-MS/MS [7D]-тебаина, обнаруженного в моче после внутрибрюшинной инъекции [7D]-салутаридинола мышам. ( B ) HR-LC-MS/MS стандарта тебаина.
Меченый алкалоид представляет собой тебаин, содержащий один атом дейтерия предположительно в положении С7. Концентрация меченого тебаина составляла 128 пмоль на мл мочи мыши. Инъекция (т. п.) другого диастереомера [7D]-эписалутаридинола по тому же протоколу введения не приводило к образованию тебаина. Это демонстрирует, что превращение салутаридинола в тебаин является стереоселективным процессом при катализе in vivo. Химического превращения эписалутаридинола в тебаин не происходило ни у животных, ни при обработке мочи.
п.) другого диастереомера [7D]-эписалутаридинола по тому же протоколу введения не приводило к образованию тебаина. Это демонстрирует, что превращение салутаридинола в тебаин является стереоселективным процессом при катализе in vivo. Химического превращения эписалутаридинола в тебаин не происходило ни у животных, ни при обработке мочи.
Образование морфина из тебаина.
Тебаин, промежуточное соединение пентациклического морфинана опийного мака, образует морфин двумя биохимическими путями.За O -деметилированием тебаина в положении 6 с образованием неопинона и кодеинона следует восстановление до кодеина, который, в свою очередь, подвергается O -деметилированию в положении 3 с образованием морфина. Альтернативой является деметилирование тебаина первоначально в положении 3 с получением орипавина с дальнейшим 6- O -деметилированием до морфина, который ферментативно восстанавливается до морфина. Примечательно, что существуют хемотипы растения мака, в которых либо доминирует, либо даже исключают пути (32).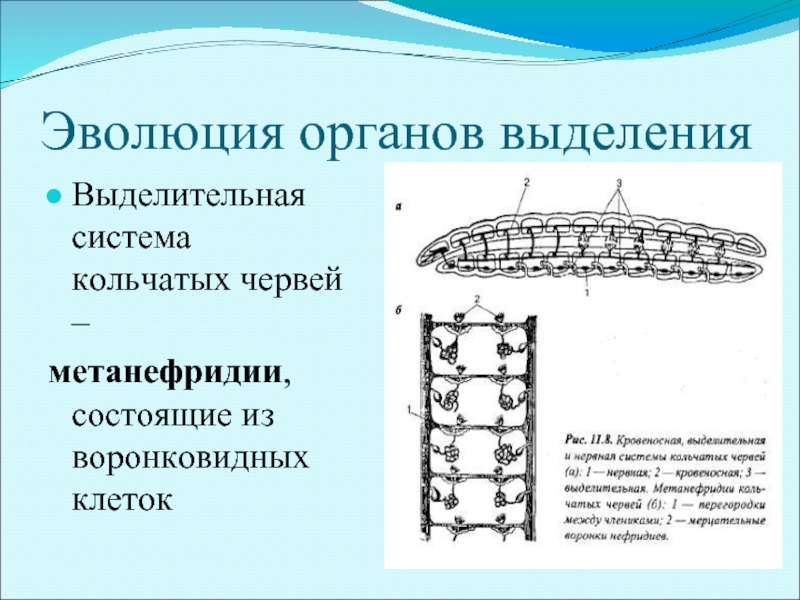 Мы продемонстрировали здесь, что [7D]-тебаин образуется мышами после инъекции (внутрибрюшинно) [7D]-салутаридинола, что измеряется экскрецией с мочой. Остается открытым вопрос, метаболизируется ли тебаин в дальнейшем у грызунов, и если да, то приводит ли метаболический путь к морфину. Если морфин образуется из тебаина, каким путем он образуется из мака, через кодеин или через орипавин, или и то, и другое? Установлена способность человека 3- O -деметилировать кодеин в морфин (33, 34). Было показано, что ферментом, ответственным за эту реакцию, является CYP 2D6 (35, 36).Активность этого фермента Р450 находится под генетическим контролем из-за полиморфизма, приводящего к различным фенотипам (37). Недавно CYP 2D6 человека был полностью охарактеризован в отношении субстратов морфинового пути ( R ) — ретикулина, тебаина и кодеина и их соответствующих продуктов (24).
Мы продемонстрировали здесь, что [7D]-тебаин образуется мышами после инъекции (внутрибрюшинно) [7D]-салутаридинола, что измеряется экскрецией с мочой. Остается открытым вопрос, метаболизируется ли тебаин в дальнейшем у грызунов, и если да, то приводит ли метаболический путь к морфину. Если морфин образуется из тебаина, каким путем он образуется из мака, через кодеин или через орипавин, или и то, и другое? Установлена способность человека 3- O -деметилировать кодеин в морфин (33, 34). Было показано, что ферментом, ответственным за эту реакцию, является CYP 2D6 (35, 36).Активность этого фермента Р450 находится под генетическим контролем из-за полиморфизма, приводящего к различным фенотипам (37). Недавно CYP 2D6 человека был полностью охарактеризован в отношении субстратов морфинового пути ( R ) — ретикулина, тебаина и кодеина и их соответствующих продуктов (24).
Синтетический [ N -CD 3 ]-тебаин вводили (внутрибрюшинно) (всего 200 нмоль на мышь), и в образце мочи были обнаружены три алкалоидных метаболита.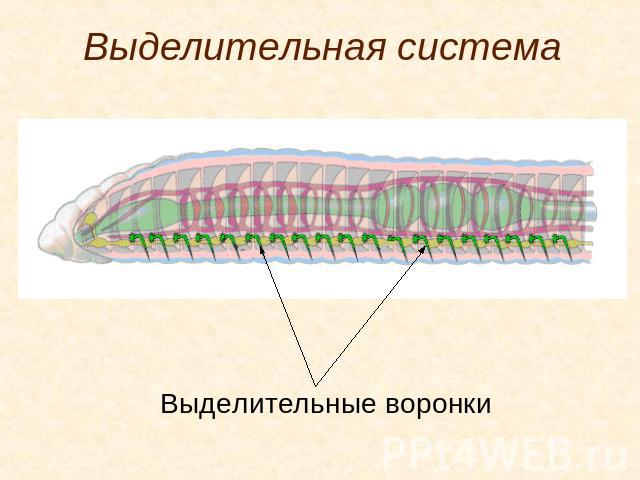 Идентификация была первоначально достигнута путем сравнения со временем удерживания немеченых потенциальных алкалоидов морфинана, а затем подтверждена масс-спектрометрией высокого разрешения (HR-MS).Три метаболита были однозначно идентифицированы как [ N -CD 3 ]-кодеин, [ N -CD 3 ]-орипавин и [ N -CD 3 ]-морфин (рис. 5) .
Идентификация была первоначально достигнута путем сравнения со временем удерживания немеченых потенциальных алкалоидов морфинана, а затем подтверждена масс-спектрометрией высокого разрешения (HR-MS).Три метаболита были однозначно идентифицированы как [ N -CD 3 ]-кодеин, [ N -CD 3 ]-орипавин и [ N -CD 3 ]-морфин (рис. 5) .
HR-LC-MS анализ метаболитов, меченных стабильными изотопами, обнаруженных в моче мышей, которым вводили (внутрибрюшинно) [ N -CD 3 ]-тебаин. ( A ) HR-MS [ N -CD 3 ]-кодеина (время удерживания 6,6 мин). ( B ) HR-MS [ N -CD 3 ]-орипавина (время удерживания 10.2 мин.). ( C ) HR-MS [ N -CD 3 ]-морфина (время удерживания 2,9 мин).
Все три продукта трансформации были проверены с помощью HR-MS с высокой точностью массы < 1 ppm. Количественное определение трех метаболитов показало, что из мочи мышей, которым вводили инъекцию (внутрибрюшинно), в общей сложности было выделено только 5 пмоль на мл мочи. Поскольку известно, что кислотный гидролиз высвобождает несвязанные морфинаны из известных метаболитов глюкуроновой кислоты или сульфатов, образец мочи гидролизовали с помощью HCl, однако выход не увеличился.Кроме того, в моче отсутствовал остаточный [ N -CD 3 ]-тебаин. Анализ печени, головного мозга, почек и крови не выявил наличия какого-либо из меченых морфинанов. Экскреция с фекалиями этих животных может быть исключена, поскольку известно, что фекалии содержат <1–8% от общего количества морфинанов, вводимых путем инъекций (34, 38). N -деметилированные алкалоиды нортебаин, норкодеин, норорипавин и норморфин в моче мышей не обнаружены. Метаболическая судьба большей части введенного тебаина остается неизвестной.Было показано, что кодеин 3- O -деметилируется in vivo до морфина (33, 34). Орипавин вводили (внутрибрюшинно) мышам, чтобы убедиться, что морфин также может образовываться у млекопитающих посредством 6- O -деметилирования орипавина.
Поскольку известно, что кислотный гидролиз высвобождает несвязанные морфинаны из известных метаболитов глюкуроновой кислоты или сульфатов, образец мочи гидролизовали с помощью HCl, однако выход не увеличился.Кроме того, в моче отсутствовал остаточный [ N -CD 3 ]-тебаин. Анализ печени, головного мозга, почек и крови не выявил наличия какого-либо из меченых морфинанов. Экскреция с фекалиями этих животных может быть исключена, поскольку известно, что фекалии содержат <1–8% от общего количества морфинанов, вводимых путем инъекций (34, 38). N -деметилированные алкалоиды нортебаин, норкодеин, норорипавин и норморфин в моче мышей не обнаружены. Метаболическая судьба большей части введенного тебаина остается неизвестной.Было показано, что кодеин 3- O -деметилируется in vivo до морфина (33, 34). Орипавин вводили (внутрибрюшинно) мышам, чтобы убедиться, что морфин также может образовываться у млекопитающих посредством 6- O -деметилирования орипавина. Количественный анализ показал, что было извлечено только 0,3% от общего количества введенного (внутрибрюшинно) вещества. Один из продуктов мочи был однозначно подтвержден после сравнения времени удерживания и HR-MS со стандартом в виде морфина (-0,4 частей на миллион) в концентрации 2.1 пмоль/мл мочи. Продемонстрированная здесь биотрансформация орипавина в морфин подтверждает, что животные способны катализировать расщепление винилового эфира в орипавине. Предполагается, что после инъекции (внутрибрюшинно) орипавина вторым метаболитом мочи с m / z 284,12803 (-0,2 млн) будет морфинон. Это предположение подтверждается сообщениями, описывающими морфинон как метаболит морфина in vivo и in vitro у млекопитающих (39, 40).
Количественный анализ показал, что было извлечено только 0,3% от общего количества введенного (внутрибрюшинно) вещества. Один из продуктов мочи был однозначно подтвержден после сравнения времени удерживания и HR-MS со стандартом в виде морфина (-0,4 частей на миллион) в концентрации 2.1 пмоль/мл мочи. Продемонстрированная здесь биотрансформация орипавина в морфин подтверждает, что животные способны катализировать расщепление винилового эфира в орипавине. Предполагается, что после инъекции (внутрибрюшинно) орипавина вторым метаболитом мочи с m / z 284,12803 (-0,2 млн) будет морфинон. Это предположение подтверждается сообщениями, описывающими морфинон как метаболит морфина in vivo и in vitro у млекопитающих (39, 40).
С помощью инъекции (внутрибрюшинно) проксимальных предшественников морфина мышам впервые было подтверждено, что млекопитающие способны синтезировать морфин из THP, как показано на рис. 6. Неожиданно данные свидетельствуют о том, что раздвоенный путь ведет от тебаина в морфин через промежуточный кодеин и одновременно из орипавина, как в растении опийного мака.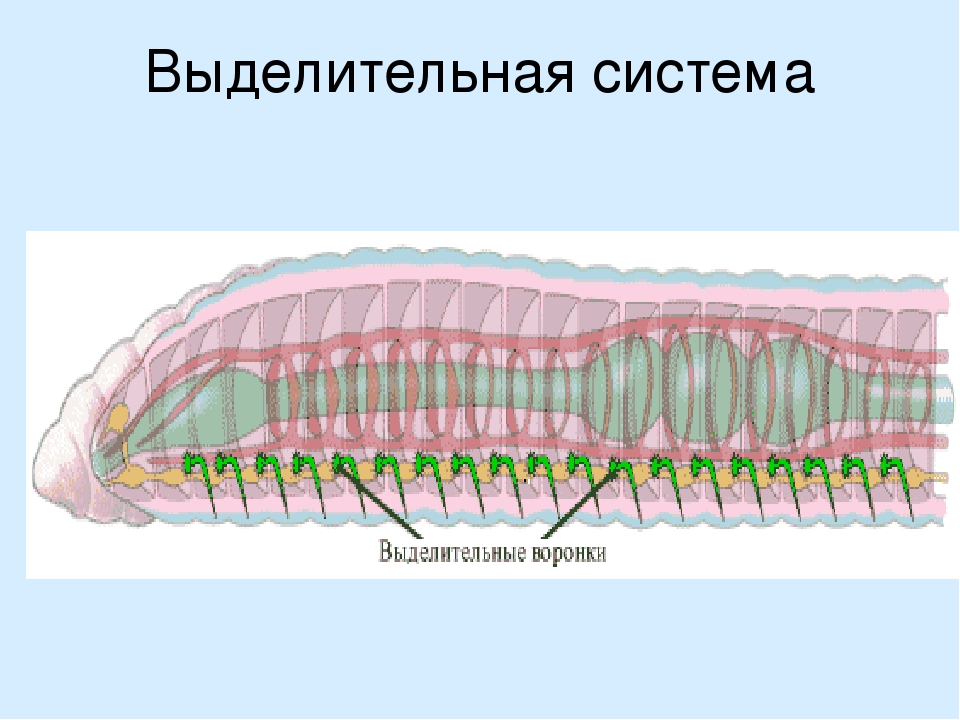
Предполагаемый путь биосинтеза от THP до морфина у млекопитающих. Предшественники морфина и морфин были проверены с помощью HR-LC-MS в виде метаболитов мочи мышей, которым вводили инъекции (т.р.) с биосинтетическими предшественниками. Теоретическая масса и химическая формула показаны для каждого обнаруженного метаболита.
Обсуждение
Основываясь на выводах о том, что морфин выводится с мочой у людей и грызунов (7, 13–15), мы изучили выведение меченого морфина и его предшественников после инъекции (внутрибрюшинно) потенциальных предшественников алкалоидов. Этот уникальный подход позволяет распределять введенные потенциальные предшественники в крови, где они метаболически модифицируются, а затем небольшая часть этих алкалоидов выводится с мочой.Таким образом, эти молекулы избегают дальнейшей модификации и дают статическую картину состава химических компонентов, образовавшихся в органах животного. Используя этот подход и первоначально используя самый отдаленный потенциальный алкалоидный предшественник морфина, ТНР, мы смогли продемонстрировать, что салутаридин, промежуточное звено пути морфина, продуцируется вместе с несколькими другими алкалоидами, уже известными из царства растений.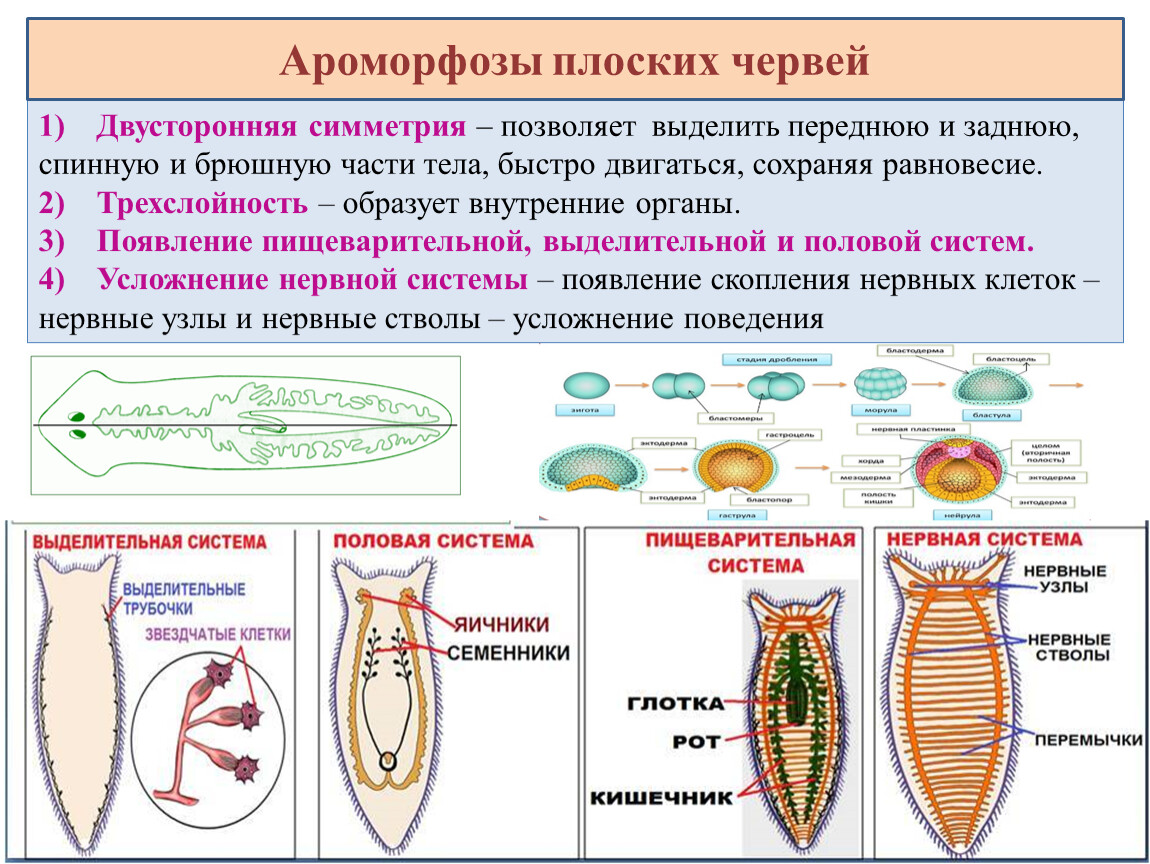 Это первый случай, когда это связанное с фенолом промежуточное соединение было обнаружено in vivo у млекопитающих.Это второй случай, когда реакция связывания фенола была обнаружена в животном мире; первым примером была фенольная связь, участвующая в образовании тироксина в щитовидной железе (41). Промежуточное соединение морфинана, образованное из THP, салутаридин, в результате реакции связывания фенола ( R )-ретикулина образуется вместе с (-)-коритуберином, (+)-паллидином и (-)-изоболдином. Эти четыре соединения были также охарактеризованы как продукты, полученные посредством O — и N -метилирования в моче мышей, которым вводили инъекции (т.р.) с ( R , S )-ТНР. Инъекция (внутрибрюшинно) природного продукта восстановления салутаридина, салутаридинола (29), мышам приводила к образованию тебаина в моче. Этот алкалоид морфинан признан промежуточным звеном (42) на пути к морфину. Действительно, инъекция [ N -CD 3 ]-тебаина мышам приводила к образованию [ N -CD 3 ]-морфина и двух его ближайших предшественников, [ N -CD 3 ] -кодеин и [ N -CD 3 ]-орипавин.
Это первый случай, когда это связанное с фенолом промежуточное соединение было обнаружено in vivo у млекопитающих.Это второй случай, когда реакция связывания фенола была обнаружена в животном мире; первым примером была фенольная связь, участвующая в образовании тироксина в щитовидной железе (41). Промежуточное соединение морфинана, образованное из THP, салутаридин, в результате реакции связывания фенола ( R )-ретикулина образуется вместе с (-)-коритуберином, (+)-паллидином и (-)-изоболдином. Эти четыре соединения были также охарактеризованы как продукты, полученные посредством O — и N -метилирования в моче мышей, которым вводили инъекции (т.р.) с ( R , S )-ТНР. Инъекция (внутрибрюшинно) природного продукта восстановления салутаридина, салутаридинола (29), мышам приводила к образованию тебаина в моче. Этот алкалоид морфинан признан промежуточным звеном (42) на пути к морфину. Действительно, инъекция [ N -CD 3 ]-тебаина мышам приводила к образованию [ N -CD 3 ]-морфина и двух его ближайших предшественников, [ N -CD 3 ] -кодеин и [ N -CD 3 ]-орипавин.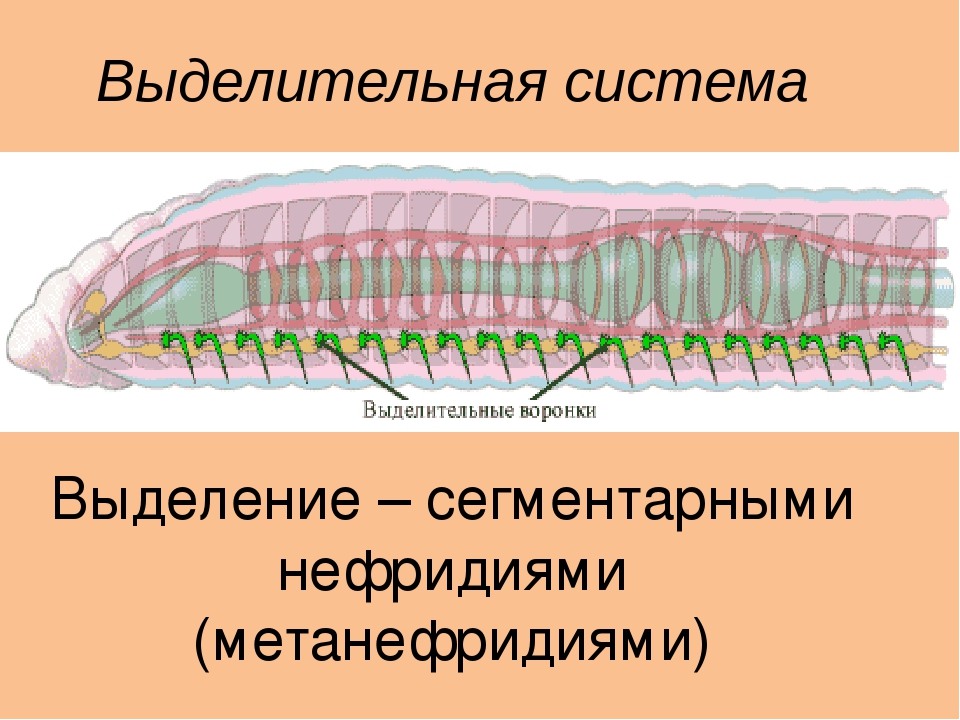 Интересно, что бифуркатный путь образования морфина, известный из опийного мака, реализуется и в морфиновом пути млекопитающих. Однако ранние стадии пути у млекопитающих отличаются от таковых у растений тем, что путь биосинтеза у млекопитающих дает тетрагидроксилированный тетрагидробензилизохинолин в качестве первого промежуточного алкалоидного соединения, тогда как путь у растений дает тригидроксилированный тетрагидробензилизохинолин. Это говорит о том, что пути поступления морфина у млекопитающих и растений могли развиваться независимо.
Интересно, что бифуркатный путь образования морфина, известный из опийного мака, реализуется и в морфиновом пути млекопитающих. Однако ранние стадии пути у млекопитающих отличаются от таковых у растений тем, что путь биосинтеза у млекопитающих дает тетрагидроксилированный тетрагидробензилизохинолин в качестве первого промежуточного алкалоидного соединения, тогда как путь у растений дает тригидроксилированный тетрагидробензилизохинолин. Это говорит о том, что пути поступления морфина у млекопитающих и растений могли развиваться независимо.
Интересным моментом является низкий выход промежуточных и конечных продуктов, обнаруженный после инъекции (внутрибрюшинно) предшественников алкалоидов мышам (таблица 2). Несмотря на используемый чувствительный аналитический метод (таблица 3), нам не удалось обнаружить морфин или меченые и немеченые предшественники ни в крови, ни в основных органах. Это будет рассмотрено в будущих исследованиях.
Таблица 2.Сводка выходов промежуточных продуктов и морфина, выделяемых после инъекции (внутрибрюшинно) предшественников морфина мышам
Таблица 3.
Краткое изложение пределов обнаружения (LOD) морфина и его прекурсоров органов животных, таких как мозг, печень, почки и надпочечники. Тщательный анализ корма для грызунов ( Материалы и методы ) также не выявил морфина или предшественников морфина. В моче применяемые соединения, такие как салутаридинол, тебаин и орипавин, обнаруживались только в диапазоне около 0.1–1%; следов этих соединений, соответствующих N -деметилированных алкалоидов или продуктов их превращения в тканях мышей обнаружено не было. Мы предполагаем, что алкалоиды либо сильно видоизменялись, либо деградировали в органах животных. Однако 1% исходно введенных алкалоидов и продуктов их превращения в моче было достаточно для анализа HR-LC-MS. Применяемые и трансформированные алкалоиды, обнаруженные в моче, следует рассматривать как качественные, а не количественные измерения.Некоторые из этих биосинтетических предшественников морфинана (орипавин и кодеинон) и сам морфин будут реагировать с опиатными рецепторами и другими связывающими компонентами (43). Их биохимическая судьба после активации рецептора неизвестна. Было обнаружено, что концентрация морфина в клетках нейробластомы человека, обнаруженная двумя независимыми группами (10, 12), и в мозжечке мыши (12) составляет от 10 до 200 нМ, концентрация, которая может стимулировать μ-рецептор in vivo (43). В связи с полученными нами в настоящее время данными о том, что морфин может подвергаться быстрой и обширной биохимической или компартментальной инактивации, мы предполагаем, что де-факто концентрация морфина в микроокружении рецептора может быть значительно выше.
Их биохимическая судьба после активации рецептора неизвестна. Было обнаружено, что концентрация морфина в клетках нейробластомы человека, обнаруженная двумя независимыми группами (10, 12), и в мозжечке мыши (12) составляет от 10 до 200 нМ, концентрация, которая может стимулировать μ-рецептор in vivo (43). В связи с полученными нами в настоящее время данными о том, что морфин может подвергаться быстрой и обширной биохимической или компартментальной инактивации, мы предполагаем, что де-факто концентрация морфина в микроокружении рецептора может быть значительно выше.
Мы использовали анализ мочи, чтобы продемонстрировать, что живые млекопитающие содержат ферментативный механизм для синтеза морфина из самого отдаленного алкалоидного предшественника ТНР, присутствие которого в тканях человека и грызунов было подробно показано. Важными будущими целями будут понимание природы ферментов, которые катализируют превращение THP в морфин, и идентичность лежащих в основе генов. Эти знания затем помогут в исследовании физиологической роли эндогенного морфина у млекопитающих.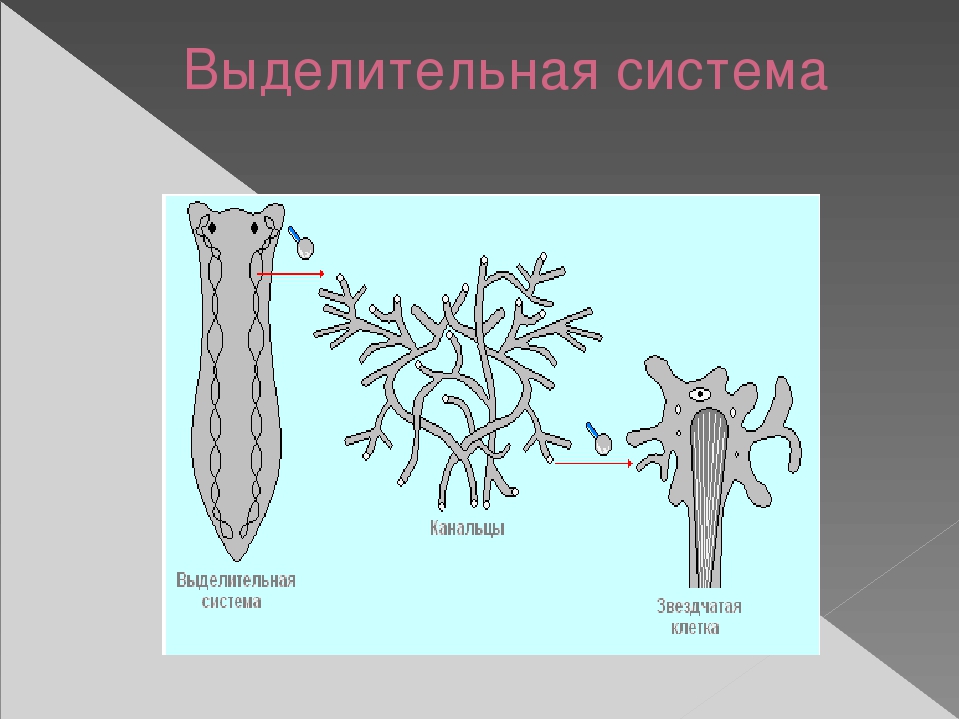
Материалы и методы
Животные.
Самки черных мышей C57 в возрасте от четырех до восьми месяцев были приобретены у Charles River. Животные были размещены в приюте для животных Вашингтонского университета. Был обеспечен бесплатный доступ к корму для грызунов (LabDiet 5001 Rodent Diet) и воде. Эксперименты на животных были одобрены Комитетом по изучению животных Вашингтонского университета.
Инъекция мышам и сбор мочи.
Субстрат и эталонные соединения были получены из нашей коллекции натуральных продуктов.Изотопное распределение меченных стабильными изотопами введенных (в/б) прекурсоров было следующим: для ( R , S )-[1,3,4-D 3 ]-THP 3,1%[D 2 ]/85,5%[D 3 ]/11,4%[D 4 ], для ( R )-[ N -CD 3 ]-ретикулин 0,1%[D 0 ] 90,2295% [D 1 ]/0,5%[D 2 ]/99,0%[D 3 ]/0,3%[D 4 ], для [7D]-салутаридинола 9,6%[D 0 ]/77,8 %[D 1 ]/12,5%[D 2 ], а для [ N -CD 3 ]-тебаина 0. 1%[D 0 ]/0,6%[D 2 ]/99,0%[D 3 ]/0,3%[D 5 ]. Стерильный раствор потенциального предшественника, содержащий 50–2000 нмоль алкалоида на 200 мкл воды, вводили (внутрибрюшинно) каждой мыши каждые 24 часа в течение 4 дней с помощью шприца для подкожных инъекций объемом 1 мл с иглой 26-го калибра (1/2 дюйма). Эта экспериментальная установка была разработана для сбора достаточного количества мочи для анализа HR-LC-MS. Мышей содержали в течение 4 дней эксперимента в метаболической клетке, мочу собирали каждые 24 ч и хранили при -20°C.Во время эксперимента был обеспечен свободный доступ к воде и корму для грызунов.
1%[D 0 ]/0,6%[D 2 ]/99,0%[D 3 ]/0,3%[D 5 ]. Стерильный раствор потенциального предшественника, содержащий 50–2000 нмоль алкалоида на 200 мкл воды, вводили (внутрибрюшинно) каждой мыши каждые 24 часа в течение 4 дней с помощью шприца для подкожных инъекций объемом 1 мл с иглой 26-го калибра (1/2 дюйма). Эта экспериментальная установка была разработана для сбора достаточного количества мочи для анализа HR-LC-MS. Мышей содержали в течение 4 дней эксперимента в метаболической клетке, мочу собирали каждые 24 ч и хранили при -20°C.Во время эксперимента был обеспечен свободный доступ к воде и корму для грызунов.
Выделение алкалоидов.
Ткань (0,4–1,5 г), объединенную мочу (1–5 мл) или кровь (1 мл), полученные от мышей, обрабатывали, как описано в (15) с небольшими изменениями. После гидролиза в 2 н. HCl в течение 40 мин при 110 °С образец охлаждали и доводили рН до 7–8 с помощью 10 н. КОН. Образец загружали в картридж Bond Elut Certify для твердофазной экстракции (ТФЭ) (130 мг, 3 мл, Varian), предварительно кондиционированный 2 мл метанола и 2 мл воды.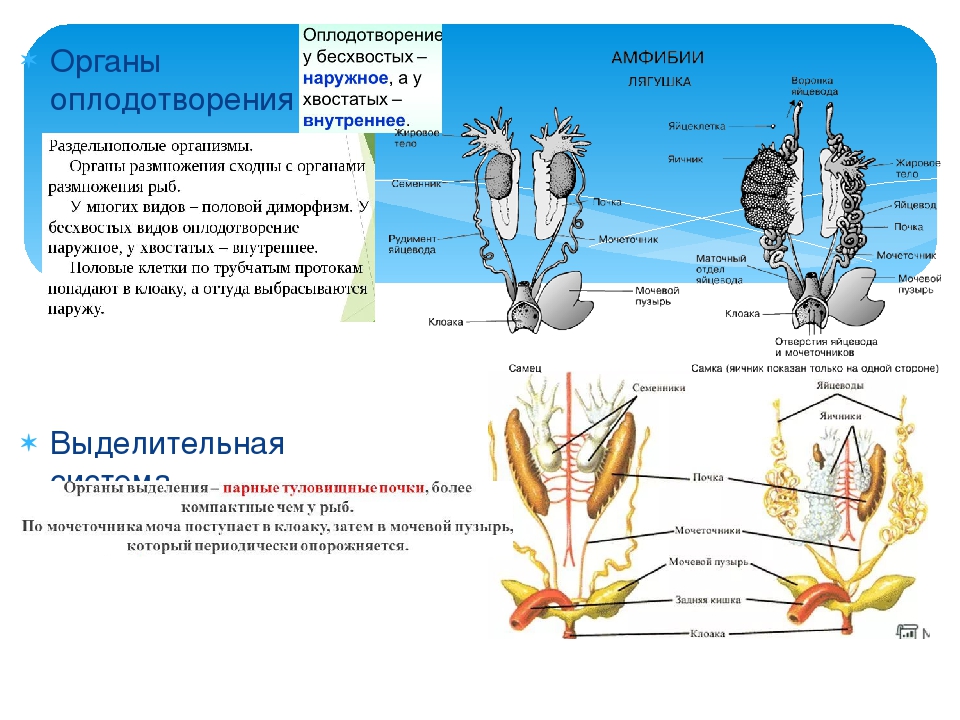 Картридж промывали 2 мл воды, 1 мл ацетатного буфера с pH 4,0, 2 × 2 мл метанола и после 2 минут вакуума элюировали 2 мл дихлорметана/изопропилового спирта/гидроксида аммония (8∶2∶0,2). Элюат выпаривали в токе азота, ресуспендировали в 100 мкл воды/метанола (8∶2), содержащем 0,1% муравьиной кислоты, и подвергали анализу HR-LC-MS. Экстракцию 100 г корма для грызунов (LabDiet 5001 Rodent Diet) проводили 2 н. ледяной уксусной кислотой в метаноле с использованием аппарата Сокслета. Растворитель удаляли в вакууме, а восстановленный экстракт подвергали ТФЭ и анализировали с помощью МС.
Картридж промывали 2 мл воды, 1 мл ацетатного буфера с pH 4,0, 2 × 2 мл метанола и после 2 минут вакуума элюировали 2 мл дихлорметана/изопропилового спирта/гидроксида аммония (8∶2∶0,2). Элюат выпаривали в токе азота, ресуспендировали в 100 мкл воды/метанола (8∶2), содержащем 0,1% муравьиной кислоты, и подвергали анализу HR-LC-MS. Экстракцию 100 г корма для грызунов (LabDiet 5001 Rodent Diet) проводили 2 н. ледяной уксусной кислотой в метаноле с использованием аппарата Сокслета. Растворитель удаляли в вакууме, а восстановленный экстракт подвергали ТФЭ и анализировали с помощью МС.
Анализ ВР-ЖХ-МС.
Спектры химической ионизации с преобразованием Фурье и масс-спектрометрией при атмосферном давлении (APCI-FT-MS) были получены с использованием спектрометра LTQ-Orbitrap (Thermo Fisher). Спектрометр работал в положительном режиме (1 спектр с-1; диапазон масс: 50–1000) с номинальной разрешающей способностью по массе 60 000 на 90 298 м 90 299 / 90 298 z 90 299 400 при частоте сканирования 1 Гц с использованием автоматической регулировки усиления для обеспечивают высокоточные измерения массы (отклонение ≤ 2 ppm). Внутренний калибровочный стандарт бис-(2-этилгексил)фталат ( m / z 391.28428) использовали для определения элементного состава. Спектрометр был оснащен системой ВЭЖХ Surveyor (Thermo Scientific), состоящей из LC-насоса, УФ-детектора ( λ = 254 нм) и автоматического пробоотборника (объем впрыска 10 мкл). Разделение образцов осуществляли с помощью колонки для ВЭЖХ Synergi Fusion RP (Phenomenex, 4 мкм, 150 × 3 мм) в сочетании с защитной колонкой Synergi Fusion RP (Phenomenex, 4 × 3 мм). Общий поток подвижной фазы устанавливали равным 0,5 мл/мин с элюированием бинарным градиентом с использованием растворителей А (0.1 % муравьиной кислоты, 10 мМ ацетата аммония) и B (0,1 % муравьиной кислоты в ацетонитриле) (все об./об.). Градиент начинался с 5 % B в течение 4 минут и был увеличен до 30 % B в течение 20 минут. Элюирование продолжали в течение 10 минут при 100% В с последующим 7-минутным уравновешиванием исходными условиями. Спектры МС/МС были получены для соответствующих исходных ионов ([M + H] + ) с энергией столкновения 35 В для салутаридина и 40 В для тебаина.
 Для количественной оценки все графики внешней калибровки были линейными (R 2 > 0.99) в диапазоне 0,35–35 пмоль.
Для количественной оценки все графики внешней калибровки были линейными (R 2 > 0.99) в диапазоне 0,35–35 пмоль.
Благодарности
Мы благодарим Тэмми Кидл, DVM, Ph.D. из Центра животных Вашингтонского университета за ее квалифицированную помощь. Мы благодарны Дженнифер Хардес за отличную техническую помощь. РС. благодарит доктора Гуннара Лоха из Немецкого института питания человека за свежие мышиные органы. Эта работа была поддержана грантом Национального института здравоохранения 5R21DA024418 и Deutsche Forschungsgemeinschaft.
Сноски
- 3 Кому следует направлять корреспонденцию.Электронная почта: mhzenk{at}danforthcenter.org.
-
Н.Г., М.Л., Р.Г.О., М.Х.З. и М.С. проектное исследование; Н.Г. и М.Л. проведенное исследование; Б.Д., Т.М.К. и М.С. предоставил новые реагенты/аналитические инструменты; Н.Г., М.Л., Р.Г.О., Б.Д., Т.М.К., М.Х.З. и М.С. проанализированные данные; и Н.Г., Т.М.К. и М.Х.З. написал бумагу.
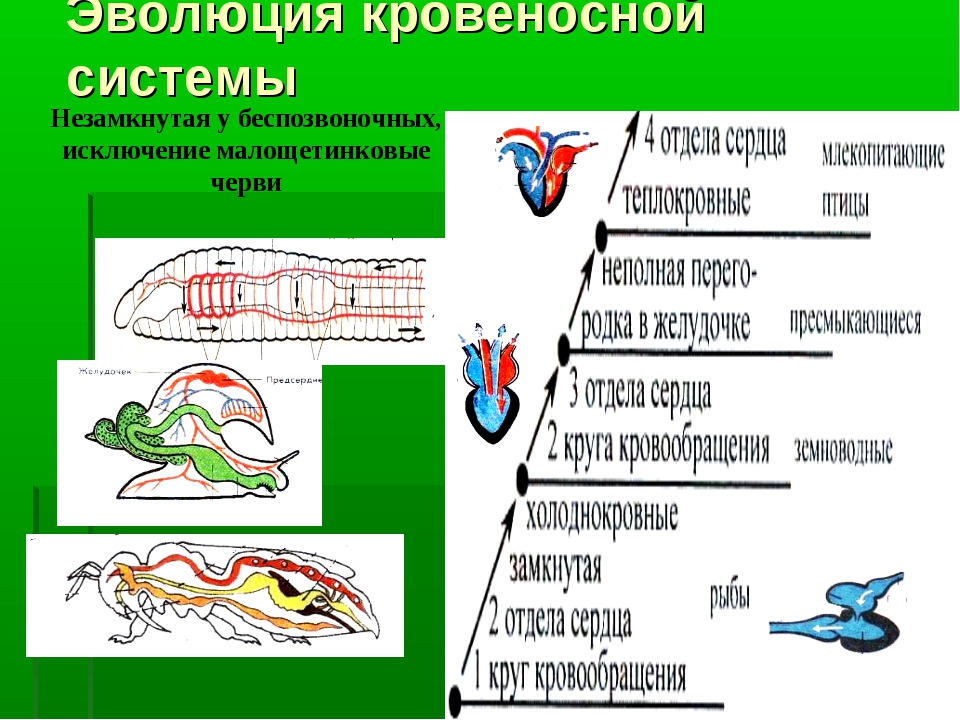
-
↵ 2 М.Г.З. и М.С. поделитесь статусом старшего автора для этой работы.
-
Авторы заявляют об отсутствии конфликта интересов.
-
Эта статья содержит вспомогательную информацию в Интернете по адресу www.pnas.org/lookup/suppl/doi:10.1073/pnas.1003423107/-/DCSupplemental.
Адаптации пустынных амфибий и рептилий
Адаптации пустынных амфибий и рептилий
Томас Р. Ван Девендер
Земноводные и рептилии имеют множество различных приспособлений, которые
позволить им жить в пустынях, избегая крайностей в засушливости, жаре или холоде. Животные могут быть активны только в определенные сезоны и в благоприятное время суток. Многие используют окружающую среду, чтобы активно регулировать температуру своего тела, предотвращая смертельные крайности.А некоторые хорошо приспособлены к поверхности, на которой они живут — с модифицированными придатками для рытья нор или способностью бегать, нырять, плавать или скользить по рыхлому песку.
Прежде чем позвоночные животные приспособились к специфическим наземным средам обитания, таким как пустыни, они сначала должны были приспособиться к жизни на суше. Первичная адаптация к жизни на суше произошла в палеозое от 400 до 360 млн лет назад (миллион лет назад) с эволюцией амфибий. Земноводные,
название происходит от греческого слова amphibios (существо с двойной жизнью), живут в пресной воде в виде личинок и могут перемещаться на сушу во взрослом возрасте.В метаморфозе амфибии от личинки к взрослой особи можно прочитать историю ее эволюции от легочной рыбы: личинка использует жабры для дыхания и отверстия вдоль боковой линии, чтобы ощущать окружающую среду; у взрослых они утрачиваются, и развиваются легкие, конечности и пальцы. Водные личинки и тонкая проницаемая кожа, уязвимая к потере воды и солнечному свету, не позволяют амфибиям полностью жить на суше и ограничивают их излучение в засушливые места обитания. Хотя ранние амфибии высаживались на берег в поисках насекомых, позвоночные окончательно не покидали воду до конца палеозоя, когда у первых рептилий развилась водонепроницаемая кожа и яйцо с оболочками (амнион, хорион), защищающими эмбрионы от высыхания.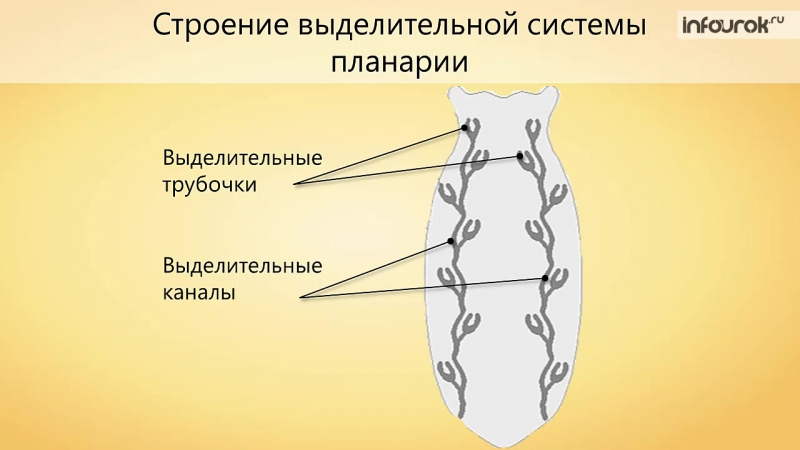
Эволюционное излучение современных амфибий и рептилий, а также современных млекопитающих и птиц началось с вымиранием динозавров в позднем меловом периоде (98-65 млн лет назад). Наиболее общие приспособления к засушливости развились в засушливые сезоны тропических лиственных лесов с эоцена (около 45 млн лет назад) до среднего миоцена. (15 млн лет назад), задолго до того, как возникли пустыни Северной Америки. Адаптации эндемиков пустыни Сонора, вероятно, произошли в тропических лиственных лесах или в терновнике.Поднятие Западной Сьерра-Мадре на 15 млн лет назад изменило погодные условия. Предадаптированные рептилии процветали по мере того, как растущая засушливость сформировала пустыню Сонора к позднему миоцену (8 млн лет назад).
Пустыня представляет большие трудности для амфибий. Тигровые саламандры и низинные леопардовые лягушки заходят в пустыню только вблизи постоянных водоемов, ручьев или родников. Тигровые саламандры часто становятся неотеническими (сохраняя свои личиночные формы), даже размножаясь в виде личинок и лишь изредка превращаясь в наземных взрослых особей.
Жаба пустыни Сонора, пустынная чесночница, северная квакша и другие выживают в пустыне благодаря своей способности рыть норы глубиной до трех футов, где они проводят девять или десять месяцев подряд. У лопатоногих и северных древесных лягушек с каской есть затвердевшие участки, называемые лопатами, на задних лапах, которыми они могут копать. Чтобы предотвратить потерю воды в норах, чесночница выделяет полупроницаемую мембрану, которая утолщает их кожу, в то время как квакша с головой образует целлофановый кокон, сбрасывая внешние слои кожи.У лопатоногих высокая толерантность к собственной мочевине, поскольку они не выделяют экскременты, находясь в своих норах.
Главной задачей пустынных амфибий является размножение в
временные лужи, образовавшиеся в результате очень спорадических и локальных летних гроз. Чаще всего размножение происходит ночью, когда самок привлекают крики самцов. Пустынные чесночницы эволюционировали с ускоренной скоростью от яйца до жабки менее чем за две недели! В юго-восточной Калифорнии, где летние осадки менее стабильны, чесночницы появляются во время первого шторма, путешествуют к прудам, кричат и размножаются, а также поедают богатых липидами роящихся термитов, часто за одну ночь.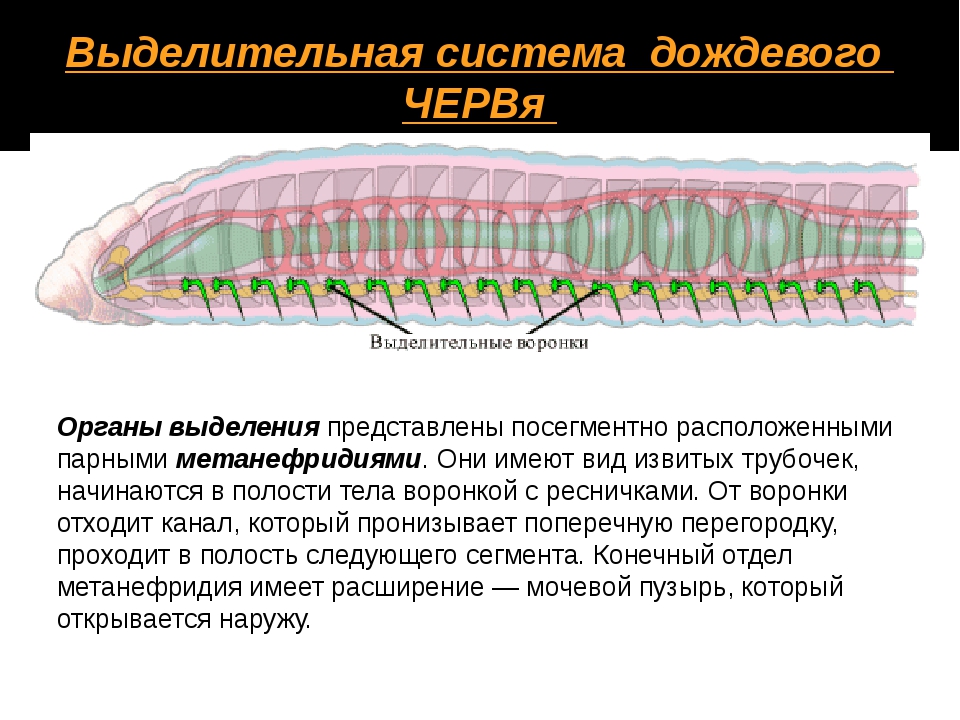 У взрослых особей может быть достаточно жировых запасов только для того, чтобы выжить без еды в течение года.
У взрослых особей может быть достаточно жировых запасов только для того, чтобы выжить без еды в течение года.
Примитивные рептилии могли проникать в более сухие места обитания, чем амфибии, благодаря яйцу амниоты с кожистой или твердой скорлупой, а также благодаря их относительно непроницаемой коже с чешуей. Популяции перестали быть сосредоточены возле источников воды, и эмбрионы сразу после вылупления превратились в маленьких взрослых особей.
Поскольку у рептилий тонкая кожа с плохой теплоизоляцией, и большинство из них не вырабатывают внутреннее тепло для подпитки своего метаболизма, адаптация для регулирования температуры тела (терморегуляция) очень важна.Терморегуляция возможна, потому что
сложных взаимосвязей между температурой тела, физиологическими процессами (химическими реакциями, выработкой гормонов и др.) и поведением. Характер активности меняется в зависимости от времени года: от полудня весной и осенью до раннего утра и позднего вечера летом. Ночные рептилии, такие как полосатый геккон и большинство змей, пассивно обмениваются теплом с воздухом и почвой. Напротив, дневные ящерицы поглощают тепло, греясь на солнце. Относительно равномерная температура тела поддерживается несколькими способами: за счет времени повседневной деятельности,
перемещением в тень и из тени и изменением ориентации тела по отношению к солнцу (инсоляция), регулированием контакта с поверхностью для регулирования теплопередачи (проводимость), изменением цвета (темная кожа быстрее поглощает энергию) и так далее.Кроме того, некоторые пустынные рептилии могут переносить довольно высокие температуры тела; активный диапазон пустынных игуан, например, составляет от 100 до 108F (38-42C).
Напротив, дневные ящерицы поглощают тепло, греясь на солнце. Относительно равномерная температура тела поддерживается несколькими способами: за счет времени повседневной деятельности,
перемещением в тень и из тени и изменением ориентации тела по отношению к солнцу (инсоляция), регулированием контакта с поверхностью для регулирования теплопередачи (проводимость), изменением цвета (темная кожа быстрее поглощает энергию) и так далее.Кроме того, некоторые пустынные рептилии могут переносить довольно высокие температуры тела; активный диапазон пустынных игуан, например, составляет от 100 до 108F (38-42C).
Во время экологического стресса пустынные рептилии проводят длительные периоды бездействия в норах, часто позаимствованных у тех, что вырыты грызунами или другими млекопитающими. Во время зимней спячки и летней спячки у животных в норах значительно снижены обменные процессы. Они живут за счет воды и питательных веществ, хранящихся в их телах, в то время как отходы накапливаются до потенциально токсичных уровней.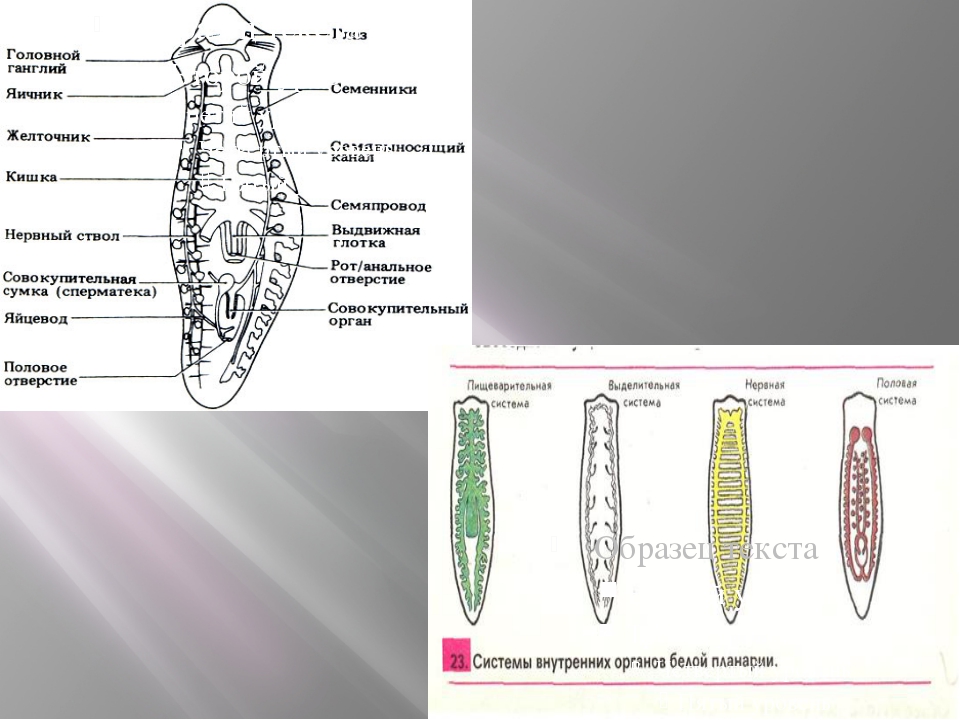 Пустынные черепахи, например, имеют большой мочевой пузырь, который может хранить более 40 процентов массы тела черепахи в воде, мочевине, мочевой кислоте и азотистых отходах в течение нескольких месяцев, пока они не смогут пить. Ураты отделяются от воды и могут удаляться в твердой форме, высвобождая воду и ионы для реабсорбции. Во время длительных засух, когда черепахи неактивны, они могут повторно поглощать минералы из своих панцирей для использования в своих метаболических процессах. У гигантского острова Сан-Эстебан и колючих чакволл на островах в Калифорнийском заливе есть пара боковых лимфатических мешков по бокам тела, которые позволяют им хранить внеклеточную жидкость.Чудовища Чакваллас и Гила, а также босоногие и полосатые гекконы хранят воду в жировой ткани в своих хвостах.
Пустынные черепахи, например, имеют большой мочевой пузырь, который может хранить более 40 процентов массы тела черепахи в воде, мочевине, мочевой кислоте и азотистых отходах в течение нескольких месяцев, пока они не смогут пить. Ураты отделяются от воды и могут удаляться в твердой форме, высвобождая воду и ионы для реабсорбции. Во время длительных засух, когда черепахи неактивны, они могут повторно поглощать минералы из своих панцирей для использования в своих метаболических процессах. У гигантского острова Сан-Эстебан и колючих чакволл на островах в Калифорнийском заливе есть пара боковых лимфатических мешков по бокам тела, которые позволяют им хранить внеклеточную жидкость.Чудовища Чакваллас и Гила, а также босоногие и полосатые гекконы хранят воду в жировой ткани в своих хвостах.
Виды из долины реки Нижний Колорадо в Аризоне и Калифорнии и Гран-Десьерто на северо-западе Соноры имеют ряд специализаций для жизни в рыхлом переносимом ветром песке. Сайдвиндеры развились с необычной формой передвижения, при которой тело касается поверхности только в двух точках, пока оно качается. Плоскохвостая рогатая ящерица и безногая ящерица из Нижней Калифорнии (змееподобная роющая ящерица размером с графитный карандаш, ограниченная небольшой территорией на западном побережье Нижней Калифорнии) утратили собирающие песок наружные ушные отверстия, присутствующие у большинства животных. ящерицы.Некоторые виды, в том числе безногая ящерица, полосатая песчаная змея и лопатоносая змея, имеют маленькие глаза, узкую голову, утопленную нижнюю челюсть и очень гладкую чешую, приспособленную к плаванию и дыханию в рыхлом песке. У бахромчатой ящерицы есть заостренные, похожие на бахрому чешуйки на удлиненных пальцах задних лап, которые обеспечивают сцепление при беге по поверхности дюн. Клиновидная голова, носовые клапаны, кольцеобразные веки, чешуйчатые ушные раковины и тонкая чешуя на теле позволяют этой ящерице спасаться от хищников, ныряя и зарываясь в песок.
Плоскохвостая рогатая ящерица и безногая ящерица из Нижней Калифорнии (змееподобная роющая ящерица размером с графитный карандаш, ограниченная небольшой территорией на западном побережье Нижней Калифорнии) утратили собирающие песок наружные ушные отверстия, присутствующие у большинства животных. ящерицы.Некоторые виды, в том числе безногая ящерица, полосатая песчаная змея и лопатоносая змея, имеют маленькие глаза, узкую голову, утопленную нижнюю челюсть и очень гладкую чешую, приспособленную к плаванию и дыханию в рыхлом песке. У бахромчатой ящерицы есть заостренные, похожие на бахрому чешуйки на удлиненных пальцах задних лап, которые обеспечивают сцепление при беге по поверхности дюн. Клиновидная голова, носовые клапаны, кольцеобразные веки, чешуйчатые ушные раковины и тонкая чешуя на теле позволяют этой ящерице спасаться от хищников, ныряя и зарываясь в песок.
Таким образом, земноводные и рептилии используют различные механизмы не только для выживания в экстремальной жаре и засушливости, но и для выживания в жарких и сухих пустынях. Практически все эти адаптации были унаследованы от тропических предков до позднемиоценового образования пустыни Сонора.
Практически все эти адаптации были унаследованы от тропических предков до позднемиоценового образования пустыни Сонора.
5 Times Evolution Ran in «Reverse»
Взгляните в лицо миксины — слизистого морского животного, похожего на угря, — и миксина не будет смотреть в ответ. Существа почти слепы, ориентируясь по морскому дну в основном с помощью обоняния и осязания.
Теперь, к шоку для биологов, внимательное изучение ископаемой миксины возрастом 300 миллионов лет показывает, что у этих животных когда-то были рабочие глаза, но эволюция их убрала.
Миксина залива в Аквариуме образцов залива в Панацее, Флорида.
Фотография Джоэла Сарторе, National Geographic Photo ArkПожалуйста, соблюдайте авторские права. Несанкционированное использование запрещено.
Открытие бросает вызов представлениям ученых о происхождении глаза. Современные миксины заметно отличаются от своих древних собратьев, и поэтому ученые долгое время считали, что глаза современных незрячих миксин представляют собой своего рода промежуточный этап между примитивными светочувствительными пятнами у многих беспозвоночных и камерами-глазами позвоночных, включая человека. (Читайте «Внутри глаза: самое изысканное творение природы».)
(Читайте «Внутри глаза: самое изысканное творение природы».)
Но когда Сара Гэбботт из Университета Лестера в Великобритании направила электронный микроскоп на ископаемое каменистой рыбы, она обнаружила в ее глазах остатки структур, содержащих пигмент. Эти структуры позволили бы животному различать формы и изображения, сообщают Гэбботт и ее коллеги в августовском выпуске Proceedings of the Royal Society B .
«Я был очень взволнован, увидев, что сами глаза состоят из сотен и сотен этих маленьких шарообразных или эллиптических структур… фрикаделек и сосисок микронного размера», — говорит Гэбботт.
У современных миксин нет этих структур, и вместо этого «у них есть эти странные прозрачные пятна там, где должны быть их глаза».
Удивительно хорошо сохранившаяся ткань сетчатки у древних миксин предполагает «обратный ход» зрения у миксин, явление, известное как регрессивная эволюция. Мы часто думаем об эволюции как о процессе накопления, но в такой же степени это процесс потери. Способности деградируют, когда стоимость становится больше пользы, а глаза, похоже, стоят довольно дорого.
Способности деградируют, когда стоимость становится больше пользы, а глаза, похоже, стоят довольно дорого.
Несколько видов пещерных животных, включая рыб, крабов и саламандр, развили слепоту и ухудшили структуру глаз. В прошлом году исследование пещерных рыб показало, что глаза и визуальная обработка в мозге могут составлять от 5 до 17 процентов от общего потребления энергии животным. Другая работа, опубликованная в том же году, отразила эти результаты, обнаружив, что у молодых мексиканских пещерных рыб, живущих на поверхности, зрение расходует 15 процентов энергии покоя животных.
Ученые впервые зафиксировали защитную стратегию миксины, которая при нападении выделяет слизь из сотен пор на своем теле.
Исследователи продолжают спорить о том, является ли причиной потери зрения потребление энергии или случайные мутации, причем оба процесса, вероятно, работают одновременно. И это не только глаза. Вот еще несколько ярких примеров регрессивной эволюции.
Пингвины стали нелетающими птицами
Предки пингвинов умели летать, но быстро утратили эту способность после исчезновения крупных динозавров.Самый старый известный пингвин, окаменелости которого датируются примерно 60 миллионами лет назад, уже был нелетающим пловцом с короткими крыльями. Современные пингвины сохраняют признаки своих летающих родственников, в том числе кости крыльев, заостренную килевидную грудину для прикрепления мышц крыльев и перья. Потеря полета сделала пингвинов более приспособленными к окружающей среде, потому что это означало, что птицы могли стать больше.
«Я часто считаю [потеря полета] большим прорывом в эволюции пингвинов», — говорит Даниэль Ксепка, палеонтолог позвоночных и биолог-эволюционист из Музея Брюса в Коннектикуте.У нелетающих пингвинов развились более крупные мышцы, чтобы лучше двигаться в воде, более плотные кости, которые добавили силы и уменьшили плавучесть, и более короткие и жесткие крылья для более мощных плавательных движений с меньшим сопротивлением. «Увеличение размеров делает их более эффективными в сохранении тепла, способными к более глубоким и продолжительным погружениям, а также открывает двери для нацеливания на более крупную добычу», — говорит Ксепка.
«Увеличение размеров делает их более эффективными в сохранении тепла, способными к более глубоким и продолжительным погружениям, а также открывает двери для нацеливания на более крупную добычу», — говорит Ксепка.
Смертельная гадюка в пустынном парке Алис-Спрингс в Австралии
Фотография Джейсона Эдвардса, Коллекция изображений Nat GeoПожалуйста, соблюдайте авторские права.Несанкционированное использование запрещено.
Змеи потеряли ноги
Множество фактов свидетельствует о том, что раньше у змей были конечности, хотя исследователи продолжают спорить о том, произошли ли современные змеи от длинноногих предков, которые жили на суше или в море. Совсем недавно в статье 2015 года в журнале Science Advances приводились доводы в пользу наземных норников. Используя подробные компьютерные томограммы, исследователи сравнили трехмерные виртуальные модели внутреннего уха водных, обитающих на поверхности и роющих змей, ящериц и их окаменелых родственников.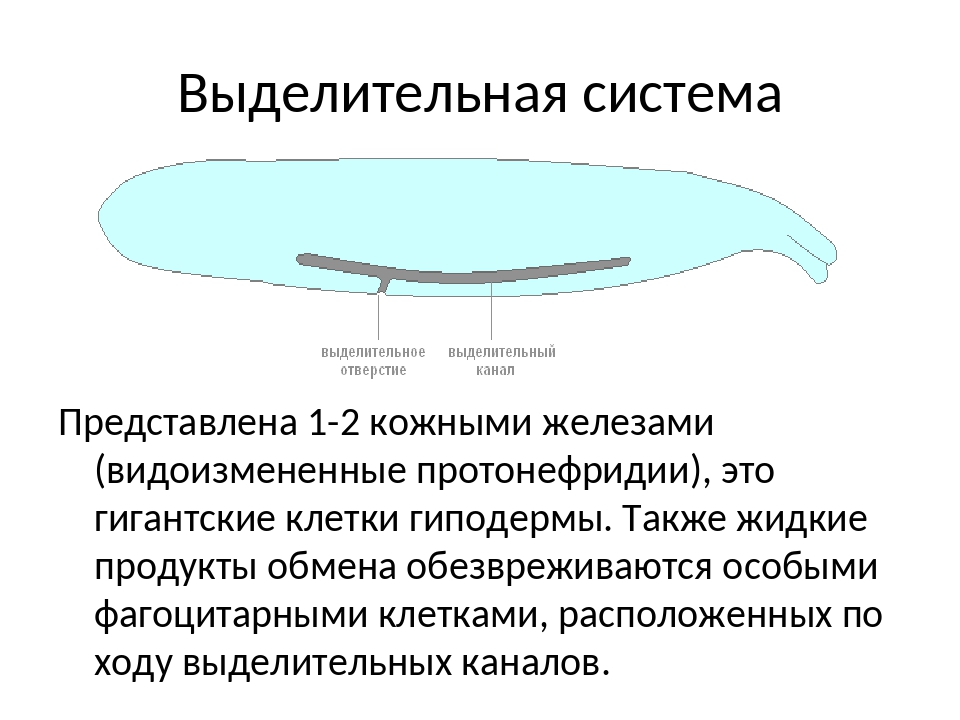 Команда обнаружила у ископаемых животных специальные структуры, похожие на те, которые современные землекопы используют для того, чтобы слышать низкочастотные вибрации земли, издаваемые хищниками и добычей. Данные свидетельствуют о том, что змеи произошли от роющего предка, и их ноги регрессировали, чтобы они могли лучше извиваться в земле.
Команда обнаружила у ископаемых животных специальные структуры, похожие на те, которые современные землекопы используют для того, чтобы слышать низкочастотные вибрации земли, издаваемые хищниками и добычей. Данные свидетельствуют о том, что змеи произошли от роющего предка, и их ноги регрессировали, чтобы они могли лучше извиваться в земле.
Молочайная тля в Колумбусе, штат Огайо
Фотография Дэвида М. Денниса, Animals Animals, Earth Scenes, Nat Geo Image CollectionПожалуйста, соблюдайте авторские права. Несанкционированное использование запрещено.
У тлей беструбчатые приклады
У большинства насекомых есть органы выделения, называемые мальпигиевыми трубочками, которые помогают регулировать задержку воды, выделение азота, детоксикацию и иммунитет — за исключением тли. Хотя выделительная система тли широко не изучена, исследования показывают, что жуки имеют гены, которые кажутся похожими на гены в мальпигиевых канальцах других насекомых. Но по какой-то причине сами трубочки были потеряны для истории эволюции. В качестве возможной причины исследователи указывают на то, что тля питается растительным соком: жидкость, как правило, однородна по составу и состоит из простых молекул, поэтому, возможно, тля просто не нуждается в этих специализированных органах.
В качестве возможной причины исследователи указывают на то, что тля питается растительным соком: жидкость, как правило, однородна по составу и состоит из простых молекул, поэтому, возможно, тля просто не нуждается в этих специализированных органах.
Пожалуйста, соблюдайте авторские права. Несанкционированное использование запрещено.
У птиц больше нет зубов
Птицы произошли от динозавров, а древние виды, такие как Археоптерикс , самое известное связующее звено между динозаврами и птицами, имели такие же длинные зубы и когти. К счастью, даже у самых прожорливых современных птиц-хищников нет зубов, хотя ученые не совсем уверены, почему птицы лишились зубов.Одна теория гласит, что зубы стали меньше и в конечном итоге уступили место клювам, чтобы уменьшить вес для полета. Но исследование 2014 года в Science опровергает эту теорию, обнаружив, что потеря зубов и раннее формирование клюва произошли примерно в одно и то же время.
Независимо от того, почему птицы потеряли свои зубы, несколько направлений исследований показывают, что для переключения не потребовалось значительных генетических изменений. В статье, опубликованной в прошлом году в журнале Evolution , исследователи смогли настроить куриные эмбрионы и придать им более зубастые, гораздо более похожие на динозавров лица всего лишь с несколькими изменениями в экспрессии генов.
Д-р Д. Р. Джонсон, Центр биологии человека В процессе эволюции мы довольно часто обнаруживаем, что структуры
эволюционировали, чтобы делать что-то одно, больше не актуальны. Аппендикс
хороший пример: полезен для животных, питающихся травой.
никакой функции в человеке, стало мало и может в конце концов исчезнуть.
В других случаях эти реликтовые органы могут быть изъяты на довольно продолжительное время. Эта структура, клубочек, почечный каналец (по существу
пространство), а проток, проходящий кзади, образовал основу
почки с тех пор. я говорю почки не потому что у нас их две
из них, а потому, что в истории позвоночных
три пары почек.Самым примитивным из них был передний,
следующий более задний и последний самый задний. Они есть
называется пронефрос , мезонефрос и метанефрос .
Репродуктивная система и ее протоки. Репродуктивная система У женщин дела обстоят несколько иначе. |

 другая цель.Это касается выделительной и репродуктивной
системы, которые анатомически и эволюционно связаны, и где
части выделительной системы были заменены репродуктивной
система.
другая цель.Это касается выделительной и репродуктивной
системы, которые анатомически и эволюционно связаны, и где
части выделительной системы были заменены репродуктивной
система.  Открытый план
Целом развился примерно в то же время, что и кровеносная система,
и это стало вовлеченным. Дорсальная аорта проходила близко к нефротому.
и образовал узел капилляров, клубочек, связанный с
каждого нефротома. Наконец, реснитчатый проток к целому был
потерял
Открытый план
Целом развился примерно в то же время, что и кровеносная система,
и это стало вовлеченным. Дорсальная аорта проходила близко к нефротому.
и образовал узел капилляров, клубочек, связанный с
каждого нефротома. Наконец, реснитчатый проток к целому был
потерял 
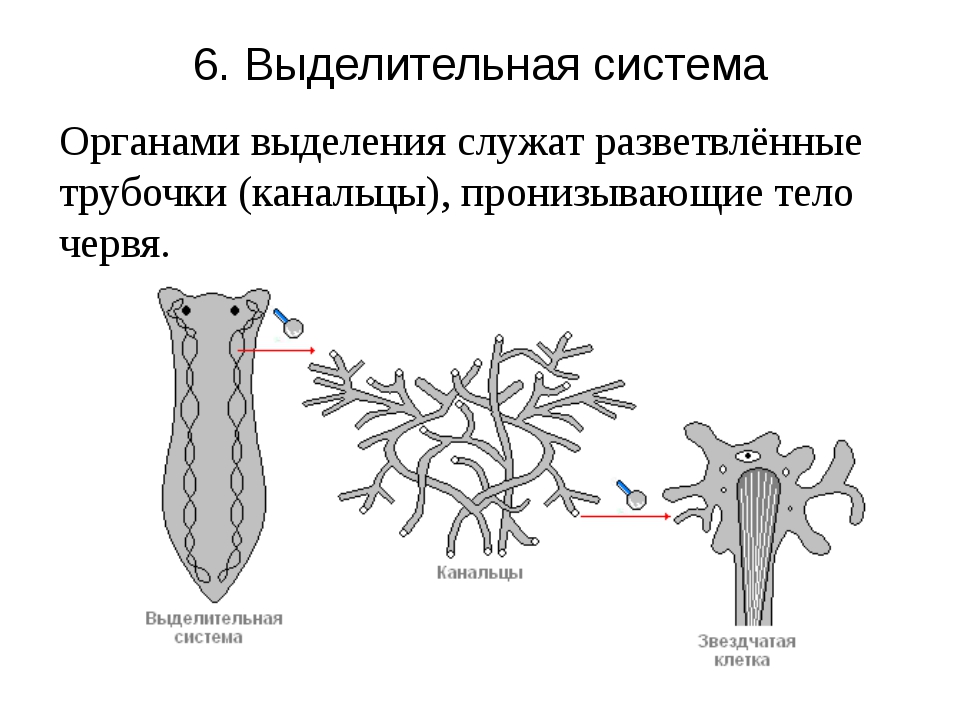
 Тестостерон влияет на развитие протоков.С тестостероном мезонефральный проток развивается, чтобы стать
семявыводящие протоки и связанные с ними структуры; без него мезонефрический
проток атрофируется и парамезонефральный проток становится яйцеводом
и большую часть матки. У некоторых людей ткани не могут
реагировать на тестостерон. Давайте посмотрим на развивающегося самца
и женской репродуктивной системы. В мужчине безразличие
гонады реагируют на действие Y-хромосомы, развивая
шнуры яичка, которые приобретают подковообразную форму и заключены внутри
утолщение белочной оболочки половых желез.Свободные концы
подковы находятся в контакте с избыточным мезонефрическим
канал. Парамезонефральный проток развивается в ответ на плацентарный проток.
и материнские гормоны, но не используется и позже регрессирует. Маленький
позже мы находим, что мезонефральный проток продолжает развиваться
образует придаток яичка, семявыносящий проток и семявыносящий проток.
Тестостерон влияет на развитие протоков.С тестостероном мезонефральный проток развивается, чтобы стать
семявыводящие протоки и связанные с ними структуры; без него мезонефрический
проток атрофируется и парамезонефральный проток становится яйцеводом
и большую часть матки. У некоторых людей ткани не могут
реагировать на тестостерон. Давайте посмотрим на развивающегося самца
и женской репродуктивной системы. В мужчине безразличие
гонады реагируют на действие Y-хромосомы, развивая
шнуры яичка, которые приобретают подковообразную форму и заключены внутри
утолщение белочной оболочки половых желез.Свободные концы
подковы находятся в контакте с избыточным мезонефрическим
канал. Парамезонефральный проток развивается в ответ на плацентарный проток.
и материнские гормоны, но не используется и позже регрессирует. Маленький
позже мы находим, что мезонефральный проток продолжает развиваться
образует придаток яичка, семявыносящий проток и семявыносящий проток. везикулы. Парамезонефральный проток регрессировал, чтобы быть представленным
только червеобразным отростком яичка проксимально и предстательной железой,
небольшой дивертикул в предстательной железе дистально.
везикулы. Парамезонефральный проток регрессировал, чтобы быть представленным
только червеобразным отростком яичка проксимально и предстательной железой,
небольшой дивертикул в предстательной железе дистально.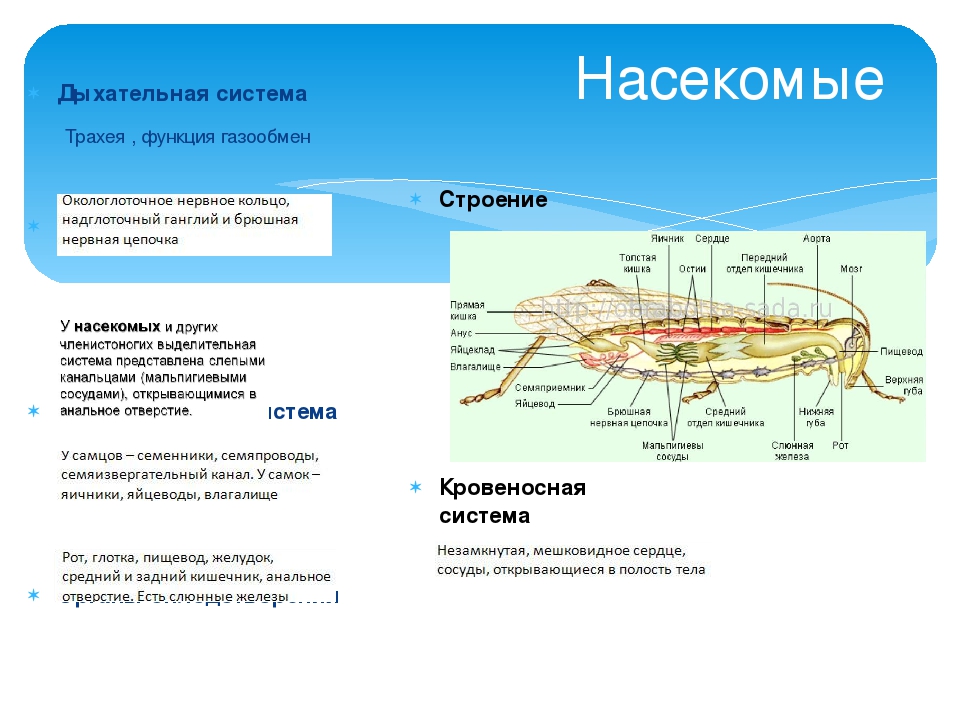 То
медуллярные тяжи (семенниковые тяжи у мужчин) дегенерируют
потому что Y-хромосомы нет. Они замещаются эпителиальными
вдавления оболочки развивающегося яичника, которые разрываются
до образования фолликулов.
То
медуллярные тяжи (семенниковые тяжи у мужчин) дегенерируют
потому что Y-хромосомы нет. Они замещаются эпителиальными
вдавления оболочки развивающегося яичника, которые разрываются
до образования фолликулов.