Це … Ци
Цезий азотнокислый … Циннамальдегид Цезий нитратCsNO3
CAS: 7789-18-6
- Молекулярная масса: 194,91
- Плотность: 3,68 г/см3 (20°C)
- Насыпная плотность: ~ 1500 кг/м3
- Растворимость в воде: 150 г/л (20°C)
- Температура плавления: 414°C
Цезий азотнокислый
| Содержание основного вещества | >= 99% |
| Производство | MERCK |
| Артикул | Номер по кат. | Фасовка |
|---|---|---|
| 7-01169 | 1028561000 | 1 кг |
| 7-30470 | 1028560025 | 25 г |
Цезий гидроксид моногидрат (синоним) → Цезий гидроокись 1-водный
Цезий гидроксид моногидратCsOH*H2O
CAS: 35103-79-8
- Молекулярная масса: 167,93
- Плотность: 3,68 г/см
- Температура плавления: 272°C
Цезий гидроокись 1-водный
, +95,0%| Содержание основного вещества | >= 95,0% |
| Производство | Fluka |
| Артикул | Номер по кат.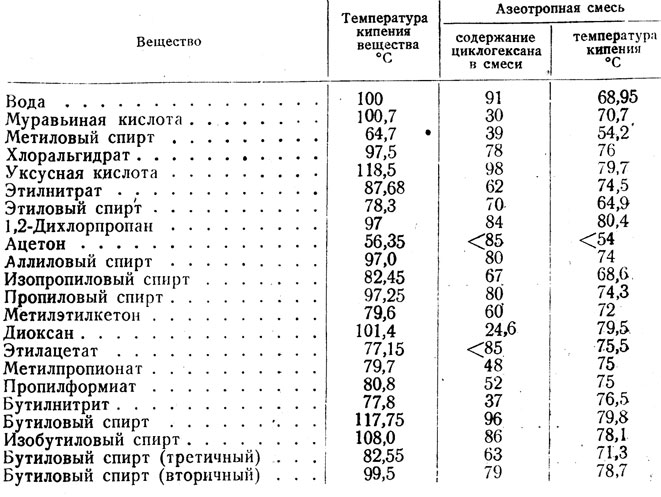 | Фасовка |
|---|---|---|
| 7-13360 | 21000-50G-F | 0,05 кг |
| 7-13370 | 21000-250G-F | 0,25 кг |
Цезий нитрат (синоним) → Цезий азотнокислый
Цезий хлорид (синоним) → Цезий хлористый
Цезий хлоридCsCl
CAS: 7647-17-8
- Молекулярная масса: 168,36
- Плотность: 3,97 г/см3 (20°C)
- Насыпная плотность: ~ 1800 кг/м3
- Растворимость в воде: 1860 г/л (20°C)
- Температура плавления: 646°C
- Температура кипения: 1382°C
Цезий хлористый
для анализа| Содержание основного вещества | >= 99,5% |
| Производство | MERCK |
| Артикул | Номер по кат. | Фасовка |
|---|---|---|
| 7-51275 | 1020380100 | 0,1 кг |
| 7-51277 | 1020380025 | 25 г |
Церий (III) нитрат гексагидрат (синоним) → Церий (III) азотнокислый 6-водный
Церий (IV) оксид (синоним) → Церий (IV) окись
Церий (IV) сульфат тетрагидрат (синоним) → Церий (IV) сернокислый 4-водный
Церий (III) нитрат гексагидратCe(NO3)3*6H2O
CAS: 10294-41-4
- Молекулярная масса: 434,23
- Насыпная плотность: 1050 кг/м3
- Растворимость в воде: 1754 г/л (25°C)
Церий (III) азотнокислый 6-водный
особо чистый| Содержание основного вещества | >= 98,5% |
| Производство | MERCK |
| Артикул | Номер по кат.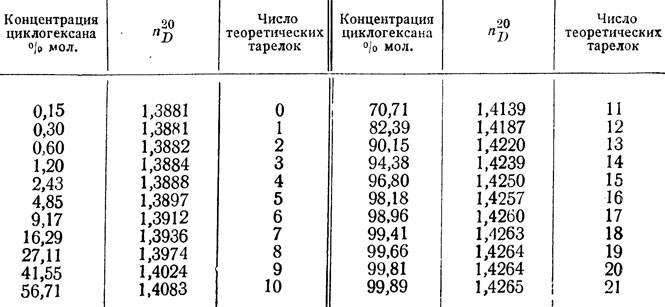 | Фасовка |
|---|---|---|
| 7-01557 | 1022710100 | 0,1 кг |
CeO2
CAS: 1306-38-3
- Молекулярная масса: 172,12
- Плотность: 7,3 г/см3 (20°C)
- Насыпная плотность: 1280 кг/м3
- Растворимость в воде: нерастворима
- Температура плавления: 2000°C
Церий (IV) окись
1…3 мм для элементного анализа| Производство | MERCK |
| Артикул | Номер по кат. | Фасовка |
|---|---|---|
| 7-01558 | 1022630100 | 0,1 кг |
Ce(SO4) 2*4H2O
CAS: 10294-42-5
- Молекулярная масса: 404,3
- Плотность: 5,02 г/см3 (20°C)
- Насыпная плотность: ~ 650…850 кг/м3
- Растворимость в воде: 38 г/л (50°C)
- Температура плавления: 180.
 ..200°C (с выделением кристаллизационной воды)
..200°C (с выделением кристаллизационной воды)
Церий (IV) сернокислый 4-водный
для анализа| Содержание основного вещества | >= 98,0% |
| Производство | MERCK |
| Артикул | Номер по кат. | Фасовка |
|---|---|---|
| 7-51281 | 1022740100 | 0,1 кг |
| 7-01172 | 1022740250 | 0,25 кг |
| 7-01171 | 1022740025 | 25 г |
Цетавлон (синоним) → Цетилтриметиламмоний бромистый
Цетан (синоним) → Гексадекан
Гексадецилтриметиламмоний бромид
Триметилгексадециламмоний бромистый
Цетавлон
C19H42BrN
CAS: 57-09-0
- Молекулярная масса: 364,46
- Насыпная плотность: ~ 390 кг/м3
- Растворимость в воде: 3 г/л (20°C)
- Температура плавления: 237.
 ..243°C
..243°C
Цетилтриметиламмоний бромистый
для анализа| Содержание основного вещества | >= 99,0% |
| Производство | MERCK |
| Артикул | Номер по кат. | Фасовка |
|---|---|---|
| 7-16650 | 1023420100 | 0,1 кг |
| 7-01174 | 1023421000 | 1 кг |
Цетилтриметиламмоний бромистый
для синтеза| Содержание основного вещества | >= 97% |
| Производство | MERCK |
| Артикул | Номер по кат. | Фасовка |
|---|---|---|
| 7-18900 | 8141190100 | 0,1 кг |
| 7-01175 | 8141190500 | 0,5 кг |
Цианобензол (синоним) → Бензонитрил
1-Цианогуанидин (синоним) → Дицианодиамид
Цианометан (синоним) → Ацетонитрил
Циануровой кислоты триамид (синоним) → 2,4,6-Триамино-1,3,5-триазин
Гексагидробензол
Гексаметилен
C6H12
CAS: 110-82-7
- Молекулярная масса: 84,16
- Плотность: 0,78 г/см3 (20°C)
- Растворимость в воде: 55 мг/л (20°C)
- Температура плавления: 6°C
- Температура кипения: 81°C
- Класс опасности: 4
Циклогексан
LiChrosolv® для ЖХ| Содержание основного вещества | >= 99,9% |
| Производство | MERCK |
| Артикул | Номер по кат. | Фасовка |
|---|---|---|
| 7-30650 | 1028271000 | 1 л |
| 7-01178 | 1028272500 | 2,5 л |
Циклогексан
для анализа| Содержание основного вещества | >= 99,5% |
| Производство | MERCK |
| Артикул | Номер по кат. | Фасовка |
|---|---|---|
| 7-30615 | 1096661000 | 1 л |
| 7-30610 | 1096662500 | 2,5 л |
Циклогексан
для хроматографии| Содержание основного вещества | 99,7% |
| ТУ | 6-09-4357-77 |
| Срок хранения | 3 года |
| Производство | Россия |
| Артикул | Фасовка | |
|---|---|---|
| 2-45721 | 3 мл |
Циклогексан
особо чистый| Содержание основного вещества | >= 99,0% |
| Производство | MERCK |
| Артикул | Номер по кат. | Фасовка |
|---|---|---|
| 7-51295 | 1028321000 | 1 л |
| 7-01179 | 1028322500 | 2,5 л |
Циклогексан
ЧДА| Содержание основного вещества | >= 99,7% |
| ТУ | 2631-029-44493179-99 с изм.1 |
| Срок хранения | 2 года |
| Производство | Россия |
| Артикул | Фасовка | |
|---|---|---|
| 7-51290 | 0,8 кг |
Дигидрорезорцинол
C
CAS: 504-02-9
- Молекулярная масса: 112,13
- Растворимость в воде: растворим
- Температура плавления: 100…103°C
1,3-Циклогександион
для синтеза| Содержание основного вещества | >= 98% |
| Производство | MERCK |
| Артикул | Номер по кат. | Фасовка |
|---|---|---|
| 7-13690 | 8203670100 | 0,1 кг |
| 7-13680 | 8203670025 | 25 г |
Гексагидрофенол
Гексалин
Циклогексиловый спирт
C6H10O
CAS: 108-93-0
- Молекулярная масса: 100,16
- Плотность: 0,9684 г/см3 (25°C)
- Растворимость в воде: малорастворим
- Температура плавления: 25,15°C
- Температура кипения: 161,1°C
- Показатель преломления: 1,4641 (20°C)
Циклогексанол
для синтеза| Содержание основного вещества | >= 99% |
| Производство | MERCK |
| Артикул | Номер по кат. | Фасовка |
|---|---|---|
| 7-30660 | 8223280100 | 0,1 л |
| 7-01181 | 8223281000 | 1 л |
| 7-01182 | 8223282500 | 2,5 л |
Анон
Кетогексаметилен
Пимелинкетон
Пимеловый кетон
Циклогексилкетон
C6H10O
CAS: 108-94-1
- Молекулярная масса: 98,15
- Плотность: 0,95 г/см3 (20°C)
- Растворимость в воде: ~ 90 г/л (20°C)
- Температура плавления: -31°C
- Температура кипения: ~ 155°C
- Показатель преломления: 1,4507 (20°C)
Циклогексанон
особо чистый| Содержание основного вещества | >= 99,0% |
| Производство | MERCK |
| Артикул | Номер по кат. | Фасовка |
|---|---|---|
| 7-30680 | 1028881000 | 1 л |
| 7-30690 | 1028882500 | 2,5 л |
Циклогексанон
для хроматографии ХЧ| Содержание основного вещества | >= 99,9% |
| ТУ | 2633-012-44493179-99 |
| Срок хранения | 3 года |
| Производство | Россия |
| Артикул | Фасовка | |
|---|---|---|
| 7-45758 | 3 мл |
бис-(Циклогексанон)оксалилдигидразон (синоним) → Купризон
Циклогексатриен (синоним) → Бензол
C6H10
CAS: 110-83-8
- Молекулярная масса: 82,14
- Плотность: 0,811 г/см3 (25°C)
- Растворимость в воде: нерастворим
- Температура плавления: 104°C
Циклогексен
, +99,0%| Производство | Sigma-Aldrich |
| Артикул | Номер по кат. | Фасовка |
|---|---|---|
| 7-68999 | 29240-1L | 1 л |
Циклогексен
для синтеза| Содержание основного вещества | >= 99% |
| Производство | MERCK |
| Артикул | Номер по кат. | Фасовка |
|---|---|---|
| 7-30730 | 8028240100 | 0,1 л |
| 7-30740 | 8028240500 | 0,5 л |
| 7-01183 | 8028241000 | 1 л |
| 7-01184 | 8028242500 | 2,5 л |
CHES
C8H17NO3S
CAS: 103-47-9
- Молекулярная масса: 207,29
2-(Циклогексиламино)этансульфокислота
| Содержание основного вещества | >= 99% |
| Производство | MERCK |
| Артикул | Номер по кат. | Фасовка |
|---|---|---|
| 7-01186 | 1152290250 | 0,25 кг |
| 7-14310 | 1152290025 | 25 г |
N-Циклогексилдиметиламин (синоним) → N,N-Диметилциклогексиламин
Циклогексилкетон (синоним) → Циклогексанон
Циклогексилметан (синоним) → Метилциклогексан
Циклогексиловый спирт (синоним) → Циклогексанол
C7H14
CAS: 291-64-5
- Молекулярная масса: 98,19
- Плотность: 0,811 г/см3 (25°C)
- Температура плавления: -12°C
- Температура кипения: 118,5°C
Циклогептан
, 98%| Содержание основного вещества | 98% |
| Производство | Aldrich |
| Артикул | Номер по кат. | Фасовка |
|---|---|---|
| 7-14752 | C98403-5G | 5 г |
Пентаметилен
C5H10
CAS: 287-92-3
- Молекулярная масса: 70,14
- Плотность: 0,755 г/см3 (20°C)
- Растворимость в воде: нерастворим
- Температура плавления: -93,3°C
- Температура кипения: 49°C
- Показатель преломления: 1,4067 (20°C)
Циклопентан
для синтеза| Содержание основного вещества | >= 99% |
| Производство | MERCK |
| Артикул | Номер по кат. | Фасовка |
|---|---|---|
| 7-01188 | 8187690250 | 0,25 л |
| 7-30743 | 8187691000 | 1 л |
C5H10O
CAS: 96-41-3
- Молекулярная масса: 86,13
- Плотность: 0,95 г/см3 (20°C)
- Растворимость в воде: малорастворим (20°C)
- Температура плавления: -19°C
- Температура кипения: 141°C
Циклопентанол
для синтеза| Содержание основного вещества | >= 99% |
| Производство | MERCK |
| Артикул | Номер по кат. | Фасовка |
|---|---|---|
| 7-30780 | 8026690100 | 0,1 л |
Циклопентил меркаптан
C5H9SH
CAS: 1679-07-8
- Молекулярная масса: 102,2
- Плотность: 0,955 г/см3 (25C)
- Температура кипения: 129…131°С
Циклопентантиол
, 97%| Содержание основного вещества | 97% |
| Производство | Aldrich |
| Артикул | Номер по кат. | Фасовка |
|---|---|---|
| 7-00172 | 319708-25G | 25 г |
Циклопентил меркаптан (синоним) → Циклопентантиол
ZnCAS: 7440-66-6
- Молекулярная масса: 65,37
- Плотность: 7,14 г/см3 (20°C)
- Насыпная плотность: 1800…2700 кг/м3
- Растворимость в воде: нерастворим
- Температура плавления: 420°C
- Температура кипения: 908°C
- Класс опасности: 2
Цинк
, гранулы 3…8 мм, для анализа| Содержание основного вещества | >= 99,9% |
| Производство | MERCK |
| Артикул | Номер по кат. | Фасовка |
|---|---|---|
| 7-30800 | 1087800500 | 0,5 кг |
| 7-30810 | 1087801000 | 1 кг |
Цинк
, крупнозернистый порошок, для анализа| Содержание основного вещества | >= 99,9% |
| Производство | MERCK |
| Артикул | Номер по кат. | Фасовка |
|---|---|---|
| 7-30820 | 1087560250 | 0,25 кг |
| 7-01189 | 1087561000 | 1 кг |
Цинк
, порошок, для анализа| Содержание основного вещества | >= 95% |
| Производство | MERCK |
| Артикул | Номер по кат. | Фасовка |
|---|---|---|
| 7-51335 | 1087890500 | 0,5 кг |
| 7-30850 | 1087891000 | 1 кг |
Zn(NO3)2*6H2O
CAS: 10196-18-6
- Молекулярная масса: 297,49
- Плотность: 2,065 г/см3
- Температура плавления: 36°C
Цинк азотнокислый 6-водный
, +99,0%| Содержание основного вещества | >= 99,0% |
| Производство | Sigma-Aldrich |
| Артикул | Номер по кат. | Фасовка |
|---|---|---|
| 7-79632 | 96482-500G | 0,5 кг |
Цинк ацетат дигидрат (синоним) → Цинк уксуснокислый 2-водный
Цинк бромид (синоним) → Цинк бромистый
Цинк бромидZnBr2
CAS: 7699-45-8
- Молекулярная масса: 225,19
- Плотность: 4,201 г/см3 (20°C)
- Растворимость в воде: растворим
- Температура плавления: 394°C
- Температура кипения: 650°C
Цинк бромистый
для синтеза| Содержание основного вещества | >= 98% |
| Производство | MERCK |
| Артикул | Номер по кат. | Фасовка |
|---|---|---|
| 7-01192 | 8186310250 | 0,25 кг |
| 7-51305 | 8186311000 | 1 кг |
| 7-01191 | 8186310005 | 5 г |
Цинк гидроксикарбонат (синоним) → Цинк углекислый основной
Цинк нитрат гексагидрат (синоним) → Цинк азотнокислый 6-водный
Цинк оксидZnO
CAS: 1314-13-2
- Молекулярная масса: 81,37
- Плотность: 5,61 г/см3 (20°C)
- Насыпная плотность: ~ 200.
 ..700 кг/м3
..700 кг/м3 - Растворимость в воде: 0,0016 г/л (29°C)
- Температура плавления: 1975°C
- Класс опасности: 2
Цинк окись
для анализа| Содержание основного вещества | >= 99,0% |
| Производство | MERCK |
| Артикул | Номер по кат. | Фасовка |
|---|---|---|
| 7-00142 | 1088490500 | 0,5 кг |
| 7-30815 | 1088491000 | 1 кг |
Цинк оксид (синоним) → Цинк окись
Цинк сульфат гептагидратZnSO4*7H2O
CAS: 7446-20-0
- Молекулярная масса: 287,54
- Плотность: 1,97 г/см3 (20°C)
- Насыпная плотность: ~ 800…1000 кг/м3
- Растворимость в воде: 965 г/л (20°C)
- Температура плавления: 100°C
Цинк сернокислый 7-водный
для анализа| Содержание основного вещества | 99,5. ..103,0% ..103,0% |
| Производство | MERCK |
| Артикул | Номер по кат. | Фасовка |
|---|---|---|
| 7-51425 | 1088830500 | 0,5 кг |
| 7-30880 | 1088831000 | 1 кг |
| 7-01193 | 1088835000 | 5 кг |
Цинк сернокислый 7-водный
Ч| Содержание основного вещества | >= 98,0% |
| ГОСТ | 4174-77 |
| Срок хранения | 1 год |
| Производство | Россия |
| Артикул | Фасовка | |
|---|---|---|
| 7-51410 | 0,9 кг |
Цинк сульфат гептагидрат (синоним) → Цинк сернокислый 7-водный
Цинк гидроксикарбонат[ZnCO3]2*[Zn(OH)2]3
CAS: 5263-02-5
- Плотность: 3,5 г/см3 (20°C)
- Насыпная плотность: 350.
 ..450 кг/м3
..450 кг/м3 - Растворимость в воде: нерастворим (20°C)
- Температура плавления: ~ 1970°C
Цинк углекислый основной
чистый| Содержание основного вещества | >= 58,0% |
| Производство | MERCK |
| Артикул | Номер по кат. | Фасовка |
|---|---|---|
| 7-01561 | 1088089029 | 25 кг |
Цинк ацетат дигидрат
C4H6O4Zn*2H2O
CAS: 5970-45-6
- Молекулярная масса: 219,49
- Плотность: 1,74 г/см3 (20°C)
- Насыпная плотность: ~ 900 кг/м3
- Растворимость в воде: 430 г/л (20°C)
- Температура плавления: 237°C
Цинк уксуснокислый 2-водный
для анализа| Содержание основного вещества | >= 99,5% |
| Производство | MERCK |
| Артикул | Номер по кат.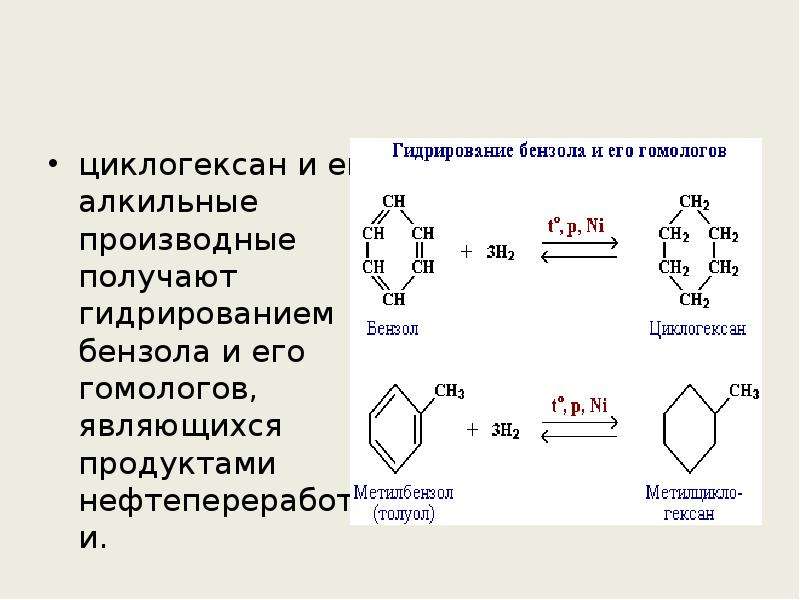 | Фасовка |
|---|---|---|
| 7-51452 | 1088020250 | 0,25 кг |
| 7-51453 | 1088021000 | 1 кг |
Цинк уксуснокислый 2-водный
особо чистый| Содержание основного вещества | 99,0…101,0% |
| Производство | MERCK |
| Артикул | Номер по кат. | Фасовка |
|---|---|---|
| 7-30910 | 1088001000 | 1 кг |
Цинк хлорид (синоним) → Цинк хлористый
Цинк хлоридZnCl2
CAS: 7646-85-7
- Молекулярная масса: 136,28
- Плотность: 2,91 г/см3 (25°C)
- Насыпная плотность: ~ 1400…1800 кг/м3
- Растворимость в воде: 4320 г/л (25°C)
- Температура плавления: 283°C
- Температура кипения: 732°C
Цинк хлористый
для анализа| Содержание основного вещества | 98,0.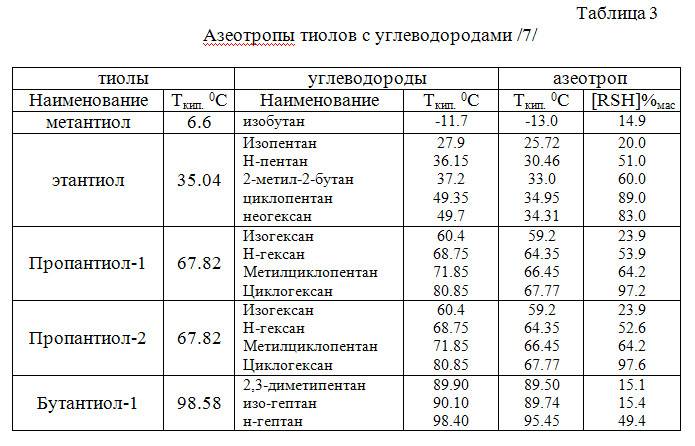 ..100,5% ..100,5% |
| Производство | MERCK |
| Артикул | Номер по кат. | Фасовка |
|---|---|---|
| 7-51455 | 1088160250 | 0,25 кг |
| 7-51459 | 1088161000 | 1 кг |
Цинк хлористый
Ч| Содержание основного вещества | >= 98,0% |
| ГОСТ | 4529-78 |
| Срок хранения | 1 год |
| Производство | Россия |
| Артикул | Фасовка | |
|---|---|---|
| 7-51460 | 0,5 кг |
Циннамальдегид (синоним) → Коричный альдегид
Свойства циклоалканов
Свойства циклоалканов
Физические свойства циклоалканов закономерно изменяются с ростом их молекулярной массы. Пpи ноpмальных условиях циклопpопан и циклобутан – газы, циклоалканы С5 – С16 – жидкости, начиная с С17, – твердые вещества. Температуры кипения циклоалканов выше, чем у соответвующих алканов. Это связано с более плотной упаковкой и более сильными межмолекулярными взаимодействиями циклических структур. Циклоалканы практически не растворимы в воде, но хорошо растворяются в органических растворителях.
Химические свойства циклоалканов в основном сходны со свойствами алканов. Однако, для некоторых представителей есть существенные различия, которые обусловлены размерами цикла.
Температуры кипения циклоалканов выше, чем у соответвующих алканов. Это связано с более плотной упаковкой и более сильными межмолекулярными взаимодействиями циклических структур. Циклоалканы практически не растворимы в воде, но хорошо растворяются в органических растворителях.
Химические свойства циклоалканов в основном сходны со свойствами алканов. Однако, для некоторых представителей есть существенные различия, которые обусловлены размерами цикла.- Трех- и четырехчленные циклы (малые циклы), являясь насыщенными, тем не менее, резко отличаются от всех остальных предельных углеводородов. Валентные углы С–С–С в циклопропане и циклобутане значительно меньше нормального тетраэдрического угла 109°28’, свойственного sp3-гибридизованному атому углерода. Например, отклонение от нормального валентного угла в циклопропане составляет 49°28′, что вызывает в цикле большое угловое напряжение α.
Зависимость устойчивости циклов от их размера Неустойчивость малых циклов определяет их стремление к раскрытию под действием реагентов.
 Поэтому циклопропан, циклобутан и их производные вступают в реакции присоединения, проявляя характер ненасыщенных соединений. Легкость реакций присоединения уменьшается с уменьшением напряженности цикла в ряду:
Поэтому циклопропан, циклобутан и их производные вступают в реакции присоединения, проявляя характер ненасыщенных соединений. Легкость реакций присоединения уменьшается с уменьшением напряженности цикла в ряду:циклопропан > циклобутан > > циклопентан.
- Циклы, содержащие 5 и более атомов углерода, существуют в неплоских формах, лишенных углового напряжения (ненапряженные или нормальные циклы). Типичным их представителем является наиболее устойчивый 6-членный цикл (циклогексан и его производные). Для ненапряженных циклов характерны реакции замещения, в которых сохраняется циклическая структура.
 д.
д.
Реакции малых циклов (С3, С4)
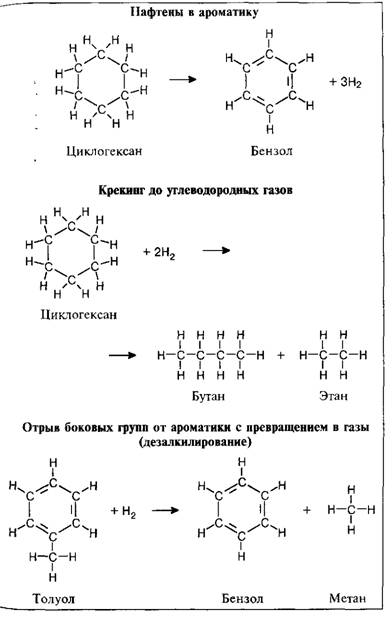
1. Гидрирование (присоединение водорода):
1. Галогенирование (замещение водорода на галоген)
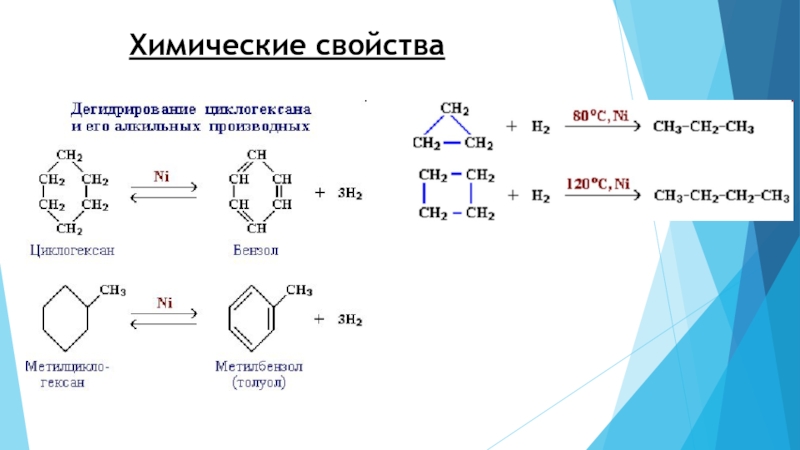
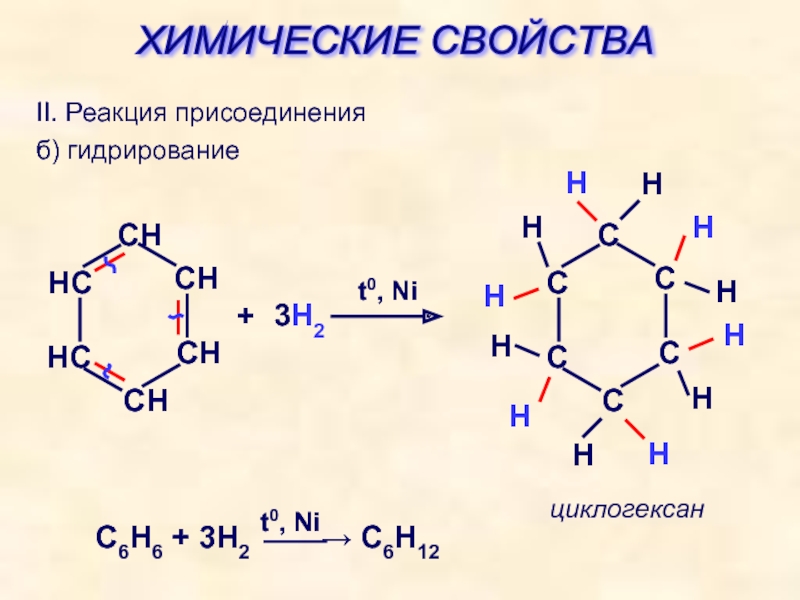
2. Дегидрирование (отщепление водорода)
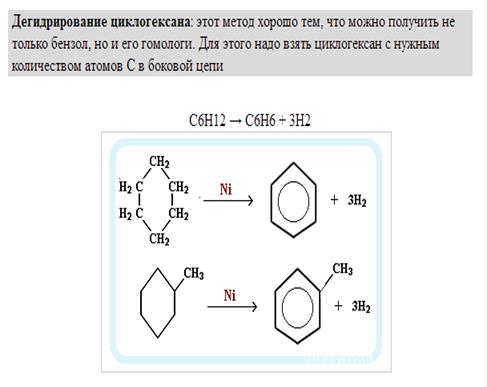
Дегидрирование циклогексана и его гомологов лежит в основе процесса ароматизации (риформинга Риформинг – промышленный процесс переработки бензиновых и лигроиновых фракций нефти с целью получения высококачественных бензинов и аромати-ческих углеводородов. ) нефтепродуктов.
) нефтепродуктов.Реакция с другими циклоалканами (C5, C7 и т.д.) приводит к образованию циклоалкенов.
Окисление циклоалканов
При обычной температуре циклоалканы устойчивы к действию окислителей (например, не обесцвечивают раствор KMnO4 – в этом их отличие от изомерных алкенов). При контакте с открытым пламенем горят, то есть окисляются полностью, выделяя большое количество тепла:
Газообразные и низкокипящие циклоалканы образуют
с кислородом или воздухом взрывоопасные смеси.
Практическое значение имеют реакции направленного окисления циклогексана. В зависимости от условий при этом получают ряд ценных продуктов. При окислении без разрыва связей С–С получают циклические продукты (спирт и кетон):
Циклогексанон применяется для производства
капролактама и синтетического волокна капрон.
 Окислением циклогексана 50-70% азотной кислотой при температуре 100-200°C и давлении до 20 атм. в промышленности получают адипиновую кислоту HOOC–(CH2)4–COOH, которая используется в производстве синтетического волокна найлон.
Окислением циклогексана 50-70% азотной кислотой при температуре 100-200°C и давлении до 20 атм. в промышленности получают адипиновую кислоту HOOC–(CH2)4–COOH, которая используется в производстве синтетического волокна найлон.
Разработка сибирских ученых позволит значительно удешевить производство синтетических тканей
Сотрудники Института неорганической химии им. А. В. Николаева СО РАН создали пористые металлорганические каркасы (МОК) для эффективного разделения бензола и циклогексана. Их применение в промышленности позволит сделать многие технологические процессы (в частности, производство пластмасс и синтетических тканей) в разы дешевле и экологичнее. Результаты работы опубликованы в Chemical Communication.
«В экономически развитых страх около трети всей производимой энергии расходуется в промышленности, а примерно половина из этой трети тратится на процессы разделения сложных химических смесей: например, при переработке нефти и природного газа», — рассказывает главный научный сотрудник ИНХ СО РАН, заведующий кафедрой неорганической химии Новосибирского государственного университета член-корреспондент РАН Владимир Петрович Федин.
Один из многотоннажных процессов промышленности — разделение бензола и циклогексана, добываемых из нефти и газа. Циклогексан, модифицированный по длительной химической цепочке, служит основой для изготовления пластмасс, нейлона и других синтетических волокон. В мире производится более пяти миллионов тонн циклогексана в год, а его рынок оценивается в 15 миллиардов долларов.
«Схема такая: сначала делается бензол, а потом уже его превращают в циклогексан. При этом бензол в небольших количествах остается и его нужно обязательно отделять, — отмечает исследователь. — Проблема в том, что у этих веществ очень близкие свойства, они имеют практически одинаковую температуру кипения (80,1 °C для бензола и 80,7 °C для циклогексана). Это означает: если вы хотите разделить их при помощи перегонки, то нужно строить большие ректификационные колонны, тратить огромное количество энергии, что сейчас и происходит в промышленности».
Метод новосибирских ученых позволяет разделять бензол и циклогексан в мягких условиях: при комнатной температуре, практически не потребляя энергию. Это возможно за счет применения синтетических металлорганических каркасов, разработанных сотрудниками лаборатории металлорганических координационных полимеров ИНХ СО РАН на основе легкодоступной терефталевой кислоты и ее производных. МОК имеют большие полости в структуре, соединенные окнами определенного диаметра, они похожи на губку: могут пропускать одни молекулы, блокируя другие. Сотрудникам ИНХ СО РАН удалось настроить МОК так, что они хорошо сорбируют бензол и не сорбируют циклогексан — и для этого не нужны ни нагревание, ни ректификационные колонны. Металлорганические каркасы обладают огромным преимуществом по сравнению с другими материалами, поскольку их можно легко модифицировать и настроить под конкретную задачу.
Это возможно за счет применения синтетических металлорганических каркасов, разработанных сотрудниками лаборатории металлорганических координационных полимеров ИНХ СО РАН на основе легкодоступной терефталевой кислоты и ее производных. МОК имеют большие полости в структуре, соединенные окнами определенного диаметра, они похожи на губку: могут пропускать одни молекулы, блокируя другие. Сотрудникам ИНХ СО РАН удалось настроить МОК так, что они хорошо сорбируют бензол и не сорбируют циклогексан — и для этого не нужны ни нагревание, ни ректификационные колонны. Металлорганические каркасы обладают огромным преимуществом по сравнению с другими материалами, поскольку их можно легко модифицировать и настроить под конкретную задачу.
МОК показали свою эффективность в стенах института, и ученые надеются, что найдутся инвесторы, готовые применить их на практике, предварительно вложившись в доработку технологии.
«Нам удалось показать, что наши металлорганические каркасы обладают рекордно высокими значениями по разделению бензола и циклогексана, которые не достигнуты ни на каких других материалах», — говорит Владимир Федин.
«Наука в Сибири»
Циклогексан жидкости — Энциклопедия по машиностроению XXL
Выбор жидкой диэлектрической среды, в которую погружается образец, имеет важное значение. Требуется иметь достаточно точные данные о значениях и tg б . Поскольку диэлектрическая проницаемость Е] неполярных жидкостей снижается с повышением температуры, необходимо в расчетные формулы подставлять значение е , соответствующее температуре в момент измерения, пользуясь температурной зависимостью е (рис. 4-15). Необходимо также соблюдение условия Так, например, при испытаниях полиэтилена = 2,3) по указанным соображениям используют хроматографический безводный бензол (вх 2,28). При испытаниях пенопластов (е . = 1,11,3) в качестве среды используют воздух (в, = 1). Диэлектрическую проницаемость фторопласта-4 определяют в циклогексане или в конденсаторном масле. [c.87]При использовании бензола ввиду его токсичности измерения ведут, поместив ячейку в вытяжной шкаф.
 Необходимо соблюдать правила обращения с токсическими жидкостями и правила противопожарной безопасности, так как бензол и циклогексан являются легковоспламеняющимися веществами. Эталонные жидкости к тому
[c.87]
Необходимо соблюдать правила обращения с токсическими жидкостями и правила противопожарной безопасности, так как бензол и циклогексан являются легковоспламеняющимися веществами. Эталонные жидкости к тому
[c.87]Неправомерно в данном случае также объяснение различной активности смачивающих жидкостей размерами их молекул [83]. Для опровержения этого мнения в состав изучаемых сред кроме членов гомологического ряда алканов включены также 1,2-дихлорэтан и циклогексан, обладающие малым мольным объемом и сравнительно высоким поверхностным натяжением. Значение критического напряжения 0кр фторопласта-32Л в этих средах хорошо вписывается в общую закономерность изменения этого параметра от поверхностного натяжения и коэффициента растекания жидкостей (см. табл. IV.5). [c.169]
Измерение спектров комбинационного рассеяния производилось в жидкой фазе фотоэлектрическим методом с помощью спектрометра ДФС-12. Колебательные спектры поглощения записывались как для чистых жидкостей, так и для их растворов в четыреххлористом углероде и циклогексане при использовании инфракрасного спектрофотометра ИКС-14. Скорость сканирования при записи спектров комбинационного
[c.301]
Скорость сканирования при записи спектров комбинационного
[c.301]
Органические растворители, используемые при изготовлении и применении полимерных покрытий, являются горючими, легко воспламеняющимися жидкостями. Они делятся на три группы особо опасные с температурой вспышки от —18 °С и ниже (в закрытом тигле) или 2—13°С (в открытом тигле) к ним относятся ацетон, бензин, диэтиловый эфир, петролейный эфир, гексан, циклогексан и др. [c.16]
Циклогексан ( h,( h,), h, 1 1 84.17 0,779 6.5 81 Бесцветная жидкость [c.53]
При небольших давлениях газы в типичных жидкостях растворяются незначительно. Например, при 25 °С и парциальном давлении 1 атм растворимость (мольная доля) азота в циклогексане имеет величину х = 7,6-10″ , а в воде х= 0,18-10 . За некоторыми исключениями (например, для водорода) растворимость какого-либо газа в типичных растворителях обычно уменьшается при повышении температуры. Однако при высоких температурах, приближающихся
[c.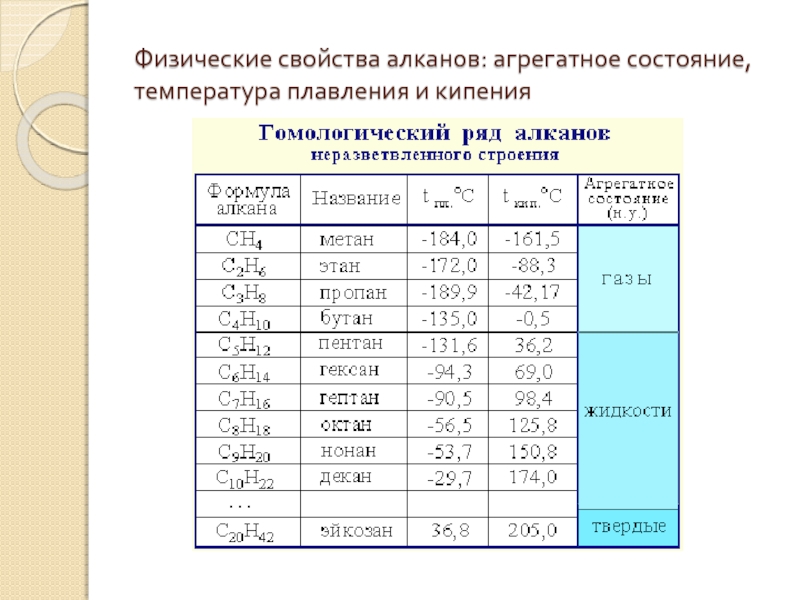 321]
321]
В полярных жидкостях скорость звука обычно больше, чем в аналогичных неполярных жидкостях. Примером могут служить бензол (с=1326 ж/се/с) и нитробензол (с=1473 м сек), а также циклогексан (с=1284 м[сек) и циклогексанон (с=1449 м сек). [c.243]
Дисперсионная среда должна хорошо смачивать порошок и быть химически инертной к нему. Часто применяют спирт (этиловый, бутиловый, изоамиловый), ацетон, соевое масло, циклогексан. Скорость оседания частиц в вязкой среде под действием силы тяжести можно определить весовым, пипеточным или оптическим методом, отмучиванием в восходящем потоке жидкости или газа, центрифугированием и др., а остальные величины известны из условий опыта. [c.189]
Для смесей бензола с циклогексаном и с метилэтилкетоном (поз. 10 и 11 на рис. 13.5 и 113.6) значения АСнк и производной d uiildt настолько малы, что влияние к.п.с. практически ие проявляется. -Расчет интенсивности теплообмена при кипении таких смесей с достаточной точностью можно производить по формулам, установленным для однокомпонентных жидкостей. На рис. il3.7 опытные данные значений а, полученные автором 1.18] при развитом кипении чистых бензола, метилэтилкетона и циклогексана, а также их смесей в интервале изменения концентраций от О до 1,0, сопоставлены со значениями а, рассчитанными по формуле (7.2). При расчете а к указанным смесям любое из свойств смеси Кем рассчитывалось из условия аддитивности (I—с нк). принималось также, что паровая фаза находится в равновесий с жидкостью, хотя в общем случае состав пара в паровых пузырях может отличаться от равновесного Ш6, 203]. Теоретическое и экспериментальное исследования динамики составов фаз в процессе кипения смесей криогенных жидкостей показали, что в период роста пузыря, особенно на начальной стадии, состав пара в пузыре может заметно отличаться от равновесного. При увеличении диаметра пузыря до отрывного отклонения действительного состава пара от равновесного уменьшается [106].
[c.350]
На рис. il3.7 опытные данные значений а, полученные автором 1.18] при развитом кипении чистых бензола, метилэтилкетона и циклогексана, а также их смесей в интервале изменения концентраций от О до 1,0, сопоставлены со значениями а, рассчитанными по формуле (7.2). При расчете а к указанным смесям любое из свойств смеси Кем рассчитывалось из условия аддитивности (I—с нк). принималось также, что паровая фаза находится в равновесий с жидкостью, хотя в общем случае состав пара в паровых пузырях может отличаться от равновесного Ш6, 203]. Теоретическое и экспериментальное исследования динамики составов фаз в процессе кипения смесей криогенных жидкостей показали, что в период роста пузыря, особенно на начальной стадии, состав пара в пузыре может заметно отличаться от равновесного. При увеличении диаметра пузыря до отрывного отклонения действительного состава пара от равновесного уменьшается [106].
[c.350]
Для определения предельного перегрева мы пользовались методом X. Вакэсима.и К. Таката [2]. Принципиально он заключается в следующем. Маленькие капельки исследуемой жидкости всплывают в вертикальном столбе другой жидкости, имеющей значительно более высокую температуру кипения и образующей с первой взаимно нерастворимую пару. По высоте столба создается градиент температуры, чем обеспечивается перегрев всплывающих капелек. При достижении некоторой высоты капельки взрывообразно с характерным треском испаряются. Автором были внесены усовершенствования в конструкцию прибора Вакэсима и Таката и совместно с В. И. Кукушкиным проведены опыты с я-гексаном, л-гептаном, циклогексаном, н-пентаном и изопентаном. Рабочей жидкостью служила концентрированная серная кислота. Полученные в работе 12] значения нами воспроизведены с точностью до 1—2°. Прибор и методика опытов будут описаны в другом сообщении.
[c.61]
Вакэсима.и К. Таката [2]. Принципиально он заключается в следующем. Маленькие капельки исследуемой жидкости всплывают в вертикальном столбе другой жидкости, имеющей значительно более высокую температуру кипения и образующей с первой взаимно нерастворимую пару. По высоте столба создается градиент температуры, чем обеспечивается перегрев всплывающих капелек. При достижении некоторой высоты капельки взрывообразно с характерным треском испаряются. Автором были внесены усовершенствования в конструкцию прибора Вакэсима и Таката и совместно с В. И. Кукушкиным проведены опыты с я-гексаном, л-гептаном, циклогексаном, н-пентаном и изопентаном. Рабочей жидкостью служила концентрированная серная кислота. Полученные в работе 12] значения нами воспроизведены с точностью до 1—2°. Прибор и методика опытов будут описаны в другом сообщении.
[c.61]
Представляют интерес смеси полиорганосилоксанов с другими продуктами. Например, полиорганосилоксановая жидкость, смешанная с 15—33% растворителя (в качестве растворителя может быть взят бензол, циклогексан, тетрагидронафталин, ме-тилэтилкетон, четыреххлористый углерод или быс-(2-этилгексил) адипинат), обладает хорошими смазывающими свойствами,
[c. 281]
281]
Криохимический метод. Сущность метода заключается в распылении водных растворов смеси солей элементов, составляющих проектируемую керамику, в охлаждающую среду. В качестве охлаждающей среды применяют жидкости, не смешивающиеся с водой они имеют достаточно низкую температуру замерзания и высокую теплопроводность (например, гексан, кумол, толуол, циклогексан, пентан и др.). В результате такого мгновенного воздействйя низкой температуры образуются мелкие замороженные гранулы сферической формы, по размерам соответствующие пылевидным каплям распыляемого раствора. Затем находящийся в гранулах аморфный лед удаляют путем сублимации водяных паров при низких температурах и давлениях. Высушенные гранулы подвергают высокотемпературному обжигу, в процессе которого происходит разложение солей. При этом образуется тонкодисперсный порошок с размером частиц 0,01—0,5 мкм. Дисперсность порошка можно регулировать изменением концентрации раствора, режима распыления, температуры разложения солей.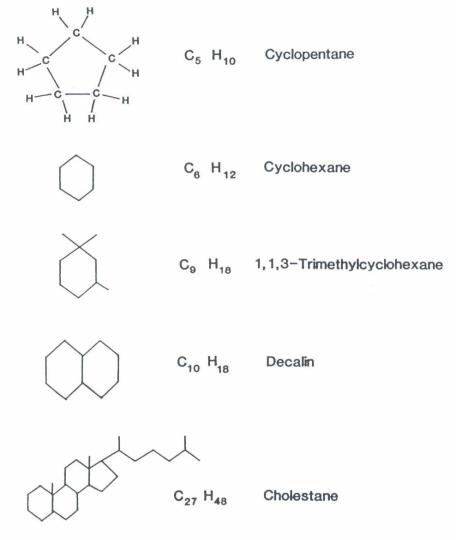 Небольшое количество добавок, вводимых в массу (и в
[c.39]
Небольшое количество добавок, вводимых в массу (и в
[c.39]
При размоле необходимо получить гомогенное распределение частиц карбида титана и стали заданной дисперсности, а загрязнение смеси материалом размольных тел и кислородом воздуха должно бьга минимальное. В качестве размольной жидкости можно использовать бензин, ацетон, этиловый спирт, циклогексан. Последний представляется наиболее предпочтительны , так как он не содержит воды и менее взрывоопасен по сравнению с остальными. Обычно размол и приготовление смесей Ti — сталь проводят в традиционных для твердосплавной промышленности шаровых мельницах, а размольными телами служат шары из твердых сплавов на основе карбида вольфрама. [c.99]
I разряд — особо опасные ЛВЖ, имеющие температуры вспышки от — 18°С и ниже (в закрытом тигле) или ниже — 13°С (в открытом тигле). Типичные представители таких ЛВЖ — гек-сан, изопентан, изогептан, циклогексан, петролейный эфир, бензины, ацетон, диэтиловый эфир и т.
 д. Главкой особенностью этих растворителей является высокое давление насыщенных паров при нормальных температурах, поэтому пары этих жидкостей в случае плохой герметичности сосудов способны легко распространяться в воздухе на значительные расстояния от места хранения и образовывать взрывоопасные смеси.
[c.169]
д. Главкой особенностью этих растворителей является высокое давление насыщенных паров при нормальных температурах, поэтому пары этих жидкостей в случае плохой герметичности сосудов способны легко распространяться в воздухе на значительные расстояния от места хранения и образовывать взрывоопасные смеси.
[c.169]Чрезвычайно широко метод ЯМР применяется при исследовании протонного резонанса в атомах водорода (ЯПР). Рассмотрение спектра протонного резонанса неизвестного органического соединения дает сведения о том, в какие группы входит водород, и, следовательно, каково строение этого вещества. Спектры ЯМР в жидкостях отличаются рядом особенностей . Одйн6чнь1ё лин получаются только для соединений, в которых наблюдается ЯМР ядер, занимающих химически эквивалентные положения, например вода, бензол, циклогексан. Более сложные соединения дают спектры из многих линий, характеризующие связи ядер водорода в различных группах (рис. 18, г). [c.181]
В экспериментах но критической опалесценции вблизи критической точки значительный вклад в наблюдаемые интенсивности дает многократное рассеяние света, если только в эксперименте не принималось тщательных мер для его устранения. Обычно для исключения многократного рассеяния сокращают размеры рассеивающего объема путем уменьшения длины пути света в ячейке. Однако измерения рассеяния в системах циклогексан — анилин [116] показывают, что при длине пути 0,1 мм возникают трудности в воспроизведении температуры расслоения. Ослабления многократного рассеяния можно добиться также, подбирая в качестве компонентов смеси вещества с близкими показателями преломления. Так как интенсивность рассеянного света пропорциональна квадрату разности показателей преломления, этот способ, по-видимому, позволяет простейшим путем добиться уменьшения интенсивности и, следовательно, довести до минимума многократное рассеяние. Разумеется, в случае однокомнонентной жидкости вблизи критической точки газ — жидкость многократное рассеяние можно ослабить лишь путем уменьшения размеров рассеивающей ячейки.
[c.115]
Обычно для исключения многократного рассеяния сокращают размеры рассеивающего объема путем уменьшения длины пути света в ячейке. Однако измерения рассеяния в системах циклогексан — анилин [116] показывают, что при длине пути 0,1 мм возникают трудности в воспроизведении температуры расслоения. Ослабления многократного рассеяния можно добиться также, подбирая в качестве компонентов смеси вещества с близкими показателями преломления. Так как интенсивность рассеянного света пропорциональна квадрату разности показателей преломления, этот способ, по-видимому, позволяет простейшим путем добиться уменьшения интенсивности и, следовательно, довести до минимума многократное рассеяние. Разумеется, в случае однокомнонентной жидкости вблизи критической точки газ — жидкость многократное рассеяние можно ослабить лишь путем уменьшения размеров рассеивающей ячейки.
[c.115]
После упоминавшихся выше экспериментальных и теоретических исследований крыла и, в особенности, после работ Вейлера [518], Руссе [72], Бапайя [519] и автора книги [52, 53, 73, 144, 230, 231, МО] было выяснено, что ротационная гипотеза происхождения крыла в жидкости не подтверждается и должна быть отвергнута. Это относится к таким жидкостям, как бензол, сероуглерод, четыреххлористый углерод, циклогексан, уксусная кислота, хлороформ, и другим обычным жидкостям. 11оявление исследований, в которых до сих пор обнаруживаются максимумы в распределении интенсивности в крыле линии Релея в бензоле, сероуглероде и других обычных жидкостях [520—522], объясняется грубой ошибкой в обработке результатов наблюдения ). О свободном вращении молекул в жидкостях и о его влиянии на спектр рассеянного света можно, по-видимому, говорить лишь в особых случаях жид-
[c.352]
Это относится к таким жидкостям, как бензол, сероуглерод, четыреххлористый углерод, циклогексан, уксусная кислота, хлороформ, и другим обычным жидкостям. 11оявление исследований, в которых до сих пор обнаруживаются максимумы в распределении интенсивности в крыле линии Релея в бензоле, сероуглероде и других обычных жидкостях [520—522], объясняется грубой ошибкой в обработке результатов наблюдения ). О свободном вращении молекул в жидкостях и о его влиянии на спектр рассеянного света можно, по-видимому, говорить лишь в особых случаях жид-
[c.352]
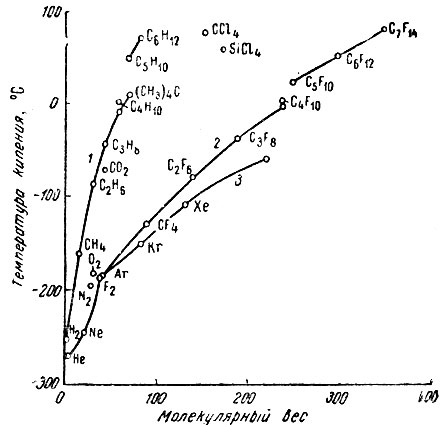
Точки кипения/плавления циклогексана и циклогептана
Не так много авторитетных источников по этому вопросу (как я мог найти), поскольку кажется, что циклогептан не самый популярный химикат вокруг (бедный парень), но я расскажу вам лучшее объяснение/аргумент/понимание ситуации, поскольку я Можно.
Обратите внимание, что это будет только моя собственная интерпретация и случай объяснения результатов, которые мы видим, вместо того, чтобы формулировать объяснение, чтобы охватить природные явления, не наблюдая предшествующих результатов.
Ключевой ингредиент, который я заметил при просмотре графиков и еще чего-то связанного с стериками. Об этом позже.
Melting and Boiling Points of Cycloalkanes
Выше представлена диаграмма точек плавления и кипения циклоалканов. Как и ожидалось, точка кипения увеличивается линейно. Это так мило! Таким образом, мы можем объяснить точку кипения с естественной интуицией, подобно обычным алканам. Больше больше! Если бы жизнь была настолько простой.
Теперь давайте посмотрим на точки плавления. СВЯТАЯ! Циклобутановы? Почему вы так высоко? (на самом деле это ошибка в книге. Тем не менее, она выше, чем циклопентан, и это точка). И вау, это циклогексан, монстр, мимо точки плавления нашей самой дорогой воды. Что-то не так с этой вселенной. Это должны быть марсиане.
Но нет. Это не марсиане. По крайней мере, я не верю в это. Ответ, я считаю, является стерикой.
Sterics? ты спрашиваешь. Вы пытаетесь сказать, что циклобутановые связи более структурированы, чем циклопентановые и циклогексановые связи, более структурированные, чем циклогексан?
Точно.
Хотя вы не можете ожидать большой разницы от циклобутана и циклопентана, циклобутан очень близок к прямому углу (идеальный квадрат), и это позволило бы плотно упаковать. Циклопентан, с другой стороны, обычно является «конвертом», который обеспечивает менее плотную упаковку.
Аналогичным образом, циклогексан имеет очень близкую упаковку цисталла , которая может учитываться его низкая температура плавления.
Затем, после того как кристаллическая структура расплавится, наша интуиция уступает место ожиданиям температуры кипения.
Опять же, это не определенно. Если возможно, я хотел бы сопоставить твердые структуры каждого циклоалкана, но, к сожалению, данные кажутся скудными, особенно для циклогептана, что вызывает беспокойство.
Разработка сибирских ученых позволит значительно удешевить производство синтетических тканей
Один из многотоннажных процессов промышленности — разделение бензола и циклогексана, добываемых из нефти и газа. Циклогексан, модифицированный по длительной химической цепочке, служит основой для изготовления пластмасс, нейлона и других синтетических волокон. В мире производится более пяти миллионов тонн циклогексана в год, а его рынок оценивается в 15 миллиардов долларов.
Циклогексан, модифицированный по длительной химической цепочке, служит основой для изготовления пластмасс, нейлона и других синтетических волокон. В мире производится более пяти миллионов тонн циклогексана в год, а его рынок оценивается в 15 миллиардов долларов.
«Схема такая: сначала делается бензол, а потом уже его превращают в циклогексан. При этом бензол в небольших количествах остается и его нужно обязательно отделять, — отмечает исследователь. — Проблема в том, что у этих веществ очень близкие свойства, они имеют практически одинаковую температуру кипения (80,1 °C для бензола и 80,7 °C для циклогексана). Это означает: если вы хотите разделить их при помощи перегонки, то нужно строить большие ректификационные колонны, тратить огромное количество энергии, что сейчас и происходит в промышленности».
Метод новосибирских ученых позволяет разделять бензол и циклогексан в мягких условиях: при комнатной температуре, практически не потребляя энергию. Это возможно за счет применения синтетических металлорганических каркасов, разработанных сотрудниками лаборатории металлорганических координационных полимеров ИНХ СО РАН на основе легкодоступной терефталевой кислоты и ее производных. МОК имеют большие полости в структуре, соединенные окнами определенного диаметра, они похожи на губку: могут пропускать одни молекулы, блокируя другие. Сотрудникам ИНХ СО РАН удалось настроить МОК так, что они хорошо сорбируют бензол и не сорбируют циклогексан — и для этого не нужны ни нагревание, ни ректификационные колонны. Металлорганические каркасы обладают огромным преимуществом по сравнению с другими материалами, поскольку их можно легко модифицировать и настроить под конкретную задачу.
МОК имеют большие полости в структуре, соединенные окнами определенного диаметра, они похожи на губку: могут пропускать одни молекулы, блокируя другие. Сотрудникам ИНХ СО РАН удалось настроить МОК так, что они хорошо сорбируют бензол и не сорбируют циклогексан — и для этого не нужны ни нагревание, ни ректификационные колонны. Металлорганические каркасы обладают огромным преимуществом по сравнению с другими материалами, поскольку их можно легко модифицировать и настроить под конкретную задачу.
МОК показали свою эффективность в стенах института, и ученые надеются, что найдутся инвесторы, готовые применить их на практике, предварительно вложившись в доработку технологии.
«Нам удалось показать, что наши металлорганические каркасы обладают рекордно высокими значениями по разделению бензола и циклогексана, которые не достигнуты ни на каких других материалах», — говорит Владимир Федин.
Разница между циклогексаном и бензолом — Разница Между
Разница между циклогексаном и бензолом — Разница Между
Основное отличие — циклогексан против бензола
Циклогексан и бензол являются двумя важными органическими соединениями, которые имеют множество применений в процессах химического синтеза. Оба состоят из шести атомов углерода и являются циклическими структурами. Поскольку 2D химическая структура циклогексана и бензола выглядит несколько схожей, их структура и названия часто сбивают с толку. Однако существует много различий между циклогексаном и бензолом. Основное различие между циклогексаном и бензолом заключается в том, что Циклогексан содержит двенадцать атомов водорода, связанных с шестью атомами углерода, по два атома водорода на каждый атом углерода, тогда как бензол содержит шесть атомов водорода, связанных с шестью атомами углерода, по одному атому водорода на каждый атом углерода.
Оба состоят из шести атомов углерода и являются циклическими структурами. Поскольку 2D химическая структура циклогексана и бензола выглядит несколько схожей, их структура и названия часто сбивают с толку. Однако существует много различий между циклогексаном и бензолом. Основное различие между циклогексаном и бензолом заключается в том, что Циклогексан содержит двенадцать атомов водорода, связанных с шестью атомами углерода, по два атома водорода на каждый атом углерода, тогда как бензол содержит шесть атомов водорода, связанных с шестью атомами углерода, по одному атому водорода на каждый атом углерода.
Ключевые области покрыты
1. Что такое циклогексан
— определение, химические свойства, структура, синтез
2. Что такое бензол
— определение, химические свойства, структура
3. В чем разница между циклогексаном и бензолом
— Сравнение основных различий
Основные термины: Аромат, Атом, Бензол, Сырая нефть, Циклический, Циклогексан, Гибридизация, Октановое число.
Что такое циклогексан
Циклогексан представляет собой органическое соединение, имеющее химическую формулу C6ЧАС12 и является циклической структурой. Это циклоалкан, что означает, что циклогексан представляет собой насыщенное соединение, не имеющее двойной или тройной связи в своей структуре, и представляет собой циклическое соединение. Следовательно, все атомы углерода в циклогексане являются sp3 гибридизовал.
Хотя двумерная структура циклогексана кажется плоской, на самом деле это не так. Химическая структура циклогексана приведена на рисунке ниже. Эта структура известна как конформация стула. Эта конформация является наиболее стабильной структурой для циклогексана, где деформация кручения была минимизирована.
Рисунок 1: Циклогексан не имеет плоской структуры
Молярная масса циклогексана составляет 84,16 г / моль. Это бесцветная жидкость при комнатной температуре. Циклогексан имеет сладкий, но похожий на бензин запах. Температура плавления циклогексана составляет 6,47 ° С, а температура кипения составляет 80,74 ° С. Он не смешивается с водой, но растворим в растворителях, таких как эфир, спирт и ацетон.
Температура плавления циклогексана составляет 6,47 ° С, а температура кипения составляет 80,74 ° С. Он не смешивается с водой, но растворим в растворителях, таких как эфир, спирт и ацетон.
Циклогексан не может быть найден в природных ресурсах, таких как сырая нефть. Поэтому циклогексан должен быть синтезирован. В промышленном масштабе циклогексан получают гидрированием бензола. Это просто и легко, потому что и бензол, и циклогексан являются циклическими структурами, состоящими из шести атомов углерода. Однако реакция очень экзотермическая.
Циклогексан является основным сырьем для производства адипиновой кислоты и капролактама. Эти соединения являются прекурсорами, используемыми в производстве нейлона. Циклогексан также используется как неполярный растворитель в лабораториях.
Что такое бензол
Бензол является очень распространенной и важной органической молекулой, имеющей химическую формулу С6ЧАС6, Он состоит из шести атомов углерода, которые2 гибридизуется, и каждый из этих атомов углерода связан с двумя другими атомами углерода и атомом водорода.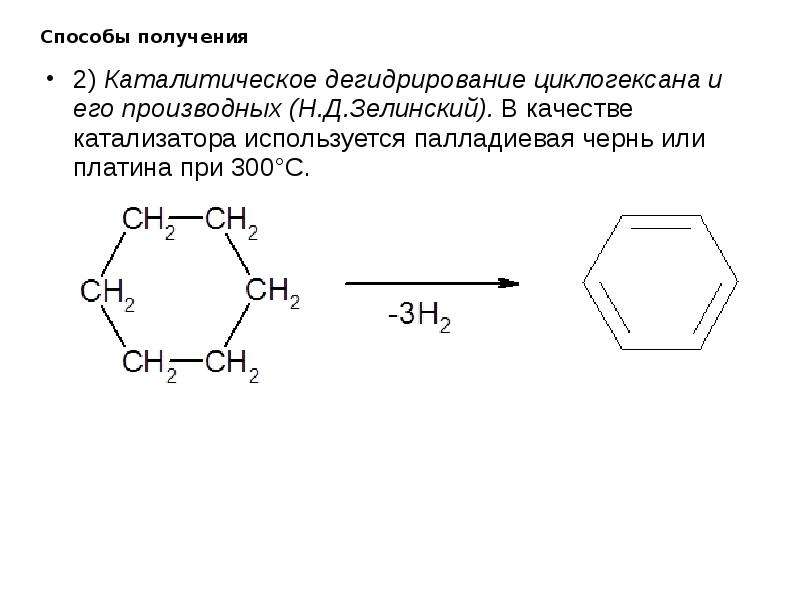 Следовательно, это плоская структура. При комнатной температуре это бесцветная жидкость.
Следовательно, это плоская структура. При комнатной температуре это бесцветная жидкость.
Молярная масса бензола составляет 78,11 г / моль. Бензол является ароматическим соединением. Имеет ароматический запах; это запах, похожий на бензин. Температура плавления бензола составляет 5,53 ° С, а температура кипения составляет 80,1 ° С. Не смешивается с водой. но он растворим в спирте, хлороформе, диэтиловом эфире и т. д.
Рисунок 2: Факты о бензоле
По своей химической структуре бензол имеет делокализованные облака пи-электронов, параллельные плоскости молекулы. Это происходит из-за присутствия негибридизованных p-орбиталей, присутствующих в каждом атоме углерода бензольного кольца. Эти пи-орбитали могут смешиваться друг с другом, образуя электронное облако.
Бензол может быть найден в сырой нефти. Бензол легко воспламеняется. Это ароматический углеводород. Поскольку бензол имеет высокое октановое число, он является важной составляющей в бензине. Основным применением бензола является его использование в качестве промежуточного продукта для производства других химических веществ, таких как этилбензол, кумол и т. Д.
Основным применением бензола является его использование в качестве промежуточного продукта для производства других химических веществ, таких как этилбензол, кумол и т. Д.
Разница между циклогексаном и бензолом
Определение
циклогексан: Циклогексан представляет собой органическое соединение, имеющее химическую формулу C6ЧАС12.
Бензол: Бензол является очень распространенной и важной органической молекулой, имеющей химическую формулу С6ЧАС6.
Количество атомов водорода
циклогексан: Циклогексан имеет 12 атомов водорода.
Бензол: Бензол имеет шесть атомов водорода.
Состав
циклогексан: Циклогексан имеет конформацию стула.
Бензол: Бензол — это плоская структура.
Молярная масса
циклогексан: Молярная масса циклогексана составляет 84,16 г / моль.
Бензол: Молярная масса бензола составляет 78,11 г / моль.
Точка плавления и точка кипения
циклогексан: Температура плавления циклогексана составляет 6,47 ° С, а температура кипения составляет 80,74 ° С.
Бензол: Температура плавления бензола составляет 5,53 ° С, а температура кипения составляет 80,1 ° С.
Гибридизация атомов углерода
циклогексан: Циклогексан имеет зр3 гибридизованные атомы углерода.
Бензол: Бензол имеет зр2 гибридизованные атомы углерода.
Делокализованные пи электроны
циклогексан: В циклогексане делокализованных облаков пи-электронов нет
Бензол: В бензоле находятся делокализованные пи-электронные облака.
Вхождение
циклогексан: Циклогексан в природе не встречается в сырой нефти.
Бензол: Бензол естественно встречается в сырой нефти.
Заключение
Циклогексан и бензол представляют собой шесть углерод-циклических структур. Хотя их 2D структуры выглядят одинаково, они очень разные соединения. Основное различие между циклогексаном и бензолом состоит в том, что циклогексан содержит 12 атомов водорода, связанных с шестью атомами углерода, по два атома водорода на каждый атом углерода, тогда как бензол содержит шесть атомов водорода, связанных с шестью атомами углерода, по одному атому водорода на каждый атом углерода.
Ссылка:
1. «ЦИКЛОГЕКСАН». Национальный центр биотехнологической информации. База данных PubChem Compound, Национальная медицинская библиотека США,
Циклогексан | Национальный реестр загрязнителей
Описание
Это соединение используется в качестве растворителя для растворения эфиров целлюлозы, лаков, смол, жиров, восков, масел, битума и сырой резины. Он также используется в парфюмерном производстве, при поверхностных покрытиях (лаках), при синтезе адипиновой кислоты для производства нейлона 66 и инженерных пластиков, при синтезе капролактама в нейлоне 6, растворителях красок и лаков, при экстракции эфирных масел, в аналитической химии для определения молекулярной массы, в производстве адипиновой кислоты, бензола, циклогексилхлорида, нитроциклогексана, циклогексанола и циклогексанона, в производстве твердого топлива для походных печей, в фунгицидных препаратах (обладает слабым фунгицидным действием) в промышленной перекристаллизации стероиды, органический синтез, рекристаллизационные заменители стекла, твердые топлива, в аналитической химии и в производстве клеев.
Информация о веществе
Название вещества: Циклогексан
Номер CASR: 110-82-7
Молекулярная формула: C 6 H 12
Синонимы: гексаметилен; гексанафтен; гексагидробензол, бензолгексагидрид
Физические свойства
Циклогексан — бесцветная подвижная жидкость со слабым сладковатым запахом. Он мало растворим в воде и растворим в спирте, ацетоне, бензоле, этаноле, этиловом эфире, оливковом масле и четыреххлористом углероде.
Температура плавления: 6,47°C
Температура кипения: 80,7°C
Удельный вес: 0,779
Плотность пара: 2,98
1 ppm = 3,44 мг/м 3
Вес формулы 84.161
Химические свойства
Циклогексан — легковоспламеняющаяся неагрессивная жидкость.
Дополнительная информация
Национальный реестр загрязнителей ( NPI ) содержит данные обо всех источниках выбросов циклогексана в Австралии.
Описание
Воздействие циклогексана на здоровье человека и окружающую среду зависит от содержания циклогексана, продолжительности и частоты воздействия. Эффекты также зависят от здоровья человека или состояния окружающей среды, когда происходит воздействие. Вдыхание больших количеств циклогексана в течение коротких промежутков времени неблагоприятно влияет на нервную систему человека. Эффекты варьируются от головной боли до анестезии, тремора и судорог. Контакт с жидкостью или парами циклогексана может повредить глаза.Эти эффекты маловероятны при концентрациях циклогексана, обычно встречающихся в окружающей среде. Влияние на здоровье человека, связанное с вдыханием или иным образом потреблением меньшего количества циклогексана в течение длительного периода времени, неизвестно. Исследования показывают, что многократное воздействие больших количеств циклогексана в воздухе вызывает эффекты нервной системы, повреждения глаз и дыхательные пути у животных. В настоящее время производители циклогексана изучают, как его химическое вещество влияет на репродуктивную систему и развитие плода животных.
Вход в тело
Циклогексан попадает в организм при вдыхании с загрязненным воздухом или при употреблении с зараженной пищей или водой. Он также может всасываться при контакте с кожей. Циклогексан вряд ли останется в организме из-за его распада и удаления с выдыхаемым воздухом и мочой.
Воздействие
Воздействие циклогексана может происходить на рабочем месте или в окружающей среде после попадания в воздух, воду, землю или грунтовые воды. Воздействие также может произойти, когда люди используют продукты, содержащие циклогексан, или когда они курят сигареты.
Стандарты воздействия на рабочем месте
Safe Work Australia устанавливает стандарт воздействия циклогексана на рабочем месте посредством стандартов воздействия на рабочем месте переносимых по воздуху загрязнителей:
- Максимальное средневзвешенное значение за восемь часов (TWA): 100 частей на миллион (350 мг/м 3 )
- Максимальный предел кратковременного воздействия (STEL): 300 частей на миллион (1050 мг/м 3 )
Эти стандарты подходят только для использования на рабочих местах и не ограничиваются какой-либо конкретной отраслью или операцией. Убедитесь, что вы понимаете, как интерпретировать стандарты, прежде чем использовать их.
Убедитесь, что вы понимаете, как интерпретировать стандарты, прежде чем использовать их.
Руководство по питьевой воде
В Австралийских рекомендациях по питьевой воде нет указаний по циклогексану.
Описание
Циклогексан не устойчив в воде, его период полураспада составляет менее 2 дней. Период полураспада загрязняющего вещества – это время, за которое распадается половина химического вещества. Практически 100% циклогексана попадает в воздух.
Ожидается, что концентрация циклогексана в тканях рыб будет несколько выше средней концентрации циклогексана в воде, из которой была взята рыба.
Циклогексан обладает умеренной острой токсичностью для водных организмов. Он вызвал повреждение мембран у декоративных культур. Недостаточно данных для оценки или прогнозирования краткосрочного воздействия циклогексана на птиц или наземных животных.
Циклогексан обладает умеренной хронической токсичностью для водных организмов. Недостаточно данных для оценки или прогнозирования долгосрочного воздействия циклогексана на растения, птиц или наземных животных.
Вход в окружающую среду
Циклогексан попадает в окружающую среду в основном с промышленными и бытовыми стоками.Циклогексан испаряется на воздухе. Немного растворяется при смешивании с водой. Наиболее прямые выбросы циклогексана в окружающую среду происходят в воздухе. Циклогексан также испаряется из воды и почвы, находящихся на воздухе. Ожидается, что в воздухе он разложится на другие химические вещества. Поскольку это жидкость, которая плохо связывается с почвой, циклогексан, попадая в землю, может перемещаться через землю и попадать в грунтовые воды. Растения и животные, живущие в среде, загрязненной циклогексаном, могут хранить небольшое количество этого химического вещества.
Где он заканчивается
Циклогексан сам по себе вряд ли причинит вред окружающей среде на уровнях, обычно присутствующих в окружающей среде. Циклогексан может способствовать образованию фотохимического смога, когда он реагирует с диоксидом азота, озоном и другими летучими органическими углеродсодержащими веществами в воздухе.
Руководство по охране окружающей среды
Нет национальных руководств.
Промышленные источники
Основными точечными источниками являются нефтепереработка, авторемонтные мастерские, коммерческая типография и издательское дело.
Рассеянные источники и промышленные источники, включенные в данные о диффузных выбросах
Подпороговые сооружения.
Природные источники
Циклогексан является естественным компонентом сырой нефти. Он также встречается в природе как летучее растение и может выделяться из вулканов.
Источники транспорта
В выхлопных газах автомобилей обнаружен циклогексан.
Потребительские товары
Циклогексан используется в качестве растворителя, экстрагента масла, смывки краски и лака, а также в твердом топливе.
Источники, использованные при подготовке этой информации
- Австралийский и Новозеландский совет по окружающей среде и охране природы (ANZECC) (1992), Австралийские рекомендации по качеству пресной и морской воды.
- Сводная информация о токсичных загрязнителях воздуха Совета по воздушным ресурсам CalEPA (по состоянию на май 1999 г.)
- ChemFinder WebServer Project (1995) (по состоянию на май 1999 г.)
- Фонд защиты окружающей среды — сводка, использование, потребительские товары, ранг (промышленный, по количеству) (по состоянию на май 1999 г.)
- Управление по предотвращению загрязнения и токсическим химическим веществам Агентства по охране окружающей среды (по состоянию на май 1999 г.)
- Сводка фактов Управления по предотвращению загрязнения и токсичным химическим веществам Агентства по охране окружающей среды (по состоянию на май 1999 г.)
- Информационный бюллетень EPA по инвентаризации токсичных выбросов (по состоянию на май 1999 г.)
- Международная карта химической безопасности IPCS (по состоянию на май 1999 г.)
- Мигер, Д. (1991), Австралийский словарь Macmillan Environment, Macmillan Education Australia Pty Ltd.
- Информационный бюллетень по охране здоровья и безопасности Национальной токсикологической программы (по состоянию на май 1999 г.
 )
) - Ричардсон, М. (1992), Словарь веществ и их эффектов, Королевское химическое общество, Clays Ltd, Англия.
- Ситтиг, М. (1991), Справочник по токсичным и опасным химическим веществам и канцерогенам, 3-е издание, Noyes Publications, США.
- Техническая консультативная группа (1999 г.), Заключительный отчет Национальному совету по охране окружающей среды.
- Министерство здравоохранения и социальных служб США (1990 г.), Карманный справочник NIOSH по химическим опасностям, публикация №90-117.
- USEPA Health Effects (по состоянию на май 1999 г.)
- Safe Work Australia, Стандарты воздействия переносимых по воздуху загрязнителей на рабочем месте, по состоянию на июнь 2021 г.
- Национальный совет по здравоохранению и медицинским исследованиям (NHMRC), Австралийские рекомендации по питьевой воде (2011 г.) — обновлено в октябре 2017 г., по состоянию на май 2018 г.
ЦИКЛОГЕКСАН | Камео Химикаты | НОАА
Химический паспорт
Химические идентификаторы
То Поля химического идентификатора включают общие идентификационные номера, алмаз NFPA У. S. Знаки опасности Департамента транспорта и общее
описание хим. Информация в CAMEO Chemicals поступает
из множества
источники данных.
S. Знаки опасности Департамента транспорта и общее
описание хим. Информация в CAMEO Chemicals поступает
из множества
источники данных.
| Номер CAS | Номер ООН/НА | Знак опасности DOT | Береговая охрана США КРИС Код |
|---|---|---|---|
|
|||
| Карманный справочник NIOSH | Международная карта химической безопасности | ||
| Циклогексан | |||
NFPA 704
| Алмаз | Опасность | Значение | Описание |
|---|---|---|---|
| Здоровье | 1 | Может вызывать сильное раздражение.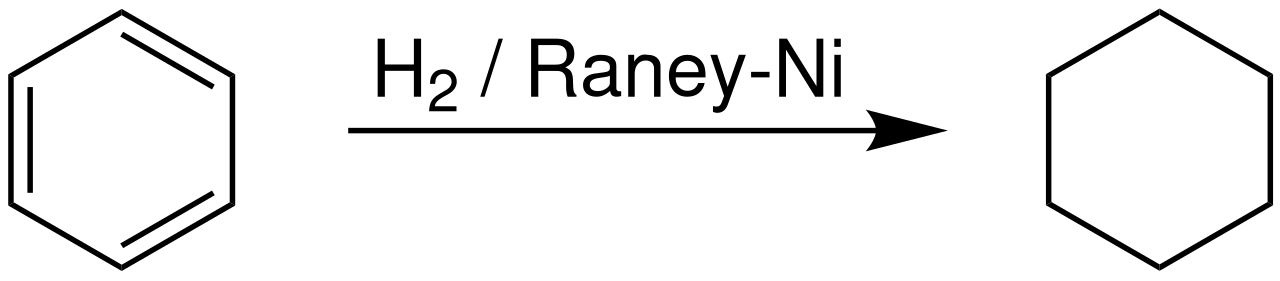 |
|
| Воспламеняемость | 3 | Может воспламеняться практически при любых температурах окружающей среды. | |
| нестабильность | 0 | Обычно стабилен даже в условиях пожара. | |
| Специальный |
(NFPA, 2010 г.)
Общее описание
Прозрачная бесцветная жидкость с запахом нефти.Используется для производства нейлона, в качестве растворителя, средства для удаления краски и других химикатов. Температура вспышки -4°F. Плотность 6,5 фунта/галлон (меньше, чем у воды) и нерастворимость в воде. Пары тяжелее воздуха.
Опасности
Предупреждения о реактивности
Реакции воздуха и воды
Легковоспламеняющиеся. Нерастворим в воде.
Пожароопасность
Выдержка из Руководства ERG 128 [Горючие жидкости (не смешивающиеся с водой)]: ЛЕГКО ОГНЕОПАСНО: Легко воспламеняется от тепла, искр или пламени.Пары могут образовывать взрывоопасные смеси с воздухом. Пары могут перемещаться к источнику воспламенения и вспыхивать обратно. Большинство паров тяжелее воздуха. Они будут распространяться по земле и собираться в низких или ограниченных пространствах (канализация, подвалы, резервуары). Опасность взрыва паров в помещении, на открытом воздухе или в канализации. Вещества, обозначенные буквой (P), могут полимеризоваться со взрывом при нагревании или попадании в огонь. Слив в канализацию может создать опасность пожара или взрыва. Контейнеры могут взорваться при нагревании. Многие жидкости легче воды.Вещество можно транспортировать в горячем виде. Для гибридных автомобилей также следует обращаться к ERG Guide 147 (литий-ионные аккумуляторы) или ERG Guide 138 (натриевые аккумуляторы). Если речь идет о расплавленном алюминии, см. Руководство ERG 169. (ERG, 2016)
Руководство ERG 169. (ERG, 2016)
Опасность для здоровья
Головокружение с тошнотой и рвотой. Концентрированный пар может вызвать потерю сознания и коллапс. (Геологическая служба США, 1999 г.)
Профиль реактивности
Жидкий диоксид азота подавали в колонну нитрования, содержащую горячий циклогексан, из-за ошибки.В результате произошел взрыв [MCA Case History 128 (1962)]. Несовместим с сильными окислителями.
Принадлежит к следующей реакционной группе (группам)
Потенциально несовместимые абсорбенты
Информация отсутствует.
Рекомендации по ответу
То Поля рекомендации ответа включают в себя расстояния изоляции и эвакуации, а также рекомендации по пожаротушение, пожарное реагирование, защитная одежда и первая помощь.То информация в CAMEO Chemicals поступает из различных источники данных.Изоляция и эвакуация
Выдержка из Руководства ERG 128 [Горючие жидкости (не смешивающиеся с водой)]: В качестве непосредственной меры предосторожности изолируйте место разлива или утечки не менее чем на 50 метров (150 футов) во всех направлениях.
КРУПНЫЙ РАЗЛИВ: Рассмотрите начальную эвакуацию по ветру на расстояние не менее 300 метров (1000 футов).
ПОЖАР: Если цистерна, железнодорожный вагон или автоцистерна вовлечены в пожар, ИЗОЛИРОВАТЬ на расстоянии 800 метров (1/2 мили) во всех направлениях; также рассмотрите первоначальную эвакуацию на 800 метров (1/2 мили) во всех направлениях.(ЭРГ, 2016)
Пожаротушение
Выдержка из Руководства ERG 128 [Горючие жидкости (не смешивающиеся с водой)]:ПРЕДОСТЕРЕЖЕНИЕ: Все эти продукты имеют очень низкую температуру воспламенения: Использование распыления воды при тушении пожара может быть неэффективным. ВНИМАНИЕ: Для смесей, содержащих спирт или полярный растворитель, спиртостойкая пена может оказаться более эффективной.
НЕБОЛЬШОЙ ПОЖАР: Сухой химикат, CO2, распыление воды или обычная пена.
БОЛЬШОЙ ПОЖАР: Распыление воды, туман или обычная пена. Не используйте прямые потоки.Переместите контейнеры из зоны пожара, если вы можете сделать это без риска.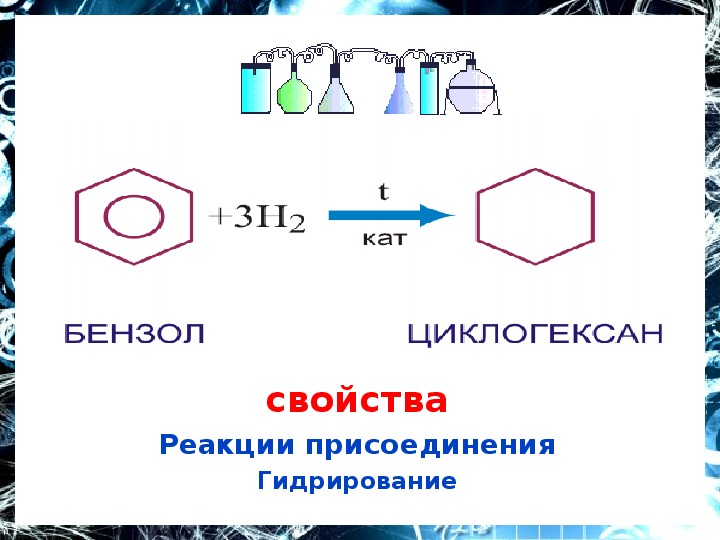
ПОЖАР, СВЯЗАННЫЙ С БАЧКАМИ ИЛИ АВТОМОБИЛЯМИ/ТРЕЙЛЕРАМИ: Тушить огонь с максимального расстояния или использовать автоматические держатели шлангов или мониторные насадки. Охладите контейнеры заливающим количеством воды до тех пор, пока огонь не погаснет. Немедленно отозвать в случае усиления звука от вентиляционных предохранительных устройств или обесцвечивания бака. ВСЕГДА держитесь подальше от танков, охваченных огнем. При массовом возгорании используйте автоматические держатели шлангов или мониторные насадки; если это невозможно, отойдите от зоны и дайте огню гореть.(ЭРГ, 2016)
Непожарный ответ
Выдержка из Руководства ERG 128 [Горючие жидкости (не смешивающиеся с водой)]: УСТРАНИТЕ все источники воспламенения (не курите, факелы, искры или пламя в непосредственной близости). Все оборудование, используемое при работе с продуктом, должно быть заземлено. Не прикасайтесь к рассыпанному материалу и не ходите по нему. Остановите утечку, если вы можете сделать это без риска.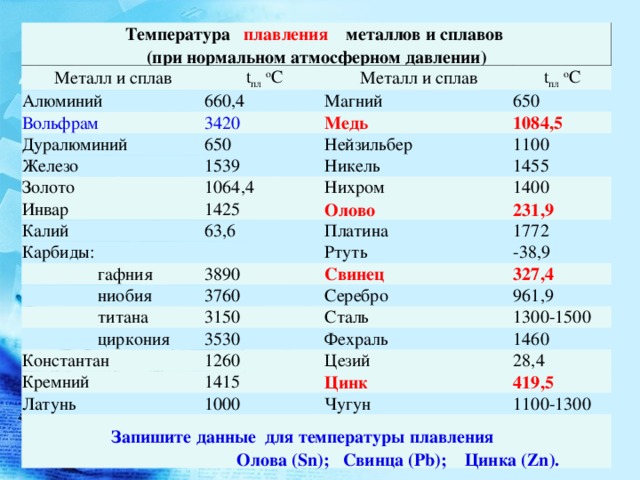 Не допускать попадания в водные пути, канализацию, подвалы или замкнутые пространства. Для уменьшения паров можно использовать пароподавляющую пену. Впитать или засыпать сухой землей, песком или другим негорючим материалом и переложить в контейнеры.Используйте чистые, искробезопасные инструменты для сбора абсорбированного материала.
Не допускать попадания в водные пути, канализацию, подвалы или замкнутые пространства. Для уменьшения паров можно использовать пароподавляющую пену. Впитать или засыпать сухой землей, песком или другим негорючим материалом и переложить в контейнеры.Используйте чистые, искробезопасные инструменты для сбора абсорбированного материала.
БОЛЬШОЙ РАЗЛИВ: Оборудуйте дамбу далеко впереди разлива жидкости для последующего удаления. Распыление воды может уменьшить испарение, но не может предотвратить возгорание в закрытых помещениях. (ЭРГ, 2016)
Защитная одежда
Кожа: Носите соответствующую защитную одежду для предотвращения контакта с кожей.Глаза: Наденьте соответствующую защиту для глаз, чтобы предотвратить попадание в глаза.
Мытье кожи: Рабочий должен немедленно вымыть кожу, когда она загрязнится.
Удалить: Рабочую одежду, которая намокла, следует немедленно снять из-за опасности воспламенения (т.е. для жидкостей с температурой вспышки < 100°F) сдвиг. (НИОСХ, 2016 г.)
(НИОСХ, 2016 г.)
Ткани для костюмов DuPont Tychem®
Легенда ткани Tychem®
| QS = Tychem 2000 SFR |
| Контроль качества = Tychem 2000 |
| SL = Tychem 4000 |
| C3 = Тайкем 5000 |
| ТФ = Тайкем 6000 |
| TP = Tychem 6000 FR |
| БР = Тайкем 9000 |
| RC = Tychem RESPONDER® CSM |
| ТК = Тайхем 10000 |
| RF = Tychem 10000 FR |
Детали тестирования
Данные о проницаемости ткани были созданы для DuPont независимым
испытательные лаборатории, использующие ASTM F739, EN369, EN 374-3, EN ISO 6529
(метод A и B) или методы испытаний ASTM D6978. Нормализованное время прорыва
(время, при котором скорость проникновения равна 0,1 мкг/см2/мин)
сообщается в минутах.
Все жидкие химикаты были протестированы при температуре от 20°C до
27°C, если не указано иное.
Различная температура может иметь существенное влияние на
время прорыва; скорость проникновения обычно увеличивается с
температура.
Все химические вещества имеют
были протестированы при концентрации более 95%, если не указано иное
заявил.Если не указано иное, проникновение измеряли для отдельных химических веществ.
Характеристики проникновения смесей могут значительно отличаться
от проникновения отдельных химических веществ.
Боевые отравляющие вещества (люизит, зарин, зоман, сера
Горчица, табун и нервно-паралитическое вещество VX) были протестированы при 22°C и 50%
относительная влажность согласно военному стандарту MIL-STD-282.
Нормализованное время прорыва
(время, при котором скорость проникновения равна 0,1 мкг/см2/мин)
сообщается в минутах.
Все жидкие химикаты были протестированы при температуре от 20°C до
27°C, если не указано иное.
Различная температура может иметь существенное влияние на
время прорыва; скорость проникновения обычно увеличивается с
температура.
Все химические вещества имеют
были протестированы при концентрации более 95%, если не указано иное
заявил.Если не указано иное, проникновение измеряли для отдельных химических веществ.
Характеристики проникновения смесей могут значительно отличаться
от проникновения отдельных химических веществ.
Боевые отравляющие вещества (люизит, зарин, зоман, сера
Горчица, табун и нервно-паралитическое вещество VX) были протестированы при 22°C и 50%
относительная влажность согласно военному стандарту MIL-STD-282.
| Химическая | Номер CAS | Состояние | КС | КК | СЛ | С3 | ТФ | ТП | БР | РЦ | ТК | РФ |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Циклогексан (>95%) | 110-82-7 | Жидкость | >480 | >480 | >480 | >480 | >480 | >480 | >480 |
Особые предупреждения от DuPont
- Прошитые и прошитые швы разлагаются некоторыми опасными жидкостями
химические вещества, такие как сильные кислоты, и не следует носить, когда
эти химические вещества присутствуют.

-
ВНИМАНИЕ: Эта информация основана на технических данных, которые
DuPont считает себя надежным. Он подлежит пересмотру, поскольку
приобретаются дополнительные знания и опыт. DuPont не производит
гарантия результата и не несет никаких обязательств или ответственности…
… в связи с этой информацией. Пользователь несет ответственность за определить уровень токсичности и соответствующие средства индивидуальной защиты. необходимое оборудование.Информация, изложенная в настоящем документе, отражает лабораторные производительность тканей, а не готовой одежды в контролируемых условиях. Он предназначен для информационного использования лицами, имеющими технические навыки для оценка в конкретных условиях конечного использования, по своему усмотрению и риск. Любой, кто намеревается использовать эту информацию, должен сначала проверить что выбранная одежда подходит для предполагаемого использования.
 Во многих случаях,
швы и застежки имеют более короткое время прорыва и более высокую проницаемость
цены, чем ткань.Пожалуйста, свяжитесь с DuPont для получения конкретных данных. Если ткань
порвется, истирается или прокалывается, или если швы или застежки выходят из строя, или если
прикрепленные перчатки, козырьки и т. д. повреждены, конечный пользователь должен прекратить использование
одежды, чтобы избежать потенциального воздействия химикатов. Поскольку условия использования
находятся вне нашего контроля, мы не даем никаких гарантий, явных или подразумеваемых,
включая, помимо прочего, отсутствие гарантий товарного состояния или пригодности
для конкретного использования и не несут никакой ответственности в связи с любым использованием
эта информация.Эта информация не предназначена в качестве лицензии на работу
в соответствии с или рекомендацией нарушить какой-либо патент или техническую информацию
компании DuPont или других лиц, охватывающих любой материал или его использование.
Во многих случаях,
швы и застежки имеют более короткое время прорыва и более высокую проницаемость
цены, чем ткань.Пожалуйста, свяжитесь с DuPont для получения конкретных данных. Если ткань
порвется, истирается или прокалывается, или если швы или застежки выходят из строя, или если
прикрепленные перчатки, козырьки и т. д. повреждены, конечный пользователь должен прекратить использование
одежды, чтобы избежать потенциального воздействия химикатов. Поскольку условия использования
находятся вне нашего контроля, мы не даем никаких гарантий, явных или подразумеваемых,
включая, помимо прочего, отсутствие гарантий товарного состояния или пригодности
для конкретного использования и не несут никакой ответственности в связи с любым использованием
эта информация.Эта информация не предназначена в качестве лицензии на работу
в соответствии с или рекомендацией нарушить какой-либо патент или техническую информацию
компании DuPont или других лиц, охватывающих любой материал или его использование.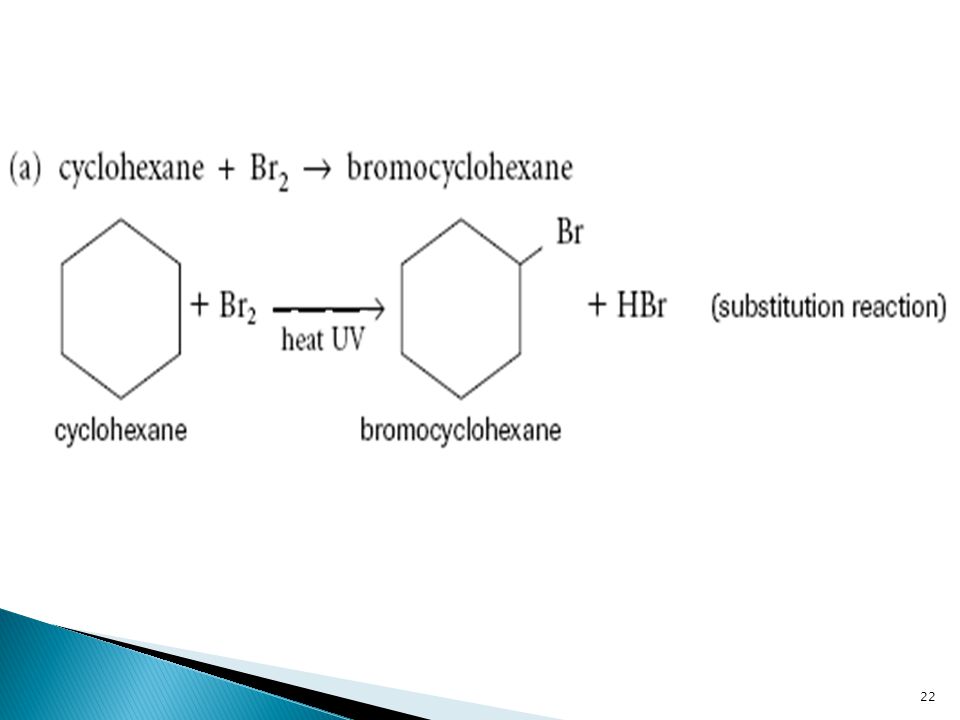
(Дюпон, 2018)
Первая помощь
ГЛАЗА: Сначала проверьте наличие у пострадавшего контактных линз и снимите их, если они есть. Промывать глаза пострадавшего водой или физиологическим раствором в течение 20–30 минут, одновременно звоня в больницу или токсикологический центр.Не закапывайте в глаза пострадавшему какие-либо мази, масла или лекарства без специальных указаний врача. НЕМЕДЛЕННО доставьте пострадавшего после промывания глаз в больницу, даже если симптомы (например, покраснение или раздражение) не развиваются.КОЖА: НЕМЕДЛЕННО промойте пораженные участки кожи водой, сняв и изолировав всю загрязненную одежду. Тщательно промойте все пораженные участки кожи водой с мылом. При появлении таких симптомов, как покраснение или раздражение, НЕМЕДЛЕННО вызовите врача и будьте готовы доставить пострадавшего в больницу для лечения.
ПРИ ВДЫХАНИИ: НЕМЕДЛЕННО покинуть зараженную зону; сделать глубокий вдох свежего воздуха.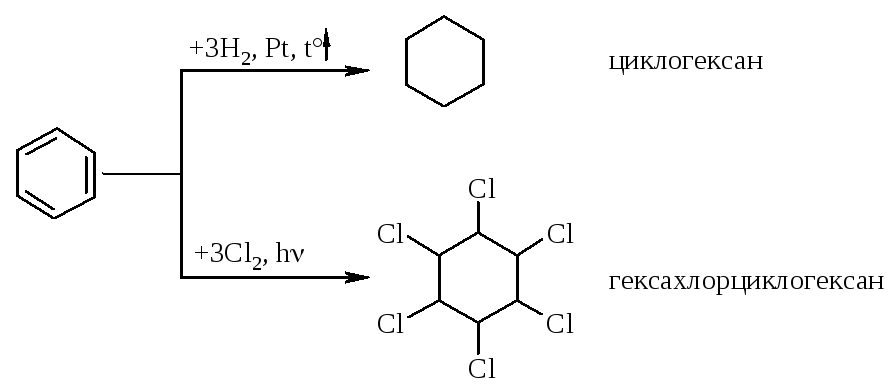 При появлении симптомов (таких как свистящее дыхание, кашель, одышка или жжение во рту, горле или груди) вызовите врача и будьте готовы доставить пострадавшего в больницу. Обеспечьте надлежащую защиту органов дыхания спасателям, входящим в неизвестную атмосферу. По возможности следует использовать автономный дыхательный аппарат (SCBA); если это невозможно, используйте уровень защиты выше или равный рекомендованному в разделе «Защитная одежда».
При появлении симптомов (таких как свистящее дыхание, кашель, одышка или жжение во рту, горле или груди) вызовите врача и будьте готовы доставить пострадавшего в больницу. Обеспечьте надлежащую защиту органов дыхания спасателям, входящим в неизвестную атмосферу. По возможности следует использовать автономный дыхательный аппарат (SCBA); если это невозможно, используйте уровень защиты выше или равный рекомендованному в разделе «Защитная одежда».
ПРОГЛАТЫВАНИЕ: НЕ ВЫЗЫВАТЬ РВОТУ. Летучие химические вещества имеют высокий риск попадания в легкие жертвы во время рвоты, что усугубляет проблемы со здоровьем. Если пострадавший в сознании и у него нет конвульсий, дайте 1-2 стакана воды для разбавления химиката и НЕМЕДЛЕННО позвоните в больницу или токсикологический центр. НЕМЕДЛЕННО доставьте пострадавшего в больницу. Если пострадавший находится в судорогах или без сознания, ничего не давать ртом, убедиться, что дыхательные пути пострадавшего открыты, и уложить пострадавшего на бок так, чтобы голова была ниже туловища. НЕ ВЫЗЫВАЕТ РВОТУ. НЕМЕДЛЕННО доставьте пострадавшего в больницу. (НТП, 1992 г.)
НЕ ВЫЗЫВАЕТ РВОТУ. НЕМЕДЛЕННО доставьте пострадавшего в больницу. (НТП, 1992 г.)
Физические свойства
Точка возгорания: -4°F (НТП, 1992 г.)
Нижний предел взрываемости (НПВ): 1,3 % (НТП, 1992 г.)
Верхний предел взрываемости (ВПВ): 8,4 % (НТП, 1992 г.)
Температура самовоспламенения: 518°F (Геологическая служба США, 1999 г.)
Температура плавления: 43,7 ° F (НТП, 1992 г.)
Давление газа: 95 мм рт.ст. при 68°F ; 100 мм рт.ст. в 77.9° по Фаренгейту (НТП, 1992 г.)
Плотность пара (относительно воздуха): 2,9 (НТП, 1992 г.)
Удельный вес: 0,779 при 68°F (Геологическая служба США, 1999 г.)
Точка кипения: 177,3 ° F при 760 мм рт.ст. (НТП, 1992 г.)
Молекулярная масса: 84,16 (НТП, 1992 г.)
Растворимость воды: менее 1 мг/мл при 63 ° F (НТП, 1992 г.)
Ионизационный потенциал:
9,88 эВ
(НИОСХ, 2016 г. )
)
ИДЛХ: 1300 частей на миллион Из расчета 10% нижнего предела взрываемости.(НИОСХ, 2016 г.)
AEGL (рекомендательные уровни острого воздействия)
Информация об AEGL отсутствует.
ERPG (Руководство по планированию реагирования на чрезвычайные ситуации)
Информация о ERPG отсутствует.PAC (критерии защитных действий)
| Химическая | ПАК-1 | ПАК-2 | ПАК-3 | |
|---|---|---|---|---|
| Циклогексан (110-82-7) | 300 частей на миллион | 1700 частей на миллион | 10000 частей на миллион | НПВ = 13000 частей на миллион |
(Министерство энергетики, 2016 г.)
Нормативная информация
То Поля нормативной информации включить информацию из У. S. Раздел III Агентства по охране окружающей среды Сводный список
списки,
Химический завод Министерства внутренней безопасности США
антитеррористические стандарты,
и Управление по охране труда и здоровья США
Перечень стандартов по управлению безопасностью технологического процесса при работе с особо опасными химическими веществами
(подробнее об этих
источники данных).
S. Раздел III Агентства по охране окружающей среды Сводный список
списки,
Химический завод Министерства внутренней безопасности США
антитеррористические стандарты,
и Управление по охране труда и здоровья США
Перечень стандартов по управлению безопасностью технологического процесса при работе с особо опасными химическими веществами
(подробнее об этих
источники данных).
Сводный перечень списков EPA
| Нормативное наименование | Номер CAS/ 313 Код категории |
EPCRA 302 EHS TPQ |
EPCRA 304 EHS RQ |
CERCLA RQ | ЭПКРА 313 ТРИ |
RCRA Код |
CAA 112(r) RMP TQ |
|---|---|---|---|---|---|---|---|
| Циклогексан | 110-82-7 | 1000 фунтов | 313 | У056 |
(Перечень списков Агентства по охране окружающей среды, 2015 г. )
)
Антитеррористические стандарты DHS Chemical Facility (CFATS)
Отсутствует нормативная информация.Список стандартов OSHA по управлению безопасностью процессов (PSM)
Отсутствует нормативная информация.Альтернативные химические названия
В этом разделе представлен список альтернативных названий этого химического вещества, включая торговые названия и синонимы.
- БЕНЗОЛА ГЕКСАГИДРИД
- БЕНЗОЛ, ГЕКСАГИДРО-
- БЕНЗОЛГЕКСАГИДРИД
- ЦИКЛОГЕКСАН
- ГЕКСАГИДРОБЕНЗОЛ
- ГЕКСАМЕТИЛЕН
- ГЕКСАНАФТЕН
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно.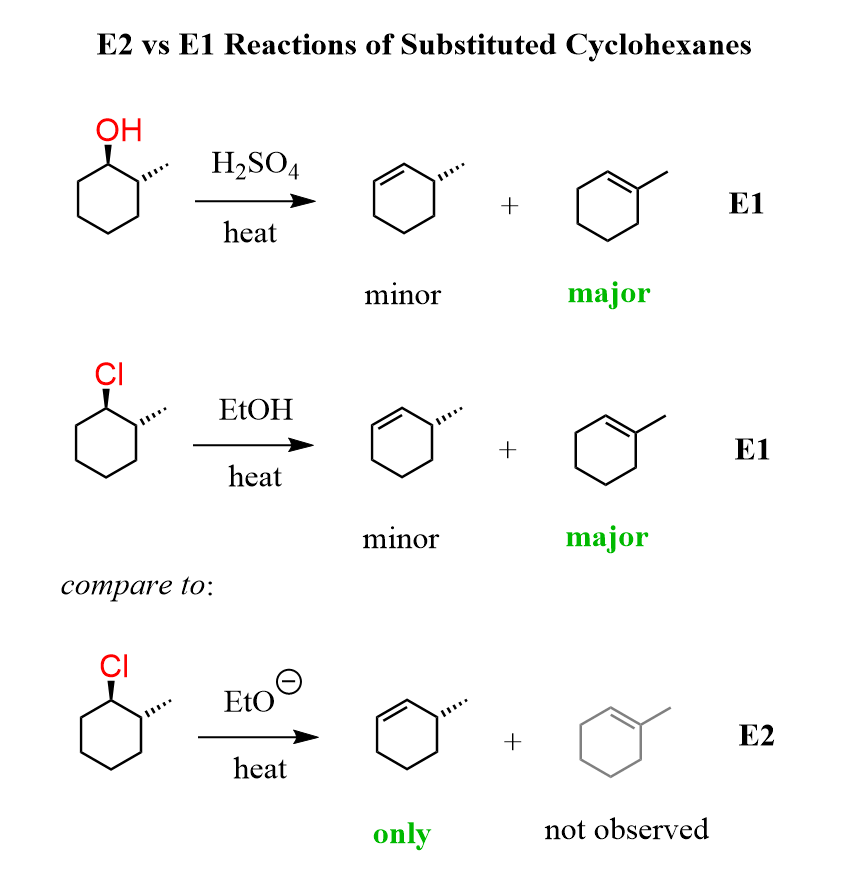 Ниже приведены наиболее распространенные причины:
Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Циклогексан — обзор | ScienceDirect Topics
5.1 МЕХАНИЗМ ДЕГИДРИРОВАНИЯ И ГАЗОВАЯ ФАЗА HO
• 2 -ЗАВИСИМЫЕ ЭЛЕМЕНТАРНЫЕ РЕАКЦИИВ настоящее время идея о том, что HO 2 • • играет ключевую роль в основе радикальной интерпретации камня несколько механизмов газофазных реакций окисления, которые вряд ли можно объяснить на основе различных предположений.
Например, в реакциях окисления, протекающих при относительно высоких температурах, в основном в виде окислительного дегидрирования и крекинга (выше 500 °С), радикалы HO • 2 становятся основными активными центрами радикального превращения субстрата. Как известно, эти радикалы образуются при диссоциации паров H 2 O 2 . Поэтому изучение окисления различных субстратов перекисью водорода может внести ясность в вопрос о радикальном действии HO 2 • на различные субстраты.
Как видно из предыдущей главы, дегидрирование различных субстратов в присутствии H 2 O 2 осуществляется по свободнорадикальному механизму, скорость которого в большей степени определяется HO 2 • концентрация радикалов в системе. При этом отмечается, что сопряженное дегидрирование пероксидом водорода осуществляется по механизму, принципиально отличному от высокотемпературного гомогенного окисления углеводородов молекулярным кислородом.Это подробно обсуждается в двух монографиях [1, 2]. Процессы окисления молекулярным кислородом сложны; поэтому при рассмотрении реакций с перекисью водорода следует учитывать некоторые особенности их механизма.
При этом отмечается, что сопряженное дегидрирование пероксидом водорода осуществляется по механизму, принципиально отличному от высокотемпературного гомогенного окисления углеводородов молекулярным кислородом.Это подробно обсуждается в двух монографиях [1, 2]. Процессы окисления молекулярным кислородом сложны; поэтому при рассмотрении реакций с перекисью водорода следует учитывать некоторые особенности их механизма.
Образование атомарного кислорода из H 2 O 2 при сопряженном дегидрировании углеводородов на стенках реактора маловероятно, но для обоснования возможности участия кислорода в дегидрировании, разложении закиси азота [3]:
N2O→ За его источник принят N2+O
.В присутствии бутана или циклогексана при 500-600 °С N 2 O разлагается на 25 и 30 мол. % соответственно [4, 5], т.е. разложение N 2 O не зависит от наличия в смеси углеводородов. .
Дегидрирование циклогексана в присутствии H 2 O 2 проявляет более высокую селективность при более высокой степени конверсии, чем в присутствии N 2 O [5]:
| 3 904 6 (%) 7 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| C 6 H 12 + H 2 O 2 2 | 20 | 4 | 9 | 98 | |||||
| C 6 H 12 + N 2 O | 9 | 2 | 7 | 80 |
Таким образом, дегидрирование пероксидом водорода имеет механизм, отличный от окислительного дегидрирования молекулярным кислородом в присутствии оксида азота. Как следствие, участие атома кислорода в качестве активного центра в сопряженном окислении субстрата пероксидом водорода практически маловероятно, а элементарные реакции с ним не должны учитываться в механизме. Этот вывод подтверждается процессом дегидрирования бутана как в присутствии перекиси водорода, так и закиси азота [6]. Во втором случае было обнаружено много побочных продуктов.
Как следствие, участие атома кислорода в качестве активного центра в сопряженном окислении субстрата пероксидом водорода практически маловероятно, а элементарные реакции с ним не должны учитываться в механизме. Этот вывод подтверждается процессом дегидрирования бутана как в присутствии перекиси водорода, так и закиси азота [6]. Во втором случае было обнаружено много побочных продуктов.
В соответствии с вышеизложенным, особый интерес представляет кинетическая оценка диссоциации H 2 O 2 до свободных радикалов HO 2 • и • OH.Диссоциация H 2 O 2 в газовой фазе является всесторонне изученной реакцией, протекающей по механизму (4.1), из которого выводится следующее уравнение:
(5.1)⌊HO2•⌋⌊ •OH⌋=k1k2 [h3O2]
Это дает возможность оценить соотношение концентраций активных центров в системе. Установлено [6, 7], что отношение в уравнении (5.1) находится в диапазоне от 10 3 до 10 7 , т.
Проиллюстрируем механизм дегидрирования субстрата перекисью водорода на модельном углеводороде — этилбензоле. Предположительно процесс состоит из следующих стадий [7] (тепловой эффект реакции указан в кДж/моль):
(5.2)h3O2→2•OH−217.9
(5.3)h3O2+ •OH→HO2• + H3O + 107,7
(5.4) C6H5C2H5 + •• OH → C6H5C2H5 • + H3O + 179.75
(5.5) C6H5C2H5 • → C6H5C2H4 + H-52.7
(5.6) C6H5C2H5 + HO2 • → C6H5C2H4 + H3O + •• О + 220,8
(5,7)h3O2+H→h3O+ ••OH+286.6
(5.8)C6H5C2H5+HO2•→C6H5C2h5•+h3O2+61.6
(5.9)-(5.10)HO2·+стенка→HO2(адс)· ·OH+стенка→ ·OH(адс)}→продукты
Данная схема учитывает три направления образования стирольных цепей в системе C 6 H 5 C 2 H 5 —H 2 O 2 —H 2 O 90. Образовавшийся на элементарной стадии (5.2) гидроксильный радикал расходуется в объеме на две возможные реакции (5. 3) и (5.4). Сравнение кинетических параметров элементарных стадий (5.3) и (5.4), энергии активации которых равны 4,2-8,4 [8] и 21-33,5 кДж/моль [9] соответственно, показывает, что скорость реакции (5.3) значительно превышает скорость реакции (5.4 ). Поэтому стадия (5.3) является наиболее вероятным путем расходования радикала • ОН в рассматриваемой системе.
3) и (5.4). Сравнение кинетических параметров элементарных стадий (5.3) и (5.4), энергии активации которых равны 4,2-8,4 [8] и 21-33,5 кДж/моль [9] соответственно, показывает, что скорость реакции (5.3) значительно превышает скорость реакции (5.4 ). Поэтому стадия (5.3) является наиболее вероятным путем расходования радикала • ОН в рассматриваемой системе.
Особое внимание следует обратить на то, что образование углеводородных радикалов в реакции:
RH+ •OH→R•+h3O
приведет к синтезу новых свободных радикалов RO • и RO 2 • при следующих стадии процесса.Помимо ненасыщенных соединений, превращение этих свободных радикалов будет индуцировать образование кислородсодержащих веществ и продуктов окислительного крекинга [10]. Однако в продуктах дегидрирования этилбензола органические кислородсодержащие соединения отсутствуют; в области относительно низких выходов стирола (около 20 %) продукты окислительного крекинга также не обнаружены [11]. Принимая во внимание это обстоятельство, можно предположить [7], что наиболее вероятной является элементарная стадия (5.6). Фактически энергия активации стадии (5.8) обычно превышает 52,4 кДж/моль (lg A (58) = 9,4 (см 3 /(моль с)) [12, 13], а энергия активации стадии (5.6) ниже 46,1 кДж/моль [7, 14] (lg A (5,8) = 9,6 (см 3 /(моль с))). Для реакций обрыва цепи за счет рекомбинации свободных радикалов • OH и HO 2 • на стенках кварцевого реактора вероятности их остановки определялись следующим образом: ε • OH = 0.5 · 10 −6 и ε HO•2 = 0,2 · 10 −5 [7, 15]. Таким образом, оценка результатов скоростей элементарных стадий (5.2)-(5.10) позволяет предположить, что сопряженное дегидрирование этилбензола представляет собой неразветвленную цепную реакцию с двумя стадиями развития цепи следующим образом:
Принимая во внимание это обстоятельство, можно предположить [7], что наиболее вероятной является элементарная стадия (5.6). Фактически энергия активации стадии (5.8) обычно превышает 52,4 кДж/моль (lg A (58) = 9,4 (см 3 /(моль с)) [12, 13], а энергия активации стадии (5.6) ниже 46,1 кДж/моль [7, 14] (lg A (5,8) = 9,6 (см 3 /(моль с))). Для реакций обрыва цепи за счет рекомбинации свободных радикалов • OH и HO 2 • на стенках кварцевого реактора вероятности их остановки определялись следующим образом: ε • OH = 0.5 · 10 −6 и ε HO•2 = 0,2 · 10 −5 [7, 15]. Таким образом, оценка результатов скоростей элементарных стадий (5.2)-(5.10) позволяет предположить, что сопряженное дегидрирование этилбензола представляет собой неразветвленную цепную реакцию с двумя стадиями развития цепи следующим образом:
h3O2+ ••OH→k (5. 3)HO2•+h3OC6H5C2H5+Oh3•→k(5.6)C6H5C2h4+h3O+ •OHC6H5C2H5+h3O2=C6H5C2h42h3O (общая реакция)
3)HO2•+h3OC6H5C2H5+Oh3•→k(5.6)C6H5C2h4+h3O+ •OHC6H5C2H5+h3O2=C6H5C2h42h3O (общая реакция)
На основе предложенного механизма и с помощью метода стационарной концентрации кинетическое уравнение скорости реакции:
(5.11)−d[EB]dt=keff[EB][h3O2]
keff=k(5,2)k(5,6)k(5,9)=0,35×1016exp(−231,707RT),1/(моль·с)
Это уравнение адекватно описывает экспериментальные данные в диапазоне 500-620 °С [6, 16].
Очевидно, что в выражение для k эфф не входит константа скорости реакции (5.3), поэтому реакция (5.6), протекающая с участием радикала НО 2 • , представляет собой лимитирующую стадию реакции распространение цепи.
Рассмотрим более подробно роль радикала HO 2 • в кинетике реакции газофазного окисления.В 1926 г. при исследовании окисления водорода молекулярным кислородом первоначально было предложено образование радикала HO 2 • по следующей реакции:
H+O2+M→HO2•+M
Затем Ллойд описание второго предела самовоспламенения [18], а Воеводский [19] использовал его для объяснения механизма образования перекиси водорода на третьем пределе самовоспламенения. В 1947 г. Элтентон предпринял первую попытку прямого обнаружения HO 2 • [20] масс-спектрометрическим методом в пламени C 3 H 8 и O 2 .В начале 1960-х годов Панфилову [21] методом электронного спинового резонанса (ЭПР) удалось обнаружить радикалы HO 2 • в замороженных продуктах сгорания водорода.
В 1947 г. Элтентон предпринял первую попытку прямого обнаружения HO 2 • [20] масс-спектрометрическим методом в пламени C 3 H 8 и O 2 .В начале 1960-х годов Панфилову [21] методом электронного спинового резонанса (ЭПР) удалось обнаружить радикалы HO 2 • в замороженных продуктах сгорания водорода.
Кинетический метод вымораживания радикалов HO 2 • и RO 2 • и анализ их спектров ЭПР в отношении окисления низших углеводородов подробно изложены в монографии [22]. Впервые (прямыми измерениями) однозначно показано, что области проявления отрицательных температурных коэффициентов при низко- и высокотемпературном окислении зависят от соотношения ]: при высокотемпературном окислении это отношение резко возрастает и радикалы НО • 2 становятся активными центрами в реакциях продолжения цепи.
Тальросе [23] и многие другие авторы [24, 25] представили интересную область участия радикалов HO 2 • : нелинейные реакции и озоносферные процессы, протекающие при образовании озона в атмосфере Земли и химические лазеры. .
.
Как следует из краткого рассмотрения роли радикалов HO 2 • в реакциях газофазного окисления, они являются ключевыми активными центрами в области высоких температур, а исследования гомогенного окислительного дегидрирования углеводородов выделяют доминирующие роль в образовании ненасыщенных соединений с ними.
В этом отношении предложенный выше механизм сопряженного дегидрирования этилбензола с перекисью водорода дает удовлетворительное объяснение образования стирола. Здесь центральное место принадлежит новой элементарной реакции:
(5.12)Общеизвестно, что реакции радикального замещения (где в результате взаимодействия между свободными радикалами и молекулами происходит перенос атома, чаще всего атома водорода, или радикала из молекулы в свободный радикал) в основном идут в сторону образования менее активного радикала.С этой точки зрения следует обсудить два конкурирующих элементарных этапа (5.6) и (5.8).
Стадия (5.6) отличается от обычных реакций радикального замещения (включая стадию (5.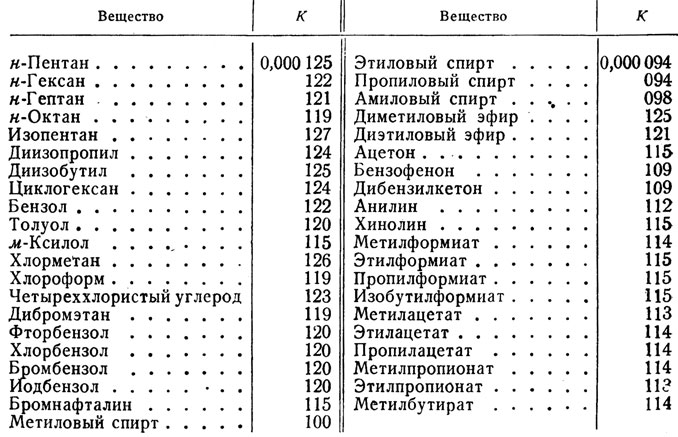 8)) одновременным переносом двух атомов водорода (или H + + e) от двух соседних атомов углерода (в молекуле этилбензола) на HO 2 • свободный радикал через гексазитное переходное состояние (I) образуется (согласно (5.6) это состояние диссоциирует на два устойчивых соединения, в настоящее время стирол и воду):
8)) одновременным переносом двух атомов водорода (или H + + e) от двух соседних атомов углерода (в молекуле этилбензола) на HO 2 • свободный радикал через гексазитное переходное состояние (I) образуется (согласно (5.6) это состояние диссоциирует на два устойчивых соединения, в настоящее время стирол и воду):
и • свободный радикал ОН, который намного активнее, чем исходный HO 2 • радикал.Если руководствоваться правилом, что реакция радикального замещения в основном развивается в сторону образования менее активного радикала [26], то можно ожидать преобладания стадии (5.8), а не (5.6). Однако, как следует из данных о тепловых эффектах реакций, стадия (5.6) несколько более экзотермическая, чем (5.8). Тогда, если в первом приближении использовать уравнение энергии активации:
E=11,5−0,25|q|
, что верно для реакций радикального замещения, выводятся следующие значения:
E(5.6)=20,1 кДж/мол и E(5. 8)=2,7 кДж/моль
8)=2,7 кДж/моль
Это указывает на предпочтение цепного процесса со стадией (5.6) над стадией (5.8). Кроме того, стадия (5.6) имеет еще одну особенность. В отличие от обычных реакций радикального замещения, он образует более активный свободный радикал • ОН, чем исходный радикал. Отсюда следует, что правило (реакция радикального замещения развивается в основном в сторону образования менее активного радикала), справедливое для радикального замещения с переносом только одного атома водорода, неверно для одновременного переноса двух атомов водорода от донора.
Объединяя вышеизложенные идеи, авторы заключают, что если в радикальной реакции синтезируются два конечных продукта и свободный радикал, то последний радикал может обладать более высокой активностью по сравнению с исходным радикалом (за счет выигрыша энергии при образовании второго вещества). Характерный для системы молекула-радикал принцип неразрушаемости свободной валентности [27] сохраняется и в этом случае, с той лишь разницей, что молекула субстрата при действии (5. 12) подвергается двухэлектронному окислению, в отличие от обычного реакции радикального замещения типов (5.4) и (5.8).
12) подвергается двухэлектронному окислению, в отличие от обычного реакции радикального замещения типов (5.4) и (5.8).
Как правило, предполагается, что если субстрат подвергается двухэлектронному переносу в одну стадию, то окисление осуществляется по молекулярному механизму. Справедливость этого утверждения однозначна; однако в контексте элементарных реакций типа (5.12) следует отметить, что субстрат действительно окисляется с двухэлектронным переносом за одно химическое действие, но в конце реакции свободная валентность сохраняется за счет образования второго вещества (H 2 О в случае реакции (5.12)).
С этих позиций в реакции (5.12) видно, что оба молекулярных продукта являются результатом окислительно-восстановительного действия между субстратом и радикалом. Такое парадоксальное, на первый взгляд, взаимодействие в системе молекула-радикал обладает всеми преимуществами молекулярного окислительно-восстановительного действия, поскольку позволяет превратить молекулу субстрата в конечный продукт, минуя стадию образования промежуточных реакционноспособных частиц (C 6 H 5 C 2 H 4 • для реакции (5. 8)). Эти реакции всегда высокоселективны и потребляют относительно мало энергии. Таким образом, уникальность радикала НО 2 • состоит в том, что по типу субстрата и условиям реакции он может быть как одноэлектронным (например, в реакции (5.8)) так и двухэлектронным окислителем (реакция (5.12)). Иными словами, хотя радикал НО 2 • взаимодействует с субстратом по радикальному механизму, сам субстрат трансформируется по молекулярному механизму.
8)). Эти реакции всегда высокоселективны и потребляют относительно мало энергии. Таким образом, уникальность радикала НО 2 • состоит в том, что по типу субстрата и условиям реакции он может быть как одноэлектронным (например, в реакции (5.8)) так и двухэлектронным окислителем (реакция (5.12)). Иными словами, хотя радикал НО 2 • взаимодействует с субстратом по радикальному механизму, сам субстрат трансформируется по молекулярному механизму.
С целью теоретического (квантово-механического) изучения способности радикала HO 2 • отрывать два атома водорода от молекулы субстрата в одну стадию, в рамках неэмпирической схемы [28] и на На основе STO-3G рассчитан тепловой эффект следующей модельной реакции:
C2H6+HO2•→C2h5+••OH+h3O
Все исходные и конечные соединения рассчитаны для оптимальных геометрических размеров реагирующих частиц. В результате установлено, что эта реакция экзотермическая (Δ q = 261. 4 кДж/моль). Это значение хорошо коррелирует с Δ q = 199 кДж/моль, полученным из справочных данных по энергии разрыва химической связи.
4 кДж/моль). Это значение хорошо коррелирует с Δ q = 199 кДж/моль, полученным из справочных данных по энергии разрыва химической связи.
В результате этих исследований делается вывод об отсутствии квантово-механических ограничений существования элементарной реакции (5.12). Более того, хорошая количественная корреляция свидетельствует о возможности ее протекания.
Кроме того, прояснился вопрос [28] о вероятности образования гексазитного переходного комплекса (II).
Предварительные приближенные расчеты переходного состояния в реакции C 2 H 6 + HO 2 • , выполненные также методом частичного резервирования двухцентрового дифференциального перекрытия (PRDDO) [29, 30], свидетельствуют взаимодействие замаскированной конформации этана (с расчетным барьером внутреннего вращения, равным 1,3 кДж/моль) и радикалом НО 2 • , приближающимся к ней в плоскости С—С. За координату реакции принимали расстояние между центрами связи С—С и О—О. Установлено, что переходному состоянию в реакции C 2 H 6 + HO 2 • соответствует плоская структура (II).
Установлено, что переходному состоянию в реакции C 2 H 6 + HO 2 • соответствует плоская структура (II).
Для переходного состояния (II) определены следующие структурные параметры: r (С—С) = 1,5 Å; r (О—О) = 1,51 Å; r (C—H) = 1,07 Å; r (О…Н) = 1,19 Å. Образование неподвижного плоского комплекса (II) свидетельствует об одновременном отрыве двух атомов водорода от молекулы C 2 H 6 .Энергия этого комплекса примерно на 838 кДж/моль выше полной энергии образования продукта реакции и может быть принята за верхнюю границу реакции. Полная оптимизация геометрии переходного состояния может вызвать некоторые отклонения от плоской структуры. Однако это не повлияет на принципиальную возможность существования гексазитного переходного состояния (II). По мере сближения продуктов связь О—О и две связи С—Н будут разрываться, образуя H 2 O и • OH, и расчетные данные будут приближаться к значению реального энергетического барьера.
Таким образом, квантово-механические исследования впервые наметили возможность двухэлектронного переноса в одну стадию по элементарной реакции (5.12), что расширило наши знания о свойствах HO 2 • свободный радикальные, еще относительно мало изученные, в процессах радикально-цепного окисления.
Элементарная реакция (5.12) была успешно применена для описания кинетики сопряженного дегидрирования различных субстратов с использованием соответствующих констант скорости взаимодействия между HO 2 • и RH.
Термическое окисление пропилена перекисью водорода осуществляется с образованием пропиленоксида, акролеина и аллена, а присутствующий в системе C 3 H 6 играет роль акцептора «активного кислорода» из • O—OH . Иными словами, сопряженное окисление пропилена пероксидом водорода также является HO 2 • -зависимой реакцией [31].
| Реакция | A (см 3 /моль с) | E (кДж/моль) |
|---|---|---|
0. 152 × 10 10 152 × 10 10 | 544 | 54,4 | 2 3 H 6 + • HO O 2 → CH 2 = C = CH 2 + H 2 O + OH | 0.154 × 10 14 | 65.7 | 65.7 | 3. C 3 H • 5 + HO O 2 → CH 2 = C- CHO + H 2 O | — | — |
Следует отметить, что для элементарных реакций (1) и (2) определенные кинетические параметры в некоторой степени согласуются с теорией [32] и результатами получен недавно в работе [33] по аррениусовским параметрам радикального присоединения НО 2 • к этилену (400-500 °С).Для реакции:
получены значения предэкспоненциального множителя и энергии активации, равные 10 -12…056 ± 0,35 см 3 /моль с соответственно.
Однако несколько заниженное значение предэкспоненциального множителя элементарной реакции (1) можно объяснить типом радикального взаимодействия HO 2 • .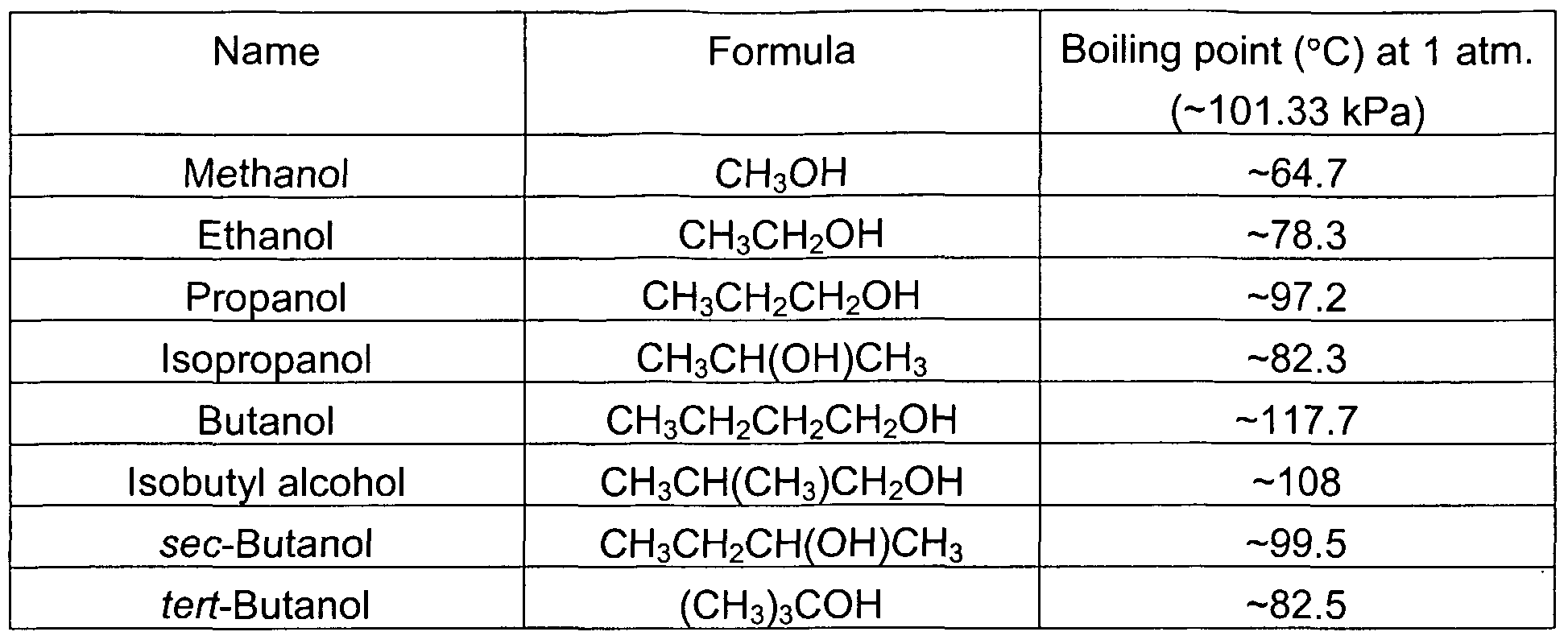
При изучении кинетики и механизма высокотемпературного окисления метана пероксидом водорода до водородсодержащего газа считается, что за образование конечных продуктов отвечает новая элементарная реакция, H 2 и CO 2 :
Ch3O+HO2•→h3+CO2+ ••OHlogA=10.3(см3/(моль с))E=14,2 кДж/моль
Кинетическая модель, основанная на свободнорадикальном механизме, включает эту стадию как одну из основных стадий реакции и адекватно описывает наблюдаемые в эксперименте закономерности. Кроме того, предлагаемый механизм содержит еще одну элементарную стадию с участием радикалов HO 2 • :
CO+HO2•→CO2+ ••OHlogA=14,18(см3/(моль с))E=99,1 кДж/моль
Подводя итоги, следует отметить, что реализация реакций селективного газофазного окисления, содержащих HO 2 • -зависимых элементарных стадий, управляющих ходом реакции, демонстрирует их универсальность в отношении высоких возможностей синтеза.
Это доказывается и теоретическими представлениями: реакции, реализуемые с участием свободных радикалов (в том числе НО 2 • ), гораздо менее чувствительны к изменению электронной плотности в молекулах субстрата по сравнению с реакциями, включающими промежуточные соединения полярных источник.
Почему циклогексен имеет более высокую температуру кипения, чем циклогексан? – Restaurantnorman.com
Почему циклогексен имеет более высокую температуру кипения, чем циклогексан?
Циклогексен является плоским и может собираться ближе друг к другу, что означает, что больше лондонских дисперсионных сил (ван-дер-ваальсовых (sp?) Для нас, стариков), удерживающих их вместе, требует больше энергии для их разделения и, соответственно, более высокую температуру кипения.В циклогексане торчат все эти осевые атомы водорода.
Почему циклогексан имеет более высокую температуру плавления, чем гексан?
Силы Ван-дер-Ваальса между молекулами обратно пропорциональны расстоянию между молекулами. Поскольку молекулы циклогексана плотно упакованы, молекулярные взаимодействия намного сильнее, чем у гексана. Следовательно, энергия, необходимая для разрыва связей и ее испарения, намного выше.
Имеет ли циклогексан температуру плавления?
177. 4°F (80,75°C)
4°F (80,75°C)
Почему циклопентан имеет более низкую температуру кипения, чем циклогексен?
Циклопентан, с другой стороны, обычно представляет собой «оболочку», которая допускает менее плотную упаковку. Точно так же циклогексан имеет очень плотную кристаллическую упаковку, что может объяснить его низкую температуру плавления. Затем, когда его кристаллическая структура растворяется, наша интуиция уступает место ожиданиям точки кипения.
Почему у циклоалканов более высокая температура кипения?
Циклоалканы похожи на алканы по своим общим физическим свойствам, но имеют более высокие температуры кипения, температуры плавления и плотности, чем алканы.Это связано с более сильными лондонскими силами, потому что форма кольца обеспечивает большую площадь контакта.
Почему более длинные алканы имеют более высокую температуру кипения?
Алканы имеют низкие температуры плавления или кипения из-за очень слабых межмолекулярных сил между молекулами алканов.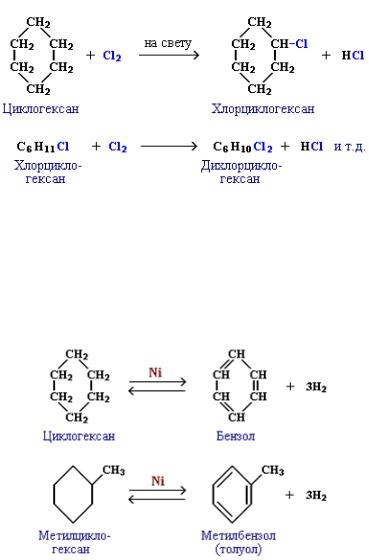 Это означает, что между молекулами действуют более (относительно) более сильные межмолекулярные силы. В результате требуется больше энергии, чтобы разрушить эти силы, и, таким образом, температуры плавления или кипения повышаются.
Это означает, что между молекулами действуют более (относительно) более сильные межмолекулярные силы. В результате требуется больше энергии, чтобы разрушить эти силы, и, таким образом, температуры плавления или кипения повышаются.
Как влияет разветвление на температуру плавления алканов?
Как влияет разветвление на температуры плавления и кипения алканов? Для одного и того же числа атомов С увеличение разветвленности приводит к более компактной молекуле, которая может более плотно упаковываться в кристаллическую решетку.Межмолекулярные силы притяжения Ван-дер-Ваальса сильнее и имеют более высокие точки плавления.
Что стабильнее E или Z?
Цис- или Z-изомеры менее стабильны и содержат больше молекул энергии, потому что они создают дестабилизирующий эффект, при котором две большие группы сталкиваются друг с другом, что приводит к электрическому отталкиванию. Поэтому, вообще говоря, транс-(Е)-изомеры более стабильны и обладают меньшей энергией, чем цис-(Z)-изомеры.
Является ли алкан более стабильным, чем алкен?
Алканы имеют одинарную связь, меньшую энергию, чем алкены и алкины, которые имеют соответственно две и три связи и более высокую энергию.Более высокая энергия означает более короткие связи, что означает более прочные связи. Но в этом случае более прочные связи в алкенах/алкинах имеют более высокую энергию связи и, следовательно, более нестабильны, чем алканы.
Какой алкен наименее стабилен?
Резюме: Стабильность алкенов По мере того, как связи С-Н заменяются связями С-С, стабильность алкена постепенно увеличивается в ряду моно (наименее устойчивый) < ди < три < тетразамещенный (наиболее устойчивый).
Почему алкены более стабильны, чем алканы?
Алкены являются относительно стабильными соединениями, но более реакционноспособны, чем алканы, из-за реакционной способности углерод-углеродной π-связи.Большинство реакций алкенов включают присоединения к этой π-связи с образованием новых одинарных связей. Двойная углерод-углеродная связь в алкенах, таких как этен, реагирует с концентрированной серной кислотой.
Двойная углерод-углеродная связь в алкенах, таких как этен, реагирует с концентрированной серной кислотой.
С какими реагентами реагируют алкены?
Гидрогалогенирование. Алкены и алкины могут реагировать с галогеноводородами, такими как HCl и HBr. Гидрогалогенирование дает соответствующие винилгалогениды или алкилдигалогениды, в зависимости от количества добавленных эквивалентов НХ.
Почему бут-2-ен является основным?
Таким образом, глядя на количество алкильных групп, присоединенных к алкену, можно определить степень замещения и, следовательно, основные и второстепенные продукты.Для бут-2-ена к алкену присоединены 2 алкильные группы. Он является более замещенным, поэтому основным продуктом.
Почему нуклеофил не может атаковать алкен?
Алкен представляет собой естественно богатую электронами систему, поэтому электрофилы, а не нуклеофилы, по своей природе будут притягивать их, но нуклеофилы будут привлекать их с приемлемой степенью дефицита электронов, вызванного EWG.
Какой сайт является местом реакции в алкенах?
Алкены вступают в реакции присоединения по месту двойных связей.Пи-связь действует как источник электронов и может иметь реакцию электрофильного присоединения для синтеза насыщенных соединений.
Подвергаются ли гидратации алкены?
Гидратация алкенов Чистое присоединение воды к алкенам известно как гидратация. В результате происходит разрыв пи-связи в алкене и связи ОН в воде и образование связи С-Н и связи С-ОН.
Почему у циклогексана высокая температура кипения? — Ответы на все
Почему у циклогексана высокая температура кипения?
Поскольку молекулы циклогексана плотно упакованы, молекулярные взаимодействия намного сильнее, чем у гексана.Следовательно, энергия, необходимая для разрыва связей и ее испарения, намного выше. Следовательно, циклогексан имеет более высокую температуру кипения.
Почему циклогексан имеет более высокую температуру плавления, чем метилциклогексан?
Циклогексан имеет высокую степень симметрии, и это позволяет молекулам хорошо упаковываться в кристаллическую структуру с сильными лондонскими дисперсионными силами между ними.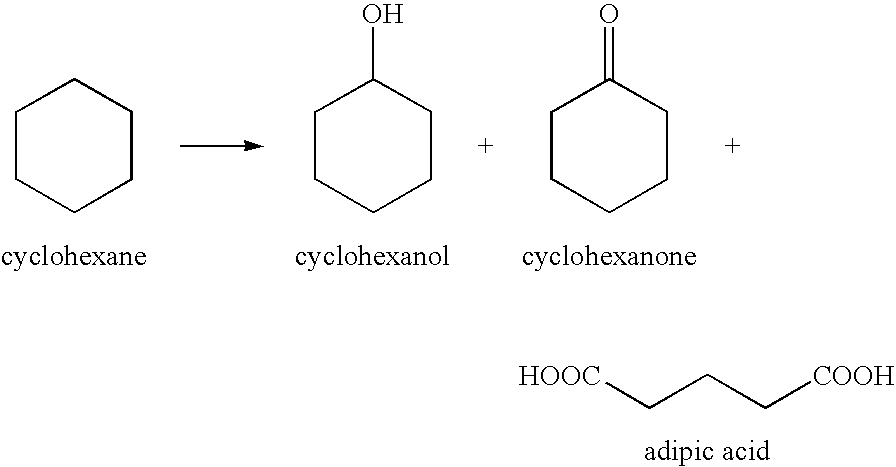 Таким образом, циклогексен имеет гораздо более низкую температуру плавления, чем циклогексан (-103,5 ° C против 6,5 ° C). С).
Таким образом, циклогексен имеет гораздо более низкую температуру плавления, чем циклогексан (-103,5 ° C против 6,5 ° C). С).
Почему циклопентан имеет более низкую температуру кипения, чем циклогексан?
Циклопентан, с другой стороны, обычно представляет собой «оболочку», которая допускает менее плотную упаковку.Точно так же циклогексан имеет очень плотную кристаллическую упаковку, что может объяснить его низкую температуру плавления. Затем, когда его кристаллическая структура растворяется, наша интуиция уступает место ожиданиям точки кипения.
Почему циклогексан имеет более низкую температуру кипения, чем толуол?
Поскольку циклогексан имеет более низкую температуру кипения, чем толуол, он достигает фазового перехода быстрее, что дает гораздо более короткое время удерживания, чем у толуола. Как при простой, так и при фракционной перегонке результаты ГХ показывают, что циклогексан имеет более короткое время удерживания, чем толуол, во всех трех фракциях.
Какова температура кипения толуола?
231,1°F (110,6°C)
Каковы температуры кипения циклогексана и толуола?
Например, смесь циклогексана и толуола в равных пропорциях имеет температуру кипения 90 °C, в результате чего образуется пар, состоящий из 80 % циклогексана и 20 % толуола, и получается дистиллят с чистотой 80 %.
Почему точка кипения важна при перегонке?
Точки кипения и давление паров каждого отдельного вещества указывают на относительную летучесть химического вещества по отношению к остальной части смеси.Определение давления паров и, в свою очередь, относительной летучести покажет, насколько сложно будет разделить вещества в смеси путем перегонки.
Что более летучее, циклогексан или толуол?
Циклогексан и толуол: Циклогексан имеет более низкую температуру кипения (80,74°C) и более летуч. Температура кипения толуола 110,6°С. Толуол не кипит при той же температуре, что и циклогексан, поэтому циклогексан выкипит из смеси первым.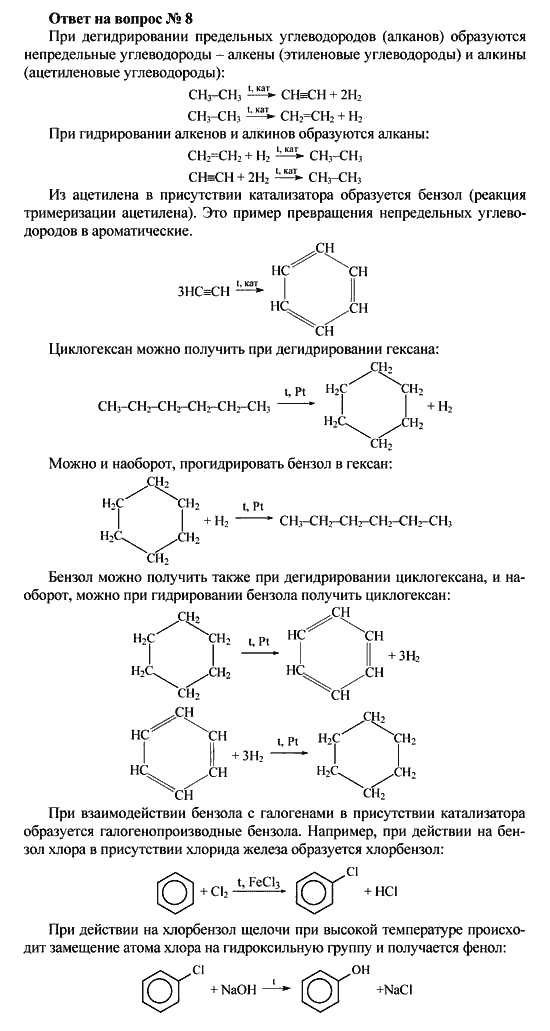
Почему толуол имеет высокую температуру кипения?
Более низкая симметрия молекул толуола не позволяет им упаковываться так же эффективно, как молекулы бензола.Напротив, температура кипения толуола выше, чем у бензола, что указывает на то, что силы межмолекулярного притяжения в жидком толуоле больше, чем в жидком бензоле.
Какой метод дистилляции более эффективен?
фракционная перегонка
Как найти температуру кипения при перегонке?
Точки кипения обычно измеряются путем записи температуры кипения (или интервала кипения) на термометре во время дистилляции. Этот метод используется всякий раз, когда соединения достаточно для проведения дистилляции.
Как записывать температуру кипения?
мини-весы
- Поместите кипящий камень в мини-пробирку.
- добавьте около 1/2 дюйма жидкости. Зажим
- в стойке вытяжного шкафа.
- вставьте термометр в пробирку так, чтобы дно ртутной колбы находилось примерно на 1/2–1 дюйм выше жидкости.

- осторожно нагревайте с помощью мини-горелки Бунзена, пока температура не станет постоянной.
- чтение температуры.
Что такое диаграмма температуры кипения?
Диаграмма температуры кипения показывает, как равновесные составы компонентов в жидкой смеси изменяются в зависимости от температуры при фиксированном давлении.Точка росы – это температура, при которой насыщенный пар начинает конденсироваться. Точка насыщения – это температура, при которой жидкость начинает кипеть.
Какой элемент имеет самую высокую температуру кипения?
Вольфрам
Как давление влияет на температуру кипения?
Атмосферное давление и кипение Давление газа над жидкостью влияет на температуру кипения. В открытой системе это называется атмосферным давлением. Чем выше давление, тем больше энергии требуется для кипения жидкости и тем выше температура кипения
Что такое нормальная температура кипения и стандартная температура кипения?
Существует два соглашения относительно стандартной температуры кипения воды: Нормальная температура кипения равна 99. 97 ° C (211,9 ° F) при давлении 1 атм (т. Е. 101,325 кПа). Рекомендуемая IUPAC стандартная температура кипения воды при стандартном давлении 100 кПа (1 бар) составляет 99,61 ° C (211,3 ° F).
97 ° C (211,9 ° F) при давлении 1 атм (т. Е. 101,325 кПа). Рекомендуемая IUPAC стандартная температура кипения воды при стандартном давлении 100 кПа (1 бар) составляет 99,61 ° C (211,3 ° F).
Является ли точка кипения прямо пропорциональной температуре плавления?
Показано, что взаимосвязь между температурой плавления и температурой кипения зависит от числа молекулярной симметрии и модифицированного подсчета общего числа атомов в молекуле. Корреляции для температуры кипения и точки плавления имеют среднеквадратичную ошибку 28 и 36°С соответственно.1994 г. 7 月1 日
3 тенденции, влияющие на температуру кипения — Мастер органической химии
Уже доступно — загрузите этот потрясающий (бесплатный) 3-страничный раздаточный материал о том, как решать распространенные проблемы с температурой кипения. С 10 примерами решенных задач! (Также содержит все ключевые моменты, обсуждаемые в этом посте)
MOC_Boiling_Point_Handout (PDF)
Выяснение порядка точек кипения — это понимание тенденций . Ключевым моментом здесь является то, что точки кипения отражают силу сил между молекулами.Чем больше они слипаются, тем больше энергии потребуется, чтобы выбросить их в атмосферу в виде газов.
Ключевым моментом здесь является то, что точки кипения отражают силу сил между молекулами.Чем больше они слипаются, тем больше энергии потребуется, чтобы выбросить их в атмосферу в виде газов.
Необходимо учитывать 3 важные тенденции.
- Относительная сила четырех межмолекулярных сил: ионные > водородные связи > диполь-диполь > дисперсионные силы Ван-дер-Ваальса. Влияние каждой из этих сил притяжения будет зависеть от присутствующих функциональных групп.
- Температуры кипения увеличиваются по мере увеличения количества атомов углерода.
- Разветвление снижает температуру кипения.
Давайте посмотрим поближе:.
Содержание
- Тенденция № 1: Относительная сила четырех межмолекулярных сил
- Тенденция № 2. Для молекул с заданной функциональной группой температура кипения увеличивается с увеличением молекулярной массы
- Роль симметрии ( или их отсутствие) О температурах плавления и кипения
1.
 Тренд №1: Относительная сила четырех межмолекулярных сил.
Тренд №1: Относительная сила четырех межмолекулярных сил. Сравните различные производные бутанового спирта, показанные ниже.Молекулы диэтилового эфира C4h20O удерживаются вместе за счет диполь-дипольных взаимодействий, возникающих за счет поляризованных связей С-О. Сравните его температуру кипения (35°С) с температурой его изомера бутанола (117°С). Значительно повышенная температура кипения обусловлена тем, что бутанол содержит гидроксильную группу, способную образовывать водородные связи. Тем не менее, силы притяжения в бутаноле бледнеют по сравнению с силами притяжения соли бутоксида натрия, которая плавит при чрезвычайно высокой температуре (намного выше 260 °C) и фактически разлагается, не успев превратиться в жидкость.
Тогда подумайте о бутане, C4h20, который не содержит полярных функциональных групп. Единственными силами притяжения между отдельными молекулами бутана являются относительно слабые дисперсионные силы Ван-дер-Ваальса. В результате бутан кипит при температуре замерзания воды (0°С), что намного ниже даже температуры диэтилового эфира.
Мораль истории : среди молекул с примерно одинаковыми молекулярными массами точки кипения будут определяться присутствующими функциональными группами.
Вы могли бы рассказать аналогичную историю для подобных изомеров амина и карбоновой кислоты, показанных ниже.
Предыдущее обсуждение четырех межмолекулярных сил см. здесь. Ссылку в учебнике Ройша см. здесь.
2. Тенденция №2 – Для молекул с данной функциональной группой температура кипения увеличивается с увеличением молекулярной массы.
Посмотрите на резкий рост температуры кипения при увеличении молекулярной массы во всех этих рядах:
Вот вопрос: Как, , межмолекулярные силы увеличиваются при увеличении молекулярной массы?
Основная сила, действующая здесь, — это дисперсионные силы Ван-дер-Ваальса, которые пропорциональны площади поверхности .Поэтому, увеличивая длину цепи, вы также увеличиваете площадь поверхности, а это означает, что вы увеличиваете способность отдельных молекул притягиваться друг к другу.
На интуитивном уровне эти длинные молекулы можно сравнить с нитями спагетти: чем длиннее лапша, тем больше усилий требуется, чтобы разорвать ее на части. По мере увеличения длины цепи будут области, в которых они могут очень хорошо выстраиваться рядом друг с другом.
По отдельности каждое взаимодействие может не иметь большого значения, но когда вы суммируете их все по всей длине цепи, дисперсионные силы Ван-дер-Ваальса могут оказывать огромное влияние.
3. Роль симметрии (или ее отсутствия) в температурах плавления и кипения
Это еще один побочный продукт зависимости дисперсионных сил Ван-дер-Ваальса от площади поверхности – чем более стержнеподобны молекулы, тем лучше в состоянии они будут выстроиться в линию и связи. Возьмем еще один интуитивный пример с макаронами. Что лучше слипается: спагетти или макароны? Чем более сфероподобна молекула, тем меньше будет площадь ее поверхности и тем меньше будет действовать межмолекулярных ван-дер-ваальсовых взаимодействий. Сравните температуры кипения пентана (36°С) и 2,2-диметилпропана (9°С).
Сравните температуры кипения пентана (36°С) и 2,2-диметилпропана (9°С).
Это также может относиться к молекулам с водородными связями, таким как спирты — сравните, например, температуры кипения 1-пентанола с 2-пентанол и 3-пентанол. Гидроксильная группа 1-пентанола более «открыта», чем в 3-пентаноле (который окружен двумя объемистыми алкильными группами), поэтому она будет лучше способна образовывать водородные связи со своими собратьями.
Таким образом, есть три основных фактора, о которых вам следует помнить, когда вы сталкиваетесь с вопросом о точках кипения.1) какие межмолекулярные силы будут присутствовать в молекулах? 2) как соотносятся молекулярные массы? 3) как соотносятся симметрии?
Последний быстрый вопрос на дороге (см. ответ в комментариях).
П.С. Новинка! Ознакомьтесь с этим бесплатным 3-страничным раздаточным материалом по решению распространенных задач на экзаменах по температуре кипения!
MOC_Точка кипения_Раздаточный материал (PDF)
.

