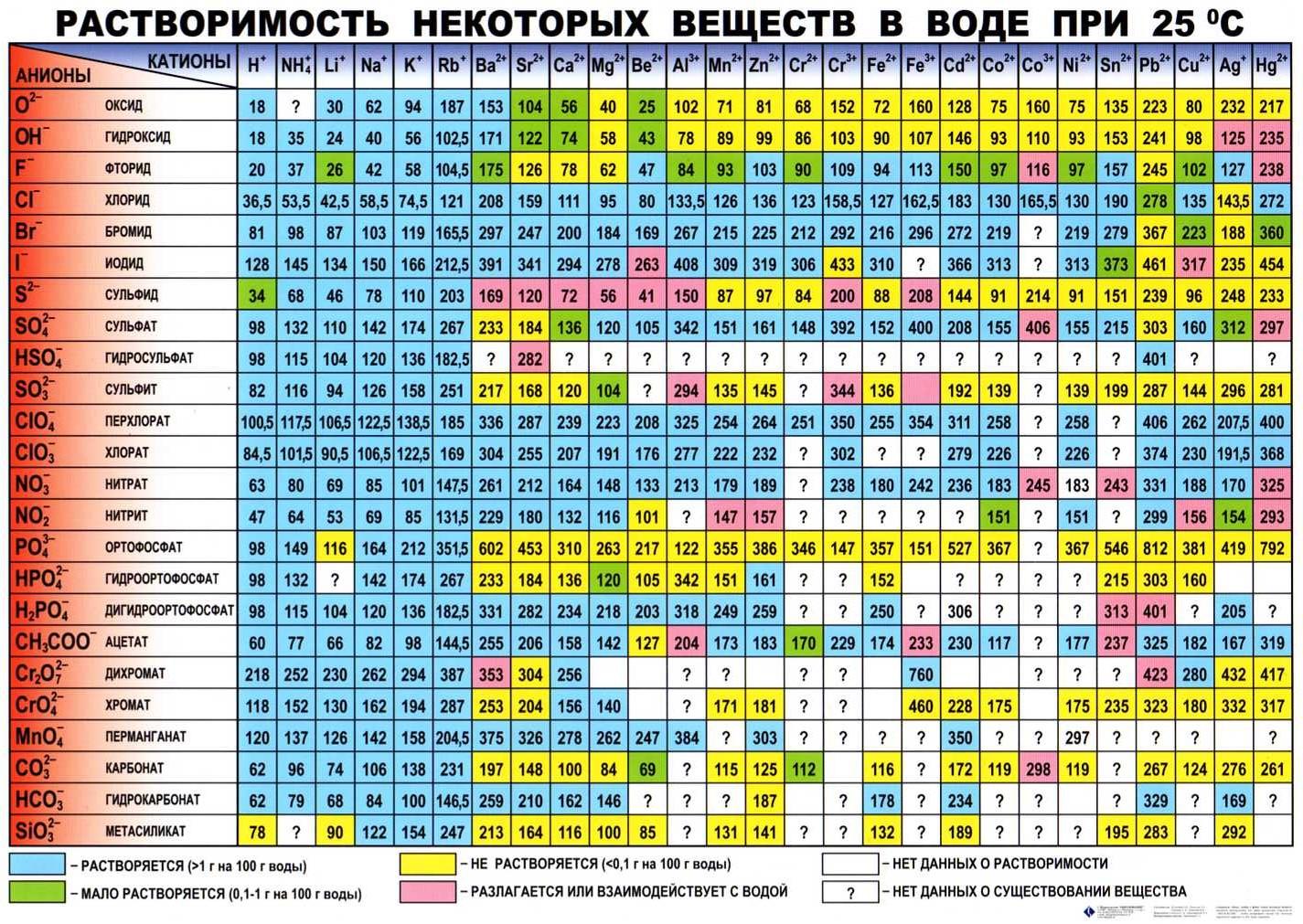
Таблица растворимости в воде
Таблица растворимости солей, кислот, оснований в воде
(при комнатной температуре)
| Катионы | Анионы | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| OH— | F— | Cl— | Br— | I— | S2- | NO3— | CO32- | SiO32- | SO |
PO43- | |
| H+ | Р | Р | Р | Р | Р | М | Р | — | Н | Р | Р |
| Na+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| K+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| NH4 |
Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| Mg2+ | Н | РК | Р | Р | Р | М | Р | Н | РК | Р | РК |
| Ca2+ | М | НК | Р | Р | Р | М | Р | Н | РК | М | РК |
| Sr2+ | М | НК | Р | Р | Р | Р | Н | РК | РК | РК | |
| Ba2+ | Р | РК | Р | Р | Р | Р | Р | Н | РК | НК | РК |
| Sn2+ | Н | Р | Р | Р | М | РК | Р | Н | Н | Р | Н |
| Pb2+ | Н | Н | М | М | М | РК | Р | Н | Н | Н | |
| Al3+ | Н | М | Р | Р | Р | Г | Р | Г | НК | Р | РК |
| Cr3+ | Н | Р | Р | Р | Р | Г | Р | Г | Н | Р | РК |
| Mn2+ | Н | Р | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Fe2+ | Н | М | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Fe3+ | Н | Р | Р | Р | — | — | Р | Г | Н | Р | РК |
| Co2+ | Н | М | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Ni2+ | Н | М | Р | Р | РК | Р | Н | Н | Р | Н | |
| Cu2+ | Н | М | Р | Р | — | Н | Р | Г | Н | Р | Н |
| Zn2+ | Н | М | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Cd2+ | Н | Р | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Hg2+ | Н | Р | Р | М | НК | НК | Р | Н | Н | Р | Н |
| Hg22+ | Н | Р | НК | НК | НК | РК | Р | Н | Н | М | Н |
| Ag+ | Н | Р | НК | НК | НК | НК | Р | Н | Н | М | Н |
Условные обозначения:
Р – вещество хорошо растворимо в воде
М – малорастворимо
Н – практически нерастворимо в воде, но легко растворяется в слабых или разбавленных кислотах
РК – нерастворимо в воде и растворяется только в сильных неорганических кислотах
НК – нерастворимо ни в воде, ни в кислотах
Г – полностью гидролизуется при растворении и не существует в контакте с водой
— вещество вообще не существует
Растворимость в воде некоторых веществ
| Поваренная соль | Хорошо растворима |
| Сахар | Хорошо растворим |
| Сера | Не растворима |
| Кислород | Мало растворим |
| Азот | Мало растворим |
| Медный купорос | Хорошо растворим |
| Питьевая сода | Хорошо растворима |
| Этиловый спирт | Смешивается в любых соотношениях |
| Мел | Не растворим |
| Железо | Не растворимо |
| Алюминий | Не растворим |
| Медь | Не растворима |
| Олово | Не растворимо |
| Свинец | Не растворим |
| Цинк | Не растворим |
| Алмаз | Не растворим |
| Графит | Не растворим |
| Иод | Мало растворим |

Чтобы произвести расчеты, необходимо разрешить элементы ActiveX!Больше интересного в телеграм @calcsbox
Таблица растворимости — катионы & анионы
Растворимостью называется способность одного или нескольких веществ вступать в реакцию с другими веществами таким образом, чтобы в результате получалась однородная система. При этом оба вещества распадаются на молекулы, атомы или ионы.
Наравне с таблицей периодической системы Д. И. Менделеева, таблица растворимости является основным теоретическим пособием при изучении химии. Не все вещества взаимодействуют между собой одинаково. Начинающие химики, учащиеся школ, колледжей и вузов не всегда могут запомнить степень растворимости в воде тех или иных веществ. Именно поэтому таблицу периодической системы Менделеева и таблицу растворимости можно увидеть в каждом кабинете или классе химии, каждой лаборатории.
То или иное сочетание веществ из таблицы может вступать в семь различных реакций с водой: хорошо растворяется в воде; практически не растворяется в воде; растворяется в слабых и разбавленных кислотах и почти не растворяется в воде; растворяется только в сильных неорганических кислотах, не растворяясь при этом в воде; не растворяется ни в кислотах, ни в воде; не существует при контакте с водой, но полностью гидролизируется при растворении; вещество не существует.
Чаще всего таблица растворимости применяется при решении уравнений с участием ионных реакций. Реакция возможна только в том случае, если конечный продукт малорастворим или нерастворим вообще.
Условные обозначения в таблице растворимости:
| Р | Вещество хорошо растворимо в воде |
| М | Малорастворимо |
| Н | Практически нерастворимо в воде, но легко растворяется в слабых или разбавленных кислотах |
| РК | Нерастворимо в воде и растворяется только в сильных неорганических кислотах |
| НК | нерастворимо ни в воде, ни в кислотах |
| Г | полностью гидролизуется при растворении и не существует в контакте с водой |
| – | вещество вообще не существует |
| Катионы | Анионы | ||||||||||
| OH– | F– | Cl– | Br– | I– | S2- | NO3– | CO32- | SiO32- | SO42- | PO43- | |
| H+ | Р | Р | Р | Р | Р | М | Р | – | Н | Р | Р |
| Na+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| K+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| NH4+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| Mg2+ | Н | РК | Р | Р | Р | М | Р | Н | РК | Р | РК |
| Ca2+ | М | НК | Р | Р | Р | М | Р | Н | РК | М | РК |
| Sr2+ | М | НК | Р | Р | Р | Р | Р | Н | РК | РК | РК |
| Ba2+ | Р | РК | Р | Р | Р | Р | Р | Н | РК | НК | РК |
| Sn2+ | Н | Р | Р | Р | М | РК | Р | Н | Н | Р | Н |
| Pb2+ | Н | Н | М | М | М | РК | Р | Н | Н | Н | Н |
| Al3+ | Н | М | Р | Р | Р | Г | Р | Г | НК | Р | РК |
| Cr3+ | Н | Р | Р | Р | Р | Г | Р | Г | Н | Р | РК |
| Mn2+ | Н | Р | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Fe2+ | Н | М | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Fe3+ | Н | Р | Р | Р | – | – | Р | Г | Н | Р | РК |
| Co2+ | Н | М | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Ni2+ | Н | М | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Cu2+ | Н | М | Р | Р | – | Н | Р | Г | Н | Р | Н |
| Zn2+ | Н | М | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Cd2+ | Н | Р | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Hg2+ | Н | Р | Р | М | НК | НК | Р | Н | Н | Р | Н |
| Hg22+ | Н | Р | НК | НК | НК | РК | Р | Н | Н | М | Н |
| Ag+ | Н | Р | НК | НК | НК | НК | Р | Н | Н | М | Н |
Растворимость солей таблицы — Справочник химика 21
Какую массу медного купороса, содержащего 5% примесей, и какую массу воды надо взять для получения насыщенного при 80 °С раствора, чтобы в результате охлаждения до 10 °С получить 30 г перекристаллизованной соли, считая, что процесс будет проведен без потерь (Растворимость соли при указанных температурах возьмите из таблицы 2 приложения.
 ) [c.67]
) [c.67]Рассмотрите таблицу, в которой показана растворимость солей в зависимости от температуры (см. табл. 2 приложения), и укажите те соли, для которых очистка перекристаллизацией особенно эффективна. Для двух выбранных солей изобразите график зависимости растворимости от температуры. [c.67]
Таблица растворимости солей й оснований в воде [c.261]
ТАБЛИЦА 126. РАСТВОРИМОСТЬ СОЛЕЙ никеля и кобальта в этилацетате [c.577]
Эта классификация, как видно из табл. 1, сохранила свое значение до настоящих дней. Однако теоретического обоснования она не получила и до сих пор с периодическим законом не связывалась. Наоборот, Н. А. Меншуткин [7] называет ее искусственной, построенной на свойствах и реакциях некоторых химических соединений, применяемых в анализе . Зарубежные школы рассматривают эту классификацию как условную, основанную на специфической растворимости солей (Тредвелл-Голл [8]), и с периодической системой ее не связывают казалось бы естественным, при разделении металлов на аналитические группы, расположить их согласно периодической системе элементов.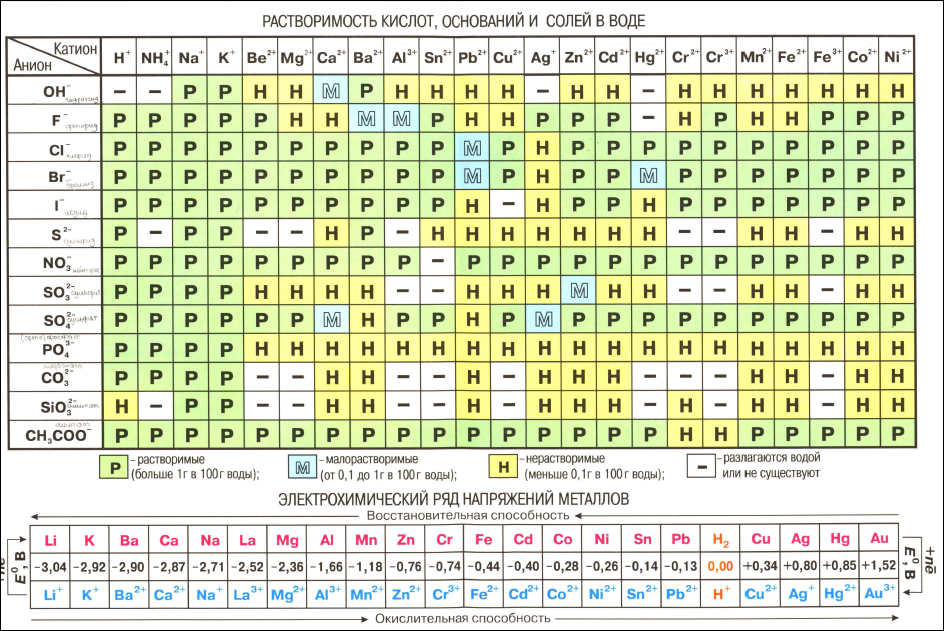 Однако периодическая система имеет весьма малое значение для качественных разделений, основанных на различной растворимости солей. Таблицы растворимости являются лучшим источником для объяснения классификаций и группировок, принятых в аналитической химии (Джон Уэр [9]). [c.5]
Однако периодическая система имеет весьма малое значение для качественных разделений, основанных на различной растворимости солей. Таблицы растворимости являются лучшим источником для объяснения классификаций и группировок, принятых в аналитической химии (Джон Уэр [9]). [c.5]
Ю. Ю. Лурье. Расчетные и справочные таблицы для химиков. Госхимиздат, 1947 (332 стр.). Книга является справочником для аналитиков химических лабораторий. В ней помещены основные справочные и расчетные таблицы. Приведены таблицы факторов, величины эквивалентных и молекулярных весов наиболее важных соединений, данные о растворимости солей, константы диссоциации кислот и оснований, таблицы окислительных потенциалов и потенциалов полуволн, сведения об индикаторах методов нейтрализации и окисления-восстановления и т. д., а также таблицы логарифмов и ряд других величин. [c.484]
Пользуясь таблицей растворимости солей и оснований в воде, выписать формулы и названия сульфидов [c.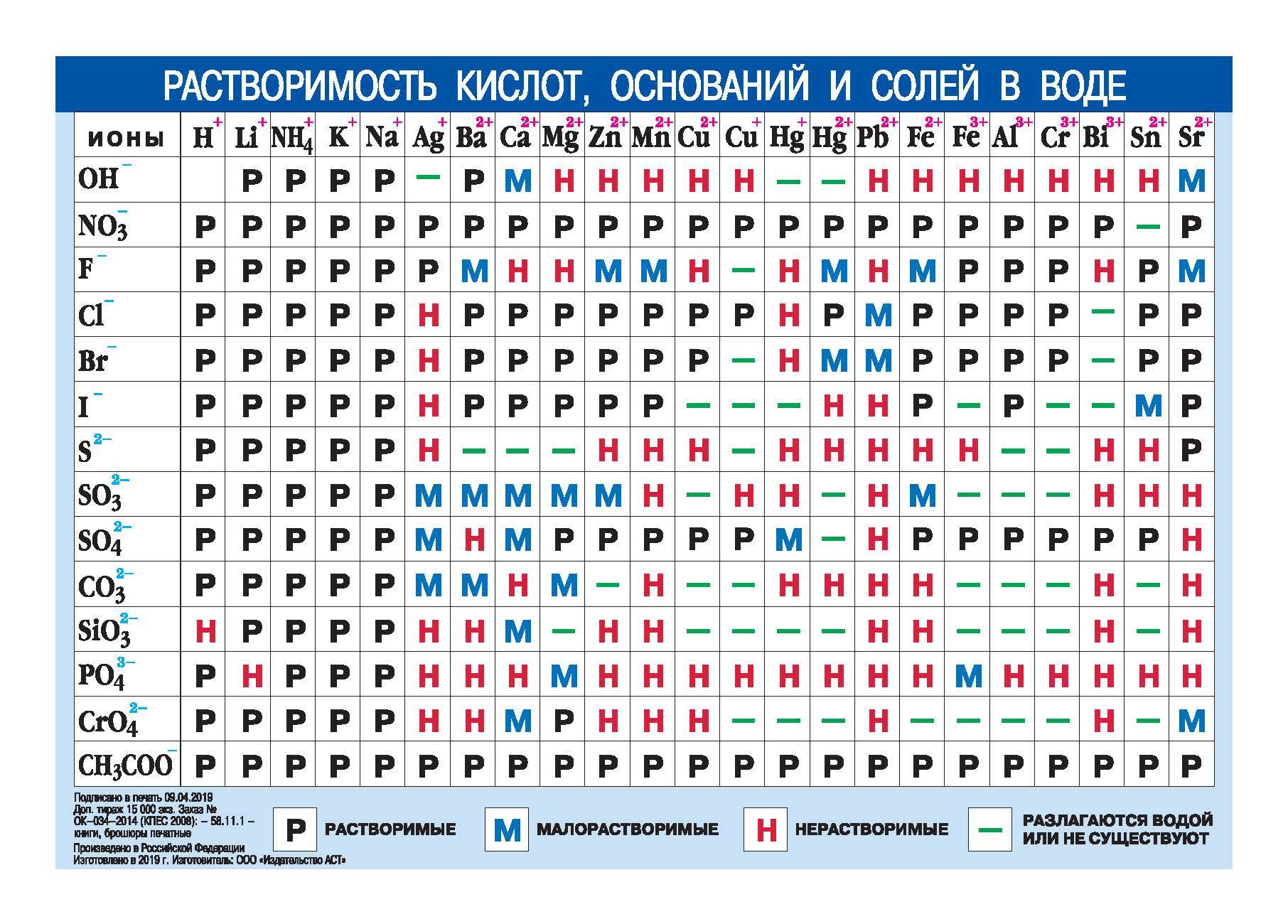 80]
80]
Чтобы электрифицированные пособия были безопасны в пожарном отношении, необходимо помнить, что при электрификации схем и таблиц ( Периодическая система элементов Д. И. Менделеева , таблица растворимости солей и т. д.), освещаемых электрическими лампочками, лучше всего в качестве источника тока использовать батарейки для карманных фонариков на 3,5 в. [c.78]
Приступая к составлению ионообменных реакций, следует пользоваться таблицей растворимости солей и оснований в воде (см. приложение 111), значениями растворимости и произведений растворимости (см. приложение IV), а также значениями констант ионизации слабых электролитов и нестойкости (устойчивости) комплексных ионов. [c.46]
Пример на каждую группу реакций записывается в молекулярной (а), ионной (б) и сокращенной ионной (в) формах. Растворимость солей, кислот и оснований в воде приводится в справочных таблицах. [c.83]
В приложении даны значения относительных электроотрицательностей элементов, таблица растворимости солей и оснований, ряд стандартных электродных потенциалов, округленные значения относительных атомных масс элементов и другие справочные материалы.
Удельное сопротивление насыщенного раствора труднорастворимой соли А (см. таблицу на с. 311) при 298 К равно р. Удельное сопротивление воды при той же температуре рн,о = 1 10 Ом м. Вычислите 1) растворимость соли А в чистой воде 2) произведение растворимости вещества А, приняв, что коэффициенты активности ионов = 1 (растворы сильно разбавлены) 3) растворимость вещества А в растворе, содержащем 0,01 моль вещества В 4) растворимость вещества А в растворе, содержащем 0,01 моль вещества С. Вещества А, В, С полностью диссоциированы. [c.310]
Лурье Ю. Ю. Справочник по аналитической химии. М., Госхимиздат, 1962, 288 стр. В книге приведены таблицы факторов, величины эквивалентных и молекулярных весов важнейших соединений, данные о растворимости солей, константы диссоциации кислот и оснований, таблицы окислительных потенциалов и потенциалов полуволн, даны сведения об индикаторах для метода нейтрализации, окисления-восстановления, для метода осаждения и комплексообразования, приведены таблицы плотности растворов кислот и щелочей.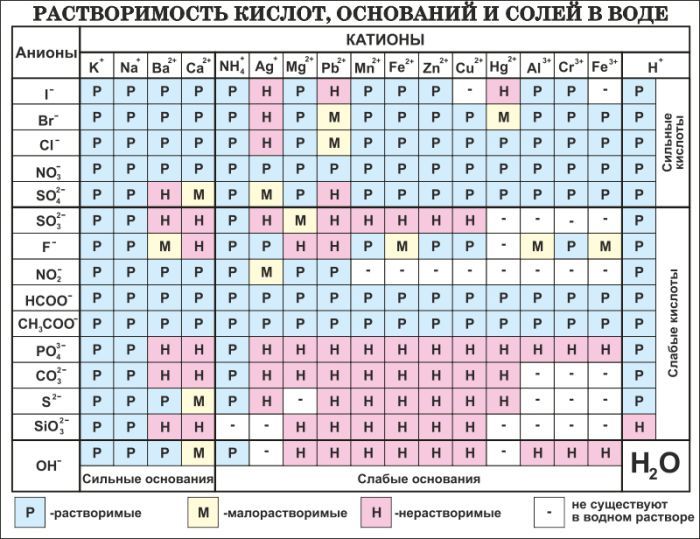 Указаны методики приготовления буферных растворов. [c.383]
Указаны методики приготовления буферных растворов. [c.383]
При решении задач, отмеченных звездочкой ( ), следует руководствоваться таблицей растворимости солей, приведенной на стр. 63, [c.64]
Другой пример — урок на тему Реакции ионного обмена, идущие с образованием осадка . В результате этого урока учащиеся должны приобрести следующие новые элементы знаний и умений 1) понятие реакции ионного обмена, 2) умение составлять полное ионное уравнение, 3) умение составлять сокращенное ионное уравнение. Для успешного усвоения нового материала учащиеся могут воспользоваться приобретенными знаниями и умениями 1) понятие диссоциации солей, 2) понятие диссоциации щелочей, 3) понятие диссоциации кислот, 4/ умет-.е составлять молекулярные уравнения реакций обмена, 5) умение составлять уравнения диссоциации солей, щелочей, кислот, 6) умение пользоваться таблицей .Растворимость солей, оснований, кислот в воде . Здесь соотношение новых и опорных элементов знаний и умений позволяет предоставить учащимся самим изучить новый материал, выполняя соответствующие лабораторные опыты. На данном уроке может быть организована самостоятельная работа, как фронтальная, так и групповая, во время которой учащиеся сверяют результаты [c.53]
Здесь соотношение новых и опорных элементов знаний и умений позволяет предоставить учащимся самим изучить новый материал, выполняя соответствующие лабораторные опыты. На данном уроке может быть организована самостоятельная работа, как фронтальная, так и групповая, во время которой учащиеся сверяют результаты [c.53]Растворимость зависит от температуры, а также от присутствия посторонних веществ. Имеющиеся в литературе сведения по этому вопросу мы представили в виде таблиц. Растворимость солей таллия в растворах электролитов см. [105, 108, 261, 263, 294, 334, 426, 471, 529, 530, 549, u96, [c.129]
Прежде чем приступить к анализу анионов, по таблице растворимости солей определяют по уже обнаруженному катиону, какие из анионов могут присутствовать в анализируемой соли. Эти соли должны быть растворимы в воде. [c.199]
В приведенных ниже табл. 2.1.7-2.1.34 неорганические соединения расположены по алфавиту химических символов (без учета цифр и скобок), а органические растворители — в алфавитном порядке названий. Для удобства поиска раздел предваряет Указатель таблиц. Растворимость солей в водных растворах минеральных кислот и аммиака см. в разделе 2.1.1. [c.396]
Для удобства поиска раздел предваряет Указатель таблиц. Растворимость солей в водных растворах минеральных кислот и аммиака см. в разделе 2.1.1. [c.396]
С оставшегося в колбе осадка сливают воду, добавляют новую порцию свежей воды, выдерживают в термостате 10—15 мин, слегка взбалтывают, заменяют раствор в измерительном сосуде свежим и измеряют сопротивление. Эти операции обновления раствора производят до установления постоянного значения получаемого в опыте сопротивления, по которому и рассчитывают электропроводность и растворимость соли согласно ранее приведенным формулам (17) и (19). Подвижности ионов приводятся в таблицах (см. Справочник, М., табл. 47). Экспериментальные и расчетные данные заносят в таблицу [c.261]
Для решения задачи нужно знать плотности 96%-ного и полученного раствора серной кислоты, так как расчет может основываться лишь иа сложении масс исходных растворов, а не на сложении объемов. Объем раствора при смешении концентрированной серной кислоты и воды не будет равен суммарному объему исходных веществ.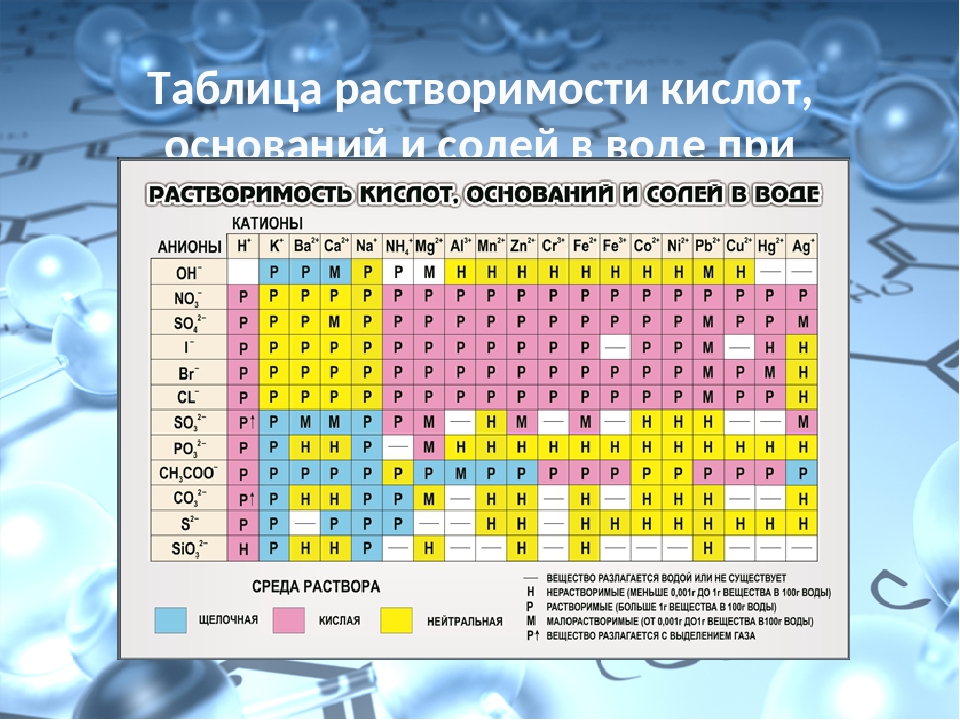 По таблице растворимости солей и оснований в воде. Нужно найти плотность 96%-ного раствора h3SO4 и рассчитать процентную концентрацию полученного раствора. Затем по этой величине найти в таблице плотность полученного раствора и рассчитать нормальную и молярную концентрации его. Ответ 19 н. 9,5 М. [c.119]
По таблице растворимости солей и оснований в воде. Нужно найти плотность 96%-ного раствора h3SO4 и рассчитать процентную концентрацию полученного раствора. Затем по этой величине найти в таблице плотность полученного раствора и рассчитать нормальную и молярную концентрации его. Ответ 19 н. 9,5 М. [c.119]
Результаты измерений растворимости соли сводят в таблицу [c.297]
Таблица растворимости солей и оснований. ……………….261 [c.279]
Следовательно, при растворении соли разрушается ее кристаллическая решетка. Очевидно, что чем больше энергия решетки, тем труднее должна растворяться соль. В следующей таблице сопоставлены некоторые данные по растворимости солей. [c.170]
Из таблицы видно, что по мере понижения энергии решетки растворимость соли повышается. [c.170]
Значения растворимостей трудно растворимых солей, не вошедших в эту таблицу и определяемых по их произведениям растворимости, см. в табл. 8. [c.77]
в табл. 8. [c.77]
Растворимость солей в тяжелой воде заметно меньше, чем в обычной. Большинство элементов состоит фактически из смесей изотопов. Обычные атомные массы, приводимые в таблице Менделеева, являются средними величинами, определяемыми атомными массами изотопов в элементе и их процентным содержанием. Так как определенное процентное содержание каждого из изотопов в элементе сохраняется во всех его соединениях, то для практических расчетов в химии используются только средние значения масс атомов. [c.414]
Определение растворимости дихромата калия в воде. Пользуясь таблицей растворимости солей в зависимости от температуры (см. табл. 4 приложения), рассчитайте, сколько граммов К2СГ2О7 необходимо взять для насыщения этой солью 20 мл воды при комнатной температуре. На технохимических весах отвесьте рассчитанное количество соли с 10 %-м избытком и перенесите ее в стакан. К соли добавьте 20 мл дистиллированной воды и нагрейте содержимое стакана до полного растворения соли, периодически помешивая его стеклянной палочкой. [c.80]
[c.80]
Таблица 5. Растворимость солей и Н3ВО3 в воде при разных температурах (грамм на 100 г воды) в пересчете на безводную соль [c.306]
11.3 Растворимость – Химия 2e
Цели обучения
К концу этого раздела вы сможете:
- Описывать влияние температуры и давления на растворимость
- Сформулируйте закон Генри и используйте его в расчетах растворимости газа в жидкости
- Объясните степени растворимости, возможные для растворов жидкость-жидкость
Представьте, что вы добавляете небольшое количество сахара в стакан воды, перемешиваете, пока весь сахар не растворится, а затем добавляете еще немного.Вы можете повторять этот процесс до тех пор, пока концентрация сахара в растворе не достигнет своего естественного предела, предела, определяемого в первую очередь относительными силами притяжения растворенного вещества, растворенного вещества и растворителя, обсуждавшихся в предыдущих двух модулях этой главы.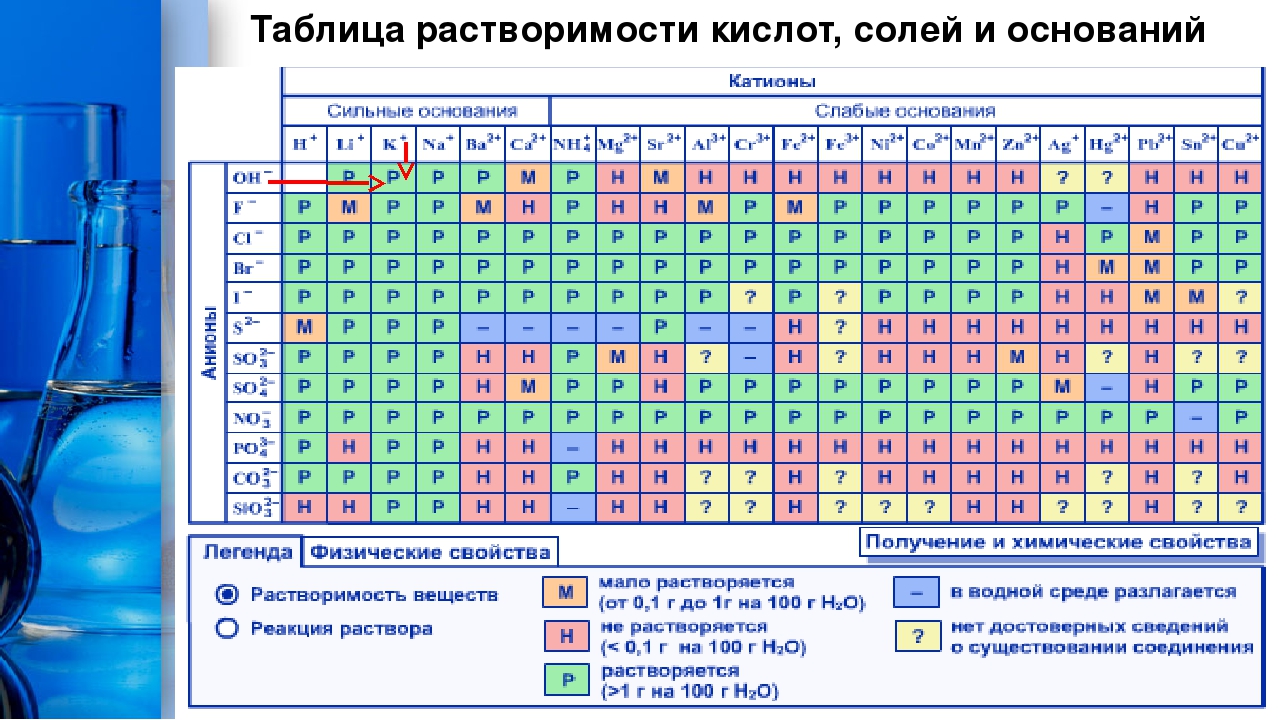 . Вы можете быть уверены, что достигли этого предела, потому что независимо от того, как долго вы перемешиваете раствор, нерастворенный сахар остается. Концентрация сахара в растворе в этот момент известна как его растворимость.
. Вы можете быть уверены, что достигли этого предела, потому что независимо от того, как долго вы перемешиваете раствор, нерастворенный сахар остается. Концентрация сахара в растворе в этот момент известна как его растворимость.
Растворимость растворенного вещества в конкретном растворителе — это максимальная концентрация, которая может быть достигнута при данных условиях, когда процесс растворения находится в равновесии .
Когда концентрация растворенного вещества равна его растворимости, говорят, что раствор насыщен этим растворенным веществом. Если концентрация растворенного вещества меньше его растворимости, говорят, что раствор ненасыщен. Раствор, содержащий относительно низкую концентрацию растворенного вещества, называют разбавленным, а раствор с относительно высокой концентрацией – концентрированным.
Могут быть приготовлены растворы, в которых концентрация растворенного вещества превышает его растворимость.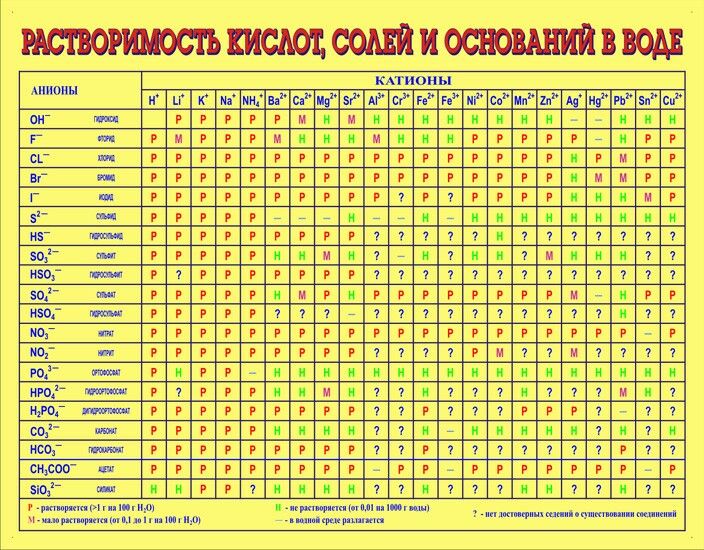 Такие растворы называются пересыщенными, и они представляют собой интересные примеры неравновесных состояний (подробное рассмотрение этого важного понятия содержится в главах текста, посвященных равновесию). Например, газированный напиток в открытой таре, который еще не «испортился», перенасыщен углекислым газом; определенное время концентрация CO 2 будет уменьшаться, пока не достигнет своей растворимости.
Такие растворы называются пересыщенными, и они представляют собой интересные примеры неравновесных состояний (подробное рассмотрение этого важного понятия содержится в главах текста, посвященных равновесию). Например, газированный напиток в открытой таре, который еще не «испортился», перенасыщен углекислым газом; определенное время концентрация CO 2 будет уменьшаться, пока не достигнет своей растворимости.
Ссылка на обучение
Посмотрите это впечатляющее видео, демонстрирующее осаждение ацетата натрия из перенасыщенного раствора.
Растворы газов в жидкостях
Как и в случае любого раствора, на растворимость газа в жидкости влияют силы межмолекулярного притяжения между растворенными веществами и растворителями. Однако, в отличие от твердых и жидких растворенных веществ, при растворении газообразного растворенного вещества в жидком растворителе не существует межмолекулярного притяжения между растворенными веществами (см. 4) поскольку атомы или молекулы, составляющие газ, находятся далеко друг от друга и практически не взаимодействуют друг с другом. Следовательно, взаимодействия растворенного вещества с растворителем являются единственным энергетическим фактором, влияющим на растворимость. Например, растворимость кислорода в воде примерно в три раза выше, чем у гелия (существуют большие дисперсионные силы между водой и более крупными молекулами кислорода), но в 100 раз меньше, чем растворимость хлорметана, CHCl 3 (полярные молекулы хлорметана испытывают диполь-дипольное притяжение к полярным молекулам воды).Также обратите внимание, что растворимость кислорода в гексане, C 6 H 14 , примерно в 20 раз выше, чем в воде, потому что между кислородом и более крупными молекулами гексана существуют большие дисперсионные силы.
4) поскольку атомы или молекулы, составляющие газ, находятся далеко друг от друга и практически не взаимодействуют друг с другом. Следовательно, взаимодействия растворенного вещества с растворителем являются единственным энергетическим фактором, влияющим на растворимость. Например, растворимость кислорода в воде примерно в три раза выше, чем у гелия (существуют большие дисперсионные силы между водой и более крупными молекулами кислорода), но в 100 раз меньше, чем растворимость хлорметана, CHCl 3 (полярные молекулы хлорметана испытывают диполь-дипольное притяжение к полярным молекулам воды).Также обратите внимание, что растворимость кислорода в гексане, C 6 H 14 , примерно в 20 раз выше, чем в воде, потому что между кислородом и более крупными молекулами гексана существуют большие дисперсионные силы.
Другим фактором, влияющим на растворимость, является температура, при этом растворимость газа обычно уменьшается с повышением температуры (рис. 11.8). Эта обратная зависимость между температурой и концентрацией растворенных газов является причиной одного из основных последствий теплового загрязнения природных вод.
11.8). Эта обратная зависимость между температурой и концентрацией растворенных газов является причиной одного из основных последствий теплового загрязнения природных вод.
Фигура 11,8 Растворимость этих газов в воде уменьшается с повышением температуры. Все растворимости измеряли при постоянном давлении газа над растворами 101,3 кПа (1 атм).
При повышении температуры реки, озера или ручья растворимость кислорода в воде снижается. Снижение уровня растворенного кислорода может иметь серьезные последствия для здоровья водных экосистем и, в тяжелых случаях, может привести к крупномасштабной гибели рыбы (Рисунок 11.9).
Фигура
11,9
(а) Маленькие пузырьки воздуха в этом стакане с охлажденной водой образовались, когда вода нагрелась до комнатной температуры и растворимость растворенного в ней воздуха уменьшилась. b) снижение растворимости кислорода в природных водах, подверженных тепловому загрязнению, может привести к крупномасштабной гибели рыбы. (кредит a: модификация работы Лиз Уэст; кредит b: модификация работы Службы рыболовства и дикой природы США)
(кредит a: модификация работы Лиз Уэст; кредит b: модификация работы Службы рыболовства и дикой природы США)
На растворимость газообразного растворенного вещества также влияет парциальное давление растворенного вещества в газе, воздействию которого подвергается раствор.Растворимость газа увеличивается с увеличением давления газа. Газированные напитки служат хорошей иллюстрацией этой взаимосвязи. Процесс карбонизации включает воздействие на напиток относительно высокого давления газообразного диоксида углерода, а затем герметизацию контейнера с напитком, таким образом насыщая напиток CO 2 при этом давлении. Когда контейнер с напитком открывается, слышно знакомое шипение, когда давление углекислого газа сбрасывается, а некоторое количество растворенного углекислого газа обычно остается в виде маленьких пузырьков (Рисунок 11.10). В этот момент напиток перенасыщен углекислым газом, и со временем концентрация растворенного углекислого газа уменьшится до своего равновесного значения, и напиток станет «плоским».
Фигура 11.10 Открытие бутылки с газированным напитком снижает давление газообразного углекислого газа над напитком. Таким образом, растворимость CO 2 снижается, и можно видеть, что некоторое количество растворенного углекислого газа выходит из раствора в виде маленьких пузырьков газа.(кредит: модификация работы Деррика Кутзи)
Для многих газообразных растворенных веществ соотношение между растворимостью C г и парциальным давлением P г пропорционально:
, где k — константа пропорциональности, которая зависит от идентичности газообразного растворенного вещества и растворителя, а также от температуры раствора. Это математическая формулировка закона Генри: Количество идеального газа, растворяющегося в определенном объеме жидкости, прямо пропорционально давлению газа.
Пример 11.1
Применение закона Генри
При 20 °C концентрация растворенного кислорода в воде, подвергнутой воздействию газообразного кислорода при парциальном давлении 101,3 кПа, составляет 1,38 × × 10 -3 моль л -1 . Используйте закон Генри, чтобы определить растворимость кислорода, когда его парциальное давление равно 20,7 кПа, приблизительное давление кислорода в земной атмосфере.Решение
Согласно закону Генри, для идеального раствора растворимость C г газа (1.38 × × 10 -3 моль л -1 , в данном случае) прямо пропорциональна давлению P г нерастворенного газа над раствором (101,3 кПа в данном случае). Поскольку оба C g и P g известны, это соотношение можно изменить и использовать для решения k .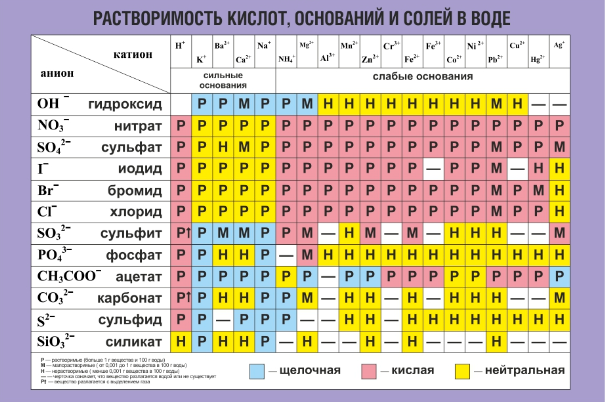 Cg=kPgk=CgPg=1,38×10-3мольл-1101,3кПа=1,36×10-5мольл-1кПа-1Cg=kPgk=CgPg=1,38×10-3мольл-1101,3кПа=1,36×10-5мольл-1кПа-1
Cg=kPgk=CgPg=1,38×10-3мольл-1101,3кПа=1,36×10-5мольл-1кПа-1Cg=kPgk=CgPg=1,38×10-3мольл-1101,3кПа=1,36×10-5мольл-1кПа-1
Теперь используйте k , чтобы найти растворимость при более низком давлении.
Cg=kPg1,36×10-5мольл-1кПа-1×20,7кПа=2,82×10-4мольл-1Cg=kPg1,36×10-5мольл-1кПа-1×20,7кПа=2,82×10-4мольл-1Обратите внимание, что для выражения величин, задействованных в такого рода вычислениях, могут использоваться различные единицы измерения. Приемлема любая комбинация единиц измерения, удовлетворяющая ограничениям размерного анализа.
Проверьте свои знания
Воздействие на образец воды объемом 100,0 мл при 0 °C в атмосфере, содержащей газообразный раствор при 152 торр, привело к растворению 1,45 × × 10 -3 г растворенного вещества.Используйте закон Генри, чтобы определить растворимость этого газообразного растворенного вещества, когда его давление составляет 760 торр.Отвечать:
7,25 ×× 10 −3 в 100,0 мл или 0,0725 г/л
Пример 11.
 2
2
Термическое загрязнение и растворимость в кислороде
Некоторым видам пресноводной форели требуется концентрация растворенного кислорода 7,5 мг/л. Могли ли эти рыбы жить в термически загрязненном горном ручье (температура воды 30,0°С, парциальное давление атмосферного кислорода 0.17 атм)? Используйте данные на рис. 11.8, чтобы оценить значение константы закона Генри при этой температуре.Решение
Сначала оцените константу закона Генри для кислорода в воде при заданной температуре 30,0 °C (на рис. 11.8 показано, что растворимость при этой температуре составляет приблизительно ~1,2 моль/л). k=CgPg=1,2×10-3моль/л/1,00 атм=1,2×10-3моль/л атм k=CgPg=1,2×10-3моль/л/1,00 атм=1,2×10-3моль/л атмЗатем используйте это значение k для вычисления растворимости кислорода при заданном парциальном давлении кислорода, равном 0.17 атм.
Cg=kPg=(1,2×10-3моль/л атм)(0,17атм)=2,0×10-4моль/LCg=kPg=(1,2×10-3моль/л атм)(0,17атм)=2,0×10-4моль/ л Наконец, переведите эту концентрацию растворенного кислорода из моль/л в мг/л.
Эта концентрация меньше требуемого минимального значения 7,5 мг/л, поэтому эта форель, скорее всего, не будет жить в загрязненном ручье.
Проверьте свои знания
Какая концентрация растворенного кислорода ожидается в верхнем потоке, когда он вернется к нормальной летней температуре 15 °C?Химия в повседневной жизни
Декомпрессионная болезнь или «изгибы»
Декомпрессионная болезнь (ДКБ), или «декомпрессионная болезнь», является следствием повышенного давления воздуха, вдыхаемого аквалангистами при плавании под водой на значительных глубинах.В дополнение к давлению, оказываемому атмосферой, водолазы подвергаются дополнительному давлению из-за воды над ними, испытывая увеличение примерно на 1 атм на каждые 10 м глубины. Следовательно, воздух, вдыхаемый водолазом под водой, содержит газы при соответствующем более высоком давлении окружающей среды, а концентрации газов, растворенных в крови водолаза, пропорционально выше в соответствии с законом Генри.
По мере всплытия дайвера на поверхность воды давление окружающей среды снижается, и растворенные газы становятся менее растворимыми.Если всплытие слишком быстрое, газы, выделяющиеся из крови дайвера, могут образовывать пузырьки, вызывающие различные симптомы, начиная от сыпи и болей в суставах и заканчивая параличом и смертью. Чтобы избежать ДКБ, дайверы должны всплывать с глубины с относительно небольшой скоростью (10 или 20 м/мин) или иным образом делать несколько декомпрессионных остановок, останавливаясь на несколько минут на заданных глубинах во время всплытия. Когда эти профилактические меры не приносят результата, дайверам с ДКБ часто назначают гипербарическую оксигенотерапию в сосудах под давлением, называемых декомпрессионными (или рекомпрессионными) камерами (рис. 11.11). Исследователи также изучают связанные реакции организма и защитные механизмы, чтобы улучшить тестирование и лечение декомпрессионной болезни. Например, Ингрид Эфтедал, барофизиолог, специализирующийся на реакциях организма на ныряние, показала, что лейкоциты претерпевают химические и генетические изменения в результате этого состояния; потенциально их можно использовать для создания тестов на биомаркеры и других методов лечения декомпрессионной болезни.
Фигура 11.11 (а) Водолазы ВМС США проходят обучение в рекомпрессионной камере.(b) Дайверы получают гипербарическую кислородную терапию.
Отклонения от закона Генри наблюдаются, когда происходит химическая реакция между газообразным растворенным веществом и растворителем. Так, например, растворимость аммиака в воде увеличивается с ростом давления быстрее, чем это предсказывает закон, потому что аммиак, будучи основанием, в некоторой степени реагирует с водой с образованием ионов аммония и гидроксид-ионов.
Газы могут образовывать пересыщенные растворы. Если раствор газа в жидкости приготовить либо при низкой температуре, либо под давлением (или и то, и другое), то при нагревании раствора или уменьшении давления газа раствор может стать пересыщенным.В 1986 году более 1700 человек в Камеруне погибли, когда облако газа, почти наверняка двуокиси углерода, вырвалось из озера Ниос (рис. 11.12), глубокого озера в кратере вулкана. Вода на дне озера Ньос насыщена углекислым газом в результате вулканической активности под озером.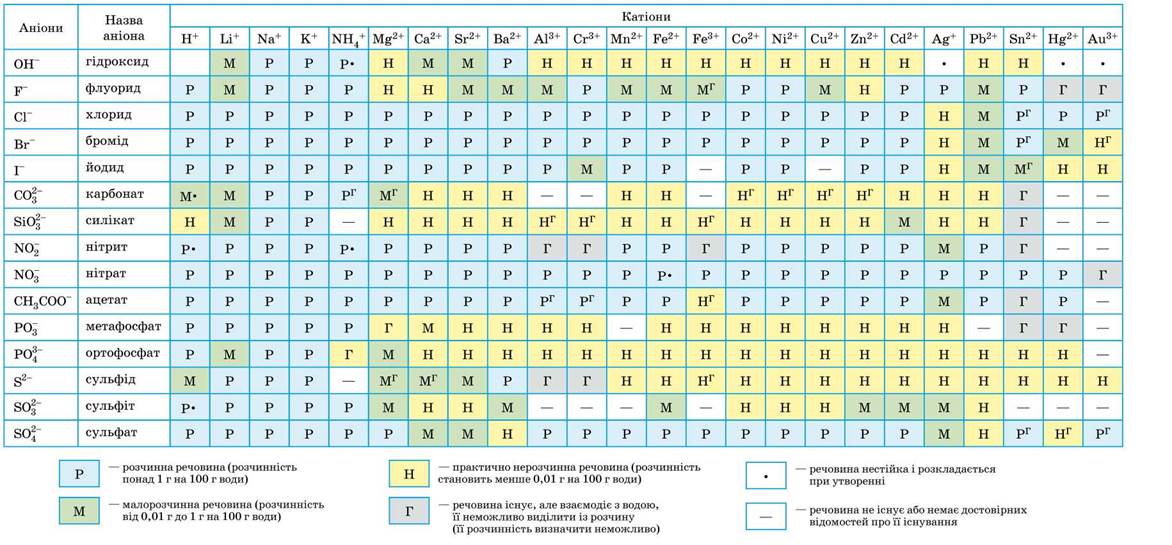 Считается, что озеро претерпело оборот из-за постепенного нагревания снизу озера, и на поверхность вышла более теплая, менее плотная вода, насыщенная углекислым газом. В результате было выпущено огромное количество растворенного CO 2 , и бесцветный газ, более плотный, чем воздух, стекал по долине под озером и душил людей и животных, живущих в долине.
Считается, что озеро претерпело оборот из-за постепенного нагревания снизу озера, и на поверхность вышла более теплая, менее плотная вода, насыщенная углекислым газом. В результате было выпущено огромное количество растворенного CO 2 , и бесцветный газ, более плотный, чем воздух, стекал по долине под озером и душил людей и животных, живущих в долине.
Фигура 11.12 а) считается, что катастрофа 1986 года, унесшая жизни более 1700 человек вблизи озера Ньос в Камеруне, произошла в результате выброса большого количества углекислого газа из озера. (b) С тех пор был установлен вентиляционный клапан CO 2 , чтобы помочь газировать озеро медленным и контролируемым образом и предотвратить подобную катастрофу в будущем. (кредит а: модификация работы Джека Локвуда; кредит б: модификация работы Билла Эванса)
Растворы жидкостей в жидкостях
Некоторые жидкости можно смешивать в любых пропорциях для получения растворов; другими словами, они обладают бесконечной взаимной растворимостью и называются смешиваемыми. Этанол, серная кислота и этиленгликоль (популярный для использования в качестве антифриза, изображенный на рис. 11.13) являются примерами жидкостей, которые полностью смешиваются с водой. Двухтактное моторное масло смешивается с бензином, смеси которого используются в качестве смазочных топлив для различных видов наружной силовой техники (бензопилы, воздуходувки и т. д.).
Этанол, серная кислота и этиленгликоль (популярный для использования в качестве антифриза, изображенный на рис. 11.13) являются примерами жидкостей, которые полностью смешиваются с водой. Двухтактное моторное масло смешивается с бензином, смеси которого используются в качестве смазочных топлив для различных видов наружной силовой техники (бензопилы, воздуходувки и т. д.).
Фигура 11.13 Вода и антифриз смешиваются; смеси этих двух однородны во всех пропорциях. (кредит: «dno1967»/Викисклад)
Смешиваемые жидкости обычно имеют очень похожую полярность.Рассмотрим, например, полярные жидкости или жидкости, способные образовывать водородные связи. Для таких жидкостей диполь-дипольное притяжение (или водородная связь) молекул растворенного вещества с молекулами растворителя не менее сильное, чем между молекулами в чистом растворенном веществе или в чистом растворителе. Следовательно, два вида молекул легко смешиваются. Точно так же неполярные жидкости смешиваются друг с другом, потому что нет заметной разницы в силе межмолекулярного притяжения растворенное вещество, растворитель-растворитель и растворенное вещество-растворитель. Растворимость полярных молекул в полярных растворителях и неполярных молекул в неполярных растворителях опять же является иллюстрацией химической аксиомы «подобное растворяется в подобном».
Растворимость полярных молекул в полярных растворителях и неполярных молекул в неполярных растворителях опять же является иллюстрацией химической аксиомы «подобное растворяется в подобном».
Две жидкости, которые не смешиваются в заметной степени, называются несмешивающимися. Отдельные слои образуются при наливании в одну и ту же емкость несмешивающихся жидкостей. Бензин, масло (рис. 11.14), бензол, четыреххлористый углерод, некоторые краски и многие другие неполярные жидкости не смешиваются с водой. Относительно слабые силы притяжения между полярными молекулами воды и неполярными молекулами жидкости недостаточны для преодоления гораздо более сильных водородных связей между молекулами воды.Различие между несмешиваемостью и смешиваемостью на самом деле заключается в степени, так что смешивающиеся жидкости имеют бесконечную взаимную растворимость, в то время как жидкости, называемые несмешиваемыми, имеют очень низкую (хотя и не нулевую) взаимную растворимость.
Фигура
11. 14
Вода и масло не смешиваются. Смеси этих двух веществ образуют два отдельных слоя с менее плотной нефтью, плавающей поверх воды. (кредит: «Yortw»/Flickr)
14
Вода и масло не смешиваются. Смеси этих двух веществ образуют два отдельных слоя с менее плотной нефтью, плавающей поверх воды. (кредит: «Yortw»/Flickr)
Две жидкости, такие как бром и вода, обладающие умеренной взаимной растворимостью, называются частично смешиваемыми.Две частично смешивающиеся жидкости при смешивании обычно образуют два слоя. В случае смеси брома и воды верхний слой представляет собой воду, насыщенную бромом, а нижний слой представляет собой бром, насыщенный водой. Поскольку бром неполярен и, следовательно, мало растворим в воде, водный слой лишь слегка обесцвечивается растворенным в нем ярко-оранжевым бромом. Поскольку растворимость воды в броме очень низкая, заметного влияния на темный цвет бромного слоя не наблюдается (рис. 11.15).
Фигура
11.15
Бром (темно-оранжевая жидкость слева) и вода (прозрачная жидкость в середине) частично смешиваются. Верхний слой в смеси справа представляет собой насыщенный раствор брома в воде; нижний слой представляет собой насыщенный раствор воды в броме. (кредит: Пол Флауэрс)
(кредит: Пол Флауэрс)
Растворы твердых веществ в жидкостях
Зависимость растворимости ряда твердых веществ в воде от температуры представлена кривыми растворимости на рисунке 11.16. Анализ этих данных указывает на общую тенденцию повышения растворимости с температурой, хотя есть и исключения, как показано на примере ионного соединения сульфата церия.
Фигура 11.16 На этом графике показано, как растворимость некоторых твердых веществ изменяется в зависимости от температуры.
Зависимость растворимости от температуры можно использовать для приготовления пересыщенных растворов некоторых соединений. Раствор можно насытить соединением при повышенной температуре (где растворенное вещество более растворимо) и затем охладить до более низкой температуры без осаждения растворенного вещества.Полученный раствор содержит растворенное вещество в концентрации, превышающей его равновесную растворимость при более низкой температуре (т. е. он является пересыщенным), и является относительно стабильным. Осаждение избыточного растворенного вещества можно инициировать путем добавления затравочного кристалла (см. видео в ссылке на обучение ранее в этом модуле) или путем механического перемешивания раствора. Некоторые грелки для рук, такие как изображенная на рис. 11.17, пользуются этим преимуществом.
е. он является пересыщенным), и является относительно стабильным. Осаждение избыточного растворенного вещества можно инициировать путем добавления затравочного кристалла (см. видео в ссылке на обучение ранее в этом модуле) или путем механического перемешивания раствора. Некоторые грелки для рук, такие как изображенная на рис. 11.17, пользуются этим преимуществом.
Фигура 11.17 Эта грелка для рук производит тепло, когда ацетат натрия в перенасыщенном растворе выпадает в осадок.Осаждение растворенного вещества инициируется механической ударной волной, генерируемой при «щелкании» гибкого металлического диска в растворе. (кредит: модификация работы Velela/Wikimedia Commons)
Ссылка на обучение
На этом видео показан процесс кристаллизации, происходящий в грелке для рук.
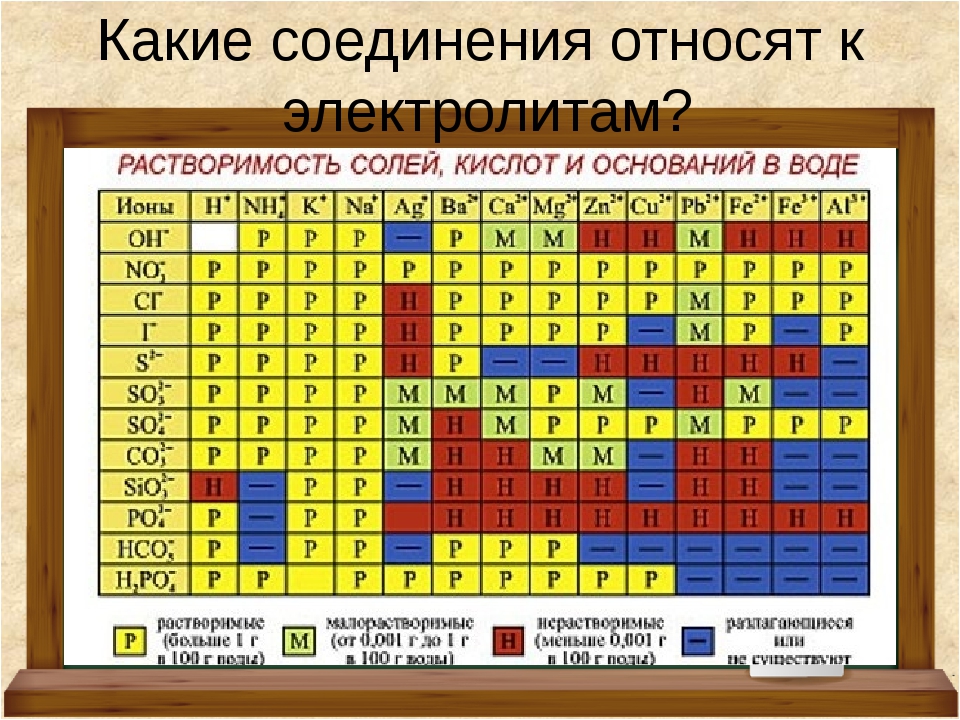
Chem – правила осаждения (таблица растворимости)
Каковы правила осаждения (таблица растворимости)?
В словесном вопросе или химическом уравнении вам не всегда будет показано, является ли химическое вещество РАСТВОРИМЫМ (водным) или НЕРАСТВОРИМЫМ (s). Иногда вам придется определить это для себя. По этой причине мы обратимся к тому, что они называют ПРАВИЛАМИ ОСАДКОВ или ТАБЛИЦЕЙ РАСТВОРИМОСТИ. Это самый простой способ визуализировать, организовать и запомнить правила осаждения.
Иногда вам придется определить это для себя. По этой причине мы обратимся к тому, что они называют ПРАВИЛАМИ ОСАДКОВ или ТАБЛИЦЕЙ РАСТВОРИМОСТИ. Это самый простой способ визуализировать, организовать и запомнить правила осаждения.
Я также создал расширенную таблицу растворимости, в которую включено больше ионов, с которыми вы можете работать в классе. Как правило, их можно увидеть только на курсах AP и колледжа, а иногда и тогда.
ТРЮК С ЗАПОМНЕНИЕМ: На уроках AP или в колледже вам, возможно, придется запомнить таблицу растворимости.Если вы запоминаете только растворимые ионы, вам нужно запомнить только половину или меньше таблицы растворимости. НЕ сосредотачивайтесь на исключениях. Сначала запомните общие ионы.
Прежде чем пытаться понять приведенные ниже примеры и решать практические задачи, убедитесь, что вы знаете, как разбивать и собирать ионные соединения. Если у вас есть какие-либо вопросы об ионных соединениях, обратитесь к разделам о том, как образовывать ионные соединения и как расщеплять ионные соединения. В примерах я буду указывать и использовать РЕДКИЕ исключения в таблице растворимости.Однако, с практическими проблемами и будущим использованием этих идей, я НЕ БУДУ требовать, чтобы были известны РЕДКИЕ исключения для таблицы растворимости.
В примерах я буду указывать и использовать РЕДКИЕ исключения в таблице растворимости.Однако, с практическими проблемами и будущим использованием этих идей, я НЕ БУДУ требовать, чтобы были известны РЕДКИЕ исключения для таблицы растворимости.
Примеры : Определите, является ли химическое вещество НЕРАСТВОРИМЫМ или РАСТВОРИМЫМ, и укажите, каким состоянием оно будет отмечено в химическом уравнении (водное или s). Обязательно используйте таблицу растворимости и определения осадков, если они вам нужны. Еще одним полезным инструментом является периодическая таблица ионов. ВИДЕО Таблица растворимости Примеры 1 .
| Химическая | Ответить |
| NaNO 3 | Растворимый (водный) |
| РУПО 4 | Нерастворимый(ые) |
| Мн 3 (СО 4 ) 2 | Растворимый (водный) |
| В(ОН) 2 | Нерастворимый(ые) |
| (NH 4 ) 2 CO 3 | Растворимый (водный) |
| Ли 3 Заказ на поставку 4 | Растворимый (водный) |
| AgCl | Нерастворимый(ые) |
| КАС | Растворимый (водный) |
ПРАКТИЧЕСКИЕ ЗАДАЧИ : Определите, является ли химическое вещество НЕРАСТВОРИМЫМ или РАСТВОРИМЫМ, и укажите, каким состоянием оно будет отмечено в химическом уравнении (aq или s). Обязательно используйте таблицу растворимости и определения осадков, если они вам нужны. Еще одним полезным инструментом является периодическая таблица ионов.
Обязательно используйте таблицу растворимости и определения осадков, если они вам нужны. Еще одним полезным инструментом является периодическая таблица ионов.
| Химическая | Ответить |
| МВД | Растворимый (водный) |
| CaSO 4 | Растворимый (водный) |
| Цирконий 3 (ПО 4 ) 2 | Нерастворимый(ые) |
| Вт(CO 3 ) 2 | Нерастворимый(ые) |
| НХ 4 ОХ | Растворимый (водный) |
| Fe 2 S 3 | Нерастворимый(ые) |
| Cs 2 CO 3 | Растворимый (водный) |
| FrOH | Растворимый (водный) |
11.
 3 Растворимость – Химия
3 Растворимость – Химия
Цели обучения
К концу этого модуля вы сможете:
- Описать влияние температуры и давления на растворимость
- Сформулируйте закон Генри и используйте его в расчетах растворимости газа в жидкости
- Объясните степени растворимости, возможные для растворов жидкость-жидкость
Представьте, что вы добавляете небольшое количество соли в стакан воды, перемешиваете, пока вся соль не растворится, а затем добавляете еще немного.Вы можете повторять этот процесс до тех пор, пока концентрация соли в растворе не достигнет своего естественного предела, предела, определяемого в основном относительными силами притяжения растворенного вещества, растворенного вещества и растворителя и растворителя, обсуждавшихся в предыдущих двух модулях этой главы. . Вы можете быть уверены, что достигли этого предела, потому что независимо от того, как долго вы перемешиваете раствор, нерастворенная соль остается. Концентрация соли в растворе в этот момент известна как ее растворимость.
Концентрация соли в растворе в этот момент известна как ее растворимость.
Растворимость растворенного вещества в конкретном растворителе представляет собой максимальную концентрацию, которая может быть достигнута при данных условиях, когда процесс растворения находится в равновесии .{-}(водный)[/латекс]
Когда концентрация растворенного вещества равна его растворимости, говорят, что раствор насыщен этим растворенным веществом. Если концентрация растворенного вещества меньше его растворимости, говорят, что раствор ненасыщенный . Раствор, содержащий относительно низкую концентрацию растворенного вещества, называют разбавленным, а раствор с относительно высокой концентрацией – концентрированным.
Если мы добавим больше соли в насыщенный раствор соли, мы увидим, что она падает на дно и больше не растворяется.Фактически, добавленная соль действительно растворяется, что представлено прямым направлением уравнения растворения. Сопровождая этот процесс, растворенная соль будет осаждаться, как показано в обратном направлении уравнения. Говорят, что система находится в равновесии, когда эти два взаимных процесса протекают с одинаковыми скоростями, и поэтому количество нерастворенной и растворенной соли остается постоянным. В пользу одновременного протекания процессов растворения и осаждения свидетельствует тот факт, что количество и размеры нерастворенных кристаллов соли со временем будут меняться, хотя их общая масса останется неизменной.
Сопровождая этот процесс, растворенная соль будет осаждаться, как показано в обратном направлении уравнения. Говорят, что система находится в равновесии, когда эти два взаимных процесса протекают с одинаковыми скоростями, и поэтому количество нерастворенной и растворенной соли остается постоянным. В пользу одновременного протекания процессов растворения и осаждения свидетельствует тот факт, что количество и размеры нерастворенных кристаллов соли со временем будут меняться, хотя их общая масса останется неизменной.
Используйте эту интерактивную симуляцию для приготовления различных насыщенных растворов.
Могут быть приготовлены растворы, в которых концентрация растворенного вещества превышает его растворимость. Такие растворы называются пересыщенными , и они являются интересными примерами неравновесных состояний. Например, газированный напиток в открытой таре, который еще не «испортился», перенасыщен углекислым газом; с течением времени концентрация CO 2 будет уменьшаться, пока не достигнет своего равновесного значения.
Посмотрите это впечатляющее видео, демонстрирующее осаждение ацетата натрия из перенасыщенного раствора.
В предыдущем модуле этой главы обсуждалось влияние сил межмолекулярного притяжения на образование растворов. Химические структуры растворенного вещества и растворителя диктуют возможные типы сил и, следовательно, являются важными факторами в определении растворимости. Например, в аналогичных условиях растворимость кислорода в воде примерно в три раза больше, чем у гелия, но в 100 раз меньше, чем растворимость хлорметана, CHCl 3 .Учитывая роль химической структуры растворителя, обратите внимание, что растворимость кислорода в жидком углеводороде гексане С 6 Н 14 примерно в 20 раз больше, чем в воде.
Другие факторы также влияют на растворимость данного вещества в данном растворителе. Одним из таких факторов является температура, при этом растворимость газа обычно уменьшается с повышением температуры (рис. 1). Это одно из основных последствий теплового загрязнения природных водоемов.
Это одно из основных последствий теплового загрязнения природных водоемов.
Когда температура реки, озера или ручья поднимается ненормально высоко, обычно из-за сброса горячей воды в результате какого-либо промышленного процесса, растворимость кислорода в воде снижается. Снижение уровня растворенного кислорода может иметь серьезные последствия для здоровья водных экосистем и, в тяжелых случаях, может привести к крупномасштабной гибели рыбы (рис. 2).
Рис. 2. (а) Маленькие пузырьки воздуха в этом стакане с охлажденной водой образовались, когда вода нагрелась до комнатной температуры и растворимость растворенного в ней воздуха уменьшилась. b) снижение растворимости кислорода в природных водах, подверженных тепловому загрязнению, может привести к крупномасштабной гибели рыбы. (кредит a: модификация работы Лиз Уэст; кредит b: модификация работы Службы охраны рыбных ресурсов и дикой природы США)
(кредит a: модификация работы Лиз Уэст; кредит b: модификация работы Службы охраны рыбных ресурсов и дикой природы США) На растворимость газообразного растворенного вещества также влияет парциальное давление растворенного вещества в газе, которому подвергается раствор.Растворимость газа увеличивается с увеличением давления газа. Газированные напитки служат хорошей иллюстрацией этой взаимосвязи. Процесс карбонизации включает воздействие на напиток относительно высокого давления газообразного диоксида углерода, а затем герметизацию контейнера с напитком, таким образом насыщая напиток CO 2 при этом давлении. Когда контейнер с напитком открывается, слышно знакомое шипение, когда сбрасывается давление газообразного диоксида углерода, и часть растворенного диоксида углерода, как правило, выходит из раствора в виде маленьких пузырьков (рис. 3).В этот момент напиток перенасыщен углекислым газом, и со временем концентрация растворенного углекислого газа уменьшится до своего равновесного значения, и напиток станет «плоским».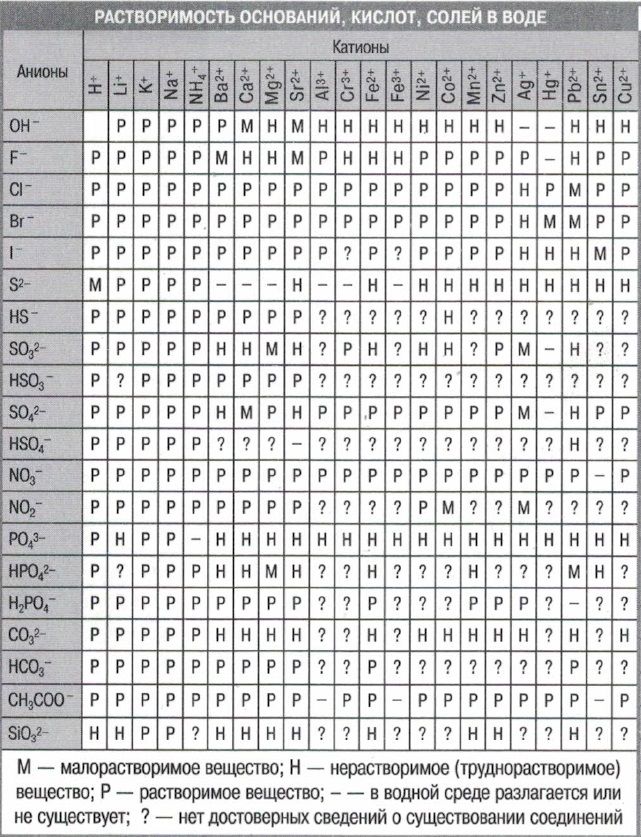
Для многих газообразных растворенных веществ соотношение между растворимостью C г и парциальным давлением P г является пропорциональным:
[латекс] C_{\text{g}} = kP_{\text{g}}[/latex]
, где k — константа пропорциональности, которая зависит от идентичности газообразного растворенного вещества и растворителя, а также от температуры раствора. Это математическая формулировка закона Генри : Количество идеального газа, растворяющегося в определенном объеме жидкости, прямо пропорционально давлению газа.
Пример 1
Применение закона Генри
При 20 °C концентрация растворенного кислорода в воде, подвергнутой воздействию газообразного кислорода при парциальном давлении 101,3 кПа (760 торр), составляет 1,38 × 10 -3 моль л -1 . Используйте закон Генри, чтобы определить растворимость кислорода, когда его парциальное давление составляет 20,7 кПа (155 торр), приблизительное давление кислорода в земной атмосфере.
Используйте закон Генри, чтобы определить растворимость кислорода, когда его парциальное давление составляет 20,7 кПа (155 торр), приблизительное давление кислорода в земной атмосфере.
Раствор
Согласно закону Генри для идеального раствора растворимость C г газа (1.38 × 10 -3 моль л -1 , в данном случае) прямо пропорционально давлению P г нерастворенного газа над раствором (в данном случае 101,3 кПа, или 760 торр). ). Поскольку мы знаем как C g , так и P g , мы можем преобразовать это выражение, чтобы найти k .
[латекс]\begin{array}{r @{{}={}} l} C_{\text{g}} & kP_{\text{g}} \\[0,5em] k & \frac{C_ {\text{g}}}{P_{\text{g}}} \\[0.{-1}[/латекс]
Обратите внимание, что для выражения величин, задействованных в такого рода вычислениях, могут использоваться различные единицы измерения. Приемлема любая комбинация единиц измерения, удовлетворяющая ограничениям размерного анализа.
Проверьте свои знания
Воздействие на образец воды объемом 100,0 мл при температуре 0 °C в атмосфере, содержащей газообразный раствор при 20,26 кПа (152 торр), привел к растворению 1,45 × 10 -3 г растворенного вещества. Используйте закон Генри, чтобы определить растворимость этого газообразного растворенного вещества, когда его давление равно 101.3 кПа (760 торр).
Ответ:
7,25 × 10 −3 в 100,0 мл или 0,0725 г/л
Декомпрессионная болезнь или «изгибы»
Декомпрессионная болезнь (ДКБ), или «декомпрессионная болезнь», является следствием повышенного давления воздуха, вдыхаемого аквалангистами при плавании под водой на значительных глубинах. В дополнение к давлению, оказываемому атмосферой, водолазы подвергаются дополнительному давлению из-за воды над ними, испытывая увеличение примерно на 1 атм на каждые 10 м глубины.Следовательно, воздух, вдыхаемый водолазом под водой, содержит газы при соответствующем более высоком давлении окружающей среды, а концентрации газов, растворенных в крови водолаза, пропорционально выше в соответствии с законом Генри.
По мере всплытия дайвера на поверхность воды давление окружающей среды снижается, и растворенные газы становятся менее растворимыми. Если всплытие слишком быстрое, газы, выделяющиеся из крови дайвера, могут образовывать пузырьки, вызывающие различные симптомы, начиная от сыпи и болей в суставах и заканчивая параличом и смертью.Чтобы избежать ДКБ, дайверы должны всплывать с глубины с относительно небольшой скоростью (10 или 20 м/мин) или иным образом делать несколько декомпрессионных остановок, останавливаясь на несколько минут на заданных глубинах во время всплытия. Когда эти профилактические меры не приносят результата, дайверам с ДКБ часто проводят гипербарическую оксигенотерапию в сосудах под давлением, называемых декомпрессионными (или рекомпрессионными) камерами (рис. 4).
Рисунок 4. (a) Водолазы ВМС США проходят обучение в рекомпрессионной камере. (b) Дайверы получают гипербарическую кислородную терапию. Отклонения от закона Генри наблюдаются, когда происходит химическая реакция между газообразным растворенным веществом и растворителем. Так, например, растворимость аммиака в воде не увеличивается с ростом давления так быстро, как предсказывает закон, потому что аммиак, будучи основанием, в некоторой степени реагирует с водой с образованием ионов аммония и гидроксид-ионов.
Так, например, растворимость аммиака в воде не увеличивается с ростом давления так быстро, как предсказывает закон, потому что аммиак, будучи основанием, в некоторой степени реагирует с водой с образованием ионов аммония и гидроксид-ионов.
Газы могут образовывать пересыщенные растворы. Если раствор газа в жидкости приготовить либо при низкой температуре, либо под давлением (или и то, и другое), то при нагревании раствора или уменьшении давления газа раствор может стать пересыщенным.В 1986 году более 1700 человек в Камеруне погибли, когда облако газа, почти наверняка двуокиси углерода, вырвалось из озера Ниос (рис. 5), глубокого озера в кратере вулкана. Вода на дне озера Ньос насыщена углекислым газом в результате вулканической активности под озером. Считается, что озеро претерпело оборот из-за постепенного нагревания снизу озера, и на поверхность вышла более теплая, менее плотная вода, насыщенная углекислым газом. В результате было выпущено огромное количество растворенного CO 2 , и бесцветный газ, более плотный, чем воздух, стекал по долине под озером и душил людей и животных, живущих в долине.
Мы знаем, что некоторые жидкости смешиваются друг с другом во всех отношениях; другими словами, они имеют бесконечную взаимную растворимость и, как говорят, смешиваются .Этанол, серная кислота и этиленгликоль (популярный для использования в качестве антифриза, изображенный на рисунке 6) являются примерами жидкостей, которые полностью смешиваются с водой. Двухтактное моторное масло смешивается с бензином.
Рисунок 6. Вода и антифриз смешиваются; смеси этих двух однородны во всех пропорциях. (кредит: «dno1967»/Wikimedia commons)
(кредит: «dno1967»/Wikimedia commons) Жидкости, которые смешиваются с водой в любых пропорциях, обычно представляют собой полярные вещества или вещества, образующие водородные связи. Для таких жидкостей диполь-дипольное притяжение (или водородная связь) молекул растворенного вещества с молекулами растворителя не менее сильное, чем между молекулами в чистом растворенном веществе или в чистом растворителе.Следовательно, два вида молекул легко смешиваются. Точно так же неполярные жидкости смешиваются друг с другом, потому что нет заметной разницы в силе межмолекулярного притяжения растворенное вещество, растворитель-растворитель и растворенное вещество-растворитель. Растворимость полярных молекул в полярных растворителях и неполярных молекул в неполярных растворителях опять же является иллюстрацией химической аксиомы «подобное растворяется в подобном».
Две жидкости, которые не смешиваются в заметной степени, называются несмешивающимися .Слои образуются, когда мы наливаем несмешивающиеся жидкости в одну и ту же емкость.
Две жидкости, такие как бром и вода, которые имеют умеренную взаимную растворимость, считаются частично смешиваемыми . Две частично смешивающиеся жидкости при смешивании обычно образуют два слоя. В случае смеси брома и воды верхний слой представляет собой воду, насыщенную бромом, а нижний слой представляет собой бром, насыщенный водой.Поскольку бром неполярен и, следовательно, мало растворим в воде, водный слой лишь слегка обесцвечивается растворенным в нем ярко-оранжевым бромом. Поскольку растворимость воды в броме очень низкая, заметного влияния на темный цвет бромного слоя не наблюдается (рис. 8).
В случае смеси брома и воды верхний слой представляет собой воду, насыщенную бромом, а нижний слой представляет собой бром, насыщенный водой.Поскольку бром неполярен и, следовательно, мало растворим в воде, водный слой лишь слегка обесцвечивается растворенным в нем ярко-оранжевым бромом. Поскольку растворимость воды в броме очень низкая, заметного влияния на темный цвет бромного слоя не наблюдается (рис. 8).
Зависимость растворимости ряда неорганических твердых веществ в воде от температуры показана кривыми растворимости на рисунке 9. Рассмотрение этих данных указывает на общую тенденцию увеличения растворимости с температурой, хотя есть и исключения, как показано на примере ионного соединения церия. сульфат.
сульфат.
Зависимость растворимости от температуры можно использовать для приготовления пересыщенных растворов некоторых соединений.Раствор можно насытить соединением при повышенной температуре (где растворенное вещество более растворимо) и затем охладить до более низкой температуры без осаждения растворенного вещества. Полученный раствор содержит растворенное вещество в концентрации, превышающей его равновесную растворимость при более низкой температуре (т. е. он является пересыщенным), и является относительно стабильным. Осаждение избыточного растворенного вещества можно инициировать путем добавления затравочного кристалла (см. видео в ссылке на обучение ранее в этом модуле) или путем механического перемешивания раствора.Некоторые грелки для рук, такие как изображенная на рис. 10, используют это свойство в своих интересах.
Рисунок 10. Эта грелка для рук вырабатывает тепло, когда ацетат натрия в перенасыщенном растворе выпадает в осадок. Осаждение растворенного вещества инициируется механической ударной волной, генерируемой при «щелкании» гибкого металлического диска в растворе. (кредит: модификация работы Velela/Wikimedia Commons)
Эта грелка для рук вырабатывает тепло, когда ацетат натрия в перенасыщенном растворе выпадает в осадок. Осаждение растворенного вещества инициируется механической ударной волной, генерируемой при «щелкании» гибкого металлического диска в растворе. (кредит: модификация работы Velela/Wikimedia Commons) На этом видео показан процесс кристаллизации, происходящий в грелке для рук.
Степень растворения одного вещества в другом определяется несколькими факторами, в том числе типами и относительными силами межмолекулярного притяжения, которые могут существовать между атомами, ионами или молекулами веществ. Эта склонность к растворению количественно определяется растворимостью вещества, его максимальной концентрацией в растворе при равновесии в заданных условиях. Насыщенный раствор содержит растворенное вещество в концентрации, равной его растворимости. Перенасыщенный раствор — это раствор, в котором концентрация растворенного вещества превышает его растворимость — неравновесное (нестабильное) состояние, которое приводит к осаждению растворенного вещества при соответствующем возмущении раствора. Смешивающиеся жидкости растворимы во всех соотношениях, а несмешивающиеся жидкости обладают очень низкой взаимной растворимостью. Растворимость газообразных растворенных веществ уменьшается с повышением температуры, в то время как растворимость большинства, но не всех твердых растворенных веществ увеличивается с повышением температуры. Концентрация газообразного растворенного вещества в растворе пропорциональна парциальному давлению газа, воздействию которого подвергается раствор, соотношение, известное как закон Генри.
Смешивающиеся жидкости растворимы во всех соотношениях, а несмешивающиеся жидкости обладают очень низкой взаимной растворимостью. Растворимость газообразных растворенных веществ уменьшается с повышением температуры, в то время как растворимость большинства, но не всех твердых растворенных веществ увеличивается с повышением температуры. Концентрация газообразного растворенного вещества в растворе пропорциональна парциальному давлению газа, воздействию которого подвергается раствор, соотношение, известное как закон Генри.
- [латекс] C_{\text{g}} = kP_{\text{g}}[/latex]
Химия Упражнения в конце главы
- Предположим, вам представлен прозрачный раствор тиосульфата натрия Na 2 S 2 O 3 .Как определить, является ли раствор ненасыщенным, насыщенным или пересыщенным?
- Пересыщенные растворы большинства твердых веществ в воде готовят путем охлаждения насыщенных растворов. Пересыщенные растворы большинства газов в воде готовят нагреванием насыщенных растворов.
 Объясните причины различия этих двух процедур.
Объясните причины различия этих двух процедур. - Предложите объяснение наблюдений, что этанол, C 2 H 5 OH, полностью смешивается с водой, а этантиол, C 2 H 5 SH, растворим только до степени 1.5 г на 100 мл воды.
- Рассчитайте массовую долю KBr в насыщенном растворе KBr в воде при 10 °C. См. полезные данные на рис. 9 и запишите вычисленный процент с точностью до одной значащей цифры.
- Какой из следующих газов лучше всего растворим в воде? Объясните свои рассуждения.
(а) CH 4
(б) CCl 4
(в) CHCl 3
- При 0 °C и 1,00 атм в 1 л воды может раствориться до 0,70 г O 2 .При 0 °C и 4,00 атм сколько граммов O 2 растворяется в 1 л воды?
- См. рис. 3.
(a) Как изменилась концентрация растворенного CO 2 в напитке, когда бутылку открыли?
(б) Чем вызвано это изменение?
(c) Является ли напиток ненасыщенным, насыщенным или перенасыщенным CO 2 ?
- Константа закона Генри для CO 2 равна 3,4 × 10 −2 M /атм при 25 °C.
 Какое давление углекислого газа необходимо для поддержания концентрации CO 2 0,10 M в банке лимонно-лаймовой газировки?
Какое давление углекислого газа необходимо для поддержания концентрации CO 2 0,10 M в банке лимонно-лаймовой газировки? - Константа закона Генри для O 2 равна 1,3 × 10 −3 M /атм при 25 °C. Какая масса кислорода будет растворена в 40-литровом аквариуме при температуре 25 °C, при условии, что атмосферное давление равно 1,00 атм, а парциальное давление O 2 равно 0,21 атм?
- Сколько литров газообразного HCl, измеренного при 30,0 °C и 745 торр, требуется для приготовления 1.25 л 3,20- М раствора соляной кислоты?
Глоссарий
- Закон Генри
- закон, устанавливающий пропорциональную зависимость между концентрацией растворенного газа в растворе и парциальным давлением газа, контактирующего с раствором
- несмешивающийся
- незначительной взаимной растворимости; обычно относится к жидким веществам
- смешиваемый
- взаиморастворим во всех пропорциях; обычно относится к жидким веществам
- частично смешиваемый
- умеренной взаимной растворимости; обычно относится к жидким веществам
- насыщенный
- концентрации, равной растворимости; содержащие максимально возможную концентрацию растворенного вещества при данной температуре и давлении
- растворимость
- степень растворимости растворенного вещества в воде или любом растворителе
- пересыщенный
- концентрации, превышающей растворимость; неравновесное состояние
- ненасыщенный
- концентрации ниже растворимости
Решения
Ответы на упражнения по химии в конце главы
2. Растворимость твердых веществ обычно уменьшается при охлаждении раствора, а растворимость газов обычно уменьшается при нагревании.
Растворимость твердых веществ обычно уменьшается при охлаждении раствора, а растворимость газов обычно уменьшается при нагревании.
4. 40%
6. 2,80 г
8. 2,9 атм
10. 102 л HCl
Растворимость
Обратите внимание, что при 20°C KCl более растворим, но при 40°C более растворим KNO 3 . Хотя растворимость обеих солей увеличивается с температурой, данное повышение температуры повышает растворимость нитрата гораздо больше, чем растворимость хлорида.
Когда соединение, содержащее ионные связи, помещают в воду, полярные молекулы воды разделяют часть или все вещество на его катионы и анионы. Разделение называется ионной диссоциацией .
Концентрация ионов может не совпадать с концентрацией раствора. Например, возьмите 14,2 г сульфата натрия (Na 2 SO 4 ) и добавьте его в воду, достаточную для получения 1 л раствора. Сульфат натрия хорошо растворим и растворяется полностью, поэтому раствор равен 0. 1 моляр в Na 2 SO 4 .
1 моляр в Na 2 SO 4 .
Однако соль полностью диссоциирует на ионы:
В предыдущем выражении (s) обозначает твердое вещество, а (aq) обозначает водный ион. В любой реакции коэффициенты пропорциональны количеству молей. Таким образом, каждый моль Na 2 SO 4 дает два моля Na + и один моль . Следовательно, 0,1 М раствор Na 2 SO 4 равен 0.2 М в Na + и 0,1 М в .
Для ионизирующих веществ, которые мало растворимы, концентрации ионов умножаются на константу, называемую произведением растворимости в насыщенном растворе. Для гипотетического соединения CA, где один катион обозначен буквой C, а анион буквой A, уравнение растворимости имеет вид
.[С] [А] = К сп
, где молярные концентрации двух ионов указаны в квадратных скобках, а константа K sp представляет собой произведение растворимости.
Многие бинарные соединения (состоящие только из двух элементов) содержат более одного катиона или аниона. Общее бинарное соединение может быть записано как C x A y , где нижние индексы означают, что соединение имеет x катионов и y анионов. В этом случае уравнение растворимости
[C] x [A] y = K sp
Выполните расчет растворимости, используя карбонат серебра (Ag 2 CO 3 ) в качестве растворенного вещества.Диссоциация соли дает три водных иона:
В таблице 2 указано, что K sp для Ag 2 CO 3 равно 8,5 × 10 –12 . Уравнение растворимости включает квадрат [Ag + ], поскольку каждая формульная единица дает два иона Ag + .
Поскольку молярность равна общей молярности Ag 2 CO 3 в растворе, назовите концентрацию карбоната x и концентрацию ионов серебра 2 x .
Раствор, таким образом, составляет 0,000129 M Ag 2 CO 3 , что идентично значению, найденному для концентрации. Поскольку формула массы Ag 2 CO 3 в граммах равна 275,75, каждый литр раствора содержит
Вы можете описать растворимость карбоната серебра как 0,0355 грамма на литр.
В таблице 2 приведены произведения растворимости некоторых важных труднорастворимых соединений. Значения даны для 25°C, и каждое из них зависит от температуры.
Вам необходимо использовать Таблицу 2 для решения следующих практических задач:
- Предположим, вы размешали 0,15 г порошка хлорида меди (CuCl) в литре воды. Порошок полностью растворится?
- Определите растворимость в граммах на литр гидроксида алюминия Al(OH) 3 .
Таблица постоянных значений произведения растворимости
Таблица постоянных значений произведения растворимости CHEM 106 — Общая химия 201.
 08.03
08.03 Константы произведения растворимости чрезвычайно трудно получить экспериментально из-за необходимости идентифицировать все химические вещества и процессы, присутствующие в химической системе, используемой для получения их значений.Литературные значения K sp могут сильно расходиться, даже на несколько порядков. Значения K sp , найденные в этой таблице, являются номинальными значениями для использования в моих курсах общей химии и не обязательно представляют наиболее известные значения констант произведения растворимости.
Константа произведения растворимости (K sp ) Значения при 25 o C
| Соль | К сп | Соль | К сп | Соль | К сп | ||
| Бромиды | Карбонаты | Оксалаты | |||||
| PbBr 2 | 6. 6 х 10 -6 6 х 10 -6 | MgCO 3 | 6,8 x 10 -6 | MgC 2 O 4 | 4,8 x 10 -6 | ||
| CuBr | 6,3 x 10 -9 | NiCO 3 | 1,3 x 10 -7 | FeC 2 O 4 | 2 x 10 -7 | ||
| AgBr | 5.4 x 10 -13 | CaCO 3 | 5,0 x 10 -9 | NiC 2 O 4 | 1 x 10 -7 | ||
| Hg 2 Br 2 | 6,4 x 10 -23 | SrCO 3 | 5,6 x 10 -10 | SrC 2 O 4 | 5 x 10 -8 | ||
| Хлориды | MnCO 3 | 2. 2 x 10 -11 2 x 10 -11 | CuC 2 O 4 | 3 x 10 -8 | |||
| PbCl 2 | 1,2 x 10 -5 | CuCO 3 | 2,5 x 10 -10 | BaC 2 O 4 | 1,6 x 10 -7 | ||
| CuCl | 1,7 x 10 -7 | КоСО 3 | 1.0 х 10 -10 | CdC 2 O 4 | 1,4 x 10 -8 | ||
| AgCl | 1,8 x 10 -10 | FeCO 3 | 2,1 x 10 -11 | ZnC 2 O 4 | 1,4 x 10 -9 | ||
| Hg 2 Cl 2 | 1,4 x 10 -18 | ZnCO 3 | 1.2 x 10 -10 | CaC 2 O 4 | 2,3 x 10 -9 | ||
| Фториды | Ag 2 CO 3 | 8,1 x 10 -12 | Ag 2 C 2 O 4 | 3,5 x 10 -11 | |||
| BaF 2 | 1,8 x 10 -7 | CdCO 3 | 6. 2 x 10 -12 2 x 10 -12 | PbC 2 O 4 | 4,8 x 10 -12 | ||
| MgF 2 | 7,4 x 10 -11 | PbCO 3 | 7,4 x 10 -14 | Hg 2 C 2 O 4 | 1,8 x 10 -13 | ||
| SrF 2 | 2,5 x 10 -9 | Гидроксиды | MnC 2 O 4 | 1 x 10 -15 | |||
| CaF 2 | 1.5 x 10 -10 | Ba(OH) 2 | 5,0 x 10 -3 | Фосфаты | |||
| Йодиды | Sr(OH) 2 | 6,4 x 10 -3 | Ag 3 Заказ на покупку 4 | 8,9 x 10 -17 | |||
| PbI 2 | 8,5 x 10 -9 | Са(ОН) 2 | 4. 7 x 10 -6 7 x 10 -6 | AlPO 4 | 9,8 x 10 -21 | ||
| CuI | 1,1 x 10 -12 | Mg(OH) 2 | 5,6 x 10 -12 | Mn 3 (PO 4 ) 2 | 1 x 10 -22 | ||
| AgI | 8,5 x 10 -17 | Mn(OH) 2 | 2.1 х 10 -13 | Ba 3 (PO 4 ) 2 | 3 x 10 -23 | ||
| Hg 2 I 2 | 4,5 x 10 -29 | Cd(OH) 2 | 5,3 x 10 -15 | BiPO 4 | 1,3 x 10 -23 | ||
| Сульфаты | Pb(OH) 2 | 1.2 x 10 -15 | Sr 3 (PO 4 ) 2 | 4 x 10 -28 | |||
| CaSO 4 | 7,1 x 10 -5 | Fe(OH) 2 | 4,9 x 10 -17 | Pb 3 (PO 4 ) 2 | 7,9 x 10 -43 | ||
| Ag 2 SO 4 | 1. 2 x 10 -5 2 x 10 -5 | Ni(OH) 2 | 5,5 x 10 -16 | Хроматы | |||
| Hg 2 SO 4 | 6,8 x 10 -7 | Co(OH) 2 | 1,1 x 10 -15 | CaCrO 4 | 7,1 x 10 -4 | ||
| СрСО 4 | 3.5 х 10 -7 | Zn(OH) 2 | 4,1 x 10 -17 | SrCrO 4 | 2,2 x 10 -5 | ||
| PbSO 4 | 1,8 x 10 -8 | Cu(OH) 2 | 1,6 x 10 -19 | Hg 2 CrO 4 | 2,0 x 10 -9 | ||
| BaSO 4 | 1.1 х 10 -10 | Hg(OH) 2 | 3,1 x 10 -26 | BaCrO 4 | 1,2 x 10 -10 | ||
| Ацетаты | Sn(OH) 2 | 5,4 x 10 -27 | Ag 2 CrO 4 | 2,0 x 10 -12 | |||
| Ag(CH 3 COO) | 4. 4 x 10 -3 4 x 10 -3 | Cr(OH) 3 | 6,7 x 10 -31 | PbCrO 4 | 2,8 x 10 -13 | ||
| Hg 2 (CH 3 COO) 2 | 4 x 10 -10 | Al(OH) 3 | 1,9 x 10 -33 | ||||
| Fe(OH) 3 | 2.6 x 10 -39 | ||||||
ВЕРНУТЬСЯ НА ГЛАВНУЮ СТРАНИЦУ
Активность: Растворимость | manoa.hawaii.edu/ExploringOurFluidEarth
Активность: Растворимость | manoa.hawaii.edu/ExploringOurFluidEarth Подходит для печатиМатериалы
-
Дистиллированная вода
-
Спирт этиловый
-
Масло растительное
-
Хлорид натрия (поваренная соль)
-
Сахар
-
Крахмал
-
Пищевая сода
-
Градуированный цилиндр 10 мл
-
Пробка для мерного цилиндра
-
Контейнеры и крышки для хранения растворов
-
Этикетировочная лента
-
Водонепроницаемый маркер
|
Жидкость |
Склеивание |
Полярность |
Модель Молекула |
|
Дистиллированная вода* |
Ковалентный |
Высокополярный |
|
|
Алкоголь |
Ковалентный |
Слабополярный |
|
|
Масло ** |
Ковалентный |
Неполярный |
|
* Дистиллированная вода – это вода, из которой удалены растворенные ионы. Это чистый Н3О.
Это чистый Н3О.
**Масла обычно представляют собой смеси различных типов молекул
Процедура
- Используйте информацию о жидкостях в Таблице 3.3 и твердых веществах в Таблице 3.4, чтобы спрогнозировать, какое количество каждого твердого растворенного вещества растворит растворитель.
- Запишите свойства каждого растворителя и растворенного вещества в Таблицу 3.5.
- Используя термины все, некоторые и ни один, запишите свои прогнозы относительно того, сколько каждого растворенного вещества растворится в каждой жидкости в таблице 3.5.
- Определите, сколько твердого вещества может растворить каждый растворитель.
- Получите растворители и растворенные вещества, с которыми вам поручено работать.
- Проверить растворимость растворенных веществ в растворителе. Поместите 2 мл вашего первого растворенного вещества в градуированный цилиндр на 10 мл, затем заполните градуированный цилиндр до отметки 10 мл растворяющей жидкостью.

- Закройте цилиндр пробкой, осторожно встряхивайте содержимое в течение 10 секунд и дайте смеси постоять, пока не прекратится отстаивание, приблизительно 20 секунд.При энергичном встряхивании может временно образоваться суспензия.
- Определите, сколько твердого вещества растворилось. Запишите свои наблюдения как все, некоторые или ни одного в Таблицу 3.4.
- Необязательно: сохраните свой раствор для проверки электропроводности. Хранить в контейнерах с герметичными крышками для предотвращения испарения. Пометьте контейнеры своим именем и раствором.
- Вымойте мерный цилиндр и пробку и ополосните водопроводной водой.
- Повторите шаги с (b) по (g) для каждого из других твердых веществ, показанных в таблице 3.5
- Для назначенного растворителя предскажите, какое количество каждой из других жидкостей он может растворить. Используя термины все, некоторые и никто, запишите свои прогнозы в Таблицу 3.6.
- Определите способность каждого жидкого растворителя растворять другие жидкости.

- Поместите 2 мл исследуемого растворенного вещества в градуированный цилиндр на 10 мл; затем заполните градуированный цилиндр до отметки 10 мл растворяющей жидкостью.
- Закройте цилиндр пробкой, аккуратно встряхните содержимое в течение 10 секунд и дайте смеси отстояться до прекращения осаждения.
- Наблюдайте, как жидкий растворитель растворяется в тестовой жидкости. Определить, сколько испытуемой жидкости растворилось. Запишите свои наблюдения как все, некоторые или ни одного.
- Если есть разделение жидкостей, измерьте объем нижнего слоя. Запишите объем и идентичность нижнего слоя в Таблицу 3.6.
- Вымойте мерный цилиндр и пробку и ополосните водопроводной водой.
- Повторите шаги с (а) по (е) для каждого из других растворителей, указанных в таблице 3.6
|
Растворенное вещество |
Химическая формула |
Склеивание |
Полярность/заряженные ионы |
Модель Молекула |
|
Соль |
NaCl |
Ионный |
Высокополярный |
|
|
Сахар столовый (сахароза) |
С 12 Н 22 О 11 |
Ковалентный (один сахар глюкозы и один сахар фруктозы связаны вместе) |
Полярный (из-за отрицательно заряженных ОН-групп) |
|
|
Крахмал |
(C 6 H 10 O 5 ) n n обычно большое число |
Ковалентные (длинные цепи сахара-глюкозы) |
Неполярный (из-за разветвления молекулы) |
|
|
Пищевая сода |
NaHCO 3 |
Ионный (соединение ковалентного многоатомного иона HCO 3 — и Na + )
|
Заряженные ионы |
|
Вопросы для занятия:
- Как узнать, когда:
- твердое вещество полностью растворилось в жидкости?
- жидкость полностью растворилась в другой жидкости?
- Какие утверждения можно сделать о растворимости полярных, неполярных и ионных растворенных веществ в
- неполярных жидких растворителях
- слабополярные жидкие растворители
- ионные растворители
- Зная, что вода полярна, какое обобщение можно сделать о смеси порошковых напитков?
- Минералы растворяются и переносятся с земли речной водой.
 Почва также переносится речной водой, но не растворяется. Что вы можете сказать о полезных ископаемых и почве?
Почва также переносится речной водой, но не растворяется. Что вы можете сказать о полезных ископаемых и почве?
Изучение нашей жидкой Земли, продукт Группы исследований и разработок учебных программ (CRDG) Педагогического колледжа. Гавайский университет, 2011 г. Этот документ можно свободно воспроизводить и распространять в некоммерческих образовательных целях.
Правила растворимости: Полное руководство по химии AP®
Введение в правила растворимости
В этой статье мы расскажем вам все о правилах растворимости.Никакое обсуждение правил растворимости не будет полным без предварительного понимания обозначений, связанных с анализом растворимости. Понимание растворимости на глубоком уровне требует от нас рассмотрения темы с точки зрения частиц, что означает, что нам придется подробно обсудить кинетическую молекулярную теорию. Это поможет вам понять, как соединения сольватируются на уровне частиц. Как только мы это поймем, нас уже не остановить! Далее следует термодинамика с общим обсуждением влияния температуры на растворимость.Затем мясо этой статьи: подробное обсуждение выражения равновесия растворимости K sp и того, что от вас потребует экзамен AP®. Наконец, мы завершим обсуждением того, как межмолекулярные силы могут влиять на способность соединений сольватироваться!
Как только мы это поймем, нас уже не остановить! Далее следует термодинамика с общим обсуждением влияния температуры на растворимость.Затем мясо этой статьи: подробное обсуждение выражения равновесия растворимости K sp и того, что от вас потребует экзамен AP®. Наконец, мы завершим обсуждением того, как межмолекулярные силы могут влиять на способность соединений сольватироваться!
Обозначение растворимости – основные знания 6.C.3.
Есть некоторые обозначения, с которыми вы, вероятно, уже знакомы, и которые мы должны рассмотреть, прежде чем продолжить это руководство.
• Иногда мы сокращаем слово «осадок» до «ppt».
• Твердые частицы могут быть обозначены как (s), т. е. NaCl (s) . В уравнении растворимости это будет равно осадку.
• Мы определяем растворимые продукты как те, которые могут сольватироваться в воде. В молекулярном обозначении это обозначается как (водн.), что означает «сольватированный в водной среде», т. е. Na + (водн.) .
е. Na + (водн.) .
В целом, чем выше температура системы, тем легче соединениям растворяться в растворе.Почему? Итак, давайте рассмотрим систему с помощью кинетической молекулярной теории.
Полная энергия системы – основные знания 5.A.1.
Полную энергию любой системы определяют три условия.
{E}_{всего} = KE + PE + U
Первый термин, кинетическая энергия ( KE ), определяет энергию, которой обладает объект в зависимости от его движения. Макроскопические объекты, такие как движущийся автомобиль, обладают определенной кинетической энергией, как и микроскопические объекты, такие как газы. Кинетическая энергия является функцией импульса ( p ) объекта, а сам импульс является функцией скорости ( v ) и массы ( m ) объекта.{ 2 }
Второй член, потенциальная энергия ( PE ), представляет собой составную функцию, которая описывает энергию, хранящуюся в системе, на основе ее внешних условий. Например, камень на вершине горы обладает определенной потенциальной энергией, потому что он находится внутри гравитационного поля , и это поле дает ему возможность упасть. Точно так же заряженный ион (то есть Na + ) имеет определенную потенциальную энергию внутри электрического поля . Каждый раз, когда упоминается слово , поле , вы можете предположить, что потенциальная энергия что-то в нем играет.Каждое внешнее силовое поле имеет свой набор уравнений для потенциальной энергии, и мы не будем вдаваться в них, пока будем говорить.
Например, камень на вершине горы обладает определенной потенциальной энергией, потому что он находится внутри гравитационного поля , и это поле дает ему возможность упасть. Точно так же заряженный ион (то есть Na + ) имеет определенную потенциальную энергию внутри электрического поля . Каждый раз, когда упоминается слово , поле , вы можете предположить, что потенциальная энергия что-то в нем играет.Каждое внешнее силовое поле имеет свой набор уравнений для потенциальной энергии, и мы не будем вдаваться в них, пока будем говорить.
Последний термин, внутренняя энергия ( U ), представляет собой термодинамическую функцию, которая охватывает всю энергию, связанную со связями внутри молекулы. На внутреннюю энергию системы влияет каждый раз, когда создаются или разрываются связи. Поглощение высокоэнергетических фотонов, которые заставляют электроны в атоме или молекуле переходить в состояние с более высокой энергией, также отражается изменениями внутренней энергии. Есть также колебательные и вращательные моменты в многоатомных молекулах, которые вносят вклад во внутреннюю энергию системы. Внутримолекулярные силы, такие как электрический диполь, связанный с образованием полярных ковалентных связей, или магнитный диполь, присутствующий в ароматических соединениях, также классифицируются как изменения внутренней энергии, поскольку они присутствуют независимо от внешних электрических или магнитных полей.
Есть также колебательные и вращательные моменты в многоатомных молекулах, которые вносят вклад во внутреннюю энергию системы. Внутримолекулярные силы, такие как электрический диполь, связанный с образованием полярных ковалентных связей, или магнитный диполь, присутствующий в ароматических соединениях, также классифицируются как изменения внутренней энергии, поскольку они присутствуют независимо от внешних электрических или магнитных полей.
Чтобы адекватно описать энергетическое состояние системы, вам необходимо включить все различные функции, относящиеся к переменным кинетической, потенциальной и внутренней энергии.Многие уравнения компрометируют полный потенциал и внутреннюю энергию системы, и вычисление каждого из них представляет собой невероятно утомительный процесс, если не совершенно невозможный. Таким образом, способ обойти это препятствие состоит только в том, чтобы учесть изменений в системе. Когда мы делаем это, нам нужно рассматривать только те переменные, которые изменяют между началом и концом нашей реакции.
Кинетическая молекулярная теория – основные знания 2.A.2.
Легче всего понять термины кинетической молекулярной теории газов .Допустим, мы поместили чистый газообразный гелий (одноатомный, He ) в контейнер и зафиксировали объем контейнера. При комнатной температуре ( T = 20°C ) частицы газа оказывают на стенки сосуда определенное давление (измеряемое барометром). Когда температура падает, мы экспериментально наблюдаем, что давление газа в резервуаре падает линейно. Уроженец Шотландии Уильям Лорд Кельвин экстраполировал линейную зависимость до точки, где давление газа равно нулю.Теоретическая температура, которую он рассчитал, была -273°C .
Что это значит? Что ж, давайте рассмотрим аргумент энергетики. Какова полная энергия одноатомного газообразного гелия? Его внутренняя энергия незначительна: у них нет ни вращательных, ни колебательных мод, ни молекулярного диполя. Межмолекулярными силами можно пренебречь, потому что молекулы газа находятся так далеко друг от друга. Он также не имеет никакой потенциальной энергии: молекулы гелия не заряжены и не обладают собственным магнитным диполем.Единственная энергия, которой обладают эти молекулы, — это фактически кинетическая энергия, энергия движения. Поскольку KE = ½mv 2 , если у частиц есть энергия, они движутся. Итак, что происходит в точке, где давление в сосуде равно нулю? В этот момент молекулы газа не имеют энергии и поэтому прекращают всякое движение.
Он также не имеет никакой потенциальной энергии: молекулы гелия не заряжены и не обладают собственным магнитным диполем.Единственная энергия, которой обладают эти молекулы, — это фактически кинетическая энергия, энергия движения. Поскольку KE = ½mv 2 , если у частиц есть энергия, они движутся. Итак, что происходит в точке, где давление в сосуде равно нулю? В этот момент молекулы газа не имеют энергии и поэтому прекращают всякое движение.
Что все это значит? Итог: температура газа прямо пропорциональна его ЭК! В жидкостях молекулы имеют значительное количество межмолекулярных сил, которые также могут поглощать энергию.Однако это базовое понимание теплоты, равной движению, является причиной того, что все расчеты растворимости меняются в зависимости от температуры. Поэтому стандартные измерения всегда выполняются при определенной температуре, такой как 25°C, так что расчетное значение всегда верно для солюбилизации при этой температуре.
Термодинамические аспекты растворимости – 6.
 C.3.
C.3.
Применяя кинетическую теорию материи к теме растворимости, мы теперь понимаем, что частицы при более высоких температурах возбуждаются до более высоких состояний энергии, что часто означает увеличение числа столкновений между этими частицами.Увеличение числа столкновений означает, что статистически у молекулы воды больше шансов столкнуться с одним из ионов, чтобы раствориться таким образом, что ион станет солюбилизированным . Это относится к любой эндотермической (теплопоглощающей) реакции, которая ставит под угрозу большинство (но не все) реакций солюбилизации.
С другой стороны, некоторые реакции сольватации, такие как реакция сульфата натрия, являются экзотермическими (с выделением тепла) и поэтому менее растворимы при более высокой температуре. В качестве примера ниже показан график зависимости некоторых констант растворимости от температуры.
Источник изображения: Wikimedia Commons Более высокая температура также способствует уменьшению притяжения между отдельными молекулами воды, которые сильно притягиваются друг к другу. Разрушение решетки водородных связей позволяет входящим ионам занять свое место внутри решетки. Наглядно это можно представить как молекулы воды вокруг иона, образующие сольватную оболочку.
Разрушение решетки водородных связей позволяет входящим ионам занять свое место внутри решетки. Наглядно это можно представить как молекулы воды вокруг иона, образующие сольватную оболочку.
Всегда растворимые — основные знания 6.С.3.
Несколько солей, всегда растворимых в воде, независимо от их состава. Все соли, содержащие следующие ионы, всегда растворимы:
• Натрий, Na +
• Калий, K +
• Аммоний, NH 4 +
• Нитрат, NO 3 –
Пример:
Поваренная соль, NaCl, полностью смешивается с водой, полностью диссоциируя на входящие в ее состав ионы натрия и хлорида.{-}
В прошлом от вас требовалось запомнить список соединений или солей и знать по памяти, растворим ли продукт в воде или образует осадок. Вместо этого в новом экзамене AP® по химии особое внимание уделяется пониманию константы равновесия растворимости, K sp . Цитата из Руководства по проведению экзамена по химии AP® (стр. 79):
Цитата из Руководства по проведению экзамена по химии AP® (стр. 79):
«Запоминание других «правил растворимости» выходит за рамки данного курса и экзамена AP®. Обоснование: Запоминание правил разрешимости не углубляет понимание больших идей».
Поэтому мы сосредоточим остальную часть нашего обсуждения на применении константы равновесия растворимости.
Константа равновесия растворимости – основные знания 6.C.3.
Для растворения соли отношение реакции Q называют произведением растворимости, а K sp — константой произведения растворимости.{ — } \правильно]
Вот почему константа равновесия растворимости называется константой «растворимость-произведение»: потому что значение K sp всегда равно произведению концентраций двух составляющих соли. Значение константы равновесия получено экспериментально и будет дано вам на экзамене AP® из таблицы стандартных продуктов растворимости. Тем не менее, это зависит от вас, чтобы знать, как его использовать и применять.
Тем не менее, это зависит от вас, чтобы знать, как его использовать и применять.
Используя приведенный выше пример и учитывая K sp = 1.{-2}
Один литр воды растворяет 2,26 x 10 -2 молей бромида свинца. Однако вопрос был на 500 мл воды. Итак, нам нужно разделить полученное значение пополам, что дает нам 1,13 х 10 -2 молей бромида свинца. Этот метод можно использовать для определения молярного количества соединения, которое может растворяться в воде.
Также важно отметить, что в некоторых случаях значение K sp будет указано в логарифмических единицах ( pK sp ).{-5} \справа)} =-4,34
Мы хотим, чтобы вы обратили внимание на эту важную тенденцию в константах произведения растворимости: чем меньше (более отрицательна) константа равновесия, тем меньше соединения может быть растворено в воде. Это верно как для регулярной, так и для логарифмической формы константы. Анализ значений K sp — это новый способ, с помощью которого экзамен по химии AP® проверяет ваше понимание правил растворимости. Возможность предсказать благоприятную способность сольватации на основе понимания константы произведения растворимости даст вам истинное понимание глубокого смысла растворимости.
Возможность предсказать благоприятную способность сольватации на основе понимания константы произведения растворимости даст вам истинное понимание глубокого смысла растворимости.
Применение принципа Ле Шателье – основные знания 6.C.3.
При проведении экспериментов по растворимости можно заметить пониженную растворимость некоторых соединений в присутствии подобных соединений. Например, хлорид натрия полностью растворим в воде. Однако, если бы вы попытались растворить другую соль натрия (например, сульфат натрия, Na 2 SO 4 ) или хлоридную соль (например, хлорид серебра, AgCl), растворимость второй соли была бы ниже, чем если бы вы пытались растворить соль в растворе чистой воды.{-}
Принцип Ле Шатлье применяется, утверждая, что меньше хлорида серебра будет растворяться в солевом растворе, потому что в растворе уже есть определенное количество хлорида. Другими словами, по мере того, как мы увеличиваем концентрацию одного из соединений в обратимой реакции, концентрация соединений на другой стороне обратимой реакции также должна увеличиваться. Это ядро эффекта общего иона, и это тема, с которой вы почти наверняка столкнетесь качественно, по крайней мере, на экзамене по химии AP®.
Это ядро эффекта общего иона, и это тема, с которой вы почти наверняка столкнетесь качественно, по крайней мере, на экзамене по химии AP®.
Молекулярная полярность – основные 2.B.1, 2.B.2, 2.C.1.
Когда два атома связаны ковалентной связью, но имеют разную электроотрицательность (0,5 < e – < 2,0), электроны в связях распределяются неравномерно, и молекула становится полярной . Ниже представлена тепловая карта электронной плотности, стандартный метод отображения полярности связи. Красная область представляет области с высокой электронной плотностью, а синяя — с низкой плотностью.
Источник изображения: Wikimedia Commons Полярность молекулы напрямую связана с тем, как соединения сольватируются водой в растворе.Может быть сложно предсказать молекулярную полярность. Двухатомные молекулы одного и того же элемента всегда неполярны. Точно так же углеводы обычно неполярны. Любая молекула с зеркальными плоскостями инверсии не может быть полярной, поскольку полярность по определению определяется неравномерным распределением зарядов. Даже в молекулах, симметричных относительно неровной оси, таких как трифторид бора (BF 3 ), который имеет неполярную треугольную плоскую форму, общее распределение зарядов является симметричным.
Даже в молекулах, симметричных относительно неровной оси, таких как трифторид бора (BF 3 ), который имеет неполярную треугольную плоскую форму, общее распределение зарядов является симметричным.
Водородная связь – основные знания 2.B.2.
Тип межмолекулярной связи — водородная связь, представляющая собой особый тип межмолекулярной связи. Ниже мы показали изображение электронной плотности молекулы воды, которая состоит из одного атома кислорода, связанного с двумя атомами водорода. Кислород ( e – = 3,44) имеет гораздо большую электроотрицательность , чем водород ( e – = 2,20), и поэтому электроны больше притягиваются к атому кислорода и проводят больше времени ближе к его ядру .Это приводит к образованию полярной связи.
Источник изображения: Wikimedia Commons Теперь молекула воды, окруженная другой подобной молекулой, имеет как положительный, так и отрицательный частичный заряд. В растворе воды частично положительные атомы водорода притягивают частичный отрицательный заряд других атомов кислорода в соседних молекулах воды, и наоборот. Это создает уникальную сеть слабых электростатических взаимодействий, которые метко называют водородными связями.
В растворе воды частично положительные атомы водорода притягивают частичный отрицательный заряд других атомов кислорода в соседних молекулах воды, и наоборот. Это создает уникальную сеть слабых электростатических взаимодействий, которые метко называют водородными связями.
В отличие от других межмолекулярных сил, водородные связи относительно прочны, хотя и слабее, чем ионные и ковалентные связи. Они также важны из-за их огромного количества в растворах полярных протонных (водородосодержащих) молекул, таких как H 2 O: они вносят основной вклад в физический эффект поверхностного натяжения в воде.
Один важный заключительный момент: водородные связи существуют только в полярных протонных молекулах.Углеводы, состоящие из молекул, состоящих из множества углерод-водородных связей (как видно из названия), не обладают никакой полярностью, а потому не могут образовывать водородные связи. Именно поэтому масла не растворяются в воде!
Именно поэтому масла не растворяются в воде!
Влияние pH на растворимость – основные знания 6.C.3.
pH раствора является мерой концентрации протонов (H + ионов), где наиболее концентрированный протонированный раствор имеет pH = 0, а наименее протонированный (самый основной) раствор имеет pH = 14.Существует более широкая дискуссия о том, что представляет собой кислота и основание, но пока мы продолжим дискуссию вокруг определения Аррениуса кислот и оснований (ионов H + и OH — ).
Как рН раствора влияет на растворимость соединения? Ну, некоторые соединения нейтральны при одних значениях pH и содержат заряды при других. Например, аммиак (NH 3 ) нейтрален при щелочном рН, но по мере увеличения концентрации Н + аммиак заряжается и превращается в аммоний (NH 4 + ).Благодаря электростатическому взаимодействию между положительным ионом аммония и частичным отрицательным зарядом полярных молекул воды аммоний растворяется в воде гораздо лучше, чем аммиак!
На этом мы закончили! Теперь вы знаете все, что нужно знать о правилах растворимости для экзамена по химии AP®! Как мы сделали? Мы ничего не пропустили? Если вы хотите узнать что-то еще или у вас есть более конкретные вопросы по этой теме, напишите нам и дайте нам знать! Мы всегда рады услышать от вас, наш читатель.

 Химическая структура, полярность и связывание выбранных жидкостей.
Химическая структура, полярность и связывание выбранных жидкостей.