Химическая связь — основные виды, типы и характеристики
Статья находится на проверке у методистов Skysmart.
Если вы заметили ошибку, сообщите об этом в онлайн-чат (в правом нижнем углу экрана).
Химическая связь и строение вещества
Все системы стремятся к равновесию и к уменьшению свободной энергии — так гласит один из постулатов химической термодинамики. Атомы, взаимодействующие в молекуле вещества, тоже подчиняются этому закону. Они стремятся образовать устойчивую конфигурацию — 8-электронную или 2-электронную внешнюю оболочку. Этот процесс взаимодействия называется химической связью, благодаря ему получаются молекулы и молекулярные соединения.
| Химическая связь — это взаимодействие между атомами в молекуле вещества, в ходе которого два электрона (по одному от каждого атома) образуют общую электронную пару либо электрон переходит от одного атома к другому. |
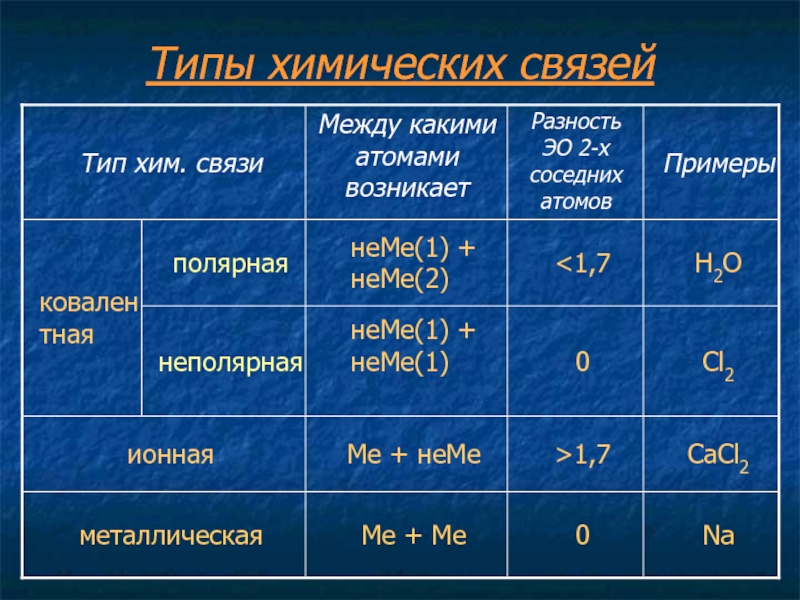
Как понятно из определения химической связи, при взаимодействии двух атомов один из них может притянуть к себе внешние электроны другого.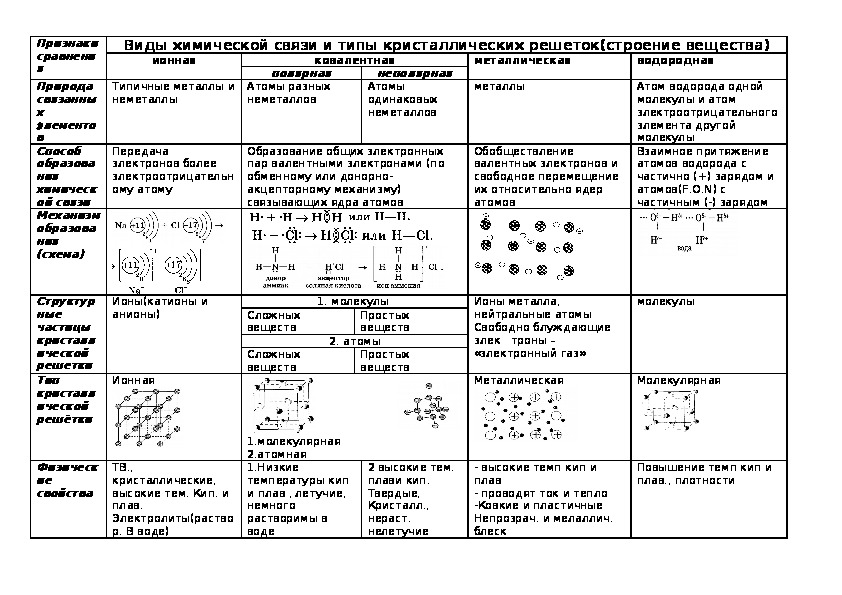
Важно!
Существует несколько систем измерения ЭО, но пользоваться для расчетов можно любой из них. Для образования химической связи важно не конкретное значение ЭО, а разница между этими показателями у двух атомов.
Механизм образования химической связи
Существует два механизма взаимодействия атомов:
обменный — предполагает выделение по одному внешнему электрону от каждого атома и соединение их в общую пару;
донорно-акцепторный — происходит, когда один атом (донор) выделяет два электрона, а второй атом (акцептор) принимает их на свою свободную орбиталь.
Независимо от механизма химическая связь между атомами сопровождается выделением энергии.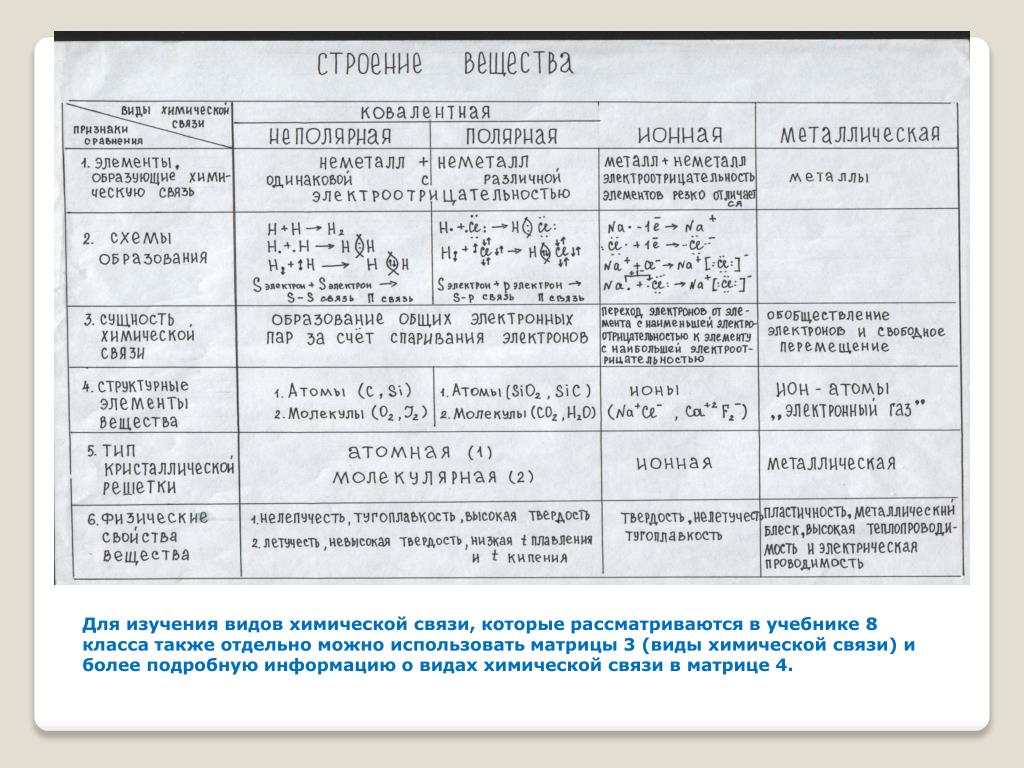 Чем выше ЭО атомов, т. е. их способность притягивать электроны, тем сильнее и этот энергетический всплеск.
Чем выше ЭО атомов, т. е. их способность притягивать электроны, тем сильнее и этот энергетический всплеск.
| Энергией связи называют ту энергию, которая выделяется при взаимодействии атомов. Она определяет прочность химической связи и по величине равна усилию, необходимому для ее разрыва. |
Также на прочность влияют следующие показатели:
Длина связи — расстояние между ядрами атомов. С уменьшением этого расстояния растет энергия связи и увеличивается ее прочность.
Кратность связи — количество электронных пар, появившихся при взаимодействии атомов. Чем больше это число, тем выше энергия и, соответственно, прочность связи.
На примере химической связи в молекуле водорода посмотрим, как меняется энергия системы при сокращении расстояния между ядрами атомов. По мере сближения ядер электронные орбитали этих атомов начинают перекрывать друг друга, в итоге появляется общая молекулярная орбиталь. Неспаренные электроны через области перекрывания смещаются от одного атома в сторону другого, возникают общие электронные пары. Все это сопровождается нарастающим выделением энергии. Сближение происходит до тех пор, пока силу притяжения не компенсирует сила отталкивания одноименных зарядов.
Неспаренные электроны через области перекрывания смещаются от одного атома в сторону другого, возникают общие электронные пары. Все это сопровождается нарастающим выделением энергии. Сближение происходит до тех пор, пока силу притяжения не компенсирует сила отталкивания одноименных зарядов.
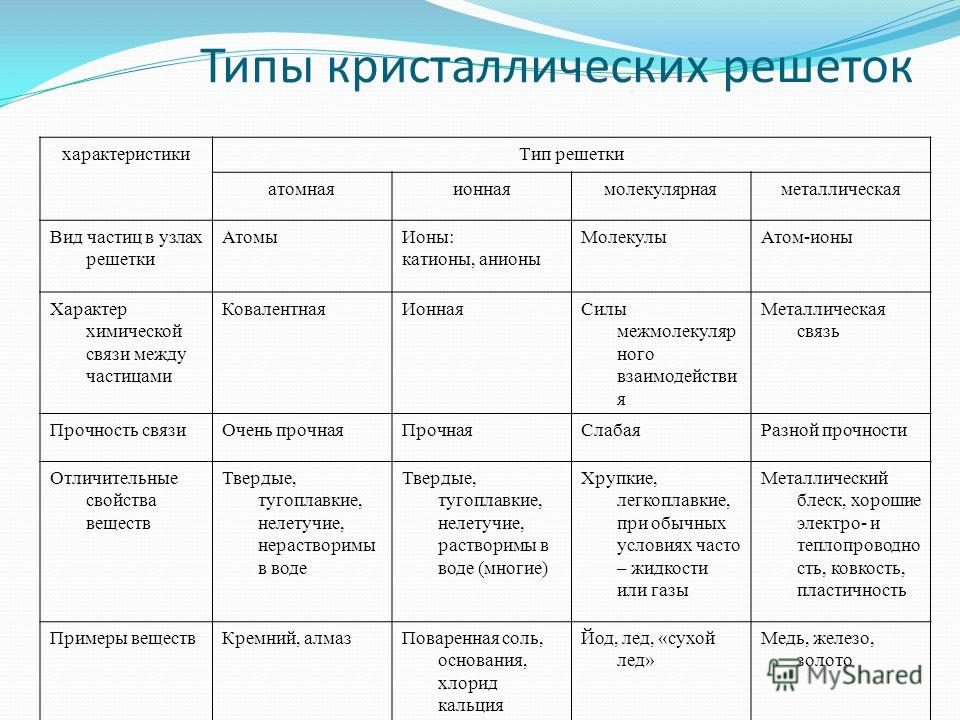
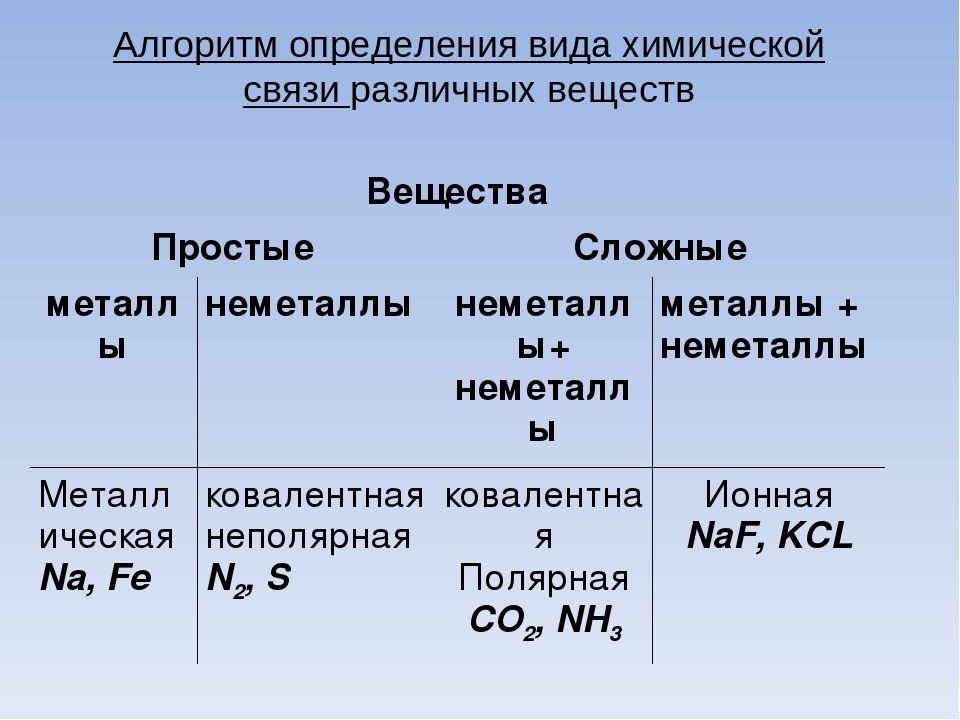
Основные типы химических связей
Различают четыре вида связей в химии: ковалентную, ионную, металлическую и водородную. Но в чистом виде они встречаются редко, обычно имеет место наложение нескольких типов химических связей. Например, в молекуле фосфата аммония (NH 4)3PO4присутствует одновременно ионная связь между ионами и ковалентная связь внутри ионов.
Также отметим, что при образовании кристалла от типа связи между частицами зависит, какой будет кристаллическая решетка. Если это ковалентная связь — образуется атомная решетка, если водородная — молекулярная решетка, а если ионная или металлическая — соответственно, будет ионная или металлическая решетка.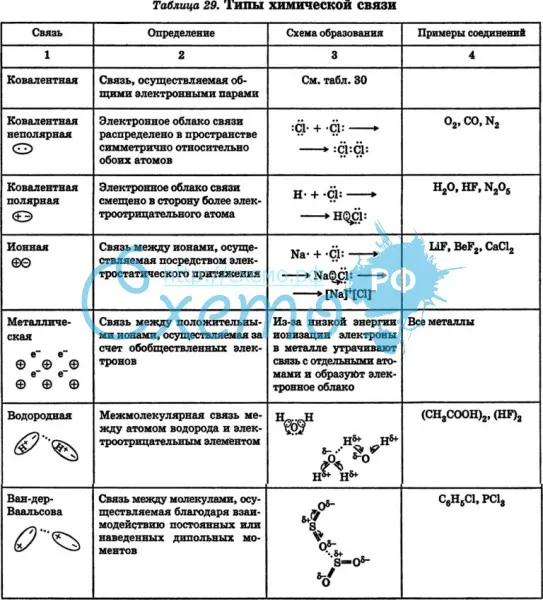 Таком образом, влияя на тип кристаллической решетки, химическая связь определяет и физические свойства вещества: твердость, летучесть, температуру плавления и т. д.
Таком образом, влияя на тип кристаллической решетки, химическая связь определяет и физические свойства вещества: твердость, летучесть, температуру плавления и т. д.
Основные характеристики химической связи:
насыщенность — ограничение по количеству образуемых связей из-за конечного числа неспаренных электронов;
полярность — неравномерная электронная плотность между атомами и смещение общей пары электронов к одному из них;
направленность — ориентация связи в пространстве, расположение орбиталей атомов под определенным углом друг к другу.
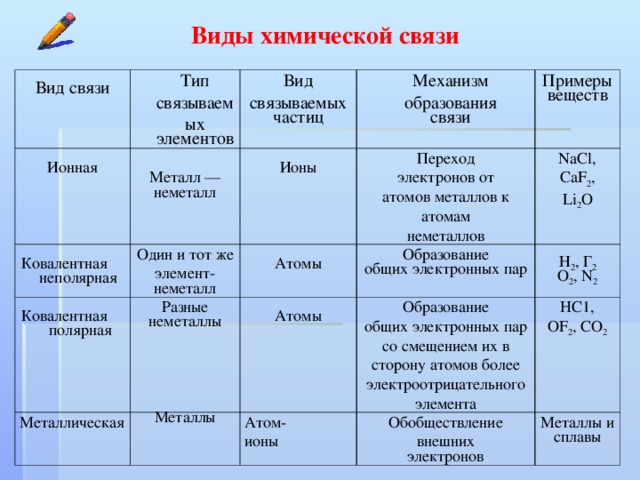
Ковалентная связь
Как уже говорилось выше, этот тип связи имеет два механизма образования: обменный и донорно-акцепторный. При обменном механизме объединяются в пару свободные электроны двух атомов, а при донорно-акцепторном — пара электронов одного из атомов смещается к другому на его свободную орбиталь.
Ковалентная связь — это процесс взаимодействия между атомами с одинаковыми или близкими радиусами, при котором возникает общая электронная пара.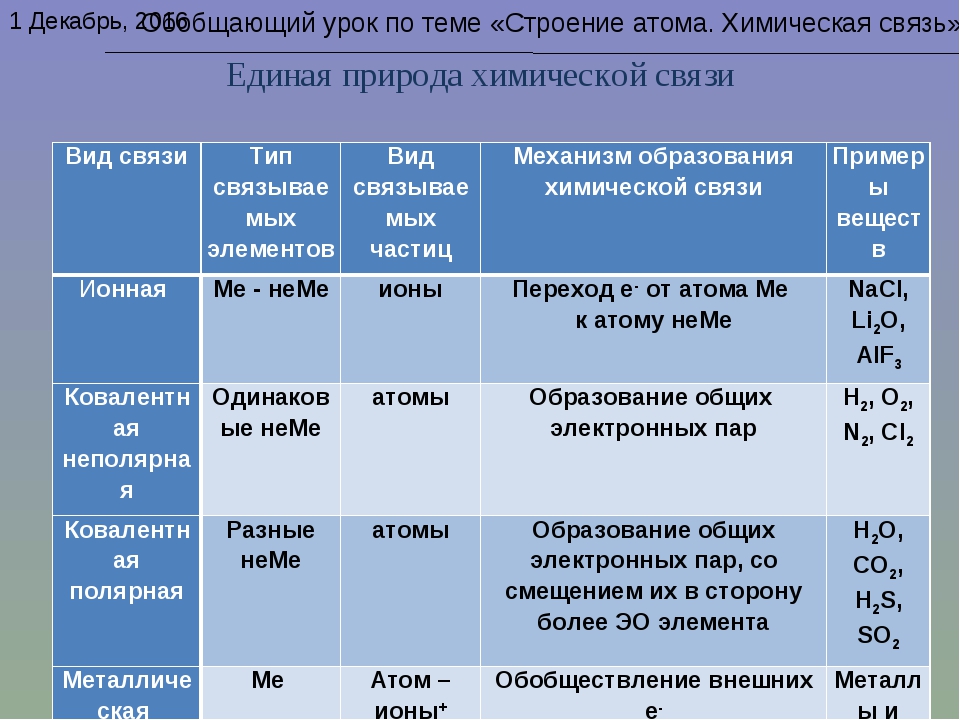 Если эта пара принадлежит в равной мере обоим взаимодействующим атомам — это неполярная связь, а если она смещается к одному из них — это полярная связь. Если эта пара принадлежит в равной мере обоим взаимодействующим атомам — это неполярная связь, а если она смещается к одному из них — это полярная связь. |
Как вы помните, сила притяжения электронов определяется электроотрицательностью атома. Если у двух атомов она одинакова, между ними будет неполярная связь, а если один из атомов имеет большую ЭО — к нему сместится общая электронная пара и получится полярная химическая связь.
Важно!
В зависимости от того, сколько получилось электронных пар, химические связи могут быть одинарными, двойными или тройными.
Ковалентная неполярная связь образуется в молекулах простых веществ, неметаллов с одинаковой ЭО: Cl2, O2, N2, F2 и других.
Посмотрим на схему образования этой химической связи. У атомов водорода есть по одному внешнему электрону, которые и образуют общую пару.
Ковалентная полярная связь характерна для неметаллов с разным уровнем ЭО: HCl, NH
Посмотрим схему такой связи в молекуле хлороводорода. У водорода имеется один свободный электрон, а у хлора — семь. Таким образом, всего есть два неспаренных электрона, которые соединяются в общую пару. Поскольку в данном случае ЭО выше у хлора, эта пара смещается к нему.
Другой пример — молекула сероводорода H2S. В данном случае мы видим, что каждый атом водорода имеет по одной химической связи, в то время как атом серы — две. Количество связей определяет валентность атома в конкретном соединении, поэтому валентность серы в сероводороде — II.
Число связей, которые могут быть у атома в молекуле вещества, называется валентностью. |
Характеристики ковалентной связи:
- насыщена,
- направлена,
- имеет полярность.
Ионная связь
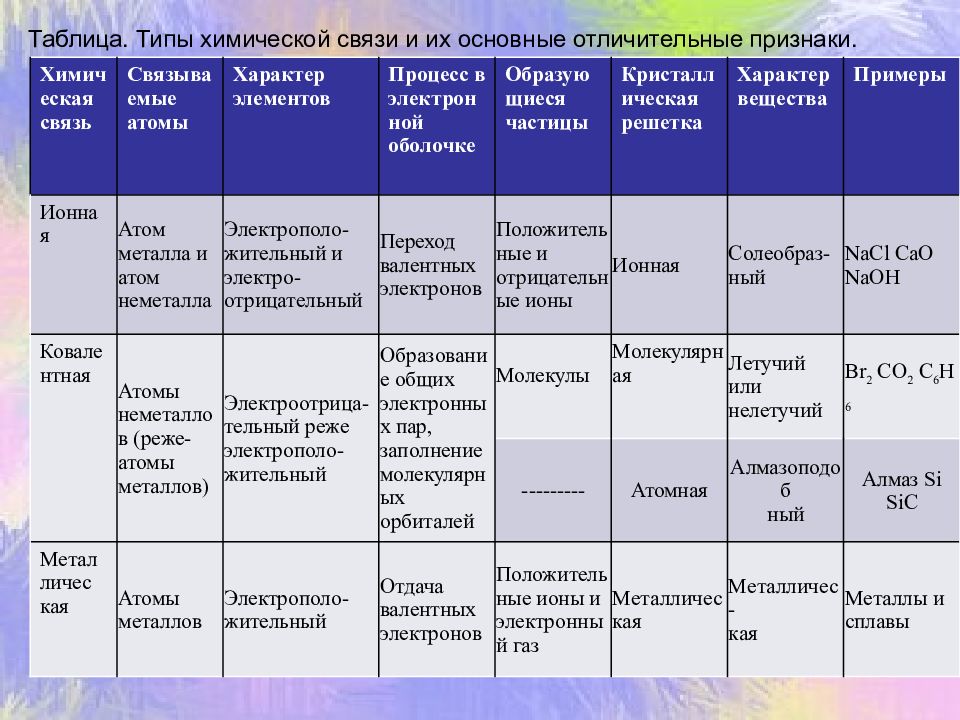
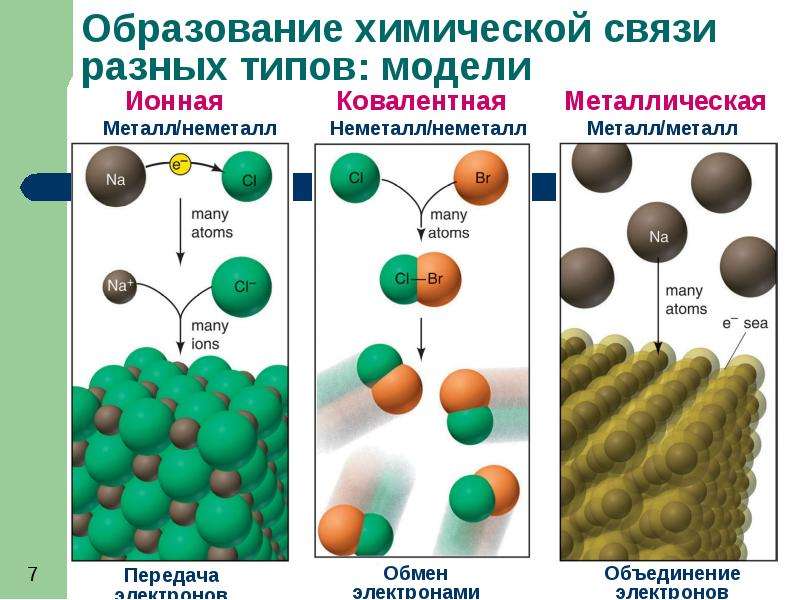
Как понятно из названия, данный тип связи основан на взаимном притяжении ионов с противоположными зарядами. Он возможен между веществами с большой разницей ЭО — металлом и неметаллом. Механизм таков: один из атомов отдает свои электроны другому атому и заряжается положительно. Второй атом принимает электроны на свободную орбиталь и получает отрицательный заряд. В результате этого процесса образуются ионы.
| Ионная связь — это такое взаимодействие между атомами в молекуле вещества, итогом которого становится образование и взаимное притяжение ионов. |
Разноименно заряженные ионы стремятся друг к другу за счет кулоновского притяжения, которое одинаково направлено во все стороны. Благодаря этому притяжению образуются ионные кристаллы, в решетке которых заряды ионов чередуются. У каждого иона есть определенное количество ближайших соседей — оно называется 
Обычно ионная связь появляется между атомами металла и неметалла в таких соединениях, как NaF, CaCl2, BaO, NaCl, MgF2, RbI и других. Ниже схема ионной связи в молекуле хлорида натрия.
Важно!
Все соли образованы с помощью ионных связей, поэтому в задачах, где нужно определить тип химической связи в веществах, в качестве подсказки можно использовать таблицу растворимости.
Характеристики ионной связи:
Ковалентная и ионная связь в целом похожи, и одну из них можно рассматривать, как крайнее выражение другой. Но все же между ними есть существенная разница. Сравним эти виды химических связей в таблице.
Ковалентная связь |
Ионная связь |
|---|---|
Характеризуется появлением электронных пар, принадлежащих обоим атомам. |
Характеризуется появлением и взаимным притяжением ионов. |
Общая пара электронов испытывает притяжение со стороны обоих ядер атомов. |
Ионы с противоположными зарядами подвержены кулоновскому притяжению. |
Имеет направленность и насыщенность. |
Ненасыщенна и не имеет направленности. |
Количество связей, образуемых атомом, называется валентностью. |
Количество ближайших соседей атома называется координационным числом. |
Образуется между неметаллами с одинаковой или не сильно отличающейся ЭО. |
Образуется между металлами и неметаллами — веществами со значимо разной ЭО. |
Металлическая связь
Отличительная особенность металлов в том, что их атомы имеют достаточно большие радиусы и легко отдают свои внешние электроны, превращаясь в положительно заряженные ионы (катионы).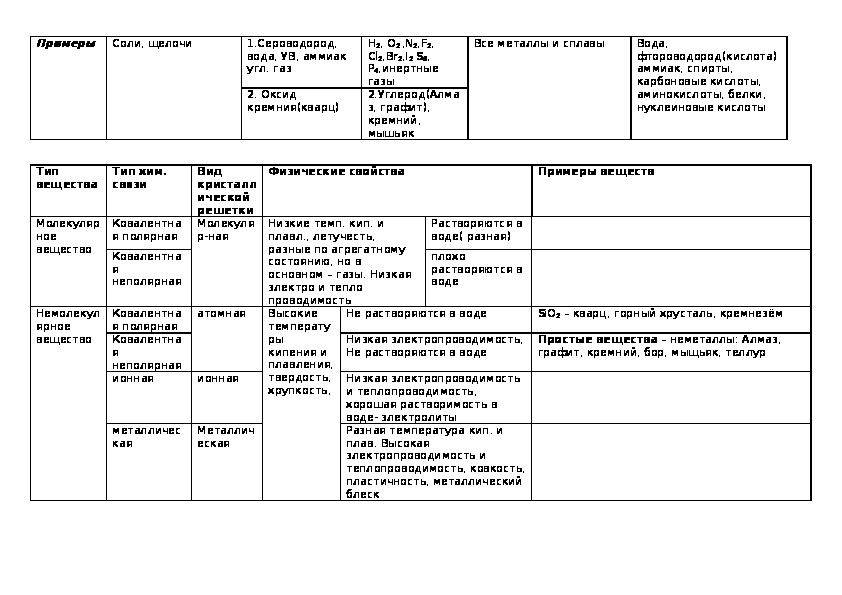 В итоге получается кристаллическая решетка, в узлах которой находятся ионы, а вокруг беспорядочно перемещаются электроны проводимости, образуя «электронное облако» или «электронный газ».
В итоге получается кристаллическая решетка, в узлах которой находятся ионы, а вокруг беспорядочно перемещаются электроны проводимости, образуя «электронное облако» или «электронный газ».
Свободные электроны мигрируют от одного иона к другому, временно соединяясь с ними и снова отрываясь в свободное плавание. Этот механизм по своей природе имеет сходство с ковалентной связью, но взаимодействие происходит не между отдельными атомами, а в веществе.
| Металлическая связь — это взаимодействие положительных ионов металлов и отрицательно заряженных электронов, которые являются частью «электронного облака», рассеянного по всему объему вещества. |
Наличие такого «электронного облака», которое может прийти в направленное движение, обусловливает электропроводность металлов. Другие их качества — пластичность и ковкость, объясняются тем, что ионы в кристаллической решетке легко смещаются. Поэтому металл при ударном воздействии способен растягиваться, но не разрушаться.
Характеристики металлической связи:
ненаправленность,
делокализованный характер,
многоэлектронность.
Металлическая связь присуща как простым веществам — таким как Na, Ba, Ag, Cu, так и сложным сплавам — например, AlCr2, CuAl11Fe4, Ca2Cu и другим.
Схема металлической связи:
M — металл,
n — число свободных внешних электронов.
К примеру, у железа в чистом виде на внешнем уровне есть два электрона, поэтому его схема металлической связи выглядит так:
Обобщим все полученные знания. Таблица ниже описывает кратко химические связи и строение вещества.
1.
|
Элементы, которые не образуют химических связей
Сложность: лёгкое |
1 |
| 2. |
Вещества с ионной связью
Сложность: лёгкое |
1 |
3.
|
Вещества с ковалентной связью
Сложность: лёгкое |
1 |
| 4. |
Вещества с металлической связью
Сложность: лёгкое |
1 |
|
5. |
Завершение внешнего электронного уровня
Сложность: среднее |
2 |
| 6. |
Основные понятия
Сложность: среднее |
2 |
7.
|
Выбери верные утверждения
Сложность: среднее |
3 |
| 8. |
Выбери вещества с определённым типом связи
Сложность: сложное |
4 |
9.
|
Заполнение внешнего электронного слоя
Сложность: сложное |
5 |
Химия 11 класс
Урок-семинар на тему «Виды химической связи, типы кристаллических решеток» — СТРОЕНИЕ ВЕЩЕСТВА — ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс — поурочные разработки — разработки уроков — авторские уроки — план-конспект урока — химия
Цели урока: обобщить, закрепить знание учащимися темы и умение применять их в решении упражнений.
Оборудование:
таблицы «Виды химической связи», «Типы кристаллических решеток»,
кристаллические решетки (модели): ионная, атомная, молекулярная;
кодотранспорант с вопросами теории и практики.
Ход урока
I. Организационный момент
Постановка целей и задач урока, организация учащихся на проведение семинара. Вопросы теории обсуждаются согласно их последовательности, используются конспекты, текст учебника, наглядные пособия.
II. Обсуждение вопросов теории и практики
Теоретическая часть
1. Понятия «химическая связь», «электроотрицательность».
2. Ионная связь. Определение. Примеры соединений. Механизм образования ионной связи. Тип кристаллической решетки, физические свойства веществ с ионной связью.
3. Ковалентная связь. Определение. Примеры соединений. Виды ковалентной связи. Механизмы образования ковалентной связи:
а) обменный;
б) донорно-акцепторный;
Типы кристаллических решеток, физические свойства веществ.
4. Металлическая связь. Определение. Пример. Механизмы образования. Тип кристаллической решетки. Физические свойства. Сходство и различия с ковалентной и ионной связью.
5.
Водородная связь.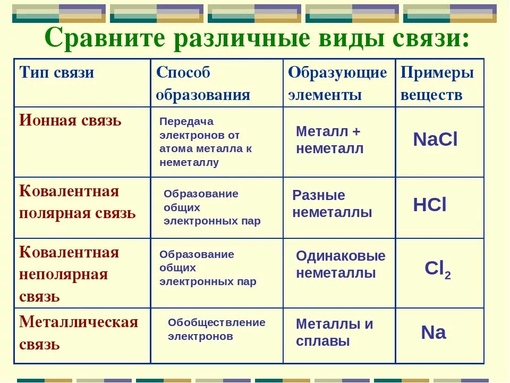 Определение. Примеры соединений. Механизмы образования
водородной связи. Тип кристаллической решетки. Физические свойства веществ.
Определение. Примеры соединений. Механизмы образования
водородной связи. Тип кристаллической решетки. Физические свойства веществ.
6. В чем заключается единство природы всех видов химической связи? На конкретных примерах объяснить переход одного вида связи в другой. Далее приступаем к обсуждению вопросов практики, которые непосредственно являются домашним заданием.
Практическая часть
1. Какие виды химической связи и типы кристаллических решеток характерны для соединений?
N2; Са; CaF2; F2; OF2; К2O2; Na2SO4.
2. Объяснить механизм образования связи в соединениях.
a) N2; б) Са; в) OF2; г) CaF2.
II. Самостоятельная работа
|
Вариант I |
Вариант II |
|
1. Дать
характеристику соединений по плану: вид связи, определение, механизм
образования связи, способ перекрывания орбиталей, тип кристаллической
решетки, физические свойства. |
|
|
а) NF3 б) MgCl2 |
a) H2S б) Сl2 |
|
2. Возникает ли в соединении водородная связь и какая именно? |
|
|
HF |
NH3 |
|
Почему они растворяются в воде? |
|
III. Подведение итогов урока
IV. Домашнее задание
Повторить: валентные состояния атома углерода в органических соединениях; гибридизация –sp3; -sp2: -sp, записи за 10 класс, учебник для 10 класса.
Ответы на вопросы теории предложены в планах-конспектах уроков № 1, 2, учебник § 6.
Ответы
Практическая часть
1. Ионная связь — CaF2; ионная кристаллическая решетка. Ковалентная неполярная связь — N2; F2; молекулярная кристаллическая решетка.
Ковалентная
полярная связь — OF2; молекулярная кристаллическая решетка.
Са — металлическая связь, металлическая решетка.
К2O2 — в соединении ионная связь и ковалентная неполярная; ионная кристаллическая решетка.
Na2SO4 — в соединении ионная связь; ковалентная полярная, в анионе SO42 — ионная кристаллическая решетка.
2. Механизм образования связи в соединениях:
a) N2 — ковалентная, неполярная связь.
+7; 1s22s22p3
— атом азота имеет пару спаренных электронов и три неспаренных по обменному механизму с другим атомом азота идет образование трех общих электронных пар, идет перекрывание р-орбиталей, одно осевое — σ-связь и два боковых перекрывания 2π-связи.
Кратность связи — 3.
Кристаллическая решетка — молекулярная.
б) Са — металл, металлическая связь, в кристалле присутствуют атомы-ионы, свободные электроны; за счет их взаимопритяжения осуществляется связь.
в)
OF2 — ковалентная полярная связь.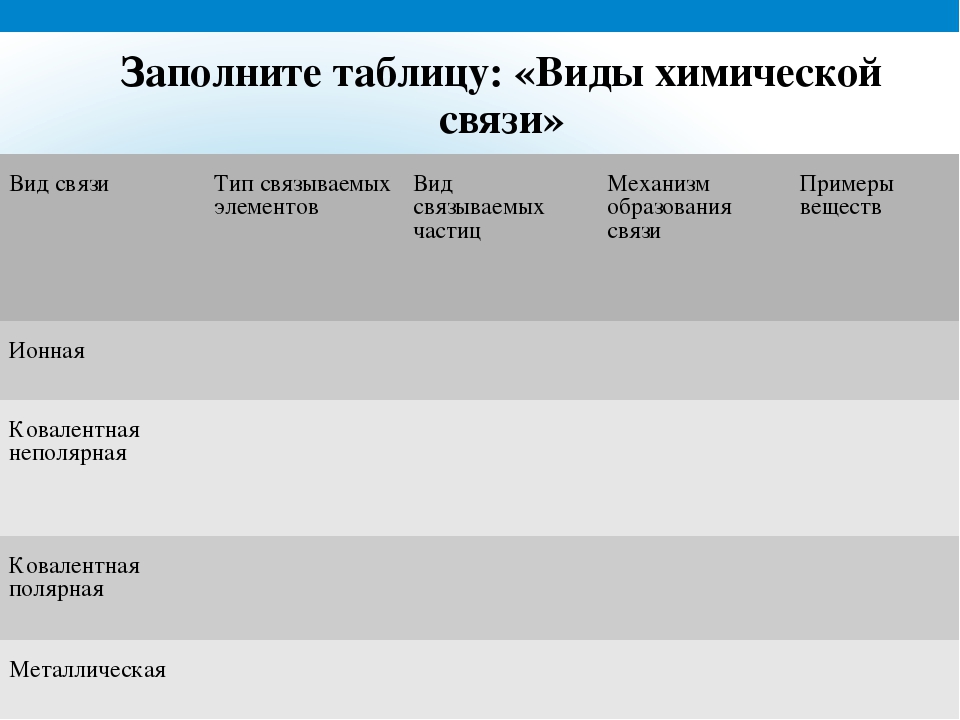
+8; 1s22s22p4
— атом кислорода имеет две пары спаренных электронов и 2p-неспаренных электрона.
-9; 1s22s22p5
— атом фтора имеет три пары спаренных электронов и 1 р-неспаренный электрон.
Между атомом кислорода и двумя атомами фтора образуются общие электронные пары по обменному механизму, т. к. ЭО фтора больше ЭО кислорода, общие электронные пары смещены в сторону атомов фтора.
г) CaF2 — ионная связь соединения образована элементами, резко отличающиеся в ЭО.
|
Са — металл |
F — неметалл |
|
Са 4s2 |
F +8; 2s22p5 |
|
отдает 2е— атомам фтора |
|
|
приобретает заряд +2 |
атом фтора
принимает один электрон, приобретает заряд -1. |
Взаимопритяжение противоположно заряженных частиц приводит к образованию соединения с ионной связью.
Самостоятельная работа
Вариант I
1. a) NF3 — ковалентная полярная связь. Связь посредством общих электронных пар, образованных по обменному механизму
|
N +7; 1s22s22р3 |
F +9; 1s22s22p5 |
|
три неспаренных р-электрона |
один неспаренный p-электрон, необходимо три атома фтора |
Перекрывание орбиталей осевое, образуются σ-связи; кратность связи между атомами — 1.
Кристаллическая решетка молекулярная, возможно, что это газ, легко переходящий в жидкость.
б)
MgCl2 — ионная связь, связь за счет электростатического
притяжения противоположно заряженных частиц. Соединение образовано металлом и
неметаллом, которые резко отличаются в ЭО.
Соединение образовано металлом и
неметаллом, которые резко отличаются в ЭО.
Взаимопритяжение противоположно заряженных частиц приводит к образованию соединения с ионной связью:
Ионная кристаллическая решетка, вещество твердое, тугоплавкое.
2. HF — соединения с полярной ковалентной связью в молекуле есть смещение общей электронной пары к ЭО атому фтора и возникает полюсность. δ+ — у атома водорода и δ- — у атома фтора, фтор также имеет неподеленные пары электронов Между молекулами возможно образование водородной связи.
Так как в молекуле воды также наблюдается смещение общих элек тронных пар к ЭО атома О — кислороду, который также имеет неподеленные пары электронов. В молекуле у атомов водорода возникает недостаток электронной плотности δ+, у атома кислорода — избыток δ-.
Между
молекулами фтороводорода и воды возможно образование водородных связей,
фтороводород растворим в воде.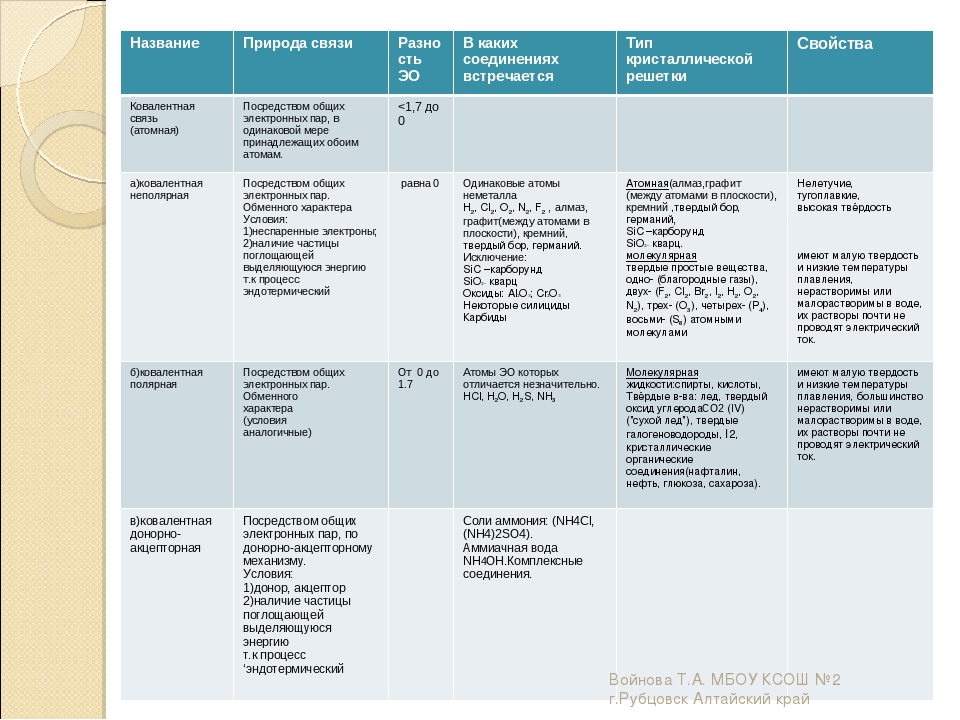
Вариант II
1. a) H2S — ковалентная полярная связь, связь посредством общих электронных пар, образованных по обменному механизму.
|
один неспаренный s-электрон |
на третьем энергетическом уровне две пары спаренных электронов и 2р-неспаренных электрона |
Идет перекрывание s-орбиталей атомов водородов и p-орбиталей атома серы, перекрывание осевое, образуется σ-связь, смешенная в сторону ЭО атома серы, кратность связи — 1; кристаллическая решетка молекулярная.
б) Сl2 — ковалентная неполярная связь, связь посредством обшей электронной пары, образованной по обменному механизму.
В атоме три пары спаренных электрона и один р-электрон, не спаренный. Происходит перекрывание p-орбиталей, осевое, возникает σ-связь.
Кратность
связи — 1. Кристаллическая решетка молекулярная.
2. NH3 — соединение с полярной ковалентной связью, в молекуле есть смещение общих электронных пар к ЭО атому азота, у которого есть неподеленная пара электрона, возникает полюсность: δ+ — у атомов водорода, δ- — у атома азота.
Между молекулами возможно возникновение водородных связей.
Так как в молекуле воды также наблюдается смешение общих электронных пар к ЭО атому — кислороду, который также имеет неподеленные пары электронов. В молекуле Н2O у атомов водорода возникает недостаток электронной плотности δ+. у атома кислорода — избыток δ+. Между молекулами NH3 и Н2O возможно образование водородных связей. NH3 растворим в воде.
Химическая связь строение вещества таблица. Металлическая и водородная химические связи
«Свойства химической связи» — Металлическая кристаллическая решётка. Диполь. Типы химической связи.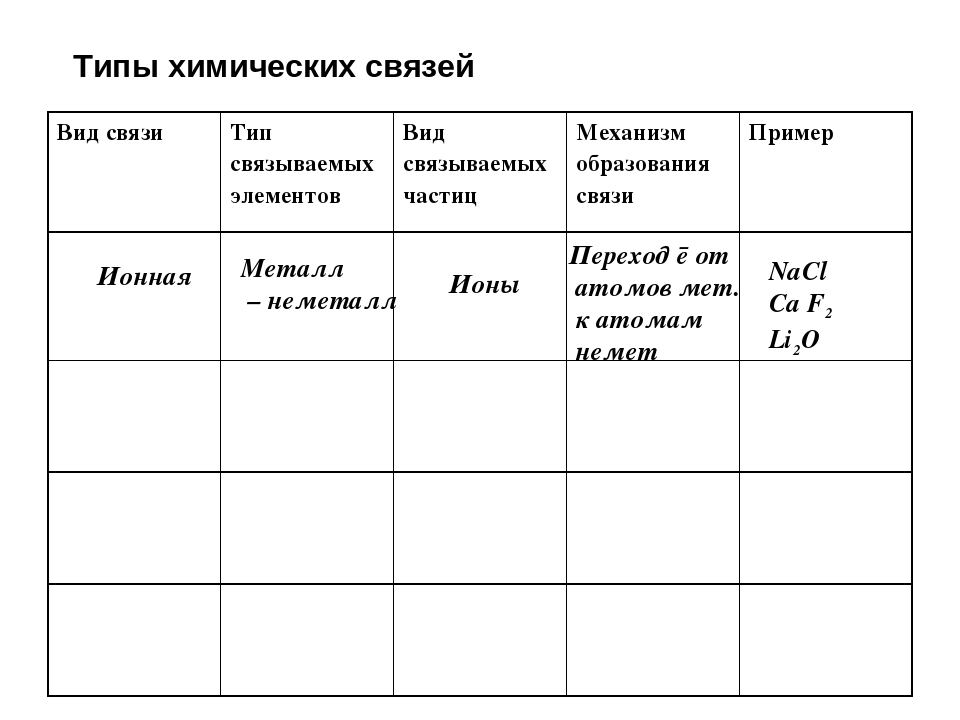 Длина связи. Основные виды связей. Водородная связь. Возбуждённое состояние атома. Характеристики связи. Силы. Электронные конфигурации. Ионная кристаллическая решётка. Ковалентная связь. Атомная кристаллическая решётка. Основы химии.
Длина связи. Основные виды связей. Водородная связь. Возбуждённое состояние атома. Характеристики связи. Силы. Электронные конфигурации. Ионная кристаллическая решётка. Ковалентная связь. Атомная кристаллическая решётка. Основы химии.
«Металлическая химическая связь» — Теплопроводность – объясняется высокой подвижность. Изделия из золота. Высокой отражательной способностью обладают ртуть, серебро, палладий, алюминий. У металлической связи общее с: Ионной – образование ионов. Наиболее пластичны золото, медь, серебро. Металлическая химическая связь. Лучшие проводники медь и серебро.
«Степени окисления соединений» — Названия бинарных соединений. Определить степени окисления элементов в соединениях. Составить формулы бинарных соединений. Степени окисления элементов. Положительная степень окисления. Бинарное соединение. Элемент. Оксид железа. Составить формулы веществ. Возможные отрицательные степени окисления. Степень окисления.
«Типы химических связей» — Вещества легкоплавки, часто имеют запах.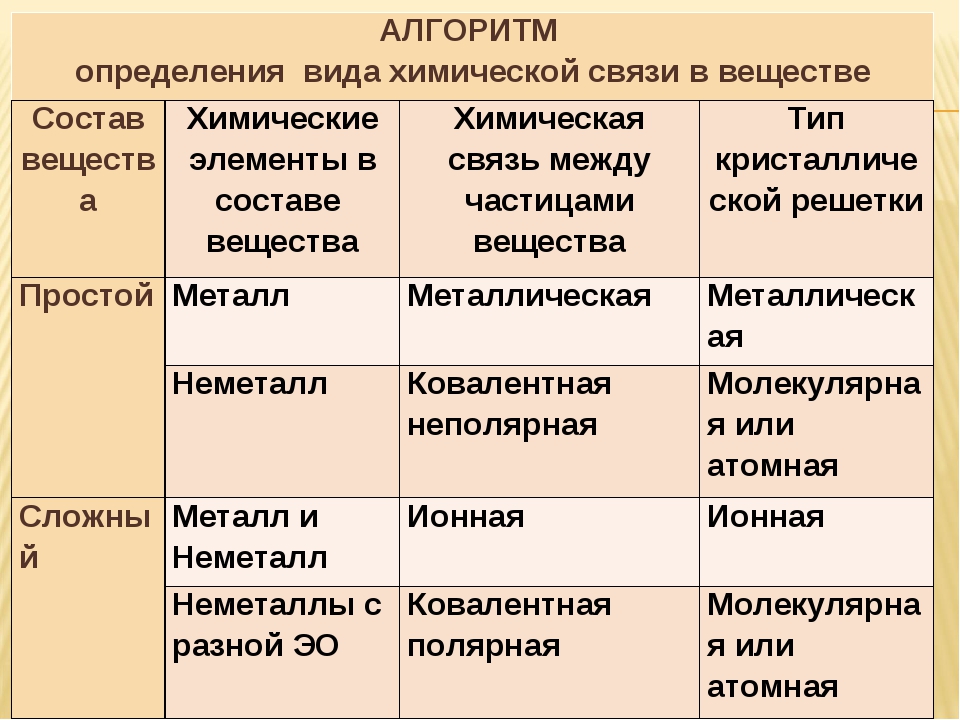 Атомный каркас обладает высокой прочностью. Металлическая связь. Ионная связь. Ковалентная полярная связь образуется между атомами различных неметаллов. ИОННАЯ СВЯЗЬ, образуемая в результате электростатического притяжения. Атомы. Удерживаются слабыми межмолекулярными силами.
Атомный каркас обладает высокой прочностью. Металлическая связь. Ионная связь. Ковалентная полярная связь образуется между атомами различных неметаллов. ИОННАЯ СВЯЗЬ, образуемая в результате электростатического притяжения. Атомы. Удерживаются слабыми межмолекулярными силами.
«Химия «Химическая связь»» — Резких границ между разными видами химических связей нет. Число общих электронных пар равно числу связей между двумя атомами. Вещества с ковалентной связью. Параметры ковалентной связи. Виды химической связи и типы кристаллических решеток. Ковалентная связь. Металлы образуют металлические кристаллические решетки.
«Основные типы химической связи» — Механизмы разрыва ковалентной связи. Координация. Полярность связи. Металлическая связь. Связи. Насыщаемость. Направленность. Механизмы образования ковалентной связи. Взаимодействие атомов в химических соединениях. Ионная химическая связь. Образование ионной химической связи. Химическая связь. Na+Cl.
Всего в теме 23 презентации
На уроке будут рассмотрены несколько типов химической связи: металлическая, водородная и Ван-дер-Ваальсовая, а также вы узнаете, как зависят физические и химические свойства от разных типов химических связей в веществе.
Тема: Типы химической связи
Урок: Металлическая и водородная химические связи
1. Металлическая связьМеталлическая связь — это тип связи в металлах и их сплавах между атомами или ионами металлов и относительно свободными электронами (электронным газом) в кристаллической решетке.
Металлы — это химические элементы с низкой электроотрицательностью, поэтому они легко отдают свои валентные электроны. Если рядом с элементом металлом находится неметалл, то электроны от атома металла переходят к неметаллу. Такой тип связи называется ионный (рис. 1).
Рис. 1. Образование ионной связи
В случае простых веществ металлов или их сплавов, ситуация меняется.
При образовании молекул электронные орбитали металлов не остаются неизменными. Они взаимодействуют между собой, образуя новую молекулярную орбиталь. В зависимости от состава и строения соединения, молекулярные орбитали могут быть как близки к совокупности атомных орбиталей, так и значительно от них отличаться. При взаимодействии электронных орбиталей атомов металла образуются молекулярные орбитали. Такие, что валентные электроны атома металла, могут свободно перемещаться по этим молекулярным орбиталям. Не происходит полное разделение, заряда, т. е. металл
— это не совокупность катионов и плавающих вокруг электронов. Но это и не совокупность атомов, которые иногда переходят в катионную форму и передают свой электрон другому катиону. Реальная ситуация — это совокупность двух этих крайних вариантов.
При взаимодействии электронных орбиталей атомов металла образуются молекулярные орбитали. Такие, что валентные электроны атома металла, могут свободно перемещаться по этим молекулярным орбиталям. Не происходит полное разделение, заряда, т. е. металл
— это не совокупность катионов и плавающих вокруг электронов. Но это и не совокупность атомов, которые иногда переходят в катионную форму и передают свой электрон другому катиону. Реальная ситуация — это совокупность двух этих крайних вариантов.
Сущность образования металлической связи состоит в следующем: атомы металлов отдают наружные электроны, и некоторые из них превращаются в положительно заряженные ионы. Оторвавшиеся от атомов электроны относительно свободно перемещаются между возникшими положительными ионами металлов. Между этими частицами возникает металлическая связь, т. е. электроны как бы цементируют положительные ионы в металлической решетке (рис. 2).
2. Физические свойства металловНаличие металлической связи обуславливает физические свойства металлов:
· Высокая пластичность
· Тепло и электропроводность
· Металлический блеск
Пластичность
— это способность материала легко деформироваться под действием механической нагрузки.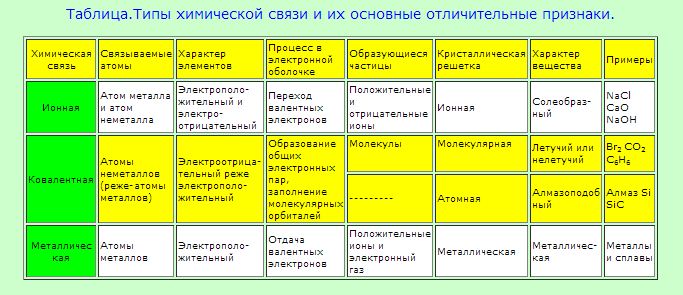 Металлическая связь реализуется между всеми атомами металла одновременно, поэтому при механическом воздействии на металл не разрываются конкретные связи, а только меняется положение атома. Атомы металла, не связанные жесткими связями между собой, могут как бы скользить по слою электронного газа, как это происходит при скольжении одного стекла по другому с прослойкой воды между ними. Благодаря этому металлы можно легко деформировать или раскатывать в тонкую фольгу. Наиболее пластичные металлы — чистое золото, серебро и медь. Все эти металлы встречаются в природе в самородном виде в той или иной степени чистоты. Рис. 3.
Металлическая связь реализуется между всеми атомами металла одновременно, поэтому при механическом воздействии на металл не разрываются конкретные связи, а только меняется положение атома. Атомы металла, не связанные жесткими связями между собой, могут как бы скользить по слою электронного газа, как это происходит при скольжении одного стекла по другому с прослойкой воды между ними. Благодаря этому металлы можно легко деформировать или раскатывать в тонкую фольгу. Наиболее пластичные металлы — чистое золото, серебро и медь. Все эти металлы встречаются в природе в самородном виде в той или иной степени чистоты. Рис. 3.
Рис. 3. Металлы, встречающиеся в природе в самородном виде
Из них, особенно из золота, изготавливаются различные украшения. Благодаря своей удивительной пластичности, золото применяется при отделке дворцов. Из него можно раскатать фольгу толщиной всего 3.10-3 мм. Она называется сусальное золото, наносится на гипсовые, лепные украшения или другие предметы.
Тепло — и электропроводность . Лучше всего электрический ток проводят медь, серебро, золото и алюминий. Но так как золото и серебро — дорогие металлы, то для изготовления кабелей используются более дешевые медь и алюминий. Самыми плохими электрическими проводниками являются марганец, свинец, ртуть и вольфрам. У вольфрама электрическое сопротивление столь велико, что при прохождении электрического тока он начинает светиться. Это свойство используется при изготовлении ламп накаливания.
Температура тела — это мера энергии составляющих его атомов или молекул. Электронный газ металла может довольно быстро передавать избыточную энергию с одного иона или атома к другому. Температура металла быстро выравнивается по всему объёму, даже если нагревание идет с одной стороны. Это наблюдается, например, если опустить металлическую ложку в чай.
Металлический блеск.
Блеск — это способность тела отражать световые лучи. Высокой световой отражательной способностью обладают серебро, алюминий и палладий. Поэтому именно эти металлы наносят тонким слоем на поверхность стекла при изготовлении фар, прожекторов и зеркал.
Поэтому именно эти металлы наносят тонким слоем на поверхность стекла при изготовлении фар, прожекторов и зеркал.
Водородная связь
Рассмотрим температуры кипения и плавления водородных соединений халькогенов: кислорода, серы, селена и теллура. Рис. 4.
Если мысленно экстраполировать прямые температур кипения и плавления водородных соединений серы, селена и теллура, то мы увидим, что температура плавления воды должна примерно составлять -1000С, а кипения — примерно -800С. Происходит это потому, что между молекулами воды существует взаимодействие — водородная связь, которая объединяет молекулы воды в ассоциацию . Для разрушения этих ассоциатов требуется дополнительная энергия.
3. Механизм образования водородной связиВодородная связь образуется между сильно поляризованным, обладающим значительной долей положительного заряда атомом водорода и другим атомом с очень высокой электроотрицательностью: фтором, кислородом или азотом
. Примеры веществ, способных образовывать водородную связь, приведены на рис. 5.
Примеры веществ, способных образовывать водородную связь, приведены на рис. 5.
Рассмотрим образование водородных связей между молекулами воды. Водородная связь изображается тремя точками. Возникновение водородной связи обусловлено уникальной особенностью атома водорода. Т. к. атом водорода содержит только один электрон, то при оттягивании общей электронной пары другим атомом, оголяется ядро атома водорода, положительный заряд которого действует на электроотрицательные элементы в молекулах веществ.
Сравним свойства этилового спирта и диметилового эфира . Исходя из строения этих веществ, следует, что этиловый спирт может образовывать межмолекулярные водородные связи. Это обусловлено наличием гидроксогруппы. Диметиловый эфир межмолекулярных водородных связей образовывать не может.
Сопоставим их свойства в таблице 1.
Т кип., Т пл, растворимость в воде выше у этилового спирта. Это общая закономерность для веществ, между молекулами которых образуется водородная связь. Эти вещества характеризуются более высокой Т кип.,Т пл, растворимостью в воде и более низкой летучестью.
Эти вещества характеризуются более высокой Т кип.,Т пл, растворимостью в воде и более низкой летучестью.
Физические свойства соединений зависят также и от молекулярной массы вещества. Поэтому проводить сравнение физических свойств веществ с водородными связями, правомерно только для веществ с близкими молекулярными массами.
Энергия одной водородной связи примерно в 10 раз меньше энергии ковалентной связи. Если в органических молекулах сложного состава имеется несколько функциональных групп, способных к образованию водородной связи, то в них могут образовываться внутримолекулярные водородные связи (белки, ДНК, аминокислоты, ортонитрофенол и др.). За счет водородной связи образуется вторичная структура белков, двойная спираль ДНК.
4. Ван-дер-Ваальсовые силыВан-дер-Ваальсовая связь.
Вспомним благородные газы. Соединения гелия до сих пор не получены. Он не способен образовывать обычные химические связи.
При сильно отрицательных температурах можно получить жидкий и даже твердый гелий. В жидком состоянии атомы гелия удерживаются при помощи сил электростатического притяжения. Существует три варианта этих сил:
В жидком состоянии атомы гелия удерживаются при помощи сил электростатического притяжения. Существует три варианта этих сил:
· ориентационные силы. Это взаимодействие между двумя диполями (НСl)
· индукционное притяжение. Это притяжение диполя и неполярной молекулы.
· дисперсионное притяжение. Это взаимодействие между двумя неполярными молекулами (He). Возникает за счет неравномерности движения электронов вокруг ядра.
Подведение итога урока
На уроке рассмотрены три типа химической связи: металлическая, водородная и Ван-дер-Ваальсовая. Объяснялась зависимость физических и химических свойств от разных типов химических связей в веществе.
Список литературы
1. Рудзитис Г. Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. — 14-е изд. — М.: Просвещение, 2012.
2. Попель П. П. Химия: 8 кл.: учебник для общеобразовательных учебных заведений / П. П. Попель, Л. С.Кривля. — К.: ИЦ «Академия», 2008. — 240 с.: ил.
П. Попель, Л. С.Кривля. — К.: ИЦ «Академия», 2008. — 240 с.: ил.
3. Габриелян О. С. Химия. 11 класс. Базовый уровень. 2-е изд., стер. — М.: Дрофа, 2007. — 220 с.
1. Internerurok. ru .
2. Hemi. nsu. ru .
3. Chemport. ru .
Домашнее задание
1. №№2, 4, 6 (с. 41) Рудзитис Г. Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. — 14-е изд. — М.: Просвещение, 2012.
2. Почему для изготовления волосков ламп накаливания используют вольфрам?
3. Чем объясняется отсутствие водородной связи в молекулах альдегидов?
Химические связи — Принципы биологии
Как элементы взаимодействуют друг с другом, зависит от того, как расположены их электроны и сколько отверстий для электронов существует во внешней области, где электроны присутствуют в атоме. Электроны существуют на энергетических уровнях, которые образуют оболочки вокруг ядра. Ближайшая оболочка может вместить до двух электронов. Ближайшая к ядру оболочка всегда заполняется первой, прежде чем может быть заполнена любая другая оболочка. Водород имеет один электрон; следовательно, в самой нижней оболочке занято только одно место.Гелий имеет два электрона; следовательно, он может полностью заполнить нижнюю оболочку двумя своими электронами. Если вы посмотрите на таблицу Менделеева, вы увидите, что водород и гелий — единственные два элемента в первой строке. Это потому, что в их первой оболочке есть только электроны. Водород и гелий — единственные два элемента, которые имеют самую низкую оболочку и не имеют других оболочек.
Ближайшая к ядру оболочка всегда заполняется первой, прежде чем может быть заполнена любая другая оболочка. Водород имеет один электрон; следовательно, в самой нижней оболочке занято только одно место.Гелий имеет два электрона; следовательно, он может полностью заполнить нижнюю оболочку двумя своими электронами. Если вы посмотрите на таблицу Менделеева, вы увидите, что водород и гелий — единственные два элемента в первой строке. Это потому, что в их первой оболочке есть только электроны. Водород и гелий — единственные два элемента, которые имеют самую низкую оболочку и не имеют других оболочек.
Второй и третий энергетические уровни могут содержать до восьми электронов. Восемь электронов расположены в четырех парах, и одна позиция в каждой паре заполняется электроном до того, как любые пары будут сформированы.
Еще раз взглянув на таблицу Менделеева (рис. 1), вы заметите, что там семь строк. Эти строки соответствуют количеству оболочек, которые имеют элементы в этой строке. Элементы в определенной строке имеют увеличивающееся количество электронов по мере того, как столбцы перемещаются слева направо. Хотя у каждого элемента одинаковое количество оболочек, не все оболочки полностью заполнены электронами. Если вы посмотрите на вторую строку периодической таблицы, вы найдете литий (Li), бериллий (Be), бор (B), углерод (C), азот (N), кислород (O), фтор (F), и неон (Ne).Все они имеют электроны, которые занимают только первую и вторую оболочки. Литий имеет только один электрон во внешней оболочке, бериллий имеет два электрона, бор имеет три и так далее, пока вся оболочка не будет заполнена восемью электронами, как в случае с неоном.
Элементы в определенной строке имеют увеличивающееся количество электронов по мере того, как столбцы перемещаются слева направо. Хотя у каждого элемента одинаковое количество оболочек, не все оболочки полностью заполнены электронами. Если вы посмотрите на вторую строку периодической таблицы, вы найдете литий (Li), бериллий (Be), бор (B), углерод (C), азот (N), кислород (O), фтор (F), и неон (Ne).Все они имеют электроны, которые занимают только первую и вторую оболочки. Литий имеет только один электрон во внешней оболочке, бериллий имеет два электрона, бор имеет три и так далее, пока вся оболочка не будет заполнена восемью электронами, как в случае с неоном.
Не все элементы имеют достаточно электронов, чтобы заполнить свои внешние оболочки, но атом наиболее стабилен, когда все позиции электронов на внешней оболочке заполнены. Из-за этих вакансий во внешних оболочках мы видим образование химических связей или взаимодействия между двумя или более одинаковыми или разными элементами, которые приводят к образованию молекул.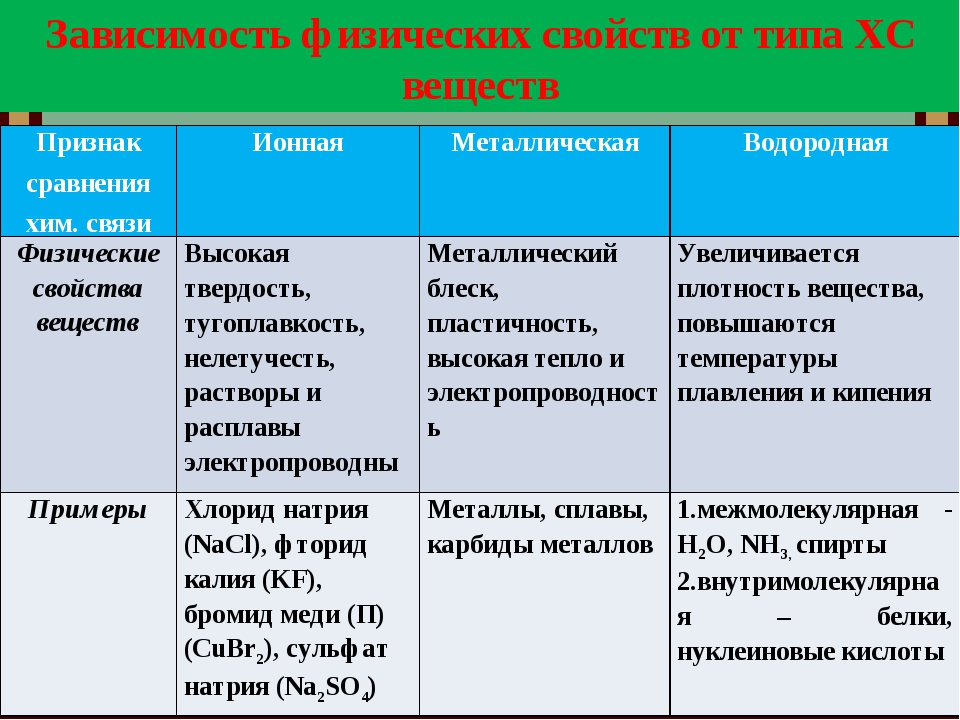 Чтобы достичь большей стабильности, атомы будут стремиться полностью заполнить свои внешние оболочки и будут связываться с другими элементами для достижения этой цели, разделяя электроны, принимая электроны от другого атома или отдавая электроны другому атому. Поскольку внешние оболочки элементов с низкими атомными номерами (вплоть до кальция с атомным номером 20) могут содержать восемь электронов, это называется правилом октетов. Элемент может отдавать, принимать или делиться электронами с другими элементами, чтобы заполнить свою внешнюю оболочку и удовлетворить правилу октетов.
Чтобы достичь большей стабильности, атомы будут стремиться полностью заполнить свои внешние оболочки и будут связываться с другими элементами для достижения этой цели, разделяя электроны, принимая электроны от другого атома или отдавая электроны другому атому. Поскольку внешние оболочки элементов с низкими атомными номерами (вплоть до кальция с атомным номером 20) могут содержать восемь электронов, это называется правилом октетов. Элемент может отдавать, принимать или делиться электронами с другими элементами, чтобы заполнить свою внешнюю оболочку и удовлетворить правилу октетов.
Когда атом не содержит равного количества протонов и электронов, он называется ионом . Поскольку количество электронов не равно количеству протонов, каждый ион имеет чистый заряд. Положительные ионы образуются при потере электронов и называются катионами. Отрицательные ионы образуются путем захвата электронов и называются анионами.
Например, у натрия только один электрон на внешней оболочке. Натрию требуется меньше энергии, чтобы отдать один электрон, чем принять еще семь электронов, чтобы заполнить внешнюю оболочку.Если натрий теряет электрон, у него теперь будет 11 протонов и только 10 электронов, а общий заряд останется +1. Теперь он называется ионом натрия.
Натрию требуется меньше энергии, чтобы отдать один электрон, чем принять еще семь электронов, чтобы заполнить внешнюю оболочку.Если натрий теряет электрон, у него теперь будет 11 протонов и только 10 электронов, а общий заряд останется +1. Теперь он называется ионом натрия.
У атома хлора семь электронов на внешней оболочке. Опять же, для хлора более энергоэффективно получить один электрон, чем потерять семь. Следовательно, он стремится получить электрон, чтобы создать ион с 17 протонами и 18 электронами, придавая ему чистый отрицательный (–1) заряд. Теперь он называется хлорид-ионом. Это движение электронов от одного элемента к другому называется переносом электронов.Как показано на рисунке 1, атом натрия (Na) имеет только один электрон в своей внешней оболочке, тогда как атом хлора (Cl) имеет семь электронов в своей внешней оболочке. Атом натрия отдаст свой один электрон, чтобы опустошить свою оболочку, а атом хлора примет этот электрон, чтобы заполнить свою оболочку, став хлоридом.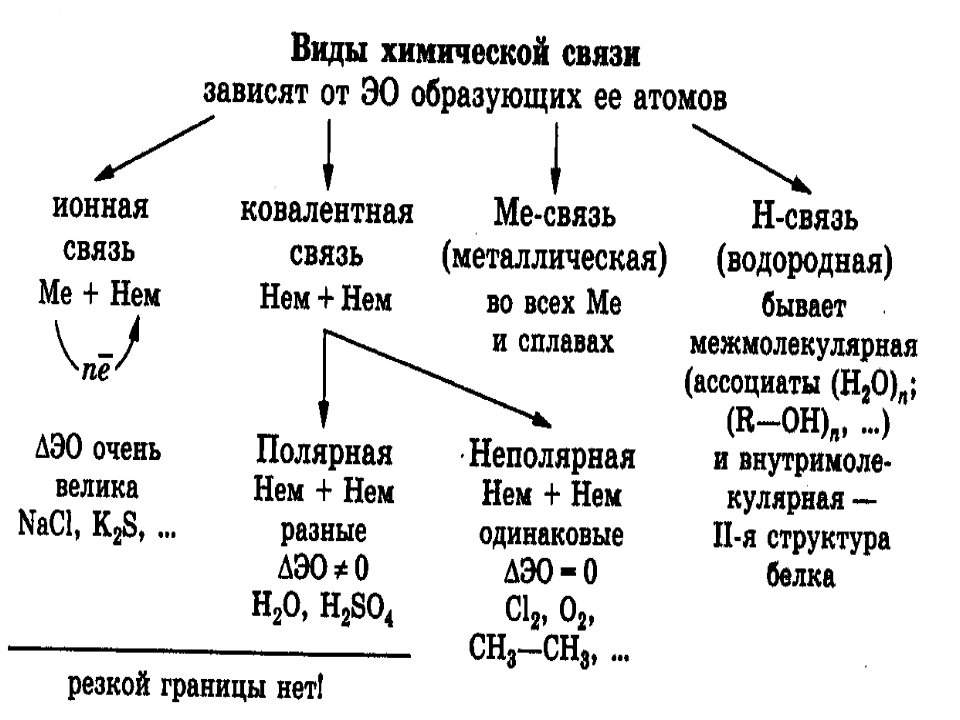 Оба иона теперь удовлетворяют правилу октетов и имеют полные внешние оболочки. Поскольку количество электронов больше не равно количеству протонов, каждый теперь является ионом и имеет заряд +1 (натрий) или –1 (хлорид).
Оба иона теперь удовлетворяют правилу октетов и имеют полные внешние оболочки. Поскольку количество электронов больше не равно количеству протонов, каждый теперь является ионом и имеет заряд +1 (натрий) или –1 (хлорид).
Ионные связи
Существует четыре типа связей или взаимодействий: ионные, ковалентные, водородные связи и ван-дер-ваальсовы взаимодействия. Ионные и ковалентные связи — это сильные взаимодействия, для разрыва которых требуется больше энергии. Когда элемент отдает электрон из своей внешней оболочки, как в примере с атомом натрия выше, образуется положительный ион (рис. 2).Элемент, принимающий электрон, теперь заряжен отрицательно. Поскольку положительные и отрицательные заряды притягиваются, эти ионы остаются вместе и образуют ионную связь , или связь между ионами. Элементы связываются вместе с электроном одного элемента, оставаясь преимущественно с другим элементом. Когда ионы Na + и Cl — объединяются, чтобы произвести NaCl, один электрон от атома натрия остается с другими семью от атома хлора, и ионы натрия и хлорида притягиваются друг к другу в решетке ионов с чистым нулем. обвинение.
Элементы связываются вместе с электроном одного элемента, оставаясь преимущественно с другим элементом. Когда ионы Na + и Cl — объединяются, чтобы произвести NaCl, один электрон от атома натрия остается с другими семью от атома хлора, и ионы натрия и хлорида притягиваются друг к другу в решетке ионов с чистым нулем. обвинение.
Ковалентные облигации
Другой тип прочной химической связи между двумя или более атомами — это ковалентная связь . Эти связи образуются, когда электрон разделяется между двумя элементами, и являются самой прочной и наиболее распространенной формой химической связи в живых организмах. Ковалентные связи образуются между элементами, из которых состоят биологические молекулы в наших клетках.В отличие от ионных связей ковалентные связи не диссоциируют в воде.
Интересно, что химики и биологи по-разному измеряют прочность связи. Химики измеряют абсолютную прочность связи (теоретическую прочность), в то время как биологов больше интересует, как эта связь ведет себя в биологической системе, которая обычно представляет собой водную (водную основу). В воде ионные связи распадаются гораздо легче, чем ковалентные связи, поэтому биологи сказали бы, что они слабее ковалентных связей.Если вы посмотрите в учебник химии, вы увидите нечто иное. Это отличный пример того, как одна и та же информация может привести к разным ответам в зависимости от точки зрения, с которой вы ее смотрите.
Химики измеряют абсолютную прочность связи (теоретическую прочность), в то время как биологов больше интересует, как эта связь ведет себя в биологической системе, которая обычно представляет собой водную (водную основу). В воде ионные связи распадаются гораздо легче, чем ковалентные связи, поэтому биологи сказали бы, что они слабее ковалентных связей.Если вы посмотрите в учебник химии, вы увидите нечто иное. Это отличный пример того, как одна и та же информация может привести к разным ответам в зависимости от точки зрения, с которой вы ее смотрите.
Атомы водорода и кислорода, которые объединяются в молекулы воды, связаны ковалентными связями. Электрон от атома водорода делит свое время между внешней оболочкой атома водорода и неполной внешней оболочкой атома кислорода. Чтобы полностью заполнить внешнюю оболочку атома кислорода, необходимы два электрона от двух атомов водорода, отсюда и индекс «2» в H 2 O.Электроны распределяются между атомами, разделяя свое время между ними, чтобы «заполнить» внешнюю оболочку каждого из них. Это совместное использование является более низким энергетическим состоянием для всех задействованных атомов, чем если бы они существовали без заполненных внешних оболочек.
Это совместное использование является более низким энергетическим состоянием для всех задействованных атомов, чем если бы они существовали без заполненных внешних оболочек.
Есть два типа ковалентных связей: полярные и неполярные. Неполярные ковалентные связи образуются между двумя атомами одного и того же элемента или между разными элементами, которые разделяют электроны в равной степени. Например, атом кислорода может связываться с другим атомом кислорода, чтобы заполнить их внешние оболочки.Эта ассоциация неполярная , потому что электроны будут равномерно распределены между каждым атомом кислорода. Две ковалентные связи образуются между двумя атомами кислорода, потому что кислород требует, чтобы два общих электрона заполняли его внешнюю оболочку. Атомы азота образуют три ковалентные связи (также называемые тройными ковалентными) между двумя атомами азота, потому что каждому атому азота требуется три электрона, чтобы заполнить его внешнюю оболочку. Другой пример неполярной ковалентной связи обнаружен в молекуле метана (CH 4 ).У атома углерода четыре электрона во внешней оболочке, и ему нужно еще четыре, чтобы заполнить его. Он получает эти четыре из четырех атомов водорода, каждый из которых обеспечивает один. Все эти элементы делят электроны в равной степени, создавая четыре неполярные ковалентные связи (рис. 3).
Другой пример неполярной ковалентной связи обнаружен в молекуле метана (CH 4 ).У атома углерода четыре электрона во внешней оболочке, и ему нужно еще четыре, чтобы заполнить его. Он получает эти четыре из четырех атомов водорода, каждый из которых обеспечивает один. Все эти элементы делят электроны в равной степени, создавая четыре неполярные ковалентные связи (рис. 3).
В полярной ковалентной связи электроны, разделяемые атомами, проводят больше времени ближе к одному ядру, чем к другому ядру. Из-за неравномерного распределения электронов между разными ядрами возникает слегка положительный (δ +) или слегка отрицательный (δ–) заряд.Ковалентные связи между атомами водорода и кислорода в воде являются полярными ковалентными связями. Общие электроны проводят больше времени рядом с ядром кислорода, придавая ему небольшой отрицательный заряд, чем они проводят рядом с ядрами водорода, придавая этим молекулам небольшой положительный заряд.
Рис.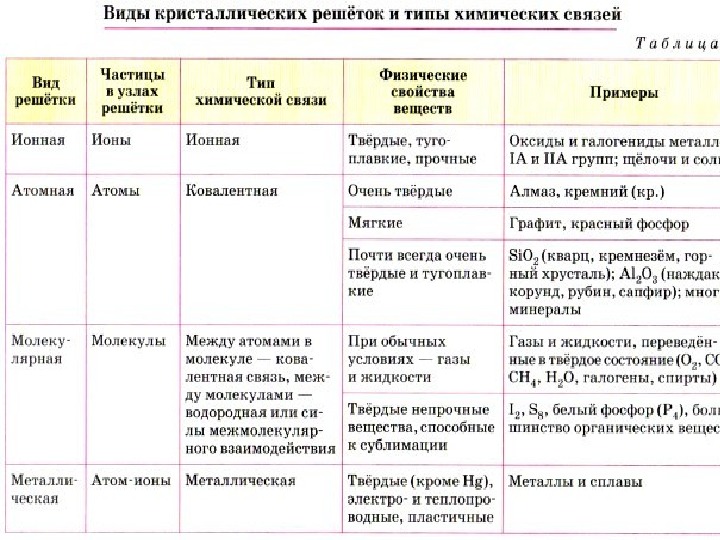 3 Молекула воды (слева) изображает полярную связь со слегка положительным зарядом на атомах водорода и слегка отрицательным зарядом на кислороде. Примеры неполярных связей включают метан (в центре) и кислород (справа).
3 Молекула воды (слева) изображает полярную связь со слегка положительным зарядом на атомах водорода и слегка отрицательным зарядом на кислороде. Примеры неполярных связей включают метан (в центре) и кислород (справа). Водородные связи
Ионные и ковалентные связи — это прочные связи, для разрыва которых требуется значительная энергия. Однако не все связи между элементами являются ионными или ковалентными связями. Могут образоваться и более слабые связи. Это притяжения, возникающие между положительными и отрицательными зарядами, для разрушения которых не требуется много энергии. Две часто встречающиеся слабые связи — это водородные связи и ван-дер-ваальсовы взаимодействия. Эти связи создают уникальные свойства воды и уникальные структуры ДНК и белков.
Когда образуются полярные ковалентные связи, содержащие атом водорода, атом водорода в этой связи имеет слегка положительный заряд. Это связано с тем, что общий электрон сильнее притягивается к другому элементу и от ядра водорода.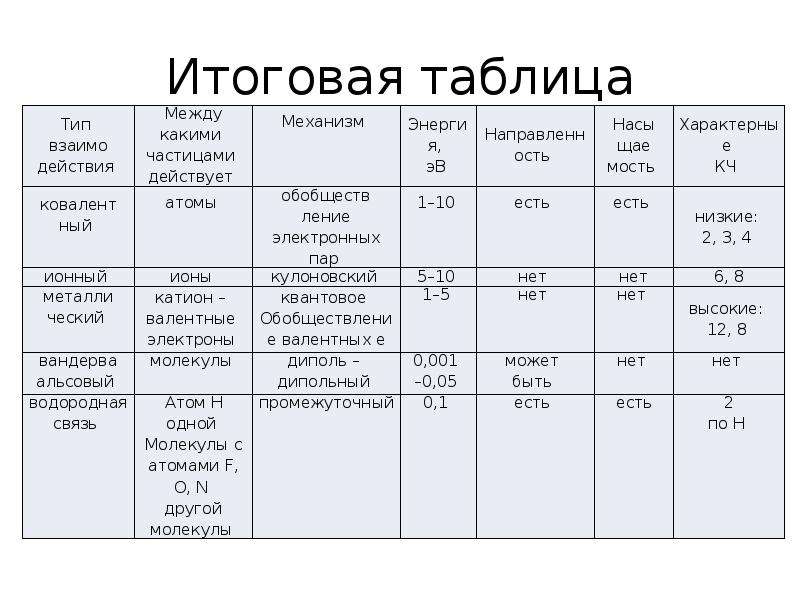 Поскольку атом водорода слегка положительный (δ +), он будет притягиваться к соседним частичным отрицательным зарядам (δ–). Когда это происходит, происходит слабое взаимодействие между зарядом δ + атома водорода одной молекулы и зарядом δ– другой молекулы.Это взаимодействие называется водородной связью. Этот тип облигации распространен; например, жидкая природа воды вызвана водородными связями между молекулами воды (рис. 4). Водородные связи придают воде уникальные свойства, поддерживающие жизнь. Если бы не водородная связь, вода была бы газом, а не жидкостью при комнатной температуре.
Поскольку атом водорода слегка положительный (δ +), он будет притягиваться к соседним частичным отрицательным зарядам (δ–). Когда это происходит, происходит слабое взаимодействие между зарядом δ + атома водорода одной молекулы и зарядом δ– другой молекулы.Это взаимодействие называется водородной связью. Этот тип облигации распространен; например, жидкая природа воды вызвана водородными связями между молекулами воды (рис. 4). Водородные связи придают воде уникальные свойства, поддерживающие жизнь. Если бы не водородная связь, вода была бы газом, а не жидкостью при комнатной температуре.
Водородные связи могут образовываться между разными молекулами, и они не всегда должны включать молекулу воды. Атомы водорода в полярных связях внутри любой молекулы могут образовывать связи с другими соседними молекулами. Например, водородные связи удерживают вместе две длинные нити ДНК, чтобы придать молекуле ДНК характерную двухцепочечную структуру.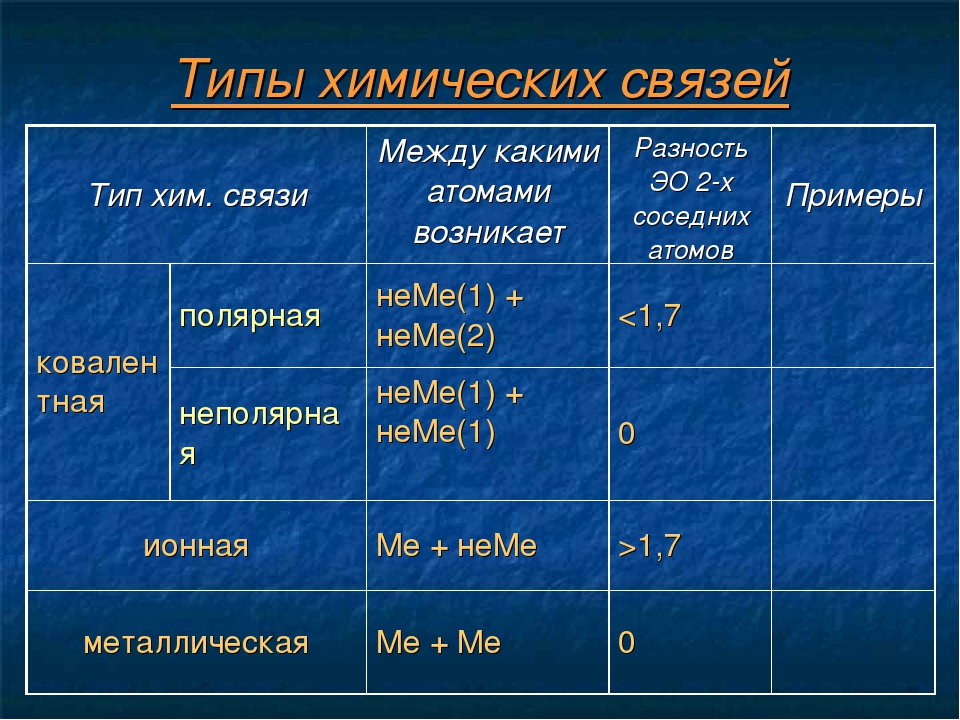 Водородные связи также ответственны за некоторые трехмерные структуры белков.
Водородные связи также ответственны за некоторые трехмерные структуры белков.
Взаимодействия Ван-дер-Ваальса
Подобно водородным связям, ван-дер-ваальсовы взаимодействия представляют собой слабое притяжение или взаимодействие между молекулами.Они возникают между полярными ковалентно связанными атомами в разных молекулах. Некоторые из этих слабых притяжений вызваны временными частичными зарядами, которые образуются при движении электронов вокруг ядра. Эти слабые взаимодействия между молекулами важны в биологических системах.
Ссылки
Если не указано иное, изображения на этой странице лицензированы OpenStax по лицензии CC-BY 4.0.
OpenStax, Концепции биологии. OpenStax CNX. 22 марта 2017 г. https://cnx.org/contents/[email protected]: IBRqRY3C @ 8 / Строительные блоки молекулы
|
День |
Тема |
|
|
Сен 7 День 1
|
Добро пожаловать в курс!
Гр 10 Обзор химии
Таблица Менделеева Диаграммы Льюиса Октет Правило и общие ионы |
Учебник Разделы (кликните по названию)
1. |
|
|
|
|
8 сентября День 2 |
Гр 10 Обзор химии Изотопное содержание Тенденции в Таблица Менделеева |
Учебник Разделы (кликните по названию)
1. |
|
|
|
|
9 сентября День 3
|
Тенденции в Таблица Менделеева |
Учебник Разделы (кликните по названию)
1. |
|
|
|
|
10 сен День 4 |
Химическая связь (ионная) |
Учебник Разделы (кликните по названию)
2. |
|
|
|
|
13 сен День 5 |
Химическая связь Ионный Номенклатура |
2. 2.1 Ионные соединения |
|
|
|
|
14 сентября День 6 |
Присвоение тенденций Рисование Молекулярный Соединения |
2. |
|
|
|
|
15 сен День 7 |
Полярность Молекулы |
3.3 полярные молекулы и Соединения |
|
|
|
|
16 сен День 8
|
Межмолекулярный Силы |
3. 3.5 Водородная связь |
|
|
|
|
17 сен День 9 |
Номенклатура Молекулярное и ионное соединение Обзор номенклатуры Многоатомные ионы и производные инструменты |
Разделы учебника (кликните по названию)
2. 2,4 Химические формулы и номенклатура (74-81) |
|
||
|
20 сен День 9
|
Номенклатура Кислоты и Производные инструменты |
2. 10,1 Недвижимость Кислоты и основания (466-468) |
|
|
|
|
21 сентября День 10
|
Склеивание и Назначение полярности Номенклатура
Кислоты Соли |
2. 10,1 Недвижимость Кислоты и основания (466-468) |
|
|
|
|
22 сентября День 11
|
Свойства Лаборатория молекулярных и ионных соединений Введение к химическим реакциям |
4. |
|
|
|
|
23 сентября День 12
|
Балансировка Химические уравнения Свойства Лабораторный анализ молекулярных и ионных соединений |
4. |
|
|
|
|
24 сен День 11
|
4. |
|
|
|
|
|
27 сен День 12
|
Номенклатура Учебная записка к оплате Синтез Реакция |
|
|
|
|
|
28 сен
|
Номенклатурный тест |
|
|
|
Пакет периодической таблицы и теста на склеивание, 11-й уровень химии Версия # 1
Тестовый набор для периодической таблицы и склеивания и набор тестов, химия 11-го класса
Этот файл содержит 10 периодических тестов / тестов на склеивание, 15 тестов и занимает 71 страницу. Обсуждаемые темы — расчет протонов, нейтронов, электронов и изотопного содержания. Он также включает атомный радиус, энергию ионизации, сродство к электрону, электроотрицательность, ионную связь, ковалентную связь, металлическую связь, свойства соединений, рисование структур Льюиса, определение полярности, организацию периодической таблицы, наименования ионных соединений, наименования ковалентных соединений, наименования многовалентных металлы, многоатомные названия, гидраты, названия кислот и оснований.
Меня зовут Даррин Мэтьюсон, и у меня есть докторская степень по органической химии.Я преподаю физику и химию более 15 лет. Все Power Points, викторины, тесты, вопросы с несколькими вариантами ответов, вопросы с короткими ответами и рабочие листы, которые я публикую, правильно отформатированы и готовы к печати. Проверены на ошибки и опечатки!
Если вы хотите сэкономить 20-25% на моих товарах, покупайте их комплектом! Ссылки на некоторые из моих наборов химии для 11 класса приведены ниже.
Обсуждаемые темы — расчет протонов, нейтронов, электронов и изотопного содержания. Он также включает атомный радиус, энергию ионизации, сродство к электрону, электроотрицательность, ионную связь, ковалентную связь, металлическую связь, свойства соединений, рисование структур Льюиса, определение полярности, организацию периодической таблицы, наименования ионных соединений, наименования ковалентных соединений, наименования многовалентных металлы, многоатомные названия, гидраты, названия кислот и оснований.
Меня зовут Даррин Мэтьюсон, и у меня есть докторская степень по органической химии.Я преподаю физику и химию более 15 лет. Все Power Points, викторины, тесты, вопросы с несколькими вариантами ответов, вопросы с короткими ответами и рабочие листы, которые я публикую, правильно отформатированы и готовы к печати. Проверены на ошибки и опечатки!
Если вы хотите сэкономить 20-25% на моих товарах, покупайте их комплектом! Ссылки на некоторые из моих наборов химии для 11 класса приведены ниже. https://www.tes.com/teaching-resource/resource-12586019 (тесты)
https://www.tes.com/teaching-resource/resource-12586220 (множественный выбор)
https: // www.tes.com/teaching-resource/resource-12586218 (краткий ответ)
https://www.tes.com/teaching-resource/resource-12595570 (рабочие листы)
https://www.tes.com/teaching-resource/resource-12608060 (очки питания)
https://www.tes.com/teaching-resource/resource-12608067 (очки питания)
В моем магазине продается более 140 Power Point, 40 пакетов с листами, 100 тестовых пакетов, 100 пакетов с множественным выбором и 70 пакетов с короткими ответами. У меня есть Power Points, тесты, викторины, вопросы с несколькими вариантами ответов, вопросы с короткими ответами и рабочие листы по каждой теме, охваченной естественными науками 10 класса, химией 11 класса, физикой 11 класса и химией 12 класса!
ПОИСКИ КЛЮЧЕВЫХ СЛОВ ДЛЯ НАВИГАЦИИ МОЙ МАГАЗИН:
1.введите «Очки силы физики 11 класса», чтобы просмотреть очки силы физики 11 класса.
тип «точка силы химии 11 класса» взгляд точка силы химии 11 класс
тип «12 класс по химии» точка зрения по химии 12 класс
введите «Очки силы науки 10 уровня», чтобы просмотреть очки силы науки 10 уровня
2.
https://www.tes.com/teaching-resource/resource-12586019 (тесты)
https://www.tes.com/teaching-resource/resource-12586220 (множественный выбор)
https: // www.tes.com/teaching-resource/resource-12586218 (краткий ответ)
https://www.tes.com/teaching-resource/resource-12595570 (рабочие листы)
https://www.tes.com/teaching-resource/resource-12608060 (очки питания)
https://www.tes.com/teaching-resource/resource-12608067 (очки питания)
В моем магазине продается более 140 Power Point, 40 пакетов с листами, 100 тестовых пакетов, 100 пакетов с множественным выбором и 70 пакетов с короткими ответами. У меня есть Power Points, тесты, викторины, вопросы с несколькими вариантами ответов, вопросы с короткими ответами и рабочие листы по каждой теме, охваченной естественными науками 10 класса, химией 11 класса, физикой 11 класса и химией 12 класса!
ПОИСКИ КЛЮЧЕВЫХ СЛОВ ДЛЯ НАВИГАЦИИ МОЙ МАГАЗИН:
1.введите «Очки силы физики 11 класса», чтобы просмотреть очки силы физики 11 класса.
тип «точка силы химии 11 класса» взгляд точка силы химии 11 класс
тип «12 класс по химии» точка зрения по химии 12 класс
введите «Очки силы науки 10 уровня», чтобы просмотреть очки силы науки 10 уровня
2. введите «пакет тестов по физике для 11 класса», чтобы просмотреть тесты по физике для 11 класса.
наберите «пакет тестов по химии для 11 класса», чтобы просмотреть тесты по химии для 11 класса.
наберите «тестовый пакет по химии 12-го класса», чтобы просмотреть тесты по химии 12-го класса.
введите «пакет тестов для 10-го класса по естествознанию», чтобы просмотреть тесты для 10-го класса.
3.введите «Рабочие листы по физике для 11 класса», чтобы просмотреть рабочие листы по физике для 11 класса.
введите «Рабочие листы по химии для 11 класса», чтобы просмотреть рабочие листы по химии для 11 класса.
введите «Рабочие листы по химии в 12 классе», чтобы просмотреть рабочие листы по химии в 12 классе.
введите «Рабочие листы по естествознанию за 10 класс», чтобы просмотреть рабочие листы по естественным наукам за 10 класс.
4. введите «краткий ответ для 11 класса по физике», чтобы просмотреть короткий ответ по физике для 11 класса.
напечатайте «короткий ответ 11 класс по химии» просмотрите 11 класс короткий ответ по химии
введите «короткий ответ 12 класс по химии» просмотрите 12 класс короткий ответ по химии
введите «краткий ответ по естествознанию 10-го класса», чтобы просмотреть краткий ответ по естествознанию 10-го класса.
введите «пакет тестов по физике для 11 класса», чтобы просмотреть тесты по физике для 11 класса.
наберите «пакет тестов по химии для 11 класса», чтобы просмотреть тесты по химии для 11 класса.
наберите «тестовый пакет по химии 12-го класса», чтобы просмотреть тесты по химии 12-го класса.
введите «пакет тестов для 10-го класса по естествознанию», чтобы просмотреть тесты для 10-го класса.
3.введите «Рабочие листы по физике для 11 класса», чтобы просмотреть рабочие листы по физике для 11 класса.
введите «Рабочие листы по химии для 11 класса», чтобы просмотреть рабочие листы по химии для 11 класса.
введите «Рабочие листы по химии в 12 классе», чтобы просмотреть рабочие листы по химии в 12 классе.
введите «Рабочие листы по естествознанию за 10 класс», чтобы просмотреть рабочие листы по естественным наукам за 10 класс.
4. введите «краткий ответ для 11 класса по физике», чтобы просмотреть короткий ответ по физике для 11 класса.
напечатайте «короткий ответ 11 класс по химии» просмотрите 11 класс короткий ответ по химии
введите «короткий ответ 12 класс по химии» просмотрите 12 класс короткий ответ по химии
введите «краткий ответ по естествознанию 10-го класса», чтобы просмотреть краткий ответ по естествознанию 10-го класса.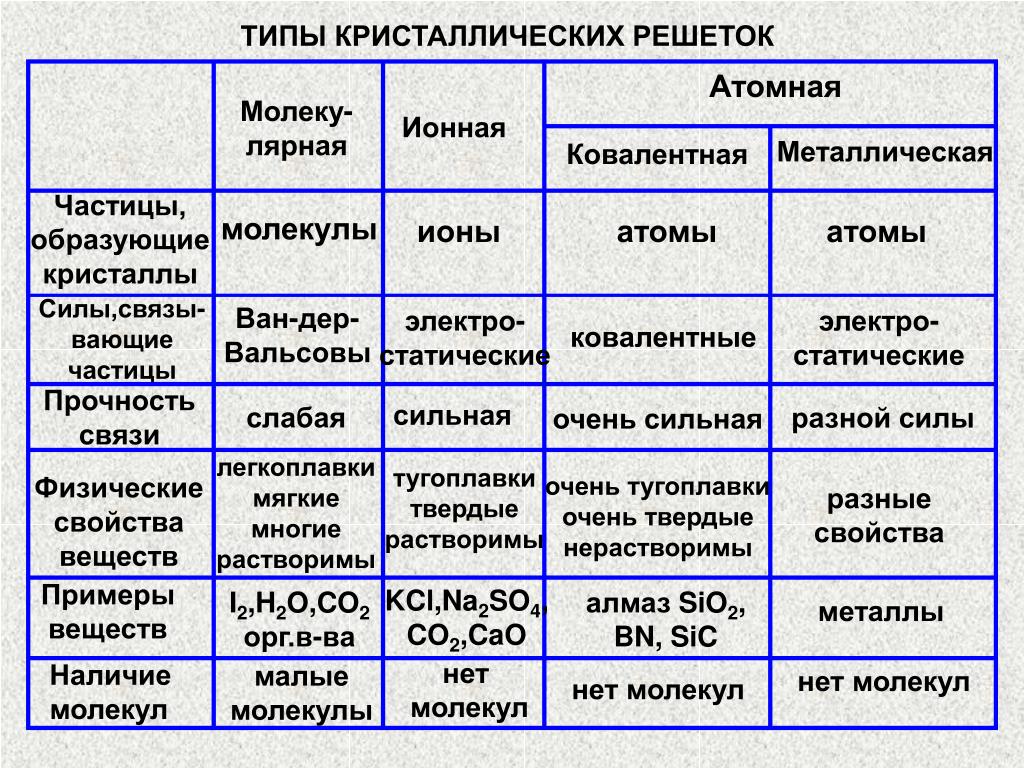 5.введите «множественный выбор для 11 класса по физике» просмотреть для 11 класса по физике множественный выбор
введите «множественный выбор для 10-го класса естествознания» просмотрите 10-й класс естествознания множественный выбор
введите «множественный выбор по химии для 11 класса», чтобы увидеть несколько вариантов по химии для 11 класса.
введите «множественный выбор химии 12 степени», чтобы просмотреть химию 12 класса множественный выбор
5.введите «множественный выбор для 11 класса по физике» просмотреть для 11 класса по физике множественный выбор
введите «множественный выбор для 10-го класса естествознания» просмотрите 10-й класс естествознания множественный выбор
введите «множественный выбор по химии для 11 класса», чтобы увидеть несколько вариантов по химии для 11 класса.
введите «множественный выбор химии 12 степени», чтобы просмотреть химию 12 класса множественный выбор
Химическая связь и молекулярная структура Класс 11 Примечания Химия Глава 4
Введение
В предыдущей главе мы обсуждали Классификацию элементов и периодичность в свойствах , но в этой главе мы изучим химические связи и молекулярную структуру.
Структура и Связь — это сердце химии. Химическая связь
очень важно объяснить свойства и структуру
сложный. Важным аспектом каждого типа силы является его относительная
сила, насколько быстро она уменьшается с увеличением расстояния и
имеет ли он направленный характер или нет.
Химическая связь
Это сила притяжения между двумя атомами, которая удерживает их вместе в соединение или молекулу.Природа любит стабильность, а образование связей связано со стабильностью. Каждый элемент имеет тенденцию занимать инертную электронную конфигурацию, которая считается очень стабильной. Электронная конфигурация благородного газа может быть достигнута с помощью
- Переноса электронов
- Взаимного обмена электронов
- Подачи неподеленной пары электронов
Типы связи
Чтобы объяснить образование химической связи в терминах электронов, Льюис постулировал, что атомы достигают стабильного октета, когда они связаны химической связью.На основе этой химической связи бывают следующие типы:
- Ионная связь
- Ковалентная связь
- Координатная связь
- Металлическая связь
- Водородная связь
- Ван-дер-Ваальская связь
Точечные структуры Льюиса
Валентные электроны
В образовании молекулы только электроны внешней оболочки принимают участие в комбинации химических связей, и они известны как валентные электроны . В символах Льюиса элемент показан с символом и валентными электронами.
В символах Льюиса элемент показан с символом и валентными электронами.
Правило октета
Это было предложено Kossel и Lewis и, согласно этому, «каждый атом имеет тенденцию достигать электронной конфигурации благородного газа или иметь 8 валентных электронов». Этот известен как закон правила октетов или, если он имеет два валентных электрона, то это известно как закон дуплета . Согласно Льюису, стабильными будут только те соединения, которые подчиняются правилу октетов.
Читайте также: Состояния вещества Класс 11 Примечания Химия Глава 5
Официальное обвинение
Формальный заряд на атоме — это разница между числом валентных электронов в изолированном атоме и числом электронов, назначенных этому атому в структуре Льюиса. Выражается как:
Ионная связь
Ионная связь образуется путем полного переноса одного или нескольких электронов с валентной оболочки одного атома на валентную оболочку другого атома. Таким образом, оба атома приобретают стабильные электронные конфигурации благородных газов. Атом, теряющий электрон, становится положительным ионом, а атом, который получает электрон, становится отрицательным ионом.
Таким образом, оба атома приобретают стабильные электронные конфигурации благородных газов. Атом, теряющий электрон, становится положительным ионом, а атом, который получает электрон, становится отрицательным ионом.
Примечание : Электровалентность — это количество электронов, потерянных или приобретенных во время образования ионной связи или электровалентной связи.
Читайте также: Движение на плоскости Класс 11 Примечания по физике Глава 4
Характеристики ионных соединений
-
Они твердые, хрупкие и кристаллические.
-
Они имеют высокие температуры плавления и кипения.
-
Они полярны по своей природе.
-
Связь между противоположно заряженными ионами нежесткая и ненаправленная.
-
Они растворимы в полярных растворителях, таких как вода, и нерастворимы в неполярных растворителях, таких как CCl 4 , Бензол, эфир и т. Д.
-
Они являются хорошими проводниками электричества в расплавленном состоянии и в растворе благодаря подвижности ионов.
 Они
являются плохими проводниками электричества в твердом состоянии, потому что ионы не могут двигаться.
Они
являются плохими проводниками электричества в твердом состоянии, потому что ионы не могут двигаться.
Ковалентная связь
Сила, которая связывает атомы одного и того же или разных элементов за счет совместного использования электронов, называется ковалентной связью . Если объединяющиеся атомы одинаковы, ковалентная молекула называется гомоатомной. Если они разные, их называют гетероатомными молекулами.
Теория валентной связи (VBT)
Теория валентной связи была введена Гейтлером и Лондоном (1927) и развита Полингом и другими.Он основан на концепции атомных орбиталей и электронной конфигурации атомов. Пусть два атома водорода A и B, имеющие свои ядра N A и N B , и электроны, присутствующие в них, являются e A и e B . По мере того, как эти два атома сближаются, начинают действовать новые силы притяжения и отталкивания.
-
Ядро одного атома притягивается к собственному электрону и электрону другого, и наоборот.
-
Силы отталкивания возникают между электронами двух атомов и ядрами двух атомов.Силы притяжения стремятся сблизить два атома, тогда как силы отталкивания стремятся их раздвинуть.
Концепция орбитального перекрытия
Если мы говорим о состоянии с минимальной энергией при образовании молекулы водорода, два атома водорода находятся достаточно близко, чтобы позволить их атомным орбиталям частично взаимопроникноваться. Это частичное взаимопроникновение атомных орбитали называют перекрытием атомных орбиталей. Перекрытие атомных орбиталей может быть положительным, отрицательным или нулевым в зависимости от характеристик. участвующих в перекрытии орбиталей.
Виды перекрытия
Ковалентные связи можно разделить на две разные категории в зависимости от типа перекрытия. Это:
1. Сигма (σ) облигация
Этот тип ковалентной связи образован осевым перекрытием наполовину заполненных атомных связей.
орбитали. Атомные орбитали перекрываются вдоль межъядерной оси и перекрываются встык или голова. Может быть три типа осевого перекрытия s- и p-орбиталей, как обсуждается ниже:
Может быть три типа осевого перекрытия s- и p-орбиталей, как обсуждается ниже:
(i) s-s overlap : В этом случае имеется перекрытие двух наполовину заполненных s-орбиталей вдоль межъядерной оси, как показано ниже.
(ii) перекрытие s-p : оно включает перекрытие наполовину заполненных s-орбиталей одного атома с наполовину заполненными p-орбиталями другого атома. Образованная таким образом связь называется сигма-связью s-p.
(iii) p-p перекрытие : Он включает в себя коаксиальное перекрытие между наполовину заполненными p-орбиталями одного атома с наполовину заполненными p-орбиталями другого атома. Сформированная связь называется сигма-связью p-p.
2. связь пи (π)
Этот тип ковалентной связи образуется, когда атомные орбитали перекрываются таким образом, что их оси остаются параллельными друг другу и перпендикулярными межъядерной оси.Орбитали, образованные из-за бокового перекрытия, состоят из двух заряженных облаков типа блюдце выше и ниже плоскости участвующих атомов. Электроны, участвующие в образовании π-связи, называются пи-электронами .
Электроны, участвующие в образовании π-связи, называются пи-электронами .
Гибридизация
Гибридизация — это процесс смешения орбиталей с немного разными энергиями, чтобы перераспределить их энергии, что приводит к образованию нового набора орбиталей эквивалентных энергий и форм.Атомные орбитали объединяются, чтобы сформировать новый набор эквивалентных орбиталей, известных как гибридные орбитали.
Основные черты гибридизации
-
Количество гибридных орбиталей равно количеству атомных орбиталей, которые подвергаются гибридизации.
-
Гибридизированные орбитали всегда эквивалентны по энергии и форме.
-
Гибридные орбитали более эффективны в образовании стабильных связей, чем чистые атомные орбитали.
-
Тип гибридизации указывает на геометрия молекул.
Важные условия для гибридизации
-
Орбитали валентной оболочки атома гибридизуются.
-
Орбитали, участвующие в гибридизации, должны иметь лишь небольшую разницу энергий.
-
Продвижение электрона не является важным условием перед гибридизацией.
-
Необязательно, чтобы в гибридизации участвовали только наполовину заполненные орбитали.
Типы гибридизации
Существует много различных типов гибридизации в зависимости от типа орбиталей, участвующих в смешивании, например as sp 3 , sp 2 , sp, sp 3 d, sp 3 d 2 и т. д.
(i) sp-гибридизация
В этой гибридизации одна s- и одна p-орбитали гибридизуются с образованием двух эквивалентных гибридных орбиталей, известных как sp-гибридные орбитали. Две sp-гибридные орбитали ориентированы по прямой под углом 180 °, поэтому молекула имеет линейную геометрию. Каждая из гибридных орбиталей имеет 50% s-символа и 50% p-символа.
Примером sp-гибридизации молекул являются BeF 2 , BeCl 2 , BeH 2 и т. Д.
Д.
(ii) sp
2 -гибридизацияВ этой гибридизации одна s и одна 2p-орбитали гибридизуются с образованием трех эквивалентных гибридных орбиталей, известных как sp 2 гибридных орбиталей. Гибридные орбитали sp 2 больше по размеру, чем sp-гибридные орбитали, но немного меньше, чем у гибридных орбиталей sp 3 . Каждые гибридные орбитали sp2 имеют 1/3 (или 33,33%) s-символа и 2/3 (или 66,7%) p-символа. Например, BF 3 , BCl 3 , BH 3 и т. Д.
(iii) sp
3 -гибридизацияВ этой гибридизации одна s и три p-орбитали смешиваются, образуя sp3-гибридные орбитали с эквивалентной энергией и идентичной формой. Эти четыре гибридные sp3-орбитали направлены к четырем углам тетраэдра, разделенным углом 109 ° 28 ‘. Гибридные орбитали sp3 имеют 1/4 (или 25%) s-символа и 3/4 (или 75%) p-символа. Например, CH 4 , NH 3 и т. Д.
(iv) sp
3 d-гибридизация Этот тип гибридизации включает смешивание одной s, трех p и одной d-орбиталей с образованием пяти sp.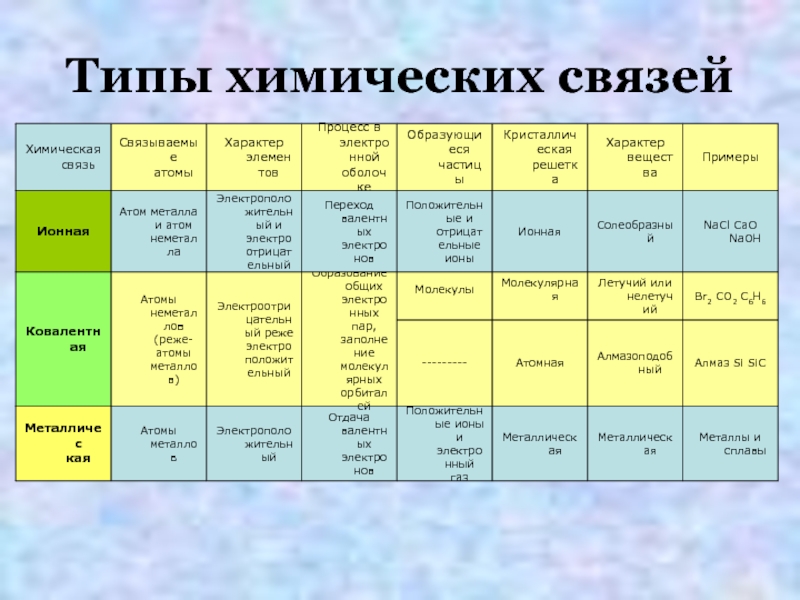 3 d гибридизированных орбиталей, которые принимают тригонально-бипирамидальные.
3 d гибридизированных орбиталей, которые принимают тригонально-бипирамидальные.
Образование PCl 5 : Электронная конфигурация фосфора в основном состоянии 1s 2 2s 2 2p 6 3s 2 3p 3 . В условиях образования связи 3s-электроны становятся неспаренными, и один из электронов продвигается на вакантную орбиталь 3d z 2 . Конфигурации основного и возбужденного состояний фосфора показаны ниже:
(v) sp
3 d 2 -гибридизацияВ этом типе гибридизации одна s, три p и две d-орбитали подвергаются перемешиванию с образуют шесть идентичных гибридных орбиталей sp 3 d 2 .Эти шесть орбиталей направлены к углам октаэдра и лежат в пространстве под углом 90 ° друг к другу.
Формирование SF 6 : Внешняя конфигурация основного состояния 16 S — 3s 2 3p 4 .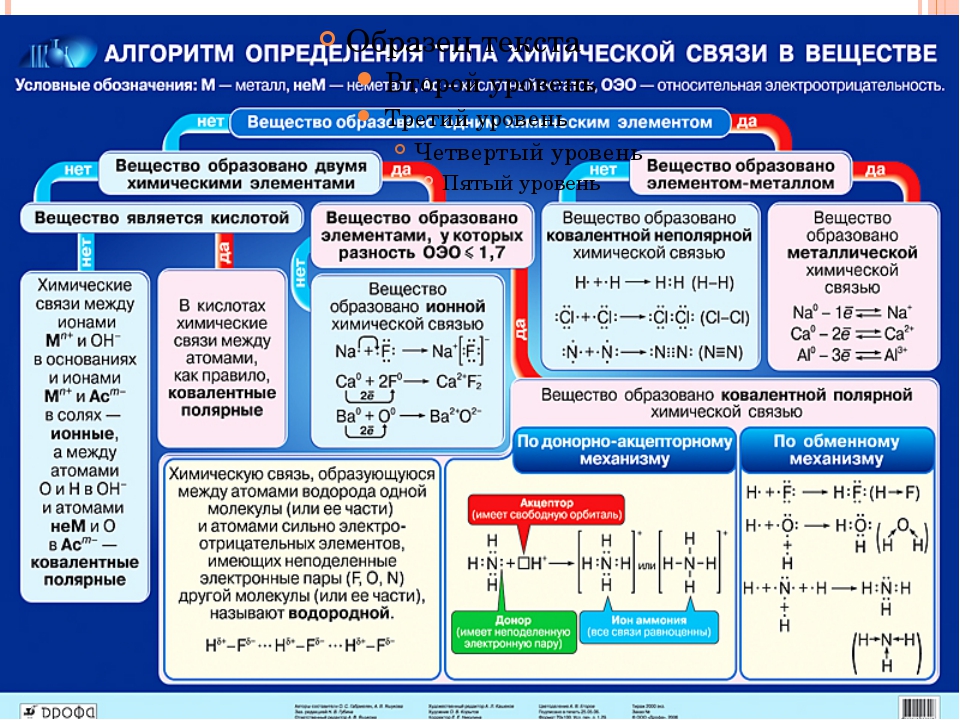 В возбужденном состоянии электронные пары на 3s и 3p орбиталях x становятся неспаренными, и одна из каждой пары перемещается на вакантные 3d z 2 и 3d x 2 -y 2 орбиталей.Конфигурация основного и возбужденного состояний 16 S имеет следующий вид:
В возбужденном состоянии электронные пары на 3s и 3p орбиталях x становятся неспаренными, и одна из каждой пары перемещается на вакантные 3d z 2 и 3d x 2 -y 2 орбиталей.Конфигурация основного и возбужденного состояний 16 S имеет следующий вид:
Теория отталкивания электронных пар валентных оболочек (VSEPR)
Сиджвик и Пауэлл в 1940 году предложили простую теорию, основанную на отталкивающем характере электронных пар в валентной оболочке атомов. Дальнейшее развитие он получил Нихольм и Гиллеспи (1957). Основные постулаты следующие:
-
Точная форма молекулы зависит от количества электронных пар (связанных или несвязанных) вокруг центральных атомов.
-
Электронные пары имеют тенденцию отталкиваться друг от друга, поскольку они существуют вокруг центрального атома, а электронные облака заряжены отрицательно.
-
Электронные пары пытаются занять такое положение, которое может минимизировать разрыв между ними.

-
Валентная оболочка принимается как сфера с электронными парами, расположенными на максимальном расстоянии.
-
Множественная связь рассматривается как одна электронная пара, а электронные пары, составляющие связь, как одинарные пары.
Параметры облигации
(я). Связующий уголок
Он определяется как угол между орбиталями, содержащими связывающие электронные пары, вокруг центрального атома в молекуле / комплексном ионе. Угол связи выражается в градусах, которые могут быть определены экспериментально спектроскопическими методами.
(ii). Длина связи
Длина связи определяется как равновесное расстояние между ядрами двух связанных атомов в молекуле.
(iii).Энтальпия решетки
Энтальпия решетки твердого ионного вещества определяется как энергия, необходимая для
полностью разделить один моль твердого ионного соединения на газообразную составляющую
ионы. Например, энтальпия решетки NaCl составляет 788 кДж / моль –1 .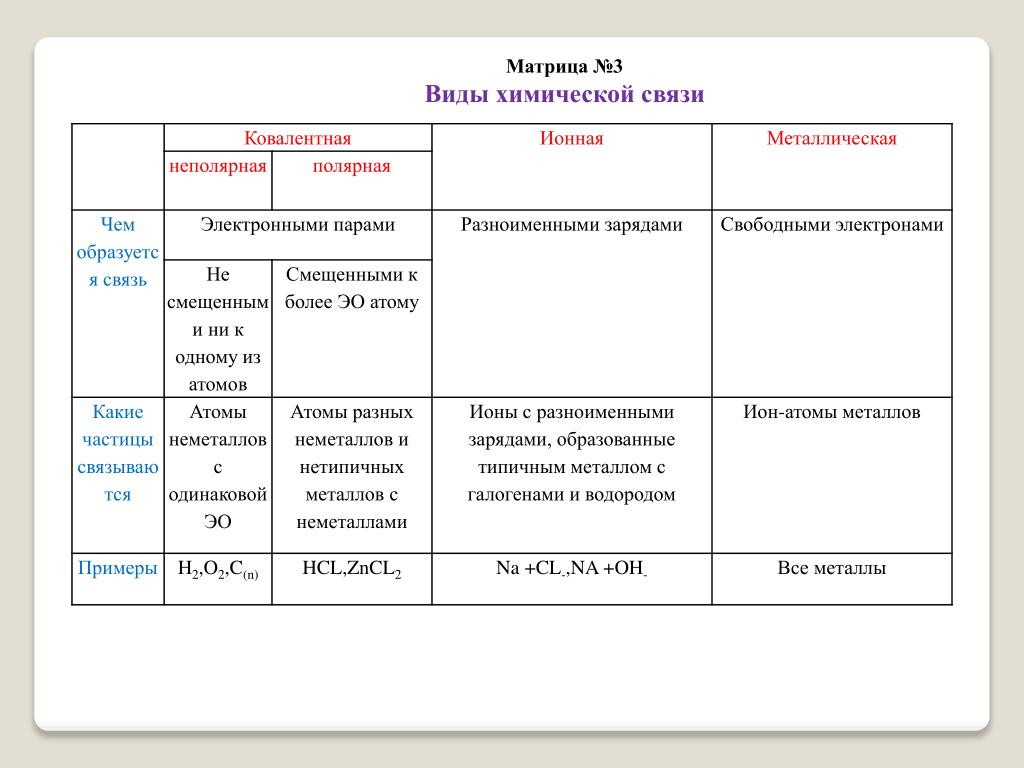
(iv). Приказ на облигации
Порядок связи определяется как половина разницы между числом электронов, присутствующих на связывающих и разрыхляющих молекулярных орбиталях. Порядок облигаций может быть целым числом, дробью или даже нулем.Он также может быть положительным или отрицательным.
Распоряжение на облигации (B.O.) = `1/2 [N_ {b} -N_ {a}]`
(vi). Связь энтальпии
Он определяется как количество энергии, необходимое для разрыва одного моля связи определенного типа между двумя атомами в газообразном состоянии. Единица энтальпии связи — кДж / моль –1 . Например, энтальпия связи H — H в молекуле водорода составляет 435,8 кДж / моль –1 .
Теория молекулярных орбиталей (МОТ)
Теория молекулярных орбиталей (МО) была разработана Ф.Хунд и Р. Mulliken в 1932 году. Согласно MOT, молекула сильно отличается от составляющих ее атомов. Считается, что все электроны, принадлежащие атомам, составляющим молекулу, движутся вдоль всей молекулы под влиянием всех ядер.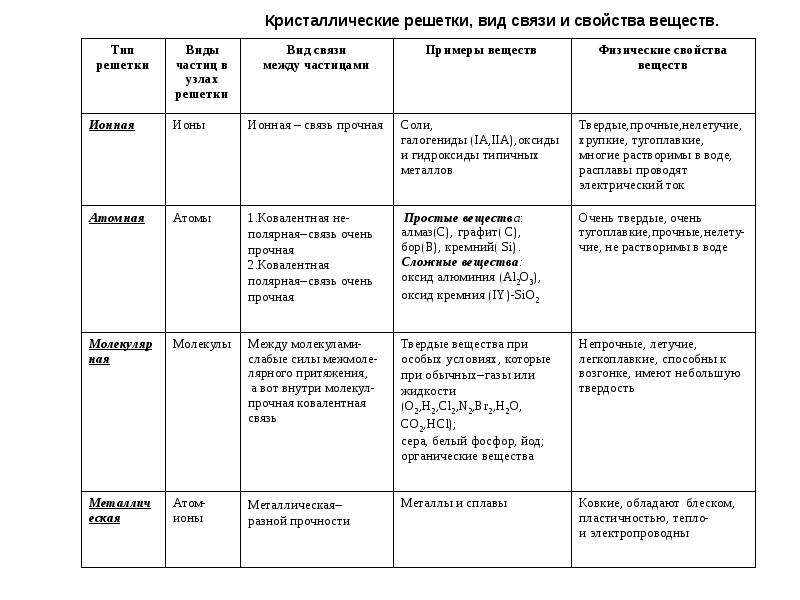 Таким образом, предполагается, что молекула имеет орбитали с разными уровнями энергии, как и атом. Эти орбитали называют молекулярными орбиталями.
Таким образом, предполагается, что молекула имеет орбитали с разными уровнями энергии, как и атом. Эти орбитали называют молекулярными орбиталями.
Диаграмма уровней энергии для молекулярных орбиталей
Резонанс
Когда соединение имеет одинаковую молекулярную формулу, но разные структурные формулы и структуры различаются только в отношении электронов.Эти структуры известны как резонирующие структуры или канонические структуры. Ни одна из этих структур не может объяснить все свойства этого соединения. Это явление известно как резонанс.
Водородная связь
Когда сильно электроотрицательные элементы, такие как азот, кислород, фтор, присоединяются к водороду с образованием ковалентной связи, электроны ковалентной связи смещаются в сторону более электроотрицательного атома. Таким образом, на атоме водорода возникает частичный положительный заряд, который образует связь с другим электроотрицательным атомом.Эта связь известна как водородная связь, и она слабее ковалентной связи.
Типы водородных связей
Есть два типа водородных связей.
1. Межмолекулярная водородная связь : это тип водородной связи между двумя похожими или разными молекулами. Пример: H — F, HF и вода, NH 3 , NH 3 и вода, спирт, спирт и вода и т. Д.
2. Внутримолекулярная водородная связь : это тип водородной связи внутри молекулы.Пример: салицилальдегид, О-нитрофенол и т. Д.
Применение водородной связи
1. Состояние : Водородная связь может повлиять на состояние соединения. Например, H 2 O является жидкостью при комнатной температуре, тогда как H 2 S является газом. Это связано с наличием межмолекулярной водородной связи между молекулами H 2 O, которого нет в молекулах H 2 S.
2. Растворимость : в воде растворимы только те ковалентные молекулы, которые имеют тенденцию к образованию межмолекулярных водородных связей с молекулами воды.
3. Точка кипения : межмолекулярная водородная связь увеличивает температуру кипения соединения. Например, NH 3 имеет более высокую температуру кипения, чем PH 3 . Это связано с тем, что существует межмолекулярная водородная связь в NH 3 , но не в PH 3 .
4. Плотность льда ниже, чем у воды. : Во льду водородные связи образуют решетчатую структуру из молекул H – O – H, в которой каждая молекула H – O – H тетраэдрически связана с четырьмя другими H– Молекула O – H.В этой конструкции образуются свободные пространства, уменьшающие плотность льда.
Металлическое соединение
Сила, которая связывает атом металла с рядом электронов в пределах его сферы влияния, известна как металлическая связь . Эта модель легко объясняет следующие свойства металлов:
- Высокая электропроводность
- Высокая теплопроводность
- Яркий металлический блеск
- Пластичность
- Пластичность
- Предел прочности на разрыв
- Эластичность
Резюме
-
Химическая связь : Сила притяжения, которая удерживает различные химические образования в разных разновидность.
-
Электровалентная связь : Сила притяжения между противоположно заряженными ионами, которая возникает к существованию посредством переноса электронов.
-
Электровалентность : количество электронов, которые атом теряет или приобретает при образовании ионной или электровалентная связь.
-
Ковалентная связь : Связь возникает в результате совместного использования электронов атомы, участвующие в связывании.
-
Подход ковалентной связи с валентной связью : Связь образована перекрытием наполовину заполненных атомных орбиталей, имеющих электроны с противоположными спинами.
-
Ковалентность : Число наполовину заполненных атомных орбиталей, которые атом обеспечивает для участия. внахлест на момент склейки.
-
Дативная связь или координационная связь : Связь образуется путем разделения электронов, в которых общая пара электронов вносится одним из атомов, называемым донором, в то время как другой атом называется акцепторным.

-
Гибридизация : процесс смешения или слияния орбиталей (немного разных энергий) атома, чтобы сформировать другой набор орбиталей с эквивалентной формой и энергией.
-
Геометрия молекулы : определенное относительное расположение связанных атомов в молекула.
-
Регулярная и нерегулярная геометрия : Говорят, что молекула обладает правильной геометрией, если отталкивающие взаимодействия между электронной парой вокруг центрального атома равны величина. Если отталкивающие взаимодействия между электронными парами неравны, геометрия называется нерегулярным.
-
Электроотрицательность : способность атома притягивать к себе пару электронов.
-
Дипольный момент (μ) : векторная величина, определяемая произведением заряда, возникающего на любом атома и расстояния между атомами; создание диполя.
-
Полярные и неполярные молекулы : молекулы с дипольным моментом (μ)> 0 называются полярные молекулы, а с μ = 0 — неполярные молекулы.

-
Диполь-дипольные взаимодействия : притягивающие взаимодействия между противоположными концами полярных молекулы в жидком и твердом состоянии.
-
Водородная связь : Электростатическая сила притяжения между ковалентно связанными атомами водорода одной молекулы и электроотрицательного атома (F, N или O) другой молекулы.
-
Резонанс : Когда молекула представлена более чем одним электронным расположением ни одно из которых не может объяснить наблюдаемые характеристики молекулы, тогда фактические структура является промежуточным звеном между различными электронными устройствами и известна как резонансная гибридный.Различные электронные устройства называются резонирующими структурами или каноническими структурами.
-
Теория молекулярных орбиталей (МОЛ) : Согласно этой теории, в молекулах электроны присутствуют на новых орбиталях, называемых молекулярными орбиталями. Молекулярные орбитали не связаны с конкретный атом, но принадлежат ядрам всех атомов, составляющих молекулу.
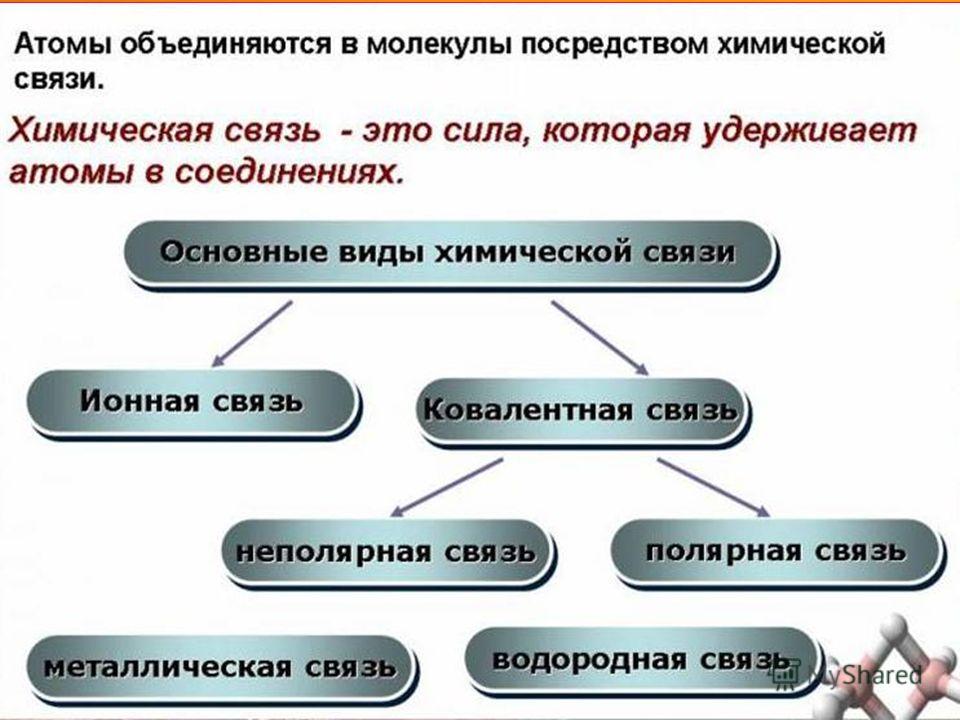
-
Метод ЛКАО : Это приблизительный метод, согласно которому молекулярные орбитали получены линейной комбинацией атомных орбиталей.
Читайте также
Связи одиннадцатого класса (11 класс) и смешанные вопросы для тестов и рабочих листов
Вы можете создавать печатные тесты и рабочие листы из этих Связи 11 класса и смешивание вопросов! Выберите один или несколько вопросов, установив флажки над каждым вопросом. Затем нажмите кнопку добавить выбранные вопросы к тесту перед переходом на другую страницу.
Предыдущая Страница 1 из 3 Следующие Выбрать все вопросы В химии мы описываем смесь как-
комбинация чистых веществ, образованных за счет химической связи.
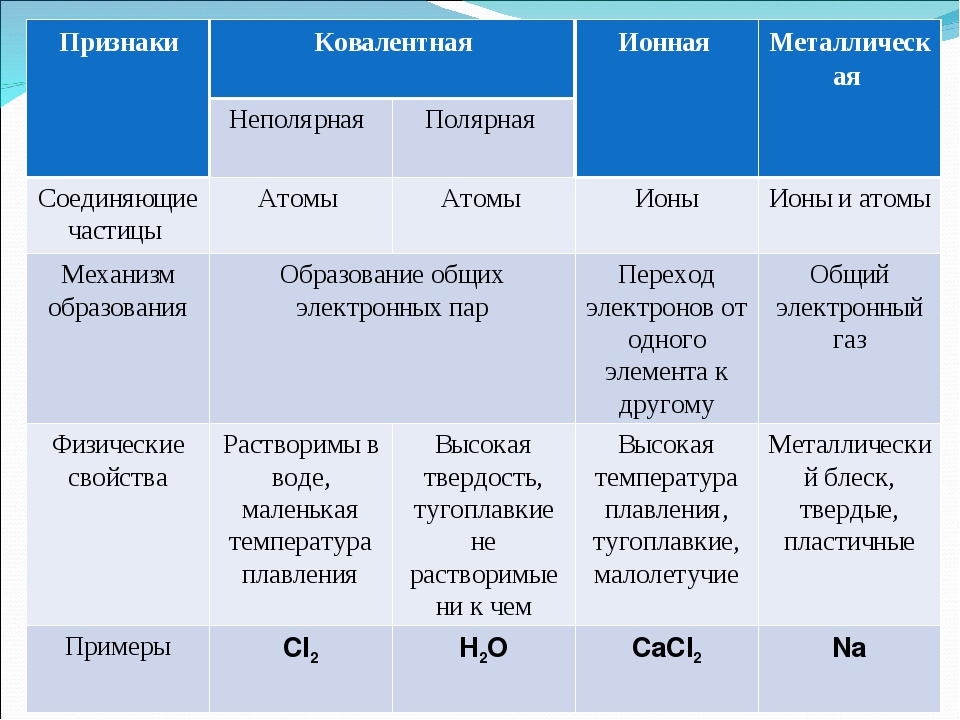
- любое вещество, имеющее однородный состав на всем протяжении.
- физическая комбинация двух или более типов веществ, каждое из которых сохраняет свои характерные свойства.
- любой набор элементов, химически связанных друг с другом.
- S-Cl, P-Cl, Mg-Cl, Si-Cl
- Mg-Cl, Si-Cl, P-Cl, S-Cl
- Mg-Cl, S-Cl, P-Cl, Si-Cl
- S-Cl, P-Cl, Si-Cl, Mg-Cl
Химическая связь и игры
Gumdrop Models
Попросите учащихся использовать леденцы для создания моделей соединений с ионными и ковалентными связями.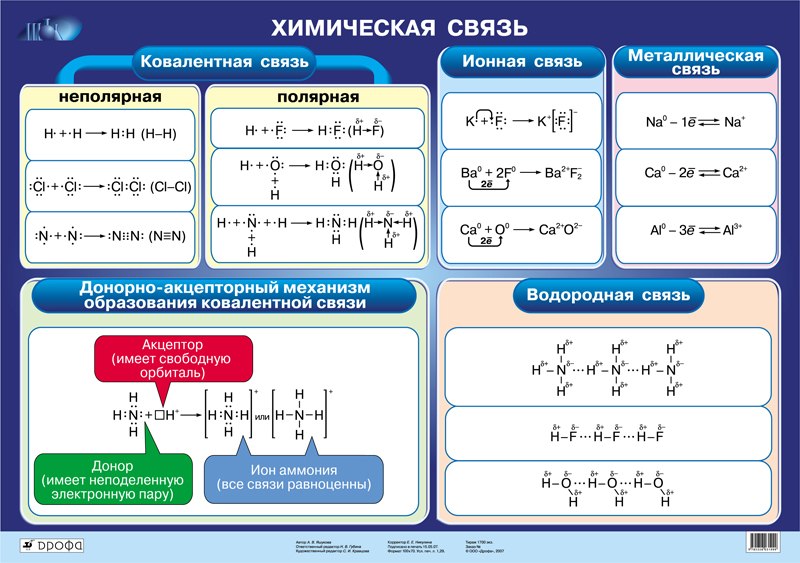
Материалы
- Периодическая система элементов
- Мармелад
- Доска для плакатов
- Клей
- Маркеры
- Учетные карточки с написанными на них химическими соединениями
Teacher Directions
Preparation
Перед выполнением упражнения создайте учетные карточки с названием и химической формулой для соединений, созданных с использованием ковалентных и ионных связей.
Мероприятие
- Покажите студентам периодическую таблицу элементов.Обсудите, как элементы периодической таблицы можно комбинировать с помощью ковалентных или ионных связей.
- Нарисуйте схемы ковалентных и ионных связей, показывающие, как электроны распределяются в ковалентной связи по сравнению с переносом в ионной связи.
- Разделите класс на пары и раздайте каждой паре леденцы, клей, маркеры, плакат и две созданные вами учетные карточки (одна ковалентная, одна ионная).
- Попросите учащихся создать модели ковалентных и ионных связей для двух соединений.
 Для каждого соединения учащиеся напишут химический символ для каждого элемента и разместят его электроны на внешней оболочке, представленные мармеладными каплями, чтобы показать, как они связаны с другими элементами в составе.
Для каждого соединения учащиеся напишут химический символ для каждого элемента и разместят его электроны на внешней оболочке, представленные мармеладными каплями, чтобы показать, как они связаны с другими элементами в составе. - Когда ученики закончат, попросите их поделиться своими моделями с классом.
Вопросы для обсуждения
- Чем ковалентные и ионные связи похожи и чем отличаются?
- Какие типы элементов, металлические и неметаллы, объединяются, образуя ковалентные связи? Ионные связи?
Давайте посмеемся над этим
Помогите ученикам вспомнить четыре различных типа химических связей, шутя об их характеристиках.
Материалы
Указания для учителя
- Опишите четыре типа химических связей: ковалентную, ионную, полярно-ковалентную и металлическую. Нарисуйте диаграммы, чтобы проиллюстрировать общие соединения, которые имеют каждый тип связи.
- В классе создайте четырехстороннюю диаграмму Венна, чтобы сравнить и сопоставить характеристики четырех связей.
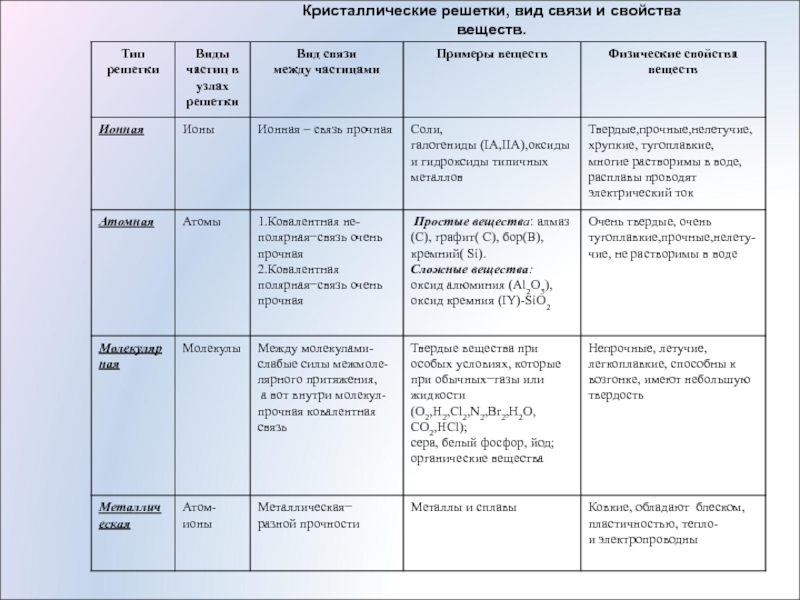
- Разделите класс на пары и раздайте каждой паре лист бумаги и маркеры.
- Попросите пары придумать шутку, чтобы помочь им вспомнить что-нибудь о каждом типе химической связи.Например, шутка может быть такой: «Почему ковалентные связи — хорошие граждане? Потому что они всегда делятся своими электронами ».
- Студенты должны писать свои анекдоты на листе бумаги.
- Когда ученики закончат, предложите им поделиться с классом своими шутками.
Вопросы для обсуждения
- Какая самая запоминающаяся шутка вы услышали сегодня?
- Чем полярные ковалентные и металлические связи похожи и отличаются от ковалентных и ионных связей?
Bonding Experience
Используйте эту кинестетическую игру, чтобы помочь студентам испытать химические связи и определить типы связей.
Материалы
- Диаграммы общих химических соединений
- Учетные карточки с написанными на них элементами
Указания для учителя
Подготовка
Перед игрой создайте учетные карточки с различными элементами, написанными на них.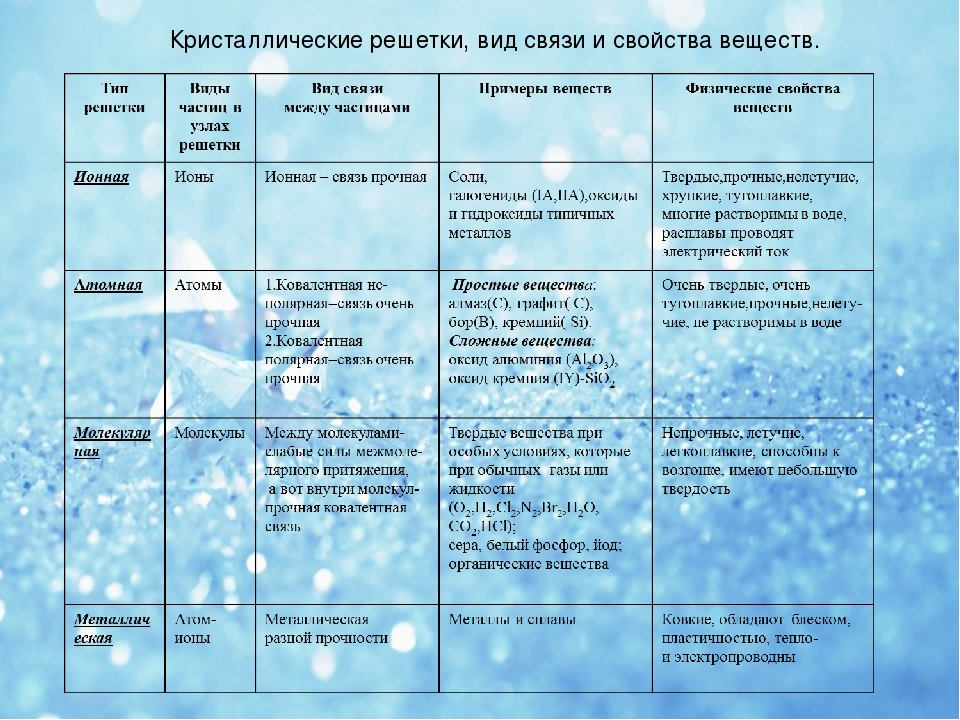
Игра
- Покажите учащимся различные диаграммы общих химических соединений, показывающие, как элементы связаны друг с другом. Включите примеры ковалентных, ионных, полярных ковалентных и металлических связей.Эти примеры должны включать элементы, перечисленные на созданных вами карточках.
- Попросите учащихся встать и раздайте каждому учащемуся одну из созданных вами учетных карточек.
- Когда вы скажете «иди», ученики будут притворяться элементами на своих карточках и мчаться в поисках других учеников, с которыми они могут создавать химические соединения.
- После того, как учащиеся создали соединение, они должны сказать вам, какие типы связей присутствуют в этом соединении.
- Учащиеся, правильно сформировавшие соединение и определившие его связи, получают 20 баллов.
- Распределите карточки и повторите один и тот же процесс несколько раз.
- Побеждает ученик, набравший наибольшее количество очков в конце игры.

Вопросы для обсуждения
- Как вы выяснили, с какими элементами можно сочетать и какие типы связей использовались для создания соединений?
- Какой вид склеивания, по вашему мнению, наиболее частый? Почему?
Bingo Ball Bonding
Используйте шары для пинг-понга и периодическую таблицу элементов, чтобы создать командную игру о химической связи.
Материалы
- Копии периодической таблицы элементов
- Мячи для пинг-понга
- Непрозрачный мешок или контейнер
- Перманентный маркер
- Маркеры сухого стирания
- Доски для сухого стирания
Указания для учителя
Подготовка
- Перед игрой используйте перманентный маркер, чтобы написать на шариках для пинг-понга числа, соответствующие атомным номерам различных элементов.
- Подумайте, следует ли включать все химические элементы или только те, которые встречаются в обычных химических соединениях.
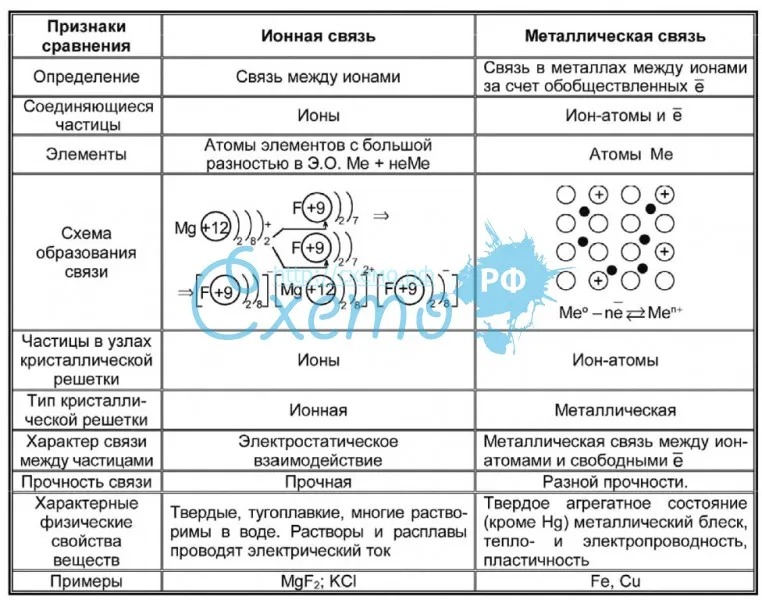
- Поместите шары в непрозрачный пакет / контейнер.
Игра
- Раздайте учащимся копии периодической таблицы элементов. Обсудите, как различные типы элементов на столе сочетаются с использованием разных химических связей.
- Разделите класс на небольшие группы и раздайте каждой группе доску для сухого стирания и маркеры.
- Для каждого раунда вытяните из мешка два шарика для настольного тенниса.
- Каждая команда решит, будут ли соединяться два химических элемента с соответствующими атомными номерами, написанными на шариках для пинг-понга.Если да, то команды должны написать на своих досках сухого стирания, какую связь они будут формировать. Если они не будут объединяться, команды должны написать на своих досках «N / A». Например, если выбраны шары для пинг-понга 11 и 17, то команды будут писать на своих досках «ионный», потому что натрий и хлор объединяются, образуя NaCl, который имеет ионные связи.
- Команды получают десять баллов за каждый правильный ответ.

- Побеждает команда, набравшая наибольшее количество очков в конце игры.
Вопросы для обсуждения
- Как определить, какие типы связи будет иметь соединение?
- Почему ученым важно знать, как элементы сочетаются?
рабочих листов по химическому связыванию и онлайн-упражнений
Расширенный поискСодержание:
Язык: AfarAbkhazAvestanAfrikaansAkanAmharicAragoneseArabicAssameseAsturianuAthabascanAvaricAymaraAzerbaijaniBashkirBelarusianBulgarianBihariBislamaBambaraBengali, BanglaTibetan стандарт, тибетский, CentralBretonBosnianCatalanChechenChamorroCorsicanCreeCzechOld церковнославянский, церковнославянский, Старый BulgarianChuvashWelshDanishGermanDivehi, Мальдивский, MaldivianDzongkhaEweGreek (современный) EnglishEsperantoSpanishEstonianBasquePersian (фарси) Фуле, фулах, пулар, PularFinnishFijianFaroeseFrenchWestern FrisianIrishScottish гэльский, GaelicGalicianGuaraníGujaratiManxHausaHebrew (современный) HindiHiri MotuCroatianHaitian, гаитянский CreoleHungarianArmenianHereroInterlinguaIndonesianInterlingueIgboNuosuInupiaqIdoIcelandicItalianInuktitutJapaneseJavaneseGeorgianKarakalpakKongoKikuyu, GikuyuKwanyama, KuanyamaKazakhKalaallisut , Гренландский, кхмерский, каннада, корейский, канури, кашмирский, курдский, коми, корнийский, киргизский, латинский, люксембургский, летцебургский, ганда, лимбургский, лимбургский, лимбургский, лингала, литовский, люба-катанга, латышский, малагасийский, маршалльский, мао riMacedonianMalayalamMongolianMarathi (маратхи) MalayMalteseBurmeseNauruanNorwegian BokmålNorthern NdebeleNepaliNdongaDutchNorwegian NynorskNorwegianSouthern NdebeleNavajo, NavahoChichewa, Chewa, NyanjaOccitanOjibwe, OjibwaOromoOriyaOssetian, OsseticEastern пенджаби, Восточная PanjabiPāliPolishPashto, PushtoPortugueseQuechuaRomanshKirundiRomanianRussianKinyarwandaSanskrit (санскрит) SardinianSindhiNorthern SamiSangoSinhalese, SinhalaSlovakSloveneSamoanShonaSomaliAlbanianSerbianSwatiSouthern SothoSundaneseSwedishSwahiliTamilTeluguTajikThaiTigrinyaTurkmenTagalogTswanaTonga (Остров Тонга) TurkishTsongaTatarTwiTahitianUyghurUkrainianUrduUzbekValencianVendaVietnameseVolapükWalloonWolofXhosaYiddishYorubaZhuang, ChuangChineseZulu Предмет:
Оценка / уровень: Возраст: 345678
Поиск: Все рабочие листы Только мои подписанные пользователи Только мои любимые рабочие листы Только мои собственные рабочие листы
.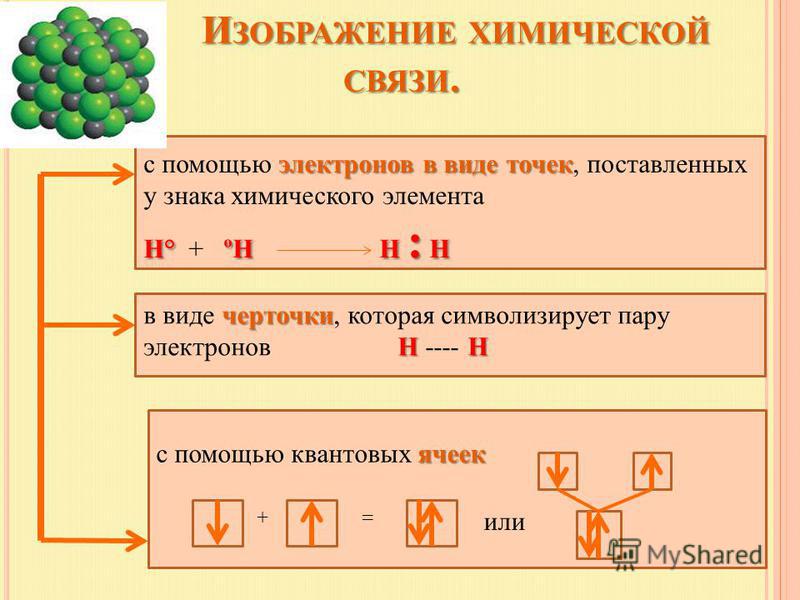

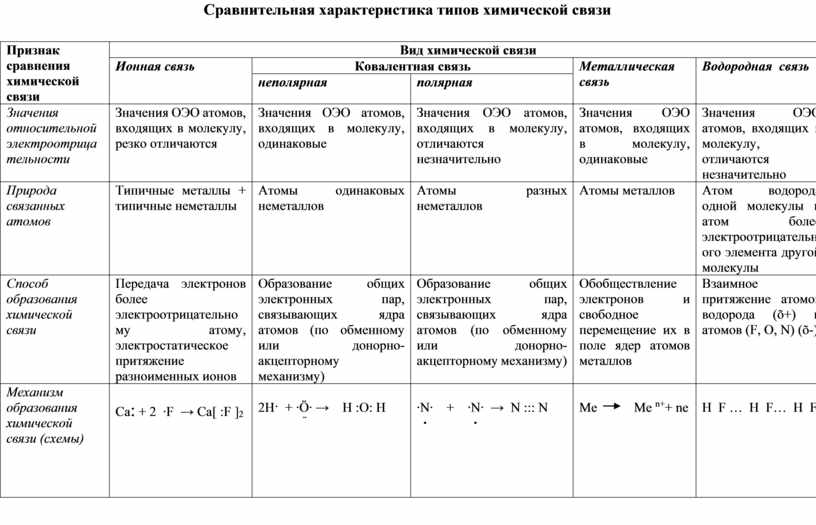


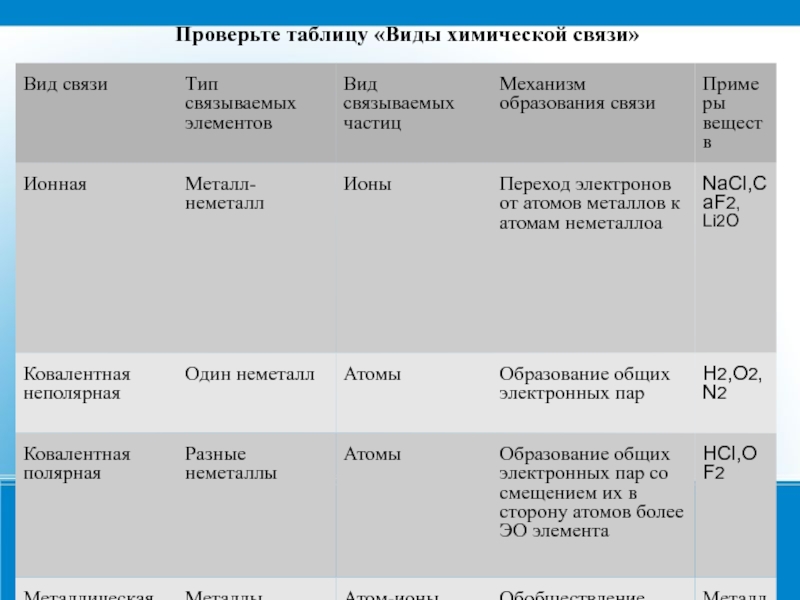 2
Атомная структура
2
Атомная структура  3
Ионы и правило октета
3
Ионы и правило октета  37, чтобы помочь вам)
37, чтобы помочь вам)  7
Периодические тенденции в атомных свойствах
7
Периодические тенденции в атомных свойствах 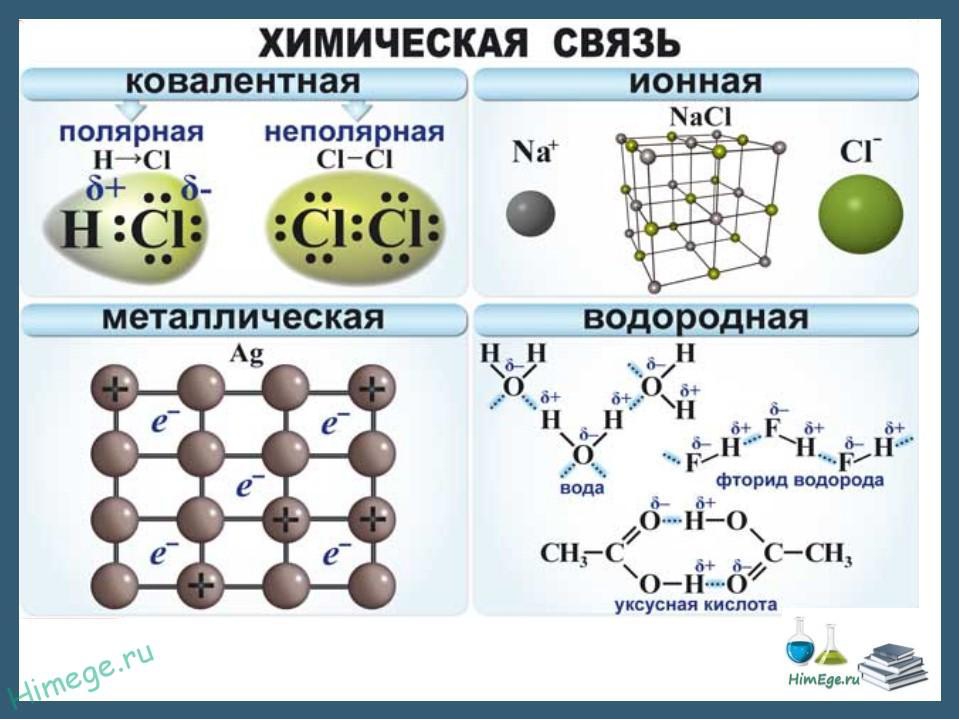 3
Химическая связь
и Электроотрицательность
3
Химическая связь
и Электроотрицательность 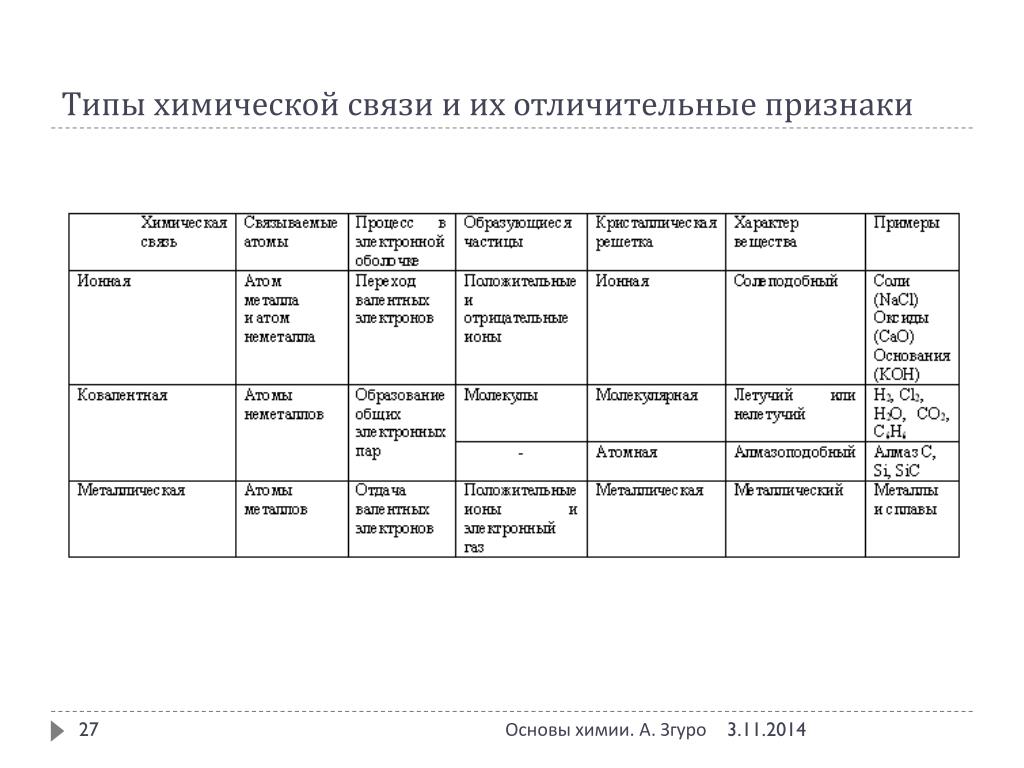 3
Химическая связь
и Электроотрицательность
3
Химическая связь
и Электроотрицательность  2
Молекулярный
Соединения
2
Молекулярный
Соединения 
 4
Межмолекулярные силы
4
Межмолекулярные силы  1
Ионные соединения
1
Ионные соединения 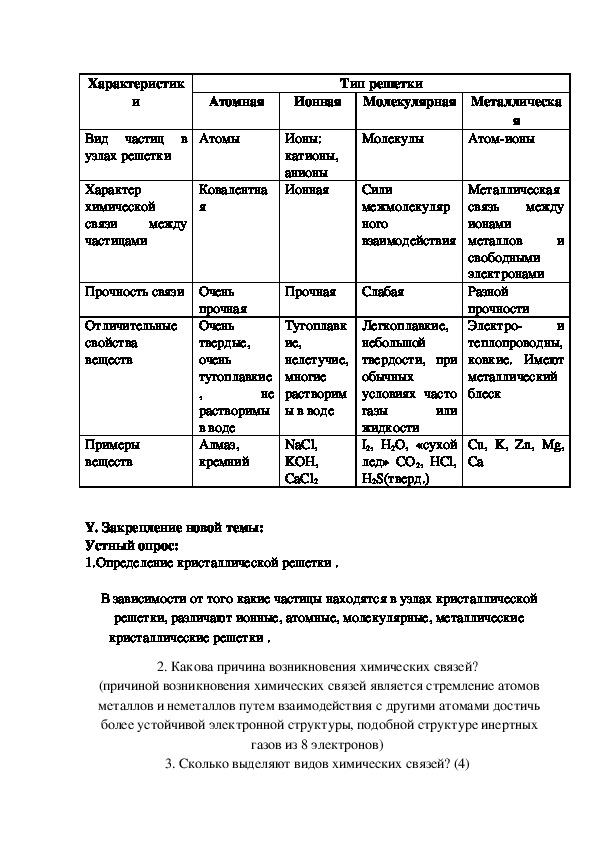 4
Химические формулы
и номенклатура (74-81)
4
Химические формулы
и номенклатура (74-81)  4
Химические формулы
и номенклатура (74-81)
4
Химические формулы
и номенклатура (74-81)  1
Введение в химические реакции
1
Введение в химические реакции  1
Введение в химические реакции
1
Введение в химические реакции  1
Введение в химические реакции
1
Введение в химические реакции