Урок №3 Лабораторная работа №5
Биология . Раздел « общая биология» Тема: «Основы цитологии» 10 класс
Технологическая карта, составленная учителем биологии МКОУ «Глядянская СОШ» Солодковой Еленой Дмитриевной
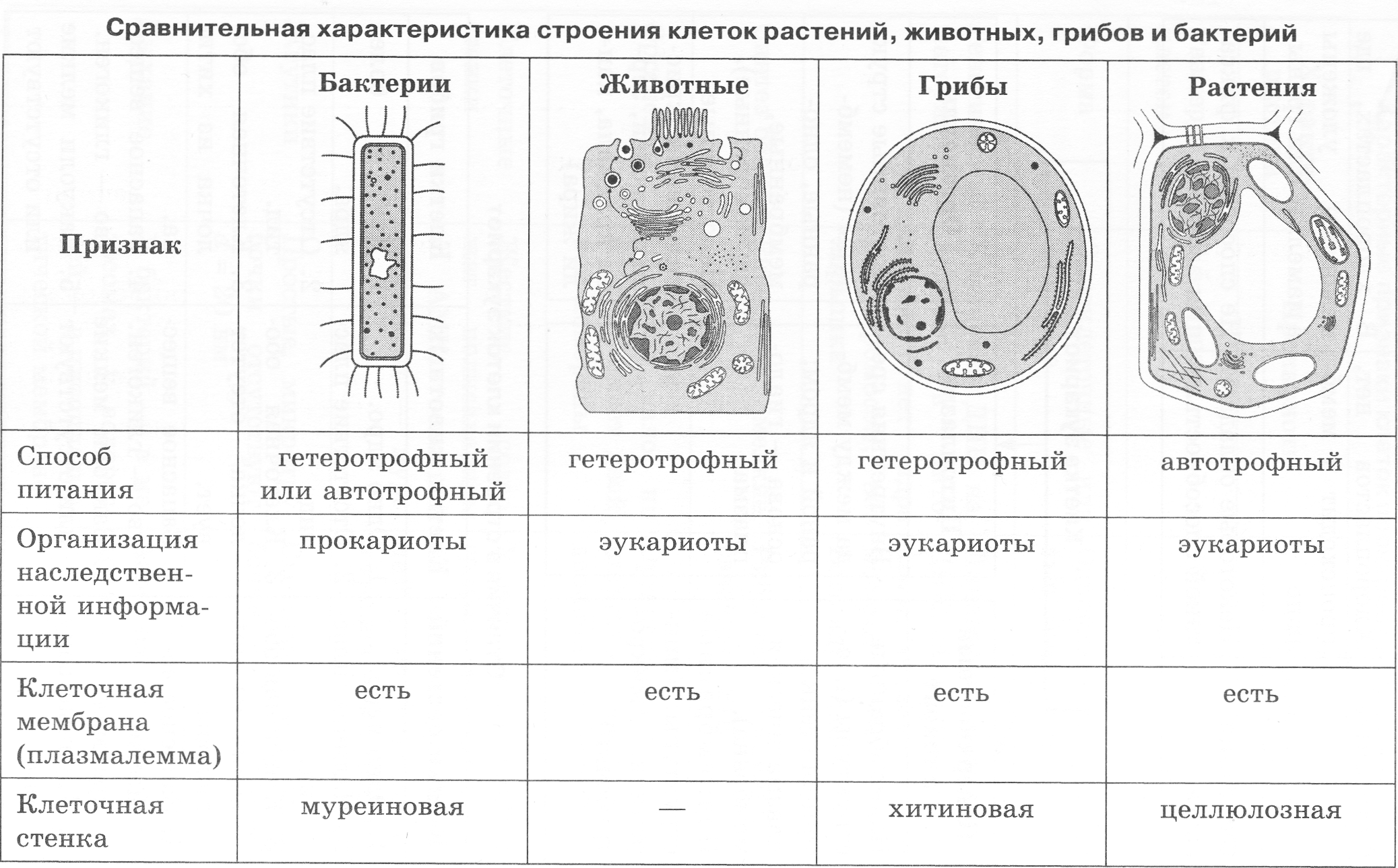
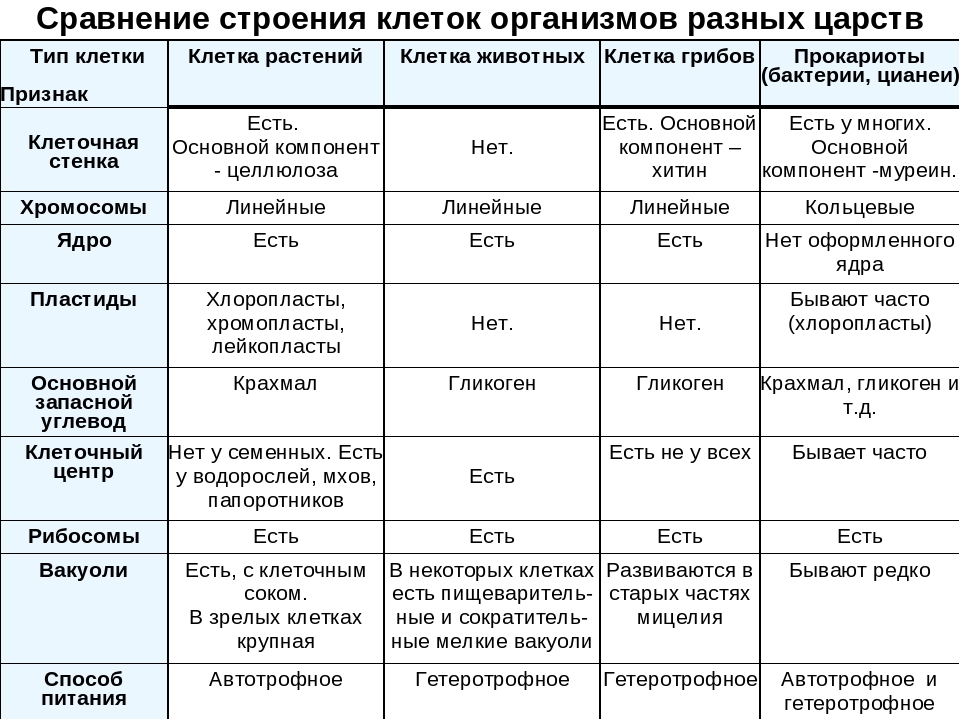
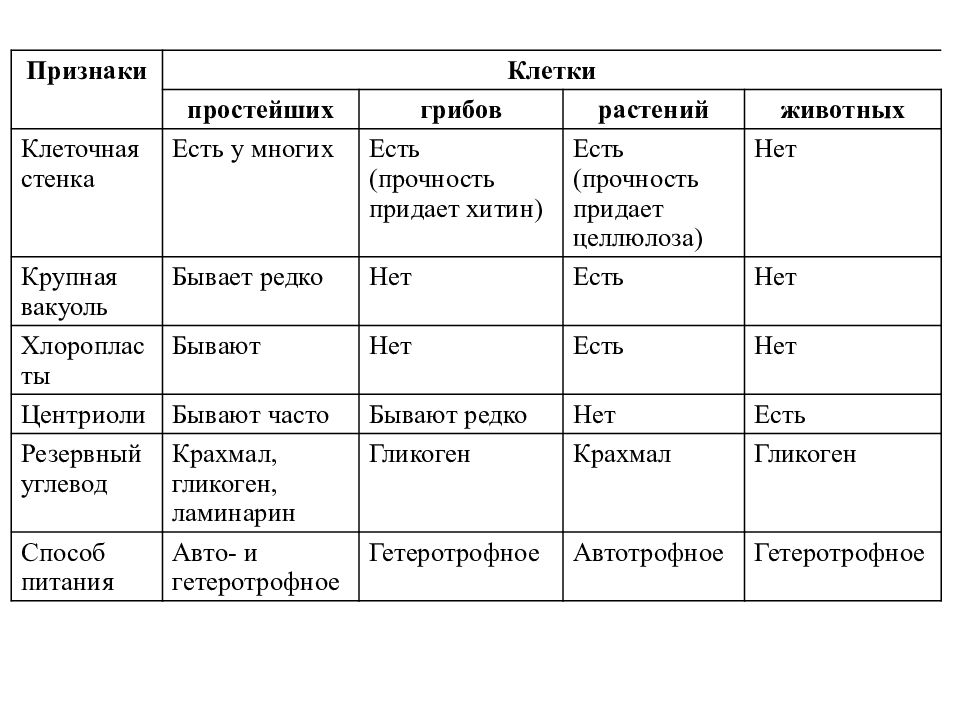
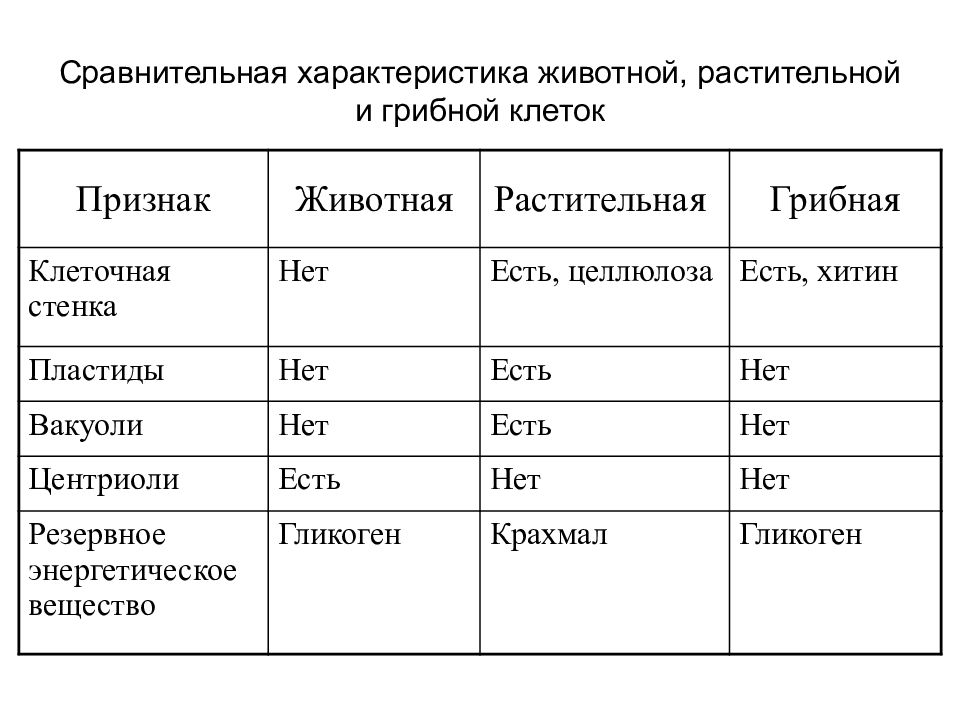
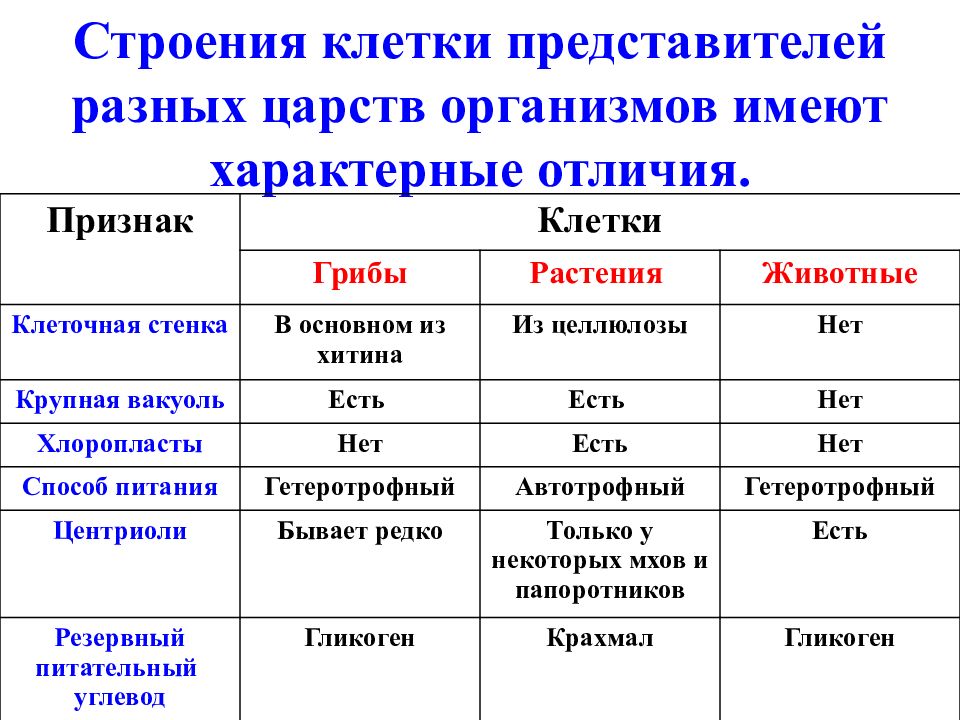
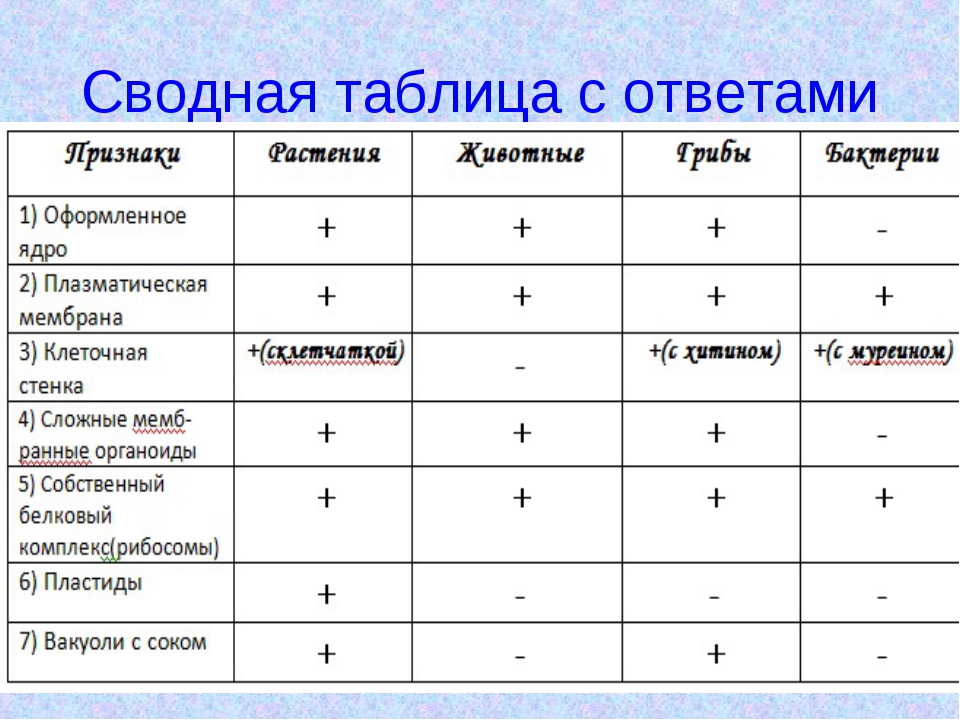
ЦельОсновываясь на знании основных положений клеточной теории, выработать у учащихся умение применять их для доказательства материального единства живой и неживой природы; продолжить формирование умений пользоваться микроскопом, готовить и рассматривать микропрепараты , находить на микропрепаратах основные органоиды клетки; сравнить клетки растений, животных, грибов и бактерий; сделать соответствующие выводы.
Задачи
Тип урока
Образовательная: Обобщить , углубить знания учащихся о строении клетки на основе сравнения прокариот и эукариот; закрепить знания об особенностях строения растительной, животной , грибной и бактериальной клеток;
Развивающая:
Воспитывающая: способствовать выработке умения осознанно трудиться над поставленной целью; бережно относиться к оптическим приборам и оборудованию; формировать аккуратность в процессе работы с оптическими приборами и оборудованием.
Урок общеметодологической направленности.
Основное содержание темы, термины и понятия
Методы и приемы
Микроскоп: штатив, тубус, окуляр, объектив, предметный столик…Микропрепарат
Растительная клетка:
наружная клеточная мембрана, клеточная стенка( целлюлоза), цитоплазма, ядро, комплекс Гольджи, рибосомы, ЭПС, митохондрии, вакуоли, хлоропласты, лизосомы;Животная клетка: наружная клеточная мембрана, ядро, клеточный центр, ЭПС, митоходрии, лизосомы, рибосомы; Грибная клетка: наружная клеточная мембрана; клеточная стенка ( хитин), ядро, митохондрии, рибосомы, ЭПС, комплекс Гольджи, Бактериальная клетка: наружная клеточная мембрана, клеточная стенка (муреин, пектин), нуклеоид, мезосомы, рибосомы;
Организационный: умение организовать самостоятельную работу учащихся в процессе выполнения лабораторной работы;
Наглядный: Микропрепараты растительной, животной, грибной и бактериальной клетки;
Таблицы со строением клеток; презентация ; рисунки и текст учебника В.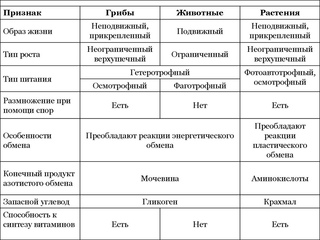 В.Пасечник « Общая биология 10- 11 класс .
В.Пасечник « Общая биология 10- 11 класс .
Словесный:
Планируемые результаты
Личностные
— сформировать познавательный интересы и мотивы, направленные на самостоятельное рассматривание под микроскопом растительной, животной, грибной и бактериальной клеток и их сравнеие;
— Сформировать интеллектуальные умения строить рассуждения, сравнивать, анализировать, делать выводы, наблюдая биологические объекты;
— воспитывать культуру общения и аккуратность в оформлении работы в тетради;
Метапредметные
Познавательные:
— овладение составляющими исследовательской деятельности, умение увидеть проблему, ставить задачи и решать их;
— умение структурировать материал , работая с микропрепаратами текстом учебника, рисунками преобразовывать информацию из одной формы в другую;
— умение находить нужную биологическую информацию в этих источниках;Регулятивные:
— умение ставить учебную задачу на основе соотнесения того, что уже известно и усвоено об основных положениях клеточной теории, строении клеток эукариот и прокариот;
— составление плана и последовательности действий при проведении лабораторной работы;
Коммуникативные:
— планировать учебное сотрудничество со сверстниками в процессе выполнения лабораторной работы
— в парах решать типовое задание на новый способ действия с проговариванием алгоритма осуществления хода лабораторной работы вслух;
Предметные
-соблюдение правил работы с биологическими приборами и инструментами;
— выделять существенных признаков строения клеток эукариот и прокариот;
— различать на таблицах и микропрепаратах частей и органоидов клеток;
— сравнивать биологические объекты, овладеть методом наблюдения, сравнивания ;
— выявить причины их сходства и различия;
— анализ и оценка глубины своих знаний;
Организация образовательного пространства
Межпредметные связи
Ресурсы
Формы работы
Информатика ( использование презентации)
Философия ( формирование материалистического взгляда на мир; Общность строения клеток эукариот и прокариот говорит об общем происходении всего живого на Земле.
Технические: компьютер, экран, мультимедия,
Микроскопы, микропрепараты растительной, животной, грибной и бактериальной клеток;
Программные: презентация, учебник В.В.Пасечник «Общая биология» 10-11 класс В.В. Пасечник и др. Таблица «Строение клеток»
фронтальная —
в паре —
ТЕХНОЛОГИЯ ИЗУЧЕНИЯ ТЕМЫ
I этап. Самоопределение к деятельности (целеполагание)
Цели деятельности
Ситуативное задание
Планируемый предметный результат
-Мобилизовать учащихся на применение знаний клеточной теории и строения клеток эукариот и прокариот на успешное выполнение лабораторной работы по сравниванию строения клеток растений, животных, грибов и бактерий;
— актуализировать, имеющиеся знания, связанные со строением клетки; основных положений клеточной теории;
-с помощью подводящего диалога учителя определяют цель и ход выполнения лабораторной работы.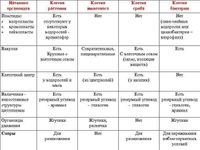
— формирование способности учащихся к новому способу действия, связанному с построением структуры изученных понятий и алгоритмов.
Учитель: Вспомним основные положения клеточной теории:
Клетка является универсальной структурной и функциональной единицей живого;
Все клетки имеют сходное строение , химический состав и общие принципы жизнедеятельности;
Клетки образуются только при делении предшествующих им клеток;
Клетки способны к самостоятельной жизнедеятельности, но в многоклеточных организмах их работа скоординирована и организм представляет собой целостную систему.
Проблемный вопрос: В ходе лабораторной работы сравнив клетки растительную , животную , грибную и бактериальную, рассматривая их на таблицах , рисунках учебника, под микроскопом установите :
— В чем заключается сходство их и различие?
-Каковы причины сходства и различия клеток различных организмов ?
— Попытайтесь объяснить как шла эволюция бактерий, животных растений и грибов.
Тема лабораторной работы:
Цель:
Оборудование:
Ход работы:
Вывод:
Запишите в тетради : тему лабораторной работы №5
«Рассматривание клетки растительной, животной, грибной и бактериальной под микроскопом»
Исходя из темы лабораторной работы, проблемных вопросов на которые вы сегодня должны ответить определите цель сегодняшней лабораторной работы. И приступайте к ее выполнению придерживаясь известного вам алгоритма выполнения лабораторных работ.
Личностный:
—На основе анализа имеющихся знаний выявить «область незнания»,
— использовать проявление познавательного эмоционального интереса и восприятия на углубление, закрепление и обобщения знаний о строении клеток эукариот и прокариот;
Предметный:
— умение оформлять лабораторную работу по уже известному алгоритму; делать выводы из полученных наблюдений строения клеток под микроскопом , на таблицах , рисунках учебника и презентации;
Познавательный:
— умение работать с текстом и понятийным аппаратом учебника;
— уметь объяснять по каким признакам организмы отличаются
Регулятивный:
Умение выполнять задания по алгоритму действий;
II этап Учебно-познавательная деятельность (изучение нового содержания)
Цели деятельности
Планируемый предметный результат
Формирование способности учащихся к новому способу действия, связанному с построением структуры, изученных понятий и алгоритмов.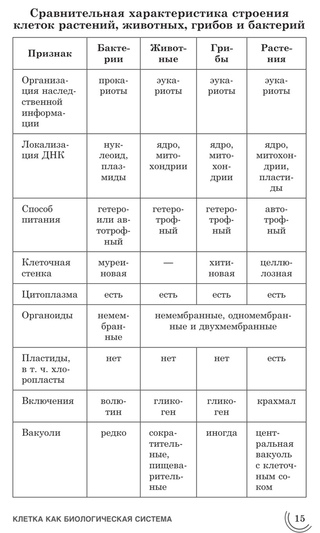
Цель: закрепить умение готовить микропрепараты и рассматривать их под микроскопом , находить особенности строения клеток различных организмов , сравнивать их между собой . Ответить на проблемные вопросы.
Оборудование: Микроскопы, предметные и покровные стекла, стаканы с водой, стеклянные палочки, листья элодеи, плесень Мукор, культура сенной палочки, готовые микропрепараты клеток многоклеточных животных.
Ход работы:
Приготовить микропрепарат листа элодеи, рассмотреть одну клетку и зарисовать ее, обозначить ее части.
Рассмотреть клетки многоклеточных животных, зарисовать одну из них и обозначить ее части?
Приготовить микропрепарат гриба Мукора. Рассмотреть его и зарисовать, обозначить основные части.
Рассмотреть микропрепарат бактерии сенной палочки и зарисовать ее.
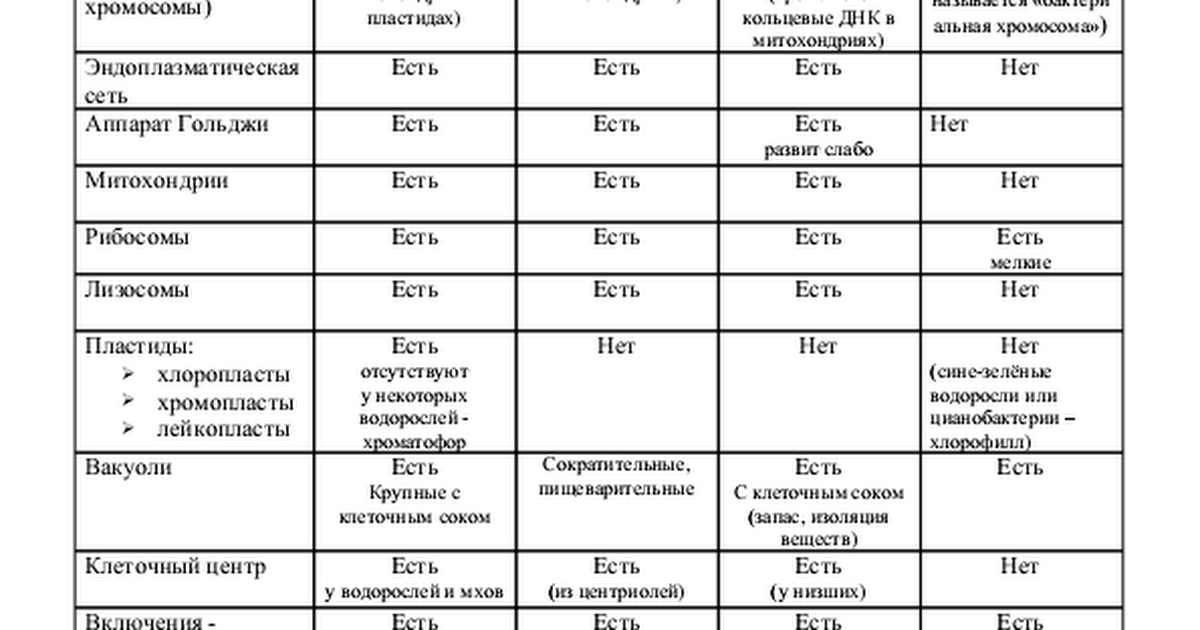
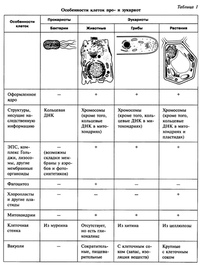
После рассматривания и сравнения клеток различных эукариот: растений, животных и грибов отметить их сходство и различие.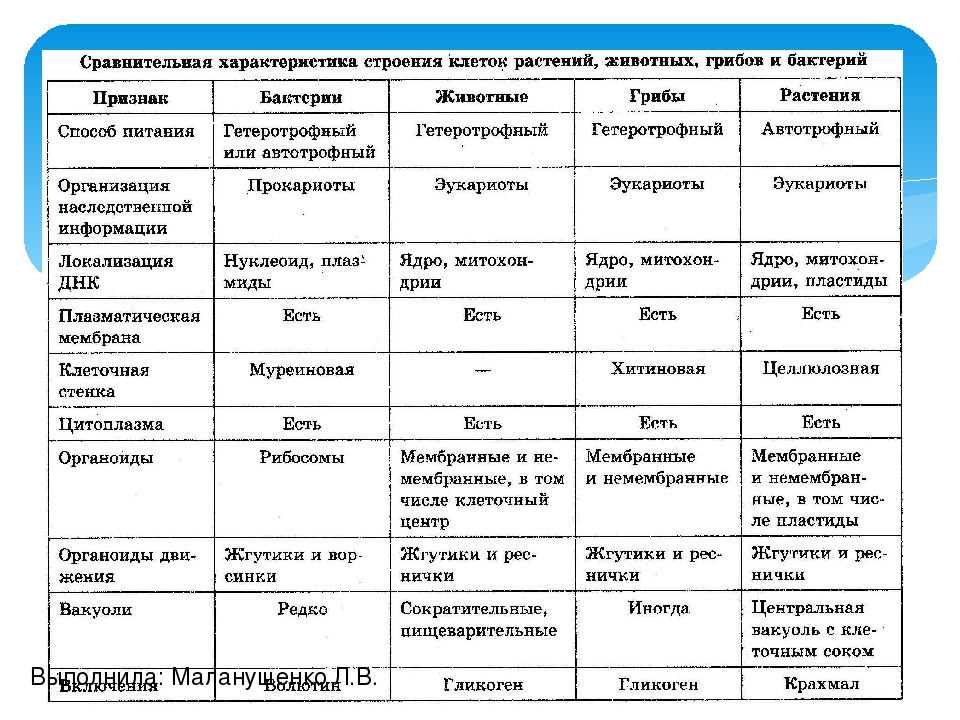 Сравнить строение клетки прокарит -бактерии сенной палочки.
Сравнить строение клетки прокарит -бактерии сенной палочки.
Сравнительную характеристику оформить в тетради в любой удобной для учащихся форме ( таблицы, схемы, тезисов).
После окончания работы исходя из цели лабораторной работы сделать вывод.
Личностный:
—На основе анализа имеющихся знаний выявить «область незнания»,
— использовать проявление познавательного эмоционального интереса и восприятия на углубление, закрепление и обобщения знаний о строении клеток эукариот и прокариот;
Предметный:
— умение оформлять лабораторную работу по уже известному алгоритму; делать выводы из полученных наблюдений строения клеток под микроскопом , на таблицах , рисунках учебника и презентации;
Познавательный:
— умение работать с текстом и понятийным аппаратом учебника;
— уметь объяснять по каким признакам организмы отличаются
Регулятивный:
Умение выполнять задания по алгоритму действий;
III этап Диагностика качества освоения темы
Цели деятельности
Планируемый предметный результат
Осуществить контроль степени усвоения изучаемого материала
Выполнение заданий в рабочей тетради
Закрепление знаний о строении клетки.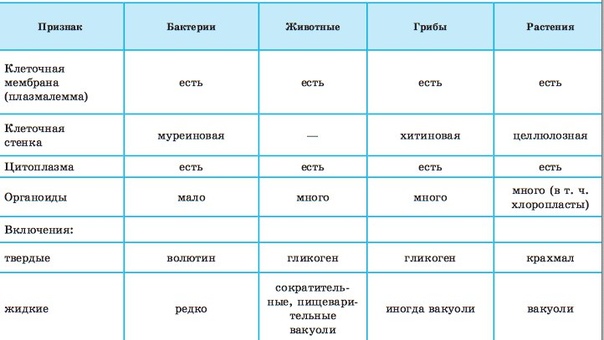
IV этап. Рефлексивная деятельность
Цели деятельности
Самоанализ и самооценка
ученика
Планируемый предметный результат
Формирование способности к рефлексии с целью последующей коррекции (фиксирование собственных затруднений деятельности и выявление их причин)
Самоанализ
I. Задание на самоанализ
Самооценка
II. Задание на самооценку. Закончите предложения:
Я доволен(льна) тем, что сегодня самостоятельно смог(ла) ………………..
Я не доволен(льна) тем, что сегодня …………………
*Заполняется учителем после освоения темы учащимися
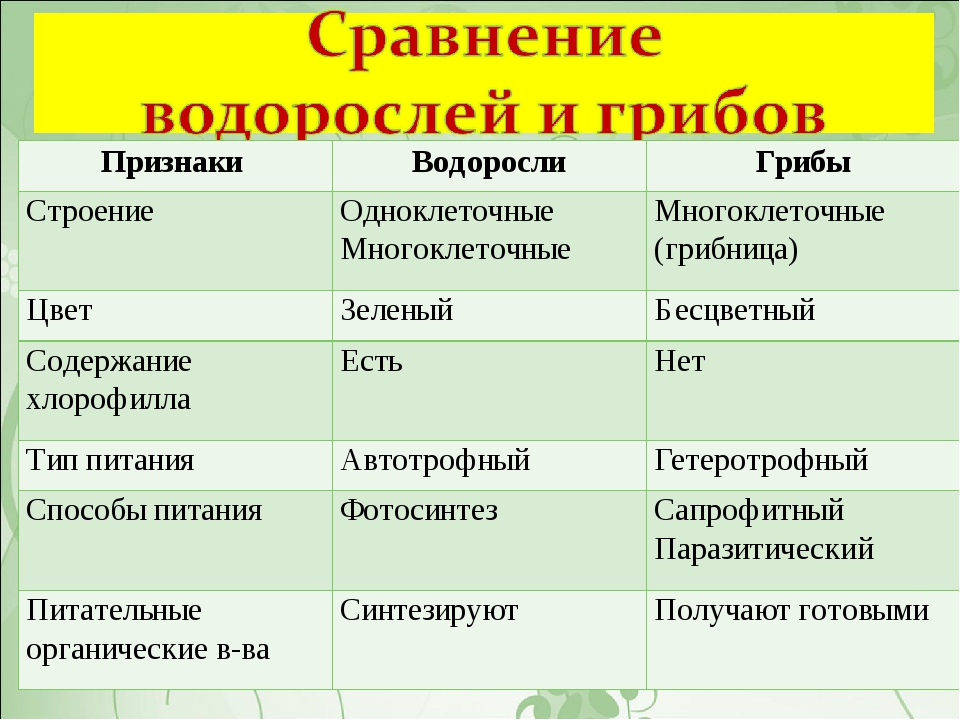
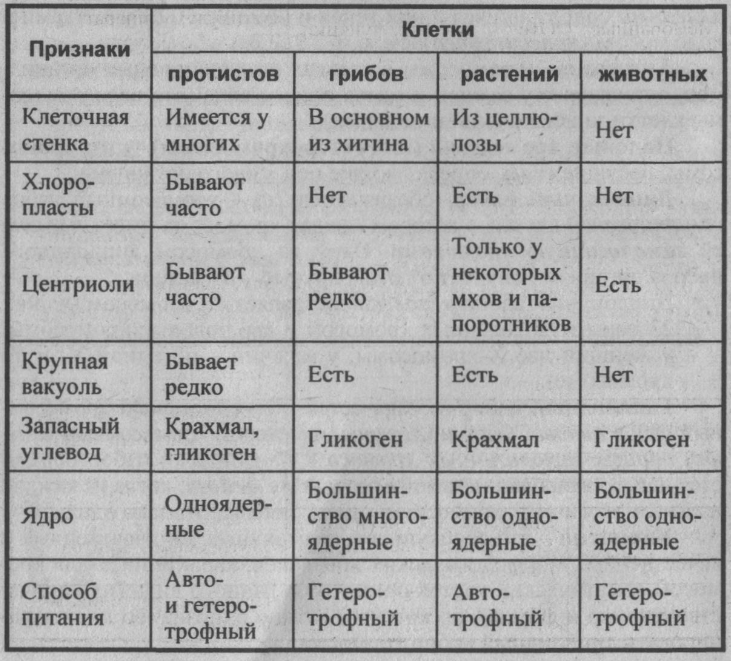
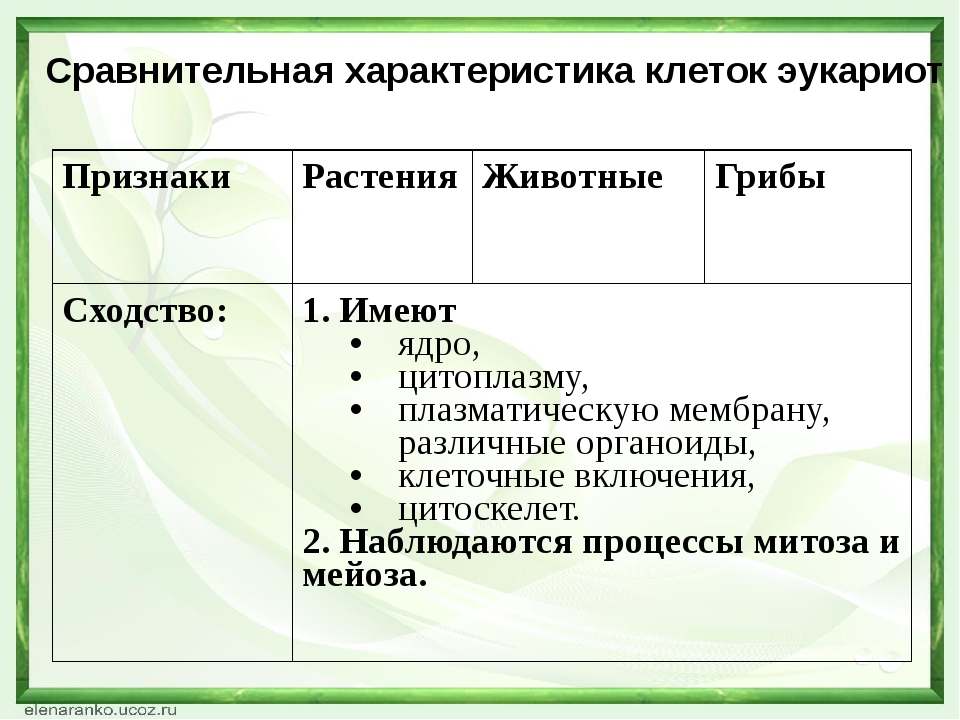
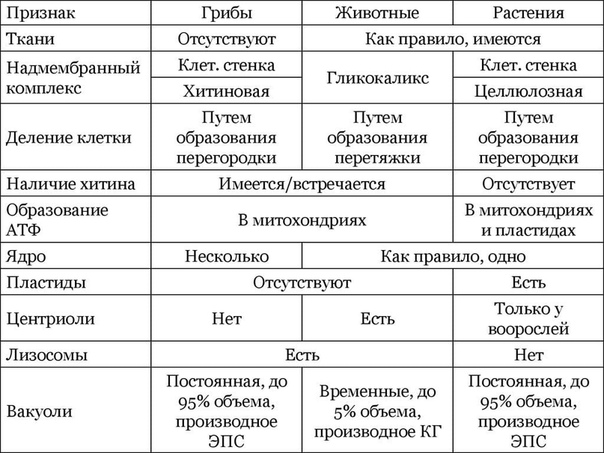
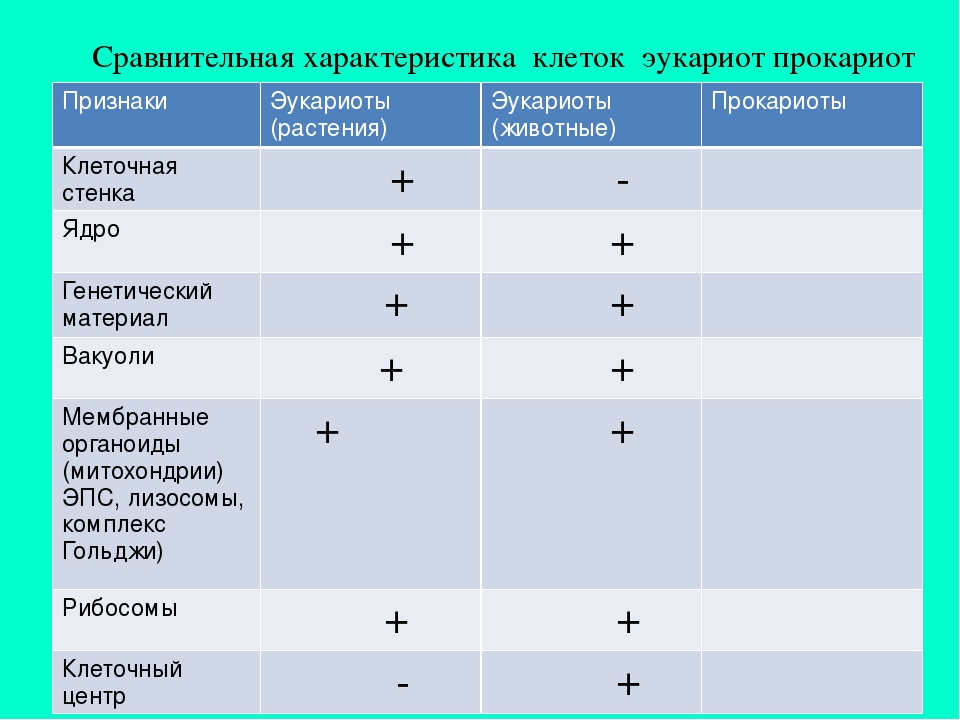
Сравнительная характеристика клеток растений, животных и грибов
1. Сравнительная характеристика клеток растений, животных и грибов.
 Презентацию
Презентациюподготовила
Назарова А. В.
Учитель биологии
3. Система органического мира
4. Империя Клеточные
ЭукариотыПрокариоты
Ядерные организмы, их
Доядерные организмы,
клетки имеют ядро хотя бы клетки которых не имеют
на одной из стадий развития. оформленного ядра.
Царство Грибы. Царство
Растения. Царство
Животные.
Царство Предъядерные.
Бактерии.
5. Строение эукариотической клетки
6. Микология – наука о грибах
Микология (от греч.«микес» — «гриб» и
«логос» – «понятие»,
«мысль») – наука,
возникшая
первоначально как
отрасль ботаники.
7. История исследований
(1831 – 1888)Генрих Антон де Бари
ботаник и микробиолог,
считается основателем
микологии. Он создал
близкую к современной
классификацию грибов и
описал механизмы их
размножения. Бари
доказал, что лишайники
состоят из клеток грибов и
водорослей.

8. Грибы (около 120 тыс. видов)
Это царство живойприроды,
объединяющее
эукариотические
организмы,
сочетающие в себе
некоторые признаки
как растений, так и
животных.
10. Сравнительная характеристика растительной, животной и грибной клеток
РастительнойЖивотной
Грибной
Сравнение клетки животных и растений
Клетка животных
d [ ES ]
k1[ E ][ S ] (k 1
dt
Клетка растений
10 до 100 мкм
Клеточная стенка
Плазматическая
k )[ ES ] 0 мембрана
2
k [ E ] [S ]
v0 2 0 0
[ S ]0 K m
Аппарат
Гольджи
Ядро
L
Ядрышко
G
RT
ЭПР
k
e K
k
Рибосома
2
(h )
N
2
G H T S
Митохондрия
pH lg[ H ]
1
Вакуоль
H
S R ln(Ct / 4)
Хлоропласт
T
m
Хлоропласты
Хлоропласты — внутриклеточные органоиды растительной клетки, в которых
осуществляется фотосинтез.

d [ ES ]
Рибосомы
k1[ E ][ S ] (k 1 k2 )[ ES ] 0
dt
Крахмальное зерно
Двойная мембрана
v0
k2 [ E ]0 [ S ]0
[ S ]0 K m
Тилакоид
Ламелла
Капля жира
e
Грана
pH lg[ H ]ДНК
G
RT
L
k
K
k
2
(h )
1
N
2
G H T S
H
Tm
S R ln(Ct / 4)
13. Особенности строения грибной клетки
14. Общая характеристика грибов
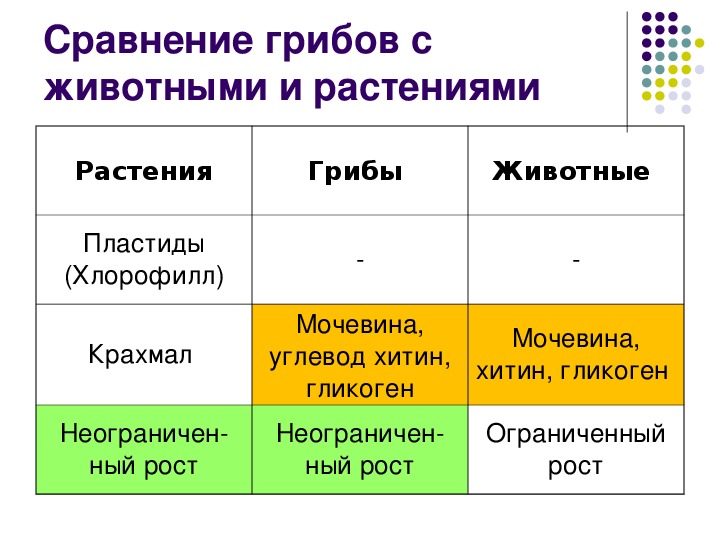
Черты сходстваС растениями
1) Неподвижны
2) Растут в течение всей жизни
3) Питание путём всасывания
(осмотрофный тип питания)
4) Имеют клеточную стенку
5) Размножаются спорами
6) Возможность синтезировать
витамины
С животными
1) Гетеротрофы
2) Отсутствие пластид и
фотосинтезирующих пигментов
3) Клеточная стенка содержит хитин, у
некоторых — целлюлозу
4) Запасное вещество – гликоген
5) Один из продуктов обмена веществ мочевина
15. Особенности строения грибов
Строение грибов разнообразно – отодноклеточных форм до сложно устроенных
шляпочных грибов.

Дрожжи
Шляпочные грибы
16. Особые признаки грибов
17. Особенности строения грибов
Тело грибов состоит из ветвящихся нитей, которыеназываются гифами (от греч. «гиф» — «ткань»,
«паутина»), а вся совокупность гиф называется
мицелием, или грибницей.
18. Грибы (для удобства микологов)
МикромицетыИмеют микроскопические
размеры, в природе их
нельзя обнаружить
невооружённым глазом.
Макромицеты
Образуются плодовые тела и
массивные сплетения
мицелия достаточно крупных
размеров, хорошо заметные
невооружённым глазом.
19. Особенности жизнедеятельности грибов
Способ питанияГетеротрофы
(питаются готовыми органическими веществами)
Хищники
убивают
жертву, а
затем
съедают её
Сапрофиты
Питаются
органическим
веществом
отмерших
организмов
Симбионты
Паразиты
Органические
вещества получают в
результате симбиоза с
другими организмами
Питаются
органическими
веществами
живых
организмов
22.
 Симбиозы Микориза (грибокорень)
Симбиозы Микориза (грибокорень)Явление микоризы было описано в
1879—1881 годах Ф. М. Каменским.
Термин «микориза» ввёл в 1885 году
Альберт Бернхард Франк.
Лишайник
(симбиоз гриба и водоросли)
24. Хищные грибы
Среди грибов существуют хищники, образующие в почве клейкиепетли, в которых запутываются мелкие черви-нематоды.
Разрастаясь грибница проникает в тело червя, высасывая из
него содержимое.
25. Среда обитания Богатая органикой почва
26. Среда обитания Продукты питания
27. Среда обитания Живые организмы
28. Значение грибов в природе
• 1. Являются пищей и лекарством для животных.• 2. Образуя грибокорень, помогают растениям
всасывать воду.
• 3. Являясь компонентом лишайников, грибы создают
среду обитания для водорослей.
• 4. Участвуют в круговороте веществ. В цепи
питания являются редуцентами – организмами,
питающимися мёртвыми органическими остатками,
подвергающими эти остатки минерализации до
простых неорганических соединений.
• 5. Разрушают древесину.
• 6. Вызывают заболевания растений и животных.
29. Положительное значение грибов в жизни человека
Съедобные грибыСлужат пищей
человеку и животным.
Известно 100 видов
съедобных грибов, но
в пищу используют
около 40.
30. Положительное значение грибов в жизни человека
С плесневых грибов (пеницилл, аспергилл)получают антибиотики — лекарства, которые
используют при многих заболеваниях.
Пеницилл
Аспергилл
31. Положительное значение грибов в жизни человека
СпорыньяИз спорыньи готовят
препараты для лечения
сердечно — сосудистых
расстройств; получают
вещество, которое
подавляет рост клеток
злокачественных
опухолей.
32. Положительное значение грибов в жизни человека
ДрожжиШироко используют
дрожжи в
хлебопечении,
виноделии,
пивоварении и
производстве спирта;
особые дрожжи
используют при
изготовлении кефира и
кумыса.
33. Положительное значение грибов в жизни человека
Грибы используютпри приготовлении
сыра, витаминов
и органических
кислот.
34. Положительное значение грибов в жизни человека
Виды грибов, паразитирующих нанасекомых, используют для борьбы
с вредителями.
Кордицепс род спорыньёвых грибов
паразитирующих на определённых
видах насекомых. Размножение
происходит путём паразитирования
на бабочках (точнее, гусеницах),
мухах и муравьях.
36. Отрицательное значение грибов в жизни человека
• Значительный ущерб наносят грибы-разрушителидревесины.
• Грибы, поражающие культурные растения,
снижают их урожаи (парша яблонь и груш и другие).
• Грибы вызывают заболевания у животных и людей
(молочница, парша, стригущий лишай и др.).
• Они могут вызвать смертельное отравление.
• Вызывают порчу продуктов питания и
непродовольственных предметов.
Многие паразитические грибы вредят здоровью
человека и народному хозяйству.
37. Грибы — паразиты
ТрутовикиЗначительный ущерб
наносят грибыразрушители древесины
38. Грибы — паразиты
ФитофтораМногие виды фитофторы
провоцируют развитие опасных
болезней растений –
фитофторозов. От
фитофтороза страдают прежде
всего представители семейства
пасленовых (томаты,
картофель, баклажан, перец), а
также земляника, клещевина,
гречиха.
39. Грибы — паразиты
Парша грушиПарша яблони
40. Грибы — паразиты
Головнёвые грибыПаразиты высших
растений. Вызывают
заболевания, при
которых растения
выглядят как бы
обугленными или
покрытыми сажей.
41. Грибы — паразиты
СпорыньяВызывает заболевания
злаков. На поражённых
колосьях появляются
чёрно-фиолетовые
рожки – склероции. При
употреблении в пищу
зерна, заражённого
грибом, у людей
развивается тяжёлое
заболевание, которое
приводило к гибели в
страшных конвульсиях.
42. Грибковые заболевания человека
Грибковые заболевания (микозы) возникают приразмножении специфических грибков в организме
человека.
43. Плесень на пищевых продуктах
44. Плесневые грибки
Плесень воздействует практически на всенезащищённые строительные и отделочные
материалы, разрушая деревянные материалы,
камень, кирпич, бетон.
45. Ядовитые грибы
При сборегрибов
необходимо
быть особенно
осторожным,
поскольку они
могут вызвать
смертельное
отравление.
47. Лабораторная работа
48. Домашнее задание
• П 19• Подготовить презентацию по одной из
предложенных тем:
• 1) Вирусы
Особенности строения клеток грибов, животных и растений.
- Осторожно, зазор!
Тема занятия:
« Жизнедеятельность бактериальной и растительной клеток »
Цели и задачи занятия:
- рассмотреть формы клеток и строение бактерий, познакомиться с процессами жизнедеятельности бактерий, их значением в природе и жизни человека
- ознакомиться с процессами жизнедеятельности растительной клетки
- раскрыть взаимосвязь между строением и функциями клетки
Фронтальный опрос
- 1.
 Половая клетка иначе называется -…
Половая клетка иначе называется -… - 2.Способность передавать признаки и свойства из поколения в поколение называется …
- 3.Полужидкое вязкое вещество клетки-это…
- 4.Хлоропласты участвуют в процессе -…
- 5.Живые организмы изучает наука-…
- 6.Клетку изучает наука-…
- 7.Основоположником эволюционной теории является ученый -…
- 8.Название науки о бактериях-…
- 9.Воспроизведение себе подобных называется …-
- 10.Элементарная структурно-функциональная единица всего живого называется …-
- 11.Клетка,содержащая оформленное ядро называется…
- 12.К органическим веществам клетки относятся нуклеиновые кислоты,белки ,жиры и …
- 13.Процесс образования органических веществ из неорганических по действием света называется…-
- 14.Животный мир изучает наука …—
- 15.Наука о наследственности и изменчивости…
Кейсы (работа в группах)
- История открытия клетки
- Бактериальная клетка
- Растительная клетка
История открытия клетки
Бактериальная клетка
Растительная клетка
По времени у нас перерыв…
Тест на тему «Растительная и бактериальная клетка»
1. Единица строения организма растений и животных
Единица строения организма растений и животных
А) Клетка
В) Ядро
С) Оболочка
Д) Вакуоль
Е) Цитоплазма
2.Содержит клеточный сок
А) Лизосома
В) Вакуоль
С) Ядро
Д) Лейкопласт
Е) Мембрана
3.Содержит клеточный сок
А) Вакуоль
В) Оболочка
С) Нуклеус
Д) Цитоплазма
Е) Ядро
4. Основные отличия бактериальной клетки от растительной заключается в:
А) отсутствие клеточной оболочки
B) отсутствие ядерного вещества
C) отсутствие цитоплазмы г) отсутствие ядра
5. Какое строение имеет бактерия?
A) одноклеточное
B) многоклеточное
C) неклеточное
6. Из каких частей состоит бактериальная клетка?
A) оболочка, ядро, цитоплазма
B) оболочка, слизистая капсула, цитоплазма
C) слизистая капсула, мембрана, цитоплазма, ядерное вещество г) слизистая капсула, мембрана, цитоплазма, ядерное вещество, пластиды
Проверьте свои ответы…
Mindmap на тему «Клетка»
- Итоги.
 Домашнее задание:
Домашнее задание:
ГДЗ по биологии для 9 класса Пасечник В.В.
1. Чем эукариоты отличаются от прокариот?
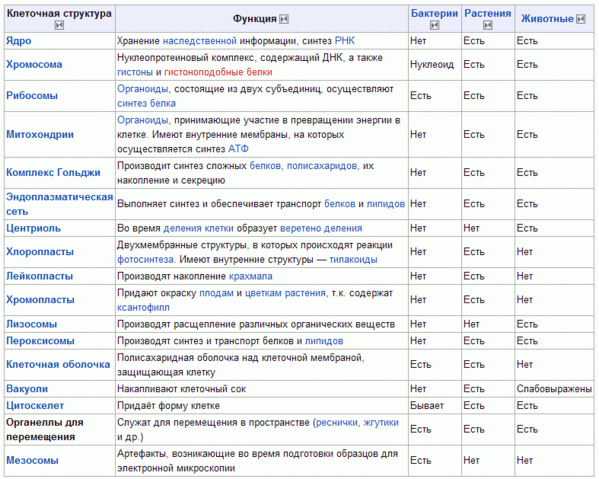
Эукариоты (ядерные) — надцарство, включающее организмы, имеющие в клетках оформленное ядро. Прокариоты (безъядерные) — надцарство, включающее организмы, не имеющие в клетках оформленное ядро. Таким образом эукариоты отличаются от прокариот наличием ядра в клетках.
2. Каковы особенности строения прокариотической клетки?
Клетки прокариот не имеют ядра, цитоскелета. Их ДНК имеет кольцеобразную форму и находится в цитоплазме.
3. Чем растительная клетка отличается от животной?
Растительная клетка поверх плазматической мембраны имеет клеточную стенку, состоящую из целлюлозы. У животной клетки клеточная стенка отсутствует. Растительные клетки, как правило, имеют большие вакуоли, заполненные клеточным соком.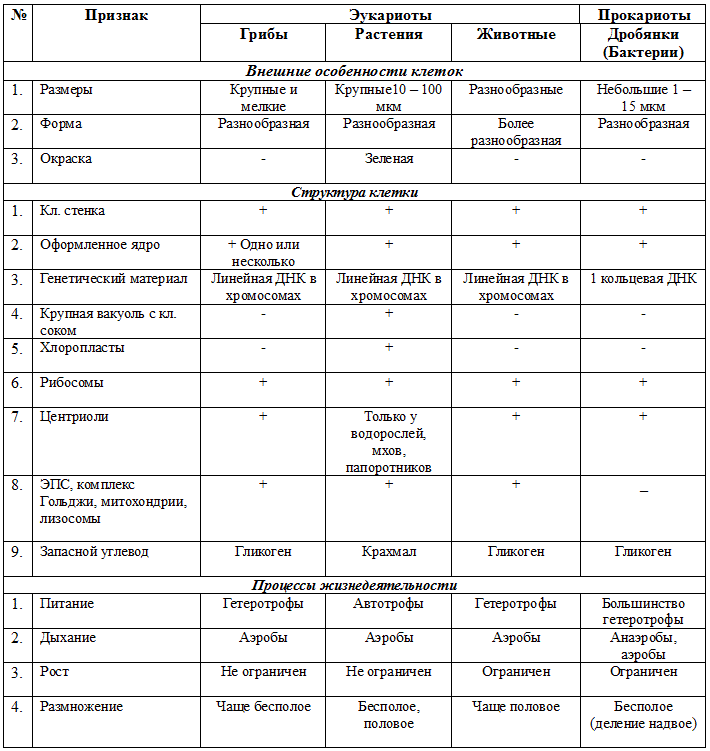 В клетках растений содержатся также различные пластиды. Запасным питательным веществом у животных является углевод гликоген, а не крахмал, как у растений.
В клетках растений содержатся также различные пластиды. Запасным питательным веществом у животных является углевод гликоген, а не крахмал, как у растений.
Используя текст на с. 31–32, составьте сравнительную таблицу «Строение клеток грибов, растений и животных».
Объясните, чем вирусы отличаются от других живых организмов.
Вирусы — это неклеточные организмы. Вирусные частицы представляют собой мельчайшие (20—300 нм) симметричные структуры, не имеющие клеточного строения. Вирус содержит нуклеиновую кислоту (ДНК или РНК), заключённую в белковую оболочку, которую называют капсидом. Вирусы не способны к самостоятельной жизнедеятельности вне клетки.
Подумайте:
— Какой опыт можно провести для того, чтобы доказать роль ядра в клетке? Предложить объект исследования и соответствующие методы.
Ответ на вопрос после 6 параграфа.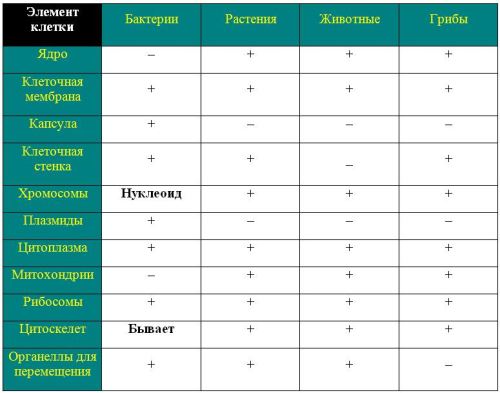
Сравнение митохондрий в растительных и животных клетках на JSTOR
Перейти к основному содержанию Есть доступ к библиотеке? Войдите через свою библиотекуВесь контент Картинки
Поиск JSTOR Регистрация Войти-
Поиск
- Расширенный поиск
- Изображения
-
Просматривать
-
По тематике
Журналы и книги -
По названию
Журналы и книги - Издатели
- Коллекции
- Изображения
-
По тематике
-
Инструменты
- Рабочее пространство
- Анализатор текста
- Серия JSTOR Understanding
- Данные для исследований
Как грибы защищаются от микробов-конкурентов и животных-хищников
Образец цитирования: Künzler M (2018) Как грибы защищаются от микробов-конкурентов и животных-хищников.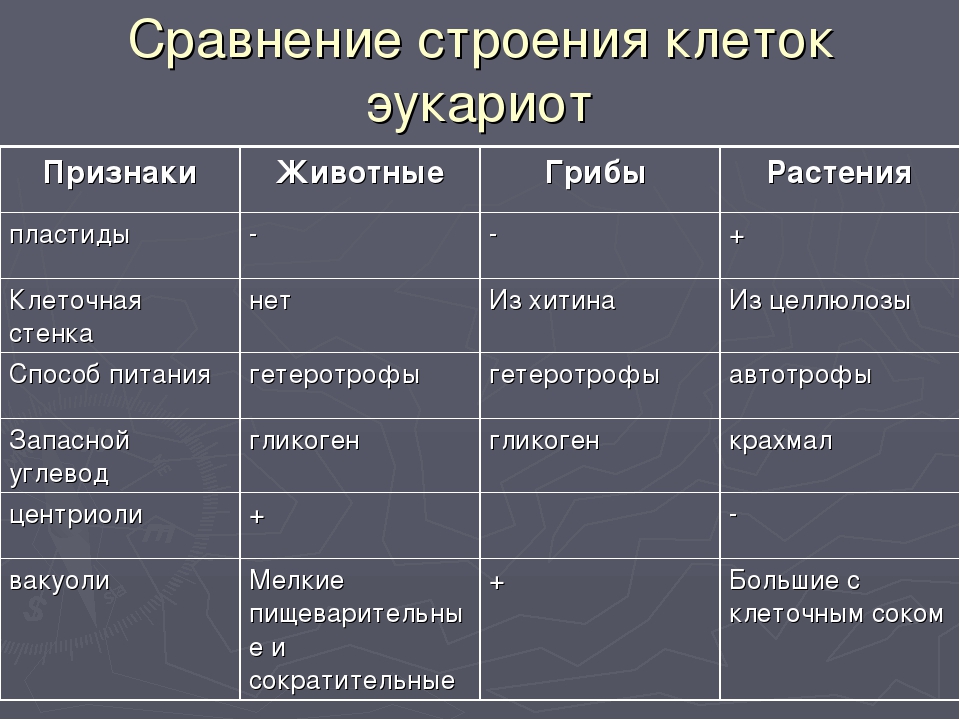 PLoS Патог 14(9):
е1007184.
https://doi.org/10.1371/journal.ppat.1007184
PLoS Патог 14(9):
е1007184.
https://doi.org/10.1371/journal.ppat.1007184
Редактор: Дебора А. Хоган, Медицинская школа Гейзеля в Дартмуте, США
Опубликовано: 6 сентября 2018 г.
Авторские права : © 2018 Маркус Кюнцлер. Это статья с открытым доступом, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника. Финансирование: Работа автора была поддержана Швейцарским национальным научным фондом (грант № 31003A_173097), Швейцарской комиссией по технологиям и инновациям (грант № 25951.2) и ETH Zürich (грант № ETH-45). 16-1). Спонсоры не участвовали в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи. Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов. Мицелиальные грибы располагают свои клетки в линейные ценоцитарные массивы, называемые гифами, которые простираются на концах и способны разветвляться и сливаться, образуя рыхлую трехмерную сеть, называемую мицелий [1].Эта архитектура представляет собой оптимальную адаптацию к осмотрофному образу жизни грибов, поскольку она максимально увеличивает поверхность для поглощения питательных веществ и позволяет грибу эффективно достигать и колонизировать свои субстраты. Некоторые гифы долгоживущего и постоянно обновляющегося вегетативного мицелия могут дифференцироваться в другие, более компактные ткани, например, в (обычно) короткоживущие и спорообразующие плодовые тела, образующиеся у дикариотических грибов при половом размножении. Различные ткани грибов подвергаются воздействию различных типов антагонистов в зависимости от экологической ниши гриба.Вегетативный мицелий сапрофитного гриба, например, подвергается воздействию других микроорганизмов, которые конкурируют за те же питательные вещества и могут питаться продуктами деградации, выделяемыми под действием гидролитических ферментов, секретируемых грибком. Грибы развили различные стратегии, чтобы повысить свою конкурентоспособность в отношении получения питательных веществ по отношению к другим микроорганизмам и защитить себя от хищничества со стороны животных. Как и у растений, основной защитной стратегией грибов является химическая защита, т. е. выработка грибом токсинов, нарушающих рост, развитие или жизнеспособность антагонистов [4].Эти защитные эффекторы включают вторичные метаболиты [5], пептиды (рибосомно или нерибосомно синтезированные) [6, 7] и белки [8] и обычно действуют путем связывания со специфическими молекулами-мишенями антагонистов (табл. Гриб представлен вегетативной мицелиальной сетью, происходящей из споры (черный овал), и плодовым телом (грибом), возникающим из этой сети. Круги показывают крупным планом конкуренцию между грибковыми гифами и бактериями (слева) и хищничество грибоядными нематодами (справа) и индукцию соответствующих эффекторов грибковой защиты; ядра грибов представлены серыми овалами, эффекторы внеклеточной антибактериальной защиты — красными квадратами, а эффекторы внутриклеточной защиты от нематод — зелеными треугольниками.Конкретные примеры антибактериальных и антинематодных эффекторов и их свойства перечислены в таблице 1. Грибковые гифы, продуцирующие два типа защитных эффекторов, окрашены соответственно. На автономную и зависимую от антагонистов продукцию защитных эффекторов указывают тонкие и толстые гифы соответственно. Указанное пространственное ограничение продукции антагонист-зависимых защитных эффекторов в грибковом мицелии является гипотетическим.
https://doi.org/10. Биосинтез эффекторов химической защиты обычно жестко регулируется, поскольку эти молекулы не являются необходимыми для жизнеспособности организма, а их биосинтез требует ресурсов, которые могут быть ограниченными [18]. Эта регуляция может быть автономной, т.е. независимой от антагониста и/или антагонистзависимой. Соответственно было показано, что регуляция вторичного метаболизма и половое развитие координируются в A . нидуланс [19]; некоторые из вторичных метаболитов, биосинтез которых ограничивается плодовым телом, проявляют токсичность по отношению к членистоногим, предполагая, что эти органы являются добычей и поэтому нуждаются в защите от животных-хищников [20]. Точно так же концентрация аматоксинов гриба Amanita phalloides , включая α-аманитин, самая низкая в вегетативном мицелии и самая высокая в плодовом теле [21]. Аналогично, полногеномный анализ экспрессии генов вегетативного мицелия и молодых плодовых тел модельного гриба C . Наличие врожденных защитных систем у многоклеточных грибов, растений и животных предполагает, что такие системы являются универсальной потребностью многоклеточных организмов. Чтобы выяснить, являются ли эти защитные системы результатом дивергентной или конвергентной эволюции, грибковая защитная система должна быть лучше охарактеризована в отношении трех ключевых вопросов врожденной защиты. Несмотря на упомянутые выше сообщения об индукции генов эффекторов защиты грибов при заражении бактериальными конкурентами и животными-хищниками, неясно, насколько специфичны эти ответы, поскольку почти не известны сигналы, рецепторы и сигнальные пути, ответственные за эти ответы. В то время как простое ранение в некоторых случаях запускает выработку грибковых защитных эффекторов [5, 29], есть несколько сообщений о молекулярных паттернах, связанных с антагонистами, воспринимаемых грибами. Эти паттерны включают фрагменты клеточной стенки [32] и сигнальные молекулы, чувствительные к кворуму [33] в случае бактерий и сигнальные молекулы развития нематод в случае животных [34]. Помимо этих растворимых сигнальных молекул или паттернов, для индукции защиты необходим физический контакт между грибком и антагонистом [23, 25].Что касается рецепторов распознавания образов, растения и животные используют два родственных набора рецепторов, а именно толл-подобные рецепторы (TLR) и рецепторы, подобные домену олигомеризации нуклеотидов (NOD) (NLR), для внеклеточного и внутриклеточного восприятия сигналов соответственно [30]. Одним из самых ранних ответов растения на травоядных (а также на атаку патогенов и паразитов) является продукция активных форм кислорода (АФК) и быстрое увеличение внутриклеточного кальция (Ca 2+ ) [40]. Аналогично грибы реагируют на биотический и абиотический стресс образованием АФК и поступлением Са 2+ в клетки, причем образование АФК зависит от НАДФН-зависимых оксидаз (Nox) [41].Поскольку Nox’ы также участвуют в дифференцировке грибов [42], эти ферменты могут играть двойную роль в развитии и защите, как показано для других многоклеточных организмов. Подобно нижестоящим сигнальным путям защитных реакций растений и животных [31], упомянутый выше MDP-рецептор в C . У растений индукция эффекторных белков защиты растений не ограничивается участками травоядных, но может распространяться на другие части того же растения или даже на соседние растения, которые еще не контактировали с антагонистом [46, 47].Это распространение защитной реакции основано на усилении первоначально воспринятого сигнала за счет образования эндогенных сигнальных молекул и передачи этих молекул внутри растения и даже другим растениям. Эндогенные сигнальные молекулы, участвующие в локальной и системной защите растений, представляют собой некоторые растительные гормоны (салициловая кислота, абсцизовая кислота, этилен) [48], оксилипины растений [49], летучие вещества зеленых листьев (GLV) [50], пептиды [51] и выше. -упомянутые АФК [52]. В дополнение к этой химической передаче сигнала этот системный защитный ответ растений также может быть опосредован деполяризацией мембраны [53].Передача сигналов внутри грибкового мицелия была изучена у некоторых аскомицетов, и было идентифицировано множество летучих и нелетучих эндогенных сигнальных молекул [54]. Первоначальная догма о том, что врожденные иммунные системы не способны создавать иммунологическую память, недавно была пересмотрена как для растений, так и для животных, и в этот процесс были вовлечены эпигенетические модификации гистонов [47, 60]. Только несколько исследований, среди двух вышеупомянутых исследований A . nidulans [26, 58] рассмотрели экологическую значимость грибковой защиты с точки зрения устойчивости грибов к выпасу. До этих исследований было показано, что A .Мутанты nidulans , лишенные основного регулятора вторичного метаболизма LaeA, и трансформанты, сверхэкспрессирующие транскрипционный фактор RsmA, более восприимчивы к выпасу на D . melanogaster личинки и более устойчивые к выпасу по F . candida соответственно [44, 62]. Соответственно, продукция афлатоксина коррелирует с приспособленностью различных изолятов Aspergillus flavus к выпасу на D . личинок melanogaster [29]. Будущая углубленная характеристика врожденной защиты грибов от микробных конкурентов и животных-хищников важна не только с точки зрения фундаментальных исследований, например эволюции врожденной защиты у эукариот, но и с точки зрения прикладных исследований. Грибы являются богатым источником химически разнообразных природных продуктов, многие из которых используются для антагонистических взаимодействий. Эти соединения имеют большой потенциал для использования в качестве лекарственных средств для борьбы с соответствующими болезнями человека или животных и вредителями.Поскольку многие из этих соединений образуются только в ответ на действие антагониста, исследования грибковых антагонистических взаимодействий являются ключом к использованию этого «сокровища природы» [63, 64]. Приношу свои извинения всем коллегам, работы которых не смогли быть процитированы в данном обзоре из-за нехватки места. 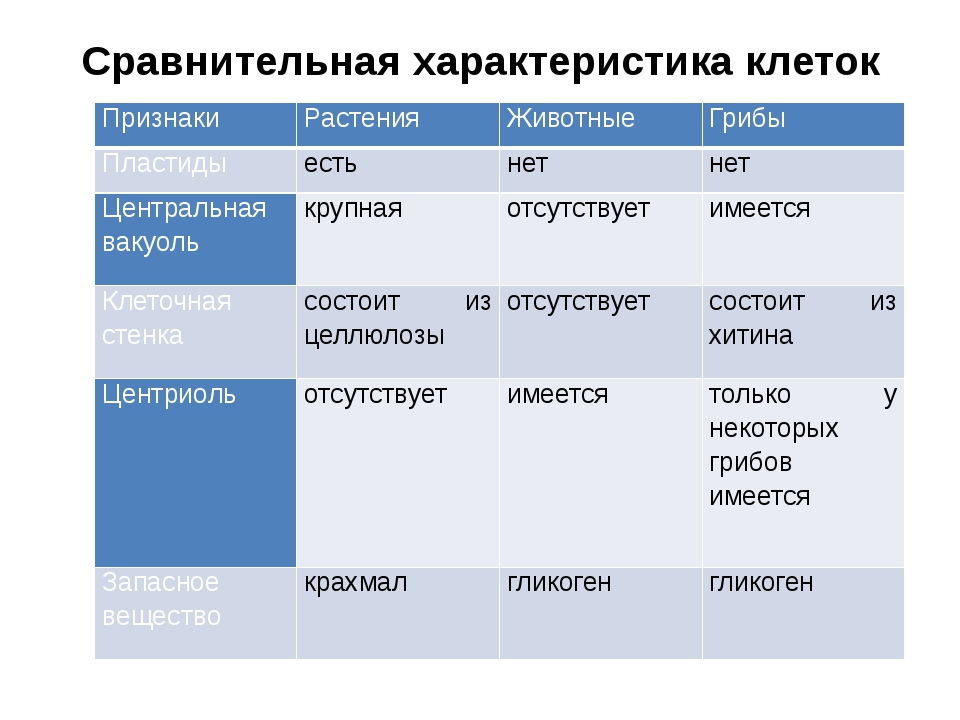
Образ жизни подвергает мицелиальные грибы воздействию антагонистов
 Соответственно, богатые питательными веществами субстраты, такие как навоз травоядных, являются полем битвы конкурирующих сапрофитных бактерий и грибов [2]. С другой стороны, отсутствие подвижности и высокое содержание питательных веществ делают как вегетативный мицелий грибов, так и плодовые тела привлекательными пищевыми ресурсами для животных-хищников.Соответственно, почвенные грибы являются важным пищевым ресурсом для почвенных членистоногих и нематод [3].
Соответственно, богатые питательными веществами субстраты, такие как навоз травоядных, являются полем битвы конкурирующих сапрофитных бактерий и грибов [2]. С другой стороны, отсутствие подвижности и высокое содержание питательных веществ делают как вегетативный мицелий грибов, так и плодовые тела привлекательными пищевыми ресурсами для животных-хищников.Соответственно, почвенные грибы являются важным пищевым ресурсом для почвенных членистоногих и нематод [3]. Основной защитной стратегией грибов является химическая защита.
 1). Было высказано предположение, что эффекторы против микробных конкурентов секретируются, тогда как эффекторы против многоклеточных хищников обычно хранятся внутри грибковых клеток и поглощаются во время хищничества (рис. 1) [9]. Примерами эффекторов грибковой защиты в соответствии с этой гипотезой являются β-лактамный антибиотик пенициллин, продуцируемый некоторыми видами Penicillium [10], противогрибковый липопептид пневмокандин B 0 , продуцируемый Glarea lozoyensis [11], и цитотоксический, рибосомально синтезированный октапептид α-аманитин, продуцируемый некоторыми видами Amanita , Galerina , Conocybe и Lepiota [12].Пенициллин секретируется, связывает и ингибирует внеклеточные ферменты, участвующие в биосинтезе пептидогликана, важном и законсервированном процессе у всех бактерий [13]. Точно так же пневмокандин B 0 секретируется и ингибирует 1,3-β-D-глюкансинтазу, один из основных ферментов, участвующих в биосинтезе клеточной стенки грибов, и поэтому называется «пенициллином противогрибковых средств» [11].
1). Было высказано предположение, что эффекторы против микробных конкурентов секретируются, тогда как эффекторы против многоклеточных хищников обычно хранятся внутри грибковых клеток и поглощаются во время хищничества (рис. 1) [9]. Примерами эффекторов грибковой защиты в соответствии с этой гипотезой являются β-лактамный антибиотик пенициллин, продуцируемый некоторыми видами Penicillium [10], противогрибковый липопептид пневмокандин B 0 , продуцируемый Glarea lozoyensis [11], и цитотоксический, рибосомально синтезированный октапептид α-аманитин, продуцируемый некоторыми видами Amanita , Galerina , Conocybe и Lepiota [12].Пенициллин секретируется, связывает и ингибирует внеклеточные ферменты, участвующие в биосинтезе пептидогликана, важном и законсервированном процессе у всех бактерий [13]. Точно так же пневмокандин B 0 секретируется и ингибирует 1,3-β-D-глюкансинтазу, один из основных ферментов, участвующих в биосинтезе клеточной стенки грибов, и поэтому называется «пенициллином противогрибковых средств» [11]. Напротив, α-аманитин поглощается грибковой клеткой при хищничестве и проникает в эпителиальные клетки пищеварительного тракта животных-хищников, где он связывает и инактивирует важный и консервативный ядерный фермент РНК-полимеразу II [14].Исключением из гипотезы является ряд секретируемых инсектицидных и нематоцидных вторичных метаболитов [15]. В дополнение к действию токсинов у грибов есть более тонкие способы химической защиты, например, путем производства молекул, препятствующих коммуникации между бактериями и животными. Примерами являются внутриклеточные лактоназы копрофильного гриба Coprinopsis cinerea , выступающие в качестве стока для сигналов определения кворума грамотрицательных бактерий [16], и продукция ювенильных гормонов насекомых плесенью Aspergillus nidulans [17].
Напротив, α-аманитин поглощается грибковой клеткой при хищничестве и проникает в эпителиальные клетки пищеварительного тракта животных-хищников, где он связывает и инактивирует важный и консервативный ядерный фермент РНК-полимеразу II [14].Исключением из гипотезы является ряд секретируемых инсектицидных и нематоцидных вторичных метаболитов [15]. В дополнение к действию токсинов у грибов есть более тонкие способы химической защиты, например, путем производства молекул, препятствующих коммуникации между бактериями и животными. Примерами являются внутриклеточные лактоназы копрофильного гриба Coprinopsis cinerea , выступающие в качестве стока для сигналов определения кворума грамотрицательных бактерий [16], и продукция ювенильных гормонов насекомых плесенью Aspergillus nidulans [17].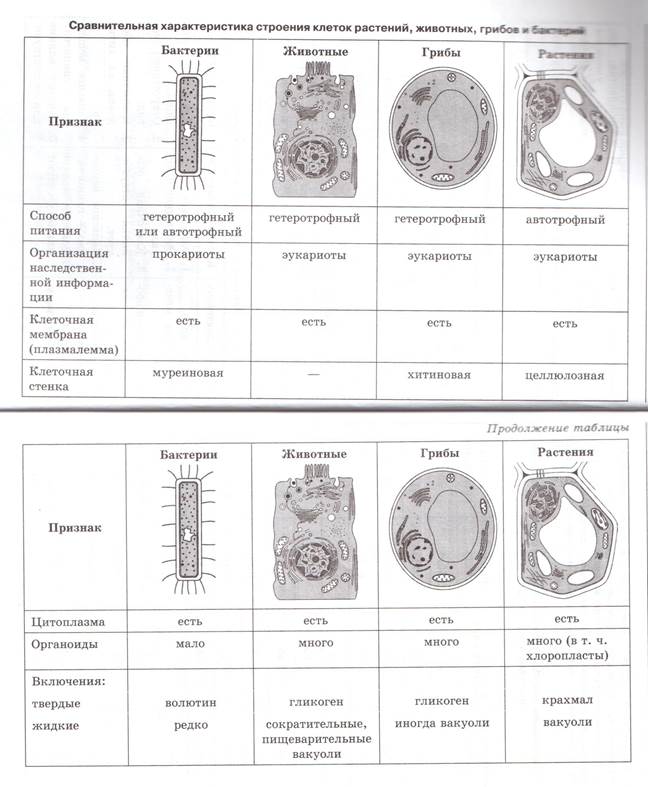
 1371/journal.ppat.1007184.g001
1371/journal.ppat.1007184.g001 Грибковая защита может быть автономной и/или зависимой от антагонистов
 cinerea показал, что секретируемый антибактериальный пептид Copsin продуцируется почти исключительно вегетативным мицелием, тогда как большая часть C . Гены cinerea , кодирующие внутриклеточные инсектицидные и нематоцидные лектины, специфически экспрессируются в плодовом теле (рис. 1) [22]. Эта пространственно-временная автономная регуляция приводит к эффективной конститутивной защите специфических грибковых тканей от наиболее релевантных антагонистов, поскольку некоторые защитные эффекторы уже действуют, когда антагонист атакует грибок.С другой стороны, по крайней мере некоторые из генов, кодирующих лектины, направленные против животных-хищников, индуцировались у C . cinerea вегетативного мицелия при заражении этой ткани грибоядной нематодой [23]. Аналогично, заражение вегетативного мицелия базидиомицета Oudemansiella murata двумя разными Penicillium spp. индуцировал выработку противогрибкового стробилурина А [24], а заражение различных аскомицетообразных плесеней бактериями и членистоногими приводило к индукции различных кластеров генов, кодирующих механизмы биосинтеза противомикробных и цитотоксических вторичных метаболитов соответственно [25–29].
cinerea показал, что секретируемый антибактериальный пептид Copsin продуцируется почти исключительно вегетативным мицелием, тогда как большая часть C . Гены cinerea , кодирующие внутриклеточные инсектицидные и нематоцидные лектины, специфически экспрессируются в плодовом теле (рис. 1) [22]. Эта пространственно-временная автономная регуляция приводит к эффективной конститутивной защите специфических грибковых тканей от наиболее релевантных антагонистов, поскольку некоторые защитные эффекторы уже действуют, когда антагонист атакует грибок.С другой стороны, по крайней мере некоторые из генов, кодирующих лектины, направленные против животных-хищников, индуцировались у C . cinerea вегетативного мицелия при заражении этой ткани грибоядной нематодой [23]. Аналогично, заражение вегетативного мицелия базидиомицета Oudemansiella murata двумя разными Penicillium spp. индуцировал выработку противогрибкового стробилурина А [24], а заражение различных аскомицетообразных плесеней бактериями и членистоногими приводило к индукции различных кластеров генов, кодирующих механизмы биосинтеза противомикробных и цитотоксических вторичных метаболитов соответственно [25–29]. Эти результаты предполагают, что грибы обладают, помимо автономной тканеспецифической защиты, также индуцируемой защитой (рис. 1). Этот тип регуляции также известен из систем врожденной защиты растений и животных [30].
Эти результаты предполагают, что грибы обладают, помимо автономной тканеспецифической защиты, также индуцируемой защитой (рис. 1). Этот тип регуляции также известен из систем врожденной защиты растений и животных [30]. Открытые вопросы
Какова пластичность и специфичность индуцированной химической защиты?
 Это отличается от растений и животных, у которых были идентифицированы сложные и многослойные системы рецепторов и сигнальных путей, ответственных за распознавание ассоциированных с антагонистами молекулярных паттернов или эффекторов и индукцию специфических для антагонистов врожденных защитных реакций [31].
Это отличается от растений и животных, у которых были идентифицированы сложные и многослойные системы рецепторов и сигнальных путей, ответственных за распознавание ассоциированных с антагонистами молекулярных паттернов или эффекторов и индукцию специфических для антагонистов врожденных защитных реакций [31]. , 35]. Связывание молекулярных паттернов этими рецепторами часто опосредуется доменами с богатыми лейцином повторами (LRR). Помимо хорошо охарактеризованных рецепторов, связанных с G-белком, для эндогенных половых феромонов, существует лишь несколько сообщений о грибковых рецепторах для специфических биотических сигналов.Интересно, что недавно было показано, что хемотропное восприятие сигналов растения-хозяина растительным патогенным грибом Fusarium oxysporum опосредуется рецептором полового феромона [36], что позволяет предположить, что эти рецепторы могут иметь более широкую специфичность. Однако ни одна из более чем 600 известных в настоящее время последовательностей генома грибов не кодирует TLR. Показано, что рост гиф анималопатогенных дрожжей Candida albicans запускается прямым взаимодействием бактериальных мурамилдипептидов (МДП) с LRR внутриклеточного белка-рецептора грибов, содержащего, кроме того, протеинфосфатазу и аденилатциклазный домен. 32].Этот механизм распознавания подобен связыванию MDP с рецептором NLR-типа млекопитающих NOD2, который запускает воспаление в ответ на бактериальные инфекции и чьи генетические вариации вовлечены в восприимчивость к болезни Крона [37].
, 35]. Связывание молекулярных паттернов этими рецепторами часто опосредуется доменами с богатыми лейцином повторами (LRR). Помимо хорошо охарактеризованных рецепторов, связанных с G-белком, для эндогенных половых феромонов, существует лишь несколько сообщений о грибковых рецепторах для специфических биотических сигналов.Интересно, что недавно было показано, что хемотропное восприятие сигналов растения-хозяина растительным патогенным грибом Fusarium oxysporum опосредуется рецептором полового феромона [36], что позволяет предположить, что эти рецепторы могут иметь более широкую специфичность. Однако ни одна из более чем 600 известных в настоящее время последовательностей генома грибов не кодирует TLR. Показано, что рост гиф анималопатогенных дрожжей Candida albicans запускается прямым взаимодействием бактериальных мурамилдипептидов (МДП) с LRR внутриклеточного белка-рецептора грибов, содержащего, кроме того, протеинфосфатазу и аденилатциклазный домен. 32].Этот механизм распознавания подобен связыванию MDP с рецептором NLR-типа млекопитающих NOD2, который запускает воспаление в ответ на бактериальные инфекции и чьи генетические вариации вовлечены в восприимчивость к болезни Крона [37]. NLR участвуют в реакции гетеронесовместимости между разными штаммами одного и того же вида грибов, и было высказано предположение, что эти белки, широко распространенные среди грибов [38], также могут играть роль в восприятии грибов-антагонистов, сходных с растениями. и животных [39].Насколько нам известно, экспериментальных подтверждений этой гипотезы пока нет.
NLR участвуют в реакции гетеронесовместимости между разными штаммами одного и того же вида грибов, и было высказано предположение, что эти белки, широко распространенные среди грибов [38], также могут играть роль в восприятии грибов-антагонистов, сходных с растениями. и животных [39].Насколько нам известно, экспериментальных подтверждений этой гипотезы пока нет.  albicans предполагает передачу сигналов ниже по течению посредством фосфорилирования/дефосфорилирования белка и цАМФ [32]. Соответственно, было показано, что митоген-активируемая протеинкиназа с высокой осмолярностью глицерина (Hog1p) дрожжей Saccharomyces cerevisiae фосфорилируется в ответ на бактериальный липополисахарид (ЛПС) [43].Что касается факторов транскрипции, участвующих в реакции грибов на антагонисты, насколько нам известно, до сих пор сообщалось только об одном примере. Сверхэкспрессия транскрипционного фактора восстановления вторичного метаболизма (RsmA) в A . nidulans приводят к индукции транскрипционного фактора регулятора биосинтеза афлатоксина (AflR), что, в свою очередь, приводит к усилению экспрессии кластера генов вторичного метаболита против хищников и избеганию трансформированного мицелия с помощью Folsomia candida [44].Кроме того, бархатное семейство грибных регуляторов, участвующих в упомянутой выше координации вторичного метаболизма и полового развития у одного и того же гриба, содержит ДНК-связывающий домен, структурно родственный основному транскрипционному фактору NF-κB на конце TLR-сигнальный каскад животных [45].
albicans предполагает передачу сигналов ниже по течению посредством фосфорилирования/дефосфорилирования белка и цАМФ [32]. Соответственно, было показано, что митоген-активируемая протеинкиназа с высокой осмолярностью глицерина (Hog1p) дрожжей Saccharomyces cerevisiae фосфорилируется в ответ на бактериальный липополисахарид (ЛПС) [43].Что касается факторов транскрипции, участвующих в реакции грибов на антагонисты, насколько нам известно, до сих пор сообщалось только об одном примере. Сверхэкспрессия транскрипционного фактора восстановления вторичного метаболизма (RsmA) в A . nidulans приводят к индукции транскрипционного фактора регулятора биосинтеза афлатоксина (AflR), что, в свою очередь, приводит к усилению экспрессии кластера генов вторичного метаболита против хищников и избеганию трансформированного мицелия с помощью Folsomia candida [44].Кроме того, бархатное семейство грибных регуляторов, участвующих в упомянутой выше координации вторичного метаболизма и полового развития у одного и того же гриба, содержит ДНК-связывающий домен, структурно родственный основному транскрипционному фактору NF-κB на конце TLR-сигнальный каскад животных [45].
Есть ли системная защитная реакция и подготовка?
 Например, конидиация аскомицетной плесени Trichoderma зависит от 1-октен-3-ола [55], летучего соединения, которое также продуцируется базидиомицетами [56]; оксилипины, известные как эндогенные сигнальные молекулы у растений и животных, также известны как эндогенные сигнальные молекулы, модулирующие половое развитие и взаимодействие патогенных грибов с хозяином [57].Однако мало что известно о роли таких молекул в защите от грибков. Интересно, что два гена, кодирующие оксигеназы жирных кислот, участвуют в биосинтезе оксилипинов у A . nidulans индуцируются при поедании мицелия личинками плодовой мушки Drosophila melanogaster [58], что указывает на возможную двойную функцию этих сигнальных молекул в развитии и защите, как предполагается для мхов [59]. Пространственное распределение и распространение индуцированной защитной реакции внутри грибного мицелия до сих пор не изучены.
Например, конидиация аскомицетной плесени Trichoderma зависит от 1-октен-3-ола [55], летучего соединения, которое также продуцируется базидиомицетами [56]; оксилипины, известные как эндогенные сигнальные молекулы у растений и животных, также известны как эндогенные сигнальные молекулы, модулирующие половое развитие и взаимодействие патогенных грибов с хозяином [57].Однако мало что известно о роли таких молекул в защите от грибков. Интересно, что два гена, кодирующие оксигеназы жирных кислот, участвуют в биосинтезе оксилипинов у A . nidulans индуцируются при поедании мицелия личинками плодовой мушки Drosophila melanogaster [58], что указывает на возможную двойную функцию этих сигнальных молекул в развитии и защите, как предполагается для мхов [59]. Пространственное распределение и распространение индуцированной защитной реакции внутри грибного мицелия до сих пор не изучены. Насколько нам известно, единственными сообщениями о персистентности усиленного защитного ответа в мицелии в отсутствие антагониста, явления, называемого у растений и животных праймингом, являются два исследования Rohlfs и соавт. [26, 58]. В этих исследованиях авторы показывают, что выпас на D . melanogaster личинки и почвенные членистоногие F . candida индуцирует устойчивость мицелия к выпасу этих хищников даже после 6-часового периода без выпаса. Эти результаты позволяют предположить, что индукция химической защиты у грибов сохраняется в течение некоторого времени, чтобы защитить мицелий от дальнейшего повреждения хищниками. Однако нет данных о пространственном распределении этой защитной реакции в мицелии. Интересно, что индукция зависит от главного регулятора вторичного метаболизма, системы LaeA-velvet, которая, как известно, действует через метилирование гистонов [19], что указывает на эпигенетический механизм индукции и праймирования защитных генов.
Насколько нам известно, единственными сообщениями о персистентности усиленного защитного ответа в мицелии в отсутствие антагониста, явления, называемого у растений и животных праймингом, являются два исследования Rohlfs и соавт. [26, 58]. В этих исследованиях авторы показывают, что выпас на D . melanogaster личинки и почвенные членистоногие F . candida индуцирует устойчивость мицелия к выпасу этих хищников даже после 6-часового периода без выпаса. Эти результаты позволяют предположить, что индукция химической защиты у грибов сохраняется в течение некоторого времени, чтобы защитить мицелий от дальнейшего повреждения хищниками. Однако нет данных о пространственном распределении этой защитной реакции в мицелии. Интересно, что индукция зависит от главного регулятора вторичного метаболизма, системы LaeA-velvet, которая, как известно, действует через метилирование гистонов [19], что указывает на эпигенетический механизм индукции и праймирования защитных генов. Соответственно, индукция связанных с защитой кластеров метаболических генов в A . Было показано, что бактериями nidulans происходит ацетилирование гистонов [61].
Соответственно, индукция связанных с защитой кластеров метаболических генов в A . Было показано, что бактериями nidulans происходит ацетилирование гистонов [61]. Каково экологическое значение защиты от грибков?
Актуальность и влияние
Благодарности
Каталожные номера
 Stajich JE, Berbee ML, Blackwell M, Hibbett DS, James TY, Spatafora JW, et al. Грибы. Карр Биол.2009;19(18):R840–5. пмид: 19788875; Центральный PMCID в PubMed: PMC2913116.
Stajich JE, Berbee ML, Blackwell M, Hibbett DS, James TY, Spatafora JW, et al. Грибы. Карр Биол.2009;19(18):R840–5. пмид: 19788875; Центральный PMCID в PubMed: PMC2913116.  Исследование биосинтеза фомопсинов выявило широко распространенный путь образования природных продуктов рибосом у аскомицетов.Proc Natl Acad Sci U S A. 2016;113(13):3521–6. пмид: 26979951; Центральный PMCID в PubMed: PMC4822579.
Исследование биосинтеза фомопсинов выявило широко распространенный путь образования природных продуктов рибосом у аскомицетов.Proc Natl Acad Sci U S A. 2016;113(13):3521–6. пмид: 26979951; Центральный PMCID в PubMed: PMC4822579.  Генетика грибов Биол. 2007;44(9):830–44. пмид: 17548217.
Генетика грибов Биол. 2007;44(9):830–44. пмид: 17548217.  Proc Natl Acad Sci U S A. 2002;99(3):1218–22. пмид:11805306; Центральный PMCID в PubMed: PMC122170.
Proc Natl Acad Sci U S A. 2002;99(3):1218–22. пмид:11805306; Центральный PMCID в PubMed: PMC122170.  Мелдау С., Эрб М., Болдуин ИТ. Защита по требованию: механизмы оптимальной защиты. Энн Бот. 2012;110(8):1503–14. Эпублик от 02.10.2012. doi: mcs212 [pii] pmid: 23022676.
Мелдау С., Эрб М., Болдуин ИТ. Защита по требованию: механизмы оптимальной защиты. Энн Бот. 2012;110(8):1503–14. Эпублик от 02.10.2012. doi: mcs212 [pii] pmid: 23022676. 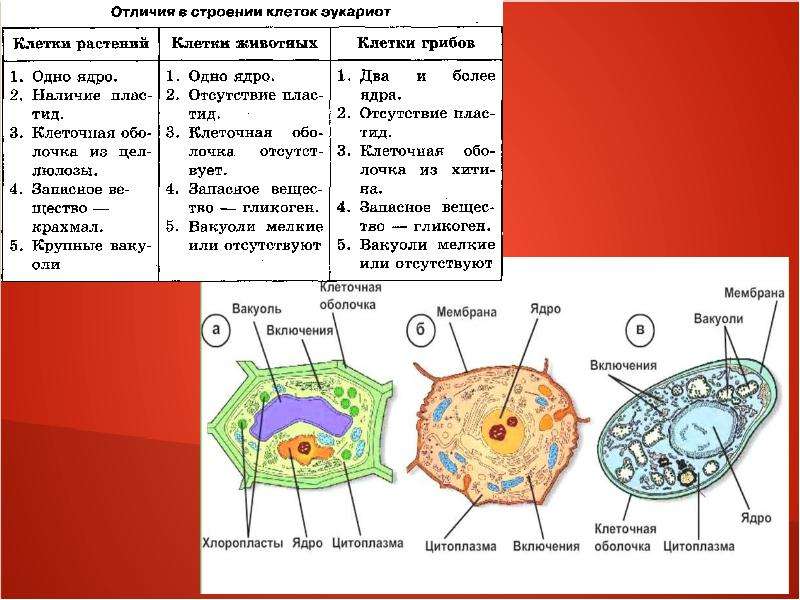 Геномика BMC. 2014;15:492. пмид: 24942908; Центральный PMCID в PubMed: PMC4082614.
Геномика BMC. 2014;15:492. пмид: 24942908; Центральный PMCID в PubMed: PMC4082614.  Proc Biol Sci. 2013;280(1771):20131219. Эпб 2013/09/27. рспб.2013.1219 [пии]. пмид: 24068353; Центральный PMCID в PubMed: PMC37.
Proc Biol Sci. 2013;280(1771):20131219. Эпб 2013/09/27. рспб.2013.1219 [пии]. пмид: 24068353; Центральный PMCID в PubMed: PMC37. 
 П., Маханти П., Шредер Ф.К., Штернберг П.В. Грибы-ловушки нематод подслушивают феромоны нематод. Карр Биол. 2013;23(1):83–6. Эпублик 19.12.2012. [пий]. пмид: 23246407.
П., Маханти П., Шредер Ф.К., Штернберг П.В. Грибы-ловушки нематод подслушивают феромоны нематод. Карр Биол. 2013;23(1):83–6. Эпублик 19.12.2012. [пий]. пмид: 23246407. 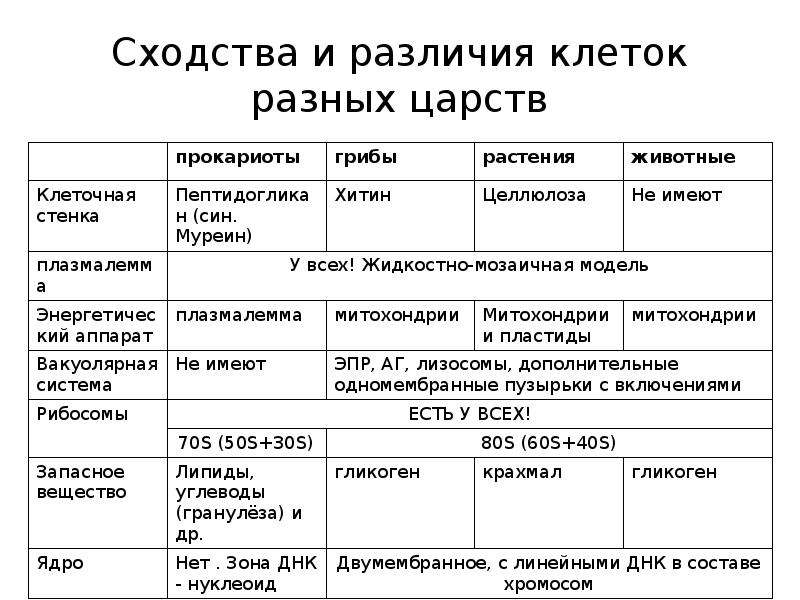 пмид: 25398782.
пмид: 25398782. 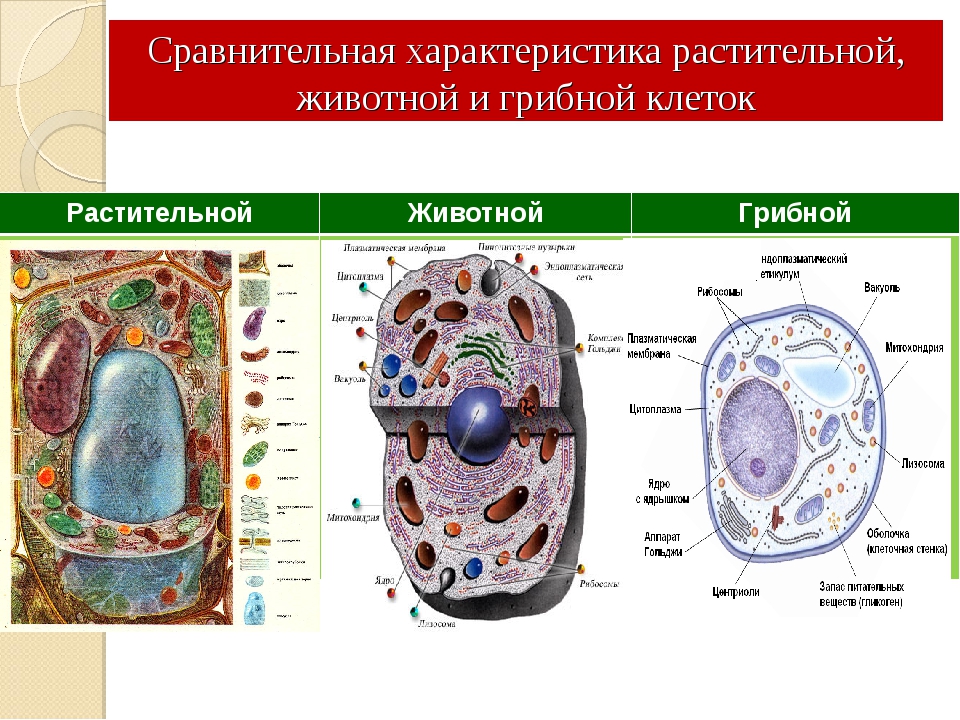
 2013;64:839–63. пмид: 23373699.
2013;64:839–63. пмид: 23373699. 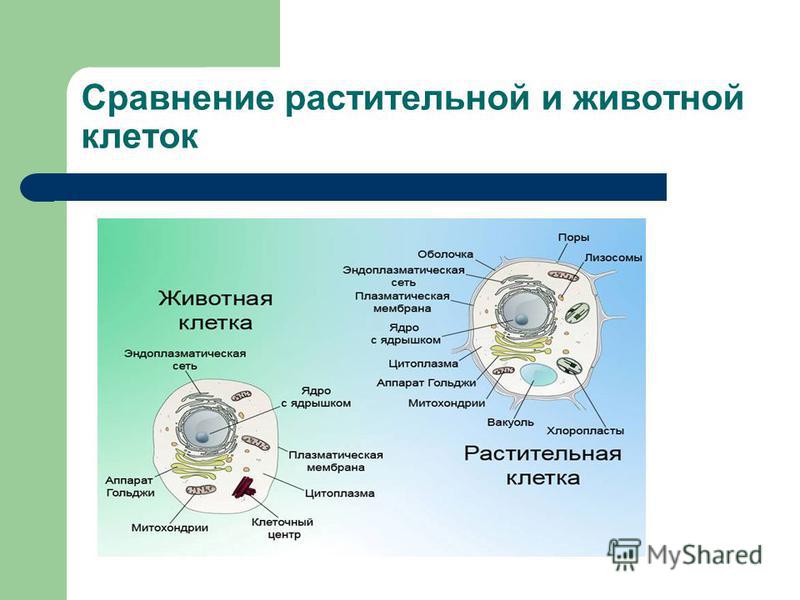 Curr Opin Plant Biol. 2011;14(4):351–7. пмид: 21636314.
Curr Opin Plant Biol. 2011;14(4):351–7. пмид: 21636314.  FEMS Microbiol Lett. 2008;284(2):231–236. пмид: 18510561.
FEMS Microbiol Lett. 2008;284(2):231–236. пмид: 18510561.  Фронт завод науч. 2015;6:483. пмид: 261
Фронт завод науч. 2015;6:483. пмид: 261 ; Центральный PMCID в PubMed: PMC44
 , Флак М., Креспах М.К., Стро М.С., Вебер Дж., Шрокх В. и др. Микробные взаимодействия запускают производство антибиотиков. Curr Opin Microbiol. 2018;45:117–23. пмид: 29702423.
, Флак М., Креспах М.К., Стро М.С., Вебер Дж., Шрокх В. и др. Микробные взаимодействия запускают производство антибиотиков. Curr Opin Microbiol. 2018;45:117–23. пмид: 29702423.  Дж. Биол. Хим. 2014;289(50):34953–64. пмид:25342741; Центральный PMCID в PubMed: PMC4263892.
Дж. Биол. Хим. 2014;289(50):34953–64. пмид:25342741; Центральный PMCID в PubMed: PMC4263892.  Nat Chem Biol. 2017;13(8):833–5. пмид: 28581484.
Nat Chem Biol. 2017;13(8):833–5. пмид: 28581484. 
Строение и организация клеток грибов
Айманианда В., Байри Дж., Бозза С. и др.(2009) Поверхностный гидрофобин предотвращает иммунное распознавание переносимых по воздуху грибковых спор. Nature 460: 1117–21. Найдите этот ресурс:
Alberts B, Johnson A, Lewis J, et al. (2014) Molecular Biology of the Cell (6th edn, New York: Garland Science). Найдите этот ресурс:
Araujo-Palomares CL, Castro-Longoria E and Riquelme M (2007) Ontogeny of Spitzenkörper in germlings of Нейроспора красса . Fungal Genet Biol 44: 492–503. Найдите этот ресурс:
Fungal Genet Biol 44: 492–503. Найдите этот ресурс:
Arkowitz RA and Bassilana M (2015) Регуляция морфогенеза гиф малыми GTPases Ras и Rho. Fungal Biol Rev 29: 7–19. Найдите этот ресурс:
Bartnicki-Garcia S (2002) Рост кончика гиф: нерешенные вопросы, в : HD Osiewacz, изд., Молекулярная биология развития грибов (новый York: Marcel Dekker, Inc.), 29–58. Найдите этот ресурс:
Bartnicki-Garcia S (2015) Манфред Гирбардт и Чарльз Брэкер: выдающиеся пионеры в микроскопии грибов. Nat Microbiol 13: 52–57. Найдите этот ресурс:
Bartnicki-Garcia S, Hergert F и Gierz G (1989) Компьютерное моделирование морфогенеза грибов и математическая основа роста кончиков гиф. Protoplasma 153: 46–57. Найдите этот ресурс:
Bayry J, Beaussart A, Dufrêne YF, et al. (2014) Характеристика структуры поверхности конидий Aspergillus fumigatus , мутировавших в пути синтеза меланина, и их клеточный ответ человека. Infect Immun 82: 3141–53. Найдите этот ресурс:
Найдите этот ресурс:
Beauvais A and Latgé J-P (2015) Aspergillus биопленка in vitro и in vivo. Microbiol Spectra 3: doi 10.1128/microbiolspec.MB-0017-2015 Найдите этот ресурс:
Берепики А., Личиус А. и Рид Н.Д. (2011) Организация и динамика актина в мицелиальных грибах. Nat Rev Microbiol 9: 876–87. Найдите этот ресурс:
Berman J (2006) Морфогенез и развитие клеточного цикла у Candida albicans. Curr Opin Microbiol 9: 595–601. Найдите этот ресурс:
Bleichrodt RJ, Hulsman M, Wösten HAB и Reinder MJT (2015) Переключение с одноклеточной на многоклеточную организацию в гифе Aspergillus niger . MBio 6: e00111–15. Найдите этот ресурс:
Bleichrodt RJ, van Veluw GJ, Recter B, Maruyama JI, Kitamoto K and Wösten HAB (2012) Неоднородность гиф в Aspergillus oryzae является результатом динамического закрытия перегородки телами Воронина. Mol Microbiol 86: 1334–44. Найдите этот ресурс:
Bowman EJ and Bowman BJ (2010) Vacuoles in filamentous fungi, in : KA Borkovich and D Ebbole, eds, Cellular and Molecular Biology of Filamentous Fungi 9040 (Вашингтон, округ Колумбия: Американское общество микробиологии), 179–90.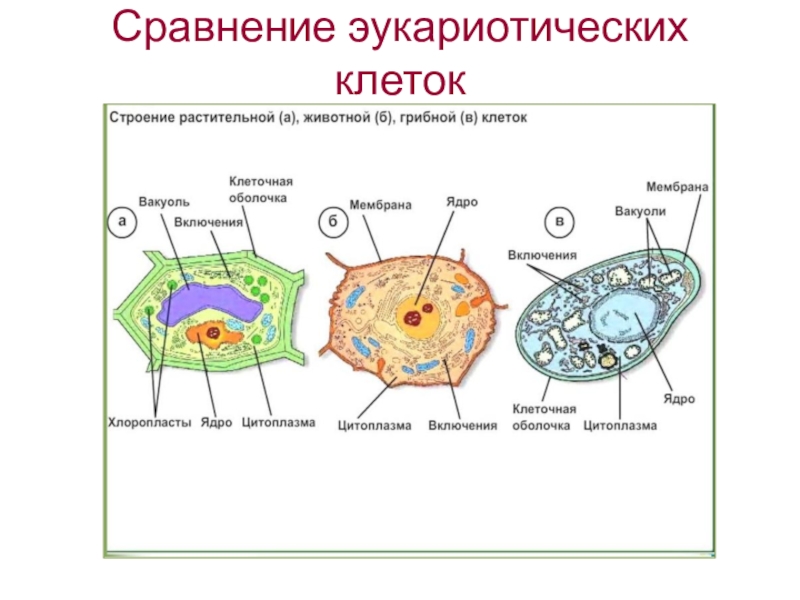 Найдите этот ресурс:
Найдите этот ресурс:
Bowman SM and Free SJ (2006) Структура и синтез клеточной стенки грибов. Bioessays 28: 799–808. Найдите этот ресурс:
Boyce K and Andrianopoulos A (2013) Морфогенетические схемы, регулирующие рост и развитие диморфного патогена Penicillium marneffei . Eukaryot Cell 12: 154–60. Найдите этот ресурс:
(стр. 33) Бойс К. и Андрианопулос А. (2015) Грибковый диморфизм: переход от гиф к дрожжам представляет собой специализированную морфогенетическую адаптацию, позволяющую колонизировать хозяина. FEMS Microbiol Rev 39: 797–811. Найдите этот ресурс:
Бренд AC и Gow NAR (2012) Реакции тропической ориентации у патогенных грибов, в : J Pérez-Martin and A Di Pietro, eds, Morphogenesis and Pathogenicity in Fungi , 22: Topics in Current Genetics (Berlin: Springer-Verlag), 21–41. Найдите этот ресурс:
Buller AHR (1931) Researches on Fungi , Vol. 4 (Лондон: Longman). Найдите этот ресурс:
Найдите этот ресурс:
d’Enfert C (1997) Прорастание спор грибов: выводы из молекулярной генетики Aspergillus nidulans и Neurospora crassa.Fungal Genet Biol 21: 163–72. Найдите этот ресурс:
De Souza CP and Osmani SA (2009) Двойная обязанность ядерных белков — цена более открытых форм митоза. Trends Genet 25: 545–54. Найдите этот ресурс:
Dhavale TJ and Jedd G (2007) Грибковое тело Воронина, в : RG Howard and NAR Gow, eds, The Mycota , 8: Biology of the Fungal Cell (Berlin: Springer-Verlag), 87–96. Найдите этот ресурс:
Ebbole D (2010) The conidium, in : KA Borkovich and D Ebbole, eds, Cellular and Molecular Biology of Filamentous Fungi (Вашингтон, округ Колумбия: Американское общество микробиологии), 577–90.Найдите этот ресурс:
Egan MJ, McClintock MA и Reck-Peterson SL (2012) Транспорт на основе микротрубочек в мицелиальных грибах. Current Opin Microbiol 15: 637–45. Найдите этот ресурс:
Erwig LP and Gow NAR (2016) Взаимодействие грибковых патогенов с фагоцитами Nat Rev Microbiol 14: 163–79.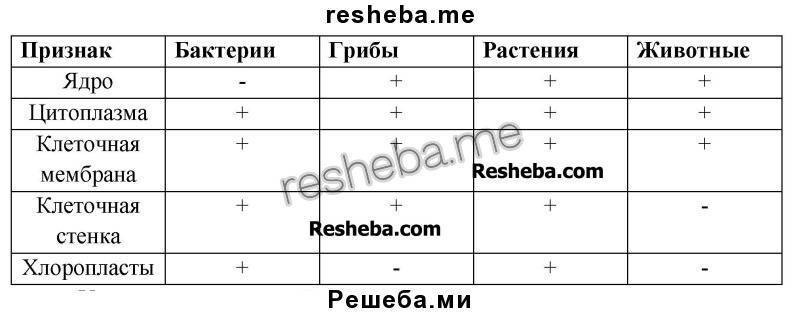 Найдите этот ресурс:
Найдите этот ресурс:
Fis , Zekert N и Takeshita N (2008)Поляризованный рост у грибов — взаимодействие между цитоскелетом, позиционными маркерами и мембранными доменами. Mol Microbiol 68: 813–26. Найдите этот ресурс:
Freitag M, Hickey PC, Raju NB, Selker EU и Read ND (2004) GFP как инструмент для анализа организации, динамики и функции ядер и микротрубочек в Нейроспора толстая . Fungal Genet Biol 41: 907–20. Найдите этот ресурс:
Gauthier GM (2015) Диморфизм грибковых патогенов млекопитающих, растений и насекомых. PLoS Pathog 11: e1004608. Найдите этот ресурс:
Gladfelter A (2006) Ядерная анархия: асинхронный митоз в гифах многоядерных грибов. Current Opin Microbiol 9: 547–52. Найдите этот ресурс:
Gow NAR, Gooday GW, Newsam RJ and Gull K (1980) Ультраструктура перегородки у Candida albicans. Curr Microbiol 4: 357–59. Найдите этот ресурс:
Harris SD (1997) Цикл удвоения Aspergillus nidulans.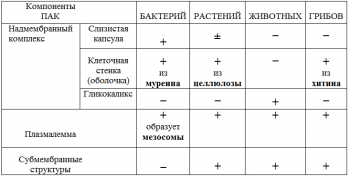 Fungal Genet Biol 22: 1–12. Найдите этот ресурс:
Fungal Genet Biol 22: 1–12. Найдите этот ресурс:
Harris SD (1999) Морфогенез координируется с делением ядра при прорастании Aspergillus nidulans конидиоспор. Microbiology 145: 2747–56. Найдите этот ресурс:
Harris SD (2008) Ветвление гиф грибов: регулирование, механизмы и сравнение с другими системами ветвления. Mycologia 100: 823–32. Найдите этот ресурс:
Herzog S, Schumann MR and Fleiβner A (2015) Слияние клеток в Neurospora crassa . Curr Opin Microbiol 28: 53–9. Найдите этот ресурс:
Hickey PC и Read ND (2009) Визуализация живых клеток Aspergillus in vitro.Med Mycol 47: S110–19. Найдите этот ресурс:
Higuchi Y and Steinberg G (2015) Ранняя подвижность эндосом у мицелиальных грибов: как и почему они двигаются. Fungal Biol Rev 29: 1–6. Найдите этот ресурс:
Huppert M, Sun SH и Harrison JL (1982) Морфогенез во время сапробных и паразитарных циклов Coccidioides immitis. Mycopathologia 22: 107–22. Найдите этот ресурс:
Mycopathologia 22: 107–22. Найдите этот ресурс:
Ishikawa FH, Souza E, Read ND and Roca MG (2013) Colletotrichum lindemuthianum демонстрирует различные модели деления ядер на разных стадиях вегетативного жизненного цикла. Mycologia 105: 795–801. Найдите этот ресурс:
Ishikawa FH, Souza E, Shoji J, et al. (2012)Несовместимость гетерокарионов подавляется после слияния трубок конидиального анастомоза у грибкового растительного патогена. PLoS One 7: e31175. Найдите этот ресурс:
Kanbe T and Tanaka K (1982) Ультраструктура инвазии человеческого волоса in vitro кератинофильным грибком Microsporum gypseum . Infect Immun 38: 706–15. Найдите этот ресурс:
Kasuga T, Townsend JP, Tian C, et al.(2005) Профилирование микрочипов длинных олигомеров у Neurospora crassa выявляет транскрипционную программу, лежащую в основе биохимических и физиологических событий прорастания конидиев. Nucleic Acids Res 33: 6469–85. Найти этот ресурс:
Найти этот ресурс:
Khan A, McQuilken M и Gladfelter AS (2015) Септины и генерация асимметрии в грибковых клетках. Annu Rev Microbiol 69: 487–503. Найдите этот ресурс:
Jacobsen ID, Wilson D, Wächtler B, Brunke S, Naglik JR and Hube B (2012) Candida albicans диморфизм в качестве терапевтической мишени. Expert Rev Anti Infect Ther 10: 85–93. Найдите этот ресурс:
Jedd G and Chua NH (2000) Новый самособирающийся пероксисомальный пузырь, необходимый для эффективного повторного запечатывания плазматической мембраны. Nat Cell Biol 2: 226–31. Найдите этот ресурс:
Lai J, Koh CH, Tjota M, et al. (2012) Внутренне неупорядоченные белки агрегируют в межклеточных каналах грибов и регулируют межклеточные связи. Proc Natl Acad Sci USA 109: 15781–6. Найдите этот ресурс:
Latgé J-P (2007) Клеточная стенка: углеводная оболочка грибковой клетки. Mol Microbiol 66: 279–90. Найдите этот ресурс:
Leslie JF and Xu JR (2010) Fusarium генетика и патогенность, в : К.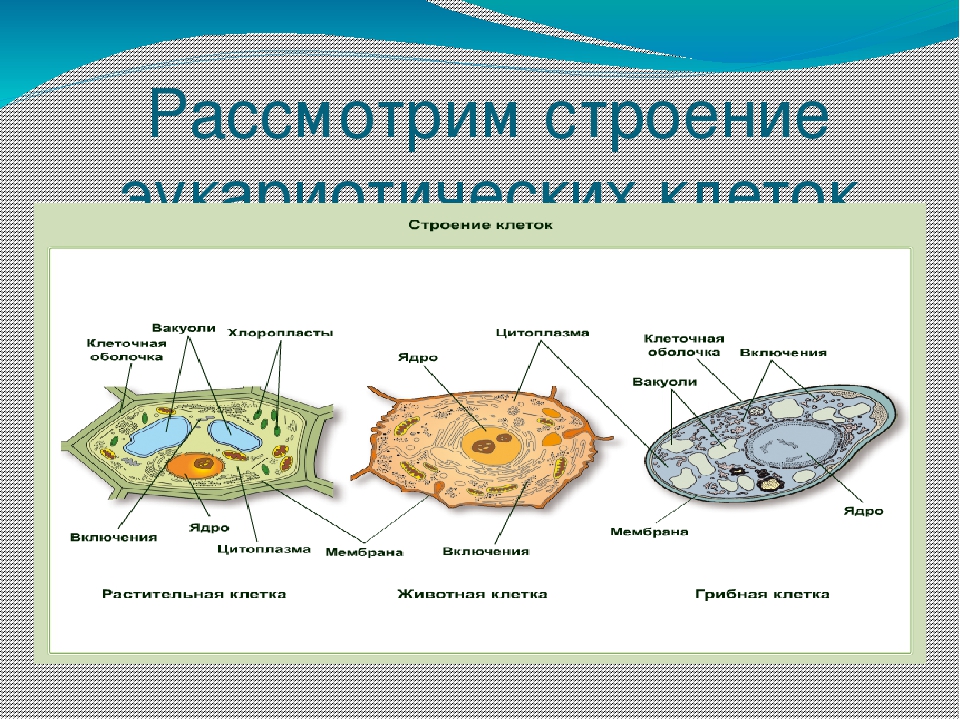 А. Fungi (Вашингтон, округ Колумбия: Американское общество микробиологии), 607–21. Найдите этот ресурс:
А. Fungi (Вашингтон, округ Колумбия: Американское общество микробиологии), 607–21. Найдите этот ресурс:
Lew DJ and Reed SI (1995) Контроль клеточного цикла морфогенеза у почкующихся дрожжей. Current Opin Genet Dev 5: 17–23. Найдите этот ресурс:
Lew RR (2011) Как растет гифа? Биофизика роста грибов под давлением. Nat Rev Microbiol 9: 509–18. Найдите этот ресурс:
Lin X and Heitman J (2006) Биология комплекса видов Cryptococcus neoformans . Annu Rev Microbiol 60: 69–105. Найдите этот ресурс:
Lockhart SR, Daniels KJ, Zhao R, Wessels D и Soll DR (2003) Клеточная биология спаривания у Candida albicans . Эукариотическая клетка 2: 49–61. Найдите этот ресурс:
Лорд К.М. и Рид Н.Д. (2011) Морфогенез перитеция в Sordaria macrospora . Fungal Genet Biol 48: 388–99. Найдите этот ресурс:
Ma LJ, van der Does HC, Borkovich KA, et al. (2010)Сравнительная геномика выявляет мобильные патогенные хромосомы у Fusarium. Nature 464: 367–73. Найдите этот ресурс:
Nature 464: 367–73. Найдите этот ресурс:
Martin SG and Arkowitz RA (2014) Поляризация клеток у почкующихся и делящихся дрожжей. FEMS Microbiol Rev 38: 228–53. Найдите этот ресурс:
Merlini L, Dudin O and Martin SG (2016) Спаривание и слияние: как это делают дрожжевые клетки. Open Biol 3: 130008. Найдите этот ресурс:
Money NP (2015) Производство, выброс и распространение спор, в : S Watkinson, L Boddy and NP Money, eds, The Fungi (3rd edn, Amsterdam: Elsevier), 67–97. Найдите этот ресурс:
Moore D, Robson GD and Trinci APJ (2011) 21st Century Guidebook to Fungi (Cambridge: CUP). Найдите этот ресурс:
Moore-Landecker E ( 2011) Споры грибов. ЭЛС . дои: 10.1002/9780470015902.a0000378.pub2Найдите этот ресурс:
Mourino-Perez RR (2013)Развитие перегородки у нитчатых аскомицетов. Fungal Biol Rev 27: 1–9. Найдите этот ресурс:
Nimrichter L, de Souza MM, Del Poeta M, et al. (2016)Переходные компоненты клеточной стенки, связанные с внеклеточными везикулами, и их влияние на взаимодействие грибов с клетками-хозяевами. Front Microbiol 7: 1034. Найдите этот ресурс:
(2016)Переходные компоненты клеточной стенки, связанные с внеклеточными везикулами, и их влияние на взаимодействие грибов с клетками-хозяевами. Front Microbiol 7: 1034. Найдите этот ресурс:
Nobile SM and Johnson AD (2007) Генетика Candida albicans , диплоидного грибкового патогена человека.Annu Rev Genet 41: 193–211. Найдите этот ресурс:
Nobile SM and Johnson AD (2015) Биопленки Candida albicans и болезни человека. Annu Rev Microbiol 69: 71–92. Найдите этот ресурс:
O’Meara TR и Alspaugh JA (2012) Капсула Cryptococcus neoformans : меч и щит. Clin Microbiol Rev 25: 387–408. Найдите этот ресурс:
Ошеров Н. и Ярден О. (2010) Клеточная стенка мицелиальных грибов, в : К.А. Боркович и Д. Эбболе, ред., Клеточная и молекулярная биология Нитчатые грибы (Вашингтон, округ Колумбия: Американское общество микробиологии), 2224–37.Найдите этот ресурс:
Pantazopoulou A, Pinar M, Xiang M и Peñalva M (2014) Созревание поздних цистерн Гольджи в RabE RAB11 экзоцитарных пост-Гольджи-носителей, визуализированных in vivo. Mol Biol Cell 25: 2428–43. Найдите этот ресурс:
Mol Biol Cell 25: 2428–43. Найдите этот ресурс:
Park HS and Yu JH (2012) Генетический контроль бесполого спорообразования у мицелиальных грибов. Curr Opin Microbiol 15: 669–77. Найдите этот ресурс:
Pieuchot L, Lai J, Loh RA, et al. (2015)Клеточные субкомпартменты через цитоплазматический поток. Dev Cell 34: 410–20. Найдите этот ресурс:
Read ND (1991) Низкотемпературная сканирующая электронная микроскопия грибов и взаимодействий грибов и растений, в : K Mendgen and DE Lesemann, eds, Electronic Microscopy of Plant Pathogens (Berlin: Springer-Verlag), 17–29. Найдите этот ресурс:
Read ND (1994) Клеточная природа и многоклеточный морфогенез высших грибов, в : D Ingram and A Hudson, eds, Shape и Form in Plants and Fungi (Лондон: Academic Press), 254–71.Найдите этот ресурс:
(стр. 34)
Читайте ND (2007) Экологическое зондирование и образ жизни нитчатых грибов, в : GM Gadd, SC Watkinson and PS Dyer, eds, Fungi and its Environment (Cambridge: CUP), 38–57.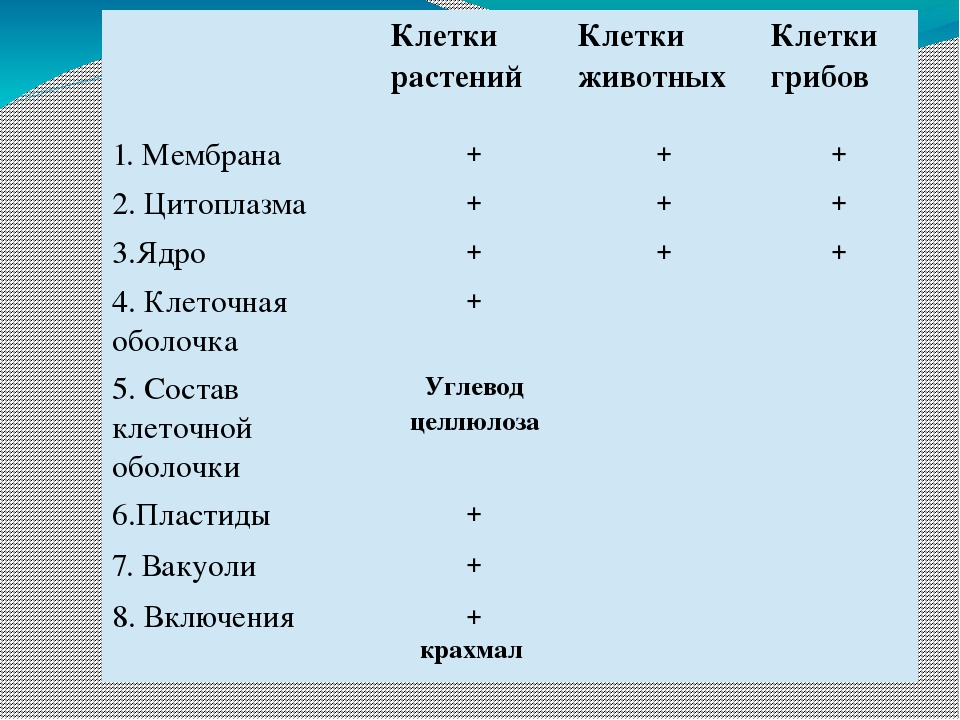 Найдите этот ресурс:
Найдите этот ресурс:
Прочитайте ND (2011) Рост гиф и экзоцитоз , а не происходят только на кончиках гиф. Mol Microbiol 81: 4–7. Найдите этот ресурс:
Read ND, Fleißner A, Roca GM and Glass NL (2010) Hyphal fusion, в : KA Borkovich and D Ebbole, eds, Cellular and Molecular Biology мицелиальных грибов (Вашингтон, округ Колумбия: Американское общество микробиологии), 260–73.Найти этот ресурс:
Читать Н.Д., Горячев А.Б. и Личиус А. (2012) Механистическая основа самослияния между трубками конидиального анастомоза во время инициации грибковой колонии. Fungal Biol Rev 26: 1–11. Найдите этот ресурс:
Reiss E, Shadomy HJ and Lyon GM (2012) Fundamental Medical Mycology (Hoboken, NJ: Wiley-Blackwell). Найдите этот ресурс:
Riquelme. M (2013) Рост кончиков мицелиальных грибов: путешествие к вершине. Annu Rev Microbiol 67: 587–609.Найдите этот ресурс:
Riquelme M, Bredeweg EL, Callejas O, et al.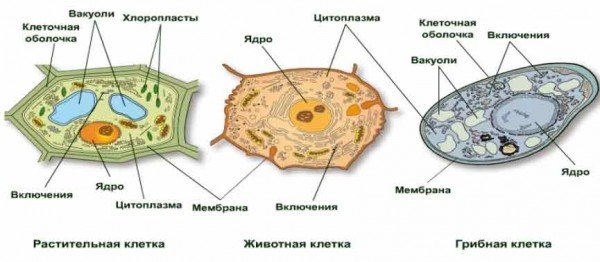 (2014) Комплекс экзоцист Neurospora crassa привязывает везикулы Spitzenkörper к апикальной плазматической мембране во время поляризованного роста. Mol Biol Cell 25: 1312–26. Найдите этот ресурс:
(2014) Комплекс экзоцист Neurospora crassa привязывает везикулы Spitzenkörper к апикальной плазматической мембране во время поляризованного роста. Mol Biol Cell 25: 1312–26. Найдите этот ресурс:
Riquelme M and Sanchez-Leon E (2014) The Spitzenkörper: хореограф роста и морфогенеза грибов. Curr Opin Microbiol 20: 27–33. Найдите этот ресурс:
Riquelme M and Sanchez-Leon E (2015) Живая визуализация b-1,3-глюкансинтазы FKS-1 в гифах Neurospora crassa . Fungal Genet Biol 82: 104–7. Найдите этот ресурс:
Roberson RW, Abril M, Blackwell M, et al. (2010) Структура гиф, в : К.А. Боркович и Д. Эбболе, ред., Клеточная и молекулярная биология нитчатых грибов (Вашингтон, округ Колумбия: Американское общество микробиологии), 8–24. Найдите этот ресурс:
Roca MG, Kuo HC, Lichius A, Freitag M и Read ND (2010)Ядерная динамика, митоз и цитоскелет на ранних стадиях образования колоний у Neurospora crassa.Eukaryot Cell 9: 1171–83. Найдите этот ресурс:
Найдите этот ресурс:
Rodrigues ML, Godinho RMC, Zamith-Miranda D and Nimrichter L (2015) Путешествие в открытый космос: вопросы без ответов о грибковых внеклеточных везикулах. PLoS Pathog 11: e1005240. Найдите этот ресурс:
Rodrigues ML, Nimrichter L, Oliveira DL, et al. (2007) Экспорт везикулярного полисахарида в Cryptococcus neoformans представляет собой эукариотическое решение проблемы транспорта грибов через клеточную стенку. Эукариотическая клетка 6: 48–59.Найдите этот ресурс:
Roper M, Ellison C, Taylor JW и Glass NL (2011) Динамика ядер и генома у многоядерных аскомицетов. Curr Biol 21: R786–93. Найдите этот ресурс:
Roper M, Simonin A, Hickey PC, Leeder A and Glass NL (2013) Динамика ядер в грибковой химере. Proc Natl Acad Sci USA 110: 12875–80. Найдите этот ресурс:
Ruiz-Roldán MC, Köhli M, Roncero MI, Philippsen P, Di Pietro A and Espeso EA (2010) Ядерная динамика во время прорастания, конидиации и слияние гиф Fusarium oxysporum . Eukaryot Cell 9: 1216–24. Найти этот ресурс:
Eukaryot Cell 9: 1216–24. Найти этот ресурс:
Salogiannis J, Egan MJ и Reck-Peterson SL (2016) Пероксисомы перемещаются автостопом по ранним эндосомам с использованием нового линкерного белка PxdA. J Cell Biol 212: 289–96. Найдите этот ресурс:
Schultzhaus ZS and Shaw BD (2015) Эндоцитоз и экзоцитоз при росте гиф. Fungal Biol Rev 29: 43–53. Найдите этот ресурс:
Schultzhaus ZS, Quintanilla L, Hilton A and Shaw BD (2016) Живая клеточная визуализация динамики актина в мицелиальном грибе Aspergillus nidulans . Microsc Microanal 22: 264–74. Найдите этот ресурс:
Schuster M, Martin-Urdiroz M, Higuchi Y, et al. (2016)Совместная доставка ферментов, формирующих клеточную стенку, в одном и том же пузырьке для скоординированного формирования клеточной стенки грибов. Nat Microbiol 1: 16149. Найдите этот ресурс:
Shahi S, Beerens B, Manders EMM и Rep M (2015) Динамика образования многоядерных компартментов в Fusarium oxysporum.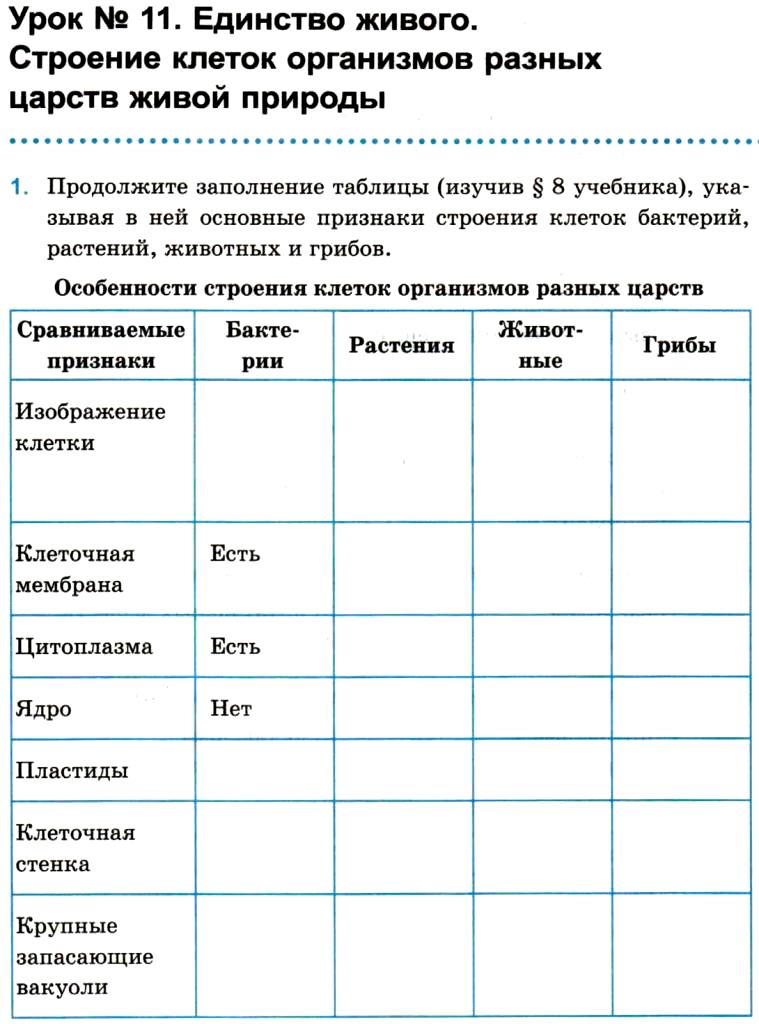 Eukaryot Cell 14: 78–85. Найдите этот ресурс:
Eukaryot Cell 14: 78–85. Найдите этот ресурс:
Shoji JY and Craven K (2011) Аутофагия в базальных компартментах гиф: зеленая стратегия великих переработчиков. Fungal Biol Rev 25: 79–83. Найдите этот ресурс:
Soll DR and Daniels KJ (2016) Пластичность биопленок Candida . Microbiol Mol Biol Rev 80: 565–95. Найдите этот ресурс:
Staib P и Mourschäuser J (2006) Образование хламидоспор в Candida albicans и Candida dublinensis — загадочная программа развития. Mycoses 50: 1–12. Найдите этот ресурс:
Steinberg G (2014) Эндоцитоз и ранняя подвижность эндосом у мицелиальных грибов. Curr Opin Microbiol 20: 10–18. Найдите этот ресурс:
Sudbery PE (2011) Рост гиф Candida albicans. Nat Rev Microbiol 9: 737–748. Найдите этот ресурс:
Takeshita N, Manck R, Grün N, de Vega SH и Fischer R (2014) Взаимозависимость актина и цитоскелета микротрубочек во время роста грибов. Curr Opin Microbiol 20: 34–41. Найдите этот ресурс:
Найдите этот ресурс:
Thomson DD, Berman J and Brand A (2016) Высокое разрешение с частотой кадров при делении клеток во время филаментации Candida albicans . Fungal Genet Biol 88: 54–8. Найдите этот ресурс:
Thomson DD, Wehmeier S, Byfield FJ, et al. (2015) Контактно-индуцированная апикальная симметрия управляет тигмотропными реакциями гиф Candida albicans . Cell Microbiol 17: 342–54. Найдите этот ресурс:
Ugalde U and Rodriguez-Urra AB (2014) Схема мицелия: понимание сигналов, формирующих колонию нитчатых грибов. Appl Microbiol Biotechnol 98: 8809–19. Найдите этот ресурс:
Veses V and Gow NAR (2009) Паттерны почкования псевдогиф Candida albicans.Med Mycol 47: 268–75. Найдите этот ресурс:
Весес В., Ричардс А. и Гоу НАР (2008) Вакуоли и биология грибов. Curr Opin Microbiol 11: 503–10. Найдите этот ресурс:
Webster J and Weber R (2007) Introduction to Fungi (3rd edn, Cambridge: CUP). Найдите этот ресурс:
Найдите этот ресурс:
Xiang X and Oakley B (2010) Цитоскелет нитчатых грибов, в : К.А. Боркович и Д. Эбболе, ред., Клеточная и молекулярная биология нитчатых грибов (Вашингтон, округ Колумбия: Американское общество микробиологии), 209–23.Найдите этот ресурс:
Сарагоса О. и Нильсен К. (2013) Клетки титана в Cryptococcus neoformans : клетки с гигантским ударом. Curr Opin Microbiol 16: 409–13. Найдите этот ресурс:
Zaragoza O, Rodrigues ML, De Jesus M, Frases S, Dadachova E и Casadevall A (2009) Капсула грибкового патогена Cryptococcus neoformans . Adv Appl Microbiol 68: 133–216. Найдите этот ресурс:
Чем отличаются клеточные стенки у бактерий, грибов и растений?
Все стенки ячеек служат морю общего назначения, но для этого могут использоваться другие материалы.Задача клеточной стенки — придать клетке определенную форму, структуру и защитить ее от изменений осмотического давления.
Волокна растительных клеток перекрестно связаны, образуя прочную и гибкую сетку. Основным волокном в клеточной стенке является целлюлоза , которая перекрестно связана с гемицеллюлозой и пектином , о котором вы, возможно, слышали как об ингредиенте, предназначенном для затвердевания джемов до гелеобразной консистенции.
Основным волокном в клеточной стенке является целлюлоза , которая перекрестно связана с гемицеллюлозой и пектином , о котором вы, возможно, слышали как об ингредиенте, предназначенном для затвердевания джемов до гелеобразной консистенции.
На изображении выше показана первичная клеточная стенка , но клетки зрелого растения также имеют вторичную клеточную стенку .Первичная клеточная стенка предназначена для расширения, она гибкая и эластичная, а также прочная. Клетка достигает точки, когда ей больше не нужно расти, и начинает откладывать вторичную клеточную стенку, также состоящую из целлюлозы, но с добавленным компонентом, называемым лигнином , внутри первичной клеточной стенки. Лигнин — волокно, делающее клеточную стенку твердой, содержится в одревесневших стеблях.
Чтобы узнать больше о строении клеточных стенок растений, перейдите по ссылке ниже:
Молекулярная биология клетки. 4-е издание. Альбертс Б., Джонсон А., Льюис Дж. и др. Нью-Йорк: Гарланд Наука; 2002.
4-е издание. Альбертс Б., Джонсон А., Льюис Дж. и др. Нью-Йорк: Гарланд Наука; 2002.
Существует много типов бактерий, у большинства из них есть клеточные стенки, их, как правило, распределяют по категориям, поскольку определить вид бактерий сложнее. Основные группы включают, но не ограничиваются ими, грамположительных и грамнегативных . Это относится к окраске, которая обычно используется для наблюдения бактерий под световым микроскопом. Основным ингредиентом клеточной стенки является пептидогликан или муреин, который представляет собой комплекс, состоящий из сахаров и аминокислот, образующих сетку.
Как вы можете видеть на изображении ниже, разница между стенками разных бактериальных клеток связана с липопротеинами, расположенными вокруг них, количеством слоев пептидогликана. В случае грамположительных бактерий у них есть дополнительная клеточная мембрана снаружи клеточной стенки, в отличие от грамотрицательных. Микобактерии имеют дополнительный слой снаружи клеточной стенки из арабиногалактана и кислот мицелия, отсюда и название.
Чтобы узнать больше о структуре клеточной стенки бактерий, перейдите по ссылке ниже:
Микробиология.Глава 4 Бактерии: клеточные стенки Линды Бруслинд
клеточные стенки состоят из белка, называемого хитином (произносится как «китин»), с добавленными слоями бета-глюкана и манно-белков, как показано на изображении выше.
Чтобы узнать больше о строении клеточной стенки грибов, перейдите по ссылке ниже:
Микология, строение и функция, клеточная стенка
В чем разница между клетками животных растений и грибов? – СидмартинБио
Каковы некоторые различия между клетками животных растений и грибов?
Различия между растительными клетками и клетками грибов включают: Клеточная стенка гриба состоит из трех частей: хитина, глюканов и белков.Некоторые грибы, в том числе дрожжевые, появляются в одноклеточных формах. В клетках грибов нет хлоропластов — органелл, которые растения используют для преобразования солнечного света в энергию.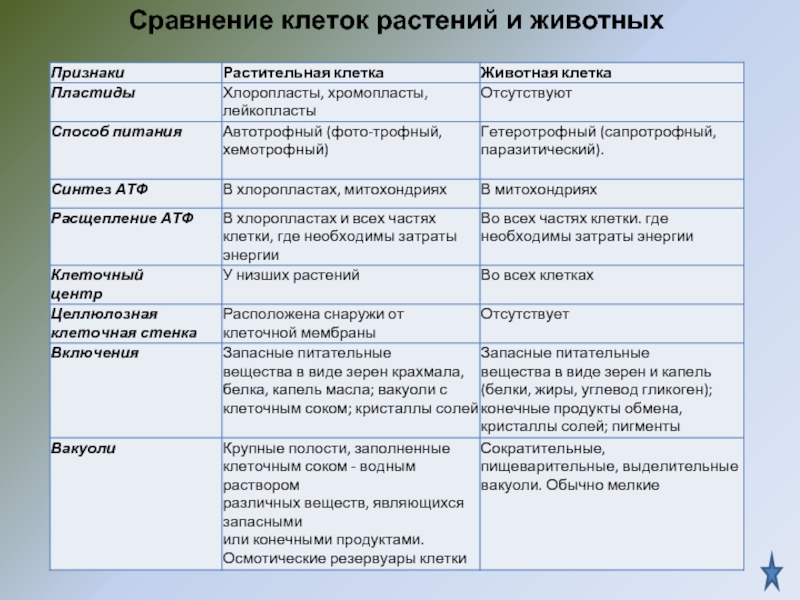
Чего не содержат клетки грибов?
В отличие от клеток растений, клетки грибов не имеют хлоропластов или хлорофилла. Жесткие слои клеточных стенок грибов содержат сложные полисахариды, называемые хитином и глюканами. Хитин, также обнаруженный в экзоскелете насекомых, придает структурную прочность клеточным стенкам грибов.
Чего нет в клетках растений и грибов?
Как вы знаете, клетки растений имеют много общего с клетками животных.Однако у них есть и другие структуры, о которых вы можете узнать, как вы можете видеть на диаграмме ниже. Клетки растений имеют цитоплазму, клеточную мембрану и ядро, которые выполняют те же функции, что и клетки животных.
Почему грибы не растения и не животные?
Основываясь на наблюдениях за грибами, ранние систематики определили, что грибы неподвижны (грибы не неподвижны) и что они имеют жесткие клеточные стенки, которые их поддерживают. Этих характеристик было достаточно для первых ученых, чтобы определить, что грибы не являются животными, и поставить их в один ряд с растениями.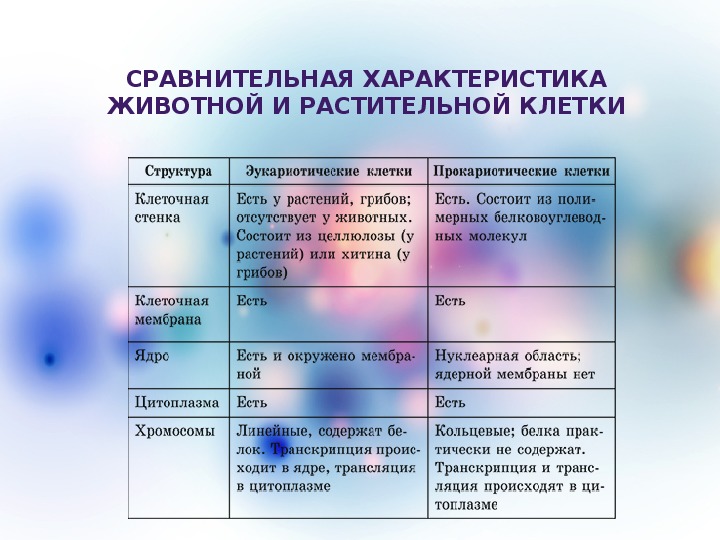
Какие 3 отличия между растениями и грибами?
Растения имеют хлорофилл и могут производить себе пищу, грибы живут за счет других, и они не могут производить себе пищу. 3. У растений есть корни, стеблевые песочные листья. У грибов есть только нити, которые прикрепляются к хозяину.
Имеют ли грибы растительные или животные клетки?
В чем разница между растением и грибком?
Одно из основных различий между растениями и грибами заключается в том, что в состав клеточных стенок грибов вместо целлюлозы входит хитин.И хитин, и целлюлоза состоят из полисахаридных цепей. Еще одним отличием растений от грибов является наличие хлорофилла в растениях, а не в грибах.
Каковы различия между растениями и животными?
| Растения | Животные |
|---|---|
| Клетки растений имеют клеточные стенки и другие структуры, отличные от таковых у животных. | Клетки животных не имеют клеточных стенок и имеют другую структуру, чем клетки растений |
У растений либо нет органов чувств, либо они очень примитивны. |
У животных гораздо более развита сенсорная и нервная система. |
Каковы различия между растениями и животными ответ?
Часто задаваемые вопросы о различиях между растениями и животными Ответ 1: Одно из различий между растениями и животными состоит в том, что растения не состоят из пищеварительной системы, в отличие от животных. Ответ 2: У растений это происходит через устьица. В то время как у животных это происходит через легкие, жабры, кожу и многое другое.
Чем отличается растение от гриба?
Клетки грибов имеют клеточные стенки, содержащие хитин, тогда как клеточные стенки растений содержат целлюлозу.Генетические исследования показали, что грибы более тесно связаны с животными, чем с растениями. Большим отличием от животных является отсутствие органов подвижности, но некоторые животные сидячие, поэтому немного туманны.
В чем сходство клеток животных и клеток грибов?
Сходства между грибами и животными У обоих есть хитин; клеточная стенка грибов в основном состоит из хитина, тогда как у некоторых животных хитин присутствует в экзоскелетных структурах насекомых, пауков и ракообразных. Также нужно знать, каковы различия между растительными животными и грибковыми клетками?
Также нужно знать, каковы различия между растительными животными и грибковыми клетками?
Что общего у грибов и животных?
Оба должны использовать внешние источники пищи для получения энергии. Грибы и животные имеют общую молекулу, называемую хитином, которой нет в растениях. Грибы и многие беспозвоночные животные используют этот сложный углевод в структурных целях. У грибов хитин является структурным компонентом клеточных стенок.
Имеют ли клетки растений и животных одинаковую клеточную стенку?
Клеточная стенка Клетки животных не имеют клеточной стенки, но имеют клеточную мембрану.Клетки растений имеют клеточную стенку, состоящую из целлюлозы, а также клеточную мембрану.
Крупномасштабное сравнение положений интронов среди генов животных, растений и грибов
Реферат
Мы очищаем большие базы данных генов животных, растений и грибов, содержащих интроны, до уровня сходства 20%, а затем идентифицируем наиболее похожие пары белков животное-растение, животное-гриб и растение-гриб.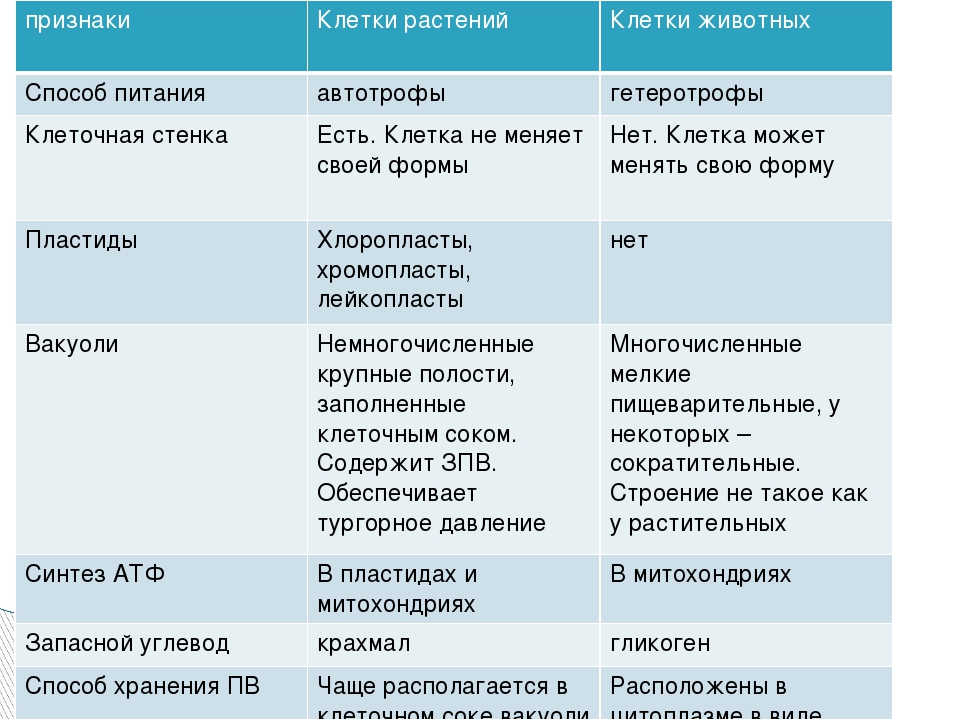 Мы идентифицируем интроны в каждом выравнивании BLAST 2.0 и автоматически подсчитываем совпадающие положения интронов и скользящие (почти совпадающие, в пределах шести нуклеотидов) положения интронов.В целом мы обнаружили, что 10% интронов животных соответствуют положениям растений, а еще 7% являются «слайдами». Пятнадцать процентов интронов грибов соответствуют позициям животных, а 13% соответствуют позициям растений. Кроме того, количество выравниваний с большим количеством совпадений сильно отклоняется от ожиданий Пуассона. 30 выравниваний животных и растений с наибольшим количеством совпадений (для которых 44% интронов животных соответствуют позициям растений) при выравнивании с генами грибов также сильно обогащены тройными совпадениями: 39% интронов грибов соответствуют положениям как животных, так и растений.Это убедительное доказательство того, что предковые интроны предшествовали дивергенции животных, растений и грибов, и полностью противоречит любым ожиданиям, основанным на случайных вставках.
Мы идентифицируем интроны в каждом выравнивании BLAST 2.0 и автоматически подсчитываем совпадающие положения интронов и скользящие (почти совпадающие, в пределах шести нуклеотидов) положения интронов.В целом мы обнаружили, что 10% интронов животных соответствуют положениям растений, а еще 7% являются «слайдами». Пятнадцать процентов интронов грибов соответствуют позициям животных, а 13% соответствуют позициям растений. Кроме того, количество выравниваний с большим количеством совпадений сильно отклоняется от ожиданий Пуассона. 30 выравниваний животных и растений с наибольшим количеством совпадений (для которых 44% интронов животных соответствуют позициям растений) при выравнивании с генами грибов также сильно обогащены тройными совпадениями: 39% интронов грибов соответствуют положениям как животных, так и растений.Это убедительное доказательство того, что предковые интроны предшествовали дивергенции животных, растений и грибов, и полностью противоречит любым ожиданиям, основанным на случайных вставках.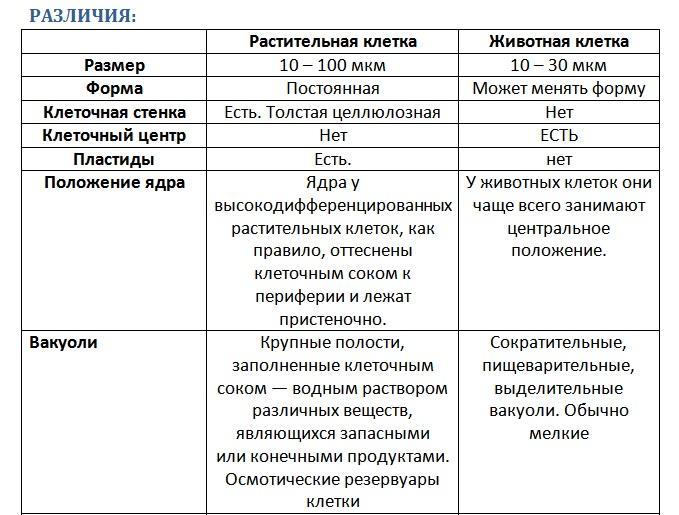 Изучая сдвинутые интроны, мы показываем, что по крайней мере половина из них вызвана несовершенством выравнивания и, скорее всего, являются фактическими совпадениями в общих позициях. Таким образом, наши окончательные оценки таковы, что ≈14% интронов животных соответствуют положениям растений, и что ≈17–18% интронов грибов соответствуют положениям животных или растений, причем все они, вероятно, являются предками эукариот.
Изучая сдвинутые интроны, мы показываем, что по крайней мере половина из них вызвана несовершенством выравнивания и, скорее всего, являются фактическими совпадениями в общих позициях. Таким образом, наши окончательные оценки таковы, что ≈14% интронов животных соответствуют положениям растений, и что ≈17–18% интронов грибов соответствуют положениям животных или растений, причем все они, вероятно, являются предками эукариот.
Интроны преобладают у сложных эукариот, но редко встречаются у простых. Являются ли эти интроны наследственными для всех эукариот или они возникают по мере усложнения организмов? Интроны могут быть приобретены геном или удалены из него в процессе эволюции, но каков баланс?
Поздний взгляд на интроны утверждает, что интроны возникают как «эгоистичные» элементы, не играющие конструктивной роли в эволюции. На этой картинке интроны появляются относительно поздно в эволюции эукариот (1–3) и распространяются как мобильные элементы, которые вторгаются в гены путем вставки в короткие «протосайты сплайсинга» длиной от 4 до 5 нуклеотидов (4) (хотя понятие прото-сайтов сплайсинга было оспорено; refs.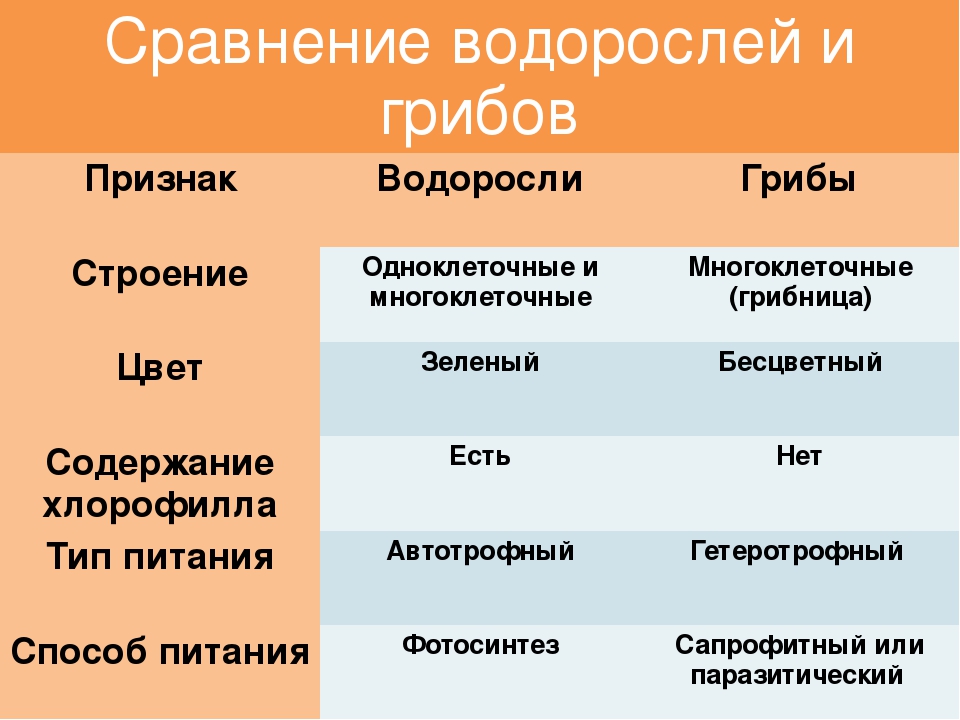 5 и 6).
5 и 6).
Ранняя теория интронов предполагает, что интроны внесли существенный вклад в эволюцию генов посредством «перетасовки экзонов», которая создавала гены из «кусков» экзонов путем рекомбинации внутри интронов (7–12). С этой точки зрения, интроны существовали до любого расхождения эукариот и прокариот, и с тех пор прокариотическая линия полностью потеряла свои интроны, тогда как у эукариот они сохранились.
Последовательности в интронах изменяются в процессе эволюции гораздо быстрее, чем в экзонах.Единственными консервативными элементами являются короткие последовательности на 5′- и 3′-концах, которые очень похожи для всех интронов. Остальная часть интронной последовательности кажется нейтральной по отношению к отбору, а длина интронной последовательности может изменяться на порядки величины. Однако положение интрона в кодирующей последовательности гена хорошо сохраняется. Если сравнить экзон-интронную структуру ортологичных генов, например, генов человека и плодовой мушки, то нельзя установить какие-либо отношения между интронами на основе их последовательностей, но около половины интронов плодовой мушки занимают такое же положение, как и интроны человека на выровненные последовательности ортологичных пар генов.
В 1980-х годах первые сравнения генов между животными и растениями показали, что существуют законсервированные интроны, которые произошли от общего предка (13–16). Однако эта точка зрения на ранние интроны была сильно оспорена анализом распределения интронов в различных ветвях эукариот, подтверждающим сценарий поздних интронов (1, 3, 17).
Гипотеза о том, что существовали глубоко разветвленные а-митохондриальные эукариоты, у которых отсутствовали интроны (1), такие как Giardia , в настоящее время подвергается сомнению.Недавняя работа показала, что, возможно, все эти протисты разветвляются гораздо позже, вместе с грибами, и являются потомками несущих митохондрии предков. Более того, имеются признаки аппарата сплайсинга и даже интронов у многих из этих видов (18-22), что позволяет предположить, что аппарат сплайсинга и интроны повсеместно распространены у всех эукариотических видов.
Однако добавляются ли интроны отдельно по каждой линии или они являются наследственными? Очевидно, что имеет место большая потеря интронов и прирост интронов.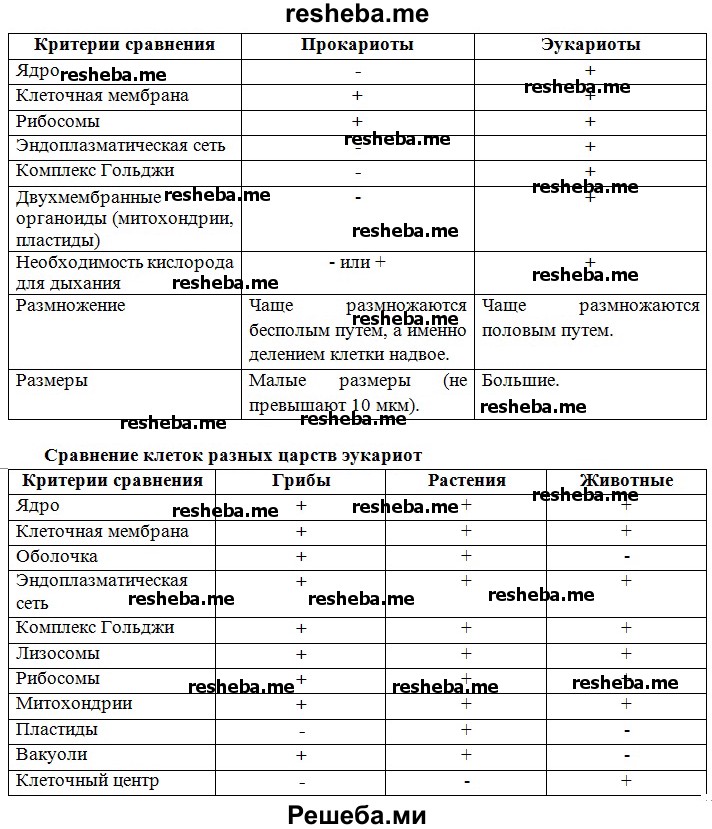 Насколько велик сигнал от интронов, предположительно предков эукариот? Чтобы ответить на этот вопрос, мы провели крупномасштабное сравнение генов животных, растений и грибов. Мы получили три большие выборки генов животных, растений и грибов с известной экзон-интронной структурой, провели попарное сравнение каждого гена из одной выборки с каждым геном из двух других выборок, отобрали наиболее подходящие пары и автоматически пометили интроны. позиции на выравниваниях. Наши окончательные оценки таковы, что ≈14% интронов животных соответствуют позициям растений, и что ≈17–18% интронов грибов соответствуют позициям животных или растений, причем все они, вероятно, являются предками эукариот.30 выравниваний животных и растений с наибольшим количеством совпадений (для которых 44% интронов животных соответствуют позициям растений) при выравнивании с генами грибов также сильно обогащены тройными совпадениями: 39% интронов грибов соответствуют положениям как животных, так и растений. Это убедительное доказательство того, что предковые интроны предшествовали дивергенции животных, растений и грибов, и полностью противоречит любым ожиданиям, основанным на случайных вставках.
Насколько велик сигнал от интронов, предположительно предков эукариот? Чтобы ответить на этот вопрос, мы провели крупномасштабное сравнение генов животных, растений и грибов. Мы получили три большие выборки генов животных, растений и грибов с известной экзон-интронной структурой, провели попарное сравнение каждого гена из одной выборки с каждым геном из двух других выборок, отобрали наиболее подходящие пары и автоматически пометили интроны. позиции на выравниваниях. Наши окончательные оценки таковы, что ≈14% интронов животных соответствуют позициям растений, и что ≈17–18% интронов грибов соответствуют позициям животных или растений, причем все они, вероятно, являются предками эукариот.30 выравниваний животных и растений с наибольшим количеством совпадений (для которых 44% интронов животных соответствуют позициям растений) при выравнивании с генами грибов также сильно обогащены тройными совпадениями: 39% интронов грибов соответствуют положениям как животных, так и растений. Это убедительное доказательство того, что предковые интроны предшествовали дивергенции животных, растений и грибов, и полностью противоречит любым ожиданиям, основанным на случайных вставках.
Материалы и методы
Образец генов.
Нашим источником генов с известными положениями интронов была база данных Exon-Intron (EID, www.mcb.harvard.edu/gilbert/EID) (23), полученная из GenBank, выпуск 121 (24). Эта база данных EID была отфильтрована, чтобы удалить все неканонические интроны (интроны без канонических динуклеотидов на концах: gt … ag, gc … ag, at … ac), поскольку неканонические соединения являются основным индикатором ошибок положения интронов в GenBank. Затем из этой отфильтрованной базы данных были извлечены образец растения (32 234 записи), образец животного (54 671 запись) и образец гриба (7 478 записей).Образец растения состоит из тех записей EID, которые содержат как «PLN», так и «Viridiplantae» в строке описания вида. Образец животного состоит из тех записей EID, которые содержат «INV», «PRI», «ROD», «MAM» или «VRT», а также «Metazoa» в строке описания вида. Образец грибка содержит записи с пометками «PLN» и «Fungi».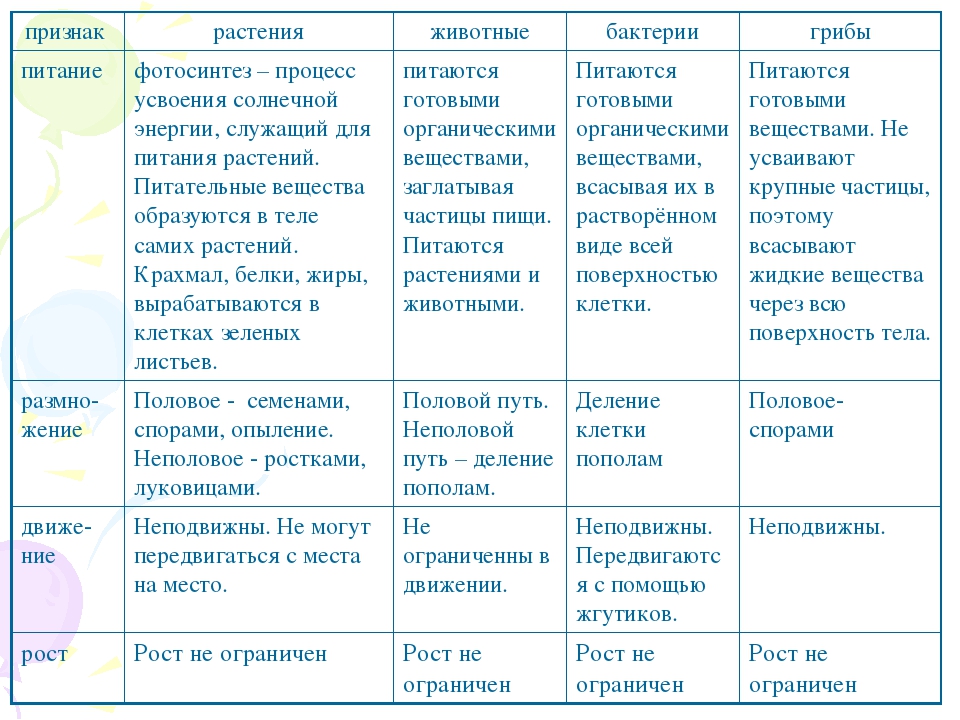 Затем образцы были очищены до уровня гомологии 20% для удаления дубликатов генов с использованием программы gbpurge (www.fallingrain.com/publicserver), в результате чего было получено 9 456 образцов животных, 5 455 образцов растений и 1 956 образцов грибов. .
Затем образцы были очищены до уровня гомологии 20% для удаления дубликатов генов с использованием программы gbpurge (www.fallingrain.com/publicserver), в результате чего было получено 9 456 образцов животных, 5 455 образцов растений и 1 956 образцов грибов. .
Сравнение положений интронов.
Для сравнения положения интронов в гомологичных генах использовали плоские файлы в формате FASTA, содержащие последовательности белков, а также информацию о положениях и фазах всех интронов в строке описания. Эти файлы были получены из белковой формы EID, файла «gb121.pEID» (23). Отдельные бинарные файлы BLAST 2.0 с промежутками сравнивали попарно все белки в одном образце со всеми белками в другом, используя опцию blast (-v1–b1), получая только одно лучшее совпадение.Выходные данные бластов автоматически обрабатывали программой Perl CIP.pl (Сравнение позиций интронов), которая принимает в качестве входных данных выравнивание бластных белков, помечает интроны генов для выровненной пары белков в выравнивании и сравнивает эти положения интронов. Кроме того, CIP.pl подсчитывает количество общих интронов (тех интронов, которые имеют идентичные положения в каждом выровненном белке), скользящих интронов (тех местоположений, которые находятся в пределах 6 нуклеотидов друг от друга) и уникальных интронов (ни общих, ни скользящих).Кроме того, CIP.pl рассчитывает распределение общих, скользящих и уникальных интронов по генам. Мы использовали следующие параметры CIP.pl: принимаются только выравнивания с бластной оценкой 55 бит или выше ( e значение ≈10 −6 ) и ( ii ) каждый ген подсчитывается только один раз (если есть несколько выравниваний для одного и того же белка, используется только выравнивание с максимальной оценкой гомологии). Все выравнивания с маркированными интронами и весь набор данных доступны на нашем веб-сайте www.mcb.harvard.edu/gilbert/CIP.
Кроме того, CIP.pl подсчитывает количество общих интронов (тех интронов, которые имеют идентичные положения в каждом выровненном белке), скользящих интронов (тех местоположений, которые находятся в пределах 6 нуклеотидов друг от друга) и уникальных интронов (ни общих, ни скользящих).Кроме того, CIP.pl рассчитывает распределение общих, скользящих и уникальных интронов по генам. Мы использовали следующие параметры CIP.pl: принимаются только выравнивания с бластной оценкой 55 бит или выше ( e значение ≈10 −6 ) и ( ii ) каждый ген подсчитывается только один раз (если есть несколько выравниваний для одного и того же белка, используется только выравнивание с максимальной оценкой гомологии). Все выравнивания с маркированными интронами и весь набор данных доступны на нашем веб-сайте www.mcb.harvard.edu/gilbert/CIP.
Результаты
Распределение общих, скользящих и уникальных позиций интронов.
В таблице 1 представлены результаты сравнения положений интронов между генами животных и растений, генами животных и грибов, а также генами растений и грибов. Почти 10% из 8737 интронов животных соответствуют позициям растений в 1514 выравниваниях генных продуктов, очищенных до уровня 20%, что в 14 раз выше ожидаемого случайного совпадения.Поскольку в этих выравниваниях интронов растений на 35% больше, только 7% интронов растений соответствуют позициям животных. В ≈700 выравниваниях 15% интронов грибов соответствуют позициям животных, тогда как 13% соответствуют позициям растений. Отношение общих интронов к скользящим интронам (неидентичные позиции в пределах 6 нуклеотидов) колеблется от 1,4 до 3, что снова предполагает, что эти совпадения не вызваны случайностью (потому что в этом случае ожидается в 12 раз большее скольжение, чем идентичные совпадения).
Почти 10% из 8737 интронов животных соответствуют позициям растений в 1514 выравниваниях генных продуктов, очищенных до уровня 20%, что в 14 раз выше ожидаемого случайного совпадения.Поскольку в этих выравниваниях интронов растений на 35% больше, только 7% интронов растений соответствуют позициям животных. В ≈700 выравниваниях 15% интронов грибов соответствуют позициям животных, тогда как 13% соответствуют позициям растений. Отношение общих интронов к скользящим интронам (неидентичные позиции в пределах 6 нуклеотидов) колеблется от 1,4 до 3, что снова предполагает, что эти совпадения не вызваны случайностью (потому что в этом случае ожидается в 12 раз большее скольжение, чем идентичные совпадения).
Сравнение положений и фаз интронов
Этот анализ данных, очищенных на 20%, устраняет большую часть предвзятости в представлении генов в базе данных.Однако доля паралогичных пар будет высокой. Чтобы изучить эту проблему, мы также рассчитали совпадения в данных, очищенных только до порога 95% (данные не показаны), чтобы максимизировать ортологичные пары во всех этих сравнениях, так что, например, α-тубулины животных будут сравниваться с α-тубулинами растений. -тубулины (вместо, возможно, сравнения животного α- и растительного β-тубулина в образце с 20%-ной очисткой). Однако пороговый набор 95% имеет большое количество повторяющихся генов из широко изученных семейств.Тем не менее, в этом сравнении животных и растений 11% из 16 091 животного интрона в 3901 выравнивании соответствуют положениям растений. Точно так же все другие совпадающие фракции были очень похожи (данные не показаны). Кроме того, мы провели все сравнения наоборот, например, растения и животные, чтобы увидеть, повлияет ли на результат отсутствие симметрии в процедурах взрывных работ. Результаты были очень похожими (данные не показаны).
-тубулины (вместо, возможно, сравнения животного α- и растительного β-тубулина в образце с 20%-ной очисткой). Однако пороговый набор 95% имеет большое количество повторяющихся генов из широко изученных семейств.Тем не менее, в этом сравнении животных и растений 11% из 16 091 животного интрона в 3901 выравнивании соответствуют положениям растений. Точно так же все другие совпадающие фракции были очень похожи (данные не показаны). Кроме того, мы провели все сравнения наоборот, например, растения и животные, чтобы увидеть, повлияет ли на результат отсутствие симметрии в процедурах взрывных работ. Результаты были очень похожими (данные не показаны).
Распределение совпадений не то, что можно было бы получить в результате случайного процесса.На рис. 1 сравнивается наблюдаемое количество совпадений в каждом выравнивании с ожиданием Пуассона: существует гораздо больше генов с большим количеством совпадений, чем можно было бы получить из кривой Пуассона.
Рис. 1. Сравнение соответствия животных и растений математическому ожиданию Пуассона. Ромбики показывают количество выравниваний в каждом наборе совпадений. Нижняя кривая с квадратами представляет собой оценку Пуассона, подобранную для нулевого и одиночного числа попаданий.
Ромбики показывают количество выравниваний в каждом наборе совпадений. Нижняя кривая с квадратами представляет собой оценку Пуассона, подобранную для нулевого и одиночного числа попаданий.
В таблице 2 перечислены 30 наиболее часто встречающихся генов в интронах животных и растений; (полный набор данных есть на нашем сайте).Лучше всего подходит RAN-связывающий белок (импортин 7). На рис. 2 показано выравнивание с отмеченными позициями интронов. В области выравнивания ген животного имеет 23 интрона, а ген растения — 21. Одиннадцать интронов имеют общие положения, а две пары интронов отмечены как скользящие. Десять интронов животных и восемь интронов растений не имеют совпадений.
Рис. 2. BLAST 2.0 выравнивание RAN-связывающего белка. Верхняя последовательность представляет собой ген Mus musculus MMU278435; нижняя последовательность представляет собой ген Arabidopsis thaliana ATF17J16.( A ) Положения общих интронов на белковых последовательностях отмечены красным, скользящие интроны отмечены синим, а уникальные интроны отмечены желтым. Фазы интронов животных показаны над их отмеченными позициями, а фазы интронов растений показаны ниже. Положение и фаза одного картированного грибкового интрона показаны под выровненной последовательностью на зеленом фоне; цифра, за которой следует «f», указывает фазу грибкового интрона. ( B и C ) За сегментами выравнивания, содержащими скользящие положения интронов, следуют исправления выравнивания, которые преобразуют скользящие положения интронов в обычные положения.
Фазы интронов животных показаны над их отмеченными позициями, а фазы интронов растений показаны ниже. Положение и фаза одного картированного грибкового интрона показаны под выровненной последовательностью на зеленом фоне; цифра, за которой следует «f», указывает фазу грибкового интрона. ( B и C ) За сегментами выравнивания, содержащими скользящие положения интронов, следуют исправления выравнивания, которые преобразуют скользящие положения интронов в обычные положения.
Ген животного-растения соответствует наибольшему количеству общих положений интрона
Общие и скользящие положения интронов.
Два положения скользящего интрона животное-растение в RAN-связывающем белке (синие на рис. 2) лежат близко к промежуткам в машинном выравнивании. Рис. 2 B и C показывают, что эти области выравнивания можно легко исправить, чтобы сделать эти два интрона общими. Таким образом, эта пара генов животное-растение в действительности имеет 13 общих положений интрона. Визуальная проверка скользящих позиций интронов для 30 лучших совпадений животных и растений показала, что в 50% случаев области выравнивания вблизи скользящих позиций интронов могут быть скорректированы для преобразования скользящих интронов в обычные.
Таким образом, эта пара генов животное-растение в действительности имеет 13 общих положений интрона. Визуальная проверка скользящих позиций интронов для 30 лучших совпадений животных и растений показала, что в 50% случаев области выравнивания вблизи скользящих позиций интронов могут быть скорректированы для преобразования скользящих интронов в обычные.
Это представление о том, что многие из «скользящих» интронов на самом деле являются обычными, смещенными, подтверждается данными в таблице 3, которая показывает отношение общих позиций к скользящим интронам в зависимости от строгости выравнивания.При высокой гомологии между парами белков животного и растительного происхождения (доля идентичных аминокислот >65%) наблюдается 7,5-кратное превышение общих позиций интронов над скользящими. Чем слабее гомология, тем меньше превышение общих позиций интронов над скольжением. Для самой слабой гомологии (когда доля одинаковых аминокислот в выравниваниях <25%) наблюдается даже 5% превышение скольжения над общими позициями. Все эти данные свидетельствуют о том, что большинство скользящих положений интронов возникает из-за несовершенства выравнивания белков и что они в действительности являются обычными.
Все эти данные свидетельствуют о том, что большинство скользящих положений интронов возникает из-за несовершенства выравнивания белков и что они в действительности являются обычными.
По мере того, как выравнивание становится менее надежным, доля скользящих интронов увеличивается
Общие интроны среди генов животных, растений и грибов.
В таблице 2 показаны 30 генов с наибольшим количеством общих положений интронов животных и растений. Для этих 30 генов 44% положений интронов животных совпадают с положениями растений, а 47% положений интронов растений соответствуют положениям животных. Мы использовали бластное парное выравнивание, чтобы сравнить эти 30 генов с генами, содержащими интроны грибов, а затем нанесли на карту грибковые интроны из наилучшего соответствия гриб-животное на 30 пар животное-растение.На рис. 2 показан пример такого сравнения животных, растений и грибов, а в таблице 2 представлен полный набор данных о совпадающих положениях интронов. Из 62 интронов грибов, сопоставленных с 30 лучшими парами животных и растений, 33 (53%) соответствуют интронам животных, 28 (45%) соответствуют интронам растений и 24 (39%) соответствуют интронам как животных, так и растений. Эти числа значительно превышают среднее совпадение между парами гриб-животное и гриб-растение (табл. 1) и, таким образом, свидетельствуют о древности этих общих интронов.
Из 62 интронов грибов, сопоставленных с 30 лучшими парами животных и растений, 33 (53%) соответствуют интронам животных, 28 (45%) соответствуют интронам растений и 24 (39%) соответствуют интронам как животных, так и растений. Эти числа значительно превышают среднее совпадение между парами гриб-животное и гриб-растение (табл. 1) и, таким образом, свидетельствуют о древности этих общих интронов.
Распределение интронов по фазам.
Фазовые распределения интронов животных, грибов и растений (табл. 1) полностью соответствуют данным Long et al. (5). Интересно, что фазовое распределение общих интронов животных и растений занимает промежуточное положение между интронами животных и интронами растений. Точно так же фазовое распределение общих растительно-грибных интронов находится между родительскими распределениями.
Обсуждение
Это широкомасштабное исследование генов животных, растений и грибов показывает, что 10% интронов животных имеют те же положения, что и интроны растений, а еще 7% лежат в пределах шести нуклеотидов от интронов растений (скользящие положения).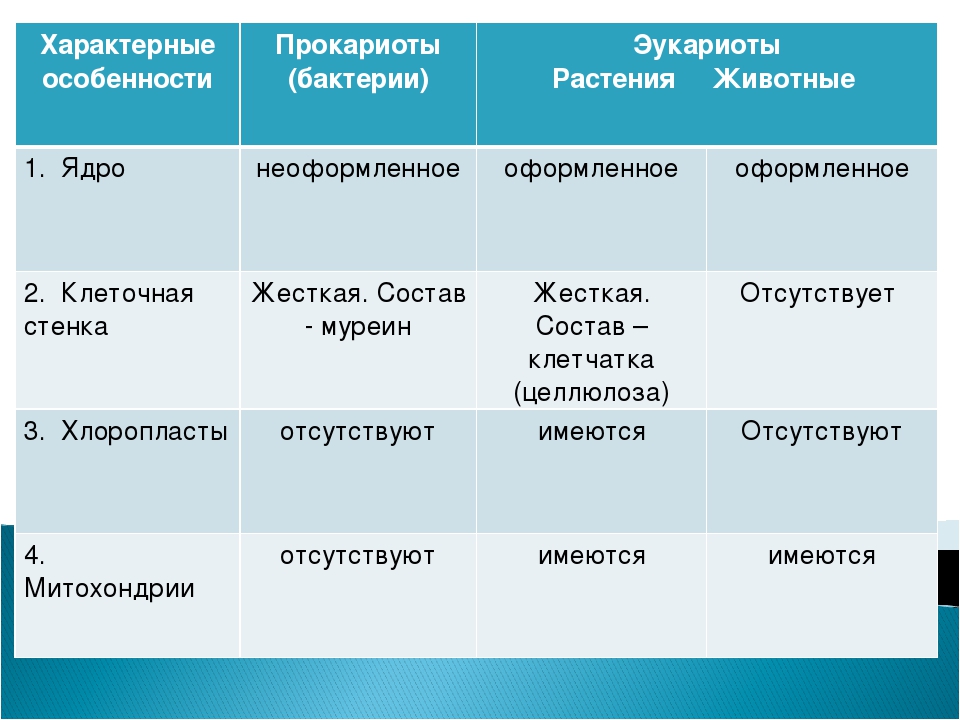 Кроме того, мы показали, что большинство скользящих интронов вызвано несовершенством машинного выравнивания, проявляясь все больше и больше по мере того, как сходство последовательностей становится все слабее и слабее, и, скорее всего, являются общими позициями в генах животных и растений. Этот вывод о скольжении согласуется с выводом Stoltzfus et al. (25), который утверждал, что большинство скользящих интронов «оказались искусственными» и вызваны ошибками выравнивания, ошибками базы данных и ошибками в точном определении положения интронов.Эти результаты дают нам основание объединить общие и половину скользящих групп, чтобы утверждать, что в целом 14% позиций интронов животных соответствуют позициям растений и что 17–18% интронов грибов соответствуют позициям животных или растений.
Кроме того, мы показали, что большинство скользящих интронов вызвано несовершенством машинного выравнивания, проявляясь все больше и больше по мере того, как сходство последовательностей становится все слабее и слабее, и, скорее всего, являются общими позициями в генах животных и растений. Этот вывод о скольжении согласуется с выводом Stoltzfus et al. (25), который утверждал, что большинство скользящих интронов «оказались искусственными» и вызваны ошибками выравнивания, ошибками базы данных и ошибками в точном определении положения интронов.Эти результаты дают нам основание объединить общие и половину скользящих групп, чтобы утверждать, что в целом 14% позиций интронов животных соответствуют позициям растений и что 17–18% интронов грибов соответствуют позициям животных или растений.
Совпадение позиций интронов выше ожидаемого, если бы все интроны вошли в последовательности случайным образом на уровне нуклеотидов. Наши расчеты показывают, что для двух генов в верхней части таблицы 2, даже для наиболее благоприятного сценария вставки интрона в ограниченное число сайтов прото-сплайсинга, вероятность такого количества совпадений составляет 10 -3 . При этом превышения обычных над «скользящими» позициями (наблюдаемое как превышение в 1,4–3 раза, но корректируемое до превышения в 3–6 раз) не ожидается; случайная вставка предсказывает 12-кратный избыток «скользящих» позиций (±6 нт).
При этом превышения обычных над «скользящими» позициями (наблюдаемое как превышение в 1,4–3 раза, но корректируемое до превышения в 3–6 раз) не ожидается; случайная вставка предсказывает 12-кратный избыток «скользящих» позиций (±6 нт).
В настоящее время существует два различных объяснения общего положения интронов. Гипотеза поздних интронов постулирует, что все интроны были вставлены недавно в «прото-сайты сплайсинга» генов. С этой точки зрения, общие положения интронов между генами животных и растений возникают в результате случайного совпадения неродственных и независимо встроенных интронов.Альтернативная гипотеза объясняет общие положения интронов как предковые: древние интроны, существовавшие до расхождения царств животных и растений. Если бы был верным второй сценарий, то общие положения интронов животных и растений должны были бы также обогащаться генами грибов, поскольку эволюционное разделение грибов и животных произошло после разделения животных и растений. Действительно, результаты в таблице 2 показывают, что это так.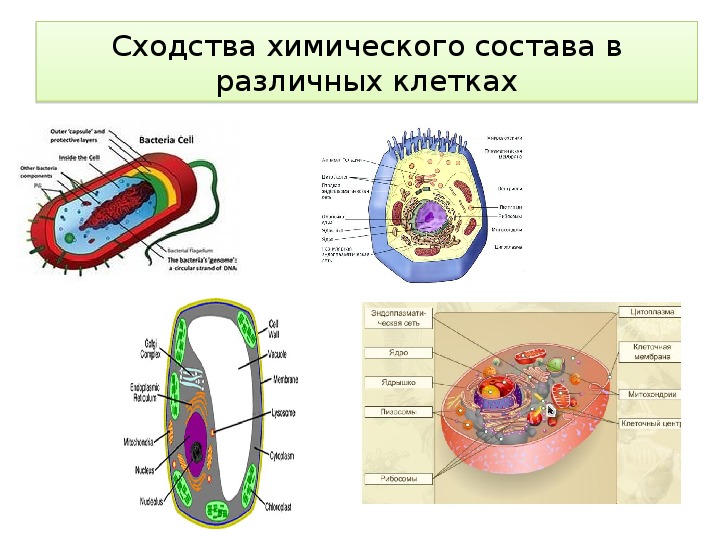 Для 30 неродственных генов с наибольшим количеством общих интронов животных и растений 60% интронов грибов имеют положения, общие с интронами животных и / или растений, а 39% интронов грибов являются общими одновременно как для интронов растений, так и для животных.Это исключительно большое количество интронов с положениями, общими для всех трех таксонов животных, растений и грибов, убедительно подтверждает древность этих общих положений интронов.
Для 30 неродственных генов с наибольшим количеством общих интронов животных и растений 60% интронов грибов имеют положения, общие с интронами животных и / или растений, а 39% интронов грибов являются общими одновременно как для интронов растений, так и для животных.Это исключительно большое количество интронов с положениями, общими для всех трех таксонов животных, растений и грибов, убедительно подтверждает древность этих общих положений интронов.
Несмотря на то, что необработанные числа невелики по сравнению с предположением, что интроны могли войти в ограниченное число «прото-сайтов сплайсинга», детали распределения не согласуются с моделью прото-сплайсинга. Последние данные Endo et al. (26) показывает, что вставка интрона не всегда ограничивается сайтами прото-сплайсинга.Более того, поскольку кодирующие последовательности претерпевают постоянные эволюционные изменения, прото-сайты сплайсинга для вставок интронов не будут иметь неизменного положения на протяжении всей эволюции. Значительные различия в предпочтениях конкретных нуклеотидов в третьем положении кодонов (так называемое смещение кодонов) генов животных, грибов и растений будут увеличивать изменения в распределении сайтов прото-сплайсинга между таксонами. Видовая изменчивость в составе геномных нуклеотидов (27) также разнообразит распределение протосайтов сплайсинга внутри кодирующих последовательностей разных видов.Таким образом, предпочтение вставки интронов в протосайты сплайсинга должно соответствовать модели полностью случайной вставки интронов в ограниченное число сайтов.
Значительные различия в предпочтениях конкретных нуклеотидов в третьем положении кодонов (так называемое смещение кодонов) генов животных, грибов и растений будут увеличивать изменения в распределении сайтов прото-сплайсинга между таксонами. Видовая изменчивость в составе геномных нуклеотидов (27) также разнообразит распределение протосайтов сплайсинга внутри кодирующих последовательностей разных видов.Таким образом, предпочтение вставки интронов в протосайты сплайсинга должно соответствовать модели полностью случайной вставки интронов в ограниченное число сайтов.
Однако распределение совпадений интронов совсем не такое, как можно было бы ожидать от модели случайных совпадений. Количество генов с большим количеством совпадений между животными и растениями намного превышает оценку Пуассона. Кроме того, эти гены, обогащенные совпадениями животных и растений (44% совпадений интронов животных), также обогащены совпадениями грибов, животных и растений (39% интронов грибов соответствуют положениям животных и растений). В любой случайной модели совпадения в генах грибов должны быть независимыми. Это высокое совпадение интронов в отдельных таксонах находится в прямом противоречии с ожиданием случайной независимой вставки.
В любой случайной модели совпадения в генах грибов должны быть независимыми. Это высокое совпадение интронов в отдельных таксонах находится в прямом противоречии с ожиданием случайной независимой вставки.
Могут ли эти общие положения интронов возникнуть в результате недавнего горизонтального переноса генов между таксонами? Мы изучили филогенетические взаимоотношения 30 животных, растительных и грибковых белков и пришли к выводу, что это не так. В лучшем случае только для нескольких белков может быть спорным древний горизонтальный перенос генов.Следовательно, недавний горизонтальный перенос генов не является основной причиной общих положений интронов в таблице 2.
Большинство современных интронов занимают уникальное положение в таксонах животных, грибов или растений, и, вероятно, значительная их часть может быть приобретена недавно. Даже среди общих позиций интронов будет некоторая доля недавно вставленных интронов, которые случайно занимают те же позиции. С другой стороны, на протяжении всей эволюции происходила потеря интронов, что уменьшало количество общих интронов. Таким образом, даже зная долю общих позиций интронов сегодня, невозможно реально оценить количество древних интронов. Более низким приближением будет цифра 14% интронов животных, приведенная выше, но мы считаем вероятным, что 60–80% исходных интронов были потеряны при таком же количестве добавлений.
Таким образом, даже зная долю общих позиций интронов сегодня, невозможно реально оценить количество древних интронов. Более низким приближением будет цифра 14% интронов животных, приведенная выше, но мы считаем вероятным, что 60–80% исходных интронов были потеряны при таком же количестве добавлений.
Наблюдаемое фазовое распределение общих интронов похоже на распределение всех интронов в том смысле, что представлены все три фазы, причем нулевая фаза является промежуточной между родительскими таксонами.Общие (предковые) интроны, появляющиеся у животных, растений и грибов, не ограничены нулевой фазой. Таким образом, все три фазы должны были быть заселены в начале эукариотической эволюции. Тем не менее, мы не можем исключить возможность того, что некоторые драматические изменения в распределении интронов по фазе произошли намного раньше, примерно во времена эукариотического происхождения, как мы предполагали в другом месте (9-11).
Таким образом, мы идентифицировали большое количество совпадающих позиций среди интронов животных, растений и грибов. 30 генов с наибольшим количеством совпадений показывают 44% совпадений между животными и растениями. Кроме того, соответствующие интроны грибов для этих генов также демонстрируют высокую степень совпадения, 39%, как с животными, так и с растениями одновременно. Этот набор интронов, скорее всего, является наследственным, лежащим в этих генах до разделения животных, растений и грибов.
30 генов с наибольшим количеством совпадений показывают 44% совпадений между животными и растениями. Кроме того, соответствующие интроны грибов для этих генов также демонстрируют высокую степень совпадения, 39%, как с животными, так и с растениями одновременно. Этот набор интронов, скорее всего, является наследственным, лежащим в этих генах до разделения животных, растений и грибов.
Благодарности
Мы благодарим доктора. W. F. Doolittle и M. Long за критические замечания и ценные предложения по рукописи.А.Ф.М. был поддержан грантом Фулбрайта 24953.
- Принято 15 октября 2002 г.
- Copyright © 2002, The National Academy of Sciences
Странная наука: пенициллин и клеточная стенка
Современные врачи часто назначают антибиотики для борьбы с инфекциями. Одним из первых открытых антибиотиков был пенициллин. Пенициллин был впервые использован для лечения бактериальных инфекций в 1942 году и получен из грибка Penicillium sp. При использовании в качестве антибиотика пенициллин действует по очень специфическому механизму. Пенициллин препятствует выработке молекулы, называемой пептидогликаном. Молекулы пептидогликана образуют прочные связи, которые придают бактериальной клетке силу, а также предотвращают утечку из цитоплазмы. Почти каждая бактерия имеет пептидогликановую клеточную стенку.
При использовании в качестве антибиотика пенициллин действует по очень специфическому механизму. Пенициллин препятствует выработке молекулы, называемой пептидогликаном. Молекулы пептидогликана образуют прочные связи, которые придают бактериальной клетке силу, а также предотвращают утечку из цитоплазмы. Почти каждая бактерия имеет пептидогликановую клеточную стенку.
Состав клеточной стенки различается в зависимости от вида организма, поэтому пенициллин не действует на другие организмы.Клеточные стенки растений, например, состоят из целлюлозы. Клеточные стенки водорослей очень разнообразны. Стенки клеток водорослей могут состоять из целлюлозы, ксилана, кремнезема, каррагинана или множества других материалов. Клеточные стенки большинства грибов состоят из хитина. Состав клеточной стенки у архей более разнообразен.
У бактерий есть два типа клеточных стенок. Грамположительные бактерии имеют слой пептидогликана на внешней стороне клеточной стенки. Грамотрицательные бактерии имеют пептидогликан между мембранами. Пенициллин лучше всего действует на грамположительные бактерии, подавляя выработку пептидогликана, делая клетки неплотными и хрупкими. Клетки разрываются, и иммунной системе намного легче их разрушить, что помогает больному человеку быстрее выздороветь. Клетки человека не содержат пептидогликана, поэтому пенициллин нацелен на бактериальные клетки.
Грамотрицательные бактерии имеют пептидогликан между мембранами. Пенициллин лучше всего действует на грамположительные бактерии, подавляя выработку пептидогликана, делая клетки неплотными и хрупкими. Клетки разрываются, и иммунной системе намного легче их разрушить, что помогает больному человеку быстрее выздороветь. Клетки человека не содержат пептидогликана, поэтому пенициллин нацелен на бактериальные клетки.
Другие антибиотики нацелены на различные молекулы, которые подавляют рост бактерий, не повреждая клетки человека.Сульфабиотики нацелены на определенный фермент, подавляющий рост бактерий. Антибиотики тетрациклинового ряда связываются с бактериальными рибосомами, которые отвечают за выработку белка, и ингибируют синтез бактериального белка. Ципрофлоксацин, один из сильнейших антибиотиков, атакует репликацию бактериальной ДНК, не затрагивая клеточную ДНК человека.
Антибиотики очень специфичны для определенных бактериальных функций и бесполезны для лечения небактериальных заболеваний. На вирусы не действуют антибиотики, потому что у них нет пептидогликановых клеточных стенок или рибосом, и они не реплицируют свою собственную ДНК.
На вирусы не действуют антибиотики, потому что у них нет пептидогликановых клеточных стенок или рибосом, и они не реплицируют свою собственную ДНК.
Бактерии могут стать устойчивыми к антибиотикам в процессе отбора и эволюции. Пенициллин убивает большинство бактериальных клеток, но не всех. Бактерии, устойчивые к действию антибиотика, остаются, но в небольшом количестве могут быть выведены из организма иммунной системой. Важно закончить прием всех назначенных антибиотиков, чтобы иммунной системе не приходилось так усердно бороться с инфекцией. Как незавершенные курсы антибиотиков, так и чрезмерное использование антибиотиков также привели к увеличению числа устойчивых к антибиотикам бактерий.
.