Сжимаемость жидкостей — Энциклопедия по машиностроению XXL
Для сжимаемых жидкостей можно записать [c.49]Для тихоходных насосов, работающих при невысоких давлениях, когда запаздывание клапанов и влияние сжимаемости жидкости незначительны, их индикаторные диаграммы близки по форме к прямоугольным (a d g a па рис. 3.10). В этом случае потери гидравлического происхождения можно разделить на мощность потерь Хрц давления и мощность утечек qy. [c.291]
На практике в уравнение (1-84) вводят эмпирический коэффициент для учета рассеяния энергии вследствие трения и других необратимых процессов. Уравнение (1-84) также находит применение для сжимаемых жидкостей, когда изменение давления достаточно мало по сравнению с абсолютным давлением. В таких случаях изменение удельного объема среды незначительно. [c.56]
Влияние давления на равновесный состав смеси можно объяснить принципом Ле-Шателье — с повышением давления возрастают равновесные концентрации компонентов для той части уравнения реакции, которой соответствует меньший объем.

Пренебрегая сжимаемостью жидкости, составить дифференциальное уравнение колебаний выведенного из положения равновесия клапана и определить частоту его колебаний, считая, что сила трения А, действующая на клапан, линейно зависит от его скорости [c.363]
Дифференциальное уравнение сплошности, или непрерывности, для сжимаемых жидкостей имеет вид [c.408]
При более сильных сокращениях пузырька амплитуда возмущений может стать сравнимой с его радиусом и он может раздробиться. При этом при достаточно больших неустойчивость пузырька может проявиться еще до того, как станет существенным влияние поверхностного натяжения (влияние 22/а), а также влияние вязкости и сжимаемости жидкости. [c.259]
Введя сжимаемость жидкости в виде
[c. 232]
232]
В случае сжимаемой жидкости давление должно уравновешивать массовые силы, а функции и, v, w, ро необходимо подчинить уравнению энергии. [c.184]
При учете сжимаемости жидкости появится новое число подобия — число Маха М = У/а, где а — скорость звука в сжимаемой жидкости. Это число подобия тоже войдет в критериальную зависимость типа (46). [c.561]
Рассмотрим движение газа (сжимаемой жидкости) параллельно оси Ох. Такое движение газа называют одномерным. В случае одномерного движения = г = 0. — V (х, I) и уравнения (45) в случае баротропного процесса [c.565]
Объем жидкости, протекающей через поперечное сечение трубки, отнесенный к единице времени, называется расходом. Расход вдоль трубки тока будет постоянным, если пренебречь сжимаемостью жидкости. Назовем далее отнесенное к единице времени количество движения жидкости, протекающее через поперечное сечение трубки тока, потоком количества движения. [c.52]
[c.52]
В этой книге не излагается значительно более сложная и менее наглядная теория пограничного слоя в сжимаемой жидкости. Сжимаемость должна учитываться при скоростях, сравнимых со скоростью звука (или превышающих ее). Ввиду возникающего при этом сильного разогрева газа и обтекаемого тела оказывается необходимым рассматривать уравнения движения в пограничном слое совместно с уравнением теплопередачи в нем. Может оказаться также необходимым учет температурной зависимости коэффициентов вязкости н теплопроводности газа, [c.230]
Следует иметь в виду, что при тех больших скоростях, когда наступает кризис сопротивления, может уже стать заметным влияние сжимаемости жидкости. Параметром, характеризующим степень этого влияния, является число M=J7/ , где с — скорость звука жидкость можно рассматривать как несжимаемую, если М С 1 ( 10). Поскольку из двух чисел М и R лишь одно содержит размеры тела, то эти числа могут меняться независимо друг от друга.
 [c.257]
[c.257]Переходя к изучению движения сжимаемой жидкости (или газа), мы начнем с исследования малых колебаний в ней колебательное движение с малыми амплитудами в сжимаемой жидкости называют звуковыми волнами. В каждом месте жидкости в звуковой волне происходят попеременные сжатия и разрежения. [c.350]
Эта формула представляет собой обобщение формулы (16,3) на случай сжимаемой жидкости и наличия теплопроводности.
Когда скорость движения жидкости делается сравнимой со скоростью звука или превышает ее, на передний план выдвигаются эффекты, связанные с сжимаемостью жидкости. С такого рода движениями приходится на практике иметь дело у газов. Поэтому о гидродинамике больших скоростей говорят обычно как о газодинамике. [c.441]
Тангенциальные разрывы, на которых испытывают скачок касательные компоненты скорости, рассматривались нами уже в 29. Там было показано, что в несжимаемой жидкости такие разрывы неустойчивы и должны размываться в турбулентную область.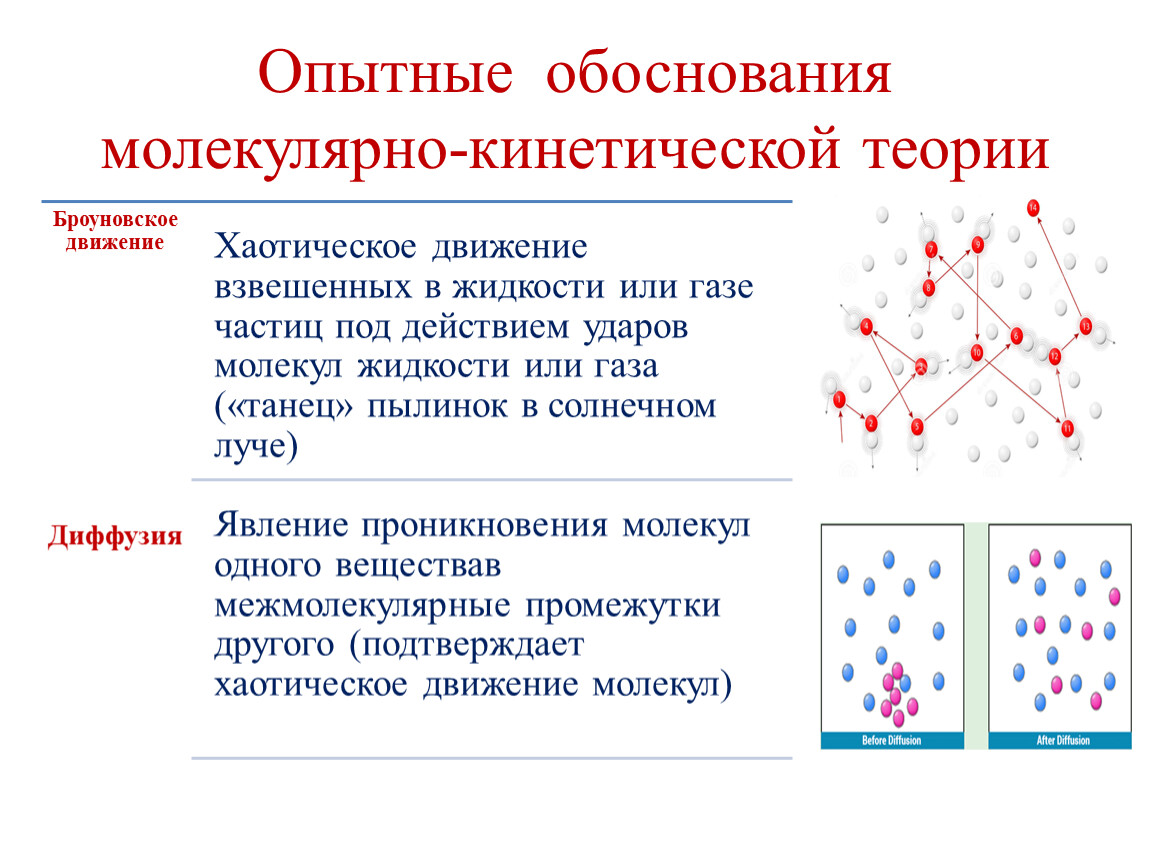 Аналогичное исследование для сжимаемой жидкости показывает, что такая неустойчивость имеет место и в общем случае произвольных скоростей (см. задачу 1).
[c.452]
Аналогичное исследование для сжимаемой жидкости показывает, что такая неустойчивость имеет место и в общем случае произвольных скоростей (см. задачу 1).
[c.452]
ПренеГфсгать сжимаемостью жидкости, как это обычно допускается в задачах гидравлики, и данном случав нельзя, так как малая сжимаемость жидкости и являете) причиной Еоэпикнопепия большого, ио конечного ударного даьленин. [c.141]
Действительная подача насоса меньше идеальной вследствие утечек через зазоры нз рабопих камер и полости нагнетання, а при больших давлениях насоса еще н за счет сжимаемости жидкости. [c.274]
Влияние сжимаемости жидкости растет с уоеличением давления насоса. На рис. 3.9 приведен график подачи трехцилиндрового насоса, аналогичный гра [c.286]
На том же графике нанесены наклонные прямые зависимости Mj. от И[, при постоянных значениях рабочего объема или, что то же, при е onst и = onst. Эти прямые представляют нагрузочные характеристики гидропривода, которые были показаны на рис. 3.94. Их наклон характеризует уменьшение частоты вращения выходного вала гидропривода (просадку) с возрастанием давления рг из-за утечек li сжимаемости жидкости.
Эти прямые представляют нагрузочные характеристики гидропривода, которые были показаны на рис. 3.94. Их наклон характеризует уменьшение частоты вращения выходного вала гидропривода (просадку) с возрастанием давления рг из-за утечек li сжимаемости жидкости.
В некоторых случаях многофазная смесь может быть описана в рамках одной из известных классических моделей, в которых неоднородность отражается в значениях модулей, коэффициентов сжимаемости, теплоемкостей и т. д. (заранее определяемых через физические свойства фаз), т. е. только в уравнениях состояния смеси (см. 5 гл. 1). Например, жидкость с пузырями может иногда описываться в рамках идеальной сжимаемой жидкости, а грунт — в рамках упругой или упруго-пластической модели. Но при более интенсивных нагрузках, скоростях движения или в ударных процессах эти классические модели обычно перестают работать и требуется введение новых моделей и новых параметров, в частности, последовательно учитывающих неоднофазность, а именно существенно различное поведение фаз (различие плотностей, скоростей, давлений, температур, деформаций и т.
Дисперсные смеси двух сжимаемых фаз с фазовыми превращениями. Рассмотрим подробнее гетерогенную смесь двух сжимаемых жидкостей т = 2), в каждой из которых отсутствуют эффекты нрочностп.

В данном уравнении используют поправки, учитывающие в некотором, так называемом квазиакустическом приближении малую сжимаемость жидкости, которая может приводить к акустическому излучению энергии пульсационного радиального движения в бесконечность и к дополнительному сдвигу фаз между пульсациями давления в жидкости и скоростью стенок пузыря. Эти поправки (см.
Эти уравнения можно обобщить для учета акустического излучения из-за сжимаемости жидкости с помощью уравнения (5.8.6а) и для учета возможной неадиабатичности поведения газа с помощью показателя политропы п, где п = 1 для изотермического поведения газа (0g = 0) и п = 7 для адиабатического поведения [c.301]
Это связано с трудностями, определяемыми, с одной стороны, малыми размерами вихревых труб, а с другой — существенными радиальными фздиентами параметров, что усложняет само измерение и заметно снижает его точность. Зонды калибруют обычно в безградиентном комбинированном потоке, что приводит к появлению заметной по величине систематической погрешности при измерении в трехмерном закрученном потоке сжимаемой жидкости в условиях высоких значений радиального фадиента давления.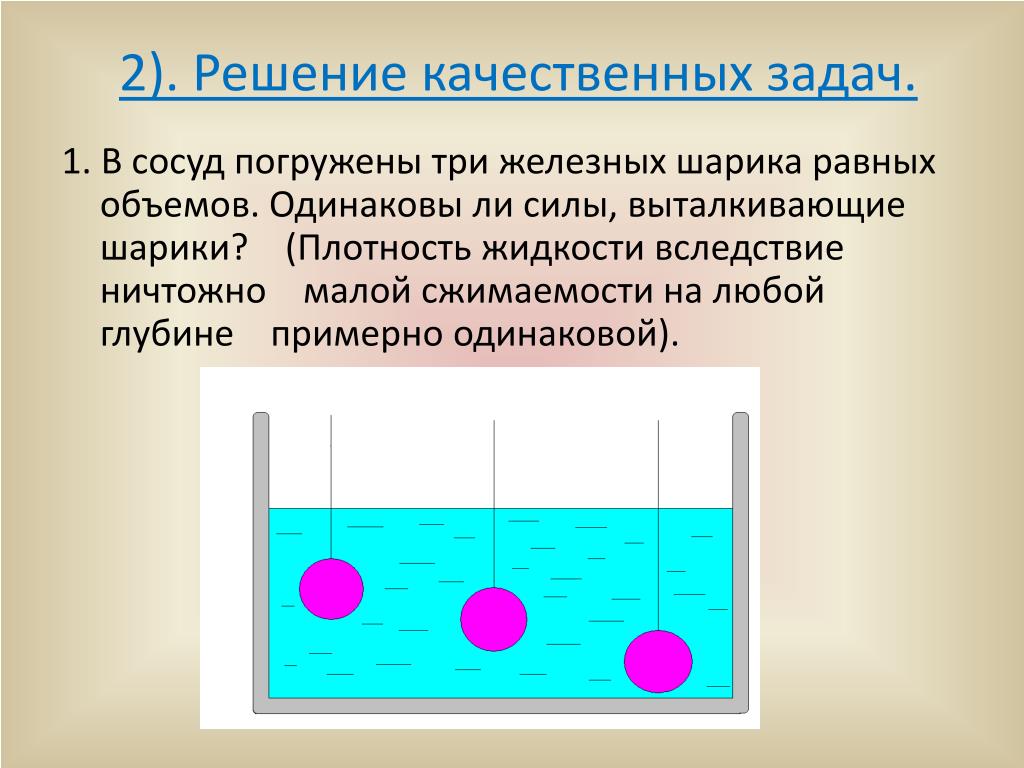
Однако устойчивость будет наблюдается и при политропном распределении с показателем политропы I процесс переноса тепла против градиента температуры обусловлен крупномасштабной турбулентностью. Хин-це считает также, что аномальная температура в следе за телами при их обтекании сжимаемыми жидкостями с большим числом Маха [197] может быть объяснена переносом энергии при совершении турбулентными молями квазимикрохолодильных циклов. По мнению Хинце [197], это явление объясняет и физическую сущность эффекта Ранка. К тому же выводу приходят И.И. Гусев и Ф.Д. Кочанов [35], получившие для плоского кругового потока в сопловом сечении политропное распределение параметров [c.165]
На динамику парового пузырька в жидкости влияют различные факторы, зависящие от стадии его роста или охлопывания и от условий, в которых они происходят, в число этих факторов входят вязкость, поверхностное натяжение, сжимаемость жидкости, ее инерция и плотность теплового потока от пузырька к жидкости при конденсации или испарении. Исчерпывающий обзор по этому вопросу представлен в работе [218].
[c.134]
Исчерпывающий обзор по этому вопросу представлен в работе [218].
[c.134]
Кроме того, при ж = 1 Пр рц и и т]р т]. Решение уравнения (8.100) можно получить, используя метод Блазиуса [686] для пограничного слоя на плоской пластине аналогично тому, как используется метод Чепмена и Рубезина для адиабатического потока сжимаемой жидкости на плоской пластине [6861. [c.359]
Маррей [564] подробно исследовал различные аспекты неустойчивости в псевдоожиженных слоях, включая распространение малых возмущений, распространение поверхностной волны, горячив слои (сжимаемая жидкость), центробежные слои и электромагнитные эффекты. Рассмотрим метод, примененный им при исследовании распространения малых возмущений в двумерных (координаты X, у Т1 единичные векторы 1, несжимаемых слоях для случая рр/р 1, и учтем только влияние силы тяжести. Устойчивое состояние можно описать выражениями [c.411]
Для насоса, если пренебречь сжимаемостью жидкости в полостях насоса, неравномерностью подачи из-за кинематики, влиянием индикаторных характеристик, можно использовать эквивалентную схему, показанную на рис. 2.25. Здесь зависимый источник момента силы М и момент инерции J представляет механическую часть насоса, зависимый источник Qm и сопротивление утечки Ry — гидравлическую часть. Связь между подсистемами — гираторного типа. Поскольку применяются источ-
[c.106]
2.25. Здесь зависимый источник момента силы М и момент инерции J представляет механическую часть насоса, зависимый источник Qm и сопротивление утечки Ry — гидравлическую часть. Связь между подсистемами — гираторного типа. Поскольку применяются источ-
[c.106]
Рассмотрим земную атмосферу как покоящуюся сжимаемую жидкость, на которую действуют силы тяжести, наттравленные в сторону, противоположную радиусу Земли. [c.252]
В механике ньютоновских жидкостей рассматривают различные их модели, Наиболее простой моделью жидкости является несжимаемая идеальная жидкость, для которой плотность р = onst (несжимаемая) и коэффициент динамической вязкости р = О (идеальная). Другой моделью является вязкая несжимаемая жидкость. Для нее р = onst и р = = onst. Самой простой моделью сжимаемой жидкости является идеальная сага-маемая жидкость, или идеальный газ. Для него р = О, а плотность уже не является постоянной. Она для совершенного газа связана с давлением р и температурой Т уравнением состояния (уравнением Клапейрона)
[c. 557]
557]
Уменьшение объема при постоянном давлении может происходить до тех пор, пока весь газ в сосуде не превратится в нсидкость. Дальнейшее уменьшение объема приводит к резкому возрастанию давления. Это объясняется малой сжимаемостью жидкости. [c.87]
Гидравлика и аэродинамика (1975) — [ c.10 ]
Гидравлика и аэродинамика (1987) — [ c.9 ]
Гидравлика и гидропривод (1970) — [ c.10 ]
Жидкости для гидравлических систем (1965) — [ c.20 , c.112 , c.113 , c.290 , c.291 ]
Справочное пособие по гидравлике гидромашинам и гидроприводам
(1985) — [
c. 8
,
c.9
,
c.17
,
c.256
]
8
,
c.9
,
c.17
,
c.256
]
Гидроаэромеханика (2000) — [ c.11 , c.48 ]
Пластичность и разрушение твердых тел Том1 (1954) — [ c.47 ]
Ультразвук и его применение в науке и технике Изд.2 (1957) — [ c.213 ]
Сжимаемость жидкостей и газов — Энциклопедия по машиностроению XXL
из «Физические основы механики »
Знак минус взят затем, чтобы К было положительно (А1/ и Ар всегда противоположны по знаку). [c.502]При очень больших давлениях коэффициент сжимаемости падает (сжимаемость жидкостей уменьшается).
 Коэффициент сжимаемости /Сзависит от температуры жидкости. Значения К при не слишком больших давлениях и температуре 0° для некоторых жидкостей приведены в таблице.
[c.503]
Коэффициент сжимаемости /Сзависит от температуры жидкости. Значения К при не слишком больших давлениях и температуре 0° для некоторых жидкостей приведены в таблице.
[c.503]
Сжимаемость газов тем меньше, чем больше давление. [c.503]
Если для газов мы ограничимся такими же малыми относительными изменениями объема, с которыми обычно имеют дело в жидкостя х, то сжимаемость газов можно считать постоянной и сравнивать ее со сжимаемостью жидкостей при том же давлении. Как следует из (15.6), при давлении р = 1 кПсм для всех газов К = I см ЫГ. Так как для воды при р = 1 кГ/см К — Ъ — 10 5 см кГ, то сжимаемость газов при атмосферном давлении в 20 ООО раз больше, чем сжимаемость воды. [c.504]
Большое количественное различие в сжимаемости жидкостей и газон приводит к существенным различиям в их поведении. Очень эффектно это различие выступает в следующем опыте. Если в эбонитовую банку, налитую водой, выстрелить (из мелкокалиберной винтовки) так чтобы пуля попала выше уровня воды, то банка остается целой (пуля лишь пробивает небольшое отверстие).
 Если же пуля пробивает банку на несколько сантиметров под уровнем воды, то банка разлетается вдребезги. Объясняется это очень малой сжимаемостью воды. Когда пуля вгоняется в воду, она должна либо сжать воду на величину своего объема, либо вытеснить ее наверх. Не только в первом, но и во втором случае в воде должны возникнуть огромные силы (так как пуля вгоняется быстро и вода должна вытесняться с большим ускорением). Эти силы и разрывают банку.
[c.504]
Если же пуля пробивает банку на несколько сантиметров под уровнем воды, то банка разлетается вдребезги. Объясняется это очень малой сжимаемостью воды. Когда пуля вгоняется в воду, она должна либо сжать воду на величину своего объема, либо вытеснить ее наверх. Не только в первом, но и во втором случае в воде должны возникнуть огромные силы (так как пуля вгоняется быстро и вода должна вытесняться с большим ускорением). Эти силы и разрывают банку.
[c.504]
Аналогичные явления происходят и при разрыве глубинных бомб, применяемых против погрузившихся подводных лодок. При разрыве бомбы на глубине вследствие малой сжимаемости в воде возникают очень большие силы, которые раздавливают лодку. [c.504]
Малая сжимаемость жидкостей позволяет во многих случаях вообще пренебрегать изменениями объема жидкостей, т. е. рассматривать абсолютно несжимаемые жидкости. Это означает следующее даже если изменения объема жидкости под действием внешних сил столь малы, что этими изменениями в рассматриваемых задачах можно пренебречь, однако уже при этих изменениях объема возникают столь большие упругие силы, что дальнейшее уменьшение объема жидкости практически прекращается.
 В последующем изложении мы в большинстве случаев будем рассматривать жидкость как несжимаемую (обратное мы всегда будем оговаривать).
[c.504]
В последующем изложении мы в большинстве случаев будем рассматривать жидкость как несжимаемую (обратное мы всегда будем оговаривать).
[c.504]
Вернуться к основной статье
Тест по физике 7 класс «Строение вещества»
Вариант I
1. К физическим телам относятся
А) молоко, Б) глина, В) скамейка, Г) лыжи.
2. К веществам относятся
А) сахар, Б) булка, В) йод, Г) бинт.
3. Мельчайшие частицы, из которых состоят вещества, называются
А) молекулами, Б) микрочастицами, В) крупинками.
4. Между молекулами в веществе происходит
А) взаимное притяжение и отталкивание, Б) только притяжение, В) только отталкивание.
5. Чем отличаются молекулы воды от молекул водяного пара
А) числом атомов, Б) размером, В) свойствами, Г) ничем.
6. Диффузия – это
А) перемешивание веществ, Б) увеличение промежутков между молекулами, В) движением молекул,
Г) проникновение хаотически движущихся молекул одного вещества в промежутки между молекулами другого вещества.
7. В каких телах – газах, жидкостях, твердых телах – диффузия происходит быстрее?
А) в жидкостях, Б) в твердых телах, В) в газах, Г) одинаково во всех телах.
8. Как следует поступить, чтобы ускорить диффузию?
А) охладить контактирующие тела, Б) положить их в темное место, В) повысить температуру тел,
Г) уменьшить площадь границы между ними.
9. Какие общие свойства присуще газам?
А) Легко охлаждаются, Б) занимают весь предоставленный им объем, В) имеют собственную форму, Г) обладают текучестью.
10. Какими общими свойствами обладают жидкости?
А) занимают объем того сосуда, в который налиты, Б) приобретают объем и форму сосуда,
В) имеют собственный объем, Г) мало сжимаемы.
11. Какие общие свойства принадлежат твердым телам?
А) имеют собственную форму и объем, Б) легко изменяют форму и объем, В) легко сжимаемы,
Г) практически несжимаемы.
12. В каком состоянии – жидком, твердом, газообразном – может находиться бензин?
А) во всех трех состояниях, Б) только в жидком состоянии, В) в жидком и газообразном,
Г) в жидком и твердом.
13. Чем объясняется малая сжимаемость твердых тел?
А) быстрым движением их молекул, Б) очень малым размером молекул, В) плотной упаковкой молекул и малостью промежутков между ними, Г) хаотичностью движения молекул.
14. Почему газы не имеют собственной формы?
А) потому что их молекулы быстро движутся, Б) из-за диффузии, В) потому что молекулы газа, практически не взаимодействуя, двигаясь свободно и хаотично, достигают всех стенок сосуда, и газ принимает его форму.
15. Чем можно объяснить сохранение жидкостью своего объема?
А) довольно сильным притяжением молекул друг к другу, Б) не очень быстрым движением молекул, В) отсутствием диффузии, Г) тем, что молекулы жидкости не отталкиваются друг от друга.
Вариант II
1. К физическим телам относятся
А) сок, Б) здание, В) песок, Г) вилка.
2. К веществам относятся
А) провод, Б) медь, В) лед, Г) ведро.
3. Все вещества состоят из мельчайших частиц, которые называются
А) неделимыми частицами, Б) микрочастицами, В) молекулами, Г) атомами.
4. Взаимодействие молекул вещества проявляется в
А) в их отталкивании друг от друга, Б) их притяжении друг от друга, В) их притяжении и отталкивании, Г) отсутствии и притяжения, и отталкивания.
5. Чем отличаются молекулы восковой свечи и молекулы застывшей капли воска?
А) размером, Б) формой, В) свойствами, Г) ничем.
6. Какое из названных явлений — диффузия
А) взаимное притяжение молекул, Б) взаимное отталкивание молекул, В) проникновение хаотически движущихся молекул одного вещества в промежутки между молекулами другого вещества,
Г) перемешивание веществ.
7. В каком случае диффузия происходит медленнее?
А) контактирующие тела сильно прижали друг к другу, Б)тела охладили, В) их нагрели,
Г) тела придвинули к нагревателю.
8. В каких телах – газах, жидкостях, твердых телах – диффузия происходит быстрее всего?
А) в газах, Б) в жидкостях, В) в твердых телах, Г) неизвестно.
9. Какие общие свойства характерны для твердых тел?
А) Легкая сжимаемость, Б) собственный объем и форма, В) собственный только объем,
Г) практическая несжимаемость.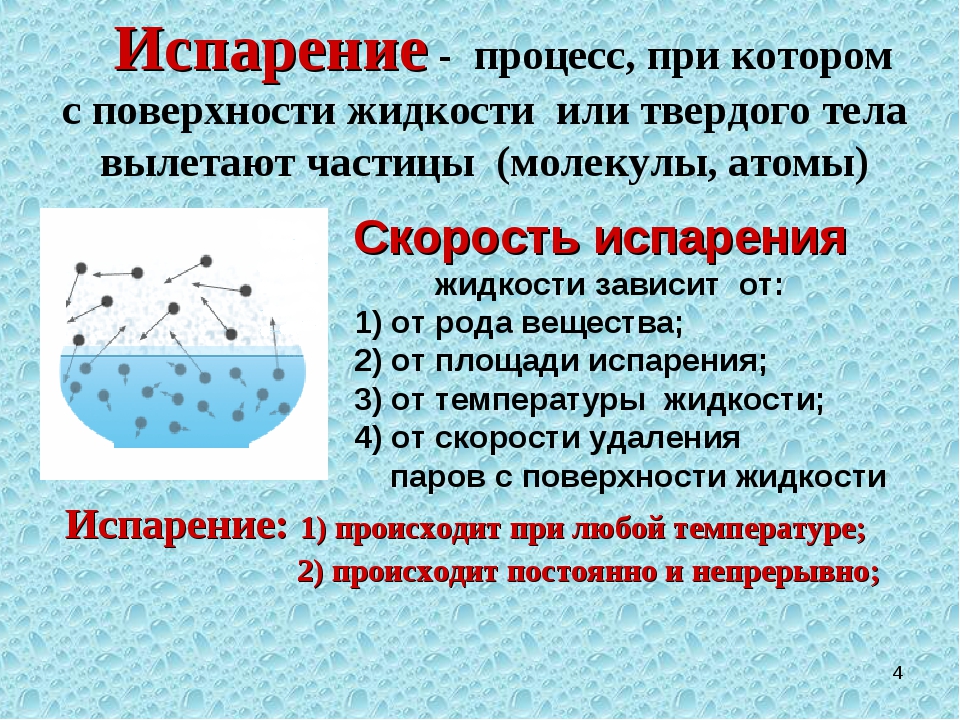
10. Какими общими свойствами обладают жидкости?
А) текучестью, позволяющей им переливаться и принимать форму сосуда, Б) отсутствием собственного объема, В) наличием собственного объема и малой сжимаемости, Г) легкой сжимаемостью.
11. Какие общие свойства присуще газам?
А) текучесть, Б) большая сжимаемость, В) заполнение всего предоставленного им объема и отсутствие собственной формы, Г) наличие собственного объема.
12. В каком состоянии – жидком, твердом, газообразном – может быть водород?
А) в твердом, Б) в жидком , В) в виде газа, Г) в зависимости от условий в любом из них.
13. Почему жидкости принимают форму сосуда?
А) из-за отталкивания их молекул друг от друга, Б) потому что молекулы жидкости, взаимодействуя не сильно, могут перемещаться относительно друг друга, В) потому что молекулы жидкости двигаются быстро, Г) потому что молекулы жидкости не взаимодействуют.
14. Чем можно объяснить сохранение твердым телом своего объема?
А) малостью промежутков между молекулами твердого тела, Б) отсутствием притяжения его молекул друг к другу, В) слабостью взаимного отталкивания молекул, Г) сильным взаимодействием молекул твердого тела.
15. Почему газы не имеют собственной формы?
А) молекулы газа удалены друг от друга на такие расстояния, что не взаимодействуют и двигаясь хаотически, занимают свободное пространство. Б) из-за диффузии, В) потому что молекулы газа быстро двигаются, Г) из-за сильного отталкивания друг от друга.
Вариант III
1. К физическим телам относятся
А) парта, Б) сахар, В) бензин, Г) комар.
2. К веществам относятся
А) соль, Б) сталь, В) рыба, Г) раковина.
3. Молекула — это
А) невидимая глазом частица, Б) очень маленькая частица тела, В) мельчайшая частица вещества.
4. Молекулы в веществе взаимодействуют:
А) притягиваются друг к другу, Б) отталкиваются друг от друга, В) в зависимости от расстояния между ними преобладает то притяжение, то отталкивание.
5. Чем отличаются молекулы в куске свинца от молекул в расплавленном свинце?
А) ничем, Б) числом атомов, В) свойствами, Г) размерами.
6. Какое из приведенных явлений – диффузия?
Какое из приведенных явлений – диффузия?
А) проникновение хаотически движущихся молекул одного вещества в промежутки между молекулами другого вещества, Б) перемешивание жидких веществ, В) сокращение промежутков между молекулами при сжатии тел, Г) перемещение одних молекул среди других по промежуткам между ними.
7.Чтобы диффузия происходила быстрее, надо
А) охладить контактирующие тела, Б) положить их в темное место, В) повысить температуру тел,
Г) отодвинуть от нагревателя.
8. В каком теле – газообразном, жидком, твердом теле – диффузия происходит медленнее?
А) в твердом, Б) в жидком, В) в газообразном, Г) одинаково во всех телах.
9. Какие общие свойства имеют газы?
А) собственную форму, Б) собственный объем, В) отсутствие собственного объема и формы,
Г) легкую сжимаемость.
10. Какие общие свойства характерны для твердых тел?
А) наличие собственных формы и объема, Б) сохранение объема и изменчивость формы, В) отсутствие собственных объема и формы, Г) сохранение формы и изменчивость объема.
11. Какими общими свойствами обладают жидкости?
А) собственной формой, Б) собственным постоянным объемом,
В) малой сжимаемостью, Г) способность занимать объем сосуда.
12. В каком состоянии – жидком, твердом, газообразном – может быть свинец?
А) в твердом, Б) в жидком, В) в газообразном,
Г) во всех трех состояниях
13. Почему газы занимают все предоставленное им пространство?
А) потому что их молекулы быстро движутся, Б) из-за отталкивания молекул друг от друга, В) вследствие диффузии, Г) потому что молекулы газа практически не взаимодействуют и движутся во всех направлениях.
14. Как движутся и взаимодействуют молекулы твердого тела?
А) слабо взаимодействуют и движутся хаотично, но медленно, Б) сильно взаимодействуют и не движутся, В) сильно взаимодействуют, каждая молекула колеблется около определенной точки.
15. Чем объясняется малая сжимаемость жидкостей?
А) достаточно близким друг к другу расположением молекул, Б) относительно большими размерами их молекул, В) быстротой движения молекул.
Вариант IV
1. К физическим телам относятся
А) бабочка, Б) графит, В) масло, Г) бутылка.
2. К веществам относятся
А) карандаш, Б) вертолет, В) сыр, Г) бронза.
3. Мельчайшие частицы, из которых состоят тела, называются
А) молекулами, Б) неделимыми частицами, В) вездесущими частицами.
4. Взаимодействие молекул вещества — это
А) их отталкивание друг от друга, Б) их притяжение друг от друга, В) притяжение и отталкивание в зависимости от расстояния между ними.
5. Чем отличаются молекулы сливочного масла в пачке от его молекул в растопленном виде?
А) размером, Б) числом атомов, В) ничем, Г) свойствами.
6. Какое из названных явлений — диффузия?
А) увеличение промежутков между молекулами при их растяжении, Б) притяжение и отталкивание молекул, В) проникновение хаотически движущихся молекул одного вещества в промежутки между молекулами другого вещества, Г) перемешивание веществ.
7. В каких телах – газах, жидкостях, твердых телах – диффузия происходит наиболее медленно?
В каких телах – газах, жидкостях, твердых телах – диффузия происходит наиболее медленно?
А) в газах, Б) в жидкостях, В) в твердых телах, Г) одинаково во всех телах.
8. Замедлить диффузию можно, если?
А) нагреть контактирующие тела, Б) охладить тела, В) сильно прижать их друг другу,
Г) переставить тела с одного стола на другой.
9. Какие общие свойства характерны для жидкостей?
А) заполнение всего объема сосуда, Б) отсутствие определенной формы,
В) имеют собственный объем и мало сжимаемы Г) легкая сжимаемость.
10. Какие общие свойства присуще газам?
А) занимают весь предоставленный им объем, Б) не имеют собственного объема и формы, В) плохо сжимаемы, Г) сохраняют свои форму и объем.
11. Какие из указанных свойств принадлежат твердому телу?
А) практическая несжимаемость, Б) способность легко приобретать любую форму, В) отсутствие собственного постоянного объема, Г) имеют собственную форму и объем.
12. В каком состоянии – жидком, твердом, газообразном – может находиться олово?
В каком состоянии – жидком, твердом, газообразном – может находиться олово?
А) в твердом, Б) в любом, В) в жидком, Г) в газообразном.
13. Как объяснить легкую сжимаемость газов?
А) притяжением молекул друг к другу, Б) хаотичностью движения молекул, В) относительно большими промежутками между молекулами газов, Г) большой скоростью их молекул.
14.Чем вызвано сохранении твердым телом своей формы?
А) постоянным действием притяжения молекул, Б) постоянным действием отталкивания молекул,
В) непрерывным движением молекул, Г) сильным взаимодействием молекул.
15. Чем объясняется текучесть жидкости?
А) быстрым движением молекул, Б) сильным отталкиванием молекул друг от друга, В) относительно слабым притяжением молекул друг к другу, Г) среди ответа нет верного.
Модели строения газов, жидкостей и твердых тел в МКТ — Молекулярная физика
Газ
Французское слово gaz (газ) произошло от греческого слова «хаос», что означает «полный беспорядок», «неразбериха» (в древнегреческой мифологии хаос — зияющая бездна, наполненная туманом и мраком, якобы существовавшая до сотворения мира).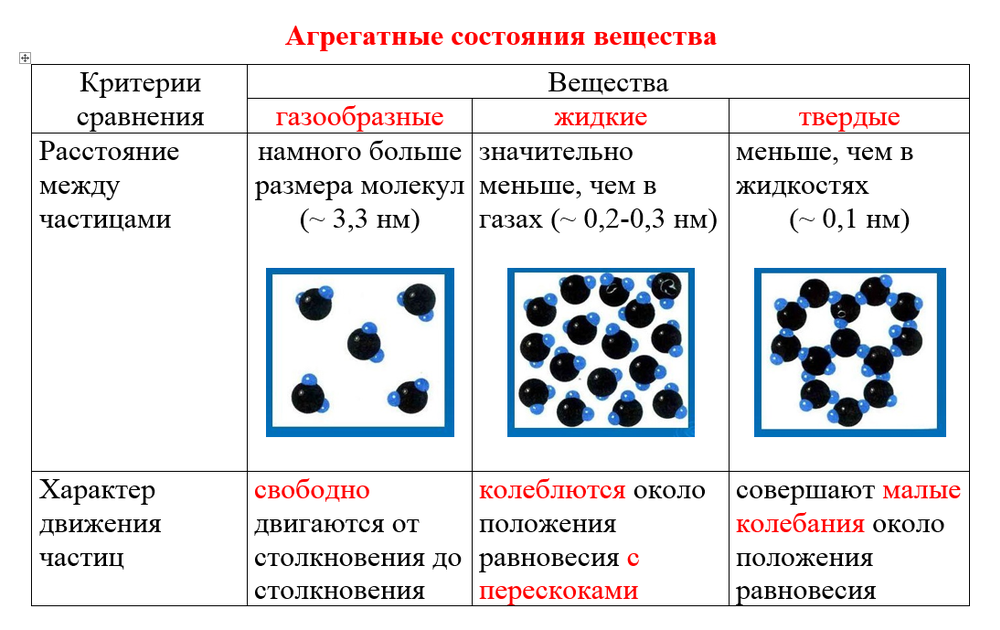
Термин «газ» был введен в начале XVII в. Я. Б. ван Бельмонтом. Действительно, модель молекулярного хаоса оказалась весьма плодотворной и сохранила свое значение для современных исследований.
Газ — это агрегатное состояние вещества, в котором составляющие его атомы и молекулы почти свободно и хаотически движутся в промежутках между столкновениями. Во время столкновения молекулы резко меняют скорость и направление своего движения. Время столкновения молекул намного меньше промежутка времени между двумя столкновениями.
Объем, занимаемый газом, значительно сильнее зависит от давления и температуры, чем объем жидкостей и твердых тел.
Газ можно сжать так, что его объем уменьшится в несколько раз. Это значит, что расстояние между молекулами I намного больше размеров самих молекул: I ˃˃ d. На таких расстояниях молекулы очень слабо притягиваются друг к другу. По этой причине газы не имеют собственной формы и постоянного объема. Нельзя заполнить газом, например, половину бутылки или стакана.
В отличие от жидкостей и твердых тел газы не образуют свободной поверхности и заполняют весь доступный им объем.
Газообразное состояние — самое распространенное состояние вещества Вселенной (межзвездное вещество, туманности, звезды, атмосферы планет). По химическим свойствам газы и их смеси очень разнообразны — от малоактивных инертных газов до взрывчатых смесей.
Давление газа. Беспрерывно и хаотически двигаясь, молекулы газа сталкиваются не только друг с другом, но и со стенками сосуда, в котором находится газ. Молекул в газе много, потому и число их ударов очень велико. Например, число ударов молекул воздуха, находящегося в комнате, о поверхность площадью 1 см2 за 1 с, выражается двадцатитрехзначным числом. Хотя сила удара одной молекулы мала, но действие всех молекул на стенки сосуда значительно, оно и составляет давление газа.
Итак, давление газа на стенки сосуда и на помещенное в газ тело вызывается ударами молекул газа.
Жидкость
Жидкость — вещество в состоянии, промежуточном между твердым и газообразным. Это агрегатное состояние вещества, в котором молекулы (или атомы) связаны между собой настолько, что это позволяет ему сохранять свой объем, но недостаточно сильно, чтобы сохранять и форму.
Это агрегатное состояние вещества, в котором молекулы (или атомы) связаны между собой настолько, что это позволяет ему сохранять свой объем, но недостаточно сильно, чтобы сохранять и форму.
Свойства жидкостей. Жидкости легко меняют свою форму, но сохраняют объем. В обычных условиях они принимают форму сосуда, в котором находятся.
Поверхность жидкости, не соприкасающаяся со стенками сосуда, называется свободной поверхностью. Она образуется в результате действия силы тяжести на молекулы жидкости.
Строение жидкостей. Свойства жидкостей объясняются тем, что промежутки между их молекулами малы: молекулы в жидкостях упакованы так плотно, что расстояние между каждыми двумя молекулами меньше размеров молекул. Объяснение поведения жидкостей на основе характера молекулярного движения жидкости было дано советским ученым Я. И. Френкелем. Оно заключается в следующем. Молекула жидкости колеблется около положения временного равновесия, сталкиваясь с другими молекулами из ближайшего окружения. Время от времени ей удается совершить «прыжок», чтобы покинуть своих соседей из ближайшего окружения и продолжать совершать колебания уже среди других соседей. Время оседлой жизни молекулы воды, т. е. время колебания около одного положения равновесия при комнатной температуре, равно в среднем 10-11 с. Время одного колебания значительно меньше — 10-12 — 10-13 с.
Время от времени ей удается совершить «прыжок», чтобы покинуть своих соседей из ближайшего окружения и продолжать совершать колебания уже среди других соседей. Время оседлой жизни молекулы воды, т. е. время колебания около одного положения равновесия при комнатной температуре, равно в среднем 10-11 с. Время одного колебания значительно меньше — 10-12 — 10-13 с.
Поскольку расстояния между молекулами жидкости малы, то попытка уменьшить объем жидкости приводит к деформации молекул, они начинают отталкиваться друг от друга, чем и объясняется малая сжимаемость жидкости. Текучесть жидкости объясняется тем, что «прыжки» молекул из одного оседлого положения в другое происходят по всем направлениям с одинаковой частотой. Внешняя сила не меняет заметным образом число «прыжков» в секунду, она лишь задает их преимущественное направление, чем и объясняется текучесть жидкости и то, что она принимает форму сосуда.
Твердое тело. Кристаллические и аморфные тела
Твердое тело — агрегатное состояние вещества, характеризующееся постоянством формы и характером движения атомов, которые совершают малые колебания около положений равновесия.
Кристаллические тела. Твердое тело в обычных условиях трудно сжать или растянуть. Для придания твердым телам нужной формы или объема на заводах и фабриках их обрабатывают на специальных станках: токарных, строгальных, шлифовальных.
В отсутствие внешних воздействий твердое тело сохраняет свою форму и объем.
Это объясняется тем, что притяжение между атомами (или молекулами) у них больше, чем у жидкостей (и тем более газов). Оно достаточно, чтобы удержать атомы около положений равновесия.
Молекулы или атомы большинства твердых тел, таких, как лед, соль, алмаз, металлы, расположены в определенном порядке. Такие твердые тела называют кристаллическими.Хотя частицы этих тел и находятся в движении, движения эти представляют собой колебания около определенных точек (положений равновесия). Частицы не могут уйти далеко от этих точек, поэтому твердое тело сохраняет свою форму и объем.
Кроме того, в отличие от жидкостей, точки положений равновесия атомов или ионов твердого тела, будучи соединенными, располагаются в вершинах правильной пространственной решетки, которая называется кристаллической.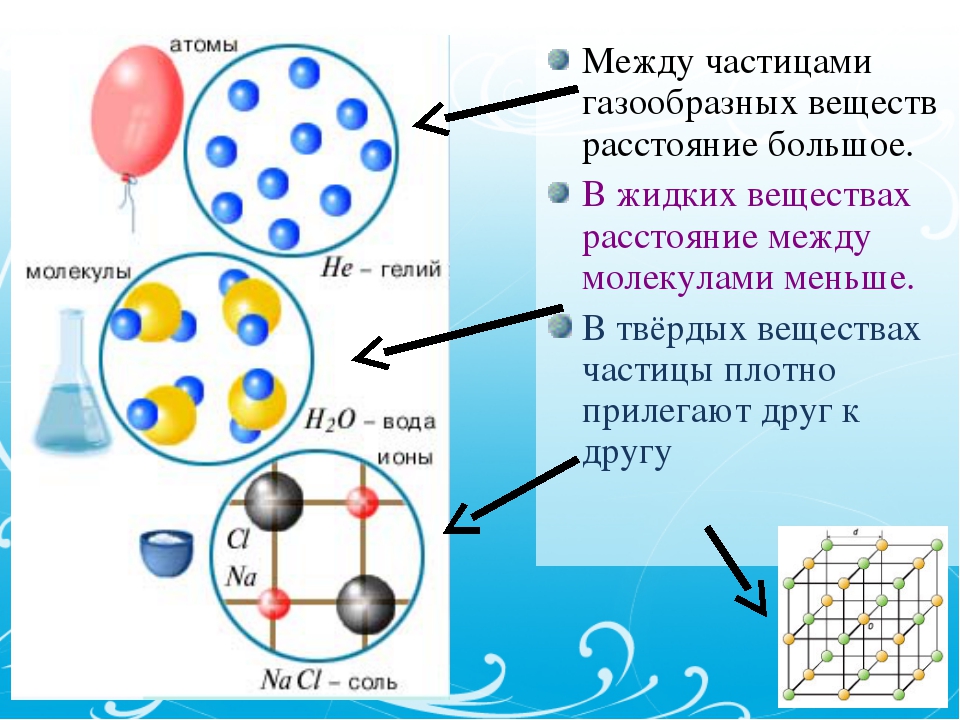
Положения равновесия, относительно которых происходят тепловые колебания частиц, называются узлами кристаллической решетки.
Монокристалл — твердое тело, частицы которого образуют единую кристаллическую решетку (одиночный кристалл).
Анизотропия монокристаллов. Одним из главных свойств монокристаллов, которым они отличаются от жидкостей и газов, является анизотропия их физических свойств. Поданизотропией понимают зависимость физических свойств от направления в кристалле. Анизотропными являются механические свойства (например, известно, что слюду легко расслоить в одном направлении и очень трудно — в перпендикулярном), электрические свойства (электропроводность многих кристаллов зависит от направления), оптические свойства (явление двойного лучепреломления, и дихроизма — анизотропии поглощения; так, например, монокристалл турмалина «окрашен» в разные цвета — зеленый и бурый, в зависимости от того, с какой стороны на него посмотреть).
Поликристалл — твердое тело, состоящее из беспорядочно ориентированных монокристаллов. Поликристаллическими являются большинство твердых тел, с которыми мы имеем дело в быту — соль, сахар, различные металлические изделия. Беспорядочная ориентация сросшихся микрокристалликов, из которых они состоят, приводит к исчезновению анизотропии свойств.
Аморфные тела. Кроме кристаллических, к твердым телам относят также аморфные тела. Аморфный в переводе с греческого означает «бесформенный».
Аморфные тела — это твердые тела, для которых характерно неупорядоченное расположение частиц в пространстве.
В этих телах молекулы (или атомы) колеблются около хаотически расположенных точек и, подобно молекулам жидкости, имеют определенное время оседлой жизни. Но, в отличие от жидкостей, время это у них очень велико.
К аморфным телам относятся стекло, янтарь, различные другие смолы, пластмассы. Хотя при комнатной температуре эти тела сохраняют свою форму, но при повышении температуры они постепенно размягчаются и начинают течь, как жидкости: у аморфных тел нет определенной температуры, плавления.
Этим они отличаются от кристаллических тел, которые при повышении температуры переходят в жидкое состояние не постепенно, а скачком (при вполне определенной температуре — температуре плавления).
Все аморфные тела изотропны, т. е. имеют одинаковые физические свойства по разным направлениям. При ударе они ведут себя как твердые тела — раскалываются, а при очень длительном воздействии — текут.
В настоящее время есть много веществ в аморфном состоянии, полученных искусственным путем, например, аморфные и стеклообразные полупроводники, магнитные материалы и даже металлы.
Свойства жидкостей — конспект — Химия и биология
Свойства жидкостей Реферат составил: студент 1 курса Овсянников А. В. Национальный университет Узбекистана Физический факультет Ташкент – 2004 Объемные свойства жидкостей Сжимаемость жидкостей Молекулы в жидкостях находятся близко друг к другу, примерно на расстояниях равных размерам самих молекул. Это является причиной высокого молекулярного ван-дер-ваальсового давления, которое равно . Для воды, например, он равен около 11000 атм. Удельный объем жидкостей в тысячи раз меньше чем газов, следовательно, отношение в жидкостях в миллионы раз больше, чем в газах. Поэтому можно пренебречь внешним давлением, и уравнение Ван-дер-Ваальса примет вид Большой величиной молекулярного давления объясняется ничтожно малая сжимаемость жидкостей. Это сразу видно из уравнения кривой Ван-дер-Ваальса, на которой жидкому состоянию соответствует участок AB (см. рис. 1). Коэффициент сжимаемости жидкости – относительное изменение объема dV при изменении давления на единицу т.е. Опыт показывает, что коэффициент сжимаемости большинства жидкостей лежит в пределах от 10-4 до 10-5 . Коэффициент сжимаемости жидкости зависит от давления. Он возрастает с повышением температуры. К этому результату можно прийти и опытным путем и исходя из уравнения Ван-дер-Ваальса. Поскольку это уравнение связывает температуру, объем и давление, то из него можно вычислить величину . При расчете необходимо учитывать, что постоянные a и b на самом деле зависят от температуры.
Для воды, например, он равен около 11000 атм. Удельный объем жидкостей в тысячи раз меньше чем газов, следовательно, отношение в жидкостях в миллионы раз больше, чем в газах. Поэтому можно пренебречь внешним давлением, и уравнение Ван-дер-Ваальса примет вид Большой величиной молекулярного давления объясняется ничтожно малая сжимаемость жидкостей. Это сразу видно из уравнения кривой Ван-дер-Ваальса, на которой жидкому состоянию соответствует участок AB (см. рис. 1). Коэффициент сжимаемости жидкости – относительное изменение объема dV при изменении давления на единицу т.е. Опыт показывает, что коэффициент сжимаемости большинства жидкостей лежит в пределах от 10-4 до 10-5 . Коэффициент сжимаемости жидкости зависит от давления. Он возрастает с повышением температуры. К этому результату можно прийти и опытным путем и исходя из уравнения Ван-дер-Ваальса. Поскольку это уравнение связывает температуру, объем и давление, то из него можно вычислить величину . При расчете необходимо учитывать, что постоянные a и b на самом деле зависят от температуры. Совокупность опытных данных позволила получить эмпирическую формулу для коэффициента сжимаемости жидкости: Рис.1 V A p B где A – некоторая функция, возрастающая с температурой, p – внешнее давление и pT – давление, связанное с силами Ван-дер-Ваальса (a/V2) при температуре T. Эта формула показывает, что коэффициент сжимаемости растет с повышением температуры и уменьшается с ростом давления. Среди всех жидкостей наибольшей сжимаемостью обладает жидкий гелий, у которого при давлении в несколько атмосфер коэффициент равен . Коэффициент сжимаемости воды равен , а ртути – . Тепловое расширение жидкости Тепловое расширение вещества характеризуется коэффициентом объемного расширения , т.е. относительным изменением объема V при изменении температуры T на 1 К. Числовые значения коэффициента сильно зависят от температуры и давления. Для различных жидкостей значения при одинаковых температурах могут меняться весьма значительно. Так, например, для воды , для бензола , для жидкой углекислоты , глицерина и т.
Совокупность опытных данных позволила получить эмпирическую формулу для коэффициента сжимаемости жидкости: Рис.1 V A p B где A – некоторая функция, возрастающая с температурой, p – внешнее давление и pT – давление, связанное с силами Ван-дер-Ваальса (a/V2) при температуре T. Эта формула показывает, что коэффициент сжимаемости растет с повышением температуры и уменьшается с ростом давления. Среди всех жидкостей наибольшей сжимаемостью обладает жидкий гелий, у которого при давлении в несколько атмосфер коэффициент равен . Коэффициент сжимаемости воды равен , а ртути – . Тепловое расширение жидкости Тепловое расширение вещества характеризуется коэффициентом объемного расширения , т.е. относительным изменением объема V при изменении температуры T на 1 К. Числовые значения коэффициента сильно зависят от температуры и давления. Для различных жидкостей значения при одинаковых температурах могут меняться весьма значительно. Так, например, для воды , для бензола , для жидкой углекислоты , глицерина и т. д. При повышении температуры сильно возрастает. Так для жидкой углекислоты при повышении температуры от 0° до 20° коэффициент теплового расширения возрастает вдвое. Увеличение давления несколько снижает значение . Вода обладает аномальным тепловым расширением. В интервале от 0° до 3,98° коэффициент отрицателен: при нагревании объем воды уменьшается и наибольшей плотности вода достигает при 3,98° C. При этой температуре = 0. Причиной этого явления является то, что молекулы воды имеют различный состав: не только h3O, но 2h3O и 3h3O. Относительные количества этих молекул меняются с температурой и давлением. Теплоемкость жидкостей Внутренняя энергия жидкостей определяется не только кинетической энергией тепловых движений частиц, но и их потенциальной энергией взаимодействия. Поэтому закономерности, полученные для теплоемкостей идеальных газов из уравнений кинетической теории, не могут быть справедливы для жидкостей. Опыт показывает, что теплоемкость жидкостей зависит от температуры, причем вид зависимости у разных жидкостей различный.
д. При повышении температуры сильно возрастает. Так для жидкой углекислоты при повышении температуры от 0° до 20° коэффициент теплового расширения возрастает вдвое. Увеличение давления несколько снижает значение . Вода обладает аномальным тепловым расширением. В интервале от 0° до 3,98° коэффициент отрицателен: при нагревании объем воды уменьшается и наибольшей плотности вода достигает при 3,98° C. При этой температуре = 0. Причиной этого явления является то, что молекулы воды имеют различный состав: не только h3O, но 2h3O и 3h3O. Относительные количества этих молекул меняются с температурой и давлением. Теплоемкость жидкостей Внутренняя энергия жидкостей определяется не только кинетической энергией тепловых движений частиц, но и их потенциальной энергией взаимодействия. Поэтому закономерности, полученные для теплоемкостей идеальных газов из уравнений кинетической теории, не могут быть справедливы для жидкостей. Опыт показывает, что теплоемкость жидкостей зависит от температуры, причем вид зависимости у разных жидкостей различный. У большинства из них теплоемкость с повышением температуры увеличивается, но есть и такие у которых, наоборот, — уменьшается. У некоторых жидкостей теплоемкость с повышением температуры сначала падает, а затем, пройдя через минимум, начинает расти. Такой ход теплоемкости наблюдается у воды. Жидкости с большим молекулярным весом обычно имеют большие значения теплоемкостей. Особенно это проявляется у органических жидкостей. обеспечивают существование поверхности и не позволяют молекулам покидать объем жидкости. Благодаря тепловому движению некоторая часть молекул имеет достаточно большие скорости, чтобы преодолеть силы, удерживающие молекулы в жидкости, и покинуть жидкость. Это явление называется испарением. Оно наблюдается при любой температуре, но его интенсивность возрастает с увеличением температуры. Если покинувшие жидкость молекулы удаляются из пространства вблизи поверхности жидкости, то, в конце концов, вся жидкость испарится. Если же молекулы, покинувшие жидкость не удаляются, то они образуют пар.
У большинства из них теплоемкость с повышением температуры увеличивается, но есть и такие у которых, наоборот, — уменьшается. У некоторых жидкостей теплоемкость с повышением температуры сначала падает, а затем, пройдя через минимум, начинает расти. Такой ход теплоемкости наблюдается у воды. Жидкости с большим молекулярным весом обычно имеют большие значения теплоемкостей. Особенно это проявляется у органических жидкостей. обеспечивают существование поверхности и не позволяют молекулам покидать объем жидкости. Благодаря тепловому движению некоторая часть молекул имеет достаточно большие скорости, чтобы преодолеть силы, удерживающие молекулы в жидкости, и покинуть жидкость. Это явление называется испарением. Оно наблюдается при любой температуре, но его интенсивность возрастает с увеличением температуры. Если покинувшие жидкость молекулы удаляются из пространства вблизи поверхности жидкости, то, в конце концов, вся жидкость испарится. Если же молекулы, покинувшие жидкость не удаляются, то они образуют пар. Молекулы пара, попавшие в область вблизи поверхности жидкости, силами притяжения втягиваются в жидкость. Этот процесс называется конденсацией. Таким образом, в случае неудаления молекул скорость испарения уменьшается со временем. При дальнейшем увеличении плотности пара достигается такая ситуация, когда число молекул, покидающих жидкость за некоторое время, будет равно числу молекул, возвращающихся в жидкость за то же время. Наступает состояние динамического равновесия. Пар в состоянии динамического равновесия с жидкостью называется насыщенным. С повышением температуры плотность и давление насыщенного пара увеличиваются. Чем выше температура, тем большее число молекул жидкости обладает энергией, достаточной для испарения, и тем большей, должна быть плотность пара, чтобы конденсация могла сравняться с испарением. Кипение Когда при нагревании жидкости достигается температура, при которой давление насыщенных паров равно внешнему давлению, устанавливается равновесие между жидкостью и ее насыщенным паром.
Молекулы пара, попавшие в область вблизи поверхности жидкости, силами притяжения втягиваются в жидкость. Этот процесс называется конденсацией. Таким образом, в случае неудаления молекул скорость испарения уменьшается со временем. При дальнейшем увеличении плотности пара достигается такая ситуация, когда число молекул, покидающих жидкость за некоторое время, будет равно числу молекул, возвращающихся в жидкость за то же время. Наступает состояние динамического равновесия. Пар в состоянии динамического равновесия с жидкостью называется насыщенным. С повышением температуры плотность и давление насыщенного пара увеличиваются. Чем выше температура, тем большее число молекул жидкости обладает энергией, достаточной для испарения, и тем большей, должна быть плотность пара, чтобы конденсация могла сравняться с испарением. Кипение Когда при нагревании жидкости достигается температура, при которой давление насыщенных паров равно внешнему давлению, устанавливается равновесие между жидкостью и ее насыщенным паром. При сообщении жидкости дополнительного количества теплоты происходит немедленное превращение соответствующей массы жидкости в пар. Этот процесс называется кипением. Температурой кипения является та температура, при которой давление насыщенных паров становится равным внешнему давлению. При увеличении давления температура кипения увеличивается, а при уменьшении — уменьшается. По причине изменения давления в жидкости с высотой ее столба, кипение на различных уровнях в жидкости происходит, строго говоря, при различной температуре. Определенную температуру имеет лишь насыщенный пар над поверхностью кипящей жидкости. Его температура определяется только внешним давлением. Именно эта температура имеется в виду, когда говорят о температуре кипения. Количество тепла, которое необходимо подвести, для того чтобы изотермически превратить в пар определенное количество жидкости, при внешнем давлении, равном давлению ее насыщенных паров, называется скрытой теплотой парообразования. Обычно эту величину соотносят к одному грамму, или одному молю.
При сообщении жидкости дополнительного количества теплоты происходит немедленное превращение соответствующей массы жидкости в пар. Этот процесс называется кипением. Температурой кипения является та температура, при которой давление насыщенных паров становится равным внешнему давлению. При увеличении давления температура кипения увеличивается, а при уменьшении — уменьшается. По причине изменения давления в жидкости с высотой ее столба, кипение на различных уровнях в жидкости происходит, строго говоря, при различной температуре. Определенную температуру имеет лишь насыщенный пар над поверхностью кипящей жидкости. Его температура определяется только внешним давлением. Именно эта температура имеется в виду, когда говорят о температуре кипения. Количество тепла, которое необходимо подвести, для того чтобы изотермически превратить в пар определенное количество жидкости, при внешнем давлении, равном давлению ее насыщенных паров, называется скрытой теплотой парообразования. Обычно эту величину соотносят к одному грамму, или одному молю. Количество теплоты, необходимое для изотермического испарения моля жидкости называется молярной скрытой теплотой парообразования. Если эту величину поделить на молекулярный вес, то получится удельная скрытая теплота парообразования. Список литературы А. К. Кикоин, И. К. Кикоин, Молекулярная физика, «Наука», 1976. Телеснин Р. В., Молекулярная физика, «Высшая школа», 1973. Матвеев А. Н., Молекулярная физика, «Высшая школа», 1987.
Количество теплоты, необходимое для изотермического испарения моля жидкости называется молярной скрытой теплотой парообразования. Если эту величину поделить на молекулярный вес, то получится удельная скрытая теплота парообразования. Список литературы А. К. Кикоин, И. К. Кикоин, Молекулярная физика, «Наука», 1976. Телеснин Р. В., Молекулярная физика, «Высшая школа», 1973. Матвеев А. Н., Молекулярная физика, «Высшая школа», 1987.
Жидкость в физике с формулой и примером
ЖидкостьЖидкость — вещество в состоянии, промежуточном между твёрдым и газообразным. Это агрегатное состояние вещества, в котором молекулы (или атомы) связаны между собой настолько, что это позволяет ему сохранять свой объём, но недостаточно сильно, чтобы сохранять и форму.
Жидкости легко меняют свою форму, но сохраняют объём. В обычных условиях они принимают форму сосуда, в котором находятся.
Поверхность жидкости, не соприкасающаяся со стенками сосуда, называется свободной поверхностью.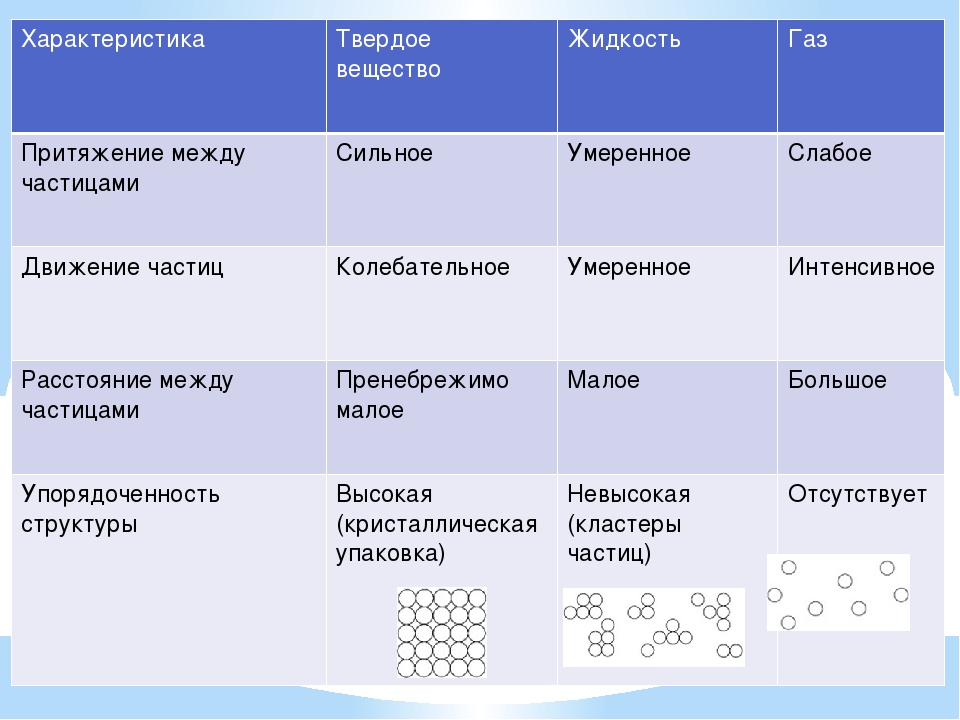 Она образуется в результате действия силы тяжести на молекулы жидкости.
Она образуется в результате действия силы тяжести на молекулы жидкости.
Свойства жидкостей объясняются тем, что промежутки между их молекулами меньше размеров молекул. Объяснение поведения жидкостей на основе характера молекулярного движения жидкости было дано советским учёным Я. И. Френкелем. Оно заключается в следующем. Молекула жидкости колеблется около положения временного равновесия, сталкиваясь с другими молекулами из ближайшего окружения. Время от времени ей удаётся совершить «прыжок», чтобы покинуть своих соседей из ближайшего окружения и продолжать совершать колебания уже среди других соседей. Время оседлой жизни молекулы воды, т. е. время колебания около одного положения равновесия при комнатной температуре, равно в среднем с. Время одного колебания значительно меньше — с.
Поскольку расстояния между молекулами жидкости малы, то попытка уменьшить объём жидкости приводит к деформации молекул, они начинают отталкиваться друг от друга, чем и объясняется малая сжимаемость жидкости. Текучесть жидкости объясняется тем, что «прыжки» молекул из одного оседлого положения в другое происходят по всем направлениям с одинаковой частотой. Внешняя сила не меняет заметным образом число «прыжков» в секунду, она лишь задаёт их преимущественное направление, чем и объясняется текучесть жидкости и то, что она принимает форму сосуда.
Текучесть жидкости объясняется тем, что «прыжки» молекул из одного оседлого положения в другое происходят по всем направлениям с одинаковой частотой. Внешняя сила не меняет заметным образом число «прыжков» в секунду, она лишь задаёт их преимущественное направление, чем и объясняется текучесть жидкости и то, что она принимает форму сосуда.
Эта лекция взята со страницы лекций по всем темам предмета физика:
Предмет физика
Возможно эти страницы вам будут полезны:
Различие в молекулярном строении твердых тел, жидкостей и газов
Лед, вода и водяной пар — три состояния одного и того же вещества-воды. Значит, молекулы льда, воды и водяного пара не отличаются друг от друга. Следовательно, эти три состояния различаются не молекулами, а тем, как молекулы расположены и как движутся. Как же расположены и как движутся молекулы газа, жидкости и твердого тела?
Газ можно сжать так, что его объем уменьшится в несколько раз. Значит, в газах расстояния между молекулами большие, много больше размеров самих молекул. В среднем расстояния между молекулами газов в десятки раз больше размера молекул. На таких расстояниях молекулы очень слабо притягиваются друг к другу, Поэтому-то газы не имеют собственной формы и постоянного объема. Нельзя наполнить газом, например, половину бутылки или стакана, так как, двигаясь во всех направлениях и почти не притягиваясь, друг к другу, молекулы быстро заполнят весь сосуд.
Значит, в газах расстояния между молекулами большие, много больше размеров самих молекул. В среднем расстояния между молекулами газов в десятки раз больше размера молекул. На таких расстояниях молекулы очень слабо притягиваются друг к другу, Поэтому-то газы не имеют собственной формы и постоянного объема. Нельзя наполнить газом, например, половину бутылки или стакана, так как, двигаясь во всех направлениях и почти не притягиваясь, друг к другу, молекулы быстро заполнят весь сосуд.
Свойства жидкостей объясняются тем, что промежутки между их молекулами малы: молекулы в жидкостях упакованы так плотно, что расстояние между каждыми двумя молекулами меньше самой молекулы. На таких расстояниях притяжение молекул друг к другу уже значительно. Поэтому молекулы жидкости не расходятся на большие расстояния и жидкость в обычных условиях, сохраняет свой объем. Однако притяжение молекул жидкостей еще не настолько велико, чтобы жидкость сохраняла свою форму. Этим объясняется, что жидкости принимают форму сосуда и их легко разбрызгать и перелить в другой сосуд.
Сжимая жидкость, мы сближаем ее молекулы настолько, что они начинают отталкиваться. Вот почему жидкость так трудно сжать.
Твердые тела в обычных условиях сохраняют и объем, и форму. Это объясняется тем, что притяжение между их частицами еще больше, чем у жидкостей.
Некоторые из твердых тел, например снежинки, имеют естественную правильную и красивую форму. Частицы (молекулы или атомы) большинства твердых тел, таких, как лед, соль, нафталин, металлы, расположены в определенном порядке. Такие твердые тела называют кристаллическими. Хотя частицы этих тел и находятся в движении, но каждая из них движется около определенной точки, подобно маятнику часов, т. е. колеблется. Частица не может переместиться далеко от этой точки, поэтому твердое тело сохраняет свою форму.
На цветной вклейке I, в середине, показано расположение молекул одного и того же вещества — воды — в разных состояниях: а — твердом (лед), б—жидком (вода), в — газообразном (водяной пар). На вклейке II показано расположение частиц в кристалле золота.
На вклейке II показано расположение частиц в кристалле золота.
Одним из основателей учения о молекулярном строении вещества был великий русский ученый М. В. Ломоносов. Вот как представлял себе М. В. Ломоносов строение газов: «Частицы газа сталкиваются с другими соседними в беспорядочной взаимности, отскакивают друг от друга и снова сталкиваются с другими, более близкими, снова отскакивают, так что стремятся рассыпаться во все стороны, постоянно отталкиваемые друг от друга такими очень частыми взаимными ударами».
На основе представлений о молекулах Ломоносов объяснял многие явления.
Вопросы. 1. Имеется ли отличие между молекулами льда, воды и водяного пара? 2. Как расположены молекулы газов? 3. Почему газы заполняют весь предоставленный им объем? 4. Чем объясняется очень малая сжимаемость жидкостей? Почему они не сохраняют свою форму? 5. Почему кристаллические твердые тела сохраняют свою форму и объем? 6. Кого из русских ученых считают основателем учения о строении вещества?
Сжимаемость жидкостей – обзор
3.
 5.5 В реологии
5.5 В реологии Hurtado-Laguna et al. [33] в своих исследованиях расплавленных полимеров, до сих пор наиболее важных приложений, связанных с объемной вязкостью, снова используют термин «объемная вязкость». Существует также историческая статья Грейвса и Аргроу [34], в которой применяется термин «коэффициент объемной вязкости».
Объемная вязкость имеет решающее значение для понимания продольной реологии ньютоновских жидкостей. В то же время для традиционной низкочастотной сдвиговой реологии, работающей с несжимаемыми жидкостями , где
(3.36)divv=0
и уравнение Навье-Стокса сводится к гораздо более знакомой форме: неважно, тогда и только тогда мы имеем право использовать более простую аппроксимацию уравнения (3.35). Действительно, многие учебники просто предполагают, что жидкость несжимаема, поэтому объемная вязкость не играет никакой роли. Неудивительно, что объемная вязкость малоизвестна, когда современный Handbook of Viscosity C.Yaws [35] и Handbook of Chemistry and Physics [7] вообще не упоминают об этом.
Интересно, что Стокс отметил и действительно известен как Гипотеза Стокса [22, 36], что существует несколько сжимаемых жидкостей, таких как одноатомные газы, где объемная вязкость равна нулю. Эта гипотеза поставила вопрос о самом существовании объемной вязкости даже в жидкостях. В нескольких работах [34, 37] обсуждается этот вопрос и ставится задача доказать, что объемная вязкость действительно существует для жидкостей.Экспериментальное обоснование существования объемной вязкости жидкостей оставалось труднодостижимым из-за нехватки значимых данных. Современные методы измерения теперь позволяют точно определять объемную вязкость, как будет показано здесь. На самом деле мы обнаружили, что объемная вязкость даже не близка к нулю ни для одной из измеренных нами жидкостей, и действительно, объемная вязкость часто превышает динамическую вязкость, как мы покажем позже.
Кто-то может спросить, зачем вообще изучать эту, казалось бы, малоизвестную объемную вязкость.
Общий ответ дал Темкин [5], который представил очень четкую физическую интерпретацию как динамической, так и объемной вязкости в терминах молекулярного движения. Он указывает, что молекулы имеют «поступательную», «вращательную» и «колебательную» степени свободы в жидкостях и газах. Классическая динамическая вязкость η связана только с «поступательным» движением молекул. Напротив, объемная вязкость η b отражает релаксацию как вращательных, так и колебательных степеней свободы.Это приводит к выводу, что если кто-то хочет изучать вращательные и колебательные молекулярные эффекты в сложных жидкостях, он должен научиться измерять объемную вязкость.
Он указывает, что молекулы имеют «поступательную», «вращательную» и «колебательную» степени свободы в жидкостях и газах. Классическая динамическая вязкость η связана только с «поступательным» движением молекул. Напротив, объемная вязкость η b отражает релаксацию как вращательных, так и колебательных степеней свободы.Это приводит к выводу, что если кто-то хочет изучать вращательные и колебательные молекулярные эффекты в сложных жидкостях, он должен научиться измерять объемную вязкость.
Более конкретный ответ заключается в том, что измерение объемной вязкости, которая является типичным выходным параметром моделей молекулярной теории, позволяет затем проверить достоверность таких моделей. Одним из важных примеров является теория Энскога [38], которая дает аналитическое выражение как для динамической, так и для объемной вязкости.
(3.38)η=b0(1Y+0.8+0,761Y)
(3,39)ηb=1,002b0Y
, где b 0 — второй вириальный коэффициент, а Y — относительная частота столкновений.
Другая классическая теория Кирквуда [25] и Кирквуда, Баффа и Грина [26] представляет интегральные выражения как для динамической, так и для объемной вязкости. Однако в конце статьи они заявляют, что численный расчет интегралов возможен только для динамической вязкости, заявляя, что численная процедура расчета объемной вязкости невозможна из-за «…чрезвычайной чувствительности к равновесной функции радиального распределения….”
Существует несколько недавних теорий расчета объемной вязкости для жидкостей Леннарда-Джонса с использованием модели Грина-Кубо. Они описаны в теоретических работах Хохейзеля, Фогельсанга и Шоена [27], Окумуры и Йонезавы [28, 29], Дайера, Петтита и Стелла [31], Мейера, Лаесеке и Кабелака [30], Тани и Бертолини [32].
Для проверки этих теорий необходимы экспериментальные данные по объемной вязкости ньютоновских жидкостей, но, как ни странно, нам известно лишь несколько работ, в которых сообщается об экспериментальных объемных вязкостях таких ньютоновских жидкостей.
Первый — это обзор 50-летней давности Литовица и Дэвиса [9], в котором сообщается об объемной вязкости воды 3,09 сП при 15 °C и метанола 2,1 сП при 2 °C. Это сообщаемое значение объемной вязкости воды может служить точкой отсчета для новых исследований по этому вопросу и проверки применяемой экспериментальной процедуры. Следует отметить, что в этом обзоре также представлены значения объемной вязкости для расплавленных солей, расплавленных металлов и некоторых других экзотических жидкостей при очень низких температурах, но это не особенно полезные данные в текущем контексте.
Во второй, более поздней работе Мальбруно, Бойера, Шарля и Абаши [37] представлены данные объемной вязкости для жидких аргона, криптона и ксенона вблизи их тройной точки. Эта статья включает в себя очень четкое описание экспериментальной техники, и мы будем следовать аналогичной процедуре с некоторыми дополнительными шагами, обеспечивающими лучшую точность.
Есть также несколько сообщений об объемной вязкости жидких металлов, например, Jarzynski [39].
Эта нехватка данных по объемной вязкости вызывает удивление, как это было выражено Темкиным [5] в его книге Elements of Acoustics , а также Грейвсом и Ангроу в их статье «Объемная вязкость: прошлое и настоящее» [34].
Недавно стало доступно больше данных по объемной вязкости благодаря разработке компанией Dispersion Technology, Inc. современного акустического спектрометра DT-600. Данные по объемной вязкости для 12 ньютоновских жидкостей были опубликованы в Ref. [6]. В таблице 3.2 представлены эти результаты. Единственные независимые данные, а именно объемная вязкость воды из обзора Литовица-Дэвиса [9], хорошо согласуются с этим новым результатом. Они сообщают о значении 3,09 сП при 15 °C, тогда как мы получили несколько меньшее значение 2,43 сП при несколько более высокой температуре 25 °C.Еще лучшей проверкой было бы сравнение отношения объемной вязкости к сдвиговой вязкости при данной температуре. Литивитц-Дэвис сообщает о соотношении 2,81 при 15 °C, тогда как мы получили значение 2,73 при 25 °C. Это единственная независимая от комнатной температуры проверка нашего измерения объемной вязкости, которую нам удалось найти.
Это единственная независимая от комнатной температуры проверка нашего измерения объемной вязкости, которую нам удалось найти.
Таблица 3.2. Затухание на частоте 100 МГц, Темп. Коэффициент, и динамическая и объемная вязкость для 12 ньютоновских жидкостей
| жидкость | Затухание на 100 МГц (дБ / см / МГц) | Отушкование T Коэффициент α T 4 | Динамическая вязкость (CP) | Объемная вязкость (сП) | Коэффициент линейной вариации | | ||
|---|---|---|---|---|---|---|---|
| Циклогексан | 2.07 | -0,05 | 0,894 | «17,4» | «0,082» | ||
| Циклогексанон | 0,63 | & л; 0,01 | 2,017 | 7,0 | 0,012 | ||
| 1-пентанол | 0,79 | -0.007 | 3.619 | 3.619 | 2.8 | 0,009 | |
0. 72 72 | 0.009 | 0.560 | 76 | 0.014 | |||
| Methanol | 0.26 | < 0,01 | 0,544 0,8 | 0,024 | |||
| Гексан 0,60 | -0,015 0,300 | 2,4 0,022 | |||||
| 2-пропанол | 0,80 -0,008 2,040 | 2.7 | 0,001 | 0,001 | |||
| бутилцетат | |||||||
| 0.38 | 0.38 | 0.004 | 0.685 | «2.4» | «0.137» | ||
| Acetone | 0.25 | & л; 0,01 | 0,306 | 1,4 | 0,038 | ||
| Этанол | 0,42 | & л; 0,01 | 1,074 | 1,4 | 0,015 | ||
| Пиридин | 3,90 | & л; 0,01 | 0.879 | 62,4 | 0.012 | 0.012 | |
| воды | -0.0043 | -0. 0043 0043 | -0.0043 | -0.0043 | 0,896 | 2,4 | 0.036 | 0.036 |
Интересно отметить, что навальная вязкость для этих 12 жидкостей меняется значительно более широкий диапазон, чем динамическая вязкость, почти на порядок.Это, по-видимому, подтверждает, что объемная вязкость более чувствительна к молекулярной структуре жидкости.
Однако корреляции между этим параметром и другими интенсивными свойствами этих жидкостей не установлено, как указано в [1]. [6].
Единственным известным методом определения объемной вязкости является измерение затухания ультразвука. Это обсуждается в разделе 3.6.
Существует по крайней мере три различных метода измерения коэффициента затухания, которые применялись для характеристики жидкостей: бриллюэновская спектроскопия [24, 40], лазерная спектроскопия переходных решеток [41–43] и акустическая спектроскопия [10].Каждый из них имеет свои преимущества и недостатки в отношении этой конкретной задачи.
Первые два метода обычно выполняются на гигагерцовых частотах, тогда как акустическая спектроскопия обычно используется в мегагерцовом диапазоне. Это различие в частотных диапазонах делает эти методы взаимодополняющими для изучения процессов с сильно различающимися временами релаксации.
Однако с целью характеризации измерений объемной вязкости при очень высокой частоте они могут представлять серьезную проблему.Затухание быстро увеличивается с увеличением частоты в соответствии с уравнением (3.42). Это означает, что бриллюэновская спектроскопия и спектроскопия с лазерной решеткой переходных процессов должны иметь дело с гораздо более высокими значениями ослабления, чем акустическая спектроскопия. Это не представляет проблемы для таких жидкостей, как вода, которые имеют небольшое затухание, но может быть серьезной проблемой для многих других жидкостей. Например, согласно представленным ниже данным, коэффициент затухания для пиридина составляет 39 000 дБ/см на частоте 1 ГГц. Измерение такого высокого затухания потребует либо очень мощного возбуждения, которое может генерировать нелинейные эффекты, либо измерения на очень коротких расстояниях.Акустическая спектроскопия явно предпочтительнее для таких сильно затухающих жидкостей.
Измерение такого высокого затухания потребует либо очень мощного возбуждения, которое может генерировать нелинейные эффекты, либо измерения на очень коротких расстояниях.Акустическая спектроскопия явно предпочтительнее для таких сильно затухающих жидкостей.
Еще одна проблема, связанная с бриллюэновской и лазерной спектроскопией на решетке переходного процесса, заключается в том, что эти методы обычно сообщают об изменении затухания в зависимости от температуры, но не от частоты. Измерение обычно выполняется на одной частоте. Выше мы указывали, что частотная зависимость очень полезна для подтверждения того, что измеренное затухание действительно может быть использовано для расчета значимой объемной вязкости.
Акустическая спектроскопия, с другой стороны, позволяет проводить простые измерения затухания на нескольких частотах в диапазоне частот 1–100 МГц.Это еще один аргумент в пользу использования акустической спектроскопии для характеристики объемной вязкости.
Последний аргумент в пользу акустической спектроскопии — точность. Мальбруно и др. [37] сравнили погрешность бриллюэновской и акустической спектроскопии и пришли к выводу, что акустическая спектроскопия с точностью всего 2,5% является значительно более точной. Как обсуждается ниже, современные акустические спектрометры могут уменьшить эту ошибку почти на порядок. Кроме того, анализ ошибок бриллюэновской спектроскопии, представленный Папайоноу, Хартом и Андерусом [40], подтверждает потенциально высокие ошибки из-за сложности оценки бриллюэновской ширины линии.Существует также проблема, связанная с лазерной спектроскопией нестационарных решеток. Расчет затухания по необработанным данным требует подгонки с пятью регулируемыми параметрами согласно Cao, Diebold и Zimmt [41]. Это существенно усложняет данный метод по сравнению с акустической спектроскопией, где непосредственно измеряется коэффициент затухания.
Мальбруно и др. [37] сравнили погрешность бриллюэновской и акустической спектроскопии и пришли к выводу, что акустическая спектроскопия с точностью всего 2,5% является значительно более точной. Как обсуждается ниже, современные акустические спектрометры могут уменьшить эту ошибку почти на порядок. Кроме того, анализ ошибок бриллюэновской спектроскопии, представленный Папайоноу, Хартом и Андерусом [40], подтверждает потенциально высокие ошибки из-за сложности оценки бриллюэновской ширины линии.Существует также проблема, связанная с лазерной спектроскопией нестационарных решеток. Расчет затухания по необработанным данным требует подгонки с пятью регулируемыми параметрами согласно Cao, Diebold и Zimmt [41]. Это существенно усложняет данный метод по сравнению с акустической спектроскопией, где непосредственно измеряется коэффициент затухания.
Этот краткий сравнительный анализ приводит нас к выводу, что акустическая спектроскопия больше подходит для измерения объемной вязкости, что согласуется с аналогичным анализом Malbrunot et al. [37]. Это одна из многих причин, по которым акустика подходит для реологических характеристик. Вообще существуют десятки работ [44–78] и патентов [79–83], посвященных применению акустики для характеристики реологических свойств чистых жидкостей, растворов полимеров и коллоидов. Есть также несколько коммерческих инструментов, разработанных за последнее десятилетие на основе акустической спектроскопии. К ним относятся Ultrasizer от Malvern Ltd., инструмент от Ultrasonic Scientific, Acoustosizer от Colloidal Dynamics, Inc., APS-100 от Matec Applied Sciences, Inc., а также DT-100 и DT-600 от Dispersion Technology, Inc.
[37]. Это одна из многих причин, по которым акустика подходит для реологических характеристик. Вообще существуют десятки работ [44–78] и патентов [79–83], посвященных применению акустики для характеристики реологических свойств чистых жидкостей, растворов полимеров и коллоидов. Есть также несколько коммерческих инструментов, разработанных за последнее десятилетие на основе акустической спектроскопии. К ним относятся Ultrasizer от Malvern Ltd., инструмент от Ultrasonic Scientific, Acoustosizer от Colloidal Dynamics, Inc., APS-100 от Matec Applied Sciences, Inc., а также DT-100 и DT-600 от Dispersion Technology, Inc.
14.1: Сжимаемость — Химия LibreTexts
-
- Последнее обновление
- Сохранить как PDF
- Сжимаемость
- Резюме
- Авторы и авторство
Когда мы собираемся в отпуск, кажется, что всегда есть «еще одна» вещь, которую нам нужно положить в чемодан. Может быть, это еще один купальный костюм, пара туфель, книга — что бы это ни было, нам нужно его надеть. К счастью, обычно мы можем как-то сжать вещи вместе. Возможно, между складками одежды осталось немного места, или мы можем переставить обувь; каким-то образом мы можем получить этот последний предмет и закрыть чемодан.
Может быть, это еще один купальный костюм, пара туфель, книга — что бы это ни было, нам нужно его надеть. К счастью, обычно мы можем как-то сжать вещи вместе. Возможно, между складками одежды осталось немного места, или мы можем переставить обувь; каким-то образом мы можем получить этот последний предмет и закрыть чемодан.
Сжимаемость
Подводное плавание с аквалангом — это форма подводного плавания, при которой дайвер носит с собой собственный дыхательный газ, обычно в виде баллона со сжатым воздухом. Давление в наиболее часто используемых аквалангах колеблется от 200 до 300 атмосфер.Газы отличаются от других состояний материи тем, что газ расширяется, чтобы заполнить форму и объем своего сосуда. По этой причине газы также могут быть сжаты, так что относительно большое количество газа может быть помещено в небольшой контейнер. Если бы воздух из обычного акваланга перекачивался в контейнер при стандартном давлении \(1 \: \text{атм}\), объем этого контейнера должен был бы составлять около 2500 литров.
Сжимаемость — это мера того, насколько данный объем вещества уменьшается под давлением.Если мы окажем давление на твердое тело или жидкость, объем практически не изменится. Атомы, ионы или молекулы, составляющие твердое тело или жидкость, расположены очень близко друг к другу. Между отдельными частицами нет пространства, поэтому они не могут собираться вместе.
Молекулярно-кинетическая теория объясняет, почему газы более сжимаемы, чем жидкости или твердые тела. Газы сжимаемы, потому что большая часть объема газа состоит из большого количества пустого пространства между частицами газа.При комнатной температуре и стандартном давлении среднее расстояние между молекулами газа примерно в десять раз превышает диаметр самих молекул. Когда газ сжимается, например, при наполнении акваланга, частицы газа сближаются.
Сжатые газы используются во многих ситуациях. В больницах кислород часто используется для пациентов с поврежденными легкими, чтобы помочь им лучше дышать. Если пациенту предстоит серьезная операция, в качестве анестезии часто используется сжатый газ.Для сварки требуется очень горячее пламя, создаваемое сжатыми смесями ацетилена и кислорода. Многие летние грили для барбекю работают на сжатом пропане.
Если пациенту предстоит серьезная операция, в качестве анестезии часто используется сжатый газ.Для сварки требуется очень горячее пламя, создаваемое сжатыми смесями ацетилена и кислорода. Многие летние грили для барбекю работают на сжатом пропане.
Сводка
Авторы и авторство
Сжимаемость жидкостей
Когда большинство людей думают или говорят о жидкостях, они обычно имеют в виду жидкости.Это не полная картина. По сути, жидкость — это среда , имеющая частицы, легко перемещающиеся и изменяющие свое взаимное положение без разделения массы и легко поддающаяся действию приложенных сил. Это означает, что жидкости включают газы, потому что они тоже текут. Фактически, корень слова «флюид» происходит от латинского «fluere», что означает «течь».
Наш сегодняшний опыт может привести нас к заключению, что газы сжимаемы, а жидкости несжимаемы. Обратите внимание на ощущение отскока, когда после сжатия рукоятку шинного насоса быстро отпускают; это демонстрирует силу, создаваемую воздухом, сжимаемым в меньший объем. Объем повторно расширяется до своего первоначального размера, когда сила сжатия удаляется. Точно так же, если мы держим палец над маленьким отверстием в аэрозольном баллончике, мы немедленно чувствуем силу сопротивления при нажатии на спусковой крючок насоса. На основании этого наблюдения жидкость кажется несжимаемой.
Обратите внимание на ощущение отскока, когда после сжатия рукоятку шинного насоса быстро отпускают; это демонстрирует силу, создаваемую воздухом, сжимаемым в меньший объем. Объем повторно расширяется до своего первоначального размера, когда сила сжатия удаляется. Точно так же, если мы держим палец над маленьким отверстием в аэрозольном баллончике, мы немедленно чувствуем силу сопротивления при нажатии на спусковой крючок насоса. На основании этого наблюдения жидкость кажется несжимаемой.
Ниже приводится исследование сжимаемости жидкостей и твердых тел в калибровочной лаборатории.Понимание поведения этих жидкостей под давлением имеет решающее значение для успешной и точной калибровки.
Во-первых, необходимо определить некоторые общие термины:
- Жидкость — материал, который легко течет и требует сосуда для его удержания.
- Газ — состояние вещества, которое принимает форму своего сосуда и не имеет определенного объема.

- Жидкость — состояние вещества, которое принимает форму своего сосуда и имеет определенный объем.
- Твердое тело — состояние вещества, которое сохраняет свою форму и имеет определенный объем.
- Сжимаемый — имеющий способность изменять плотность при приложении давления.
- Плотность — масса на единицу объема.
- Химическая связь — передача или совместное использование самых удаленных электронов между двумя или более атомами.
- Сила Ван-дер-Ваальса — силы притяжения между всеми молекулами, вызванные флуктуирующей поляризацией соседних частиц, которые становятся значительными только в том случае, если молекулы расположены очень близко друг к другу.
Газы ведут себя иначе, чем жидкости. Почему? Чтобы понять, что происходит на макроуровне, нам нужно понять внутреннюю работу материала на атомном и молекулярном уровнях. В любом веществе химические связи, полярность, силы, а также физическая конфигурация атомов в молекуле определяют основные свойства материала, такие как вязкость и сжимаемость. Эти силы, действующие в атомном масштабе, вносят основной вклад в свойства, которые мы наблюдаем в этих объемных материалах.
В любом веществе химические связи, полярность, силы, а также физическая конфигурация атомов в молекуле определяют основные свойства материала, такие как вязкость и сжимаемость. Эти силы, действующие в атомном масштабе, вносят основной вклад в свойства, которые мы наблюдаем в этих объемных материалах.
Рисунок 1. Состояния вещества со связями в каждом состоянии
На рис. 1 сравнение трех распространенных состояний материи — твердого, жидкого и газообразного — показывает типы связи в каждом состоянии. На каждой иллюстрации мы видим увеличенный очень маленький объем материала и упрощенное представление соответствующих связей внутри материала. Ниже приведено более подробное объяснение различных состояний со ссылками на иллюстрации.
Твердые вещества
Твердые тела сохраняют свою собственную форму, потому что химическая связь, показанная в виде пружин между каждым атомом, относительно сильна.Однако одинаковые заряды электронов отталкивают атомы по мере их сближения. И наоборот, если атомы расходятся, они притягиваются связью друг к другу. Расстояние между каждым атомом очень мало из-за силы связи, но эта связь может только удерживать их вместе так сильно из-за сил отталкивания. Таким образом, когда сила прикладывается к этому кубу со всех сторон, сопротивление сжатию между каждым атомом очень велико, что приводит к минимальному сжатию в объемном твердом теле.
И наоборот, если атомы расходятся, они притягиваются связью друг к другу. Расстояние между каждым атомом очень мало из-за силы связи, но эта связь может только удерживать их вместе так сильно из-за сил отталкивания. Таким образом, когда сила прикладывается к этому кубу со всех сторон, сопротивление сжатию между каждым атомом очень велико, что приводит к минимальному сжатию в объемном твердом теле.
Жидкости
Жидкости, с другой стороны, имеют больше пространства между молекулами, что позволяет им совершать большее относительное движение. Однако межмолекулярные связи не так прочны, как в твердых телах. Вода, например, представляет собой полярную молекулу и проявляет диполь-дипольное притяжение, как показано пунктирными линиями на рисунке 1. Атом кислорода слегка отрицателен, а два атома водорода слегка положительны. Поскольку эти дипольные заряды намного меньше по силе, чем типичные связи, силы Ван-дер-Ваальса между молекулами слабы и непостоянны.Каждая из них может ломаться и переделываться много миллиардов раз в секунду. Это то, что позволяет воде течь и при этом оставаться жидкостью. Более слабые межмолекулярные силы и более высокое межмолекулярное расстояние являются причиной того, что жидкости могут быть сжаты больше, чем твердые тела.
Это то, что позволяет воде течь и при этом оставаться жидкостью. Более слабые межмолекулярные силы и более высокое межмолекулярное расстояние являются причиной того, что жидкости могут быть сжаты больше, чем твердые тела.
Газы
Для таких газов, как азот или воздух, при нормальных температурах и давлениях связи между молекулами отсутствуют. Каждая молекула движется с высокой скоростью в различных направлениях. Когда две молекулы газа сталкиваются, они отскакивают друг от друга с идеальной упругостью.Потерь в столкновениях нет. Межмолекулярное расстояние слишком велико, чтобы межмолекулярные силы могли быть значительными. При комнатной температуре и стандартном давлении среднее расстояние между молекулами газа примерно в десять раз превышает диаметр самих молекул. Таким образом, когда к молекулам газа прикладывается внешняя сила, они сближаются, что делает газы очень сжимаемыми.
Степень сжимаемости
Теперь, когда мы знаем на молекулярном уровне, что газы и жидкости более сжимаемы, чем твердые тела.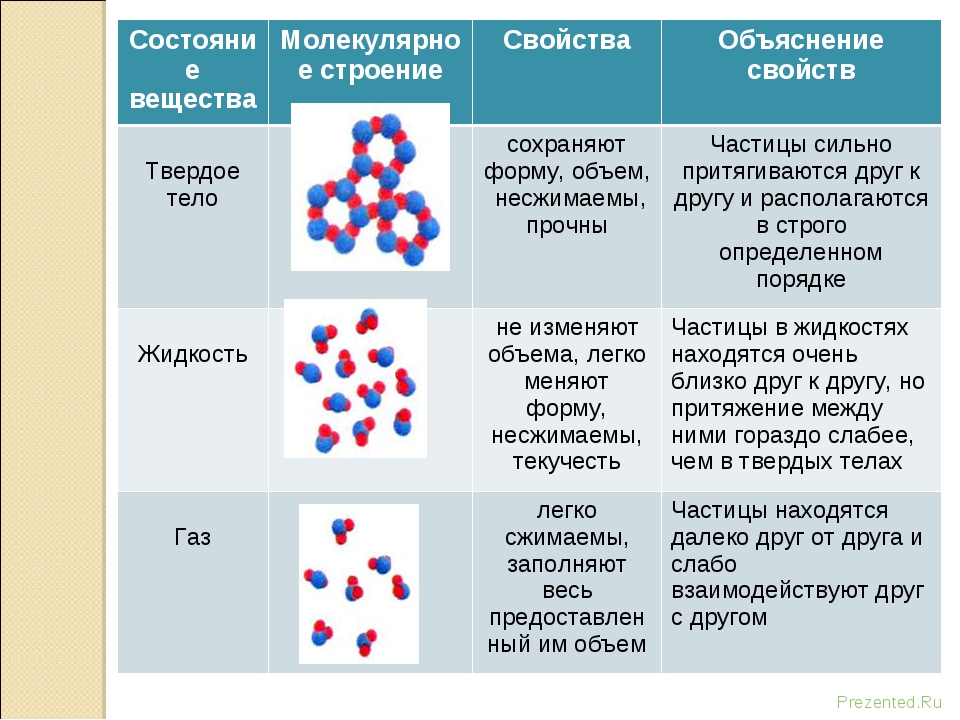 Как насчет сжимаемости обычных сред под давлением, используемых в калибровочной лаборатории? Относительная степень сжимаемости материала с приложенной силой определяет наше восприятие жесткости. Когда материал сжимается со всех сторон, он сжимается пропорционально приложенному давлению. Константа пропорциональности называется объемным модулем.
Как насчет сжимаемости обычных сред под давлением, используемых в калибровочной лаборатории? Относительная степень сжимаемости материала с приложенной силой определяет наше восприятие жесткости. Когда материал сжимается со всех сторон, он сжимается пропорционально приложенному давлению. Константа пропорциональности называется объемным модулем.
Β = — В * (∂P ⁄ ∂V)
Где B = модуль объемного сжатия
В = начальный объем
∂P/∂V = изменение давления по отношению к изменению объема
Обратите внимание, что увеличение давления вызывает уменьшение объема, это означает, что плотность материала увеличивается.Если одну и ту же силу приложить к равному объему твердого тела, жидкости и газа, становится очевидным относительное уменьшение объема. Изотермический объемный модуль каждого состояния вещества можно сравнить, чтобы получить отношение порядка величины. Ниже приведен объемный модуль для некоторых распространенных материалов в каждом состоянии:
Нержавеющая сталь: -23 600 000 фунтов силы/кв. в.
в.
Вода: -310 000 фунтов/кв. в.
Воздух, при нормальных условиях эксплуатации: -14,7 фунт-сила/кв. В.
Здесь выражено сравнительное соотношение материалов:
Нержавеющая сталь : Вода : Воздух = 1 600 000 : 21 000 : 1
Цифры обозначают относительную жесткость материалов.Чем выше число, тем менее сжимаемый материал. Например, соотношение воды к воздуху составляет 21 000:1, поэтому мы не ощущаем сжатия воды в распылительном насосе с забитым отверстием. Он сжимается настолько мало, что мы не можем обнаружить его нашими органами чувств.
Следует отметить, что объемные модули зависят от давления и температуры. Для воды с увеличением давления объемный модуль упругости увеличивается. Когда температура жидкости повышается от 0°C при постоянном давлении, объемный модуль упругости увеличивается, достигая максимума около 330 000 фунтов силы./кв. в. примерно при 45°С, а затем снижается.
Это создает сложную цепочку событий в среде калибровки. В гидравлических калибровочных системах высокого давления, таких как Mensor CPC8000-H, мы полагаемся на жидкую среду в качестве среды под давлением из соображений безопасности. По мере увеличения давления в системе жидкость сжимается, и все содержащиеся в ней компоненты расширяются (регулятор давления, трубки, фитинги, камера давления и т. д.). Части, окруженные жидкостью, сжимаются, и объемный модуль упругости среды изменяется в зависимости от давления и температуры.В системах высокого давления учет и компенсация относительных объемных модулей, обусловленных сцеплением материалов, а также хорошая инженерия делают системы калибровки точными и надежными.
В гидравлических калибровочных системах высокого давления, таких как Mensor CPC8000-H, мы полагаемся на жидкую среду в качестве среды под давлением из соображений безопасности. По мере увеличения давления в системе жидкость сжимается, и все содержащиеся в ней компоненты расширяются (регулятор давления, трубки, фитинги, камера давления и т. д.). Части, окруженные жидкостью, сжимаются, и объемный модуль упругости среды изменяется в зависимости от давления и температуры.В системах высокого давления учет и компенсация относительных объемных модулей, обусловленных сцеплением материалов, а также хорошая инженерия делают системы калибровки точными и надежными.
Заключение
Сжимаемость жидкостей играет решающую роль при проектировании технологической системы в промышленном секторе, а также в поддержании эффективности инфраструктуры калибровочной лаборатории. Выбор правильного калибратора при оптимизации системы для компенсации сжимаемости компонентов системы и используемой среды обеспечит более точные результаты калибровки. Сжимаемость может сильно различаться у разных жидких жидкостей с различиями в модуле объемного сжатия, вязкости, температурном коэффициенте среды и растворимости. Мы углубимся в сравнение сжимаемости различных жидких сред, обычно используемых для гидравлической калибровки, в части II книги «Сжимаемость жидкостей».
Сжимаемость может сильно различаться у разных жидких жидкостей с различиями в модуле объемного сжатия, вязкости, температурном коэффициенте среды и растворимости. Мы углубимся в сравнение сжимаемости различных жидких сред, обычно используемых для гидравлической калибровки, в части II книги «Сжимаемость жидкостей».
Связанное Чтение:
Можно ли сжимать жидкости? Как обсудить
Являются ли жидкости сжимаемыми
Почему жидкость более сжимаема, чем твердое тело?
Поскольку на частицы в твердых телах действуют сильные силы, межмолекулярное или межатомное расстояние существенно не уменьшается.Поэтому жидкости более сжимаемы. потому что они содержат более мелкие пустоты (межмолекулярные пространства).И почему газы обладают большей сжимаемостью по сравнению с твердыми телами и жидкостями?
Газы хорошо сжимаемы, потому что их молекулы находятся далеко друг от друга. Между молекулами много пустых пространств. эта сжимаемость ниже для жидкостей и ниже для твердых тел.
эта сжимаемость ниже для жидкостей и ниже для твердых тел. Мы также можем спросить себя, почему твердое тело несжимаемо?
Сухое вещество несжимаемо, потому что молекулы очень узкие, а межмолекулярное пространство маленькое или незначительное.Жидкости занимают больше места, чем твердые тела, но меньше, чем газы, и поэтому менее сжимаемы. Однако твердые тела имеют незначительное пространство и поэтому несжимаемы.Твердые тела и жидкости также сжимаемы?
Сухое вещество несжимаемо и имеет постоянный объем и форму. Жидкости несжимаемы и имеют постоянный объем, но могут менять форму. Форма жидкости определяется формой сосуда, в котором она находится.Можно ли сжать жидкость?
Да, вы можете сжимать воду или почти любой материал.Однако для достижения сжатия требуется большое давление. По этой причине жидкости и твердые тела иногда называют несжимаемыми.Что такое сжимаемость жидкости?
Сжимаемость жидкостей. Сжимаемость — это фракционное изменение объема на единицу увеличения давления. С каждым повышением атмосферного давления объем воды будет уменьшаться на 46,4 промилле.
С каждым повышением атмосферного давления объем воды будет уменьшаться на 46,4 промилле. Почему жидкости несжимаемы?
Жидкости обычно считаются несжимаемыми.Молекулы уже близко друг к другу, что затрудняет их длительное прижатие друг к другу. Жидкости на самом деле сжимаются при очень высоком давлении, но не сильно. В отличие от газов, жидкости имеют прозрачную поверхность: они не должны образовываться на емкостях.Что является примером сжимаемости?
любая жидкость может рассматриваться как сжимаемая жидкость. Например, воздух с малыми числами Маха считается несжимаемой жидкостью, а воздух с большими числами Маха считается сжимаемой. известное предположение состоит в том, что любая жидкость с числом Маха больше 0.3 рассматривается как сжимаемая жидкость.Какой газ наиболее сжимаемый?
Газообразный водородПочему газы сжимаемы, но не жидкие?
Ответ: Газы сжимаемы, потому что межмолекулярное пространство в газах очень велико, а жидкости несжимаемы, потому что межмолекулярное пространство меньше.
Почему жидкость легко выливается?
Силы между жидкими частицами слабее сил между твердыми частицами. Это означает, что частицы жидкости находятся дальше друг от друга и могут легче двигаться.Поскольку частицы могут двигаться, жидкость может вытекать и принимать форму контейнера.Можно ли сжимать газы?
Когда мы оказываем давление на твердое тело или жидкость, объем практически не меняется. Молекулярно-кинетическая теория объясняет, почему газы более сжимаемы, чем жидкости или твердые тела. Газы сжимаемы, потому что большая часть объема газа состоит из большого количества пустого пространства между частицами газа.Что такое Z в термодинамике?
Коэффициент сжимаемости (Z), также называемый коэффициентом сжатия или коэффициентом отклонения газа, является поправочным коэффициентом, который описывает отклонение поведения реального газа от поведения идеального газа.Это термодинамическое свойство, полезное для модификации закона идеального газа с учетом фактического поведения газа.
Какая жидкость наиболее сжимаема?
РтутьЯвляется ли вода сжимаемой жидкостью?
Вода в некоторой степени сжимаема. Мы часто рассматриваем его как несжимаемый в расчетах потока, потому что связанные с ним изменения давления слишком малы, чтобы вызвать значительное изменение плотности. Из-за очень высокого давления вода на морском дне более плотная, чем на поверхности.Каковы шесть свойств твердых тел?
Окончательная форма, удельный объем, удельная температура плавления, высокая плотность, сжимаемость и низкая скорость диффузии.Что означает сжимаемый?
Определение сжимаемости Если что-то сжимаемо, его объем может измениться при приложении давления. Жидкость сжимаема, если ее плотность изменяется при изменении давления. Если что-то сжимается, его объем может измениться при приложении давления.Что такое твердое и жидкое?
Газы, жидкости и твердые тела состоят из атомов, молекул и/или ионов, но поведение этих частиц различается во всех трех фазах. газ хорошо отделяется без обычного устройства. Жидкость регулируется без обычной регулировки. твердое тело хорошо упаковано, обычно в правильном порядке.
газ хорошо отделяется без обычного устройства. Жидкость регулируется без обычной регулировки. твердое тело хорошо упаковано, обычно в правильном порядке. Является ли кровь сжимаемой жидкостью?
Кровь: несжимаема, то есть плотность крови (масса на единицу объема) постоянна и невидима, то есть силы вязкости отсутствуют. стабильный, д. час он не меняется со временем.Являются ли жидкости сжимаемыми
Чудеса воды | Артикул
Вода, самая распространенная из жидкостей, также и самая странная.Он обладает как минимум 66 свойствами, отличающими его от большинства жидкостей, — высоким поверхностным натяжением, высокой теплоемкостью, высокими температурами плавления и кипения и низкой сжимаемостью. Одна школа мысли состоит в том, что вода — это не сложная жидкость, а «две простые жидкости со сложными отношениями». Для некоторых это утверждение противоречит основным принципам физической химии; для других это объясняет, почему вода ведет себя таким аномальным образом.
За последнее десятилетие академические споры достигли точки кипения.«[Это] вызывает очень сильные, почти религиозные мнения среди разных ученых», — говорит Андерс Нильссон, физик-химик, работающий в Стокгольмском университете в Швеции и Стэнфордском университете в США. Химики приписывают странные свойства воды тетраэдрически расположенным сетям водородных связей, которые она образует, но что именно происходит, особенно когда вода находится в переохлажденном состоянии, все еще остается предметом споров.
Как и многие другие химики, Нильссон в начале своей карьеры предполагал, что структура воды хорошо изучена, но начал понимать, что это не так.В течение последних 10 лет он сосредоточился на понимании необычного поведения воды, и его недавняя работа придает вес теории о том, что вода — это не одна жидкость, а две отдельные жидкие структуры, которые могут сосуществовать — идея, которая до сих пор остается спорной.
Для такой маленькой молекулы много водородных связей
«Если вы посмотрите на простые термодинамические и кинетические свойства жидкостей, когда вы измените давление и температуру, все они будут вести себя одинаково», — объясняет Нильссон.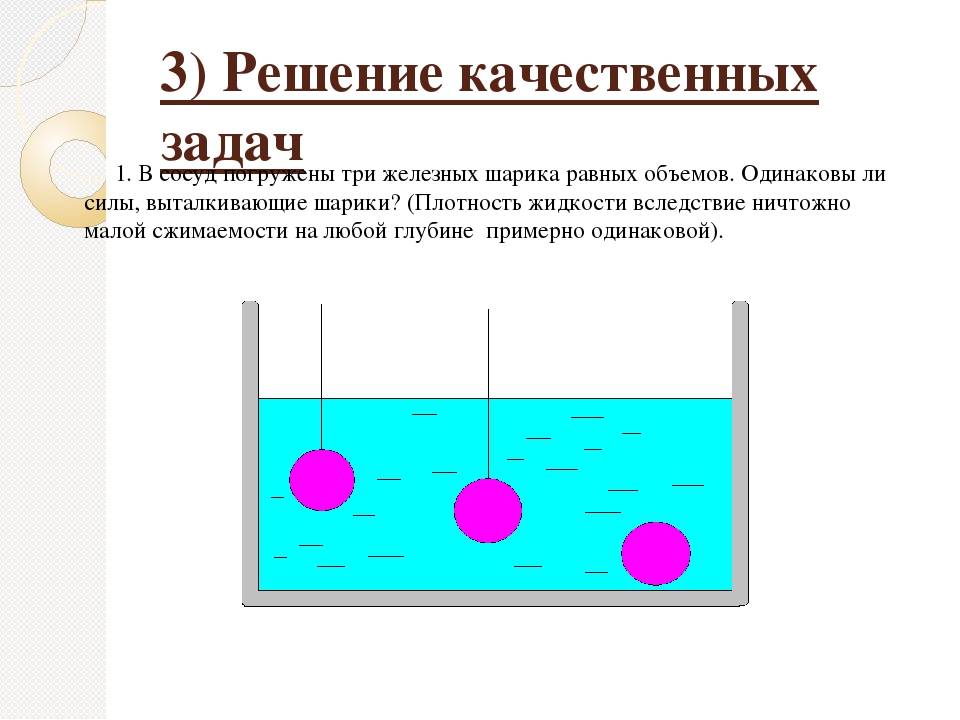 При охлаждении жидкости ее плотность увеличивается, а теплоемкость и сжимаемость уменьшаются. «Почти все жидкости на планете ведут себя так. Кроме воды». Эта странность становится очевидной, когда вода охлаждается до 4°C, когда ее плотность достигает максимума, ниже которого она снова начинает уменьшаться.
При охлаждении жидкости ее плотность увеличивается, а теплоемкость и сжимаемость уменьшаются. «Почти все жидкости на планете ведут себя так. Кроме воды». Эта странность становится очевидной, когда вода охлаждается до 4°C, когда ее плотность достигает максимума, ниже которого она снова начинает уменьшаться.
Объяснение, которому учат химиков, заключается в том, что, хотя большинство жидкостей неупорядочены, а их молекулы постоянно перестраиваются, вода отличается сетью водородных связей. Водородные связи имеют силу между более сильными ковалентными связями и более слабыми взаимодействиями, индуцированными диполями.В отличие от последних, они являются направленными, при этом каждый атом водорода указывает на пару электронов на атоме кислорода.
«Для такой маленькой молекулы много водородных связей», — говорит Мартин Чаплин, химик и исследователь воды из Лондонского университета Саут-Бэнк в Великобритании. В то время как вода ведет себя как большинство жидкостей при более высоких температурах, по мере ее охлаждения водородные связи начинают играть более важную роль. «Они на самом деле создают структурированное упорядоченное государство», — говорит Чаплин. По мере снижения температуры дополнительные связывающие взаимодействия компенсируют потерю энтропии, вызванную упорядоченным расположением.
«Они на самом деле создают структурированное упорядоченное государство», — говорит Чаплин. По мере снижения температуры дополнительные связывающие взаимодействия компенсируют потерю энтропии, вызванную упорядоченным расположением.
Две жидкости
Теории, объясняющие свойства воды, постоянно появлялись с течением времени. В 1960-х годах российские химики даже предположили, что молекулы воды в капиллярных трубках могут образовывать полимерные цепи, известные как поливода. К этому относились серьезно, пока не стало ясно, что их результаты связаны с экспериментальными загрязнителями.
Идея о том, что в жидкой воде могут быть два разных и различных расположения молекул, возникла более 100 лет назад.Немецкий физик Вильгельм Рентген, впервые открывший рентгеновские лучи, в 1892 году предположил, что вода состоит из двух различных фаз, сосуществующих в смеси.
В 1990-х годах вернулась модель жидкой воды с двумя состояниями, основанная на компьютерном моделировании, которое пыталось воспроизвести реальное поведение воды. Эти две формы представляют расположение молекул воды с низкой и высокой плотностью. Версия с низкой плотностью представляет собой менее упорядоченную льдоподобную структуру, в которой большинство молекул окружено четырьмя другими, образуя открытую тетраэдрическую структуру с низкой плотностью.Жидкость с более высокой плотностью имеет более высокую упаковку молекул, и присутствие этих дополнительных молекул искажает водородные связи, создавая менее направленные и более слабые молекулярные взаимодействия.
Эти две формы представляют расположение молекул воды с низкой и высокой плотностью. Версия с низкой плотностью представляет собой менее упорядоченную льдоподобную структуру, в которой большинство молекул окружено четырьмя другими, образуя открытую тетраэдрическую структуру с низкой плотностью.Жидкость с более высокой плотностью имеет более высокую упаковку молекул, и присутствие этих дополнительных молекул искажает водородные связи, создавая менее направленные и более слабые молекулярные взаимодействия.
В этой гипотезе доля каждого компонента изменяется с температурой, при этом по мере понижения температуры образуется вода с более низкой плотностью. В результате возникает конкуренция между ожидаемым увеличением плотности при понижении температуры и образованием воды с более низкой плотностью. Это приводит к максимуму плотности при 4°C, а также объясняет многие другие аномальные свойства воды.
Отстройка воды
Мощным подходом к пониманию воды стало компьютерное моделирование. «Это означает создание атомистической модели, в которой вы пытаетесь настроить заряды и электронное распределение, чтобы максимально точно воспроизвести поведение воды», — говорит математик и модельер Джон Руссо из Римского университета Ла Сапиенца в Италии. Руссо вместе с сотрудниками из Токийского университета в Японии создал модель, которая может «настраивать» молекулярные взаимодействия молекул воды, чтобы понять происхождение ее аномальных свойств.«Я пытался сделать воду менее «водянистой» и старался постоянно переходить от поведения воды к поведению простой жидкости, — объясняет он.
«Это означает создание атомистической модели, в которой вы пытаетесь настроить заряды и электронное распределение, чтобы максимально точно воспроизвести поведение воды», — говорит математик и модельер Джон Руссо из Римского университета Ла Сапиенца в Италии. Руссо вместе с сотрудниками из Токийского университета в Японии создал модель, которая может «настраивать» молекулярные взаимодействия молекул воды, чтобы понять происхождение ее аномальных свойств.«Я пытался сделать воду менее «водянистой» и старался постоянно переходить от поведения воды к поведению простой жидкости, — объясняет он.
Ключом к этому процессу является изменение прочности водородной связи, что приводит к тетраэдрической координации. 1 ‘Силу этого взаимодействия можно настроить. Вы можете искусственно сделать ее более или менее четырехгранной». Делая это, вы можете настроить структуру, чтобы изменить макроскопическое поведение воды, и, по словам Руссо, «многие аномалии практически исчезнут — вы можете заставить воду вести себя как простая жидкость. Например, увеличивая «тетраэдральность» — долю молекул воды, имеющих ровно четыре ближайших соседа, — лед становится более плотным, чем вода, и тонет, а не плавает, что обычно происходит с обычными жидкостями.
Например, увеличивая «тетраэдральность» — долю молекул воды, имеющих ровно четыре ближайших соседа, — лед становится более плотным, чем вода, и тонет, а не плавает, что обычно происходит с обычными жидкостями.
Ученые создали компьютерную модель, которая сделает воду менее «водянистой»
Руссо использует модель с двумя состояниями, которая рассматривает воду как смесь форм с высокой и низкой плотностью, но если эти формы существуют, можно ли выделить их как отдельные жидкости? В 1992 году моделирование, проведенное Юджином Стэнли из Бостонского университета в США, показало, что это произойдет в переохлажденной воде при очень низких температурах. 2 Хотя вода замерзает при 0°C при атмосферном давлении, без примесей, способных зародышеобразовать кристаллы, процесс настолько медленный, что жидкую воду можно охладить примерно до 232K (–41°C). Ниже этой точки вода быстро замерзает, что делает измерение жидкости невозможным. Вода также существует в стеклообразном состоянии при температуре ниже 150 К, но быстро замерзает выше этой точки.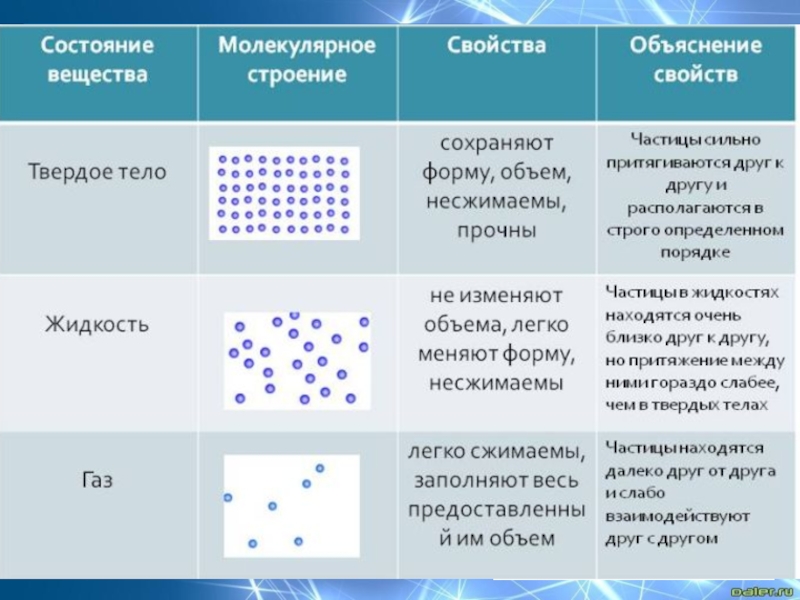 «Между 235K и 150K находится то, что называется ничейной зоной», — объясняет Нильссон, где вообще невозможно измерить жидкую фазу.
«Между 235K и 150K находится то, что называется ничейной зоной», — объясняет Нильссон, где вообще невозможно измерить жидкую фазу.
Модель Стэнли предполагает, что переохлажденная вода на самом деле разделится на две отдельные фазы внутри этой нейтральной зоны, и что при таких низких температурах существует ранее неизвестная критическая точка. Критическая точка — это температура и давление, при которых исчезает граница между двумя фазами; например, вода имеет критическую точку между ее жидким и паровым состояниями при 647 К и 22,064 МПа, и свойства двух фаз становятся неразличимыми. Предполагаемая вторая критическая точка на ничейной территории будет означать исчезновение фазового разделения между двумя отдельными жидкими фазами.
Но найти доказательства существования этих двух жидких фаз непросто. «Мы не можем наполнить стакан двумя типами воды, но были проведены некоторые эксперименты, которые косвенно наблюдали такие переходы», — говорит Руссо.
Один из подходов заключается в изучении низкотемпературной воды в ее аморфном стекловидном состоянии. При температуре ниже 136К существуют два типа стекловидной воды: один имеет низкую плотность, а другой – высокую плотность. Одно из направлений мысли состоит в том, что они, возможно, эквивалентны фазам воды с низкой и высокой плотностью, которые были предложены, и при правильных экспериментальных условиях можно обнаружить отдельные жидкие фазы и переход между ними.«Люди пробуют этот путь, чтобы найти доказательства этого перехода жидкость-жидкость», — объясняет Руссо. «Они начинают со стекла, немного нагревают его и пытаются увидеть, есть ли переход в другую жидкость до того, как она кристаллизуется [при 150 К]»,
При температуре ниже 136К существуют два типа стекловидной воды: один имеет низкую плотность, а другой – высокую плотность. Одно из направлений мысли состоит в том, что они, возможно, эквивалентны фазам воды с низкой и высокой плотностью, которые были предложены, и при правильных экспериментальных условиях можно обнаружить отдельные жидкие фазы и переход между ними.«Люди пробуют этот путь, чтобы найти доказательства этого перехода жидкость-жидкость», — объясняет Руссо. «Они начинают со стекла, немного нагревают его и пытаются увидеть, есть ли переход в другую жидкость до того, как она кристаллизуется [при 150 К]»,
Нильссон пытался обнаружить две жидкости, используя рассеяние рентгеновских лучей от ультрахолодных капель воды. «Мы разработали методы, позволяющие делать все очень быстро», — объясняет он. «Если вы можете проводить [эксперименты] на микросекундном уровне, вы можете расширять границы ничейной земли до все более и более низких температур.Его команда охладила капли воды размером 10–20 мкм, введя их в вакуум, где они очень быстро испаряются и остывают. Используя 50–100 фемтосекундных импульсов рентгеновского лазера, они смогли измерить свойства, связанные со структурой любой жидкой воды, присутствующей в капле. «Нам удалось опуститься до 227 000 000 000 000 000 000 000 000, и мы увидели, что происходит внутри этой нейтральной зоны, — говорит Нильссон. 3
Используя 50–100 фемтосекундных импульсов рентгеновского лазера, они смогли измерить свойства, связанные со структурой любой жидкой воды, присутствующей в капле. «Нам удалось опуститься до 227 000 000 000 000 000 000 000 000, и мы увидели, что происходит внутри этой нейтральной зоны, — говорит Нильссон. 3
Линия Widom
В 2017 году команда Нильссона опубликовала новаторский результат, который, как они утверждают, предоставляет больше доказательств модели воды с двумя состояниями и помогает объяснить странное поведение воды при охлаждении.Они нашли доказательства существования линии Widom, названной в честь Бенджамина Видома, почетного профессора химии Корнельского университета в США. Эта линия выступает из критической точки на фазовой диаграмме и, в случае воды, представляет собой разделение жидкой фазы на две области, одна из которых ведет себя как фаза с высокой плотностью (на высокотемпературной, высокоплотной фазе). -сторона давления), а другая больше похожа на низкоплотную (на стороне низкой температуры и низкого давления).
Вблизи этой линии Уидома жидкость претерпевает наибольшую скорость изменения между двумя формами жидкости, и возможно образование одной фазы внутри другой.Существование линии Видома и связанной с ней критической точки может объяснить, почему вода колеблется между жидкостью с низкой и высокой плотностью выше критической точки. Гипотезы Нильссона предполагают, что даже в пределах одной фазы вблизи линии Видома при понижении температуры образуются очень маленькие карманы жидкости с более низкой плотностью, что объясняет, почему плотность воды уменьшается от 4°C до точки замерзания.
Из экспериментов по рассеянию рентгеновских лучей каплями воды Нильссон смог произвести расчеты флуктуаций электронной плотности и определить максимальное значение сжимаемости воды при температуре 229 К и давлении 0 бар, которое соответствовало бы ожидаемому поведению вблизи линии Видома.На этой линии жидкая структура претерпевает самое быстрое структурное преобразование и, следовательно, наиболее сжимаема. 4 Нильссон продолжает искать точное положение критической точки. «Мы думаем, что это, вероятно, температурный режим около 1 кбар [100 МПа] при 210 К», — говорит он.
4 Нильссон продолжает искать точное положение критической точки. «Мы думаем, что это, вероятно, температурный режим около 1 кбар [100 МПа] при 210 К», — говорит он.
Скептики
Но не все довольны этой гипотезой. «Многие крайне скептически относятся к идее, что вода — это смесь двух жидкостей, — говорит Алан Сопер из Лаборатории Резерфорда Эпплтона в Оксфордшире, Великобритания.«Лично мне трудно представить, как могут быть молекулы воды двух разных типов».
Сопер говорит, что он не оспаривает, что может быть вторая критическая точка в нейтральной зоне, но он говорит, что идея о том, что вода может содержать участки двух типов воды до условий окружающей среды, подразумевает разделение фаз выше критической точки. «Я хочу сказать, что у вас не может быть разделения фаз, если вы находитесь выше второй критической точки — это не имеет никакого смысла, иначе это не критическая точка.Ты не можешь получить свой пирог и съесть его».
Сопер утверждает, что если бы там были пятна двух типов воды, это можно было бы обнаружить в экспериментах по рассеянию рентгеновских лучей.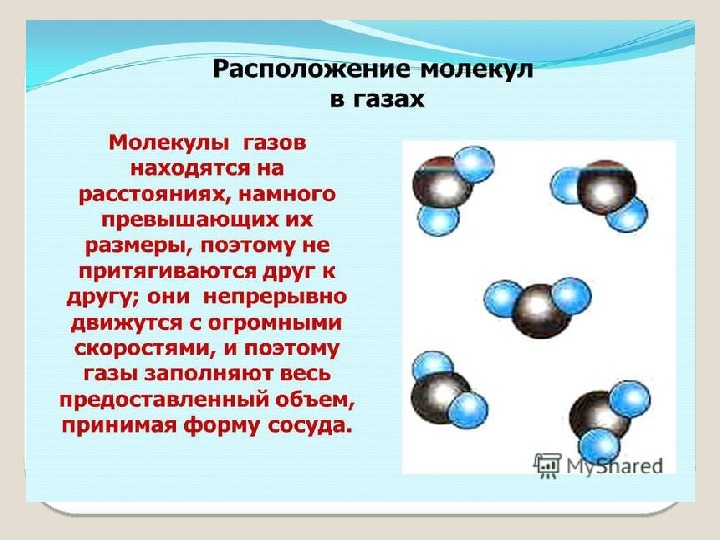 «Вы должны иметь гораздо более высокое рассеяние, а рассеяния там нет.» Например, говорит он, из рентгеновского рассеяния хорошо известно, что смеси, такие как структуры мицелл масла и воды, показывают огромные контрасты между область воды и область нефти, с огромным количеством рассеяния, вызванным флуктуациями плотности между каждой отдельной областью, и этого не видно с водой.
«Вы должны иметь гораздо более высокое рассеяние, а рассеяния там нет.» Например, говорит он, из рентгеновского рассеяния хорошо известно, что смеси, такие как структуры мицелл масла и воды, показывают огромные контрасты между область воды и область нефти, с огромным количеством рассеяния, вызванным флуктуациями плотности между каждой отдельной областью, и этого не видно с водой.
У вас не может быть фазового разделения, если вы находитесь выше второй критической точки
Но Нильссон говорит, что он не предполагает, что его заплаты составляют две фазы выше критической точки. «В жидкости не две фазы, а флуктуирующие области — это нечто отличное от фаз». Он говорит, что они могут иметь размер от 50 до 100 молекул и постоянно взаимозаменяемы с окружающими молекулами. Он описывает расстановку как гостей на свадьбе или за ужином-танцем – в одном месте люди двигаются и танцуют; в другом они сидят за столами — зоны различны, но люди (или молекулы) постоянно перемещаются из одной в другую. Нильссон говорит, что простая модель жидкости просто не объясняет аномальные свойства воды.
Нильссон говорит, что простая модель жидкости просто не объясняет аномальные свойства воды.
С другой стороны, исследование рассеяния рентгеновских лучей, проведенное в 2019 году группой под руководством Александра Фёлиша из Центра Гельмгольца в Берлине и Потсдамского университета, показало результаты, согласующиеся с моделью непрерывного распределения жидкой воды в условиях окружающей среды с уровнем порядка при этом каждая молекула воды вносит в среднем около 1,75 водородных связей, переданных и принятых на молекулу. 5 Таким образом, они пришли к выводу, что, даже если флуктуации могут возникать вблизи фазовой границы, в условиях окружающей среды модель с двумя состояниями маловероятна.
Что интересно, мы вглядываемся в регион, где существует жизнь
Сопер считает, что вместо идеи о дискретных участках двух жидкостей воде ее уникальные свойства при охлаждении придает постепенное «замораживание» ориентационного порядка молекул воды в тетраэдрическом выравнивании, даже когда они все еще находятся в движении, как ожидаемо для жидкости. «Именно это изменение в ориентационном порядке воды, кажется, упускается из виду во всех дискуссиях», — говорит он, и это может объяснить замечательное поведение воды без необходимости двух различных состояний выше критической точки.
«Именно это изменение в ориентационном порядке воды, кажется, упускается из виду во всех дискуссиях», — говорит он, и это может объяснить замечательное поведение воды без необходимости двух различных состояний выше критической точки.
Среди физико-химиков до сих пор нет единого мнения о том, как ведет себя вода. Это может показаться чисто эзотерическим спором, но необычные свойства воды, особенно при очень низких температурах, действительно имеют значение для других областей науки. «Это влияет на модели климата [при] высоком давлении, [и] внеземную воду, [которую] мы можем найти на других планетах, или [воду в] наноограничениях», — говорит Руссо.Например, недавнее исследование показало, что вода на поверхности капель гораздо более упорядочена, чем объемная вода, и находится в состоянии, сравнимом с состоянием переохлажденной воды с сильными водородными связями, даже при комнатной температуре. 6
Будь то смесь двух жидкостей или только одной, свойства воды также имеют фундаментальное значение для биологии. «Вода — это то, что придает [нуклеиновым кислотам] их интересную структуру и свойства, и то же самое с белками», — говорит Чаплин. Сама жизнь процветала, потому что лед менее плотный, чем вода, что позволяет организмам выживать под плавающими слоями льда.«Что интересно, так это то, что мы смотрим в регион, где существует жизнь, когда всплывает [аномальное поведение воды]», — говорит Нильссон. Согласно его модели с двумя состояниями, только при температурах ниже 50°C вода становится смесью жидкости с низкой и высокой плотностью, и это также область температур, при которой существует жизнь. «Это совпадение или в этом есть что-то важное?» — спрашивает Нильссон. «Мы [пока] не знаем».
«Вода — это то, что придает [нуклеиновым кислотам] их интересную структуру и свойства, и то же самое с белками», — говорит Чаплин. Сама жизнь процветала, потому что лед менее плотный, чем вода, что позволяет организмам выживать под плавающими слоями льда.«Что интересно, так это то, что мы смотрим в регион, где существует жизнь, когда всплывает [аномальное поведение воды]», — говорит Нильссон. Согласно его модели с двумя состояниями, только при температурах ниже 50°C вода становится смесью жидкости с низкой и высокой плотностью, и это также область температур, при которой существует жизнь. «Это совпадение или в этом есть что-то важное?» — спрашивает Нильссон. «Мы [пока] не знаем».
Рэйчел Бразил, научный писатель из Лондона, Великобритания
Закон Бойля | Учебник для начинающих
На Земле материя существует в одном из трех состояний: твердом, жидком или газообразном.Материя в каждом состоянии проявляет различные характеристики. Газы, например, не имеют фиксированного объема «>* или формы. В результате газы реагируют на изменение давления изменением своего объема. Другими словами, газы сжимаемы. Напротив, жидкости и твердые тела не сжимаемы: их объем не изменяется при изменении давления. Эта разница в сжимаемости является причиной того, что заполненные воздухом полости в наших ушах «хлопают» во время взлета и посадки самолета, а полости в наших телах, заполненные жидкостью, — нет.
Закон Бойля «>* описывает зависимость между давлением и объемом при постоянной температуре для фиксированной массы * (т.е. числа молекул) газа.
Чтобы понять закон Бойля, полезно визуализировать поведение молекул газа в замкнутом пространстве. В закрытом сосуде, наполненном газом, отдельные молекулы газа постоянно отскакивают от стенок сосуда. Каждый раз, когда молекула газа ударяется о стену, она придает этой стене силу. 1 В гибком контейнере, таком как воздушный шар, сила удара молекул о стенки воздушного шара удерживает воздушный шар надутым.Сила каждого удара невелика, но само количество столкновений создает достаточную силу, чтобы предотвратить коллапс воздушного шара. 2
Давление в закрытом сосуде изменяется, если
- изменение температуры
- количество молекул увеличивается или уменьшается
- изменение громкости
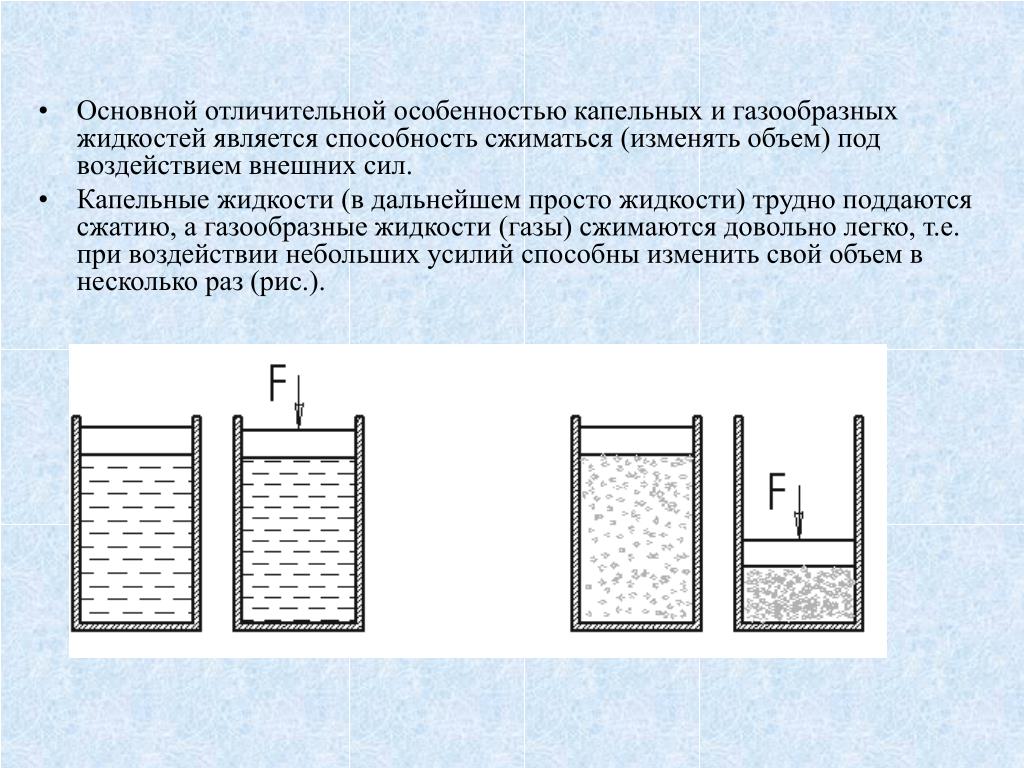
Согласно закону Бойля степень сжатия газа пропорциональна приложенному давлению.Его математическое выражение:
P 1 В 1 =P 2 В 2
Где P 1 — давление количества газа объемом V 1 , а P 2 — давление того же количества газа, когда он имеет объем V 2 . Формула показывает, что если больше ничего не изменится, то объем данной массы газа обратно пропорционален приложенному к нему давлению. Эта зависимость является линейной, если давление на газ увеличивается вдвое, его объем уменьшается на 1/2.Альтернативное выражение закона:
PV = C
Произведение объема (V) и давления (P) равно константе (C).
Взаимосвязь между давлением и объемом является результатом влияния объема на скорость, с которой молекулы газа сталкиваются со стенками контейнера. Если объем уменьшается, что приводит к увеличению давления, молекулы чаще сталкиваются со стенками сосуда. Это верно даже при том, что скорость (температура) отдельных молекул не изменилась.И наоборот, если объем увеличивается, уменьшается и скорость столкновений, и давление.
Это верно даже при том, что скорость (температура) отдельных молекул не изменилась.И наоборот, если объем увеличивается, уменьшается и скорость столкновений, и давление.
На следующем рисунке показана эта зависимость для контейнера с газом с фиксированной температурой и числом молекул.
Проверьте свое понимание концепций с помощью практических задач на концепции и расчеты.
Демонстрация видео:
1 Это третий закон движения Ньютона, который гласит, что при взаимодействии двух тел они действуют друг на друга с равными и противоположными силами.Когда молекулы газа сталкиваются со стенкой, и стенка, и частица испытывают силу удара. 2 Типичный воздушный шар для вечеринок имеет объем от 10 до 15 литров. Полностью надутый он содержит примерно 3×10 23 молекул воздуха. При нормальной комнатной температуре On a curved surface, the normal is a line perpendicular to a line tangent to the curve at a particular point. Normals have many uses in mathematics and physics. In optics, for example, the normal line is used to calculate angels of reflection and refraction for light rays encountering surfaces and interfaces.»> * эти молекулы воздуха движутся со скоростью от 300 до 500 м/с. При таких скоростях каждая молекула сталкивается со стенками воздушного шара тысячи раз в секунду.
Родственный контент
- Иллюстрации
- Наборы задач
Кинетическая молекулярная теория: свойства твердых и жидких тел — видео и расшифровка урока
КМТ и свойства жидкости
Посмотрите на эти две фотографии жидкой воды:
Одна фотография воды в бассейне; другой представляет собой жидкую воду на молекулярном уровне. Какие свойства жидкостей видны на этих двух рисунках?
Какие свойства жидкостей видны на этих двух рисунках?
Одним из наиболее примечательных свойств жидкостей является то, что они текучие и могут течь. Жидкости имеют определенный объем, но не определенную форму. Говорят, что жидкости имеют низкую сжимаемость; другими словами, трудно упаковать жидкие частицы ближе друг к другу. По сравнению с газами между частицами относительно мало места. Однако по сравнению с твердыми телами жидкости имеют некоторое пространство между частицами. Это, в сочетании с тем фактом, что жидкие частицы также обладают относительно большей энергией, чем твердые частицы, позволяет жидкости течь.На молекулярном уровне эти два фактора придают жидкостям неорганизованный вид.
Типы межмолекулярных сил в жидкости зависят от химического состава самой жидкости. Сила межмолекулярной силы связана с типом межмолекулярной силы, но на нее также влияет количество кинетической энергии в веществе. Чем больше кинетическая энергия, тем слабее межмолекулярные силы. Жидкости обладают большей кинетической энергией, чем твердые тела, поэтому межмолекулярные силы между жидкими частицами, как правило, слабее.Мы обсудим типы межмолекулярных сил позже.
Жидкости обладают большей кинетической энергией, чем твердые тела, поэтому межмолекулярные силы между жидкими частицами, как правило, слабее.Мы обсудим типы межмолекулярных сил позже.
KMT и Solids
Теперь давайте проверим некоторые Solids:
На одном из этих изображений изображены кристаллы пирита в их природной кубической форме; другой — структура триоксида фосфора в молекулярном масштабе. Какие свойства твердых тел вы заметили?
Твердые вещества имеют определенную форму и объем.Твердые частицы двигаются, но не очень далеко! Твердые частицы имеют относительно небольшую кинетическую энергию и вибрируют на месте. Из-за этого они не могут течь как жидкости. Большинство твердых тел имеют плотно упакованную кристаллическую структуру. Кристаллическая структура представляет собой упорядоченное повторяющееся расположение частиц, называемое кристаллической решеткой. Форма кристалла показывает расположение частиц в твердом теле.
Форма кристалла показывает расположение частиц в твердом теле.
Некоторые твердые тела не имеют кристаллической формы. Те, которые не называются аморфными твердыми телами. Аморфные твердые тела не имеют упорядоченной внутренней структуры. Примеры аморфных твердых тел включают резину, пластик и стекло. Воск также является аморфным твердым телом. Ему можно придать любую форму и переформовать в любое время, когда он немного нагреется.
Межмолекулярные силы
Как отмечалось ранее, межмолекулярные силы представляют собой силы притяжения между частицами. Они резко отличаются от связей, возникающих внутри частиц. Тип присутствующих межмолекулярных сил зависит от типа присутствующих частиц.
Водородные связи возникают между полярными молекулами, которые содержат атом кислорода, азота или фтора, ковалентно связанный с атомом водорода. Межмолекулярное притяжение возникает между частично отрицательно заряженным кислородом, фтором или азотом и частично положительно заряженным водородом соседней молекулы. Водородные связи представляют собой относительно сильные межмолекулярные силы.
Водородные связи представляют собой относительно сильные межмолекулярные силы.
Ион-дипольные силы возникают между ионом и полярной молекулой. Ион будет притягиваться к противоположно заряженному полюсу соседней молекулы.Соленая вода насыщена ионно-дипольными притяжениями. Положительные ионы натрия притягиваются к отрицательным полюсам молекул воды. Отрицательно заряженные ионы хлора притягиваются к положительным полюсам молекул воды.
Диполь-диполь силы возникают между противоположно заряженными полюсами полярных молекул.
Индуцированные диполем дипольные силы возникают, когда полярная молекула индуцирует временный дипольный момент в соседней неполярной молекуле. Вы можете спросить себя, что? Как неполярная молекула может получить дипольный момент? Отрицательно заряженные электроны, вращающиеся вокруг атома или молекулы, подвижны и поляризуемы.Если отрицательно заряженная частица приблизится к сгустку электронов, они будут отталкиваться от нее и удаляться как можно дальше. Теперь представьте, что отрицательный полюс молекулы приближается к неполярной молекуле. Электроны движутся в сторону, обращенную от входящего отрицательного полюса. Теперь у нас есть одна сторона более отрицательная, а другая более положительная: это индуцированный диполь! Эти межмолекулярные силы относительно слабы.
Теперь представьте, что отрицательный полюс молекулы приближается к неполярной молекуле. Электроны движутся в сторону, обращенную от входящего отрицательного полюса. Теперь у нас есть одна сторона более отрицательная, а другая более положительная: это индуцированный диполь! Эти межмолекулярные силы относительно слабы.
Лондонские дисперсионные силы (LDF) — самый слабый тип межмолекулярного взаимодействия.LDF возникают между неполярными молекулами, когда случайное движение электронов вокруг молекулы создает временный диполь, который индуцирует временный диполь в соседней молекуле.
Фазовые превращения
Количество кинетической энергии вещества связано с его фазой. Газы обладают большей кинетической энергией, чем жидкости. Жидкости обладают большей кинетической энергией, чем твердые тела. При повышении температуры вещества добавляется теплота, а его частицы приобретают кинетическую энергию.
Из-за близкого расположения друг к другу жидкие и твердые частицы испытывают межмолекулярные силы. Эти силы удерживают частицы близко друг к другу. Чем большей кинетической энергией обладают частицы, тем слабее становятся эти силы. При определенных температурах частицы преодолевают достаточно межмолекулярных сил, чтобы испытать значительное изменение свойств. В этот момент происходит изменение фазы. Для каждого вещества существуют определенные температуры, совпадающие с количеством кинетической энергии, необходимой для того, чтобы частицы обладали свойствами, характерными для жидкости, твердого тела или газа.
Эти силы удерживают частицы близко друг к другу. Чем большей кинетической энергией обладают частицы, тем слабее становятся эти силы. При определенных температурах частицы преодолевают достаточно межмолекулярных сил, чтобы испытать значительное изменение свойств. В этот момент происходит изменение фазы. Для каждого вещества существуют определенные температуры, совпадающие с количеством кинетической энергии, необходимой для того, чтобы частицы обладали свойствами, характерными для жидкости, твердого тела или газа.
Итоги урока
Давайте повторим.
Кинетическая молекулярная теория (КМТ) — это модель, используемая для объяснения поведения материи.
Свойства жидкостей включают:
- Определенный объем, но неопределенная форма
- Относительно несжимаемый
- Частицы обладают большей энергией, чем твердые тела, но меньшей энергией, чем газы
- Жидкости могут течь
Свойства твердых тел включают:
- Определенную форму и объем
- Очень несжимаемый
- Частицы имеют относительно небольшую энергию
- Твердые частицы вибрируют на месте
- Твердые тела часто имеют кристаллическую структуру
Межмолекулярные силы (IMF) — это силы притяжения между частицами.
