Проект человеческого генома и его роль в развитии фармацевтической промышленности
Перспективы развития фармацевтической промышленности в XXI веке прежде всего связывают с достижениями в области биотехнологий. Особую роль в этом призван сыграть Проект человеческого генома (HGP — Human Genome Project). В 1990 г. Министерство энергетики США и Национальные институты здоровья приступили к реализации HGP, рассчитанного на 15 лет. Вскоре проект стал частью международного сотрудничества 18 государств — США, некоторых стран Европы, Японии и Китая. Основная задача HGP — идентифицировать и локализовать все гены в молекулах ДНК человека, определить последовательность расположения 3 млрд химических оснований, из которых состоит ДНК, создать базу данных генома человека и некоторых микроорганизмов и разработать средства для эффективного анализа генетических данных. Другой важной целью HGP является определение механизмов действия и взаимодействия генов в процессе развития человеческого организма и в патогенезе заболеваний.
Ожидают, что в результате реализации этого грандиозного проекта ученые получат доступ к «книге жизни» — к точному биохимическому коду каждого из 80–100 тыс. генов, составляющих геном человека.
Всего несколько лет назад появилась наука геномика, которая изучает весь генетический материал человека. Сегодня на базе геномики уже заложены основы новых дисциплин: геномной медицины, фармакогеномики, протеомики, микробной геномики и др. Применение новых знаний в области генетики может кардинально изменить подходы к диагностике, лечению и профилактике сотен и даже тысяч не только наследственных генетических заболеваний (например, фенилкетонурии, муковисцидоза, талассемий), но и множества других широко распространенных болезней, в развитии которых участвуют как генетические факторы, так и факторы окружающей среды (например, болезни сердечно-сосудистой системы, сахарный диабет, некоторые формы злокачественных новообразований, психические и неврологические расстройства, инфекционные болезни, в том числе туберкулез и СПИД).
Кроме того, эти знания могут быть использованы для разработки новых источников энергии (биологического топлива), методов контроля за состоянием окружающей среды, современных способов безопасного и эффективного уничтожения токсических отходов. Потенциальные возможности в этой сфере очень велики, поскольку в настоящее время только 0,01% всех микроорганизмов культивированы и изучены. Поэтому с 1994 г. одновременно с программой изучения генома человека Министерство энергетики США осуществляет Программу изучения генома микроорганизмов (Microbal Genome Program).
Несмотря на огромную стоимость HGP — 3 млрд долларов США (в среднем около 200 млн в год), проект позволит сэкономить значительные средства за счет эффекта масштаба. Так, затраты на поиск одного гена, который обусловливает развитие наследственного заболевания (например, муковисцидоза), составляют около 100 млн долларов США. Поэтому расшифровка каждого гена в отдельности составила бы астрономическую сумму. Подсчитано, что системный подход к изучению всего генома обойдется намного дешевле и средняя стоимость обнаружения одного гена составит не более 30 тыс.
В 1995 г. впервые были полностью определены последовательности генома первого микроорганизма (Haemophilus influenzae), а в 1998 г. — первого животного организма (круглого червя Caenorhabditis elegans). Если геном H. influenzae насчитывает 1,9 Mb, то геном C. elegans — 97 Mb. К 1998 г. ученым удалось установить последовательности 7% человеческого генома. В настоящее время полностью расшифрованы геномы 20 микроорганизмов (111 Mb), в том числе
— первого животного организма (круглого червя Caenorhabditis elegans). Если геном H. influenzae насчитывает 1,9 Mb, то геном C. elegans — 97 Mb. К 1998 г. ученым удалось установить последовательности 7% человеческого генома. В настоящее время полностью расшифрованы геномы 20 микроорганизмов (111 Mb), в том числе 
С учетом этих достижений в 1998 г. участники программы провели корректировку планов осуществления HGP. Решено, что проект будет завершен на 2 года раньше срока. Таким образом, полностью геном человека будет расшифрован не позже 2003 г., а предварительный проект генома будет представлен уже весной этого года. Под полной расшифровкой генома понимают точное определение расположения всех последовательностей ДНК, даже тех больших участков, которые не содержат генов (они составляют около 97% генома).
Однако над полной расшифровкой кода работают в основном государственные институты, а не частные компании. Например, специалисты компании «Genset» (Франция) в начале 2000 г. должны завершить составление карты только 60 тыс. наиболее важных участков и, сравнивая эти участки ДНК различных людей, выявить конкретные гены, которые действительно вызывают развитие определенного заболевания. Руководитель исследований по геномике компании «Genset» Д. Коуэн считает, что, например, из 100 тыс. генов только 200 могут иметь отношение к развитию 20 наиболее распространенных заболеваний, в 80% случаев являющихся причиной смерти людей, поэтому именно таким генам следует уделить особое внимание. Картирование генов частными компаниями, безусловно, способствует выполнению проекта, однако часто компании пытаются запатентовать отдельные участки ДНК или генов. В настоящее время вопросы патентования генетического материала недостаточно разработаны и заинтересованные стороны интенсивно работают над совершенствованием законодательства.
генов только 200 могут иметь отношение к развитию 20 наиболее распространенных заболеваний, в 80% случаев являющихся причиной смерти людей, поэтому именно таким генам следует уделить особое внимание. Картирование генов частными компаниями, безусловно, способствует выполнению проекта, однако часто компании пытаются запатентовать отдельные участки ДНК или генов. В настоящее время вопросы патентования генетического материала недостаточно разработаны и заинтересованные стороны интенсивно работают над совершенствованием законодательства.
Данные о геноме человека и других организмов уже используют в таких областях медицины и фармации, как генная инженерия, генная терапия, фармакогенетика, протеомика, а также в создании генных вакцин.
Генное тестирование
В геноме человека около 2–5 тыс. генов могут вызывать или обусловливать предрасположенность к развитию заболеваний. В результате выполнения проекта появится реальная возможность диагностировать индивидуальную предрасположенность к заболеваниям и заблаговременно принимать соответствующие меры профилактики (например, путем изменения образа жизни, проведения целенаправленных профилактических осмотров или применения генной терапии).
В конечном счете целью проекта является разработка новых методов лечения (и излечения) и предупреждения множества заболеваний. Однако путь от выявления гена, ответственного за развитие определенного патологического состояния, до создания эффективного метода лечения достаточно долог и изобилует многочисленными препятствиями.
При генном тестировании с помощью новейших методик определяют наличие генетических заболеваний путем исследования самой молекулы ДНК.
Пока многие биотехнологические компании заняты разработкой коммерческих диагностических тестов, предназначенных для выявления измененных генов у лиц с подозрением на наличие определенного заболевания или с высоким риском его развития. Количество таких тестов на рынке постоянно увеличивается, хотя многие вопросы их практического применения пока еще недостаточно разработаны. В настоящее время большое количество диагностических лабораторий в США и странах Западной Европы проводят генетическое тестирование. Перечни лабораторий и информация о используемых ими методах генетических или генных (так называемое ДНК-тестирование) исследований можно найти в сети Интернет.
Несмотря на то что некоторые из этих методов достаточно совершенны и играют важную роль в спасении человеческих жизней, среди врачей и ученых существуют разногласия о целесообразности проведения тестов и интерпретации результатов тестирования для выявления заболеваний, методы лечения которых отсутствуют. Кроме того, в США известны случаи, когда результаты генетического тестирования страховые компании или работодатели использовали во вред пациентам.
Генная терапия
Большинство методик генной терапии основано на введении с помощью различных методов генетического материала в клетки больного для замены, коррекции или блокирования дефектного гена. Генную терапию пытаются использовать для лечения пациентов с наследственными заболеваниями, злокачественными образованиями и СПИДом. Генная терапия является относительно новым методом лечения. В 1990 г. американский генетик У.Ф. Андерсон впервые применил генную терапию для лечения 4-летней девочки с тяжелым иммунодефицитом (дефицит фермента аденозиндезаминазы — АДА), при котором летальный исход наступает в первые месяцы или первые годы жизни. В качестве носителя (вектора) для переноса гена АДА в лимфоциты
Генную терапию пытаются использовать для лечения пациентов с наследственными заболеваниями, злокачественными образованиями и СПИДом. Генная терапия является относительно новым методом лечения. В 1990 г. американский генетик У.Ф. Андерсон впервые применил генную терапию для лечения 4-летней девочки с тяжелым иммунодефицитом (дефицит фермента аденозиндезаминазы — АДА), при котором летальный исход наступает в первые месяцы или первые годы жизни. В качестве носителя (вектора) для переноса гена АДА в лимфоциты  Целью значительной части исследований (252) является лечение больных со злокачественными новообразованиями.
Целью значительной части исследований (252) является лечение больных со злокачественными новообразованиями.
Фармакогеномика
«Фармакогеномика» — новый термин, под которым подразумевают использование данных геномики о вариабельности генов для оптимизации поиска и разработки лекарственных веществ и для более индивидуализированного подхода к лечению больных.
Фармакогенетическими исследованиями подтверждено, что и на этническом, и на индивидуальном уровне имеются различия в механизмах обмена веществ в организме человека, которые могут значительно влиять на метаболизм лекарственных средств. Несмотря на то что имеется множество лекарственных средств, которые специфически действуют на определенные органы или ткани организма, они не всегда являются максимально эффективными из-за индивидуальных генетических различий или генетического полиморфизма (наличие нескольких аллелей одного гена, причем носители редкого аллеля данного гена составляют 2% популяции и более). В последние годы стало ясно, что вариабельность генов — более распространенное явление, чем считали ранее, и этим обусловлены многие случаи неэффективного лечения или развития побочных реакций. Ранее фармакогенетика развивалась главным образом на основе информации о генетических маркерах для генов, кодирующих определенные признаки, данных семейного анамнеза, сведений о расовых или этнических особенностях. Применение новых методов физического картирования генов или маркеров и «функционального клонирования» генов позволяет выяснить особенности генетических механизмов нарушения обмена веществ, то есть определить гены, кодирующие соответствующие измененные белковые продукты.
В последние годы стало ясно, что вариабельность генов — более распространенное явление, чем считали ранее, и этим обусловлены многие случаи неэффективного лечения или развития побочных реакций. Ранее фармакогенетика развивалась главным образом на основе информации о генетических маркерах для генов, кодирующих определенные признаки, данных семейного анамнеза, сведений о расовых или этнических особенностях. Применение новых методов физического картирования генов или маркеров и «функционального клонирования» генов позволяет выяснить особенности генетических механизмов нарушения обмена веществ, то есть определить гены, кодирующие соответствующие измененные белковые продукты.
В клинической практике наибольшее значение имеет полиморфизм генов, ответственных за синтез ферментов, катализирующих метаболические процессы, например процессы окисления с участием системы цитохрома Р450 (фермент CYP2D6), ацетилирования с участием N-ацетилтрансферазы, S-метилирования (тиопуринметилтрансфераза), а также гидролиза эфиров (псевдохолинэстераза). Полиморфизм генов или кодируемых ими энзимов существенно влияет на метаболизм и соответственно на фармакокинетику и фармакодинамику большого количества лекарственных средств. Генетические исследования позволят с помощью аллельспецифической амплификации ДНК и генотипирования определять эффективную дозу лекарственного препарата и предупреждать случаи лекарственной токсичности, особенно для препаратов с ограниченной широтой терапевтического действия.
Полиморфизм генов или кодируемых ими энзимов существенно влияет на метаболизм и соответственно на фармакокинетику и фармакодинамику большого количества лекарственных средств. Генетические исследования позволят с помощью аллельспецифической амплификации ДНК и генотипирования определять эффективную дозу лекарственного препарата и предупреждать случаи лекарственной токсичности, особенно для препаратов с ограниченной широтой терапевтического действия.
Генетические вакцины
Вакцины являются одним из важнейших достижений современной медицины. Благодаря их применению удалось ликвидировать многие смертельно опасные заболевания, воспрепятствовать распространению тяжелых болезней. Однако в отношении некоторых заболеваний обычные методы вакцинации являются неэффективными. Поэтому необходимы принципиально новые вакцины.
Перспективными считаются вакцины, созданные на основе генетического материала, участков молекул ДНК или РНК. Генетические вакцины могут обладать высокой иммуногенностью живых аттенуированных вакцин (поскольку они способны стимулировать как гуморальный, так и клеточный иммунный ответ) и безопасностью сплит- или субъединичных вакцин. Принцип действия генетических вакцин основан на введении в клетки человека только тех участков цепочки ДНК (плазмид) возбудителя, которые при поступлении в ядро клетки индуцируют синтез антигенных белковых молекул. В настоящее время несколько генетических вакцин находятся на различных стадиях разработки и даже проводится I фаза их клинических исследований.
Принцип действия генетических вакцин основан на введении в клетки человека только тех участков цепочки ДНК (плазмид) возбудителя, которые при поступлении в ядро клетки индуцируют синтез антигенных белковых молекул. В настоящее время несколько генетических вакцин находятся на различных стадиях разработки и даже проводится I фаза их клинических исследований.
Результаты, полученные при изучении генома человека, используют в фармацевтической промышленности. В патогенезе любого заболевания можно выделить генетический компонент, касается ли это наследственной патологии или реакции организма на воздействие различных вредных факторов окружающей среды, таких, как вирусы, токсины, канцерогены и др. По некоторым оценкам более 50 тыс. генов могут служить потенциальными «мишенями» (объектами) для фармакологического воздействия. Для сравнения: за последние 50 лет объектом изучения стали 500 биологических «мишеней». Все больше компаний занимаются исследованиями в области биотехнологий. По данным Consulting Resources Corporation Newsletter (1999), объем продаж такими компаниями технологий и продукции, полученной на основе использования ДНК, в 2009 г. превысит 45 млрд долларов.
превысит 45 млрд долларов.
В результате выполнения HGP ученые получат возможность исправлять нарушения в функционировании определенных генов. Разработка принципиально новых лекарственных средств ускорится благодаря более глубоким знаниям об этиологии полигенетических заболеваний, таких, как сахарный диабет, артериальная гипертензия, болезни сердца и новообразования. Использование баз данных HGP, доступных для общего пользования (например, генетическая база данных «GenBank» Национальных институтов здоровья США), ускорит создание олигонуклеотидных лекарственных средств, которые способны изменять транскрипцию ДНК. При разработке медикаментов, основу которых будут составлять белковые молекулы, особо полезной станет возможность пользоваться базами данных о последовательностях ДНК. Это облегчит прогнозирование трехмерной структуры белков и их функции. Кроме того, базы данных HGP облегчат поиск неорганических действующих веществ для лечения людей, относящихся к группам риска развития наследственных заболеваний, а также разработку стратегии исследования специфических лекарственных средств. Поэтому многие специалисты считают, что XXI век будет столетием компьютерных и биотехнологий.
Поэтому многие специалисты считают, что XXI век будет столетием компьютерных и биотехнологий.
Андрей Спасокукоцкий
В геноме человека обнаружили несколько сотен новых генов
https://ria.ru/20210128/genom-1595008428.html
В геноме человека обнаружили несколько сотен новых генов
В геноме человека обнаружили несколько сотен новых генов — РИА Новости, 28.01.2021
В геноме человека обнаружили несколько сотен новых генов
Американские генетики обнаружили несколько сотен неизвестных ранее генов в наименее изученных частях генома человека. Оказалось, что более 50 из них продуцируют РИА Новости, 28.01.2021
2021-01-28T19:00
2021-01-28T19:00
2021-01-28T19:00
наука
сша
массачусетский технологический институт
гарвардский университет
здоровье
рак
биология
генетика
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21. img.ria.ru/images/154886/93/1548869333_0:448:2048:1600_1920x0_80_0_0_d3809f2beea70fc6dbcd5b9927545592.jpg
img.ria.ru/images/154886/93/1548869333_0:448:2048:1600_1920x0_80_0_0_d3809f2beea70fc6dbcd5b9927545592.jpg
МОСКВА, 28 янв — РИА Новости. Американские генетики обнаружили несколько сотен неизвестных ранее генов в наименее изученных частях генома человека. Оказалось, что более 50 из них продуцируют белки, которые участвуют в развитии раковых клеток. Результаты исследования опубликованы в журнале Nature Biotechnology.На данный момент в геноме человека идентифицировано около 20 тысяч генов. Ранние анализы последовательности генома человека предполагали существование более ста тысяч генов, кодирующих белки, но дальнейшие исследования показали, что большинство этих генов-кандидатов, скорее всего, продуцируют некодирующие РНК, фрагментированные комплементарные клоны ДНК и РНК, экспрессируемые на несущественных уровнях. Текущая база данных проекта протеома человека NeXtProt содержит примерно 17 600 белок-кодирующих генов, подтвержденных масс-спектрометрией, и около 2100 неподтвержденных белок-кодирующих генов. Тем не менее, появляется все больше доказательств того, что в генах, которые в настоящее время аннотируются как некодирующие РНК или псевдогены, а также находящихся в некоторых нетранслируемых областях, имеет место трансляция — процесс синтеза белка из аминокислот на матрице информационной (матричной) РНК, осуществляемый специальной клеточной органеллой рибосомой. Однако до сих пор отсутствовали систематические экспериментальные подтверждения того, являются ли возникающие при такой трансляции белки биологически функциональными.Исследователи из Института Броуда Гарвардского университета и Массачусетского технологического института — крупнейшего центра геномики и реализации проекта «Геном человека» — экспериментально проверили 553 гена-кандидата, в качестве которых авторы рассматривали открытые рамки считывания (Open Reading Frame, ORF) — последовательности нуклеотидов в составе длинных некодирующих РНК. Гены-кандидаты отбирали на основе опубликованных данных, предсказывающих ORF, потенциально способные кодировать биологически активные белки.
Тем не менее, появляется все больше доказательств того, что в генах, которые в настоящее время аннотируются как некодирующие РНК или псевдогены, а также находящихся в некоторых нетранслируемых областях, имеет место трансляция — процесс синтеза белка из аминокислот на матрице информационной (матричной) РНК, осуществляемый специальной клеточной органеллой рибосомой. Однако до сих пор отсутствовали систематические экспериментальные подтверждения того, являются ли возникающие при такой трансляции белки биологически функциональными.Исследователи из Института Броуда Гарвардского университета и Массачусетского технологического института — крупнейшего центра геномики и реализации проекта «Геном человека» — экспериментально проверили 553 гена-кандидата, в качестве которых авторы рассматривали открытые рамки считывания (Open Reading Frame, ORF) — последовательности нуклеотидов в составе длинных некодирующих РНК. Гены-кандидаты отбирали на основе опубликованных данных, предсказывающих ORF, потенциально способные кодировать биологически активные белки. При этом из анализа исключили псевдогены и ORF, представляющие собой варианты уже известных белок-кодирующих областей.В экспериментах по эктопической экспрессии — экспрессия генов в необычном месте организма — 257 ORF показали признаки экспрессии белка и 401 индуцировали изменения экспрессии генов. Из них 57 способствовали жизнеспособности раковых клеток человека.В частности, исследователи установили, что один из этих ORF — G029442 — кодирует богатый глицином внеклеточный белок-1 (GREP1), обладающий повышенным содержанием онкогенного цитокина GDF15 и высоко экспрессируемый при раке молочной железы. Блокирование его с помощью специального ингибитора смягчало эффект развития раковых клеток в 263 линиях.Авторы считают, что биологически активные белки, экспрессируемые неканоническими ORF, могут стать потенциальными мишенями для разработки новых методов лечения рака.
При этом из анализа исключили псевдогены и ORF, представляющие собой варианты уже известных белок-кодирующих областей.В экспериментах по эктопической экспрессии — экспрессия генов в необычном месте организма — 257 ORF показали признаки экспрессии белка и 401 индуцировали изменения экспрессии генов. Из них 57 способствовали жизнеспособности раковых клеток человека.В частности, исследователи установили, что один из этих ORF — G029442 — кодирует богатый глицином внеклеточный белок-1 (GREP1), обладающий повышенным содержанием онкогенного цитокина GDF15 и высоко экспрессируемый при раке молочной железы. Блокирование его с помощью специального ингибитора смягчало эффект развития раковых клеток в 263 линиях.Авторы считают, что биологически активные белки, экспрессируемые неканоническими ORF, могут стать потенциальными мишенями для разработки новых методов лечения рака.
https://ria.ru/20210121/rak-1594080861.html
https://ria.ru/20210113/ukraintsy-1592836225.html
сша
РИА Новости
internet-group@rian.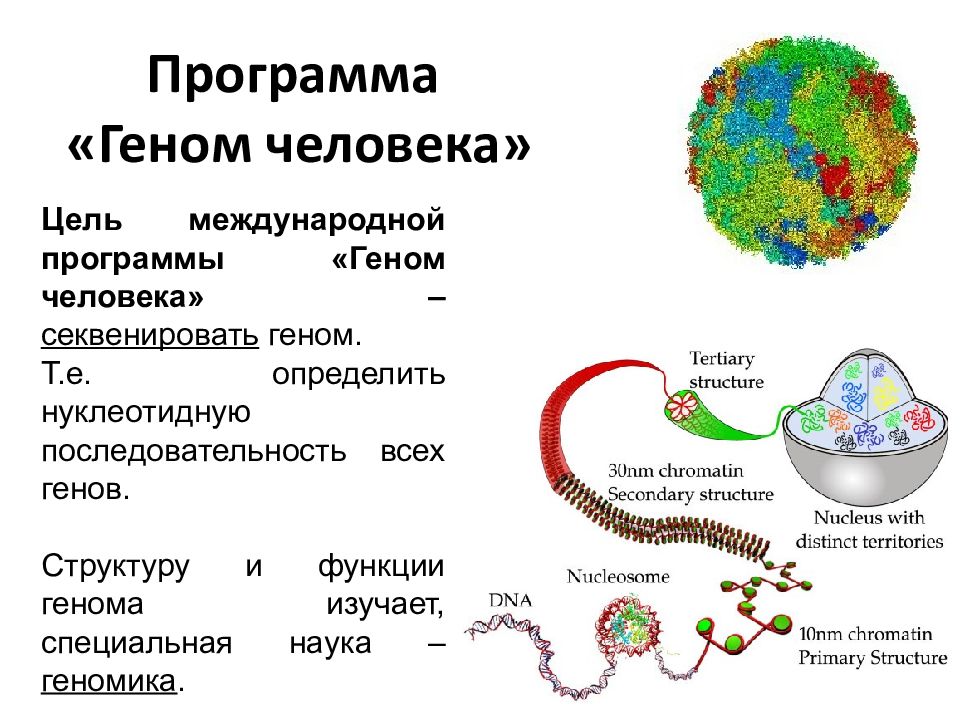 ru
ru
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2021
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdnn21.img.ria.ru/images/154886/93/1548869333_0:256:2048:1792_1920x0_80_0_0_a65c87335c99777683a73cde24c1c2b2.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og. xn--p1ai/awards/
xn--p1ai/awards/
сша, массачусетский технологический институт, гарвардский университет, здоровье, рак, биология, генетика
МОСКВА, 28 янв — РИА Новости. Американские генетики обнаружили несколько сотен неизвестных ранее генов в наименее изученных частях генома человека. Оказалось, что более 50 из них продуцируют белки, которые участвуют в развитии раковых клеток. Результаты исследования опубликованы в журнале Nature Biotechnology.На данный момент в геноме человека идентифицировано около 20 тысяч генов. Ранние анализы последовательности генома человека предполагали существование более ста тысяч генов, кодирующих белки, но дальнейшие исследования показали, что большинство этих генов-кандидатов, скорее всего, продуцируют некодирующие РНК, фрагментированные комплементарные клоны ДНК и РНК, экспрессируемые на несущественных уровнях.
Текущая база данных проекта протеома человека NeXtProt содержит примерно 17 600 белок-кодирующих генов, подтвержденных масс-спектрометрией, и около 2100 неподтвержденных белок-кодирующих генов.
Тем не менее, появляется все больше доказательств того, что в генах, которые в настоящее время аннотируются как некодирующие РНК или псевдогены, а также находящихся в некоторых нетранслируемых областях, имеет место трансляция — процесс синтеза белка из аминокислот на матрице информационной (матричной) РНК, осуществляемый специальной клеточной органеллой рибосомой. Однако до сих пор отсутствовали систематические экспериментальные подтверждения того, являются ли возникающие при такой трансляции белки биологически функциональными.
21 января, 22:00НаукаБиологи научились следить за раковыми клетками в режиме реального времениИсследователи из Института Броуда Гарвардского университета и Массачусетского технологического института — крупнейшего центра геномики и реализации проекта «Геном человека» — экспериментально проверили 553 гена-кандидата, в качестве которых авторы рассматривали открытые рамки считывания (Open Reading Frame, ORF) — последовательности нуклеотидов в составе длинных некодирующих РНК.
Гены-кандидаты отбирали на основе опубликованных данных, предсказывающих ORF, потенциально способные кодировать биологически активные белки. При этом из анализа исключили псевдогены и ORF, представляющие собой варианты уже известных белок-кодирующих областей.
В экспериментах по эктопической экспрессии — экспрессия генов в необычном месте организма — 257 ORF показали признаки экспрессии белка и 401 индуцировали изменения экспрессии генов. Из них 57 способствовали жизнеспособности раковых клеток человека.
В частности, исследователи установили, что один из этих ORF — G029442 — кодирует богатый глицином внеклеточный белок-1 (GREP1), обладающий повышенным содержанием онкогенного цитокина GDF15 и высоко экспрессируемый при раке молочной железы. Блокирование его с помощью специального ингибитора смягчало эффект развития раковых клеток в 263 линиях.
Авторы считают, что биологически активные белки, экспрессируемые неканоническими ORF, могут стать потенциальными мишенями для разработки новых методов лечения рака.
Ученые сообщили о новом успехе в расшифровке полного генома человека
https://ria.ru/20200729/1575126574.html
Ученые сообщили о новом успехе в расшифровке полного генома человека
Ученые сообщили о новом успехе в расшифровке полного генома человека — РИА Новости, 29.07.2020
Ученые сообщили о новом успехе в расшифровке полного генома человека
Международный консорциум ENCODE, состоящий из 500 ученых-биологов из многих стран мира сообщил о завершении третьего этапа глобального проекта по составлению… РИА Новости, 29.07.2020
2020-07-29T18:12
2020-07-29T18:12
2020-07-29T19:32
наука
открытия — риа наука
здоровье
биология
геном
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/07e4/07/1d/1575122181_0:0:1920:1080_1920x0_80_0_0_c09c7518bc67a63c3f0312916aab08a7./genetic-individuality--male-body-with-dna-548001023-59f9d183af5d3a0010859452.jpg) jpg
jpg
МОСКВА, 29 июл — РИА Новости. Международный консорциум ENCODE, состоящий из 500 ученых-биологов из многих стран мира сообщил о завершении третьего этапа глобального проекта по составлению энциклопедии функциональных элементов ДНК. В 14 статьях, опубликованных в журналах Nature, Nature Methods и Nature Communications, авторы подводят итоги 17-летней работы.Геном человека содержит около 20 тысяч генов, кодирующих белки, на долю которых приходится всего около 1,5 процентов ДНК генома человека.Международный исследовательский консорциум ENCODE, созданный в 2003 году и задуманный как продолжение проекта «Геном человека», ставит целью составление всеобъемлющего каталога функциональных элементов генома человека и мыши, включая кодирующие белки гены, некодирующие гены и регуляторные элементы. Все результаты, получаемые в ходе реализации проекта, публикуются в открытых базах данных. Тысячи исследователей во всем мире уже воспользовались данными ENCODE для определения генетических изменений, влияющих на появление таких болезней, как рак, сердечно-сосудистые заболевания и многие другие. «Когда был завершен первый набросок генома человека, сразу стало ясно, что первичная последовательность генома — это черновик, — приводятся в пресс-релизе Лаборатории в Колд-Спринг-Харбор слова одного из участников консорциума, профессора лаборатории Томаса Джингераса (Thomas Gingeras). — Мы знали, где находятся гены, но знаний о том, где расположены регуляторные механизмы и локусы, было недостаточно».В ходе третьей фазы проекта исследователи провели почти шесть тысяч новых экспериментов — 4834 с участием человеческих образцов и 1158 — на мышах — и добавили в онлайн-реестр более 1 200 000 функциональных элементов — областей некодирующей ДНК, которые регулируют транскрипцию генов, охватывающих 7,9 процента человеческого генома и 3,4 процента генома мыши.Часть исследований посвящена изучению принципов, регулирующих работу некоторых из этих функциональных элементов. Например, Майкл Снайдер (Michael Snyder) из Медицинской школы Стенфордского университета в США и его коллеги исследовали взаимодействие хроматина — комплекса ДНК и белков — в 24 типах клеток человека и обнаружили, что различия в цикличности хроматина между типами клеток могут влиять на экспрессию генов.
«Когда был завершен первый набросок генома человека, сразу стало ясно, что первичная последовательность генома — это черновик, — приводятся в пресс-релизе Лаборатории в Колд-Спринг-Харбор слова одного из участников консорциума, профессора лаборатории Томаса Джингераса (Thomas Gingeras). — Мы знали, где находятся гены, но знаний о том, где расположены регуляторные механизмы и локусы, было недостаточно».В ходе третьей фазы проекта исследователи провели почти шесть тысяч новых экспериментов — 4834 с участием человеческих образцов и 1158 — на мышах — и добавили в онлайн-реестр более 1 200 000 функциональных элементов — областей некодирующей ДНК, которые регулируют транскрипцию генов, охватывающих 7,9 процента человеческого генома и 3,4 процента генома мыши.Часть исследований посвящена изучению принципов, регулирующих работу некоторых из этих функциональных элементов. Например, Майкл Снайдер (Michael Snyder) из Медицинской школы Стенфордского университета в США и его коллеги исследовали взаимодействие хроматина — комплекса ДНК и белков — в 24 типах клеток человека и обнаружили, что различия в цикличности хроматина между типами клеток могут влиять на экспрессию генов. Команда Томаса Джингераса изучила элементы генома, которые инструктируют клетки о том, как и когда транскрибировать последовательности ДНК в РНК. Ученым удалось идентифицировать и описать молекулярные признаки пяти групп клеток человека.»Наша работа определяет, основываясь на экспрессии генов, основные гистологические типы, по которым традиционно классифицируются ткани человека», — говорит Родерик Гиго (Roderic Guigó) из Центра геномного регулирования, один из авторов исследования.Участники консорциума отмечают, что элементы, управляющие функционированием генов, целиком кодируются в геноме человека и знания об их организации могут послужить отправной точкой для изучения нарушений развития человека. Однако, несмотря на очевидный прогресс, многие элементы, которые влияют на конкретные типы или состояния генов, еще предстоит идентифицировать.»Эта энциклопедия является живым ресурсом. У нее есть начало, но на самом деле нет конца. Со временем она будет только совершенствоваться и расти», — пишут во вступительной статье авторы.
Команда Томаса Джингераса изучила элементы генома, которые инструктируют клетки о том, как и когда транскрибировать последовательности ДНК в РНК. Ученым удалось идентифицировать и описать молекулярные признаки пяти групп клеток человека.»Наша работа определяет, основываясь на экспрессии генов, основные гистологические типы, по которым традиционно классифицируются ткани человека», — говорит Родерик Гиго (Roderic Guigó) из Центра геномного регулирования, один из авторов исследования.Участники консорциума отмечают, что элементы, управляющие функционированием генов, целиком кодируются в геноме человека и знания об их организации могут послужить отправной точкой для изучения нарушений развития человека. Однако, несмотря на очевидный прогресс, многие элементы, которые влияют на конкретные типы или состояния генов, еще предстоит идентифицировать.»Эта энциклопедия является живым ресурсом. У нее есть начало, но на самом деле нет конца. Со временем она будет только совершенствоваться и расти», — пишут во вступительной статье авторы. На четвертом этапе исследования участники проекта ENCODE планируют сосредоточить усилия на новых типах анализируемых клеток и тканей.
На четвертом этапе исследования участники проекта ENCODE планируют сосредоточить усилия на новых типах анализируемых клеток и тканей.
https://ria.ru/20200714/1574331963.html
https://ria.ru/20200319/1568838103.html
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2020
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdnn21.img.ria.ru/images/07e4/07/1d/1575122181_238:0:1678:1080_1920x0_80_0_0_b1197b2345cad8e15168ec4a60bfc499.jpgРИА Новости
internet-group@rian. ru
ru
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
открытия — риа наука, здоровье, биология, геном
МОСКВА, 29 июл — РИА Новости. Международный консорциум ENCODE, состоящий из 500 ученых-биологов из многих стран мира сообщил о завершении третьего этапа глобального проекта по составлению энциклопедии функциональных элементов ДНК. В 14 статьях, опубликованных в журналах Nature, Nature Methods и Nature Communications, авторы подводят итоги 17-летней работы.Геном человека содержит около 20 тысяч генов, кодирующих белки, на долю которых приходится всего около 1,5 процентов ДНК генома человека.
Международный исследовательский консорциум ENCODE, созданный в 2003 году и задуманный как продолжение проекта «Геном человека», ставит целью составление всеобъемлющего каталога функциональных элементов генома человека и мыши, включая кодирующие белки гены, некодирующие гены и регуляторные элементы.
Все результаты, получаемые в ходе реализации проекта, публикуются в открытых базах данных. Тысячи исследователей во всем мире уже воспользовались данными ENCODE для определения генетических изменений, влияющих на появление таких болезней, как рак, сердечно-сосудистые заболевания и многие другие.
«Когда был завершен первый набросок генома человека, сразу стало ясно, что первичная последовательность генома — это черновик, — приводятся в пресс-релизе Лаборатории в Колд-Спринг-Харбор слова одного из участников консорциума, профессора лаборатории Томаса Джингераса (Thomas Gingeras). — Мы знали, где находятся гены, но знаний о том, где расположены регуляторные механизмы и локусы, было недостаточно».
14 июля 2020, 18:00НаукаГенетики расшифровали полную последовательность Х-хромосомы человекаВ ходе третьей фазы проекта исследователи провели почти шесть тысяч новых экспериментов — 4834 с участием человеческих образцов и 1158 — на мышах — и добавили в онлайн-реестр более 1 200 000 функциональных элементов — областей некодирующей ДНК, которые регулируют транскрипцию генов, охватывающих 7,9 процента человеческого генома и 3,4 процента генома мыши.
Часть исследований посвящена изучению принципов, регулирующих работу некоторых из этих функциональных элементов.
Например, Майкл Снайдер (Michael Snyder) из Медицинской школы Стенфордского университета в США и его коллеги исследовали взаимодействие хроматина — комплекса ДНК и белков — в 24 типах клеток человека и обнаружили, что различия в цикличности хроматина между типами клеток могут влиять на экспрессию генов.Команда Томаса Джингераса изучила элементы генома, которые инструктируют клетки о том, как и когда транскрибировать последовательности ДНК в РНК. Ученым удалось идентифицировать и описать молекулярные признаки пяти групп клеток человека.
«Наша работа определяет, основываясь на экспрессии генов, основные гистологические типы, по которым традиционно классифицируются ткани человека», — говорит Родерик Гиго (Roderic Guigó) из Центра геномного регулирования, один из авторов исследования.
Участники консорциума отмечают, что элементы, управляющие функционированием генов, целиком кодируются в геноме человека и знания об их организации могут послужить отправной точкой для изучения нарушений развития человека. Однако, несмотря на очевидный прогресс, многие элементы, которые влияют на конкретные типы или состояния генов, еще предстоит идентифицировать.
Однако, несмотря на очевидный прогресс, многие элементы, которые влияют на конкретные типы или состояния генов, еще предстоит идентифицировать.
«Эта энциклопедия является живым ресурсом. У нее есть начало, но на самом деле нет конца. Со временем она будет только совершенствоваться и расти», — пишут во вступительной статье авторы.
На четвертом этапе исследования участники проекта ENCODE планируют сосредоточить усилия на новых типах анализируемых клеток и тканей.
19 марта 2020, 13:30Распространение коронавирусаРоссийские ученые расшифровали полный геном коронавирусаУченые приблизились к разгадке тайны жизни — Российская газета
Участникам международного проекта FANTON удалось построить карту регуляторных ДНК в геноме человека. Это сообщение сразу стало почти такой же мировой сенсацией, как расшифровка в свое время генома человека. Тогда казалось, что теперь-то с генами все ясно, и ученые могут довольно легко ими манипулировать по своему желанию. Однако эйфория быстро прошла. Последовательность букв в геноме не объясняла, как он функционирует, то есть геном оставался по-прежнему зашифрованным. С тем же успехом можно иметь набор всех букв, которыми написан роман «Война и мир», но не уметь читать сам роман.
Последовательность букв в геноме не объясняла, как он функционирует, то есть геном оставался по-прежнему зашифрованным. С тем же успехом можно иметь набор всех букв, которыми написан роман «Война и мир», но не уметь читать сам роман.
А разве не странно, что все клетки организма имеют одинаковую ДНК, в которой содержится информация о кодировании определенных белков, но при этом клетки сердца, почек, легких, печени и других органов разные. Получается, что в разных клетках гены работают по-разному. Да что там клетки. Скажем, у человека и мыши примерно одинаковый набор генов, но где мышь, а где человек. Как же из одного «конструктора» природа создает такие разные творения?
— Ученые давно поняли, что есть какие-то регуляторы, которые включают, выключают, переключают, то есть регулируют активность генов в течение всей жизни клетки, — говорит кандидат биологических наук из Института общей генетики Светлана Боринская. — Такая регулировка зависит, в частности, от специфики клетки и условий внешней среды. Но найти этих «командиров» оказалось крайне сложной задачей. Так вот сейчас она решена. Конечно, это прорыв. Если сравнивать наш геном с заводом, то раньше мы изучали только рабочих на станках, смотрели, что они делают, а теперь впервые удалось обнаружить командиров производства, менеджеров, которые управляют рабочими.
Но найти этих «командиров» оказалось крайне сложной задачей. Так вот сейчас она решена. Конечно, это прорыв. Если сравнивать наш геном с заводом, то раньше мы изучали только рабочих на станках, смотрели, что они делают, а теперь впервые удалось обнаружить командиров производства, менеджеров, которые управляют рабочими.
Всего открыто около 220 тысяч таких «командиров». Проект FANTOM начался в 2000 году, в него вошли свыше 250 специалистов из 114 научных центров более чем в 20 странах, в том числе и российские специалисты из Института общей генетики РАН. Необходимо подчеркнуть, что речь идет именно о карте, то есть регуляторные последовательности в данном случае соотносятся с генами, которыми они управляют. Ученые подчеркивают, что проект изучает здоровые клетки, а не генетически измененные. В дальнейшем эти же методы позволят изучить генную активность и в патологических клетках пациентов с самыми разными заболеваниями, чтобы понять причины поломки на молекулярном уровне. Вообще перспективы этого открытия столь масштабны, что ученые уже говорят о революции в медицине и многих отраслях биологии.
Вообще перспективы этого открытия столь масштабны, что ученые уже говорят о революции в медицине и многих отраслях биологии.
Практически одновременно появилось сообщение о другой сенсации. Ученые впервые создали искусственную хромосому в клетках дрожжей. По сути речь идет о программировании ДНК, которое тоже может стать прорывом в науке. Например, поможет исправлять «слабые места» в геноме человека, программировать и создавать лекарства, топливо, сырье для продуктов питания и т.д. Словом, перспективы самые заманчивые. Неудивительно, что ученые давно пытаются создать искусственные хромосомы. Несколько лет назад это удалось российскому генетику Евгению Ананьеву, который сейчас работает в США. Он впервые в мире синтезировал хромосому кукурузы. И вот теперь аналогичную работу, но уже на живом организме выполнил Джеф Бок из Университета Нью-Йорка.
— Как вообще создается искусственная хромосома? Повторить природу, разработать полный аналог естественной хромосомы наука пока не умеет. Поэтому общий принцип такой. В хромосоме надо ставить минимум нуклеотидов, которые, тем не менее, обеспечивают жизнеспособность клетки, — объясняет кандидат биологических наук из Института общей генетики РАН Татьяна Гришаева. — Для этого из нее удаляется все «лишнее», например, гены, которые не участвуют при воспроизводстве хромосом и росте дрожжей, а также так называемую «мусорную» ДНК, которая не производит каких-либо конкретных белков. Отрезают и «прыгающие» гены, способные вызвать неконтролируемые мутации.
Поэтому общий принцип такой. В хромосоме надо ставить минимум нуклеотидов, которые, тем не менее, обеспечивают жизнеспособность клетки, — объясняет кандидат биологических наук из Института общей генетики РАН Татьяна Гришаева. — Для этого из нее удаляется все «лишнее», например, гены, которые не участвуют при воспроизводстве хромосом и росте дрожжей, а также так называемую «мусорную» ДНК, которая не производит каких-либо конкретных белков. Отрезают и «прыгающие» гены, способные вызвать неконтролируемые мутации.
Полученную после такого отсечения конструкцию Джеф Бок внедрил в клетку дрожжей, где она работала вместе с ее остальными хромосомами. Несмотря на столь масштабный секвестр, модифицированные дрожжи вполне нормально живут и размножаются, повышая возможности живого организма. А ведь сбой даже в одном гене может привести к патологическим изменениям и смерти клетки.
Этот проект также был международным, в нем участвовали ученые более чем 10 стран. Им понадобилось семь лет мозгового штурма, чтобы создать искусственную хромосому. Потенциал программирования ДНК огромен. Ведь даже в самом совершенном организме есть различные «поломки», которые можно исправить с помощью генной инженерии.
Потенциал программирования ДНК огромен. Ведь даже в самом совершенном организме есть различные «поломки», которые можно исправить с помощью генной инженерии.
ВПЕРВЫЕ ОГРОМНЫЙ ГЕНЕТИЧЕСКИЙ «ЧЕРТЕЖ» МНОГОКЛЕТОЧНОГО СУЩЕСТВА ПРОЧИТАН ПОЛНОСТЬЮ. НА ОЧЕРЕДИ — РАСШИФРОВКА ГЕНОМА ЧЕЛОВЕКА
Достижение века: после восьми лет работы многих исследовательских групп удалось точно определить 97 миллионов пар нуклеотидов и их местонахождение в спирали ДНК, хранящей полную наследственную информацию микроскопического червячка Сaenorhabditis elegans.Так выглядит при сильном увеличении героиня грандиозного эксперимента — нематода С. elegans. Ее истинная величина — 1мм.
Просматриваются фрагменты расшифровки строения генома.
Сотрудники Сенгеровского центра в Кембридже, принимавшие участие в расшифровке генома C. elegans.
На рисунке показано строение C. elegans: 1 — так называемый желудочек, 2 — тонкий отдел кишечника, 3 — яичник, 4 — яйца.
Машины, применявшиеся для секвенирования генома С. elegans.
‹
›
С самых древних времен люди задумывались над вопросом о том, как особенности живых организмов передаются их потомкам. Разрабатывались самые разные теории, иногда очень остроумные и не противоречащие многим фактам, но по-настоящему материальные основы наследственности начали проясняться лишь 45 лет назад, когда Дж. Уотсон и Ф. Крик расшифровали строение ДНК. Оказалось, что в этой скрученной двойным жгутом гигантской молекуле записаны все признаки организма.
Каждая прядь молекулы ДНК представляет собой
цепочку из четырех типов звеньев — нуклеотидов,
повторяющихся в разном порядке. Нуклеотиды
обычно считают парами, как сапоги или перчатки,
потому что в молекуле ДНК две цепочки и их
нуклеотиды соединены поперечными связями
попарно. Четыре сорта нуклеотидов, четыре
«буквы» позволяют записать генетический
«текст», который прочитывается механизмом
синтеза белка в живой клетке. Группа из трех
стоящих подряд нуклеотидов, действуя через
довольно сложный передаточный механизм,
заставляет рибосому — внутриклеточную частичку,
занимающуюся синтезом белков, — подхватывать из
цитоплазмы определенную аминокислоту, следующие
три нуклеотида через посредников «диктуют»
рибосоме, какую аминокислоту ставить в цепочку
белка на следующее место, и так постепенно
получается молекула белка. А белки — не только
основной строительный материал живого
организма: многие из них — ферменты — управляют
процессами в клетке. Так что информации,
записанной в ДНК тройками пар нуклеотидов,
достаточно для построения нового организма со
всеми его особенностями.
Группа из трех
стоящих подряд нуклеотидов, действуя через
довольно сложный передаточный механизм,
заставляет рибосому — внутриклеточную частичку,
занимающуюся синтезом белков, — подхватывать из
цитоплазмы определенную аминокислоту, следующие
три нуклеотида через посредников «диктуют»
рибосоме, какую аминокислоту ставить в цепочку
белка на следующее место, и так постепенно
получается молекула белка. А белки — не только
основной строительный материал живого
организма: многие из них — ферменты — управляют
процессами в клетке. Так что информации,
записанной в ДНК тройками пар нуклеотидов,
достаточно для построения нового организма со
всеми его особенностями.
Еще задолго до открытия всех этих (и многих
других) молекулярных тонкостей, изучая передачу
наследственных признаков при скрещивании,
биологи поняли, что каждый признак определяется
отдельной частицей, которую назвали геном.
Удалось понять, что гены лежат в ядре клетки, в
хромосомах. А после открытия роли ДНК и механизма
синтеза белков стало ясно, что ген — это участок
цепочки ДНК, на котором записано строение
молекулы определенного белка. В некоторых генах
всего 800 пар нуклеотидов, в
других — около миллиона. У человека около 80-90
тысяч генов. Набор генов, присущий организму,
называется его геномом.
А после открытия роли ДНК и механизма
синтеза белков стало ясно, что ген — это участок
цепочки ДНК, на котором записано строение
молекулы определенного белка. В некоторых генах
всего 800 пар нуклеотидов, в
других — около миллиона. У человека около 80-90
тысяч генов. Набор генов, присущий организму,
называется его геномом.
В последние годы зародилась новая отрасль
генетики — геномика, изучающая не отдельные гены,
а целые геномы. Достижения молекулярной биологии
и генной инженерии дали человеку возможность
читать генетические тексты — сначала вирусов,
бактерий, дрожжевых грибков. А сейчас впервые
удалось полностью прочитать геном
многоклеточного животного — обитающего в почве
микроскопического червячка длиной около
миллиметра. В лабораториях мира полным ходом
идет расшифровка генома человека. Эта
международная программа была начата в 1989 году,
тогда же благодаря инициативе и энергии
выдающегося биолога, ныне покойного академика А. А. Баева, к программе подключилась и Россия. В
феврале этого года в Черноголовке под Москвой
прошла конференция «Геном человека-99»,
посвященная десятилетию начала этих работ и
памяти их инициатора, руководившего российской
частью программы первые пять лет. Сейчас в разных
странах мира, в лабораториях,
разделивших между собой «фронт работ» (всего
надо прочитать около трех миллиардов пар
нуклеотидов), ежедневно расшифровывается более
миллиона нуклеотидных пар, причем темп работ все
ускоряется.
А. Баева, к программе подключилась и Россия. В
феврале этого года в Черноголовке под Москвой
прошла конференция «Геном человека-99»,
посвященная десятилетию начала этих работ и
памяти их инициатора, руководившего российской
частью программы первые пять лет. Сейчас в разных
странах мира, в лабораториях,
разделивших между собой «фронт работ» (всего
надо прочитать около трех миллиардов пар
нуклеотидов), ежедневно расшифровывается более
миллиона нуклеотидных пар, причем темп работ все
ускоряется.
Об успехах и перспективах геномики рассказывает публикуемая статья.
Как это было
Биология, по всеобщему признанию, заняла
доминирующее положение среди естественных наук
во второй половине уходящего века. В конце 1998
года эта точка зрения получила новое мощное
подтверждение: завершена восьмилет няя работа по
расшифровке строения генома (совокупности генов
и межгенных участков) многоклеточного животного,
круглого червя, нематоды, имеющего латинское
название Caenorhabditis elegans.
Хотя это очень маленький червь, скорее червячок, с него без всякого преувеличения начинается новая эра в биологии. Геном этой нематоды состоит из 97 миллионов пар нуклеотидов ДНК, округленно 0,1 миллиарда пар. Геном человека, согласно большинству оценок, — 3 миллиарда нуклеотидных пар. Разница в 30 раз. Однако именно эта работа, о которой идет речь, окончательно убедила даже самых закоренелых скептиков, что расшифровка строения всего генома человека не только возможна, но и достижима в ближайшие годы.
Расшифровка, или, как говорят биологи,
секвенирование, генома C. elegans была осуществлена
по совместному проекту двумя исследовательскими
группами: из Центра геномного секвенирования
Вашингтонского университета (США) и
Сенгеровского центра (Кембридж, Англия). В
журнале «Science» от 11 декабря 1998 года
опубликована серия статей, подробно
рассказывающая об этой поистине грандиозной
работе. Число авторов этой работы столь велико,
что журнал не опубликовал списка, отослав
читателей к Internet, а авторов назвал просто
«Консорциум секвенаторов C. elegans». Это,
вероятно, первый случай в истории науки, когда
открытие с самого начала и с согласия авторов как
бы становится анонимным. Эту работу можно с
полным правом считать знаковой, символизирующей
«индустриальную» науку. Зримый символ
современной науки, где огромные финансовые
вложения, роботизация, автоматизация,
менеджмент, дисциплина, координация играли
определяющую роль, оттеснив на этом этапе роль
интеллекта и творческой изобретательности
отдельных участников проекта.
Число авторов этой работы столь велико,
что журнал не опубликовал списка, отослав
читателей к Internet, а авторов назвал просто
«Консорциум секвенаторов C. elegans». Это,
вероятно, первый случай в истории науки, когда
открытие с самого начала и с согласия авторов как
бы становится анонимным. Эту работу можно с
полным правом считать знаковой, символизирующей
«индустриальную» науку. Зримый символ
современной науки, где огромные финансовые
вложения, роботизация, автоматизация,
менеджмент, дисциплина, координация играли
определяющую роль, оттеснив на этом этапе роль
интеллекта и творческой изобретательности
отдельных участников проекта.
Будет справедливым напомнить о том, кто первым
обратил внимание на C. elegans как на объект
исследования. В середине 1960-х годов Сидней
Бреннер, выдающийся молекулярный генетик,
внесший огромный вклад в изучение генетического
кода, работал в знаменитой лаборатории
молекулярной биологии в Кембридже в Англии (в ней
трудились нобелевские лауреаты Ф. Крик, Дж.
Кендрю, М. Перутц, А. Клуг и другие знаменитые
исследователи). После работы над кодом С. Бреннер
решил посвятить себя изучению нервной системы и
путей ее возникновения и формирования. Он
обратил внимание на малюсенького червя (C. elegans),
состоящего всего из 959 клеток, из которых 302
нейроны, нервные клетки. Замечательным свойством
нематоды была ее прозрачность: можно следить за
поведением и судьбой каждой отдельной клетки!
Сидней Бреннер привлек в свою «нематодную»
лабораторию талантливых молодых исследователей,
сделавших немало важных открытий. Многие из них
стали «мотором» проекта секвенирования,
который был реализован в Сенгеровском центре.
Крик, Дж.
Кендрю, М. Перутц, А. Клуг и другие знаменитые
исследователи). После работы над кодом С. Бреннер
решил посвятить себя изучению нервной системы и
путей ее возникновения и формирования. Он
обратил внимание на малюсенького червя (C. elegans),
состоящего всего из 959 клеток, из которых 302
нейроны, нервные клетки. Замечательным свойством
нематоды была ее прозрачность: можно следить за
поведением и судьбой каждой отдельной клетки!
Сидней Бреннер привлек в свою «нематодную»
лабораторию талантливых молодых исследователей,
сделавших немало важных открытий. Многие из них
стали «мотором» проекта секвенирования,
который был реализован в Сенгеровском центре.
Естественно, расшифровать геном таких
гигантских размеров, как у названной нематоды
(напомню: 97 миллионов пар нуклеотидов ДНК),
невозможно без огромной подготовительной
работы. Ее в основном завершили к 1989 году. Прежде
всего была построена физическая карта всего
генома нематоды. Физическая карта представляет
собой небольшие участки ДНК известной структуры
(маркеры), расположенные на определенных
расстояниях один от другого.
Физическая карта представляет
собой небольшие участки ДНК известной структуры
(маркеры), расположенные на определенных
расстояниях один от другого.
И вот с 1990 года началось само секвенирование. Его темп составлял в 1992 году 1 миллион пар нуклеотидов в год. Если бы такой темп сохранился, на расшифровку всего генома понадобилось бы почти 100 лет! Ускорить работы удалось простейшим способом — число исследователей в каждом центре возросло примерно до 100. Люди и аппараты работали круглосуточно, производительность каждой машины была увеличена за счет большего числа дорожек, на которых секвенировали фрагменты ДНК.
По мере того, как раскрывалась нуклеотидная
последовательность ДНК C. elegans, пришлось
расстаться с двумя заблуждениями. Во-первых,
оказалось, что генов у нее не 15 тысяч, как
предполагали вначале, а 19099. Во-вторых, надежда на
то, что гены сосредоточены в середине хромосом, а
к концам сильно редеют, оправдалась лишь отчасти,
гены распределены вдоль хромосом относительно
равномерно, хотя в центральной части их все-таки
больше.
Если у дрожжей функция половины генов в геноме неизвестна (так называемые молчащие гены), то у червя эта доля еще больше: из 19 тысяч генов 12 тысяч остаются пока загадочными.
Два исследовательских центра, решившие гигантскую по сложности задачу, приобрели уникальный опыт — и в ходе получения самих результатов, и в ходе их осмысления, хранения и переработки. Поэтому неудивительно, что обе группы недавно заявили, что они готовы раскрыть структуру половины генома человека, то есть выполнить работу в 15 раз большую по объему, чем то, что было сделано на геноме червя. И это реально. Приведу такие цифры. Сейчас во всем мире в день расшифровывается более 1 миллиона пар нуклеотидов — столько, сколько за весь 1992 год. Скорость возросла в 365 раз!
Значение секвенирования генома нематоды,
конечно, выходит далеко за рамки того, что можно
назвать полигоном для расшифровки генома
человека. C. elegans — первый многоклеточный организм,
геном которого раскрыт практически полностью.
Можно напомнить: два года назад был расшифрован
первый геном эукариотического организма -
дрожжей, то есть организма, клетки которого
содержат оформленные ядра. (К эукариотам
относятся все высшие животные и растения, а также
одноклеточные и многоклеточные водоросли, грибы
и простейшие. Дрожжи, согласно биологической
систематике, относятся к одноклеточным грибам.)
Иначе говоря, за два года был пройден путь от
генома одноклеточного до генома многоклеточного
организма. Биологи знают, это гигантская
дистанция на лестнице эволюции и, следовательно,
на пути усложнения геномов. Поразительно, как невероятно быстро пройден этот
путь!
C. elegans — первый многоклеточный организм,
геном которого раскрыт практически полностью.
Можно напомнить: два года назад был расшифрован
первый геном эукариотического организма -
дрожжей, то есть организма, клетки которого
содержат оформленные ядра. (К эукариотам
относятся все высшие животные и растения, а также
одноклеточные и многоклеточные водоросли, грибы
и простейшие. Дрожжи, согласно биологической
систематике, относятся к одноклеточным грибам.)
Иначе говоря, за два года был пройден путь от
генома одноклеточного до генома многоклеточного
организма. Биологи знают, это гигантская
дистанция на лестнице эволюции и, следовательно,
на пути усложнения геномов. Поразительно, как невероятно быстро пройден этот
путь!
Сравнивая теперь геномы бактерий (известно уже
более 20 геномов) с геномами дрожжей и нематоды,
биологи-эволюционисты имеют уникальную
возможность сравнивать не отдельные гены и даже
не генные ансамбли, а целиком геномы — такой
возможности в биологии еще десять лет назад
просто не существовало, об этом только мечтали. В
ближайшие месяцы, когда полученные огромные
объемы информации начнут осваивать и
осмысливать, следует ждать появления
принципиально новых концепций в теории биологической эволюции.
В
ближайшие месяцы, когда полученные огромные
объемы информации начнут осваивать и
осмысливать, следует ждать появления
принципиально новых концепций в теории биологической эволюции.
Новые данные и перспективы биологии
Каковы же ближайшие перспективы, открывающиеся
сейчас в биологии? Вот самые очевидные. У
человека только в пять раз больше генов, чем у
нематоды. Следовательно, по крайней мере около 20%
генома человека должно иметь родственников
среди известных теперь генов C. elegans. Это в
громадной степени облегчает поиск новых генов
человека. Функции еще не известных генов
нематоды изучать несравненно легче, чем
аналогичные гены у человека. Гены червя можно
легко изменить (мутировать), одновременно следя
за изменениями структуры гена и свойств
организма. Таким путем можно выявлять
биологическую роль генных продуктов (то есть
белков) у червя, а затем экстраполировать эти
данные на другие организмы, в первую очередь на
человека. А можно угнетать активность генов
(например, с помощью особых молекул
специфических РНК) и следить, как меняется
поведение организма. Этот путь тоже раскрывает
функции неизвестных генов и, разумеется,
сильнейшим образом повлияет на изучение генома
человека и других высших организмов.
А можно угнетать активность генов
(например, с помощью особых молекул
специфических РНК) и следить, как меняется
поведение организма. Этот путь тоже раскрывает
функции неизвестных генов и, разумеется,
сильнейшим образом повлияет на изучение генома
человека и других высших организмов.
Биологов всегда интригует вопрос: как регулируется работа генов? Хотя мы знаем об этом очень много, наши знания получены в основном на отдельных генах, а потому не дают цельной картины регуляции работы всего генома как единого целого. Сейчас бурно развивается техника так называемых биочипов (по аналогии с микрочипами в кибернетике). Это маленькие пластинки, на которые с помощью прецизионных приборов в тысячи точек, на строго фиксированных расстояниях одна от другой, наносят микроскопические количества фрагментов ДНК.
Такой микрочип может, например, содержать все
19000 генов нематоды — по одному гену в каждой точке,
и его можно использовать для того, чтобы
определить, какие гены работают в данной клетке
червя, а какие молчат. Разумеется, здесь возможно
использовать клетки на любой стадии развития и
из любой части тела червя. В результате
исследователь получит информацию о
функциональном состоянии всех генов любой
клетки на любой стадии развития червя. Опыты уже
начаты, есть все основания не сомневаться, что
еще в текущем году мы узнаем о первых
результатах. Это будет действительно
революционным прорывом для биологии развития.
Помимо совершенной микротехники эти опыты
требуют и совершенных компьютерных программ,
чтобы полученные фактические данные можно было
осмыслить и интерпретировать.
Разумеется, здесь возможно
использовать клетки на любой стадии развития и
из любой части тела червя. В результате
исследователь получит информацию о
функциональном состоянии всех генов любой
клетки на любой стадии развития червя. Опыты уже
начаты, есть все основания не сомневаться, что
еще в текущем году мы узнаем о первых
результатах. Это будет действительно
революционным прорывом для биологии развития.
Помимо совершенной микротехники эти опыты
требуют и совершенных компьютерных программ,
чтобы полученные фактические данные можно было
осмыслить и интерпретировать.
Методика биочипов открывает новую стратегию в
решении одной из сложнейших в биологии проблем -
проблемы взаимосвязи сигнальных регуляторных
путей. Основная трудность заключается в том, что
взаимодействие белковых продуктов многих генов
происходит одновременно, причем комбинации
белков меняются не только во времени, но и в
клеточном пространстве. В результате изучение
отдельных генов и их продуктов (что в основном
делалось до сих пор) нередко было неэффективным.
В результате изучение
отдельных генов и их продуктов (что в основном
делалось до сих пор) нередко было неэффективным.
Каково соотношение областей в геноме C. elegans, кодирующих синтез белков (экзоны) и не кодирующих (интроны)? Компьютерный анализ показывает, что экзоны и интроны занимают в геноме нематоды примерно равные доли (27 и 26%), остальное (47%) приходится на повторы, на межгенные участки и т. д., то есть на ДНК с неизвестными науке функциями.
Если сравнить по этим данным дрожжевой геном и
геном человека, то станет очевидным, что в ходе
эволюции доля кодирующих участков в расчете на
весь геном резко уменьшается: у дрожжей она очень
высока, а у человека очень мала. Об этом знали
сравнительно давно, но сейчас названные
соотношения приобрели не только количественную
меру, но и структурную основу. Мы приходим, на
первый взгляд, к достаточно парадоксальному
выводу. Эволюция у эукариот от низших форм к
высшим сопряжена с «разбавлением» генома -
на единицу длины ДНК приходится все меньше
информации о структуре белков и РНК и все больше
информации «ни о чем», то есть для нас
непонятной, непрочитанной.
Это одна из больших загадок биологической эволюции. По поводу «лишней» ДНК существуют самые разные предположения, зачастую прямо противоположные по смыслу. Много лет назад Ф. Крик, один из отцов двойной спирали ДНК, назвал эту «лишнюю» ДНК «эгоистической», или «мусорной». Он считал ее издержкой эволюции, накапливающейся в геноме в результате неполного совершенства генетических процессов, «балластом», платой за совершенство остальной части генома. Возможно, что некоторая небольшая «эгоистическая» доля в ДНК человека и других высших организмов действительно относится к такому типу. Однако теперь стало ясно, что основная доля «эгоистической» ДНК сохраняется в эволюции и даже увеличивается, потому что она дает ее обладателям эволюционные преимущества.
Классическим примером «эгоистической» ДНК
служат так называемые короткие повторы участков
ДНК (Alu-элементы, альфа-сателлитные ДНК и другие). Как выяснилось в последние годы, их структура
абсолютно консервативна, то есть мутации,
нарушающие «правила», установленные
природой для этих элементов, не сохраняются, они
«отбрасываются» отбором. Структурное
постоянство — мощный аргумент в пользу идеи о том,
что такие участки являются отнюдь не
«эгоистическими», а это очень важная часть
ДНК для жизни вида. Другое дело, что мы еще не
знаем, в чем конкретно состоит ее биологическая
роль.
Как выяснилось в последние годы, их структура
абсолютно консервативна, то есть мутации,
нарушающие «правила», установленные
природой для этих элементов, не сохраняются, они
«отбрасываются» отбором. Структурное
постоянство — мощный аргумент в пользу идеи о том,
что такие участки являются отнюдь не
«эгоистическими», а это очень важная часть
ДНК для жизни вида. Другое дело, что мы еще не
знаем, в чем конкретно состоит ее биологическая
роль.
Геномика человека и будущее человечества
Сегодня почти каждый день широкая пресса США и
западноевропейских стран сообщает о все новых и
новых генах человека и об их функциях или связи с
теми или иными заболеваниями. В 1998 году
правительство США истратило на проект по
изучению генома человека 300 миллионов долларов, а
частные компании, прежде всего
биотехнологические, — даже больше этой суммы. По
крайней мере 20 самых развитых стран мира имеют
свои национальные программы по изучению генома
человека.
Сейчас геномная программа уже доказала свое выдающееся значение для развития наших знаний о жизни в целом. Интересно вспомнить, как эти идеи были встречены в момент их первоначального обсуждения и создания программы. Научное сообщество тогда разделилось на две части: одна встретила идею геномной программы с энтузиазмом, тогда как другая — со скепсисом, недоверием и подозрительностью. Среди этой второй группы были и выдающиеся ученые, например, лауреат Нобелевской премии Дэвид Балтимор, один из отцов обратной транскрипции. Основное возражение противников: создание геномной программы направлено на то, чтобы привлечь большие финансовые средства (и тем самым отобрать их у других направлений биологии), а не получить новые знания.
Истекшие 10 лет показали, что новый уровень
понимания биологических проблем, сложившийся
благодаря результатам геномных исследований,
уже сейчас с лихвой оправдал все организационные
усилия и финансовые вложения. Более того, стало
ясно, что добытая информация не могла быть
получена простой поддержкой сотен отдельных
исследовательских групп, даже высококвали
фицированных и хорошо оснащенных. Но вместе с тем
теперь мы понимаем, что 10 лет назад трудно было
оценить глубину и широту влияния геномики
(области биологии, изучающей геномы) человека на
биологию в целом.
Более того, стало
ясно, что добытая информация не могла быть
получена простой поддержкой сотен отдельных
исследовательских групп, даже высококвали
фицированных и хорошо оснащенных. Но вместе с тем
теперь мы понимаем, что 10 лет назад трудно было
оценить глубину и широту влияния геномики
(области биологии, изучающей геномы) человека на
биологию в целом.
Один из сильных аргументов против геномной программы состоял также в том, что «индустриализация» биологии приведет к утрате ее творческого потенциала, исчезновению «малой» биологии — небольших исследовательских групп, возглавляемых талантливыми, оригинально мыслящими исследователями, которые не захотят пойти работать на «фабрики секвенирования ДНК». Среди ученых, придерживавшихся таких взглядов, был, например, и Брюс Олбертс, нынешний президент Национальной академии США.
Безусловно справедливо, что одно из основных
звеньев геномной программы — секвенирование,
которое в столь гигантском масштабе достижимо
только индустриальными методами. Однако само
достижение этой фазы требовало больших
интеллектуальных усилий, новой приборной базы,
новых методов, новых инструментов исследования.
Здесь требовалось творческое усилие отдельных
ученых. И это творческое начало как необходимый
компонент индустриализации было недооценен о
скептиками.
Однако само
достижение этой фазы требовало больших
интеллектуальных усилий, новой приборной базы,
новых методов, новых инструментов исследования.
Здесь требовалось творческое усилие отдельных
ученых. И это творческое начало как необходимый
компонент индустриализации было недооценен о
скептиками.
Разработанные в геномике человека идеи и методы имеют универсальное значение и применимы для решения огромного круга биологических проблем, далеко отстоящих от собственно генома человека. Напомним только о некоторых из них.
Для картирования генома (обязательная стадия
исследований, предшествующая секвенированию)
разработаны высокоэффективные техники, такие,
как радиационные гибриды (коллекции клеток, в
которых удалены разные небольшие фрагменты
каждой из хромосом), или искусственные дрожжевые
хромосомы, содержащие огромные фрагменты
хромосом человека, бактериальные и фаговые
векторы, позволяющие размножить (клонировать)
фрагменты ДНК человека. ..
Новые техники в совокупности позволили
построить детальную карту генома человека,
которая к концу 1998 года содержала более 30 тысяч
маркеров, создававших детальную карту генома.
..
Новые техники в совокупности позволили
построить детальную карту генома человека,
которая к концу 1998 года содержала более 30 тысяч
маркеров, создававших детальную карту генома.
Быстро прогрессировала техника секвенирования (например, многоканальный капиллярный электрофорез резко ускорил и удешевил расшифровку первичной структуры ДНК), созданы компьютерные программы, позволяющие находить гены в расшифрованных участках ДНК.
Важно подчеркнуть, что вся эта приборная база и методология в полной мере может применяться к любым геномам, от бактерий до сельскохозяйственных животных и растений.
Пожалуй, от развития геномики человека в
настоящее время выиграла больше всего
микробиология, поскольку уже расшифровано более
20 полных геномов, в том числе возбудителей многих
опасных болезней (туберкулеза, сыпного тифа, язвы
желудка и других). Можно с уверенностью
утверждать, что без геномного проекта эти данные
были бы получены гораздо позже и, вероятно, в
гораздо меньшем объеме. Знание геномной
структуры патогенных бактерий очень важно для
создания вакцин (причем рационально
сконструированных), для диагностики и других
медицинских целей. Велико влияние геномики и на
медицинскую генетику, которая занимается
генодиагностикой наследственных болезней,
генетическими основами предрасположенности ко
многим распространенным болезням.
Знание геномной
структуры патогенных бактерий очень важно для
создания вакцин (причем рационально
сконструированных), для диагностики и других
медицинских целей. Велико влияние геномики и на
медицинскую генетику, которая занимается
генодиагностикой наследственных болезней,
генетическими основами предрасположенности ко
многим распространенным болезням.
Частные компании, кредитовавшие проект,
получили тысячи патентов на новые гены,
фрагменты ДНК, новые методики и
т. д. Это имеет как бы двойной эффект. С одной
стороны, геномика получает мощный
дополнительный импульс к развитию, а с другой -
коммерциализация геномики ведет к тому, что
многое из полученной информации фирмы
засекречивают, особенно по геномике
микроорганизмов, заставляя и некоторых ученых
поступать аналогичным образом.
Геномные методы идентификации личности,
разработанные и практически реализованные в
геномике человека, имеют далеко идущие
последствия для общества. Действительно,
криминалистика получила в свое распоряжение
абсолютно надежный метод доказательства
виновности или невиновности человека. Для такого
геномного анализа (его часто называют геномной
дактилоскопией) достаточно одной капли крови,
одного волоса, кусочка ногтя, следов пота, спермы,
слюны, перхоти и т. д. Сегодня в мире тысячи людей
осуждены или оправданы только на основании
геномного анализа. Идентификация родственных
связей людей решает сейчас проблемы отцовства и
материнства, проблемы наследования прав и
имущества между родственниками и неродственни
ками, если эти вопросы возникают.
Действительно,
криминалистика получила в свое распоряжение
абсолютно надежный метод доказательства
виновности или невиновности человека. Для такого
геномного анализа (его часто называют геномной
дактилоскопией) достаточно одной капли крови,
одного волоса, кусочка ногтя, следов пота, спермы,
слюны, перхоти и т. д. Сегодня в мире тысячи людей
осуждены или оправданы только на основании
геномного анализа. Идентификация родственных
связей людей решает сейчас проблемы отцовства и
материнства, проблемы наследования прав и
имущества между родственниками и неродственни
ками, если эти вопросы возникают.
Огромный интерес вызывает вторжение геномики в
историю человечества, этнографию, лингвистику и
другие области гуманитарного знания. В эту
орбиту уже вовлечены и такие биологические
науки, как антропология и палеонтология, теория
эволюции. Многие спорные вопросы истории
цивилизаций в древние времена будут, скорее
всего, решены не историками, а геномоведами. Например, уже сейчас ясно (хотя эти работы
начались совсем недавно), что происхождение и
миграцию многих народов в мире (и, конечно, в том
числе в России) легче всего будет проследить по геномным маркерам, которые дают
количественную и однозначную информацию.
Например, уже сейчас ясно (хотя эти работы
начались совсем недавно), что происхождение и
миграцию многих народов в мире (и, конечно, в том
числе в России) легче всего будет проследить по геномным маркерам, которые дают
количественную и однозначную информацию.
Программа «Геном человека», как уже говорилось, — программа общечеловеческая. Каждая лаборатория, в какой бы стране она ни находилась, вносит в нее посильный вклад. И как только кому-то удается раскрыть структуру нового гена, эта информация немедленно поступает в Международный банк данных, доступный каждому исследователю. Без преувеличения надо сказать, что развитие информатики играет поистине огромную роль в успехе мировой геномной программы.
В России по этой программе работают около 100
исследовательских групп. Есть оригинальные
работы, получившие международное признание
(только в прошлом году участники программы
опубликовали более 70 статей в международных
журналах). Первые пять лет главным в программе
было картирование, иначе говоря — расстановка
«опознавательных значков», попытка понять:
где, в какой части хромосомы ученые находятся -
подобно тому, как географы прошлого составляли
первые карты Земли.
Первые пять лет главным в программе
было картирование, иначе говоря — расстановка
«опознавательных значков», попытка понять:
где, в какой части хромосомы ученые находятся -
подобно тому, как географы прошлого составляли
первые карты Земли.
Теперь акцент сместился, и исследователи пытаются уже определить функции отдельных генов. Это переход от «индустриальной науки», требующей прежде всего оборудования, к науке интеллектуальной. И на этом этапе мы надеемся преуспеть. «Массовое производство» было нам недоступно прежде всего из-за недостатка финансирования, а кроме того — русские ученые никогда не любили механическую работу.
***
Оглядываясь на 10 лет назад, можно увидеть, что
значение геномики было недооценено, а ее влияние
оказалось гораздо шире и глубже, чем ожидалось.
Ясно также, что создание геномного проекта было
огромным достижением для биологов всего мира,
так как впервые поставило биологию в ряд тех
наук, которые способны реализовать глобальные
проекты с огромным не только общенаучным, но и
практическим выходом. Сравнивая геномный проект
с проектом освоения космического пространства
(программа полетов к Луне и Марсу, программа
околоземных станций), видно, что биологическая
программа, будучи во много раз дешевле, по своему
влиянию на жизнь людей не только
не уступает, но и в конечном итоге, безусловно,
превзойдет достижения космических программ,
поскольку окажет влияние в XXI веке почти на
каждого жителя Земли.
Сравнивая геномный проект
с проектом освоения космического пространства
(программа полетов к Луне и Марсу, программа
околоземных станций), видно, что биологическая
программа, будучи во много раз дешевле, по своему
влиянию на жизнь людей не только
не уступает, но и в конечном итоге, безусловно,
превзойдет достижения космических программ,
поскольку окажет влияние в XXI веке почти на
каждого жителя Земли.
Ученые подсчитали количество генов в геноме человека — РБК
Согласно новым данным ученых, геном человека содержит в полтора раза меньше генов, чем принято считать.
Генами называют участки ДНК, по которым в клетках синтезируются белки. На гены приходится лишь около 3% всего объема генома. Полный его код был прочтен в ходе 10-летнего международного проекта «Геном человека». Однако до сих пор продолжается работа по выявлению работающих генов в огромном массиве полученной информации.
На гены приходится лишь около 3% всего объема генома. Полный его код был прочтен в ходе 10-летнего международного проекта «Геном человека». Однако до сих пор продолжается работа по выявлению работающих генов в огромном массиве полученной информации.
До завершения проекта считалось, что у человека 100 тыс. генов, в 2001г. была получены данные, что их «всего» 30-40 тыс. Согласно же новым данным, геном содержит только 20-25 тыс. генов, кодирующих белки, сообщает журнал Nature.
Интересно, что китайские ученые пытаются применить генную инженерию в необычном проекте. В 2003г. они заявили, что надеются раскрыть секрет женской красоты, тщательно изучив наборы ДНК нескольких идеальных по всем параметрам представительниц прекрасного пола. В ходе исследования ученые из университета провинции Хунань планируют изучить ДНК двадцати красавиц, надеясь найти общие признаки в генетической структуре женщин, отвечающие за внешнюю привлекательность.
А вот британские ученые надеются с помощью знаний о генах вылечить хандру. По их мнению, предрасположенность людей к депрессии заложена на генетическом уровне. Исследования показали, что вероятность впадения человека в хандру в сложный период жизни зависит от комбинации его генов.
По их мнению, предрасположенность людей к депрессии заложена на генетическом уровне. Исследования показали, что вероятность впадения человека в хандру в сложный период жизни зависит от комбинации его генов.
Пятнадцать лет открытию Генома человека
«Геном человека» спустя тридцать лет с запуска международной научной программы
В 1988 году в СССР была официально запущена государственная научно-техническая программа «Геном человека» Постановлением Совета Министров СССР «О мерах по ускорению работ в области генома человека» №1060. С инициативой секвенирования генома человека выступил академик Баев А.А. — ученый в области генной инженерии.
Мы были не единственными, кто в этот период озадачился проблемами генетики. Программа «Геном человека» стала международной и одновременно самой масштабной и грандиозной за всю многовековую историю науки!
Как все начиналось
В 1988 г. в США два ученых-генетика Уильям Гилберт и Джеймс Уотсон выступили с идеей о проведении научной программы «Геном человека». Основной целью программы была расшифровка генома человека, а также других видов: бактерий, дрожжей, мышей. Планировалось, что открытие генома человека станет ключом к пониманию многих процессов эволюции, позволит изучить множество генетических заболеваний, а также разработать эффективные медицинские препараты. Неожиданно, идею поддержали Министерство энергетики США и Национальный институт здоровья США, которые согласились спонсировать программу. Стоимость ее изначально планировалась в 3 млрд. долларов США.
в США два ученых-генетика Уильям Гилберт и Джеймс Уотсон выступили с идеей о проведении научной программы «Геном человека». Основной целью программы была расшифровка генома человека, а также других видов: бактерий, дрожжей, мышей. Планировалось, что открытие генома человека станет ключом к пониманию многих процессов эволюции, позволит изучить множество генетических заболеваний, а также разработать эффективные медицинские препараты. Неожиданно, идею поддержали Министерство энергетики США и Национальный институт здоровья США, которые согласились спонсировать программу. Стоимость ее изначально планировалась в 3 млрд. долларов США.
Во многом удалось получить такую высокую поддержку благодаря статусу Джеймса Уотсона, который еще в 1962 г. получил Нобелевскую премию за открытие двойной спирали ДНК, после чего им была построена одна из лучших биологических лабораторий мира «Cold Spring Harbor», существующая и по сей день.
В последующие годы к программе присоединились другие страны: Великобритания, Франция, Германия, Италия и другие страны (всего 23 государства, геном человека состоит из 23 пар хромосом). Стоит отметить, что и СССР не поскупился на финансирование развития генетики. Уже в первый год на программу «Геном человека» было выделено 20 млн. долларов США для реконструкции лабораторий, разработки нового оборудования и создания внутренней информационной базы. Каждой стране была выделена своя хромосома для исследования, работа велась полным ходом.
Стоит отметить, что и СССР не поскупился на финансирование развития генетики. Уже в первый год на программу «Геном человека» было выделено 20 млн. долларов США для реконструкции лабораторий, разработки нового оборудования и создания внутренней информационной базы. Каждой стране была выделена своя хромосома для исследования, работа велась полным ходом.
Первые результаты
Нельзя не отметить, что тяжелая политическая и экономическая обстановка в России 90-х годов негативно сказались и на развитии науки. В программу «Геном человека» стали выделять все меньше финансов, поэтому участие России в международной программе почти было сведено на нет. При этом, большой вклад в развитие генетики внесли ученые Института Цитологии и Генетики СО РАН (Новосибирск, Академгородок). Под руководством профессора Колчанова Н.А. было создано несколько компьютерных программ для поиска регуляторных участков генома.
При этом, правительственное финансирование в США в этот период тоже было снижено, научная работа замедлилась. По сути, программу спасла частная лаборатория «Сelera Genomics», возглавляемая биологом – Дж. Вентером. Для сравнения: программа, финансируемая правительствами государств по всему миру, могла расшифровать миллион нуклеотидных пар в год, «Сelera Genomics» расшифровывала не менее 10 млн. нуклеотидных пар в сутки. Это позволило в короткие сроки добиться значительного прогресса.
По сути, программу спасла частная лаборатория «Сelera Genomics», возглавляемая биологом – Дж. Вентером. Для сравнения: программа, финансируемая правительствами государств по всему миру, могла расшифровать миллион нуклеотидных пар в год, «Сelera Genomics» расшифровывала не менее 10 млн. нуклеотидных пар в сутки. Это позволило в короткие сроки добиться значительного прогресса.
И еще важным открытием «Сelera Genomics» стал новый способ расшифровки генома, названный впоследствии – метод произвольного секвенирование путем дробления. С его помощью, в компьютерной программе можно было смоделировать полный геном, имея в физическом наличии только его фрагменты. При помощи этого способа впервые удалось узнать геном бактерии Haemophilus in-fluenzae Rd. Затем, в 1996 году этим же методом окрыли геном дрожжевой клетки, а уже 1998 удалось расшифровать геном многоклеточного организма – земляного червя Caenorhabolits elegans.
Открытие генома человека
Геном человека — это совокупность генетического материала, укомплектованного в гаплоидном наборе хромосом (23 пары) в клетке организма.
В 2000 году президент США и премьер-министр Великобритании сделали амбициозное заявление о расшифровке генома человека и завершении генетической гонки. Как выяснилось позже, заявление было преждевременным, так как на тот момент геном был изучен только на 90 %. Возможно, недостоверное взыскивание представителей власти было связано с тем, что государства больше не имели возможности вкладывать огромные деньги на программу «Геном человека» или просто стремились присвоить себе лавры многолетней международной программы для поднятия политического рейтинга.
На самом деле, в окончательной версии геном человека был расшифрован в 2003 году, то есть, всего лишь 15 лет назад! При этом, некоторые пробелы в познаниях генетического кода человека остаются даже сегодня. Ученые продолжают работать над тайнами генома Homo sapiens.
Что нам дало это открытие?
Медицина. Расшифровка ДНК человека в первую очередь открыла новые грани медицины. После этого открытия, удалось научно подтвердить, что огромное количество заболеваний являются наследственными и передаются от предков к потомкам. Кроме того, понимание динамики и признаков заболевания с точки зрения молекулярной биологии позволило создать прогрессивные медицинские методы и средства. Этот процесс продолжается и сейчас, благодаря чему появляются все более эффективные способы лечения таких патологий, как онкология, сахарный диабет, болезнь Альцгеймера и многие другие.
После этого открытия, удалось научно подтвердить, что огромное количество заболеваний являются наследственными и передаются от предков к потомкам. Кроме того, понимание динамики и признаков заболевания с точки зрения молекулярной биологии позволило создать прогрессивные медицинские методы и средства. Этот процесс продолжается и сейчас, благодаря чему появляются все более эффективные способы лечения таких патологий, как онкология, сахарный диабет, болезнь Альцгеймера и многие другие.
Знание секретов молекулы ДНК дает зеленый свет развитию «персонализированной медицины», о которой ведутся разговоры уже многие годы. Термин означает применение к каждому пациенту индивидуальных способов лечения. Эпоха стандартных методов лечения уходит в прошлое. Это обусловлено тем, что теперь нам известно — генетически каждый человек уникален, природе не существует людей с одинаковым набором генов! А это означает, что не существует и универсальных медицинских средств.
Биологам удалось выявить роль и значение многих генов в организме человека. Сегодня в обширную медицинскую практику входят ДНК-тесты, которые позволяют анализировать гены конкретного человека. Генетический тест позволяет выявить предрасположенность человека к разлитым патологиям, риски и особенности его организма. Обладая такими глубокими данными, врачи имеют возможность подобрать пациенту индивидуальную программу лечения и профилактики.
Сегодня в обширную медицинскую практику входят ДНК-тесты, которые позволяют анализировать гены конкретного человека. Генетический тест позволяет выявить предрасположенность человека к разлитым патологиям, риски и особенности его организма. Обладая такими глубокими данными, врачи имеют возможность подобрать пациенту индивидуальную программу лечения и профилактики.
Оказалось, что гены играют огромную роль во многих аспектах жизни человека. Генетические тесты используются и в таких сферах медицины как диетология, косметология, трихология. Например, склонность к полноте, особенности метаболизма и усвоения продуктов питания тоже заложены генетически. Сейчас ученые активно изучают влияние генов на характер и таланты человека.
Криминалистика. Знание об уникальности каждого человека положило начало новой вехе в развитии криминалистики. Теперь даже один оставленный волос, капля крови, фрагмент кожи, слюна и любой биоматериал преступника может послужить для идентификации его ДНК. При чем, в надлежащих условиях хранения ДНК может храниться очень долго. Например, современные ученые изучают ДНК останков солдат, погибших во время Великой Отечественной Войны, и сравнивают их с фрагментами ДНК с фронтовых писем. Более того, проводятся даже исследования мумий египетских фараонов, пролежавших в земле более трех тысяч лет.
При чем, в надлежащих условиях хранения ДНК может храниться очень долго. Например, современные ученые изучают ДНК останков солдат, погибших во время Великой Отечественной Войны, и сравнивают их с фрагментами ДНК с фронтовых писем. Более того, проводятся даже исследования мумий египетских фараонов, пролежавших в земле более трех тысяч лет.
История. До момента расшифровки генома человека, большинство данных о прошлых цивилизациях мы получали из археологических раскопок. После открытия генома историки смогли понять многие исторические события более глубоко. Например, удалось проанализировать процесс заселения Европы: оказалось, что сначала она заселялась выходцами из Ближнего Востока, которая имели темные волосы и глаза, постепенно гены мутировали, в результате чего, в средние века в Европе проживали уже люди со светлыми волосами и голубыми глазами. Это во многом связано с климатическими условиями, под которые поступательно мутирует организм.
Интересной находкой оказалась мутация гены лактазы (это фермент, расщепляющий молочный сахар — лактозу). Изначально люди не имели способности расщеплять лактозу в течение всей жизни, а могли делать это только в младенчестве (то есть, могли употреблять молоко только в период лактации младенца). Постепенная мутация гена привела к тому, что люди стали пить молоко в течение всей жизни. Мутация впервые распространилась в популяции примерно 4 тыс. лет назад, а значит, люди стали способны употреблять в пищу молоко далеко не сразу после того, как одомашнили животных. Вероятно, люди вообще не сразу поняли, что можно употреблять в пищу молоко животных. В итоге эта привычка прижилась так основательно, что сегодня у 70 % населения планеты генетически заложены способность употреблять молоко животного происхождения всю жизнь. При этом, например, жители Китая практически не употребляют в пищу молоко и не имеют способности к расщеплению лактозы. Истерически сложилось так, что на этой территории в силу муссонного климата было слабо развито скотоводство. Таким образом, мутация гена лактазы у этих народов не формировалась.
Изначально люди не имели способности расщеплять лактозу в течение всей жизни, а могли делать это только в младенчестве (то есть, могли употреблять молоко только в период лактации младенца). Постепенная мутация гена привела к тому, что люди стали пить молоко в течение всей жизни. Мутация впервые распространилась в популяции примерно 4 тыс. лет назад, а значит, люди стали способны употреблять в пищу молоко далеко не сразу после того, как одомашнили животных. Вероятно, люди вообще не сразу поняли, что можно употреблять в пищу молоко животных. В итоге эта привычка прижилась так основательно, что сегодня у 70 % населения планеты генетически заложены способность употреблять молоко животного происхождения всю жизнь. При этом, например, жители Китая практически не употребляют в пищу молоко и не имеют способности к расщеплению лактозы. Истерически сложилось так, что на этой территории в силу муссонного климата было слабо развито скотоводство. Таким образом, мутация гена лактазы у этих народов не формировалась.
Подводя итоги, можно сделать вывод, что научная программа «Геном человека» имела значительные плоды и внесла серьёзный вклад в развитие генетики и других наук. По неофициальным данным, на ее реализацию было затрачено 3 млрд. долларов США бюджетных средств и столько же профинансировали частные компании. В совокупности на программу ушло около 6 млрд. долларов США. Благодаря вкладу частных корпораций программа была завершена даже раньше, чем планировалось, и полностью оправдала ожидания ее создателей. Но, мы не можем останавливаться на достигнутом, поэтому эпоха научных открытий в генетике продолжается…
Код, текст и язык Бога
Резюме
При объяснении науки и ее значения для широкой публики пригодятся метафоры. Но их неизбирательное использование может также легко иметь неприятные последствия.
Общение между учеными о своей работе наполнено изображениями. Это неизбежно, когда дело доходит до объяснения сложных идей и концепций, которые нельзя наблюдать напрямую, таких как субатомные частицы, составляющие протон или электрон, или процессы внутри клетки, которые приводят к правильному образованию белка. Когда делаются новые открытия, обычно не хватает слов для их описания, и они должны быть заимствованы из физического мира или обычной речи: липидные рафты, шапероны, молекулярные маркеры. Когда ученые пытаются объяснить свои открытия общественности или когда средства массовой информации пытаются сделать науку более привлекательной для своих читателей или зрителей, эти метафоры становятся еще более красочными: клетки — это фабрики, белки несут почтовые индексы, митохондрии — это электростанция. клетка и клетки иммунной системы ходят в школу.Как сказал Гарольд Вармус: «Идет конкурс метафор» (Angier, 2000).
Когда делаются новые открытия, обычно не хватает слов для их описания, и они должны быть заимствованы из физического мира или обычной речи: липидные рафты, шапероны, молекулярные маркеры. Когда ученые пытаются объяснить свои открытия общественности или когда средства массовой информации пытаются сделать науку более привлекательной для своих читателей или зрителей, эти метафоры становятся еще более красочными: клетки — это фабрики, белки несут почтовые индексы, митохондрии — это электростанция. клетка и клетки иммунной системы ходят в школу.Как сказал Гарольд Вармус: «Идет конкурс метафор» (Angier, 2000).
… метафоры, если зайти слишком далеко, могут передать публике сбивающее с толку или даже вводящее в заблуждение сообщение
Придумывание метафор для объяснения сложных концепций — творческий процесс, и он показывает, как думают ученые и как идеи о мире слишком малы для схватывание представлены в их сознании (Brown, 2003). Однако метафоры, если зайти слишком далеко, могут передать публике запутанное или даже вводящее в заблуждение сообщение. Они подчеркивают одни аспекты объекта или процесса, которые изображают, игнорируя другие. Иногда они даже вызывают ассоциации, не предусмотренные автором, когда молекулы внезапно приобретают собственную индивидуальность или наделены целенаправленным поведением человека — например, молекула, которая «находит» партнера, или клетка, которая принимает «решение» развития, такое как совершение «клеточного самоубийства». На примере молекулярной генетики я попытаюсь проследить некоторые метафоры биологии от их происхождения в научном общении до реального мира и проанализировать их влияние на общественное восприятие науки.
Они подчеркивают одни аспекты объекта или процесса, которые изображают, игнорируя другие. Иногда они даже вызывают ассоциации, не предусмотренные автором, когда молекулы внезапно приобретают собственную индивидуальность или наделены целенаправленным поведением человека — например, молекула, которая «находит» партнера, или клетка, которая принимает «решение» развития, такое как совершение «клеточного самоубийства». На примере молекулярной генетики я попытаюсь проследить некоторые метафоры биологии от их происхождения в научном общении до реального мира и проанализировать их влияние на общественное восприятие науки.
Обычный язык говорит о ДНК как о «информации» или «коде». В течение очень долгого времени ученые подозревали, что что-то — своего рода план, специфичность или движущая сила — находится внутри сперматозоидов и / или яйцеклеток, так что змея развилась из змеиного яйца, а люди создали человеческое потомство. Но только в конце 1940-х и 1950-х годах, когда кибернетики, физики и математики вошли в область молекулярной биологии, ученые пришли к интерпретации этого «чего-то» как информации. Физик Эрвин Шредингер, вероятно, придумал термин «код», когда описал живые организмы с точки зрения их молекулярной и атомной структуры в своей влиятельной книге What is Life (Schrödinger, 1944). Шредингер писал, что полная картина будущего развития организма и его функций в зрелом возрасте содержится в хромосомах в виде «кода». Его труды оказали сильное влияние как на Фрэнсиса Крика, так и на Джеймса Уотсона, а также на их более позднее открытие структуры ДНК.«Шредингер, вероятно, не был первым, но он был первым, кого я прочитал, чтобы сказать, что должен существовать какой-то код, который позволяет молекулам в клетках передавать информацию», — сказал Уотсон в интервью Scientific American (Уотсон, 2003). В самом деле, Уотсон и Крик в статье о значении их структуры ДНК подхватили метафору Шредингера, когда они написали, что «поэтому кажется вероятным, что точная последовательность оснований — это код, который несет генетическую информацию.«С сегодняшней точки зрения кажется довольно неизбежным, что, когда люди начали задумываться о молекулярной основе наследования, они пришли к этим аналогиям.
Физик Эрвин Шредингер, вероятно, придумал термин «код», когда описал живые организмы с точки зрения их молекулярной и атомной структуры в своей влиятельной книге What is Life (Schrödinger, 1944). Шредингер писал, что полная картина будущего развития организма и его функций в зрелом возрасте содержится в хромосомах в виде «кода». Его труды оказали сильное влияние как на Фрэнсиса Крика, так и на Джеймса Уотсона, а также на их более позднее открытие структуры ДНК.«Шредингер, вероятно, не был первым, но он был первым, кого я прочитал, чтобы сказать, что должен существовать какой-то код, который позволяет молекулам в клетках передавать информацию», — сказал Уотсон в интервью Scientific American (Уотсон, 2003). В самом деле, Уотсон и Крик в статье о значении их структуры ДНК подхватили метафору Шредингера, когда они написали, что «поэтому кажется вероятным, что точная последовательность оснований — это код, который несет генетическую информацию.«С сегодняшней точки зрения кажется довольно неизбежным, что, когда люди начали задумываться о молекулярной основе наследования, они пришли к этим аналогиям. Хотя метафоры кажутся настолько интуитивными, что генетику трудно представить ДНК как что-то иное, кроме кода, передающего информацию, в своей книге Кто написал книгу жизни Лили Кей сомневалась, что это естественное свойство ДНК следует рассматривать как информационную (Kay, 2000).
Хотя метафоры кажутся настолько интуитивными, что генетику трудно представить ДНК как что-то иное, кроме кода, передающего информацию, в своей книге Кто написал книгу жизни Лили Кей сомневалась, что это естественное свойство ДНК следует рассматривать как информационную (Kay, 2000).
Когда Х. Гобинд Хорана, Маршалл В.Ниренберг и другие ученые выявили тринуклеотидный код и корреляцию между нуклеиновыми кислотами и белками, это было названо «расшифровкой» или «расшифровкой» кода. Эти метафоры получили распространение и теперь обычно используются для описания секвенирования генома человека. Для вовлеченных ученых эти ссылки понятны в зависимости от контекста — независимо от того, является ли проблема самой последовательностью ДНК или взаимосвязью между ДНК и белком. Но заголовки новостей, такие как «Расшифровка книги жизни», «Взломать код жизни» или «Нарушение кода жизни», когда говорят о секвенировании генома человека, вводят в заблуждение непрофессионала, поскольку подразумевают, что расшифрованный код текст можно читать как роман. Ни один ученый не станет спорить, что это далеко от современного состояния дел. Для понимания сообщения, скрытого в 3 миллиардах пар оснований человеческого генома, потребуется подробный перевод его последовательности в физиологические функции. Сама ДНК — это «текст без контекста» (Нелькин, 2001). В самом деле, сами по себе гены почти ничего не делают. Гены просто описывают, как производить белки, или как перестать их производить, или как регулировать их производство в соответствии с указаниями других белков. Из генов невозможно вывести даже основы функции белка на уровне сворачивания белка.Это не гены, а сложные белковые сети, которые постоянно исследуют окружающую среду вне клетки, контролируют метаболические процессы и интегрируют эту информацию в физические функции. Поэтому простая расшифровка текста, заложенного в геноме, не обязательно предсказывает, как жизнь работает на клеточном, не говоря уже об организменном уровне. Тем не менее, метафоры «декодирования» используются как средствами массовой информации, так и учеными, и даже достигли отрасли: компания deCODE Genetics использует слоган «декодирование языка жизни» на своем корпоративном веб-сайте.
Ни один ученый не станет спорить, что это далеко от современного состояния дел. Для понимания сообщения, скрытого в 3 миллиардах пар оснований человеческого генома, потребуется подробный перевод его последовательности в физиологические функции. Сама ДНК — это «текст без контекста» (Нелькин, 2001). В самом деле, сами по себе гены почти ничего не делают. Гены просто описывают, как производить белки, или как перестать их производить, или как регулировать их производство в соответствии с указаниями других белков. Из генов невозможно вывести даже основы функции белка на уровне сворачивания белка.Это не гены, а сложные белковые сети, которые постоянно исследуют окружающую среду вне клетки, контролируют метаболические процессы и интегрируют эту информацию в физические функции. Поэтому простая расшифровка текста, заложенного в геноме, не обязательно предсказывает, как жизнь работает на клеточном, не говоря уже об организменном уровне. Тем не менее, метафоры «декодирования» используются как средствами массовой информации, так и учеными, и даже достигли отрасли: компания deCODE Genetics использует слоган «декодирование языка жизни» на своем корпоративном веб-сайте. Посредством этих метафор мирянин воспринимает человечество как демистифицированное, раскрывающее его секреты.
Посредством этих метафор мирянин воспринимает человечество как демистифицированное, раскрывающее его секреты.
«И в геноме человека, главе IXX хромосом, Господь говорит нам о Своем божественном плане, говоря:« cggggggccc ggagcgggat … »»
Из понимания генома как закодированного сообщения, интерпретируя его как текст, книга или язык не так уж надуманы. Эти метафоры передают важный научный принцип: последовательность из ограниченного набора строительных блоков, таких как буквы в тексте, может нести сообщение.В своей книге The Language of Life Джордж Бидл писал: «… расшифровка кода ДНК открыла язык … столь же старый, как сама жизнь, язык, который является самым живым языком из всех» (Beadle И Бидл, 1966). Совсем недавно, когда ученые праздновали завершение первого проекта генома человека в 2000 году, метафоры «книга» и «язык» были возрождены — не только заново изобретены прессой на службе общественного понимания науки, но и использовались высокопоставленные ученые, вовлеченные в проект по геному, описывают свои достижения. 26 июня 2000 года, когда Фрэнсис Коллинз, директор Национального института исследования генома человека, объявил о завершении первого проекта на крупном мероприятии для СМИ в Белом доме, он сказал: «Сегодня мы празднуем обнародование первого проекта человеческая книга жизни »и заявил, что этот прорыв впервые позволяет людям читать« наши собственные инструкции ».
26 июня 2000 года, когда Фрэнсис Коллинз, директор Национального института исследования генома человека, объявил о завершении первого проекта на крупном мероприятии для СМИ в Белом доме, он сказал: «Сегодня мы празднуем обнародование первого проекта человеческая книга жизни »и заявил, что этот прорыв впервые позволяет людям читать« наши собственные инструкции ».
Но что именно имеют в виду ученые, когда говорят «книга жизни»? У Коллинза есть несколько объяснений его содержания, описывая его как «повествование о путешествии нашего вида во времени», «магазинное руководство», «подробный план» и «преобразующий учебник медицины».Эти объяснения сбивают с толку. Геном несет информацию, которая эволюционировала и переводится клетками в физиологию. Назвать его «повествованием» или «учебником» означает, что он написан намеренно и предназначен для чтения людьми. Эта путаница в намерениях и целевой аудитории неверно интерпретирует роль ученых. Вместо того, чтобы описывать их как сторонних наблюдателей, пытающихся распутать сложность жизни, они отображаются как часть процесса, как те, кто должен читать и интерпретировать сообщение, записанное в геноме. Но кто автор?
Но кто автор?
Фрэнсис Коллинз на мероприятии в Белом доме быстро дал ответ и познакомил еще одного игрока с биологическими исследованиями. Он назвал последовательность человеческого генома «нашей собственной инструкцией, ранее известной только Богу». Президент США Уильям Дж. Клинтон также похвалил работу ученых, заявив, что «сегодня мы изучаем язык, на котором Бог создал жизнь». На пресс-конференции в следующем году Коллинз продвинул свое упоминание о Боге еще дальше: «Но мы также глубоко унижены привилегией перелистывать страницы, описывающие чудо человеческой жизни, написанные таинственным языком всех веков. язык Бога.
В своих замечаниях Коллинз не только еще больше запутал сообщение общественности о реальных последствиях знания последовательности генома человека, но и, возможно, даже оказал науке медвежью услугу. По его словам, текст генома был написан Богом на Его языке. Если мы будем следовать этому убеждению дальше, это означает, что Бог на самом деле разговаривает с людьми через геном, а ученый является посредником между Богом и остальным миром. Эта метафора определенно не передает научную концепцию и ложно приписывает ученым роль священников, которые читают наставления Бога и переводят и интерпретируют их для публики.Это не служит ни науке, ни религии. С религиозной точки зрения это вполне могло быть равносильно богохульству. С точки зрения науки, это может еще больше навредить роли науки, потому что оно вводит волю и намерения некоторых высших существ в научное упражнение после столетий попыток освободить науку и исследования от ограничений, налагаемых религиозными лидерами. В лучшем случае это вызывает сарказм: «И в геноме человека, хромосомах, глава IXX, Господь говорит нам о Своем божественном плане, говоря:« cggggggccc ggagcgggat… »» (Franks, 2002). В худшем случае это вызывает общественный страх — мысль о том, что ученые «разыгрывают Бога», не так уж невероятна. И общественность действительно прислушивается к тому, что говорят ученые — действительно, общественное внимание к проекту генома было непревзойденным. В 2000 г.
Эта метафора определенно не передает научную концепцию и ложно приписывает ученым роль священников, которые читают наставления Бога и переводят и интерпретируют их для публики.Это не служит ни науке, ни религии. С религиозной точки зрения это вполне могло быть равносильно богохульству. С точки зрения науки, это может еще больше навредить роли науки, потому что оно вводит волю и намерения некоторых высших существ в научное упражнение после столетий попыток освободить науку и исследования от ограничений, налагаемых религиозными лидерами. В лучшем случае это вызывает сарказм: «И в геноме человека, хромосомах, глава IXX, Господь говорит нам о Своем божественном плане, говоря:« cggggggccc ggagcgggat… »» (Franks, 2002). В худшем случае это вызывает общественный страх — мысль о том, что ученые «разыгрывают Бога», не так уж невероятна. И общественность действительно прислушивается к тому, что говорят ученые — действительно, общественное внимание к проекту генома было непревзойденным. В 2000 г. в газете «Нью-Йорк Таймс» только было опубликовано 108 статей, связанных с проектом «Геном человека». Неужели именно этот всплеск внимания СМИ превратил ученых в пиарщиков и побудил их раздуть свою речь?
в газете «Нью-Йорк Таймс» только было опубликовано 108 статей, связанных с проектом «Геном человека». Неужели именно этот всплеск внимания СМИ превратил ученых в пиарщиков и побудил их раздуть свою речь?
Распространено заблуждение, что метафоры используются только при обращении или объяснении научных концепций общественности, тогда как общение между учеными является чисто объективным.Представление о генах как о «контролирующем» или «программирующем» развитии — распространенные метафоры, используемые в биологии развития — диктует определенный взгляд на эти процессы, который может не отражать всей истины, и маскирует другие аспекты. Последствия для этой области исследований обсуждаются в другом месте (Nijhout, 1990). Использование метафор в публичном дискурсе влияет на понимание общественностью и, в конечном итоге, на общественное признание науки и технологий. В общем, существует два уровня неправильного использования метафор: метафоры, размывающие научную концепцию, которую они должны прояснять, и метафоры, которые пробуждают непреднамеренные ассоциации и вводят в заблуждение общественное понимание.
Чрезмерное использование метафор мало помогает прояснить науку, стоящую за ними, потому что их объяснительная ценность не аддитивна.
Распространенным симптомом метафор, размывающих научную концепцию, является их появление в большом количестве и с высокой плотностью. Чрезмерное использование метафор мало помогает прояснить науку, стоящую за ними, потому что их объяснительная ценность не аддитивна. «Эта карта будет описывать для нас точное содержание и структуру, не только каждого гена, связанного с видом, но и предварительно закодированную информацию или« химическое написание », которое контролирует, когда конкретный ген включается или выключается. ‘»(Вентер и Коэн, 1997).Это болото многословия содержит четыре или пять метафор, но, тем не менее, — или, скорее, из-за этого — трудно понять. Даже тот, кто обладает базовыми знаниями в области молекулярной биологии, не сможет легко понять смысл этого предложения, не перечитывая его. Просто кажется невозможным думать о ДНК как о карте, информации (включающей как содержание, так и структуру), коде (или, скорее, предварительном коде), тексте и химической структуре одновременно. Непрофессиональный читатель поражен впечатлением воздействия, смысла, значимости, значимости и серьезности, но лишен каких-либо средств, чтобы понять, что именно было сказано.Если это попытка углубить общественное понимание биологических исследований, то она потерпела неудачу и вполне могла бы способствовать дальнейшему укреплению имиджа ученых как практиков, которые не могут объяснить свою работу простыми и легко понятными терминами.
Непрофессиональный читатель поражен впечатлением воздействия, смысла, значимости, значимости и серьезности, но лишен каких-либо средств, чтобы понять, что именно было сказано.Если это попытка углубить общественное понимание биологических исследований, то она потерпела неудачу и вполне могла бы способствовать дальнейшему укреплению имиджа ученых как практиков, которые не могут объяснить свою работу простыми и легко понятными терминами.
Более того, невнимательное использование метафор, приводящих к путанице, также может привести к неправильным представлениям. Генетические метафоры часто создают впечатление, что в генетике и геномике гораздо больше возможностей или гораздо больше значений, чем это есть на самом деле.Это, конечно, может быть выгодно для сбора средств, но контрпродуктивно для повышения доверия или поощрения общественного признания. Преувеличение потенциала молекулярной генетики достигается за счет переоценки силы гена, а также анализирующего его ученого. Уолтер Гилберт, профессор кафедры молекулярной и клеточной биологии Гарвардского университета (Бостон, Массачусетс, США), начал публичные лекции, вытащив из кармана компакт-диск и сказав: «Это ты» (Nelkin, 2001). Это грубая переоценка роли генома в нашем развитии и полное игнорирование важности факторов окружающей среды на формирование человека. Точно так же, как выразился Коллинз, «читать от корки до корки первый черновик этой« Книги жизни »» — это не совсем то, на что сейчас способны ученые. Скорее, они пытаются вывести какой-то смысл из небольших отдельных фрагментов текста. Комбинация этих двух мощных метафор поддерживает идею о том, что сущность человечества — это последовательность ДНК и что ученые собираются раскрыть ее — прочитать «от корки до корки».Если пойти немного дальше, это означает, что люди лишены всех своих тайн и секретов, поскольку их ДНК можно анализировать и манипулировать ими по прихоти ученых, которые, таким образом, принимают участие Бога в человеческой эволюции. Неизбирательное использование этих метафор вызывает у общественности страх и неодобрение, что мы уже были свидетелями в различных публичных дебатах по пренатальной генетической диагностике, патентованию генов, использованию геномных маркеров для прогнозирования предрасположенности к заболеванию и использованию ДНК для идентификации людей.
Это грубая переоценка роли генома в нашем развитии и полное игнорирование важности факторов окружающей среды на формирование человека. Точно так же, как выразился Коллинз, «читать от корки до корки первый черновик этой« Книги жизни »» — это не совсем то, на что сейчас способны ученые. Скорее, они пытаются вывести какой-то смысл из небольших отдельных фрагментов текста. Комбинация этих двух мощных метафор поддерживает идею о том, что сущность человечества — это последовательность ДНК и что ученые собираются раскрыть ее — прочитать «от корки до корки».Если пойти немного дальше, это означает, что люди лишены всех своих тайн и секретов, поскольку их ДНК можно анализировать и манипулировать ими по прихоти ученых, которые, таким образом, принимают участие Бога в человеческой эволюции. Неизбирательное использование этих метафор вызывает у общественности страх и неодобрение, что мы уже были свидетелями в различных публичных дебатах по пренатальной генетической диагностике, патентованию генов, использованию геномных маркеров для прогнозирования предрасположенности к заболеванию и использованию ДНК для идентификации людей. .Эти растущие опасения, в свою очередь, могут побудить ученых объяснять свою работу еще более грубыми терминами, с еще большей проникающей способностью, вызывая еще больший страх и сопротивление среди общественности — порочный круг. Это не означает, что ученые должны начать общение с общественностью в чисто научных терминах — метафоры играют важную роль, помогая общественности понять и в конечном итоге принять науку. Но они должны лучше осознавать природу метафор и образов, которые они создают в сознании читателя или слушателя, и не должны использовать их без разбора или с преувеличением.Как говорили нам родители, когда мы были детьми: «Следи за своим языком!»
.Эти растущие опасения, в свою очередь, могут побудить ученых объяснять свою работу еще более грубыми терминами, с еще большей проникающей способностью, вызывая еще больший страх и сопротивление среди общественности — порочный круг. Это не означает, что ученые должны начать общение с общественностью в чисто научных терминах — метафоры играют важную роль, помогая общественности понять и в конечном итоге принять науку. Но они должны лучше осознавать природу метафор и образов, которые они создают в сознании читателя или слушателя, и не должны использовать их без разбора или с преувеличением.Как говорили нам родители, когда мы были детьми: «Следи за своим языком!»
ДНК-стеганография: сокрытие неопределяемых секретных сообщений внутри однонуклеотидных полиморфизмов генома и обнаружение ошибок, вызванных мутациями | Microbial Cell Factories
Идентификация SNP и горячих точек SNP
Во-первых, dbSNP (сборка 153) был загружен из NCBI для идентификации полиморфных областей в геноме человека, которые могут использоваться для сокрытия зашифрованного текста. В отличие от других организмов, у людей было обнаружено множество SNP, что дает достаточно информации для стеганографии ДНК.С этой целью я искал SNP, позволяющий присутствовать в позиции одного из четырех нуклеотидов (A / T / G / C), и отбросил SNP, которые были патогенными (Таблица 1, Рис. 1a). Затем были отобраны последовательности вокруг SNP (последовательность длиной 21 нт вокруг SNP), которые были уникальными в геноме человека. Кроме того, отбрасывались SNP, которые находились в мобильных элементах, островках CpG или консервативных областях. Для идентификации SNP в мобильных элементах использовалась база данных мобильных элементов (Dfam) [14].Для идентификации CpG-островков, набор Sequence Manipulation Suite [15] был использован для прогнозирования регионов CpG-островков. Для идентификации SNP в консервативных регионах, которые могут изменять фенотипы, использовались оценки консервации, рассчитанные PhastCons [16]. Окончательное количество выбранных SNP составило 275 967 (таблица 1).
В отличие от других организмов, у людей было обнаружено множество SNP, что дает достаточно информации для стеганографии ДНК.С этой целью я искал SNP, позволяющий присутствовать в позиции одного из четырех нуклеотидов (A / T / G / C), и отбросил SNP, которые были патогенными (Таблица 1, Рис. 1a). Затем были отобраны последовательности вокруг SNP (последовательность длиной 21 нт вокруг SNP), которые были уникальными в геноме человека. Кроме того, отбрасывались SNP, которые находились в мобильных элементах, островках CpG или консервативных областях. Для идентификации SNP в мобильных элементах использовалась база данных мобильных элементов (Dfam) [14].Для идентификации CpG-островков, набор Sequence Manipulation Suite [15] был использован для прогнозирования регионов CpG-островков. Для идентификации SNP в консервативных регионах, которые могут изменять фенотипы, использовались оценки консервации, рассчитанные PhastCons [16]. Окончательное количество выбранных SNP составило 275 967 (таблица 1).
Сбор данных SNP и примерное шифрование символа «H». — это набор наборов данных SNP. SNP были загружены с NCBI dbSNP (ftp://ftp.ncbi.nih.gov/snp/latest_release/JSON). Чтобы использовать SNP для хранения зашифрованных сообщений, патогенные SNP были отброшены, а затем были выбраны SNP с максимальной вариацией (A / T / G / C). Кроме того, отбрасывались SNP, которые находились в мобильных элементах, островках CpG или консервативных областях. Затем были отобраны последовательности вокруг SNP (-10 ~ + 10 нт, всего 21 нт), которые были уникальными в геномных последовательностях. Благодаря этому процессу было обнаружено, что 275 967 SNP доступны для стеганографии ДНК. b точки доступа SNP. Были выбраны регионы, содержащие более 35 SNP в пределах 1 kb, и названы их горячими точками SNP. Наибольшее количество SNP в точке доступа было 120 (таблица 2). SNP в горячих точках использовались для уменьшения количества экспериментов. c Пример стеганографии ДНК. Символ «H» был зашифрован в последовательность ДНК в соответствии с таблицей шифрования (Таблица 3), и каждый зашифрованный нуклеотид заменял исходный нуклеотид в заранее определенных положениях SNP.Чтобы построить последовательность ДНК для расшифровки, позиции SNP, используемые для вставки ДНК, должны быть доставлены получателю в дополнение к таблице шифрования. d Общая схема доставки и дешифрования секретного сообщения
SNP в горячих точках использовались для уменьшения количества экспериментов. c Пример стеганографии ДНК. Символ «H» был зашифрован в последовательность ДНК в соответствии с таблицей шифрования (Таблица 3), и каждый зашифрованный нуклеотид заменял исходный нуклеотид в заранее определенных положениях SNP.Чтобы построить последовательность ДНК для расшифровки, позиции SNP, используемые для вставки ДНК, должны быть доставлены получателю в дополнение к таблице шифрования. d Общая схема доставки и дешифрования секретного сообщения
Теоретически все SNP могут использоваться для хранения зашифрованных сообщений. Однако современные технологии редактирования генома, включая CRISPR / Cas, не позволяют редактировать несколько геномов одновременно. Например, чтобы зашифровать последовательность ДНК из 70 нуклеотидов, которая требует 70 SNP, необходимо выполнить редактирование 70 нуклеотидов.Таким образом, были исследованы горячие точки SNP, чтобы облегчить модификацию генома. В этом поиске были отобраны регионы, которые имели более 35 SNP в пределах 1 т.п.н. Если доступны две горячие точки, вставка зашифрованной последовательности возможна всего за две итерации генетической рекомбинации. Было пять горячих точек SNP, имеющих не менее 35 SNP в пределах 1 кб. Самая большая горячая точка содержала 120 SNP в области 1 т.п.н. (хромосома 12, позиции 88860531–88861530). Например, используя эту точку доступа, зашифрованная последовательность ДНК (70 нт) может быть скрыта с помощью одностадийного эксперимента по гомологичной рекомбинации.Найденные «горячие точки» перечислены в таблице 2.
В этом поиске были отобраны регионы, которые имели более 35 SNP в пределах 1 т.п.н. Если доступны две горячие точки, вставка зашифрованной последовательности возможна всего за две итерации генетической рекомбинации. Было пять горячих точек SNP, имеющих не менее 35 SNP в пределах 1 кб. Самая большая горячая точка содержала 120 SNP в области 1 т.п.н. (хромосома 12, позиции 88860531–88861530). Например, используя эту точку доступа, зашифрованная последовательность ДНК (70 нт) может быть скрыта с помощью одностадийного эксперимента по гомологичной рекомбинации.Найденные «горячие точки» перечислены в таблице 2.
Выбранные SNP не являются патогенными. Однако молчащие SNP в кодирующих последовательностях, таких как третий нуклеотид CUN , кодирующего лейцин, можно использовать для большего уменьшения фенотипических изменений. Однако такое ограничение резко сокращает пространство для хранения информации с 275 967 нт до 8790 нт и затрудняет поиск точек доступа SNP. При использовании 8790 нуклеотидов горячих точек для стеганографии ДНК обнаружено не было. Следовательно, редактирование множественного генома неизбежно для введения зашифрованных сообщений в позиции вырожденности кодонов и, таким образом, также делает стеганографию ДНК менее применимой.
Следовательно, редактирование множественного генома неизбежно для введения зашифрованных сообщений в позиции вырожденности кодонов и, таким образом, также делает стеганографию ДНК менее применимой.
Шифрование простого текста в последовательность ДНК
Затем простой текст был зашифрован с использованием шифра подстановки [17] (Таблица 3). Существует множество других алгоритмов шифрования, включая стандарт шифрования данных (DES) [18], расширенный стандарт шифрования (AES) [19] и Ривест-Шамир-Адлеман (RSA) [20]. Эти алгоритмы также можно использовать вместо метода простой подстановки. В этом исследовании для простоты и подтверждения концепции стеганографии ДНК был использован метод замещения.
Таблица 3 Таблица шифрования ДНК Как показано на рис.1c, символ преобразуется в триплет ДНК с использованием ключей, аналогичных таблице кодонов (Таблица 3). Символ H был зашифрован с использованием таблицы шифрования для TAC, и эту последовательность TAC можно было вставить в заранее определенные позиции SNP, чтобы скрыть зашифрованный символ. Например, «Hello» можно заменить последовательностью ДНК TAC CTG TGT TGT GGA. «Докюн» на рис. 2 зашифрован как AAC GGA TGA ACG CGG TGC.
Например, «Hello» можно заменить последовательностью ДНК TAC CTG TGT TGT GGA. «Докюн» на рис. 2 зашифрован как AAC GGA TGA ACG CGG TGC.
Алгоритм проверки блочной суммы зашифрованной последовательности ДНК. a Три типа информации (разработчик, таксономия и версия) были зашифрованы из простого текста в последовательность ДНК в соответствии с таблицей шифрования (Таблица 3).«9606» означает Homo sapiens . Затем нуклеотидная последовательность была размещена в 2D. b Для проверки суммы блока нуклеотиды были заменены на четвертичные цифры (A = 0, T = 1, G = 2, C = 3). Для каждой строки сумма чисел была разделена на 4, а остаток затем преобразован в нуклеотид. Например, сумма первой строки была разделена на 4, а ее остаток был 2. Затем эти 2 были преобразованы в соответствующий нуклеотид G. Для каждого столбца был повторен тот же процесс для получения нуклеотидов четности. c Нуклеотиды четности для проверки ошибок показаны красным цветом. d Конечная 1D последовательность зашифрованной и определяемой мутациями последовательности была построена
d Конечная 1D последовательность зашифрованной и определяемой мутациями последовательности была построена
Проверка суммы блоков для обнаружения мутаций
Затем для обнаружения мутаций в зашифрованной последовательности ДНК был использован метод проверки суммы блоков, который обычно используется в сетевая передача данных [13]. Как показано на рис. 2а, сначала слова «Докюн», «9606» и «1.1004» были зашифрованы в последовательности ДНК, и эти последовательности были расположены в 2D.Для проверки целостности последовательности к каждой строке и столбцу были прикреплены дополнительные нуклеотиды. Например, последовательность в первой строке (AACGGATGA) была преобразована в строку четвертичных цифр (003220120, где A = 0 / T = 1 / G = 2 / C = 3). Затем сумма чисел (0 + 0 + 3 + 2 + 2 + 0 + 1 + 2 + 0) была разделена на 4, а остаток 2 был преобразован в нуклеотид G. Этот процесс повторялся до последней строки. , а дополнительные нуклеотиды (G, G, A, T, T, T) были добавлены в каждый ряд (рис. 2б). Такой же расчет был повторен для каждого столбца. Например, сумма первого столбца (0 + 0 + 3 + 3 + 1 + 3) была разделена на 4, а оставшиеся 2 были преобразованы в нуклеотид G. Полные дополнительные нуклеотиды (нуклеотиды четности) показаны красным на рис. 2в и d.
2б). Такой же расчет был повторен для каждого столбца. Например, сумма первого столбца (0 + 0 + 3 + 3 + 1 + 3) была разделена на 4, а оставшиеся 2 были преобразованы в нуклеотид G. Полные дополнительные нуклеотиды (нуклеотиды четности) показаны красным на рис. 2в и d.
Дополнительные нуклеотиды использовались для проверки целостности зашифрованной последовательности ДНК и для обнаружения ошибок, вызванных мутациями. Например, если первый нуклеотид A был мутирован в T, остаток от суммы первой строки, деленной на 4, будет равен 3, что соответствует C; это не соответствовало G в нуклеотиде четности.Используя этот подход, можно обнаружить мутацию в первой строке и первом столбце.
Расшифровка последовательности ДНК
Чтобы расшифровать секретное сообщение, скрытое в геноме, пользователь должен знать таблицу шифрования и позиции используемых SNP. Расшифровка происходила в обратном порядке по сравнению с процессом, изображенным на рис. 2. Во-первых, если сообщение было скрыто внутри точки доступа SNP, эту область можно было легко упорядочить, поскольку длина точки доступа составляла всего 1 КБ. Затем нуклеотиды в заранее определенных положениях SNP были объединены для создания 1D последовательности ДНК.Во-вторых, последовательность ДНК была преобразована в 2D, и каждая строка содержала 10 нуклеотидов (9 для сообщения и 1 для проверки ошибок). Дополнительные нуклеотиды четности использовали для определения наличия мутационных изменений. В-третьих, если не было мутаций, последовательность в основной части (черная на рис. 2c) была преобразована в 1D последовательность. Затем, аналогично трансляции мРНК, триплеты ДНК переводили в символы с помощью таблицы шифрования. После этого процесса можно было получить расшифрованное сообщение.
Затем нуклеотиды в заранее определенных положениях SNP были объединены для создания 1D последовательности ДНК.Во-вторых, последовательность ДНК была преобразована в 2D, и каждая строка содержала 10 нуклеотидов (9 для сообщения и 1 для проверки ошибок). Дополнительные нуклеотиды четности использовали для определения наличия мутационных изменений. В-третьих, если не было мутаций, последовательность в основной части (черная на рис. 2c) была преобразована в 1D последовательность. Затем, аналогично трансляции мРНК, триплеты ДНК переводили в символы с помощью таблицы шифрования. После этого процесса можно было получить расшифрованное сообщение.
Когда мутации были внесены в зашифрованное сообщение, их можно легко обнаружить и определить исходные нуклеотиды. Пример показан на рис. 3. В сообщение были внесены две мутации (G → A, окрашенная в фиолетовый цвет, и A → G, окрашенная в голубой цвет). На основе алгоритма проверки суммы блоков, нуклеотид четности второй строки должен быть G. Однако остаток при делении на 4 равен 0, что означает A. Это несоответствие позволяет узнать, что мутация была внесена во вторую строку.Аналогично, остаток пятого столбца при делении на 4 равен 3, обозначающему C. Однако нуклеотид четности должен быть A. Следовательно, можно обнаружить, что A является мутированным нуклеотидом. Чтобы вывести исходный нуклеотид, нуклеотид должен удовлетворять нуклеотидам четности (строка и столбец). Для второй строки остаток должен быть 2, потому что нуклеотид четности — G. Кроме того, для пятого столбца остаток должен быть 0, потому что нуклеотид четности — A. Следовательно, число (нуклеотид), которое удовлетворяет двум условиям, равно 2 (G).Следовательно, можно сделать вывод, что A был мутирован из G. Аналогичным образом, мутация A → G (голубой) может быть выведена с помощью того же процесса.
Это несоответствие позволяет узнать, что мутация была внесена во вторую строку.Аналогично, остаток пятого столбца при делении на 4 равен 3, обозначающему C. Однако нуклеотид четности должен быть A. Следовательно, можно обнаружить, что A является мутированным нуклеотидом. Чтобы вывести исходный нуклеотид, нуклеотид должен удовлетворять нуклеотидам четности (строка и столбец). Для второй строки остаток должен быть 2, потому что нуклеотид четности — G. Кроме того, для пятого столбца остаток должен быть 0, потому что нуклеотид четности — A. Следовательно, число (нуклеотид), которое удовлетворяет двум условиям, равно 2 (G).Следовательно, можно сделать вывод, что A был мутирован из G. Аналогичным образом, мутация A → G (голубой) может быть выведена с помощью того же процесса.
Обнаружение мутации и вычитание исходного нуклеотида. В этом зашифрованном сообщении ДНК были представлены две мутации (G → A, окрашенная в фиолетовый цвет, и A → G, окрашенная в голубой цвет). Мутации обнаруживали путем вычисления остатков и сравнения с нуклеотидами четности. Вычисление исходного нуклеотида может быть выполнено путем нахождения числа (нуклеотида), которое удовлетворяет числам четности строк и столбцов (нуклеотидов)
Мутации обнаруживали путем вычисления остатков и сравнения с нуклеотидами четности. Вычисление исходного нуклеотида может быть выполнено путем нахождения числа (нуклеотида), которое удовлетворяет числам четности строк и столбцов (нуклеотидов)
Распределения SNP у других видов
Стеганография ДНК доказала свою полезность с использованием SNP человека в этом исследовании.Для практического применения SNP должны быть доступны и для других видов. Поэтому наборы данных SNP для 311 видов были получены из dbSNP, а виды, которые имеют менее 70 SNP (SNP, которые могут быть любым из четырех нуклеотидов (A / T / G / C)), были отброшены. В результате я получил 53 вида бактерий, 11 видов растений, 13 видов млекопитающих, два вида насекомых и два вида рыб (рис. 4а, б). Это означает, что SNP широко доступны у многих видов, даже у бактерий, и стеганография ДНК, возможно, применима к любым видам, у которых есть SNP.
Рис. 4 Распределение SNP по видам. Наборы данных SNP других видов были получены из dbSNP, и их распределения общих SNP (синий) и доступных SNP (красный, SNP, которые могут быть любым из 4 нуклеотидов (A / T / G / C) и, таким образом, могут использоваться для стеганографии ДНК ) были проанализированы. Показаны номера SNP у видов бактерий ( a ) и других видов (растений, млекопитающих, насекомых и рыб) ( b )
Наборы данных SNP других видов были получены из dbSNP, и их распределения общих SNP (синий) и доступных SNP (красный, SNP, которые могут быть любым из 4 нуклеотидов (A / T / G / C) и, таким образом, могут использоваться для стеганографии ДНК ) были проанализированы. Показаны номера SNP у видов бактерий ( a ) и других видов (растений, млекопитающих, насекомых и рыб) ( b )
Если бы вы были секретным сообщением, где в геноме человека вы бы спрятались? — Такие романтические факты
Элли Эрроуэй (Джоди Фостер) использует VLA (очень большой массив) для поиска сигналов пришельцев.Но это не единственный выход. Warner Brothers
Когда люди думают о SETI, Поиске внеземного разума, они представляют себе сообщения, отправляемые по радио — Джоди Фостер настраивает антенны, надеясь уловить сигналы от «миллиардов и миллиардов» звездных систем, о которых размышлял Карл Саган. Потенциальные инопланетяне могут рассылать сообщения в космос, и все, что нам нужно сделать, это прислушаться к ним. Конечно, даже используя свет — самый быстрый из возможных носителей сигнала — нам все равно придется годами ждать, пока до нас дойдут сообщения даже от самых близких звезд.И это предполагает, что мы слушаем в самый подходящий момент 13,8-миллиардной истории Вселенной. Вероятность того, что разные цивилизации по всей галактике пересекаются настолько точно, что мы сможем прослушать прямо сейчас, сообщения инопланетян, может быть довольно низкой.
Конечно, даже используя свет — самый быстрый из возможных носителей сигнала — нам все равно придется годами ждать, пока до нас дойдут сообщения даже от самых близких звезд.И это предполагает, что мы слушаем в самый подходящий момент 13,8-миллиардной истории Вселенной. Вероятность того, что разные цивилизации по всей галактике пересекаются настолько точно, что мы сможем прослушать прямо сейчас, сообщения инопланетян, может быть довольно низкой.
Но есть еще один потенциальный способ посылать сигналы через космос, хотя и требующий большого терпения и опыта: хранение сообщений внутри генетического материала. Кодирование сообщения в организме или вирусе с последующей отправкой его в межзвездное путешествие на другие планеты требует долгого ожидания — могут потребоваться эоны, чтобы разумная жизнь эволюционировала на планете назначения, где сообщение ожидает, — но эти организмы, заполненные сообщение, терпеливы, и они плодовиты.Они незаметно воспроизводят, переносят и копируют сообщение, скрытое в их информационных магистралях. Пока однажды живое существо не обратит внимание на важное послание вокруг него (или даже внутри себя): « Вы не одиноки, ».
Пока однажды живое существо не обратит внимание на важное послание вокруг него (или даже внутри себя): « Вы не одиноки, ».
Если это звучит как что-то из научной фантастики, то это потому, что это так. Когда я учился в начальной и средней школе, мне нравился Star Trek: the Next Generation . Я вырос на этом. А в одном из последних сезонов в эфир вышла серия, в которой рассматривалась эта идея.
Сюжет этого конкретного эпизода вращается вокруг погони за частями генетического материала, который, как выясняется, существует во многих разумных видах, обычно встречающихся в Star Trek . Люди, клингоны, ромуланцы и многие другие оказываются родственниками общего предка, который поместил информацию о нашем происхождении — о том, что все наши планеты были засеяны биологической информацией от этого прародителя — в наших собственных наследственных геномах. Забавная идея, в которой персонажи отправлялись в шумную игру в стиле Индианы Джонса на поиски биологических образцов, необходимых для сборки генетической головоломки.
Эта история — не единственный пример этой концепции, которая появилась в научной фантастике достаточно, чтобы стать предметом пародии: персонажи онлайн-комикса Dresden Codak находят сообщение, спрятанное в земной ДНК, которое оказывается быть межзвездным письмом по цепочке, обещающим «невероятные призы» каждому, кто «переправит [s] это по крайней мере на ДВУХ из ваших [sic] любимых планет.”
Но у этой концепции также есть четкая научная родословная. Фрэнсис Крик, один из первооткрывателей структуры ДНК, думал о направленной панспермии — идее о том, что живое вещество было послано инопланетянами между звездами — и это всего лишь короткий мысленный прыжок к следующему шагу: отправке сообщений внутри этих звезд. живые существа. Фактически, вскоре после того, как в 1970-х годах был расшифрован первый полный геном, он был протестирован на наличие инопланетных сообщений.
Первым геномом, который был расшифрован, была короткая и простая генетическая последовательность бактериофага — вируса, поражающего бактерии, известного как ΦX174.Он заражает Escherichia coli , или, как выразительно выразились авторы исследования, «кишечную бактерию, населяющую толстую кишку единственных разумных существ на Земле». Авторы взяли кусок генома, который отвечает за кодирование двух разных белков, и попытались изучить его информацию на предмет любого потенциального сообщения. Этот раздел ДНК кодирует 121 аминокислоту (с тремя нуклеотидами или «буквами» ДНК для каждой аминокислоты), специальное число, которое кратно двум простым числам: если вы пытаетесь создать изображение из в этом разделе, где каждая аминокислота представлена одним пикселем, он всегда будет 11 пикселей в ширину и 11 пикселей вниз.Другого способа разделить нет. Исследователи попробовали несколько различных способов визуализации этого участка ДНК — например, закодировав две буквы ДНК как темный квадрат, а две другие как светлый, и рассматривая по одному нуклеотиду каждого триплета за раз. Они также посмотрели на некоторые другие части генома. К сожалению, ничего не выскочило. Авторы отметили некоторые недостатки своей работы — вирус, предназначенный для заражения одного конкретного вида на одной конкретной планете, с гораздо меньшей вероятностью будет выбран в качестве средства межзвездного сообщения, чем что-то, что может жить независимо, например, бактерия или гриб, но других геномов в то время просто не было.Они застряли в том, что у них было. Но поиски начались.
Они также посмотрели на некоторые другие части генома. К сожалению, ничего не выскочило. Авторы отметили некоторые недостатки своей работы — вирус, предназначенный для заражения одного конкретного вида на одной конкретной планете, с гораздо меньшей вероятностью будет выбран в качестве средства межзвездного сообщения, чем что-то, что может жить независимо, например, бактерия или гриб, но других геномов в то время просто не было.Они застряли в том, что у них было. Но поиски начались.
Несколько лет спустя обезьяний вирус исследовали на наличие внутри него звездной карты. А совсем недавно физик Пол Дэвис предложил искать сообщения в огромном количестве геномной информации, сгенерированной с тех пор, с помощью распределенной вычислительной сети, которую он сравнивает с [электронная почта защищена] — проектом NASA, который использует домашние компьютеры граждан для помощи в поиске. через кладези данных телескопа на предмет признаков разумных инопланетян.
Для многих из нас естественно искать секреты, надеемся ли мы на потайные проходы за книжными шкафами или карту, нацарапанную на обратной стороне Декларации независимости, как сказал бы Николас Кейдж.
Как существа, ищущие паттерны, мы воспринимаем паттерны, связи и структуры даже там, где их нет, явление, известное как апофения.
Генетик Джордж Черч показал, что информацию можно легко сохранить в ДНК: он и его команда использовали микрочип ДНК, чтобы записать целую книгу 70 миллиардов раз в ДНК.Они используют один нуклеотид для каждого бита информации, закодированной в двоичном формате, подобно тому, как исследователи, глядя на бактериофаг, подозревали, что умный инопланетянин может кодировать информацию.
ДНК стабильна при комнатной температуре и может сохраняться в течение длительного времени, что потенциально делает ее хорошим механизмом хранения информации. Но вот в чем загвоздка, как объясняет Черч: «Мы целенаправленно избегали живых клеток. В организме ваше сообщение представляет собой крошечную долю от целой клетки, поэтому теряется много места.Но что еще более важно, почти сразу после того, как ДНК входит в клетку, если эта ДНК не оправдывает себя, если она не является эволюционно выгодной, клетка начнет ее мутировать, и в конечном итоге клетка полностью ее удалит ».
Одно дело, когда кусок кристалла ДНК сидит где-то десятки тысяч лет. Но этот кусок, каким бы стабильным он ни был, невелик. Если вы хотите, чтобы он действительно работал как средство передачи сообщения, его необходимо воспроизводить и распространять. Значит, вам нужно вложить это во что-то живое.Но при этом, если сообщение не будет также полезно для организма, оно быстро превратится в забвение.
Если написать сообщение в лишних частях генома, то эти разделы могут просто случайным образом безнаказанно мутировать. Попробуйте вернуться через несколько миллионов лет и прочитать сообщение, и вы обнаружите ошибки, нанесенные граффити по всей информации. С другой стороны, если сообщение закодировано во что-то, что важно для функционирования организма, оно, вероятно, будет сохраняться с течением времени, но это сильно ограничит способ создания сообщения; Трудно вписать «Hello World» в генетическую последовательность, когда она также должна производить важный белок.Но, возможно, это единственный способ добиться такого результата.
Исследователи, изучавшие бактериальный вирус, ожидали этого, и это была одна из причин, по которой они исследовали область генома, отвечающую не за один, а за два белка. Эволюционное давление не позволяет ему изменяться с течением времени, поэтому он должен быть особенно стабильным.
Через много лет после моей первой встречи с этой идеей, когда я уже защитил докторскую диссертацию по вычислительной биологии, я вернулся к ней как к забавному мысленному эксперименту.Я решил проверить это на конкретном типе биологической информации: ультраконсервированных элементах. Это несколько сотен участков генома, длина которых превышает 200 букв ДНК, которые полностью или почти идентичны у многих разных животных — от людей до крыс — разделенных сотнями миллионов лет дивергентной эволюции. Если какое-либо место может содержать сообщение, то это могут быть цепочки информации, впервые изученные чуть более 10 лет назад. Я исследовал некоторые из этих последовательностей оснований ДНК, длина которых, как и 121, оказалась произведением двух простых чисел — в данном случае меня интересовали последовательности, которые могут создавать красивые квадратные или прямоугольные изображения. Я попытался визуализировать данные, чтобы каждое из четырех оснований ДНК было выделено другим цветом. Опять же, после беглого осмотра ничего не выскочило.
Я попытался визуализировать данные, чтобы каждое из четырех оснований ДНК было выделено другим цветом. Опять же, после беглого осмотра ничего не выскочило.
Но эпизод Star Trek получил это: семена, которые виды-прародители развили для исконных супов многих планет (которые в конечном итоге привели к гуманоидной жизни), также содержали послание. Когда дело доходит до ультраконсервированных элементов, многие из них, кажется, действительно обладают жизненно важными биологическими функциями, поэтому любое сообщение в них будет выполнять важную двойную функцию.Конечно, можно сохранить сообщение, даже если оно не делает ничего полезного, если вы сделаете много-много его копий в геноме. Но более вероятно, что совпадение функций и информации было бы гораздо более способным сохраняться в долгом путешествии между звездами и долгой задержке в эволюционном времени, ожидая кого-то, кто сможет прочитать сообщение.
Опять же, это может быть не более чем научная фантастика и что-то, что говорит о нашей психологии. Писатель-научный сотрудник Деннис Овербай сравнивает наше стремление найти секреты в нашей ДНК с воспроизведением записей Beatles в обратном порядке и прислушиванием к загадочным сообщениям. Для многих из нас естественно искать секреты, надеемся ли мы на потайные проходы за книжными шкафами или на карту, нацарапанную на обратной стороне Декларации независимости, как сказал бы Николас Кейдж.
Писатель-научный сотрудник Деннис Овербай сравнивает наше стремление найти секреты в нашей ДНК с воспроизведением записей Beatles в обратном порядке и прислушиванием к загадочным сообщениям. Для многих из нас естественно искать секреты, надеемся ли мы на потайные проходы за книжными шкафами или на карту, нацарапанную на обратной стороне Декларации независимости, как сказал бы Николас Кейдж.
Но в мире так не всегда. Как существа, ищущие паттерны, мы воспринимаем паттерны, связи и структуры даже там, где их нет — явление, известное как апофения .
Тем не менее, если эти сообщения, скрытые в какой-то земной ДНК, действительно существуют, потребуется время и терпение, чтобы это определить. Возможно, как утверждал Дэвис, настало время для масштабных усилий по прочесыванию всей оцифрованной геномной информации, которую мы сгенерировали. Проект с открытым исходным кодом, который делает именно это, будет интересен тем, кто интересуется как астрономией, так и биологией, независимо от того, принесет ли он какие-либо результаты или нет.
Но одно вероятно. Любое сообщение, которое будет найдено, будет обнаружено в регионах, наиболее важных для нашего выживания: тех, которые гарантируют, что мы сможем передать наши гены следующему поколению.Что-нибудь меньшее, и это, вероятно, было бы давно сметено постоянным всплеском эволюции.
Сэмюэл Арбесман — старший научный сотрудник Центра права, технологий и предпринимательства Silicon Flatirons при Университете Колорадо и автор книги «Half-Life of Facts».
ученых наконец завершили геном человека
Спустя два десятилетия после того, как с большой помпой был обнародован проект последовательности генома человека, команда из 99 ученых наконец-то расшифровала все.Они заполнили огромные пробелы и исправили длинный список ошибок в предыдущих версиях, дав нам новый взгляд на нашу ДНК.
За последние недели консорциум разместил в Интернете шесть статей, в которых описывается полный геном. Эти столь востребованные данные, которые сейчас анализируются научными журналами, дадут ученым более глубокое понимание того, как ДНК влияет на риски заболеваний, говорят ученые, и как клетки удерживают ее в аккуратно организованных хромосомах, а не в молекулярных клубках.
Например, исследователи обнаружили более 100 новых генов, которые могут быть функциональными, и определили миллионы генетических вариаций между людьми.Некоторые из этих различий, вероятно, играют роль в заболеваниях.
Для Николаса Альтемоза, постдокторанта Калифорнийского университета в Беркли, который работал в команде, вид полного генома человека напоминает фотографии Плутона крупным планом с космического зонда New Horizons.
«Вы могли видеть каждый кратер, вы могли видеть каждый цвет из чего-то, о чем мы раньше имели лишь самое смутное представление», — сказал он. «Это просто сбылась абсолютная мечта.
Эксперты, не участвовавшие в проекте, заявили, что он позволит ученым гораздо более детально изучить геном человека. Большие фрагменты генома, которые раньше были пустыми, теперь расшифрованы настолько четко, что ученые могут приступить к их серьезному изучению.
«Результат этих усилий по секвенированию потрясающий, — сказал Юкико Ямасита, биолог развития из Института биомедицинских исследований Уайтхеда при Массачусетском технологическом институте.
Хотя ученым на протяжении десятилетий было известно, что гены распределены по 23 парам хромосом, эти странные, похожие на червя микроскопические структуры оставались в значительной степени загадкой.
К концу 1970-х ученые получили возможность точно определять несколько отдельных человеческих генов и расшифровывать их последовательность. Но их инструменты были настолько примитивны, что поиск одного гена мог занять целую карьеру.
К концу 20 века международная сеть генетиков решила попытаться секвенировать всю ДНК в наших хромосомах. Проект «Геном человека» был смелым начинанием, учитывая, насколько много нужно было секвенировать. Ученые знали, что двойные нити ДНК в наших клетках содержат примерно три миллиарда пар букв — текста, достаточного для заполнения сотен книг.
Когда эта команда начинала свою работу, ученые могли использовать лучшие технологии, которые могли использовать секвенированные биты ДНК длиной всего несколько десятков букв или оснований. Исследователям оставалось сложить их вместе, как кусочки огромной головоломки. Чтобы собрать пазл, они искали фрагменты с одинаковыми концами, то есть происходили из перекрывающихся частей генома. Им потребовались годы, чтобы постепенно собрать секвенированные фрагменты в более крупные полосы.
Чтобы собрать пазл, они искали фрагменты с одинаковыми концами, то есть происходили из перекрывающихся частей генома. Им потребовались годы, чтобы постепенно собрать секвенированные фрагменты в более крупные полосы.
Белый дом объявил в 2000 году, что ученые завершили первый набросок генома человека, и подробности этого проекта были опубликованы в следующем году.Но длинные участки генома оставались неизвестными, в то время как ученые изо всех сил пытались выяснить, где принадлежат миллионы других оснований.
Оказалось, что загадку генома очень сложно собрать из маленьких кусочков. Многие из наших генов существуют в виде нескольких копий, которые почти идентичны друг другу. Иногда разные копии выполняют разную работу. Другие копии, известные как псевдогены, отключаются мутациями. Короткий фрагмент ДНК одного гена может так же хорошо вписаться в другие.
И гены составляют лишь небольшой процент генома. Остальное может быть еще более непонятным. Большая часть генома состоит из вирусоподобных участков ДНК, которые существуют в основном для того, чтобы создавать новые копии самих себя, которые вставляются обратно в геном.
В начале 2000-х ученые немного лучше научились складывать головоломку генома из ее крошечных кусочков. Они сделали больше фрагментов, прочитали их более точно и разработали новые компьютерные программы, чтобы собрать их в более крупные фрагменты генома.
Периодически исследователи представляли последний, лучший проект генома человека, известный как эталонный геном. Ученые использовали эталонный геном в качестве ориентира для своих собственных усилий по секвенированию. Например, клинические генетики каталогизируют мутации, вызывающие болезни, сравнивая гены пациентов с эталонным геномом.
Новейший эталонный геном вышел в 2013 году. Он был намного лучше, чем первый черновик, но был далек от завершения. Восемь процентов было просто пустым.
«По сути, пропала вся хромосома человека», — сказал Майкл Шац, вычислительный биолог из Университета Джона Хопкинса.
В 2019 году два ученых — Адам Филлиппи, вычислительный биолог из Национального института исследования генома человека, и Карен Мига, генетик из Калифорнийского университета в Санта-Крус, — основали Консорциум теломер-теломер для завершения генома.
Доктор Филлиппи признал, что отчасти его мотивация для такого смелого проекта заключалась в том, что его раздражали отсутствующие пробелы.«Они просто меня очень раздражали», — сказал он. «Вы берете красивый пейзажный пазл, вытаскиваете сотню кусочков и смотрите на него — это очень надоедает перфекционисту».
Доктор Филлиппи и доктор Мига призвали ученых присоединиться к ним, чтобы решить загадку. В итоге 99 ученых работали непосредственно над секвенированием генома человека, и еще десятки пытались разобраться в данных. Исследователи работали удаленно во время пандемии, координируя свои усилия с помощью приложения для обмена сообщениями Slack.
«Это была удивительно красивая колония муравьев», — сказал доктор Мига.
Консорциум воспользовался преимуществами новых машин, которые могут считывать участки ДНК длиной в десятки тысяч оснований. Исследователи также изобрели методы, позволяющие определить место в геноме особенно загадочных повторяющихся последовательностей.
В общей сложности ученые добавили или зафиксировали более 200 миллионов пар оснований в эталонном геноме. Теперь они могут с уверенностью сказать, что человеческий геном измеряет 3.Длина 05 миллиардов пар оснований.
В этих новых последовательностях ДНК ученые обнаружили более 2000 новых генов. Похоже, что большинство из них отключены в результате мутаций, но 115 из них выглядят так, как будто они могут производить белки — функцию которых ученым, возможно, потребуются годы, чтобы выяснить. По оценкам консорциума, геном человека содержит 19 969 генов, кодирующих белок.
Когда, наконец, собран полный геном, исследователи смогут лучше изучить вариации ДНК от одного человека к другому.Они обнаружили более двух миллионов новых точек в геноме, в которых люди отличаются. Использование нового генома также помогло им избежать выявления связанных с болезнью мутаций там, где их фактически нет.
«Это большой шаг вперед в этой области», — сказал доктор Мидхат Фаруки, директор по молекулярной онкологии в больнице Children’s Mercy в Канзас-Сити, штат Миссури, не принимавший участия в проекте.
Доктор Фаруки начал использовать геном для своих исследований редких детских болезней, сравнивая ДНК своих пациентов с недавно заполненными пробелами для поиска мутаций.
Однако переход на новый геном может стать проблемой для многих клинических лабораторий. Им придется перенести всю свою информацию о связях между генами и болезнями на новую карту генома. «Это будет большая работа, но это займет пару лет», — сказала доктор Шэрон Плон, медицинский генетик из Медицинского колледжа Бейлора в Хьюстоне.
Доктор Альтемоз планирует использовать полный геном для исследования особенно загадочной области в каждой хромосоме, известной как центромера.Вместо хранения генов центромеры закрепляют белки, которые перемещают хромосомы вокруг клетки при ее делении. Область центромеры содержит тысячи повторяющихся сегментов ДНК.
При первом взгляде на них доктор Альтемоз и его коллеги были поражены тем, насколько разные центромеры могут быть у разных людей. Это наблюдение предполагает, что центромеры быстро эволюционируют, поскольку мутации вставляют новые части повторяющейся ДНК в области или вырезают другие части.
Хотя часть этой повторяющейся ДНК может играть роль в разделении хромосом, исследователи также обнаружили новые сегменты, некоторые из которых имеют длину в миллионы оснований, которые, по-видимому, не задействованы.«Мы не знаем, что они делают, — сказал доктор Альтемоз.
Но теперь, когда пустые зоны генома заполнены, доктор Альтемоз и его коллеги могут изучить их поближе. «Я очень рад двигаться вперед, чтобы увидеть все, что мы можем открыть», — сказал он.
Пунктурирующие сообщения, закодированные в геноме человека
изображение: Недавнее исследование, опубликованное в Proceedings of the National Academy of Sciences и проведенное группой исследователей из Технологического института Джорджии и Aelan Cell Technologies, выявило регулирующие элементы, которые позволяют создавать разнообразный спектр разных типов клеток с разной генетической информацией. посмотреть еще
посмотреть еще
Кредит: Aelan Cell Technologies
Сан-Франциско, Калифорния — Начиная с классических исследований Джейкоба и Моно в начале 1960-х годов стало очевидно, что последовательности генома содержат не только схемы генов и белков, которые они кодируют, но также инструкции для скоординированной регуляторной программы, которая управляет когда, где и в какой степени экспрессируются эти гены и белки. Выполнение этого регуляторного кода позволяет создавать очень разные типы клеток и тканей из одного и того же набора генетических инструкций, обнаруженных в ядре каждой клетки.Недавнее исследование, опубликованное в PNAS (27 июля 2015 г.), показывает, что критические аспекты этой регуляторной программы кодируются элементами геномной последовательности, которые ранее считались просто «мусорной ДНК» без важных функций.
Подавляющая часть генома человека (~ 98% всей генетической информации) не предназначена для кодирования белков, и эта некодирующая последовательность изначально была обозначена как «мусорная ДНК», чтобы подчеркнуть отсутствие у нее очевидной функции. Большая часть так называемой мусорной ДНК в наших геномах накапливалась в течение эволюционного времени из-за активности ретротранспортируемых элементов (RTE), которые способны перемещаться (транспонироваться) из одного места в другое в геноме и создавать копии самих себя, когда они Сделай так.Эти элементы считаются геномными паразитами, которые существуют благодаря своей способности воспроизводить себя в большом количестве в геномах, не обеспечивая при этом никакой полезной функции для хозяев, в которых они проживают. Однако недавние исследования RTE показали, что они на самом деле могут кодировать важные функции, и большая часть их функциональной активности оказывается связана с тем, как регулируются геномы. RTE связаны с функцией стволовых клеток, дифференцировкой тканей, прогрессированием рака и, в конечном итоге, со старением и возрастными патологиями.
Большая часть так называемой мусорной ДНК в наших геномах накапливалась в течение эволюционного времени из-за активности ретротранспортируемых элементов (RTE), которые способны перемещаться (транспонироваться) из одного места в другое в геноме и создавать копии самих себя, когда они Сделай так.Эти элементы считаются геномными паразитами, которые существуют благодаря своей способности воспроизводить себя в большом количестве в геномах, не обеспечивая при этом никакой полезной функции для хозяев, в которых они проживают. Однако недавние исследования RTE показали, что они на самом деле могут кодировать важные функции, и большая часть их функциональной активности оказывается связана с тем, как регулируются геномы. RTE связаны с функцией стволовых клеток, дифференцировкой тканей, прогрессированием рака и, в конечном итоге, со старением и возрастными патологиями.
Исследование Wang et al. недавно опубликованный в PNAS (27 июля 2015 г.) предлагает новый взгляд на роль, которую последовательности, производные от RTE, играют в точном выполнении регуляторной программы генома человека. Это исследование показало, что один конкретный класс RTE — вкрапленные повторы на уровне млекопитающих (MIR) — может служить в качестве генетических ориентиров, которые помогают нацеливать определенные регуляторные механизмы на большое количество геномных сайтов и тем самым вести к скоординированной регуляции генов, расположенных поблизости. эти сайты.
Это исследование показало, что один конкретный класс RTE — вкрапленные повторы на уровне млекопитающих (MIR) — может служить в качестве генетических ориентиров, которые помогают нацеливать определенные регуляторные механизмы на большое количество геномных сайтов и тем самым вести к скоординированной регуляции генов, расположенных поблизости. эти сайты.
Это открытие было инициировано группой вычислительных биологов во главе с доктором Кингом Джорданом, адъюнкт-профессором и директором программы выпускников биоинформатики Технологического института Джорджии, которая выполнила анализ «больших данных» огромных наборов данных, созданных сотнями ученых из десятков лабораторий по всему миру, работающих в рамках проекта «Энциклопедия элементов ДНК» или ENCODE. Их всесторонний и комплексный анализ данных, проведенный в первую очередь доктором Дж.Цзянжун Ван из команды доктора Джордана позволил им точно определить местоположение тысяч отдельных элементов MIR в геноме человека, которые, по-видимому, функционируют как так называемые «граничные элементы» в Т-лимфоцитарных клетках иммунной системы.
Граничные элементы представляют собой эпигенетические регуляторные последовательности, которые отделяют транскрипционно активные области человеческого генома от транскрипционно молчащих областей специфическим для клеточного типа образом. При этом эти критические регуляторные элементы помогают обеспечить отличную идентичность для разных типов клеток, хотя все они содержат идентичные наборы информации.Регуляторные программы, лежащие в основе этих специфичных для клеток и тканей функций и идентичностей, в значительной степени основаны на упаковке генома. Гены, которые не должны экспрессироваться в данной клетке или ткани, расположены в плотно упакованных областях генома и недоступны для факторов транскрипции, которые в противном случае могли бы их включить. Эти граничные элементы помогают установить географию упаковки генома, очерчивая границы между молчащими регионами, в которых гены не экспрессируются, и активными регионами, в которых они находятся.В этой важной роли граничные элементы помогают контролировать время и степень экспрессии генов по всему геному. В результате дефекты в организации генома граничными элементами имеют большое значение для физиологических и патологических процессов.
В результате дефекты в организации генома граничными элементами имеют большое значение для физиологических и патологических процессов.
«Наши коллеги из Технологического института Джорджии смогли развить наше раннее открытие, что другой класс ретротранспозонов, элемент SINEB2, может обеспечивать граничную функцию в локусе гормона роста мышей», — сказал д-р.Виктория Луняк, генеральный директор компании Aelan Cell Technologies, исследовательская группа которой сотрудничала с лабораторией Иордании над этим проектом.
«Мы случайным образом отобрали целую группу последовательностей MIR, которые, по прогнозам Иорданской лаборатории, будут служить в качестве граничных элементов, и экспериментально подтвердили их активность в линиях клеток мышей и, с помощью наших испанских сотрудников, в рыбе-зебре при эмбриональном развитии», — сказал доктор. — сказал Луняк. «Это тестирование показало, что последовательности MIR могут служить знаками препинания в нашем геноме, которые позволяют клеткам правильно читать и понимать сообщение, передаваемое геномными последовательностями. «
«
«Особенно поразительно то, что эти знаки препинания, как их называет Виктория, играют роль, глубоко сохраненную эволюционным путем», — сказал д-р Джордан. «Те же самые точные последовательности MIR были способны функционировать как границы в лимфоцитах CD4 + человека, в моделях клеток мышей и у рыбок данио».
«Это важное открытие, потому что понимание того, как RTE перемежает сообщения, закодированные в геноме человека, может помочь исследователям в разработке методов лечения широкого спектра заболеваний человека, включая старение», — добавил д-р.Луняк
Старение характеризуется рядом глобальных изменений в организации и функции генома, и связанные со старением дефекты в том, как наш геном упакован, могут иметь серьезные патологические последствия. В частности, возрастные дефекты упаковки генома могут значительно повысить уязвимость генома к повреждению. На основе открытий, опубликованных в их статье PNAS , лаборатория Иордании в Технологическом институте Джорджии и команда Луняк из Aelan Cell Technologies и их партнер Nuclea Biotechnologies в настоящее время работают над разработкой новых диагностических и терапевтических стратегий, нацеленных на критически важные роли эпигенетических регуляторы, такие как человеческие ретротранспозоны, в координации регуляторных программ, специфичных для клеточного типа.
Исследование было опубликовано в журнале Proceedings Национальной академии наук , США.
###
Журнал
Труды Национальной академии наук
Заявление об отказе от ответственности: AAAS и EurekAlert! не несут ответственности за точность выпусков новостей, размещенных на EurekAlert! участвующими учреждениями или для использования любой информации через систему EurekAlert.
Следы бессмысленного замысла в человеческом геноме
Абстракция
Интеллектуальный замысел (ID) — последнее воплощение религиозного креационизма — утверждает, что сложные биологические особенности не возникли постепенно в результате естественных эволюционных сил, а были созданы. ex nihilo когнитивным агентом. Тем не менее, многие сложные биологические черты неоправданно усложняются, плохо функционируют и ослабляют своих носителей. Более того, такие дисфункциональные черты изобилуют не только фенотипами, но и геномами эукариотических видов.Здесь я выделяю несколько диковинных особенностей человеческого генома, которые не поддаются идее идентификации со стороны заботливого когнитивного агента. Они варьируются от мутационных сбоев de novo, которые коллективно убивают или калечат бесчисленное количество людей (включая эмбрионы и зародыши), до всеобъемлющих архитектурных недостатков (включая псевдогены, паразитические мобильные элементы и излишне причудливые регуляторные пути), которые являются эндогенными в каждом геноме человека. Грубое несовершенство на молекулярном уровне представляет собой загадку для традиционных парадигм естественного богословия, а также для недавних утверждений ИД, но оно согласуется с понятием бессмысленных изобретений эволюционных сил.
ex nihilo когнитивным агентом. Тем не менее, многие сложные биологические черты неоправданно усложняются, плохо функционируют и ослабляют своих носителей. Более того, такие дисфункциональные черты изобилуют не только фенотипами, но и геномами эукариотических видов.Здесь я выделяю несколько диковинных особенностей человеческого генома, которые не поддаются идее идентификации со стороны заботливого когнитивного агента. Они варьируются от мутационных сбоев de novo, которые коллективно убивают или калечат бесчисленное количество людей (включая эмбрионы и зародыши), до всеобъемлющих архитектурных недостатков (включая псевдогены, паразитические мобильные элементы и излишне причудливые регуляторные пути), которые являются эндогенными в каждом геноме человека. Грубое несовершенство на молекулярном уровне представляет собой загадку для традиционных парадигм естественного богословия, а также для недавних утверждений ИД, но оно согласуется с понятием бессмысленных изобретений эволюционных сил. В этом важном философском смысле наука об эволюционной генетике должна справедливо рассматриваться как союзник (а не противник) основных религий, поскольку она помогает последним избежать глубоких теологических загадок, связанных с понятиями ИД.
В этом важном философском смысле наука об эволюционной генетике должна справедливо рассматриваться как союзник (а не противник) основных религий, поскольку она помогает последним избежать глубоких теологических загадок, связанных с понятиями ИД.
Результатом этих кумулятивных усилий по исследованию клетки — исследованию жизни на молекулярном уровне — стал громкий, ясный, пронзительный крик «замысел!» Результат настолько однозначен и настолько значим, что его следует причислить к одному из величайших достижений в истории науки.… Наблюдение за разумным устройством жизни столь же важно, как наблюдение, что Земля вращается вокруг Солнца или что болезнь вызывается бактериями…
Майкл Бихи (ссылка 1, стр. 232–233)
Майкл Предполагаемый биохимический вызов эволюции Бихи основан на утверждении, что дарвиновские механизмы просто неадекватны для объяснения существования сложных биохимических машин. Он не только ошибается, он ошибается самым ярким образом.
Биохимические машины, происхождение которых он считает столь загадочным, на самом деле предоставляют нам убедительные и убедительные примеры эволюции в действии.
Кеннет Миллер (ссылка 2, стр. 160)
В «Черном ящике Дарвина » биохимик Майкл Бих (1) бросил вызов эволюционной биологии, заявив, что различные молекулярные аппараты внутри клеток «неразрешимо сложны» и, следовательно, могло быть создано целенаправленно только высшим разумом. Нет никаких сомнений в том, что молекулярные системы могут быть удивительно сложными, но большинство генетиков приписывают такую биологическую сложность кумулятивным эффектам эволюционного вмешательства естественных сил (включая бездумный управляющий агент, естественный отбор), а не сознательной инженерии сверхъестественной сущностью.В поддержку этого утверждения биологи-эволюционисты проанализировали генетические механизмы и возможные поэтапные филогенетические истории, с помощью которых сложные биологические особенности [в том числе некоторые, которые Бихи считал неснижаемо сложными, такие как глаз (3, 4), бактериальный flagellum (5⇓ – 7) и биохимические устройства свертывания крови (2, 8)] каждый мог постепенно развиваться из более простых систем предшественников.
Однако каждый год мы становимся свидетелями возобновления давления на издателей учебников, а также на государственные и местные советы по образованию с целью включения интеллектуального замысла (ID) в учебные программы государственных школ по естествознанию.В последние десятилетия суды в США обычно выносили решения против подобных креационистских инициатив на том основании, что правительство не должно поддерживать определенные религиозные верования (9) (Таблица 1). Однако социальное давление продолжается не только со стороны евангелического христианства, но и со стороны фундаменталистских ветвей некоторых других религий, включая ислам (10, 11). Эта ситуация свидетельствует о значительной глобальной симпатии к ИД (а также о глубоком непонимании общественностью эволюционной биологии), несомненно, усугубляемой интуитивным призывом задействовать высший разум для объяснения превосходных адаптаций, таких как глаз позвоночных.На поверхностном уровне хорошо работающие адаптивные черты легко рационализировать; Людям креационистского толка нужно только призвать внимательное мастерство любящего Бога, тогда как люди с научным складом ума могут задействовать бессознательный агент, естественный отбор. И Бог-Создатель, и естественный отбор являются мощными формирующими силами, которые, как можно ожидать, превратили прекрасную функциональность и эффективность в сложные биологические особенности, такие как геном человека. Гораздо более серьезная проблема — как для сторонников ИД, так и для ученых — состоит в том, чтобы объяснить сложные биологические особенности, которые действуют неэффективно или даже открыто не работают.При более внимательном рассмотрении геном человека сам становится ярким примером очень сложной характеристики с серьезными молекулярными недостатками.
Таблица 1.Решения или выдержки из четырех самых известных судебных дел, связанных с попытками санкционировать обучение креационистов или исключить эволюционную биологию из учебных классов (9)
Эскизы историй трех видов древнего мира
Естественное богословие и аргумент замысла.
До Дарвина большинство ученых и богословов принимали то, что казалось очевидным: божественное вмешательство должно было лежать в основе замысла природы.Стандартный «аргумент от замысла» восходит, по крайней мере, к классическому греческому философу Сократу (12). Действительно, в последние столетия и, конечно же, в западных культурах распространено мнение, что религия и биологические исследования были интеллектуальными союзниками в великой миссии по объяснению и тем самым прославлению Бога и Его творений. Ученые и религиозные лидеры часто разделяли убеждение, что тщательное изучение природы подтвердит изобретение Бога и контроль над жизнью. Многие ученые были признанными деистами, и многие священнослужители были также учеными, все вместе участвовали в подтверждении Бога посредством рационального исследования (которое часто рассматривалось как полезное дополнение к традиционным знаниям о Боге из евангельских истин и религиозных откровений).Когда в теологии высказывались возражения против науки (а они часто были), они обычно исходили из представления о том, что было еретическим или даже опасным (учитывая гневный Бог) стремиться эмпирически доказать то, что не требует доказательств: величие Бога, как подробно описано в Священное Писание.
В 1802 году преподобный Уильям Пейли (13) опубликовал красноречивую и содержательную книгу ( Natural Theology ), в которой формально объяснялось, чего многие ученые его эпохи стремились достичь в своих исследованиях природы: доказательство и прославление величия Бога посредством эмпирических исследований. его работ.Эти биологи (т.е.теологи-естественники) обычно исходили из двух предпосылок: красота и сложность жизни были prima facie свидетельством творческой силы Бога и что, тщательно анализируя живую природу, они неизбежно превозносят Бога и, возможно, лучше понимают Его намерения. Эти темы получили дальнейшее развитие в последующих трактатах Бриджуотера , наборе из восьми работ различных экспертов в области биологии, геологии и физики, опубликованных между 1833 и 1840 годами. Эти книги были написаны по заказу преподобного Фрэнсиса Генри, графа Бриджуотера, который умер в 1829 году, но его последняя воля и завещание поощряли и финансировали уважаемых ученых к написанию трактатов «о силе, мудрости и доброте Бога, проявленных в Сотворении мира».
Сам Дарвин был прирожденным теологом, когда сел на HMS Beagle в 1831 году. Позже он вспоминает в своей автобиографии, что логика Пэли «доставила мне столько же удовольствия, как и Евклид», и что это была «часть академического курса». [в Кембриджском университете], который … больше всего помог мне в воспитании моего ума ». Пятилетнее путешествие на HMS Beagle окажется роковым путешествием — не только для Дарвина, но и для человечества — в ранее неизведанные воды науки и философии.Позже объяснение Дарвином естественного отбора положило начало революционной парадигме в биологии, в которой биологические результаты (виды и особенности, которыми они обладают) могли быть поняты как продукты естественных сил (а не сверхъестественного), которые полностью поддаются критическому научному анализу. Дарвиновская революция сделала для биологии то же, что революция Коперника тремя столетиями ранее сделала для физических наук: позволила интерпретировать работу Вселенной как отражение естественных законов, которые можно было бы изучить и проверить с помощью объективных научных гипотез, наблюдений и экспериментов (14). , 15).
Креационизм и ид.
Креационизм во многих его проявлениях также является древней человеческой философией. В самом деле, почти все человеческие культуры и религии имели свои собственные мифологии творения: о происхождении жизни в целом и / или о генах человека в частности (16, 17). Естественное богословие (как описано ранее) и его ответвление, ID, как правило, были движениями внутри христианства, но многие другие культуры придерживались схожих взглядов на то, как Бог-Создатель или боги сознательно манипулируют биологическим миром.Современная идентификационная версия естественного богословия может быть приурочена к публикации в 1984 году книги Тайна происхождения жизни (18). Этот проект был поддержан Фондом мысли и этики (FTE), христианской организацией из Далласа. Книга была призвана осветить трудности с научным объяснением происхождения жизни; действительно, он категорически утверждал, что жизнь не может возникнуть естественными причинами. Вскоре FTE спонсировала школьный учебник « Of Pandas and People » (19), который также враждебно относился к научным свидетельствам эволюции.
Движение ID получило поддержку СМИ после публикации в 1991 г. книги Darwin on Trial (20), которая, хотя и была антиэволюционистской по своей позиции, имела более серьезную ауру учености и не рекламировала жесткие креационистские мантры (например, , молодая Земля, всемирный потоп), которые были явно несостоятельны с научной точки зрения. В том же году консервативный аналитический центр, известный как Discovery Institute (DI), открыл магазин в Сиэтле. С того времени DI в значительной степени вытеснил FTE в качестве основного центра деятельности для движения ID в Северной Америке.Еще одна заслуживающая внимания публикация в движении ID — это книга Уильяма Дембски «Нет бесплатного обеда: почему указанная сложность не может быть приобретена без разведки» (21). Это перекликается с утверждениями креационистов о том, что сложные биологические черты не могут возникнуть в результате естественных эволюционных процессов, и призваны подтвердить их. Тем не менее, современная идентификационная книга, возможно, имеющая наибольшее влияние на публику, — это Черный ящик Дарвина (1), в котором биохимик Майкл Бихи ввел термин неснижаемая сложность .Согласно Бихи, клеточная структура или другая биологическая особенность является неснижаемой сложностью, если удаление любой из ее частей приводит к потере функции. Такая структура, утверждает Бихи, не могла развиваться постепенно путем естественного отбора, а должна была быть спроектирована — целиком и для ее нынешней роли — разумным агентом. Этот агент не указан; однако здесь явно говорится о Боге. Аргументы Бихи в «Черный ящик Дарвина» , хотя и сформулированы уникальным языком и метафорами и применяются на уникальном фенотипическом уровне биохимии и молекул, по сути повторяют мнение Пэли в Natural Theology (13).
Эти и другие публикации сообщества ID были опровергнуты в научной литературе, и я не собираюсь здесь повторять обширные доказательства того, как естественный отбор в сочетании с другими бессмысленными эволюционными силами может приводить к сложной адаптации. Вместо этого я сосредоточен в этой статье на относительно игнорируемой категории аргументов против ИД и в пользу эволюции: аргументе от несовершенства в применении к человеческому геному в данном случае.
Теодицея.
Теодицея (от греческих корней theós для Бога и dik для справедливости) — это оборотная сторона или темная сторона естественного богословия. Это формальный термин для философских попыток оправдать святость и справедливость Бога в установлении мира, изобилующего бедствиями и бедами. На протяжении веков богословы размышляли, почему любящее и всемогущее божество допускает человеческие страдания. Что касается человеческих фенотипов, почему Бог допускает диабет, сердечные приступы, геморрой, ретинированные зубы мудрости, трудные роды или проблемы со спиной (не говоря уже о поведенческих недостатках, этических недостатках и смерти)? Для некоторых христианских конфессий выход из этой головоломки состоит в том, чтобы утверждать, что такие слабости являются результатом падения человечества из-за Благодати в Эдемском саду.У других религий есть свои собственные объяснения. То же самое и с биологическими науками. С научной точки зрения, биологические недостатки человека (и других видов) являются понятным побочным продуктом эволюции бессознательных и безразличных сил природы. Есть много веских научных причин, почему ожидается, что биологические результаты эволюции путем естественного отбора обычно не дотягивают до дизайнерского совершенства (Таблица 2).
Таблица 2.Некоторые причины, по которым эволюция обычно дает неоптимальные биологические результаты
Теодицея и связанный с ней «контраргумент замыслу» также имеют долгую историю (вероятно, столь же древнюю, как человеческий вид).В 1779 году шотландский философ-историк Дэвид Хьюм лаконично уловил эту идею в словесном обмене между двумя своими вымышленными персонажами в книге «Диалоги о естественной религии ». , хотя и обладал гораздо большими способностями, соразмерными величию проделанной им работы … Только этим аргументом мы сразу же доказываем существование Божества.
[Филон]: Какое удивление мы должны развлечь, когда находим его глупым механиком.
Сам Дарвин прекрасно понимал (и временами казался огорченным), что биологическое несовершенство является мощным контраргументом против ИД. В главе 14 книги «Происхождение видов посредством естественного отбора» (22):
он писал о том, что каждое органическое существо и каждый отдельный орган были специально созданы, насколько совершенно необъяснимо то, что части … должны так часто несут на себе печать бесполезности.
Он также знал, что биологическая эволюция бессмысленных сил природы, в сущности, может облегчить большую часть теодического парадокса.
Геном человека
В 2001 году был опубликован первый проект последовательности генома человека (23, 24). Ее длина составляла около 3 миллиардов пар нуклеотидов, что примерно в 50 000 раз больше, чем длина статьи, которую вы сейчас читаете (если каждый буквенный символ или пробел можно приравнять к паре нуклеотидов). Геном человека, секвенированный исследователями в 2001 году, на самом деле представлял собой совокупность последовательностей ДНК, собранных у разных людей; однако в совокупности он представлял один «геномный эквивалент» нашего вида.В 2007 году был полностью секвенирован полный геном одного человека (25), и вскоре последовали аналогичные отчеты о последовательностях полногенома других людей (например, 26, 27). Недавно был объявлен проект Personal Genome Project (28), цель которого — использовать быстрое секвенирование ДНК для сбора многочисленных геномных последовательностей человека. Такие исследования — это всего лишь последнее поколение научных исследований в области генетики и биохимии человека, начавшееся около столетия назад.
Извечная дилемма теодицеи традиционно была мотивирована человеческими слабостями на наблюдаемых уровнях морфологии и поведения.Распространяются ли биологические недостатки и на молекулярный уровень? Особенно за последние полвека ученые ответили на этот вопрос окончательно, утвердительно. Далее я опишу несколько сложных особенностей генома человека, которые дают убедительные доказательства отсутствия идентификации, а затем я закончу, выделив некоторые философские разветвления этих молекулярных открытий. Для более полного рассмотрения всех этих тем см. Исх. 29.
Ошибочный дизайн: последовательности ДНК, кодирующие белок
К началу 1900-х годов врачи начали понимать, что биохимические нарушения в организме человека могут вызывать физические недомогания и аномалии.Арчибальд Гаррод был пионером этого революционного взгляда в двух новаторских книгах: Врожденные ошибки метаболизма, (1909) и Врожденные факторы наследственных заболеваний, (1931). В книге Inborn Errors of Metabolism Гаррод подробно описал то, что тогда было известно о биохимии и наследовании четырех атипичных человеческих состояний: альбинизма, алкаптонурии, цистинурии и пентозурии. Сегодня мы знаем, например, что алкаптонурия — это редкое заболевание (1 из 200 000 рождений), вызванное биохимическим дефектом (в пути деградации фенилаланина и тирозина), который, в свою очередь, является результатом различных мутационных дефектов в гене, кодирующем оксидазу гомогентизиновой кислоты. который в противном случае катализирует распад гомогентизиновой кислоты.По мере того, как эта кислота накапливается, она необратимо связывается с коллагеном в организме пациента, в конечном итоге вызывая дегенеративный артрит в крупных суставах и позвоночнике, обычно начинающийся в среднем возрасте. До Гаррода это и многие другие расстройства часто приписывали неземным или мистическим явлениям, таким как плохая карма или злобные демоны. После Гаррода медицинские работники начали понимать, что тщательное научное исследование метаболических нарушений может выявить их механистическую (генетическую и биохимическую) основу и, возможно, когда-нибудь даже привести к лечению или излечению.
Современный аналог Inborn Errors of Metabolism был запущен в 1960 году с публикацией The Metabolic Basis of Inherited Disease (30). С тех пор книга увидела более полудюжины обновленных изданий (примерно с 6-летними интервалами), а название работы также расширилось до Метаболические и молекулярные основы наследственных заболеваний ( MMBID ), что отражает недавний взрывной рост. данных о последовательности ДНК и белков. Недавнее издание MMBID включает более 6000 страниц в четырех томах.В 255 главах, каждая из которых посвящена отдельному наследственному заболеванию или набору связанных генетических нарушений, ведущие биомедицинские эксперты обобщают текущие знания о молекулярных механизмах, лежащих в основе врожденных болезней человека. Они фокусируют внимание на генетической основе каждого заболевания, а также на структуре и функции белкового продукта каждого гена. Более 500 хорошо охарактеризованных генетических заболеваний описаны с поразительной детализацией, и это число будет только резко расти по мере того, как медицинская профессия продвигается дальше в эру геномики.Правдоподобное предположение состоит в том, что по крайней мере некоторые вредные мутации существуют где-то у человека в каждом из ≈24000 локусов, кодирующих белок.
Мутационные дефекты, описанные в MMBID , встречаются почти во всех операционных категориях белков, включая ферментно-опосредованный энергетический метаболизм, обработку ДНК / РНК, фолдинг и деградацию белка, молекулярный транспорт и секрецию, передачу сигналов (механизмы, которые связывают механические или химические стимулы к клеточному ответу), цитоскелетные элементы, функции рибосом, а также структуры и функции экспортируемых (внеклеточных) белков.Известно, что различные мутации ослабляют нервную систему, печень, поджелудочную железу, кости, глаза, уши, кожу, мочевыводящие и репродуктивные тракты, эндокринную систему, кровь и другие элементы системы кровообращения, мышц, суставов, зубов, иммунной системы, пищеварительного тракта. , конечности, легкие и почти любую другую часть тела, которую вы можете назвать. Что касается возраста начала, различные генетические нарушения появляются внутриутробно, от рождения до первого года жизни (наиболее часто диагностируемый класс), от первого года до полового созревания, от полового созревания до 50 лет или у пожилых людей.Примерно две трети генетических дефектов, описанных в MMBID , сокращают продолжительность жизни человека, а около трех четвертей из них вызывают смерть в возрасте до 30 лет.
Другой сборник такого рода, выпущенный в 1966 году, это Mendelian Inheritance in Man ( MIM ), текущая версия которого описывает тысячи человеческих генов, из которых более 75%, как известно, несут мутационные дефекты, связанные с болезненное состояние. MIM появился в десятке печатных изданий, а теперь также доступен в Интернете ( OMIM ), где он регулярно обновляется путем компьютерного поиска литературы.Еще одна подобная компиляция — это Интернет-база данных по мутациям генов человека (HGMD) (31), последние версии которой описывают более 75000 различных мутаций, вызывающих заболевание, выявленных на сегодняшний день в Homo sapiens . Более 50% этих молекулярных повреждений связаны с несинонимичными заменами в кодирующих белки сегментах (экзонах) генов, тогда как остальные молекулярные повреждения попадают в множество категорий, включая большие и малые вставки или делеции генетического материала, перестройки ДНК, регуляторные мутации. в областях, фланкирующих ген, и изменениях того, как определенные молекулы мРНК были сплайсированы вместе.HGMD ссылается на OMIM и обновляется еженедельно. HGMD представляет собой краткое изложение всех задокументированных мутаций, лежащих в основе данного метаболического нарушения. Например, он описывает 86 различных мутаций, вызывающих нарушение, известных в гене глюкозо-6-фосфатазы, 63 из которых являются несинонимичными заменами, 18 из которых являются небольшими добавлениями и / или делециями, 4 связаны с аномалиями сплайсинга, а 1 касается регуляторной области. фланкирующую кодирующую последовательность. Предоставляется много дополнительных молекулярных подробностей о каждой мутации, а также электронные ссылки на оригинальные статьи.
У апологета разумного конструктора может возникнуть соблазн заявить, что такие вредные мутации — просто неизбежные сбои или вторичные отклонения от прототипного генома человека, который в противном случае был разработан и спроектирован почти до совершенства. Однако, как я кратко опишу в следующих двух разделах, это оправдание было бы несостоятельным, потому что все человеческие геномы также испещрены внутренними (эндогенными) конструктивными недостатками.
Дизайн в стиле барокко: беспричинная сложность генома
Для естественных богословов в прошлые века, а также для приверженцев современных версий строгого религиозного креационизма биотическая сложность является отличительной чертой — бесспорной подписью — ID.Однако беспричинная или ненужная биологическая сложность — в отличие от экономии дизайна — может показаться полной противоположностью продуманной органической инженерии. Тем не менее, согласно объективным научным данным, необоснованные и часто дисфункциональные сложности (как в молекулярной структуре, так и в молекулярных операциях) настолько распространены, что подтверждают статус отличительных черт человеческого генома. Вот несколько характерных примеров.
Расщепленные гены.
Открытие в 1977 году того, что стандартные локусы, кодирующие белок, разделены на кодирующие области (экзоны), перемежающиеся с некодирующими областями (интронами), стало полной неожиданностью.То же самое произошло и с открытием больших рибонуклеопротеинов, известных как сплайсосомы, которые биохимически удаляют производные от интрона сегменты из каждой пре-мессенджера (прем) РНК, а затем сплавляют экзоны каждого гена от конца к концу для генерации зрелой мРНК. Примерно 1% всех известных генов в геноме человека кодируют молекулярные продукты, которые наши клетки используют для создания сплайсосом и проведения операций сплайсинга на премРНК. Вся эта чепуха имеет некоторые преимущества (например, возможности для альтернативного сплайсинга во время онтогенеза и перетасовки экзонов во время эволюции, оба из которых могут генерировать функциональное разнообразие белков), но такие преимущества не обходятся без больших затрат на приспособленность.
Есть веские причины полагать, что в идеальном мире клетки могли бы жить лучше без интронов. Интроны создают энергетическую нагрузку на клетки. В среднем они в 30 раз длиннее экзонов и транскрибируются в премРНК перед тем, как вырезаются; таким образом, они, вероятно, увеличивают время производства каждой зрелой мРНК по крайней мере в 30 раз (по сравнению с ожиданиями для нерасщепленных генов). Даже если для соматических клеток время не важно, метаболические затраты на поддержание и репликацию всех дополнительных нуклеотидов в интронах должны быть значительными.К этим клеточным затратам необходимо добавить метаболические затраты на создание сплайсосом и запуск обширного механизма процессинга премРНК. Также можно отметить, что многие организмы (например, бактерии) прекрасно обходятся без расщепления генов и интронов, как и митохондриальные геномы в клетках человека; таким образом, не существует универсальной биологической необходимости, чтобы эти особенности существовали. Наконец, в ядерном геноме человека было бы достаточно места для размещения нерасщепленных генов для всех необходимых ему белков (включая те, которые теперь альтернативно сращиваются), если бы разумный разработчик просто выбросил ненужную ДНК генома (см. Далее).
Тем не менее, ради аргумента, предположим, что метаболические издержки, налагаемые интронами, незначительны. Свидетельствуют ли интроны об оптимальном дизайне генома? Нет, потому что процессинг премРНК также открыл огромные возможности для клеточных сбоев в производстве белка. Такие неудачи не являются чисто гипотетическими. Поразительным открытием является то, что большая часть (возможно, одна треть) всех известных генетических нарушений человека в по крайней мере в некоторых клинических случаях может быть связана с мутационными ошибками в том, как обрабатываются молекулы премРНК (32, 33).Например, давно известно, что мутации на границах интрон-экзон часто нарушают сплайсинг премРНК, изменяя генные продукты и приводя к бесчисленным генетическим нарушениям, включая различные виды рака и другие метаболические дефекты (34). Также имеются убедительные доказательства того, что количество интронов в генах человека положительно коррелирует с вероятностью того, что ген является возбудителем болезни (35). Avise (29) суммирует многие из документально подтвержденных генетических недугов человека (в конкретных клинических случаях) с молекулярными ошибками при сплайсинге мРНК в специфицируемых локусах.Они варьируются от множества нейродегенеративных заболеваний до истощения кровеносной, выделительной и других систем организма. Многие из этих генетических нарушений начинаются в младенчестве или раннем детстве; другие полагаются на пожилых людей. Разрушительные симптомы многих таких заболеваний, таких как болезнь Лу Герига (боковой амиотрофический склероз), просто ужасны по любым человеческим меркам.
Регулирование генов и надзор за нуклеиновыми кислотами.
Каждый ген, кодирующий белок, или «структурный ген» также имеет прилегающие ( цис ) регуляторные последовательности, которые помогают модулировать, когда во время развития и в различных тканях или органах он экспрессируется.Наиболее примечательным является сердцевинный промотор, обычно длиной в несколько десятков пар оснований, с которым связываются наборы белков, известных как факторы транскрипции, к которым присоединяются молекулы РНК-полимеразы, которые катализируют производство премРНК из соседнего структурного гена. Другие регуляторные последовательности, называемые энхансерами и сайленсерами, иногда на тысячи нуклеотидов выше или ниже основного промотора, дополнительно усиливают или ингибируют транскрипцию. У каждого гена может быть несколько энхансеров и сайленсеров; они могут быть общими для разных генов, но разные гены имеют разные комбинации.Энхансеры и сайленсеры влияют на транскрипцию через свои связи с большими семействами белков-активаторов и репрессоров, которые передают регуляторные сигналы РНК-полимеразе через коактиваторы и другие белки. Разные батареи факторов транскрипции и их молекулярных ассоциатов действуют в разных типах клеток, помогая тем самым объяснить, как разные ткани и органы внутри человека могут иметь разные паттерны экспрессии генов, несмотря на то, что они используют один и тот же лежащий в основе геном.
После того, как ген, кодирующий белок, был включен соответствующими регуляторными сигналами и мРНК была транскрибирована, в действие вступают механизмы наблюдения за РНК.По любой из множества причин некоторые молекулы мРНК становятся ошибочно усеченными или иным образом искаженными, что препятствует их эффективной трансляции в полезный полипептид. Соматические клетки отслеживают такие дефекты и активно разрушают многие поврежденные копии мРНК. Что касается исправления генетических ошибок, надзор за РНК является аналогом на уровне РНК многих клеточных механизмов репарации генов, которые действуют непосредственно на уровне ДНК. Во многом это имеет смысл с точки зрения дизайна; если ДНК не восстанавливалась в обычном порядке или если дефектные мРНК не были разрушены, дисфункциональные белки-изгоя могут появляться в клетках гораздо чаще, чем это происходит.Однако, если за такие механизмы восстановления отвечает разумный конструктор, он также должен предвидеть или понимать, что его первоначальный геномный дизайн будет включать в себя множество недостатков.
В широком смысле слова генетическая регуляция генов, кодирующих белок, также может происходить на любой посттранскрипционной стадии производства белка, включая редактирование премРНК, экспорт зрелых мРНК из ядра, различия в стабильности и транспорте молекул мРНК после они достигли цитоплазмы, факторы, влияющие на процесс трансляции, посредством которого полипептиды конструируются из мРНК на рибосомах, сборку полипептидов в функциональные белки и посттрансляционные модификации или деградации белков.Многие из этих регуляторных механизмов включают сложные биохимические пути, и в совокупности они требуют значительных затрат на клеточные усилия и молекулярные материалы. Вероятно, можно считать, что 50% или более всех кодирующих генов в геноме человека играют некоторую прямую или косвенную регулирующую роль в развитии; например, в передаче сигналов и коммуникации клеток контроль над экспрессией генов как таковой или влияние на деление, структуру или подвижность клеток.
Протеинкиназы служат главной иллюстрацией посттранскрипционной регуляции в эукариотических клетках.Киназы — это ферменты, которые фосфорилируют и тем самым изменяют активность молекул субстрата. Геном человека содержит около 518 функциональных генов протеинкиназ, которые могут быть организованы в несколько десятков функциональных семейств и подсемейств локусов, все из которых возникли, согласно эволюционной интерпретации, в результате последовательных событий дупликации генов на протяжении долгой истории позвоночных животных (36). Изменяя профили активности белков, киназы осуществляют регуляторный контроль над многочисленными клеточными процессами, включая метаболизм, развитие клеточного цикла, движение и дифференциацию клеток, физиологический гомеостаз, функционирование нервной и иммунной систем и передачу сигналов (механистические пути, с помощью которых химические вещества или другие раздражители окружающей среды вызывают клеточные реакции).
Микро-РНК (miRNAs) — еще один важный класс локусов, участвующих в посттранскрипционной генетической регуляции (37–39). Каждая миРНК представляет собой короткий (около 20 нуклеотидов) участок РНК, который может связываться с комплементарными последовательностями в молекулах информационной РНК генов, кодирующих белок, и тем самым ингибировать трансляцию или вызывать деградацию определенных генетических сообщений. Хотя точное количество и точная роль miRNAs в геноме человека еще предстоит выяснить, более 500 таких локусов уже известны, и результаты предполагают, что miRNAs могут быть основными клеточными настройщиками синтеза белка.Другой интересный класс молекул — длинные некодирующие РНК, каждая из которых обычно состоит из сотен или тысяч пар оснований (40). Некоторые генетики полагают, что длинные некодирующие РНК окажутся важными регуляторами экспрессии генов; другие пока возражают против этой возможности, указывая на противоречащие друг другу доказательства, такие как тот факт, что клетки, по-видимому, разрушают длинные РНК почти сразу после их образования.
Таким образом, описанные здесь различные механизмы помогают управлять тем, как определенные гены и их белковые продукты экспрессируются в клетке.Существует множество дополнительных путей регуляции генов, например, как последовательности нуклеиновых кислот пространственно организованы и упакованы в хроматиновые волокна и хромосомы, как молекулы ДНК образуют комплексы с гистоновыми белками, а также структура, по которой цитозиновые основания в ДНК иногда модифицируются посредством химического метилирования. Короче говоря, абсолютная сложность структуры и функций генетического регуляторного аппарата клетки не вызывает сомнений.
Однако регуляторная сложность в процессе развития — палка о двух концах для любого организма.Молекулярные механизмы регуляции генов являются метаболически дорогостоящими и часто дают сбой с катастрофическими последствиями для здоровья. Несоответствия в том или ином аспекте регуляции генов ответственны за многие человеческие недуги, начиная от конкретных случаев астмы и заканчивая различными иммунными нарушениями, проблемами кровообращения и сердечными заболеваниями. Многие проявления рака были связаны с паттернами аберрантного метилирования в промоторных областях определенных генов (41). Талассемии — генетические нарушения, возникающие из-за недостаточного снабжения кровью глобинов, переносящих кислород, — это еще один большой класс метаболических заболеваний, связанных с проблемами регуляции генов (42).Протеинкиназы также подвержены нарушениям, вызывающим нарушения, при этом более 160 различных киназ участвуют в раковых заболеваниях благодаря их общей ассоциации с определенными типами опухолей, а 80 киназ были связаны, по крайней мере, временно с различными другими болезненными состояниями (36). Точно так же исследования показывают, что случайная неправильная регуляция молекул miRNA вносит свой вклад в общий пул метаболических нарушений у человека, включая, возможно, синдром ДиДжорджи, а также некоторые виды рака (43).
Почему умный и любящий дизайнер мог бы наполнить человеческий геном таким количеством потенциальных (и часто осознаваемых) нормативных недостатков, остается открытым для богословских споров. Любая такая философская дискуссия, вероятно, должна включать вопрос о том, был ли дизайнер ошибаться (и если да, то почему?). Следует также выяснить, мог ли разработчик признать свою собственную инженерную ошибочность, о чем, возможно, свидетельствуют, например, механизмы наблюдения ДНК и РНК, которые улавливают некоторые (но не все) из многочисленных молекулярных ошибок.
С эволюционной точки зрения такие геномные недостатки объяснить легче. Случайные ошибки в регуляции генов и надзоре следует ожидать в любом сложном изобретении, которое создавалось на протяжении эонов бесконечными манипуляциями бессмысленных эволюционных сил: мутации, рекомбинации, генетического дрейфа и естественного отбора. Опять же, сложность геномной архитектуры могла бы быть более верным признаком искусственной эволюции естественными процессами, чем прямого изобретения всемогущим интеллектуальным агентом.
мтДНК.
Митохондрии — единственные цитоплазматические органеллы человека, в которых размещается собственная ДНК (мтДНК). Прототип молекулы мтДНК человека имеет длину 16 569 п.н. Это замкнутый круг из 37 генов, наследуемых от матери, 22 из которых кодируют тРНК, 13 определяют полипептиды и 2 кодируют рРНК.
Митохондрии являются основным местом производства энергии в клетках. Основным биохимическим путем в митохондриях, посредством которого это осуществляется, является окислительное фосфорилирование, ключевым компонентом которого является дыхательная цепь.Дыхательная цепь состоит из пяти ферментных комплексов (I – V) плюс кофермент Q и цитохром c . Комплексы I и II окисляют НАДН и сукцинат соответственно; комплексы I, III и IV накачивают протоны для создания электрохимического градиента; а комплекс V использует энергию этого градиента для синтеза аденозинтрифосфата из аденозиндифосфата. Примечателен тот факт, что четыре из этих пяти ферментных комплексов состоят из комбинаций полипептидов митохондриального и ядерного геномов (44).В комплексе IV, например, 3 из 13 полипептидов кодируются митохондриальными локусами (COI, COII и COIII), тогда как остальные полипептиды кодируются ядерными генами. Только в комплексе II все необходимые ферментные субъединицы (в данном случае четыре) кодируются только одним геномом (ядерным). Ядерные гены также непосредственно участвуют в других основных функциях митохондрий. Действительно, мтДНК не кодирует какие-либо белки, которые непосредственно участвуют в ее собственной репликации, транскрипции, трансляции, наблюдении или репарации.Короче говоря, мтДНК — это всего лишь крошечный фрагмент ДНК, который сам по себе был бы абсолютно беспомощным для себя и для организма, в котором он находится. Ничто из этого не имеет никакого биологического смысла, кроме как в свете эволюционной науки (которая обнаружила, что современные митохондрии — это остатки микроба, который вторгся или был поглощен протоэукариотической клеткой в результате эндосимбиотического слияния, которое произошло миллиарды лет назад).
Подобно другим генетическим системам, которые мы рассмотрели до сих пор, митохондриальный геном страдает от мутаций, которые часто ставят под угрозу молекулярные операции.Действительно, в расчете на нуклеотид мтДНК претерпевает примерно на 5-10 больше мутаций в единицу времени, чем типичные ядерные гены, кодирующие белок (45). Многие мутации мтДНК практически не имеют последствий для здоровья человека, но многие другие имеют отрицательные эффекты, от умеренно ослабляющих до смертельных. Клинические нарушения в результате мутаций мтДНК непропорционально поражают высокоэнергетические ткани и органы (46, 47): мозг, глаза и другие компоненты периферической нервной системы, сердце, скелетные мышцы, почки и эндокринную систему.Мутации в мтДНК также участвуют в ряде видов рака (48). Короче говоря, возникающая парадигма состоит в том, что многие из дегенеративных заболеваний старения имеют свою этиологию в митохондриях либо в виде вредных мутаций в самих молекулах мтДНК, либо в виде операционных недостатков ядерно-митохондриальных взаимодействий.
Серьезные проблемы со здоровьем, возникающие в результате мутаций мтДНК, немедленно ставят под сомнение любые претензии на всемогущее совершенство митохондриального дизайна. Возможно, эти мутационные аберрации можно рассматривать как неудачные, но неизбежные побочные продукты молекулярной сложности.Однако интеллектуальные проблемы идентификации намного глубже. Учитывая критическую роль производства клеточной энергии в здоровье человека и метаболических процессах, почему умный дизайнер доверил бы так много производственного процесса митохондрии, учитывая возмутительные молекулярные особенности, которыми обладает эта органелла? Почему мудрый разработчик наделил мтДНК некоторыми, но не всеми генами, необходимыми для выполнения ее метаболической роли (а затем вместо этого поместил оставшиеся гены в ядро)? Зачем мудрому инженеру поместить какие-либо важные гены в едкую цитоплазматическую среду, в которой они регулярно подвергаются воздействию высоких концентраций мутагенных кислородных радикалов? Почему он мог бы диктовать, что митохондриальный генетический код должен отличаться от ядерного генетического кода, тем самым исключая перекрестную трансляцию между двумя геномами, для которых эффективная коммуникация представляется весьма желательной? Зачем разумному конструктору создавать структуры мтДНК (например,g., замкнутый кольцевой геном, без интронов, без мусорной ДНК, отсутствие связывающих гистонов) и операции мтДНК (например, небольшая генетическая рекомбинация или ее отсутствие, производство полигенного транскрипта, ограниченная способность к самовосстановлению, отсутствие самодостаточности в транскрипции или перевод) так кардинально отличаться от аналогов чертами ядерного генома? Короче говоря, основная структура всей митохондриальной операции, кажется, не имеет (тео) логического смысла. Мало того, что общий дизайн мтДНК неоптимален, но и выглядит просто смехотворным!
Расточительный дизайн: повторяющиеся элементы ДНК
До того, как ученые получили прямой доступ к последовательностям ДНК с помощью современных инструментов молекулярной биологии, было широко распространено мнение, что ядерные геномы состоят из гладких и эффективных генов, кодирующих белок, нанизанных вместе вдоль хромосом, как плотные бусины на струнах.На самом деле, однако, структурные гены имеют сложные внутренние структуры, в которых экзоны обычно похожи на небольшие островки в гораздо более крупных наследственных реках некодирующих интронов и регуляторных областей. Еще большим сюрпризом стало открытие того, что подавляющее большинство человеческой ДНК существует не как функциональные генные области какого-либо вида, а вместо этого состоит из различных классов повторяющихся последовательностей ДНК, включая разлагающиеся трупы структурных генов умерших и легионы активных и списанные сменные элементы.
Дубликоны и псевдогены.
По крайней мере, 4000 генов, кодирующих белок, и другие длинные участки ДНК (до 200000 п.н.) присутствуют не один раз, а в небольших или умеренных количествах копий на геном. По крайней мере, 5% ядерного генома человека состоит из таких семейств генов, в которых повторяющиеся элементы (названные дуплонами , которые возникли в результате процессов дупликации генов) обычно более чем на 90% идентичны друг другу по нуклеотидной последовательности (49, 50) .Дублирующиеся гены часто выполняют полезные функции, но здесь нас интересуют доказательства геномных ошибок, а не преимущества.
Поскольку повторяющиеся гены демонстрируют близкое сходство последовательностей, они предрасполагают хромосомы к неправильному спариванию во время мейоза. Такая гомологичная рекомбинация может вызвать делеции, добавления, инверсии или транслокации генетического материала в полученных гаметах, что, в свою очередь, может вызвать проблемы со здоровьем у полученного потомства. Нарушения метаболизма, которые возникают в результате геномных перестроек, опосредованных дупликонами, обычно возникают из-за дисбаланса дозировок, связанного с присутствием слишком большого или слишком малого количества копий гена или с измененной ориентацией определенных генов относительно их регуляторных областей.
Многочисленные метаболические нарушения связаны с рекомбинацией, опосредованной дуплонами. Кажется, что ни одна система органов не застрахована от повреждений; Известно, что различные нарушения влияют на элементы кровеносной, дыхательной, гормональной, скелетной, мышечной, репродуктивной, выделительной или нервной систем. Некоторые генетические заболевания, такие как красно-зеленая дальтонизм, довольно доброкачественные, тогда как другие, такие как синдром Прадера-Вилли, серьезно изнуряют. Многие тяжелые заболевания, как правило, не передаются через семью (поскольку больные редко могут воспроизводить потомство), а, напротив, рецидивируют в человеческой популяции в результате мутаций de novo в отцовских или материнских зародышевых линиях.Примерно 0,1% людей, доживающих до рождения, имеют инвалидность, связанную с дупликоном, а это означает, что миллионы людей во всем мире страдают от этой категории метаболических нарушений. Многие другие люди, вероятно, умирают в утробе матери. Ясно, что человечество несет серьезное бремя для здоровья из-за геномных нарушений, опосредованных дупликоном.
Мобильные элементы.
Возможно, самая удивительная находка в геноме последних десятилетий касается изобилия мобильных элементов. Эти участки ДНК обладают — или во многих случаях имели ранее — способность колонизировать уникальные хромосомные участки, репликативно перемещаясь из одной геномной позиции в другую в клеточном клоне.Невероятно, но мобильные элементы составляют не менее 45% генома человека, а истинная доля, вероятно, составляет 75% или более, если в подсчет включены (—) обработанные псевдогены, которые возникли как побочный продукт активности мобильных элементов (51) и ( ii ) другие межгенные области ДНК, которые, вероятно, возникли давно как мобильные элементы, но больше не идентифицируются как таковые из-за постформационных мутаций.
Мобильные элементы потенциально могут вызывать заболевания человека по нескольким причинам.Когда мобильный элемент вставляется в геном хозяина, он обычно делает это случайным образом в зависимости от того, нанесет ли его воздействие на место посадки хозяину или нет. Если он попадает в экзон, это может нарушить рамку считывания функционального гена с катастрофическими последствиями. Если он перескакивает в интрон или на границу между интроном и экзоном, это может вызвать проблемы, изменяя способ сплайсинга генного продукта во время обработки РНК. Если он внедряется в регуляторную область гена, он также может нанести серьезный ущерб.Потенциал вреда от такого инсерционного мутагенеза велик. Было подсчитано, например, что мобильный элемент L1 или Alu вновь вставляется где-нибудь в геноме примерно в 1-2% и 5%, соответственно, человеческих рождений (52, 53). Другая проблема заключается в том, что когда мобильный элемент попадает в функциональный ген, иногда наблюдается генетическая нестабильность, которая приводит к удаленным частям локуса-реципиента. Некоторые генетические нарушения были связаны с делециями генома, связанными со вставками мобильных элементов de novo (54).Наконец, мобильные элементы (или их неподвижные потомки, которые ранее накапливались в геноме человека) также могут вызывать нарушения генома через неаллельную гомологичную рекомбинацию (55). Это может привести к серьезным нарушениям обмена веществ (56).
Несмотря на относительно недавнее открытие мобильных элементов, список генетических нарушений, полностью или частично связанных с их активностью, уже велик. Тем не менее, любой такой список дает лишь минимальную оценку коллективного ущерба, наносимого этими элементами здоровью человека.Это связано с тем, что некоторые из наиболее серьезных медицинских проблем, вероятно, возникают на столь раннем этапе онтогенеза, что вызывают выкидыши, которые обычно остаются неизвестной этиологии. Действительно, большинство мобильных элементов особенно активны в зародышевой линии; таким образом, многие из их пагубных эффектов, вероятно, приводят к смерти гамет и снижению фертильности.
Примирение: эволюция как спасение теологии
На основании научных данных, собранных в прошлом веке, и особенно в последние десятилетия, мы теперь понимаем, что человеческий геном и лежащие в его основе метаболические процессы пронизаны структурными и функциональными недостатками, начиная от от тонкого к вопиющему.Эти генетические дефекты регистрируются не только как вредные мутационные отклонения от некоего гипотетического геномного идеала, но и как универсальные архитектурные недостатки самих стандартных геномов. Таким образом, открытия молекулярной биологии бросают гигантский вызов представлениям об идентификации личности. Они распространяют извечный вызов теодицеи, традиционно мотивированный очевидными недостатками на уровне человеческой морфологии и поведения, в самое сокровенное молекулярное святилище нашего физического существа.
Как именно падение благодати в Эдемском саду могло быть переведено в эти молекулярные дефекты, механически неясно (мягко говоря).Однако то, как возникают и сохраняются такие геномные недостатки, не представляет собой непреодолимой загадки с научной точки зрения генетики и эволюции. В этом, как я полагаю, кроется прекрасная возможность для нефундаменталистских религий.
Эволюция по естественным причинам фактически освобождает религию от оков теодицеи. Нам больше не нужно беспокоиться о том, почему Бог-Создатель является ведущим в мире абортом и массовым убийцей. Нам больше не нужно сомневаться в мотивах Бога-Создателя изнурять бесчисленное количество невинных людей ужасными генетическими заболеваниями.Мы больше не должны беспокоиться об интервенционистских мотивах высшего разума, допускающего грубое зло и страдания в мире. Нам больше не нужно подвергаться соблазну хулить всемогущее Божество, обвиняя Его в прямой ответственности за человеческие слабости и физические недостатки (включая те, которые, как мы теперь понимаем, являются обычным явлением на молекулярном и биохимическом уровнях). Нам больше не нужно обвинять прямую руку Бога-Создателя в любом из этих тревожных эмпирических фактов. Вместо этого мы можем полностью винить неразумную естественную эволюционную причинность.С этой точки зрения эволюционные науки могут стать желанным партнером (а не традиционно воспринимаемым противником) основной религии (рис. 1).
Рис. 1.( Верхний ) Традиционное размещение эволюционной биологии как «необычного человека» в сферах основной религии и идентичности во многих философских дискурсах о человеческом состоянии. ( Нижний ) Уникальная и, возможно, просвещенная перспектива, в которой ИД является странным человеком по сравнению с основными религиями и эволюционными науками (чьи сферы или магистерии могут пересекаться в спорной степени).
Таким образом, эволюционно-генетические науки могут помочь религиям уйти от глубоких загадок идентификации и тем самым вернуть религию в ее законное царство — не в качестве светского толкователя биологических мелочей нашего физического существования, а, скорее, в качестве уважаемого философского советник по более важным вопросам, включая этику и мораль, душу, духовность, святость и другие подобные вопросы, которые всегда были первостепенной заботой человечества.
Сноски
-
Вклад авторов: J.C.A. разработал исследование, провел исследование и написал статью.
-
Автор заявляет об отсутствии конфликта интересов.
-
Эта статья представляет собой прямое представление PNAS.
-
Настоящий документ является результатом Коллоквиума Артура М. Саклера Национальной академии наук «В свете эволюции IV: условия жизни человека», состоявшегося 10–12 декабря 2009 г. в Центре Арнольда и Мейбл Бекман в Национальные академии наук и инженерии в Ирвине, Калифорния.Полная программа и аудиофайлы большинства презентаций доступны на веб-сайте NAS по адресу www.nasonline.org/SACKLER_Human_Condition.
300 миллионов недостающих букв ДНК в геноме человека
В марте 1997 года мужчина ответил на объявление в The Buffalo News . Он согласился сдать 50 миллилитров крови. Он не оставил имени, поскольку исследователи, взявшие его кровь, хотели сохранить анонимность. Они назвали его RP11.
Объявление, на которое ответил RP11, предназначалось для проекта «Геном человека».И случилось так, что когда разгорелась гонка за завершение первого генома человека, именно образец RP11 был готов к секвенированию первым. В конечном итоге 70 процентов ДНК проекта «Геном человека» было получено из RP11. Остальные прибыли от 50 других добровольцев.
С тех пор этот первый геном человека постоянно совершенствовался. Он стал «эталонным геномом», стандартом, с которым сравнивается практически каждый человек, чья ДНК была секвенирована. Но большая часть его по-прежнему исходит от RP11.Генетический код каждого человека уникален, поэтому использование только одного эталонного генома — большей частью от одного человека — для замены всего человечества внесло тонкие предубеждения в генетические исследования.
Новое исследование ДНК людей африканского происхождения показывает, насколько отсутствует эталонный геном: в ходе своего исследования ученые обнаружили у 910 человек 300 миллионов букв ДНК, которых нет в эталонном геноме. Некоторые из этих новооткрытых сегментов ДНК могут представлять новые гены, на которые раньше не обращали внимания.
Африканцы в совокупности гораздо более генетически разнообразны, чем люди в других частях мира, поэтому их ДНК с большой вероятностью будет отличаться от эталонного генома. В настоящее время секвенаторы ДНК работают, разбивая геном на сегменты, которые индивидуально «читаются», а затем собираются как пазл. Алгоритмы используют эталонный геном, чтобы сообщить им, куда поместить каждый сегмент. Если появляется новый сегмент — тот, который не соответствует чему-либо в эталонном геноме, — алгоритмы не знают, что делать.Обычно ученые игнорируют это.
Прочитано: 23andMe хочет, чтобы его данные ДНК были менее белыми.
«Мы хотели посмотреть, что находится в кусках, которые мы игнорируем», — говорит Рэйчел Шерман, вычислительный биолог из Университета Джона Хопкинса, ведущий автор исследования. Советник Шермана Стивен Зальцберг сотрудничает с исследователями, изучающими генетику астмы у лиц африканского происхождения. В это исследование включены люди, живущие в Западной Африке, Северной Америке, Южной Америке и странах Карибского бассейна.«Мне пришло в голову, что у нас была эта очень генетически разнообразная группа», — говорит Зальцберг. Другими словами, их исследование предоставило возможность изучить разнообразие, отсутствующее в эталонном геноме.
Более мелкие исследования обнаружили достаточно новых последовательностей ДНК, которые, по их оценкам, насчитывают до 40 миллионов букв, которые могут появиться в геноме человека, но отсутствуют в текущем эталонном геноме. Шерман и Зальцберг обнаружили почти 300 миллионов пропавших без вести букв в 125 715 отдельных сегментах ДНК — намного больше, чем они ожидали.«Я подумал, что, должно быть, сделал что-то не так», — говорит Шерман. Но когда она вернулась и просмотрела весь свой код, она не нашла никаких ошибок.
Теперь вопрос в том, что содержат эти 300 миллионов ранее пропущенных букв ДНК. Возможно, они кодируют новые интересные мутации, связанные с заболеванием, которое при исследованиях с использованием эталонного генома упускается из виду. Если вы сравниваете только с эталонным геномом, «вы никогда не найдете этот недостающий фрагмент», — говорит Тина Грейвс-Линдси, генетик из Вашингтонского университета Св.Луи. Это особенно верно в отношении лиц африканского происхождения, поскольку их высокое генетическое разнообразие означает, что их ДНК с большей вероятностью не будет соответствовать эталонному геному. Ученые позже предположили, что RP11, вероятно, сам был афроамериканцем, но проблема использования одного эталонного генома для представления всей человеческой популяции все еще актуальна.
Грейвс-Линдси говорит, что ее не удивило количество новых последовательностей ДНК, обнаруженных Шерман, поскольку она и ее сотрудники также работают над устранением пробелов в эталонном геноме.Они собирают эталонные геномы разных групп людей, чтобы ученые могли сравнивать их не только с одной текущей версией. На данный момент команда секвенировала 15 образцов, в том числе пять из Африки. «Это была очень хорошая статья для нас, чтобы прочитать», — говорит Грейвс-Линдси об исследовании Шермана. «Это доказывает, что то, что мы делаем, действительно необходимо». Но ее работа все еще ограничена тем, что существует в репозиториях ДНК. Например, у нее нет отрывка, который можно было бы отследить от коренного населения Австралии.
С тех пор, как начался проект «Геном человека», ученые постепенно осознали, что недооценивают генетическое разнообразие человека. В то время они сосредоточились на однобуквенных мутациях. Но теперь становится ясно, что большие структурные вариации — тысячи букв, которые вставляются, удаляются или переворачиваются, — тоже обычное дело, — говорит Дина Черч, член-основатель Консорциума ссылок на геном и ученый из компании 10x Genomics. Это все равно, что сравнивать две копии книги на предмет опечаток и понимать, что в одной не хватает целых страниц.
Большие фрагменты ДНК, которые Шерман и Зальцберг обнаружили отсутствующими в эталонном геноме, вероятно, являются продуктом тысяч вставок и делеций. RP11 имеет свой собственный уникальный образец их, как и все другие оригинальные добровольцы Проекта генома человека.
