| 1. |
Формулы солей
Сложность: лёгкое |
1 |
| 2. |
Названия соединений азота
Сложность: лёгкое |
1 |
3.
|
Применение соединений азота
Сложность: лёгкое |
1 |
| 4. |
Свойства азота
Сложность: лёгкое |
1 |
5.
|
Азот: элемент или вещество
Сложность: среднее |
1 |
| 6. |
Строение молекул азота и аммиака
Сложность: среднее |
2 |
7.
|
Свойства солей азотной кислоты и аммония
Сложность: среднее |
2 |
| 8. |
Реагируют с азотной кислотой
Сложность: среднее |
3 |
9.
|
Азот — окислитель или восстановитель? Сложность: сложное | 3 |
| 10. |
Соответствие: соединения азота — свойства
Сложность: сложное |
4 |
Аммиак — Что такое Аммиак?
Аммиак представляет собой бинарное неорганическое химическое соединение азота и водорода
Аммиак (Ammonia, нитрид водорода) — химическое соединение азота и водорода с формулой Nh4, при нормальных условиях — бесцветный газ с резким характерным запахом.
Плотность аммиака почти в 2 раза меньше, чем у воздуха, ПДКр.з. 20 мг/м3 — IV класс опасности (малоопасные вещества) по ГОСТ 12.1.007.
Растворимость Nh4 в воде чрезвычайно велика — около 1200 объемов (при 0°C) или 700 объемов (при 20°C) в объеме воды.
В холодильной технике носит название R717, где R — Refrigerant (хладагент), 7 — тип хладагента (неорганическое соединение), 17 — молекулярная масса.
Аммиак относится к числу важнейших продуктов химической промышленности, ежегодное его мировое производство превышает 180 млн т.
Молекула аммиака имеет форму треугольной пирамиды с атомом азота в вершине. 3 неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами 3х атомов водорода (связи N − H), 4я пара внешних электронов является неподеленной, она может образовать ковалентную связь по донорно-акцепторному механизму с ионом водорода, образуя ион аммония Nh5+.
Несвязывающее 2х-электронное облако строго ориентировано в пространстве, поэтому молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
В жидком аммиаке молекулы связаны между собой водородными связями. Сравнение физических свойств жидкого аммиака с водой показывает, что аммиак имеет более низкие температуры кипения (tкип −33,35 °C) и плавления (t
Это в некоторой степени объясняется тем, что прочность водородных связей в жидком аммиаке существенно ниже, чем у воды; а также тем, что в молекуле аммиака имеется лишь одна пара неподеленных электронов, в отличие от двух пар в молекуле воды, что не дает возможность образовывать разветвленную сеть водородных связей между несколькими молекулами.
Аммиак легко переходит в бесцветную жидкость с плотностью 681,4 кг/м3, сильно преломляющую свет.
Подобно воде, жидкий аммиак сильно ассоциирован, главным образом за счет образования водородных связей.
Жидкий аммиак — хороший растворитель для очень большого числа органических, а также для многих неорганических соединений.
Твердый аммиак — кубические кристаллы.
§ 3. Кислородные соединения азота
Для азота известны окислы, по составу формально отвечающие всем валентностям от . единицы до пяти. Их формулы и названия сопоставлены ниже:
N2 O – закись азота
NO – окись азота
N2 O3 – азотистый ангидрид
NO2 – двуокись азота
N2 O5 – азотный ангидрид
Азотный ангидрид пpeдcтaвляeт собой твердое вещество, а остальные окислы при обычных условиях газообразны.
1) За исключением NO2 , все окислы азота ядовиты. При взаимодействии с раскаленной медью они полностью разлагаются, образуя СuО и N2 . По количеству окиси меди и азота может быть установлена формула исходного окисла.
Закись азота может быть получена разложением азотнокислого аммония, протекающим около 200 °С по уравнению:
NH4 NO3 = 2Н2 О + N2 O
Структура молекулы N2 O соответствует
формуле N≡N = O. 3акись азота представляет собой бесцветный газ (т. пл. –91
°С, т. кип. –89°С) со слабым приятным запахом. В воде она довольно хорошо
растворима, но химически с ней не взаимодействует. Выше 500°С закись азота
разлагается по реакции:
3акись азота представляет собой бесцветный газ (т. пл. –91
°С, т. кип. –89°С) со слабым приятным запахом. В воде она довольно хорошо
растворима, но химически с ней не взаимодействует. Выше 500°С закись азота
разлагается по реакции:
2N2 O = 2N2 + О2
Поэтому при повышенных температурах она действует как сильный окислитель. Например, тлеющая лучина вспыхивает в ней.
Так как температура человеческого тела далеко недостаточна Для разложения N2 O, этот газ, поддерживающий горение, дыхания не поддерживает. Вдыхание закиси азота в смеси с воздухом вызывает характерное состояние опьянения, сопровождающееся значительным ослаблением болевых ощущений. На этом основано использование N2 O при операциях в качестве наркотика.
2) Молекула N2 O линейна [d(NN) = 1,13 А, d(N0) = 1,19 А].
Закись азота является постоянной составной частью воздуха (0,00005% по объему). Один объем воды поглощает при 0°С около 1,3, а
при 25 °С – 0, 6 объема N2 O.
Один объем воды поглощает при 0°С около 1,3, а
при 25 °С – 0, 6 объема N2 O.
Образование окиси азота из элементов при обычных условиях не происходит. Лишь примерно с 1200 °С начинает заметно протекать обратимая реакция:
N2 + О2 + 43 ккал < = >2NO
Как видно из рис. 117, около 1500°С равновесие еще почти нацело смещено влево. Устанавливается оно при этих условиях чрезвычайно медленно: для достижения равновесного состояния требуется30 часов. Напротив, более высоким температурам отвечает не только большее содержание N0 в газовой смеси, но и несравненно быстрейшее достижение равновесия, которое при 3000°С устанавливается за миллионные дбли секунды. По Этим причинам NO всегда образуется в атмосфере при грозовьц разрядах.
Несмотря на эндотерйичность окиси азота, при обычных условиях она вполне устойчива. В лабораториях ее чаще всего получают по реакции:
3Cu + 8HNO3 = 3Cu(NO3 )2 + 2NO + 4Н2 О
Окись азота
представляет собой бес цветный газ (т. пл. –164 °С, т. кип. –151°С),
сравнительно малорастворимый в воде и химически с ней не взаимодействующий.
Свой кислород она отдает лишь с трудом. Поэтому горящая лучина в атмосфере NO гаснет.
пл. –164 °С, т. кип. –151°С),
сравнительно малорастворимый в воде и химически с ней не взаимодействующий.
Свой кислород она отдает лишь с трудом. Поэтому горящая лучина в атмосфере NO гаснет.
Наиболее характерны для окиси азота реакции присоединения. Так, при взаимодействии ее с хлором по реакции
2NO + Сl2 = 2NOCl
образуется хлористый нитрозил (Сl–N = O), представляющий собой желтый газ (т. пл. – 64°С, т. кип. –6°С). Непосредственно соединяется NO и с кислородом. Известен также ряд комплексных соединений, содержащих NO во внутренней сфере.
3) Молекула NO характеризуется расстоянием d(NO) = 1,15 А и очень малой полярностью (длина диполя 0,03 А). Сто объемов воды растворяют при 0°С около 7 объемов окиси азота. В жидком и твердом состояниях она имеет синий цвет.
4) Если подсчитать
общее число внешних электронов в молекуле NO, то получается цифра 11 (5 у азота и 6 у кислорода). Так как
валентная связь осуществляется электронной парой, последняя должна быть
системой более устойчивой, чем неспаренный электрон. Можно поэтому ожидать, что
молекулы с нечетным числом электронов («нечетные» молекулы) будут склонны к
димеризации (т. е. попарному сочетанию). Как правило, это и наблюдается уже при обычных условиях. К очень немногочисленным исключениям
относится окись азота, проявляющая заметные признаки димеризации по схеме
Так как
валентная связь осуществляется электронной парой, последняя должна быть
системой более устойчивой, чем неспаренный электрон. Можно поэтому ожидать, что
молекулы с нечетным числом электронов («нечетные» молекулы) будут склонны к
димеризации (т. е. попарному сочетанию). Как правило, это и наблюдается уже при обычных условиях. К очень немногочисленным исключениям
относится окись азота, проявляющая заметные признаки димеризации по схеме
NO + NO < = > N2 O2
лишь при низких температурах. В жидком состоянии при –163 °С содержание молекул N2 O2 достигает 95, а твердая окись азота состоит, по–видимому, уже только из таких молекул.
Спокойно протекающая реакция соединения NO с кислородом воздуха ведет к образованию двуокиси азота по уравнению:
2NO + O2 = 2NO2 + 27 ккал
Двуокись азота представляет собой бурый
газ, легко сгущающийся в жидкость, кипящую при +21 °С.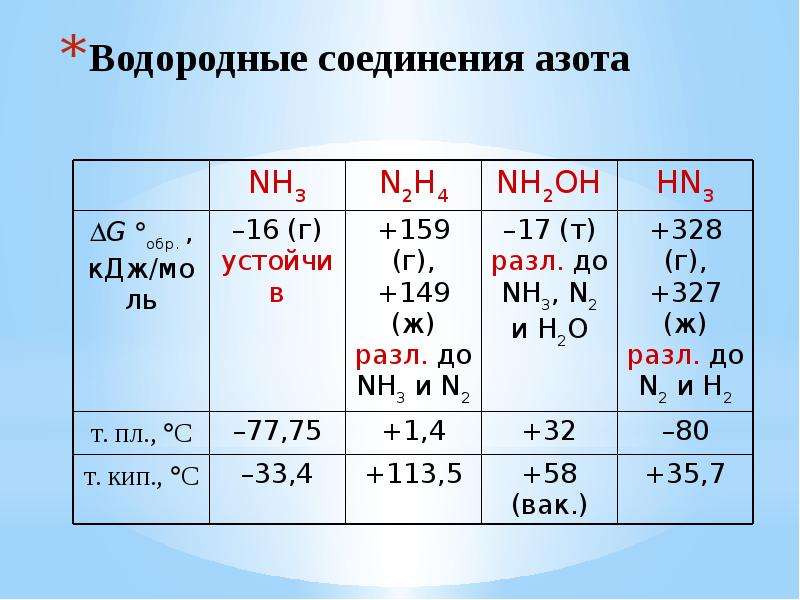 Будучи охлаждена до –11
°С, жидкость эта застывает в бесцветную кристаллическую массу. Определение
молекулярного веса по плотности пара дает цифры, лежащие между простым (14 + 2 ·16 = 46) и удвоенным (92) его значениями,
причем цифры эти зависят от температуры опыта, уменьшаясь при ее повышении и увеличиваясь
при понижении.
Будучи охлаждена до –11
°С, жидкость эта застывает в бесцветную кристаллическую массу. Определение
молекулярного веса по плотности пара дает цифры, лежащие между простым (14 + 2 ·16 = 46) и удвоенным (92) его значениями,
причем цифры эти зависят от температуры опыта, уменьшаясь при ее повышении и увеличиваясь
при понижении.
5) Реакция присоединения кислорода к NO особенно интересна тем, что она является одним из очень немногих известных случаев, когда при повышении температуры химический процесс не только не ускоряется, но даже несколько замедляется. Объяснение этой аномалии скорости исходит из того, что в реакцию вступают лишь димерные молекулы N2 O2 , вероятность возникновения которых с повышением температуры очень быстро уменьшается.
Такие результаты обусловлены наличием
равновесия между молекулами двуокиси азота (NO2 ) и азотноватой окиси (N2 O4 ).
Результаты определения
молекулярного веса около 140 °С показывают, что при этих условиях в газе
имеются только молекулы двуокиси азота, тогда как при более низких температурах
они частично соединяются попарно, образуя молекулы N2 O4 . Так как процесс образования
из нейтральных молекул одного и того же вещества более сложных частиц с
удвоенным, утроенным и т. д. молекулярным весом называется полимеризацией,
можно сказать, что ниже 140 °С NO2 частично полимеризуется (точнее –
димеризуется) в N2 O4 . Это происходит тем в большей степени, чем
ниже температура, и вблизи точки замерзания (–11°С) вещество состоит уже
исключительно из молекул N2 O4 . Напротив, при нагревании азотноватой
окиси она диссоциирует на простые молекулы.
Так как процесс образования
из нейтральных молекул одного и того же вещества более сложных частиц с
удвоенным, утроенным и т. д. молекулярным весом называется полимеризацией,
можно сказать, что ниже 140 °С NO2 частично полимеризуется (точнее –
димеризуется) в N2 O4 . Это происходит тем в большей степени, чем
ниже температура, и вблизи точки замерзания (–11°С) вещество состоит уже
исключительно из молекул N2 O4 . Напротив, при нагревании азотноватой
окиси она диссоциирует на простые молекулы.
Каждой промежуточной между –11 °С и +140сС температуре отвечает определенное состояние равновесия обратимой реакции:
полимеризация–––––––––––––––––>>>
NO2 + NO2 N2 O4 + 13 ккал
<<<––––––––––––––––
диссоциация
Положения этого равновесия при различных
температурах показаны на рис.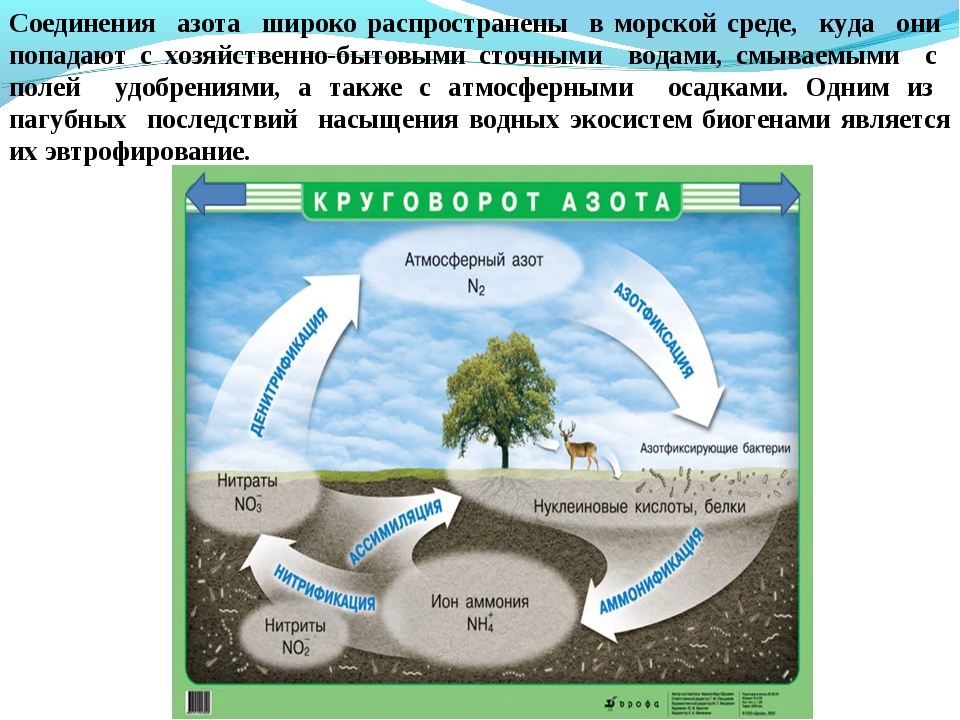 118. Так как N2 O4 бесцветна, a NO2 имеет красно–бурый цвет, за
смещением равновесия при нагревании или охлаждении газовой смеси легко следить
по изменению ее окраски.
118. Так как N2 O4 бесцветна, a NO2 имеет красно–бурый цвет, за
смещением равновесия при нагревании или охлаждении газовой смеси легко следить
по изменению ее окраски.
Склонность молекул O = N = O к взаимодействию друг с другом обусловлена наличием в каждой из них одного непарного электрона (при атоме азота). Сочетание двух таких электронов и создает связь N–N в молекуле N2 O4 . Неустойчивость последней является следствием непрочности этой связи. Пространственное строение молекул NO2 и N2 O4 показано на рис. 119.
Двуокись азота является очень сильным окислителем. Уголь, сера, фосфор и т. п. энергично сгорают в ней. С парами многих органических веществона дает взрывчатые смеси.
6) Молекула NO2 характеризуется малой полярностью (длина
диполя 0,08А). Выше 140 °С реакция образования двуокиси азота из N0 и кислорода
становится заметно обратимой. Положения ее равновесия при различных
температурах показаны на рис. 120. Как видно из последнего, выше 620 °С
двуокись азота под обычным давлением существовать уже не может.
Положения ее равновесия при различных
температурах показаны на рис. 120. Как видно из последнего, выше 620 °С
двуокись азота под обычным давлением существовать уже не может.
Взаимодействие NO2 с NO по обратимой реакции
NO2 + NO < = > N2 O3 + 10 ккал
ведет к частичному образованию азотистого ангидрида (N2 O3 ), который при охлаждении системы может быть получен в виде синей жидкости. Строение азотистого ангидрида выражается формулой O = N–О–N = O. В обычных условиях он неустойчив и равновесие приведенной выше реакции сильно смещено влево.
Растворение NO2 (или N2 O4 ) в воде сопровождается образованием азотной (HNO3 ) и азотистой (HNO2 ) кислот:
2NO2 + Н2 О = HNO3 + HNO2
Тогда как азотная кислота в растворе вполне устойчива, азотистая легко распадается по обратимой реакции:
2HNO2 < = > H2 O + N2 O3 < = > H2 O + NO + NO2
поэтому практически взаимодействие NO2 с водой идет по уравнению:
3NO2 + Н2 О = 2HNO3 + NO
Если
растворение двуокиси азота вести в присутствии избытка кислорода, то
выделяющаяся NO окисляется им
до NO2 .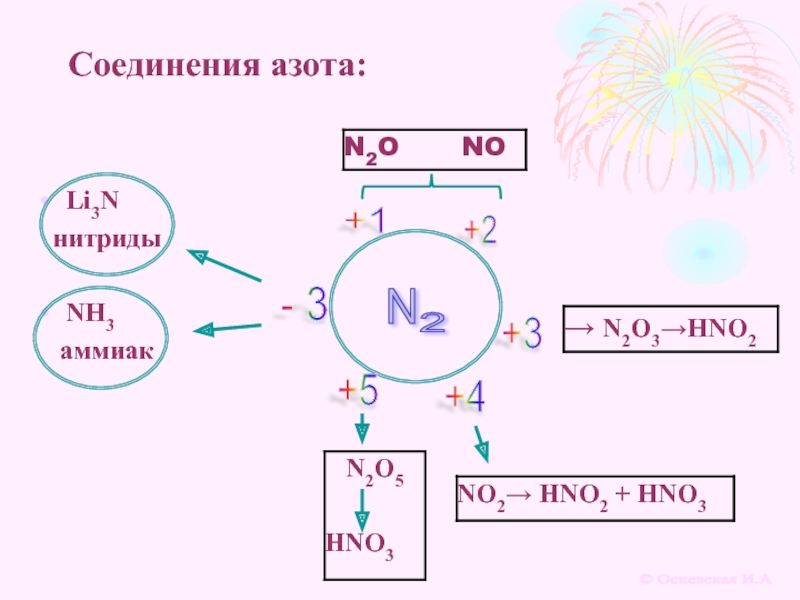 При этих
условиях можно полностью перевести двуокись азота в азотную кислоту по суммарной
схеме:
При этих
условиях можно полностью перевести двуокись азота в азотную кислоту по суммарной
схеме:
4NO2 + 2Н2 О + O2 = 4HNO3
Подобным же образом (с образованием солей HNO3 ) протекает растворение NO2 в щелочах при наличии избытка кислорода. Напротив, в отсутствие последнего по реакции, например
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2 O
образуется смесь солей азотной и азотистой кислот (в отличие от самой HNO2соли ее в растворе устойчивы).
Соли азотистой кислоты называются азотистокислыми или нитритами. Подобно самому аниону NO2 , большинство их бесцветно. Почти все нитриты хорошо растворимы в воде (труднее других – AgNO2 ). Чаще всего встречается в практике NaNO2 , который получают обычно из окислов азота по реакции:
NO2 + NO + 2NaOH = 2NaNO2 + Н2 O
Все соли
азотистой кислоты весьма ядовиты.
Сама HNO2 известна только в разбавленных водных растворах. По силе она лишь немного превышает уксусную кислоту.
Наиболее характерны для азотистой кислоты сильно выраженные окислительные свойства, причем восстанавливается она в большинстве случаев до NO. С другой стороны, действием сильных окислителей азотистая кислота может быть окислена до азотной. Типичные примеры характерных для нее окислительно–восстановительных процессов приводятся ниже:
2HNO2 + 2HJ = J2 + 2NO + 2Н2 О
2НМnО4 + 5HNO2 = 2Mn(NO3 )2 + HNO3 + ЗН2 О
Обе эти реакции протекают в кислой среде.
7) Для азотистой кислоты (K = 5 ·10–4) вероятно наличие двух способных переходить друг в друга структур:
Нитриты активных
металлов (например, NaNO2 ) построены,
по–видимому, в соответствии с первой из них, нитриты малоактивных (например, AgNO2 ) – со второй. Органические производные
известны для обеих форм HNO2 .
Органические производные
известны для обеих форм HNO2 .
Основной продукт взаимодействия NO2 с водой – азотная кислота является одним из важнейших химических соединений. Она потребляется при выработке взрывчатых веществ, органических красителей, пластических масс и в ряде других производств. Для получения азотной кислоты могут быть использованы три технических метода, причем исходными продуктами служат соответственно: а) аммиак, б) воздух и в) селитра.
Сущность первого метода заключается в каталитическом окислении аммиака кислородом воздуха. Как было выяснено еще в 1900 г., при быстром пропускании смеси NH3 с избытком воздуха над платиновым катализатором (нагретым до 800 °С) по реакции
4NH3 + 5О2 = 6Н2 О + 4NO + 216 ккал
образуется окись азота. Последняя переводится затем в NO2 и HNO3 . Каталитическое окисление аммиака является в настоящее время основным методом получения азотной кислоты.
8) Схема установки для окисления аммиака показана на рис. 121 (А –теплообменник). Катализатор из сплава платины с 5–10% родия оформляют в виде тонкой сетки, сквозь которую ‘ и продувается смесь исходных газов. На практике пользуются смесью аммиака с воздухом, содержащей не более 12%
Nh4 по объему. Максимальный выход окиси азота составляет около 98% от теоретического.
Второй метод (т. н. дуговой) – получение азотной кислоты «сжиганием воздуха»–был разработан в 1905 г. Как видно из рис. 117, более или менее выгодное положение равновесия синтеза NO из элементов достигается лишь при очень высоких температурах. С другой стороны, устанавливается оно при этих условиях практически моментально. В связи с этим задача.технического осуществления синтеза NO формулировалась следующим образом: необходимо было изыскать способ нагреть воздух до возможно высокой температуры и затем очень быстро охладить газовую смесь ниже 1200°С с тем, чтобы не дать возможности образовавшейся окиси азота распасться обратно на азот и кислород.
При разрешении этой задачи в качестве нагревателя была использована электрическая дуга, дающая температуры около 4000°С. Если такую дугу поместить между полюсами сильного электромагнита, то пламя ее образует огненный диск. При быстром пропускании сквозь него струи воздуха последний в момент соприкосновения с пламенем очень сильно нагревается, а затем тотчас же охлаждается ниже 1200°С. В процессе дальнейшего охлаждения газовой смеси N0 присоединяет кислород с образованием NO2 , из которой затем и может быть получена азотная кислота.
Хотя при техническом осуществлении дугового метода выход NO составляет лишь около 2% по объему, однако это не играет особой роли ввиду бесплатности исходного сырья – воздуха. Гораздо более важным недостатком дугового метода является большой расход электроэнергии. Именно поэтому его промышленное значение в настоящее время невелико.
Наконец, третий способ получения азотной кислотыиз селитры – являлся в прошлом единственным, но теперь почти не имеет промышленного значения. В его основе лежит взаимодействие селитры с концентрированной серной кислотой:
NaNO3 + H2 SO4 = NaHSO4 + HNO3
Реакция эта легко протекает при нагревании.
9) Очень концентрированная (98%) HNO3 может быть получена взаимодействием воды или разбавленной кислоты с жидкой N2 O4 и кислородом под давлением 50 ат. Этот «прямой синтез» осуществляют обычно при 70 °С. Получаемая кислота находит использование в реактивной технике.
10) Строение молекулы азотной кислоты может быть сокращенно выражено формулой HONO2 . Значение d(NO) для связи с гидроксильным кислородом составляет 1,41 А, а для связей с двумя другими кислородами–1,22 А. Угол ONO в группе NO2 равен 130 °С. Ион NO3– имеет структуру плоского равностороннего треугольника с азотом в центре [d(N0) = l,21 A].
Безводная азотная кислота представляет собой бесцветную (при хранении быстро желтеющую) жидкость, которая кипит при 86 °С. Кипение сопровождается частичным разложением по реакции:
4HNO3 = 2Н2 О + 4NO2 + О2
Растворяясь в перегнавшейся кислоте, двуокись азота сообщает ей желтую или красную (в зависимости от количества NO2 ) окраску. Так как NO2 постепенно выделяется из раствора, подобная азотная кислота называется дымящей. Разложение 100%–ной HNO3 медленно идет на свету уже при обычных температурах.
С водой HNO3 смешивается в любых соотношениях. Применяемая в лабораторной практике концентрированная азотная кислота содержит около 65% HNO3 и имеет плотность 1,40. По составу она приблизительно соответствует формуле HNO3· 2H2 O.
С химической стороны азотная кислота характеризуется прежде всего сильно выраженными окислительными свойствами.
При этом основным конечным продуктом восстановления не очень крепкой HNO3 является NO, а концентрированной – NO2 .
11) Основным первоначальным продуктом восстановления крепкой НNО3 является, по–видимому, азотистая кислота. Если процесс проводится в не очень крепких растворах, то из образующихся при ее распаде газов выделяется только N0 (так как NO2 , реагируя с водой, дает НNО3 и NO). Однако при повышении концентрации большое значение приобретает обратимость реакции
3NO2 + H2 O < = > 2HNO3 + NO + 33 ккал
При эквивалентных соотношениях –реагирующих веществ равновесие ее смещено вправо, но последовательное повышение концентрации HNO3 все более смещает его влево Поэтому основным конечным продуктом восстановления концентрированной НNО2 и является на NO, a NO2 .
Все часто встречающиеся в практике металлы, за исключением Au и Pt, переводятся крепкой азотной кислотой в окислы. Если последние растворимы в HNO3 , то образуются азотнокислые соли. По этой схеме азотная кислота растворяет и такие стоящие в ряду напряжений правее водорода металлы, как Сu, Hg и Ag.
Некоторые бурно реагирующие с разбавленной азотной кислотой металлы (например, Fe) практически не взаимодействуют с концентрированной (и особенно – дымящей). Обусловлено это тем, что на их поверхности образуется очень тонкий, но плотный защитный слой нерастворимого в кислоте окисла. Благодаря такой «пассивности» железа концентрированную HNO3 можно перевозить в стальных цистернах.
Весьма энергично действует крепкая (особенно – дымящая) азотная кислота на некоторые металлоиды. Так, сера окисляется ею при кипячении до H2 SO4 , уголь – до СO2 и т. д. Животные и растительные ткани при действии HNO3 разрушаются.
Для отличия азотной кислоты от азотистой важно их отношение к йодистому водороду, В то время как HNO3 тотчас окисляет его до иода, разбавленная азотная кислота на HJ не действует. Напротив, концентрированная HNO3 окисляет не только HJ, но и НСl. Однако в последнем случае реакция обратима:
HNO3 + 3HCl < = >2H2 O + NOCl + Сl2
Смесь концентрированной HNO3 с концентрированной НСl называют обычно «царской водкой», Она действует значительно энергичнее, чем каждая из этих кислот в отдельности. Так, даже Au и Pt легко растворяются в царской водке с образованием соответствующих хлористых соединений по схемам:
Au + HNO3 + 3HCl = AuCl3 + NO + 2H2 O
3Pt + 4HNO3 + 12HCl = 3PtCl4 + 4NO + 8H2 O
Активным действующим началом царской водки является, с одной стороны, хлор в момент выделения с другой – легко отдающий его хлористый нитрозил.
Подобно окислительной, очень сильно выражена у HNO3 и кислотная функция. Так как при разбавлении раствора первая из них ослабляется, а вторая усиливается, реакции многих металлов с разбавленной HNO3 протекают по общему типу, т. е. с вытеснением водорода. Однако последний не выделяется, а расходуется на восстановление избытка HNO3 до производных более низкой валентности азота, вплоть до NНз. Как правило, получается смесь различных продуктов восстановления.
12) Характер конечных продуктов восстановления HNO3 сильно зависит от ряда факторов – концентрации кислоты, природы восстановителя, температуры и т. д. Как влияет концентрация самой кислоты (при равных прочих услозиях),видно из приводимого в качестве примера рис. 122. Кипячением в щелочной среде с порошком алюминия нитраты могут быть количественно восстановлены до аммиака. Реакция идет по уравнению, например:
8Al+3NaNO3 +5NaOH + 2H2 O = 8NaAlO2 +3NH3 .
В качестве очень сильной одноосновной кислоты HNO3 образует вполне устойчивые при обычных условиях соли. Подобно самому иону NO3 , большинство нитратов бесцветно. Почти все азотнокислые соли хорошо растворимы в воде. Многие из них находят разнообразное практическое использование.
При достаточном нагревании нитратов они разлагаются, причем характер распада зависит от природы катиона. Соли наиболее активных металлов (расположенных в ряду напряжения левее Mg) с отщеплением кислорода переходят в соответствующие нитриты, соли менее активных (Mg–Cu) распадаются с образованием окислов и еще менее активных (правее Cu) – свободных металлов. Примерами могут служить реакции:
2NaNO3 = 2NaNO2 + O2
2Pb(NO3 )2 = 2PbO + 4NO2 + O2
2AgNO3 = 2Ag + 2NO2 + O2
Неодинаковый характер протекания этих реакций обусловлен различной устойчивостью соответствующих нитритов и окислов при температурах распада: в этих условиях для Na еще устойчив нитрит, для Рb он уже неустойчив, но еще устойчив окисел, а для Ag неустойчиво и то и другое соединение, вследствие чего и происходит выделение свободного металла.
Ввиду легкости отдачи нитратами кислорода при высоких температурах, смеси их с горючими веществами сгорают чрезвычайно быстро. На этом основано применение нитратов в пиротехнике и для изготовления черного пороха.
13) Черный порох представляет собой тесную смесь КNО3 с серой и углем, причем «нормальный» порох (68% KNO3 , 15% S и 17% С) приблизительно отвечает составу 2KNO3 +3C + S. Горение его протекает в основном по уравнению:
2KNO3 + 3C + S = N2 + 3CO2 + K2 S + 169 ккал.
Отвечающий азотной кислоте ангидрид может быть получен взаимодействием NO2 с озоном:
2NO2 + O3 = O2 + N2 O5
Азотный ангидрид (N2 O5 ) представляет собой бесцветные, очень летучие кристаллы (т. возг. 32 °С). Последние образованы ионами NO2+и NO3 , а в парах азотный ангидрид состоит из отдельных молекул, строение которых отвечает формуле O2 N–О–NO2 . Он крайне неустойчив и уже при обычных условиях медленно распадается на двуокись азота и кислород (иногда распад этот настолько ускоряется, что приобретает даже взрывной характер). Будучи сильным окислителем, N2 O5 бурно реагирует со многими веществами. С водой он образует азотную кислоту.
Азот. Химия азота и его соединений
1. Положение азота в периодической системе химических элементов
2. Строение атома азота
3. Физические свойства и нахождение в природе
4. Строение молекулы
5. Соединения азота
6. Способы получения
7. Химические свойства
7.1. Взаимодействие с простыми веществами
7.1.1. Взаимодействие с галогенами
7.1.2. Взаимодействие с серой и кремнием
7.1.3. Взаимодействие с водородом и фосфором
7.1.4. Взаимодействие с азотом
7.1.5. Взаимодействие с активными металлами
Аммиак
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Взаимодействие с серной кислотой
3.2. Взаимодействие с азотной кислотой
3.3. Взаимодействие с солями
Соли аммония
Способы получения солей аммония
Химические свойства солей аммония
Оксиды азота
1. Оксид азота (I)
2. Оксид азота (II)
3. Оксид азота (III)
4. Оксид азота (IV)
5. Оксид азота (V)
Азотная кислота
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Диссоциация азотной кислоты
2.3. Взаимодействие с основными и амфотерными оксидами и гидроксидами
2.4. Вытеснение более слабых кислот из солей
2.5. Взаимодействие с металлами
2.6. Взаимодействие с неметаллами
2.7. Окисление сложных веществ
2.8. Взаимодействие с белками
Азотистая кислота
Соли азотной кислоты — нитраты
Соли азотистой кислоты — нитриты
Азот
Положение в периодической системе химических элементов
Азот расположен в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение азота
Электронная конфигурация азота в основном состоянии:
Атом азота содержит на внешнем энергетическом уровне 3 неспаренных электрона и одну неподеленную электронную пару в основном энергетическом состоянии. Следовательно, атом азота может образовать 3 связи по обменному механизму и 1 связь по донорно-акцепторному механизму. Таким образом, максимальная валентность азота в соединениях равна IV. Также характерная валентность азота в соединениях — III.
Степени окисления атома азота – от -3 до +5. Характерные степени окисления азота -3, 0, +1, +2, +3, +4, +5.
Физические свойства и нахождение в природе
Азот в природе существует в виде простого вещества газа N2. Нет цвета, запаха и вкуса. Молекула N2 неполярная, следовательно, в воде азот практически нерастворим.
Азот – это основной компонент воздуха (79% по массе). В земной коре азот встречается в основном в виде нитратов. Входит в состав белков, аминокислот и нуклеиновых кислот в живых организмах.
Строение молекулы
Связь между атомами в молекуле азота – тройная, т.к. у каждого атома в молекуле по 3 неспаренных электрона. Одна σ-связь (сигма-связь) и две — π-связи.
Структурная формула молекулы азота:
Структурно-графическая формула молекулы азота: N≡N.
Схема перекрывания электронных облаков при образовании молекулы азота:
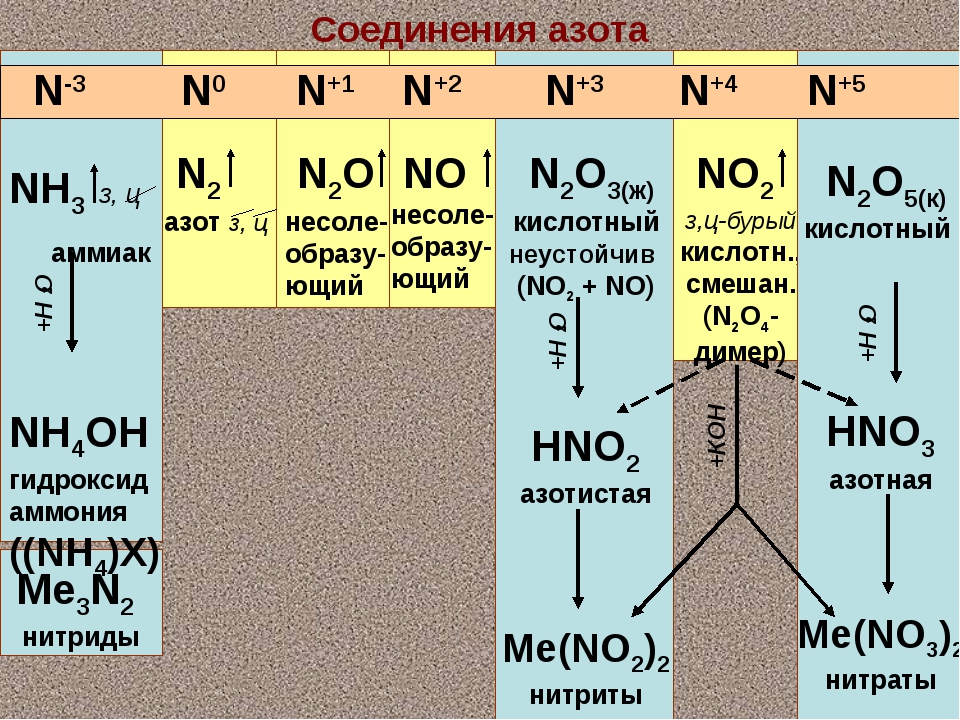
Соединения азота
Типичные соединения азота:
| Степень окисления | Типичные соединения |
| +5 | оксид азота (V) N2O5 азотная кислота HNO3 нитраты MeNO3 |
| +4 | оксид азота (IV) NO2 |
| +3 | оксид азота (III)
азотистая кислота нитриты MeNO2 |
| +2 | оксид азота (II) NO |
| +1 | оксид азота (I) |
| -3 | аммиак NH3 нитриды металлов MeN бинарные соединения азота с неметаллами |
Способы получения азота
1. Азот в лаборатории получают при взаимодействии насыщенных растворов хлорида аммония и нитрита натрия. Образующийся в результате реакции обмена нитрит аммония легко разлагается с образованием азота и воды. В колбу наливают раствор хлорида аммония, а капельную воронку раствор нитрита натрия. При приливании нитрита натрия в колбу начинается выделение азота. Собирают выделяющийся азот в цилиндр. Горящая лучинка в атмосфере азота гаснет.
NaNO2 + NH4Cl → NH4NO2 + NaCl
NH4NO2 → N2 + 2H2O
Суммарное уравнение процесса:
NaNO2 + NH4Cl → N2 + NaCl + 2H2O
Видеоопыт взаимодействия нитрита натрия с хлоридом аммония можно посмотреть здесь.
Азот также образуется при горении аммиака:
4NH3 + 3O2 → 2N2 + 6H2O
2. Наиболее чистый азот получают разложением азидов щелочных металлов.
Например, разложением азида натрия:
2NaN3 → 2Na + 3N2
3. Еще один лабораторный способ получения азота — восстановление оксида меди (II) аммиаком при температуре ~700 °C:
3CuO + 2NH3 → 3Cu + N2 + 3H2O
В промышленности азот получают, буквально, из воздуха. При промышленном производстве очень важно, чтобы сырье было дешевым и доступным. Воздуха много и он пока бесплатный.
Используются различные способы выделения азота из воздуха — адсорбционная технология, мембранная и криогенная технологии.
Адсорбционные методы разделения воздуха на компоненты основаны на разделения газовых сред в азотных установках лежит явление связывания твёрдым веществом, называемым адсорбентом, отдельных компонентов газовой смеси.
Основным принципом работы мембранных систем является разница в скорости проникновения компонентов газа через вещество мембраны. Движущей силой разделения газов является разница парциальных давлений на различных сторонах мембраны.
В основе работы криогенных установок разделения воздуха лежит метод разделения газовых смеси, основанный на разности температур кипения компонентов воздуха и различии составов находящихся в равновесии жидких и паровых смесей.
Химические свойства азота
При нормальных условиях азот химически малоактивен.
1. Азот проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому азот реагирует с металлами и неметаллами.
1.1. Молекулярный азот при обычных условиях с кислородом не реагирует. Реагирует с кислородом только при высокой температуре (2000оС), на электрической дуге (в природе – во время грозы):
N2 + O2 ⇄ 2NO – Q
Процесс эндотермический, т.е. протекает с поглощением теплоты.
1.2. При сильном нагревании (2000оС или действие электрического разряда) азот реагирует с серой, фосфором, мышьяком, углеродом с образованием бинарных соединений:
2С + N2 → N≡C–C≡N
1.3. Азот взаимодействует с водородом при высоком давлении и высокой температуре ,в присутствии катализатора. При этом образуется аммиак:
N2 + ЗН2 ⇄ 2NH3
Этот процесс экзотермический, т.е. протекает с выделением теплоты.
1.4. Азот реагирует с активными металлами: с литием при комнатной температуре, кальцием, натрием и магнием при нагревании. При этом образуются бинарные соединения-нитриды.
Например, литий реагирует с азотом с образованием нитрида лития:
N2 + 6Li → 2Li3N
2. Со сложными веществами азот практически не реагирует из-за крайне низкой реакционной способности.
Взаимодействие возможно только в жестких условиях с активными веществами, например, сильными восстановителями.
Например, азот окисляет гидрид лития:
N2 + 3LiH → Li3N + NH3
Аммиак
Строение молекулы и физические свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3о:
У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск
ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например, аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
2NH4Cl + Са(OH)2 → CaCl2 + 2NH3 + 2Н2O
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например, гидролиз нитрида кальция:
Ca3N2 + 6H2O → ЗСа(OH)2 + 2NH3
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
N2 + 3Н2 ⇄ 2NH3
Процесс проводят при температуре 500-550оС и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H+), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
:NH3 + H2O ⇄ NH4+ + OH–
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание. При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например, аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
NH3 + H2SO4 → NH4HSO4
2NH3 + H2SO4 → (NH4)2SO4
Еще один пример: аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
NH3 + H2O + CO2 → NH4HCO3
2NH3 + H2O + CO2 → (NH4)2CO3
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов, образуя нерастворимые гидроксиды.
Например, водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
FeSO4 + 2NH3 + 2H2O → Fe(OH)2 + (NH4)2SO4
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – амминокомплексы.
Например, хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
4NH3 + CuCl2 → [Cu(NH3)4]Cl2
Гидроксид меди (II) растворяется в избытке аммиака:
4NH3 + Cu(OH)2 → [Cu(NH3)4](OH)2
5. Аммиак горит на воздухе, образуя азот и воду:
4NH3 + 3O2 → 2N2 + 6H2O
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
4NH3 + 5O2 → 4NO + 6H2O
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя, например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием. С металлами реагирует только жидкий аммиак.
Например, жидкий аммиак реагирует с натрием с образованием амида натрия:
2NH3 + 2Na → 2NaNH2 + H2
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например, аммиак окисляется хлором до молекулярного азота:
2NH3 + 3Cl2 → N2 + 6HCl
Пероксид водорода также окисляет аммиак до азота:
2NH3 + 3H2O2 → N2 + 6H2O
Оксиды металлов, которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например, оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Соли аммония
Соли аммония – это соли, состоящие из катиона аммония и аниона кислотного остатка.
Способы получения солей аммония
1. Соли аммония можно получить взаимодействием аммиака с кислотами. Реакции подробно описаны выше.
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Например, хлорид аммония реагирует с нитратом серебра:
NH4Cl + AgNO3 → AgCl + NH4NO3
3. Средние соли аммония можно получить из кислых солей аммония. При добавлении аммиака кислая соль переходит в среднюю.
Например, гидрокарбонат аммония реагирует с аммиаком с образованием карбоната аммония:
NH4НCO3 + NH3 → (NH4)2CO3
Химические свойства солей аммония
1. Все соли аммония – сильные электролиты, почти полностью диссоциируют на ионы в водных растворах:
NH4Cl ⇄ NH4+ + Cl–
2. Соли аммония проявляют свойства обычных растворимых солей –вступают в реакции обмена с щелочами, кислотами и растворимыми солями, если в продуктах образуется газ, осадок или образуется слабый электролит.
Например, карбонат аммония реагирует с соляной кислотой. При этом выделяется углекислый газ:
(NH4)2CO3 + 2НCl → 2NH4Cl + Н2O + CO2
Соли аммония реагируют с щелочами с образованием аммиака.
Например, хлорид аммония реагирует с гидроксидом калия:
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
3. Соли аммония подвергаются гидролизу по катиону, т.к. гидроксид аммония — слабое основание:
NH4Cl + Н2O ↔ NH3 ∙ H2O + HCl
NH4+ + HOH ↔ NH3 ∙ H2O + H+
4. При нагревании соли аммония разлагаются. При этом если соль не содержит анион-окислителя, то разложение проходит без изменения степени окисления атома азота. Так разлагаются хлорид, карбонат, сульфат, сульфид и фосфат аммония:
NH4Cl → NH3 + HCl
NH4HCO3 → NH3 + CO2 + H2O
(NH4)2SO4 → NH4HSO4 + NH3
NH4HS → NH3 + H2S
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
NH4NO2 → N2 + 2H2O
190 – 245° C:
NH4NO3 → N2O + 2H2O
При температуре 250 – 300°C:
2NH4NO3 → 2NO + 4H2O
При температуре выше 300°C:
2NH4NO3 → 2N2 + O2 + 4H2O
Разложение бихромата аммония («вулканчик»). Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
(NH4)2Cr2O7 → Cr2O3 + N2 + 4H2O
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Видеоопыт разложения дихромата аммония можно посмотреть здесь.
Оксиды азота
| Оксиды азота | Цвет | Фаза | Характер оксида |
| N2O Оксид азота (I), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| NO Оксид азота (II), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| N2O3 Оксид азота (III), азотистый ангидрид | синий | жидкость | кислотный |
| NO2 Оксид азота (IV), диоксид азота, «лисий хвост» | бурый | газ | кислотный (соответствуют две кислоты) |
| N2O5 Оксид азота (V), азотный ангидрид | бесцветный | твердый | кислотный |
Оксид азота (I)
Оксид азота (I) – это несолеобразующий оксид. Малые концентрации закиси азота вызывают лёгкое опьянение (отсюда название — «веселящий газ»). При вдыхании чистого газа быстро развиваются состояние опьянения и сонливость. Закись азота обладает слабой наркотической активностью, в связи с чем в медицине её применяют в больших концентрациях. В смеси с кислородом при правильном дозировании (до 80 % закиси азота) вызывает хирургический наркоз.
Строение молекулы оксида азота (I) нельзя описать методом валентных связей. Так как оксид азота (I) состоит из двух, так называемых резонансных структур, которые переходят одна в другую:
Общую формулу в таком случае можно задать, обозначая изменяющиеся связи в резонансных структурах пунктиром:
Получить оксид азота (I) в лаборатории можно разложением нитрата аммония:
NH4NO3 → N2O + 2H2O
Химические свойства оксида азота (I):
1. При нормальных условиях оксид азота (I) инертен. При нагревании проявляет свойства окислителя. Оксид азота (I) при нагревании окисляет водород, аммиак, металлы, сернистый газ и др. При этом азот восстанавливается в простое вещество.
N2O + H2 → N2 + H2O
N2O + Mg → N2 + MgO
N2O + 2Cu → N2 + Cu2O
3N2O + 2NH3 → 4N2 + 3H2O
N2O + H2O + SO2 → N2 + H2SO4
Еще пример: оксид азота (I) окисляет углерод и фосфор при нагревании:
N2O + C → N2 + CO
5N2O + 2Р → 5N2 + Р2O5
2. При взаимодействии с сильными окислителями N2O может проявлять свойства восстановителя.
Например, N2O окисляется раствором перманганата в серной кислоте:
5N2O + 3H2SO4 + 2KMnO4 → 10NO + 2MnSO4 + K2SO4 + 3H2O
Оксид азота (II)
Оксид азота (II) – это несолеобразующий оксид. В нормальных условиях это бесцветный ядовитый газ, плохо растворимый в воде. На воздухе коричневеет из-за окисления до диоксида азота. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет.
Способы получения.
1. В лаборатории оксид азота (II) получают действием разбавленной азотной кислоты (30%) на неактивные металлы.
Например, при действии 30 %-ной азотной кислоты на медь образуется NO:
3Cu + HNO3(разб.) → 3Cu(NO3)2 + 2NO + 4H2O
Также NO можно получить при окислении хлорида железа (II) или иодоводорода азотной кислотой:
3FeCl2 + NaNO3 + 4HCl → 3FeCl3 + NaCl + NO + 2H2O
2HNO3 + 6HI → 2NO + I2 + 4H2O
2. В природе оксид азота (II) образуется из азота и кислорода под действием электрического разряда, например, во время грозы:
N2 + O2 → 2NO
3. В промышленности оксид азота (II) получают каталитическим окислением аммиака:
4NH3 + 5O2 → 4NO + 6H2O
Химические свойства.
1. Оксид азота (II) легко окисляется под действием окислителей.
Например, горит в атмосфере кислорода:
2NO + O2 → 2NO2
Оксид азота (II) легко окисляется под действием хлора или озона:
2NO + Cl2 → 2NOCl
NO + O3 → NO2 + O2
2. В присутствии более сильных восстановителей проявляет свойства окислителя. В атмосфере оксида азота (II) могут гореть водород, углерод и т.п.
Например, оксид азота (II) окисляет водород и сернистый газ:
2NO + 2H2 → N2 + 2H2O
2NO + 2SO2 → 2SO3 + N2
Оксид азота (III)
Оксид азота (III), азотистый ангидрид – кислотный оксид. За счет азота со степенью окисления +3 проявляет восстановительные и окислительные свойства. Устойчив только при низких температурах, при более высоких температурах разлагается.
Способы получения: можно получить при низкой температуре из оксидов азота:
NO2 + NO ↔ N2O3
Химические свойства:
1. Оксид азота (III) взаимодействует с водой с образованием азотистой кислоты:
N2O3 + H2O ↔ 2HNO2
2. Оксид азота (III) взаимодействует с основаниями и основными оксидами:
Например, оксид азота (III) реагирует с гидроксидом и оксидом натрия с образованием нитрита натрия и воды:
N2O3 + 2NaOH → 2NaNO2 + H2O
N2O3 + Na2O → 2NaNO2
Оксид азота (IV)
Оксид азота (IV) — бурый газ. Очень ядовит! Для NO2 характерна высокая химическая активность.
Способы получения.
1. Оксид азота (IV) образуется при окислении оксида азота (I) и оксида азота (II) кислородом или озоном:
2NO + O2 → 2NO2
2. Оксид азота (IV) образуется при действии концентрированной азотной кислоты на неактивные металлы.
Например, при действии концентрированной азотной кислоты на медь:
4HNO3(конц.) + Cu → Cu(NO3)2 + 2NO2 + 2H2O
3. Оксид азота (IV) образуется также при разложении нитратов металлов, которые в ряду электрохимической активности расположены правее магния (включая магний) и при разложении нитрата лития.
Например, при разложении нитрата серебра:
2AgNO3 → 2Ag + 2NO2 + O2
Химические свойства.
1. Оксид азота (IV) реагирует с водой с образованием двух кислот — азотной и азотистой:
2NO2 + H2O → HNO3 + HNO2
Если растворение NO2 в воде проводить в избытке кислорода, то образуется только азотная кислота:
4NO2 + 2H2O + O2 → 4HNO3
Поскольку азотистая кислота неустойчива, то при растворении NO2 в теплой воде образуются HNO3 и NO:
3NO2 + H2O → 2HNO3 + NO
2. При растворении оксида азота (IV) в щелочах образуются нитраты и нитриты:
2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O
4NO2 + 2Ca(OH)2 → Ca(NO2)2 + Ca(NO3)2 + 2H2O
В присутствии кислорода образуются только нитраты:
4NO2 + 4NaOH + O2 → 4NaNO3 + 2H2O
3. Оксид азота (IV) – сильный окислитель. В атмосфере оксида азота (IV) горят фосфор, уголь, сера, оксид серы (IV) окисляется до оксида серы (VI):
2NO2 + 2S → N2 + 2SO2
2NO2 + 2C → N2 + 2CO2
10NO2 + 8P → 5N2 + 4P2O5
NO2 + SO2 → SO3 + NO
4. Оксид азота (IV) димеризуется:
2NO2 ⇄ N2O4
Оксид азота (V)
N2O5– оксид азота (V), ангидрид азотной кислоты – кислотный оксид.
Получение оксида азота (V).
1. Получить оксид азота (V) можно окислением диоксида азота:
2NO2 + O3 → N2O5 + O2
2. Еще один способ получения оксида азота (V) – обезвоживание азотной кислоты сильным водоотнимающим веществом, оксидом фосфора (V):
2HNO3 + P2O5 → 2HPO3 + N2O5
Химические свойства оксида азота (V).
1. При растворении в воде оксид азота (V) образует азотную кислоту:
N2O5 + H2O → 2HNO3
2. Оксид азота (V), как типичный кислотный оксид, взаимодействует с основаниями и основными оксидами с образованием солей-нитратов.
Например, оксид азота (V) реагирует с гидроксидом натрия:
N2O5 + 2NaOH → 2NaNO3 + H2O
Еще пример: оксид азота (V) реагирует с оксидом кальция:
N2O5 + CaO → Ca(NO3)2
3. За счет азота со степенью окисления +5 оксид азота (V) – сильный окислитель.
Например, он окисляет серу:
2N2O5 + S → SO2 + 4NO2
4. Оксид азота (V) легко разлагается при нагревании (со взрывом):
2N2O5 → 4NO2 + O2
Азотная кислота
Строение молекулы и физические свойства
Азотная кислота HNO3 – это сильная одноосновная кислота-гидроксид. При обычных условиях бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении). Азотная кислота смешивается с водой во всех соотношениях. На свету частично разлагается.
Валентность азота в азотной кислоте равна IV, так как валентность V у азота отсутствует. При этом степень окисления атома азота равна +5. Так происходит потому, что атом азота образует 3 обменные связи и одну донорно-акцепторную, является донором электронной пары.
Поэтому строение молекулы азотной кислоты можно описать резонансными структурами:
Обозначим дополнительные связи между азотом и кислородом пунктиром. Этот пунктир по сути обозначает делокализованные электроны. Получается формула:
Способы получения
В лаборатории азотную кислоту можно получить разными способами:
1. Азотная кислота образуется при действии концентрированной серной кислоты на твердые нитраты металлов. При этом менее летучая серная кислота вытесняет более летучую азотную.
Например, концентрированная серная кислота вытесняет азотную из кристаллического нитрата калия:
KNO3 + H2SO4(конц) → KHSO4 + HNO3
2. В промышленности азотную кислоту получают из аммиака. Процесс осуществляется стадийно.
1 стадия. Каталитическое окисление аммиака.
4NH3 + 5O2 → 4NO + 6H2O
2 стадия. Окисление оксида азота (II) до оксида азота (IV) кислородом воздуха.
2NO + O2 → 2NO2
3 стадия. Поглощение оксида азота (IV) водой в присутствии избытка кислорода.
4NO2 + 2H2O + O2 → 4HNO3
Химические свойства
Азотная кислота – это сильная кислота. За счет азота со степенью окисления +5 азотная кислота проявляет сильные окислительные свойства.
1. Азотная кислота практически полностью диссоциирует в водном растворе.
HNO3 → H+ + NO3–
2. Азотная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например, азотная кислота взаимодействует с оксидом меди (II):
CuO + 2HNO3 → Cu(NO3)2 + H2O
Еще пример: азотная кислота реагирует с гидроксидом натрия:
HNO3 + NaOH → NaNO3 + H2O
3. Азотная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов, сульфитов).
Например, азотная кислота взаимодействует с карбонатом натрия:
2HNO3 + Na2CO3 → 2NaNO3 + H2O + CO2
4. Азотная кислота частично разлагается при кипении или под действием света:
4HNO3 → 4NO2 + O2 + 2H2O
5. Азотная кислота активно взаимодействует с металлами. При этом никогда не выделяется водород! При взаимодействии азотной кислоты с металлами окислителем всегда выступает азот +5. Азот в степени окисления +5 может восстанавливаться до степеней окисления -3, 0, +1, +2 или +4 в зависимости от концентрации кислоты и активности металла.
металл + HNO3 → нитрат металла + вода + газ (или соль аммония)
С алюминием, хромом и железом на холоду концентрированная HNO3 не реагирует – кислота «пассивирует» металлы, т.к. на их поверхности образуется пленка оксидов, непроницаемая для концентрированной азотной кислоты. При нагревании реакция идет. При этом азот восстанавливается до степени окисления +4:
Fe + 6HNO3(конц.) → Fe(NO3)3 + 3NO2 + 3H2O
Al + 6HNO3(конц.) → Al(NO3)3 + 3NO2 + 3H2O
Золото и платина не реагируют с азотной кислотой, но растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в соотношении 1 : 3 (по объему):
HNO3 + 3HCl + Au → AuCl3 + NO + 2H2O
Концентрированная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (IV), азот восстанавливается минимально:
4HNO3(конц.) + Cu → Cu(NO3)2 + 2NO2 + 2H2O
С активными металлами (щелочными и щелочноземельными) концентрированная азотная кислота реагирует с образованием оксида азота (I):
10HNO3 + 4Ca → 4Ca(NO3)2 + 2N2O + 5H2O
Разбавленная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (II).
8HNO3 (разб.) + 3Cu → 3Cu(NO3)2 + 2NO + 4H2O
С активными металлами (щелочными и щелочноземельными), а также оловом и железом разбавленная азотная кислота реагирует с образованием молекулярного азота:
12HNO3(разб) + 10Na → 10NaNO3 + N2 + 6H2O
При взаимодействии кальция и магния с азотной кислотой любой концентрации (кроме очень разбавленной) образуется оксид азота (I):
10HNO3 + 4Ca → 4Ca(NO3)2 + 2N2O + 5H2O
Очень разбавленная азотная кислота реагирует с металлами с образованием нитрата аммония:
10HNO3 + 4Zn → 4Zn(NO3)2 + NH4NO3 + 3H2O
Таблица. Взаимодействие азотной кислоты с металлами.
| Азотная кислота | ||||
| Концентрированная | Разбавленная | |||
| с Fe, Al, Cr | с неактивными металлами и металлами средней активности (после Al) | с щелочными и щелочноземельными металлами | с неактивными металлами и металлами средней активности (после Al) | с металлами до Al в ряду активности, Sn, Fe |
| пассивация при низкой Т | образуется NO2 | образуется N2O | образуется NO | образуется N2 |
6. Азотная кислота окисляет и неметаллы (кроме кислорода, водорода, хлора, фтора и некоторых других). При взаимодействии с неметаллами HNO3 обычно восстанавливается до NO или NO2, неметаллы окисляются до соответствующих кислот, либо оксидов (если кислота неустойчива).
Например, азотная кислота окисляет серу, фосфор, углерод, йод:
6HNO3 + S → H2SO4 + 6NO2 + 2H2O
Безводная азотная кислота – сильный окислитель. Поэтому она легко взаимодействует с красным и белым фосфором. Реакция с белым фосфором протекает очень бурно. Иногда она сопровождается взрывом.
5HNO3 + P → H3PO4 + 5NO2 + H2O
5HNO3 + 3P + 2H2O → 3H3PO4 + 5NO
Видеоопыт взаимодействия фосфора с безводной азотной кислотой можно посмотреть здесь.
4HNO3 + C → CO2 + 4NO2 + 2H2O
Видеоопыт взаимодействия угля с безводной азотной кислотой можно посмотреть здесь.
10HNO3 + I2 → 2HIO3 + 10NO2 + 4H2O
7. Концентрированная азотная кислота окисляет сложные вещества (в которых есть элементы в отрицательной, либо промежуточной степени окисления): сульфиды металлов, сероводород, фосфиды, йодиды, соединения железа (II) и др. При этом азот восстанавливается до NO2, неметаллы окисляются до соответствующих кислот (или оксидов), а металлы окисляются до устойчивых степеней окисления.
Например, азотная кислота окисляет оксид серы (IV):
2HNO3 + SO2 → H2SO4 + 2NO2
Еще пример: азотная кислота окисляет йодоводород:
6HNO3 + HI → HIO3 + 6NO2 + 3H2O
Азотная кислота окисляет углерод до углекислого газа, т.к. угольная кислота неустойчива.
3С + 4HNO3 → 3СО2 + 4NO + 2H2O
Сера в степени окисления -2 окисляется без нагревания до простого вещества, при нагревании до серной кислоты.
Например, сероводород окисляется азотной кислотой без нагревания до молекулярной серы:
2HNO3 + H2S → S + 2NO2 + 2H2O
При нагревании до серной кислоты:
2HNO3 + H2S → H2SO4 + 2NO2 + 2H2O
8HNO3 + CuS → CuSO4 + 8NO2 + 4H2O
Соединения железа (II) азотная кислота окисляет до соединений железа (III):
4HNO3 + FeS → Fe(NO3)3 + NO + S + 2H2O
8. Азотная кислота окрашивает белки в оранжево-желтый цвет («ксантопротеиновая реакция»).
Ксантопротеиновую реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляем концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака окраска переходит в оранжевую.
Видеоопыт обнаружения белков с помощью азотной кислоты можно посмотреть здесь.
Азотистая кислота
Азотистая кислота HNO2— слабая, одноосновная, химически неустойчивая кислота.
Получение азотистой кислоты.
Азотистую кислоту легко получить вытеснением из нитритов более сильной кислотой.
Например, соляная кислота вытесняет азотистую кислоту из нитрита серебра:
AgNO2 + HCl → HNO2 + AgCl
Химические свойства.
1. Азотистая кислота HNO2 существует только в разбавленных растворах, при нагревании она разлагается:
3HNO2 → HNO3 + 2NO + H2O
без нагревания азотистая кислота также разлагается:
2HNO2 → NO2 + NO + H2O
2. Азотистая кислота взаимодействует с сильными основаниями.
Например, с гидроксидом натрия:
HNO2 + NaOH → NaNO2 + H2O
3. За счет азота в степени окисления +3 азотистая кислота проявляет слабые окислительные свойства. Окислительные свойства HNO2 проявляет только при взаимодействии с сильными восстановителями.
Например, HNO2 окисляет иодоводород:
2HNO2 + 2HI → 2NO + I2 + 2H2O
Азотистая кислота также окисляет иодиды в кислой среде:
2НNO2 + 2KI + 2H2SO4 → K2SO4 + I2 + 2NO + 2H2O
Азотистая кислота окисляет соединения железа (II):
2HNO2 + 3H2SO4 + 6FeSO4 → 3Fe2(SO4)3 + N2 + 4H2O
4. За счет азота в степени окисления +3 азотистая кислота проявляет сильные восстановительные свойства. Под действием окислителей азотистая кислота переходит в азотную.
Например, хлор окисляет азотистую кислоту до азотной кислоты:
HNO2 + Cl2 + H2O → HNO3 + 2HCl
Кислород и пероксид водорода также окисляют азотистую кислоту:
2HNO2 + O2 → 2HNO3
HNO2 + H2O2 → HNO3 + H2O
Соединения марганца (VII) окисляют HNO2:
5HNO2 + 2HMnO4 → 2Mn(NO3)2 + HNO3 + 3H2O
Соли азотной кислоты — нитраты
Нитраты металлов — это твердые кристаллические вещества. Большинство очень хорошо растворимы в воде.
1. Нитраты термически неустойчивы, причем все они разлагаются на кислород и соединение, характер которого зависит от положения металла (входящего в состав соли) в ряду напряжений металлов:
- Нитраты щелочных и щелочноземельных металлов (до Mg в электрохимическом ряду) разлагаются до нитрита и кислорода.
Например, разложение нитрата натрия:
2KNO3 → 2KNO2 + O2
Исключение – литий.
Видеоопыт разложения нитрата калия можно посмотреть здесь.
- Нитраты тяжелых металлов (от Mg до Cu, включая магний и медь) и литий разлагаются до оксида металла, оксида азота (IV) и кислорода:
Например, разложение нитрата меди (II):
2Cu(NO3)2 → 2CuO + 4NO2 + O2
- Нитраты малоактивных металлов (правее Cu) – разлагаются до металла, оксида азота (IV) и кислорода.
Например, нитрат серебра:
2AgNO3 → 2Ag + 2NO2 + O2
Исключения:
Нитрит железа (II) разлагается до оксида железа (III):
4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2
Нитрат марганца (II) разлагается до оксида марганца (IV):
Mn(NO3)2 → MnO2 + 2NO2
2. Водные растворы не обладают окислительно-восстановительными свойствами, расплавы – сильные окислители.
Например, смесь 75% KNO3, 15% C и 10% S называют «черным порохом»:
2KNO3 + 3C + S → N2 + 3CO2 + K2S
Соли азотистой кислоты — нитриты
Соли азотистой кислоты устойчивее самой кислоты, и все они ядовиты. Поскольку степень окисления азота в нитритах равна +3, то они проявляют как окислительные свойства, так и восстановительные.
Кислород, галогены и пероксид водорода окисляют нитриты до нитратов:
2KNO2 + O2 → 2KNO3
KNO2 + H2O2 → KNO3 + H2O
KNO2 + H2O + Br2 → KNO3 + 2HBr
Лабораторные окислители — перманганаты, дихроматы — также окисляют нитриты до нитратов:
5KNO2 + 3H2SO4 + 2KMnO4 → 5KNO3 + 2MnSO4 + K2SO4 + 3H2O
3KNO2 + 4H2SO4 + K2Cr2O7 → 3KNO3 + Cr2(SO4)3 + K2SO4 + 4H2O
В кислой среде нитриты выступают в качестве окислителей.
При окислении йодидов или соединений железа (II) нитриты восстанавливаются до оксида азота (II):
2KNO2 + 2H2SO4 + 2KI → 2NO + I2 + 2K2SO4 + 2H2O
2KNO2 + 2FeSO4 + 2H2SO4 → Fe2(SO4)3 + 2NO + K2SO4 + 2H2O
При взаимодействии с очень сильными восстановителями (алюминий или цинк в щелочной среде) нитриты восстанавливаются максимально – до аммиака:
NaNO2 + 2Al + NaOH + 6H2O → 2Na[Al(OH)4] + NH3
Смесь нитратов и нитритов также проявляет окислительные свойства. Например, смесь нитрата и нитрита калия окисляет оксид хрома (III) до хромата калия:
3KNO2 + Cr2O3 + KNO3 → 2K2CrO4 + 4NO
Азот: что это такое и где он используется?
Во-первых, это инертный газ. Он не имеет запаха, цвета и не поддерживает жизнь, однако он важен для роста растений и является ключевой добавкой в удобрениях. Его применение распространяется далеко за пределы садоводства. Азот обычно имеет жидкую или газообразную форму (однако также можно получить твердый азот). Жидкий азот используется в качестве хладагента, который способен быстро замораживать продукты и объекты медицинских исследований, а также для репродуктивных технологий. Для пояснения мы остановимся на газообразном азоте.Азот широко используется, главным образом, по причине того, что он не вступает в реакцию с другими газами, в отличие от кислорода, который является крайне реактивным. Из-за своего химического состава атомам азота требуется больше энергии для разрушения и взаимодействия с другими веществами. С другой стороны, молекулы кислорода легче разрываются, поэтому газ становится гораздо более реактивным. Газообразный азот обладает противоположными свойствами, обеспечивая, при необходимости, инертную среду.
Отсутствие реакционной способности у азота является его самым важным качеством. В результате газ используется для предотвращения медленного и быстрого окисления. Электронная промышленность представляет собой прекрасный пример такого использования, поскольку при производстве печатных плат и других небольших компонентов может возникать медленное окисление в виде коррозии. Кроме того, медленное окисление характерно для производства продуктов питания и напитков, в этом случае азот используется для замещения или замены воздуха, чтобы лучше сохранить конечный продукт. Взрывы и пожары являются хорошим примером быстрого окисления, поскольку для их распространения требуется кислород. Удаление кислорода из резервуара с помощью азота уменьшает вероятность возникновения этих аварий.
Если в системе необходимо использовать азот, то рекомендуется рассмотреть три основных способа получения газа. Первым является аренда резервуара с азотом на месте и подача газа, вторым — использование газообразного азота, поставляемого в баллонах под высоким давлением. Третьим способом является производство собственного азота с использованием сжатого воздуха. Покупка или аренда азота может оказаться очень неудобной, неэффективной и дорогостоящей, поскольку приходится иметь дело со сторонним поставщиком. По этим причинам многие компании отказались от аренды и приняли решение производить свой собственный азот с возможностью контроля количества, чистоты и давления для требуемого применения. Дополнительные преимущества включают стабильную стоимость, отсутствие транспортных расходов или задержек, устранение опасностей, связанных с криогенным хранением, и исключение отходов, вызванных потерями от испарения или возврата баллонов под высоким давлением, которые никогда не опустошаются полностью.
Существует два типа генераторов азота: мембранные генераторы азота, а также генераторы азота PSA (адсорбция при переменном давлении), которые обеспечивают очень высокую чистоту 99,999% или 10 PPM (частей на миллион) и даже выше. Узнайте больше о последнем варианте здесь.
Многоликий азот: одним — польза, другим — вред | Научные открытия и технические новинки из Германии | DW
Атмосфера Земли более чем на три четверти состоит из азота. Казалось бы, какая опасность для окружающей среды может от него исходить? Однако дело в том, что если элементарный азот химически чрезвычайно инертен, то различные его соединения, напротив, проявляют весьма высокую реакционную активность.
В то же время азот является элементом, без которого существование животных и растений невозможно: он входит в состав всех нуклеиновых кислот, белков, хлорофилла и так далее. Однако связывать элементарный атмосферный азот высшие растения и животные не могут. В усваиваемую ими форму молекулы азота переводят определенные виды микроорганизмов.
Антропогенный фактор
Круговорот азота в природе — это цепочка сложных реакций и превращений, сформировавшаяся в процессе эволюции жизни на Земле и, казалось бы, устоявшаяся очень прочно. «Высокореактивный азот в природе, по вполне понятным причинам, редок, — говорит британский исследователь Марк Саттон (Mark Sutton), сотрудник Центра экологии и гидрологии в Эдинбурге. — Между тем, использовать его растения и животные могут только в такой форме. Поэтому биосфера за многие миллионы лет приспособилась обходиться малым количеством азота».
Однако с конца 19 века все заметнее становится влияние деятельности человека на эти процессы. В окружающую среду попадает все больше азотистых соединений: нитраты вносятся в почву в качестве искусственных минеральных удобрений, оксиды выбрасываются в атмосферу при сжигании ископаемых углеводородов, аммиак выделяется стадами коров, свиней, овец и прочих сельскохозяйственных животных.
Первая экспертная оценка
И вот теперь группа из 200 европейских экспертов во главе с Марком Саттоном представила результаты своего 5-летнего исследования, в ходе которого впервые был не только обобщен ущерб, наносимый окружающей среде избытком азота, но и ему была дана материальная оценка. «Мы получили теперь первое общее представление о положении вещей», — говорит руководитель проекта. Правда, некоторое удивление вызывает очень широкий диапазон в материальной оценке ущерба — по мнению Марка Саттона и его коллег, в Европе ущерб составляет от 70 до 320 миллиардов евро в год.
Ученый поясняет: «Это связано, прежде всего, с тем, что до сих пор не вполне понятно, как соотносить экологические факторы с экономическими. Очень трудно предложить денежный эквивалент, например, исчезновению какого-то вида растений или уменьшению продолжительности жизни вследствие загрязнения воздуха. Поэтому названные нами цифры носят очень приблизительный характер, а столь значительный разброс лишний раз это подчеркивает».
Сколько эффектов, столько и методик
Скажем, оценка ущерба, причиняемого здоровью оксидами азота в выхлопных газах, основывается на результатах опроса, в ходе которых респонденты сообщили, сколько они были бы готов заплатить, чтобы предотвратить этот ущерб. Каждый эффект, вызываемый избытком азота, оценивался по своей методике. Несмотря на такую приблизительность результатов, непричастные к этому исследованию специалисты отзываются о нем очень высоко.
В частности, американец Джеймс Геллоуэй (James N. Galloway), профессор Вирджинского университета в Шарлотсвилле, вот уже 30 лет занимающийся азотом, говорит: «Это великолепная работа. Это первое крупное региональное исследование, оценивающее не только биогеохимические аспекты круговорота азота, но и их воздействие на благополучие всего общества. Пусть даже конкретные цифры не вполне точны, важно, что первый шаг в нужном направлении сделан. Кроме того, этот документ и в нынешнем виде может послужить серьезным подспорьем для политиков при принятии решений».
Если бы все европейцы были вегетарианцами
Может показаться странным, что такое исследование не было проведено раньше, однако это объясняется сложностью процессов круговорота азота. Скажем, оксиды азота загрязняют атмосферу и вызывают кислотные дожди. Пролившись на лес, такой дождь служит удобрением для тех или иных растений, нарушая видовое равновесие экосистемы. А попав в водоемы, азот способствует их эвтрофикации, то есть перенасыщению питательными веществами, и, соответственно, повышению биопродуктивности.
Весь этот сложный каскад событий в окружающей среде, связанных с круговоротом азота, открылся исследователям лишь в последние годы. Теперь же они разрабатывают практические рекомендации. Например, оптимизация технологии внесения удобрений поможет сократить их количество на две трети. А еще европейцам следовало бы есть поменьше мяса — ведь при производстве животных белков в окружающую среду попадает гораздо больше азота, чем при производстве такого же количества растительных белков. Если бы вдруг все европейцы стали вегетарианцами, 70 процентов азотистых удобрений оказались бы лишними.
Автор: Владимир Фрадкин
Редактор: Дарья Брянцева
АЗОТ | Энциклопедия Кругосвет
Содержание статьиАЗОТ, N (nitrogenium), химический элемент (ат. номер 7) VA подгруппы периодической системы элементов. Атмосфера Земли содержит 78% (об.) азота. Чтобы показать, как велики эти запасы азота, отметим, что в атмосфере над каждым квадратным километром земной поверхности находится столько азота, что из него можно получить до 50 млн. т нитрата натрия или 10 млн. т аммиака (соединение азота с водородом), и все же это составляет малую долю азота, содержащегося в земной коре. Существование свободного азота свидетельствует о его инертности и трудности взаимодействия с другими элементами при обычной температуре. Связанный азот входит в состав как органической, так и неорганической материи. Растительный и животный мир содержит азот, связанный с углеродом и кислородом в белках. Помимо этого, известны и могут быть получены в больших количествах азотсодержащие неорганические соединения, такие, как нитраты (NO3–), нитриты (NO2–), цианиды (CN–), нитриды (N3–) и азиды (N3–).
Историческая справка.
Опыты А.Лавуазье, посвященные исследованию роли атмосферы в поддержании жизни и процессов горения, подтвердили существование относительно инертного вещества в атмосфере. Не установив элементную природу остающегося после сгорания газа, Лавуазье назвал его azote, что на древнегреческом означает «безжизненный». В 1772 Д.Резерфорд из Эдинбурга установил, что этот газ является элементом, и назвал его «вредный воздух». Латинское название азота происходит от греческих слов nitron и gen, что означает «образующий селитру».
Фиксация азота и азотный цикл.
Термин «фиксация азота» означает процесс связывания атмосферного азота N2. В природе это может происходить двумя путями: либо бобовые растения, например горох, клевер и соя, накапливают на своих корнях клубеньки, в которых бактерии, фиксирующие азот, превращают его в нитраты, либо происходит окисление атмосферного азота кислородом в условиях разряда молнии. С.Аррениус установил, что таким способом фиксируется до 400 млн. т азота ежегодно. В атмосфере оксиды азота соединяются с дождевой водой, образуя азотную и азотистую кислоты. Кроме того, установлено, что с дождем и снегом на каждый гектар земли попадает ок. 6700 г азота; достигая почвы, они превращаются в нитриты и нитраты. Растения используют нитраты для образования растительных белковых веществ. Животные, питаясь этими растениями, усваивают белковые вещества растений и превращают их в животные белки. После смерти животных и растений происходит их разложение, азотные соединения превращаются в аммиак. Аммиак используется двумя путями: бактерии, не образующие нитратов, разрушают его до элементов, выделяя азот и водород, а другие бактерии образуют из него нитриты, которые другими бактериями окисляются до нитратов. Таким образом происходит круговорот азота в природе, или азотный цикл.
Строение ядра и электронных оболочек.
В природе существуют два стабильных изотопа азота: с массовым числом 14 ( содержит 7 протонов и 7 нейтронов) и с массовым числом 15 ( содержит 7 протонов и 8 нейтронов). Их соотношение составляет 99,635:0,365, поэтому атомная масса азота равна 14,008. Нестабильные изотопы азота 12N, 13N, 16N, 17N получены искусственно. Схематически электронное строение атома азота таково: 1s22s22px12py12pz1. Следовательно, на внешней (второй) электронной оболочке находится 5 электронов, которые могут участвовать в образовании химических связей; орбитали азота могут также принимать электроны, т.е. возможно образование соединений со степенью окисления от (–III) до (V), и они известны. См. также АТОМА СТРОЕНИЕ.
Молекулярный азот.
Из определений плотности газа установлено, что молекула азота двухатомна, т.е. молекулярная формула азота имеет вид NєN (или N2). У двух атомов азота три внешних 2p-электрона каждого атома образуют тройную связь:N:::N:, формируя электронные пары. Измеренное межатомное расстояние N–N равно 1,095 Å. Как и в случае с водородом (см. ВОДОРОД), существуют молекулы азота с различным спином ядра – симметричные и антисимметричные. При обычной температуре соотношение симметричной и антисимметричной форм равно 2:1. В твердом состоянии известны две модификации азота: a – кубическая и b – гексагональная с температурой перехода a ® b –237,39° С. Модификация b плавится при –209,96° С и кипит при –195,78° C при 1 атм (см. табл. 1).
Энергия диссоциации моля (28,016 г или 6,023Ч1023 молекул) молекулярного азота на атомы (N2 2N) равна примерно –225 ккал. Поэтому атомарный азот может образовываться при тихом электрическом разряде и химически более активен, чем молекулярный азот.
Получение и применение.
Способ получения элементного азота зависит от требуемой его чистоты. В огромных количествах азот получают для синтеза аммиака, при этом допустимы небольшие примеси благородных газов.
Азот из атмосферы.
Экономически выделение азота из атмосферы обусловлено дешевизной метода сжижения очищенного воздуха (пары воды, CO2, пыль, другие примеси удалены). Последовательные циклы сжатия, охлаждения и расширения такого воздуха приводят к его сжижению. Жидкий воздух подвергают фракционной перегонке при медленном подъеме температуры. Первыми выделяются благородные газы, затем азот, и остается жидкий кислород. Очистка достигается многократностью процессов фракционирования. Таким методом производят многие миллионы тонн азота ежегодно, преимущественно для синтеза аммиака, который является исходным сырьем в технологии производства различных азотсодержащих соединений для промышленности и сельского хозяйства. Кроме того, очищенную азотную атмосферу часто используют, когда недопустимо присутствие кислорода.
Лабораторные способы.
Азот в небольших количествах можно получать в лаборатории разными способами, окисляя аммиак или ион аммония, например:
Очень удобен процесс окисления иона аммония нитрит-ионом:
Известны и другие способы – разложение азидов при нагревании, разложение аммиака оксидом меди(II), взаимодействие нитритов с сульфаминовой кислотой или мочевиной:
При каталитическом разложении аммиака при высокой температуре тоже можно получить азот:
Физические свойства.
Некоторые физические свойства азота приведены в табл. 1.
| Таблица 1. НЕКОТОРЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА АЗОТА | |
| Плотность, г/см3 | 0,808 (жидк.) |
| Температура плавления, °С | –209,96 |
| Температура кипения, °С | –195,8 |
| Критическая температура, °С | –147,1 |
| Критическое давление, атма | 33,5 |
| Критическая плотность, г/см3а | 0,311 |
| Удельная теплоемкость, Дж/(мольЧК) | 14,56 (15° С) |
| Электроотрицательность по Полингу | 3 |
| Ковалентный радиус, | 0,74 |
| Кристаллический радиус, | 1,4 (M3–) |
| Потенциал ионизации, Вб | |
| первый | 14,54 |
| второй | 29,60 |
| а Температура и давление, при которых плотности азота жидкого и газообразного состояния одинаковы. б Количество энергии, необходимое для удаления первого внешнего и следующего за ним электронов, в расчете на 1 моль атомарного азота. |
|
Химические свойства.
Как уже было отмечено, преобладающим свойством азота при обычных условиях температуры и давления является его инертность, или малая химическая активность. Электронная структура азота содержит электронную пару на 2s-уровне и три наполовину заполненные 2р-орбитали, поэтому один атом азота может связывать не более четырех других атомов, т.е. его координационное число равно четырем. Небольшой размер атома также ограничивает количество атомов или групп атомов, которые могут быть связаны с ним. Поэтому многие соединения других членов подгруппы VA либо вовсе не имеют аналогов среди соединений азота, либо аналогичные соединения азота оказываются нестабильными. Так, PCl5 – стабильное соединение, а NCl5 не существует. Атом азота способен связываться с другим атомом азота, образуя несколько достаточно стабильных соединений, такие, как гидразин N2H4 и азиды металлов MN3. Такой тип связи необычен для химических элементов (за исключением углерода и кремния). При повышенных температурах азот реагирует со многими металлами, образуя частично ионные нитриды MxNy. В этих соединениях азот заряжен отрицательно. В табл. 2 приведены степени окисления и примеры соответствующих соединений.
| Таблица 2. СТЕПЕНИ ОКИСЛЕНИЯ АЗОТА И СООТВЕТСТВУЮЩИЕ СОЕДИНЕНИЯ | |
| Степень окисления | Примеры соединений |
| –III | Аммиак NH3, ион аммония NH4+, нитриды M3N2 |
| –II | Гидразин N2H4 |
| –I | Гидроксиламин NH2OH |
| I | Гипонитрит натрия Na2N2O2, оксид азота(I) N2O |
| II | Оксид азота(II) NO |
| III | Оксид азота(III) N2O3, нитрит натрия NaNO2 |
| IV | Оксид азота(IV) NO2, димер N2O4 |
| V | Оксид азота(V) N2O5, азотная кислота HNO3 и ее соли (нитраты) |
Нитриды.
Соединения азота с более электроположительными элементами, металлами и неметаллами – нитриды – похожи на карбиды и гидриды. Их можно разделить в зависимости от характера связи M–N на ионные, ковалентные и с промежуточным типом связи. Как правило, это кристаллические вещества.
Ионные нитриды.
Связь в этих соединениях предполагает переход электронов от металла к азоту с образованием иона N3–. К таким нитридам относятся Li3N, Mg3N2, Zn3N2 и Cu3N2. Кроме лития, другие щелочные металлы IA подгруппы нитридов не образуют. Ионные нитриды имеют высокие температуры плавления, реагируют с водой, образуя NH3 и гидроксиды металлов.
Ковалентные нитриды.
Когда электроны азота участвуют в образовании связи совместно с электронами другого элемента без перехода их от азота к другому атому, образуются нитриды с ковалентной связью. Нитриды водорода (например, аммиак и гидразин) полностью ковалентны, как и галогениды азота (NF3 и NCl3). К ковалентным нитридам относятся, например, Si3N4, P3N5 и BN – высокостабильные белые вещества, причем BN имеет две аллотропные модификации: гексагональную и алмазоподобную. Последняя образуется при высоких давлениях и температурах и имеет твердость, близкую к твердости алмаза.
Нитриды с промежуточным типом связи.
Переходные элементы в реакции с NH3 при высокой температуре образуют необычный класс соединений, в которых атомы азота распределены между регулярно расположенными атомами металла. В этих соединениях нет четкого смещения электронов. Примеры таких нитридов – Fe4N, W2N, Mo2N, Mn3N2. Эти соединения, как правило, совершенно инертны и обладают хорошей электрической проводимостью.
Водородные соединения азота.
Азот и водород взаимодействуют, образуя соединения, отдаленно напоминающие углеводороды (см. также ОРГАНИЧЕСКАЯ ХИМИЯ). Стабильность азотоводородов уменьшается с увеличением числа атомов азота в цепи в отличие от углеводородов, которые устойчивы и в длинных цепях. Наиболее важные нитриды водорода – аммиак NH3 и гидразин N2H4. К ним относится также азотистоводородная кислота HNNN (HN3).
Аммиак Nh4.
Аммиак – один из наиболее важных промышленных продуктов современной экономики. В конце 20 в. США производили ок. 13 млн. т аммиака ежегодно (в пересчете на безводный аммиак).
Строение молекулы.
Молекула NH3 имеет почти пирамидальное строение. Угол связи H–N–H составляет 107°, что близко к величине тетраэдрического угла 109°. Неподеленная электронная пара эквивалентна присоединенной группе, в результате координационное число азота равно 4 и азот располагается в центре тетраэдра.
Cвойства аммиака.
Некоторые физические свойств аммиака в сравнении с водой приведены в табл. 3.
| Таблица 3. НЕКОТОРЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА АММИАКА И ВОДЫ | ||
| Свойство | Аммиак | Вода |
| Плотность, г/см3 | 0,65 (–10° С) | 1,00 (4,0° С) |
| Температура плавления, °С | –77,7 | 0 |
| Температура кипения, °С | –33,35 | 100 |
| Критическая температура, °С | 132 | 374 |
| Критическое давление, атм | 112 | 218 |
| Энтальпия испарения, Дж/г | 1368 (–33° С) | 2264 (100° С) |
| Энтальпия плавления, Дж/г | 351 (–77° С) | 334 (0° С) |
| Удельная электропроводность | 5Ч10–11 (–33° С) | 4Ч10–8 (18° С) |
Температуры кипения и плавления у аммиака намного ниже, чем у воды, несмотря на близость молекулярных масс и сходство строения молекул. Это объясняется относительно большей прочностью межмолекулярных связей у воды, чем у аммиака (такая межмолекулярная связь называется водородной).
Аммиак как растворитель.
Высокая диэлектрическая проницаемость и дипольный момент жидкого аммиака позволяют использовать его как растворитель для полярных или ионных неорганических веществ. Аммиак-растворитель занимает промежуточное положение между водой и органическими растворителями типа этилового спирта. Щелочные и щелочноземельные металлы растворяются в аммиаке, образуя темносиние растворы. Можно полагать, что в растворе происходит сольватация и ионизация валентных электронов по схеме
Синий цвет связывают с сольватацией и движением электронов или с подвижностью «дырок» в жидкости. При высокой концентрации натрия в жидком аммиаке раствор принимает бронзовую окраску и отличается высокой электропроводностью. Несвязанный щелочной металл можно выделить из такого раствора испарением аммиака или добавлением хлорида натрия. Растворы металлов в аммиаке являются хорошими восстановителями. В жидком аммиаке происходит автоионизация
аналогично процессу, протекающему в воде:
Некоторые химические свойства обеих систем сопоставлены в табл. 4.
Жидкий аммиак как растворитель имеет преимущество в некоторых случаях, когда невозможно проводить реакции в воде из-за быстрого взаимодействия компонентов с водой (например, окисление и восстановление). Например, в жидком аммиаке кальций реагирует с KCl с образованием CaCl2 и K, поскольку CaCl2 нерастворим в жидком аммиаке, а К растворим, и реакция протекает полностью. В воде такая реакция невозможна из-за быстрого взаимодействия Ca с водой.
Получение аммиака.
Газообразный NH3 выделяется из солей аммония при действии сильного основания, например, NaOH:
Метод применим в лабораторных условиях. Небольшие производства аммиака основаны также на гидролизе нитридов, например Mg3N2, водой. Цианамид кальция CaCN2 при взаимодействии с водой также образует аммиак. Основным промышленным методом получения аммиака является каталитический синтез его из атмосферного азота и водорода при высоких температуре и давлении:
Водород для этого синтеза получают термическим крекингом углеводородов, действием паров воды на уголь или железо, разложением спиртов парами воды или электролизом воды. На синтез аммиака получено множество патентов, отличающихся условиями проведения процесса (температура, давление, катализатор). Существует способ промышленного получения при термической перегонке угля. С технологической разработкой синтеза аммиака связаны имена Ф.Габера и К.Боша.
Химические свойства аммиака.
Кроме реакций, упомянутых в табл. 4, аммиак реагирует с водой, образуя соединение NH3ЧH2O, которое часто ошибочно считают гидроксидом аммония NH4OH; в действительности существование NH4OH в растворе не доказано. Водный раствор аммиака («нашатырный спирт») состоит преимущественно из NH3, H2O и и малых концентраций ионов NH4+ и OH–, образующихся при диссоциации
Основной характер аммиака объясняется наличием неподеленной электронной пары азота:NH3. Поэтому NH3 – это основание Льюиса, которое имеет высшую нуклеофильную активность, проявляемую в форме ассоциации с протоном, или ядром атома водорода:
Любые ион или молекула, способные принимать электронную пару (электрофильное соединение), будут взаимодействовать с NH3 с образованием координационного соединения. Например:
Символ Mn+ представляет ион переходного металла (B-подгруппы периодической таблицы, например, Cu2+, Mn2+ и др.). Любая протонная (т.е. Н-содержащая) кислота реагирует с аммиаком в водном растворе с образованием солей аммония, таких, как нитрат аммония NH4NO3, хлорид аммония NH4Cl, сульфат аммония (NH4)2SO4, фосфат аммония (NH4)3PO4. Эти соли широко применяются в сельском хозяйстве как удобрения для введения азота в почву. Нитрат аммония кроме того применяют как недорогое взрывчатое вещество; впервые оно было применено с нефтяным топливом (дизельным маслом). Водный раствор аммиака применяют непосредственно для введения в почву или с орошающей водой. Мочевина NH2CONH2, получаемая синтезом из аммиака и углекислого газа, также является удобрением. Газообразный аммиак реагирует с металлами типа Na и K с образованием амидов:
Аммиак реагирует с гидридами и нитридами также с образованием амидов:
Амиды щелочных металлов (например, NaNH2) реагируют с N2O при нагревании, образуя азиды:
Газообразный NH3 восстанавливает оксиды тяжелых металлов до металлов при высокой температуре, по-видимому, благодаря водороду, образующемуся в результате разложения аммиака на N2 и H2:
Атомы водорода в молекуле NH3 могут замещаться на галоген. Иод реагирует с концентрированным раствором NH3, образуя смесь веществ, содержащую NI3. Это вещество очень неустойчиво и взрывается при малейшем механическом воздействии. При реакции NH3 c Cl2 образуются хлорамины NCl3, NHCl2 и NH2Cl. При воздействии на аммиак гипохлорита натрия NaOCl (образуется из NaOH и Cl2) конечным продуктом является гидразин:
Гидразин.
Приведенные выше реакции представляют собой способ получения моногидрата гидразина состава N2H4ЧH2O. Безводный гидразин образуется при специальной перегонке моногидрата с BaO или другими водоотнимающими веществами. По свойствам гидразин слегка напоминает пероксид водорода H2O2. Чистый безводный гидразин – бесцветная гигроскопичная жидкость, кипящая при 113,5° C; хорошо растворяется в воде, образуя слабое основание
В кислой среде (H+) гидразин образует растворимые соли гидразония типа [NH2NH2H]+X–. Легкость, с которой гидразин и некоторые его производные (например, метилгидразин) реагируют с кислородом, позволяет использовать его в качестве компонента жидкого ракетного топлива. Гидразин и все его производные сильно ядовиты.
Оксиды азота.
В соединениях с кислородом азот проявляет все степени окисления, образуя оксиды: N2O, NO, N2O3, NO2 (N2O4), N2O5. Имеется скудная информация об образовании пероксидов азота (NO3, NO4).
Оксид азота(I)
N2O (монооксид диазота) получается при термической диссоциации нитрата аммония:
Молекула имеет линейное строение
N2O довольно инертен при комнатной температуре, но при высоких температурах может поддерживать горение легко окисляющихся материалов. N2O, известный как «веселящий газ», используют для умеренной анестезии в медицине.
Оксид азота(II)
NO – бесцветный газ, является одним из продуктов каталитической термической диссоциации аммиака в присутствии кислорода:
NO образуется также при термическом разложении азотной кислоты или при реакции меди с разбавленной азотной кислотой:
NO можно получать синтезом из простых веществ (N2 и O2) при очень высоких температурах, например в электрическом разряде. В структуре молекулы NO имеется один неспаренный электрон. Соединения с такой структурой взаимодействуют с электрическим и магнитным полями. В жидком или твердом состоянии оксид имеет голубую окраску, поскольку неспаренный электрон вызывает частичную ассоциацию в жидком состоянии и слабую димеризацию в твердом состоянии: 2NO N2O2.
Оксид азота(III)
N2O3 (триоксид азота) – ангидрид азотистой кислоты: N2O3 + H2O 2HNO2. Чистый N2O3 может быть получен в виде голубой жидкости при низких температурах (–20° С) из эквимолекулярной смеси NO и NO2. N2O3 устойчив только в твердом состоянии при низких температурах (т.пл. –102,3° С), в жидком и газообразном состояния он снова разлагается на NO и NO2.
Оксид азота(IV)
NO2 (диоксид азота) также имеет в молекуле неспаренный электрон (см. выше оксид азота(II)). В строении молекулы предполагается трехэлектронная связь, и молекула проявляет свойства свободного радикала (одна линия соответствует двум спаренным электронам):
NO2 получается каталитическим окислением аммиака в избытке кислорода или окислением NO на воздухе:
а также по реакциям:
При комнатной температуре NO2 – газ темнокоричневого цвета, обладает магнитными свойствами благодаря наличию неспаренного электрона. При температурах ниже 0° C молекула NO2 димеризуется в тетраоксид диазота, причем при –9,3° C димеризация протекает полностью: 2NO2 N2O4. В жидком состоянии недимеризовано только 1% NO2, а при 100° C остается в виде димера 10% N2O4.
NO2 (или N2O4) реагирует в теплой воде с образованием азотной кислоты: 3NO2 + H2O = 2HNO3 + NO. Технология NO2 поэтому очень существенна как промежуточная стадия получения промышленно важного продукта – азотной кислоты.
Оксид азота(V)
N2O5 (устар. ангидрид азотной кислоты) – белое кристаллическое вещество, получается обезвоживанием азотной кислоты в присутствии оксида фосфора P4O10:
N2O5 легко растворяется во влаге воздуха, вновь образуя HNO3. Свойства N2O5 определяются равновесием
N2O5 – хороший окислитель, легко реагирует, иногда бурно, с металлами и органическими соединениями и в чистом состоянии при нагреве взрывается. Вероятную структуру N2O5 можно представить как
Оксокислоты азота.
Для азота известны три оксокислоты: гипоазотистая H2N2O2, азотистая HNO2 и азотная HNO3.
Гипоазотистая кислота
H2N2O2 – очень нестабильное соединение, образуется в неводной среде из соли тяжелого металла – гипонитрита при действии другой кислоты: M2N2O2 + 2HX 2MX + H2N2O2. При выпаривании раствора образуется белое взрывчатое вещество с предполагаемой структурой H–O–N=N–O–H.
Азотистая кислота
HNO2 не существует в чистом виде, однако водные растворы ее невысокой концентрации образуются при добавлении серной кислоты к нитриту бария:
Азотистая кислота образуется также при растворении эквимолярной смеси NO и NO2 (или N2O3) в воде. Азотистая кислота немного сильнее уксусной кислоты. Степень окисления азота в ней +3 (ее структура H–O–N=O), т.е. она может являться и окислителем, и восстановителем. Под действием восстановителей она восстанавливается обычно до NO, а при взаимодействии с окислителями окисляется до азотной кислоты.
Скорость растворения некоторых веществ, например металлов или иодид-иона, в азотной кислоте зависит от концентрации азотистой кислоты, присутствующей в виде примеси. Соли азотистой кислоты – нитриты – хорошо растворяются в воде, кроме нитрита серебра. NaNO2 применяется в производстве красителей.
Азотная кислота
HNO3 – один из наиболее важных неорганических продуктов основной химической промышленности. Она используется в технологиях множества других неорганических и органических веществ, например, взрывчатых веществ, удобрений, полимеров и волокон, красителей, фармацевтических препаратов и др. См. также ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ.
азота | Определение, символ, использование, свойства, атомный номер и факты
азот (N) , неметаллический элемент 15 группы [Va] периодической таблицы. Это бесцветный газ без запаха и вкуса, который является наиболее распространенным элементом атмосферы Земли и является составной частью всего живого.
Британская викторина
118 Названия и символы из таблицы Менделеева
Периодическая таблица Менделеева состоит из 118 элементов.Насколько хорошо вы знаете их символы? В этой викторине вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
| атомный номер | 7 |
|---|---|
| атомный вес | 14.0067 |
| точка плавления | −209,86 ° C (−345,8 ° F) |
| точка кипения | −195,8 ° С (-320.4 ° F) |
| плотность (1 атм, 0 ° C) | 1,2506 г / литр |
| обычные степени окисления | −3, +3, +5 |
| электронная конфигурация | 1 s 2 2 s 2 2 p 3 |
История
Около четырех пятых атмосферы Земли составляет азот, который был выделен и признан в качестве особого вещества в ходе ранних исследований воздух.Карл Вильгельм Шееле, шведский химик, показал в 1772 году, что воздух представляет собой смесь двух газов, один из которых он назвал «огненным воздухом», потому что он поддерживает горение, а другой «грязным воздухом», потому что он остался после « огненный воздух ». «Огненный воздух» — это, конечно, кислород, а «грязный воздух» — азот. Примерно в то же время азот был признан шотландским ботаником Дэниелом Резерфордом (который первым опубликовал свои открытия), британским химиком Генри Кавендишем и британским священником и ученым Джозефом Пристли, который вместе с Шееле, дается заслуга в открытии кислорода.Более поздние исследования показали, что новый газ является составной частью селитры, общего названия нитрата калия (KNO 3 ), и, соответственно, французский химик Жан-Антуан-Клод Шапталь в 1790 году назвал его азотом. считался химическим элементом Антуаном-Лораном Лавуазье, чье объяснение роли кислорода в горении в конечном итоге опровергло теорию флогистона, ошибочный взгляд на горение, который стал популярным в начале 18 века. Неспособность азота поддерживать жизнь (по-гречески: zoe ) заставила Лавуазье назвать его азот , все еще французский эквивалент азота .
Возникновение и распространение
Среди элементов азот занимает шестое место по количеству в космосе. Атмосфера Земли состоит из 75,51 процента по весу (или 78,09 процента по объему) азота; это основной источник азота для торговли и промышленности. Атмосфера также содержит различные небольшие количества аммиака и солей аммония, а также оксидов азота и азотной кислоты (последние вещества образуются во время грозы и в двигателе внутреннего сгорания).Свободный азот содержится во многих метеоритах; в газах вулканов, шахт и некоторых минеральных источников; на солнце; и в некоторых звездах и туманностях.
Азот также присутствует в минеральных отложениях селитры или селитры (нитрат калия, KNO 3 ) и чилийской селитры (нитрат натрия, NaNO 3 ), но эти отложения существуют в количествах, которые совершенно не соответствуют потребностям человека. Еще один богатый азотом материал — гуано, которое можно найти в пещерах летучих мышей и в сухих местах, часто посещаемых птицами.В сочетании азот содержится в дожде и почве в виде аммиака и солей аммония, а в морской воде — в виде аммония (NH 4 + ), нитрита (NO 2 —) и нитрата (NO 3 . — ) ионы. Азот составляет в среднем около 16 процентов по массе сложных органических соединений, известных как белки, присутствующих во всех живых организмах. Естественное содержание азота в земной коре составляет 0,3 части на 1000 человек. Космическое содержание — предполагаемое общее содержание во Вселенной — составляет от трех до семи атомов на атом кремния, что считается стандартом.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасИндия, Россия, США, Тринидад и Тобаго и Украина входили в пятерку крупнейших производителей азота (в форме аммиака) в начале 21 века.
Промышленное производство и использование
Промышленное производство азота в основном осуществляется путем фракционной перегонки сжиженного воздуха. Температура кипения азота составляет -195,8 ° C (-320,4 ° F), что примерно на 13 ° C (-23 ° F) ниже, чем у кислорода, который поэтому остается позади.Азот также можно производить в больших масштабах путем сжигания углерода или углеводородов в воздухе и отделения образующихся диоксида углерода и воды от остаточного азота. В небольших масштабах чистый азот получают путем нагревания азида бария, Ba (N 3 ) 2 . Различные лабораторные реакции, дающие азот, включают нагревание растворов нитрита аммония (NH 4 NO 2 ), окисление аммиака бромной водой и окисление аммиака горячим оксидом меди.
Элементарный азот можно использовать в качестве инертной атмосферы для реакций, требующих исключения кислорода и влаги.В жидком состоянии азот имеет ценные криогенные применения; За исключением газов водорода, метана, окиси углерода, фтора и кислорода, практически все химические вещества имеют пренебрежимо малое давление пара при температуре кипения азота и, следовательно, существуют в виде кристаллических твердых веществ при этой температуре.
В химической промышленности азот используется для предотвращения окисления или другого порчи продукта, в качестве инертного разбавителя реактивного газа, в качестве носителя для отвода тепла или химикатов, а также в качестве ингибитора пожара или взрывов.В пищевой промышленности газообразный азот используется для предотвращения порчи из-за окисления, плесени или насекомых, а жидкий азот используется для сублимационной сушки и для холодильных систем. В электротехнической промышленности азот используется для предотвращения окисления и других химических реакций, для создания избыточного давления в оболочках кабелей и для защиты двигателей. Азот находит применение в металлургической промышленности при сварке, пайке и пайке, где он помогает предотвратить окисление, науглероживание и обезуглероживание. Как инертный газ, азот используется для изготовления вспененного или вспененного каучука, пластмасс и эластомеров, в качестве газа-вытеснителя для аэрозольных баллончиков и для повышения давления жидких пропеллентов для реакционных струй.В медицине быстрое замораживание жидким азотом может использоваться для сохранения крови, костного мозга, тканей, бактерий и спермы. Жидкий азот также оказался полезным в криогенных исследованиях.
Азотные соединения — обзор
5.3 Антипирены на основе азота
Азотсодержащие соединения представляют собой один из наиболее экологически безвредных классов антипиренов, выделяющих небольшое количество дыма и отсутствие побочных продуктов диоксина и / или галогена во время горение. Они также обладают рядом очень важных преимуществ перед соединениями на основе галогенов и красным фосфором благодаря своему химическому составу, который очень похож на химический состав большинства самих полимеров.Кроме того, было показано, что полимерные материалы, в том числе антипирены на основе азота, подходят для вторичной переработки. Соединения азота, представляющие основной интерес в качестве антипиренов, представляют собой меламин, производные меламина и родственные гетероциклические соединения. Азотсодержащие антипирены использовались для повышения огнестойкости в первую очередь полиамидов и, во вторую очередь, полиолефинов (и полиуретанов), но обычно они не очень эффективны только для других полимеров [62,63].
Меламин (2,4,6-триамино-1,3,5-триазин, C 3 N 6 H 6 ) представляет собой термостойкий кристаллический продукт, производимый мочевиной.Как и цианамид, он содержит 67% азота по массе и характеризуется температурой плавления до 345 ° C. Огнезащитное действие этого недорогого твердого вещества обусловлено способностью меламина сублимироваться (плавиться с испарением) при температуре около 350 ° C, поглощая значительное количество тепла, тем самым снижая температуру поверхности разрушающегося полимера, подверженной воздействию огня. При высокой температуре (или если испарение ограничено) меламин разлагает выделяющийся аммиак (который разбавляет кислород и горючие газы) и приводит к образованию термостабильного конденсата мелем (2,5,8-триамино-1,3,4,6 , 7,9,9b-гептаазафенален), мелам ((N-4,6-диамино-1,3,5-триазин-2-ил) -1,3,5-триазин-2,4,6-триамин) и дыня (Поли (8-амино-1,3,4,6,7,9,9b-гептаазафенален-2,5-диил) имино).Развитие мелама, мелема и дыни сопровождается образованием остатков в конденсированной фазе, что приводит к возникновению эндотермических процессов, также эффективных для замедления горения. Меламин иногда используется сам по себе в качестве антипирена (было обнаружено, что при уровнях 3–20 частей на 100 он обеспечивает смеси нейлона 6, 6,6 и 6 / 6,6 с номинальными характеристиками V-0), но чаще он используется в качестве пенообразователь и антипирен в вспучивающихся покрытиях, эластомерах и пластиковых составах, а также в гибких пенополиуретанах [24,59,64].
Меламин — слабое основание, которое может образовывать четко определенные термически стабильные соли как с органическими, так и с неорганическими кислотами. Было обнаружено, что солями, обладающими огнестойкими характеристиками и по этой причине, обычно используемыми на практике для улучшения огнестойкости полимеров, являются цианурат меламина, фосфат меламина и пирофосфат меламина. Последние два действуют как вспучивающиеся соединения во время горения, и их способ действия обсуждается в следующем разделе. С другой стороны, цианурат меламина (соль меламина и циануровой кислоты), химическая структура которого показана на рисунке 9, действует совершенно по-другому.В частности, было продемонстрировано, что цианурат меламина разлагает полиамиды в условиях горения, способствуя усиленному стеканию негорючего потока; следовательно, полимер удаляется из источника пламени, не обеспечивая топливо для разжигания огня. Он также физически мешает циклу сгорания, работая как теплоотвод и как источник инертного газа. Более конкретно, его первоначальная эндотермическая диссоциация с последующей сублимацией полученного меламина и последующее разложение паров меламина поглощают выделяемое тепло, охлаждая субстрат.Кроме того, образующиеся инертные газы дополнительно увеличивают огнестойкость, разбавляя кислород и горючие газы. О действии, аналогичном действию цианурата меламина, сообщалось также в случае оксалата меламина и фталата меламина. Однако цианурат меламина является ведущим антипиреном для незаполненного PA6 и PA6,6, будучи более эффективным (требуется меньшее количество антипирена) в случае PA6,6. Это различие связано с механизмами разложения этих двух полимеров: продукты разложения PA66 (циклопентанон) могут сшиваться с продуктами разложения (в основном NH 3 ) цианурата меламина, давая менее воспламеняющиеся высокомолекулярные структуры.Напротив, PA6 разлагается до менее реакционноспособных соединений, которые не образуют поперечных связей. Хотя цианурат меламина эффективен для неармированных полимеров, он относительно неэффективен для наполненных композиций, таких как полимерные материалы, армированные стекловолокном; стеклянные волокна действуют как «фитиль» и замедляют течение расплава, удерживая полимер на месте, чтобы разжечь пламя [65–69].
РИСУНОК 9. Химическая структура цианурата меламина.
Большинство солей меламина работают в конденсированной фазе. Совершенно иной механизм действия был обнаружен при использовании N -алкокси или циклоалкоксипроизводных в качестве антипиренов, образующих радикальные частицы во время разложения.Эти составы эффективны для повышения огнестойкости, главным образом, полипропиленовых и полиэтиленовых пленок, а в некоторых случаях — полипропиленовых формованных изделий, полиуретановых клеев и полистирола. Это новое семейство антипиренов на основе азота было открыто изобретателями Ciba Specialty Chemicals (ныне BASF), которые первыми осознали, что алкоксиамины могут индивидуально действовать как антипирены без помощи других добавок (синергистов). Алкоксиамины обычно синтезируются из соответствующего стерически затрудненного пиперидина через нитроксильный промежуточный продукт посредством реакции с углеводородом; для облегчения этой реакции присутствие органического пероксида (например,грамм. перуксусная кислота) необходима перекись водорода, оксид молибдена или йодид. Впервые они были представлены в качестве УФ-стабилизаторов для защиты от окисления автомобильных покрытий и сельскохозяйственных пленок. Однако неожиданно было обнаружено, что они не только улучшают устойчивость этих материалов к ультрафиолетовому излучению, но также способствуют их огнестойкости, даже когда их добавляют отдельно. Их активность основана на термолизе нитроксиловых эфиров, во время которого образуются либо алкокси, либо аминильные радикалы, либо алкильные и нитроксильные радикалы, препятствующие свободнорадикальным химическим реакциям, протекающим в процессе горения.Сообщалось также, что алкоксиамины взаимодействуют с обычными антипиренами, включая бромированные, фосфорные и неорганические соединения, дополнительно усиливая их огнезащитное действие. Первый коммерческий продукт, использующий огнезащитные свойства алкоксиаминов, был выпущен на рынок в 2000 году компанией Ciba под торговым названием Flamestab NOR 116 (в его структуру входит N -циклогексилокси-2,2,6,6-тетраметилпиперидинильная группа, присоединенная к олигомерная полимерная цепь). С тех пор дальнейшие исследования были сосредоточены на серии различных затрудненных аминов N -алкокси, а также на соединениях азота, способных генерировать свободные радикалы во время горения, таких как азоалканы [59,70–72].
Другой азотсодержащий состав, проявляющий огнезащитные свойства, — это оксазеновая смола; он может использоваться либо как гомополимер, либо как реактивная добавка в эпоксидных смолах, демонстрируя, по сравнению с бромированными эпоксидными смолами, превосходные механические и электрические свойства, хорошие технологические характеристики, а также низкую токсичность и коррозионную активность в дополнение к повышенной огнестойкости. Поли (изоцианураты) (PIC) также обладают присущей им огнестойкостью из-за их циклической структуры. Тем не менее, он особенно эффективен в сочетании с фосфорсодержащими эпоксидными смолами.Эпоксидные смолы обычно имеют LOI 20; совсем недавно было сообщено о способе производства фосфазен-триазиновых композиций, достигающих LOI от 32 до 38. Эти полимеры, благодаря конденсированной фазе действия, образуют обугленное покрытие на своей поверхности во время горения, предотвращая дальнейшее разрушение подложки. Также было предложено, чтобы составы, полученные поликонденсацией макроциклического хлористого цианурхлорида с ароматическими диаминами или диолами, обладали многообещающими огнестойкими свойствами.Соответственно, было показано, что включение -NH- связей в полимерную цепь представляет собой эффективное средство повышения огнестойкости полимера. Более того, совместное присутствие металлов (Cu, Co и Ni) приводит к дальнейшему увеличению термической стабильности [4,73–76].
Органическое соединение азота — обзор
12.3 Биологические превращения азота
Наша следующая задача — рассмотреть различные способы переработки азота в биосфере. Эти механизмы являются основным двигателем земного и океанического азотных циклов.Важно помнить, что хотя большая часть нашего обсуждения азотного цикла вращается вокруг переноса азота между основными глобальными резервуарами (атмосферой, водными ресурсами и биосферой), эти потоки представляют собой лишь небольшую часть азота, переносимого в биосфере. почва и биосферно-водные системы. Россвалл (1976) оценивает, что в глобальном масштабе «внутренний» биологический цикл азота составляет 95% всех потоков азота. Важные процессы схематически показаны на рис.12-1. Различные термины легче идентифицировать, если вспомнить, что они определены с точки зрения организма.
Рис. 12-1. Биологические превращения соединений азота. Цифры относятся к процессам, описанным в тексте.
- 1.
-
Фиксация азота — это любой процесс, в котором N 2 в атмосфере реагирует с образованием любого соединения азота . Биологическая фиксация азота представляет собой катализируемое ферментами восстановление N 2 до NH 3 , NH 4 + или любого органического соединения азота.
- 2.
-
Ассимиляция аммиака — это процесс, посредством которого NH 3 или NH 4 + поглощаются организмом, чтобы стать частью его биомассы в виде органических соединений азота.
- 3.
-
Нитрификация — окисление NH 3 или Nh5 + на NO 2 — или NO 3 — организмом как средство производства энергии.
- 4.
-
Ассимиляционное восстановление нитратов — это восстановление NO 3 — с последующим поглощением азота организмом в виде биомассы.
- 5.
-
Аммонификация — это разложение органических соединений азота на NH 3 или NH 4 + .
- 6.
-
Денитрификация — это восстановление NO 3 — до любых газообразных форм азота, обычно N 2 или N 2 O.
Все вышеперечисленные процессы опосредуются различными типами микроорганизмов. Некоторые из этих процессов производят энергию, а некоторые происходят в симбиотических отношениях с другими организмами. Обсуждение процессов уместно начать с азотфиксации, поскольку это единственный способ внесения азота в естественные системы (при отсутствии искусственных удобрений). Точно так же, главным образом, денитрификация удаляет азот из биосферы.
Биологическая фиксация азота является основным источником азота для всех живых организмов, в отсутствие промышленных удобрений. Это может быть сделано различными бактериями и водорослями, как симбиотическими, так и свободноживущими, хотя в целом симбиотические организмы считаются более значимыми в количественном отношении. Есть два основных ограничения на биологическую фиксацию азота. Во-первых, процесс требует больших затрат энергии для преодоления высокой энергии активации тройной связи азота.Несмотря на то, что ΔG 0 для производства NH 3 из N 2 и H 2 отрицательна при 25 ° C, только те организмы с высокоразвитыми каталитическими системами способны фиксировать азот. . Второе ограничение заключается в том, что фиксация азота — это восстановительный процесс, очень чувствительный к присутствию O 2 , и поэтому только те организмы, которые живут в анаэробной среде или могут обеспечивать анаэробную среду, будут фиксировать азот.Бернс и Харди (1975) представляют хороший обзор биологической фиксации азота.
В наземных системах симбиотические бактерии, особенно штаммы рода Rhizobium , являются важным источником азотфиксации. Эти бактерии находятся на корнях многих бобовых растений (клевера, сои, нута и т. Д.) И используются в сельском хозяйстве как средство пополнения почвенного азота («сидераты») (Smil, 1997). Многие из этих организмов являются анаэробами или разработали механизмы для поддержания анаэробной среды (Granhall, 1981).Существуют и другие симбиотические диазотрофы (азотфиксирующие организмы), но Rhizobium был наиболее изучен (например, Postgate, 1982).
Большинство диазотрофных (азотфиксирующих) организмов используют фермент нитрогеназа. В последние годы этот фермент стал предметом интенсивных исследований из-за возможностей его использования для улучшения промышленной фиксации азота (Postgate, 1982). Он был выделен от 20 до 30 различных прокариотических организмов и, по-видимому, имеет очень похожие свойства независимо от источника.Нитрогеназа состоит из двух металлопротеинов; один — белок Mo-Fe, который служит для связывания N 2 с ферментом, вероятно, на участке металла, другой — белок Fe, который является источником электронов для восстановления. Оба этих металлопротеина очень чувствительны к O 2 . Интересно отметить, что в то время как микроорганизмы могут фиксировать N 2 при парциальном давлении 0,8 атм и 20 ° C, для промышленной фиксации требуется 250 атм и 400 ° C!
После фиксации азота в почве или водной системе как NH 3 или Кh5 +, есть два основных пути.Он может окисляться до NO 2 — / NO 3 — или ассимилироваться организмом, чтобы стать частью его биомассы. Последний процесс называется ассимиляцией аммиака, и для тех организмов, которые могут напрямую использовать аммиак, он представляет собой значительный источник азота. Поскольку многие растения получают большую часть азота из нитратов путем восстановительной ассимиляции, прямая ассимиляция аммиака дает значительную экономию энергии и, следовательно, дает этим организмам конкурентное преимущество.Свободный ион NH 4 + недолго существует в аэробных почвах до того, как произойдет нитрификация, поэтому NO 3 — является преобладающей формой азота в аэробной почве и водной среде (Delwiche, 1981). Ассимиляция аммиака не связана с переносом азота в другие резервуары и количественно менее значима, чем нитрификация.
Нитрификация состоит из двух этапов получения энергии: окисления аммония до нитрита и окисления нитрита до нитрата.Эти уравнения обычно представлены следующим образом:
Nh5 ++ 32O2 → NO2− + h3O + 2H + ΔG0 = −290 кДж / мольNO2− + 12O2 → NO3− ΔG0 = −82 кДж / моль
Есть несколько организмов, которые используют нитрификацию в качестве источника энергии (Delwiche, 1981 ). Первый шаг в этом процессе в основном выполняется бактериями рода Nitrosamonas , а второй — Nitrobacter , оба автотрофные организмы. Эти организмы используют CO 2 в качестве источника углерода и получают энергию от окисления Кh5 +.Гетеротрофные бактерии, которые используют органические соединения, а не CO 2 , также могут выполнять нитрификацию; однако считается, что они количественно гораздо менее значимы, чем автотрофы (Bremner and Blackmer, 1981). При окислении Nh5 + к NO 3 —, гидроксиламин (NH 2 OH) и другие менее стабильные соединения, вероятно, являются промежуточными продуктами, а NO и N 2 O почти наверняка являются промежуточными продуктами, вероятно, в виде комплексов, связанных с ферментом. Эти промежуточные продукты привлекли внимание к нитрификации как возможному источнику атмосферных компонентов, особенно N 2 O.
Попадая в почву или водную систему, нитрат имеет два основных пути: он может служить конечным акцептором электронов в анаэробных условиях (денитрификация), или он может одновременно восстанавливаться и ассимилироваться в биомассе организма. Последний процесс называется ассимиляционным восстановлением нитратов и, вероятно, будет доминирующим, когда восстановленный азот находится в недостаточном количестве, например, в аэробных условиях. Это основной источник азота для большинства растений и многих микроорганизмов. Большинство растений могут усваивать оба Nh5 + и NO 3 — , даже несмотря на то, что первое уменьшение NO 3 — требует затрат энергии.После того, как NO 3 — был поглощен корневой системой растения и уменьшен, он затем следует тем же путем, по которому Nh5 + включается в его биомассу (Kikby, 1981).
Помимо азотфиксации, единственным другим важным источником восстановленного азота является разложение почвы или водного органического вещества. Этот процесс называется аммонификацией. Основную ответственность за это несут гетеротрофные бактерии. Эти организмы используют органические соединения из мертвых растений или животных в качестве источника углерода и оставляют после себя NH 3 и Nh5 +, который затем может быть переработан биосферой.В некоторых случаях гетеротрофные бактерии могут включать полную органическую молекулу в свою биомассу. Большая часть производимого таким образом NH 3 остается в биосфере; однако небольшая его часть будет улетучиваться. В дополнение к этому источнику, расщепление экскрементов животных также вносит вклад в атмосферный аммиак. Обычно считается, что улетучивание с экскрементами животных является более значительным, чем аммификация, как источник атмосферного аммиака. Freney et al. (1983) представляет хороший обзор всего процесса улетучивания аммиака.
Денитрификация — единственный процесс, в котором основной конечный продукт удаляется из биологического цикла азота. Это основное средство уравновешивания входящего потока от азотфиксации. Обычно N 2 является конечным продуктом денитрификации; однако NO, и особенно N 2 O, также являются обычными. Микроорганизмы используют NO 3 — в качестве конечного поглотителя электронов (окислителя) в отсутствие O 2 , как в заболоченных анаэробных почвах.Общий процесс окисления органического соединения и восстановления NO 3 — представляет собой процесс производства энергии для микроорганизмов. Существует приблизительно 17 родов факультативных анаэробных бактерий, которые могут использовать NO 3 — в качестве окислителя, и считается, что они широко распространены. Денитрификация происходит с помощью хорошо известного ряда промежуточных соединений, включая NO 2 —, NO и N 2 O. Отношение образования N 2 : N 2 O во время денитрификации является интересной темой.Обычно основным продуктом является N 2 , на долю которого приходится 80–100% выделяемого азота (Delwiche, 1981). Седерлунд и Свенссон (1976) использовали глобальное среднее земное значение 16: 1 для N 2 : N 2 O при вычислении потока N 2 O в атмосферу. При определенных условиях окружающей среды закись азота может стать основным продуктом. Обычно условия, которые увеличивают количество продуцирования N 2 O, также снижают общую скорость денитрификации. Например, при более низких значениях pH и более высоких концентрациях O 2 доля N 2 O увеличивается, но общая скорость денитрификации снижается.
С точки зрения биогеохимического цикла, биологический цикл азота — непростая система. Ясно, что наибольшее поступление азота в биосферу — это биологическая фиксация, а основная потеря биосферы — денитрификация. Однако с биогеохимической точки зрения наиболее важным процессом является не обмен N 2 , а, скорее, обмен различных газовых примесей, таких как NO, NO 2 , N 2 O и NH 3 .Следовые газы выбрасываются в атмосферу на различных стадиях биологического цикла азота. Чтобы понять поведение этих следовых газов, необходимо рассмотреть широкий спектр биологических процессов.
Соединения азота | Введение в химию
Цель обучения
- Приведите примеры применения соединений азота.
Ключевые моменты
- Оксиды азота, называемые соединениями NO x , важны из-за их взрывоопасных свойств.Эти свойства определяются чрезвычайно прочной и стабильной связью, обнаруженной в молекулярном двухатомном азоте, N 2 , который имеет энергию диссоциации связи 945 кДж / моль (226 ккал / моль).
- Основным нейтральным гидридом азота является аммиак (NH 3 ) с pK b , равным 9,2, и поэтому он является слабым основанием. Соответствующий депротонированный вид NH 2 — называется амидом и является сильным основанием (потому что это сопряженное основание аммиака, pK a которого составляет около 38).
- Азот входит в состав молекул всех основных классов лекарств в фармакологии и медицине, от антибиотиков до нейротрансмиттеров и т. Д. Одним из важных аспектов азота является то, что это единственный неметалл, который может поддерживать положительный заряд при физиологическом pH.
Условия
- пропеллент Топливо, окислитель, реакционная масса или смесь для одного или нескольких двигателей (особенно двигателей внутреннего сгорания или реактивных двигателей), которые перевозятся в транспортном средстве перед использованием.
- оксид — бинарное химическое соединение кислорода с другим химическим элементом.
- анион: отрицательно заряженный ион, в отличие от катиона.
- энергия диссоциации связи Энергия, необходимая для разделения двух атомов, соединенных определенной связью. Выражается в молях таких связанных атомов. Указывает на прочность связи.
Обзор соединений азота и их использования
Соединения азота играют важную роль во многих аспектах жизни и коммерческих процессов, от промышленного производства удобрений до строительных блоков жизни.
Тройная связь азот-азот в N 2 содержит 226 ккал / моль энергии, что делает ее одной из самых прочных известных связей. Когда газообразный азот образуется как продукт различных реакций, энергия связи, связанная с тройной связью N-N, высвобождается, вызывая взрывные свойства, наблюдаемые во многих соединениях азота.
Амины
Основным нейтральным гидридом азота является аммиак (NH 3 ), хотя также обычно используется гидразин (N 2 H 4 ).Аммиак на 6 порядков щелочнее воды. В растворе аммиак образует ион аммония (NH 4 + ). PK a хлорида аммония составляет 9,2. Жидкий аммиак (точка кипения 240 K) является амфипротонным (проявляет либо кислотный, либо основной характер по Бренстеду-Лоури) и образует аммоний и менее распространенные амид-ионы (NH 2 —). Аммиак имеет pK и , равное 38, что делает соответствующие амид-ионы очень сильными основаниями. По отдельности, дважды, трех- и четырехзамещенные алкильные соединения аммиака называются аминами (четыре замещения с образованием коммерчески и биологически важных четвертичных аминов, приводят к положительно заряженному азоту и, таким образом, к водорастворимому соединению).
Азиды
Другие классы анионов азота (отрицательно заряженные ионы) представляют собой ядовитые азиды (N 3 —), которые являются линейными и изоэлектронными по отношению к диоксиду углерода, но которые связываются с важными железосодержащими ферментами в организме способом, напоминающим цианид.
Оксиды азота
Другой молекулой такой же структуры является бесцветный и относительно инертный анестезирующий газ закись азота (окись азота, N 2 O), также известный как веселящий газ.Это один из множества оксидов азота, которые образуют семейство, часто обозначаемое сокращенно NO x . Оксид азота (оксид азота, NO) — это естественный свободный радикал, используемый для передачи сигналов как у растений, так и у животных. Красноватый и ядовитый диоксид азота (NO 2 ) содержит неспаренный электрон и является важным компонентом смога. Молекулы азота, содержащие неспаренные электроны, проявляют тенденцию к димеризации (тем самым спаривая электроны) и, как правило, обладают высокой реакционной способностью. Соответствующими кислотами являются азотистая (HNO 2 ) и азотная кислота (HNO 3 ) с соответствующими солями, называемыми нитритами и нитратами.
Соединения азота, используемые в качестве взрывчатых веществ и топлива
Одним из первых соединений азота в качестве взрывчатого вещества был нитрат калия, также называемый селитрой, который использовался в порохе. Это смесь нитрата калия, углерода и серы. Когда смесь воспламеняется в замкнутом пространстве, таком как дуло ружья или фейерверк, ионы нитрата окисляют углерод и серу в сильно экзотермической реакции, очень быстро образуя высокотемпературные газы. Это может выбить пулю из пистолета или вызвать взрыв фейерверка.
Нитрат калия Нитрат калия, или селитра, входил в состав раннего пороха. Он служит окислителем вместе с окисляемым материалом, таким как сахар.Высшие оксиды, триоксид диазота (N 2 O 3 ), четырехокись азота (N 2 O 4 ) и пятиокись азота (N 2 O 5 ), нестабильны и взрывоопасны, a Следствие химической устойчивости N 2 . Почти каждый гиперголик (т.е.не требует зажигания) в ракетном двигателе в качестве окислителя используется N 2 O 4 ; их топливо, различные формы гидразина, также являются соединениями азота.
Эти двигатели широко использовались на космических кораблях, таких как космические шаттлы и двигатели программы «Аполлон», поскольку их топливо является жидким при комнатной температуре, а воспламенение происходит при контакте без системы зажигания, что позволяет получить многие точно контролируемые ожоги. N 2 O 4 является промежуточным продуктом при производстве азотной кислоты HNO 3 , одной из немногих кислот, более сильных, чем ион гидроксония, и довольно сильным окислителем.
Азот отличается рядом взрывоопасных соединений, которые он может производить. Трииодид азота (NI 3 ) — чрезвычайно чувствительное контактное взрывчатое вещество. Нитроцеллюлоза, полученная путем нитрования целлюлозы азотной кислотой, также известна как пушечный хлопок. Нитроглицерин, полученный нитрованием глицерина, является опасно нестабильным взрывчатым ингредиентом динамита. Сравнительно стабильный, но менее мощный взрывчатый тринитротолуол (ТНТ) является стандартным взрывчатым веществом, с которым измеряется мощность ядерных взрывов.Во всех случаях взрывоопасные свойства соединений азота проистекают из чрезвычайной стабильности продукта этих реакций: газообразного молекулярного азота, N 2 .
Соединения азота в лекарствах и медицине
Азот входит в состав молекул всех основных классов лекарств в фармакологии и медицине. Оксид азота (NO) недавно был обнаружен как важная сигнальная молекула в физиологии. Закись азота (N 2 O) была открыта в начале XIX века как частичный анестетик, хотя позже она не использовалась в качестве хирургического анестетика.Было обнаружено, что под названием «веселящий газ» он вызывает состояние социальной расторможенности, напоминающее опьянение.
Другими известными азотсодержащими препаратами являются препараты, полученные из растительных алкалоидов, таких как морфин. Известно, что многие алкалоиды обладают фармакологическим действием; в некоторых случаях они проявляются как естественная химическая защита растений от хищников. К лекарствам, содержащим азот, относятся все основные классы антибиотиков, а также препараты на основе органических нитратов, такие как нитроглицерин и нитропруссид, которые регулируют кровяное давление и сердечную деятельность.Амины (алкильные производные азота) важны в фармакологии, потому что они могут легко нести положительный заряд, как соответствующие протонированные формы аммония. Это позволяет электростатическим взаимодействиям между катионом аммония и различными отрицательно заряженными или поляризуемыми частицами в белках.
Показать источники
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
8.19: Органические соединения азота — Химия LibreTexts
Существует огромное разнообразие органических соединений, которые могут быть получены из углерода, водорода и кислорода, что очевидно из многочисленных предыдущих разделов, в которых обсуждаются эти соединения. Если мы включим азот в качестве возможного компонента этих молекулярных структур, появится гораздо больше возможностей. Однако большинство азотсодержащих соединений менее важны с коммерческой точки зрения, и мы обсудим здесь лишь некоторые из них.
Амины могут быть производными аммиака путем замены одного, двух или всех трех атомов водорода алкильными группами.Некоторые примеры:
Термины первичный (один), вторичный (два) и третичный (три) относятся к количеству замененных атомов водорода. И первичные, и вторичные амины способны образовывать водородные связи сами с собой, но третичные амины не имеют атомов водорода на электроотрицательном атоме азота.
Амины обычно имеют неприятный запах, «рыбный». Все три перечисленных выше метиламина можно выделить из рассола сельди. Амины, как и аммиак, образуются при разложении азотсодержащих соединений при смерти живого организма.Метиламины получают в промышленных масштабах путем конденсации метанола с аммиаком на катализаторе из оксида алюминия:
Диметиламин является наиболее важным, поскольку он используется при приготовлении гербицидов, при вулканизации каучука и для синтеза диметилформамида, важного растворителя.Амиды — еще одно важное азотсодержащее органическое соединение. Ключевой особенностью амина является атом азота, связанный с карбонильным атомом углерода. Как и сложные эфиры, амиды образуются в результате реакции конденсации.В то время как сложные эфиры образуются в результате реакции конденсации спирта и карбоновой кислоты, амиды образуются в результате конденсации амина и карбоновой кислоты:
Эта общая реакция обычно неблагоприятна, потому что гидроксильная группа действует как плохо уходящая группа. Химики-органики разработали методы, позволяющие обойти это, используя определенные химические вещества для активации карбоновой кислоты и добавления амина.
Поскольку амиды образуются в результате реакций конденсации, многие важные полимеры конденсации включают амидные связи.Например, нейлон образуется в результате амидной конденсации гексаметилендиамина и адипиновой кислоты.
Второй набор конденсационных полимеров, образованных из амидных связей, — это белки и пептиды, обнаруженные в вашем теле и во всех организмах. Эти полимеры образованы из другого органического соединения азота, аминокислоты . Эти молекулы содержат как аминогруппу, так и карбоксильную группу. Примерами таких аминокислот являются глицин и лизин:
Аминокислоты — это составляющие, из которых состоят белки.Некоторые, например глицин, могут синтезироваться в организме человека, а другие — нет. Лизин является примером незаменимой аминокислоты — той, которая должна присутствовать в рационе человека, потому что она не может быть синтезирована в организме. Как уже упоминалось, при конденсации аминокислот в пептиды образуются амидные связи. По этой причине ученые иногда называют амидный каркас белка или пептида. Белок имеет длинную серию амидных связей, как видно на следующем рисунке, показывающем синтез трипептида из трех аминокислот:
Аминокислоты и белки дополнительно обсуждаются в разделах, посвященных ферментам, и в наборе разделов, посвященных белкам и их химии в живых системах.
Межмолекулярные силы и точки кипения азотсодержащих органических соединений можно объяснить в соответствии с теми же принципами, что и для кислородсодержащих веществ.
Пример \ (\ PageIndex {1} \): точки кипения
Рационализируйте следующие точки кипения: (a) 0 ° C для CH 3 CH 2 CH 2 CH 3 ; (b) 11 ° C для CH 3 CH 2 OCH 3 ; (c) 97 ° C для CH 3 CH 2 CH 2 OH; и d) 170 ° C для NH 2 CH 2 CH 2 OH.
Решение Все четыре молекулы имеют очень похожую геометрию и одинаковое количество электронов (26 валентных электронов плюс 8 остовных электронов), поэтому их силы Лондона должны быть примерно одинаковыми. Соединение (а) представляет собой алкан и неполярно. Напротив, соединение (b) представляет собой эфир и должно быть слегка полярным. Эта небольшая полярность приводит к немного более высокой температуре кипения. Соединение (c) изомерно с соединением (b), но представляет собой спирт. Между молекулами (c) существует водородная связь, а его температура кипения намного выше.Молекула (d) имеет как аминогруппу, так и гидроксильную группу, каждая из которых может участвовать в водородной связи. Следовательно, у него самая высокая температура кипения из всех.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Азот
Что такое азот?
Азот — это естественный элемент, необходимый для роста и размножения как растений, так и животных. Он содержится в аминокислотах, из которых состоят белки, в нуклеиновых кислотах, которые составляют наследственный материал и план жизни всех клеток, а также во многих других органических и неорганических соединениях.Кроме того, азот составляет около 80% атмосферы Земли.
Формы азота
Чтобы понять всю сложность загрузки азота в прибрежные воды, может быть полезно некоторое понимание того, как азот химически реагирует в окружающей среде. Азот — это элемент, который может соединяться с самим собой или с другими элементами, образуя различные соединения. Например, газообразный азот, N 2 , представляет собой соединение, образованное, когда два атома азота образуют химическую связь.Его составляет около 80% атмосферы, в то время как газообразный кислород, O 2 , составляет немногим менее 20% атмосферы. Так что газообразный азот очень распространен и его много. Однако только специализированная группа бактерий и производство промышленных удобрений могут «закрепить» это в значительной степени инертное соединение в биологически полезные соединения азота. Производство удобрений в настоящее время превышает естественную азотфиксацию, делая доступным для биосферы N 2 .
Азот в живых организмах
Азот входит в состав аминокислот и мочевины.Аминокислоты являются строительными блоками всех белков. Белки содержат не только структурные компоненты, такие как мышцы, ткани и органы, но также ферменты и гормоны, необходимые для функционирования всего живого. Мочевина — это побочный продукт переваривания белков. Мы используем термин «органический азот» для описания азотного соединения, которое возникло в живом материале. Азот в белке и мочевине — это органический азот. Органический азот может попадать в септические системы в виде телесных отходов, выброшенных пищевых продуктов или в качестве компонентов чистящих средств.
Аммонификация
Многие превращения азота опосредуются бактериями, которые используют различные формы азота для подпитки некоторых своих метаболических процессов. Во время процессов разложения азот в белках в конечном итоге превращается в аммиак (NH 3 ) или аммоний (NH 4 + ) некоторыми видами бактерий. Эти процессы называются аммонификацией. Азот покидает септик в основном в виде аммония в фильтрате.Часть аммония адсорбируется на частицах почвы и эффективно иммобилизуется при дальнейшей транспортировке.
Нитрификация
Другие виды бактерий превращают аммиак в нитрит. И все же другие виды бактерий могут превращать нитрит в нитрат. Эти процессы называются нитрификацией. Нитрификация — это аэробный процесс. Это означает, что нитрификация может происходить только в присутствии кислорода. Неабсорбируемый аммоний септика подвергается нитрификации в почвах полей аэробного выщелачивания.
Денитрификация
И все же другие виды бактерий могут брать нитрат и превращать его обратно в газообразный азот с помощью процесса, называемого денитрификацией. Денитрификация — анаэробный процесс. Это означает, что это происходит только при отсутствии кислорода или при очень низких концентрациях кислорода. Для денитрификации также требуется источник углерода. Часть нитратов, покидающих почвы полей выщелачивания, денитрифицируется в рыхлых почвах и грунтовых водах по мере их поступления в устье реки.Определение количества потерянного таким образом азота — важная область текущих исследований.
Упрощенный цикл азота
Таким образом, азот циркулирует в воздухе, воде и почве, причем многие преобразования опосредуются действиями специализированных бактерий. Некоторые из этих преобразований требуют аэробных условий, в то время как другие происходят только в анаэробных условиях. Лучшие системы очистки сточных вод используют метаболические потребности этих бактерий для уменьшения количества азота в сточных водах.
Упрощенный цикл азота, курсивом обозначены процессы, а различные формы азота жирным шрифтом. .
