Методы гиперплазии миофибрилл в мышечных волокнах
В. Н. Селуянов, В. А. Рыбаков, М. П. Шестаков
Глава 4. Методы управления адаптационными процессами
Для управления адаптационными процессами в определенных клетках органов тела человека необходимо знать устройство органа, механизм его функционирования, факторы, обеспечивающие целевое направление адаптационных процессов. Модель организма спортсмена построена в предыдущих главах. На основе этой модели может быть реализовано теоретическое мышление в виде умозрительного или компьютерного (математического) моделирования. В ходе имитационного моделирования находятся различные варианты принятия управленческих решений, из которых в дальнейшем выбирается наиболее подходящая к данным условиям технология спортивной подготовки. Технология управления адаптационными процессами, реализуемая с помощью физических упражнений, характеризуется следующими параметрами: интенсивность сокращения мышц (ИС), средняя интенсивность упражнения (ИУ), продолжительность (П), интервал отдыха (ИО), количество повторений упражнения (КП), интервал отдыха до следующей тренировки (ИОТ).
4.1. Методы гиперплазии миофибрилл в мышечных волокнах
Цель силовой подготовки — увеличить число миофибрилл в мышечных волокнах. Силовое воздействие человека на окружающую среду есть следствие функционирования мышц. Мышца состоит из мышечных волокон — клеток. Для увеличения силы тяги МВ необходимо добиться гиперплазии (увеличения) миофибрилл. Этот процесс возникает при ускорении синтеза и при прежних темпах распада белка. Исследования последних лет позволили выявить четыре основных фактора, определяющих ускоренный синтез белка в клетке:
1. Запас аминокислот в клетке. (Аминокислоты в клетке накапливаются после потребления пищи богатой белками.)
2. Повышенная концентрация анаболических гормонов в крови как результат психического напряжения (Holloszy et al. , 1971; Schants, 1986).
, 1971; Schants, 1986).
3. Повышенная концентрация «свободного» креатина в МВ (Walker, 1979).
4. Повышенная концентрация ионов водорода (Панин Л. Е., 1983).
Второй, третий и четвертый факторы прямо связаны с содержанием тренировочных упражнений.
Механизм синтеза органелл в клетке, в частности, миофибрилл, можно описать следующим образом.
В ходе выполнения упражнения энергия АТФ тратится на образование актин миозиновых соединений, выполнение механической работы. Ресинтез АТФ идет благодаря запасам КрФ. Появление свободного Кр активизирует деятельность всех метаболических путей, связанных с образованием АТФ (гликолиз в цитоплазме, аэробное окисление в различных митохондриях, например, миофибриллярных, а также в находящихся в ядрышке и на мембранах СПР). В быстрых мышечных волокнах (БМВ) преобладает мышечная лактат-дегидрогеназа (М ЛДГ), поэтому пируват, образующийся в ходе анаэробного гликолиза, в основном трансформируется в лактат. В ходе такого процесса в клетке накапливаются ионы Н.
Наряду с важной ролью в определении сократительных свойств в регуляции энергетического метаболизма, накопление свободного креатина в саркоплазматическом пространстве служит мощным эндогенным стимулом, возбуждающим белковый синтез в скелетных мышцах (Walker J., 1979; Волков Н. И. с соав., 1983). Показано, что между содержанием сократительных белков и содержанием креатина имеется строгое соответствие. Свободный креатин, видимо, влияет на синтез и РНК, т. е. на транскрипцию в ядрышках МВ, либо активирует деятельность ядерных митохондрий, которые начинают в большей мере вырабатывать АТФ, которая используется для транскрипции ДНК (Walker, 1979).
Предполагается, что повышение концентрации ионов водорода вызывает лабилизацию мембран (увеличение размеров пор в мембранах, это ведет к облегчению проникновения гормонов в клетку), активизирует действие ферментов, облегчает доступ гормонов к наследственной информации, к молекулам ДНК (Панин Л. Е., 1983). В ответ на одновременное повышение концентрации Кр и Н интенсивнее образуются РНК. Срок жизни и РНК короток, несколько секунд в ходе выполнения силового упражнения плюс пять минут в паузе отдыха (Виру А. А., 1981). Затем молекулы и РНК разрушаются.
Е., 1983). В ответ на одновременное повышение концентрации Кр и Н интенсивнее образуются РНК. Срок жизни и РНК короток, несколько секунд в ходе выполнения силового упражнения плюс пять минут в паузе отдыха (Виру А. А., 1981). Затем молекулы и РНК разрушаются.
Теоретический анализ показывает, что при выполнении силового упражнения до отказа, например 10 приседаний со штангой с темпом одно приседание за 3–5 с, упражнение длится до 50 с. В мышцах в это время идет циклический процесс: опускание и подъем со штангой 1–2 с выполняется за счет запасов АТФ; за 2–3 с паузы, когда мышцы становятся малоактивными (нагрузка распространяется вдоль позвоночного столба и костей ног), идет ресинтез АТФ из запасов КрФ, а КрФ ресинтезируется за счет аэробных процессов в ОМВ и анаэробного гликолиза в ГМВ. В связи с тем, что мощность аэробных и гликолитических процессов значительно ниже скорости расхода АТФ, запасы КрФ постепенно исчерпываются, продолжение упражнения заданной мощности становится невозможным наступает отказ.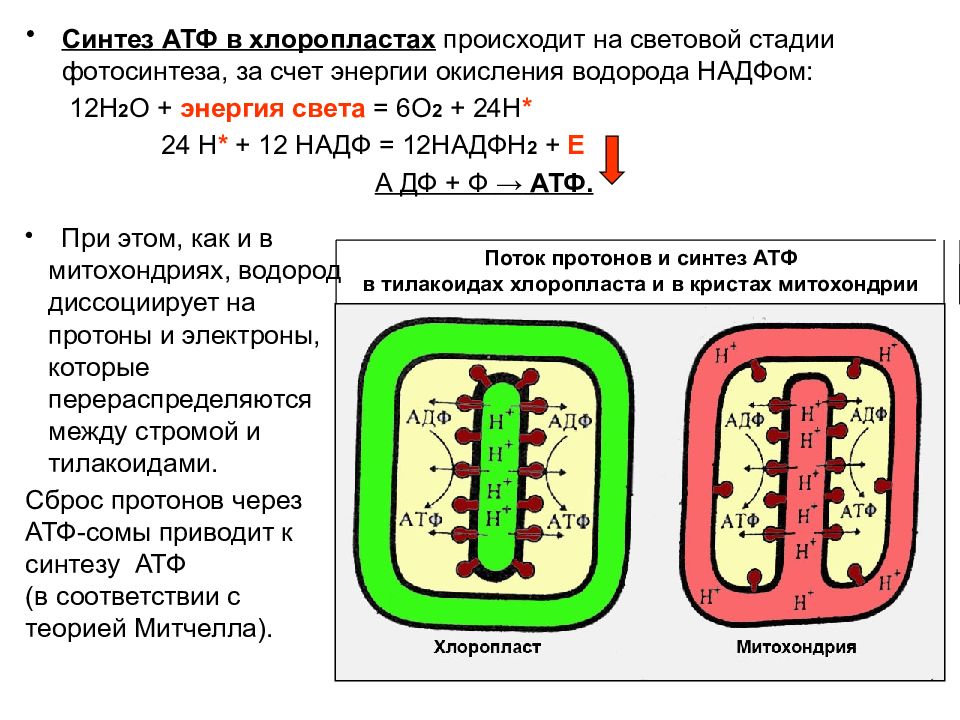
 В частности, в исследовании А. Salminen e. a. (1984) на крысах было показано, что интенсивный (гликолитический) бег вызывает некротические изменения и 4–5-кратное увеличение активности лизосомальных ферментов. Совместное действие ионов водорода и свободного Кр приводит к активизации синтеза РНК. Известно, что Кр присутствует в мышечном волокне в ходе упражнения и в течение 30–60 с после него, пока идет ресинтез КрФ. Поэтому можно считать, что за один подход к снаряду спортсмен набирает около одной минуты чистого времени, когда в его мышцах происходит образование и РНК. При повторении подходов количество накопленной и РНК будет расти, но одновременно с повышением концентрации ионов Н; поэтому возникает противоречие, то есть можно разрушить больше, чем потом будет синтезировано. Избежать этого можно при проведении подходов с большими интервалами отдыха или тренировках несколько раз в день с небольшим числом подходов в каждой тренировке.
В частности, в исследовании А. Salminen e. a. (1984) на крысах было показано, что интенсивный (гликолитический) бег вызывает некротические изменения и 4–5-кратное увеличение активности лизосомальных ферментов. Совместное действие ионов водорода и свободного Кр приводит к активизации синтеза РНК. Известно, что Кр присутствует в мышечном волокне в ходе упражнения и в течение 30–60 с после него, пока идет ресинтез КрФ. Поэтому можно считать, что за один подход к снаряду спортсмен набирает около одной минуты чистого времени, когда в его мышцах происходит образование и РНК. При повторении подходов количество накопленной и РНК будет расти, но одновременно с повышением концентрации ионов Н; поэтому возникает противоречие, то есть можно разрушить больше, чем потом будет синтезировано. Избежать этого можно при проведении подходов с большими интервалами отдыха или тренировках несколько раз в день с небольшим числом подходов в каждой тренировке.Вопрос об интервале отдыха между днями силовой тренировки связан со скоростью реализации и РНК в органеллы клетки, в частности, в миофибриллы.
Логика происходящего при выполнении силовой тренировки представляется в основном корректной, однако доказать ее истинность может лишь эксперимент. Проведение эксперимента требует затрат времени, привлечения испытуемых и др., а если логика окажется где-то порочной, то придется вновь проводить эксперимент. Понятно, что такой подход возможен, но малоэффективен. Более продуктивен подход с применением модели организма человека и имитационным моделированием физиологических функций и структурных, адаптационных перестроек в системах и органах. На ЭВМ возможно в короткое время систематически изучать процессы адаптации и проверять корректность планирования физической подготовки. Эксперимент же можно проводить уже после того, как будет ясно, что грубых ошибок в планировании не допущено.
Проведение эксперимента требует затрат времени, привлечения испытуемых и др., а если логика окажется где-то порочной, то придется вновь проводить эксперимент. Понятно, что такой подход возможен, но малоэффективен. Более продуктивен подход с применением модели организма человека и имитационным моделированием физиологических функций и структурных, адаптационных перестроек в системах и органах. На ЭВМ возможно в короткое время систематически изучать процессы адаптации и проверять корректность планирования физической подготовки. Эксперимент же можно проводить уже после того, как будет ясно, что грубых ошибок в планировании не допущено.
Из описания механизма должно быть ясно, что ОМВ и БГВ должны тренироваться в ходе выполнения разных упражнений, разными методиками.
Биоэнергетика миокарда в условиях гипоксии: возрастные аспекты
Проблема влияния гипоксии на сердечную мышцу, адаптации миокарда к ее воздействию, а также вызываемые ею последствия не утрачивает своей актуальности и продолжает оставаться предметом исследований на протяжении многих десятилетий [1—8]. Это обусловлено тем, что многие заболевания и состояния, возникающие как в терапевтической (хроническая обструктивная болезнь легких, апноэ во сне, ишемическая болезнь сердца и др.), так и в педиатрической практике (перинатальная гипоксия, врожденные пороки сердца и т.д.), сопровождаются ограничением поступления кислорода, что, с одной стороны, может привести к развитию заболеваний, а с другой — повышает устойчивость организма к последующим воздействиям кислорододефицита [1, 3, 9—15].
Это обусловлено тем, что многие заболевания и состояния, возникающие как в терапевтической (хроническая обструктивная болезнь легких, апноэ во сне, ишемическая болезнь сердца и др.), так и в педиатрической практике (перинатальная гипоксия, врожденные пороки сердца и т.д.), сопровождаются ограничением поступления кислорода, что, с одной стороны, может привести к развитию заболеваний, а с другой — повышает устойчивость организма к последующим воздействиям кислорододефицита [1, 3, 9—15].
Особый интерес вызывает исследование распространенных патологических состояний перинатального периода — внутриутробной гипоксии плода и асфиксии новорожденного [14—20]. Среди их последствий, проявляющихся реакцией внутренних органов, поражение сердечно-сосудистой системы занимает 2-е место после патологии почек и, по мнению зарубежных исследователей, встречается в 25%, а по данным отечественных авторов — в 40—70% случаев развития кислорододефицита [16, 21]. При этом установлено, что возникающая в результате дефицита кислорода транзиторная ишемия миокарда связана с временным уменьшением или прекращением кровообращения в отдельных участках мышцы сердца, вызывающим снижение ее функциональной активности [17, 19].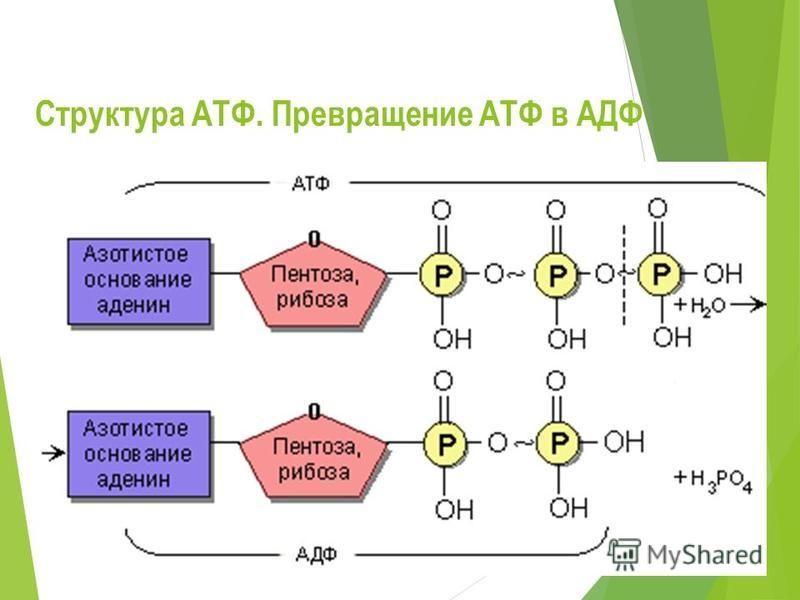
Общепризнано, что основной причиной возникновения ишемии миокарда у новорожденных является снижение энергообразования в миокардиальной клетке вследствие перинатальной «гипоксической травмы» и относительной коронарной недостаточности, которая обусловлена несоответствием имеющегося коронарного кровотока функциональным потребностям сердца, возникающим в результате высокой гемодинамической нагрузки на миокард желудочков в период послеродовой адаптации кровообращения [16, 17]. Развитие кислородного голодания приводит к возникновению тканевой гипоксии, обусловленной нарушением механизмов утилизации кислорода в клетках сердца, которые, как известно, в силу высокой функциональной нагрузки очень чувствительны к дефициту кислорода [22, 23].
Биоэнергетика миокарда в физиологических условиях. Особенности у новорожденных
Сердечная мышца является самым кислородозависимым органом организма человека: потребление миокардом кислорода превышает средний уровень его потребления другими тканями организма человека в среднем в 25—36 раз [22]. Миокард, как плода, так и взрослого, потребляет примерно одинаковое количество кислорода в пересчете на 1 г ткани [22]. Известно, что сердце человека в состоянии покоя вырабатывает 65—104 кал/мин [24]. Такое энергообразование требует доставки 13—21 мл кислорода ежеминутно. Необходимое количество кислорода наряду с высоким коэффициентом его экстракции миокардом (до 12—15 мл О2 из 100 мл крови) доставляется благодаря интенсивному кровоснабжению сердца, что в условиях мышечного покоя составляет 75—85 мл на 100 г/мин (около 5% минутного объема крови) и при нагрузке на сердце может увеличиваться примерно в 3 раза (до 225—255 мл на 100 г/мин) [22]. Способность сердца обеспечивать кровоснабжение тканей организма адекватно их потребностям определяется уровнем миокардиального кровотока и комплексом биохимических явлений, которые начинаются с момента поступления окисляемых субстратов в клетки сердечной мышцы и заканчиваются взаимодействием ряда контрактильных протеинов, что ведет к сокращению миофибрилл [24, 25].
Миокард, как плода, так и взрослого, потребляет примерно одинаковое количество кислорода в пересчете на 1 г ткани [22]. Известно, что сердце человека в состоянии покоя вырабатывает 65—104 кал/мин [24]. Такое энергообразование требует доставки 13—21 мл кислорода ежеминутно. Необходимое количество кислорода наряду с высоким коэффициентом его экстракции миокардом (до 12—15 мл О2 из 100 мл крови) доставляется благодаря интенсивному кровоснабжению сердца, что в условиях мышечного покоя составляет 75—85 мл на 100 г/мин (около 5% минутного объема крови) и при нагрузке на сердце может увеличиваться примерно в 3 раза (до 225—255 мл на 100 г/мин) [22]. Способность сердца обеспечивать кровоснабжение тканей организма адекватно их потребностям определяется уровнем миокардиального кровотока и комплексом биохимических явлений, которые начинаются с момента поступления окисляемых субстратов в клетки сердечной мышцы и заканчиваются взаимодействием ряда контрактильных протеинов, что ведет к сокращению миофибрилл [24, 25].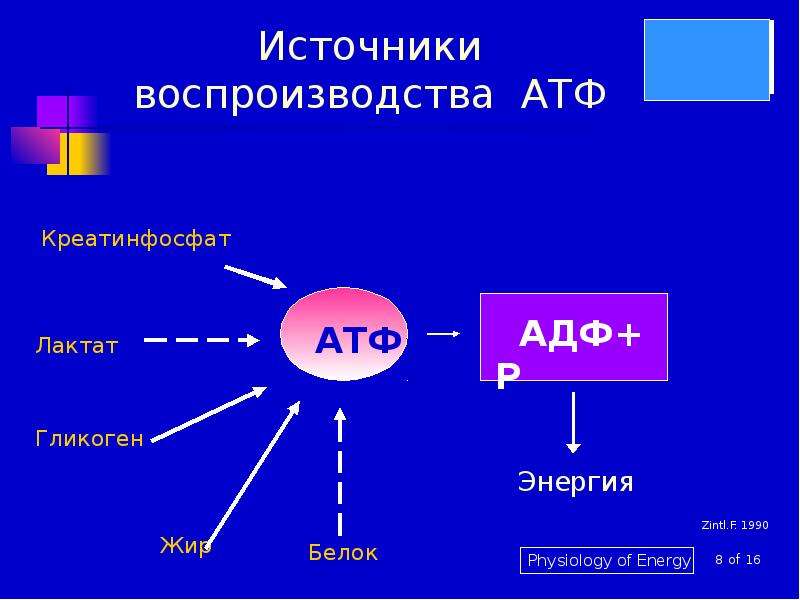
Сократительная функция сердца устойчиво поддерживается в течение всей жизни [22, 26]. Это происходит благодаря тесному сопряжению процесса сокращения с энергетическим обменом. Биоэнергетика миокарда в физиологических условиях определяется темпом окисления субстратов (прежде всего молочной и пировиноградной кислот) в цикле трикарбоновых кислот (Кребса), что обеспечивает выход36 моль аденозинтрифосфата (АТФ) на 1 моль глюкозы [24, 27]. Однако этот энергетический цикл в условиях дефицита кислорода нарушается, и молочная кислота не утилизируется. Еще один вариант энергообеспечения витальных функций миокарда, реализующийся в цикле Эмбдена-Мейергофа при адекватной доставке кислорода, играет лишь вспомогательную роль, т.к. в ходе окисления 1 моля глюкозы синтезируются лишь 2 молекулы АТФ [22]. Существует еще один путь —прямое окисление глюкозы (пентозный цикл Варбурга), который является высокоэкономичным и может давать достаточное количество энергии, ввиду того, что из одной молекулы глюкозы образуется около 117 молекул АТФ [22, 24].
Основными энергетическими субстратами для миокарда взрослых и детей более старшего возраста в условиях аэробного метаболизма служат преимущественно жирные кислоты (40—60%), удельный вес углеводов составляет лишь 35—45% [22]. Сердце же плода и новорожденного ребенка в качестве основного источника энергии использует глюкозу и основной продукт его метаболизма — молочную кислоту [16]. Энергетическая метаболизация миокардом жирных кислот, свойственная детям старшего возраста и взрослым, у них практическиотсутствует. Такой тип биоэнергетики обусловлен тем, что при метаболизации глюкозы эффективность преобразования энергии выше, чем жирных кислот: на 1 моль кислорода при ипользовании глюкозы синтезируется АТФ на 14% больше, чем при метаболизации жирных кислот [16, 22]. Помимо этих субстратов кардиомиоциты (КМ) могут использовать и другие метаболиты, циркулирующие в сосудистом русле (кетоновые тела, лактат, аминокислоты и т.д.), благодаря чему поддерживается устойчивый уровень деятельности сердечной мышцы в отличие от скелетных мышц, которые могут использовать только жирные кислоты или глюкозу. Примечательно, что аминокислоты покрывают лишь 5—7% всех энергозатрат КМ [22].
Примечательно, что аминокислоты покрывают лишь 5—7% всех энергозатрат КМ [22].
Соотношение потребления миокардом различных субстратов зависит от интенсивности механической работы миокарда, концентрации этих веществ и содержания кислорода в артериальной крови. Механическая активность сердечной мышцы линейно связана со скоростью поглощения кислорода миокардом, что в состоянии покоя составляет ежеминутно около 30 мкл О2на 1 г сырой ткани миокарда [28]. При повышении сократительной активности сердечной мышцы пропорционально увеличивается и потребление О2, которое может возрастать в десятки раз и достигать 300 мкл/мин на 1 г сырой ткани [29].
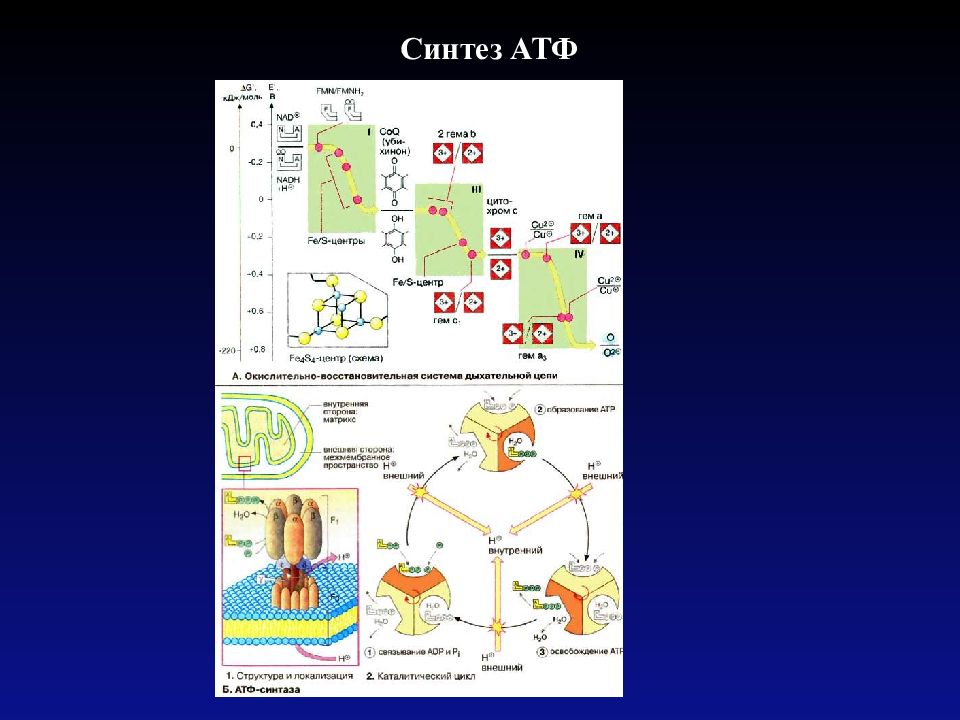
Скорость расхода энергии тесно связана со скоростью синтеза АТФ. Для поддержания насосной функции сердца человека в течение всей жизни организм вырабатывает ежесуточно около 36 кг АТФ [22]. Более 90% его образуется при окислительном фосфорилировании в митохондриях, при этом продукты окисления глюкозы и жирных кислот как бы сгорают в клетке, давая ей тепло и АТФ [30].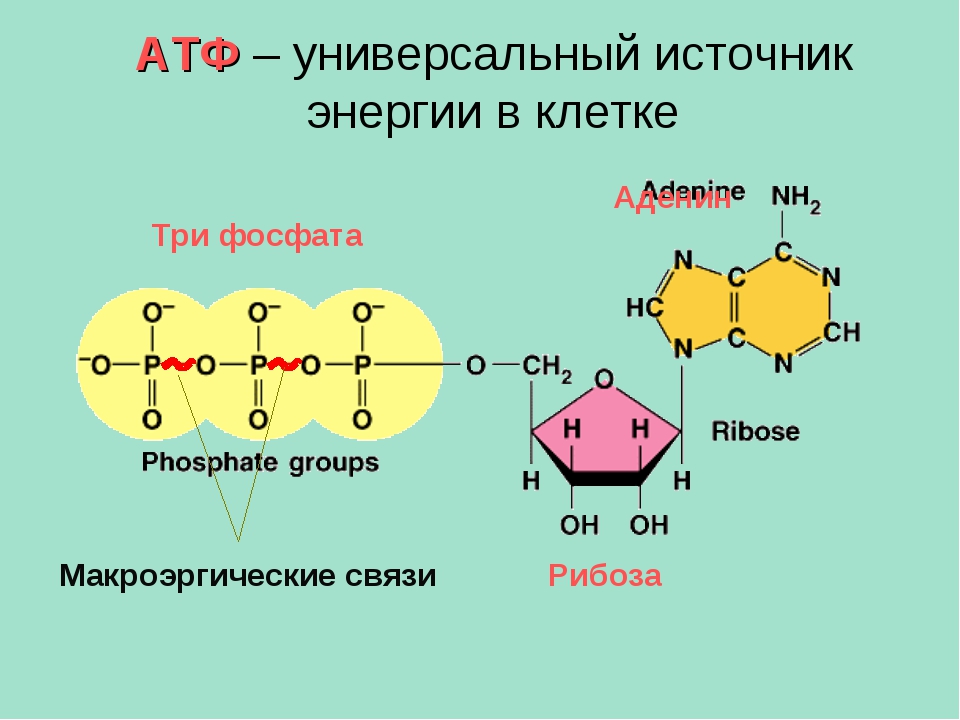 Из митохондрий АТФ поступает в цитоплазму и превращается в креатинфосфат (КФ). Его молекулы являются оптимальными для транспортировки к структурам, которые являются потребителями энергии. Здесь КФ снова превращается в АТФ. Именно АТФ и КФ представляют собой энергетические запасы КМ, которые непосредственно ими используются [24].
Из митохондрий АТФ поступает в цитоплазму и превращается в креатинфосфат (КФ). Его молекулы являются оптимальными для транспортировки к структурам, которые являются потребителями энергии. Здесь КФ снова превращается в АТФ. Именно АТФ и КФ представляют собой энергетические запасы КМ, которые непосредственно ими используются [24].
Согласно современным представлениям [22] энергия КМ расходуется на следющие процессы:
— сокращение в миофибриллах, где под влиянием повышенной концентрации Са2+ образуются актомиозиновые связи, обеспечивающие сокращение сердечной мышцы;
— работу кальциевого насоса в саркоплазматическом ретикулуме: эта структура способна выделять ионы кальция, активирующие миофибриллы, и поглощать их обратно против концентрационного градиента, на что нужна энергия АТФ, т.е. поддержка работы кальциевого насоса является энергозависимым процессом;
— работу мембранного натрий-калиевого насоса, транспортирующего ионы натрия наружу, а ионы калия внутрь клетки против концентрационного градиента, что также требует энергетических затрат;
— обеспечение функционирования специальных калиевых каналов (АТФ-зависимых калиевых каналов — КАТФ-каналов и Са2+-зависимых К+-каналов), которые, присоединяя молекулы АТФ, закрываются, что препятствует выходу ионов калия из этих каналов;
— обеспечение синтетических процессов.
Вся эта энергия используется в соответствии с суммарным количеством АТФазной активности, находящейся в клеточных органеллах. Миофибриллы, которые имеют наибольшую суммарную АТФазную активность, используют примерно 80% энергетических запасов, на ионный транспорт приходится еще 15% и на синтетические процессы — около 5% всей энергии, используемой КМ [22].
В энергетике сердца выделяют 3 фазы [22]:
Фаза образования энергии включает освобождение ионизированного кислорода — прежде всего из окисляемых углеводов, в минимальной степени из жирных кислот и аминокислот — в основном цикле трикарбоновых кислот и его окисление до воды при участии катализаторов транспорта электронов [23];
Фаза кумуляции и транспорта энергии связана с ее депонированием в форме энергии АТФ, образованием КФ и переносом макроэргической фосфатной связи на аденозиндифосфат (АДФ) миофибрилл;
Фаза использования энергии обусловлена трансформацией энергии, образованной при дефосфорилировании АТФ, в сокращение актомиозина и работу миофибрилл.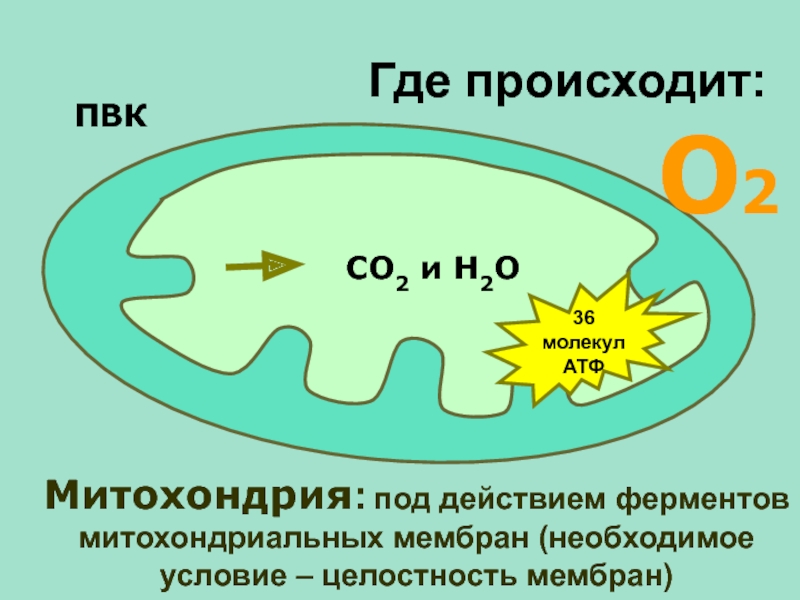 В ходе клеточного метаболизма АТФ распадается до АДФ и аденозинмонофосфата (АМФ), которые, в свою очередь, в физиологических условиях рефосфорилируются в АТФ [22].
В ходе клеточного метаболизма АТФ распадается до АДФ и аденозинмонофосфата (АМФ), которые, в свою очередь, в физиологических условиях рефосфорилируются в АТФ [22].
При этом все макроэргические фосфатные соединения находятся в попарном равновесии между собой [24]. Молекулярные механизмы, лежащие в основе сокращения, являются результатом строго детерминированного взаимодействия контрактильных мышечных белков актина и миозина, образующих соответственно тонкие и толстые нити миофибрилл, и регуляторных протеинов — тропомиозина и тропонина. В мышцах регуляторные белки связаны с актином. Акцептором кальция является кальцийсвязанный протеин — тропонин. При связывании кальция с последним конформационные изменения тропомиозина устраняют стерическую блокаду актиновых центров, и при взаимодействии актина с миозином образуются актинмиозиновые мостики, тянущая сила которых определяет сокращение мышц [24]. Фаза образования и кумуляции энергии проходит в митохондриях. Фаза утилизации (сопряжения и сокращения) реализуется в ретикулуме и миофибриллах.
Гликолитической энергопродукции принадлежит важная роль в поддержании основных процессов гомеостаза миокардиальной клетки, что обеспечивает функционирование кальциевого насоса ретикулума, транспорт макроэргов к контрактильным белкам за счет активации цитоплазматической креатинфосфокиназы, подготовку аминокислот для вовлечения в цикл трикарбоновых кислот, поддержку физиологической продолжительности потенциала действия КМ [28]. АТФ, образованному в процессе гликолиза, отводится важная роль в энергообеспечении физиологической продолжительности потенциала действия мембраны КМ [24]. Дефицит АТФ существенно повышает опасность развития фибрилляции желудочков, что получило подтверждение в условиях эксперимента. С гликолитической продукцией АТФ связан синтез КФ в цитоплазме [22, 28, 31].
Энергетический обмен гипоксически поврежденного миокарда
Существует множество определений термина «гипоксия». С позиции биоэнергетики гипоксия рассматривается как нарушение окислительных путей генерации в клетках, т.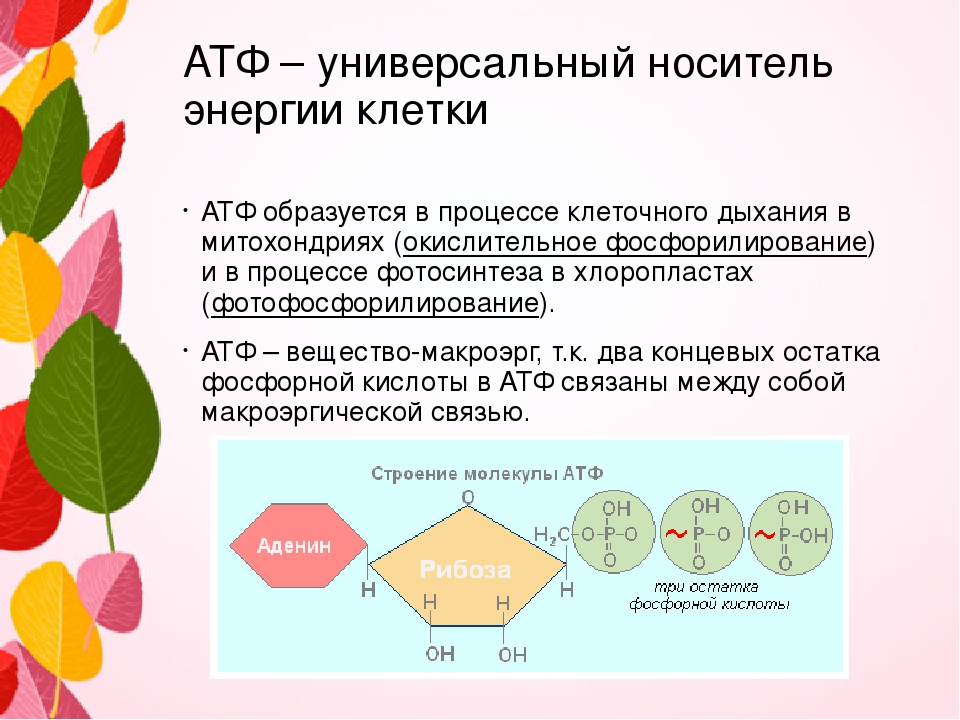 е. форма гипоэргоза [4]. Эта дефиниция была предложена С.Н. Эфуни и В.А. Шпектором для обозначения энергетической патологии клетки [32].
е. форма гипоэргоза [4]. Эта дефиниция была предложена С.Н. Эфуни и В.А. Шпектором для обозначения энергетической патологии клетки [32].
Доказано, что гипоксия, быстро нарушающая синтез АТФ в митохондриях и сопровождающаяся при этом снижением сократительной функции сердца, является первым по времени и основным по значению фактором развития ишемии, которая вызывает ряд глубоких нарушений в метаболизме кардиомиоцитов [24, 27].
В основе развития гипоксии лежит усиление несоответствия между снабжением кислорода клеток и тканей и резким ростом потребности в нем организма в результате интенсификации аэробного обмена на системном уровне, особенно у новорожденных [33, 34]. Для удовлетворения потребностей метаболизма в условиях недостаточного снабжения кислородом тканей развивается цепь биохимических и физиологических изменений, цель которых — обеспечить оптимальное функционирование и, по возможности, восстановление организма на исходном уровне по окончании периода кислородной недостаточности [7, 35].
В условиях ишемии прекращение доставки кислорода к миокарду мобилизует свободный (около 0,07 мл О2 на 100 г ткани) и остаточный кислород сердечной мышцы, главным образом связанный с миоглобином, содержание которого — около 0,5 г на 100 г ткани [23]. В физиологических условиях функция миоглобина как акцептора кислорода, заключается в обеспечении непрерывности поступления кислорода в митохондрии при резком снижении коронарного кровотока в период систолы. Однако это не решает проблему, так как этого количества кислорода достаточно для энергообеспечения лишь 6—7 сердечных сокращений [22]. При гипоксии происходит быстрое истощение резерва кислорода, связанного с гемоглобином и миоглобином, снижается уровень субстратов окисления в тканях, падает активность ферментов. Вследствие этого в митохондриях нарушаются процессы окислительного фосфорилирования, а также транспорт АТФ из митохондрий к местам его использования [23, 24]. Это приводит к снижению концентрации АТФ и КФ и накоплению продуктов метаболизма макроэргов.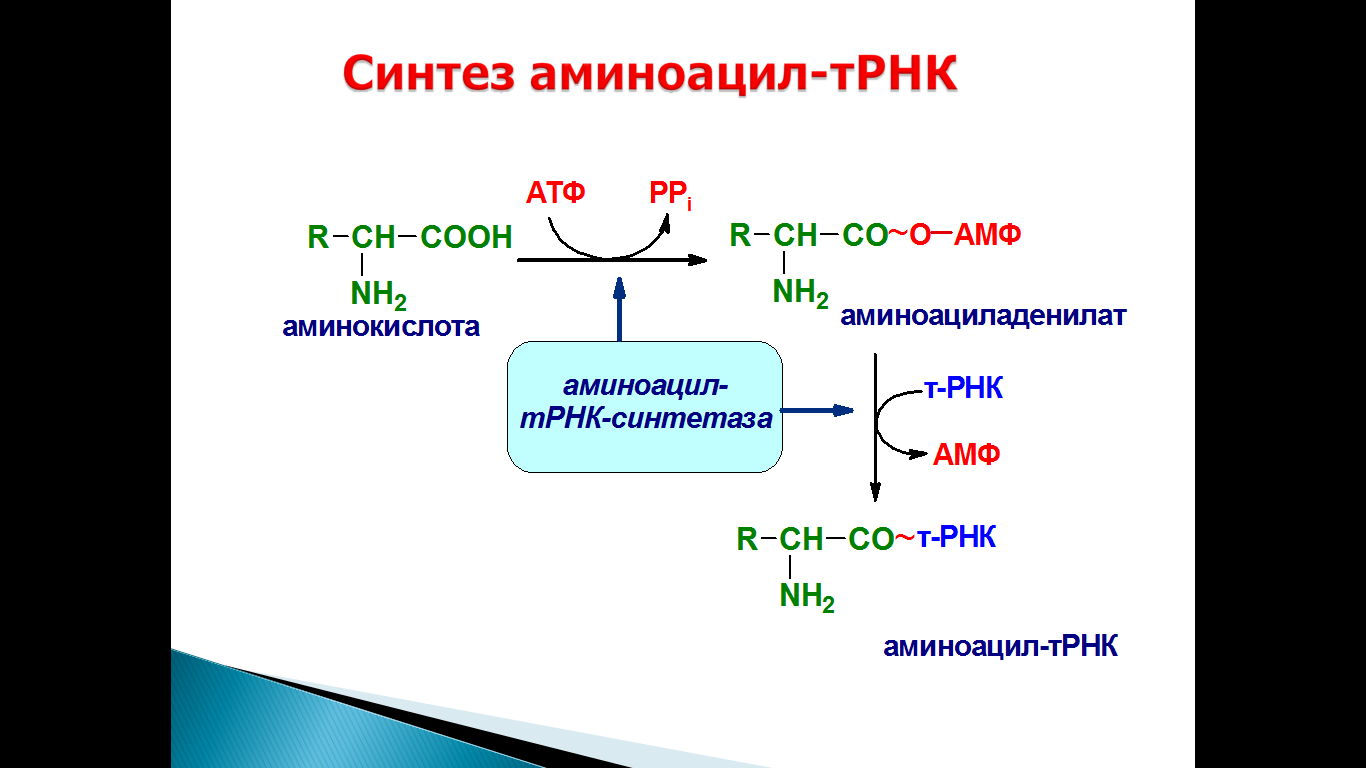 При этом скорость снижения концентрации КФ существенно больше, чем АТФ, что обусловлено быстрым расходом его на образование АТФ и нарушением транспорта из митохондрий [22, 23]. Характерно, что темп потерь КФ опережает скорость деградации АТФ. Представляет интерес, что в условиях ишемии сердечной мышцы отмечается повышение количества КФ в зоне, граничащей с участком ишемии, носящее компенсаторный характер [36].
При этом скорость снижения концентрации КФ существенно больше, чем АТФ, что обусловлено быстрым расходом его на образование АТФ и нарушением транспорта из митохондрий [22, 23]. Характерно, что темп потерь КФ опережает скорость деградации АТФ. Представляет интерес, что в условиях ишемии сердечной мышцы отмечается повышение количества КФ в зоне, граничащей с участком ишемии, носящее компенсаторный характер [36].
Несмотря на усиление гликолитической энергопродукции, острая ишемия резко тормозит темп синтеза макроэргов, что ведет к нарушению энергообеспечения функций и гомеостаза ишемизированных КМ [22]. Одновременно с нарушением синтеза АТФ в митохондриях и накоплением восстановленных форм компонентов дыхательной цепи в ишемизированной ткани происходит мобилизация аварийных компенсаторных механизмов энергообеспечения, в частности, гликолитической продукции макроэргов [37].
При длительной и тяжелой гипоксии происходит переход метаболизма на анаэробный путь с увеличением утилизации различных субстратов и прекращение синтетических процессов, о чем свидетельствует интенсификация процессов перекисного окисления липидов (ПОЛ) [38—40]. Ранний переход от окислительного метаболизма к анаэробной продукции энергии обеспечивается активацией фосфорилазы и повышением транспорта глюкозы в ишемизированных клетках миокарда.
Ранний переход от окислительного метаболизма к анаэробной продукции энергии обеспечивается активацией фосфорилазы и повышением транспорта глюкозы в ишемизированных клетках миокарда.
Однако усиление анаэробного гликолиза, которое можно рассматривать как компенсаторную реакцию, направленную на восполнение энергозатрат в условиях гипоксии, является неэффективным механизмом, поскольку это дает очень малый выход энергии: из одной молекулы глюкозы образуются только две молекулы АТФ [24].
Известно, что в начальной стадии ишемии наблюдается универсальная первичная реакция митохондрий — эффект «мягкого разобщения» [22]. В случае уменьшения напряжения кислорода в сердечной мышце ниже 3—5 мм рт.ст. тормозится не только окисление субстратов цикла трикарбоновых кислот, но и связанное с ним фосфорилирование, причем его скорость резко падает. При длительной ишемии снижается способность митохондрий КМ использовать NAD·H-зависимые субстраты [22, 41]. Накопление NAD·Н, лактата и протонов приводит к ингибированию ферментов гликолиза и нарушению энергообеспечения процессов поддержания гомеостаза в ишемизированных КМ.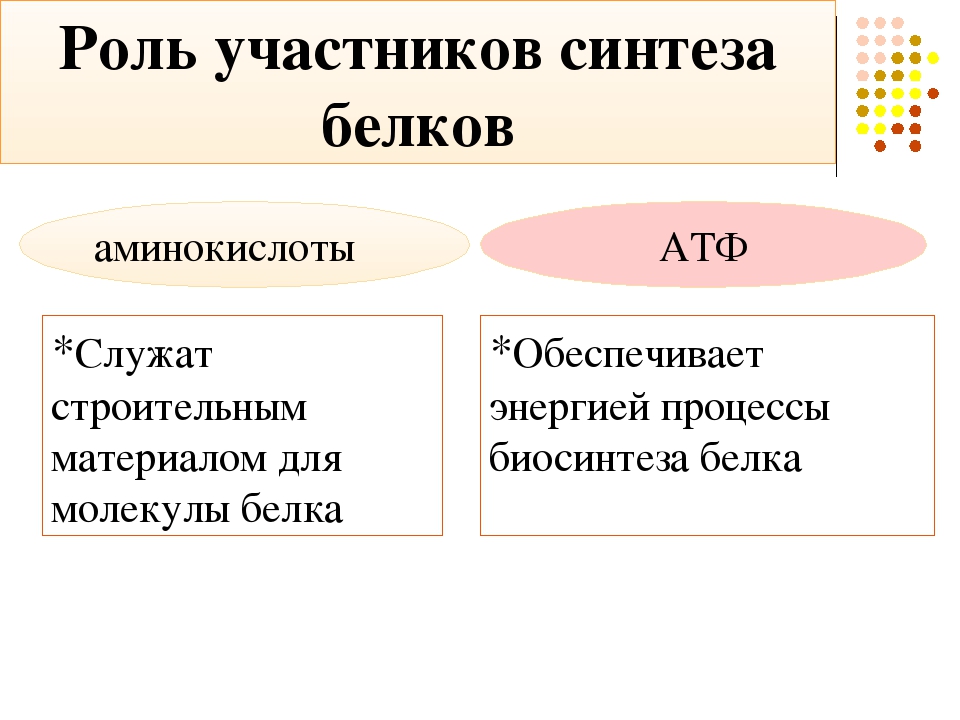 К концу 60-й минуты ишемии гликолиз тормозится полностью, содержание адениновых нуклеотидов при этом падает на 69%, а АТФ — на 94% [22]. В свою очередь транспорт и использование АТФ, который производится в цикле Эмбдена-Мейергофа вследствие торможения активности цитоплазматических изоформ КФ, блокирует падение рН менее 6,6 [23].
К концу 60-й минуты ишемии гликолиз тормозится полностью, содержание адениновых нуклеотидов при этом падает на 69%, а АТФ — на 94% [22]. В свою очередь транспорт и использование АТФ, который производится в цикле Эмбдена-Мейергофа вследствие торможения активности цитоплазматических изоформ КФ, блокирует падение рН менее 6,6 [23].
Снижение содержания окисленной формы никотинамидных коферментов является «ахиллесовой пятой» при гипоксии, потому что, выполняя функцию переносчиков водорода, NAD, NADP и их восстановленные формы участвуют в процессах клеточного дыхания, которые при дефиците кислорода нарушаются в первую очередь [22, 42—45]. Изменение соотношения окисленных и восстановленных их форм, в свою очередь, может служить одной из причин нарушений окислительно-восстановительных процессов в цикле трикарбоновых кислот и сопряженного с ним окислительного фосфорилирования, окисления жирных кислот и других путей обмена веществ, участвующих в адаптации организма к гипоксии [24]. Кроме того что АТФ служит непосредственным источником энергии для большинства клеточных метаболических процессов, он также регулирует активность многих ферментов. Достаточная внутриклеточная концентрация АТФ — необходимое условие для обеспечения клеточной функции и выживания, однако для метаболической регуляции не менее важно соотношение АТФ и других адениновых нуклеотидов («адениновый заряд энергии» или «потенциал фосфорилирования») [2].
Достаточная внутриклеточная концентрация АТФ — необходимое условие для обеспечения клеточной функции и выживания, однако для метаболической регуляции не менее важно соотношение АТФ и других адениновых нуклеотидов («адениновый заряд энергии» или «потенциал фосфорилирования») [2].
При гипоксии снижается энергетический заряд, поскольку фосфорилирование АДФ в АТФ нарушено [46—49]. Это ведет к увеличению концентрации АМФ, который образуется из АДФ при участии аденилаткиназы. Другое следствие — снижение общего пула адениновых нуклеотидов вследствие стимуляции катаболизма нуклеотидов. Это происходит посредством участия АМФ-дезаминазы — фермента, активирующегося при снижении энергетического заряда. Продуктами этого нарушенного пути являются инозинмонофосфат (ИМФ), инозин, гипоксантин, ксантин и мочевая кислота. Альтернативным вариантом катаболизма АМФ является первичное дефосфорилирование аденозина в инозин. Значение этого пути заключается в том, что аденозин является сильнодействующим вазодилататором и, как было установлено, играет роль в защитной реакции миокарда на гипоксию [2, 50, 51]. Адениновые нуклеотиды и ИМФ остаются внутри клетки, тогда как пуриновые нуклеозиды (аденозин, инозин) и производные (гипоксантин, ксантин, мочевая кислота) выходят в экстрацелюлярное пространство [35]. Небольшое количество АМФ дефосфорилируется в аденозин, далее из миоцита поступает в эндотелиальную клетку, где необратимо метаболизируется до гипоксантина, который затем под действием ксантиндегидрогеназы превращается в мочевую кислоту и выводится почками [4].
Адениновые нуклеотиды и ИМФ остаются внутри клетки, тогда как пуриновые нуклеозиды (аденозин, инозин) и производные (гипоксантин, ксантин, мочевая кислота) выходят в экстрацелюлярное пространство [35]. Небольшое количество АМФ дефосфорилируется в аденозин, далее из миоцита поступает в эндотелиальную клетку, где необратимо метаболизируется до гипоксантина, который затем под действием ксантиндегидрогеназы превращается в мочевую кислоту и выводится почками [4].
В отличие от адениннуклеотидов аденозин может выходить из клетки и в обычных условиях. Его молекула как бы осуществляет обратную связь, с помощью которой клетка сама регулирует свое кровоснабжение. Если содержание АТФ уменьшается, то аденозин образуется в избыточном количестве и, диффундируя к артериолам, увеличивает капиллярный кровоток, вследствие чего КМ получает достаточное количество кислорода [41, 47]. В условиях ишемии эта молекула выступает как природный ингибитор адренорецепторов КМ, клетки становятся невосприимчивыми к симпатической стимуляции, что, несомненно, сохраняет их энергию, в результате чего увеличивается жизнеспособность клеток в неблагоприятных условиях [52].
По завершению гипоксии отношение концентрации нуклеотидов — быстро, а размеры их пулов — более медленно, возобновляются. На этой стадии аденозин и гипоксантин могут быть утилизированы для синтеза нуклеотидов («спасительный путь») при меньших энергетических затратах, чем синтез пуринов de novo [24].
Как известно, при активации гликолиза вследствие накопления недоокисленных продуктов образуется лактат и повышается концентрация ионов водорода [51, 53—55]. В аэробных условиях продукты метаболизма обычно используются в митохондриях, однако при выключении функции этих клеточных органелл в условиях ишемии недоокисленные продукты накапливаются. Таким образом, происходит смещение реакции среды КМ в кислую сторону, что приводит к развитию внутриклеточного ацидоза [56—59].
По данным литературы, снижение рН на 0,5—1,7 после 30-минутной ишемии вызывает падение механической функции сердца на 30—100% [22]. Доказано, что жесткий ацидоз (рН менее 6,6) является инициирующим фактором клеточной альтерации.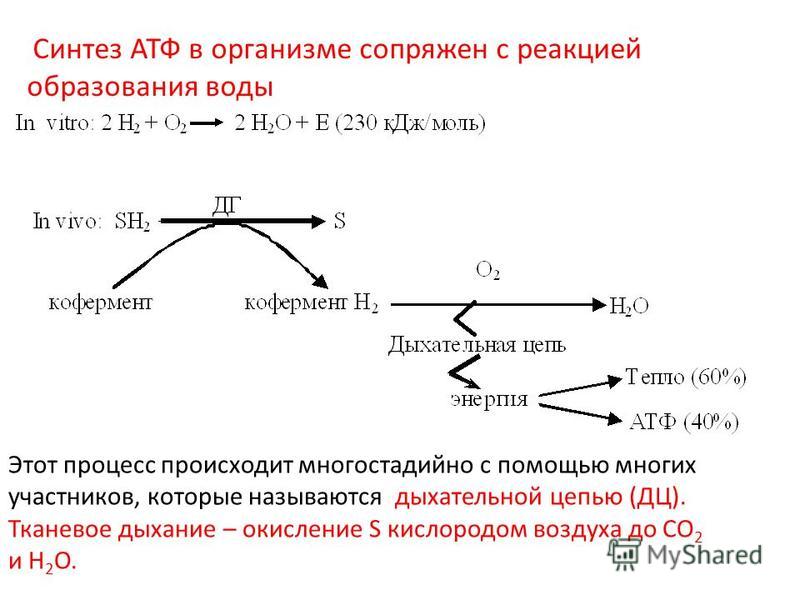 В миокарде повышается концентрация свободного кальция, а наличие неорганического фосфата способствует его перемещению к митохондриям [24], активирует освобождение «миокардиальных» катехоламинов, повышает активность фосфолипаз, активирует кислые лизосомальные протеазы, индуцирует развитие так называемого пероксидного стресса (накопление Н2О2, стимуляция перекисного окисления липидов). Это еще более увеличивает энергетическую недостаточность сердечной мышцы, что приводит к необратимым изменениям в ишемизированном миокарде [42, 60—62].
В миокарде повышается концентрация свободного кальция, а наличие неорганического фосфата способствует его перемещению к митохондриям [24], активирует освобождение «миокардиальных» катехоламинов, повышает активность фосфолипаз, активирует кислые лизосомальные протеазы, индуцирует развитие так называемого пероксидного стресса (накопление Н2О2, стимуляция перекисного окисления липидов). Это еще более увеличивает энергетическую недостаточность сердечной мышцы, что приводит к необратимым изменениям в ишемизированном миокарде [42, 60—62].
Как известно, ацидоз подавляет АТФазную активность миозина [56]. Он вызывает нарушениезахвата Са2+саркоплазматическим ретикулумом [22]. Повышение концентрации протонов ухудшает взаимодействие Са2+ с тропонином и процесс его депонирования в саркоплазматическом ретикулуме [59]. Одновременно внутриклеточный ацидоз сопровождается деградацией миозина за счет диссоциации его легких цепей и диффузии их в кровь [22].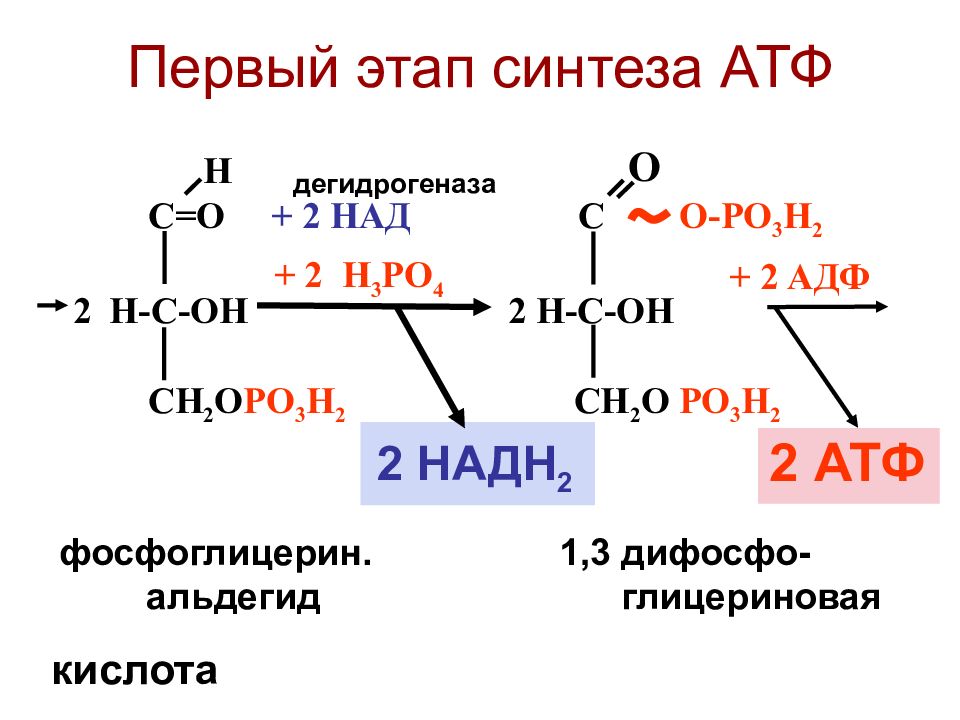 Увеличение концентрации Са2+ в сократительных белках приводит к тому, что отсоединение «головок» миозина от центров актина становится невозможным, нарушается процесс диастолического расслабления, развивается контрактура, характерная для гипоксии [33]. Ухудшению сократимости миокарда способствует и накопление фосфатов в клетке, образующегося в результате неконтролируемого распада АТФ до АДФ И АМФ. Накопление фосфатов наряду с ацидозом снижает чувствительность миофибрилл к ионам кальция.
Увеличение концентрации Са2+ в сократительных белках приводит к тому, что отсоединение «головок» миозина от центров актина становится невозможным, нарушается процесс диастолического расслабления, развивается контрактура, характерная для гипоксии [33]. Ухудшению сократимости миокарда способствует и накопление фосфатов в клетке, образующегося в результате неконтролируемого распада АТФ до АДФ И АМФ. Накопление фосфатов наряду с ацидозом снижает чувствительность миофибрилл к ионам кальция.
Поскольку кислород является акцептором электронов на конечном этапе электроннотранспортной цепи, снижение содержания кислорода в митохондриях ниже «критического давления кислорода» (1—2 мм рт.ст.) приводит к замедлению скорости всего процесса. В результате этого начинает накапливаться АДФ, поскольку он больше не превращается в АТФ. НАДФ перестает реокисляться, и отношение НАД/НАДФ в митохондриях начинает снижаться [2].
Существовавшее ранее представление о митохондриях как о специализированных органеллах, контролирующих исключительно энергетический обмен, в настоящее время дополнено сведениями о них как об органеллах, содержащих факторы, определяющие судьбу клетки [8, 63, 64]. Доказано, что митохондрии ответственны за функционирование и регулирование большого числа сигнальных путей, которые обеспечивают не только митохондриальный биогенез и пролиферацию клеток, но и, наоборот, запрограммированную гибель клетки посредством ограничения окислительно-восстановительных реакций [8].
Доказано, что митохондрии ответственны за функционирование и регулирование большого числа сигнальных путей, которые обеспечивают не только митохондриальный биогенез и пролиферацию клеток, но и, наоборот, запрограммированную гибель клетки посредством ограничения окислительно-восстановительных реакций [8].
В настоящее время достаточно изученным из митохондриальных факторов, регулирующих метаболическую и функциональную активность клетки, является митохондриальный АТФ-зависимый калиевый канал (КАТФ-канал; ATP-sensitiveK+ channels). Установлено, что воздействие хронической гипоксии приводит к активации митохондриальных КАТФ-каналов в миокарде [65], которые вне гипоксии при наличии достаточного количества молекул АТФ закрыты. Если же количество молекул АТФ уменьшается, то калиевые каналы открываются и ионы калия выходят во внеклеточную среду. При этом, как известно, потери ионов калия приводят к тому, что КМ утрачивает способность к возбуждению.
Доказано, что умеренная хроническая гипоксия приводит к увеличению синтеза белка SUR2Aт (регуляторная субъединица КАТФ-канала) и возрастанию плотности этих каналов на мембранах кардиомиоцитов по механизму, который не зависит от HIF-1α (hypoxia inducible factor 1 alpha) [66, 67].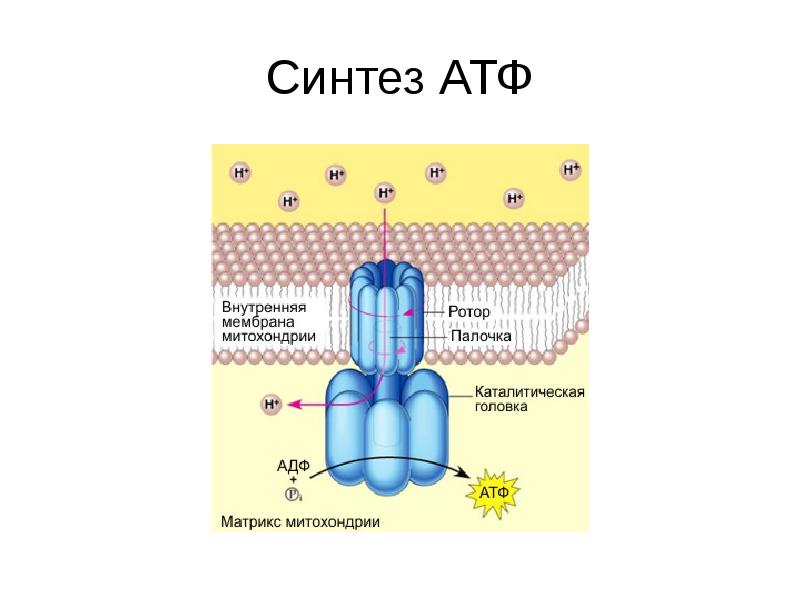 Последний, как известно, представляет собой субъединицу гетеродимерного белка HIF-1, причем, в отличие от его β-субъединицы, экспрессируемой постоянно, α-субъединица регулируется уровнем кислорода [68—70]. В состоянии кислорододефицита белковая молекула HIF-1α не гидроксилируется, остается стабильной, происходит их накопление. В последующем эти субъединицы (HIF-1α, HIF-1β) объединяются, и образовавшийся в результате этого транскрипционный белок HIF-1 в ядре клетки связывается с особыми последовательностями ДНК в генах, экспрессия которых индуцируется гипоксией [67, 68, 71].
Последний, как известно, представляет собой субъединицу гетеродимерного белка HIF-1, причем, в отличие от его β-субъединицы, экспрессируемой постоянно, α-субъединица регулируется уровнем кислорода [68—70]. В состоянии кислорододефицита белковая молекула HIF-1α не гидроксилируется, остается стабильной, происходит их накопление. В последующем эти субъединицы (HIF-1α, HIF-1β) объединяются, и образовавшийся в результате этого транскрипционный белок HIF-1 в ядре клетки связывается с особыми последовательностями ДНК в генах, экспрессия которых индуцируется гипоксией [67, 68, 71].
Активация КАТФ-каналов в условиях хронической гипоксии приводит к увеличению устойчивости пор, регулирующих проницаемость митохондрий — МРТ-пор (mitochondrial transition pore). Открытие этих пор провоцирует набухание митохондрий, приводит к разобщению окислительного фосфорилирования и выходу из митохондрий цитохрома С и белка AIF (apoptosis-inducing factor) [72]. Именно эти вещества катализируют превращение неактивной прокаспазы-9 в активную каспазу-9; последняя, в свою очередь, активирует превращение прокаспазы-3 в каспазу-3, что в конечном итоге приводит к апоптозу [73].
МРТ-пора, ответственная за проницаемость митохондрий, модулируется еще одним К+-каналом: Са2+-зависимым К+-каналом митохондрий (BKCa Big-conductance Ca2+-activated K+ channel) [74—77]. Установлено, что открытие этих каналов сопровождается увеличением продукции O2—*.
Как известно, цитохромы дыхательной цепи митохондрий — это кислород-чувствительные ферменты и основные источники активных форм кислорода (АФК) в клетке [78, 79]. При развитии ишемии увеличение продукции АФК компонентами электронно-транспортной цепи возрастает лавинообразно [79, 80]. Примечательно, что наибольшее содержание АФК регистрируется в миокарде при длительной (более 30 мин) ишемии, характеризующейся очень низким уровнем кислорода в ткани миокарда [54, 79]. Предполагается, что гипоксия сопровождается увеличением количества восстановленных форм переносчиков дыхательной цепи (НАД, коэнзим Q и др. ), подвергающиеся аутоокислению с образованием АФК даже при низких концентрациях кислорода [54].
), подвергающиеся аутоокислению с образованием АФК даже при низких концентрациях кислорода [54].
Трудно недооценить роль АФК в развитии ишемии миокарда [78—81]. Установлено, что АФК выступают важным фактором ишемического повреждения миокарда [82—85] и аритмогенеза [86, 87].
Немаловажную роль в предотвращении нарушений микроциркуляции, развивающихся при ишемии, отводится состоятельности регулирующей системы «NO-синтаза (NOS) — оксид азота» [88—92]. Помимо вазомоторных эффектов радикала оксида азота (NO*) в настоящее время открыто множество его внутриклеточных функций. Установлено, что NO* может конкурентно ингибировать цитохромоксидазу, тем самым участвуя в регуляции выработки супероксидного радикала и перекиси водорода [55]. Оксид азота способен активировать митохондриальные АТФ-чувствительные К+-каналы, предупреждать образование MPT-пор и регулировать митохондриальный биогенез [93]. Оксид азота активирует растворимую гуанилатциклазу, что ведет к выработке цГМФ с последующей активацией протеинкиназы С и ее регуляторного каскада [90].
Метаболические расстройства, развивающиеся при ишемии, можно охарактеризовать как накопление ионов водорода и фосфата, а также увеличенный выход аденозина и ионов калия из клетки [89, 94—101]. Эти метаболические последствия ишемии фактически направлены на защиту клеточного метаболизма, ресурсов клеток от быстрого использования. По сути при глубокой ишемии клетки впадают в состояние гибернации, основная цель которой — обеспечить жизнеспособность клеток в ожидании возможного восстановления кровотока. По даннымS. Rahimtoola, давшего название этому феномену в 1984 г. [102]: «Гибернация миокарда — это тонкий механизм регуляции, адаптирующий функциональную активность миокарда к конкретным условиям кровоснабжения, т.е. это защитная реакция страдающего сердца». Быстрая реперфузия, т.е. восстановление кровотока к исходному уровню в таком гибернированном сердце, устраняет этот метаболический защитный механизм и способна возродить сократительную функцию миокарда [83]. По образному выражению L. Opie [29]: «Участки пораженного миокарда находятся как бы в уснувшем состоянии, но способны проснуться после восстановления кровотока». При этом степень и качество его восстановления зависят прежде всего от продолжительности ишемического периода. Восстановление энергетического метаболизма после кратковременной ишемии (не более 5 мин) происходит полностью. Более того, КМ приобретают повышенную резистентность к следующему ишемическому воздействию [3, 100, 101]. Однако, если кровоток восстанавливается после периода длительной ишемии, то сократительная функция сердца может возобновиться и в условиях неполного энергетического ресурса клетки. Для такого состояния в литературе используется термин «оглушенный» или реперфузионный миокард [99, 101, 102]. Основной проблемой этого состояния является продолжение повреждения внутриклеточных структур, которое в значительной степени обусловлено действием свободных радикалов кислорода, образующихся в большом количестве при реперфузии поврежденного участка, которая возвращает кислород в ишемизированные клетки [3, 85].
Opie [29]: «Участки пораженного миокарда находятся как бы в уснувшем состоянии, но способны проснуться после восстановления кровотока». При этом степень и качество его восстановления зависят прежде всего от продолжительности ишемического периода. Восстановление энергетического метаболизма после кратковременной ишемии (не более 5 мин) происходит полностью. Более того, КМ приобретают повышенную резистентность к следующему ишемическому воздействию [3, 100, 101]. Однако, если кровоток восстанавливается после периода длительной ишемии, то сократительная функция сердца может возобновиться и в условиях неполного энергетического ресурса клетки. Для такого состояния в литературе используется термин «оглушенный» или реперфузионный миокард [99, 101, 102]. Основной проблемой этого состояния является продолжение повреждения внутриклеточных структур, которое в значительной степени обусловлено действием свободных радикалов кислорода, образующихся в большом количестве при реперфузии поврежденного участка, которая возвращает кислород в ишемизированные клетки [3, 85].
Причиной длительного снижения контрактильности миокарда принято считать реперфузионное повреждение [3, 101]. Миокард в стадии реперфузии, даже после кратковременной, обратимой ишемии выявляет длительное угнетение контрактильной функции, что является следствием ультраструктурных, метаболических, сосудистых, электрофизиологических и других нарушений [3, 84].
Исходя из этого следует различать понятие «спящий»/ «гибернирующий» (hibernating myocardium) и «оглушенный»/ «реперфузионный» (miocardial stunning) миокард. «Спящий» миокард возникает при хронической ишемии, «оглушенный» — в ходе реперфузии, после непостоянной ишемии (см. таблицу).
Основные дифференциально-диагностические отличия функционального состояния миокарда при гибернации и «оглушенности»При «спящем» миокарде кровоток хронически снижен, при «оглушенном» — нормальный или почти нормальный [14]. Это наиболее важные различия. Функция левого желудочка в обоих случаях снижена. При «спящем» миокарде сохраняется соответствие между изменением его функции и нарушением кровотока, при «оглушенном» этого соответствия нет: функция левого желудочка и сократимость нарушены, развивается ишемическая дисфункция, в то же время кровоток отстается нормальным или почти нормальным [63, 99]. При «оглушенном» миокарде наблюдается спонтанное постепенное восстановление функции сердечной мышцы. Глубокое угнетение его функции при «спящем» миокарде продолжается неопределенно долго, и если коронарный кровоток не улучшается, то происходит прогрессирование изменений вплоть до некроза сердечной мышцы. Функция левого желудочка восстанавливается только при нормализации кровотока [14].
При «спящем» миокарде сохраняется соответствие между изменением его функции и нарушением кровотока, при «оглушенном» этого соответствия нет: функция левого желудочка и сократимость нарушены, развивается ишемическая дисфункция, в то же время кровоток отстается нормальным или почти нормальным [63, 99]. При «оглушенном» миокарде наблюдается спонтанное постепенное восстановление функции сердечной мышцы. Глубокое угнетение его функции при «спящем» миокарде продолжается неопределенно долго, и если коронарный кровоток не улучшается, то происходит прогрессирование изменений вплоть до некроза сердечной мышцы. Функция левого желудочка восстанавливается только при нормализации кровотока [14].
Таким образом, ишемия приводит к выраженным нарушениям процессов энергообразования и повреждению клеточных структур миокарда, особенно после возобновления поставки кислорода, т.е. реперфузии. Переключение на анаэробные метаболические пути приводит к тому, что запасы АТФ снижаются, т.к. последний превращается в АДФ и АМФ с ограниченной возможностью рефосфорилирования. При более тяжелом или более длительном дефиците кислорода поддержание достаточных уровней богатых энергией фосфатных соединений, особенно АТФ, становится невозможным. Большая часть энергозависимых процессов замедляется или прекращается. Это ведет к более глубоким нарушениям клеточной функции, неспособности поддерживать ионное равновесие и, в конечном итоге, к гибели клетки.
При более тяжелом или более длительном дефиците кислорода поддержание достаточных уровней богатых энергией фосфатных соединений, особенно АТФ, становится невозможным. Большая часть энергозависимых процессов замедляется или прекращается. Это ведет к более глубоким нарушениям клеточной функции, неспособности поддерживать ионное равновесие и, в конечном итоге, к гибели клетки.
Авторы заявляют об отсутствии конфликта интересов.
Итоговый тест по теме «Строение клетки»
Проверочная работа по теме «Строение клетки»
9 класс
Вариант 1
Уровень А (выберите один правильный ответ)
А1. Главным структурным компонентом ядра клетки являются
- хромосомы; 2) рибосомы; 3) митохондрии; 4)хлоропласты
А2. В растительных клетках, в отличие от животных, происходит
- хемосинтез; 2)биосинтез белка; 3)фотосинтез; 4) синтез липидов
А3. Собственную ДНК имеет
Собственную ДНК имеет
- комплекс Гольджи; 2) лизосома; 3) эндоплазматическая сеть;
4) митохондрия
А4. Мембранная система канальцев, пронизывающая всю клетку
- хлоропласты; 2)лизосомы; 3)митохондрии; 4) эндоплазматическая сеть
А5. Клетки животных имеют менее стабильную форму, чем клетки растений, так как у них нет:
- хлоропластов 2) вакуолей 3)клеточной стенки 4) лизосом
А6. Лизосомы формируются на:
- каналах гладкой ЭПС 2) каналах шероховатой ЭПС 3)цистернах аппаратах Гольджи 4) внутренней поверхности плазмалеммы
А7. Постоянную структурную основу биологических мембран составляют:
- белки 2) углеводы 3)нуклеиновые кислоты 4) фосфолипиды
А8. К двумембранным органоидам относятся:
1) рибосомы 2) митохондрии 3) лизосомы 4) клеточный центр
А9. Основная функция лизосом:
Основная функция лизосом:
1) синтез белков 2)расщепление органических веществ в клетке 3)избирательный транспорт веществ
4)хранение наследственной информации
А10. К пластидам не относятся:
- хлоропласты 2) хромопласты 3) хромосомы 4) лейкопласты
Уровень В
В1. Закончите следующие фразы:
А) Синтез запасов АТФ клетки происходит в_______________
Б) фотосинтез осуществляется в_______________
В) Биосинтез белка происходит на ______________
Г) Избирательный транспорт веществ осуществляет__________
В2. Установите соответствие между органоидами клетки и их функциями.
ФУНКЦИИ ОРГАНОИДЫ КЛЕТКИ
А) Имеет двухмембранную оболочку с порами
1) Ядро
2) Митохондрии
Б) Хранит наследственную информацию и
участвует в ее передаче
В) Содержит ядрышко, в котором собираются
рибосомы
Г) Содержат множество ферментов, участвующих
в синтезе АТФ
Д) Отвечает за синтез АТФ
Е) Содержит кариоплазму
А
Б
В
Г
Д
Е
Проверочная работа по теме «Строение клетки»
9 класс
Вариант 2
Уровень А (выберите один правильный ответ)
А1. Цитология – это наука о
Цитология – это наука о
грибах 2) клетке 3) простейших 4) о человеке
А2. Какие органоиды клетки можно увидеть в школьный световой микроскоп
лизосомы 2) рибосомы 3) клеточный центр 4) хлоропласты
А3. Основным компонентом клеточной стенки растений является
крахмал 2) хитин 3) целлюлоза 4) гликоген
А4. Сходство строения клеток автотрофных и гетеротрофных организмов состоит в наличии у них
хлоропластов 2) плазматической мембраны 3) оболочки из клетчатки 4) вакуолей с клеточным соком
А5. Эндоплазматическая сеть выполняет следующие функции
1)синтетические и защитные 2) защитные и запасающие 3)транспортные и защитные 4)транспортные и синтетические
А6. К немембранным органоидам клетки относится:
комплекс Гольджи 2) митохондрии 3) ЭПС 4) ядро 5) рибосома
А7. На видовую принадлежность эукариотической клетки указывает:
1)наличие ядра в клетке 2) количество хромосом 3) количество ядер в клетке 4) размеры клеток
А8. Антоний Левенгук в свой микроскоп мог
увидеть:
Антоний Левенгук в свой микроскоп мог
увидеть:
1)митохондрии 2) эндоплазматическую сеть 3) ядро клетки 4) рибосомы
А9. ДНК у представителей клеточных форм жизни находится:
1)в ядре или цитоплазме 2) в хлоропластах 3) в митохондриях 4) во всех выше перечисленных
А10. Накопление крахмала происходит в пластидах:
хлоропластах 2) лейкопластах 3) хромопластах 4) во всех выше перечисленных
Уровень В
В1. Закончите следующие фразы:
А) Лейкопласты на свету превращаются в__________
Б) Органоидами движения являются______________
В) Набор хромосом, содержащийся в клетках того или иного организма получил название__________
Г) Синтез запасов АТФ осуществляется в органоиде_________________
В2. Установите соответствие между органоидами клетки и их функциями.
ФУНКЦИИ ОРГАНОИДЫ КЛЕТКИ
А) Участвует в транспорте и синтезе веществ
1) Рибосомы
2) ЭПС)
Б) Может быть гладкой или шероховатой
В) Состоит из двух субъединиц
Г) Образованы рибонуклеиновыми кислотами
и белками
Д) Отвечает за синтез белков
Е) Есть у бактерий
А
Б
В
Г
Д
Е
Энергия во время тренировки.
 Статья посвещена тому, как расходуется, распределяется и восстанавливается энергия во время и после тренировки.
Статья посвещена тому, как расходуется, распределяется и восстанавливается энергия во время и после тренировки.Как расходуется энергия во время тренировки?
Начало тренировки
В самом начале тренировки, или когда энергозатраты резко возрастают (спринт), потребность в энергии больше, чем уровень, с которым происходит синтез АТФ с помощью окисления углеводов. Вначале углеводы \»сжигаются\» анаэробно (без участия кислорода), это процесс сопровождается выделением молочной кислоты (лактата). В результате освобождается некоторое количество АТФ – меньше, чем при аэробной реакции (с участием кислорода), но быстрее.
Другим \»быстрым\» источником энергии, идущим на синтез АТФ, является креатин фосфат. Небольшие количества этого вещества содержатся в мышечной ткани. При распаде креатин фосфата освобождается энергия, необходимая для восстановления АДФ до АТФ. Этот процесс протекает очень быстро, и запасов креатин фосфата в организме хватает лишь на 10-15 секунд \»взрывной\» работы, т.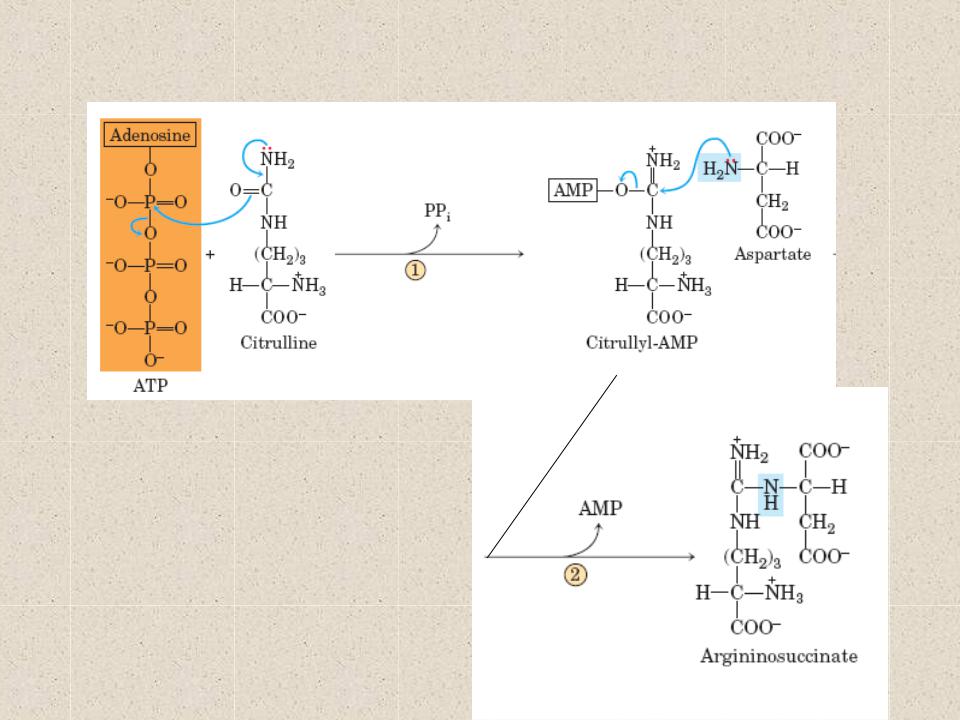 е. креатин фосфат является своеобразным буфером, покрывающим краткосрочный дефицит АТФ.
е. креатин фосфат является своеобразным буфером, покрывающим краткосрочный дефицит АТФ.
Втягивающий период тренировки
В это время в организме начинает работать аэробный метаболизм углеводов, прекращается использование креатин фосфата и образование лактата. Запасы жирных кислот мобилизуются и становятся доступными как источник энергии для работающих мышц, при этом повышается уровень восстановления АДФ до АТФ за счет окисления жиров.
Основной период тренировки
Между пятой и пятнадцатой минутой после начала тренировки в организме повышенная потребность в АТФ стабилизируется. В течение продолжительной, относительно ровной по интенсивности тренировки синтез АТФ поддерживается за счет окисления углеводов (гликогена и глюкозы) и жирных кислот. Запасы креатин фосфата в это время постепенно восстанавливаются.
При возрастании нагрузки (например, при беге в гору) расход АТФ увеличивается, причем, если это возрастание значительное, организм вновь переходит на анаэробное окисление углеводов с образованием лактата и использование креатин фосфата. Если организм не успевает восстанавливать уровень АТФ, может быстро наступить состояние усталости.
Если организм не успевает восстанавливать уровень АТФ, может быстро наступить состояние усталости.
Какие источники энергии используются в процессе тренировки?
Углеводы являются самым важным и самым дефицитным источником энергии для работающих мышц. Они необходимы при любом виде физической активности. В организме человека углеводы хранятся в небольших количествах в виде гликогена в печени и в мышцах. Во время тренировки гликоген расходуется, и вместе с жирными кислотами и глюкозой, циркулирующей в крови, используется как источник мышечной энергии. Соотношение различных используемых источников энергии зависит от типа и продолжительности упражнений.
Несмотря на то, что в жире больше энергии, его утилизация происходит медленнее, и синтез АТФ через окисление жирных кислот поддерживается использованием углеводов и креатин фосфата. Когда запасы углеводов истощаются, организм становится не в состоянии переносить высокие нагрузки. Таким образом, углеводы являются источником энергии, лимитирующим уровень нагрузки во время тренировки.
Факторы, ограничивающие энергозапасы организма во время тренировки.
1. Источники энергии, используемые при различных типах физической активности
слабая интенсивность (бег трусцой): Требуемый уровень восстановления АТФ из АДФ относительно низок, и достигается окислением жиров, глюкозы и гликогена. Когда запасы гликогена исчерпаны, возрастает роль жиров как источника энергии. Поскольку жирные кислоты окисляются довольно медленно, чтобы восполнять расходуемую энергию, возможность долго продолжать подобную тренировку зависит от количества гликогена в организме.
средняя интенсивность (быстрый бег): Когда физическая активность достигает максимального для продолжения процессов аэробного окисления уровня, возникает потребность быстрого восстановления запасов АТФ. Углеводы становятся основным топливом для организма. Однако только окислением углеводов требуемый уровень АТФ поддерживаться не может, поэтому параллельно происходит окисление жиров и образование лактата.
максимальная интенсивность (спринт): Синтез АТФ поддерживается, в основном, использованием креатин фосфата и образование лактата, поскольку метаболизм окисления углеводов и жиров не может поддерживаться с такой большой скоростью.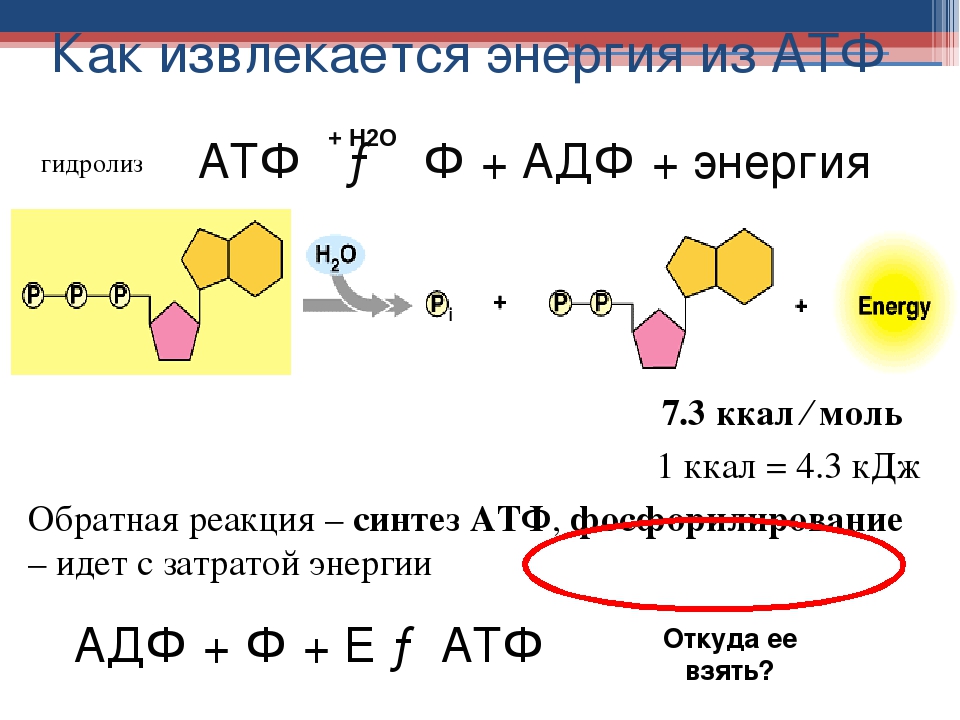
2. Продолжительность тренировки
Тип источника энергии зависит от продолжительности тренировки. Сначала происходит выброс энергии за счет использования креатин фосфата. Затем организм переходит на преимущественное использование гликогена, что обеспечивает энергией приблизительно на 50-60% синтез АТФ. Остальную часть энергии на синтез АТФ организм получает за счет окисления свободных жирных кислот и глюкозы. Когда запасы гликогена истощаются, основным источником энергии становятся жиры, в то же время из углеводов начинает больше использоваться глюкоза.
3. Тип тренировки
В тех видах спорта, где периоды относительно низких нагрузок сменяются резкими повышениями активности (футбол, хоккей, баскетбол), происходит чередование использования креатин фосфата (во время пиков нагрузки) и гликогена как основных источников энергии для синтеза АТФ. В течение \»спокойной\» фазы в организме восстанавливаются запасы креатин фосфата.
4. Тренированность организма
Чем тренированнее человек, тем выше способность организма к окислительному метаболизму (меньше гликогена превращается в лактозу) и тем экономичнее расходуются запасы энергии.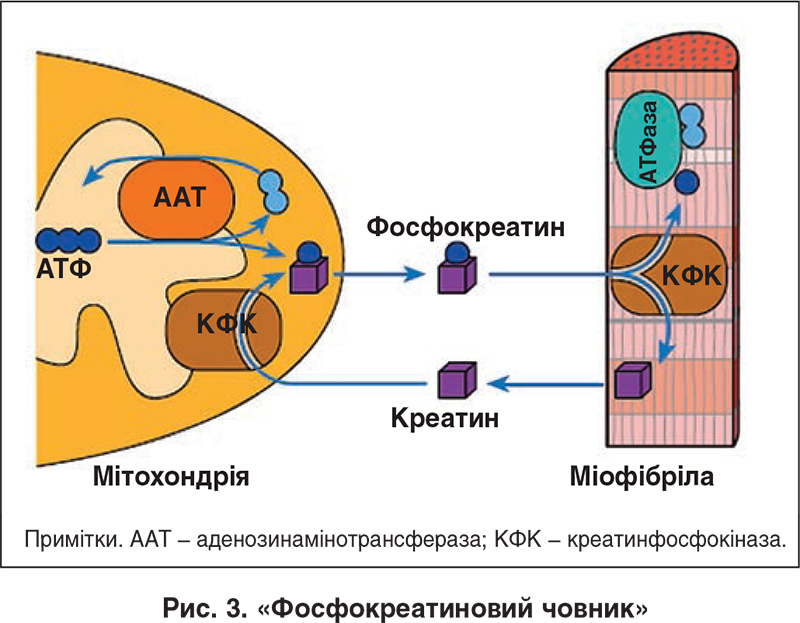 То есть, тренированный человек выполняет какое-либо упражнение с меньшим расходом энергии, чем нетренированный.
То есть, тренированный человек выполняет какое-либо упражнение с меньшим расходом энергии, чем нетренированный.
5. Диета
Чем выше уровень гликогена в организме перед началом тренировки, тем позднее настанет утомление. Чтобы повысить запасы гликогена, необходимо увеличить потребление пищи, богатой углеводами. Специалисты в области спортивного питания рекомендуют придерживаться таких диет, в которых до 70% энергетической ценности составляли бы углеводы.
Рекомендуемая спортсменам пища, богатая углеводами:
рис
паста (макаронные изделия)
хлеб
зерновые злаки
корнеплоды
Спортсмены должны съедать в день не менее 500 г углеводов. Ниже, в таблице приведено примерное содержание углеводов в различных видах пищи:
Пища Содержание углеводов (г)
Большая порция спагетти 90
Большая порция риса 60
Большая порция картофеля в мундире 45
Банка бобов 45
Два куска белого хлеба 30
500 мл молока 30
Банан 20
Яблоко 10
Из приведенной таблицы видно, что чтобы получить 500 г углеводов, съесть придется довольно много всего, поэтому многие спортсмены предпочитают употреблять специализированные углеводные добавки (глюкозу, спортивные напитки с углеводами).
Олимпийский центр спортивного питания
Пособие для персональных тренеров: наука и практика
Пособие для персональных тренеров: наука и практика.
В зависимости от интенсивности нагрузок и их продолжительности, а также физической подготовленности человека, энергия может вырабатываться тремя различными способами. Вот почему очень важно знать источники энергии, независимо от компонента фитнеса, с которым Вы работаете (кардио-респираторные упражнения, развитие силы и выносливости мышц, гибкости).
Вы должны задавать такие нагрузки, чтобы равномерно задействовать все три источника.
1. Энергия для «взрывной», кратковременной работы. Система АТФ-ФК, действующая за счет энергии, высвобождающейся при разрыве фосфатной связи. Эта система включается, когда Вы подхватываете падающего ребенка, отбиваете волейбольный мяч, т.е. быстро реагируете на какую-либо ситуацию.
2. Энергия для кратковременной работы. Система разложения молочной кислоты (бескислородный гликолиз).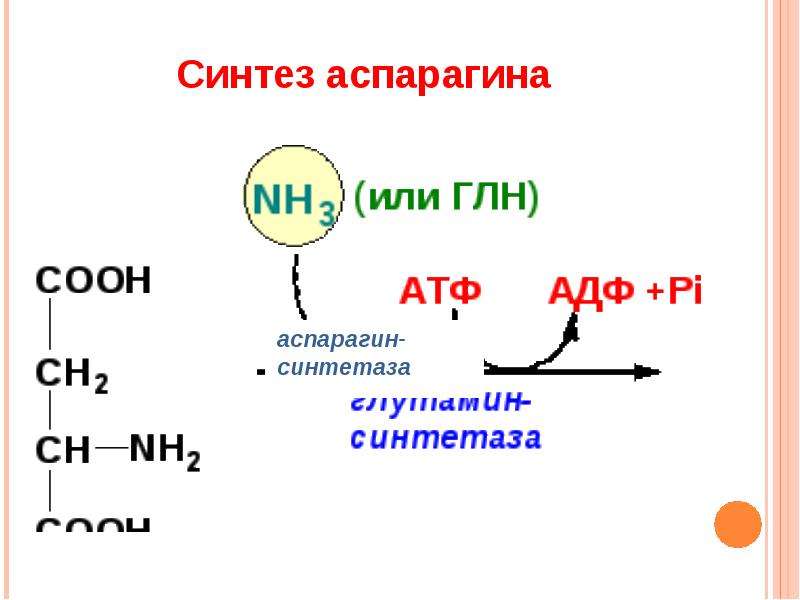 Данный источник энергии задействуется, когда надо как можно быстрее пробежать в гору расстояние в 100 ярдов (90 метров).
Данный источник энергии задействуется, когда надо как можно быстрее пробежать в гору расстояние в 100 ярдов (90 метров).
3. Энергия для продолжительной работы. Система включается, когда нужно долго идти или ехать на велосипеде и в других случаях, где требуется работа более 3-5 минут.
Все эти три системы функционируют одновременно. Процент вклада каждой из них в так называемый энергетический спектр определятся интенсивностью и продолжительностью деятельности и физическим уровнем участника. Один уровень плавно переходит в другой, и все три системы функционируют одновременно, перекрывая и дополняя друг друга, независимо от интенсивности нагрузки.
Откуда берется энергия, расходуемая на физическую деятельность и поддержание жизнедеятельности клеток? Ученые дают следующий ответ. Энергия, освобождается при окислении углеводов, жиров и белков, используется для образования в клетке универсального химического «топлива» — аденозинтрифосфорной кислоты (АТФ). Без нее невозможна жизнедеятельность клетки. АТФ – это запас энергетического топлива и основа всех трех энергетических систем: именно за счет аденозинтрифосфорной кислоты расщепляются пищевые молекулы и образуются новые, энергетически ценные, соединения. Этот процесс лежит в основе всех трех источников образования энергии.
АТФ – это запас энергетического топлива и основа всех трех энергетических систем: именно за счет аденозинтрифосфорной кислоты расщепляются пищевые молекулы и образуются новые, энергетически ценные, соединения. Этот процесс лежит в основе всех трех источников образования энергии.
ЭНЕРГИЯ ДЛЯ «ВЗРЫВНОЙ» КРАТКОВРЕМЕННОЙ
РАБОТЫ: СИСТЕМА АТФ-ФК
Энергия для сокращения мускулатуры и совершения движений высвобождается при разрыве одной из фосфатных связей, участвующих в образовании аденозинтрифосфорной кислоты (АТФ). АТФ образуется из материала, который поступает в организм с пищей. Все процессы, происходящие в организме, как-то: сокращение мышц, передача нервных импульсов, кровообращение, синтез тканей, пищеварение, секреция желез – происходят именно за счет АТФ.
Запасы АТФ в организме невелики: около 85 граммов. Это количество рассчитано всего лишь на несколько секунд работы мышц при максимальной нагрузке. Поэтому процессы синтеза АТФ в организме идут беспрерывно.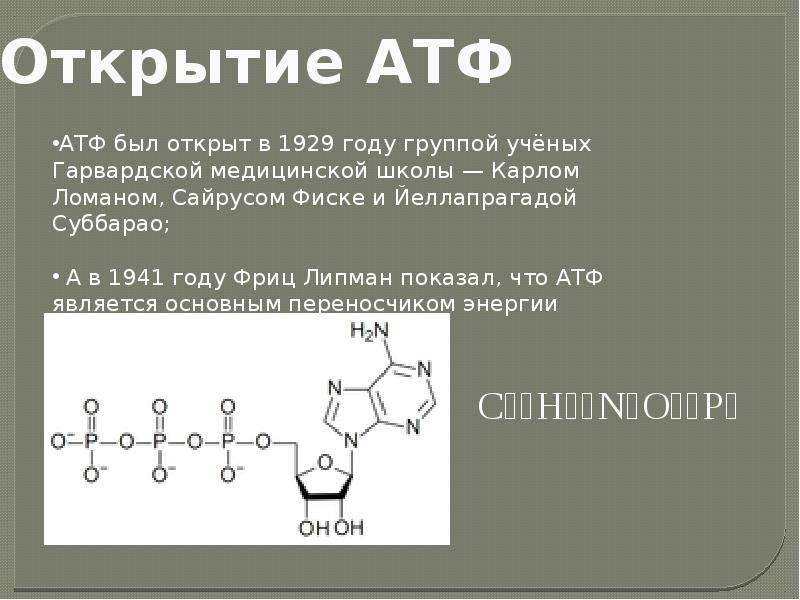
Энергия выделяется в ходе реакции разложения АТФ на аденозиндифосфорную и фосфорную кислоты. Аденозиндифосфорная кислота (АДФ) не может разлагаться далее с выделением энергии, а АТФ не является материалом, поставляемым из крови или вырабатываемым определенными тканями. Поэтому процессы синтеза АТФ в клетках постоянно пополняются: в ходе взаимодействия АДФ с фосфорной кислотой, глюкозой и кислородом снова образуется АТФ. Итак, мы наблюдаем два взаимообратных процесса: превращение АТФ в АДФ и АДФ в АТФ. Именно таким способом энергия образуется, хранится и используется.
АТФ – это универсальное химическое «топливо». Без нее наши мускулы не сокращались бы, и мы не могли бы двигаться. Так как запасы АТФ в клетках малы, то синтез АТФ из АДФ происходит постоянно, причем, чем больше энергии мы затрачиваем, тем активнее идет процесс образования АТФ, в котором задействованы все три энергетические системы.
Фосфокреатин (ФК) – еще один источник энергии, также имеющий в своем составе фосфатную связь, которая при необходимости разрывается с выделением энергии (в этом сходство ФК с АТФ). Отчасти синтез АТФ происходит за счет разложения ФК. Такое явление особенно часто наблюдается при экстренных ситуациях в условиях недостатка кислорода, необходимого для синтеза АТФ. ФК разлагается быстро и анаэробно (без кислорода), представляя, таким образом, своеобразную «резервную топливную станцию».
Отчасти синтез АТФ происходит за счет разложения ФК. Такое явление особенно часто наблюдается при экстренных ситуациях в условиях недостатка кислорода, необходимого для синтеза АТФ. ФК разлагается быстро и анаэробно (без кислорода), представляя, таким образом, своеобразную «резервную топливную станцию».
Накопление энергии в организме происходит путем синтеза АТФ и ФК (соответственно из АДФ и по реакции «Ф (фосфат) + К (креатин)»). При выполнении упражнений затрачивается огромное количество этих вещество. Теперь представьте себе, какую гигантскую работу проделывает Ваш организм ежесекундно.
На первых стадиях образования энергии идет окисление жиров, углеводов и белков, потребляемых нами в пищу. АТФ и ФК – результаты этого сложного процесса, который может протекать как аэробно (с участием кислорода) – при небольших нагрузках и восстановлении организма после физических упражнений, так и анаэробно (без кислорода). Отметим, что в организме превалирует аэробный способ синтеза АТФ и ФК.
Анаэробная система включается при выполнении физических упражнений, необходимых движений, то есть при кратковременных нагрузках. Запасы АТФ ограничены и способны поддерживать активность организма лишь очень короткое время.
Система АТФ-ФК включается при кратковременных, но сильных физических нагрузках, например, при поднятии какого-нибудь груза. В первый момент активности энергия образуется за счет разложения АТФ и ФК в клетках мышц.
Система АТФ-ФК способна поддерживать максимальную активность организма лишь в течение 10 секунд.
|
В ситуациях, когда недостаток АТФ-ФК энергии ограничивает деятельность, человек начинает регулярно заниматься упражнениями на определенные группы мышц. В результате запасы АТФ-ФК в этих зонах возрастают. Так занимаются спортсмены, например тяжелоатлеты, когда требуется взять вес, бегуны на короткие дистанции.
Вашим клиентам это не нужно. Они не спортсмены, заинтересованные в высоких результатах, видящие перед собой четкую цель. Разрабатывать АТФ-ФК-систему очень непросто: это трудоемкий процесс, не доставляющий человеку особого удовольствия.
ЭНЕРГИЯ ДЛЯ КРАТКОВРЕМЕННОЙ РАБОТЫ:
МОЛОЧНАЯ КИСЛОТА И ГЛИКОЛИЗ
Так как запасы АТФ в организме ограничены, то это соединение должно постоянно синтезироваться, иначе Вы не сможете продолжать свою деятельность. Система, в которой для выработки АТФ и ФК задействуется молочная кислота, позволяет очень быстро пополнять запасы этих энергетически важных веществ.
Во время интенсивных нагрузок энергия на восстановление АТФ и ФК берется из глюкозы и гликогена. Анаэробный процесс взаимодействия глюкозы с фосфорной кислотой и АДФ с образованием АТФ, молочной кислоты и воды называется гликолизом синтез ФК из фосфата и креатина происходит непосредственно за счет АТФ.
Анаэробный гликолиз начинается, когда истощаются ресурсы системы АТФ-ФК, например, когда надо как можно быстрее пробежать в гору отрезок длиной 100 ярдов (90 метров).
В результате гликолиза образуется большое количество молочной кислоты и в местах рабочих мышц появляется ощущение «жжения»; у Вас возникает желание прекратить активность. Подобный механизм может действовать лишь непродолжительное время, однако он позволяет быстро синтезировать АТФ из АДФ и интенсивно работать в течение такого периода времени, когда ресурсы системы АТФ-ФК истощились, а ресурсы системы для продолжительной работы задействуются незначительно.
Гликолиз очень важен, так как он позволяет продолжать двигательную активность после истощения первоначальных запасов АТФ-ФК.
Наибольшее количество молочной кислоты образуется после 60-180 с максимальных нагрузок.
Таким образом, системы АТФ-ФК и гликолиза обеспечивают максимальную физическую нагрузку на протяжении 3 минут. Однако если уровень нагрузки снижается, то период работоспособности значительно увеличивается вследствие подключения аэробного механизма выработки энергии.
Молочная кислота. Аэробный и анаэробный механизм
выработки энергии
Максимальное количество молочной кислоты вырабатывается при максимальных нагрузках.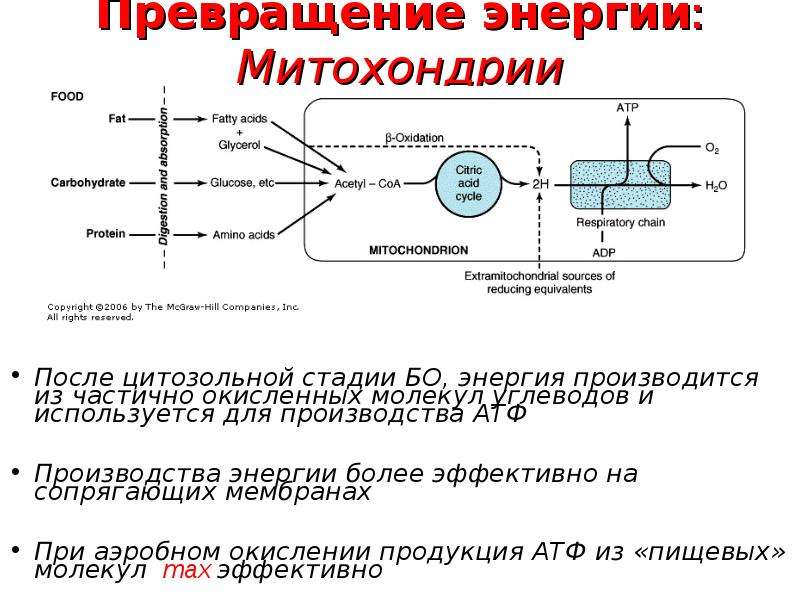 Если Вы работаете не очень интенсивно, задействуется аэробный механизм выработки энергии, при котором в мышцах или печени происходит окисление кислородом молочной кислоты.
Если Вы работаете не очень интенсивно, задействуется аэробный механизм выработки энергии, при котором в мышцах или печени происходит окисление кислородом молочной кислоты.
Здесь следует подчеркнуть, что аэробный и анаэробный механизм действуют одновременно даже в периоды отдыха или очень небольших нагрузок. Так, эритроциты не имеют митохондрий, «аэробных станций энергии», поэтому вся энергия в этих клетках образуется только за счет реакции с молочной кислотой. В организме есть и такие клетки, которые в силу своей природы не могут вырабатывать энергию по механизму гликолиза (анаэробно) и в которых действует только аэробная схема. Отметим также, что при небольших нагрузках молочная кислота образуется неинтенсивно, так что коэффициент образовавшихся молекул равен коэффициенту распавшихся молекул. С увеличением нагрузок возрастает и количество молочной кислоты.
При достижении здоровым, но не тренированным человеком аэробного уровня (VO2) в 50-55% максимального значения или при достижении пульса, равного 60-65%максимального уровня, количество молочной кислоты в организме резко увеличивается.
|
При достижении аэробного уровня в 50%, 85% или иного значения максимального потребления кислорода участник преодолевает определенный барьер, так называемый анаэробный порог, или точнее – точку аккумуляции молочной кислоты в крови. При переходе через эту точку возможностей аэробной энергетической системы уже не хватает, чтобы обеспечить необходимый уровень активности мышц, и тогда начинается интенсивная выработка молочной кислоты, т.е. организм переходит на систему гликолиза. Концентрация молочной кислоты в крови возрастает до очень больших значений (по сравнению с периодом отдыха) и, в конце концов, Вы вынуждены остановиться.
Если нагрузки соответствуют физическому уровню человека, молочная кислота не образуется в больших количествах вследствие адаптации мышц к нагрузкам.
ЭНЕРГИЯ ДЛЯ ПРОДОЛЖИТЕЛЬНОЙ РАБОТЫ:
АЭРОБНАЯ СИСТЕМА
Это наиболее сложный механизм выработки энергии из всех остальных, однако этот процесс, который еще называют клеточным дыханием, мы не будем рассматривать детально.
Кислород расщепляет углеводы и жиры. (Из белков вырабатывается лишь 5-10% всей энергии здорового организма – их аминокислоты окисляются кислородом до глюкозы, которая затем принимает участие в синтезе АТФ. Белки обычно не учитывают, когда говорят о затратах энергии при отдыхе или двигательной активности). Аэробный процесс (клеточное дыхание) выработки АТФ происходит в особых органеллах клетки — митохондриях. Механизмы АТФ-ФК и гликолиза не позволяют вырабатывать АТФ в больших количествах вследствие того, что процесс распада углеводов при отсутствии кислорода идет не до конца. По этой же причине аэробный механизм образования АТФ очень эффективен.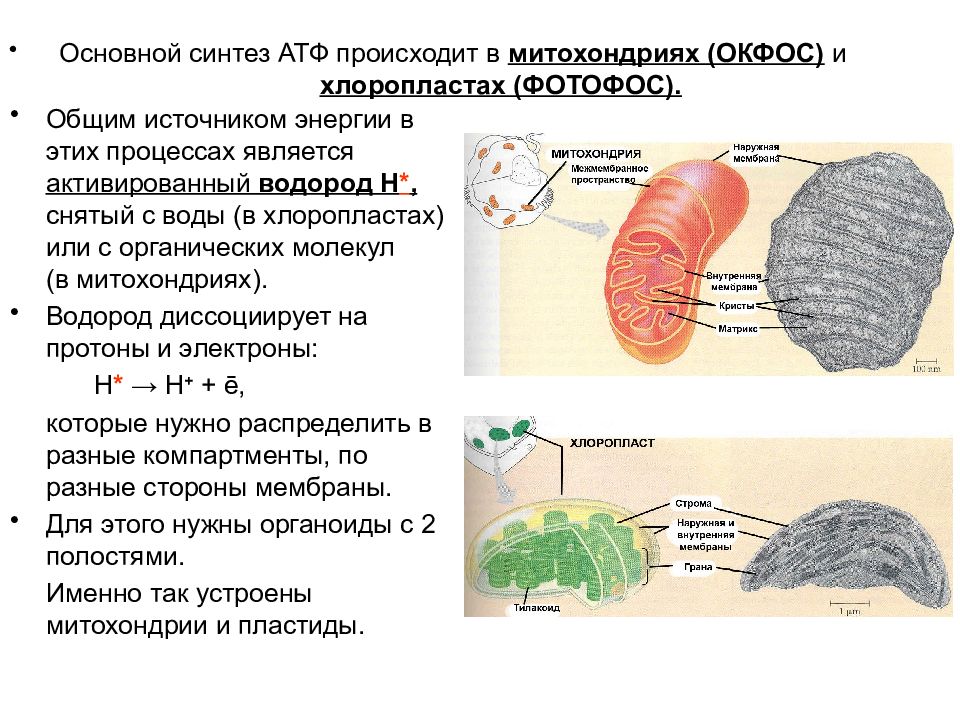
При полном окислении углеводов происходят процессы аэробного гликолиза и аэробного окисления (цикл Кребса), связанного с переносом электронов. Конечным продуктом анаэробного и аэробного гликолиза является пировиноградная кислота (ПВК). В случае анаэробного гликолиза ПВК превращается в молочную кислоту. В присутствии кислорода ПВК переходит в ацетил-кофермент А, из которого затем в процессе цикла Кребса образуется лимонная кислота. Цикл Кребса – это сложный комплекс химических реакций, в результате которых ацетил-кофермент А полностью окисляется. Свободный углерод (образовавшийся в результате разложения первоначального углевода) соединяется с кислородом, образуя углекислый газ (СО2), который кровью переносится к легким и выводится из организма.
В процессе гликолиза, когда углевод (глюкоза) превращается в ПВК, и во время цикла Кребса образуются ионы водорода. Чтобы среда клетки оставалась нейтральной, ионы водорода необходимо выводить (избыток ионов Н+ создает кислотную среду). Цикл Кребса тесно связан с серией химических реакций, в результате которых происходит передача электрона. Ионы водорода, образовавшиеся в результате гликолиза и цикла Кребса, соединяются с двумя коферментами (НАД и ФАД), которые перемещают водород по многоступенчатой цепи переноса электрона. В ходе цепи реакций водород соединяется с кислородом с образованием воды. Таким образом, среда в клетке остается нейтральной. Выигрыш энергии, достигаемый в процессе аэробных реакций, колоссальный: при полном окислении одной молекулы гликогена мы получаем 38-39 молекул АТФ, тогда как при анаэробном окислении образуются лишь три молекулы АТФ.
Цикл Кребса тесно связан с серией химических реакций, в результате которых происходит передача электрона. Ионы водорода, образовавшиеся в результате гликолиза и цикла Кребса, соединяются с двумя коферментами (НАД и ФАД), которые перемещают водород по многоступенчатой цепи переноса электрона. В ходе цепи реакций водород соединяется с кислородом с образованием воды. Таким образом, среда в клетке остается нейтральной. Выигрыш энергии, достигаемый в процессе аэробных реакций, колоссальный: при полном окислении одной молекулы гликогена мы получаем 38-39 молекул АТФ, тогда как при анаэробном окислении образуются лишь три молекулы АТФ.
Процессы окисления жиров очень важны, так как гликоген, содержащийся в мышцах и печени, может обеспечить только 1200-2000 ккал. Энергия, высвобождаемая при окислении жиров, безгранична, если имеется доступ кислорода. Триглицериды – самые большие источники «топлива». Их запасы сосредоточены в жировых клетках и волокнах скелетных мышц. В процессе образования АТФ молекула триглицерида разлагается на одну молекулу глицерина и три молекулы жирных кислот. Этот процесс называется липолизом. Жирные кислоты легко захватываются кровью и переносятся к скелетным мышцам. Далее они проникают в клетки мышц и внутри митохондрий разлагаются. Подобный процесс разложения жиров в митохондриях называется бета-окислением. В результате образуются уксусная кислота и ацетил-кофермент А.
Этот процесс называется липолизом. Жирные кислоты легко захватываются кровью и переносятся к скелетным мышцам. Далее они проникают в клетки мышц и внутри митохондрий разлагаются. Подобный процесс разложения жиров в митохондриях называется бета-окислением. В результате образуются уксусная кислота и ацетил-кофермент А.
Далее ацетил-кофермент А, как и в случае с углеводом, проходит цикл Кребса. В результате образуются молекулы АТФ, вода и углекислый газ.
При окислении жиров происходит больший выигрыш в энергии, чем при окислении углеводов, но на этот процесс требуется больше кислорода. Вот почему при значительных нагрузках в первую очередь идет разложение углеводов, однако при регулярных тренировках развивается кардиореспираторная система, кислорода начинает поступать больше и организм начинает сжигать жиры.
|
В основе окислительного процесса выработки энергии лежит способность организма поглощать и использовать кислород.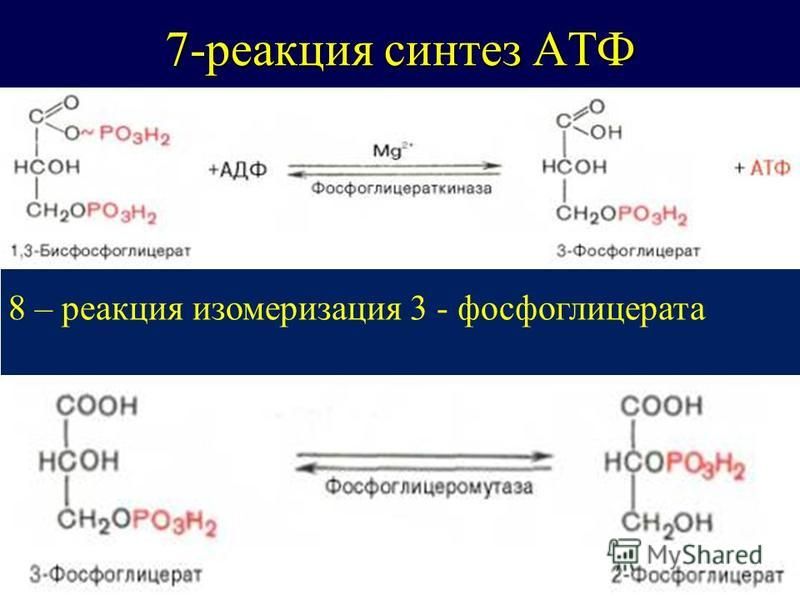 Без подключения данного механизма невозможны продолжительные нагрузки, а также восстановление организма после анаэробной деятельности (табл. 3).
Без подключения данного механизма невозможны продолжительные нагрузки, а также восстановление организма после анаэробной деятельности (табл. 3).
Таблица 3. Некоторые важные характеристики энергетических систем
| |||
| Энергия для усиленной, но кратковременной работы: система АТФ-ФК | Энергия для кратковременной работы: система гликолиза или молочной кислоты | Энергия для продолжительной работы: окислительная система |
|
анаэробная система
|
анаэробная система
|
аэробная система
|
«Топливо» | фосфокреатин запасы АТФ | глюкоза из крови гликоген | жирные кислоты глюкоза из крови гликоген |
Нагрузки | очень, очень интенсивные 9-10 баллов по шкале Борга | очень интенсивные 7 баллов по шкале Борга | средние с переходом в интенсивные 3-4 балла по шкале Борга |
% VO2 | > 95% от максимального аэробного уровня | 85-95% | < 85% |
Время работы энергетической системы | очень быстрое истощение; 1-10с | быстрое истощение – 60-180с | выдерживает длительные нагрузки; > 3 минут |
Количество вырабатываемой АТФ | небольшие запасы ФК и АТФ в клетках мышц | выработка молочной кислоты быстрое истощение системы | истощение запасов гликогена и глюкозы в клетках мышц недостаточное снабжение кислородом |
КАКУЮ ИЗ ТРЕХ ЭНЕРГЕТИЧЕСКИХ СИСТЕМ
НАДО РАЗВИВАТЬ?
Многие Ваши клиенты не захотят работать над всеми тремя энергетическими системами.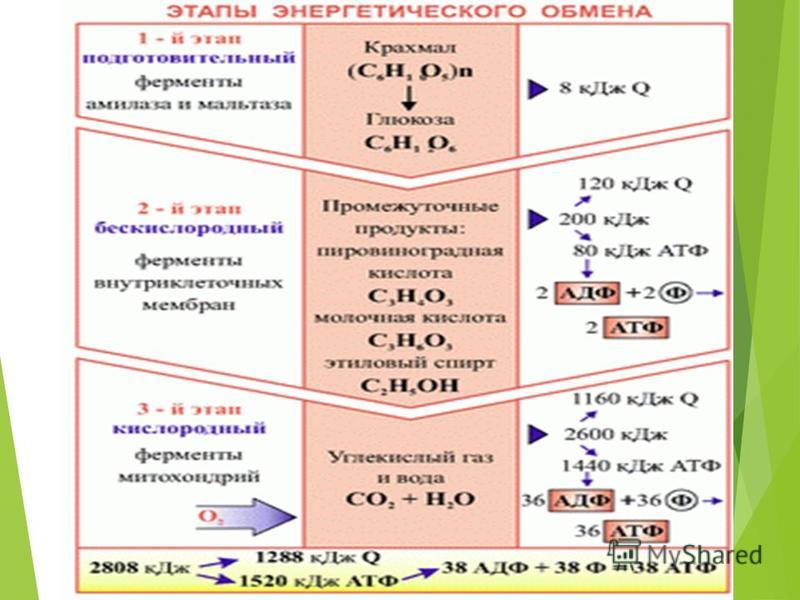 Так, тренировка механизма АТФ-ФК требует больших, но коротких нагрузок. Если человек в плохой физической форме, ему трудно будет заниматься по программе, составленной с целью развития этой энергетической системы. Кроме того, большинству клиентов вообще это не нужно.
Так, тренировка механизма АТФ-ФК требует больших, но коротких нагрузок. Если человек в плохой физической форме, ему трудно будет заниматься по программе, составленной с целью развития этой энергетической системы. Кроме того, большинству клиентов вообще это не нужно.
Когда Вы будете решать вопрос, на какой энергетической системе остановиться, спросите себя: «Мой клиент сможет выдержать нагрузки, требуемые для тренировки этой системы?». Далее ориентируйтесь по ситуации.
ЗАКЛЮЧЕНИЕ
Механизм выработки энергии определяется интенсивностью нагрузок. При разработке программы обязательно учитывайте, на какую систему следует обратить внимание, чтобы достичь целей клиента. Если Вы поняли, что такое аэробный и анаэробный механизмы получения энергии, Вам легко будет составлять «интервальные» программы, а также готовиться к занятиям на развитие мышц. Не ошибитесь на этом моменте, иначе цели клиента никогда не будут достигнуты!
АТФ-2 регулирует жировой обмен у дрозофилы
Рисунок 7.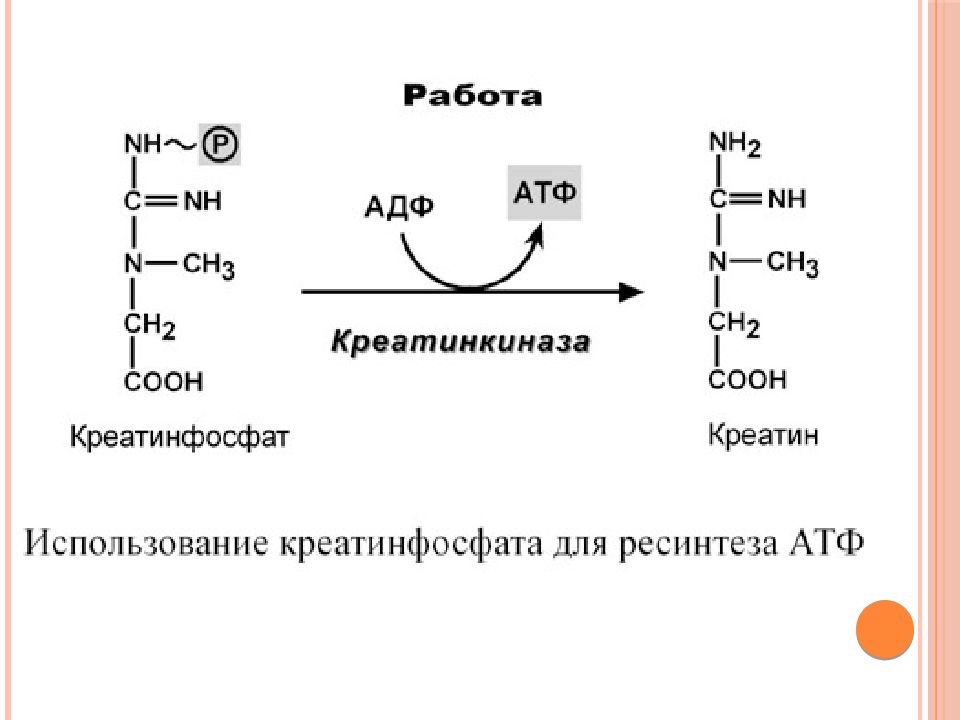
Регуляция транскрипции dPEPCK с помощью dATF-2. (A) dATF-2 локализован в ядре…
Рисунок 7. Регуляция транскрипции dPEPCK с помощью dATF-2. (A) dATF-2 локализован в ядре. dATF-2 экспрессируется в клетках жирового тела третьего возраста, что отмечено экспрессией GFP (c).Ядра окрашивали TOPO-3 (а), а dATF-2 окрашивали антителом против dATF-2 (б). Три окрашивания от a до c накладываются друг на друга в d. Генотип: y, w, hs-Flp/y, w; Act > CD2 > UAS-GFPnls /+; УАС-dATF-2 /+. (B) Активация промотора dPEPCK с помощью dATF-2. Репортерную плазмиду, в которой полноразмерная или укороченная промоторная область dPEPCK связана с геном люциферазы, котрансфицировали в клетки S2 экспрессирующей dATF-2 плазмидой или контрольной плазмидой и измеряли активность люциферазы.Репортерные плазмиды схематически показаны ниже. Остатки, составляющие полусайт CRE, обозначены закрашенными овалами, тогда как мутированные сайты показаны как ×s. Относительная активность люциферазы по сравнению с активностью, полученной без экспрессионной плазмиды dATF-2, указана как среднее значение трех экспериментов ± SE (n = 6–10). (C) Путь dp38 усиливает dATF-2-зависимую -транс--активацию промотора dPEPCK . Промотор-люциферазный репортер dPEPCK трансфицировали в клетки S2 вместе с плазмидой, экспрессирующей dATF-2 дикого типа или мутантный, в котором два сайта фосфорилирования dp38 были заменены на Ala, и измеряли активность люциферазы.В некоторых случаях трансфицированные клетки обрабатывали ингибиторами p38, JNK или Erk. Планка погрешности, среднее значение ± стандартная ошибка (n = 10). (D) Экспрессия dATF-2. Клетки S2 трансфицировали плазмидой для экспрессии dATF-2 дикого типа (WT) или мутанта T59/61A. Готовили цельноклеточные лизаты и подвергали Вестерн-блоттингу с антителом против dATF-2. (E) Активация промотора AcCoAS с помощью dATF-2. Репортерную плазмиду, в которой промоторная область AcCoAS связана с геном люциферазы, котрансфицировали в клетки S2 экспрессионной плазмидой dATF-2 дикого типа или мутантной или контрольной плазмидой и измеряли активность люциферазы.
Относительная активность люциферазы по сравнению с активностью, полученной без экспрессионной плазмиды dATF-2, указана как среднее значение трех экспериментов ± SE (n = 6–10). (C) Путь dp38 усиливает dATF-2-зависимую -транс--активацию промотора dPEPCK . Промотор-люциферазный репортер dPEPCK трансфицировали в клетки S2 вместе с плазмидой, экспрессирующей dATF-2 дикого типа или мутантный, в котором два сайта фосфорилирования dp38 были заменены на Ala, и измеряли активность люциферазы.В некоторых случаях трансфицированные клетки обрабатывали ингибиторами p38, JNK или Erk. Планка погрешности, среднее значение ± стандартная ошибка (n = 10). (D) Экспрессия dATF-2. Клетки S2 трансфицировали плазмидой для экспрессии dATF-2 дикого типа (WT) или мутанта T59/61A. Готовили цельноклеточные лизаты и подвергали Вестерн-блоттингу с антителом против dATF-2. (E) Активация промотора AcCoAS с помощью dATF-2. Репортерную плазмиду, в которой промоторная область AcCoAS связана с геном люциферазы, котрансфицировали в клетки S2 экспрессионной плазмидой dATF-2 дикого типа или мутантной или контрольной плазмидой и измеряли активность люциферазы. Репортерные плазмиды схематически показаны справа. Остатки, составляющие полусайт CRE, обозначены заштрихованными овалами. В некоторых случаях трансфицированные клетки обрабатывали ингибиторами p38 или JNK. Относительная активность люциферазы по сравнению с активностью, полученной без экспрессионной плазмиды dATF-2, указана как среднее значение трех экспериментов ± SE (n = 6–10).
Репортерные плазмиды схематически показаны справа. Остатки, составляющие полусайт CRE, обозначены заштрихованными овалами. В некоторых случаях трансфицированные клетки обрабатывали ингибиторами p38 или JNK. Относительная активность люциферазы по сравнению с активностью, полученной без экспрессионной плазмиды dATF-2, указана как среднее значение трех экспериментов ± SE (n = 6–10).
Активирующий фактор транскрипции-2
БИОЛОГИЧЕСКИЙ ОБЗОР ATF-2 является членом семейства транскрипционных факторов ATF/CREB, который активируется стресс-активируемыми протеинкиназами, такими как p38.Для анализа физиологической роли Drosophila ATF-2 (dATF-2) с помощью РНК-интерференции было создано dATF-2 нокдаун-мух. Уменьшение dATF-2 в жировом теле, эквиваленте печени и жировой ткани мух млекопитающих, снижало выживаемость в условиях голодания. Это было связано с меньшими запасами триглицеридов у dATF-2 нокдаунных мух, чем у контрольных мух.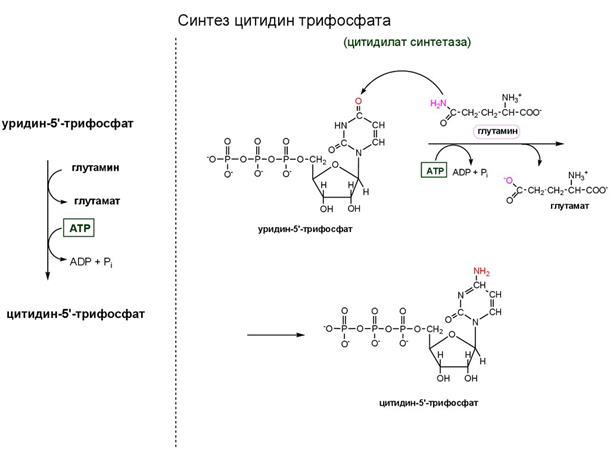 Среди нескольких генов, которые контролируют уровни триглицеридов, экспрессия гена Drosophila PEPCK ( dPEPCK ) была поразительно снижена у dATF-2 нокдаунных мух.PEPCK является ключевым ферментом как для глюконеогенеза, так и для глицеронеогенеза, который является путем, необходимым для синтеза триглицеридов через глицерол-3-фосфат. Хотя уровень сахара в крови у мух с нокдауном dATF-2 был почти таким же, как у контрольных мух, активность глицеронеогенеза была снижена в жировых телах мух с нокдауном dATF-2 . Таким образом, сниженный глицеронеогенез может, по крайней мере частично, способствовать уменьшению запасов триглицеридов у dATF-2 нокдаунных мух.Кроме того, было показано, что dATF-2 положительно регулирует транскрипцию гена dPEPCK через несколько полусайтов CRE в промоторе PEPCK . Таким образом, dATF-2 имеет решающее значение для регуляции метаболизма жиров (Okamura, 2007).
Среди нескольких генов, которые контролируют уровни триглицеридов, экспрессия гена Drosophila PEPCK ( dPEPCK ) была поразительно снижена у dATF-2 нокдаунных мух.PEPCK является ключевым ферментом как для глюконеогенеза, так и для глицеронеогенеза, который является путем, необходимым для синтеза триглицеридов через глицерол-3-фосфат. Хотя уровень сахара в крови у мух с нокдауном dATF-2 был почти таким же, как у контрольных мух, активность глицеронеогенеза была снижена в жировых телах мух с нокдауном dATF-2 . Таким образом, сниженный глицеронеогенез может, по крайней мере частично, способствовать уменьшению запасов триглицеридов у dATF-2 нокдаунных мух.Кроме того, было показано, что dATF-2 положительно регулирует транскрипцию гена dPEPCK через несколько полусайтов CRE в промоторе PEPCK . Таким образом, dATF-2 имеет решающее значение для регуляции метаболизма жиров (Okamura, 2007).
ATF-2 (активирующий фактор транскрипции-2) является членом семейства факторов транскрипции ATF/CREB (CRE-связывающий белок), который имеет ДНК-связывающий домен типа bZIP.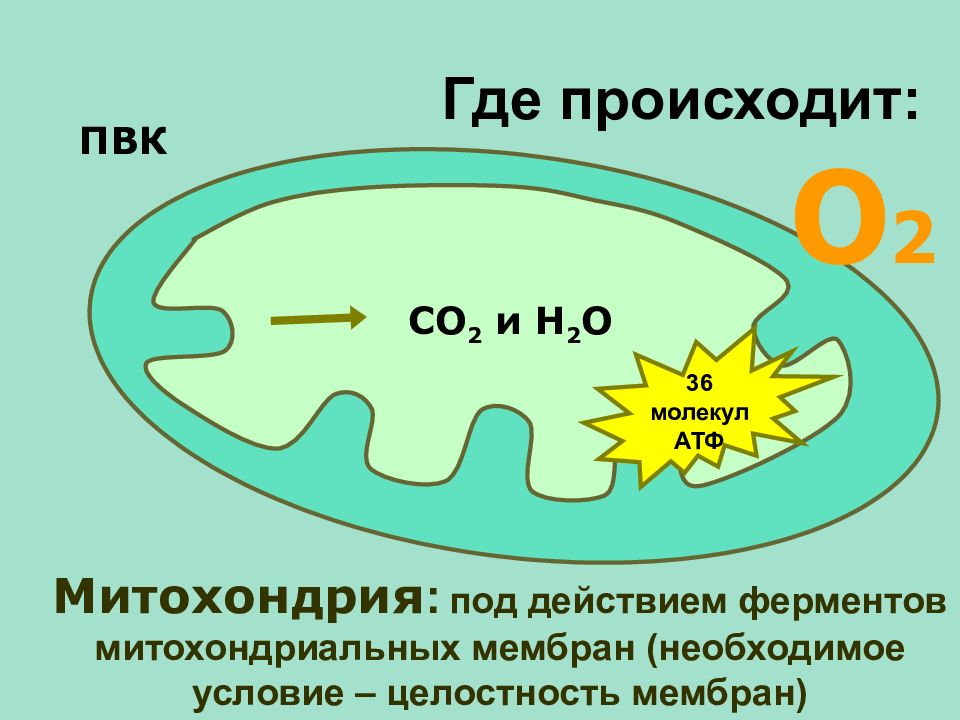 ATF-2 может образовывать либо гомодимеры, либо гетеродимеры с c-Jun: димеры впоследствии связываются с ответным элементом циклического AMP (CRE: 5′-TGACGTCA-3′) и позитивно регулируют транскрипцию.Стресс-активируемые протеинкиназы (SAPK), такие как p38 и JNK (c-Jun N-концевая протеинкиназа), фосфорилируют ATF-2 по Thr-69 и Thr-71 вблизи N-концевого домена активации транскрипции, содержащего домен цинкового пальца и тем самым повысить его транс -активирующую способность. Считается, что активация ATF-2 с помощью p38/JNK играет роль в апоптозе. ATF-2 также активируется инсулином, эпидермальным фактором роста и сывороткой посредством двухступенчатого механизма, включающего два различных эффекторных пути Ras.Была идентифицирована группа генов-мишеней ATF-2, которые участвуют во многих биологических явлениях. Гены-мишени гетеродимеров c-Jun/ATF-2, которые участвуют в контроле роста, включают сам c- jun и интерферон-β . Ген рецептора тромбоцитарного фактора роста α, который имеет решающее значение для пролиферации цитотрофобластов, является мишенью ATF-2, и уровень его экспрессии снижен в плаценте мышей с мутацией Atf-2 (Okamura, 2007 и ссылки в этой публикации).
ATF-2 может образовывать либо гомодимеры, либо гетеродимеры с c-Jun: димеры впоследствии связываются с ответным элементом циклического AMP (CRE: 5′-TGACGTCA-3′) и позитивно регулируют транскрипцию.Стресс-активируемые протеинкиназы (SAPK), такие как p38 и JNK (c-Jun N-концевая протеинкиназа), фосфорилируют ATF-2 по Thr-69 и Thr-71 вблизи N-концевого домена активации транскрипции, содержащего домен цинкового пальца и тем самым повысить его транс -активирующую способность. Считается, что активация ATF-2 с помощью p38/JNK играет роль в апоптозе. ATF-2 также активируется инсулином, эпидермальным фактором роста и сывороткой посредством двухступенчатого механизма, включающего два различных эффекторных пути Ras.Была идентифицирована группа генов-мишеней ATF-2, которые участвуют во многих биологических явлениях. Гены-мишени гетеродимеров c-Jun/ATF-2, которые участвуют в контроле роста, включают сам c- jun и интерферон-β . Ген рецептора тромбоцитарного фактора роста α, который имеет решающее значение для пролиферации цитотрофобластов, является мишенью ATF-2, и уровень его экспрессии снижен в плаценте мышей с мутацией Atf-2 (Okamura, 2007 и ссылки в этой публикации).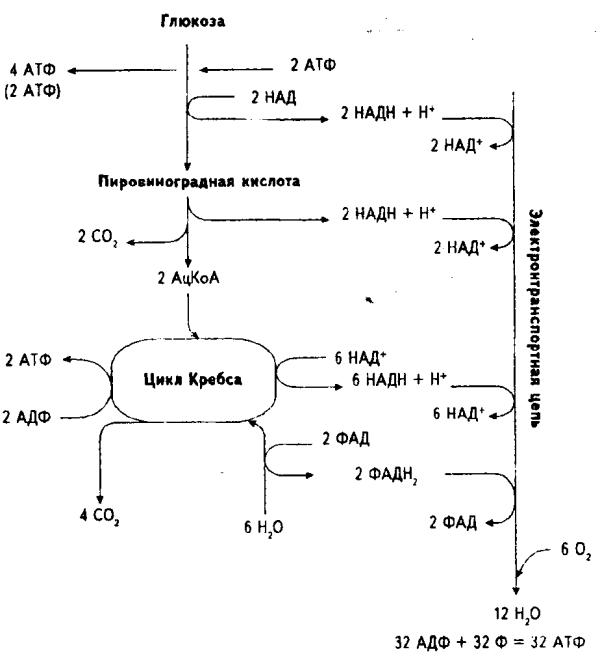
ATF-2 повсеместно экспрессируется и обнаруживается в печени и белой жировой ткани (WAT), которые являются важными органами для регуляции метаболизма. Этот профиль экспрессии ATF-2 указывает на возможность того, что ATF-2 играет важную роль в регуляции метаболизма. Фактически, ATF-2 активирует транскрипцию фосфоенолпируваткарбоксикиназы-цитозольного ( PEPCK-C ) гена в клетках гепатомы путем прямого связывания с CRE в его промоторе через путь p38 (Cheong, 1998).Также предполагалось, что полностью транс-ретиноевая кислота активирует путь р38, ведущий к фосфорилированию и активации ATF-2, тем самым усиливая транскрипцию гена PEPCK (Lee, 2002). PEPCK катализирует первую стадию печеночного глюконеогенеза и является ферментом, ограничивающим скорость глюконеогенеза. Недавно также было показано, что PEPCK играет ключевую роль в липидном гомеостазе посредством глицеронеогенеза в WAT (Reshef, 2003). Глицеронеогенез определяется как синтез de novo глицерол-3-фосфата из пирувата, лактата или некоторых аминокислот. Тем не менее, трудно исследовать на целой животной системе, является ли ATF-2 критическим для метаболической регуляции посредством регуляции экспрессии PEPCK, т.к. мыши с нулевыми мутациями Atf-2 умирают сразу после рождения из-за дефекта дыхания (Maekawa, 1999). Кроме того, в настоящее время нет тканеспецифических мышей с нокдауном Atf-2 . Таким образом, роль ATF-2 в регуляции метаболизма все еще остается неясной (Okamura, 2007 и ссылки в ней).
Тем не менее, трудно исследовать на целой животной системе, является ли ATF-2 критическим для метаболической регуляции посредством регуляции экспрессии PEPCK, т.к. мыши с нулевыми мутациями Atf-2 умирают сразу после рождения из-за дефекта дыхания (Maekawa, 1999). Кроме того, в настоящее время нет тканеспецифических мышей с нокдауном Atf-2 . Таким образом, роль ATF-2 в регуляции метаболизма все еще остается неясной (Okamura, 2007 и ссылки в ней).
Поскольку у дрозофилы низкая степень избыточности генов и, следовательно, меньше родственных генов, чем у млекопитающих, иногда целесообразно анализировать гомолог интересующего гена млекопитающего у дрозофилы.Кроме того, у дрозофилы экспрессия двухцепочечной РНК (dsRNA), соответствующей части гена, может подавлять мРНК гена с помощью РНК-интерференции. Кроме того, система RNAi дрозофилы обеспечивает тканеспецифический нокдаун с использованием системы Gal4/UAS. Для выяснения физиологической роли ATF-2 был идентифицирован гомолог ATF-2 дрозофилы (dATF-2; Sano, 2005). Подобно ATF-2 млекопитающих, dATF-2 имеет ДНК-связывающий домен bZIP-типа и сайты фосфорилирования p38 в своих C- и N-концевых областях соответственно.dATF-2 связывается с ответным элементом цАМФ в виде гомодимера или гетеродимера у Drosophila Jun и активирует транскрипцию. Drosophila p38, но не Drosophila JNK, фосфорилирует dATF-2 и усиливает dATF-2-зависимую транскрипцию (Okamura, 2007).
Подобно ATF-2 млекопитающих, dATF-2 имеет ДНК-связывающий домен bZIP-типа и сайты фосфорилирования p38 в своих C- и N-концевых областях соответственно.dATF-2 связывается с ответным элементом цАМФ в виде гомодимера или гетеродимера у Drosophila Jun и активирует транскрипцию. Drosophila p38, но не Drosophila JNK, фосфорилирует dATF-2 и усиливает dATF-2-зависимую транскрипцию (Okamura, 2007).
Это исследование демонстрирует, что снижение функции dATF-2 в жировом теле с помощью трансгенной РНК-интерференции снижает выживаемость при диетических ограничениях и триглицерид как запасенную энергию. Эти фенотипы коррелируют со сниженными уровнями транскрипции гена dPEPCK в жировом теле, что позитивно регулируется dATF-2.Таким образом, dATF-2 играет критическую роль в регуляции метаболизма жиров, особенно синтеза триглицеридов (Okamura, 2007).
Было показано, что некоторые члены семейства ATF/CREB и семейства SAPK регулируют метаболизм. Было показано, что с использованием трансгенных мышей, экспрессирующих доминантно-негативный CREB, CREB контролирует метаболизм липидов в печени и глюконеогенез в ответ на ряд гормональных сигналов. В культивируемых клетках дрозофилы box-B-binding factor-2 (BBF-2), член семейства ATF/CREB, специфически связывается со специфичным для жирового тела регуляторным элементом для активации транскрипции (Abel, 1992).Ожирение увеличивает общую активность JNK, и у мышей с дефицитом JNK1 наблюдается снижение ожирения и повышенная чувствительность к инсулину (Hirosumi, 2002). p38 опосредует индуцированную свободными жирными кислотами транскрипцию ключевых глюконеогенных генов, включая PEPCK (Collins, 2006). Кроме того, мыши, лишенные MKP-1, который является членом фосфатазы MAPK и инактивирует p38, устойчивы к ожирению, вызванному диетой, из-за расхода энергии (Wu, 2006; Okamura, 2007 и ссылки в них).
В культивируемых клетках дрозофилы box-B-binding factor-2 (BBF-2), член семейства ATF/CREB, специфически связывается со специфичным для жирового тела регуляторным элементом для активации транскрипции (Abel, 1992).Ожирение увеличивает общую активность JNK, и у мышей с дефицитом JNK1 наблюдается снижение ожирения и повышенная чувствительность к инсулину (Hirosumi, 2002). p38 опосредует индуцированную свободными жирными кислотами транскрипцию ключевых глюконеогенных генов, включая PEPCK (Collins, 2006). Кроме того, мыши, лишенные MKP-1, который является членом фосфатазы MAPK и инактивирует p38, устойчивы к ожирению, вызванному диетой, из-за расхода энергии (Wu, 2006; Okamura, 2007 и ссылки в них).
АТФ-2 также был предложен для регуляции обмена веществ.ATF-2, активированный p38, стимулирует транскрипцию гена PTEN , что приводит к ингибированию передачи сигналов инсулина (Shen, 2006). ATF-2 также активирует транскрипцию гена PEPCK-C (Cheong, 1998).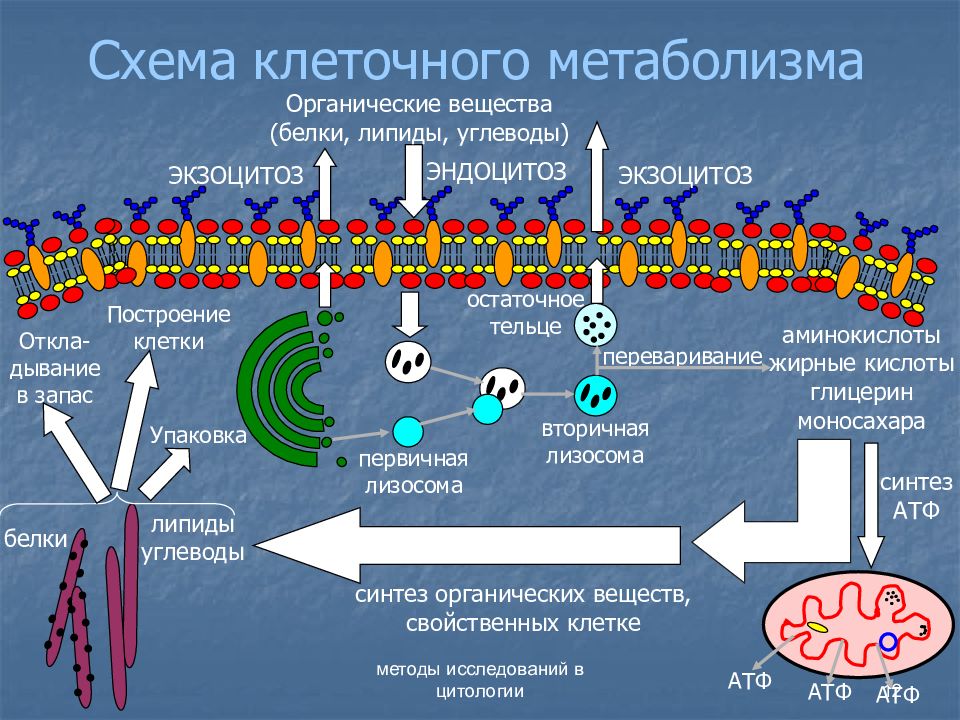 Однако эти данные были получены с использованием культивируемых клеток, и роль АТФ-2 в регуляции метаболизма остается невыясненной. Отчасти это связано с отсутствием подходящей модельной системы для изучения роли ATF-2 во всей животной системе. В этом исследовании были созданы специфичные для жирового тела мухи dATF-2 с нокдауном, у которых уровень мРНК dATF-2 был снижен до ~ 40% от уровня дикого типа.Мухи с нокдауном dATF-2 не были летальными и демонстрировали пониженное накопление триглицеридов по сравнению с контрольными мухами. Таким образом, мух с нокдауном dATF-2 можно рассматривать как хорошую модель, подходящую для изучения роли ATF-2 в метаболизме (Okamura, 2007).
Однако эти данные были получены с использованием культивируемых клеток, и роль АТФ-2 в регуляции метаболизма остается невыясненной. Отчасти это связано с отсутствием подходящей модельной системы для изучения роли ATF-2 во всей животной системе. В этом исследовании были созданы специфичные для жирового тела мухи dATF-2 с нокдауном, у которых уровень мРНК dATF-2 был снижен до ~ 40% от уровня дикого типа.Мухи с нокдауном dATF-2 не были летальными и демонстрировали пониженное накопление триглицеридов по сравнению с контрольными мухами. Таким образом, мух с нокдауном dATF-2 можно рассматривать как хорошую модель, подходящую для изучения роли ATF-2 в метаболизме (Okamura, 2007).
Жировое тело и мышцы являются критическими органами для метаболизма дрозофилы. Мухи хранят энергию в виде триглицеридов в жировом теле, которое, как считается, напоминает WAT млекопитающих. Кроме того, жировое тело функционирует подобно печени млекопитающих и содержит множество ферментов, необходимых для гликолиза и синтеза липидов. Снижение активности dATF-2 в жировом теле приводило к нарушению выживаемости в условиях голодания, тогда как снижение активности dATF-2 в мышцах не приводило к этому. Мухи с нокдауном dATF-2 , специфичные для жирового тела, имели сниженный запас триглицеридов по сравнению с контрольными мухами, что позволяет предположить, что ухудшение выживаемости мух с нокдауном dATF-2 может быть связано с уменьшением триглицеридов в жировом теле. Кроме того, мух с нокдауном dATF-2 не влияли ни на уровень трегалозы в гемолимфе, ни на скорость расходования триглицеридов в условиях голодания.Таким образом, dATF-2 может участвовать в регуляции запасов триглицеридов в жировом теле, влияя на синтез триглицеридов, но не на их потребление (Okamura, 2007).
Снижение активности dATF-2 в жировом теле приводило к нарушению выживаемости в условиях голодания, тогда как снижение активности dATF-2 в мышцах не приводило к этому. Мухи с нокдауном dATF-2 , специфичные для жирового тела, имели сниженный запас триглицеридов по сравнению с контрольными мухами, что позволяет предположить, что ухудшение выживаемости мух с нокдауном dATF-2 может быть связано с уменьшением триглицеридов в жировом теле. Кроме того, мух с нокдауном dATF-2 не влияли ни на уровень трегалозы в гемолимфе, ни на скорость расходования триглицеридов в условиях голодания.Таким образом, dATF-2 может участвовать в регуляции запасов триглицеридов в жировом теле, влияя на синтез триглицеридов, но не на их потребление (Okamura, 2007).
В жировом теле экспрессируются многие ферменты, контролирующие уровень триглицеридов. Среди этих ферментов экспрессия гена PEPCK была поразительно снижена в жировом теле мух с нокдауном dATF-2 . Ранее сообщалось, что ATF-2 млекопитающих регулирует транскрипцию гена PEPCK в клетках гепатомы (Cheong, 1998; Lee, 2002).PEPCK является ферментом, ограничивающим скорость глюконеогенеза в печени млекопитающих, а жировое тело дрозофилы представляет собой орган, который имеет функцию, сходную как с печенью млекопитающих, так и с WAT. Следовательно, можно ожидать, что снижение активности dPEPCK в жировом теле снизит уровень трегалозы сахара в крови. Однако уровни трегалозы в гемолимфе у мух с нокдауном dATF-2 были аналогичны таковым у контрольных мух. Это может быть связано с наличием нескольких резервных систем для поддержания стабильного уровня сахара в крови, потому что это очень важно для организма.В отличие от трегалозы, уровень накопленных триглицеридов в жировых телах мух с нокдауном dATF-2 был снижен по сравнению с контрольными мухами. Эти данные свидетельствуют о том, что накопленный триглицерид может превращаться в трегалозу для поддержания уровня сахара в крови даже в нормальных условиях.
Ранее сообщалось, что ATF-2 млекопитающих регулирует транскрипцию гена PEPCK в клетках гепатомы (Cheong, 1998; Lee, 2002).PEPCK является ферментом, ограничивающим скорость глюконеогенеза в печени млекопитающих, а жировое тело дрозофилы представляет собой орган, который имеет функцию, сходную как с печенью млекопитающих, так и с WAT. Следовательно, можно ожидать, что снижение активности dPEPCK в жировом теле снизит уровень трегалозы сахара в крови. Однако уровни трегалозы в гемолимфе у мух с нокдауном dATF-2 были аналогичны таковым у контрольных мух. Это может быть связано с наличием нескольких резервных систем для поддержания стабильного уровня сахара в крови, потому что это очень важно для организма.В отличие от трегалозы, уровень накопленных триглицеридов в жировых телах мух с нокдауном dATF-2 был снижен по сравнению с контрольными мухами. Эти данные свидетельствуют о том, что накопленный триглицерид может превращаться в трегалозу для поддержания уровня сахара в крови даже в нормальных условиях. Результаты предполагают, что это было связано со снижением активности глицероноэгенеза, хотя также могло способствовать снижение уровней некоторых других ферментов, таких как AcCoAS, которые участвуют в синтезе жирных кислот. Эти результаты свидетельствуют о том, что снижение на 60% мРНК dATF-2 снижает как глицеронеогенез, так и запасы триглицеридов (Okamura, 2007).
Результаты предполагают, что это было связано со снижением активности глицероноэгенеза, хотя также могло способствовать снижение уровней некоторых других ферментов, таких как AcCoAS, которые участвуют в синтезе жирных кислот. Эти результаты свидетельствуют о том, что снижение на 60% мРНК dATF-2 снижает как глицеронеогенез, так и запасы триглицеридов (Okamura, 2007).
Хотя о глицеронеогенезе впервые сообщалось более 35 лет назад, он мало исследовался до недавнего времени, когда он был в центре внимания многих исследований. Первоначальным открытием глицеронеогенеза было то, что цитозольный PEPCK, который катализирует первую стадию печеночного и почечного глюконеогенеза, присутствует в адипоцитах. Жировая ткань млекопитающих не обладает глюконеогенной активностью, поскольку в адипоцитах отсутствуют два терминальных фермента пути. Это привело к выводу, что PEPCK превращает предшественники глюконеогенеза, такие как пируват, в глицерин-3-фосфат, глицериновую основу триацилглицерина, основную форму хранения жира.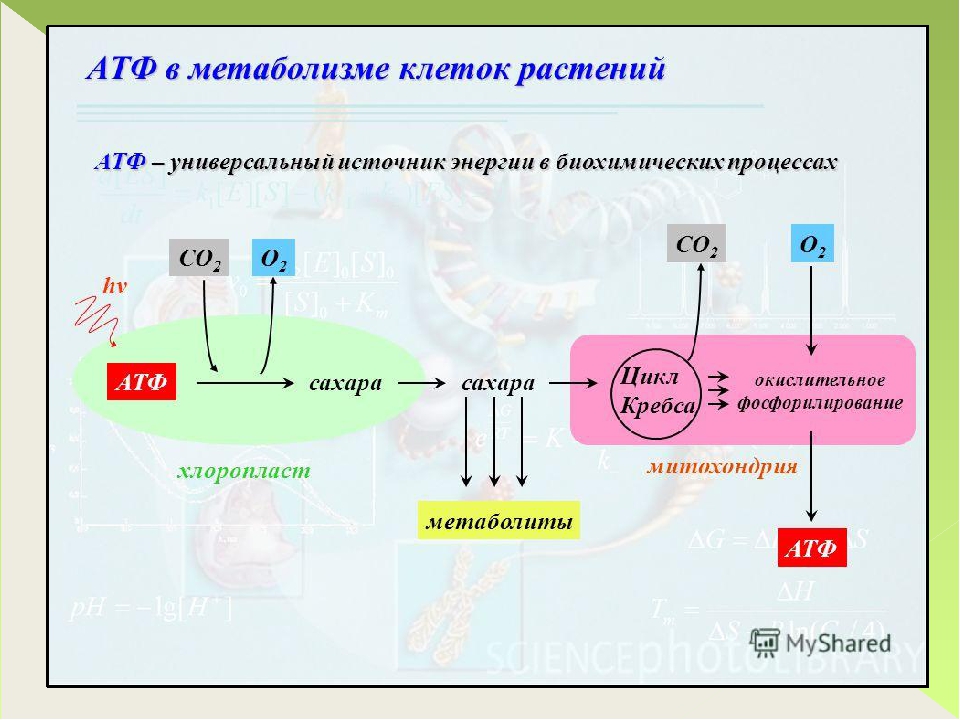 Путь теперь описывается как глицеронеогенез. В некоторых сообщениях описывается важная роль глицеронеогенеза в контроле запасов жира. Например, у голодающих беременных женщин до 60% глицерид-глицерина плазмы (глицериновая часть триглицеридов) образуется в результате глицеронеогенеза, главным образом в печени (Kalhan, 2001). Точно так же более 80% глицерида-глицерина в эпидидимальном жире крыс, получавших диету с высоким содержанием белка (Botion, 1998), продуцируется глицеронеогенезом адипоцитов (Okamura, 2007).
Путь теперь описывается как глицеронеогенез. В некоторых сообщениях описывается важная роль глицеронеогенеза в контроле запасов жира. Например, у голодающих беременных женщин до 60% глицерид-глицерина плазмы (глицериновая часть триглицеридов) образуется в результате глицеронеогенеза, главным образом в печени (Kalhan, 2001). Точно так же более 80% глицерида-глицерина в эпидидимальном жире крыс, получавших диету с высоким содержанием белка (Botion, 1998), продуцируется глицеронеогенезом адипоцитов (Okamura, 2007).
Известно, что у млекопитающих PEPCK регулирует глицеронеогенез в дополнение к глюконеогенезу. Важная роль PEPCK в глицеронеогенезе была продемонстрирована на мышах, у которых PEPCK подавлялась или повышалась в WAT. Мыши, у которых сайт связывания PPARγ в промоторе гена PEPCK-C демонстрировал уменьшенный размер жировой ткани и содержание жира (Olswang, 2002). Наоборот, трансгенные мыши, экспрессирующие PEPCK в жировой ткани, увеличивают размер адипоцитов и жировую массу (Franckhauser, 2002).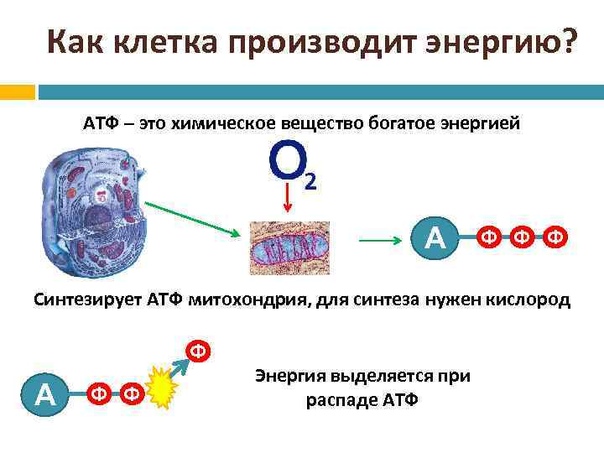 В соответствии с этими сообщениями было продемонстрировано, что сниженные уровни триглицеридов коррелируют со сниженным глицеронеогенезом и транскрипцией гена dPEPCK у мух с нокдауном dATF-2 . Следовательно, вполне вероятно, что 60% снижение мРНК dATF-2 снижало уровни триглицеридов, по крайней мере частично, влияя на глицеронеогенез посредством транскрипции гена dPEPCK (Okamura, 2007).
В соответствии с этими сообщениями было продемонстрировано, что сниженные уровни триглицеридов коррелируют со сниженным глицеронеогенезом и транскрипцией гена dPEPCK у мух с нокдауном dATF-2 . Следовательно, вполне вероятно, что 60% снижение мРНК dATF-2 снижало уровни триглицеридов, по крайней мере частично, влияя на глицеронеогенез посредством транскрипции гена dPEPCK (Okamura, 2007).
Считается, что глицеронегенез происходит во время голодания.Однако у мышей с нокдауном PEPCK , специфичных для жировой ткани, уровни триглицеридов были ниже не только натощак, но и натощак (Olswang, 2002). Это наблюдение согласуется с текущими результатами с использованием dATF-2 нокдаунных мух. Жировые тела мух с нокдауном dATF-2 , которых кормили в нормальных условиях, проявляли сниженную активность глицеронеогенеза по сравнению с контрольными мухами. Эти результаты свидетельствуют о том, что PEPCK способствует глицеронеогенезу не только в условиях голодания, но и в условиях нормального приема пищи. Важная роль PEPCK в глицеронеогенезе была также продемонстрирована наблюдениями, что тиазолидиндионы, противодиабетическое лекарственное средство, снижают уровни жирных кислот в сыворотке путем усиления глицеронеогенеза путем активации транскрипции гена PEPCK (Tordjman, 2003). Если этот результат может быть распространен на млекопитающих, ATF-2 может быть полезной мишенью для противодиабетических препаратов, таких как тиазолидиндионы, хотя роль ATF-2 в WAT интенсивно не изучалась (Okamura, 2007).
Важная роль PEPCK в глицеронеогенезе была также продемонстрирована наблюдениями, что тиазолидиндионы, противодиабетическое лекарственное средство, снижают уровни жирных кислот в сыворотке путем усиления глицеронеогенеза путем активации транскрипции гена PEPCK (Tordjman, 2003). Если этот результат может быть распространен на млекопитающих, ATF-2 может быть полезной мишенью для противодиабетических препаратов, таких как тиазолидиндионы, хотя роль ATF-2 в WAT интенсивно не изучалась (Okamura, 2007).
Это исследование показало, что dATF-2 частично активирует транскрипцию гена dPEPCK через полусайты CRE в промоторе dPEPCK .Ингибитор р38, SB203580, подавлял dATF-2-зависимую активацию промотора dPEPCK , предполагая, что сигнал dp38 позитивно регулирует транскрипцию dPEPCK в жировом теле. Эти результаты согласуются с наблюдениями у млекопитающих, что ATF-2 напрямую связывается с промотором PEPCK и активирует его через путь p38 (Cheong, 1998).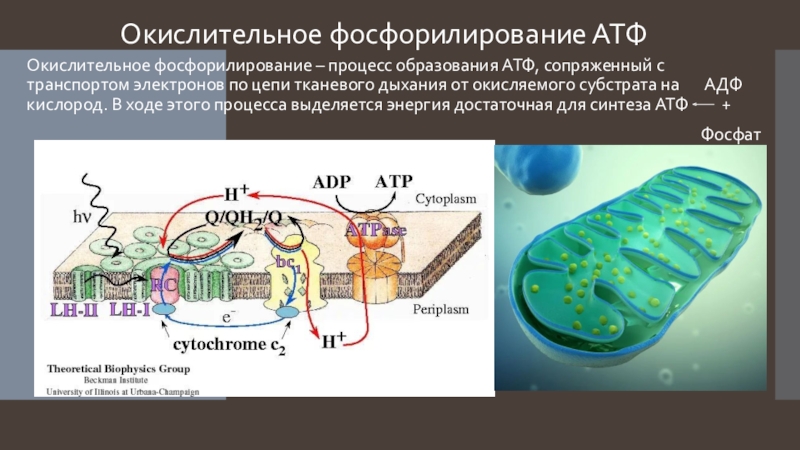 Также сообщалось, что C/EBP контролирует транскрипцию гена PEPCK в печени (Croniger, 1998) и может образовывать гетеродимер с ATF-2, который связывается с асимметричной последовательностью, состоящей из одного консенсусного полусайта для каждого мономера (Shuman, 1997). ).Следовательно, ATF-2 может регулировать транскрипцию гена PEPCK вместе с другими факторами, такими как C/EBP, который образует гетеродимер с ATF-2. Если dp38 необходим для dATF-2-зависимой активации транскрипции dPEPCK , dp38 должен конститутивно активироваться в жировом теле. На самом деле, p38 конститутивно активен в печени млекопитающих, что может быть результатом метаболического окислительного стресса (Mendelson, 1996). Также было показано, что ретиноевая кислота активирует путь p38, приводящий к ATF-2-зависимой активации транскрипции гена PEPCK (Lee, 2002).Кроме того, было показано, что мутанты dp38 более чувствительны к голоданию, чем мухи дикого типа (Craig, 2004). Если сигнальный путь р38 важен для запасов триглицеридов посредством глицеронеогенеза, этот путь может быть полезной мишенью для антидиабетических препаратов, поскольку уже разработаны различные ингибиторы киназ этого пути (Okamura, 2007).
Также сообщалось, что C/EBP контролирует транскрипцию гена PEPCK в печени (Croniger, 1998) и может образовывать гетеродимер с ATF-2, который связывается с асимметричной последовательностью, состоящей из одного консенсусного полусайта для каждого мономера (Shuman, 1997). ).Следовательно, ATF-2 может регулировать транскрипцию гена PEPCK вместе с другими факторами, такими как C/EBP, который образует гетеродимер с ATF-2. Если dp38 необходим для dATF-2-зависимой активации транскрипции dPEPCK , dp38 должен конститутивно активироваться в жировом теле. На самом деле, p38 конститутивно активен в печени млекопитающих, что может быть результатом метаболического окислительного стресса (Mendelson, 1996). Также было показано, что ретиноевая кислота активирует путь p38, приводящий к ATF-2-зависимой активации транскрипции гена PEPCK (Lee, 2002).Кроме того, было показано, что мутанты dp38 более чувствительны к голоданию, чем мухи дикого типа (Craig, 2004). Если сигнальный путь р38 важен для запасов триглицеридов посредством глицеронеогенеза, этот путь может быть полезной мишенью для антидиабетических препаратов, поскольку уже разработаны различные ингибиторы киназ этого пути (Okamura, 2007).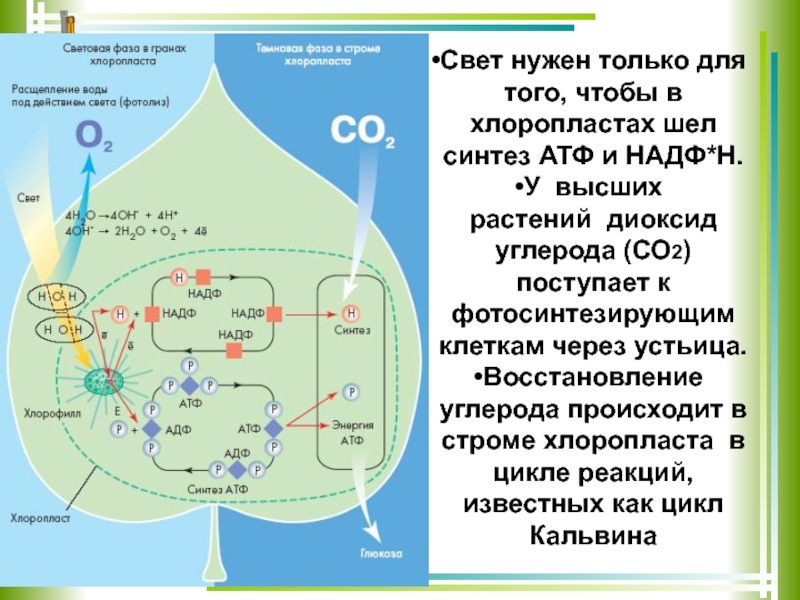
Сигнальная кассета киназы митоген-активируемого белка (MAP) p38 вовлечена в стресс и иммунитет у эволюционно различных видов.В ответ на самые разнообразные физические, химические и биологические стрессы киназы р38 фосфорилируют различные субстраты, транскрипционные факторы семейства ATF и другие протеинкиназы, регулирующие клеточную адаптацию к стрессу. Геном дрозофилы кодирует три киназы p38, названные p38a, p38b и p38c. В этом исследовании проанализирована роль p38c в кишечнике дрозофилы. Ген p38c экспрессируется в средней кишке и активируется при кишечной инфекции. Мутантные мухи p38c более устойчивы к заражению летальным патогеном Pseudomonas entomophila, но более восприимчивы к непатогенной бактерии Erwinia carotovora.Этот фенотип был связан с более низкой продукцией активных форм кислорода (АФК) в кишечнике мутантов p38c, в результате чего транскрипция фермента, продуцирующего АФК, двойной оксидазы (Duox) снижена у мутантных мух p38c.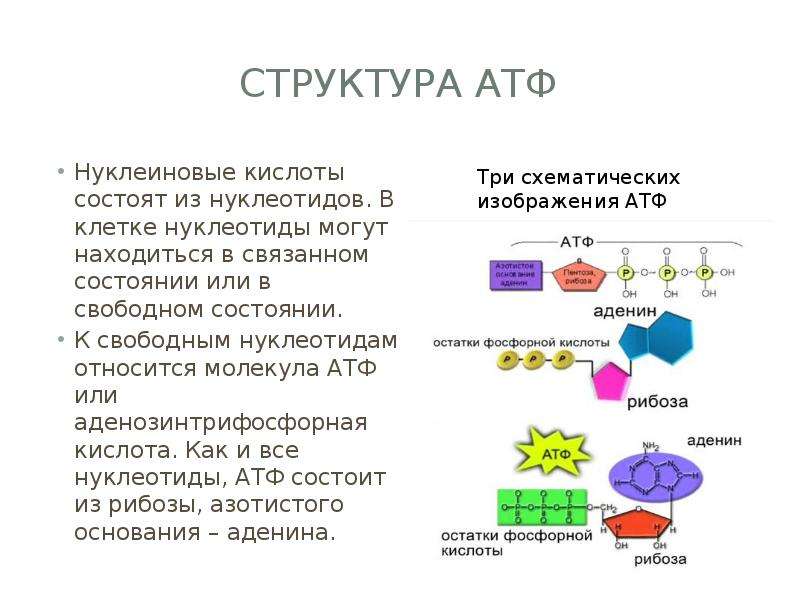 Этот генетический анализ показывает, что p38c функционирует в пути с Mekk1 и Licorne (Mkk3), чтобы индуцировать фосфорилирование Atf-2, фактора транскрипции, который контролирует экспрессию Duox. Интересно, что мухи с дефицитом p38c накапливают липиды в кишечнике, в то же время экспрессируя более высокие уровни антимикробных пептидов и метаболических генов.Роль p38c в метаболизме липидов опосредована транскрипционным фактором Atf3. Это наблюдение предполагает, что p38c и Atf3 функционируют в общем пути в кишечнике, чтобы регулировать метаболизм липидов и иммунный гомеостаз. В совокупности это исследование демонстрирует, что p38c играет центральную роль в кишечнике дрозофилы. Это также показывает, что многие роли, первоначально приписываемые p38a, на самом деле опосредованы p38c (Chakrabarti, 2014. PubMed ID: PubMed).
Этот генетический анализ показывает, что p38c функционирует в пути с Mekk1 и Licorne (Mkk3), чтобы индуцировать фосфорилирование Atf-2, фактора транскрипции, который контролирует экспрессию Duox. Интересно, что мухи с дефицитом p38c накапливают липиды в кишечнике, в то же время экспрессируя более высокие уровни антимикробных пептидов и метаболических генов.Роль p38c в метаболизме липидов опосредована транскрипционным фактором Atf3. Это наблюдение предполагает, что p38c и Atf3 функционируют в общем пути в кишечнике, чтобы регулировать метаболизм липидов и иммунный гомеостаз. В совокупности это исследование демонстрирует, что p38c играет центральную роль в кишечнике дрозофилы. Это также показывает, что многие роли, первоначально приписываемые p38a, на самом деле опосредованы p38c (Chakrabarti, 2014. PubMed ID: PubMed).
Активирующий фактор транскрипции (ATF)-2 является членом семейства факторов транскрипции, связывающих элемент ответа ATF/cAMP, и его транс--активирующая способность усиливается активируемыми стрессом протеинкиназами, такими как c-Jun NH 2 -терминальная киназа (JNK) и p38. Однако мало что известно о роли ATF-2 in vivo. Здесь идентифицирован гомолог ATF-2 дрозофилы (dATF-2), состоящий из 381 аминокислоты. В ответ на УФ-облучение и осмотический стресс Drosophila p38 (dp38), но не JNK, фосфорилирует dATF-2 и усиливает dATF-2-зависимую транскрипцию. В соответствии с этим, инъекция двухцепочечной РНК dATF-2 (dsRNA) в эмбрионы не индуцирует дефекты дорсального закрытия, которые обычно наблюдаются у мутантов Drosophila JNK. Более того, экспрессия доминантно-негативного dp38 усиливала аберрантный фенотип крыла, вызванный экспрессией доминантно-негативного dATF-2.Сходные генетические взаимодействия между dATF-2 и сигнальным путем dMEKK1-dp38 также наблюдались при летальности эмбрионов, вызванной осмотическим стрессом. Потеря dATF-2 в клетках дрозофилы S2 с использованием dsRNA отменяет индукцию 40% генов, индуцированных осмотическим стрессом, включая множественные гены, связанные с иммунным ответом. Это указывает на то, что dATF-2 является основным фактором транскрипции при стресс-индуцированной транскрипции.
Однако мало что известно о роли ATF-2 in vivo. Здесь идентифицирован гомолог ATF-2 дрозофилы (dATF-2), состоящий из 381 аминокислоты. В ответ на УФ-облучение и осмотический стресс Drosophila p38 (dp38), но не JNK, фосфорилирует dATF-2 и усиливает dATF-2-зависимую транскрипцию. В соответствии с этим, инъекция двухцепочечной РНК dATF-2 (dsRNA) в эмбрионы не индуцирует дефекты дорсального закрытия, которые обычно наблюдаются у мутантов Drosophila JNK. Более того, экспрессия доминантно-негативного dp38 усиливала аберрантный фенотип крыла, вызванный экспрессией доминантно-негативного dATF-2.Сходные генетические взаимодействия между dATF-2 и сигнальным путем dMEKK1-dp38 также наблюдались при летальности эмбрионов, вызванной осмотическим стрессом. Потеря dATF-2 в клетках дрозофилы S2 с использованием dsRNA отменяет индукцию 40% генов, индуцированных осмотическим стрессом, включая множественные гены, связанные с иммунным ответом. Это указывает на то, что dATF-2 является основным фактором транскрипции при стресс-индуцированной транскрипции. Таким образом, dATF-2 имеет решающее значение для p38-опосредованной реакции на стресс (Sano, 2005).
Таким образом, dATF-2 имеет решающее значение для p38-опосредованной реакции на стресс (Sano, 2005).
Семейство белков, связывающих активирующий фактор транскрипции/связывающий элемент ответа цАМФ (ATF/CREB), несет ДНК-связывающий домен, состоящий из кластера основных аминокислот и лейциновой молнии, которые вместе образуют так называемую структуру b-ZIP .Эти белки могут образовывать гомодимеры или гетеродимеры путем связывания через свои мотивы лейциновой молнии, после чего они могут связываться с циклическим ответным элементом AMP (CRE: 5′-TGACGTCA-3′) через свою основную область. Двумя основными подгруппами белков семейства ATF/CREB являются CREB и ATF-2. Подгруппа CREB включает CREB и модулятор элемента ответа цАМФ (CREM), тогда как подгруппа ATF-2 содержит ATF-2, ATFa (недавно также называемую ATF-7) и CRE-BPa. Когда остаток Ser-133 CREB фосфорилируется цАМФ-зависимой протеинкиназой, CREB может связываться с коактиватором транскрипции CREB-связывающим белком (CBP), что значительно стимулирует -транс--активирующую способность CREB.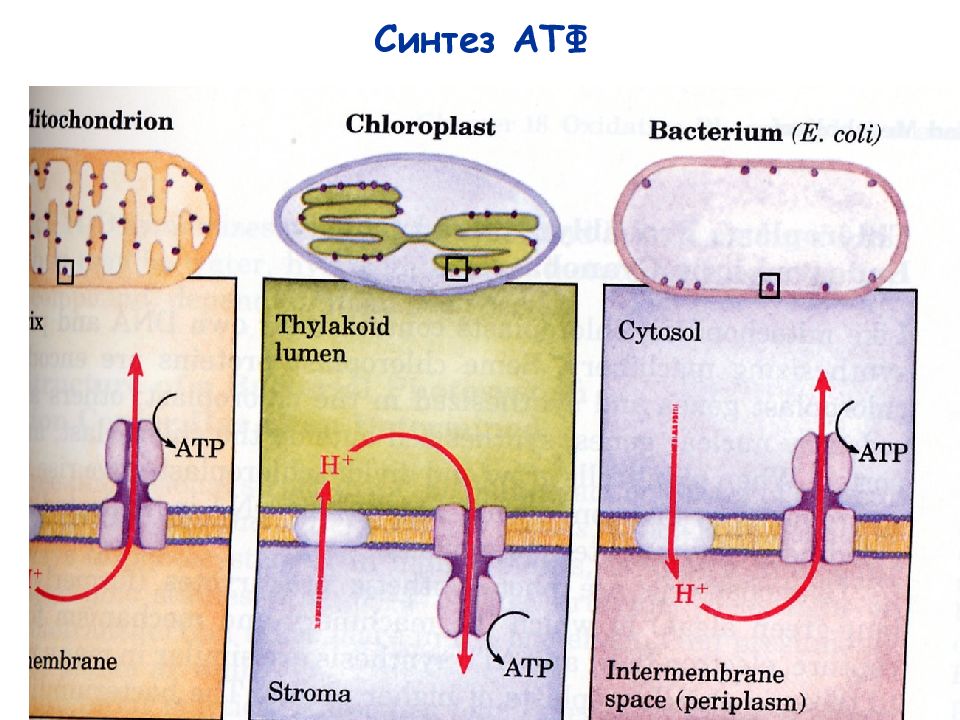 С другой стороны, транс -активирующая способность ATF-2 усиливается за счет фосфорилирования его остатков Thr-69 и Thr-71 стресс-активируемыми протеинкиназами (SAPK), такими как c-Jun NH 2 -терминальная киназа (JNK) и р38 (Gupta, 1995; Livingstone, 1995; van Dam, 1995). SAPK активируются различными внеклеточными стрессами, такими как УФ, осмотический стресс и воспалительные цитокины. Все три члена подгруппы ATF-2 несут -транс -активирующий домен в своей N-концевой области: этот домен состоит из двух субдоменов, а именно, N-концевого субдомена, содержащего хорошо известный мотив цинкового пальца, и С-концевого субдомена. субдомен, содержащий сайты фосфорилирования SAPK.Последний субдомен имеет очень гибкую и неупорядоченную структуру. Хотя коактиватор CBP связывается с поверхностью белка b-ZIP домена ATF-2 (Sano, 1998), кофактор, который связывается с N-концевым доменом активации ATF-2, остается неизвестным (Sano, 2005).
С другой стороны, транс -активирующая способность ATF-2 усиливается за счет фосфорилирования его остатков Thr-69 и Thr-71 стресс-активируемыми протеинкиназами (SAPK), такими как c-Jun NH 2 -терминальная киназа (JNK) и р38 (Gupta, 1995; Livingstone, 1995; van Dam, 1995). SAPK активируются различными внеклеточными стрессами, такими как УФ, осмотический стресс и воспалительные цитокины. Все три члена подгруппы ATF-2 несут -транс -активирующий домен в своей N-концевой области: этот домен состоит из двух субдоменов, а именно, N-концевого субдомена, содержащего хорошо известный мотив цинкового пальца, и С-концевого субдомена. субдомен, содержащий сайты фосфорилирования SAPK.Последний субдомен имеет очень гибкую и неупорядоченную структуру. Хотя коактиватор CBP связывается с поверхностью белка b-ZIP домена ATF-2 (Sano, 1998), кофактор, который связывается с N-концевым доменом активации ATF-2, остается неизвестным (Sano, 2005).
Физиологическая роль ATF-2 была проанализирована с использованием мутантных мышей. Мутантные по Null Atf-2 мыши умирают вскоре после рождения, у них проявляются симптомы тяжелой дыхательной недостаточности, а их легкие заполнены меконием (Maekawa, 1999).У мутантных зародышей возникает гипоксия, которая может привести к сильному судорожному дыханию с последующей аспирацией амниотической жидкости, содержащей меконий. Это связано с нарушением развития клеток цитотрофобласта в плаценте, что, в свою очередь, вызвано снижением уровня экспрессии рецептора тромбоцитарного фактора роста альфа. Кроме того, другая мышь с мутацией Atf-2 , которая экспрессирует только фрагмент ATF-2, проявляет сниженную постнатальную жизнеспособность и рост, дефект эндохондриальной оссификации и уменьшенное количество мозжечковых клеток Пуркинье (Reimold, 1996).Однако физиологические роли, которые играют другие белки семейства ATF-2, остаются неизвестными (Sano, 2005).
Мутантные по Null Atf-2 мыши умирают вскоре после рождения, у них проявляются симптомы тяжелой дыхательной недостаточности, а их легкие заполнены меконием (Maekawa, 1999).У мутантных зародышей возникает гипоксия, которая может привести к сильному судорожному дыханию с последующей аспирацией амниотической жидкости, содержащей меконий. Это связано с нарушением развития клеток цитотрофобласта в плаценте, что, в свою очередь, вызвано снижением уровня экспрессии рецептора тромбоцитарного фактора роста альфа. Кроме того, другая мышь с мутацией Atf-2 , которая экспрессирует только фрагмент ATF-2, проявляет сниженную постнатальную жизнеспособность и рост, дефект эндохондриальной оссификации и уменьшенное количество мозжечковых клеток Пуркинье (Reimold, 1996).Однако физиологические роли, которые играют другие белки семейства ATF-2, остаются неизвестными (Sano, 2005).
У дрозофилы идентифицированы три члена семейства белков митоген-активируемой протеинкиназы (MAPK): Rolled (гомолог Erk), dJNK (гомолог JNK, также называемый Basket) и dp38a и dp38b (гомолог p38).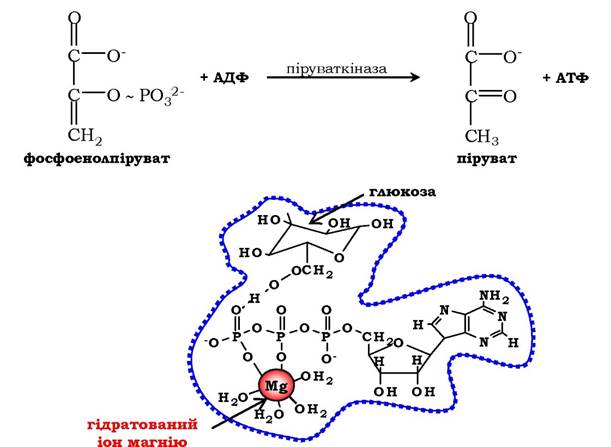 Rolled опосредует различные сигналы рецепторной тирозинкиназы в процессе развития трахеи, клеточной пролиферации, формирования мезодермального паттерна, дифференцировки фоторецепторных клеток R7 и дифференцировки терминальных эмбриональных структур.Напротив, путь, содержащий Hemipterous (Hep; гомолог MAPK kinase [MAPKK]), dJNK и Drosophila Jun (dJun), участвует в закрытии спины во время развития эмбриона. Все мутанты этого пути обнаруживают дорсальный открытый фенотип и пониженный уровень экспрессии Decapentaplegic (Dpp), секреторного лиганда, принадлежащего к суперсемейству трансформирующего фактора роста (TGF)-β, в клетках переднего края. Что касается dp38, то они фосфорилируются при различных стрессах, включая УФ, липополисахаридный (ЛПС) и осмотический стресс.Фенотип, возникающий в результате эктопической экспрессии доминантно-негативного (DN) dp38b в имагинальном диске крыла, указывает на то, что dp38b функционирует ниже толстой жилки (Tkv), рецептора типа I лиганда Dpp, в морфогенезе крыла (Sano, 2005).
Rolled опосредует различные сигналы рецепторной тирозинкиназы в процессе развития трахеи, клеточной пролиферации, формирования мезодермального паттерна, дифференцировки фоторецепторных клеток R7 и дифференцировки терминальных эмбриональных структур.Напротив, путь, содержащий Hemipterous (Hep; гомолог MAPK kinase [MAPKK]), dJNK и Drosophila Jun (dJun), участвует в закрытии спины во время развития эмбриона. Все мутанты этого пути обнаруживают дорсальный открытый фенотип и пониженный уровень экспрессии Decapentaplegic (Dpp), секреторного лиганда, принадлежащего к суперсемейству трансформирующего фактора роста (TGF)-β, в клетках переднего края. Что касается dp38, то они фосфорилируются при различных стрессах, включая УФ, липополисахаридный (ЛПС) и осмотический стресс.Фенотип, возникающий в результате эктопической экспрессии доминантно-негативного (DN) dp38b в имагинальном диске крыла, указывает на то, что dp38b функционирует ниже толстой жилки (Tkv), рецептора типа I лиганда Dpp, в морфогенезе крыла (Sano, 2005).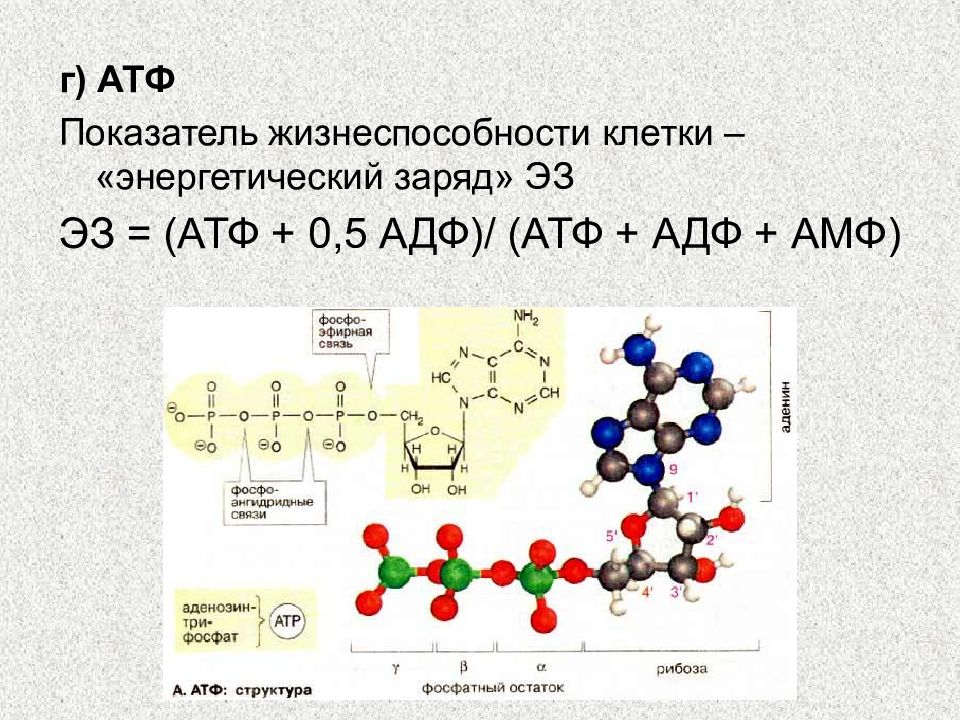
Для определения функции ATF-2 in vivo был идентифицирован и охарактеризован гомолог ATF-2 дрозофилы (dATF-2). dATF-2 напрямую фосфорилируется dp38b, но не dJNK. Более того, генетические анализы показали, что dATF-2 действует на сигнальный путь dp38.Кроме того, анализ массива ДНК показал, что dATF-2 является основным активатором транскрипции генов, индуцируемых осмотическим стрессом (Sano, 2005).
Аминокислотные последовательности домена b-Zip и области, содержащей сайты фосфорилирования p38/JNK ATF-2 млекопитающих, хорошо консервативны в dATF-2. Однако в dATF-2 отсутствует N-концевой домен цинкового пальца, который сохраняется у трех членов семейства ATF-2 млекопитающих (ATF-2, CRE-BPa и ATF-a). N-концевой мотив цинкового пальца и соседняя область, которая содержит сайты фосфорилирования p38/JNK в ATF-2 млекопитающих, вместе действуют как домен активации транскрипции (Matsuda, 1991).Следовательно, медиаторы, которые регулируют транскрипционную активацию ATF-2 и dATF-2 млекопитающих, могут иметь разные характеристики (Sano, 2005).
Внеклеточный стресс, такой как УФ или осмотический стресс, индуцирует dp38-индуцированное фосфорилирование dATF-2 в Thr-59 и Thr-61, и это увеличивает способность trans -активировать dATF-2. Хотя хорошо известно, что ATF-2 млекопитающих фосфорилируется не только p38, но и JNK, это исследование показало, что dJNK не фосфорилирует непосредственно dATF-2 и не усиливает dATF-2-зависимую транскрипцию.Более того, трансгенные эмбрионы, экспрессирующие DN-dATF-2 или dATF-2 dsRNA, не обнаруживают явно дорсально-открытого фенотипа, который является общим для мутантов Hep, Bsk, dJun и dFos. Полная аминокислотная последовательность JNK1 на 65% идентична dJNK, а участок ~50 аминокислот в N-концевом домене ATF-2 млекопитающих, который содержит сайты фосфорилирования, также хорошо консервативен в dATF-2 (59% идентичности). ). Поэтому удивительно, что dJNK не может фосфорилировать dATF-2, в отличие от того, что наблюдается для JNK и ATF-2 млекопитающих.Кроме того, было обнаружено, что хотя dATF-2 фосфорилируется только dp38, dJun фосфорилируется как dp38, так и dJun.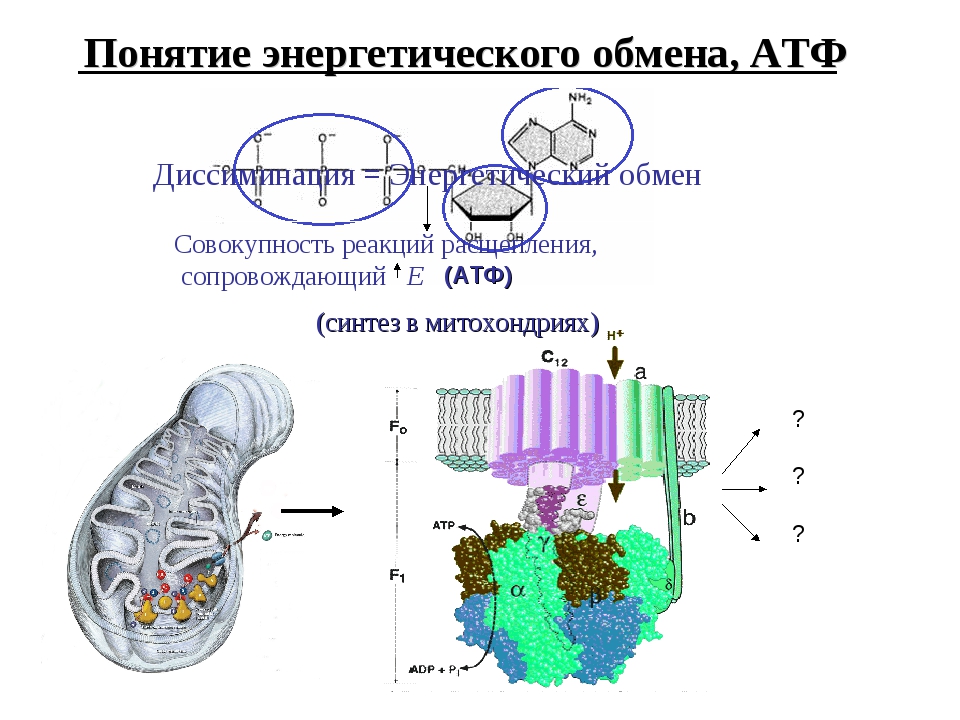 Напротив, ATF-2 млекопитающих фосфорилируется как p38, так и JNK, тогда как Jun фосфорилируется только JNK. Стоит отметить, что АТФа не фосфорилируется JNK (De Graeve, 1999). Это может повысить вероятность того, что механизм регуляции dATF-2 подобен механизму ATFa, и что предковый ген ATF-2/CRE-BPa произошел от дублированного ATFa-подобного гена. Взаимосвязь между SAPKs и транскрипционными факторами у Drosophila и млекопитающих может быть полезна для понимания того, как во время эволюции устанавливается стресс-индуцируемая система экспрессии генов (Sano, 2005).
Напротив, ATF-2 млекопитающих фосфорилируется как p38, так и JNK, тогда как Jun фосфорилируется только JNK. Стоит отметить, что АТФа не фосфорилируется JNK (De Graeve, 1999). Это может повысить вероятность того, что механизм регуляции dATF-2 подобен механизму ATFa, и что предковый ген ATF-2/CRE-BPa произошел от дублированного ATFa-подобного гена. Взаимосвязь между SAPKs и транскрипционными факторами у Drosophila и млекопитающих может быть полезна для понимания того, как во время эволюции устанавливается стресс-индуцируемая система экспрессии генов (Sano, 2005).
Гибриды GAL4-dATF-2, содержащие N-концевые 150 аминокислот, обладали большей активностью, чем гибриды, содержащие N-концевые 274 аминокислоты, что указывает на то, что область между аминокислотами 150 и 274 оказывает негативное влияние на домен активации дАТФ-2. В случае ATF-2 позвоночных b-ZIP DBD подавляет домен активации ATF-2 посредством внутримолекулярного взаимодействия (Li, 1996). Это различие может свидетельствовать о том, что механизм, с помощью которого С-концевая область подавляет домен активации, различен для ATF-2 позвоночных и dATF-2. Интересно, влияет ли область между аминокислотами 150 и 274 dATF-2 на стабильность или конформацию белка dATF-2. dATF-2 дикого типа стимулировал экспрессию люциферазы с CRE-содержащего промотора в нестимулированных условиях. Поскольку аланиновые мутанты Thr-59 и Thr-61 резко снижают эту транс -активирующую способность dATF-2, фосфорилирование этих остатков, по-видимому, необходимо для транс -активирующей способности dATF-2. Эти результаты указывают на возможность того, что остатки Thr-59 и Thr-61 фосфорилируются на низких уровнях даже в нестимулированных условиях.Это может быть связано с низким уровнем TNF-α или IL-1 в сыворотке крови. Альтернативно, другие киназы также могут фосфорилировать эти остатки, т.к. ATF-2 позвоночных активируется путем Raf-MEK-ERK (Ouwens, 2002) посредством фосфорилирования Thr-71 (Sano, 2005).
Интересно, влияет ли область между аминокислотами 150 и 274 dATF-2 на стабильность или конформацию белка dATF-2. dATF-2 дикого типа стимулировал экспрессию люциферазы с CRE-содержащего промотора в нестимулированных условиях. Поскольку аланиновые мутанты Thr-59 и Thr-61 резко снижают эту транс -активирующую способность dATF-2, фосфорилирование этих остатков, по-видимому, необходимо для транс -активирующей способности dATF-2. Эти результаты указывают на возможность того, что остатки Thr-59 и Thr-61 фосфорилируются на низких уровнях даже в нестимулированных условиях.Это может быть связано с низким уровнем TNF-α или IL-1 в сыворотке крови. Альтернативно, другие киназы также могут фосфорилировать эти остатки, т.к. ATF-2 позвоночных активируется путем Raf-MEK-ERK (Ouwens, 2002) посредством фосфорилирования Thr-71 (Sano, 2005).
Используя две разные системы анализа, это исследование продемонстрировало на генетическом уровне, что dATF-2 действует на сигнальный путь dp38.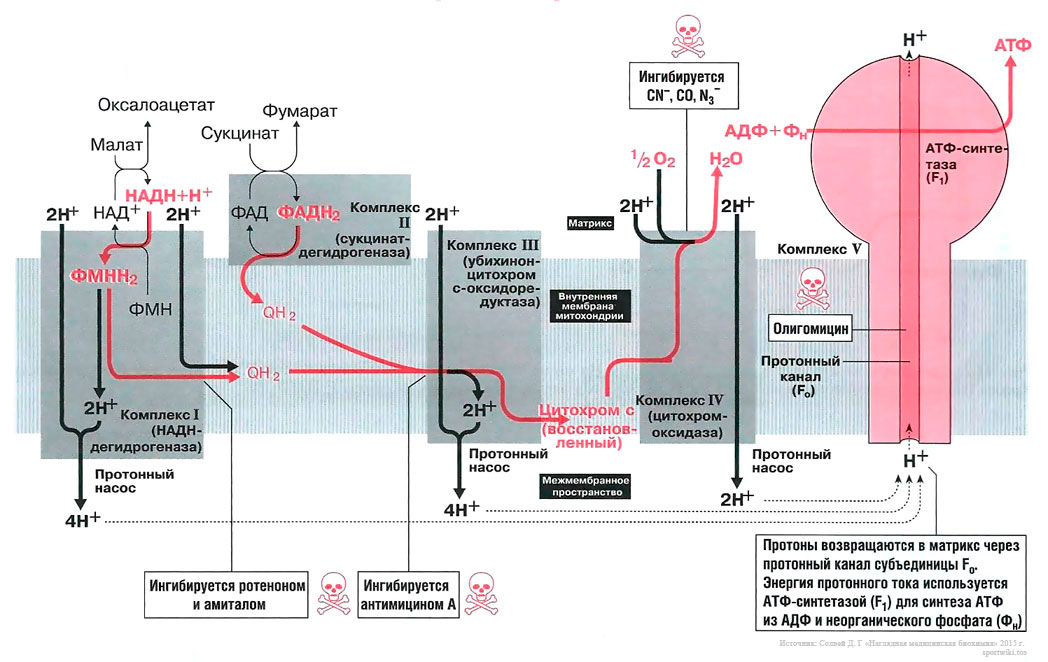 Во-первых, было показано, что экспрессия DN-dp38b усиливает аберрантный фенотип крыла, вызванный DN-dATF-2.Ранее сообщалось, что dp38b действует ниже рецептора Dpp Tkv, поскольку DN-dp38b, экспрессируемый в имагинальном диске крыла, вызывает фенотип, сходный с мутантным dpp , гомологом дрозофилы костного морфогенетического белка млекопитающих /TGF-β/. суперсемейство активинов. Следовательно, dATF-2 может функционировать в сигнальном пути Dpp. Это может согласовываться с открытием, что ATF-2 млекопитающих фосфорилируется с помощью передачи сигналов TGF-β через TAK1 и p38, а затем напрямую связывается с комплексом Smad3/4 для синергической активации транскрипции с помощью Smad3/4 (Sano, 1999).Это исследование также продемонстрировало, что коэкспрессия DN-dp38b повышает чувствительность эмбрионов, экспрессирующих DN-dATF-2, к высокой осмолярности. Т.о., dATF-2 действует на пути передачи сигналов dp38, по крайней мере, в формировании паттерна крыльев и в ответ на осмотический стресс.
Во-первых, было показано, что экспрессия DN-dp38b усиливает аберрантный фенотип крыла, вызванный DN-dATF-2.Ранее сообщалось, что dp38b действует ниже рецептора Dpp Tkv, поскольку DN-dp38b, экспрессируемый в имагинальном диске крыла, вызывает фенотип, сходный с мутантным dpp , гомологом дрозофилы костного морфогенетического белка млекопитающих /TGF-β/. суперсемейство активинов. Следовательно, dATF-2 может функционировать в сигнальном пути Dpp. Это может согласовываться с открытием, что ATF-2 млекопитающих фосфорилируется с помощью передачи сигналов TGF-β через TAK1 и p38, а затем напрямую связывается с комплексом Smad3/4 для синергической активации транскрипции с помощью Smad3/4 (Sano, 1999).Это исследование также продемонстрировало, что коэкспрессия DN-dp38b повышает чувствительность эмбрионов, экспрессирующих DN-dATF-2, к высокой осмолярности. Т.о., dATF-2 действует на пути передачи сигналов dp38, по крайней мере, в формировании паттерна крыльев и в ответ на осмотический стресс.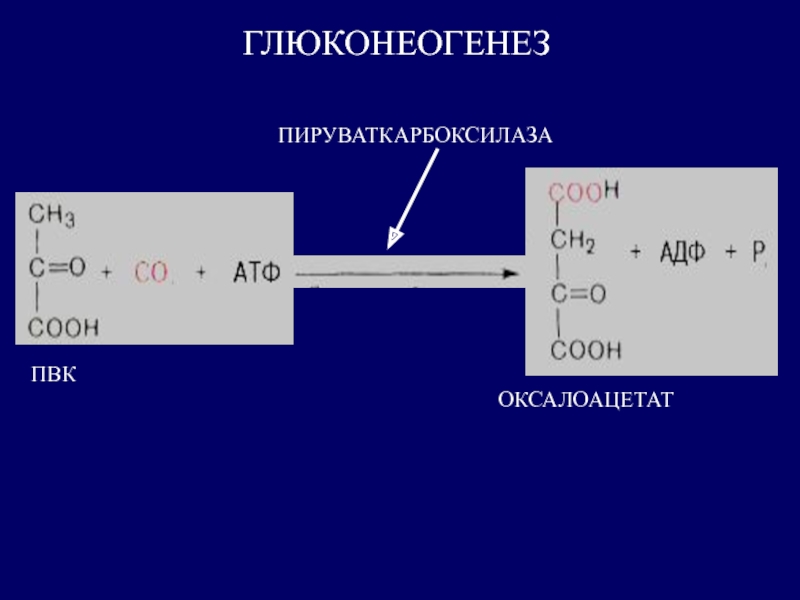 Однако у трансгенных мух, экспрессирующих DN-dATF-2, дефектов ооцитов не наблюдалось, хотя известно, что путь dp38 MAPK необходим во время оогенеза для асимметричного развития яиц. Т.о., dATF-2 может функционировать только в некоторых специфических событиях, которые регулируются сигнальным путем dp38 (Sano, 2005).
Однако у трансгенных мух, экспрессирующих DN-dATF-2, дефектов ооцитов не наблюдалось, хотя известно, что путь dp38 MAPK необходим во время оогенеза для асимметричного развития яиц. Т.о., dATF-2 может функционировать только в некоторых специфических событиях, которые регулируются сигнальным путем dp38 (Sano, 2005).
Анализ массива ДНК показал, что около 40% генов, которые индуцируются осмотическим стрессом, также регулируются dATF-2, что указывает на то, что dATF-2 является основным индуктором экспрессии генов, индуцируемых осмотическим стрессом. Эти гены кодируют белки клеточной поверхности и кутикулы, транспортеры и рецепторы, а также различные эндопептидазы. Неудивительно, что осмотический стресс может увеличивать продукцию белков клеточной поверхности, включая некоторые рецепторы. Кроме того, эндопептидазы могут продуцироваться, поскольку высокая осмолярность может увеличить денатурацию белков, которые затем должны быть расщеплены клеткой.Гены-мишени dATF-2 также включают семь генов иммунного ответа, а именно несколько кодирующих антимикробные пептиды и один кодирующий белок распознавания пептидогликана, который связывается с пептидогликанами клеточных стенок бактерий и запускает иммунные ответы. Было показано, что LPS увеличивает киназную активность dp38. Следовательно, dp38-фосфорилированный dATF-2 может непосредственно индуцировать эти гены, связанные с иммунным ответом. Однако также было показано, что сверхэкспрессия dp38 ингибирует экспрессию генов иммунного ответа.Это может быть объяснено возможностью того, что сверхэкспрессия dp38 может ингибировать сигнальный путь p38 путем активации регуляторных механизмов отрицательной обратной связи, таких как p38α-индуцированное снижение стабильности мРНК MKK6 в клетках млекопитающих. У дрозофилы грамположительные бактерии и грибы преимущественно индуцируют сигнальный путь Toll для активации таких генов, как дросомицин, тогда как грамотрицательные бактерии активируют путь Imd для активации таких генов, как диптерицин. Анализ массива ДНК показал, что и дросомицин, и диптерицин регулируются dATF-2, что позволяет предположить, что dATF-2 может быть компонентом путей Toll и Imd.Дальнейший анализ dATF-2, скорее всего, улучшит понимание молекулярных механизмов, вовлеченных в иммунную систему Drosophila (Sano, 2005).
Было показано, что LPS увеличивает киназную активность dp38. Следовательно, dp38-фосфорилированный dATF-2 может непосредственно индуцировать эти гены, связанные с иммунным ответом. Однако также было показано, что сверхэкспрессия dp38 ингибирует экспрессию генов иммунного ответа.Это может быть объяснено возможностью того, что сверхэкспрессия dp38 может ингибировать сигнальный путь p38 путем активации регуляторных механизмов отрицательной обратной связи, таких как p38α-индуцированное снижение стабильности мРНК MKK6 в клетках млекопитающих. У дрозофилы грамположительные бактерии и грибы преимущественно индуцируют сигнальный путь Toll для активации таких генов, как дросомицин, тогда как грамотрицательные бактерии активируют путь Imd для активации таких генов, как диптерицин. Анализ массива ДНК показал, что и дросомицин, и диптерицин регулируются dATF-2, что позволяет предположить, что dATF-2 может быть компонентом путей Toll и Imd.Дальнейший анализ dATF-2, скорее всего, улучшит понимание молекулярных механизмов, вовлеченных в иммунную систему Drosophila (Sano, 2005).
Получение и характеристика наночастиц SiC для ATF-FCM
[1] Дж.Ван, М. Маккейб, Моделирование устойчивых к авариям плакированных материалов с помощью MELCOR: эталон для краткосрочного отключения электроэнергии на станции SUPPY, ядерной инженерии и проектирования. 313 (2017) 458-469.
DOI: 10.1016/j.nucengdes.2017.01.002
[2]
К. Юэ, К. А. Террани, Карбид кремниевый композит для тепловыделяющих сборок легководных реакторов, Journal of Nuclear Materials. 448 (2014) 380-388.
Юэ, К. А. Террани, Карбид кремниевый композит для тепловыделяющих сборок легководных реакторов, Journal of Nuclear Materials. 448 (2014) 380-388.
DOI: 10.1016/j.jnucmat.2013.12.004
[3] Л.Юнкер, М. Фратони, Нейтронная оценка материалов покрытий и оболочек для устойчивого к авариям топлива, Прогресс в ядерной энергетике. 88(2016)10-18.
DOI: 10. 1016/j.pnucene.2015.11.006
1016/j.pnucene.2015.11.006
[4] ЧАС.Ким, Дж. Ян, Состояние разработки устойчивого к авариям топлива для легководных реакторов в Корее, Ядерная техника и технологии. 48(2016)1-15.
[5]
М.Т. Фармер, Л. Лейбовиц, Предварительные оценки воздействия АТФ на развитие аварии на поздних стадиях, включая взаимодействие расплавленной активной зоны с бетоном, Журнал ядерных материалов.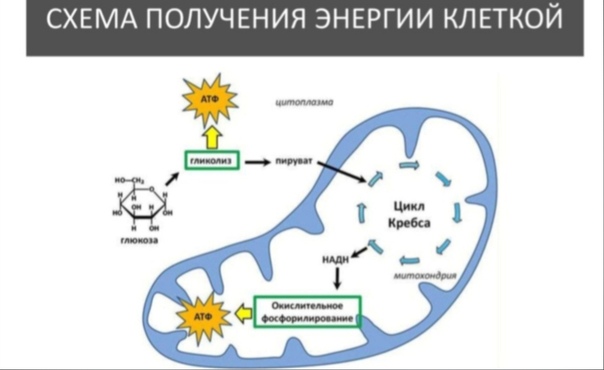 448 (2014) 534-540.
448 (2014) 534-540.
DOI: 10.1016/j.jnucmat.2013.12.022
[6] Ю.В. Ву, Б.В. Цю, Г.Х. Су, Анализ характеристик и оценка аварийно-стойкого тепловыделяющего элемента, Четырнадцатый национальный симпозиум по реакторным теплоносителям, Пекин (2015 г.).
[7]
Ю. Ф. Сюй, H.Q. Ру, Х.Ю. Юэ, Слой на основе Si/SiC, нанесенный на частицы карбида бора с помощью CVD, Основные инженерные материалы. 602-603 (2014) 270-273.
Ф. Сюй, H.Q. Ру, Х.Ю. Юэ, Слой на основе Si/SiC, нанесенный на частицы карбида бора с помощью CVD, Основные инженерные материалы. 602-603 (2014) 270-273.
DOI: 10.4028/www.scientific.net/kem.602-603.270
[8] М.Лю, Р.З. Лю, Дж. К. Чанг, Ю. Л. Шао, Подготовка слоя покрытия из карбида кремния путем химического осаждения из паровой фазы в псевдоожиженном слое с использованием прекурсора, не содержащего галогенов, Key Engineering Materials. 697 (2016) 846-51.
DOI: 10. 4028/www.scientific.net/kem.697.846
4028/www.scientific.net/kem.697.846
[9] G Ferro, J Camassel, S Juillaguet, Гексаметилдисилан/пропан по сравнению с предшественниками силан/пропан: применение для выращивания высококачественного 3C-SiC на Si, Semicond.науч. Технол. 18 (2003) 1015-1023.
DOI: 10.1088/0268-1242/18/12/303
[10]
В. Дж. Буллок, Р. Уолш, Пиролиз гексаметилдисилана при очень низком давлении. Кинетическое определение энтальпии диссоциации связи DH (Me3Si-SiMe3) и последствия для энтальпии образования радикала триметилсилила, J.Phys.Chem. 98 (1994).
Дж. Буллок, Р. Уолш, Пиролиз гексаметилдисилана при очень низком давлении. Кинетическое определение энтальпии диссоциации связи DH (Me3Si-SiMe3) и последствия для энтальпии образования радикала триметилсилила, J.Phys.Chem. 98 (1994).
DOI: 10.1021/j100061a016
[11] А.Гупта, Т. Гош, Влияние состава и температуры газа-разбавителя на формирование нанопорошка SiC методом CVD, J Mater Sci 42:5142-5146.
DOI: 10. 1007/s10853-006-1267-1
1007/s10853-006-1267-1
[12] Р.З. Лю, М. Лю, Дж. К. Чанг, Крупномасштабный синтез монодисперсных наночастиц SiC с регулируемым размером, стехиометрическим соотношением и свойствами путем химического осаждения из паровой фазы в псевдоожиженном слое, J Nanopart Res (2017) 19:26.
DOI: 10.1007/s11051-016-3737-y
Внедрение ATF — Nuclear Engineering International
Westinghouse Electric Company и ее партнеры применяют двухэтапный подход к разработке топлива, устойчивого к авариям, как Пэн Сюй, Роберт Л.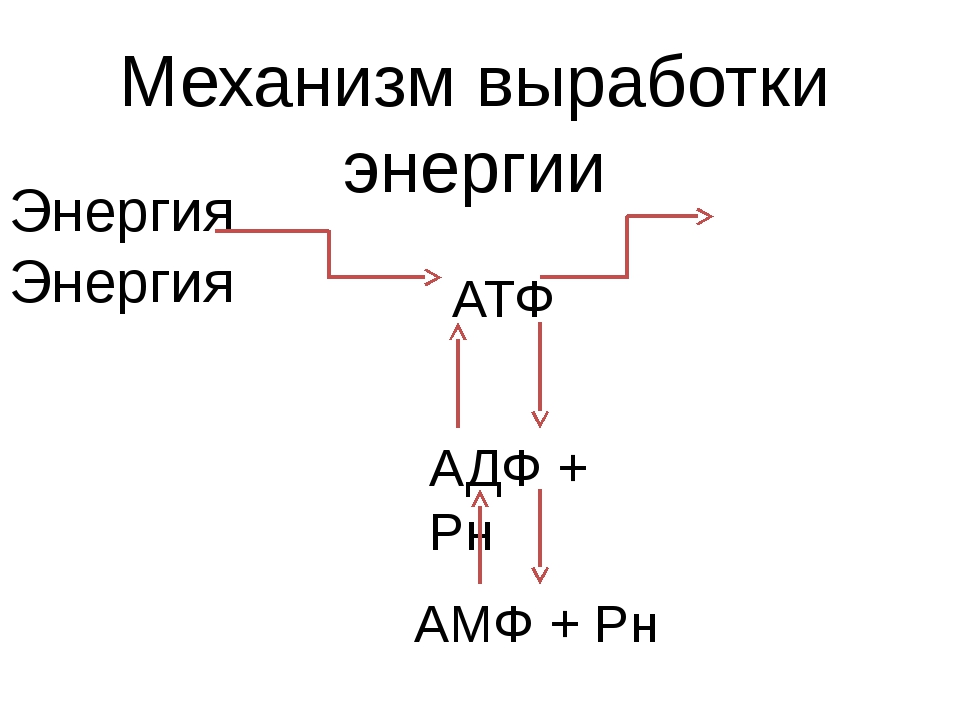 Олрих, Сумит Рэй, Кристиан Дек и Кристина Бэк объясняют.
Олрих, Сумит Рэй, Кристиан Дек и Кристина Бэк объясняют.
ТОПЛИВО С ЦИРКОНИЕМ, В НАСТОЯЩЕЕ ВРЕМЯ используемое в качестве отраслевого стандарта для легководных реакторов (LWR), было безопасным и надежным в нормальных и аварийных условиях, но оно проявляет экзотермическую реакцию с паром при воздействии высоких температур, наблюдаемых в «запредельных условиях». аварии на базе. Вот почему в 2012 году Конгресс США поручил Министерству энергетики США (DOE) уделить приоритетное внимание разработке усовершенствованных видов топлива и оболочек.
В результате Министерство энергетики США вложило средства в исследования и разработки в области устойчивого к авариям топлива (ATF) в лабораториях Министерства энергетики США, в университетах и в атомной промышленности. Компания Westinghouse, назначенная на конкурсной основе, является одним из трех разработчиков ядерного топлива, получивших награды Министерства энергетики США за разработку и внедрение технологий ATF.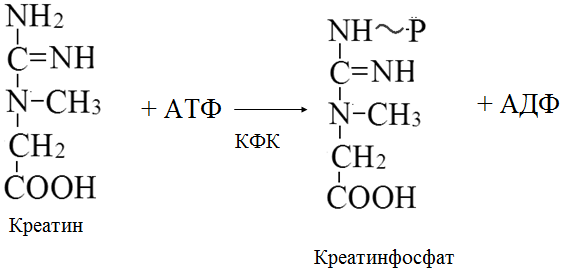 Westinghouse начала разработку топлива, предназначенного для аналогичных целей, в 2003–2004 годах.
Westinghouse начала разработку топлива, предназначенного для аналогичных целей, в 2003–2004 годах.
Набор продуктов Westinghouse ATF под названием EnCore® Fuel разрабатывается и внедряется в соответствии со стратегическим графиком.Некоторые продукты EnCore Fuel разрабатываются для быстрого внедрения, поэтому коммунальные предприятия быстро получают преимущества в плане безопасности и затрат. Другие передовые продукты EnCore Fuel с более длительным сроком эксплуатации разрабатываются медленнее, чтобы снизить риск использования ATF.
Топливные продукты EnCore
В ближайшем будущем EnCore Fuel имеет циркониевую оболочку с хромированным покрытием и топливные таблетки ADOPTTM (диоксид урана), предлагая умеренные преимущества в плане безопасности и экономичности. Внося только постепенные изменения в текущий используемый облицовочный материал Westinghouse (Zirlo® или Optimized ZirloTM) и используя гранулы ADOPT, он обеспечивает лучшие характеристики топлива и более быструю доступность для промышленности. Свинцовые испытательные стержни будут вставлены в коммерческий реактор весной 2019 года; количества для региона запланированы на 2023 год.
Свинцовые испытательные стержни будут вставлены в коммерческий реактор весной 2019 года; количества для региона запланированы на 2023 год.
Более долгосрочное топливо EnCore состоит из оболочки, изготовленной из композита с керамической матрицей карбида кремния, с топливными таблетками из силицида урана высокой плотности. Westinghouse считает, что экономические преимущества этой комбинации отличают продукты EnCore Fuel от других продуктов ATF в отрасли.
Плакирование с хромовым покрытием
Компания Westinghouse начала предварительные исследования циркониевого покрытия с покрытием в 2013 году и исследовала широкий спектр материалов и процессов покрытия.Совместно с Университетом Висконсин-Мэдисон команда разработала и оптимизировала технологию холодного напыления для покрытия труб из циркониевой оболочки различными материалами. Хром был выбран в качестве окончательного материала покрытия из-за его превосходного качества покрытия и производительности. Метод холодного напыления был выбран потому, что это быстрый процесс осаждения в условиях окружающей среды и обеспечивает оптимальную прочность сцепления между покрытием и базовым циркониевым материалом.
Оболочка с покрытием сохраняет все преимущества свойств базового циркониевого материала, но повышает его стойкость к окислению и коррозии как в нормальных условиях эксплуатации, так и в аварийных условиях.Также ожидается, что покрытие обеспечит лучшую механическую прочность против разрыва при более высоких температурах благодаря сохранению прочности даже тонкослойного хрома, а также лучшую стойкость к фреттинг-износу, чем цирконий без покрытия.
Испытания показали, что циркониевое топливо с хромированным покрытием может выдерживать температуры до 1500°C, что на 300°C лучше максимальной температуры выживания 1200°C для современного топлива.
Чтобы расширить процесс нанесения покрытия на полноразмерную трубу длиной 14 футов, Westinghouse заключила партнерское соглашение с Военной исследовательской лабораторией (ARL) благодаря обширному опыту и знаниям ARL в области холодного напыления и промышленных применений для более крупных компонентов.Компания ARL покрыла прототипы циркониевых труб на своем предприятии холодного напыления. В мае ARL построила платформу для полноразмерных труб с покрытием. Эта работа поддерживает текущую направленность программы Westinghouse ATF: квалификация и производство полноразмерных хромированных трубок, которые будут загружены в качестве первых свинцовых испытательных стержней EnCore Fuel в Exelon Generation Byron 2 весной 2019 года.
В мае ARL построила платформу для полноразмерных труб с покрытием. Эта работа поддерживает текущую направленность программы Westinghouse ATF: квалификация и производство полноразмерных хромированных трубок, которые будут загружены в качестве первых свинцовых испытательных стержней EnCore Fuel в Exelon Generation Byron 2 весной 2019 года.
Гранулы ADOPT
Таблетки Westinghouse ADOPT представляют собой зрелую конструкцию, которая используется в реакторах BWR в Европе уже 10 лет.Он улучшает диоксид урана за счет включения глинозема и хрома в очень малых количествах. Эти добавки способствуют росту зерен и спекаемости диоксида урана, утроению размера зерен и повышению плотности до 2%. Больший размер зерен задерживает перенос продуктов деления и обеспечивает лучшее удержание газов деления. Более высокая плотность позволяет размещать больше урана в тепловыделяющих сборках для более высокой линейной мощности (более высокого выгорания), что улучшает экономию топлива. Также ожидается, что гранулы обеспечат дополнительные преимущества с точки зрения безопасности с точки зрения фрагментации топлива, перемещения и утилизации в таких случаях, как авария с потерей теплоносителя.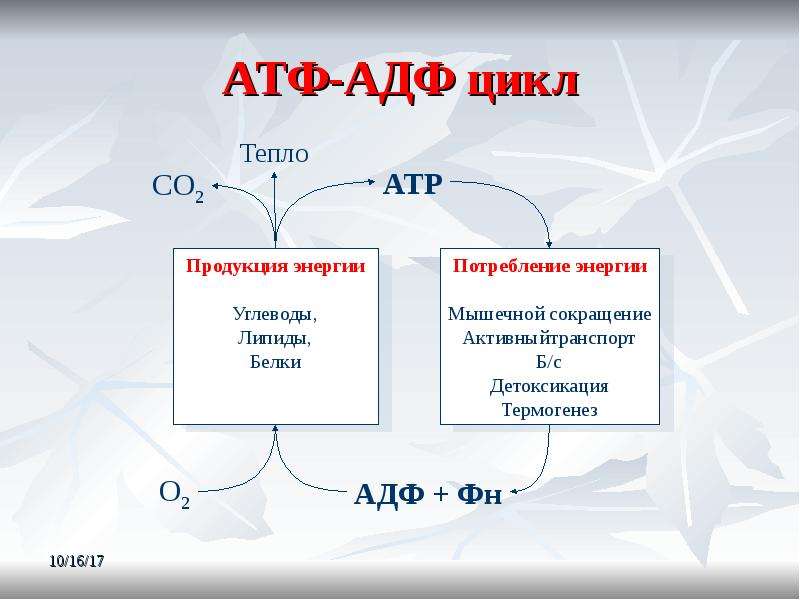
Топливный завод Westinghouse в Вестеросе, Швеция, уже изготовил таблетки, необходимые для планируемых свинцовых испытательных стержней.
Westinghouse сотрудничает с ENUSA Industrias Avanzandas в Испании с целью улучшения методологии моделирования и лицензирования ATF в Европе.
Прогресс в области долгосрочных продуктов
Более долгосрочная и революционная технология EnCore Fuel меняет правила игры, обеспечивая значительно более высокий уровень безопасности и экономичности.
Испытания показали, что покрытие из карбида кремния сохраняет свою прочность без ухудшения свойств и сопротивляется окислению паром при температурах выше 1700°C.Современные покрытия на основе циркония теряют большую часть своей прочности при температурах выше 800°C. Испытания также показывают, что плакирование обладает отличной устойчивостью к авариям с минимальным окислением и небольшим выделением водорода в паре при температуре 1700°C – на 500°C выше, чем текущий температурный предел для циркониевого плакирования. Более агрессивные испытания показали, что покрытие из карбида кремния может выдерживать температуры выше 2000°C, что является шагом вперед в плане безопасности при тяжелых авариях. Кроме того, покрытие из карбида кремния имеет более низкое сечение поглощения нейтронов, чем цирконий, что приводит к лучшей экономии нейтронов и лучшему использованию топлива.
Более агрессивные испытания показали, что покрытие из карбида кремния может выдерживать температуры выше 2000°C, что является шагом вперед в плане безопасности при тяжелых авариях. Кроме того, покрытие из карбида кремния имеет более низкое сечение поглощения нейтронов, чем цирконий, что приводит к лучшей экономии нейтронов и лучшему использованию топлива.
Westinghouse сотрудничает с General Atomics для разработки усовершенствованной композитной оболочки с керамической матрицей из карбида кремния, известной как SiGATM. Компания General Atomics имеет большой опыт в разработке SiGA для ядерных приложений и имеет мощности для производства и испытаний компонентов. General Atomics превращает волокна карбида кремния в тонкостенные трубки. Структура армированного волокна является ключом к достижению высокотемпературной прочности и повышению живучести оболочки при тяжелых авариях.
General Atomics увеличила длину трубок с усиленной оболочкой SiGA с шести дюймов до трех футов и работает над производством полноразмерных трубок.
Команда также добивается успехов в решении технических проблем, которые ранее считались слишком сложными для решения. Это включает способность поддерживать хорошую прочность соединения в герметичном соединении между трубками из карбида кремния и концевыми заглушками из карбида кремния во время облучения. Чтобы добиться этого, производственный процесс тщательно контролировался для достижения оптимального состояния поверхности и соответствия чертежным требованиям и спецификациям.Во-вторых, гидротермальная коррозионная стойкость карбида кремния при нормальных условиях эксплуатации была улучшена до такой степени, что теперь она соответствует критериям приемлемости. Чтобы оценить совместимость оболочки из карбида кремния с современными конструкциями топливных сборок легководных реакторов, General Atomics и Westinghouse проводят механические испытания, такие как испытания на нагрузку стержня, испытания на разрушение сетки, испытания на расширяющуюся пробку и испытания на четырехточечный изгиб.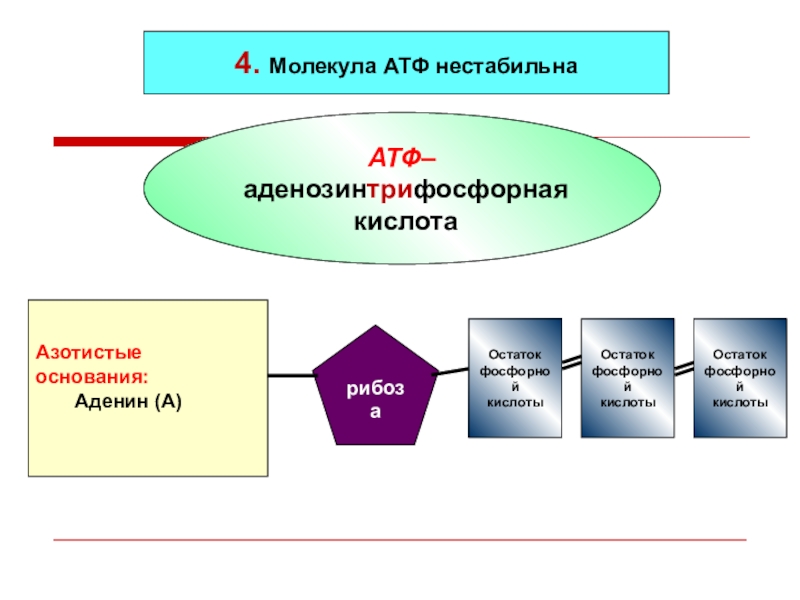
Таблетки из силицида урана
В 2009 году компания Westinghouse начала исследования передового высокоплотного топлива.С плотностью урана, которая на 17% выше, чем у диоксида урана, силицид урана (U3Si2) обеспечивает повышение экономичности топлива. Таблетки из силицида урана также улучшают эксплуатационные характеристики топлива и запасы безопасности. Его теплопроводность более чем в пять раз выше, чем у диоксида урана при рабочих температурах, и она увеличивается в зависимости от температуры (теплопроводность диоксида урана уменьшается в зависимости от температуры). Эта теплопроводность компенсирует его более низкую температуру плавления, так что улучшаются эксплуатационные характеристики топлива и запасы безопасности.
Компания Westinghouse, Национальная лаборатория Айдахо (INL) и Национальная лаборатория Лос-Аламоса приступили к разработке и производству силицида урана и его композитного топлива в рамках программы Министерства энергетики США по созданию толерантного к авариям топлива. INL изготовила тепловыделяющие элементы из силицида урана и начала их облучение в своем усовершенствованном испытательном реакторе в 2014 году. В 2016 году пара топливных элементов достигла выгорания около 20 МВт⋅сут/кгU и была выгружена для послереакторных исследований. Они прошли, среди прочего, нейтронную и рентгеновскую томографию, анализы ядерных газов, гамма-сканирование, оптическую микроскопию и профилометрию.Результаты показывают стабильность топлива из силицида урана при облучении при линейной мощности около 15 кВт/фут, что более чем в два раза выше, чем у современных видов топлива LWR, с почти нулевым распуханием и выделением газа деления, что свидетельствует о том, что силицид урана подходит для мощных и тяжелых режимов работы. операции.
INL изготовила тепловыделяющие элементы из силицида урана и начала их облучение в своем усовершенствованном испытательном реакторе в 2014 году. В 2016 году пара топливных элементов достигла выгорания около 20 МВт⋅сут/кгU и была выгружена для послереакторных исследований. Они прошли, среди прочего, нейтронную и рентгеновскую томографию, анализы ядерных газов, гамма-сканирование, оптическую микроскопию и профилометрию.Результаты показывают стабильность топлива из силицида урана при облучении при линейной мощности около 15 кВт/фут, что более чем в два раза выше, чем у современных видов топлива LWR, с почти нулевым распуханием и выделением газа деления, что свидетельствует о том, что силицид урана подходит для мощных и тяжелых режимов работы. операции.
Команда Westinghouse также решала технические проблемы при разработке силицида урана. Одним из них является отсутствие коммерческого способа получения силицида урана из гексафторида урана. Технологический партнер Westinghouse в Соединенном Королевстве, Национальная ядерная лаборатория, разработал, установил и в настоящее время эксплуатирует исследовательскую установку, которая уже получила данные для оценки оптимального пути синтеза. Национальная ядерная лаборатория планирует модернизировать новую установку, чтобы позволить реакциям протекать при более высоких температурах — выше 850°C — чтобы ускорить более желательные реакции.
Национальная ядерная лаборатория планирует модернизировать новую установку, чтобы позволить реакциям протекать при более высоких температурах — выше 850°C — чтобы ускорить более желательные реакции.
График внедрения
Общий график внедрения продукта Westinghouse EnCore Fuel, включая вспомогательные мероприятия, такие как испытания облучением, лицензирование и производство, показан в таблице. Многие мероприятия программы Westinghouse ATF сосредоточены на подготовке к установке свинцовых испытательных стержней (LTR) ближайшего хромированного покрытия и гранул ADOPT в Brion 2 весной 2019 года с целью перезагрузки региона к 2023 году.
Westinghouse также продвигается вперед, чтобы облучать таблетки силицида урана в свинцовых испытательных стержнях, предназначенных для реактора Байрона, чтобы получить ценный опыт эксплуатации. Оболочка SiGA, заполненная топливными таблетками из силицида урана высокой плотности, будет облучена в коммерческом реакторе в 2022 году. от облучения инструментированных свинцовых испытательных стержней с механистическим моделированием для лицензирования, чтобы ускорить лицензирование ATF и сократить график коммерческого внедрения. Более долгосрочный продукт EnCore Fuel планируется внедрить в регионы к 2027 году. Роберт Л. Элрих, менеджер по глобальным технологиям ATF в Westinghouse Electric Company LLC; Сумит Рэй, директор по методам и технологиям Westinghouse Electric Company LLC; Кристиан Дек, руководитель группы Advanced Materials в General Atomics; Кристина Бэк, вице-президент по ядерным технологиям и материалам General Atomics
Более долгосрочный продукт EnCore Fuel планируется внедрить в регионы к 2027 году. Роберт Л. Элрих, менеджер по глобальным технологиям ATF в Westinghouse Electric Company LLC; Сумит Рэй, директор по методам и технологиям Westinghouse Electric Company LLC; Кристиан Дек, руководитель группы Advanced Materials в General Atomics; Кристина Бэк, вице-президент по ядерным технологиям и материалам General Atomics
Легкий синтез наночастиц Ag, нанесенных на инверсный опал TiO2, с повышенной фотокаталитической активностью в видимом свете | Интернет-исследования в области здравоохранения и окружающей среды (HERO)
ID ГЕРОЯ
1581243
Тип ссылки
Журнальная статья
Заголовок
Легкий синтез наночастиц Ag, нанесенных на инверсный опал TiO2, с повышенной фотокаталитической активностью в видимом свете
Авторы)
Чжао, Ю; Ян, Б; Сюй, Дж; Фу, З; Ву, Мин; Ли, Ф
Год
2012 г.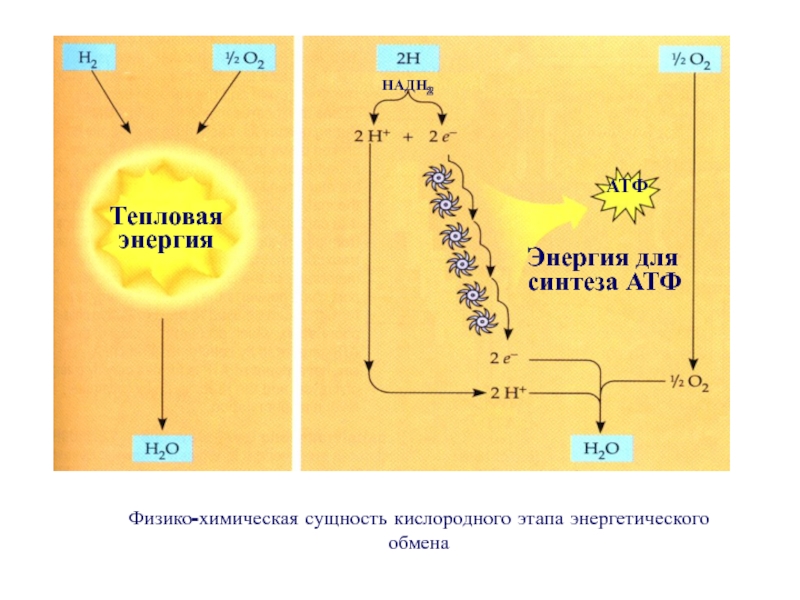
Рецензируется ли эксперт?
да
Журнал
Тонкие твердые пленки
ISSN: 0040-6090
EISSN: 1879-2731
Объем
520
Проблема
9
Номера страниц
3515-3522
DOI
10.1016/ж.цф.2011.12.076Идентификатор Web of Science
WOS:000301627100017Абстрактный
Инверсионные опаловые пленки TiO2, нагруженные наночастицами серебра
(ATIO), были синтезированы на стеклянных подложках. Пленки инверсного опала (TIO) TiO2 были приготовлены с помощью золь-гель процесса
с использованием самосборки шаблона коллоидного кристалла SiO2 и легкого влажного химического способа
с использованием раствора прекурсора AgNO3 для изготовления наночастиц серебра на пленках TIO.
Обратная структура опала и осаждение Ag физически и химически модифицируют диоксид титана,
соответственно. Катализаторы охарактеризованы методами рамановской спектроскопии, автоэмиссионной сканирующей электронной микроскопии
Катализаторы охарактеризованы методами рамановской спектроскопии, автоэмиссионной сканирующей электронной микроскопии
, просвечивающей электронной микроскопии высокого разрешения (HRTEM). УФ-видимые спектры поглощения
, рентгеновская фотоэлектронная спектроскопия и фотолюминесцентная спектроскопия. Результаты HRTEM
показывают, что наночастицы Ag размером 5-10 нм были равномерно распределены на TIO. Фотокаталитическую активность образцов как в ультрафиолетовом, так и в видимом свете
оценивали путем анализа разложения
метиленового синего (МС) в водном растворе.Результаты показывают, что кажущаяся константа скорости реакции
(k(app)) разложения MB образца ATIO под воздействием УФ-излучения
примерно в 1,5 раза больше, чем у обычной пленки TiO2 (ATF), нагруженной Ag, без упорядоченной пористой структуры
. структура при концентрации AgNO3 5 мМ в растворе прекурсора. При концентрации AgNO3
, равной 10 мМ, образец демонстрирует значение kapp примерно в 4,2 раза выше, чем у ATF
при облучении видимым светом.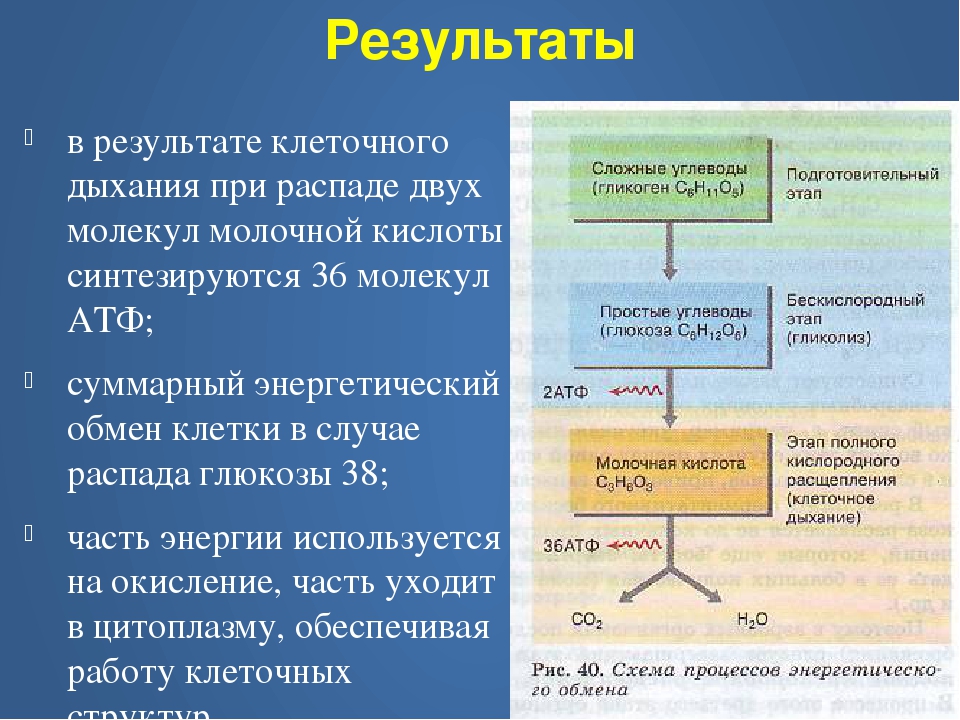 Это улучшенное фотокаталитическое действие в видимом свете можно объяснить
Это улучшенное фотокаталитическое действие в видимом свете можно объяснить
синергетическим эффектом оптимизированного осаждения наночастиц Ag и упорядоченной макропористой структуры TIO
.Многократные циклические испытания показали, что образцы демонстрируют стабильную фотокаталитическую активность
даже после шести повторных циклов. (C) 2012 Elsevier B.V. Все права
защищены.
Ключевые слова
Диоксид титана; Инверсный опал; Серебряный; наночастицы; Поглощение поверхностных плазмонов; пористая структура; Фотокаталитическая активность
ATF Белок крупного рогатого скота | Апо трансферрин натуральный белок
Каталожный номер
ПРО-511
Синонимы
Серотрансферрин, трансферрин, сидерофилин, бета-1-металлсвязывающий глобулин, TF, PRO1557, PRO2086, DKFZp781D0156, апо-трансферрин, ATF.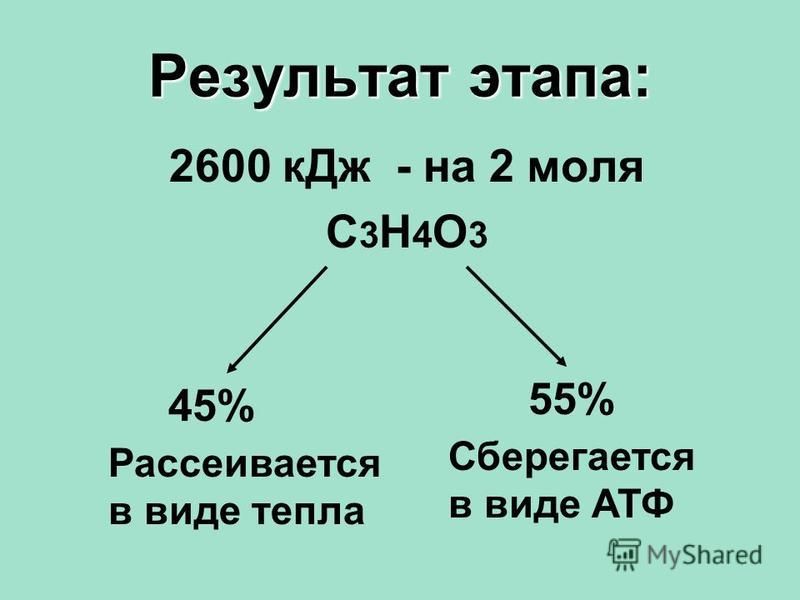
Введение
Трансферрин представляет собой железотранспортный белок сыворотки позвоночных, который отдает железо клеткам посредством взаимодействия со специфическим мембранным рецептором CD71. Трансферрин, по-видимому, незаменим для большинства клеток, растущих в тканевой культуре.
Его часто называют фактором роста, потому что, по аналогии с другими взаимодействиями фактора роста и рецептора, пролиферирующие клетки экспрессируют большое количество рецепторов трансферрина, и связывание трансферрина с их рецепторами необходимо для того, чтобы клетки инициировали и поддерживали синтез своей ДНК. .Помимо своей роли белка, транспортирующего железо, трансферрин действует как цитокин и выполняет функции, которые могут не быть связаны с его способностью переносить железо.
Бычий трансферрин является ключевым компонентом для культивирования клеток млекопитающих in vitro. Бычий трансферрин имеет решающее значение для длительного роста клеток in vitro. Бычий трансферрин используется в качестве детоксиканта в средах путем связывания загрязняющих ионов металлов. Бычий трансферрин часто используется в качестве питательного вещества в ферментационных средах для производства рекомбинантных белков и биофармацевтических препаратов.Другими распространенными применениями бычьего трансферрина являются молекулярная масса, аффинная очистка антител против человеческого трансферрина, а также опосредованная рецептором трансфекция молекул, таких как ДНК, в клетки.
Бычий трансферрин используется в качестве детоксиканта в средах путем связывания загрязняющих ионов металлов. Бычий трансферрин часто используется в качестве питательного вещества в ферментационных средах для производства рекомбинантных белков и биофармацевтических препаратов.Другими распространенными применениями бычьего трансферрина являются молекулярная масса, аффинная очистка антител против человеческого трансферрина, а также опосредованная рецептором трансфекция молекул, таких как ДНК, в клетки.
Описание
Бычий апо-трансферрин представляет собой гликопротеин с молекулярной массой приблизительно 77 кДа.
Источник
Внешний вид
Стерильный отфильтрованный не совсем белый лиофилизированный (сублимированный) порошок.
Состав
Белок (1 мг/мл) лиофилизировали без добавок.
Растворимость
Рекомендуется восстанавливать лиофилизированный апотрансферрин в стерильном 18 МОм-см водяном столбе не менее 1 г/30 мл за 20 мин. при 20-25С.
Стабильность
Лиофилизированный апотрансферрин крупного рогатого скота, хотя и стабилен при комнатной температуре в течение 3 недель, должен храниться в высушенном виде при температуре ниже -18°C.После восстановления бычий апо-трансферрин следует хранить при температуре 4°C в течение 2-7 дней, а для дальнейшего использования — при температуре ниже -18°C.
Не допускайте циклов замораживания-оттаивания.
Содержание железа
Содержание железа было определено с помощью ИСП-ОЭС и оказалось менее 40 частей на миллион.
Чистота
Более 95,0% по данным SDS-PAGE.
Паспорт безопасности
Использование
Продукция Prospec предназначена ТОЛЬКО ДЛЯ ИСПОЛЬЗОВАНИЯ В ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЯХ.Продукт нельзя использовать в качестве лекарств, сельскохозяйственных или пестицидных продуктов, пищевых добавок или бытовой химии.
Синтетическое масло Mobil 1™ для автоматических коробок передач
Особенности и преимущества
Mobil 1 Synthetic ATF превосходит по своим характеристикам обычные жидкости для автоматических трансмиссий и обеспечивает выдающуюся устойчивость к разрушению масла и образованию отложений. Присущий Mobil 1 Synthetic ATF высокий индекс вязкости и стабильность помогают защитить от термического разрушения при высоких рабочих температурах, сохраняя при этом превосходные рабочие характеристики при температуре окружающей среды до -54ºC.Кроме того, это помогает повысить общую долговечность и чистоту трансмиссии. Основные характеристики и потенциальные преимущества:
|
Характеристики |
Преимущества и потенциальные выгоды |
|
Улучшенные, долговременные фрикционные свойства |
Помогает улучшить и увеличить эффективность трансмиссии, плавное переключение передач и экономию топлива |
|
Исключительная термическая и окислительная стабильность |
Поддерживает трансмиссию в чистоте, обеспечивая выдающуюся производительность даже в тяжелых условиях вождения |
|
Превосходная прочность пленки и противоизносные свойства |
Значительное снижение износа, что может способствовать увеличению срока службы трансмиссии |
|
Отличная текучесть при низких температурах |
Помогает обеспечить быструю и надежную смазку при температуре окружающей среды до -54º C |
|
Исключительная устойчивость к сдвигу |
Сохранение вязкости даже в самых тяжелых условиях эксплуатации при высоких температурах |
|
Совместимость с минеральными жидкостями для автоматических коробок передач и всеми распространенными материалами уплотнений |
Снижение беспокойства в аварийных ситуациях и превосходный контроль утечек |
Приложения
• Mobil 1 Synthetic ATF — это универсальная формула, рекомендованная для использования в современных высокопроизводительных автомобилях, внедорожниках, универсалах, фургонах и других легких грузовиках
• Рекомендовано ExxonMobil для использования в приложениях, требующих уровней производительности Dexron III, Ford Mercon и Mercon V
• Рекомендовано ExxonMobil для использования в приложениях, определяющих требования к силовой передаче для внедорожной техники Allison C-4
.
Технические характеристики и сертификаты
|
Этот продукт рекомендуется для использования в приложениях, требующих: |
|
Эллисон С-4 |
|
Форд МЕРКОН |
|
ГМ ДЕКСРОН |
|
ГМ ДЕКСРОН II |
|
GM DEXRON IID |
|
ГМ ДЕКСРОН ИИЕ |
|
GM DEXRON IIIiG |
|
ГМ ДЕКСРОН IIIH |
|
ВОЛЬВО 97340 |
|
Этот продукт соответствует или превосходит требования: |
|
Форд МЕРКОН В |
|
ДЖАСО 1-А |
Свойства и характеристики
|
Собственность |
|
|
Класс |
МЕРКОН В |
|
ASTM Цвет, ASTM D1500 |
Красный |
|
Вязкость по Брукфилду при -40°С, мПа.с, ASTM D2983 |
10040 |
|
Плотность при 15,6°С, г/мл, ASTM D4052 |
0,846 |
|
Температура вспышки, открытый тигель Кливленда, °C, ASTM D92 |
220 |
|
Кинематическая вязкость при 100°C, мм2/с, ASTM D445 |
7.4 |
|
Кинематическая вязкость при 40°C, мм2/с, ASTM D445 |
36,3 |
|
Температура застывания, °C, ASTM D97 |
-51 |
|
Индекс вязкости, ASTM D2270 |
176 |
Здоровье и безопасность
Рекомендации по охране труда и технике безопасности для этого продукта можно найти в паспорте безопасности материала (MSDS) @ http://www.

 Если человек в хорошей физической форме, то активная выработка молочной кислоты начинается, когда аэробный уровень достигает 80-85%. Количество молочной кислоты в организме возрастает пропорционально росту нагрузок. Это своеобразный сигнал того, что аэробная энергетическая система исчерпала лимит своих возможностей и не может больше удовлетворять потребности мышц в дополнительной энергии.
Если человек в хорошей физической форме, то активная выработка молочной кислоты начинается, когда аэробный уровень достигает 80-85%. Количество молочной кислоты в организме возрастает пропорционально росту нагрузок. Это своеобразный сигнал того, что аэробная энергетическая система исчерпала лимит своих возможностей и не может больше удовлетворять потребности мышц в дополнительной энергии.