Что такое щелочноземельные металлы?
Щелочноземельные металлы — это металлические элементы, которые находятся во втором вертикальном ряду периодической таблицы. Щелочноземельные металлы получили свое название из-за их реактивных свойств. Когда эти металлы смешиваются в растворах, они создают рН выше 7, уровень, который определяется как щелочной. В состав щелочноземельных металлов входят шесть элементов: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Щелочноземельные металлы находятся в земной коре, обычно в скальных структурах. Наиболее часто встречающимися элементами в группе являются магний и кальций. Магний содержится в карнелите, магнезите и доломите и является восьмым наиболее распространенным элементом в земной коре. Кальций является пятым наиболее распространенным элементом в коре и часто содержится в меле, известняке и ангидрите.
Есть определенные свойства щелочноземельных металлов, которые разделяют все элементы в группе.
Еще одна черта, которую разделяют все щелочноземельные металлы, — это серебряный блеск на их поверхностях и их способность служить сильным проводником электричества. Все элементы также очень реактивны, настолько, что их редко можно встретить в природе, кроме случаев, когда они находятся в соединениях с другими материалами. Каждый из щелочноземельных металлов также имеет свои особые черты, которые делают его полезным по-разному.
Бериллий — очень легкий металл, который часто используется для окон в рентгеновских аппаратах и в ядерной среде. Он также часто комбинируется с другими металлами, такими как медь, чтобы создать очень прочные сплавы, которые не искрятся и не подвергаются коррозии.
Магний часто используется в качестве замены алюминия благодаря его большому содержанию. Это очень мягкий металл, и его можно легко отливать в различные формы. Магний также находит применение в медицине; и магнезиальное молоко, и английские соли входят в состав магния.
Это очень мягкий металл, и его можно легко отливать в различные формы. Магний также находит применение в медицине; и магнезиальное молоко, и английские соли входят в состав магния.
Кальций имеет много разных целей. Стекло, цемент и строительный раствор созданы с использованием кальция. Его свойства в качестве антибактериального агента также были использованы на фермах или в зданиях, где содержатся птицы.
Хотя стронций и барий используются в производстве вакуумных трубок реже, чем другие металлы в семействе щелочноземельных металлов. Радий, единственный радиоактивный элемент в группе, используется в лечении рака.
ДРУГИЕ ЯЗЫКИ
Металлы щелочноземельные — Энциклопедия по машиностроению XXL
У некоторых парамагнитных металлов (твердые и жидкие щелочные металлы, щелочноземельные металлы), парамагнетизм которых вызывается спиновыми магнитными моментами электронов проводимости, магнитная восприимчивость X почти не зависит от температуры.
Щелочноземельные металлы. Щелочноземельные металлы обладают малой работой выхода электронов. Используются для получения активных катодов газоразрядных ламп, газопоглотителей и др. [c.85]
Растворимость. Практически нерастворимы в железе щелочные металлы, щелочноземельные металлы Ag, Hg, Pb, Bi. [c.319]
Бериллий вступает в реакцию с ра. плавленными галогенидами щелочных металлов, восстанавливая их до металла, пока не наступает равновесие. Бериллий не взаимодействует с расплавленными галогенидами щелочноземельных металлов и магния, но восстанавливает галогениды алюминия и тяжелых металлов. Щелочноземельные металлы и магний можио успешно применять для получения бериллия из его галогенидов. [c.60]
Щелочноземельные металлы в свободном металл Ическом состоянии не применяются, за исключением специальных случаев.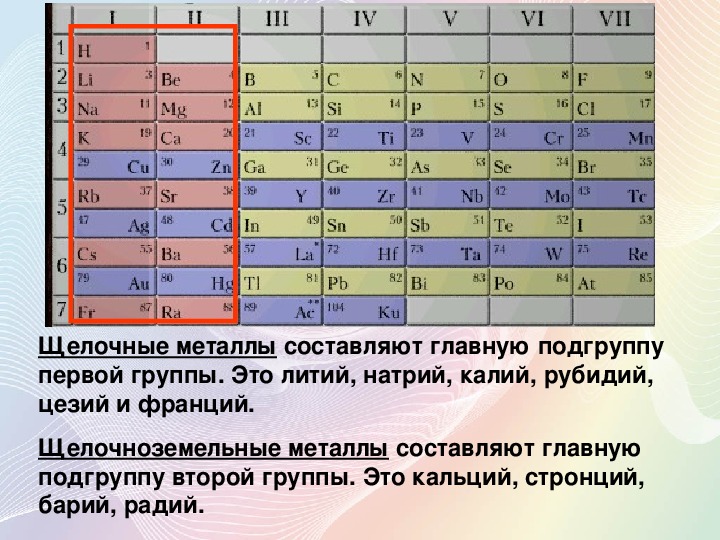 [c.17]
[c.17]
Получили применение смеси хлористых, азотнокислых и азотистокислых солей щелочноземельных металлов и смеси щелочей. Наиболее применяемые составы солей с указанием области их применения приведены в табл. 27. [c.289]
Во избежание загорания плавку магниевых сплавов проводят под слоем универсальных флюсов из хлористых и фтористых солей щелочных и щелочноземельных металлов или в среде защитных газов. [c.169]К металлам, не удовлетворяющим условию сплошности при окислении их кислородом, относятся все щелочные и щелочноземельные металлы (за исключением бериллия), в том числе имеющий большое техническое значение магний (табл. 4). [c.33]
Наиболее коррозионно неустойчивые металлы находятся в подгруппах А I и II групп периодической системы элементов, это щелочные и щелочноземельные металлы. [c.325]
Магний — щелочноземельный металл, II группы Периодической системы элементов, порядковый номер 12 (см. табл. 1), атомная масса 24,312. Цвет светло-серый. Характерным свойством магния является малая плотность 1,74 г/см , температура плавления магния 650 °С. Кристаллическая решетка гексагональная (с/а = 1,62354). Теплопроводность магния значительно меньше, чем у алюминия 125 Вт/(м-К), а коэффициенты линейного расширения примерно одинаковы (26,1 10 при (20—100 С) I. Технический магний Мг1 содержит 99,92 % Mg. В качестве примесей присутствуют Ре, Si, Ni, Na, Al, Мп. Вредными примесями являются Ре, Ni, Си и S1, снижающие коррозионную стойкость магния. Механические свойства литого магния сГв = 115 МПа, о ,., = 25 МПа, б 8 %, Е = = 45 ГПа, НВ 300 МПа, а деформированного (прессованные прутки) Оц 200 МПа, ст ,., = 9 МПа, б =— 11,5 %, НВ 400 Л Па. На воздухе м, 11 ит легко воспламеняется. Используется в пиротехнике и химической промышленности.
[c.337]
табл. 1), атомная масса 24,312. Цвет светло-серый. Характерным свойством магния является малая плотность 1,74 г/см , температура плавления магния 650 °С. Кристаллическая решетка гексагональная (с/а = 1,62354). Теплопроводность магния значительно меньше, чем у алюминия 125 Вт/(м-К), а коэффициенты линейного расширения примерно одинаковы (26,1 10 при (20—100 С) I. Технический магний Мг1 содержит 99,92 % Mg. В качестве примесей присутствуют Ре, Si, Ni, Na, Al, Мп. Вредными примесями являются Ре, Ni, Си и S1, снижающие коррозионную стойкость магния. Механические свойства литого магния сГв = 115 МПа, о ,., = 25 МПа, б 8 %, Е = = 45 ГПа, НВ 300 МПа, а деформированного (прессованные прутки) Оц 200 МПа, ст ,., = 9 МПа, б =— 11,5 %, НВ 400 Л Па. На воздухе м, 11 ит легко воспламеняется. Используется в пиротехнике и химической промышленности.
[c.337]
Тонкие слои адсорбированных щелочных и щелочноземельных металлов на поверхности тел существенно снижают работу выхода.
 Особенно сильно уменьшается работа выхода металлов и полупроводников при адсорбции на их предварительно очищенных поверхностях слоев цезия, бария и их оксидов. Углерод и кислород при адсорбции на поверхности тел. как правило, увеличивают их работу выхода (табл. 25.2, рис. 25.1 и 25.2).
Особенно сильно уменьшается работа выхода металлов и полупроводников при адсорбции на их предварительно очищенных поверхностях слоев цезия, бария и их оксидов. Углерод и кислород при адсорбции на поверхности тел. как правило, увеличивают их работу выхода (табл. 25.2, рис. 25.1 и 25.2).
Оксидный термокатод — смесь оксидов металлов, нанесенная на металлический керн. В низкотемпературных катодах, работающих в интервале температур от 900 до 1300 К, используются смеси оксидов щелочноземельных металлов — бария, кальция и стронция. Эти [c.570]
Кристаллические структуры металлов непосредственно определяются характером межатомных связей. Так, в самых простых металлах — щелочных и щелочноземельных, имеющих во внешней оболочке по одному-два s-электрона,— при низких температурах [c.167]
Первые два металла этой подгруппы занимают особое положение бериллий по некоторым свойствам близок к алюминию, а магний — к цинку. Кальций, стронций и барий называют щелочноземельными. Они образуют гидриды и нитриды с увеличением атомной массы это взаимодействие усиливается.
[c.68]
Кальций, стронций и барий называют щелочноземельными. Они образуют гидриды и нитриды с увеличением атомной массы это взаимодействие усиливается.
[c.68]
Щелочноземельные металлы 68 Щелочные металлы 65 [c.207]
Щелочноземельные металлы восстанавливают бериллий из его галоидных солей. [c.518]
Даны основы металлургии магния, бериллия, лития и щелочноземельных металлов (кальция, стронция, бария). Освещены важнейшие свойства этих металлов и области их применения. Рассмотрены вопросы экономичности технологий, утилизации отходов, а также охраны труда. [c.20]
БАРИЕВЫЕ РУДЫ, минералы, представляющие собой сернокислые и углекислые соединения бария и имеющие промышленное значение. В настоящее время такое значение имеют два минерала барит, или тяжелый шпат, — природный сульфат бария BaSOj (ВаО 65,7 %, SOg 34,3 %), витерит — природный карбонат бария ВаСОз (ВаО 77,7%, СОа 22,3%). Витерит по сравнению с баритом как баритовое сырье играет меньшую роль благодаря относительной редкости его месторождений (сокр.
ЧЕРНЫЕ МЕТАЛЛЫ имеют темно-серый цвет, большую плотность (кроме щелочноземельных), высокую температуру плавления, относительно высокую твердость и во многих слу чаях обладают полиморфизмом (о последнем см.
Флюсы для сварки легированных и высоколегированных сталей должны обеспечивать минимальное окисление легирующих элементов в шве. Для этого приме няют плавленые и керамические пизкокремпистые, бескреинистые и фторидные флюсы. Их шлаки имеют высокое содержание СаО, СгР и А1,0ч. Плавленые флюсы изготовляют из плавикового шпата, алюмосиликатов, алюминатов, путем сплавления в электропечах. Их шлаки имеют основной характер. Керамические флюсы приготовляют из порошкообразных компонентов путем замеса их на жидком стекле, гранулирования и последующего прокаливания. Основу керамических флюсов составляет мрамор, плавиковый шпат и хлориды щелочноземельных металлов.
Пленка оксида покрывает капли расплавленного металла и препятствует сплавлению их между собой и основным металлом. Для разрушения и удаления пленки и защиты металла от повторного окисления при сварке используют специальные флюсы или ведут сварку в атмосфере инертных газов. Флюсы состоят из смеси хлористых и фтористых солей щелочноземельных металлов (Na I, K I, Ba Ij, LiF, aFj и др.). Действие флюсов основано на растворении пленки оксидов. При сварке в защитных газах пленка разрушается в результате электрических процессов в том случае, если она оказывается в катодной области дуги. Это реализуется при сварке плавящимся электродом на постоянном токе обратной полярности и сварке не-плавящимся электродов на переменном токе с использованием специальных источников тока (см.
 разд. 5, гл. II, п. 6).
[c.236]
разд. 5, гл. II, п. 6).
[c.236]Хотя между коррозионной стойкостью металлов, которая характеризуется скоростью протекания термодинамически возможных электрохимических коррозионных процессов, и их термодинамическими характеристиками [например, (1 л1Лобр1 и наблюдается некоторое соответствие (щелочные и щелочноземельные металлы наименее устойчивы, а благородные металлы наиболее устойчивы), однако между ними нет простой однозначной зависимости. Металл, нестойкий в одних условиях, в других условиях часто оказывается стойким. Это обусловлено тем, что протекание термодинамически возможного процесса бывает сильно заторможено образующимися вторичными труднорастворимыми продуктами коррозии, пассивными пленками или какими-либо другими факторами. Так, термодинамически весьма неустойчивые Ti, А1 и Mg (см. табл. 28) в ряде сред коррозионностойки благодаря наступлению пассивности. [c.324]
Все элементы имеют внешние валентные оболочки с числом электронов, равным номеру группы (от 1 для щелочных металлов и до 8 у инертных газов) У щелочных и щелочноземельных металлов (I и II основные группы) внешними являются один или два -электрона, вращающиеся по круговым орбитам и обра-вующие электронные облака в форме сферического слоя. У всех элементов, начиная с III группы, р-оболочки достраиваются из шести электронов, вращающихся по эллиптическим орбитам и образующих электронные облака в форме трех перпендикулярных гантелей или шести эллипсоидов со взаимно-прямоугольными большими осями У всех элементов, начиная с III группы, достраиваются внутренние d- и /-электронные оболочки
[c.10]
У всех элементов, начиная с III группы, р-оболочки достраиваются из шести электронов, вращающихся по эллиптическим орбитам и образующих электронные облака в форме трех перпендикулярных гантелей или шести эллипсоидов со взаимно-прямоугольными большими осями У всех элементов, начиная с III группы, достраиваются внутренние d- и /-электронные оболочки
[c.10]
В состав стекла вводят нуклеаторы — вещества, образующие центры кристаллизации. Раньше в качестве нуклеаторов применяли коллоидные частицы Си, Ag, Аи, которые становились зародышами кристаллизации в результате облучения изделия проникающей радиацией (фотокерамы). Сейчас дорогой фотохимический процесс исключен в качестве нуклеаторов применяют сульфиды железа, окись титана, фториды и фосфиды щелочных и щелочноземельных металлов. [c.191]
Сильная окисляемость при высоких температурах с образованием тугоплавкой (Т л=2200°С) окисной пленки А1аОз, имеющей большую плотность по сравнению с алюминием (р=3,85 г/см ).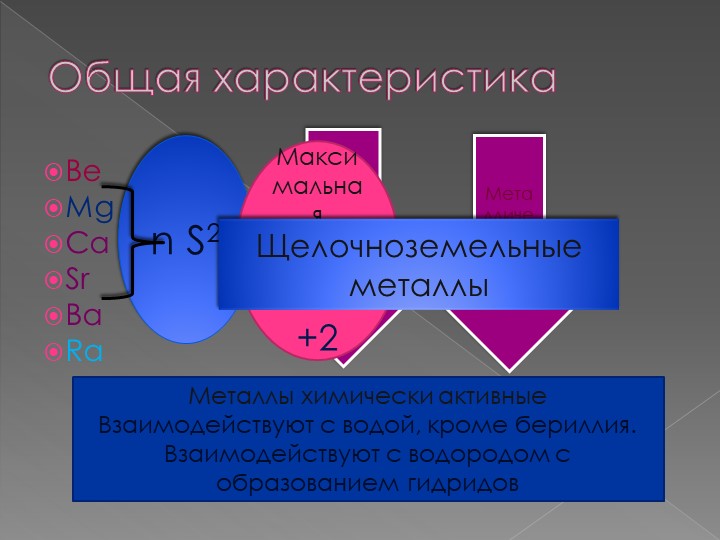 Окисная пленка затрудняет сплавление, способствует непроварам и охрупчивает металл. Поэтому окисную пленку удаляют со свариваемых кромок механическими и химическими способами перед сваркой, во время сварки защищают зону сварки инертным газом, катодным распылением, применяют покрытия и флюсы на основе солей щелочных и щелочноземельных металлов (Na l, NaF, КС1 и
[c.133]
Окисная пленка затрудняет сплавление, способствует непроварам и охрупчивает металл. Поэтому окисную пленку удаляют со свариваемых кромок механическими и химическими способами перед сваркой, во время сварки защищают зону сварки инертным газом, катодным распылением, применяют покрытия и флюсы на основе солей щелочных и щелочноземельных металлов (Na l, NaF, КС1 и
[c.133]
К органическим добавкам, подходящим для использования в противокоррозионных смазках, относятся органические амины, нафтенат цинка, различные продукты окисления нефти, соли сульфированных масел, содержащие щелочные и щелочноземельные металлы, и различные другие соединения [43]. В течение длительного времени успешно применяют ланолин, получаемый при обработке шерсти. Его активными составляющими являются высокомолекулярные жирные спирты и кислоты. Иногда в противокоррозионные смазки добавляют свинцовые мыла, которые образуют плохо растворимый Pb lj при взаимодействии с Na l, попадающим на поверхность металла при прикосновении потных рук. [c.272]
[c.272]
Успех Бальмера направил внимание исследователей на поиски сериальных зависимостей в спектрах других веществ. В первую очередь были исследованы спектры щелочных металлов, затем щелочноземельных и некоторых других элементов. Несмотря на трудность расшифровки, и здесь найдены были серии, и, что очень важно, полученные формулы очень напоминали сериальную формулу для водорода. Отличие сводится к поправочным членам а и Р, имеющим для водорода значения, равные нулю [c.716]
Спектры щелочных и щелочноземельных металлов и других элементов гораздо сложнее спектра водорода. Одним из отличий, имеющих место и в других сложных элементах, является мульти-плетный характер линий линии состоят из нескольких (две, три и более) компонент с близкими значениями частот. Частоты отдельных компонент также подчинены определенным закономерностям. Разыскивать закономерности в таких сложных спектрах нелегко, и это явилось в значительной степени делом догадки и остроумия. Благодаря работам Ридберга и других выяснились некоторые правила, помогающие обнаруживать и выделять отдельные серии. В настоящее время теория атома позволила обосновать многие такие правила. В частности, принадлежность линии к той или другой серии можно установить по характеру аномального расщепления в магнитном поле (см. 172).
[c.717]
Благодаря работам Ридберга и других выяснились некоторые правила, помогающие обнаруживать и выделять отдельные серии. В настоящее время теория атома позволила обосновать многие такие правила. В частности, принадлежность линии к той или другой серии можно установить по характеру аномального расщепления в магнитном поле (см. 172).
[c.717]
Боридный термокатод — катод на основе металлоподобных соединений типа МеВе, где iMe — щелочноземельный, редкоземельный металлы или торий. В качестве термокатода наиболее широко применяется гекса-борид лантана, реже — гексабориды иттрия и гадолиния и диборид хрома. Покрытие оксидного слоя тонкой пленкой осмия понижает работу выхода катода и увеличивает его эмиссионную способность. Термоэмиссионные катоды из гексаборида лантана работают при температуре 1650 К и обеспечивают получение плотности тока ТЭ до 50 А/см . Высокая механическая прочность и устойчивость таких катодов к ионной бомбардировке позволяет использовать их в режиме термополевой эмиссии (при напряженности внешнего электрического поля 10° В/см значительная часть эмиссионного тока обусловлена туннелированием электронов сквозь барьер).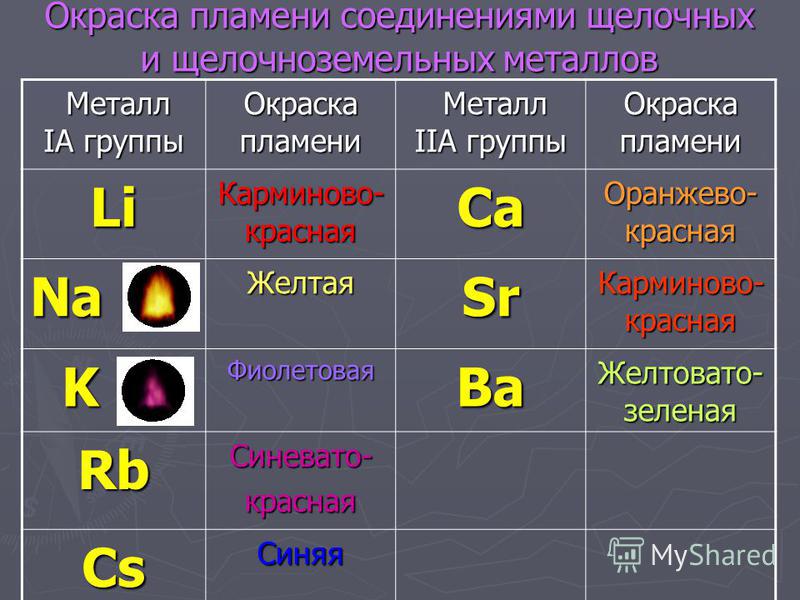 В этом режиме катод из гексаборида лантана при температуре 1400—1500 К может эмитировать ток с плотностью до 1000 A/ м . Катоды из гексаборида лантана не отравляются на воздухе и устойчиво работают в относительно плохом вакууме. Срок их службы не зависит от давления остаточных газов в приборе до давлений порядка 10 Па. Эти катоды используются в ускорителях и различных вакуумных устройствах.
[c.571]
В этом режиме катод из гексаборида лантана при температуре 1400—1500 К может эмитировать ток с плотностью до 1000 A/ м . Катоды из гексаборида лантана не отравляются на воздухе и устойчиво работают в относительно плохом вакууме. Срок их службы не зависит от давления остаточных газов в приборе до давлений порядка 10 Па. Эти катоды используются в ускорителях и различных вакуумных устройствах.
[c.571]
Ртуть и ее соединения весьма ядовиты очень вредны пары ртути. Щелочные и щелочноземельные металлы, магний, алюминий, цинк, олово, свинец, кадмий, платина, золото и серебро пастворяютс.я в ртут.и, образуя амальгамы. Слабо растворяются в ртути медь и никель. Приборы, содержащие ртуть, должны иметь металлическую арматуру из вольфрама, железа или тантала, так как эти металлы не растворимы в ртути. [c.35]
Баббит Сатко. Сплав свинца с 2% Sn и добавками малых количеств других металлов, главным образом щелочных и щелочноземельных, носит название Сатко-металла. От отечественного баббита БК2 этот сплав отличается тем, что содержит ртуть вместо натрия и дополнительные добавки алюминия, калия и лития.
[c.337]
От отечественного баббита БК2 этот сплав отличается тем, что содержит ртуть вместо натрия и дополнительные добавки алюминия, калия и лития.
[c.337]
Галлоиды взаимодействуют с бериллием при слабом нагреве. Расплавы щелочноземельных металлов с бериллием не взаимодейстпуют. [c.518]
Никель. Серебристо-белого цвета металл — Ni с температурой плавления 1452 С выпускается нескольких марок с содержанием до 99,99% Ni при использовании электровакуумной плавкп. В интервале 25— 600 С значение ТК1 = 1,55-10 Иград. Электрические свойства отожженного никеля р = 0,0683 ом-мм 1м, TKR = 6,8-10 Иград. Никель применяют в качестве оснований (кернов) оксидных катодов, которые активируют окислами в. основном щелочноземельных металлов (ВаО, SrO), с целью снижения работы выхода. Для упрочнения никеля-используют присадку марганца (2,3—5,4%) из марганцовистого никеля изготовляют прочные сетки и траверсы небольших приемно-усилительных ламп. Алюминированный никель в виде ленты, покрытой тонким слоем алюминия (8—15 мкм), обладает высоким коэффициентом теплового излучения (до 0,8) такую ленту используют для анодов небольших электронных ламп. Допустимая для никеля температура в вакууме составляет 800° С.
[c.299]
Допустимая для никеля температура в вакууме составляет 800° С.
[c.299]
Спектры щелочных металлов и щелочноземельных элементов (один и два валентных s-электрона) были уже подробно разобраны, и мы к ним возвращаться не будем. Остановимся сейчас на спектрах атомов с достраивающейся р-оболочкой, начиная с элементов с одним и двумя р-электронами. Атомы с ббльшим числом р-электронов и с замкнутой оболочкой (инертные газы) будут рассмотрены в следующих параграфах. [c.237]
Щелочноземельные металлы, подготовка к ЕГЭ по химии
К щелочноземельным металлам относятся металлы IIa группы: бериллий, магний, кальций, стронций, барий и радий. Отличаются легкостью, мягкостью и сильной реакционной способностью.
Общая характеристика
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств,
реакционная способность. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2:
- Be — 2s2
- Mg — 3s2
- Ca — 4s2
- Sr — 5s2
- Ba — 6s2
- Ra — 7s2
Природные соединения
В природе щелочноземельные металлы встречаются в виде следующих соединений:
- Be — BeO*Al2O3*6SiO2 — берилл
- Mg — MgCO3 — магнезит, MgO*Al2O3 — шпинель, 2MgO*SiO2 — оливин
- Ca — CaCO3 — мел, мрамор, известняк, кальцит, CaSO4*2H2O — гипс, CaF2 — флюорит
Получение
Это активные металлы, которые нельзя получить электролизом раствора.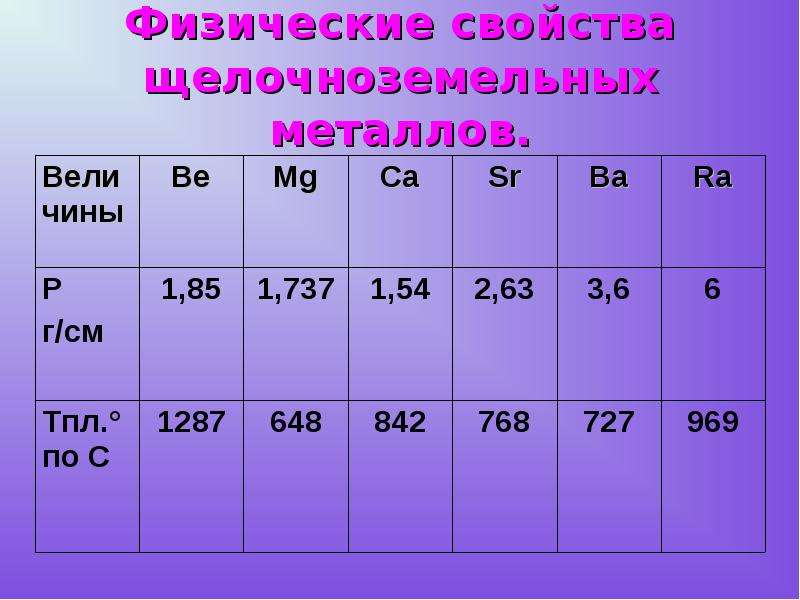 С целью их получения применяют электролиз расплавов,
алюминотермию и вытеснением их из солей другими более активными металлами.
С целью их получения применяют электролиз расплавов,
алюминотермию и вытеснением их из солей другими более активными металлами.
MgCl2 → (t) Mg + Cl2 (электролиз расплава)
CaO + Al → Al2O3 + Ca (алюминотермия — способ получения металлов путем восстановления их оксидов алюминием)
MgBr2 + Ca → CaBr2 + Mg
Химические свойства
- Реакции с водой
- Реакции с кислотами
- Реакции с неметаллами
- С оксидами других металлов
Все щелочноземельные металлы (кроме бериллия и магния) реагируют с холодной водой с образованием соответствующих гидроксидов. Магний реагирует с водой только при нагревании.
Ca + H2O → Ca(OH)2 + H2↑
Щелочноземельные металлы — активные металлы, стоящие в ряду активности левее водорода, и, следовательно, способные вытеснить водород из кислот:
Ba + HCl → BaCl2 + H2
Хорошо реагируют с неметаллами: кислородом, образуя оксиды состава RO, с галогенами (F, Cl, Br, I). Степень окисления у щелочноземельных
металлов постоянная +2.
Степень окисления у щелочноземельных
металлов постоянная +2.
Mg + O2 → MgO (оксид магния)
Ca + I2 → CaI2 (йодид кальция)
При нагревании реагируют с серой, азотом, водородом и углеродом.
Mg + S → (t) MgS (сульфид магния)
Ca + N2 → (t) Ca3N2 (нитрид кальция)
Ca + H2 → (t) CaH2 (гидрид кальция)
Ba + C → (t) BaC2 (карбид бария)
Ba + TiO2 → BaO + Ti (барий, как более активный металл, вытесняет титан)
Оксиды щелочноземельных металлов
Имеют общую формулу RO, например: MgO, CaO, BaO.
Получение
Оксиды щелочноземельных металлов можно получить путем разложения карбонатов и нитратов:
MgCO3 → (t) MgO + CO2
Ca(NO3)2 → (t 2)2 + O2
Ca(NO3)2 → (t > 560°C) CaO + O2 + NO2
Рекомендую взять на вооружение общую схему разложения нитратов:
Химические свойства
Проявляют преимущественно основные свойства, все кроме BeO — амфотерного оксида.
- Реакции с кислотами и кислотными оксидами
- Реакция с водой
- Амфотерный оксид бериллия
BaO + HCl → BaCl2 + H2O
CaO + H2SO4 → CaSO4 + H2O
MgO + SO3 → MgSO4
CaO + CO2 → CaCO3
CaO + SiO2 → CaSiO3
В нее вступают все, кроме оксида бериллия.
CaO + H2O → Ca(OH)2
MgO + H2O → Mg(OH)2
Амфотерные свойства оксида бериллия требуют особого внимания. Этот оксид проявляет двойственные свойства: реагирует с кислотами с образованием солей, и с основаниями с образованием комплексных солей.
BeO + HCl → BeCl2 + H2O
BeO + NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Если реакция проходит при высоких температурах (в расплаве) комплексная соль не образуется, так как происходит испарение воды:
BeO + NaOH → Na2BeO2 + H2O (бериллат натрия)
BeO + Na2O → Na2BeO2
Гидроксиды щелочноземельных металлов
Проявляют основные свойства, за исключением гидроксида бериллия — амфотерного гидроксида.
Получение
Получают гидроксиды в реакции соответствующего оксида металла и воды (все кроме Be(OH)2)
CaO + H2O → Ca(OH)2
Химические свойства
Основные свойства большинства гидроксидов располагают к реакциям с кислотами и кислотными оксидами.
Ba(OH)2 + H2SO4 → BaSO4↓ + H2O
Ca(OH)2 + 2CO2 → Ca(HCO3)2
Ca(HCO3)2 + Ca(OH)2 → CaCO3 + H2O + CO2
Ca(OH)2 + CO2 → CaCO3↓ + H2O
Реакции с солями (и не только) идут в том случае, если соль растворимы и по итогам реакции выделяется газ, выпадает осадок или образуется
слабый электролит (вода).
Ba(OH)2 + Na2SO4 → BaSO4↓ + NaOH
Гидроксид бериллия относится к амфотерным: проявляет двойственные свойства, реагируя и с кислотами, и с основаниями.
Be(OH)2 + HCl → BeCl2 + H2O
Be(OH)2 + NaOH → Na2[Be(OH)4]
Жесткость воды
Жесткостью воды называют совокупность свойств воды, зависящую от присутствия в ней преимущественно солей кальция и магния: гидрокарбонатов, сульфатов и хлоридов.
Различают временную (карбонатную) и постоянную (некарбонатную) жесткость.
Вероятно, вы часто устраняете жесткость воды у себя дома, осмелюсь предположить — каждый день. Временная жесткость воды устраняется обычным кипячением воды в чайнике, и известь на его стенках — CaCO3 — бесспорное доказательство устранения жесткости:
Ca(HCO3)2 → CaCO3↓ + CO2 + H2O
Также временную жесткость можно устранить, добавив Na2CO3 в воду:
Ca(HCO3)2 + Na2CO3 → CaCO3↓ + NaHCO3
С постоянной жесткостью бороться кипячением бесполезно: сульфаты и хлориды не выпадут в осадок при кипячении. Постоянную
жесткость воды устраняют добавлением в воду Na2CO3:
Постоянную
жесткость воды устраняют добавлением в воду Na2CO3:
CaCl2 + Na2CO3 → CaCO3↓ + NaCl
MgSO4 + Na2CO3 + H2O → [Mg(OH)]2CO3↓ + CO2↑ + Na2SO4
Жесткость воды можно определить с помощью различных тестов. Чрезмерно высокая жесткость воды приводит к быстрому образованию накипи на стенках котлов, труб, чайника.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Разница между щелочными металлами и щелочноземельными металлами | Сравните разницу между похожими терминами — Наука
Разница между щелочными металлами и щелочноземельными металлами — Наука
В ключевое отличие между щелочными металлами и щелочноземельными металлами заключается в том, что все щелочные металлы имеют электрон во внешней оболочке, тогда как все щелочноземельные металлы имеют два внешних электрона.
Поскольку щелочные металлы и щелочноземельные металлы являются первыми двумя группами в периодической таблице, разница между щелочными и щелочноземельными металлами представляет интерес для любого студента-химика. Щелочные металлы и щелочноземельные металлы являются элементами «S-блока», потому что элементы в обеих этих группах имеют свои внешние электроны в s-подоболочке.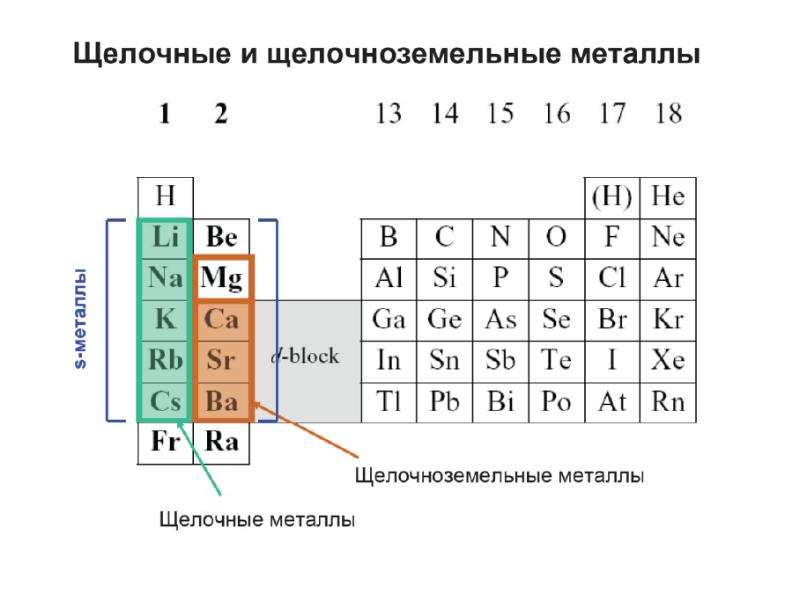
И щелочные, и щелочноземельные металлы являются хорошими проводниками электричества и тепла. Элементы этих двух групп являются наиболее химически активными металлами в периодической таблице. Их точки плавления относительно ниже, чем у других металлов. Щелочные металлы и щелочноземельные металлы обладают многими схожими свойствами, но в этой статье рассматриваются в основном их различия.
1. Обзор и основные отличия
2. Что такое щелочные металлы
3. Что такое щелочноземельные металлы
4. Параллельное сравнение — щелочные металлы и щелочноземельные металлы в табличной форме
5. Резюме
Что такое щелочные металлы?
Щелочные металлы — это элементы, присутствующие в первой группе периодической таблицы. Это литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Все они являются металлами и очень реактивными, поэтому ни один из этих металлов не встречается в природе в виде свободных металлов. Мы всегда должны хранить эти металлы в инертных жидкостях, таких как керосин, потому что они быстро вступают в реакцию с воздухом, водяным паром и кислородом воздуха. Иногда они взрывно реагируют с другими веществами. Они могут легко достичь состояния благородного газа, удалив внешний электрон валентной оболочки.
Иногда они взрывно реагируют с другими веществами. Они могут легко достичь состояния благородного газа, удалив внешний электрон валентной оболочки.
Плотность лития и натрия меньше плотности воды. Однако другие элементы более плотные, чем вода. Многие соединения щелочных металлов (NaCl, KCl, Na2CO3, NaOH) имеют большое коммерческое значение.
Что такое щелочноземельные металлы?
Щелочноземельные металлы относятся ко второй группе таблицы Менделеева. Элементы группы II включают; Бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Подобно щелочным металлам, эти элементы также не встречаются в природе свободно, и они также очень реактивны.
Рисунок 01: Атомный радиус щелочных и щелочноземельных металлов
Все элементы этой группы плотнее воды. Чистые металлы имеют серебристо-серый цвет, но они, как правило, быстро обесцвечиваются на воздухе, поскольку образуют оксидный слой на поверхности. Как и щелочные металлы, эти металлы также являются хорошими проводниками тепла и электричества. Все эти металлы имеют коммерческую ценность.
Все эти металлы имеют коммерческую ценность.
В чем разница между щелочными металлами и щелочноземельными металлами?
Щелочные металлы — это элементы, присутствующие в первой группе периодической таблицы. Щелочноземельные металлы относятся ко второй группе таблицы Менделеева. Щелочные металлы имеют электронную конфигурацию [Благородный газ] нс.1 в то время как щелочноземельные металлы имеют [благородный газ] нс2 электронная конфигурация. Что касается валентности этих металлов, все щелочные металлы имеют электрон на своей внешней оболочке. И все щелочноземельные металлы имеют два внешних электрона.
Щелочные металлы имеют ионный заряд только +1 в своих соединениях, тогда как щелочноземельные металлы имеют ионный заряд +2 в своих соединениях. Для сравнения, щелочные металлы более химически активны, чем щелочноземельные металлы. К тому же щелочные металлы очень мягкие и их можно резать острым ножом. Однако щелочноземельные металлы тверже щелочных металлов.
Резюме — Щелочные металлы против щелочноземельных металлов
Щелочные металлы и щелочноземельные металлы являются элементами группы I и группы II в периодической таблице соответственно. Наиболее существенное различие между этими двумя группами — электронная конфигурация. Он определяет валентность элементов. Следовательно, разница между щелочными металлами и щелочноземельными металлами состоит в том, что все щелочные металлы имеют электрон в своей внешней оболочке, тогда как все щелочноземельные металлы имеют два внешних электрона.
Химические свойства металлов — с чем реагируют? Свойства и таблица
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
4Li + O2 = 2Li2O
натрий образует пероксид
2Na + O2 = Na2O2
калий, рубидий и цезий — надпероксид
K + O2 = KO2
Остальные металлы с кислородом образуют оксиды:
2Mg + O2 = 2MgO
2Al + O2 = Al2O3
2Zn + O2 = 2ZnO (при нагревании)
4Cr + 3O2 = 2Cr2O3
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
Например, так делает железо:
4Fe + 3O2 (воздух) + 6H2O(влага) = 4Fe(OH)3
С галогенами металлы образуют галогениды:
2Na + Cl2 = 2NaCl
Mg + Cl2 = MgCl2
2Al + 3Br2 = 2AlBr3
Zn + Cl2 =ZnCl2
2Cr + 3Cl2 = 2CrCl3
Медный порошок реагирует с хлором и бромом (в эфире):
Cu + Cl2 = CuCl2
Cu + Br2 = CuBr2
При взаимодействии с водородом образуются гидриды:
2Na + H2 = 2NaH
Ca + H2 +СaH2
Zn + H2 =ZnH2
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
2K + S = K2S
Сa + S = CaS
2Al + 3S = Al2S3
2Cr + 3S = Cr2S3
Cu +S = CuS
Реакции с фосфором протекают до образования фосфидов (при нагревании):
3K + P = K3P
3Mg + 2P = Mg3P2
3Zn + 2P = Zn3P2
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
2Li + 2C = Li2C2
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
Ca + 2C = CaC2
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
6Li + N2 = 2Li3N
3Mg + N2 = Mg3N2
2Al + N2 = 2AlN
2Cr + N2 = 2CrN
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется h3. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
2Li + 2H2O = 2LiOH + H2
Ca + 2H2O = Ca(OH)2 + H2
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Результат данной реакции — образование оксида.
Cr + H2O = Cr2O3 + H2
Zn + H2O = ZnO + H2
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Металлы IА группы:
2K + H2SO4 (раствор) = K2SO4 + H2
8K + 5H2SO4 (конц) = 4K2SO4 + H2S + 4H2O
8Na + 10HNO3 (раствор) = 8NaNO3 + NH4NO3 + 3H2O
3Na + 4HNO3 (конц) = 3NaNO3 + NO + 2H2О
Металлы IIА группы
Mg + H2SO4 (раствор) = MgSO4 + H2
4Mg + 5H2SO4 (конц) = 4MgSO4 + H2S + 4H2O
Mg+ 4HNO3 (конц) = Mg(NO3)2 + 2NO2 + 2H2O
4Mg + 10HNO3 (раствор) = 4Mg(NO3)2 + 2N2O + 5H2O
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
2Li + 2NH3 = 2LiNH2 + H2
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C2H5OH = 2C2H5ONa + H2
2K + 2C6H5OH = 2C6H5OK + H2
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.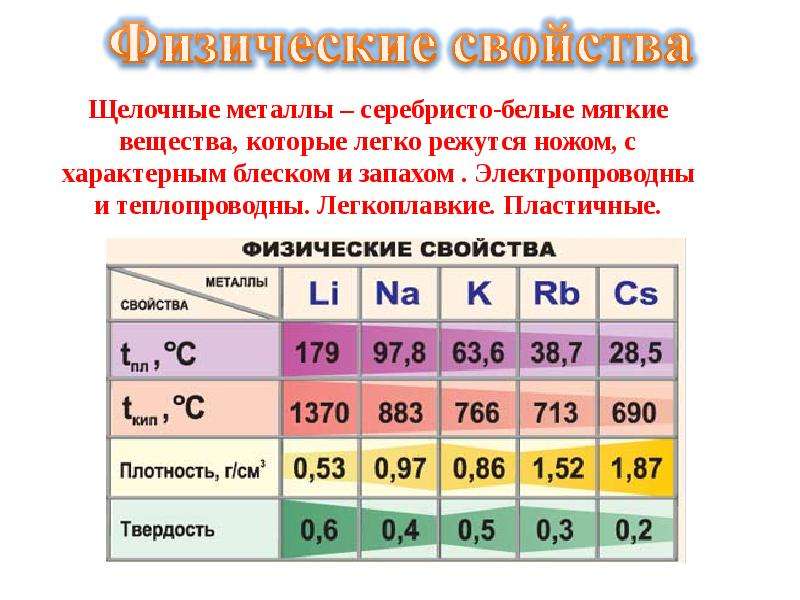
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
8Al + 3Fe3O4 = 4Al2O3 + 9Fe (алюмотермия)
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + Nh5NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Краткий конспект подготовки к ЗНО по химии №15 Щелочноземельные металлы
Физические свойства щелочноземельных металлов
Щелочноземельные металлы находятся в главной подгруппе II группы Периодической системы Д.И.Менделеева. Это магний , кальций , стронций , барий и радий .
Практически все эти элементы представляют собой твердые вещества сероватого цвета (по крайне мере, при нормальных условиях и комнатной температуре). Кстати, физические свойства щелочных металлов немного отличаются – эти вещества хотя и довольно стойкие, но легко поддаются воздействию. Интересно, что с порядковым номером в таблице растет и такой показатель металла, как плотность. Например, в этой группе наименьшим показателем обладает кальций, в то время как радий по плотности сходен с железом.
Химические свойства щелочноземельных металлов
Обнаружение ионов металла в солях.
Ионы металлов легко определить по изменению окраски пламени.
Соли щелочноземельных металлов: кальция – кирпично-красный, стронция – карминово-красный и бария – желтовато- зеленый. Соли алюминия окраску пламени не меняют. Соли щелочных и щелочноземельных металлов используются для создания фейерверков. И можно легко определить по окраске, соли какого металла применялись.
Металлы — восстановители.
Щелочные и щелочноземельные металлы, как типичные металлы проявляют ярко выраженные восстановительные свойства. У элементов главных подгрупп металлические свойства с увеличением радиуса возрастают. Особенно сильно восстановительные свойства проявляются у щелочных металлов. Настолько сильно, что практически невозможно проводить их реакции с разбавленными водными растворами, так как в первую очередь будет идти реакция взаимодействия их с водой.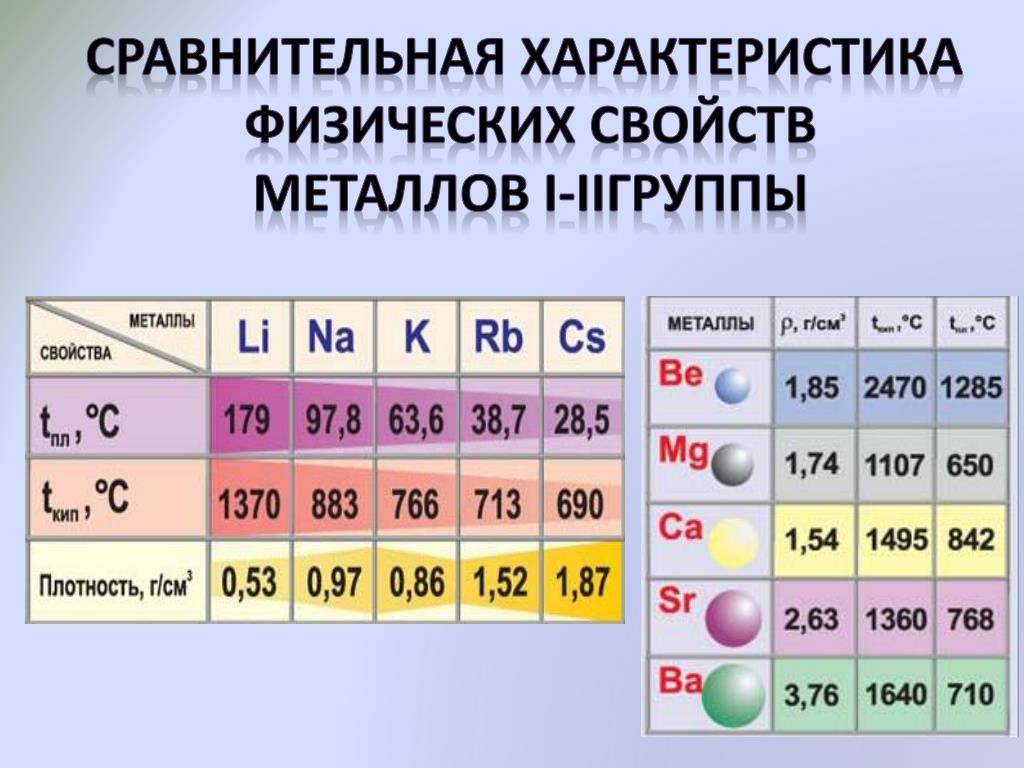 У щелочноземельных металлов ситуация аналогичная. Они тоже взаимодействуют с водой, но гораздо менее интенсивно, чем щелочные металлы.
У щелочноземельных металлов ситуация аналогичная. Они тоже взаимодействуют с водой, но гораздо менее интенсивно, чем щелочные металлы.
Их название связано с тем, что гидроксиды этих металлов являются щелочами, а оксиды раньше называли «земли». Например, оксид бария – бариевая земля. Бериллий и магний чаще всего к щелочноземельным металлам не относят. Мы не будем рассматривать и радий, так как он радиоактивный.
1. С неметаллами.
→
→
→
→
2. Взаимодействие с кислородом.
→
3. Взаимодействие с водой.
→ ↑, но взаимодействие более спокойное, чем с щелочными металлами.
4. Взаимодействие с кислотами – сильными окислителями.
(конц) →
(конц) → ↑
Получение щелочноземельных металлов
Металлический кальций и стронций получают электролизом расплава солей, чаще всего хлоридов.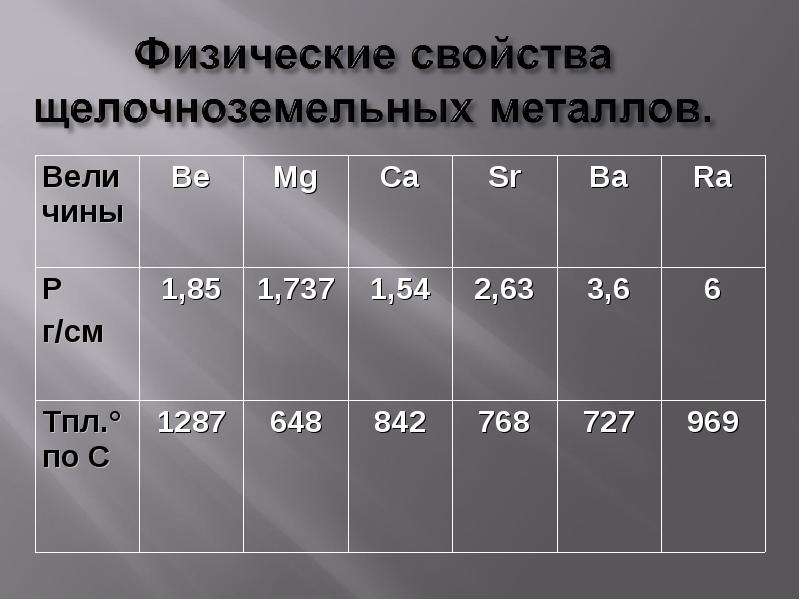
→
Барий высокой чистоты можно получить алюмотермическим способом из оксида бария.
→
Применение щелочноземельных металлов
Самыми известными соединениями щелочноземельным металлов являются: – негашеная известь. – гашеная известь или известковая вода. При пропускании углекислого газа через известковую воду происходит помутнение, так как образуется нерастворимый карбонат кальция .Но надо помнить, что при дальнейшем пропускании углекислого газа образуется уже растворимый гидрокарбонат и осадок исчезает.
→
↑ → ↓
↓ →
Гипс – это , алебастр – . Гипс и алебастр используются в строительстве, в медицине и для изготовления декоративных изделий.
Карбонат кальция образует множество различных минералов.
Фосфат кальция — фосфорит, фосфорная мука используется как минеральное удобрение.
Чистый безводный хлорид кальция – это гигроскопичное вещество, поэтому широко применяется в лабораториях как осушитель.
Карбид кальция . Его можно получить
→. Одно из его применений – это получение ацетилена.
→↑
Сульфат бария – барит. Используется как эталон белого в некоторых исследованиях.
Жесткость воды
В природной воде содержатся соли кальция и магния. Если они содержатся в заметных концентрациях, то в такой воде не мылится мыло из-за образования нерастворимых стеаратов. При её кипячении образуется накипь.
Временная жесткость обусловлена присутствием гидрокарбонатов кальция и магния и . Такую жесткость воды можно устранить кипячением.
→↓ ↑
Постоянная жесткость воды обусловлена наличием катионов , и анионов и др. Постоянная жесткость воды устраняется только благодаря реакциям ионного обмена, в результате которых ионы магния и кальция будут переведены в осадок.
→ ↓
Характерные химические свойства Be, Mg и щелочноземельных металлов » HimEge.ru
К семейству щёлочноземельных элементов относят кальций, стронций, барий и радий. Д. И. Менделеев включал в это семейство и магний. Щёлочноземельными элементы именуются по той причине, что их гидроксиды, подобно гидроксидам щелочных металлов, растворимы в воде, т. е. являются щелочами. «…Земельными же они названы потому, что в природе они встречаются в состоянии соединений, образующих нерастворимую массу земли, и сами в виде окисей RO имеют землистый вид», — пояснял Менделеев в «Основах химии».
Д. И. Менделеев включал в это семейство и магний. Щёлочноземельными элементы именуются по той причине, что их гидроксиды, подобно гидроксидам щелочных металлов, растворимы в воде, т. е. являются щелочами. «…Земельными же они названы потому, что в природе они встречаются в состоянии соединений, образующих нерастворимую массу земли, и сами в виде окисей RO имеют землистый вид», — пояснял Менделеев в «Основах химии».
Общая характеристика элементов II а группы
•Металлы главной подгруппы II группы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами.
• Легко отдают два валентных электрона, и во всех соединениях имеют степень окисления +2
• Сильные восстановители
•Активность металлов и их восстановительная способность увеличивается в ряду: Be–Mg–Ca–Sr–Ba
• К щёлочноземельным металлам относят только кальций, стронций, барий и радий, реже магний
• Бериллий по большинству свойств ближе к алюминию
Физические свойства простых веществ
Щелочноземельные металлы (по сравнению со щелочными металлами) обладают более высокими t°пл. и t°кип., потенциалами ионизации, плотностями и твердостью.
и t°кип., потенциалами ионизации, плотностями и твердостью.
Химические свойства щелочноземельных металлов + Be
1. Реакция с водой.
В обычных условиях поверхность Be и Mg покрыты инертной оксидной пленкой, поэтому они устойчивы по отношению к воде. В отличие от них Ca, Sr и Ba растворяются в воде с образованием щелочей:
Mg + 2H 2 O – t° → Mg(OH) 2 + H 2 ↑
Ca + 2H 2 O → Ca(OH) 2 + H 2 ↑
2. Реакция с кислородом.
Реакция с кислородом.
Все металлы образуют оксиды RO, барий-пероксид – BaO 2 :
2Mg + O 2 → 2MgO
Ba + O 2 → BaO 2
3. С другими неметаллами образуют бинарные соединения:
Be + Cl 2 → BeCl 2 (галогениды)
Ba + S → BaS (сульфиды)
3Mg + N 2 → Mg 3 N 2 (нитриды)
Ca + H 2 → CaH 2 (гидриды)
Ca + 2C → CaC 2 (карбиды)
3Ba + 2P → Ba 3 P 2 (фосфиды)
Бериллий и магний сравнительно медленно реагируют с неметаллами.
4. Все щелочноземельные металлы растворяются в кислотах:
Ca + 2HCl → CaCl 2 + H 2
Mg + H 2 SO 4 (разб.) → MgSO 4 + H 2
5. Бериллий растворяется в водных растворах щелочей:
Be + 2NaOH + 2H 2 O → Na 2 [Be(OH) 4 ] + H 2
6. Летучие соединения щёлочноземельных металлов придают пламени характерный цвет:
Летучие соединения щёлочноземельных металлов придают пламени характерный цвет:
соединения кальция — кирпично-красный, стронция — карминово-красный, а бария — желтовато-зелёный.
Бериллий, также как и литий, относится к числу s-элементов. Четвертый электрон, появляющийся в атоме Be, помещается на 2s-орбитали. Энергия ионизации бериллия выше, чем у лития, из-за большего заряда ядра. В сильных основаниях он образует ион-бериллат ВеО 2- 2 . Следовательно, бериллий ‑ металл, но его соединения обладают амфотерностью. Бериллий, хотя и металл, но значительно менее электроположительный, по сравнению с литием.
Высокой энергией ионизации атома бериллий заметно отличается от остальных элементов ПА-подгруппы (магния и щелочноземельных металлов). Его химия во многом сходна с химией алюминия (диагональное сходство). Таким образом, это элемент с наличием у его соединений амфотерных качеств, среди которых преобладают все же основные.
Таким образом, это элемент с наличием у его соединений амфотерных качеств, среди которых преобладают все же основные.
Электронная конфигурация Mg: 1s 2 2s 2 2p 6 3s 2 по сравнению с натрием имеет одну существенную особенность: двенадцатый электрон помещается на 2s-орбитали, где уже имеется 1е — .
Ионы магния и кальция ‑ незаменимые элементы жизнедеятельности любой клетки. Их соотношение в организме должно быть строго определённым. Ионы магния участвуют в деятельности ферментов (например, карбоксилазы), кальция – в построении скелета и обмена веществ. Повышение содержания кальция улучшает усвоение пищи. Кальций возбуждает и регулирует работу сердца. Его избыток резко усиливает деятельность сердца. Магний играет отчасти роль антагониста кальция. Введение ионов Mg
2+
под кожу вызывает наркоз без периода возбуждения, паралич мышц, нервов и сердца. Попадая в рану в форме металла, он вызывает долго незаживающие гнойные процессы. Оксид магния в лёгких вызывает так называемую литейную лихорадку. Частый контакт поверхности кожи с его соединениями приводит к дерматитам. Самые широко используемые в медицине соли кальция: сульфат СаSO
4
и хлорид CaCL
2
. Первый используется для гипсовых повязок, а второй применяется для внутривенных вливаний и как внутреннее средство. Он помогает бороться с отёками, воспалениями, аллергией, снимает спазмы сердечно-сосудистой системы, улучшает свертываемость крови.
Его избыток резко усиливает деятельность сердца. Магний играет отчасти роль антагониста кальция. Введение ионов Mg
2+
под кожу вызывает наркоз без периода возбуждения, паралич мышц, нервов и сердца. Попадая в рану в форме металла, он вызывает долго незаживающие гнойные процессы. Оксид магния в лёгких вызывает так называемую литейную лихорадку. Частый контакт поверхности кожи с его соединениями приводит к дерматитам. Самые широко используемые в медицине соли кальция: сульфат СаSO
4
и хлорид CaCL
2
. Первый используется для гипсовых повязок, а второй применяется для внутривенных вливаний и как внутреннее средство. Он помогает бороться с отёками, воспалениями, аллергией, снимает спазмы сердечно-сосудистой системы, улучшает свертываемость крови.
Все соединения бария, кроме BaSO
4
, ядовиты. Вызывают менегоэнцефалит с поражением мозжечка, поражение гладких сердечных мышц, паралич, а в больших дозах – дегенеративные изменения печени. В малых же дозах соединения бария стимулируют деятельность костного мозга.
Вызывают менегоэнцефалит с поражением мозжечка, поражение гладких сердечных мышц, паралич, а в больших дозах – дегенеративные изменения печени. В малых же дозах соединения бария стимулируют деятельность костного мозга.
При введении в желудок соединений стронция наступает его расстройство, паралич, рвота; поражения по признакам сходны с поражениями от солей бария, но соли стронция менее токсичны. Особую тревогу вызывает появление в организме радиоактивного изотопа стронция 90 Sr. Он исключительно медленно выводится из организма, а его большой период полураспада и, следовательно, длительность действия могут служить причиной лучевой болезни.
Радий опасен для организма своим излучением и огромным периодом полураспада (Т
1/2
= 1617 лет). Первоначально после открытия и получения солей радия в более или менее чистом виде его стали использовать довольно широко для рентгеноскопии, лечения опухолей и некоторых тяжёлых заболеваний. Теперь с появлением других более доступных и дешевых материалов применение радия в медицине практически прекратилось. В некоторых случаях его используют для получения радона и как добавку в минеральные удобрения.
Теперь с появлением других более доступных и дешевых материалов применение радия в медицине практически прекратилось. В некоторых случаях его используют для получения радона и как добавку в минеральные удобрения.
В атоме кальция завершается заполнение 4s-орбитали. Вместе с калием он образует пару s-элементов четвертого периода. Гидроксид кальция ‑ довольно сильное основание. У кальция — наименее активного из всех щелочноземельных металлов — характер связи в соединениях ионный.
По своим характеристикам стронций занимает промежуточное положение между кальцием и барием.
Свойства бария наиболее близки к свойствам щелочных металлов.
Бериллий и магний широко используют в сплавах. Бериллиевые бронзы – упругие сплавы меди с 0,5-3% бериллия; в авиационных сплавах (плотность 1,8) содержится 85-90% магния («электрон»). Бериллий отличается от остальных металлов ИИА группы – не реагирует с водородом и водой, зато растворяется в щелочах, поскольку образует амфотерный гидроксид:
Be+H
2
O+2NaOH=Na
2
[Be(OH)
4
]+H
2
.
Магний активно реагирует с азотом:
3 Mg + N 2 = Mg 3 N 2 .
В таблице приведена растворимость гидроксидов элементов II группы.
| Растворимость, моль/л (20 0 С) | Растворимость, г/л | |
|
Be(OH)
2
Mg(OH) 2 Ca(OH) 2 Sr(OH) 2 Ba ( OH ) 2 |
8∙10
-6
5∙10 -4 2∙10 -2 7∙10 -2 2∙10 -1 |
3,4∙10
-4
2,9∙10 -2 1,5 8,5 34,2 |
Традиционная техническая проблема –
жесткость воды
, связанная с наличием в ней ионов Mg
2+
и Ca
2+
. Из гидрокарбонатов и сульфатов на стенках нагревательных котлов и труб с горячей водой оседают карбонаты магния и кальция и сульфат кальция. Особенно мешают они работе лабораторных дистилляторов.
Из гидрокарбонатов и сульфатов на стенках нагревательных котлов и труб с горячей водой оседают карбонаты магния и кальция и сульфат кальция. Особенно мешают они работе лабораторных дистилляторов.
S-элементы в живом организме выполняют важную биологическую функцию. В таблице приведено их содержание.
Содержание S-элементов в организме человека
| Элемент | Содержание, % |
|
Li
Na K Rb Cs Be Mg Ca Sr Ba |
10
-4
0,08 0,23 10 -5 10 -4 10 -7 0,027 1,4 10 -3 10 -5 |
Во внеклеточной жидкости содержится в 5 раз больше ионов натрия, чем внутри клеток. Изотонический раствор («физиологическая жидкость») содержит 0,9% хлорида натрия, его применяют для инъекций, промывания ран и глаз и т. п. Гипертонические растворы (3-10% хлорида натрия) используют как примочки при лечении гнойных ран («вытягивание» гноя). 98% ионов калия в организме находится внутри клеток и только 2% во внеклеточной жидкости. В день человеку нужно 2,5-5 г калия. В 100 г кураги содержится до 2 г калия. В 100 г жареной картошки – до 0,5 г калия. Во внутриклеточных ферментативных реакциях АТФ и АДФ участвуют в виде магниевых комплексов.
Изотонический раствор («физиологическая жидкость») содержит 0,9% хлорида натрия, его применяют для инъекций, промывания ран и глаз и т. п. Гипертонические растворы (3-10% хлорида натрия) используют как примочки при лечении гнойных ран («вытягивание» гноя). 98% ионов калия в организме находится внутри клеток и только 2% во внеклеточной жидкости. В день человеку нужно 2,5-5 г калия. В 100 г кураги содержится до 2 г калия. В 100 г жареной картошки – до 0,5 г калия. Во внутриклеточных ферментативных реакциях АТФ и АДФ участвуют в виде магниевых комплексов.
Ежедневно человеку требуется 300-400 мг магния. Он попадает в организм с хлебом (90 мг магния на 100 г хлеба), крупой (в 100 г овсяной крупы до 115 мг магния), орехами (до 230 мг магния на 100 г орехов). Кроме построения костей и зубов на основе гидроксилапатита Ca
10
(PO
4
)
6
(OH)
2
, катионы кальция активно участвуют в свертывании крови, передаче нервных импульсов, сокращении мышц.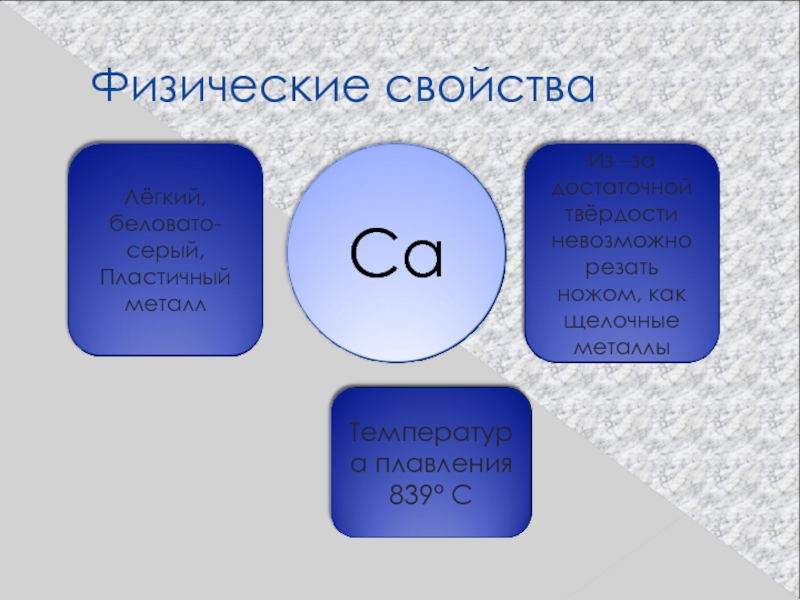 В сутки взрослому человеку нужно потреблять около 1 г кальция. В 100 г твердых сыров содержится 750 мг кальция; в 100 г молока – 120 мг кальция; в 100 г капусты – до 50 мг.
В сутки взрослому человеку нужно потреблять около 1 г кальция. В 100 г твердых сыров содержится 750 мг кальция; в 100 г молока – 120 мг кальция; в 100 г капусты – до 50 мг.
Щелочноземельный металл – обзор
6.4.5 Диффузия катионов
Экспериментальные данные по диффузии щелочных и щелочноземельных металлов (Na + , Cs + , Sr 2+ ) в глинистых материалах собраны в Рисунки 6.7–6.10. Данные по α по сравнению с ρ b, глиной показаны на рисунке 6.7, где каждая цифра соответствует разному иону. Пунктирные линии на рисунке 6.7 рассчитаны на основе предположения, что адсорбция катионов может быть описана линейным коэффициентом адсорбции K d = q / C b , что дает:
Рисунок 6.7. Экспериментальные данные по α в зависимости от ρ b, глины для (а) Na + , (б) Cs + и (в) Sr 2+ в бентоните, уравновешенном с 0,1 моль л раствора -1 NaCl (закрашенные красные символы (серые в печатных версиях)) и в глинистых породах, уравновешенных синтетическими грунтовыми водами (незакрашенные синие символы (светло-серые в печатных версиях)).
Рисунок 6.8. Экспериментальные данные d ( α )/ d (log I ) в зависимости от ρ б, глины для (а) Na + + , (б) Cs и (в) Sr 2+ в бентоните (закрашенные красные символы (серые в печатных версиях)) и в глинистых породах (открытый синий символ (светло-серые в печатных версиях)).
Рисунок 6.9. Экспериментальные данные для D a / D 0 в зависимости от ρ b, глины в бентоните для (a) Na + , (b) Cs + , (b) ) Sr 2+ (закрашенные зеленые символы (темно-серые в печатных версиях): наилучшие доступные данные ; бледно-голубые символы (серые в печатных версиях): данные, полученные без отбора проб профилей концентраций в глине ; открытые оранжевые символы (светло-серые в печатных версиях): данные, полученные методами ТД или ИД без учета влияния фильтровальных пластин ).
Рисунок 6.10. Экспериментальные данные о ( D A / D 0 ) Anion / ( D A / D 0 ) Вода в зависимости от ρ B, глина для (а) Na + , (б) Cs + и (в) Sr 2+ в бентоните (заштрихованные красные символы (темно-серые в печатных версиях)) и в глинистых породах (открыто-синий символы (светло-серые в печатных версиях)).
(6.17)α=ϕ+ρbKd
Согласно уравнению (6.17), значения катионов α должны увеличиваться с ρ b (и с ρ b,глина , если f глина фиксируется), как это наблюдается экспериментально в случае Рис 6.7. бентонита, уравновешенного 0,1 моль л -1 раствора NaCl. Пунктирные линии на рисунке 6.7 были рассчитаны с использованием значений K d , выбранных для заключения в скобки значений α в бентоните. Выходные результаты K D = 3-11 дм 3 кг -1 для Na + , 50-1000 дм 3 кг -1 для CS + и 70-220 дм 3 кг −1 для Sr 2+ .Большой диапазон значений K d , связанный с данными о диффузии Cs + , может отражать существование различных участков адсорбции на поверхности глинистых минералов с очень разным сродством к Cs + (рис. 6.2). Это может усложнить интерпретацию данных о диффузии Cs + , вызывая значительные эффекты конкуренции при адсорбции (Jakob et al., 2009) и сильное влияние концентрации цезия на диффузионные свойства Cs + (Gimmi and Kosakowski, 2011).Значения α катионов в глинистых породах примерно на порядок ниже, чем в бентоните, со значительным разбросом. Это различие согласуется с меньшей удельной поверхностью илистой фракции в глинистых породах, чем в бентоните (из-за обрушения межслоевых пространств иллита), а также с более высокими значениями ионной силы, используемой для диффузионных измерений в глинистых породах (0,1 –0,24 моль л -1 , в случае данных глинистых пород, представленных для Cs + на рисунке 6.
Выходные результаты K D = 3-11 дм 3 кг -1 для Na + , 50-1000 дм 3 кг -1 для CS + и 70-220 дм 3 кг −1 для Sr 2+ .Большой диапазон значений K d , связанный с данными о диффузии Cs + , может отражать существование различных участков адсорбции на поверхности глинистых минералов с очень разным сродством к Cs + (рис. 6.2). Это может усложнить интерпретацию данных о диффузии Cs + , вызывая значительные эффекты конкуренции при адсорбции (Jakob et al., 2009) и сильное влияние концентрации цезия на диффузионные свойства Cs + (Gimmi and Kosakowski, 2011).Значения α катионов в глинистых породах примерно на порядок ниже, чем в бентоните, со значительным разбросом. Это различие согласуется с меньшей удельной поверхностью илистой фракции в глинистых породах, чем в бентоните (из-за обрушения межслоевых пространств иллита), а также с более высокими значениями ионной силы, используемой для диффузионных измерений в глинистых породах (0,1 –0,24 моль л -1 , в случае данных глинистых пород, представленных для Cs + на рисунке 6.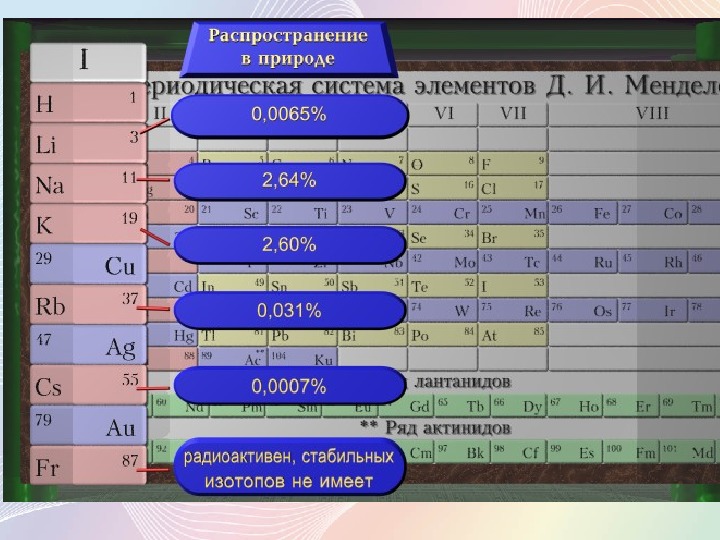 7).
7).
Экспериментальные данные по зависимости α значений катионов от солености (рисунок 6.8) показывают значительный разброс и отсутствие четкой зависимости от ρ б,глины . Средние зарегистрированные значения d (log α )/ d (log I ) для катионов в бентоните при 0,1 моль л 0,2 для Cs + и -1,2 ± 0,2 для Sr 2+ . Первые два значения согласуются с ожидаемыми на основе теории ионного обмена для реакции гомовалентного обмена ( d (log α )/ d (log I ) = -1) (Glaus et al., 2007). Среднее зарегистрированное значение для Sr 2+ значительно менее отрицательно, чем значение -2, ожидаемое для гетеровалентной реакции обмена Sr 2+ –Na + , что, возможно, указывает на то, что адсорбция Sr 2+ модулируется образование ионных пар, таких как SrHCO 3 + или SrSO 4 (Cole et al. , 2000; Appelo et al., 2010).
, 2000; Appelo et al., 2010).
Экспериментальные данные по D a / D 0 для катионов в бентоните в направлении, параллельном уплотнению, показывают сильную зависимость от ρ b, глины (рис. 6.9), как и в случае воды и анионов. Данные о соотношении ( D A / D 0 ) катион / ( D A / D 0 ) Water Показать, что наличие глиняных минералов имеет большее влияние на значения D a катионов, чем на значения воды (рис. 6.10). Соотношение ( D A / D 0 ) катион / ( D A / D 0 ) Вода по сути идентична в бентоните и глиняных породах и ρ b, глина существенно не повлияли в пределах точности экспериментальных данных.Для сравнения, модели, основанные на теориях EDL с предположением о том, что разновидности слоя Штерна (поверхностные комплексы) неподвижны, предсказывают, что / D 0 ) вода увеличивается с ρ b, глина (Shainberg and Kemper, 1966; Kim et al. , 1993), тогда как модели, учитывающие более медленную диффузию молекул воды, расположенных в прямом Связаться с глиняными минеральными поверхностями прогнозировать небольшое увеличение ( D A / D 0 ) катион / ( D A / D 0 ) Вода с ρ b, глина (Bourg et al., 2007; Бург и Спозито, 2010).
, 1993), тогда как модели, учитывающие более медленную диффузию молекул воды, расположенных в прямом Связаться с глиняными минеральными поверхностями прогнозировать небольшое увеличение ( D A / D 0 ) катион / ( D A / D 0 ) Вода с ρ b, глина (Bourg et al., 2007; Бург и Спозито, 2010).
как ρ B, глина и I Подход нуля, экспериментальные данные на ( D A / D 0 ) катион / ( D A / D 0 ) вода должны дать оценку соотношения коэффициентов диффузии катионов на поверхности глинистых минералов и в объеме жидкой воды (Bourg et al., 2007, 2008; Bourg and Sposito, 2010). Средние значения ( D A / D 0 ) катион / ( D A / D 0 ) Water сообщено на рисунке 6. 10 на ρ B, глиняная <1,2 кг ДМ -3 и I = 0 MOL L -1 равный 0,54 ± 0,13 для Na + , 0,03 ± 0,01 для CS + и 0,13 ± 0,01 для Sr 2+ . Эти значения примерно согласуются с данными по электропроводности разбавленных дисперсий смектита, согласно которым адсорбированные ионы Na + , Cs + и Ca 2+ в 0,55, 0,15 и 0,15 раза подвижнее, чем те же ионов в объемной воде соответственно (Кремерс, 1968).Эти значения также согласуются с МД-моделированием внешних базальных поверхностей Na + /Ca 2+ -смектита (где внешнесферные поверхностные комплексы Na + , основные адсорбированные виды Na + , диффузные 0,48 ± 0,08 раза так же быстро, как в объемной жидкой воде (Bourg and Sposito, 2011a)) и межслоевых нанопор Na + -смектит (где Na + , Cs + и Sr 2+ диффузные 0,24 ± 0,14, 0,06 ± 0,03 и 0,13 ± 0,07 раза быстрее, чем в объемной жидкой воде, в среднем в двух- и трехслойных гидратах (Bourg and Sposito, 2010)).
10 на ρ B, глиняная <1,2 кг ДМ -3 и I = 0 MOL L -1 равный 0,54 ± 0,13 для Na + , 0,03 ± 0,01 для CS + и 0,13 ± 0,01 для Sr 2+ . Эти значения примерно согласуются с данными по электропроводности разбавленных дисперсий смектита, согласно которым адсорбированные ионы Na + , Cs + и Ca 2+ в 0,55, 0,15 и 0,15 раза подвижнее, чем те же ионов в объемной воде соответственно (Кремерс, 1968).Эти значения также согласуются с МД-моделированием внешних базальных поверхностей Na + /Ca 2+ -смектита (где внешнесферные поверхностные комплексы Na + , основные адсорбированные виды Na + , диффузные 0,48 ± 0,08 раза так же быстро, как в объемной жидкой воде (Bourg and Sposito, 2011a)) и межслоевых нанопор Na + -смектит (где Na + , Cs + и Sr 2+ диффузные 0,24 ± 0,14, 0,06 ± 0,03 и 0,13 ± 0,07 раза быстрее, чем в объемной жидкой воде, в среднем в двух- и трехслойных гидратах (Bourg and Sposito, 2010)). Эти результаты ясно демонстрируют, что адсорбированные ионы Na + сохраняют значительную подвижность (van Schaik et al., 1966; Gimmi and Kosakowski, 2011), что противоречит предположениям нескольких исследований по моделированию (Jo et al., 2006; Leroy et al., 2006; др., 2006). Гораздо более низкая подвижность адсорбированного Cs + по сравнению с Na + может быть связана со значительными различиями в адсорбционном поведении, поскольку Na + и Cs + склонны образовывать поверхностные комплексы внешней и внутренней сфер, соответственно, на глинисто-минеральные базальные поверхности (Marry et al., 2008а; Бург и Спозито, 2011b).
Эти результаты ясно демонстрируют, что адсорбированные ионы Na + сохраняют значительную подвижность (van Schaik et al., 1966; Gimmi and Kosakowski, 2011), что противоречит предположениям нескольких исследований по моделированию (Jo et al., 2006; Leroy et al., 2006; др., 2006). Гораздо более низкая подвижность адсорбированного Cs + по сравнению с Na + может быть связана со значительными различиями в адсорбционном поведении, поскольку Na + и Cs + склонны образовывать поверхностные комплексы внешней и внутренней сфер, соответственно, на глинисто-минеральные базальные поверхности (Marry et al., 2008а; Бург и Спозито, 2011b).
Соленость практически не влияет на значения катионов, как показано на рисунке 6.11. (Однако соленость влияет на D e из-за ее влияния на α .) Такое поведение отличается от поведения анионов (рис. 6.6(c)). Это различие зависимости D a от солености для катионов и анионов согласуется с теорией Гуи-Чепмена, согласно которой соленость оказывает гораздо более сильное влияние на характерную шкалу длин, связанную с исключением анионов, чем на шкалу, связанную с адсорбцией катионов. , явление, известное как конденсация противоионов (Sposito, 2004).Экспериментальные данные по энергии активации диффузии катионов (рис. 6.12) свидетельствуют о том, что Т -зависимость D а в бентоните значительно больше, чем в объемной жидкой воде при ρ кг дм -3 , что также наблюдается для анионов на рисунке 6.6 (d). Моделирование МД предполагает, что это увеличение E a является результатом диффузии катионов, происходящей преимущественно в межслойных нанопорах (двух- и трехслойные гидраты) при ρ b,глине > 1.3 кг дм −3 и преимущественно на внешних базальных поверхностях частиц глинистых минералов при более низких степенях уплотнения (Holmboe, Bourg, 2014).
, явление, известное как конденсация противоионов (Sposito, 2004).Экспериментальные данные по энергии активации диффузии катионов (рис. 6.12) свидетельствуют о том, что Т -зависимость D а в бентоните значительно больше, чем в объемной жидкой воде при ρ кг дм -3 , что также наблюдается для анионов на рисунке 6.6 (d). Моделирование МД предполагает, что это увеличение E a является результатом диффузии катионов, происходящей преимущественно в межслойных нанопорах (двух- и трехслойные гидраты) при ρ b,глине > 1.3 кг дм −3 и преимущественно на внешних базальных поверхностях частиц глинистых минералов при более низких степенях уплотнения (Holmboe, Bourg, 2014).
Рисунок 6.11. Экспериментальные данные на D ( D A / D 0 ) / D (LOG I ) для (A) Na + , (b) CS + , и ( в) Sr 2+ , построенный в зависимости от ρ b, глины в бентоните (заштрихованные красные символы (серые в печатных версиях)) и глинистых породах (открытые синие символы (светло-серые в печатных версиях)) .
Рисунок 6.12. Экспериментальные данные по энергии активации диффузии E a в зависимости от ρ b, глина для Na + (желтые ромбы (светло-серые в печатных версиях)), Cs + (зеленые треугольники (темно-серые в печатных версиях)) и Sr 2+ (синие квадраты (серые в печатных версиях)) в бентоните.
Chem4Kids.com: Элементы и периодическая таблица: щелочноземельные металлы
Итак, мы только что рассмотрели щелочные металлы в группе I.Вы найдете щелочноземельных металлов прямо по соседству в группе II. Это второе наиболее реакционноспособное семейство 90 528 элементов в периодической таблице. Вы знаете, почему они называются щелочными или ? Когда эти соединения смешиваются в растворах, они, вероятно, образуют растворы с pH выше 7. Эти более высокие уровни pH означают, что они определяются как «основные» или «щелочные» растворы.
Кто в семье? К щелочноземельным металлам относятся: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
 Как и во всех семьях, эти элементы имеют общие черты. Хотя это семейство не так реакционноспособно, как щелочные металлы, оно умеет очень легко образовывать связи. Каждый из них имеет два электрона на внешней оболочке. Они готовы отдать эти два электрона в электровалентных/ионных связях . Иногда вы увидите их с двумя атомами галогена, как у фторида бериллия (BeF 2 ), а иногда они могут образовывать двойную связь, как у оксида кальция (CaO). Все дело в том, чтобы отказаться от этих электронов, чтобы иметь полную внешнюю оболочку.
Как и во всех семьях, эти элементы имеют общие черты. Хотя это семейство не так реакционноспособно, как щелочные металлы, оно умеет очень легко образовывать связи. Каждый из них имеет два электрона на внешней оболочке. Они готовы отдать эти два электрона в электровалентных/ионных связях . Иногда вы увидите их с двумя атомами галогена, как у фторида бериллия (BeF 2 ), а иногда они могут образовывать двойную связь, как у оксида кальция (CaO). Все дело в том, чтобы отказаться от этих электронов, чтобы иметь полную внешнюю оболочку. Когда вы дойдете до конца списка, вы найдете радиоактивный радий . Хотя радий больше не встречается в вашем доме, раньше он был ингредиентом светящихся в темноте красок. Первоначально он был смешан с сульфидом цинка (ZnS). Другие элементы встречаются во многих предметах, включая фейерверки, батареи, лампы-вспышки и специальные сплавы. Более легкие щелочноземельные металлы, такие как магний и кальций, очень важны для физиологии животных и растений. Вы все знаете, что кальций помогает строить ваши кости.Магний содержится в молекулах хлорофилла .
Вы все знаете, что кальций помогает строить ваши кости.Магний содержится в молекулах хлорофилла .
Not So Heavy Metal — Бериллий (видео НАСА)
6.10: Щелочноземельные металлы — Химия LibreTexts
Бенгальские огни дополняют торжества. Вы можете использовать их самостоятельно. Однако будьте осторожны, потому что их пламя очень горячее! Яркое белое пламя бенгальских огней образуется при горении магния. Магний — легкий металл, который горит при очень высокой температуре.Другие области применения магния включают фотосъемку со вспышкой, сигнальные ракеты и фейерверки. Магний — это металл 2-й группы периодической таблицы, о котором вы прочтете в этом разделе.
Вторая группа
Барий \(\left( \ce{Ba} \right)\) является одним из шести элементов в группе 2 периодической таблицы, которая показана ниже. Элементы этой группы называются щелочноземельными металлами . Эти металлы серебристого или серого цвета. Они относительно мягкие и имеют низкую плотность, хотя и не такие мягкие и легкие, как щелочные металлы.
Эти металлы серебристого или серого цвета. Они относительно мягкие и имеют низкую плотность, хотя и не такие мягкие и легкие, как щелочные металлы.
Реакционная способность щелочноземельных металлов
Все щелочноземельные металлы имеют схожие свойства, потому что все они имеют два валентных электрона. Они легко отдают свои два валентных электрона, чтобы достичь полного внешнего энергетического уровня, что является наиболее стабильным расположением электронов. В результате они очень реакционноспособны, хотя и не так реакционноспособны, как щелочные металлы группы 1. Например, щелочноземельные металлы будут реагировать с холодной водой, но не взрывоопасно, как щелочные металлы.Из-за своей реакционной способности щелочноземельные металлы никогда не существуют в природе в виде чистых веществ. Вместо этого они всегда встречаются в сочетании с другими элементами.
Реакционная способность щелочноземельных металлов возрастает сверху вниз группы. Это потому, что атомы становятся больше сверху вниз, поэтому валентные электроны находятся дальше от ядра. Когда валентные электроны находятся дальше от ядра, они менее сильно притягиваются ядром и легче удаляются от атома.Это делает атом более реактивным.
Это потому, что атомы становятся больше сверху вниз, поэтому валентные электроны находятся дальше от ядра. Когда валентные электроны находятся дальше от ядра, они менее сильно притягиваются ядром и легче удаляются от атома.Это делает атом более реактивным.
Примеры щелочноземельных металлов
Для лучшего понимания щелочноземельных металлов рассмотрим два из них подробнее: кальций \(\left( \ce{Ca} \right)\) и стронций \(\left( \ce{Sr} \right )\). Кальций — мягкий, серый, нетоксичный щелочноземельный металл. Хотя чистого кальция в природе не существует, соединения кальция очень распространены в земной коре и морской воде. Кальций также является наиболее распространенным металлом в организме человека, встречаясь в виде соединений кальция, таких как фосфат кальция и карбонат кальция.Эти соединения кальция находятся в костях и делают их твердыми и крепкими. Скелет среднего взрослого человека содержит около килограмма кальция. Поскольку кальций, как и барий, поглощает рентгеновские лучи, кости на рентгеновских снимках выглядят белыми. Кальций является важным компонентом здорового питания человека. Хорошие пищевые источники кальция показаны на рисунке ниже.
Кальций является важным компонентом здорового питания человека. Хорошие пищевые источники кальция показаны на рисунке ниже.
Стронций — это щелочноземельный металл серебристого цвета, который даже мягче, чем кальций.Соединения стронция довольно распространены и имеют множество применений — от фейерверков до цемента и зубной пасты. В фейерверках соединения стронция производят темно-красные взрывы. В зубной пасте, подобной той, что изображена на рисунке ниже, соединение хлорида стронция снижает чувствительность зубов.
Рисунок \(\PageIndex{3}\): Хлорид стронция, соединение, содержащееся в некоторых зубных пастах, снижает чувствительность зубов.Резюме
- Элементы группы 2 периодической таблицы называются щелочноземельными металлами.Они серебристого или серого цвета. Они также относительно мягкие и имеют низкую плотность.
- Щелочноземельные металлы очень реакционноспособны, потому что они легко отдают свои два валентных электрона для достижения полного внешнего энергетического уровня, что является наиболее стабильным расположением электронов.
 Реактивность возрастает от верха к низу группы.
Реактивность возрастает от верха к низу группы. - Примеры щелочноземельных металлов включают кальций, который необходим для крепких костей, и стронций, который используется для производства цемента и других продуктов.
Узнать больше
По следующему URL-адресу посмотрите, как четыре различных щелочноземельных металла реагируют с водой. После просмотра видео ответьте на вопросы ниже:
1. Понаблюдайте за реакциями на видео, а затем расположите щелочноземельные металлы в порядке убывания реакции с водой.
2. Чем объясняются различия в реактивности?
3. Предсказать реакцию бериллия с водой. Где бы он поместился в вашем рейтинге?
4.Какие вещества образуются в каждой реакции, которую вы наблюдали на видео?
Авторы и авторство
Щелочноземельные металлы | Encyclopedia.com
КОНЦЕПЦИЯ
Шесть щелочноземельных металлов — бериллий, магний, кальций, стронций, барий и радий — составляют группу 2 периодической таблицы элементов.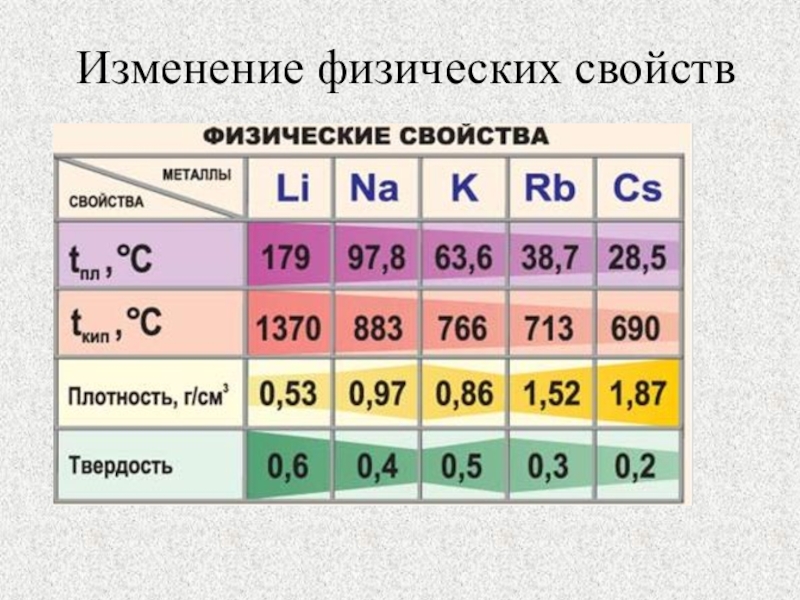 Это ставит их рядом с щелочными металлами в группу 1, и, как следует из их названий, эти два семейства имеют ряд общих характеристик, в первую очередь их высокую реакционную способность.Кроме того, подобно щелочным металлам или любому другому семейству в периодической таблице, не все члены семейства щелочных металлов созданы одинаково с точки зрения их изобилия на Земле или их полезности для жизни человека. Магний и кальций имеют ряд применений, начиная от строительства и других конструкционных приложений и заканчивая пищевыми добавками. Фактически, оба являются важными компонентами метаболизма живых существ, в том числе человеческого тела. Барий и бериллий имеют множество специализированных применений в различных областях, от ювелирных изделий до медицины, а стронций в основном используется в фейерверках.Радий, с другой стороны, редко используется вне лабораторий, в основном потому, что его радиоактивные свойства представляют опасность для жизни человека.
Это ставит их рядом с щелочными металлами в группу 1, и, как следует из их названий, эти два семейства имеют ряд общих характеристик, в первую очередь их высокую реакционную способность.Кроме того, подобно щелочным металлам или любому другому семейству в периодической таблице, не все члены семейства щелочных металлов созданы одинаково с точки зрения их изобилия на Земле или их полезности для жизни человека. Магний и кальций имеют ряд применений, начиная от строительства и других конструкционных приложений и заканчивая пищевыми добавками. Фактически, оба являются важными компонентами метаболизма живых существ, в том числе человеческого тела. Барий и бериллий имеют множество специализированных применений в различных областях, от ювелирных изделий до медицины, а стронций в основном используется в фейерверках.Радий, с другой стороны, редко используется вне лабораторий, в основном потому, что его радиоактивные свойства представляют опасность для жизни человека.
КАК ЭТО РАБОТАЕТ
Определение семейства
Выражение «семейство элементов» относится к группам элементов периодической таблицы, которые имеют общие характеристики. К ним относятся (в дополнение к щелочноземельным металлам и щелочным металлам) переходные металлы, галогены, инертные газы, лантаноиды и актиноиды. (Все они рассматриваются в отдельных эссе в этой книге.) Кроме того, есть несколько более крупных категорий общих черт, которые часто пересекаются по семейным линиям; таким образом, все элементы классифицируются как металлы, металлоиды и неметаллы. (Они также обсуждаются в отдельных очерках, в которых упоминаются «сироты» или элементы, не принадлежащие ни к одной из упомянутых выше семей.)
К ним относятся (в дополнение к щелочноземельным металлам и щелочным металлам) переходные металлы, галогены, инертные газы, лантаноиды и актиноиды. (Все они рассматриваются в отдельных эссе в этой книге.) Кроме того, есть несколько более крупных категорий общих черт, которые часто пересекаются по семейным линиям; таким образом, все элементы классифицируются как металлы, металлоиды и неметаллы. (Они также обсуждаются в отдельных очерках, в которых упоминаются «сироты» или элементы, не принадлежащие ни к одной из упомянутых выше семей.)
внешние, наблюдаемые характеристики, а также поведение части электронов в атомных структурах элементов.Например, металлы, составляющие подавляющее большинство элементов периодической таблицы, имеют тенденцию быть блестящими, твердыми и ковкими (то есть они могут гнуться, не ломаясь). Многие из них плавятся при довольно высоких температурах, и практически все они испаряются (становятся газами) при высоких температурах. Металлы также образуют ионные связи, самую тесную форму химической связи.
ЭЛЕКТРОННЫЕ КОНФИГУРАЦИИ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ.
Что касается семейств, существуют определенные наблюдаемые свойства, которые заставляли химиков в прошлом объединять щелочноземельные металлы в группы.Эти свойства будут обсуждаться применительно к щелочноземельным металлам, но следует подчеркнуть еще один момент в отношении деления элементов на семейства. С прогрессом в понимании, который последовал за открытием электрона в 1897 году, наряду с развитием квантовой теории в начале двадцатого века, химики разработали более фундаментальное определение семейства с точки зрения электронной конфигурации.
Как уже отмечалось, семейство щелочноземельных металлов занимает вторую группу или столбец периодической таблицы.Все элементы в той или иной группе, независимо от их кажущихся различий, имеют общую закономерность в конфигурации своих
валентные электроны — электроны «снаружи» атома, участвующие в химической связи. (Напротив, основные электроны, которые занимают более низкие области энергии внутри атома, не играют никакой роли в связывании элементов. )
)
Все члены семейства щелочноземельных металлов имеют конфигурацию валентных электронов s 2 . Это означает, что два электрона вовлечены в химическую связь и что эти электроны движутся по орбитали или диапазону вероятностей, примерно соответствующему сфере.Орбитальная структура s соответствует первому из нескольких подуровней основного энергетического уровня.
Каким бы ни был номер главного энергетического уровня, соответствующего периоду или строке периодической таблицы, атом имеет одинаковое количество подуровней. Таким образом, бериллий в Периоде 2 имеет два главных энергетических уровня, и его валентные электроны находятся на подуровне 2 s 2 . На другом конце группы находится радий, относящийся к периоду 7. Хотя радий намного сложнее бериллия и имеет семь энергетических уровней вместо двух, тем не менее он имеет ту же конфигурацию валентных электронов, только на более высоком энергетическом уровне: 7 с. 2 .
ГЕЛИЙ И ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ.
Если изучить конфигурации валентных электронов элементов периодической таблицы, можно заметить удивительную симметрию и порядок. Все члены группы, хотя их основные энергетические уровни различаются, имеют общие характеристики в структуры их валентных оболочек. Кроме того, для восьми групп, пронумерованных в североамериканской версии периодической таблицы, номер группы соответствует количеству валентных электронов.
Есть только одно исключение: гелий с валентной электронной конфигурацией 1 s 2 обычно помещается в группу 8 с благородными газами.Основываясь на этой конфигурации s 2 , может показаться логичным разместить гелий поверх бериллия в семействе щелочноземельных металлов; но есть несколько причин, почему это не делается. Во-первых, гелий явно не металл. Что еще более важно, гелий ведет себя совершенно иначе, чем щелочноземельные металлы.
В то время как гелий, как и остальные благородные газы, обладает высокой устойчивостью к химическим реакциям и связыванию, щелочноземельные металлы известны своей высокой реакционной способностью, т. е. тенденцией к установлению или разрыву связей между атомами или молекулами, так что материалы трансформируются.(Аналогичная взаимосвязь существует в группе 1, в которую входят водород и щелочные металлы. Все они имеют одинаковую валентную конфигурацию, но водород никогда не включается в семейство щелочных металлов.)
е. тенденцией к установлению или разрыву связей между атомами или молекулами, так что материалы трансформируются.(Аналогичная взаимосвязь существует в группе 1, в которую входят водород и щелочные металлы. Все они имеют одинаковую валентную конфигурацию, но водород никогда не включается в семейство щелочных металлов.)
Характеристики щелочноземельных металлов
Аналогично щелочные металлы, щелочноземельные металлы обладают свойствами основания, в отличие от кислоты. Щелочноземельные металлы блестящие, и большинство из них белого или серебристого цвета. Как и их «собратья» по семейству щелочных металлов, при нагревании они светятся характерными цветами.Кальций светится оранжевым, стронций — очень ярко-красным, а барий — яблочно-зеленым. Физически они мягкие, хотя и не такие мягкие, как щелочные металлы, многие из которых можно резать ножом.
Еще одно сходство щелочноземельных металлов с щелочными металлами заключается в том, что четыре из них — магний, кальций, стронций и барий — были идентифицированы или выделены в первом десятилетии девятнадцатого века английским химиком сэром Хамфри. Дэви (1778-1829). Примерно в то же время Дэви также выделил натрий и калий из семейства щелочных металлов.
Дэви (1778-1829). Примерно в то же время Дэви также выделил натрий и калий из семейства щелочных металлов.
РЕАКТИВНОСТЬ.
Щелочноземельные металлы менее реакционноспособны, чем щелочные металлы, но, как и щелочные металлы, они гораздо более реакционноспособны, чем большинство элементов. Опять же, как и их «собратья», они реагируют с водой с образованием газообразного водорода и гидроксида металла, хотя их реакции менее выражены, чем у щелочных металлов. Металлический магний в чистом виде горюч, а на воздухе он горит интенсивным белым светом, соединяясь с кислородом с образованием оксида магния.Точно так же кальций, стронций и барий реагируют с кислородом с образованием оксидов.
Из-за высокой реакционной способности щелочноземельные металлы редко встречаются в природе сами по себе; скорее, они обычно встречаются с другими элементами в форме соединений, часто в виде карбонатов или сульфатов. Это, опять же, еще одно сходство с щелочными металлами. Но в то время как щелочные металлы склонны образовывать катионы 1+ (положительно заряженные атомы), щелочноземельные металлы образуют катионы 2+, то есть катионы с положительным зарядом 2.
ТЕМПЕРАТУРЫ КИПЕНИЯ И ПЛАВЛЕНИЯ.
Щелочноземельные металлы отличаются от щелочных металлов точками плавления и кипения — теми температурами, при которых твердый металл превращается в жидкость, а жидкий металл — в пар. Для щелочных металлов температуры кипения и плавления уменьшаются с увеличением атомного номера. Однако картина не столь ясна для щелочноземельных металлов.
Самые высокие температуры плавления и кипения у бериллия, который действительно имеет самый низкий атомный номер.Он плавится при 2348,6°F (1287°C) и кипит при 4789,8°F (2471°C). Эти цифры намного выше, чем у лития, щелочного металла того же периода, что и бериллий, который плавится при 356,9°F (180,5°C) и кипит при 2457°F (1347°C).
Магний, второй щелочноземельный металл, плавится при 1202°F (650°C) и кипит при 1994°F (1090°C) — значительно более низкие показатели, чем у бериллия. Однако температуры плавления и кипения выше у кальция, третьего из щелочноземельных металлов, с цифрами 1547. 6°F (842°C) и 2703,2°F (1484°C) соответственно. Температуры плавления и кипения неуклонно снижаются по мере повышения уровня энергии стронция, бария и радия, однако эти температуры никогда не бывают ниже, чем для магния.
6°F (842°C) и 2703,2°F (1484°C) соответственно. Температуры плавления и кипения неуклонно снижаются по мере повышения уровня энергии стронция, бария и радия, однако эти температуры никогда не бывают ниже, чем для магния.
ИЗОБИЛИЕ.
Из щелочноземельных металлов наиболее распространен кальций. Он занимает пятое место среди элементов земной коры, составляя 3,39% массы элемента. Он также занимает пятое место по распространенности в организме человека с долей 1,4%. Магний, входящий в состав 1.93% земной коры, является восьмым по распространенности элементом на Земле. Он занимает седьмое место в организме человека, составляя 0,50% массы тела.
Барий занимает семнадцатое место среди элементов в земной коре, хотя на его долю приходится всего 0,04% массы элемента. Ни он, ни остальные три щелочных металла не появляются в организме в незначительных количествах: действительно, барий и бериллий ядовиты, а радий настолько радиоактивн, что воздействие его может быть чрезвычайно вредным.
В земной коре стронций присутствует в количестве 360 частей на миллион (частей на миллион), что на самом деле довольно много по сравнению с рядом элементов.В океане его присутствие составляет около 8 частей на миллион. Напротив, содержание бериллия в земной коре измеряется в частях на миллиард (частей на миллиард) и оценивается в 1900 частей на миллиард. Значительно более редким является радий, который составляет всего 0,6 части на триллион земной коры — факт, который сделал его выделение франко-польским физиком и химиком Марией Кюри (1867–1934) еще более впечатляющим.
ПРИМЕНЕНИЕ В РЕАЛЬНОЙ ЖИЗНИ
Бериллий
В восемнадцатом веке французский минералог Рене Жюст-Хаюи (1743-1822) заметил, что и изумруды, и минералы берилла обладают схожими свойствами.Французский химик Луи-Николя Воклен (1763–1829) в 1798 году определил общий для них элемент: бериллий (Be), имеющий атомный номер 4 и атомную массу 9,01 а.е.м. Прошло около трех десятилетий, прежде чем немецкому химику Фридриху Вёлеру (1800–1882) и французскому химику Антуану Бюсси (1794–1882), работавшим независимо друг от друга, удалось выделить этот элемент.
Бериллий содержится в основном в изумрудах и аквамаринах, оба драгоценных камня являются формами соединения бериллия алюмосиликата берилла.Хотя он токсичен для человека, бериллий, тем не менее, находит применение в сфере здравоохранения: поскольку он пропускает больше рентгеновских лучей, чем стекло, бериллий часто используется в рентгеновских трубках.
Металлические сплавы, содержащие около 2 % бериллия, имеют тенденцию быть особенно прочными, устойчивыми к износу и стабильными при высоких температурах. Медно-бериллиевые сплавы, например, применяются в ручных инструментах для производств, использующих легковоспламеняющиеся растворители, так как инструменты из этих сплавов не дают искр при ударе друг о друга.Сплавы бериллия и никеля применяются для специальных электрических соединений, а также для высокотемпературных применений.
Магний
Английский ботаник и врач Неемия Грю (1641-1712) в 1695 году обнаружил сульфат магния в родниках недалеко от английского города Эпсом, графство Суррей. Это соединение, называемое с тех пор «солями Эпсома», давно известно своей лечебной ценностью. Английская соль используется для лечения эклампсии, состояния, которое вызывает судороги у беременных женщин. Соединение также является сильным слабительным и иногда используется для избавления организма от ядов, таких как родственный элемент магния, барий.
Это соединение, называемое с тех пор «солями Эпсома», давно известно своей лечебной ценностью. Английская соль используется для лечения эклампсии, состояния, которое вызывает судороги у беременных женщин. Соединение также является сильным слабительным и иногда используется для избавления организма от ядов, таких как родственный элемент магния, барий.
Некоторое время ученые путали оксидное соединение магнезии с известью или карбонатом кальция, что на самом деле включает в себя другой щелочноземельный металл. В 1754 году шотландский химик и физик Джозеф Блэк (1728–1799) написал «Опыты над магнезией, альбой, негашеной известью и некоторыми другими щелочными веществами», важную работу, в которой он различал магнезию и известь. Дэви в 1808 году объявил магнезию оксидом нового элемента, который он назвал магнием, но прошло около 20 лет, прежде чем Бюсси удалось выделить этот элемент.
Магний (Mg) имеет атомный номер 12 и атомную массу 24,31 а.е.м. Он содержится в основном в таких минералах, как доломит и магнезит, оба из которых являются карбонатами; а в карналлите — хлорид. Силикаты магния включают асбест, мыльный камень или тальк и слюду. Не все формы асбеста содержат магний, но тот факт, что многие из них содержат магний, лишь показывает, как химические реакции могут изменить свойства элемента, которым он обладает сам по себе.
Силикаты магния включают асбест, мыльный камень или тальк и слюду. Не все формы асбеста содержат магний, но тот факт, что многие из них содержат магний, лишь показывает, как химические реакции могут изменить свойства элемента, которым он обладает сам по себе.
ВАЖНАЯ КОМПОНЕНТА ЗДОРОВЬЯ.
В то время как магний легко воспламеняется, асбест когда-то использовался в больших количествах в качестве антипирена. И хотя асбест был в значительной степени удален из общественных зданий по всей территории Соединенных Штатов из-за сообщений о связи воздействия асбеста с раком, магний является важным компонентом здоровья живых организмов. Он играет важную роль в хлорофилле, зеленом пигменте растений, который улавливает энергию солнечного света, и по этой причине он также используется в удобрениях.
В организме человека ионы магния (заряженные атомы) помогают процессу пищеварения, поэтому многие люди принимают минеральные добавки, содержащие магний, иногда в сочетании с кальцием. Существует также его использование в качестве слабительного, о чем уже упоминалось. Английская соль, как и подобает ее щелочному или щелочному свойству, чрезвычайно горька — такое вещество человек принимает внутрь только в условиях крайней необходимости. С другой стороны, магнезиальное молоко является слабительным с гораздо менее неприятным вкусом.
Существует также его использование в качестве слабительного, о чем уже упоминалось. Английская соль, как и подобает ее щелочному или щелочному свойству, чрезвычайно горька — такое вещество человек принимает внутрь только в условиях крайней необходимости. С другой стороны, магнезиальное молоко является слабительным с гораздо менее неприятным вкусом.
МАГНИЙ ИДЕТ НА ВОЙНУ.
Отличительной чертой химической универсальности магния является то, что этот же элемент, столь важный для сохранения жизни, также широко используется в войне.Незадолго до Первой мировой войны Германия была ведущим производителем магния во многом благодаря методу электролиза, разработанному немецким химиком Р. В. Бунзеном (1811–1899). Когда Соединенные Штаты начали войну против Германии, американские компании начали производство магния в больших количествах.
Бунзен обнаружил, что порошкообразный магний горит ярко-белым пламенем, а на войне магний использовался в сигнальных ракетах, трассирующих пулях и зажигательных бомбах, которые воспламеняются и сгорают при ударе. Яркий свет, получаемый при сжигании магния, также нашел применение в мирное время, например, в фейерверках и вспышках, используемых в фотографии.
Яркий свет, получаемый при сжигании магния, также нашел применение в мирное время, например, в фейерверках и вспышках, используемых в фотографии.
Магний участвовал в другой мировой войне. К тому времени, когда нацистские танки вошли в Польшу в 1939 году, немецкий военно-промышленный комплекс начал использовать этот металл для производства самолетов и другой военной техники. Америка снова запустила свою собственную машину военного производства, резко увеличив производство магния до пика почти в 184 000 тонн (166 924 800 кг) в 1943 году.
ПРИМЕНЕНИЕ В КОНСТРУКЦИЯХ.
Магний в основном использовался в Первой мировой войне из-за его зажигательных свойств, но во Второй мировой войне он в основном использовался в качестве конструкционного металла. Он легкий, но прочнее на единицу массы, чем любой другой обычный конструкционный металл. Как металл для строительных машин и другого оборудования магний по популярности уступает только железу и алюминию (плотность которого примерно на 50% больше, чем у магния).
Автомобильная промышленность является одной из областей производства, особенно заинтересованной в структурных качествах магния.По обе стороны Атлантики автопроизводители используют или тестируют автомобильные детали из сплавов магния и других металлов, прежде всего алюминия. Магний легко отливается в сложные конструкции, что может означать сокращение количества деталей, необходимых для сборки автомобиля, и, следовательно, оптимизацию процесса сборки.
Среди видов спортивного инвентаря, в которых используются магниевые сплавы, есть маски для бейсбольных мячей, лыжи, гоночные автомобили и даже подковы. Различные марки лестниц, переносных инструментов, электронного оборудования, биноклей, фотоаппаратов, мебели и багажа также используют детали из этого легкого и прочного металла.
Кальций
Дэви выделил кальций (Ca) с помощью электролиза в 1808 году. Элемент, название которого происходит от латинского calx, или «известь», имеет атомный номер 20 и атомную массу 40,08. . Основными источниками кальция являются известняк и доломит, оба из которых являются карбонатами, а также сульфатный гипс.
. Основными источниками кальция являются известняк и доломит, оба из которых являются карбонатами, а также сульфатный гипс.
В виде известняка и гипса кальций использовался в качестве строительного материала с древних времен и продолжает находить применение в этой области.Известь смешивают с глиной для получения цемента, а цемент смешивают с песком и водой для приготовления раствора. Кроме того, при смешивании с песком, гравием и водой из цемента получается бетон. Мрамор, который когда-то использовался для строительства дворцов, а сегодня используется в основном для декоративных целей, также содержит кальций.
Сталелитейная, стекольная, бумажная и металлургическая промышленность используют гашеную известь (гидроксид кальция) и негашеную известь или оксид кальция. Он помогает удалить примеси из стали и загрязняющие вещества из дымовых труб, а карбонат кальция в бумаге обеспечивает гладкость и непрозрачность готового продукта.При добавлении карбида кальция (CaC 2 ) в воду образуется легковоспламеняющийся газ ацетилен (C 2 H 2 ), используемый в сварочных горелках. В различных соединениях кальций используется как отбеливатель; материал в производстве удобрений; и как заменитель соли в качестве плавящего средства на обледенелых дорогах.
В различных соединениях кальций используется как отбеливатель; материал в производстве удобрений; и как заменитель соли в качестве плавящего средства на обледенелых дорогах.
В пищевой, косметической и фармацевтической промышленности кальций используется в антацидах, зубной пасте, жевательной резинке и витаминах. В еще большей степени, чем магний, кальций важен для живых существ и присутствует в листьях, костях, зубах, раковинах и кораллах.В организме человека он помогает свертыванию крови, сокращению мышц и регуляции сердцебиения. Содержащийся в зеленых овощах и молочных продуктах кальций (наряду с добавками кальция) рекомендуется для профилактики остеопороза. Последнее, состояние, связанное с потерей плотности костей, особенно затрагивает пожилых женщин и приводит к тому, что кости становятся хрупкими и легко ломаются.
Стронций
Ирландский химик и врач Адэр Кроуфорд (1748-1795) и шотландский химик и хирург Уильям Камберленд Круикшенк (1790-1800) в 1790 году открыли то, что Кроуфорд назвал «новым видом земли» недалеко от Стронтиана в Шотландии. Год спустя английский химик Томас Чарльз Хоуп (1766-1844) приступил к изучению руды, найденной Кроуфордом и Круикшенком, которую они назвали стронцией.
Год спустя английский химик Томас Чарльз Хоуп (1766-1844) приступил к изучению руды, найденной Кроуфордом и Круикшенком, которую они назвали стронцией.
В отчетах, подготовленных в 1792 и 1793 годах, Хоуп объяснил, что стронций можно отличить от извести или гидроксида кальция на с одной стороны, и барит или гидроксид бария, с другой, благодаря его реакции на испытания пламенем. В то время как кальций давал красное пламя, а барий — зеленое, стронций светился ярко-красным, легко отличимым от более темного красного цвета кальция.
И снова именно Дэви выделил новый элемент с помощью электролиза в 1808 году. Впоследствии названный стронцием (Sr), его атомный номер 38, а атомная масса 87,62. Серебристо-белый, он быстро окисляется на воздухе, образуя бледно-желтую оксидную корку на любой свежесрезанной поверхности.
Хотя он обладает свойствами, подобными свойствам кальция, сравнительная редкость стронция и затраты на его извлечение не предлагают экономических стимулов для использования его вместо гораздо более распространенного родственного элемента.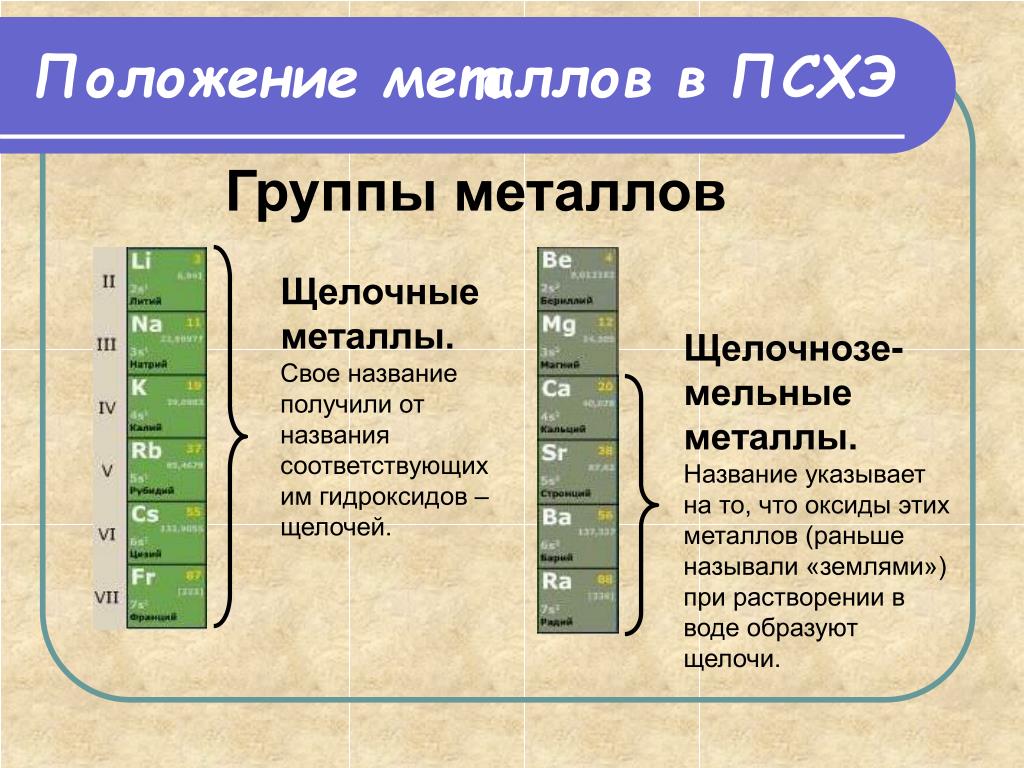 Тем не менее, у стронция есть несколько применений, в первую очередь из-за его яркого малинового пламени. Поэтому он применяется при изготовлении фейерверков, сигнальных ракет и трассирующих пуль, то есть снарядов, излучающих свет при полете по воздуху.
Тем не менее, у стронция есть несколько применений, в первую очередь из-за его яркого малинового пламени. Поэтому он применяется при изготовлении фейерверков, сигнальных ракет и трассирующих пуль, то есть снарядов, излучающих свет при полете по воздуху.
Одним из наиболее противоречивых «применений» стронция был радиоактивный изотоп стронций-90, побочный продукт испытаний ядерного оружия в атмосфере с конца 1940-х годов. Изотоп выпал на землю в виде мелкого порошка, покрыл траву, был проглочен коровами и в конце концов оказался в производимом ими молоке.Из-за своего сходства с кальцием изотоп попал в зубы и десны детей, которые пили молоко, что вызвало проблемы со здоровьем, которые помогли положить конец атмосферным испытаниям в начале 1960-х годов.
Барий
История бария аналогична истории других щелочноземельных металлов. В восемнадцатом веке химики были убеждены, что оксид бария и оксид кальция представляют собой одно и то же вещество, но в 1774 году шведский химик Карл Вильгельм Шееле (1742–1786) продемонстрировал, что оксид бария представляет собой отдельное соединение. Дэви выделил этот элемент, как и два других щелочноземельных металла, с помощью электролиза в 1808 году.
Дэви выделил этот элемент, как и два других щелочноземельных металла, с помощью электролиза в 1808 году.
Барий (Ba) имеет атомную массу 137,27 и атомный номер 56. сульфат и витерит, карбонат. Сульфат бария используется в качестве белого пигмента в красках, а карбонат бария применяется в производстве оптического стекла, керамики, глазури. гончарные и специальные изделия из стекла. Одно из его наиболее важных применений — это смазка буровых долот, известная как «грязь» или суспензия, для бурения нефтяных скважин.Как и ряд родственных элементов, барий (в форме нитрата бария) используется в фейерверках и сигнальных ракетах. В моющих средствах для моторных масел для поддержания чистоты двигателей используются оксид бария и гидроксид бария.
Бериллий — не единственный щелочноземельный металл, используемый для получения рентгеновских лучей, а магний — не единственный член семейства, применяемый в качестве слабительного. Барий используется в клизмах, а сульфат бария используется для покрытия внутренней оболочки кишечника, что позволяет врачу исследовать пищеварительную систему пациента. (Хотя барий ядовит, в форме сульфата бария он безопасен для приема внутрь, поскольку это соединение не растворяется в воде или других жидкостях организма). который поглощает большую часть излучения, испускаемого рентгеновским аппаратом. Это добавляет контраста черно-белому рентгеновскому снимку, позволяя врачу поставить более информативный диагноз.
(Хотя барий ядовит, в форме сульфата бария он безопасен для приема внутрь, поскольку это соединение не растворяется в воде или других жидкостях организма). который поглощает большую часть излучения, испускаемого рентгеновским аппаратом. Это добавляет контраста черно-белому рентгеновскому снимку, позволяя врачу поставить более информативный диагноз.
Радий
Сегодня радий (Ra; атомный номер 88; атомная масса 226 а.е.м.) практически не используется вне научных исследований; тем не менее, история его открытия Марией Кюри и ее мужем Пьером (1859–1906), французским физиком, представляет собой захватывающую главу не только в истории химии, но и в истории человечества в целом.Вдохновленная открытием французским физиком Анри Беккерелем (1852-1908) радиоактивных свойств урана, Мария Кюри увлеклась предметом радиоактивности, по которому написала докторскую диссертацию. Отправившись на поиски других радиоактивных элементов, она и Пьер переработали большое количество урановой смолы, руды, обычно встречающейся в урановых рудниках. В течение года они обнаружили
элемент полоний, но были убеждены, что другой радиоактивный ингредиент присутствует, хотя и в гораздо меньших количествах, в обманке.
В течение года они обнаружили
элемент полоний, но были убеждены, что другой радиоактивный ингредиент присутствует, хотя и в гораздо меньших количествах, в обманке.
Кюри потратили большую часть своих сбережений на покупку тонны руды и начали работу по извлечению достаточного количества гипотетического элемента 88 для годной к употреблению пробы — 0,35 унции (1 г). Работая практически без перерыва в течение четырех лет, Кюри, к тому времени уставшие и испытывавшие финансовые затруднения, наконец произвели необходимое количество радия. Их состояние должно было улучшиться: в 1903 году они разделили Нобелевскую премию по физике с Беккерелем, а в 1911 году Мари получила вторую Нобелевскую премию, на этот раз по химии, за открытие полония и радия.Она единственный человек в истории, получивший Нобелевскую премию в двух разных научных категориях.
Однако, поскольку Кюри не удалось запатентовать свой процесс, они не получили прибыли от многочисленных «центров радия», которые вскоре возникли, рекламируя недавно открытый элемент как лекарство от рака.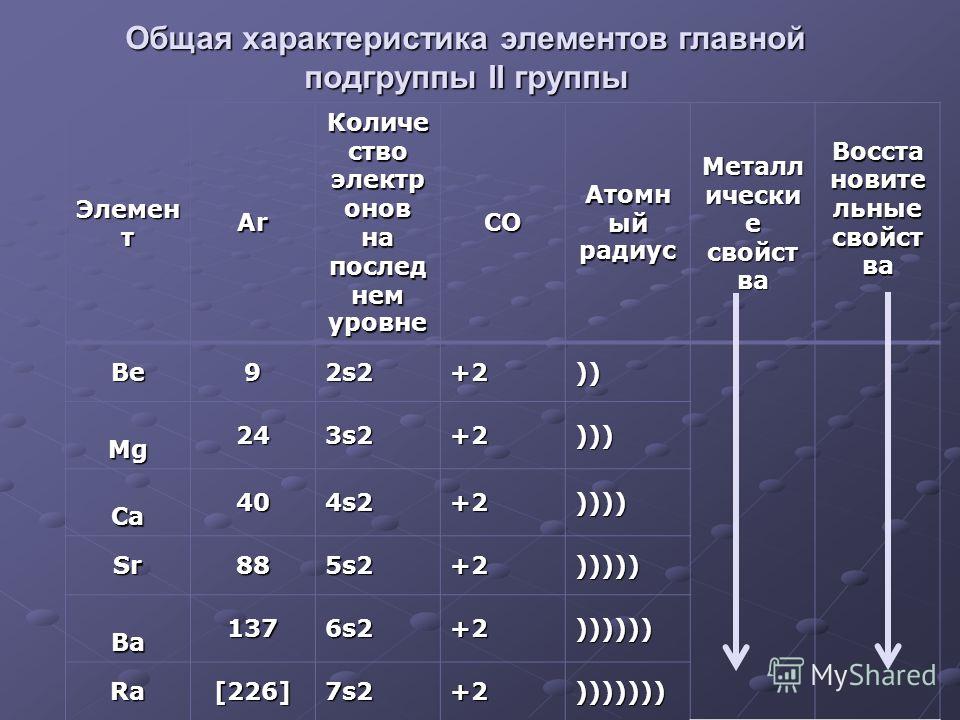 На самом деле, как оказалось, опасности, связанные с этим высокорадиоактивным веществом, перевешивают любые преимущества. Таким образом, радий, который когда-то использовался в светящейся краске и на циферблатах часов, был постепенно выведен из употребления.Смерть Марии Кюри от лейкемии в 1934 году наступила в результате длительного воздействия радиации радия и других элементов.
На самом деле, как оказалось, опасности, связанные с этим высокорадиоактивным веществом, перевешивают любые преимущества. Таким образом, радий, который когда-то использовался в светящейся краске и на циферблатах часов, был постепенно выведен из употребления.Смерть Марии Кюри от лейкемии в 1934 году наступила в результате длительного воздействия радиации радия и других элементов.
ГДЕ УЗНАТЬ БОЛЬШЕ
«Щелочноземельные металлы». ChemicalElements.com (веб-сайт).
«Щелочноземельные металлы» (веб-сайт).
Эббинг, Даррелл Д.; Р.А. Д. Вентворт; и Джеймс П. Бирк. Введение в химию. Бостон: Houghton Mifflin, 1995.
Керрод, Робин. Материя и материалы. Иллюстрировано Терри Хэдлером. Тарритаун, Нью-Йорк: Benchmark Books, 1996.
Мебейн, Роберт С. и Томас Р. Райболт. Металлы. Иллюстрации Анни Матсик. Нью-Йорк: Twenty-First Century Books, 1995.
Иллюстрации Анни Матсик. Нью-Йорк: Twenty-First Century Books, 1995.
Окслейд, Крис. Металл. Чикаго, Иллинойс: Библиотека Хайнемана, 2001.
Снедден, Роберт. Материалы. Des Plaines, IL: Heinemann Library, 1999.
«Визуальные элементы: группа 1 — щелочноземельные металлы» (веб-сайт).
КЛЮЧЕВЫЕ ТЕРМИНЫ
ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ:
Группа 2 периодической таблицы элементов с конфигурациями валентных электронов n s 2 . Шесть щелочноземельных металлов, все из которых обладают высокой химической активностью, — это бериллий, магний, кальций, стронций, барий и радий.
ЩЕЛОЧНЫЕ МЕТАЛЛЫ:
Элементы 1-й группы периодической таблицы элементов, за исключением водорода. Все щелочные металлы имеют один валентный электрон на s1-орбитали и обладают высокой реакционной способностью.
КАТИОН:
Положительный ион, который образуется, когда атом теряет один или несколько электронов. Все щелочноземельные металлы имеют тенденцию образовывать катионы 2+ (произносится как KAT-ieunz).
Все щелочноземельные металлы имеют тенденцию образовывать катионы 2+ (произносится как KAT-ieunz).
ЭЛЕКТРОЛИЗ:
Использование электрического тока для проведения химической реакции.
ION:
Атом или группа атомов, которые потеряли или приобрели один или несколько электронов и, таким образом, имеют суммарный электрический заряд.
ИЗОТОПЫ:
Атомы, имеющие одинаковое количество протонов и, следовательно, принадлежащие к одному и тому же элементу, но различающиеся по количеству нейтронов. Это приводит к разнице масс. Изотопы могут быть как стабильными, так и нестабильными, то есть радиоактивными. Так обстоит дело с изотопами радия, радиоактивного члена семейства щелочноземельных металлов.
ОРБИТАЛЬНЫЙ:
Схема вероятностей относительно положения электрона для анатома в определенном энергетическом состоянии.Все шесть щелочноземельных металлов имеют валентные электроны на орбите s 2 , которая описывает более или менее сферическую форму.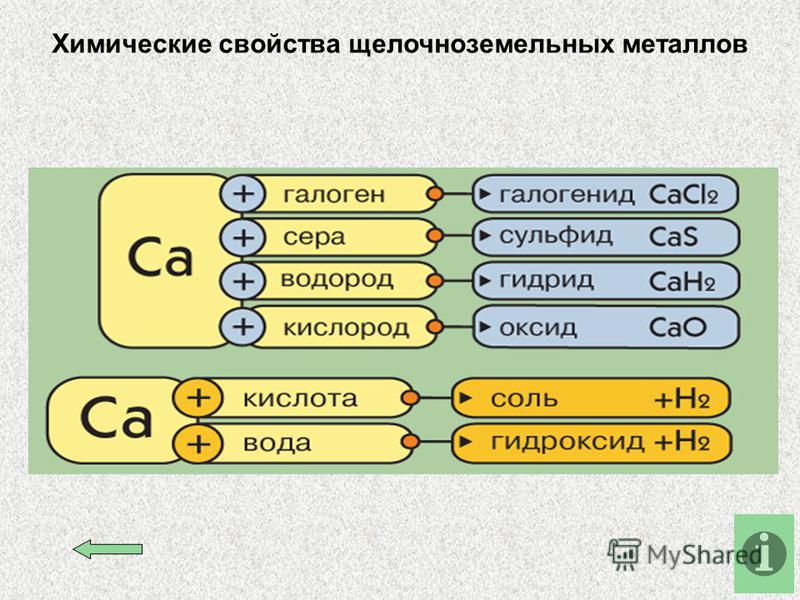
ПЕРИОДЫ:
Строки периодической таблицы элементов. Они представляют последовательные главные энергетические уровни в атомах вовлеченных элементов.
ОСНОВНОЙ ЭНЕРГЕТИЧЕСКИЙ УРОВЕНЬ:
Значение, указывающее расстояние, на которое электрон может удалиться от ядра анатома. Это обозначается целым числом, начиная с 1 и двигаясь вверх.Чем выше главный энергетический уровень, тем больше энергия атома и тем сложнее структура орбиталей.
РАДИОАКТИВНОСТЬ:
Термин, описывающий явление, при котором некоторые материалы подвергаются распаду, вызванному испусканием высокоэнергетических частиц. «Распад» в этом смысле не означает «гниение»; вместо этого радиоактивные изотопы продолжают превращаться в другие изотопы, пока не станут стабильными.
РЕАКЦИОННАЯ СПОСОБНОСТЬ:
Тенденция образования или разрыва связей между атомами или молекулами таким образом, что материалы трансформируются.
СОЛЬ:
Вообще говоря, соединение, которое объединяет металл и неметалл. В частности, соли (вместе с водой) являются продуктом реакции между кислотой и основанием.
В частности, соли (вместе с водой) являются продуктом реакции между кислотой и основанием.
ОБОЛОЧКА:
Группа электронов на одном главном энергетическом уровне.
ПОДУРОВЕНЬ:
Область внутри основного энергетического уровня, занятого электронами в анатоме. Каким бы ни было число n основного энергетического уровня, существует n подуровней.На каждом основном энергетическом уровне первым заполняется подуровень, соответствующий орбитальной модели s , где все щелочноземельные металлы имеют свои валентные электроны.
ВАЛЕНТНЫЕ ЭЛЕКТРОНЫ:
Электроны, занимающие высшие энергетические уровни в анатомическом организме и участвующие в химической связи.
Части периодической таблицы
Группа 2A (или IIA ) периодической таблицы являются щелочными
земные металлы : бериллий (Be), магний (Mg), кальций (Ca),
стронций (Sr), барий (Ba) и радий (Ra).Они тяжелее и
менее реакционноспособны, чем щелочные металлы группы 1А. Имя приходит
от того, что оксиды этих металлов давали основные растворы
при растворении в воде и оставались твердыми при температурах
доступны древним алхимикам. Как и элементы группы 1А,
Щелочноземельные металлы слишком реакционноспособны, чтобы их можно было найти в природе.
элементарная форма.
Имя приходит
от того, что оксиды этих металлов давали основные растворы
при растворении в воде и оставались твердыми при температурах
доступны древним алхимикам. Как и элементы группы 1А,
Щелочноземельные металлы слишком реакционноспособны, чтобы их можно было найти в природе.
элементарная форма.
Щелочноземельные металлы имеют два валентных электрона на орбиталях с наивысшей энергией. ( нс 2 ).Они меньше, чем щелочные металлы тот же период и, следовательно, имеют более высокие энергии ионизации. В большинстве случаев щелочноземельные металлы ионизируются. для формирования заряда 2+.
Щелочноземельные металлы имеют гораздо более высокую температуру плавления, чем щелочные
металлы: бериллий плавится при 1287С, магний при 649С, кальций при 839С,
стронций при 768°С, барий при 727°С и радий при 700°С. Они есть
более твердые металлы, чем элементы группы 1А, но мягкие и легкие
по сравнению со многими переходными металлами.
Соли металлов 2А группы менее растворимы в воде, чем соли Группа 1А из-за более высокой плотности заряда на катионах 2+; тем не менее, многие соли группы 2А, по крайней мере, умеренно растворимы. Некоторые соли группы 2А прочно связываются с молекулами воды и кристаллизуются в виде гидратов ; среди них английская соль, MgSO 4 7H 2 O и гипс, CaSO 4 2H 2 О.
Бериллий (Be, Z=4).
Бериллий — серебристо-белый мягкий металл. Его название происходит от
греческое слово, обозначающее минерал берилл, beryllo . Он находится в
земной коры с концентрацией 2,6 промилле, что делает ее 47-й по величине
обильный элемент. Первичные руды
бериллия берилл [алюмосиликат бериллия, Be 3 Al 2 (SiO 3 ) 6 ]
и бертрандит [гидроксид силиката бериллия, Be 4 Si 2 O 7 (OH) 2 ]. Бериллы драгоценного качества включают изумруды и аквамарины; зеленый цвет
этих драгоценных камней происходит из следовых количеств хрома.
Бериллы драгоценного качества включают изумруды и аквамарины; зеленый цвет
этих драгоценных камней происходит из следовых количеств хрома.
Из-за небольшого размера и высокой плотности заряда бериллий через ковалентную связь вместо ионной связи. Элементаль бериллий очень инертен по отношению к воздуху и воде даже при высоких температурах. температуры.
Бериллий используется для изготовления окон для рентгеновских трубок (это прозрачен для рентгеновских лучей) и используется в сплавах с другими металлами, такими как медь и никель для изготовления искробезопасных инструментов и часовых пружин. Бериллий также используется в корпусах ядерного оружия и в атомной промышленности. электростанции из-за его способности отражать нейтроны. Бериллий накапливается в костях; Длительное воздействие бериллия приводит к воспаление в легких и одышка (состояние, называемое бериллиозом).
Магний (Mg, Z=12).
Магний — относительно мягкий металл серебристо-белого цвета. Название элемента происходит от
Магнезия, район в Фессалии в центральной Греции.Он находится в
земная кора с концентрацией 2,3%, что делает ее 7-й по величине
обильный элемент. Большое количество магния также содержится в
полезных ископаемых в мантии Земли. Получают из морской воды, карналита
[MgKCl 3 6H 2 O], доломит
[смесь карбонатов кальция и магния, CaMg(CO 3 ) 2 ],
и магнезит [карбонат магния, MgCO 3 ].
Название элемента происходит от
Магнезия, район в Фессалии в центральной Греции.Он находится в
земная кора с концентрацией 2,3%, что делает ее 7-й по величине
обильный элемент. Большое количество магния также содержится в
полезных ископаемых в мантии Земли. Получают из морской воды, карналита
[MgKCl 3 6H 2 O], доломит
[смесь карбонатов кальция и магния, CaMg(CO 3 ) 2 ],
и магнезит [карбонат магния, MgCO 3 ].
Магний, легированный алюминием и следами других металлов, используется в автомобилестроение и авиастроение; магниевые сплавы также используются в других легкие устройства, такие как лестницы, камеры, велосипедные рамы, жесткий диск приводы и т.д.Магний легче окисляется, чем железо, и используется в жертвенных анодах для защиты железных труб и других структуры, которые легко подвергаются коррозии.
Магний горит на воздухе ярко
белое пламя,
и используется в фейерверках и зажигательных бомбах. (Это было
используется в одноразовых лампах-вспышках, но это использование было вытеснено другими
виды освещения.) Магниевые костры очень трудно зажечь
наружу, так как даже в отсутствие воздуха горящий магний вступает в реакцию с
азот с образованием нитрида магния (Mg 3 N 2 ) и
с водой для получения гидроксида магния и газообразного водорода.
(Это было
используется в одноразовых лампах-вспышках, но это использование было вытеснено другими
виды освещения.) Магниевые костры очень трудно зажечь
наружу, так как даже в отсутствие воздуха горящий магний вступает в реакцию с
азот с образованием нитрида магния (Mg 3 N 2 ) и
с водой для получения гидроксида магния и газообразного водорода.
Магний содержится в ряде известных соединений. Магний
оксид MgO используется в огнеупорных кирпичах, способных
выдерживать высокие температуры в каминах и печах (магниевый
оксид плавится при 2800 С). Гептагидрат сульфата магния, MgSO 4 7H 2 O,
более известная как английская соль, является
миорелаксант и мягкое слабительное. Гидроксид магния, Mg(OH) 2 ,
также известный как молоко магнезии, является слабительным и антацидом.
(«Молоко» в «молоке магнезии» относится к тому факту, что, поскольку магний
гидроксид плохо растворяется в воде, имеет тенденцию образовывать известковую, белую
суспензия, похожая на молоко, но со значительно
физиологические эффекты. )
)
Зеленые растения содержат молекулу под названием хлорофилл, состоящий из плоского кольца атомов углерода и азота с большим открытым пространством посередине, в котором связан ион магния, удерживается на месте атомами азота.То молекула хлорофилла поглощает солнечный свет, и в процессе фотосинтеза, энергия света превращается в химическую энергии, которую завод может использовать для питания множества процессов.
В органической химии магний реагирует с бромалканами.
(углеводороды, содержащие бромуглеродные связи) с образованием магнийорганических соединений
известны как реактивы Гриньяра (по имени их первооткрывателя Виктора
Гриньяр, получивший Нобелевскую премию по химии в 1912 г.).Эти соединения чрезвычайно полезны при формировании
новый углерод-углерод
связи и часто используются в синтезе органических соединений. Известно, что реактивы Гриньяра чувствительны к воде, поэтому необходимо соблюдать осторожность.
удостовериться, что аппарат, в котором идет реакция,
проведено очень сухо.
Кальций (Ca, Z=20).
Кальций — относительно мягкий металл серебристого цвета. Название элемента происходит от Латинское слово, обозначающее известь, calx .Он находится в земная кора с концентрацией 4,1%, что делает ее пятой по величине обильный элемент. Основными источниками кальция являются кальцит и известняк. [карбонат кальция, CaCO 3 ], ангидрит [кальций сульфат, CaSO 4 ], гипс [дигидрат сульфата кальция, CaSO 4 2H 2 O], и доломит [смесь карбонатов кальция и магния, CaMg(CO 3 ) 2 ].
Соли кальция образуют твердые части тела большинства живых существ. существ, из раковин морских организмов и кораллов кораллов рифы (в виде кальция карбонат, CaCO 3 ) к костям и зубам наземных существ (в виде гидроксиапатита кристаллы, Ca 3 (PO 4 ) 2 ] 3 Ca(OH) 2 ).
Поскольку кальций образует такие твердые минералы, он полезен в строительстве. материалов, таких как гипс, раствор и цемент. Раствор изготавливается из оксида кальция CaO, также известного как известь или негашеная известь. При взаимодействии оксида кальция с водой образуется гидроксид кальция.
Ca(OH) 2 или гашеная известь, которая поглощает углекислый газ из
на воздухе и постепенно образует карбонат кальция CaCO 3 .
Известь, нагретая водородом, горящим в кислороде, горит ярко-белым цветом.
свет, который можно сфокусировать в узкий пучок, видимый на большой
расстояния.Такое освещение использовалось на маяках, в
съемки, а в театрах производить прожекторы (оставляя актера «в
в центре внимания»).
материалов, таких как гипс, раствор и цемент. Раствор изготавливается из оксида кальция CaO, также известного как известь или негашеная известь. При взаимодействии оксида кальция с водой образуется гидроксид кальция.
Ca(OH) 2 или гашеная известь, которая поглощает углекислый газ из
на воздухе и постепенно образует карбонат кальция CaCO 3 .
Известь, нагретая водородом, горящим в кислороде, горит ярко-белым цветом.
свет, который можно сфокусировать в узкий пучок, видимый на большой
расстояния.Такое освещение использовалось на маяках, в
съемки, а в театрах производить прожекторы (оставляя актера «в
в центре внимания»).
Хлорид кальция расплывается (он поглощает достаточное количество воды из
воздух, который он растворяет в растворе), и используется для удаления влаги
с воздуха в сырых подвалах. (Потребуется более сильный человек
что я не могу назвать только что открытую коробку с хлоридом кальция,
не вел себя должным образом как «несовершеннолетний распутник». «)
«)
«Жесткая вода» содержит растворенные минералы, имеющие 2+ или 3+ заряда, такие как кальций и магний; эти соли вызывают некоторые мыла и моющие средства, выпадающие в осадок в виде «мыльной пены»; эти минералы осаждаются со временем образует «накипь» в воде обогреватели и кастрюли. Кальций можно удалить водой умягчители, которые обменивают ионы кальция на ионы натрия, которые имеют 1+ заряжается и не выпадает в осадок.
Стронций (Sr, Z=38).
Стронций — блестящий, относительно мягкий металл. Название элемента происходит от Стронтиан — город в Шотландии, где добывали минерал стронтианит. открыт, из которого впервые был выделен стронций. Он находится в земная кора с концентрацией 370 частей на миллион, что делает ее 16-й по величине обильный элемент. Встречается в рудах целестита [стронция сульфат, SrSO 4 ] и стронцианит [карбонат стронция, SrCO 3 ].
Соли стронция при нагревании окрашиваются в ярко-красный цвет. по этой причине используется в фейерверках и сигнальных ракетах. Радиоактивный
стронций-90 (бета-излучатель) образуется при ядерных взрывах; поскольку
он химически похож на кальций, он включается в кости
у людей, подвергающихся его воздействию. Стронций-90 является бета-излучателем,
и препятствует выработке эритроцитов.
по этой причине используется в фейерверках и сигнальных ракетах. Радиоактивный
стронций-90 (бета-излучатель) образуется при ядерных взрывах; поскольку
он химически похож на кальций, он включается в кости
у людей, подвергающихся его воздействию. Стронций-90 является бета-излучателем,
и препятствует выработке эритроцитов.
Барий (Ba, Z=56).
Барий — блестящий мягкий металл. Название элемента происходит от греческое слово барыс , что означает «тяжелый», по отношению к высокая плотность некоторых минералов бария. Он находится в земная кора с концентрацией 500 частей на миллион, что делает ее 14-й по величине обильный элемент. Встречается в баритовых рудах [сульфат бария, BaSO 4 ] и витерит [карбонат бария, BaCO 3 ].
Барий был обнаружен в
1500-х годов в виде «болонских камней» (теперь известных как бариевые
сульфат, BaSO 4 ), обнаруженный недалеко от Болоньи, Италия. Эти
камни светились в присутствии света, а также при нагревании.
Соли бария при нагревании окрашиваются в зеленый цвет и используются в
фейерверки (в виде нитрата бария, Ba(NO 3 ) 2 ).
Эти
камни светились в присутствии света, а также при нагревании.
Соли бария при нагревании окрашиваются в зеленый цвет и используются в
фейерверки (в виде нитрата бария, Ba(NO 3 ) 2 ).
Сульфат бария, BaSO 4 , ядовит, но это так нерастворимым, что он проходит через тело до любого поглощения может иметь место барий.Используется в диагностике некоторых проблемы с кишечником в виде «бариевых клизм»: сульфат бария непрозрачен для рентгеновских лучей и может быть использован для рентгенографии пищеварительного тракта. тракт.
Радий (Ra, Z=88).
Радий — мягкий, блестящий, радиоактивный металл. Название элемента
произошло от латинского слова «луч», радиус , из-за его
способность светиться в темноте слабым голубым светом.Он находится в
земной коры с концентрацией 0,6 ppt (частей на триллион), что делает ее
84-й самый распространенный элемент. Он содержится в следовых количествах в
урановых руд, но коммерчески используемый радий легче получить из
отработавшее ядерное топливо.
Радий был обнаружен Пьером и Марией Кюри в 1898 году; они извлекли миллиграмм радия из трех тонн урановой руды. Радий производится в радиоактивный распад урана-235, урана-238, тория-232 и плутоний-241.После его открытия и до опасностей радиация была понята, радий использовался во многих шарлатанских лекарствах и патентованные лекарства. Радий использовался для изготовления часов, светящихся в темноте. лица в начале 1900-х годов; альфа-частицы, испускаемые радием ударил частицы сульфида цинка, заставив их светиться, но был остановлен по корпусу часов по стеклу циферблата. Многие из рабочие, расписывавшие эти циферблаты, заболели или умерли от лучевая болезнь.
Каталожные номера
Джон Эмсли, Элементы , 3-е издание. Оксфорд: Clarendon Press, 1998.
. Джон Эмсли, Строительные блоки природы:
Путеводитель по элементам от А до Я . Оксфорд: Оксфордский университет
Пресс, 2001.
Дэвид Л. Хейзерман, Исследование Химические элементы и их соединения . Нью-Йорк: TAB Книги, 1992.
Гиперглоссарий MSDS: Щелочные земли
Гиперглоссарий MSDS: Щелочные землиОпределение
Щелочная земля — это любой элемент во втором столбце периодической таблицы. Эти элементы включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra): 90 027.
Не путайте этот термин со словом «щелочной», которое относится к основному веществу (с pH выше 7) или со щелочным металлом.
Дополнительная информация
Щелочноземельные элементы встречаются во многих распространенных материалах. Например, ионы кальция являются основным компонентом ваших костей, магний используется в различных металлических сплавах, стронций используется в телевизионных трубках, а соединения бария используются в качестве рентгеноконтрастных веществ. Радий — очень редкий радиоактивный материал. Бериллий является токсичным и канцерогенным материалом, требующим специального обращения.
Бериллий является токсичным и канцерогенным материалом, требующим специального обращения.
Ca, Sr и Ba реагируют с воздухом и водой в своей элементарной (металлической) форме, но гораздо меньше, чем их аналоги из щелочных металлов.Эта реактивность увеличивается по мере продвижения вниз по колонке от Са к Ва. Реакцию элементарных Ca, Sr и Ba с водой можно резюмировать приведенным ниже химическим уравнением, где M = щелочноземельный металл.
M(s) + 2 H 2 O M 2+ (водн.) + 2 HO — (водн.) + H 2 (г)
В некоторых случаях тепло этой реакции может воспламенить газообразный водород (H 2 ), который выделяется в ходе реакции.
Хотя эти металлы блестят при резке, на воздухе они тускнеют.Кальций, барий и стронций следует хранить в инертной атмосфере и/или в минеральном масле.
Обратите внимание, что существует большая разница между щелочноземельным металлом (таким как Ca) и катионом щелочноземельного металла (таким как Ca 2+ ). Опасности часто зависят от химического состояния материала!
Опасности часто зависят от химического состояния материала!
Актуальность паспорта безопасности
Бериллий токсичен как в элементарной форме, так и в солях/соединениях, таких как Be 2+ , поэтому необходимо использовать специальные меры предосторожности, такие как респираторы, всякий раз, когда возможен выброс пыли или паров Be или его соединений.См. приведенные ниже ссылки для получения дополнительной информации. Все другие щелочные металлы легко воспламеняются и реагируют с водой, поэтому при их использовании необходимо соблюдать особую осторожность, и должен быть доступен надлежащий огнетушитель класса D.
Elemental Mg, Ca, Ba и Sr несовместимы с некоторыми классами химикатов, такими как галогенированные растворители. Дополнительную информацию см. в примечаниях к щелочным металлам.
Дополнительное чтение
См. также: щелочной металл, галоген, инертный, реагирующий с водой.
Дополнительные определения от Google и OneLook.
Последнее обновление записи: суббота, 1 февраля 2020 г. Эта страница защищена авторским правом 2000-2022 ILPI. Несанкционированное копирование или размещение на других веб-сайтах строго запрещено. Присылайте предложения, комментарии и новые пожелания (укажите URL-адрес, если применимо) нам по электронной почте.
Заявление об отказе от ответственности : Информация, содержащаяся в данном документе, считается достоверной и точной, однако ILPI не дает никаких гарантий относительно правдивости любого утверждения.Читатель использует любую информацию на этой странице на свой страх и риск. ILPI настоятельно рекомендует читателю проконсультироваться с соответствующими местными, государственными и федеральными агентствами по вопросам, обсуждаемым здесь.
Щелочные и щелочноземельные металлы
Элементы первой группы периодической таблицы (за исключением водорода — см. ниже) известны как щелочные металлы , потому что они образуют щелочные растворы при взаимодействии с водой. В эту группу входят элементы литий , натрий , калий , рубидий , цезий и франций . Каждый из этих элементов имеет только один валентный электрон, а это означает, что они образуют только слабые металлические связи. В результате они относительно мягкие и имеют низкую температуру плавления.
В эту группу входят элементы литий , натрий , калий , рубидий , цезий и франций . Каждый из этих элементов имеет только один валентный электрон, а это означает, что они образуют только слабые металлические связи. В результате они относительно мягкие и имеют низкую температуру плавления.
Единственный валентный электрон легко теряется, что делает эти металлы очень реакционноспособными. Они энергично реагируют как с воздухом, так и с водой — например, когда натрий вступает в контакт с водой, он бурно реагирует с образованием гидроксида натрия и водорода.Тепло реакции фактически воспламеняет водород! Щелочные металлы также легко соединяются с элементами семнадцатой группы ( хлор , фтор , бром и т. д.) с образованием устойчивых ионных соединений , таких как хлорид натрия.
Щелочные металлы (выделены) занимают первую группу в периодической таблице.
Вторая группа периодической таблицы включает элементы бериллий , магний , кальций , стронций , барий и радий .Элементы этой группы, все блестящие и серебристо-белые на вид, известны как щелочноземельные металлы . Как и щелочные металлы, они образуют щелочные растворы при взаимодействии с водой. Термин «земля» исторический; это было общее название, используемое алхимиками для оксидов этих элементов (которые одно время считались самостоятельными элементами).
Все элементы второй группы имеют и два электронов на внешней оболочке.Таким образом, металлические связи в щелочноземельных металлах прочнее, чем в щелочных металлах, что приводит к более высоким температурам плавления, но они все еще достаточно реакционноспособны, поскольку два внешних электрона легко теряются.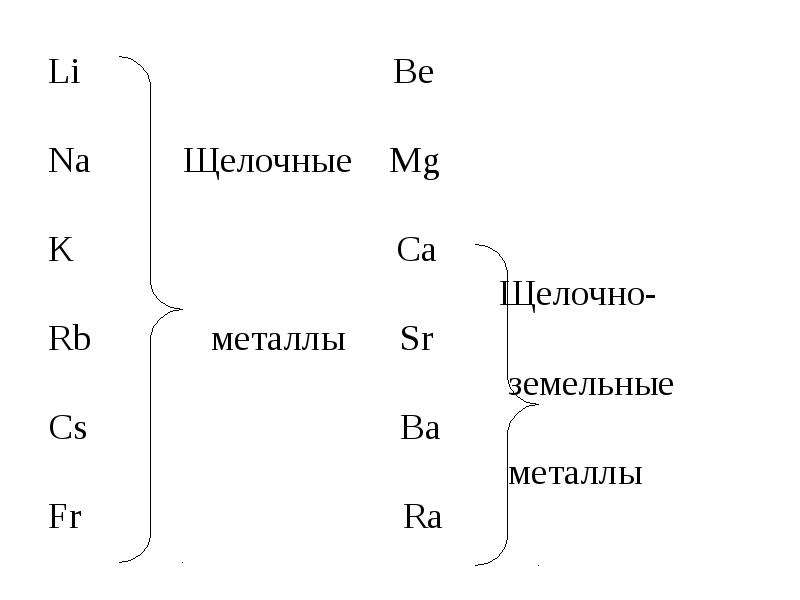 В результате они не встречаются в природе в их элементарном состоянии.
В результате они не встречаются в природе в их элементарном состоянии.
Все щелочноземельные металлы, кроме одного, реагируют с галогенами ( хлор , фтор и т. д.) с образованием ионных соединений (исключение составляет хлорид бериллия, так как связь является ковалентной).Все щелочноземельные металлы, кроме бериллия и магния, также реагируют с водой с образованием газообразного водорода и их соответствующих гидроксидов (однако магний будет реагировать с паром ). По существу, чем тяжелее щелочноземельный металл, тем энергичнее он будет реагировать с водой.
Щелочноземельные металлы (выделены) занимают вторую группу в периодической таблице.
Магний является пятым по распространенности элементом на земле, за ним следует кальций на восьмом месте, что тоже хорошо, поскольку и магний, и кальций жизненно важны для всех живых существ, включая людей! Магний участвует в огромном количестве биохимических реакций; среди прочего, он необходим для здоровья костей и зубов.
