История ⚠️ развития генетики: методы изучения, этапы
Активное развитие генетики началось только в последней трети 20 века, поэтому она считается сравнительно молодой наукой. В современном научном знании исследования генетики учитываются не только в биологии и медицине, но и в истории, спорте, криминалистике. В статье мы рассказали о том, как появилась генетика и почему она имеет такое большое значение в нашей жизни.
Развитие генетики как науки
Сегодня генетика является одной из основополагающих наук современной биологии. Но так было не всегда. Несмотря на то, что люди издревле интересовались наследственностью, наблюдая за тем, как живые существа приобретают черты своих родителей, им не удавалось объяснить механизмы передачи наследственных черт потомкам.
Впервые о генетике как о науке заговорили в середине 19 века после публикации трудов австрийского ботаника Грегора Менделя. В работе «Опыты над растительными гибридами» Мендель на основе исследований определил закономерности наследования признаков у гороха.
Впервые термин «генетика» применил венгерский дворянин Имре Фестерик, а в современную биологическую науку его ввел английский биолог Уильям Бэтсон в 1905 году.
Генетика — наука, специализирующая на изучении закономерностей, материальных основ и механизмов наследственности, изменчивости и эволюции живых организмов. Возникновение генетики связывается с развитием сельского хозяйства, разведением домашних животных и рядом крупных открытий в биологии и медицине.
Под наследственностью понимается свойство живых организмов из поколения в поколение передавать потомкам признаки старения, физиологические особенности и специфический характер индивидуального развития.
В современной науке историю становления генетики представляют в форме поэтапного развития.
Первый этап связан с именем основателя генетики Менделя, вклад которого заключается в установлении дискретности или делимости наследственных факторов. Это открытие показало, что не все наследственные задатки в процессе слияния гамет и образования зиготы смешиваются или растворяются. Часть из них наследуется от родителей к потомкам в форме дискретных частиц вне зависимости друг от друга. Это свойство организма получило название «закона Менделя». Однако при жизни его открытие не было оценено. Работы Менделя воспринимались критически, потому что опережали доступное знание о биологии и не могли быть поняты в то время.
Это открытие показало, что не все наследственные задатки в процессе слияния гамет и образования зиготы смешиваются или растворяются. Часть из них наследуется от родителей к потомкам в форме дискретных частиц вне зависимости друг от друга. Это свойство организма получило название «закона Менделя». Однако при жизни его открытие не было оценено. Работы Менделя воспринимались критически, потому что опережали доступное знание о биологии и не могли быть поняты в то время.
Только в 1900 году на исследования австрийского ученого снова обратили внимание биологи де Фриз, К. Корренс и Э. Чермак, которые независимо друг от друга поставили опыты, подтверждающие открытие Менделя. Одновременно с этим датский ботаник В. Иогансен изучал закономерности наследования на примере чистых линий фасоли. Он предложил термин «гены» для обозначения наследующихся факторов и сформулировал понятия «популяция», «фенотип» и «генотип». Научные результаты ученого внесли большой вклад в дальнейшее развитие генетики.
Второй этап ознаменован рядом важнейших открытий, сделавших генетику одной из самых развивающихся отраслей биологии. Американский генетик Т. Морган вместе со своими учениками А. Стертевантом, К. Бриджесом и Г. Меллером эмпирическим путем сформулировал и доказал хромосомную теорию наследственности. Это новое направление получило название цитогенетики и стало величайшим достижением естествознания первой половины прошлого века.
Передача наследственной информации (генов) от родителей к потомкам основана на передаче хромосом, в которых расположены гены в определенном и линейном порядке. Вывод был сделан на основе изучения закономерностей наследования на мушках дрозофилах в 1910–1911 гг.
В результате этого открытия Морган и американский цитолог Э. Вильсон выяснили и утвердили механизм определения пола, установив закономерности наследования свойств, сцепленных с половыми признаками. Определение хромосомной теории наследственности повлияло на становление и развитие современной молекулярной биологии.
К достижениям второго этапа развития науки можно также отнести:
- определение основ биохимической, популяционной и эволюционной генетики;
- доказательство того, что молекула ДНК является носителем наследственной информации;
- становление основ ветеринарной генетики и ее последующее развитие.
Третий этап характеризуется развитием современной генетики на уровне молекулярной биологии. Его начало отсчитывается с 1940 года, когда Дж. Бидл и Э. Татум сформулировали
В 1953 году молекулярные биологи Ф. Крик и Дж. Уотсон обнаружили структуру ДНК и расшифровали генетический код, благодаря чему был определен молекулярный механизм изменчивости. Под этим механизмом подразумевается, что однажды возникшие отклонения в структуре гена и ошибки самоудвоения ДНК будут впоследствии повторятся в дочерних нитях ДНК. Это положение позволило разработать способы искусственного получения мутаций, на основе которых разработаны новые сорта растений и штаммы микроорганизмов.
Под этим механизмом подразумевается, что однажды возникшие отклонения в структуре гена и ошибки самоудвоения ДНК будут впоследствии повторятся в дочерних нитях ДНК. Это положение позволило разработать способы искусственного получения мутаций, на основе которых разработаны новые сорта растений и штаммы микроорганизмов.
Также это способствовало возникновению генной инженерии, ставшей одним из основных направлений современной генетики.
Генная инженерия — это совокупность приемов и технологий, которые позволяют выделять гены из организма для осуществления последующих манипуляций и создания искусственных генетических систем.
Это открытие обеспечило качественно новый виток в развитии медицины, в особенности, в изучении закономерности заболеваний, передающихся наследственным путем.
Источник: unsplash.comОсновные понятия и методы генетики
К фундаментальным понятиям науки относятся наследственность и изменчивость, присущие каждому живому организму. Наследственность определяет свойство организма воспроизводить совокупность признаков, которыми обладали его предки. Механизмы изменчивости, напротив, приводят к трансформации комбинаций наследственных признаков или обретению совершенно новых черт у особей данного вида под влиянием внешних изменений окружающей среды. Изменчивость может развиваться в виде мутаций, необходимых для выживания в новых условиях жизни.
Наследственность определяет свойство организма воспроизводить совокупность признаков, которыми обладали его предки. Механизмы изменчивости, напротив, приводят к трансформации комбинаций наследственных признаков или обретению совершенно новых черт у особей данного вида под влиянием внешних изменений окружающей среды. Изменчивость может развиваться в виде мутаций, необходимых для выживания в новых условиях жизни.
Для понимания важны и другие определения:
- ген — специфический участок молекулы ДНК, отвечающий за хранение и передачу определенного наследственного признака;
- популяция — группа особей одного вида;
- генотип — совокупность всех генов и наследственных факторов организма;
- фенотип — целостность биологических свойств и признаков живого организма, возникших в ходе индивидуального развития под влиянием внешней и внутренней среды;
- аллели — альтернативные формы одного и того же гена, которые находятся в одинаковых локусах и определяют различные варианты становления одного признака;
- доминантность подразумевает форму взаимодействия между аллелями одного гена, в рамках которой один из генов — доминантный — подавляет проявление другого;
- рецессивность характеризует признак подавляемого гена из аллельной пары, который не развивается в гетерозиготном состоянии;
- хромосома представляет собой линейную структуру, в которой расположены гены;
- локус — часть хромосомы, в которой находится определенный ген.

В современной генетике применяются различные методы изучения наследственности и изменчивости. К ним относятся:
- гибридологический метод является основным методом, который состоит в скрещивании организмов, имеющих различные друг от друга признаки, а также последующее изучение их потомства;
- генеалогический метод специализируется на анализе родословных и позволяет предупредить возникновение заболеваний, имеющих генетический характер;
- популяционный метод помогает выявить наследственные заболевания как в определенных странах, так и в отдельных группах населения;
- цитогенетический метод применяется в изучении строения хромосом и изменчивости их количества. Позволяет на раннем этапе выявить хромосомные болезни, характеризующиеся нарушением числа хромосом или с изменением их строения;
- биохимический и биофизический методы изучают наследственные патологии, которые возникают по причине генных мутаций, нарушающих строение и скорость синтеза белков.
 На основе методов изучается химический состав и строение определенных частей клеток.
На основе методов изучается химический состав и строение определенных частей клеток.
Этические проблемы развития медицинской генетики
Источник: unsplash.comСтремительное развитие современной науки спровоцировало возникновение вопросов относительно этической стороны генетических исследований в медицине. Ученые, философы, политики и социологи сформулировали ряд этических проблем применения генных технологий: доступность генетических обследований, необходимость перинатального генетического тестирования, формирование способов обеспечения конфиденциальности.
На основании этих вопросов в медицинской генетике был сформирован ряд основополагающих правил:
- Правило конфиденциальности подразумевает запрет передачи информации о результатах генетического исследования без письменного согласия пациента.
- Правило правдивости заключается в том, что врач обязан ставить пациента в известность обо всех исследованиях, которые он планирует провести.

- Правило информированного согласия и уважения автономности пациента регулируется правовыми и юридическими нормами, которые регламентируют проведение медицинских вмешательств. Согласно этому правилу, любое генетическое обследование должно осуществляться строго по согласию пациента или его представителей.
Несмотря на официальный статус, мнения ученых по перечисленным правилам все еще расходятся, так как их реализация не всегда применима к конкретной ситуации. Такая неоднозначность еще больше усугубляет и углубляет этические проблемы развития генетики в медицине.
Законы генетики
Воплощение законов генетики можно обнаружить только при рассмотрении большого количества организмов, так как они имеют статистический характер. При этом четкость проявления того или иного генетического закона зависит от количества параллельных наблюдений. Рассмотрим основные законы:
Рассмотрим основные законы:
- Закон единообразия гибридов первого поколения является первым законом Менделя. Его также называют законом доминирования признаков. Суть состоит в том, что при моногибридном скрещивании двух гомозиготных организмов у гибридов первого поколения проявятся только доминантные признаки. По фенотипу и генотипу все поколение будет однообразно и вберет в себя признаки только одного из родителей.
- Закон расщепления — второй закон Менделя, основанный на наблюдениях за самоопылением гибридов первого поколения, при котором происходит расщепление признаков у второго поколения в числовом отношении 3:1 по фенотипу и 1:1:2 по генотипу. То есть образуется не одна, а две фенотипические группы — доминантная и рецессивная.
- Закон независимого наследования признаков определяет третий закон Менделя. Определив закономерности наследования одной пары признаков, Мендель занялся изучением наследования двух или более пар разнообразных признаков.
 В результате скрещивания гомозиготных растений, которые отличались по разным признакам, он обнаружил, что в потомстве они комбинировались так, словно их наследование происходило независимо друг от друга. Из этого ученый сделал вывод, что пары альтернативных признаков, которые находятся в каждом организме, не смешиваются при образовании гамет, а по одному от каждой пары переходят в них в чистом виде.
В результате скрещивания гомозиготных растений, которые отличались по разным признакам, он обнаружил, что в потомстве они комбинировались так, словно их наследование происходило независимо друг от друга. Из этого ученый сделал вывод, что пары альтернативных признаков, которые находятся в каждом организме, не смешиваются при образовании гамет, а по одному от каждой пары переходят в них в чистом виде. - Закон сцепленного наследования или закон Моргана основан на знании о том, что в одной хромосоме расположено множество генов, так как число признаков организма намного выше количества хромосом. Наследование признаков, гены которых расположены в одной хромосоме, передается совместно и не может распределяться по отдельности.
- Закон гомологических рядов наследственной изменчивости сформулирован советским ученым Н. И. Вавиловым в 1920 году. Его суть заключается в том, что генетически близкие виды обладают сходными рядами наследственной изменчивости.

Значение генетики в современном мире
Развитие современной генетики уже достигло небывалых высот в изучении человека и особенностей его наследственности. Генетика активно используется в медицине и биологии, криминалистике, вирусологии, истории и других областях. При этом для человечества первостепенное значение представляют достижения генетики в медицине, которые проявляются в следующих функциях:
- проведение генетического тестирования для предупреждения зачатия или рождения ребенка с наследственными патологиями;
- использование генетических методов в борьбе с раком;
- генетический анализ шизофрении;
- применение выявленных закономерностей в наследственных заболеваниях для производства медикаментов;
- возможность точного диагностирования наследственных заболеваний.
Ученые предсказывают, что уже в начале следующего века станет известна информация о работе каждого гена из генома человека, а также будут созданы технологии лечения большинства неизлечимых болезней.
Такова теоретическая основа генетической науки, а если вам срочно нужно решить задачи по генетике, обращайтесь к специалистам сервиса ФениксХелп.
Группа технологий: Путин назвал цель развития генетики в России | Статьи
Все научные проекты в России прежде всего должны быть направлены на повышение благополучия людей, заявил Владимир Путин на совещании по развитию генетических технологий. Уже два года в стране действует соответствующая федеральная программа, головной организацией в которой выступает НИЦ «Курчатовский институт». Его президент Михаил Ковальчук рассказал главе государства о колоссальных возможностях, которые дает расшифровка генома: речь идет о персонализированной медицине, перестройке сельского хозяйства и животноводства, а также о противостоянии экологическим проблемам. Глава «Роснефти» Игорь Сечин сообщил, что в России появится база геномов 100 тыс. россиян, а директор Института молекулярной биологии РАН Александр Макаров рассказал о разработке высокоэффективного препарата, обезвреживающего COVID и его вариант «Дельта».
Новые возможности
Особое внимание развитию генетических технологий власти уделяют на протяжении нескольких лет. В 2019-м кабмин утвердил соответствующую федеральную научно-техническую программу до 2027 года. Однако, как сообщила на совещании вице-премьер Татьяна Голикова, программа будет продлена до 2030-го.
В целом она направлена на усовершенствование технологий геноредактирования, которые можно будет применить в медицине, сельском хозяйстве и промышленности. Кроме того, ожидается, что разработки смогут улучшить систему предупреждения чрезвычайных ситуаций биологического характера и контроля в этой области. Всего над программой работают 100 вузов, головной научной организацией стал НИЦ «Курчатовский институт» — в его компетенции методические, информационно-аналитические и организационные аспекты реализации документа.
Все научные проекты должны быть направлены на достижение национальных целей развития и повышение благополучия людей, отметил Владимир Путин. Однако, чтобы эта активно развивающаяся сфера науки оставалась в правовом поле, потребуется урегулировать вопросы получения, использования и защиты генетических данных человека и его семьи — в том числе и для будущих поколений.
Однако, чтобы эта активно развивающаяся сфера науки оставалась в правовом поле, потребуется урегулировать вопросы получения, использования и защиты генетических данных человека и его семьи — в том числе и для будущих поколений.
Президент РФ Владимир Путин во время совещания по вопросам развития генетических технологий в стране
Фото: пресс-служба Президента России/kremlin.ru
— Совершенно очевидно, что законодательство в сфере генетики должно открывать простор для научного поиска и создания инноваций в медицине, ветеринарии, селекции, в других сферах. Вместе с тем нужно четко обозначить и пределы допустимого использования генетических технологий. Речь идет не только о современном правовом регулировании, но и о соблюдении этических норм, — заявил на совещании президент.
Федеральная программа дала новый толчок в развитии генетических технологий, сообщил на совещании президент НИЦ «Курчатовский институт» Михаил Ковальчук. В России, по его словам, есть необходимые специалисты, которые активно участвуют в ней. Курчатовский геномный центр успешно развивает сельскохозяйственные технологии в области растениеводства, животноводства, а также в микробиологической и биотехнологической промышленности.
В России, по его словам, есть необходимые специалисты, которые активно участвуют в ней. Курчатовский геномный центр успешно развивает сельскохозяйственные технологии в области растениеводства, животноводства, а также в микробиологической и биотехнологической промышленности.
— В советском лексиконе было слово «районирование», то есть, например, подгонка сортов растений для данных условий — климатических, почвенных, — то, что в виноделии называется терруаром. Фактически этим в нашей стране занимались всегда, и очень успешно, но сегодня эта деятельность переходит на качественно новый уровень благодаря знанию генома — раньше это была эмпирика, а сегодня это стало серьезной научной задачей. Вопрос заключается в том, что знание геномов позволяет не только просто продолжать целенаправленное скрещивание, даже без генетического редактирования, но видеть, что происходит на уровне генома. Поэтому первоочередная задача — это знание геномов, — подчеркнул Михаил Ковальчук.
Он добавил, что чтение генома дает колоссальные возможности: «Это означает, что всё, что записано в скрижали у каждого человека, у каждого цветочка, растения, рыбки, птички, мы читаем и видим это, можем сравнивать, извлекать и влиять на это».
С помощью программы, по мнению главы НИЦ «Курчатовский институт», можно также противостоять глобальным вызовам современности. Открытия в генетике, в частности, позволят избежать экологических проблем или минимизировать их влияние.
Фото: ИЗВЕСТИЯ/Зураб Джавахадзе
— Мы с вами должны понимать: предсказывая возможные климатические изменения, а это означает изменение и сельскохозяйственных вредителей, и болезни, которые будут по мере потепления перемещаться из теплых мест в более холодные, где они непривычные, мы должны на опережение подготавливать сорта, которые будут адаптированы к изменившимся климатическим условиям и новым вредителям, в первую очередь в сельском хозяйстве. Это касается и медицины, но и этим мы тоже занимаемся, — сообщил Михаил Ковальчук.
Это касается и медицины, но и этим мы тоже занимаемся, — сообщил Михаил Ковальчук.
Кроме того, он отметил, что ученые уделяют особое внимание развитию виноделия. В ответ президент пошутил, что в России будет «и что выпить, и чем закусить», потому что «еще со времен реализации Советским Союзом ядерного проекта известно, что если «Курчатник» за что-то берется, то он делает всё основательно и доводит всегда задачи, которые перед ним ставит государство, до логического завершения».
Развитие генетики чрезвычайно важно, заявил «Известиям» Михаил Ковальчук. Раньше возможности человека просто копировались в виде механических систем. Однако с помощью науки получится создать более сложные конструкции.
— Знание генома дает возможность взглянуть научно на то, что мы делали эмпирически. Это значит, на другом уровне делать мир лучше — создавать персонализированную медицину, персонализированное сельское хозяйство, — сказал руководитель Курчатовского института.
Фото: РИА Новости/Рамиль Ситдиков
Время реализовывать
Что касается изучения геномов человека, то как сообщил на совещании глава «Роснефти» Игорь Сечин, в РФ появится соответствующая база данных 100 тыс. россиян.
россиян.
— На первом этапе основным результатом станет создание базы данных на 100 тыс. полногеномных исследований последовательностей россиян, расположенных на серверах, находящихся в России. Для этого будет произведено масштабное добровольное популяционное исследование. Мы начнем с собственных сотрудников, что позволит определить референсные геномы для разных народов России, — пояснил он.
По мнению руководителя лаборатории геномной инженерии МФТИ Павла Волчкова, наука о живом — особенно медицина и биотех — самые активно развивающиеся сейчас направления. Отдельного внимания заслуживают технологии, где пересекаются искусственный интеллект и генетика, а также синтетическая биология и направленная эволюция. Специалист отметил, что подходы в этих областях с 1990-х годов очень сильно изменились.
Как считает эксперт, сегодня уже сделано много фундаментальных открытий, и человечество вступило в эпоху, когда из них нужно создавать технологии мирового уровня. Это не делается на уровне министерств, уверен Павел Волчков. Этим должны заниматься стартапы, венчурные фонды или частные компании.
Это не делается на уровне министерств, уверен Павел Волчков. Этим должны заниматься стартапы, венчурные фонды или частные компании.
Один из удачных примеров — компания «Биокад», директор которой — Дмитрий Морозов — принял участие в совещании. Отвечая на вопрос президента, как в практическом плане продвигается работа в области генетических технологий, он рассказал, что перед ним и его сотрудниками стояла задача взять у коллег, занятых чистой наукой, академические разработки и трансформировать их в продукты, которые будут доступны всем.
Фото: ИЗВЕСТИЯ/Зураб Джавахадзе
Во время этой непростой работы стало понятно, как должно быть построено взаимодействие фарминдустрии и академического сообщества. Одним из результатов этого сотрудничества должно в скором времени стать создание первого в мире препарата против болезни Бехтерева с уникальным механизмом действия.
— Если мы поспешим, то станем первыми в мире, — отметил он во время совещания.
Глава Минздрава Михаил Мурашко подчеркнул, что в ведомстве «кровно» заинтересованы в продвижении российской разработки.
— Вы сказали о беспрецедентном сопровождении этих препаратов, — парировал президент. — Вот создайте, пожалуйста, прецедент, наоборот. И на основе этого прецедента продолжите, пожалуйста, совершенствование системы регистрации препаратов, не только полученных с помощью генетических исследований, а в целом препаратов, которые крайне нужны людям.
С актуальным докладом выступил директор Государственного научного центра прикладной микробиологии и биотехнологии Роспотребнадзора Иван Дятлов. В своем сообщении он подчеркнул, что развитие генетических технологий в сфере борьбы с инфекционными заболеваниями — основная задача центра.
Эта работа ведется путем создания эффективных препаратов против большинства возбудителей и внедрения в образовательные процессы методологий для увеличения количества специалистов-генетиков в этой области.
По его словам, для информационной поддержки этого направления деятельности центра разработан прототип национального каталога патогенных микроорганизмов и биотоксинов, который объединит все коллекционные фонды страны в единую базу данных. На практике это позволит в ускоренном режиме проводить идентификацию выделенных патогенов, определять их происхождение и предсказывать появление их новых форм.
На практике это позволит в ускоренном режиме проводить идентификацию выделенных патогенов, определять их происхождение и предсказывать появление их новых форм.
Фото: РИА Новости/Александр Гальперин
Тему специалистов-генетиков продолжила директор Федерального исследовательского центра «Всероссийский институт генетических ресурсов растений имени Н.И. Вавилова» (ВИР) Елена Хлесткина. Специалист подчеркнула, что биоресурсные коллекции не должны становиться музейными экспонатами, напротив, их необходимо интенсивно изучать. «Известиям» она сообщила, что на совещании активно обсуждался вопрос по созданию биоресурсных центров, изначально заложенный в программу развития генетических технологий. Такие центры должны содержать физические носители генетической информации, также речь идет о нормативном регулировании.
— Этого нам очень не хватало, — сказала Елена Хлесткина. — Так как речь идет о безопасности всех коллекций.
Она отметила, что государством предпринимаются важные шаги по консолидации генетических коллекций, хранящихся в разных учреждениях.
Ковидная повестка
Не обошлось на совещании и без обсуждения коронавируса. Ученые разработали высокоэффективный препарат, обезвреживающий COVID и его вариант «Дельта», сообщил президенту директор Института молекулярной биологии РАН Александр Макаров. Специалистам удалось подобрать дозу антител, снижающую вирусную нагрузку в 100 тыс. раз.
В России еще продолжается распространение инфекции, однако глава Роспотребнадзора Анна Попова надеется на стабилизацию ситуации. Сейчас хорошие показатели, например, демонстрирует Москва: заболеваемость в столице снизилась почти на 23%.
— У нас есть субъекты, их больше десяти сегодня, которые уже в стадии снижения, есть субъекты, которые остановились и дальше не растут, — заявила руководитель федеральной службы.
Фото: РИА Новости/Александр Гальперин
Облегчить ситуацию, по ее мнению, помогают QR-коды, применяющиеся в 77 регионах. Снизить темпы распространения инфекции поможет массовое тестирование. Все пациенты с признаками ОРВИ в России будут обязательно проходить проверку на COVID, соответствующее постановление уже принято, сообщила Анна Попова. При этом скорость тестирования должна быть увеличена, отметил президент.
Все пациенты с признаками ОРВИ в России будут обязательно проходить проверку на COVID, соответствующее постановление уже принято, сообщила Анна Попова. При этом скорость тестирования должна быть увеличена, отметил президент.
Генетика развития и агрогенетика растений: Участники и порядок отбора
Московский государственный университет имени М.В.Ломоносова
Ежова Татьяна Анатольевна – д.б.н., профессор кафедры генетики
Соловьёв Александр Александрович – д.б.н., профессор кафедры генетики
Еланский Сергей Николаевич – д.б.н., в.н.с. кафедры микологии и альгологии, с.н.с. Учебно-опытного почвенно-экологического центра, с.н.с. Евразийского центра по продовольственной безопасности (Аграрный центр)
Синюшин Андрей Андреевич – к.б.н., доцент кафедры генетики
Санкт-Петербургский государственный университет
Тихонович Игорь Анатольевич – д. б.н., академии РАН, декан биологического факультета
б.н., академии РАН, декан биологического факультета
Лутова Людмила Алексеевна – д.б.н., профессор кафедры генетики и биотехнологии
Матвеева Татьяна Валерьевна – д.б.н., профессор кафедры генетики и биотехнологии
Творогова Варвара Евгеньевна – к.б.н., с.н.с. кафедры генетики и биотехнологии
Матвеенко Андрей Георгиевич – к.б.н., н.с. кафедры генетики и биотехнологии
Рогоза Татьяна Михайловна – старший преподаватель кафедры генетики и биотехнологии
Ганчева Мария Семеновна – инженер-исследователь кафедры генетики и биотехнологии
Новосибирский государственный аграрный университет
Дубовский Иван Михайлович – д.б.н, профессор кафедры защиты растений, заведующий лабораторией
Всероссийский научно-исследовательский институт сельскохозяйственной микробиологии
Тихонович Игорь Анатольевич – д. б.н., академии РАН, директор Федерального государственного бюджетного научного учреждения
б.н., академии РАН, директор Федерального государственного бюджетного научного учреждения
Всероссийский институт генетических ресурсов растений им. Н.И. Вавилова
Хлесткина Елена Константиновна – д.б.н., профессор, директор института
Шипилина Лилия Юрьевна – к.б.н., старший научный сотрудник отдела агроботаники и in situ сохранения генетических ресурсов растений
Санкт-Петербургский государственный лесотехнический университет, Санкт-Петербург
Потокина Елена Кирилловна Константиновна – д.б.н., профессор, Научный руководитель Центра биоинформатики и геномных исследований
Всероссийский научно-исследовательский институт сельскохозяйственной биотехнологии» (ФГБНУ ВНИИСБ), Москва
Соловьёв Александр Александрович – д.б.н., профессор, заместитель директора по научной и образовательной деятельности
Таранов Василий Васильевич – к.б.н., заведующий лабораторией стрессоустойчивости растений
Федеральные научно-технические программы
Программа разработана в соответствии с подпунктом «а» пункта 1 Указа Президента Российской Федерации от 28 ноября 2018 г. № 680 «О развитии генетических технологий в Российской Федерации» и утверждена постановлением
Правительства Российской Федерации от 22 апреля 2019 г. № 479.
№ 680 «О развитии генетических технологий в Российской Федерации» и утверждена постановлением
Правительства Российской Федерации от 22 апреля 2019 г. № 479.
Основные цели Программы состоят в комплексном решении задач ускоренного развития генетических технологий, в том числе технологий генетического редактирования, и создании научно-технологических заделов для медицины, сельского
хозяйства и промышленности, а также совершенствовании мер предупреждения чрезвычайных ситуаций биологического характера и контроля в этой области.
Управление реализацией Программы и контроль за ее выполнением осуществляется советом по реализации Программы и ответственным исполнителем-координатором Программы, которым определено Минобрнауки России. Функции головной научной
организации Программы возложены на федеральное государственное бюджетное учреждение «Национальный исследовательский центр «Курчатовский институт».
Указ Президента Российской Федерации от 28 ноября 2018 г. № 680 «О развитии генетических технологий в Российской Федерации».
Постановление Правительства Российской Федерации от 22 апреля 2019 г. № 479 «Об утверждении Федеральной научно-технической программы развития генетических технологий на 2019 — 2027 годы» .
Распоряжение Правительства Российской Федерации от 26 октября 2019 г. № 2535-р «Об утверждении прилагаемого перечня организаций, на базе которых создаются центры геномных исследований мирового уровня».
Приказ Министерства науки и высшего образования Российской Федерации от 1 ноября 2019 г. № 1224 «Об утверждении порядка направления в адрес головной научной организации Федеральной научно-технической программы развития
генетических технологий на 2019 — 2027 годы предложений по актуальным тематикам научной и научно-технической деятельности для формирования комплексного плана научных исследований на весь период реализации указанной программы
и информации о поддержке и реализации таких тематик участниками этой программы»
.
Программа разработана в соответствии с подпунктом «а» пункта 1 Указа Президента Российской Федерации от 25 июля 2019 г. № 356 «О мерах по развитию синхротронных и нейтронных исследований и исследовательской инфраструктуры в Российской Федерации» и утверждена постановлением Правительства Российской Федерации от 16 марта 2020 г. № 287.
Основной целью Программы является комплексное решение задач ускоренного развития синхротронных и нейтронных исследований, необходимых для создания прорывных технологий, а также обеспечение создания и развития исследовательской инфраструктуры в Российской Федерации.
Управление реализацией Программы и контроль за ее выполнением осуществляют совет по реализации Программы и заказчик — координатор Программы, которым определено Минобрнауки России, посредством формирования и реализации
комплексных планов синхротронных и нейтронных исследований (разработок) и ежегодного плана реализации Программы. Функции головной научной организации Программы возложены на федеральное государственное бюджетное учреждение
«Национальный исследовательский центр «Курчатовский институт».
Функции головной научной организации Программы возложены на федеральное государственное бюджетное учреждение
«Национальный исследовательский центр «Курчатовский институт».
Указ Президента Российской Федерации от 25 июля 2019 г. № 356 «О мерах по развитию синхротронных и нейтронных исследований и исследовательской инфраструктуры в Российской Федерации» .
Постановление Правительства Российской Федерации от 16 марта 2020 г. № 287 «Об утверждении Федеральной научно-технической программы развития синхротронных и нейтронных исследований и исследовательской инфраструктуры на 2019 — 2027 годы».
Постановление Правительства Российской Федерации от 30 июня 2020 г. № 951 «Об утверждении Правил предоставления грантов в форме субсидий из федерального бюджета на реализацию отдельных мероприятий Федеральной
научно-технической программы развития синхротронных и нейтронных исследований и исследовательской инфраструктуры на 2019 — 2027 годы».
Путин поручил утвердить меры по обеспечению России специалистами в сфере генетики — Общество
МОСКВА, 24 января. /ТАСС/. Президент РФ Владимир Путин распорядился до 1 июня утвердить комплекс мер, которые позволят обеспечить страну высококвалифицированными кадрами в области генетики. Об этом сообщается в понедельник на сайте Кремля.
«Утвердить комплекс мер, направленных на удовлетворение потребности Российской Федерации в высококвалифицированных кадрах в области генетических технологий до 2030 года, и обеспечить его реализацию», — говорится в сообщении.
Поручение дано правительству РФ. Срок его исполнения установлен до 1 июня 2022 года.
Помимо этого кабмин должен обеспечить синхронизацию мер государственной поддержки, которые предоставляются разработчикам и производителям отечественного оборудования, позволяющего осуществлять исследования мирового уровня в области генетических технологий, и расходных материалов к нему. Президент также поручил усовершенствовать механизмы государственной поддержки таких производителей. Доклад по этой теме должен быть представлен до 1 сентября 2022 года, далее — ежегодно.
Доклад по этой теме должен быть представлен до 1 сентября 2022 года, далее — ежегодно.
Еще одно решение касается налоговых льгот для предприятий в этой сфере. Правительству РФ необходимо обеспечить внесение в Налоговый кодекс изменений, которые позволят ряду организаций уменьшать налог на прибыль на сумму, равную 50% расходов на развитие генетических технологий. Речь идет о компаниях, являющихся технологическими партнерами Федеральной научно-технической программы развития генетических технологий на 2019-2027 годы, и их дочерних обществах.
Поручение должно быть выполнено до 10 июля 2022 года.
Коллекции генетических ресурсов
Путин также поручил к марту продумать вопрос о поправках, касающихся порядка использования в РФ коллекций генетических ресурсов.
«Правительству Российской Федерации с учетом ранее данных поручений рассмотреть вопрос о необходимости внесения в законодательство Российской Федерации изменений, касающихся установления порядка создания, ведения и использования коллекций генетических ресурсов, а также деятельности биоресурсных центров», — говорится в тексте документа. Указывается, что соответствующая работа должна быть проведена до 1 марта 2022 года.
Указывается, что соответствующая работа должна быть проведена до 1 марта 2022 года.
Помимо этого, кабмину поручено при участии федерального государственного бюджетного учреждения «Национальный исследовательский центр «Курчатовский институт» рассмотреть вопрос о необходимости внесения в российское законодательство изменений, направленных на совершенствование функционирования информационно-аналитической системы хранения и обработки генетических данных «Национальная база генетической информации». Речь в том числе идет об установлении обязательных требований к передаче (депонированию) в эту базу генетических данных. Такой доклад должен быть представлен до 1 октября 2022 года, в дальнейшем — ежегодно.
В чем важность генетики животных? | Генетика животных | Продовольственная и сельскохозяйственная организация Объединенных Наций
Livestock populations provide people with a variety of products and services, including meat, milk, eggs, fibre and draught power, in a wide range of environments. This diversity of function is only possible because of the diversity of their genetic make-up.
This diversity of function is only possible because of the diversity of their genetic make-up.
The genetic variation within livestock populations also provides the raw material both for evolution through natural selection in response to changing conditions and for human-managed genetic improvement programmes. It is vital both to efforts to increase production and to the adaption of livestock populations to challenges such as climate change, emerging diseases and pressures on feed and water resources.
Animal genetics is one of the pillars of livestock development (alongside animal health, animal nutrition and husbandry issues such as housing). It is a broad field, ranging from characterization to conservation to genetic improvement, and involves actions at local, national, regional and global scales.
Characterization is the assessment of livestock populations and their production environments to establish their current status and identify strengths that can be enhanced and weaknesses that need to be overcome, for example via a genetic improvement programme. It can also help to inform conservation strategies.
It can also help to inform conservation strategies.
Conservation of animal genetic resources refers to measures taken to prevent the loss of genetic diversity in livestock populations, including to protect breeds from extinction. It can involve both the conservation of live populations and the cryoconservation (preservation through freezing at extremely low temperatures) of material such as semen or embryos.
Genetic improvement (animal breeding) is based on the principle that the products (milk, meat, wool, etc.) and services (e.g. transport, draught power or cultural services) provided by animals are a function of their genes and the environmental influences that they are exposed to. Improvement can be achieved by selecting genetically superior animals to be the parents of the next generation. “Genetically superior” means superior in terms of a particular set of characteristics, which usually include productivity in the environmental conditions expected in the future, but should also consider traits such as fertility, disease resistance or longevity that relate to costs of production.
Since the middle of the twentieth century, genetic improvement efforts have concentrated on a very small number of breeds worldwide, frequently without due consideration to the way in which local production environments affect animals’ ability to survive, produce and reproduce.
ЕР разработает предложения по развитию госполитики в сфере генетики
https://ria.ru/20211118/genetika-1759577434.html
ЕР разработает предложения по развитию госполитики в сфере генетики
ЕР разработает предложения по развитию госполитики в сфере генетики — РИА Новости, 18.11.2021
ЕР разработает предложения по развитию госполитики в сфере генетики
Партия «Единая Россия» разработает предложения по развитию госполитики в сфере генетических технологий, куда войдут создание образовательных программ,… РИА Новости, 18.11.2021
2021-11-18T09:58
2021-11-18T09:58
2021-11-18T09:58
общество
единая россия
общероссийский народный фронт
елена шмелева
россия
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21. img.ria.ru/images/07e5/05/1b/1734364657_0:308:3072:2036_1920x0_80_0_0_dbdbf75cc8e8059a42b3a7ae7a0c963d.jpg
img.ria.ru/images/07e5/05/1b/1734364657_0:308:3072:2036_1920x0_80_0_0_dbdbf75cc8e8059a42b3a7ae7a0c963d.jpg
МОСКВА, 18 ноя — РИА Новости. Партия «Единая Россия» разработает предложения по развитию госполитики в сфере генетических технологий, куда войдут создание образовательных программ, обеспечение учёных требуемыми материалами и другое, рассказала руководитель комиссии «Единой России» по образованию и науке, сопредседатель Центрального штаба ОНФ Елена Шмелева.»Нашей общей задачей является развитие как научных, так и технологических компетенций в области генетики и других наук о жизни, чтобы этот потенциал реализовывался в виде и других продуктов и технологий, имеющих рыночный потенциал в России и за рубежом… Все эти вопросы мы будем обсуждать на площадке комиссии Генсовета «Единой России» по образованию и науке, посвятим этому специальное заседание и разработаем предложения по развитию госполитики в сфере генетических технологий. Приоритетом партии является возрождение и развитие отечественных научных школ. Всему миру известна, например, наша математическая школа. Самые перспективные технологии сегодня связаны именно науками о жизни – пандемия это лишь доказала. И наша цель – сделать Россию первой в генетике», — сказала Шмелева, которую цитирует пресс-служба партии.Шмелева отметила, что необходимо также развитие и совершенствование технологических платформ, позволяющих оперативно создавать востребованные рынком продукты, в том числе средства для профилактики и лечения новых инфекционных заболеваний. «При этом обеспечивая такие их характеристики, которые делают возможным быстрое масштабирование их производства и соответствие регуляторным требованиям зарубежных государств», — сказала она.Кроме того, необходимо актуализировать существующие образовательные программы и создавать новые программы повышения квалификации. По словам главы комиссии по образованию, также требуется обеспечить российских ученых необходимыми для генетических исследований материалами, в том числе за счет локализации производства критического оборудования, реагентов и материалов.
Всему миру известна, например, наша математическая школа. Самые перспективные технологии сегодня связаны именно науками о жизни – пандемия это лишь доказала. И наша цель – сделать Россию первой в генетике», — сказала Шмелева, которую цитирует пресс-служба партии.Шмелева отметила, что необходимо также развитие и совершенствование технологических платформ, позволяющих оперативно создавать востребованные рынком продукты, в том числе средства для профилактики и лечения новых инфекционных заболеваний. «При этом обеспечивая такие их характеристики, которые делают возможным быстрое масштабирование их производства и соответствие регуляторным требованиям зарубежных государств», — сказала она.Кроме того, необходимо актуализировать существующие образовательные программы и создавать новые программы повышения квалификации. По словам главы комиссии по образованию, также требуется обеспечить российских ученых необходимыми для генетических исследований материалами, в том числе за счет локализации производства критического оборудования, реагентов и материалов. Появление регуляторных механизмов также позволит обеспечить ранний доступ пациентов к разрабатываемым в стране лекарствам, подчеркнула Шмелева.
Появление регуляторных механизмов также позволит обеспечить ранний доступ пациентов к разрабатываемым в стране лекарствам, подчеркнула Шмелева.
https://ria.ru/20211117/genetika-1759460678.html
https://ria.ru/20211117/genetika-1759459717.html
россия
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2021
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdnn21.img.ria.ru/images/07e5/05/1b/1734364657_341:0:3072:2048_1920x0_80_0_0_9bd2178e41bbef2cd63b24c54faceb82. jpg
jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
общество, единая россия, общероссийский народный фронт, елена шмелева, россия
ЕР разработает предложения по развитию госполитики в сфере генетики
Принципы развития: Генетика развития — Биология развития
Дифференциальная экспрессия генов из генетически идентичных ядер создает разные типы клеток. Дифференциальная экспрессия генов может происходить на уровнях транскрипции генов, процессинга ядерной РНК, трансляции мРНК и модификации белков.
Гены обычно репрессированы. Активация гена часто означает ингибирование его репрессора. Это приводит к двойному и тройному отрицательному мышлению: активация часто является торможением ингибитора; репрессия – это торможение ингибитора ингибитором.
Гены эукариот содержат промоторные последовательности, с которыми может связываться РНК-полимераза для инициации транскрипции. Эукариотические РНК-полимеразы связаны серией белков, называемых базальными факторами транскрипции.
Эукариотические гены, экспрессируемые в определенных типах клеток, содержат энхансерные последовательности, которые регулируют их транскрипцию во времени и пространстве.
Специфические факторы транскрипции могут распознавать определенные последовательности ДНК в промоторной и энхансерной областях.Они активируют или репрессируют транскрипцию генов, с которыми они связаны.
Энхансеры работают по комбинаторному принципу. Связывание нескольких факторов транскрипции может стимулировать или ингибировать транскрипцию с определенного промотора. В некоторых случаях транскрипция активируется только в том случае, если присутствуют оба фактора А, и фактора В, в то время как в других случаях транскрипция активируется, если либо фактор А, , либо фактор В присутствует.
Ген, кодирующий фактор транскрипции, может сохранять свою активность, если кодируемый им фактор транскрипции также активирует свой собственный промотор. Таким образом, ген фактора транскрипции может иметь один набор энхансерных сайтов для инициации его активации и второй набор энхансерных сайтов (которые связывают кодируемый транскрипционный фактор) для поддержания его активации.
Часто те же самые факторы транскрипции, которые используются во время дифференцировки определенного типа клеток, также используются для активации генов для специфических продуктов этого типа клеток.Например, Pax6 необходим как для дифференцировки хрусталика, так и для транскрипции генов кристаллинов хрусталика, а Mitf необходим для дифференцировки пигментных клеток и для транскрипции генов, продукты которых катализируют синтез меланина.
Энхансеры могут действовать как сайленсеры для подавления транскрипции гена в неподходящих типах клеток.
Области контроля локуса могут функционировать, делая относительно большие участки хромосомы доступными для транскрипционных факторов.
Факторы транскрипции по-разному регулируют синтез РНК. Некоторые факторы транскрипции стабилизируют связывание РНК-полимеразы с ДНК, некоторые разрушают нуклеосомы, а некоторые повышают эффективность транскрипции.
Транскрипция коррелирует с отсутствием метилирования в промоторной и энхансерной областях генов. Различия в метилировании могут объяснить примеры геномного импринтинга, когда ген, передаваемый через сперму, экспрессируется иначе, чем тот же ген, передаваемый через яйцеклетку.
Компенсация дозы позволяет продуктам, происходящим от Х-хромосомы самцов (которые имеют одну Х-хромосому на клетку у плодовых мушек и млекопитающих), сравняться с продуктами, происходящими от Х-хромосомы самок (которые имеют две Х-хромосомы на клетку). клетка). Эта компенсация достигается на уровне транскрипции либо путем ускорения транскрипции одиночной Х-хромосомы у самцов ( Drosophila ), либо путем инактивации большой части одной из двух Х-хромосом у самок (млекопитающих).
клетка). Эта компенсация достигается на уровне транскрипции либо путем ускорения транскрипции одиночной Х-хромосомы у самцов ( Drosophila ), либо путем инактивации большой части одной из двух Х-хромосом у самок (млекопитающих).
Инактивация Х-хромосомы у плацентарных млекопитающих, как правило, случайна и включает активацию гена Xist на хромосоме, которая будет инактивирована.
Дифференциальная селекция РНК может позволить некоторым транскриптам войти в цитоплазму, не позволяя другим транскриптам покинуть ядро.
Дифференциальный сплайсинг РНК может создать семейство родственных белков, вызывая считывание различных областей нРНК как экзонов и интронов.То, что является экзоном в одном стечении обстоятельств, может быть интроном в другом.
Некоторые сообщения переводятся только в определенное время. Ооцит, в частности, использует трансляционную регуляцию, чтобы отложить определенные сообщения, которые он расшифровывает во время развития яйцеклетки, но использует только после оплодотворения яйцеклетки. Эта активация часто достигается либо за счет удаления ингибиторных белков, либо за счет полиаденилирования сообщения.
Эта активация часто достигается либо за счет удаления ингибиторных белков, либо за счет полиаденилирования сообщения.
Многие матричные РНК локализованы в определенных областях ооцита или других клеток.Эта локализация, по-видимому, регулируется 3′-нетранслируемой областью мРНК.
Последние разработки в области генетики и вспомогательной репродукции с медицинской точки зрения: от исследований до клинического применения
Два ведущих европейских профессиональных сообщества в области вспомогательной репродукции и медицинской генетики: Европейское общество генетики человека (ESHG) [1] и Европейское Общество репродукции человека и эмбриологии (ESHRE) [2] работает вместе с 2004 года, чтобы оценить влияние быстрого прогресса исследовательских и диагностических технологий на стыке вспомогательной репродукции и медицинской/молекулярной генетики.Ранее результаты двух консенсусных встреч были опубликованы [3, 4] в обоих общественных журналах. Междисциплинарная экспертная группа (далее именуемая в настоящем документе «комиссией») объединила нескольких новых членов и провела третье заседание в Амстердаме (21–22 сентября 2016 г.).
Междисциплинарная экспертная группа (далее именуемая в настоящем документе «комиссией») объединила нескольких новых членов и провела третье заседание в Амстердаме (21–22 сентября 2016 г.).
В последнее время было проведено множество исследований в области геномики, включая в основном продолжающийся переход от традиционной «моногенной генетики» к всестороннему тестированию генома человека путем интеграции массивно-параллельного секвенирования (MPS; или синоним «секвенирование следующего поколения»). подходы вместе с передовой биоинформатикой.В настоящее время возможно выяснить все нуклеотиды (SNV), число копий (CNV) и структурные вариации (SV) генома человека, т. е. за пределами первоначальных медицинских показаний, по которым пациент (вместе с его или ее семьи) был направлен на генетическое тестирование. Эти технологические достижения находят отражение в расширенном скрининге носителей (ECS), аннулировании анонимности доноров гамет, преимплантационном генетическом тестировании (PGT) и неинвазивном пренатальном тестировании (NIPT), а также в нашем понимании основных причин мужского и женского бесплодия. Точно так же проблемы, связанные с заменой митохондрий в ооцитах человека и технологиями межпоколенческого эпигенетического наследования или редактирования генома зародышевой линии (GGE), постепенно приводят к сдвигам парадигмы в области вспомогательных репродуктивных технологий (ВРТ). Поэтому панель в основном сосредоточилась на вышеупомянутых избранных темах, которые в настоящее время внедряются или могут быть внедрены в клиническую практику.
Точно так же проблемы, связанные с заменой митохондрий в ооцитах человека и технологиями межпоколенческого эпигенетического наследования или редактирования генома зародышевой линии (GGE), постепенно приводят к сдвигам парадигмы в области вспомогательных репродуктивных технологий (ВРТ). Поэтому панель в основном сосредоточилась на вышеупомянутых избранных темах, которые в настоящее время внедряются или могут быть внедрены в клиническую практику.
Недавно данные транснационального регистра предоставили доказательства того, что число циклов ВРТ в Европе постепенно увеличивается [5], при этом в 2012 г. было зарегистрировано более 640 000 циклов, что вносит растущий вклад в общую рождаемость во многих странах Европы и за ее пределами.Беспрецедентная сложность генерируемых данных исследований и быстрое (и часто поспешное) внедрение новых технологий в области вспомогательной репродукции, а также репродуктивной генетики затрудняют внедрение результатов исследований в клиническую практику. Таким образом, в связи с растущим влиянием АРТ на население и быстрым развитием исследований внедрение как новых методов диагностики [6], так и методов лечения в рутинную клиническую практику АРТ требует осмотрительности и доказательств [7].
Таким образом, в связи с растущим влиянием АРТ на население и быстрым развитием исследований внедрение как новых методов диагностики [6], так и методов лечения в рутинную клиническую практику АРТ требует осмотрительности и доказательств [7].
Также необходимо признать, что существует размытая граница между исследованиями и их клиническим применением. Вопросы медицинской и юридической ответственности также могут возникнуть, если четко не установлены роли и обязанности различных участников на разных этапах перевода результатов исследования. Генетическое консультирование приобретает все большее значение для пациентов с различными нарушениями, связанными с бесплодием, и для будущих родителей при осознанном репродуктивном выборе.
Целью настоящего консенсусного документа является описание последних достижений в области ВРТ и генетики/геномики, включая их практическое значение для клинического ведения пациентов с генетическими рисками и/или бесплодием.
ЭКС в контексте преконцепции и донорства гамет
Все большее число тестов на носительство аутосомно-рецессивных (АР) заболеваний стало доступным для пар, желающих забеременеть. Первоначально тестирование на носительство было разработано для АР заболеваний, которые часто встречались в определенных этнических группах (например, болезнь Тея-Сакса у евреев-ашкенази, гемоглобинопатии среди населения Средиземноморья и Африки и кистозный фиброз у населения европейского происхождения). Различные профессиональные сообщества рекомендовали тестирование на носительство перед зачатием в группах высокого риска (Американский комитет акушерства и гинекологии, 2015 г. [8]) и Американский колледж медицинской генетики и геномики, 2015 г. [9, 10].Учитывая технологические достижения в области генетического тестирования, панели для ECS стали широко доступны, предлагая параллельный анализ связанных с заболеванием вариантов в нескольких генах для отдельных лиц или пар, независимо от их происхождения. Ряд таких тестов в настоящее время предоставляется в виде коммерческих продуктов и даже в рамках настройки прямого доступа к потребителю (DTC) [11, 12].
Первоначально тестирование на носительство было разработано для АР заболеваний, которые часто встречались в определенных этнических группах (например, болезнь Тея-Сакса у евреев-ашкенази, гемоглобинопатии среди населения Средиземноморья и Африки и кистозный фиброз у населения европейского происхождения). Различные профессиональные сообщества рекомендовали тестирование на носительство перед зачатием в группах высокого риска (Американский комитет акушерства и гинекологии, 2015 г. [8]) и Американский колледж медицинской генетики и геномики, 2015 г. [9, 10].Учитывая технологические достижения в области генетического тестирования, панели для ECS стали широко доступны, предлагая параллельный анализ связанных с заболеванием вариантов в нескольких генах для отдельных лиц или пар, независимо от их происхождения. Ряд таких тестов в настоящее время предоставляется в виде коммерческих продуктов и даже в рамках настройки прямого доступа к потребителю (DTC) [11, 12].
Основная цель ECS у отдельных лиц или пар должна заключаться в том, чтобы информировать их о возможных рисках генетических заболеваний для их будущего потомства и их репродуктивных возможностях, чтобы способствовать самостоятельному репродуктивному выбору [10]. Хотя вторичный результат широко предлагаемых схем ЭКС может снижать частоту целевого состояния, как сообщалось, например, при муковисцидозе [13], его основной целью является обеспечение репродуктивной автономии у испытуемых пар. Таким образом, недирективное консультирование до и после тестирования имеет первостепенное значение в этом контексте [14]. Тем не менее, могут возникнуть сложные вопросы, если «положительная» бесплодная пара-носитель потребует АРТ, отказавшись от ПГД. Будет ли в таком случае морально приемлемым или даже морально обязанным участие медицинских работников, учитывая их обязанность учитывать благополучие возможного будущего ребенка, отказывать в доступе к вспомогательной репродукции? [15].
Хотя вторичный результат широко предлагаемых схем ЭКС может снижать частоту целевого состояния, как сообщалось, например, при муковисцидозе [13], его основной целью является обеспечение репродуктивной автономии у испытуемых пар. Таким образом, недирективное консультирование до и после тестирования имеет первостепенное значение в этом контексте [14]. Тем не менее, могут возникнуть сложные вопросы, если «положительная» бесплодная пара-носитель потребует АРТ, отказавшись от ПГД. Будет ли в таком случае морально приемлемым или даже морально обязанным участие медицинских работников, учитывая их обязанность учитывать благополучие возможного будущего ребенка, отказывать в доступе к вспомогательной репродукции? [15].
Доступная ECS требует правильной стратегии внедрения [10]. В связи с этим в первую очередь необходимо ответить на соответствующие вопросы, а именно: каковы обязанности медицинских работников, которые осматривают пары до наступления беременности; на какие гены и болезни следует проверить; на какие группы населения следует ориентироваться; кто будет платить за ЭКС; знают ли пары, что de novo вариантов, связанных с заболеванием, не учитываются и что некоторые варианты, связанные с заболеванием (например, CNV, SNV) при множественных состояниях AR, не исследуются из-за используемой методологии и присущих ей технических ограничений?
Чтобы обеспечить успешное внедрение ECS среди населения, необходимо приложить усилия для расширения знаний о генетических заболеваниях (т. е., не только по расстройствам АР) в рамках первичной медико-санитарной помощи, среди гинекологов, акушеров и широкой общественности, чтобы создать соответствующую осведомленность и недирективным образом использовать личные преимущества скрининга [16]. Такая информация должна включать остаточные риски тестируемых заболеваний и возрастные риски de novo вариантов, связанных с заболеванием [17]. Важно отметить, что доминантные мутации de novo представляют собой значительную (1-2%) причину генетических нарушений [11, 18].
е., не только по расстройствам АР) в рамках первичной медико-санитарной помощи, среди гинекологов, акушеров и широкой общественности, чтобы создать соответствующую осведомленность и недирективным образом использовать личные преимущества скрининга [16]. Такая информация должна включать остаточные риски тестируемых заболеваний и возрастные риски de novo вариантов, связанных с заболеванием [17]. Важно отметить, что доминантные мутации de novo представляют собой значительную (1-2%) причину генетических нарушений [11, 18].
ESHG рекомендует, чтобы в панелях ECS «приоритет отдавался панелям скрининга на носительство, которые включают (полный набор) тяжелых расстройств, начинающихся в детстве [10].Тесты должны быть разработаны для достижения высокой клинической достоверности (клиническая чувствительность, отрицательные и положительные прогностические значения (PPV) и должны иметь установленную клиническую полезность». Текущие и / или будущие общегеномные подходы к ECS также должны стремиться к минимизации случайных результатов [19] поскольку возможности генетических служб по последующему консультированию ограничены (см. , например, обзор укомплектования кадрами клинической генетики в отдельных европейских странах за 2013 г. из исследования, проведенного ESHG в 2013 г.: [20]).Медицинские работники также должны учитывать индивидуальные различия в восприятии генетического риска и тяжести заболевания населением в целом. Наконец, растущая иммиграция неевропейского населения требует расширения охвата болезнями за счет болезней, особенно встречающихся в больших этнических группах иммигрантов, и может создавать проблемы с интерпретацией и консультированием как из-за различного спектра вариантов, связанных с болезнью (часто с неясным фенотипическим влиянием, так как в неевропейском населении в целом недостаточно доказательств из-за нехватки соответствующих исследований) и из-за расходящихся культурных представлений об обследованных людях и/или их семьях [16, 21, 22].
, например, обзор укомплектования кадрами клинической генетики в отдельных европейских странах за 2013 г. из исследования, проведенного ESHG в 2013 г.: [20]).Медицинские работники также должны учитывать индивидуальные различия в восприятии генетического риска и тяжести заболевания населением в целом. Наконец, растущая иммиграция неевропейского населения требует расширения охвата болезнями за счет болезней, особенно встречающихся в больших этнических группах иммигрантов, и может создавать проблемы с интерпретацией и консультированием как из-за различного спектра вариантов, связанных с болезнью (часто с неясным фенотипическим влиянием, так как в неевропейском населении в целом недостаточно доказательств из-за нехватки соответствующих исследований) и из-за расходящихся культурных представлений об обследованных людях и/или их семьях [16, 21, 22].
ЭКС может быть полезной для бесплодных пар, когда донорские гаметы используются для подбора донора с соответствующим партнером [11, 23]. Пары, у которых уже есть ребенок с моногенным заболеванием, также могут быть заинтересованы в том, чтобы избежать других генетических нарушений, и кровнородственные пары также могут извлечь выгоду из этого подхода. Следовательно, более широкое использование ЭКС может привести к более широкому использованию ПГД и, таким образом, к менее частой потребности в пренатальной диагностике (ПНД), что приводит к уменьшению планового прерывания беременности (ЭТП) при тяжелых генетических заболеваниях.Кроме того, антенатальная ЭКС и генетическое тестирование на разных этапах жизни могут быть взаимосвязаны. В то время как ранние предложения ECS до зачатия могут быть нацелены на серьезные детские состояния, для которых PGD или PND являются вариантами предотвращения живорождения больного ребенка, ECS может также включать излечимые состояния (например, фенилкетонурию или дефицит ацил-КоА-дегидрогеназы со средней длиной цепи). для возможности лечения сразу после рождения или даже во время беременности (например, дефицит 21-гидроксилазы/врожденная гиперплазия надпочечников) [24, 25].
Следовательно, более широкое использование ЭКС может привести к более широкому использованию ПГД и, таким образом, к менее частой потребности в пренатальной диагностике (ПНД), что приводит к уменьшению планового прерывания беременности (ЭТП) при тяжелых генетических заболеваниях.Кроме того, антенатальная ЭКС и генетическое тестирование на разных этапах жизни могут быть взаимосвязаны. В то время как ранние предложения ECS до зачатия могут быть нацелены на серьезные детские состояния, для которых PGD или PND являются вариантами предотвращения живорождения больного ребенка, ECS может также включать излечимые состояния (например, фенилкетонурию или дефицит ацил-КоА-дегидрогеназы со средней длиной цепи). для возможности лечения сразу после рождения или даже во время беременности (например, дефицит 21-гидроксилазы/врожденная гиперплазия надпочечников) [24, 25].
Наконец, появляется все больше доказательств того, что комбинированный низкосортный соматический и зародышевый мозаицизм ускользает от современных методов обнаружения и что рутинное использование лейкоцитов крови в качестве показателя для исследования зародышевой изменчивости недостаточно. Таким образом, если это экономически и технически возможно, было бы разумно проверить в неясных случаях генетическую изменчивость в трех основных эмбриональных линиях у данного пациента, чтобы оценить степень потенциального постзиготического мозаицизма (т.д., из лейкоцитов, отражающих мезодерму, клеток осадка мочи — энтодермы и клеток сухого буккального мазка или волосяных фолликулов — эктодермы). Тем не менее, даже после такого сложного подхода к генетическому тестированию полностью исключить мозаицизм нельзя. В этом отношении невыявленный родительский мозаицизм низкой степени может быть причиной ошибочно присвоенного «статуса de novo » для наблюдаемой изменчивости и может исказить консультирование по риску рецидива [26]. Таким образом, следует всегда упоминать о возможном зародышевом мозаицизме, а пары должны быть проинформированы об эмпирическом риске рецидива <1% в вариантах simplex de novo [27].
Таким образом, если это экономически и технически возможно, было бы разумно проверить в неясных случаях генетическую изменчивость в трех основных эмбриональных линиях у данного пациента, чтобы оценить степень потенциального постзиготического мозаицизма (т.д., из лейкоцитов, отражающих мезодерму, клеток осадка мочи — энтодермы и клеток сухого буккального мазка или волосяных фолликулов — эктодермы). Тем не менее, даже после такого сложного подхода к генетическому тестированию полностью исключить мозаицизм нельзя. В этом отношении невыявленный родительский мозаицизм низкой степени может быть причиной ошибочно присвоенного «статуса de novo » для наблюдаемой изменчивости и может исказить консультирование по риску рецидива [26]. Таким образом, следует всегда упоминать о возможном зародышевом мозаицизме, а пары должны быть проинформированы об эмпирическом риске рецидива <1% в вариантах simplex de novo [27].
Таким образом, ЭКС может дать ложное чувство уверенности, и неспециалисты и специалисты должны быть должным образом информированы в этом отношении [10].
Комиссия рекомендует национальным профессиональным организациям в области АРТ и медицинской/клинической генетики либо принять соответствующие международные руководства по ЭКС с изменениями, если это необходимо, либо разработать собственные руководства о том, как ответственно обеспечить доступность ЭКС для соответствующих групп населения. Комиссия также призывает поставщиков ECS открыто заявить о присущих применяемой методологии ограничениях.
Достижения в генетическом тестировании и лишение анонимности доноров гамет
Исторически донорство гамет было преимущественно анонимным. Более того, многие гетеросексуальные родители предпочитают не раскрывать своим детям происхождение донора, независимо от того, было ли пожертвование анонимным или нет [28, 29]. Большинство, но не все европейские страны делегируют решение о раскрытии информации родителям [30].
Некоторые регистры, такие как Реестр братьев и сестер-доноров [31], Реестр зачатых донорами [32] и Генеалогическое древо ДНК [33], позволяют донорам, детям, зачатым донором, и братьям и сестрам-донорам отслеживать друг друга с помощью генетического тестирования происхождения, таким образом возможно изменение анонимности донора. Когда обе стороны согласились найти генетических родственников, этические и юридические проблемы невелики. Однако в контексте генетического тестирования DTC обнаружение родственников может быть случайным, и/или родственники могут быть отслежены без их предварительного уведомления или согласия. В связи с этим генетическое тестирование DTC уже использовалось несколькими миллионами человек для определения их происхождения [30]. Результаты этих тестов, которые обычно предоставляются на коммерческой основе, позволяют потребителю подобрать родственников «в режиме онлайн».Эта стратегия также уже широко используется усыновленными и найденышами [34]. Кроме того, доступная в настоящее время стоимость генетического тестирования DTC делает его доступным для большинства потребителей в Европе и за ее пределами.
Когда обе стороны согласились найти генетических родственников, этические и юридические проблемы невелики. Однако в контексте генетического тестирования DTC обнаружение родственников может быть случайным, и/или родственники могут быть отслежены без их предварительного уведомления или согласия. В связи с этим генетическое тестирование DTC уже использовалось несколькими миллионами человек для определения их происхождения [30]. Результаты этих тестов, которые обычно предоставляются на коммерческой основе, позволяют потребителю подобрать родственников «в режиме онлайн».Эта стратегия также уже широко используется усыновленными и найденышами [34]. Кроме того, доступная в настоящее время стоимость генетического тестирования DTC делает его доступным для большинства потребителей в Европе и за ее пределами.
С ростом использования генетического тестирования DTC анонимность доноров гамет больше не может быть гарантирована [30, 35]. Донорам недостаточно воздерживаться от внесения генетических данных в банк данных. Если это сделает кто-то из их родственников, семья донора может быть «побочно» идентифицирована.Также дети, родители которых не сообщили, что они были зачаты донором, могут непреднамеренно узнать о своем донорском происхождении. Генетическое тестирование DTC может предоставить интересную информацию о происхождении человека (хотя даже в этом случае существует вероятность серьезного неправильного использования такой информации [36]), а иногда даже полезную информацию о генетической предрасположенности. Кроме того, дети, зачатые донором, также могут найти своих сводных братьев и сестер, самого донора или других родственников посредством проверки родословной [37, 38].
Если это сделает кто-то из их родственников, семья донора может быть «побочно» идентифицирована.Также дети, родители которых не сообщили, что они были зачаты донором, могут непреднамеренно узнать о своем донорском происхождении. Генетическое тестирование DTC может предоставить интересную информацию о происхождении человека (хотя даже в этом случае существует вероятность серьезного неправильного использования такой информации [36]), а иногда даже полезную информацию о генетической предрасположенности. Кроме того, дети, зачатые донором, также могут найти своих сводных братьев и сестер, самого донора или других родственников посредством проверки родословной [37, 38].
Следовательно, анонимные доноры гамет должны быть проинформированы о том, что, хотя центр репродукции или агентство доноров будут стремиться защитить их личность, их анонимность не может быть полностью гарантирована. Они должны быть осведомлены о том, что даже если они не представят свою ДНК в один из реестров доноров, они могут быть идентифицированы сами или один из их родственников. Кроме того, собственное (будущее) биологическое потомство донора может найти сводных братьев и сестер через эти реестры. Те, кто жертвует или зачинает с помощью донорских гамет, должны помнить об этой возможности при принятии решения о том, раскрывать ли свой статус донора / зачатие донора своим родственникам.Другая возникающая проблема связана с тем фактом, что раскрытие личности вновь открывает обоснованный анализ и юридические дискуссии о количественных ограничениях в режимах зачатия доноров с точки зрения их потенциального популяционно-генетического воздействия [39].
Кроме того, собственное (будущее) биологическое потомство донора может найти сводных братьев и сестер через эти реестры. Те, кто жертвует или зачинает с помощью донорских гамет, должны помнить об этой возможности при принятии решения о том, раскрывать ли свой статус донора / зачатие донора своим родственникам.Другая возникающая проблема связана с тем фактом, что раскрытие личности вновь открывает обоснованный анализ и юридические дискуссии о количественных ограничениях в режимах зачатия доноров с точки зрения их потенциального популяционно-генетического воздействия [39].
Комиссия рекомендует информировать пациентов, проходящих ВРТ-терапию с использованием донорских гамет, о том, что их дети могут в конечном итоге обнаружить своего донора с помощью генетического тестирования. Кроме того, лаборатории, предлагающие генетическое тестирование DTC, должны прозрачно информировать своих клиентов о потенциальном влиянии их услуг на возможное обнаружение отсутствия отцовства или неизвестных родственных связей.
Центры ВРТ, использующие анонимных доноров гамет, должны предоставлять четкую информацию о том, что в конечном итоге доноров можно будет отследить.
Достижения в области генетики нарушений фертильности
В области мужского (MI) и женского (FI) бесплодия были достигнуты значительные успехи в исследованиях основных генетических причин бесплодия. Однако необходимо отметить, что ИМ/ФИ имеют сложное многофакторное происхождение и имеют очень широкий спектр клинических проявлений.Более того, диагноз «бесплодие» обычно определяется только в клинических терминах, при этом в научных исследованиях проводится небольшая априорная стратификация пациентов. Большая часть заявленного прогресса в исследованиях в основном связана с использованием MPS и других «омных» технологий, включая современные подходы в области биоинформатики. Тем не менее, несмотря на такие успехи, современные варианты лечения ИМ/ИМ не достигли существенного прогресса [40, 41].
Мужское бесплодие
Алгоритм генетического тестирования при ИМ не изменился. За кариотипированием (главным образом направленным на изучение аберраций гоносом, которые являются основной причиной ИМ) следует тестирование ассоциированных с заболеванием вариантов в гене CFTR и/или микроделеций Y-хромосомы. Однако примерно в 40% всех случаев ИМ лежащий в основе генетический патогенез неизвестен, так называемый «идиопатический ИМ» [42]. Генетика может сыграть свою роль, но все еще необходимо добиться прогресса в понимании роли факторов окружающей среды, например, ожирения или эндокринных нарушений [43], курения и загрязнения воздуха [40] и эпигенетических механизмов (см. далее).Другим фактором, который важно учитывать в западных популяциях, является увеличение возраста отца и одновременное увеличение числа вариантов, связанных с заболеванием зародышевой линии de novo [44].
За кариотипированием (главным образом направленным на изучение аберраций гоносом, которые являются основной причиной ИМ) следует тестирование ассоциированных с заболеванием вариантов в гене CFTR и/или микроделеций Y-хромосомы. Однако примерно в 40% всех случаев ИМ лежащий в основе генетический патогенез неизвестен, так называемый «идиопатический ИМ» [42]. Генетика может сыграть свою роль, но все еще необходимо добиться прогресса в понимании роли факторов окружающей среды, например, ожирения или эндокринных нарушений [43], курения и загрязнения воздуха [40] и эпигенетических механизмов (см. далее).Другим фактором, который важно учитывать в западных популяциях, является увеличение возраста отца и одновременное увеличение числа вариантов, связанных с заболеванием зародышевой линии de novo [44].
Недавно проведенное в одном центре 9-летнее проспективное исследование, включающее 1737 случаев, выявило основные причины ИМ у 40% всех пациентов в отношении «снижения общего количества сперматозоидов» [45]. Дополнительный прогресс был достигнут благодаря анализу протеомики и профилирования экспрессии [46], включая изучение соответствующих моделей животных (например, информатика генома мыши) [47] и микробиома репродуктивного тракта [48].Однако применение результатов исследования в рутинной клинической практике затруднено из-за нечетких определений изучаемых когорт ИМ, в том числе нечеткой спецификации «идиопатического ИМ» (т. е. какие критерии исключения применялись, какие тесты исключения использовались?), что исключает репликацию. или доказательный метаанализ [49]. Еще один сбивающий с толку фактор связан с тем, что во многих исследованиях используются разные стандарты анализа спермы и не всегда придерживаются стандартизированных критериев Всемирной организации здравоохранения [49].
Дополнительный прогресс был достигнут благодаря анализу протеомики и профилирования экспрессии [46], включая изучение соответствующих моделей животных (например, информатика генома мыши) [47] и микробиома репродуктивного тракта [48].Однако применение результатов исследования в рутинной клинической практике затруднено из-за нечетких определений изучаемых когорт ИМ, в том числе нечеткой спецификации «идиопатического ИМ» (т. е. какие критерии исключения применялись, какие тесты исключения использовались?), что исключает репликацию. или доказательный метаанализ [49]. Еще один сбивающий с толку фактор связан с тем, что во многих исследованиях используются разные стандарты анализа спермы и не всегда придерживаются стандартизированных критериев Всемирной организации здравоохранения [49].
Ассоциация вариаций SNV [50], полученная из полногеномных ассоциативных исследований (GWAS) при ИМ, часто основывается на небольших когортах [42]. Тем не менее, был достигнут заметный прогресс в идентификации генов заболеваний и связанных с заболеванием вариантов при «несиндромальном» ИМ. Некоторые из наиболее известных случаев включают тератозооспермию в ее редких формах, характеризующихся глобозооспермией с вариациями, связанными с заболеванием, обнаруженными в DPY19L2 [51]; SPATA16 [52], макрозооспермия у AURKC [53], изменения жгутиков сперматозоидов у TUN-STBG1 (Viville et al.2017; личное сообщение) и астенозооспермия в ДНКх2 [54] , CATSPER1 , GALNTL5 [55]. В случае нарушения сперматогенеза, характеризующегося азооспермией и/или олигозооспермией, также был достигнут прогресс в идентификации генов болезни, включающих, например, NR0B1 , NR5A1 , TEX11 , TEX15 [56] и [56] и . MageB4 , NANOS1 , NR5A1 , NR5A1 , SOHLH2 , SYCE1 , TAF4B , WT1 и ZMYND15 и ZMYND15 (в алфавитном порядке) (см. Таблицу 1 для имена генов).Интересно, что TEX11 является Х-сцепленным геном с вариантами, связанными с гемизиготными заболеваниями как SNV, так и CNV, вызывающими остановку мейоза у мужчин, передаваемых женщинами [57].
Некоторые из наиболее известных случаев включают тератозооспермию в ее редких формах, характеризующихся глобозооспермией с вариациями, связанными с заболеванием, обнаруженными в DPY19L2 [51]; SPATA16 [52], макрозооспермия у AURKC [53], изменения жгутиков сперматозоидов у TUN-STBG1 (Viville et al.2017; личное сообщение) и астенозооспермия в ДНКх2 [54] , CATSPER1 , GALNTL5 [55]. В случае нарушения сперматогенеза, характеризующегося азооспермией и/или олигозооспермией, также был достигнут прогресс в идентификации генов болезни, включающих, например, NR0B1 , NR5A1 , TEX11 , TEX15 [56] и [56] и . MageB4 , NANOS1 , NR5A1 , NR5A1 , SOHLH2 , SYCE1 , TAF4B , WT1 и ZMYND15 и ZMYND15 (в алфавитном порядке) (см. Таблицу 1 для имена генов).Интересно, что TEX11 является Х-сцепленным геном с вариантами, связанными с гемизиготными заболеваниями как SNV, так и CNV, вызывающими остановку мейоза у мужчин, передаваемых женщинами [57].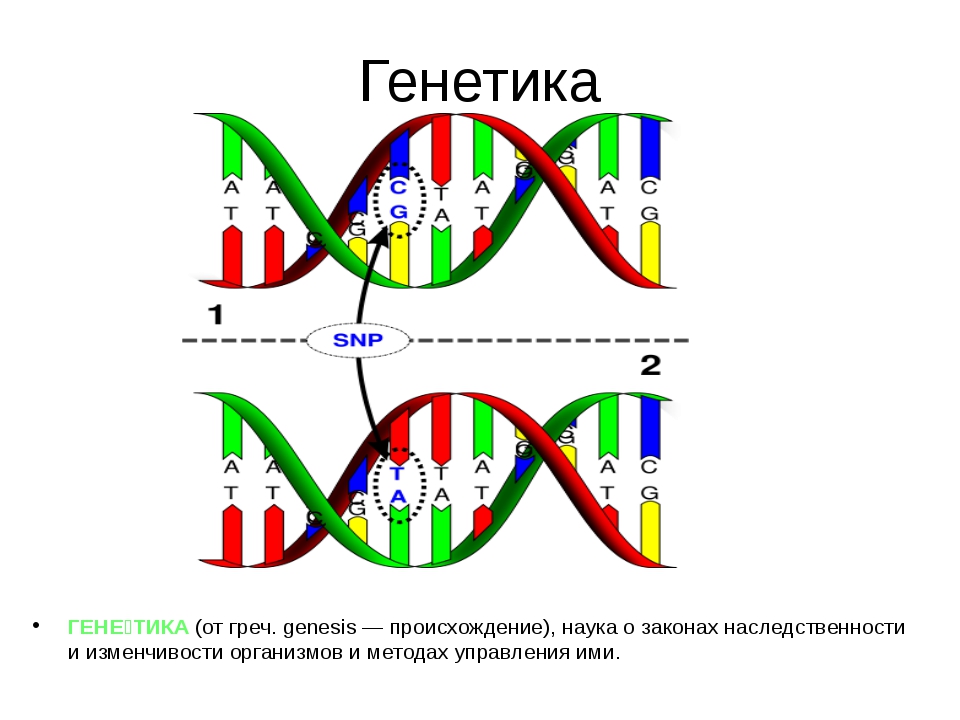 Хотя до сих пор не наблюдалось преобладающих вариаций, связанных с заболеванием, с клинической точки зрения выявление таких вариаций, связанных с нарушением сперматогенеза, может указывать на полезность криоконсервации спермы в соответствующем возрасте для сохранения фертильности у вовлеченных лиц. В настоящее время разрабатываются новые целевые анализы биомаркеров [40], которые могут улучшить генетическое консультирование и стратификацию пациентов для таргетного лечения АРТ.
Хотя до сих пор не наблюдалось преобладающих вариаций, связанных с заболеванием, с клинической точки зрения выявление таких вариаций, связанных с нарушением сперматогенеза, может указывать на полезность криоконсервации спермы в соответствующем возрасте для сохранения фертильности у вовлеченных лиц. В настоящее время разрабатываются новые целевые анализы биомаркеров [40], которые могут улучшить генетическое консультирование и стратификацию пациентов для таргетного лечения АРТ.
Осведомленность о редких генетических синдромах также имеет значение при необъяснимом ИМ. Хотя такие синдромы часто выявляются на основании анамнеза и семейного анамнеза, типичных дисморфических признаков, сопутствующих нарушений и медицинского осмотра, т. е. до постановки диагноза самого ИМ, могут быть легкие формы этих заболеваний, проявляющиеся во взрослом возрасте как ИМ, в связи с улучшением состояния. стандартная медицинская и социальная помощь.Эти клинические формы, например, включают гипогонадотропный гипогонадизм (синдром Каллмана — MIM: 308700), где MPS привел к идентификации дополнительных генов-кандидатов [58]. Прогресс в исследованиях синдрома Клайнфельтера был достигнут за счет применения транскриптомного анализа яичек [59]. ИМ также часто ассоциируется с редкими синдромами с неправильным опущением яичек, где большая часть прогресса в исследованиях снова связана с применением МФС и биоинформатики: Noonan — MIM: 163950 [60], ключично-черепная дисплазия — MIM: 119600 [61], Блума — MIM: 210900 [62] и синдромы Сильвера-Рассела — MIM: 180860 [63].Подобным образом, первичная цилиарная дискинезия (MIM: 244400) и миотоническая дистрофия 1 (MIM: 160900), которые в своих более легких формах связаны с ИМ, подвергались сходным исследовательским стратегиям [64, 65].
стандартная медицинская и социальная помощь.Эти клинические формы, например, включают гипогонадотропный гипогонадизм (синдром Каллмана — MIM: 308700), где MPS привел к идентификации дополнительных генов-кандидатов [58]. Прогресс в исследованиях синдрома Клайнфельтера был достигнут за счет применения транскриптомного анализа яичек [59]. ИМ также часто ассоциируется с редкими синдромами с неправильным опущением яичек, где большая часть прогресса в исследованиях снова связана с применением МФС и биоинформатики: Noonan — MIM: 163950 [60], ключично-черепная дисплазия — MIM: 119600 [61], Блума — MIM: 210900 [62] и синдромы Сильвера-Рассела — MIM: 180860 [63].Подобным образом, первичная цилиарная дискинезия (MIM: 244400) и миотоническая дистрофия 1 (MIM: 160900), которые в своих более легких формах связаны с ИМ, подвергались сходным исследовательским стратегиям [64, 65].
Комиссия рекомендует использовать стандартизированную клиническую терминологию и критерии включения/исключения для ИМ, чтобы позволить повторным исследованиям и научно обоснованным метаанализам продвинуться вперед.
Благодаря быстрому прогрессу в исследованиях, выбранные генные панели вскоре могут стать полезным инструментом, позволяющим идентифицировать дополнительные причины ИМ и, таким образом, улучшать генетическое и репродуктивное консультирование, облегчать стратификацию пациентов и, следовательно, обеспечивать более точные подходы к АРТ.
Женское бесплодие
Так же, как и в случае ИМ, быстро продвигаются исследования основных генетических причин ИМ. Тем не менее относительно мало известно о генетическом фоне большинства случаев ФИ или женского бесплодия (FSF), и еще меньше известно о новой клинической практике. Очевидно, что ФИ имеет сложное многофакторное происхождение, что отражается в клинической и генетической гетерогенности изучаемых когорт, что затем затрудняет воспроизводимость ранее проведенных анализов.Предположительно сотни генов должны точно взаимодействовать во время определения пола, гаметогенеза, сложных действий/взаимодействий гормонов, имплантации эмбриона и его раннего развития, чтобы создать здоровое потомство. Таким образом, ожидается, что расстройства, связанные с FI/FSF, будут в высокой степени полигенными [66]. Учитывая, что у мышей более 500 генов уже связаны с FI (MGI, см. выше), в ближайшие годы предстоит идентифицировать еще много генов болезней у людей. Некодирующие РНК и эпигенетические модификации также участвуют в контроле функции яичников, поэтому их нарушения, вероятно, связаны с FI [67].
Таким образом, ожидается, что расстройства, связанные с FI/FSF, будут в высокой степени полигенными [66]. Учитывая, что у мышей более 500 генов уже связаны с FI (MGI, см. выше), в ближайшие годы предстоит идентифицировать еще много генов болезней у людей. Некодирующие РНК и эпигенетические модификации также участвуют в контроле функции яичников, поэтому их нарушения, вероятно, связаны с FI [67].
Хромосомные аберрации остаются основной известной причиной преждевременной недостаточности яичников (POI) и повторных выкидышей, что снижает шансы на успешную беременность [68, 69]. Значительная часть нарушений полового развития также вызвана аберрациями гоносом, а для других этиологий, таких как гипоталамо-гипофизарно-гонадная недостаточность, уже идентифицировано множество дополнительных болезнетворных генов [70].
Был достигнут некоторый прогресс в понимании роли генетических генов, вызывающих заболевание, в распространенных многофакторных заболеваниях, таких как синдром поликистозных яичников (СПКЯ) и эндометриоз, каждое из которых затрагивает около 10% женщин с FI/FSF. При СПКЯ лучшая стратификация пациентов и функциональная геномика могут обеспечить новые направления исследований [71, 72], в то время как при эндометриозе [73] аномальные эпигенетические механизмы в стромальных клетках могут играть патогенную роль. [74]. ПНЯ крайне клинически гетерогенна и связана либо с дисгенезией яичников, проявляющейся первичной аменореей, либо со вторичной аменореей.Однако большинство случаев ПНЯ являются «идиопатическими». Дополнительные гены, вызывающие заболевание, были идентифицированы с помощью подходов к генам-кандидатам, GWAS и/или анализа всего экзома с использованием MPS. Однако ассоциированные с заболеванием варианты в этих генах были зарегистрированы в довольно небольшом числе случаев, некоторые из которых были ограничены определенными популяциями [66, 67, 75]. Интересно, что недавние исследования выявили сложную генетическую архитектуру POI [76]. Авторы проверили как известные, так и потенциальные гены-кандидаты в клинически хорошо охарактеризованной когорте пациентов.
При СПКЯ лучшая стратификация пациентов и функциональная геномика могут обеспечить новые направления исследований [71, 72], в то время как при эндометриозе [73] аномальные эпигенетические механизмы в стромальных клетках могут играть патогенную роль. [74]. ПНЯ крайне клинически гетерогенна и связана либо с дисгенезией яичников, проявляющейся первичной аменореей, либо со вторичной аменореей.Однако большинство случаев ПНЯ являются «идиопатическими». Дополнительные гены, вызывающие заболевание, были идентифицированы с помощью подходов к генам-кандидатам, GWAS и/или анализа всего экзома с использованием MPS. Однако ассоциированные с заболеванием варианты в этих генах были зарегистрированы в довольно небольшом числе случаев, некоторые из которых были ограничены определенными популяциями [66, 67, 75]. Интересно, что недавние исследования выявили сложную генетическую архитектуру POI [76]. Авторы проверили как известные, так и потенциальные гены-кандидаты в клинически хорошо охарактеризованной когорте пациентов. Варианты, связанные с болезнями, были найдены, например, в BMP15 , Figla , Foxl2 , GALT , GDF9 , LHX8, NOBOX , Rec8 , SMC1β и SOHLH2 (в алфавитном порядке), которые попадают в функциональные категории транскрипционного фактора TGF-β, лиганда, фермента и «мейоза» [53]. В последней категории другие авторы сообщали об ассоциированных с заболеванием вариантах в STAG3 [77], SYCE1 [78], HFM1 [79], MCM8 и MCM9 [80] (табл. 1 для гена имена).С клинической точки зрения вариации, связанные с ПНЯ, также могут предсказывать риск преждевременной менопаузы в затронутых семьях [67, 81].
Варианты, связанные с болезнями, были найдены, например, в BMP15 , Figla , Foxl2 , GALT , GDF9 , LHX8, NOBOX , Rec8 , SMC1β и SOHLH2 (в алфавитном порядке), которые попадают в функциональные категории транскрипционного фактора TGF-β, лиганда, фермента и «мейоза» [53]. В последней категории другие авторы сообщали об ассоциированных с заболеванием вариантах в STAG3 [77], SYCE1 [78], HFM1 [79], MCM8 и MCM9 [80] (табл. 1 для гена имена).С клинической точки зрения вариации, связанные с ПНЯ, также могут предсказывать риск преждевременной менопаузы в затронутых семьях [67, 81].
Список болезнетворных генов, связанных с «синдромной» ПНЯ, где ее патогенез связан с другими клиническими формами, был рассмотрен в другом месте [75]. Во многих случаях эти мультисистемные синдромы, а не сам FI, приводят к клинической диагностике и направлению на генетическое тестирование, часто в дорепродуктивном возрасте. Примером могут служить ассоциированные с заболеванием варианты в гене FOXL2 .Изменение функции этого гена вызывает синдром блефарофимоза/птоза/обратного эпикантуса (BPES; MIM: 110100) с ПНЯ или без него. Прогрессирующая наружная офтальмоплегия (MIM: 157640) вместе с другими симптомами, включая POI, вызвана ассоциированными с заболеванием вариантами в POLG , что указывает на патологию, связанную с митохондриями [82]. Ассоциированные с заболеванием варианты в GALT (MIM: 230400 для галактоземии), PMM2 (MIM: 212065 для врожденных нарушений гликозилирования типа Ia), CLPP (MIM: 614921 для врожденных нарушений гликозилирования типа It), NOG (MIM: 185800 и 186500 для симфалангизма 1a и синдрома множественных синостозов 1 соответственно), EIF2B2 (MIM: 603896 для лейкоэнцефалии с исчезающим синдромом белого вещества) и HARS2 (MIM: 157400 для прогрессирующей наружной офтальмопатии) делеции мтДНК) также были вторично вовлечены в POI (см.
Примером могут служить ассоциированные с заболеванием варианты в гене FOXL2 .Изменение функции этого гена вызывает синдром блефарофимоза/птоза/обратного эпикантуса (BPES; MIM: 110100) с ПНЯ или без него. Прогрессирующая наружная офтальмоплегия (MIM: 157640) вместе с другими симптомами, включая POI, вызвана ассоциированными с заболеванием вариантами в POLG , что указывает на патологию, связанную с митохондриями [82]. Ассоциированные с заболеванием варианты в GALT (MIM: 230400 для галактоземии), PMM2 (MIM: 212065 для врожденных нарушений гликозилирования типа Ia), CLPP (MIM: 614921 для врожденных нарушений гликозилирования типа It), NOG (MIM: 185800 и 186500 для симфалангизма 1a и синдрома множественных синостозов 1 соответственно), EIF2B2 (MIM: 603896 для лейкоэнцефалии с исчезающим синдромом белого вещества) и HARS2 (MIM: 157400 для прогрессирующей наружной офтальмопатии) делеции мтДНК) также были вторично вовлечены в POI (см. выше) (см. Таблицу 1 для названий генов).Аналогичным образом, ассоциированные с заболеванием варианты в нескольких различных болезнетворных генах ( CLPP , HARS2 , HSD17B4 , LARS2 и TWNK ; в алфавитном порядке (названия генов см. в таблице 1) участвуют в развитии. синдрома Перро (MIM: 233400), который связан с нейросенсорной тугоухостью и дисфункцией яичников [83]. Наконец, экспансии CGG в «предмутационном диапазоне» в гене FMR1 остаются хорошо установленной причиной изолированной ПНЯ, чаще в семьях с синдромом Fragile X (MIM: 300624), чем в спорадических случаях ПНЯ.
выше) (см. Таблицу 1 для названий генов).Аналогичным образом, ассоциированные с заболеванием варианты в нескольких различных болезнетворных генах ( CLPP , HARS2 , HSD17B4 , LARS2 и TWNK ; в алфавитном порядке (названия генов см. в таблице 1) участвуют в развитии. синдрома Перро (MIM: 233400), который связан с нейросенсорной тугоухостью и дисфункцией яичников [83]. Наконец, экспансии CGG в «предмутационном диапазоне» в гене FMR1 остаются хорошо установленной причиной изолированной ПНЯ, чаще в семьях с синдромом Fragile X (MIM: 300624), чем в спорадических случаях ПНЯ.
Недавно в нескольких семьях были описаны доминантно-негативные ассоциированные с заболеванием варианты в гене TUBB8 , вызывающие дефекты сборки веретена и приводящие к остановке созревания ооцитов. Это аутосомное заболевание передавалось либо мужчинами, либо de novo, а его фенотип был специфичен для женщин [84]. Ассоциированные с заболеванием варианты в TLE6 были связаны с преимплантационной эмбриональной летальностью [85]. Хотя существование истинного синдрома пустых фолликулов все еще является предметом споров, при этом заболевании сообщалось об ассоциированных с заболеванием вариантах в гене рецептора ЛГ/ХГ ( LHCGR ) [86].
Хотя существование истинного синдрома пустых фолликулов все еще является предметом споров, при этом заболевании сообщалось об ассоциированных с заболеванием вариантах в гене рецептора ЛГ/ХГ ( LHCGR ) [86].
Также были достигнуты успехи в исследованиях фармакогеномики, направленных на выявление генетической изменчивости, связанной с индивидуальной реакцией на контролируемую гиперстимуляцию яичников (КГЯ). Хотя известно несколько генов-кандидатов, только вариация рецептора ФСГ ( FSHR ) («полиморфизм» p.Asn680Ser) имеет клиническую ценность благодаря своей определенной прогностической ценности [87], и эта вариация также была связана с некоторыми случаями ПОИ [88].
Комиссия пришла к выводу, что увеличение знаний о генетическом фоне вместе с быстрым технологическим развитием может способствовать улучшению диагностики FI.Это означает, что в дополнение к текущему рутинному тестированию пациентов с ПНЯ на хромосомные аберрации и премутации FMR1 выбранные генные панели вскоре могут стать полезным инструментом, позволяющим идентифицировать дополнительные причины ФИ и, таким образом, улучшить генетическое и репродуктивное консультирование и стратификация пациентов.
То же самое верно для женщин с бесплодием, которые не производят или производят только нежизнеспособные ооциты, или женщин, страдающих преждевременной менопаузой. В конце концов, донорство ооцитов может быть предложено более персонализированным образом в FI.
Достижения в PGT
PGT определяется как междисциплинарное клиническое применение генетических и ВРТ-технологий, направленное на исследование ограниченного числа клеток эмбриона в предимплантационной фазе его развития in vitro, т. е. в контексте ЭКО. PGT представляет собой сложную последовательную лабораторную процедуру, которая требует междисциплинарного сотрудничества специалистов по ВРТ с лабораторными генетиками, имеющими опыт анализа минимального количества клеток.
В настоящее время произвольное различие между двумя основными модальностями PGT, включающими PGD и PGS, постепенно стирается, поскольку с технической точки зрения одновременно проводится генетическое лабораторное тестирование полногеномных вариаций SNV и CNV. Это также отражено в предлагаемом изменении номенклатуры этих лабораторных процедур в «Международном глоссарии по бесплодию и лечению бесплодия», который в настоящее время готовится Международным комитетом по мониторингу вспомогательных репродуктивных технологий [89].Там PGT станет «основным процедурным термином», к которому могут быть присоединены скрининг / тестирование хромосомной анеуплоидии (PGT-A) и диагностика моногенного заболевания PGT (PGT-M) или любой другой метод генетического тестирования.
Это также отражено в предлагаемом изменении номенклатуры этих лабораторных процедур в «Международном глоссарии по бесплодию и лечению бесплодия», который в настоящее время готовится Международным комитетом по мониторингу вспомогательных репродуктивных технологий [89].Там PGT станет «основным процедурным термином», к которому могут быть присоединены скрининг / тестирование хромосомной анеуплоидии (PGT-A) и диагностика моногенного заболевания PGT (PGT-M) или любой другой метод генетического тестирования.
PGT-M предназначен для диагностики специфического «менделевского» генетического нарушения у эмбриона, в отношении которого будущие родители находятся в группе повышенного риска [90]. PGT-M имеет преимущество перед обычным PND, поскольку исключает необходимость рассмотрения ETP при продолжающейся беременности с нарушениями.
PGT-A (также известная в литературе как PGS, «PGD для скрининга/тестирования анеуплоидии/- PGD-AS» или «PGD для анеуплоидии – PGD-A») направлена на выявление хромосомной анеуплоидии (одной или нескольких из 23 хромосом человека) для того, чтобы выбрать (т. д., «экран») эмбрионов без ассоциированных с заболеванием хромосомных аберраций. Ожидается, что эти эмбрионы будут иметь самые высокие шансы на здоровое живорождение. PGT-A в основном проводится для повышения эффективности ЭКО [91]. Положительный эффект PGT-A с использованием технологии «комплексного хромосомного скрининга» на клинические и устойчивые показатели имплантации, в частности, у пациенток с нормальным овариальным резервом, был задокументирован в метаанализе [92]. Однако, поскольку исследования, включенные в вышеупомянутую статью, относятся только к пациентам с хорошим прогнозом, необходимы дополнительные данные для подтверждения достоверности PGT-A для улучшения клинических результатов PGT-A у других категорий пациентов и на различных этапах биопсии эмбриона [7]. ].Важно отметить, что, поскольку «успех ЭКО» по-разному определяется разными авторами, практически невозможно сравнивать результаты различных исследований в рамках доказательного метаанализа [91]. Улучшенная стратификация пациентов перед PGT-A поможет оценить, какая стратегия тестирования оптимальна для конкретных групп пациентов.
д., «экран») эмбрионов без ассоциированных с заболеванием хромосомных аберраций. Ожидается, что эти эмбрионы будут иметь самые высокие шансы на здоровое живорождение. PGT-A в основном проводится для повышения эффективности ЭКО [91]. Положительный эффект PGT-A с использованием технологии «комплексного хромосомного скрининга» на клинические и устойчивые показатели имплантации, в частности, у пациенток с нормальным овариальным резервом, был задокументирован в метаанализе [92]. Однако, поскольку исследования, включенные в вышеупомянутую статью, относятся только к пациентам с хорошим прогнозом, необходимы дополнительные данные для подтверждения достоверности PGT-A для улучшения клинических результатов PGT-A у других категорий пациентов и на различных этапах биопсии эмбриона [7]. ].Важно отметить, что, поскольку «успех ЭКО» по-разному определяется разными авторами, практически невозможно сравнивать результаты различных исследований в рамках доказательного метаанализа [91]. Улучшенная стратификация пациентов перед PGT-A поможет оценить, какая стратегия тестирования оптимальна для конкретных групп пациентов. Поэтому в настоящее время благоприятные эффекты ПГТ-А не имеют достаточного уровня доказательности, так как не опубликованы результаты стандартизированных РКИ [7].Поскольку PGT-A является дорогостоящим, «положительные» результаты РКИ также обычно являются необходимым условием для возмещения расходов на PGT-A в большинстве европейских систем здравоохранения.
Поэтому в настоящее время благоприятные эффекты ПГТ-А не имеют достаточного уровня доказательности, так как не опубликованы результаты стандартизированных РКИ [7].Поскольку PGT-A является дорогостоящим, «положительные» результаты РКИ также обычно являются необходимым условием для возмещения расходов на PGT-A в большинстве европейских систем здравоохранения.
Поскольку в настоящее время внедряются усовершенствованные методы витрификации [93] и было проведено специальное РКИ [94], отбор свежих эмбрионов для переноса с помощью PGT все чаще заменяется переносом замороженных эмбрионов. Такой подход позволяет больше времени проводить высококачественную ПГТ и собирать больше «диагностических случаев» для одновременного обследования, что также снижает затраты.По сути, более широкое использование доказательной PGT переплетается с достижениями в области витрификации эмбрионов и зависит от высококачественных знаний в области микроманипуляций с эмбрионами [91], включая правильно установленные индикаторы [95].
Подходы к полногеномному гаплотипированию, например, кариомаппинг [94,95,98], а также полногеномное «глубокое секвенирование» на основе MPS позволяют проводить одновременное гаплотипирование, исследование SNV и CNV, тем самым позволяя оценивать анеуплоидию при специфическом PGT применяются подходы информатики [99].Гаплотипирование позволяет получить надежный PGT-M практически для любых наследственных вариантов, ассоциированных с заболеванием (даже без необходимости предварительного исследования для выявления соответствующих вариантов в данном семействе), в то время как полногеномный MPS с низким охватом позволяет проводить PGT-A, включая диагностику частичные хромосомные анеуплоидии размером до 1,8 Mbp [98,99,102]. В то время как большинство методов тестирования PGT-M на сегодняшний день были сосредоточены на анализе одного локуса или локализованной области генома, новые технические подходы могут обеспечить более широкое изучение геномной вариации эмбриона.Как следствие, могут быть обнаружены не только интересующие генетические варианты, но и геномные вариации, не связанные с первоначальным направлением и запросом пары. Этот подход открывает новые этические проблемы для изучения [103, 104], и впоследствии должны быть разработаны профессиональные рекомендации.
Этот подход открывает новые этические проблемы для изучения [103, 104], и впоследствии должны быть разработаны профессиональные рекомендации.
PGT, как и все формы клинического генетического тестирования, требует строгого контроля качества и оценки. Регулярное участие во внешней оценке качества следует рассматривать как важное и действительно обязательное для генетических тестов в некоторых странах.Схемы, специфичные для PGT, легко доступны как для тестирования на моногенность, так и на анеуплоидию в Европе и за ее пределами. Аккредитация лабораторий в соответствии с ISO15189 по-прежнему считается наиболее эффективным способом обеспечения качества [105], и ее использование растет в Европе и за ее пределами. Следует отметить, что рекомендации по конкретным методам, например, для диагностики МПС, в равной степени актуальны и важны для ПГТ и должны соблюдаться [106, 107].
Аналогичным образом следует соблюдать «Стандарты и рекомендации по интерпретации вариантов последовательностей: совместная согласованная рекомендация Американского колледжа медицинской генетики и геномики и Ассоциации молекулярной патологии» [108]. Более того, рекомендации Общества вариаций генома человека по номенклатуре вариантов последовательностей и правильному назначению «ассоциации с заболеванием» в обнаруженных вариантах (следовательно, префикс «патогенный» зарезервирован только для четкого набора диагностических ситуаций, обозначающих, что данный вариант «вызывает заболевание в определенном контекст’) [109], включая соответствующие рекомендации по отчету о диагностических тестах, следует соблюдать в PGT [110].
Более того, рекомендации Общества вариаций генома человека по номенклатуре вариантов последовательностей и правильному назначению «ассоциации с заболеванием» в обнаруженных вариантах (следовательно, префикс «патогенный» зарезервирован только для четкого набора диагностических ситуаций, обозначающих, что данный вариант «вызывает заболевание в определенном контекст’) [109], включая соответствующие рекомендации по отчету о диагностических тестах, следует соблюдать в PGT [110].
Еще одна проблема, связанная с клинической реализацией PGT-A, связана с тем фактом, что мозаицизм эмбрионов затрудняет предоставление категорических (или «убедительных») результатов.Хотя биопсия трофэктодермы (TE; «день 5» или «день 6») позволяет получить «агрегированную» ДНК-матрицу из нескольких эмбриональных клеток, а не одной или двух клеток в биопсии бластомера («день 3»), она остается просто общий метод биопсии с присущими ему ограничениями в отношении репрезентативности образца, взятого с точки зрения исследуемой ткани/органа. Эти ограничения аналогичны тем, которые в настоящее время обсуждаются в области рака, где точный диагноз и/или воспроизводимый прогресс исследования также в значительной степени зависят от опыта оператора биопсии и точного положения биопсии в интересующей ткани [111]. .Таким образом, образец клеток, полученный с помощью биопсии эмбриона (на любой данной стадии развития), может не быть репрезентативным для всего эмбриона, поскольку на стадии бластоцисты также сообщалось о высокой частоте мозаицизма [112]. В заключение, в то время как MPS улучшает аналитическую чувствительность и, таким образом, обнаружение мозаицизма в данной биопсии эмбриона, это не устраняет ограничение, заключающееся в том, что анализируются только клетки, присутствующие в биопсии [113].
Эти ограничения аналогичны тем, которые в настоящее время обсуждаются в области рака, где точный диагноз и/или воспроизводимый прогресс исследования также в значительной степени зависят от опыта оператора биопсии и точного положения биопсии в интересующей ткани [111]. .Таким образом, образец клеток, полученный с помощью биопсии эмбриона (на любой данной стадии развития), может не быть репрезентативным для всего эмбриона, поскольку на стадии бластоцисты также сообщалось о высокой частоте мозаицизма [112]. В заключение, в то время как MPS улучшает аналитическую чувствительность и, таким образом, обнаружение мозаицизма в данной биопсии эмбриона, это не устраняет ограничение, заключающееся в том, что анализируются только клетки, присутствующие в биопсии [113].
Уже есть сообщения об успешных исходах беременности после замещения отдельных мозаичных анеуплоидных бластоцист [114, 115].Это наблюдение, потенциально изменяющее текущую парадигму PGT-A, требует проведения последующих многоцентровых исследований по сравнению с этим первоначальным наблюдением и должного определения приоритетов эмбрионов для переноса с точки зрения количественных и качественных параметров хромосомного мозаицизма эмбрионов. Вероятность здорового живорождения будет варьироваться в зависимости как от скорости мозаицизма, так и от типа анеуплоидии (какая хромосома, моносомия или трисомия вовлечена). Текущая задача в этой области, таким образом, состоит в том, чтобы определить «пороговые» уровни, позволяющие классифицировать эмбрионы как пригодные для переноса в первую очередь (т.э., мозаицизм не обнаружен), переносимый как второй приоритет (т. е. умеренный уровень мозаицизма с исключением тех хромосом, которые потенциально связаны с жизнеспособными патологическими состояниями) и непередаваемый (т. е. чрезмерный уровень мозаицизма или мозаики, включая хромосомы, потенциально связанные с жизнеспособными патологическими состояниями) патологических состояний [116].Поэтому PGT-A можно рассматривать в первую очередь как «инструмент ранжирования» (т. е. «количественная стратегия отбора»), а не как «инструмент скрининга» (т. е. «качественная стратегия отбора»), в чтобы отличить эуплоидные зародыши от анеуплоидных [117].
Вероятность здорового живорождения будет варьироваться в зависимости как от скорости мозаицизма, так и от типа анеуплоидии (какая хромосома, моносомия или трисомия вовлечена). Текущая задача в этой области, таким образом, состоит в том, чтобы определить «пороговые» уровни, позволяющие классифицировать эмбрионы как пригодные для переноса в первую очередь (т.э., мозаицизм не обнаружен), переносимый как второй приоритет (т. е. умеренный уровень мозаицизма с исключением тех хромосом, которые потенциально связаны с жизнеспособными патологическими состояниями) и непередаваемый (т. е. чрезмерный уровень мозаицизма или мозаики, включая хромосомы, потенциально связанные с жизнеспособными патологическими состояниями) патологических состояний [116].Поэтому PGT-A можно рассматривать в первую очередь как «инструмент ранжирования» (т. е. «количественная стратегия отбора»), а не как «инструмент скрининга» (т. е. «качественная стратегия отбора»), в чтобы отличить эуплоидные зародыши от анеуплоидных [117].
Это важное наблюдение приводит к дальнейшим вопросам о том, кто должен принимать решение о ранжировании или исключении эмбрионов для переноса, и о том, какую информацию предоставляет генетическая лаборатория врачу ВРТ и лаборатории ЭКО, а также будущим родителям [103]. Всестороннее репродуктивное и генетическое консультирование с последним необходимо для обеспечения адекватного понимания парами возможностей и ограничений современных подходов геномики и ВРТ, связанных с PGT-A.Бесплодные пары также должны быть четко осведомлены о том факте, что PGT-A сама по себе не может увеличить частоту живорождения на один инициированный цикл, поскольку она представляет собой механизм ранжирования, а не терапию как таковую [7]. Тем не менее, проведение PGT-A у определенных групп пациентов может оказать положительное влияние на вторичные показатели исхода, такие как уменьшение частоты неудач при имплантации эмбриона, частоту выкидышей и экономическую эффективность [91, 101, 118]. PGT-A также позволяет осуществлять негативный отбор эмбрионов с жизнеспособными трисомиями в избранных парах с ограниченными репродуктивными перспективами, например, из-за возраста родителей. Поскольку имеющиеся данные ограничены, необходимо провести дополнительные исследования и собрать данные из многоцентровых РКИ с помощью согласованных методологий, что позволит использовать предлагаемую концепцию «PGS 2.0» [91, 119, 120, 121]. Использование передовых технологий на основе MPS, позволяющих проводить чувствительные и специфические лабораторные процедуры тестирования вместе с соответствующей стандартизацией отчетов об успешном ЭКО в соответствии с предлагаемым глоссарием «ICMART» (см. выше), может способствовать воспроизводимости РКИ в PGT-A.
Поскольку имеющиеся данные ограничены, необходимо провести дополнительные исследования и собрать данные из многоцентровых РКИ с помощью согласованных методологий, что позволит использовать предлагаемую концепцию «PGS 2.0» [91, 119, 120, 121]. Использование передовых технологий на основе MPS, позволяющих проводить чувствительные и специфические лабораторные процедуры тестирования вместе с соответствующей стандартизацией отчетов об успешном ЭКО в соответствии с предлагаемым глоссарием «ICMART» (см. выше), может способствовать воспроизводимости РКИ в PGT-A.
Даже при отсутствии РКИ PGT-A в настоящее время практикуется во все большем числе лабораторий по всему миру. Как только появится апробированная лабораторная технология, позволяющая отбирать заведомо нежизнеспособные эмбрионы на основании их хромосомного состава, применение PGT-A можно будет рассматривать как часть медицинской практики в случаях высокого риска (например, при запущенных материнских возраст). Избегая неизбежного сбоя соответствующих циклов ВРТ путем отмены отбора явно нежизнеспособных эмбрионов с хромосомными аномалиями, PGT-A может смягчить ненужные страдания пациентов, повысить общую эффективность ЭКО в вовлеченной паре и снизить ненужные затраты, связанные с КГН.
Достигнут многообещающий прогресс в исследованиях по использованию жидкости бластоцеля (BF) [122, 123], служащей альтернативным источником матричной ДНК для PGT, проводимого с помощью MPS [124]. BF отражает хромосомный статус эмбриона (т. е. внутренней клеточной массы; ICM) по сравнению с выборкой клеток TE, которые представляют только внеэмбриональные ткани. Образец BF берется путем аспирации тонкой иглой (бластоцентез) до витрификации эмбриона (см. выше). Документально подтверждено, что время повторного расширения бластоцеля в циклах витрификации-нагревания представляет собой благоприятный прогностический фактор положительного клинического исхода беременности: чем быстрее происходит повторное расширение бластоцеля, тем выше дальнейший потенциал развития бластоцисты [125]. .Исследования в этой области продолжаются, но когда технические трудности будут преодолены и результаты PGT-A после бластоцентеза могут быть подтверждены независимо, BF может стать предпочтительным источником ДНК для PGT.
Наконец, использование внеклеточных эмбриональных «матриксов», например, взятых из отработанных культуральных сред in vitro (CM), представляет собой еще одно исследовательское направление для отбора образцов матричной ДНК (хотя, вероятно, фрагментированной) для «неинвазивного PGT». Однако есть опасения, что CM не продуцируются в условиях «без ДНК человека» и/или остается возможность присутствия остаточной ДНК из материнских (например, кумулюсных) клеток [126, 127].
Будущее PGT тесно связано с разработкой новых полногеномных стратегий MPS, но также зависит от достижений в области витрификации бластоцист, а также от соответствующего опыта микроманипуляций с эмбрионами в данном центре ЭКО. Большинство соответствующих профессиональных руководств по генетическому/геномному тестированию в «постнатальной области» применимы к PGT, включая строгое соблюдение требований по обеспечению качества.
Комиссия призывает к сбалансированному взгляду на текущую роль PGT-A в ВРТ с точки зрения общего повышения эффективности ЭКО.
В настоящее время PGT-A представляет собой механизм ранжирования, который задокументировал положительный эффект в отдельных популяциях пациентов в отношении положительных вторичных показателей исхода, таких как снижение числа неудачных имплантаций эмбрионов или частоты выкидышей.
Комиссия также призывает к стандартизированному описанию отчетов об успешных результатах ЭКО (например, связанных с коэффициентом живорождения), чтобы можно было воспроизвести текущие и/или будущие РКИ, связанные с применением новых подходов PGT-A, и, таким образом, противостоять требования доказательной медицины, следовательно, в поддержку «PGS 2.0 концепция».
Полногеномные подходы к PGT-A предлагают потенциал для определения приоритетности переноса эмбрионов не только на основании отсутствия вариантов, связанных с заболеванием (SNV/CNV), связанных с первичным генетическим направлением и запросом бесплодной пары, но также общая генетическая конституция эмбриона.
Тем не менее, руководства по использованию этой информации в генетической лаборатории отсутствуют, равно как и соответствующие этические соображения, и, таким образом, профессиональные сообщества должны рассмотреть их в ближайшем будущем.Будем надеяться, что новые методы, связанные с использованием BF или отработанного CM, смогут преодолеть инвазивную выборку матричной ДНК раннего эмбриона для PGT.
Неинвазивная ПНД и пренатальный скрининг
Подобно «процедурной» характеристике ПГТ (см. выше), термин НИПТ обычно следует использовать для описания генетических технологий, использующих анализ бесклеточной «фетальной» ДНК (вкДНК) циркулирует в материнской плазме [128]. Тем не менее, благодаря первоначальному клиническому применению НИПТ для выявления отдельных хромосомных анеуплоидий плода (т.э., для хромосом 13, 18, 21, X и Y), этот термин исторически слился с этой основной целью скрининга (см. ниже).
«Плодовая фракция» включает ~10% вкДНК в первом триместре беременности и происходит из плаценты. НИПТ эквивалентна концепции «жидкой биопсии» плаценты со всеми ее диагностическими ограничениями, исторически сложившимися в результате использования биопсии ворсин хориона [129, 130] в качестве источника матричной ДНК при ПНД. Циркулирующий генетический материал эмбрионального происхождения можно использовать либо для неинвазивной пренатальной диагностики (НИПД), например, моногенных заболеваний [131, 132], и/или для «скрининга» хромосомной анеуплоидии плода с помощью неинвазивного пренатального тестирования. (NIPT; альтернативная терминология: неинвазивный пренатальный скрининг — NIPS [133].Термин NIPS является более подходящим, поскольку этот процесс пренатального скрининга может также включать беременных женщин без априорных генетических показаний для их тестирования, например, в схемах популяционного скрининга.
НИПТ эквивалентна концепции «жидкой биопсии» плаценты со всеми ее диагностическими ограничениями, исторически сложившимися в результате использования биопсии ворсин хориона [129, 130] в качестве источника матричной ДНК при ПНД. Циркулирующий генетический материал эмбрионального происхождения можно использовать либо для неинвазивной пренатальной диагностики (НИПД), например, моногенных заболеваний [131, 132], и/или для «скрининга» хромосомной анеуплоидии плода с помощью неинвазивного пренатального тестирования. (NIPT; альтернативная терминология: неинвазивный пренатальный скрининг — NIPS [133].Термин NIPS является более подходящим, поскольку этот процесс пренатального скрининга может также включать беременных женщин без априорных генетических показаний для их тестирования, например, в схемах популяционного скрининга.
Внедрение НПВП в клиническую практику ПНД привлекло значительное внимание со стороны профессиональных обществ, которые разработали соответствующие руководства [133, 134, 135]. В дополнительных отчетах должным образом оценивались глобальные перспективы и препятствия для внедрения НИПС в контексте ПНД [136, 137], включая ее роль при «пост-ПГД» [138] беременности.Соответствующие этические вопросы были рассмотрены в совместном документе ESHG/Американского общества генетики человека [139] и недавно Советом по биоэтике Наффилда [140].
В дополнительных отчетах должным образом оценивались глобальные перспективы и препятствия для внедрения НИПС в контексте ПНД [136, 137], включая ее роль при «пост-ПГД» [138] беременности.Соответствующие этические вопросы были рассмотрены в совместном документе ESHG/Американского общества генетики человека [139] и недавно Советом по биоэтике Наффилда [140].
NIPS широко применяется в контексте пренатального скрининга распространенных хромосомных анеуплоидий уже с 10-й недели беременности [141]. MPS с низким охватом всего генома вместе с передовыми (часто запатентованными) биоинформационными алгоритмами часто используются для определения количества фрагментов ДНК из каждой целевой хромосомы, чтобы определить вероятность хромосомной анеуплоидии плода.Другие подходы оценивают число копий с помощью анализа микрочипов или SNV [142, 102]. Основным преимуществом по сравнению с традиционным комбинированным антенатальным скринингом первого триместра (cFTS) [143], который основан на возрасте матери, ультразвуковой оценке воротникового пространства плода (NT) и отдельных биохимических биомаркерах в крови матери, являются более высокая частота обнаружения и гораздо более низкий процент ложноположительных (FP) результатов (~ 0,1% в NIPS по сравнению с cFTS, где он может достигать 5%). Таким образом, NIPS снижает общее количество последующих инвазивных процедур PND и потенциально ятрогенных выкидышей [142, 143, 146].Тем не менее, появляется все больше доказательств того, что NIPS и cFTS являются взаимодополняющими подходами в процессе комплексного обеспечения антенатального скрининга при беременности с низким и высоким риском. У каждого подхода есть свои сильные стороны и ограничения, как показано в обзорах cFTS [147] и NIPS [104], которые могут быть прагматически дополнены синергетической (например, контингентной) диагностической стратегией [148]. В связи с тем, что на сегодняшний день расходы на НПВ не возмещаются большинством европейских систем здравоохранения по сравнению с установленными региональными или общенациональными схемами cFTS, такой контингентный подход может быть экономически эффективным для большинства систем здравоохранения, основанных на солидарности.Например, протокол UK NHS Rapid предлагает NIPS у женщин с определенным диапазоном риска, связанного с cFTS, и, таким образом, может обеспечить равный доступ к антенатальному скринингу [131, 149].
Таким образом, NIPS снижает общее количество последующих инвазивных процедур PND и потенциально ятрогенных выкидышей [142, 143, 146].Тем не менее, появляется все больше доказательств того, что NIPS и cFTS являются взаимодополняющими подходами в процессе комплексного обеспечения антенатального скрининга при беременности с низким и высоким риском. У каждого подхода есть свои сильные стороны и ограничения, как показано в обзорах cFTS [147] и NIPS [104], которые могут быть прагматически дополнены синергетической (например, контингентной) диагностической стратегией [148]. В связи с тем, что на сегодняшний день расходы на НПВ не возмещаются большинством европейских систем здравоохранения по сравнению с установленными региональными или общенациональными схемами cFTS, такой контингентный подход может быть экономически эффективным для большинства систем здравоохранения, основанных на солидарности.Например, протокол UK NHS Rapid предлагает NIPS у женщин с определенным диапазоном риска, связанного с cFTS, и, таким образом, может обеспечить равный доступ к антенатальному скринингу [131, 149].
Существует несколько конкретных вопросов, связанных с внедрением НИПС в рамках широких стратегий антенатального скрининга [150]. Первая проблема, которую следует принять во внимание, связана с тем, что, в отличие от НИПД моногенных заболеваний, НИПС не является диагностическим тестом. Тестируемые лица должны знать, что на точность NIPS влияет ограниченный плацентарный мозаицизм или обнаружение неожиданных материнских хромосомных аномалий.Таким образом, НИПС, проводимая полногеномными методами, представляет собой не только «жидкую биопсию» плаценты [102, 151], но и выявляет другой циркулирующий ДНК-материал, например происходящий из циркулирующих опухолевых клеток [152, 153].
Второй вопрос связан с дискуссиями о том, как NIPS оптимально вписывается в комплексную политику пренатального скрининга, принимая во внимание также его экономическую эффективность [154, 155] и оптимизацию его диагностической ценности [156]. «Условная» процедура, предлагающая NIPS для случаев среднего риска после cFTS, была бы выгодна с точки зрения затрат и смягчения материнского стресса после неубедительного результата cFTS. Однако как высокая чувствительность NIPS, так и более короткое время ожидания являются ценными, если NIPS применяется в качестве теста первой линии. В связи с этим исследования, в которых оценивалась клиническая полезность НИПС, предлагаемых поставщиками первичной акушерской помощи для общей популяции беременных женщин, показали, что НИПС широко используется и что пациенты понимают ее основную концепцию и ограничения. Авторы пришли к выводу, что NIPS можно интегрировать в рутинную практику антенатального скрининга в первичной медико-санитарной помощи.Кроме того, также обсуждалась взаимодополняемость пренатальных ультразвуковых измерений NT в контексте NIPS [157, 158].
Однако как высокая чувствительность NIPS, так и более короткое время ожидания являются ценными, если NIPS применяется в качестве теста первой линии. В связи с этим исследования, в которых оценивалась клиническая полезность НИПС, предлагаемых поставщиками первичной акушерской помощи для общей популяции беременных женщин, показали, что НИПС широко используется и что пациенты понимают ее основную концепцию и ограничения. Авторы пришли к выводу, что NIPS можно интегрировать в рутинную практику антенатального скрининга в первичной медико-санитарной помощи.Кроме того, также обсуждалась взаимодополняемость пренатальных ультразвуковых измерений NT в контексте NIPS [157, 158].
Третий вопрос заключается в том, следует ли предлагать НИПС при других аномалиях, помимо обычных хромосомных анеуплоидий, включая аномалии половых хромосом и клинически значимые микроделеции (например, для выявления синдрома Ди Джорджи; MIM: 188400). Однако редкость, выраженная генетическая и клиническая гетерогенность этих состояний и, как следствие, низкий PPV могут привести к нежелательному увеличению числа инвазивных процедур PND для получения большего количества результатов FP [159, 160]. Такой сценарий может свести на нет большую часть потенциальных преимуществ внедрения НИПС, поэтому необходимо тщательно рассмотреть возможность добавления других клинических объектов в «панели» НИПС. Тем не менее, некоторые современные коммерческие анализы NIPS действительно включают аномалии половых хромосом и микроделеции, некоторые из которых могут даже иметь вариабельный фенотип. В некоторых случаях они могут быть материнского происхождения. Неясно, имеет ли клиническое значение информирование внешне здоровых женщин об их мозаицизме. Поскольку тестирование на более легкие состояния может не привести к прерыванию беременности, клиническая полезность будет зависеть от того, позволят ли полученные результаты улучшить лечение ребенка.С положительной стороны, осведомленность родителей может позволить лечить некоторые состояния при рождении, а не ждать появления симптомов, чтобы вызвать послеродовое тестирование. С другой стороны, есть также опасения, что преимущества могут перевешиваться стигматизацией после диагностики фенотипически легких половых хромосомных аномалий или микроделеций.
Такой сценарий может свести на нет большую часть потенциальных преимуществ внедрения НИПС, поэтому необходимо тщательно рассмотреть возможность добавления других клинических объектов в «панели» НИПС. Тем не менее, некоторые современные коммерческие анализы NIPS действительно включают аномалии половых хромосом и микроделеции, некоторые из которых могут даже иметь вариабельный фенотип. В некоторых случаях они могут быть материнского происхождения. Неясно, имеет ли клиническое значение информирование внешне здоровых женщин об их мозаицизме. Поскольку тестирование на более легкие состояния может не привести к прерыванию беременности, клиническая полезность будет зависеть от того, позволят ли полученные результаты улучшить лечение ребенка.С положительной стороны, осведомленность родителей может позволить лечить некоторые состояния при рождении, а не ждать появления симптомов, чтобы вызвать послеродовое тестирование. С другой стороны, есть также опасения, что преимущества могут перевешиваться стигматизацией после диагностики фенотипически легких половых хромосомных аномалий или микроделеций. Для уточнения этого баланса необходимы дополнительные исследования [139]. Некоторые тесты NIPS могут даже предложить новые возможности для репродуктивного здоровья, PGT и ведения беременности [102].Таким образом, в настоящее время усовершенствованная технология, по-видимому, «подталкивает» к развитию таких предложений по тестированию, а не к установленной клинической полезности и / или соответствующим перспективам пациента / клиента.
Для уточнения этого баланса необходимы дополнительные исследования [139]. Некоторые тесты NIPS могут даже предложить новые возможности для репродуктивного здоровья, PGT и ведения беременности [102].Таким образом, в настоящее время усовершенствованная технология, по-видимому, «подталкивает» к развитию таких предложений по тестированию, а не к установленной клинической полезности и / или соответствующим перспективам пациента / клиента.
Четвертый вопрос касается качества информации и консультирования по всем важным аспектам, включая случайные находки [139]. Существует опасение, что женщины недостаточно осведомлены о том факте, что NIPS не является диагностическим тестом, и что возможная ETP не должна основываться только на его выводах, особенно в группах населения с низким уровнем риска, в которых PPV значительно ниже, чем в популяция высокого риска.За «положительным» результатом NIPS всегда должно следовать инвазивное PND для проверки, как и при всех других подходах к пренатальному скринингу.
Среди первых применений NIPD при моногенных нарушениях было определение пола плода [161] при Х-сцепленных рецессивных заболеваниях, когда идентификация плода женского пола позволяет избежать необходимости инвазивного PND [162]. Первые геноспецифические NIPD были введены для наследуемых по отцовской линии аутосомно-доминантных (AD) и AR нарушений, когда родители являются носителями отличимых вариантов, связанных с заболеванием, по сравнению с плодом.Для других рецессивных заболеваний проблема по-прежнему состоит в том, чтобы надежно различать генетическую информацию, полученную от плода и от беременной женщины [131, 132]. NIPD может также использоваться в качестве последующей (подтверждающей) процедуры после PGT-M, главным образом, как альтернатива PND, у пар, которые не хотят подвергаться инвазивным процедурам (например, из-за повторной неудачи ЭКО или беспокойства родителей), которые связаны с риском ятрогенной потери беременности [138].
Принимая во внимание будущие сценарии неинвазивной полногеномной НИПС, необходимо обсудить общий объем антенатального скрининга, принимая также во внимание интересы конфиденциальности информации будущего ребенка [163, 164]. Возможность фетальной терапии также может повлиять на показания к NIPD/NIPS в ближайшем будущем. Если внутриутробное лечение станет возможным для растущего числа генетических состояний, включая, например, синдром Дауна [165], тогда информированное решение должно учитывать такие «двойные цели» антенатального скрининга, будь то cFTS или NIPS, или их комбинация.
Возможность фетальной терапии также может повлиять на показания к NIPD/NIPS в ближайшем будущем. Если внутриутробное лечение станет возможным для растущего числа генетических состояний, включая, например, синдром Дауна [165], тогда информированное решение должно учитывать такие «двойные цели» антенатального скрининга, будь то cFTS или NIPS, или их комбинация.
Комиссия рекомендует в будущем проводить междисциплинарные обсуждения между соответствующими профессиональными обществами, которые несут ответственность за реализацию политики неинвазивного антенатального скрининга и их потенциальную связь с разработкой соответствующих антенатальных методов лечения.Лица, проходящие тестирование NIPS, должны быть осведомлены о том, что его положительные результаты должны быть подтверждены инвазивным PND. Кроме того, испытуемые должны быть осведомлены о том, что NIPS с использованием полногеномных подходов может обнаруживать «случайные» находки, например, циркулирующую ДНК опухоли у матери.
Наконец, технологические достижения способствуют более широкому клиническому внедрению NIPD как более приемлемой альтернативы стандартной PND, связанной с инвазивным забором клеток или тканей плода.
Митохондрии: от диагностики к лечению
Предотвращение передачи вариантов мтДНК, связанных с заболеванием
В настоящее время технически возможно точно установить нагрузку вариантов мтДНК, связанных с заболеванием (далее в устаревшей терминологии «мутационная нагрузка») в различных типах образцов, включая биопсию эмбриона и амниотическую жидкость, и, следовательно, выбрать эмбрион/плод с мутационной нагрузкой ниже порога, считающегося «патогенным» при выполнении PGT-M и PND.Следовательно, PGT-M и PND могут использоваться для снижения риска развития у ребенка различных митохондриальных нарушений [166, 167]. Однако этот «избирательный» подход имеет ряд недостатков. Одна важная проблема заключается в том, что остается неопределенность в отношении того, является ли мутационная нагрузка, обнаруженная в тестируемом образце, неизменно репрезентативной для остальной части эмбриона/плода. Кроме того, мутационная нагрузка может изменяться во время эмбрионального/фетального развития, и трудно установить пороговое значение для отбора из-за неопределенности корреляции между мутационной нагрузкой и результирующими клиническими симптомами.Наконец, с клинической точки зрения могут возникнуть вопросы по эффективности такого подхода, так как нет гарантии, что женщина с данной гетероплазматической нагрузкой в ее соматических тканях будет продуцировать ооциты с достаточно низкой мутационной нагрузкой для успешного проведения цикла ПГТ. [168].
Кроме того, мутационная нагрузка может изменяться во время эмбрионального/фетального развития, и трудно установить пороговое значение для отбора из-за неопределенности корреляции между мутационной нагрузкой и результирующими клиническими симптомами.Наконец, с клинической точки зрения могут возникнуть вопросы по эффективности такого подхода, так как нет гарантии, что женщина с данной гетероплазматической нагрузкой в ее соматических тканях будет продуцировать ооциты с достаточно низкой мутационной нагрузкой для успешного проведения цикла ПГТ. [168].
Для решения этой проблемы была разработана митохондриальная заместительная терапия (МЗТ) [169, 170]. Он заключается в трансплантации пронуклеусов, мейотического веретена или полярных телец ооцитов пациентки в цитоплазму энуклеированных донорских ооцитов, которые предположительно содержат «здоровые» митохондрии.Пронуклеарный перенос был впервые осуществлен у мышей [171], но полученное потомство показало высокие уровни митохондриального переноса [170]. Второй подход основан на трансплантации пронуклеусов вскоре после завершения мейоза, а не незадолго до первого митотического деления, что приводит к меньшему переносу мтДНК [167, 172].
Второй подход основан на трансплантации пронуклеусов вскоре после завершения мейоза, а не незадолго до первого митотического деления, что приводит к меньшему переносу мтДНК [167, 172].
Техника переноса веретена впервые была применена на макаках-резусах, где она оказалась эффективной и безопасной [173]. Возможность замены мтДНК переносом веретена также была продемонстрирована у человека, хотя некоторые из этих ооцитов демонстрировали аномальное оплодотворение [174, 175].Сообщалось о первом рождении ребенка после переноса веретена у матери с мутацией мтДНК, вызывающей синдром Лея (MIM 256000), что привело к четырем невынашиваниям беременности и двум умершим детям. Хотя ребенок, родившийся после переноса веретена, имел мутационную нагрузку 5,7% и чувствовал себя хорошо на момент сообщения, необходимо длительное наблюдение [176]. В Китае осуществлен первый клинический пронуклеарный перенос ооцитов человека с результатом здоровых родов. Впервые об этом сообщили на ежегодном ежегодном собрании Американского общества репродуктивной медицины в 2003 г. , но опубликовали только 13 лет спустя [177].Перенос полярного тела был успешно осуществлен у мышей [170], а недавно также и у людей [178]. Однако существуют присущие ей технические трудности, поскольку полярные тельца имеют короткую продолжительность жизни из-за апоптотического давления, которое приводит к фрагментации и деградации ДНК [170]. В целом, учитывая экспериментальный характер всех этих подходов, ПГТ и/или ПНД всегда следует рассматривать после МРТ в качестве дополнительной процедуры «подстраховки».
, но опубликовали только 13 лет спустя [177].Перенос полярного тела был успешно осуществлен у мышей [170], а недавно также и у людей [178]. Однако существуют присущие ей технические трудности, поскольку полярные тельца имеют короткую продолжительность жизни из-за апоптотического давления, которое приводит к фрагментации и деградации ДНК [170]. В целом, учитывая экспериментальный характер всех этих подходов, ПГТ и/или ПНД всегда следует рассматривать после МРТ в качестве дополнительной процедуры «подстраховки».
Обсуждаемые этические вопросы включают приемлемость модификации генома человека [179], роль митохондриального донора как участника «родительского проекта» (т.е., концепция «трех родительских семей» в непрофессиональной прессе) и последствия для идентичности потомства, соразмерность развития технологии МРТ, основанная на важности генетического отцовства, и поиск баланса между принятием соответствующих мер предосторожности и препятствованием инновациям [180, 181, 182, 183].
Аутологичный перенос митохондрий зародышевой линии для улучшения/улучшения развития эмбриона
Методы митохондриальной добавки были внедрены около двух десятилетий назад с целью преодоления низкого качества ооцитов и повторяющихся неудач ЭКО [184].Несмотря на многообещающие показатели успеха этих первых экспериментальных испытаний, дальнейшие исследования были в значительной степени прекращены из соображений безопасности, особенно после того, как такие процедуры привели к 45,X беременностям. Статьи, доказывающие существование взрослых оогониальных (генерирующих ооциты) стволовых клеток у мышей и, возможно, у женщин [185], вновь открыли перспективы доставки источника нетронутых и подходящих пациенту зародышевых митохондрий для улучшения здоровья яйцеклеток и эмбрионального развития. потенциал без необходимости использования молодых донорских яйцеклеток для получения «здоровой цитоплазмы» [186].Однако более широкий клинический опыт применения этой процедуры ограничен, а существование и роль взрослых оогониальных стволовых клеток в организме человека до сих пор являются предметом профессиональных дискуссий [115, 187].
Количество копий мтДНК как маркер жизнеспособности эмбриона
Количество мтДНК в биоптатах ТЭ и бластомеров было связано с возрастом самок старшего возраста и хромосомной анеуплоидией, и было предложено обеспечить независимую меру эмбрионального имплантационного потенциала [188, 189]. Количество мтДНК оказывается значительно выше у эмбрионов пожилых женщин и у анеуплоидных эмбрионов, независимо от возраста пациента.Бластоцисты, которые успешно имплантировались, содержат более низкие количества мтДНК, чем те, которые не смогли имплантироваться, с порогом количества мтДНК, выше которого имплантация никогда не наблюдалась. Однако многие эмбрионы, которым не удалось имплантироваться, также имели количество мтДНК ниже указанного порога. Недавнее исследование не смогло подтвердить эти результаты и не обнаружило статистически значимых различий в бластоцистах, сгруппированных по хромосомной плоидности, возрасту матери или потенциалу имплантации после применения математического поправочного коэффициента [190].
Наоборот, было продемонстрировано, что мтДНК сокращается в преимплантационном эмбрионе до ее последующего увеличения на стадии бластоцисты [191]. Чтобы обеспечить правильную экстраполяцию биопсий ТЭ, необходимо изучить корреляцию между содержанием мтДНК в ТЭ и ВКМ бластоцисты. Наконец, может быть полезно измерить содержание мтДНК в 3-дневном эмбрионе, растущем in vitro, чтобы улучшить идентификацию жизнеспособных эмбрионов с высоким потенциалом развития [192].
Комиссия пришла к выводу, что применение различных процедур, связанных с митохондриями, в ВРТ по-прежнему не имеет достаточного уровня доказательств и что в этом отношении необходимы дальнейшие фундаментальные и трансляционные исследования. Кроме того, перед применением этих технологий в клинической практике необходимо принять во внимание соответствующие этические вопросы.
Вопросы, связанные с эпигенетическим наследованием, в АРТ
Несмотря на то, что можно найти несколько определений эпигенетического наследования, наиболее общепринятым является следующее: «любое потенциально стабильное и наследуемое изменение экспрессии генов, которое происходит без изменения последовательности ДНК» [193, 194]. Эпигенетика включает в себя контроль структуры хроматина и переключение между открытой и закрытой конфигурацией, тем самым влияя на транскрипцию. Имеют место различные модификации, такие как ковалентная модификация ДНК путем метилирования и/или посттрансляционные модификации связанных с ДНК белков, в основном гистонов [195]. До сих пор большинство экспериментальных исследований в области эпигенетического наследования выполнялось на моделях мышей [196]. Это означает, что применение их результатов к людям нуждается в дальнейшем обосновании.
Эпигенетика включает в себя контроль структуры хроматина и переключение между открытой и закрытой конфигурацией, тем самым влияя на транскрипцию. Имеют место различные модификации, такие как ковалентная модификация ДНК путем метилирования и/или посттрансляционные модификации связанных с ДНК белков, в основном гистонов [195]. До сих пор большинство экспериментальных исследований в области эпигенетического наследования выполнялось на моделях мышей [196]. Это означает, что применение их результатов к людям нуждается в дальнейшем обосновании.
Основные эпигенетические изменения, ответственные за стирание и возобновление формирования эпигенома человека, происходят во время гаметогенеза и раннего развития эмбриона. Эти сложные молекулярные процессы включают перепрограммирование после оплодотворения с образованием тотипотентной зиготы, за которым следует перепрограммирование зародышевой линии с образованием гамет [197]. Эти процессы вместе с влиянием окружающей среды на формирование эпигенома человека, особенно на раннем этапе развития, хорошо документированы [198, 199]. Следовательно, существует вероятность того, что некоторые процедуры ВРТ могут непреднамеренно изменить эпигеном гамет и/или эмбриона и потенциально вызвать неблагоприятные медицинские последствия для потомства.
Следовательно, существует вероятность того, что некоторые процедуры ВРТ могут непреднамеренно изменить эпигеном гамет и/или эмбриона и потенциально вызвать неблагоприятные медицинские последствия для потомства.
Эпигенетические механизмы в гаметах в настоящее время остаются более или менее «черным ящиком», особенно в отношении оогенеза. На мышах было показано, что ДНК сперматозоидов может быть метилирована и гидроксиметилирована, но точная роль таких процессов метилирования неясна. Считается, что метилирование может иметь как глобальное влияние на стабилизацию ДНК, так и конкретную цель, т.е.е., чтобы заставить замолчать (импринтировать) определенные гены. Также было показано, что некоторые специфические геномные локусы будут сохранять свои гистоны во время мейоза, а не обменивать их на протамины, и что этот молекулярный механизм коррелирует с гипометилированием. Предполагается, что гены, избегающие протаминирования, должны экспрессироваться очень рано во время эмбрионального развития [200]. После оплодотворения отцовская ДНК активно деметилируется, но некоторые локусы остаются метилированными (в основном в случае импринтированных генов).До сих пор роль метилирования ДНК сперматозоидов в будущем эмбриональном развитии изучена недостаточно [201].
После оплодотворения отцовская ДНК активно деметилируется, но некоторые локусы остаются метилированными (в основном в случае импринтированных генов).До сих пор роль метилирования ДНК сперматозоидов в будущем эмбриональном развитии изучена недостаточно [201].
Уровень метилирования ДНК в ооците вдвое меньше, чем в сперматозоидах. Метилирование ДНК в ооците не играет роли в регуляции экспрессии генов самого ооцита, но важно для эмбрионального развития [202]. Интересно, что области, которые метилированы в ооците, с большей вероятностью будут метилированы и в эмбрионе [203]. Эти сложные процессы могут регулироваться неполным деметилированием во время репрограммирования материнского аллеля после оплодотворения или другим механизмом памяти и представляют собой потенциальный путь эпигенетического межпоколенческого наследования экологически индуцированных (например, КОГ и/или КМ) изменений в организме. Паттерны метилирования ДНК ооцита [106].
Другой функцией метилирования ДНК в зародышевой линии является контроль экспрессии мобильных элементов (TPE). Это наследственные следы ретровирусов, составляющие примерно половину генома человека. TPE повторно активируются во время формирования первичных зародышевых клеток и раннего развития, и строго контролируются, чтобы не прыгать «куда-либо» в геноме. Пути, контролирующие экспрессию и транспозицию TPE, до сих пор полностью не изучены. Однако у мышей потенциально патогенные изменения белков, участвующих в их контроле, могут вызывать ИМ, главным образом, за счет мейотической блокады на стадии пахитены [204, 205].В последнее время также появляется все больше данных о причастности ТПО к различным заболеваниям человека [206].
Это наследственные следы ретровирусов, составляющие примерно половину генома человека. TPE повторно активируются во время формирования первичных зародышевых клеток и раннего развития, и строго контролируются, чтобы не прыгать «куда-либо» в геноме. Пути, контролирующие экспрессию и транспозицию TPE, до сих пор полностью не изучены. Однако у мышей потенциально патогенные изменения белков, участвующих в их контроле, могут вызывать ИМ, главным образом, за счет мейотической блокады на стадии пахитены [204, 205].В последнее время также появляется все больше данных о причастности ТПО к различным заболеваниям человека [206].
Исследования на животных показали, что процедуры ВРТ могут быть связаны с множественными изменениями в экспрессии генов и метилированием ДНК, в основном импринтированных генов [207]. Однако потенциальная связь с фенотипическими исходами (если таковая имеется) остается в значительной степени неизвестной. Также в исследованиях на людях сообщалось об эпигенетических изменениях, связанных с ВРТ, в эмбрионах, плацентарной ткани или пуповинной крови [208]. Однако до сих пор эти чередования не были однозначно связаны с какими-либо клинически значимыми исходами. Будущие исследования должны быть сосредоточены на нормальной эпигенетической регуляции гамет и эмбрионов человека, естественной межиндивидуальной вариации, например, метилирования ДНК, последствиях незначительных изменений метилирования ДНК и фенотипических (долгосрочных) последствиях эпимутаций [209]. . [210].Кроме того, индуцированные окружающей средой эпимутации происходят, возможно, на стохастической основе [211], делая ассоциации «один к одному» между ключом к окружающей среде и эпигенетическими изменениями в конкретном гене или наборе генов менее информативными. Это наблюдение может также объяснить несоответствия, обнаруженные между различными исследованиями. Эпигенетические изменения, вызванные АРТ, если они существуют, могут, таким образом, возникать в случайных местах генома только у подгруппы уязвимых субъектов, что, вероятно, приводит к широкому спектру неблагоприятных фенотипических последствий, что усложняет исследование потенциальных эпигенетических эффектов АРТ.
Однако до сих пор эти чередования не были однозначно связаны с какими-либо клинически значимыми исходами. Будущие исследования должны быть сосредоточены на нормальной эпигенетической регуляции гамет и эмбрионов человека, естественной межиндивидуальной вариации, например, метилирования ДНК, последствиях незначительных изменений метилирования ДНК и фенотипических (долгосрочных) последствиях эпимутаций [209]. . [210].Кроме того, индуцированные окружающей средой эпимутации происходят, возможно, на стохастической основе [211], делая ассоциации «один к одному» между ключом к окружающей среде и эпигенетическими изменениями в конкретном гене или наборе генов менее информативными. Это наблюдение может также объяснить несоответствия, обнаруженные между различными исследованиями. Эпигенетические изменения, вызванные АРТ, если они существуют, могут, таким образом, возникать в случайных местах генома только у подгруппы уязвимых субъектов, что, вероятно, приводит к широкому спектру неблагоприятных фенотипических последствий, что усложняет исследование потенциальных эпигенетических эффектов АРТ. [211].Наконец, необходимо отметить, что этим последующим исследованиям также препятствует обычное нежелание родителей раскрывать информацию о предыдущих методах ЭКО, включая проблемы с безопасностью данных в отношении соответствующих реестров пациентов.
[211].Наконец, необходимо отметить, что этим последующим исследованиям также препятствует обычное нежелание родителей раскрывать информацию о предыдущих методах ЭКО, включая проблемы с безопасностью данных в отношении соответствующих реестров пациентов.
Комиссия пришла к выводу, что необходимы дополнительные исследования потенциального воздействия конкретных процедур ВРТ на эпигеном и его последствия для потомства, включая возможные пути эпигенетического наследования. Кроме того, стандартизация методологий последующего наблюдения и реестров пациентов после ЭКО может решить сложные биологические проблемы и способствовать воспроизводимости первоначальных наблюдений неблагоприятных эпигенетических явлений, связанных с наследованием, у детей/взрослых, зачатых с помощью ЭКО.Кроме того, необходимо изучить соответствующие социальные и этические вопросы, связанные с этой проблемой.
Редактирование генома зародышевой линии
Редактирование генома с использованием инструментов, позволяющих проводить точную модификацию, таких как нуклеазы с цинковыми пальцами и TALEN (эффекторные нуклеазы, подобные активаторам транскрипции), доступны уже много лет и широко используются в исследованиях [212]. Однако с недавним внедрением системы CRISPR/Cas9 (кластеризованные регулярно расположенные короткие палиндромные повторы/нуклеаза Cas9) редактирование генома стало намного проще, дешевле и эффективнее, что открыло путь к соматической генной терапии и, в конечном итоге, к ГГЭ [213]. .
Однако с недавним внедрением системы CRISPR/Cas9 (кластеризованные регулярно расположенные короткие палиндромные повторы/нуклеаза Cas9) редактирование генома стало намного проще, дешевле и эффективнее, что открыло путь к соматической генной терапии и, в конечном итоге, к ГГЭ [213]. .
GGE можно проводить на различных типах зародышевых клеток, таких как сперматогониальные стволовые клетки, in vitro созревшие ооциты, дифференцированные гаметы, полученные из стволовых клеток in vitro из линий плюрипотентных стволовых клеток, полученных после переноса ядер соматических клеток или индуцированных плюрипотентных стволовых клеток клеток и даже у раннего эмбриона [214, 215].
ГГЭ на уровне эмбриона имеет важные технические недостатки, такие как неполное редактирование, ведущее к мозаичности эмбрионов и нецелевым эффектам (индуцированные варианты, связанные с заболеванием, на участках, отличных от предполагаемого на целевом участке), которые необходимо решить, прежде чем рассматривать возможные клиническое применение методики. По мере разработки новых, более точных, эффективных и, следовательно, более безопасных систем ГГЭ следует ожидать, что эти технические ограничения могут быть преодолены [216], как это было недавно задокументировано в случае гипертрофической кардиомиопатии [217].
По мере разработки новых, более точных, эффективных и, следовательно, более безопасных систем ГГЭ следует ожидать, что эти технические ограничения могут быть преодолены [216], как это было недавно задокументировано в случае гипертрофической кардиомиопатии [217].
Тем не менее, количество клинических показаний, которые могут быть предусмотрены для коррекции ГГЭ, пока ограничено, поскольку PGT-M предлагает альтернативу для пар с риском генетического заболевания у их потомства. Потенциальное использование ГГЭ можно было бы предусмотреть в парах с очень высоким риском, например, если один из партнеров гомозиготен по болезни Альцгеймера или когда оба партнера страдают одним и тем же расстройством АР.Менее «строгие» показания могут быть в тех случаях, когда количество эмбрионов, которые, как ожидается, будут получены после PGT-M, невелико, например, в случае преклонного возраста матери, или у пар с высоким риском передачи более одного генетического заболевания, или когда HLA-совместимые эмбрионы рассматриваются для лечения родного брата, пораженного тяжелым моногенным заболеванием. Другие области медицины также начали обсуждать потенциальные последствия ГГЭ [218]. Недавно Американское общество генетики человека опубликовало заявление о своей позиции в отношении GGE человека [219], а ESHG и ESHRE совместно разрабатывают рекомендации, относящиеся к этой теме («Ответственные инновации в редактировании генома зародышевой линии человека»; de Wert et al, 2017, личное общение).Кроме того, продолжаются дебаты об этических (т. е. аргументе «скользкой дорожки») и социальных последствиях GGE, и в конечном итоге текущие ограничения на GGE могут потребовать возобновления дебатов [220, 217, 223]. Наконец, необходимо прозрачное и широкое сотрудничество, чтобы ответственно продвигать область GGE [224, 225].
Другие области медицины также начали обсуждать потенциальные последствия ГГЭ [218]. Недавно Американское общество генетики человека опубликовало заявление о своей позиции в отношении GGE человека [219], а ESHG и ESHRE совместно разрабатывают рекомендации, относящиеся к этой теме («Ответственные инновации в редактировании генома зародышевой линии человека»; de Wert et al, 2017, личное общение).Кроме того, продолжаются дебаты об этических (т. е. аргументе «скользкой дорожки») и социальных последствиях GGE, и в конечном итоге текущие ограничения на GGE могут потребовать возобновления дебатов [220, 217, 223]. Наконец, необходимо прозрачное и широкое сотрудничество, чтобы ответственно продвигать область GGE [224, 225].
Комиссия пришла к выводу, что, хотя исследования в области ГГЭ быстро развиваются, его потенциальное медицинское применение в контексте ВРТ и генетической медицины требует дальнейших фундаментальных и трансляционных исследований.Соответствующие профессиональные сообщества должны разработать согласованные руководящие принципы, которые будут учитывать любые потенциально неблагоприятные индивидуальные, популяционные, генетические, этические и социальные последствия этой новой медицинской технологии.

Генетика развития: методы и приложения | Биология развития
Развитие каждого организма определяется генетической информацией, закодированной в его ДНК. Изучая, как гены контролируют процессы развития, такие как миграция и дифференцировка клеток, ученые в области генетики развития пытаются лучше понять, как формируются сложные структуры многоклеточных организмов.
В этом видеоролике представлены некоторые важные открытия в этой области, ряд фундаментальных вопросов, заданных генетиками развития, основные инструменты, которые ученые используют для ответа на эти вопросы, и, наконец, конкретные исследования, проводимые в области генетики развития сегодня.
Давайте начнем с обзора некоторых важных открытий, сформировавших область генетики развития.
В 1865 году австрийский монах Грегор Мендель провел эксперименты по селекции гороха.Он заметил, что видимые признаки или «фенотипы» гороха, такие как цвет семян, наследуются в соответствии с последовательными правилами. Предполагая, что эти фенотипы на самом деле контролируются некоторыми невидимыми дискретными факторами наследственности, Мендель посеял семена области генетики.
Предполагая, что эти фенотипы на самом деле контролируются некоторыми невидимыми дискретными факторами наследственности, Мендель посеял семена области генетики.
Эти факторы наследственности были названы «генами» датским ботаником Вильгельмом Йохансеном в 1909 году. Затем, в 1910 году, Томас Хант Морган и его студенты использовали плодовую мушку дрозофилу в качестве модельного организма, чтобы обнаружить, что гены находятся в физических структурах клеточного ядра. называются хромосомами.
В 1938 году Саломея Глюксон-Вельш показала, что для развития эмбриональной структуры, известной как хорда, необходим специфический ген. Это было одним из первых доказательств того, что гены контролируют ранние процессы развития.
В 1940 году Конрад Хэл Уоддингтон предположил, что клетки эмбриона дифференцируются по путям или «судьбам», которые контролируются генами. Он сформулировал метафору для этого процесса, усовершенствованную в течение следующих 17 лет, названную «эпигенетическим ландшафтом», где клетка видится как шарик, катящийся по склону холма к разным клеточным судьбам. Пути, по которым идет клетка, проходят по горным хребтам и долинам ландшафта, которые, в свою очередь, контролируются генами и паттернами их экспрессии.
Пути, по которым идет клетка, проходят по горным хребтам и долинам ландшафта, которые, в свою очередь, контролируются генами и паттернами их экспрессии.
В 1952 году Вольфганг Бирманн подтвердил, что хотя разные клетки в организме имеют одинаковое генетическое содержимое, активны разные области хромосом, и эта дифференциальная экспрессия генов определяет клеточную идентичность.
После того, как было установлено, что экспрессия генов влияет на развитие, возник следующий вопрос: какие именно гены? Чтобы ответить на этот вопрос, в 1970-х годах Эдвард Б.Льюис, Кристиан Нуссляйн-Фольхард и Эрик Вайшаус использовали химические вещества для случайной мутации генов плодовых мушек. С помощью этих экранов мутаций ученые определили большое количество генов, контролирующих каждый этап процесса развития.
В 2007 году международный консорциум ученых начал работу по созданию коллекции мышей, в которой каждый ген, по одному у каждой мыши, удален или «выбит». Фенотип каждой из этих мышей в настоящее время охарактеризован, и это даст нам первый каталог функций всех генов у млекопитающего.
Теперь, когда мы рассмотрели основы этой области, давайте рассмотрим несколько ключевых вопросов, на которые пытаются ответить генетики развития.
Некоторые исследователи сосредотачиваются на ранних этапах трансформации оплодотворенных яйцеклеток или зигот в многоклеточные эмбрионы. Эти события зависят от РНК и белков, которые откладываются в яйцеклетку матерью, в явлении, известном как «материнский вклад» или «материнский эффект». Ученые заинтересованы в том, чтобы узнать, как генотип матери влияет на фенотип эмбриона.
Другой центральный вопрос генетики развития: как генетически идентичные клетки принимают разные клеточные судьбы? Ученые выявляют множество факторов, которые контролируют дифференциальную экспрессию генов в разных клетках, в том числе сигнальные пути, которые сообщают клетке, какие гены экспрессировать и когда их экспрессировать во время развития.
Наконец, ученые также задаются вопросом, как ранний эмбрион, аморфная масса клеток, превращается в сложный организм с отдельными функциональными частями. Формирование этого плана тела называется морфогенезом, и ученые пытаются определить гены и пути, управляющие этим процессом.
Формирование этого плана тела называется морфогенезом, и ученые пытаются определить гены и пути, управляющие этим процессом.
Теперь, когда вы знаете некоторые вопросы, которые задают генетики развития, давайте рассмотрим методы, которые они используют для ответа на эти вопросы.
Ученые могут изучать роль конкретных генов в развитии, нарушая их экспрессию. Один из способов сделать это — «выбить» ген из ДНК организма, внеся мутации или заменив его нефункциональной ДНК.В качестве альтернативы экспрессию гена можно «подавить» путем введения олигонуклеотидов, которые будут связываться с целевыми последовательностями мРНК и предотвращать продукцию функциональных белков.
Чтобы определить, какие гены отвечают за определенные фенотипы, ученые могут провести генетический скрининг. При прямом генетическом скрининге мутации случайным образом генерируются в организмах либо радиацией, либо химическими веществами, известными как мутагены. Когда обнаруживается, что мутант демонстрирует интересующий фенотип, тогда можно идентифицировать неизвестный мутировавший ген. Противоположным подходом является обратный генетический скрининг, когда ученые сначала нацеливаются на большое количество конкретных генов-кандидатов на разрушение, а затем смотрят на получившиеся фенотипы мутантов.
Противоположным подходом является обратный генетический скрининг, когда ученые сначала нацеливаются на большое количество конкретных генов-кандидатов на разрушение, а затем смотрят на получившиеся фенотипы мутантов.
Наконец, биологи также заинтересованы в определении экспрессии генов на разных стадиях развития. Одним из инструментов для измерения экспрессии генов является микроматрица, представляющая собой чип, усеянный олигонуклеотидами, содержащими последовательности генов, подлежащих тестированию. В типичном эксперименте РНК, выделенная из организмов на двух разных стадиях развития, используется для создания двух разных наборов флуоресцентно меченных зондов, которые затем гибридизуются с микрочипом.Затем изменения в экспрессии генов можно интерпретировать по флуоресцентному сигналу в каждой точке массива.
Имея в виду эти экспериментальные методы, давайте посмотрим, как исследователи применяют их для изучения генетики развития.
Ученые проводят крупномасштабный генетический скрининг модельных организмов, таких как C. elegans, для поиска генов, влияющих на развитие. Обычно это делается с помощью РНК-интерференции, или РНКи, процесса, при котором гены подавляются с помощью малых молекул РНК.Здесь ученые кормили червей бактериями, содержащими библиотеку РНКи, разработанную против большого количества генов червей, и анализировали влияние нокдауна генов на развитие животных.
elegans, для поиска генов, влияющих на развитие. Обычно это делается с помощью РНК-интерференции, или РНКи, процесса, при котором гены подавляются с помощью малых молекул РНК.Здесь ученые кормили червей бактериями, содержащими библиотеку РНКи, разработанную против большого количества генов червей, и анализировали влияние нокдауна генов на развитие животных.
Другие исследователи проводят прямой генетический скрининг, используя случайный мутагенез для идентификации фенотипов развития. В этом эксперименте исследователи использовали метод генной ловушки для мутагенеза эмбрионов рыбок данио, где репортерная конструкция случайным образом нацеливается на интроны генов и делает их нефункциональными.Затем ученые могут легко идентифицировать животных, у которых ген успешно разрушен, путем поиска репортерного сигнала, а те, у которых обнаружен дефект развития, могут идентифицировать ответственный ген.
Наконец, экспрессию генов различных типов клеток в развивающемся организме можно профилировать с помощью микрочипов, чтобы определить, какие гены включаются или выключаются во время дифференцировки и специализации клеток. В этом исследовании из развивающейся сетчатки были выделены отдельные нейрональные клетки разных типов.Затем из этих клеток была извлечена РНК для микрочипового анализа, чтобы идентифицировать гены, которые играют роль в развитии каждого конкретного типа клеток.
В этом исследовании из развивающейся сетчатки были выделены отдельные нейрональные клетки разных типов.Затем из этих клеток была извлечена РНК для микрочипового анализа, чтобы идентифицировать гены, которые играют роль в развитии каждого конкретного типа клеток.
Вы только что посмотрели введение Юпитера в генетику развития. В этом видео были рассмотрены некоторые исторические моменты в этой области, важные вопросы, заданные генетиками развития, несколько известных методов, которые в настоящее время используются в лабораториях, и конкретные приложения этих подходов к изучению биологии развития. Как всегда, спасибо за просмотр!
Требуется подписка.Пожалуйста, порекомендуйте JoVE вашему библиотекарю.
Генетика и пренатальное развитие – развитие на протяжении всей жизни
Зачем изучать внутриутробное развитие и генетику?
Перед рождением люди проходят совершенно невероятное путешествие. Подумайте об этом — когда время и условия подходят, крошечная яйцеклетка освобождается от овуляции, и один сперматозоид из сотен миллионов объединяется, чтобы начать процесс оплодотворения. Генетический материал от матери и отца объединяется, чтобы сформировать совершенно новый организм.Этот новый организм должен продолжать путешествовать и имплантироваться в стенку матки, чтобы продолжать расти и процветать. Это нелегкий подвиг. Он все еще должен расти и развиваться в течение примерно 268 дней, прежде чем он начнет жизнь вне матки.
Генетический материал от матери и отца объединяется, чтобы сформировать совершенно новый организм.Этот новый организм должен продолжать путешествовать и имплантироваться в стенку матки, чтобы продолжать расти и процветать. Это нелегкий подвиг. Он все еще должен расти и развиваться в течение примерно 268 дней, прежде чем он начнет жизнь вне матки.
Сегодня у нас больше знаний и технологий, чем когда-либо прежде, которые влияют на этот процесс. Мы посвящены в тесты, которые могут дать нам массу информации еще до того, как мы забеременеем. У нас есть возможность узнать генетический состав эмбриона до того, как он будет имплантирован в матку.Если бы вы могли выбрать все черты вашего будущего ребенка, вы бы сделали это? Каковы будут плюсы и минусы этого? У новых родителей также есть выбор дородового ухода, который они получают, и того, как они хотят подготовиться к родам. Как видите, выбор, сделанный на этом пути, и непредвиденные сюрпризы создают уникальную историю беременности и родов.
Этот модуль исследует этот путь и процесс разработки с момента замысла до поставки.
Чему вы научитесь: объяснять роль генетики во внутриутробном развитии
В этом разделе мы рассмотрим некоторые способы, с помощью которых наследственность помогает формировать нас.Наследственность включает в себя больше, чем генетическая информация от наших родителей. Согласно эволюционной психологии, наше генетическое наследие исходит от наиболее адаптивных генов наших предков. Мы рассмотрим, что происходит генетически во время зачатия, и кратко рассмотрим некоторые генетические аномалии. Однако прежде чем перейти к этим темам, важно подчеркнуть взаимодействие между наследственностью и окружающей средой. Почему ты такой, какой ты есть? Если учесть некоторые свои особенности (рост, вес, личность, здоровье и т.), спросите себя, являются ли эти черты результатом наследственности, факторов окружающей среды или того и другого. Скорее всего, вы можете увидеть, как наследственность и факторы окружающей среды (такие как образ жизни, диета и т. д.) способствовали возникновению этих особенностей.
д.) способствовали возникновению этих особенностей.
Результаты обучения
- Объяснить точку зрения эволюционной психологии на развитие продолжительности жизни
- Опишите генетические компоненты зачатия
- Описать гены и их значение в генетической наследственности
- Опишите хромосомные аномалии
- Объясните ценность пренатального тестирования
- Описать взаимодействие между генетикой и окружающей средой
- Сравните монозиготных и дизиготных близнецов
Эволюционная психология
Эволюционная психология
Рисунок 1 .Эволюционная психология исследует связь между биологической адаптацией и предпочтениями в выборе партнера. Эволюционная психология фокусируется на том, как универсальные модели поведения и когнитивных процессов развивались с течением времени. Различия в познании и поведении сделают людей более или менее успешными в воспроизведении и передаче этих генов своему потомству. Психологи-эволюционисты изучают множество психологических феноменов, которые могли развиться в результате адаптации, включая реакцию страха, предпочтения в еде, выбор партнера и кооперативное поведение (Confer et al., 2010).
Психологи-эволюционисты изучают множество психологических феноменов, которые могли развиться в результате адаптации, включая реакцию страха, предпочтения в еде, выбор партнера и кооперативное поведение (Confer et al., 2010).
Многие думают об эволюции как о развитии черт и поведения, которые позволяют нам выжить в этом мире «собачьих поеданий», таких как сильные мышцы ног, чтобы быстро бегать, или кулаки, чтобы бить и защищаться. Однако физическое выживание важно только в том случае, если оно в конечном итоге способствует успешному размножению. То есть, даже если вы доживете до 100 лет, если вам не удастся спариться и родить детей, ваши гены умрут вместе с вашим телом. Таким образом, репродуктивный успех, а не выживание успех, является двигателем эволюции путем естественного отбора.
Чарльз Дарвин описывает этот процесс в теории эволюции путем естественного отбора . Проще говоря, теория утверждает, что организмы, которые лучше приспособлены к окружающей среде, выживут и размножатся, а те, которые плохо приспособлены к окружающей среде, вымрут. Растет интерес к применению принципов эволюционной психологии для лучшего понимания развития человека в течение жизни.
Растет интерес к применению принципов эволюционной психологии для лучшего понимания развития человека в течение жизни.
Эволюционная перспектива: генетическое наследие наших предков
Основы эволюционной перспективы
Рис. 6. Портрет Чарльза Роберта Дарвина. В далеком будущем я вижу простор для гораздо более важных исследований. Психология будет основываться на новом фундаменте, на фундаменте необходимого приобретения каждой умственной силы и способности по градации. — Дарвин, Чарльз (1859 г.). Происхождение видов . п. 488 — через Wikisource Одним из очень влиятельных подходов к пониманию человеческого развития является эволюционная перспектива, последняя перспектива развития, которую мы рассмотрим.Эта точка зрения стремится определить поведение, которое является результатом нашего генетического наследования от наших предков. Эволюционная психология — это теоретический подход в социальных и естественных науках, который исследует психологическую структуру с современной эволюционной точки зрения. Он стремится определить, какие психологические черты человека являются эволюционными адаптациями, то есть функциональными продуктами естественного отбора или полового отбора в эволюции человека.
Он стремится определить, какие психологические черты человека являются эволюционными адаптациями, то есть функциональными продуктами естественного отбора или полового отбора в эволюции человека.
Дэвид М. Басс — психолог-эволюционист из Техасского университета в Остине, теоретизирующий и исследующий половые различия людей при выборе партнера.Основные темы его исследований включают стратегии мужского спаривания, конфликт между полами, социальный статус, социальную репутацию, престиж, эмоцию ревности, убийство, защиту от убийства и, совсем недавно, преследование. Все они рассматриваются с эволюционной точки зрения.
Эволюционная психология уходит своими историческими корнями в теорию естественного отбора Чарльза Дарвина. В «Происхождении видов» Дарвин предсказал, что психология разработает эволюционную основу и что процесс естественного отбора создает у видов черты, которые приспосабливаются к окружающей среде.
Используя аргументы Дарвина, эволюционные подходы утверждают, что генетическая наследственность определяет не только такие физические черты, как цвет кожи и глаз, но также определенные черты личности и социальное поведение. Например, некоторые психологи-эволюционисты предполагают, что такое поведение, как застенчивость и ревность, может быть вызвано частично генетическими причинами, предположительно потому, что они помогли увеличить выживаемость древних родственников человека.
Например, некоторые психологи-эволюционисты предполагают, что такое поведение, как застенчивость и ревность, может быть вызвано частично генетическими причинами, предположительно потому, что они помогли увеличить выживаемость древних родственников человека.
Существует общее признание того, что эволюционная теория Дарвина дает точное описание основных генетических процессов и что эволюционная перспектива все более заметна в области развития продолжительности жизни.Однако приложения эволюционной точки зрения подверглись значительной критике. Некоторые специалисты по психологии развития обеспокоены тем, что слишком много внимания уделяется генетическим и биологическим аспектам поведения, и предполагают, что эволюционная точка зрения уделяет недостаточно внимания экологическим и социальным факторам, участвующим в формировании поведения детей и взрослых. Другие критики утверждают, что нет хорошего способа экспериментальной проверки теорий, основанных на этом подходе, потому что люди эволюционировали так давно. Например, мы можем признать, что зависть помогает людям более эффективно выживать, но как мы это докажем? Однако, учитывая все обстоятельства, эволюционный подход постоянно стимулирует исследования того, как наша биологическая наследственность хотя бы частично влияет на наши черты и поведение.
Например, мы можем признать, что зависть помогает людям более эффективно выживать, но как мы это докажем? Однако, учитывая все обстоятельства, эволюционный подход постоянно стимулирует исследования того, как наша биологическая наследственность хотя бы частично влияет на наши черты и поведение.
Развитие продолжительности жизни и эволюционная психология
Когда мы рассматриваем развитие от зачатия до всей жизни, у нас будет много возможностей понять, как эволюционная психология расширяет наше понимание развития.Например, женщины и мужчины различаются в своих предпочтениях в отношении нескольких ключевых качеств при длительном спаривании из-за несколько разных адаптивных соображений. Современные женщины унаследовали эволюционную черту желать партнеров, которые обладают ресурсами, обладают качествами, связанными с приобретением ресурсов (например, амбициями, богатством, трудолюбием), и готовы поделиться с ними этими ресурсами. С другой стороны, мужчины сильнее желают молодости и здоровья у женщин, поскольку и то, и другое указывает на фертильность. Эти мужские и женские различия исторически были универсальными для людей.
Эти мужские и женские различия исторически были универсальными для людей.
То, что психологическая адаптация была полезна в нашей истории, не означает, что она полезна и сегодня. Например, даже несмотря на то, что в предыдущих поколениях женщины могли предпочитать мужчин с ресурсами, наше современное общество продвинулось вперед так, что эти предпочтения больше не нужны. Тем не менее важно учитывать, как наша эволюционная история сформировала наши сегодняшние автоматические или «инстинктивные» желания и рефлексы, чтобы мы могли лучше формировать их для будущего.
Следуя жизненному пути от зачатия до смерти, подумайте о том, как теория естественного отбора и концепции эволюционной психологии могут пролить свет на наше понимание того, почему одни автоматические рефлексы или инстинктивные желания встречаются чаще, чем другие. Помните, что конечным продуктом теории эволюции путем естественного отбора является успешное выживание и размножение. Можете ли вы придумать, каким образом конечная цель репродуктивного успеха влияет на наш выбор партнера, как мы воспитываем маленьких детей, почему мы мотивированы на достижение определенных целей или что отличает семьи с традиционно большей продолжительностью жизни? Теория эволюции путем естественного отбора утверждает, что для достижения репродуктивного успеха организмы должны соответствовать окружающей среде. Подумайте о том, как разные среды или культуры требуют разных качеств для успешного выживания и размножения. Можете ли вы придумать, как мы можем измениться, чтобы лучше соответствовать нашей меняющейся культуре?
Подумайте о том, как разные среды или культуры требуют разных качеств для успешного выживания и размножения. Можете ли вы придумать, как мы можем измениться, чтобы лучше соответствовать нашей меняющейся культуре?
Ссылка на обучение
Дэвид Басс — один из ведущих исследователей эволюционной психологии. В Ted Talk Дэвида Басса он объясняет несколько теорий, связанных с выбором сексуальных партнеров, предпочтениями в спаривании и неверностью.
Наследственность и хромосомы
Рисунок 2 .Женская репродуктивная система.Гаметы
Существует два типа половых клеток или гамет , участвующих в размножении: мужские гаметы, или сперматозоиды, и женские гаметы, или яйцеклетки. Мужские гаметы образуются в яичках в ходе процесса, называемого сперматогенезом, который начинается примерно в 12-летнем возрасте. Женские гаметы, хранящиеся в яичниках, присутствуют при рождении, но являются незрелыми. Каждый яичник содержит около 250 000 яйцеклеток, но только около 400 из них станут зрелыми яйцеклетками (Mackon & Fauser, 2000; Rome, 1998). Начиная с полового созревания, одна яйцеклетка созревает и высвобождается примерно каждые 28 дней, этот процесс называется оогенезом.
Начиная с полового созревания, одна яйцеклетка созревает и высвобождается примерно каждые 28 дней, этот процесс называется оогенезом.
После того, как яйцеклетка или яйцеклетка созреет и выйдет из яичника, она втягивается в фаллопиеву трубу и через 3–4 дня достигает матки. Обычно он оплодотворяется в фаллопиевой трубе и продолжает свое путешествие в матку. При эякуляции миллионы сперматозоидов выбрасываются во влагалище, но лишь немногие достигают яйцеклетки, и обычно только одна оплодотворяет яйцеклетку. Как только один сперматозоид проникает в стенку яйцеклетки, стенка становится твердой и препятствует проникновению других сперматозоидов.После попадания сперматозоида в яйцеклетку хвост сперматозоида отрывается, а головка спермия, содержащая генетическую информацию от отца, соединяется с ядром яйцеклетки. В результате образуется новая клетка. Эта клетка, содержащая объединенную генетическую информацию от обоих родителей, называется зиготой.
Хромосомы
В то время как другие нормальные человеческие клетки имеют 46 хромосом (или 23 пары), гаметы содержат 23 хромосомы. Хромосомы представляют собой длинные нитевидные структуры, обнаруженные в ядре клетки, которое содержит генетический материал, известный как дезоксирибонуклеиновая кислота (ДНК) .ДНК представляет собой спиральную молекулу, состоящую из пар нуклеотидов [аденин (А), гуанин (G), цитозин (С) и тимин (Т)]. В каждой хромосоме последовательности ДНК составляют гена , которые контролируют или частично контролируют ряд видимых характеристик, известных как черты, такие как цвет глаз, цвет волос и так далее. Один ген может иметь несколько возможных вариаций или аллелей. Аллель – это особая версия гена. Таким образом, данный ген может кодировать признак цвета волос, а различные аллели этого гена влияют на цвет волос человека.
Рисунок 3 . Дезоксирибонуклеиновая кислота (ДНК) представляет собой спиральную молекулу, состоящую из пар нуклеотидов. Последовательности ДНК составляют гены.В процессе, называемом мейозом, сегменты хромосом от каждого родителя образуют пары, а генетические сегменты обмениваются случайным образом. Из-за непредсказуемости такого обмена вероятность рождения генетически идентичных потомков (а не близнецов) составляет один к триллиону (Gould & Keeton, 1997). Генетическая изменчивость важна, потому что она позволяет видам адаптироваться так, чтобы те, кто лучше приспособлен к окружающей среде, выживали и размножались, что является важным фактором естественного отбора.
Генотипы и фенотипы
Когда сперматозоид и яйцеклетка сливаются, их 23 хромосомы спариваются, образуя зиготу с 23 парами хромосом. Таким образом, каждый родитель передает половину генетической информации потомству; результирующие физические характеристики потомства (называемые фенотипом) определяются взаимодействием генетического материала, поставляемого родителями (называемого генотипом). Генотип человека – это генетический состав этого человека. Фенотип, с другой стороны, относится к унаследованным физическим характеристикам человека.
Посмотрите в зеркало. Что вы видите, свой генотип или свой фенотип? Что определяет экспрессию генов? На самом деле, это довольно сложно. Некоторые признаки следуют аддитивной модели, что означает, что множество разных генов вносят свой вклад в конечный результат. Рост и оттенок кожи являются примерами. В других случаях ген может быть либо включен, либо выключен в зависимости от нескольких факторов, включая ген, с которым он связан, или унаследованные эпигенетические метки.
Ссылка на обучение
Посетите веб-страницу «Что такое ДНК и гены?» из Университета Юты, чтобы лучше понять ДНК и гены, а затем посмотрите видео «Что такое наследование?» узнать, как гены родителей передают генетическую информацию своим детям.
Определение пола ребенка
Двадцать две из этих хромосом от каждого родителя аналогичны по длине соответствующей хромосоме от другого родителя. Однако оставшаяся хромосома выглядит как X или Y.Половина сперматозоидов самца содержит Y-хромосому, а половина — X. Все яйцеклетки содержат X-хромосомы. Если ребенок получит комбинацию XY, ребенок будет генетически мужским. Если он получит комбинацию ХХ, ребенок будет генетически женским.
Многие потенциальные родители явно предпочитают иметь мальчика или девочку и хотели бы определить пол ребенка. На протяжении многих лет потенциальным родителям предлагалось несколько советов, чтобы максимально увеличить свои шансы на рождение сына или дочери, как они предпочитают.Тем не менее, существует не так много научных доказательств, подтверждающих эти утверждения. Однако сегодня доступна новая технология, называемая сортировкой спермы, которая позволяет выделять сперму, содержащую либо X, либо Y, в зависимости от предпочтений, и использовать эту сперму для оплодотворения яйцеклетки матери. Преимплантационная генетическая диагностика (ПГД) также может быть использована для отбора эмбрионов только желаемого пола для имплантации во время экстракорпорального оплодотворения (ЭКО). Однако эти методы вызывают споры, и как центры репродукции, так и медицинские организации не одобряют их, если нет реальной медицинской причины для выбора пола.
Генетическая изменчивость и наследование
Генетическая изменчивость, генетическое различие между особями, — это то, что способствует адаптации вида к окружающей среде. У людей генетическая изменчивость начинается с яйцеклетки, нескольких миллионов сперматозоидов и оплодотворения. Яйцеклетка и сперматозоид содержат по 23 хромосомы, составляющие наши гены. Один ген может иметь несколько возможных вариаций или аллелей (конкретная версия гена), что приводит к множеству комбинаций наследуемых признаков.
Генетическое наследование признаков у людей основано на модели наследования Грегора Менделя. Для генов на аутосоме (любой хромосоме, кроме половой хромосомы) аллели и связанные с ними признаки являются аутосомно-доминантными или аутосомно-рецессивными. В этой модели некоторые гены считаются доминантными, поскольку они будут экспрессироваться. Другие, называемые рецессивными, экспрессируются только при отсутствии доминантного гена. Некоторые характеристики, которые когда-то считались доминантно-рецессивными, такие как цвет глаз, теперь считаются результатом взаимодействия между несколькими генами (McKusick, 1998).Доминирующие черты включают вьющиеся волосы, ямочки на лице, нормальное зрение и темные волосы. К рецессивным признакам относятся рыжие волосы, облысение и близорукость.
Серповидноклеточная анемия является аутосомно-рецессивным заболеванием; Болезнь Гентингтона является аутосомно-доминантным заболеванием. Другие признаки являются результатом частичного доминирования или кодоминирования, при котором оба гена оказывают влияние. Например, если человек наследует оба рецессивных гена муковисцидоза, у него возникнет заболевание. Но если у человека есть только один рецессивный ген болезни, человек будет носителем болезни.
В этом примере мы назовем нормальный ген «N», а ген кистозного фиброза — «с». Нормальный ген является доминантным, а это означает, что наличие доминантного аллеля либо от одного родителя (Nc), либо от обоих родителей (NN) всегда приводит к фенотипу, связанному с доминантным аллелем. Когда у кого-то есть две копии одного и того же аллеля, говорят, что они гомозиготны по этому аллелю . Когда у кого-то есть комбинация аллелей для данного гена, говорят, что он гетерозиготный .Например, кистозный фиброз является рецессивным заболеванием, что означает, что человек будет болеть этим заболеванием только в том случае, если он гомозиготен по этому рецессивному аллелю (cc).
Представьте, что у женщины, являющейся носителем гена муковисцидоза, есть ребенок от мужчины, который также является носителем того же заболевания. Каковы шансы, что их ребенок унаследует болезнь? И женщина, и мужчина гетерозиготны по этому гену (Nc). Мы можем ожидать, что потомство будет иметь 25%-й шанс иметь кистозный фиброз (cc), 50%-й шанс быть носителем заболевания (Nc) и 25%-й шанс получить две нормальные копии гена (NN). .
Рисунок 4 . Квадрат Пеннета — это инструмент, используемый для предсказания того, как гены будут взаимодействовать при производстве потомства. Заглавная буква N представляет доминантный аллель, а строчная буква с представляет рецессивный аллель. В примере с муковисцидозом, где N — нормальный ген (доминантный аллель), если пара содержит доминантный аллель N, можно ожидать фенотип, не выражающий заболевание. Вы можете ожидать муковисцидозного фенотипа только при наличии двух копий с (рецессивный аллель), который содержит генную мутацию, вызывающую заболевание.Откуда берутся вредные гены, способствующие таким заболеваниям, как кистозный фиброз? Генные мутации являются одним из источников вредных генов. Мутация — это внезапное и необратимое изменение гена. Хотя многие мутации могут быть вредными или смертельными, время от времени мутация приносит пользу человеку, давая ему преимущество перед теми, у кого мутации нет. Напомним, что теория эволюции утверждает, что особи, лучше всего приспособленные к своей конкретной среде, с большей вероятностью размножаются и передают свои гены будущим поколениям.Для того, чтобы этот процесс происходил, должна быть конкуренция — точнее говоря, должна быть вариабельность генов (и вытекающих из них черт), которая допускает вариативность приспособляемости к окружающей среде. Если бы популяция состояла из одинаковых особей, то любые резкие изменения в окружающей среде отражались бы на всех одинаково, и в отборе не было бы вариаций. Напротив, разнообразие генов и связанных с ними черт позволяет некоторым людям работать немного лучше, чем другие, когда они сталкиваются с изменением окружающей среды.Это создает явное преимущество для особей, лучше всего приспособленных к окружающей их среде, с точки зрения успешного размножения и генетической передачи.
Ссылка на обучение
Посетите Фонд муковисцидоза , чтобы узнать больше о кистозном фиброзе и о том, как мутация в ДНК приводит к заболеванию.
Хромосомные аномалии и генетическое тестирование
Хромосомные аномалии
Рисунок 5 . Три основные мутации одиночной хромосомы: делеция (1), дупликация (2) и инверсия (3).Хромосомная аномалия возникает, когда ребенок наследует слишком много или слишком мало хромосом. Наиболее частой причиной хромосомных аномалий является возраст матери. У 20-летней женщины шанс рождения ребенка с распространенной хромосомной аномалией составляет 1 к 800. Однако у 44-летней женщины шанс один к 16. Считается, что проблема возникает, когда яйцеклетка созревает до овуляции каждый месяц. По мере старения матери яйцеклетка в это время с большей вероятностью будет страдать от аномалий.
Другой распространенной причиной хромосомных аномалий является неравномерное деление гамет в процессе их формирования.Следовательно, некоторые клетки имеют более 46 хромосом. На самом деле считается, что около половины всех зигот имеют нечетное число хромосом. Большинство этих зигот не развиваются и спонтанно прерываются организмом. Однако, если ненормальное число встречается в паре № 21 или № 23, у человека могут быть определенные физические или другие отклонения.
Измененная структура хромосом может принимать несколько различных форм и приводить к различным заболеваниям или злокачественным новообразованиям:
-
Делеции : Часть хромосомы отсутствует или удалена.Известные заболевания у людей включают синдром Вольфа-Хиршхорна, который вызывается частичной делецией короткого плеча хромосомы 4; и синдром Якобсена, также называемый синдромом терминальной делеции 11q.
- Дупликации : Часть хромосомы дублируется, что приводит к дополнительному генетическому материалу. Известные заболевания человека включают болезнь Шарко-Мари-Тута типа 1А, которая может быть вызвана дупликацией гена, кодирующего белок периферического миелина 22 (PMP22) на хромосоме 17.
Рисунок 6 . Две основные двуххромосомные мутации: вставка (1) и транслокация (2). - Транслокации : Часть одной хромосомы переносится на другую хромосому. Существует два основных типа транслокаций:
- Реципрокная транслокация : Обмен сегментами двух разных хромосом.
- Робертсоновская транслокация : целая хромосома присоединена к другой на центромере — у людей это происходит только с хромосомами 13, 14, 15, 21 и 22.
- Инверсии : Часть хромосомы оторвалась, перевернута вверх дном и снова прикрепилась, поэтому генетический материал инвертирован.
- Вставки : Часть одной хромосомы удалена со своего нормального места и вставлена в другую хромосому.
- Кольца : Часть хромосомы оторвалась и образовала кольцо или кольцо. Это может произойти с потерей генетического материала или без нее.
- Изохромосома : образована зеркальной копией сегмента хромосомы, включая центромеру.
Одной из наиболее распространенных хромосомных аномалий является пара № 21. Трисомия 21 возникает, когда в № 21 имеется три, а не две хромосомы. У человека с синдромом Дауна есть отчетливые черты лица, умственная отсталость и часто сердечные и желудочно-кишечные расстройства. Симптомы варьируются от человека к человеку и могут варьироваться от легких до тяжелых. Благодаря раннему вмешательству ожидаемая продолжительность жизни людей с синдромом Дауна в последние годы увеличилась. Имейте в виду, что у людей с синдромом Дауна столько же различий, сколько и у большинства групп населения, и эти различия необходимо признавать и ценить.
Если хромосомная аномалия находится в паре № 23, результатом является сцепленная с полом хромосомная аномалия. В результате у человека может быть XXY, XYY, XXX, XO, 45 или 47 хромосом. Двумя наиболее распространенными сцепленными с полом хромосомными заболеваниями являются синдром Тернера и синдром Клайнфельтера. Синдром Тернера возникает у 1 из каждых 2500 живорожденных девочек, когда яйцеклетка, в которой отсутствует хромосома, оплодотворяется сперматозоидом с Х-хромосомой (Carroll, 2007). Полученная зигота имеет состав ХО.Оплодотворение Y-сперматозоидом нежизнеспособно. Синдром Тернера влияет на когнитивные функции и половое созревание. Наружные половые органы выглядят нормально, но молочные железы и яичники не развиваются полностью, и у женщины нет менструаций. Синдром Тернера также приводит к низкорослости и другим физическим характеристикам. Синдром Клайнфельтера (XXY) возникает у 1 из 700 живорожденных мальчиков и возникает, когда яйцеклетка, содержащая дополнительную Х-хромосому, оплодотворяется Y-спермой. Y-хромосома стимулирует рост мужских гениталий, а дополнительная X-хромосома тормозит это развитие.У человека с синдромом Клайнфельтера наблюдается некоторое развитие груди, бесплодие (это наиболее частая причина бесплодия у мужчин) и низкий уровень тестостерона.
Пренатальное тестирование
Пренатальное тестирование состоит из пренатального скрининга и пренатальной диагностики, которые являются аспектами дородовой помощи, направленной на выявление проблем с беременностью как можно раньше. Это могут быть анатомические и физиологические проблемы со здоровьем зиготы, эмбриона или плода либо до начала беременности, либо на самом раннем сроке беременности, насколько это практически возможно. Пренатальный скрининг сосредоточен на выявлении проблем среди большого числа людей с помощью доступных и неинвазивных методов. Наиболее распространенными процедурами скрининга являются обычные УЗИ, анализы крови и измерение артериального давления. Пренатальная диагностика сосредотачивается на получении дополнительной подробной информации после обнаружения конкретной проблемы и иногда может быть более инвазивной.
Скринингможет выявить такие проблемы, как дефекты нервной трубки, анатомические дефекты, хромосомные аномалии и генные мутации, которые могут привести к генетическим нарушениям и врожденным дефектам, таким как расщелина позвоночника, расщепление неба, синдром Дауна, болезнь Тея-Сакса, серповидно-клеточная анемия, талассемия, кистозный фиброз, мышечная дистрофия и синдром ломкой Х-хромосомы.Некоторые тесты предназначены для выявления проблем, которые в первую очередь влияют на здоровье матери, например, РАРР-А для выявления преэклампсии или тесты на толерантность к глюкозе для диагностики гестационного диабета. Скрининг также может выявить анатомические дефекты, такие как гидроцефалия, анэнцефалия, пороки сердца и синдром амниотической перетяжки.
Общие процедуры пренатальной диагностики включают амниоцентез и биопсию ворсин хориона. Из-за рисков выкидыша и повреждения плода, связанных с процедурами амниоцентеза и CVS, многие женщины предпочитают сначала пройти скрининг, чтобы выяснить, достаточно ли высок риск врожденных дефектов плода, чтобы оправдать риски инвазивного тестирования.Скрининговые тесты дают оценку риска, которая представляет вероятность того, что у ребенка есть врожденный дефект; наиболее распространенный порог высокого риска составляет 1: 270. Таким образом, оценка риска 1:300 многими врачами будет считаться низким риском. Однако компромисс между риском врожденных дефектов и риском осложнений от инвазивного тестирования является относительным и субъективным; некоторые родители могут решить, что даже риск врожденных дефектов 1:1000 требует инвазивного теста, в то время как другие не выбрали бы инвазивный тест, даже если бы у них был показатель риска 1:10.
Пренатальная диагностика преследует три основные цели: (1) обеспечить своевременное медикаментозное или хирургическое лечение состояния до или после рождения, (2) дать родителям возможность сделать аборт плода с диагностированным состоянием и (3) дать родителям возможность подготовиться психологически, социально, финансово и с медицинской точки зрения к ребенку с проблемами со здоровьем или инвалидностью или к вероятности мертворождения. Наличие этой информации до рождения означает, что медицинские работники, а также родители могут лучше подготовиться к рождению ребенка с проблемами со здоровьем.Например, синдром Дауна связан с пороками сердца, которые могут потребовать вмешательства сразу после рождения.
Руководство Американского колледжа акушеров и гинекологов (ACOG) в настоящее время рекомендует всем беременным женщинам, независимо от возраста, предлагать инвазивное тестирование для получения окончательного диагноза определенных врожденных дефектов. Поэтому большинство врачей предлагают диагностическое тестирование всем своим пациентам, с предварительным скринингом или без него, и предоставляют пациенту право выбора.
Поведенческая генетика
Генетики поведения изучают, как в настоящее время возникают индивидуальные различия в результате взаимодействия генов и окружающей среды.Изучая человеческое поведение, поведенческие генетики часто используют исследования близнецов и усыновлений для изучения интересующих вопросов. Исследования близнецов сравнивают показатели того, что данная поведенческая черта является общей для однояйцевых и разнояйцевых близнецов; исследования усыновления сравнивают эти показатели среди биологически связанных родственников и усыновленных родственников. Оба подхода дают некоторое представление об относительной важности генов и окружающей среды для проявления данного признака.
Эволюционная перспектива охватывает одну из самых быстрорастущих областей в области развития продолжительности жизни: поведенческую генетику. Поведенческая генетика — это область научных исследований, в которой используются генетические методы для изучения природы и происхождения индивидуальных различий в поведении и изучается влияние наследственности на поведение. Поведенческие генетики стремятся понять, как мы можем наследовать определенные поведенческие черты и как окружающая среда влияет на то, действительно ли мы проявляем эти черты. Также рассматривается, как генетические факторы могут влиять на психологические расстройства, такие как шизофрения, депрессия и злоупотребление психоактивными веществами.
Природа или воспитание?
Десятилетиями ученые ведут споры о «природе/воспитании». Сторонники «природы» утверждают, что в отношении любой конкретной особенности наследственность играет наиболее важную роль в возникновении этой особенности. Те, кто на стороне «воспитания», утверждают, что наше окружение наиболее важно для формирования того, кем мы являемся. Эти дебаты продолжаются в вопросах о том, что делает нас мужчинами или женщинами (Lippa, 2002), беспокойства о зрении (Mutti, Kadnik, & Adams, 1996) и многих других проблемах развития.
Большинство ученых согласны с тем, что между двумя силами существует постоянное взаимодействие. Трудно выделить корень любого отдельного поведения в результате исключительно природы или воспитания, и большинство ученых считают, что трудно ответить даже на определение степени, в которой природа или воспитание влияют на человеческую черту. На самом деле, почти все человеческие черты полигенны (результат многих генов) и мультифакториальны (результат многих факторов, как генетических, так и экологических). Это как если бы генетическая структура человека заложила ряд возможностей, которые могут быть реализованы или не реализованы в зависимости от опыта окружающей среды.Например, человек может быть генетически предрасположен к развитию диабета, но образ жизни человека может способствовать возникновению заболевания.
Когда вы думаете о своей собственной семейной истории, легко заметить, что некоторые личностные черты, поведенческие характеристики и медицинские состояния встречаются чаще, чем другие. Именно по этой причине врачи спрашивают вас об истории болезни вашей семьи. Хотя генетическую предрасположенность важно учитывать, есть некоторые члены семьи, которые по разным причинам, казалось, не обращали внимания на шансы развития этих состояний.Эти различия можно частично объяснить влиянием эпигенетических (над геномных) изменений.
Эпигенетическая структура
Термин «эпигенетический» использовался в психологии развития для описания психологического развития как результата постоянного двунаправленного обмена между наследственностью и окружающей средой. Готлиб (1998; 2000; 2002) предлагает аналитическую основу для дебатов о природе и воспитании, которая признает взаимодействие между окружающей средой, поведением и генетическим выражением.Это двунаправленное взаимодействие предполагает, что окружающая среда может влиять на экспрессию генов так же, как генетическая предрасположенность может влиять на потенциал человека. Точно так же обстоятельства окружающей среды могут вызвать симптомы генетического расстройства. Например, человек, генетически предрасположенный к диабету 2 типа, может спровоцировать заболевание из-за неправильного питания и малоподвижного образа жизни.
Психолог, занимающийся развитием, Эрик Эриксон, написал об эпигенетическом принципе в своей книге Идентичность: Молодежь и кризис (1968), охватывающей представление о том, что мы развиваемся посредством раскрытия нашей личности на заранее определенных стадиях, и что наша среда и окружающая культура влияют на то, как мы проходим эти этапы.Это биологическое развертывание по отношению к нашим социокультурным условиям происходит на этапах психосоциального развития, где «прогресс на каждом этапе частично определяется нашим успехом или отсутствием успеха на всех предыдущих этапах».
В типичных человеческих семьях биологические родители детей воспитывают их, поэтому очень трудно понять, ведут ли дети себя как родители по генетическим (природа) или экологическим (воспитание) причинам. Тем не менее, несмотря на наши ограничения на постановку экспериментов на людях, мы видим реальные примеры работы природы и воспитания в человеческой сфере, хотя они дают лишь частичные ответы на наши многочисленные вопросы.Наука о том, как гены и окружающая среда работают вместе, чтобы влиять на поведение, называется поведенческой генетикой . Самая простая возможность, которую мы можем наблюдать, — это исследование усыновления . Когда детей отдают на усыновление, родители, которые их рожают, уже не являются родителями, которые их воспитывают. Детей не назначают случайным приемным родителям, чтобы удовлетворить особые интересы ученого, но усыновление все же говорит нам кое-что интересное или, по крайней мере, подтверждает некоторые основные ожидания.Например, если биологический ребенок высоких родителей будет усыновлен в семью невысоких людей, как вы думаете, это повлияет на рост ребенка? Как насчет биологического ребенка из испаноязычной семьи, усыновленного при рождении в англоязычную семью? На каком языке вы ожидаете, что ребенок будет говорить? И что эти результаты могут сказать вам о разнице между ростом и языком с точки зрения природы-воспитания?
Монозиготные и дизиготные близнецы
Другой вариант наблюдения природы-воспитания у людей включает исследования близнецов .Для анализа природы-воспитания с использованием близнецов мы сравниваем сходство монозиготных и дизиготных пар. Монозиготные близнецы возникают, когда одна зигота или оплодотворенная яйцеклетка разделяется на части в течение первых двух недель развития. Результатом является создание двух отдельных, но генетически идентичных потомков. Около трети близнецов — монозиготные близнецы. Монозиготные близнецы рождаются с частотой около 3 на каждые 1000 родов во всем мире (около 0,3% населения мира). Монозиготные близнецы генетически почти идентичны, и они всегда одного пола, если только в процессе развития не произошла мутация.Дети монозиготных близнецов генетически тестируются как сводные братья и сестры (или полные братья и сестры, если пара монозиготных близнецов воспроизводится с другой парой однояйцевых близнецов или с одним и тем же человеком), а не как двоюродные братья и сестры.
Иногда высвобождаются две яйцеклетки или яйцеклетки, которые оплодотворяются двумя отдельными сперматозоидами. В результате получается дизиготных или разнояйцевых близнецов. Около двух третей близнецов являются дизиготными. Эти два человека имеют такое же количество генетического материала, как и любые два ребенка от одних и тех же матери и отца.У пожилых матерей чаще рождаются дизиготные близнецы, чем у молодых матерей, а пары, принимающие препараты для лечения бесплодия, также чаще рожают дизиготных близнецов. Следовательно, в последние годы увеличилось число разнояйцевых близнецов (Bortolus et al., 1999). Методы экстракорпорального оплодотворения (ЭКО) с большей вероятностью приводят к созданию дизиготных близнецов. При родах ЭКО на каждую 1000 приходится почти 21 пара близнецов.
В матке у большинства монозиготных близнецов (60–70%) общая плацента, но отдельные амниотические мешки.Плацента – это временный орган, который соединяет развивающийся плод через пуповину со стенкой матки, обеспечивая поглощение питательных веществ, терморегуляцию, выведение отходов и газообмен через кровоснабжение матери. Амниотический мешок (также называемый водяным пузырем или оболочками), – это тонкая, но прочная прозрачная пара мембран, которые удерживают развивающийся эмбрион (а затем и плод) незадолго до рождения. У 18–30% монозиготных близнецов каждый плод имеет отдельную плаценту и отдельный амниотический мешок.Небольшое количество (1–2%) монозиготных близнецов имеют одну и ту же плаценту и амниотический мешок. У разнояйцевых близнецов есть своя плацента и собственный амниотический мешок.
Рисунок 7. Монозиготные близнецы происходят от одной зиготы и обычно имеют одну и ту же плаценту, хотя у некоторых (18-30%) плаценты разные. Дизиготные близнецы происходят из двух отдельно оплодотворенных яйцеклеток и имеют собственные плаценты и амниотические мешочки.Монозиготных (однояйцевых/однояйцовых) близнецов можно разделить на четыре типа в зависимости от времени разделения и удвоения клеток.Различные типы хорионизма и амниозности (как выглядит плодный мешок) у монозиготных близнецов являются результатом деления оплодотворенной яйцеклетки. Это известно как плацентация.
Рисунок 8. Различные типы хорионизма и амниозности (как выглядит плодный мешок) у монозиготных (однояйцевых/однояйцевых) близнецов в результате деления оплодотворенной яйцеклетки (Автор Кевин Дуфенбах)Сиамские близнецы
Сиамские близнецы — это монозиготные близнецы, тела которых срослись во время беременности.Это происходит, когда зигота начинает делиться после 12-го дня после оплодотворения и не может полностью отделиться. Это состояние встречается примерно в 1 из 50 000 беременностей человека. Большинство сиамских близнецов в настоящее время оцениваются для хирургического вмешательства, чтобы попытаться разделить их на отдельные функциональные тела. Степень сложности возрастает, если жизненно важный орган или структура являются общими для близнецов, например, мозг, сердце или печень.
Исчезающие близнецы
Исследователи подозревают, что 1 из 8 беременностей начинается как многоплодная, но только один плод доводится до полного срока, потому что другой плод умер на очень раннем сроке беременности и не был обнаружен или зарегистрирован. Ранние акушерские ультразвуковые исследования иногда выявляют «лишний» плод, который не развивается, а вместо этого распадается и исчезает в матке. Существует несколько причин «исчезновения» плода, в том числе его воплощение или поглощение другим плодом, плацентой или матерью. Это известно как синдром исчезающих близнецов. Кроме того, в неизвестном количестве случаев две зиготы могут сливаться вскоре после оплодотворения, в результате чего образуется один химерный эмбрион, а затем и плод.
Исследования близнецов
Используя в качестве примера особенности роста и разговорной речи, давайте посмотрим, как применяются природа и воспитание: неудивительно, что однояйцевые близнецы почти идеально похожи по росту.Однако рост разнояйцевых близнецов такой же, как и у любых других пар братьев и сестер: они больше похожи друг на друга, чем на людей из других семей, но едва ли идентичны. Этот контраст между типами близнецов дает нам представление о роли генетики в определении роста.
Рисунок 9. Однояйцевые близнецы Лоран и Ларри Николя Буржуа, также известные как Les Twins, являются всемирно известными танцорами.
Теперь рассмотрим разговорный язык. Если один однояйцевый близнец говорит дома по-испански, то близнец, с которым она растет, почти наверняка тоже.Но то же самое верно и для пары разнояйцевых близнецов, воспитанных вместе. С точки зрения разговорной речи разнояйцевые близнецы так же похожи, как и однояйцевые близнецы, поэтому похоже, что генетическое совпадение однояйцевых близнецов не имеет большого значения.
Исследования близнецов и усыновлений — это два примера гораздо более широкого класса методов наблюдения за природой и воспитанием, называемых количественной генетикой , научной дисциплиной, в которой сходство между людьми анализируется на основе того, насколько они биологически связаны.Мы можем проводить эти исследования с братьями и сестрами, сводными братьями и сестрами, двоюродными братьями и сестрами и близнецами, которые были разлучены при рождении и воспитывались отдельно (Bouchard, Lykken, McGue & Segal, 1990). Такие близнецы очень редки и играют меньшую роль, чем принято считать в науке о природе-воспитании или в целых расширенных семьях (Plomin, DeFries, Knopik, & Neiderhiser, 2012).
Было бы приятно иметь возможность сказать, что исследования природы и воспитания дали нам убедительные и полные доказательства того, откуда берутся черты, при этом некоторые черты явно являются результатом генетики, а другие почти полностью обусловлены факторами окружающей среды, такими как методы воспитания детей и личная воля; Но это не тот случай.Вместо этого 90 559 оказалось, что все 90 560 имеют некоторую основу в генетике. Чем более генетически связаны люди, тем больше они похожи — для все : рост, вес, интеллект, личность, психическое заболевание и т. д. Конечно, кажется здравым смыслом, что некоторые черты имеют генетическую предвзятость. Например, усыновленные дети похожи на своих биологических родителей, даже если они никогда не встречались с ними, а однояйцевые близнецы больше похожи друг на друга, чем разнояйцевые близнецы. И хотя определенные психологические черты, такие как личность или психическое заболевание (например,g., шизофрения), кажутся разумными под влиянием генетики, оказывается, что то же самое относится и к политическим взглядам, к тому, сколько люди смотрят телевизор (Plomin, Corley, DeFries, & Fulker, 1990) и к тому, разводятся ли они ( МакГью и Ликкен, 1992).
Чему вы научитесь: объяснять основные этапы внутриутробного развития
Как ты стал тем, кто ты есть? Ваше внутриутробное развитие, начиная с одноклеточной структуры и заканчивая вашим рождением, происходило в упорядоченной и деликатной последовательности.Различают три стадии внутриутробного развития: зародышевую, эмбриональную и фетальную. Имейте в виду, что это отличается от трех триместров беременности. Давайте посмотрим, что происходит с развивающимся ребенком на каждой из этих стадий.
Результаты обучения
- Различают развитие в зародышевый, эмбриональный и фетальный периоды
- Изучить риски для внутриутробного развития, связанные с воздействием тератогенов
- Объясните возможные осложнения беременности и родов
Пренатальное развитие
«Тело будущего ребенка сложнее нашего.У новорожденного ребенка есть несколько дополнительных частей тела, которые ему нужны только до тех пор, пока он живет внутри своей матери. У него есть собственная космическая капсула, амниотический мешок. У него есть своя линия жизни, пуповина, и у него есть своя корневая система, плацента. Все это принадлежит самому ребенку, а не его матери. Все они развились из его исходной клетки».
ПОСМОТРЕТЬ: TED-ED: Удивительное влияние беременности на мать: Мышцы и суставы смещаются и толкаются.Учащается ритм сердцебиения. Кровь бурлит в артериях и венах. Во время беременности каждый орган в организме меняется. Инициированные целым рядом гормонов, эти изменения начинаются сразу после начала беременности. Узнайте, что мы знаем — и не знаем — о влиянии беременности на тело и мозг.
Периоды внутриутробного развития
Давайте рассмотрим некоторые изменения, происходящие в течение каждого из трех периодов внутриутробного развития: зародышевого периода, эмбрионального периода и плодного периода.
Зародышевый период (недели 1-2)
Рисунок 1 . Сперматозоид и яйцеклетка при зачатииЗачатие происходит, когда сперматозоид оплодотворяет яйцеклетку и образует зиготу , , которая начинается как одноклеточная структура. ДНК матери и отца передается ребенку в момент зачатия. На этом этапе устанавливаются генетический состав и пол ребенка. Зародышевый период (около 14 дней) длится от зачатия до имплантации зиготы (оплодотворенной яйцеклетки) в слизистую оболочку матки.
В течение первой недели после зачатия зигота делится и размножается, переходя от одноклеточной структуры к двухклеточной, затем четырехклеточной, затем восьмиклеточной и так далее. Процесс клеточного деления называется митозом . После четвертого деления начинает происходить и дифференцировка клеток. Дифференцированные клетки становятся более специализированными, образуя различные органы и части тела. Через 5 дней митоза насчитывается 100 клеток, а через 9 месяцев — миллиарды клеток.Митоз — это хрупкий процесс, и менее половины всех зигот выживают после первых двух недель (Hall, 2004).
После того, как зигота делится в течение примерно 7–10 дней и состоит из 150 клеток, она перемещается по фаллопиевым трубам и внедряется в слизистую оболочку матки. Подсчитано, что около 60 процентов естественных зачатий не имплантируются в матку. Скорость выше для зачатия in vitro. Как только зигота прикрепляется к матке, начинается следующая стадия.
Эмбриональный период (недели 3-8)
Рисунок 2 .Эмбрион человекаЭмбриональный период начинается после имплантации зиготы в стенку матки. Он длится с третьей по восьмую неделю после зачатия. После имплантации этот многоклеточный организм называется эмбрионом . Теперь кровеносные сосуды растут, образуя плаценту. плацента является структурой, соединенной с маткой, которая обеспечивает питание и кислород от матери к развивающемуся эмбриону через пуповину.
В этот период клетки продолжают дифференцироваться.Основные структуры эмбриона начинают развиваться в области, которые станут головой, грудью и животом. На эмбриональной стадии сердце начинает биться, формируются и начинают функционировать органы. На 22-й день после зачатия вдоль задней части эмбриона формируется нервная трубка, развивающаяся в спинной и головной мозг.
Рост во время внутриутробного развития происходит в двух основных направлениях: от головы к хвосту (цефалокаудальное развитие) и от средней линии наружу (проксимодистальное развитие).Это означает, что ближайшие к голове структуры развиваются раньше ближайших к ступням, а ближайшие к туловищу структуры развиваются раньше тех, что находятся дальше от центра тела (например, руки и пальцы).
Голова развивается на четвертой неделе, и предшественник сердца начинает пульсировать. На ранних стадиях эмбрионального периода видны жабры и хвост. Но к концу этой стадии они исчезают и организм приобретает более человеческий вид. Эмбрион составляет примерно 1 дюйм в длину и весит около 4 граммов в конце этого периода.В это время эмбрион может двигаться и реагировать на прикосновения.
Около 20 % организмов в эмбриональный период выходят из строя, как правило, из-за грубых хромосомных аномалий. Как и в случае с зародышевым периодом, часто мать еще не знает, что беременна. Именно на этом этапе формируются основные структуры организма, что делает эмбриональный период временем, когда организм наиболее уязвим для наибольшего ущерба при воздействии вредных веществ. Потенциальные матери часто не осознают риски, которые они представляют для развивающегося ребенка в это время.
Плодный период (недели 9-40)
Рисунок 3 . Плод на 10 неделе развития.Когда организму около девяти недель, эмбрион называется плодом . На этой стадии плод размером с фасоль начинает приобретать узнаваемую форму человека, поскольку «хвост» начинает исчезать.
В возрасте 9–12 недель начинают дифференцироваться половые органы. К 12-й неделе у плода есть все части тела, включая наружные половые органы.В последующие недели у плода разовьются волосы, ногти, зубы, а выделительная и пищеварительная системы будут продолжать развиваться. В конце 12-й недели плод имеет длину около 3 дюймов и весит около 28 граммов.
Примерно в 16 недель длина плода составляет примерно 4,5 дюйма. Пальцы рук и ног полностью развиты, видны отпечатки пальцев. В течение 4-6 месяцев глаза становятся более чувствительными к свету и развивается слух. Дыхательная система продолжает развиваться. Такие рефлексы, как сосание, глотание и икота, развиваются в течение 5-го месяца.В это время также присутствуют циклы сна и бодрствования. На протяжении всей эмбриональной стадии мозг продолжает расти и развиваться, почти удваиваясь в размерах с 16-й по 28-ю неделю. продолжать расти. В 24 недели плод может чувствовать боль (Королевский колледж акушеров и гинекологов, 1997).
Первый шанс на выживание вне матки, известный как возраст жизнеспособности, достигается примерно в возрасте от 22 до 26 недель (Moore & Persaud, 1998).К тому времени, когда плод достигает шестого месяца развития (24 недели), он весит до 1,4 кг. Слух развился, поэтому плод может реагировать на звуки. Внутренние органы, такие как легкие, сердце, желудок и кишечник, сформировались в достаточной степени, чтобы плод, родившийся в этот момент преждевременно, имел шанс выжить вне чрева матери.
Между 7-м и 9-м месяцами плод в первую очередь готовится к рождению. Он тренирует свои мышцы, его легкие начинают расширяться и сжиматься.Он развивает жировые слои под кожей. Плод набирает около 5 фунтов и 7 дюймов в течение этого последнего триместра беременности, включая слой жира, накопленный в течение 8-го месяца. Этот слой жира служит изоляцией и помогает ребенку регулировать температуру тела после рождения.
Около 36 недель плод почти готов к рождению. Он весит около 6 фунтов и имеет длину около 18,5 дюймов, а к 37 неделе все системы органов плода достаточно развиты, чтобы он мог выжить вне матки матери без многих рисков, связанных с преждевременными родами.Плод продолжает набирать вес и увеличиваться в длину примерно до 40 недель. К тому времени у плода остается очень мало места для передвижения, и роды становятся неизбежными.
Рисунок 4 . На стадии эмбриона развивается мозг ребенка, а тело прибавляет в размерах и весе, пока плод не достигнет полного развития.Экологические риски
Тератология
Необходим хороший дородовой уход. Развивающийся ребенок наиболее подвержен риску возникновения некоторых из самых серьезных проблем в течение первых трех месяцев развития.К сожалению, в это время большинство матерей не знают, что они беременны. Подсчитано, что 10% всех врожденных дефектов вызваны внутриутробным воздействием или тератогенами . Тератогены — это факторы, которые могут способствовать врожденным дефектам, включая некоторые материнские заболевания, наркотики, алкоголь и стресс. Эти воздействия могут также включать экологические и профессиональные воздействия. Сегодня мы знаем многие факторы, которые могут поставить под угрозу здоровье развивающегося ребенка. Врожденные дефекты, вызванные тератогенами, потенциально предотвратимы.
Изучение факторов, способствующих врожденным дефектам, называется тератологией. Тератогены обычно обнаруживаются после увеличения распространенности определенного врожденного дефекта. Например, в начале 1960-х годов для лечения утреннего недомогания использовали препарат, известный как талидомид. Воздействие на плод на этой ранней стадии развития приводило к случаям фокомелии, врожденного порока развития, при котором руки и ноги прикрепляются к укороченным рукам и ногам.
Взгляд на некоторые тератогены
Алкоголь Рисунок 5 .Некоторые отличительные характеристики расстройств алкогольного спектра плода включают более узкие глазные отверстия, гладкий желобок, что означает гладкую область между верхней губой и носом, и тонкую верхнюю губу.
Одним из наиболее часто используемых тератогенов является алкоголь. Поскольку половина всех беременностей в Соединенных Штатах являются незапланированными, женщинам детородного возраста рекомендуется проявлять большую осторожность в отношении употребления алкоголя, когда они не используют противозачаточные средства и во время беременности (Рекомендации главного хирурга по употреблению алкоголя во время беременности, 2005 г.).Употребление алкоголя, особенно на втором месяце внутриутробного развития, но в любой момент беременности, может привести к нейрокогнитивным и поведенческим проблемам, которые могут сохраняться на всю жизнь.
Не существует допустимого безопасного предела употребления алкоголя во время беременности, но чрезмерное употребление алкоголя (5 или более порций за один раз) или употребление 7 или более порций в течение одной недели подвергает ребенка особенно высокому риску. В крайних случаях употребление алкоголя может привести к гибели плода, но чаще это может привести к нарушениям алкогольного спектра плода (FASD) .Эта терминология теперь используется при рассмотрении последствий воздействия и заменяет термин алкогольный синдром плода. Он предпочтительнее, потому что он признает, что симптомы проявляются в спектре и что все люди не имеют одинаковых характеристик. Дети с ФАСН имеют общие физические особенности, такие как уплощенный нос, маленькие глазные отверстия, маленькие головы, задержки интеллектуального развития и поведенческие проблемы. Люди с ФАСН больше подвержены риску таких проблем на всю жизнь, как преступное поведение, психиатрические проблемы и безработица (CDC, 2006).
Термины «неврологическое расстройство, связанное с алкоголем» (ARND) и врожденные дефекты, связанные с алкоголем (ARBD), заменили термин «воздействие алкоголя на плод» для обозначения лиц с менее выраженными симптомами FASD. ARBD включает проблемы с почками, костями и сердцем.
Табак
Курение также считается тератогенным, поскольку никотин проходит через плаценту к плоду. Когда мать курит, у развивающегося ребенка снижается уровень кислорода в крови. Употребление табака во время беременности было связано с низкой массой тела при рождении, предлежанием плаценты, врожденными дефектами, преждевременными родами, задержкой роста плода и синдромом внезапной детской смерти.Курение за месяц до беременности и на протяжении всей беременности увеличивает вероятность этих рисков. Лучше всего бросить курить 90 559 до 90 560 и забеременеть. Тем не менее, для уже беременных женщин прекращение курения как можно раньше может помочь защитить от некоторых проблем со здоровьем матери и ребенка.
Наркотики
Рецептурные, безрецептурные или рекреационные наркотики могут иметь серьезные тератогенные эффекты. В целом, если требуется медикаментозное лечение, следует использовать минимально возможную дозу.Следует избегать комбинированной лекарственной терапии и воздействия в первом триместре. Почти три процента беременных женщин употребляют запрещенные наркотики, такие как марихуана, кокаин, экстази и другие амфетамины, а также героин. Эти препараты могут вызывать низкий вес при рождении, симптомы отмены, врожденные дефекты или проблемы с обучением или поведением. Дети, рожденные с героиновой зависимостью, нуждаются в героине так же, как взрослые наркоманы. Ребенка нужно будет постепенно отучать от героина под наблюдением врача; в противном случае у ребенка могут быть судороги и смерть.
Экологические химикаты
Экологические химические вещества могут включать в себя воздействие широкого спектра агентов, включая загрязнение, органические соединения ртути, гербициды и промышленные растворители. Некоторые загрязнители окружающей среды, вызывающие серьезную озабоченность, включают отравление свинцом, которое связано с низкой массой тела при рождении и замедлением неврологического развития. Известно, что дети, живущие в старых домах, в которых использовались краски на основе свинца, поедают облупившуюся краску, подвергаясь воздействию свинца.Химические вещества в некоторых гербицидах также потенциально опасны. Радиация – еще одна экологическая опасность, о которой должна знать беременная женщина. Если мать подверглась облучению, особенно в первые три месяца беременности, у ребенка могут возникнуть врожденные уродства. Существует также повышенный риск выкидыша и мертворождения. Ртуть приводит к физическим уродствам и умственной отсталости (Дитрих, 1999).
Инфекции, передающиеся половым путем
Инфекции, передающиеся половым путем (ИППП), могут осложнить беременность и могут иметь серьезные последствия как для матери, так и для развивающегося ребенка.Большая часть дородового ухода сегодня включает тестирование на ИППП, и раннее выявление имеет важное значение. Такие ИППП, как хламидиоз, гонорея, сифилис, трихомониаз и бактериальный вагиноз, можно лечить с помощью антибиотиков, безопасных для приема во время беременности. ИППП, вызванные вирусами, такие как генитальный герпес, гепатит В или ВИЧ, неизлечимы. Однако в некоторых случаях эти инфекции можно лечить противовирусными препаратами или принимать другие профилактические меры, чтобы снизить риск передачи инфекции ребенку.
Болезни матери
Болезни матери увеличивают вероятность того, что ребенок родится с врожденным дефектом или будет иметь хронические проблемы со здоровьем. Некоторые из заболеваний, которые, как известно, потенциально могут оказывать неблагоприятное воздействие на плод, включают диабет, цитомегаловирус, токсоплазмоз, краснуху, ветряную оспу, гипотиреоз и стрептококк B. Если мать заражается краснухой в течение первых трех месяцев беременности, повреждение может произойти в глаза, уши, сердце или мозг будущего ребенка. Положительным моментом является то, что краснуха почти полностью ликвидирована в промышленном мире благодаря вакцине, созданной в 1969 году.Ранняя диагностика этих заболеваний и получение соответствующей медицинской помощи могут помочь улучшить результаты. Обычный дородовой уход теперь включает скрининг на гестационный диабет и стрептококк B.
Материнский стресс
Стресс представляет собой воздействие любого фактора, способного угрожать гомеостазу организма; эти либо реальные, либо предполагаемые угрозы называются «стрессорами» и включают длинный список потенциальных неблагоприятных факторов, которые могут быть эмоциональными или физическими. Было обнаружено, что из-за связи кровоснабжения между матерью и плодом стресс может оказывать длительное воздействие на развивающийся плод, даже до рождения ребенка.Наиболее изученными исходами воздействия материнского пренатального стресса на плод являются преждевременные роды и низкая масса тела при рождении. Пренатальный стресс матери также считается ответственным за различные изменения головного мозга ребенка и фактором риска таких состояний, как поведенческие проблемы, расстройства обучения, высокий уровень тревожности, синдром дефицита внимания и гиперактивности, аутизм и шизофрения. Кроме того, материнский пренатальный стресс был связан с более высоким риском различных иммунных и метаболических изменений у ребенка, таких как астма, аллергические расстройства, сердечно-сосудистые заболевания, гипертония, гиперлипидемия, диабет и ожирение (Konstantinos et al., 2017).
ЧТО ВЫ ДУМАЕТЕ? Следует ли арестовывать и заключать в тюрьму женщин, употребляющих наркотики во время беременности?
Как вы теперь знаете, женщины, употребляющие наркотики или алкоголь во время беременности, могут причинить серьезный вред своему ребенку на всю жизнь. Некоторые люди выступают за обязательное обследование беременных женщин, злоупотребляющих наркотиками в анамнезе, и, если женщины продолжают употреблять наркотики, арестовывать их, преследовать в судебном порядке и заключать в тюрьму (Фигдор и Каезер, 1998). Эта политика была опробована в Чарльстоне, Южная Каролина, совсем недавно, 20 лет назад.Эта политика называлась Межведомственной политикой по борьбе со злоупотреблением психоактивными веществами во время беременности и имела катастрофические результаты.
Межведомственная политика распространяется на пациентов, посещающих акушерскую клинику в MUSC, которая в первую очередь обслуживает малоимущих или получающих Medicaid. Он не распространялся на частных акушерских пациенток. Политика требовала информирования пациентов о вредных последствиях злоупотребления психоактивными веществами во время беременности. . . . Заявление [A] также предупредило пациентов о том, что в защиту нерожденных и новорожденных детей от вреда, связанного с незаконным употреблением наркотиков, может входить полиция Чарльстона, солиситор Девятого судебного суда и отдел служб защиты Департамента социальных служб (DSS).(Джос, Маршалл и Перлмуттер, 1995, стр. 120–121)
Эта политика, казалось, удерживала женщин от обращения за дородовой помощью, удерживала их от обращения за другими социальными услугами и применялась исключительно к женщинам с низким доходом, что приводило к судебным искам. Программа была закрыта через 5 лет, в течение которых было арестовано 42 женщины. Позже федеральное агентство определило, что программа включала эксперименты на людях без одобрения и надзора со стороны институционального наблюдательного совета (IRB). Какие были недостатки в программе и как бы вы их исправили? Каковы этические последствия обвинения беременных женщин в жестоком обращении с детьми?
Факторы, влияющие на пренатальные риски
При определении типа и степени повреждения, которое может возникнуть в результате воздействия того или иного тератогена, необходимо учитывать несколько соображений (Berger, 2004).К ним относятся:
- Время воздействия : Структуры тела уязвимы для самых серьезных повреждений, когда они формируются. Если вещество вводится в критический период определенной структуры (время развития), повреждение этой структуры может быть больше. Например, уши и руки достигают своего критического периода примерно через 6 недель после зачатия. Если в этот период мать подвергает эмбрион воздействию определенных веществ, руки и уши могут деформироваться.
- Количество воздействия: Некоторые вещества не являются вредными, если количество не достигает определенного уровня. Критический уровень частично зависит от размера и метаболизма матери.
- Генетика: Генетический состав также играет роль в воздействии того или иного тератогена на ребенка. На это указывают исследования разнояйцевых близнецов, которые подвергаются воздействию одной и той же пренатальной среды, но не испытывают одинаковых тератогенных эффектов. Генетический состав матери также может иметь значение; некоторые матери могут быть более устойчивы к тератогенным эффектам, чем другие.
- Быть мужчиной или женщиной: Мужчины чаще страдают от повреждений из-за тератогенов, чем женщины. Считается, что Y-хромосома, которая содержит меньше генов, чем X, может оказывать влияние.
Осложнения беременности и родов
Рисунок 7 . Беременность влияет на женщин по-разному; некоторые замечают несколько неблагоприятных побочных эффектов, в то время как другие испытывают сильный дискомфорт или у них развиваются более серьезные осложнения.Существует ряд общих побочных эффектов беременности. Не все испытывают все это, и женщины не испытывают их в одинаковой степени. И хотя они считаются «незначительными», эти проблемы потенциально очень неудобны.Эти побочные эффекты включают тошноту (особенно в течение первых 3-4 месяцев беременности в результате более высокого уровня эстрогена в организме), изжогу, газы, геморрой, боли в спине, судороги в ногах, бессонницу, запор, одышку или варикозное расширение вен. (в результате ношения тяжелой нагрузки на живот). Что такое лекарство? Доставка!
Основные осложнения
Ниже перечислены некоторые серьезные осложнения беременности, которые могут представлять опасность для здоровья матери и ребенка и часто требуют особого ухода.
- Гестационный диабет — это когда у женщины без диабета во время беременности повышается уровень сахара в крови.
- Hyperemesis gravidarum — это наличие тяжелой и непрекращающейся рвоты, вызывающей обезвоживание и потерю веса. Это более серьезное заболевание, чем более распространенное утреннее недомогание.
- Преэклампсия — это гипертензия беременных. Тяжелая преэклампсия включает артериальное давление выше 160/110 с дополнительными признаками. Эклампсия — это судороги у пациентки с преэклампсией.
- Тромбоз глубоких вен — это образование тромба в глубокой вене, чаще всего в ногах.
- Беременная женщина более восприимчива к инфекциям. Этот повышенный риск вызван повышенной иммунной толерантностью во время беременности, чтобы предотвратить иммунную реакцию против плода.
- Перипартальная кардиомиопатия — это снижение функции сердца, возникающее в последний месяц беременности или в течение шести месяцев после беременности.
Материнская смертность
Материнская смертность неприемлемо высока.Около 295 000 женщин умерли во время и после беременности и родов в 2017 году. Подавляющее большинство этих смертей (94%) произошло в условиях ограниченных ресурсов, и большинство из них можно было предотвратить. Большое количество материнских смертей в некоторых регионах мира отражает неравенство в доступе к качественным медицинским услугам и подчеркивает разрыв между богатыми и бедными. КМС в странах с низким уровнем дохода в 2017 году составляет 462 на 100 000 живорождений по сравнению с 11 на 100 000 живорождений в странах с высоким уровнем дохода. Большое число материнских смертей в некоторых регионах мира отражает неравенство в доступе к услугам здравоохранения и подчеркивает разрыв между богатыми и бедными.
У женщин в менее развитых странах в среднем гораздо больше беременностей, чем у женщин в развитых странах, и риск смерти в результате беременности у них выше. Пожизненный риск материнской смерти для женщины — это вероятность того, что 15-летняя женщина в конечном итоге умрет по материнской причине. В странах с высоким уровнем дохода это 1 случай на 5400, по сравнению с 1 случаем на 45 в странах с низким уровнем дохода. Каждый день в 2017 году примерно 810 женщин умирали от предотвратимых причин, связанных с беременностью и родами.
Рисунок 8 . Число женщин и девочек, ежегодно умирающих от осложнений беременности и родов, сократилось с 451 000 в 2000 г. до 295 000 в 2017 г. Эти улучшения особенно заметны в свете быстрого роста населения во многих странах, где материнская смертность является самой высокой. Тем не менее, более 800 женщин умирают каждый день от осложнений во время беременности и родов. И на каждую умирающую женщину приходится примерно 20 других с серьезными травмами, инфекциями или инвалидностью.Источник: ЮНИСЕФ, https://data.unicef.org/topic/maternal-health/maternal-mortality/. Несмотря на то, что материнская смертность в Соединенных Штатах сегодня относительно редка из-за достижений в области необходимо решить. К сожалению, около 700 женщин ежегодно умирают в Соединенных Штатах в результате осложнений во время беременности или родов. Центры по контролю и профилактике заболеваний определяют связанную с беременностью смерть как смерть женщины во время беременности или в течение 1 года после окончания беременности, независимо от исхода, продолжительности или места беременности, по любой причине. связанные с беременностью или ее ведением, или усугубленные ею, но не по случайным или случайным причинам.
С момента внедрения Системы наблюдения за смертностью при беременности число зарегистрированных смертей, связанных с беременностью, в Соединенных Штатах неуклонно росло с 7,2 смертей на 100 000 живорождений в 1987 году до 17,3 смертей на 100 000 живорождений в 2017 году. связанные коэффициенты смертности в период с 1987 по 2017 год (последний год данных).
Причины общего увеличения смертности, связанной с беременностью, неясны. Как вы думаете, каковы причины такого удивительного роста в Соединенных Штатах? Что можно сделать, чтобы изменить эту статистику?
Смотрите: материнская смертность в США
В Соединенных Штатах чернокожие женщины непропорционально чаще умирают от осложнений, связанных с беременностью или родами, чем представители любой другой расы; они в три или четыре раза чаще, чем белые женщины, умирают из-за смерти, связанной с беременностью, и с большей вероятностью получают худший материнский уход.Чернокожие женщины из групп с более высокими доходами и с высшим уровнем образования также подвержены повышенному риску — даже у суперзвезды тенниса Серены Уильямс были почти смертельные осложнения во время рождения дочери Олимпии. Почему так происходит в нашем современном мире? Посмотрите это видео, чтобы узнать больше.
Существуют значительные расовые/этнические различия в смертности, связанной с беременностью. 2,3 За 2014–2017 годы коэффициенты смертности, связанной с беременностью, составили:
- 41,7 смертей на 100 000 живорождений среди неиспаноязычных чернокожих женщин.
- 28,3 смертей на 100 000 живорождений среди неиспаноязычных американских индейцев или женщин коренных жителей Аляски.
- 13,8 смертей на 100 000 живорождений среди неиспаноязычных женщин азиатского или тихоокеанского происхождения.
- 13,4 смертей на 100 000 живорождений среди неиспаноязычных белых женщин.
- 11,6 смертей на 100 000 живорождений для латиноамериканских или латиноамериканских женщин.
Изменчивость риска смерти в зависимости от расы/этнической принадлежности может быть обусловлена несколькими факторами, включая доступ к медицинской помощи, качество медицинской помощи, распространенность хронических заболеваний, структурный расизм и неявные предубеждения.
Почему во всем мире умирают женщины во время беременности и родов?
Женщины умирают в результате осложнений во время и после беременности и родов. Большинство этих осложнений развиваются во время беременности, и большинство из них можно предотвратить или вылечить. Другие осложнения могут существовать до беременности, но они усугубляются во время беременности, особенно если их не лечить в рамках ухода за женщиной. Основные осложнения, на долю которых приходится почти 75% всех материнских смертей:
- сильное кровотечение (в основном кровотечение после родов)
- инфекции (обычно после родов)
- высокое кровяное давление при беременности (преэклампсия и эклампсия)
- осложнения родов
Остальные вызваны или связаны с инфекциями, такими как малярия, или связаны с хроническими состояниями, такими как болезни сердца или диабет.
Почему женщины умирают во время беременности и родов в США?
Сравните данные, о которых вы узнали выше, с процентами смертей, связанных с беременностью, в США в 2014–2017 годах.
- Другие сердечно-сосудистые заболевания, 15,5%.
- Инфекция или сепсис, 12,7%.
- Кардиомиопатия, 11,5%.
- Кровоизлияние, 10,7%.
- Тромботическая легочная или другая эмболия, 9,6%.
- Нарушения мозгового кровообращения, 8.2%.
- Гипертензивные расстройства беременности, 6,6%.
- Эмболия околоплодными водами, 5,5%.
- Осложнения анестезии, 0,4%.
- Другие несердечно-сосудистые заболевания, 12,5%.
Причина смерти неизвестна для 6,7% всех смертей, связанных с беременностью, в 2014–2017 гг.
В то время как вклад кровотечения, гипертензивных нарушений беременности (например, преэклампсии, эклампсии) и осложнений анестезии в смертность, связанную с беременностью, снизился, вклад сердечно-сосудистых заболеваний, нарушений мозгового кровообращения и других заболеваний увеличился. 12 Исследования показывают, что все большее число беременных женщин в Соединенных Штатах имеют хронические заболевания, такие как гипертония, 13,14 диабет, 14-17 и хронические болезни сердца. 12,18 Эти состояния могут подвергать женщину более высокому риску осложнений во время беременности или в течение года после родов.
Выкидыш
Потеря беременности наблюдается примерно в 20-40 процентах невыявленных беременностей и еще в 10 процентах диагностированных беременностей.Обычно аборт происходит из-за хромосомных аномалий, и обычно это происходит до 12-й недели беременности. В результате спазмы и кровотечения, нормальные менструации должны вернуться через несколько месяцев. Или может потребоваться хирургическая процедура, называемая D&E (расширение и эвакуация). У некоторых женщин чаще случаются повторные выкидыши из-за хромосомных, амниотических или гормональных проблем; но выкидыш также может быть результатом дефектной спермы (Carroll et al., 2003).
В СШАS., потеря беременности до 20-й недели беременности называется выкидышем, а термин мертворождение относится к потере ребенка после 20-й недели беременности. Женщина все равно должна пройти через роды или кесарево сечение, чтобы родить ребенка. Мертворождение встречается примерно у 1 из 160 новорожденных, и ежегодно в Соединенных Штатах рождается около 24 000 детей. Это примерно столько же детей, которые умирают в течение первого года жизни, и это более чем в 10 раз больше, чем число смертей от синдрома внезапной детской смерти (СВДС).
Как видите, то, что может показаться простым процессом, на самом деле является прекрасным и деликатным путешествием. Каждая история беременности и родов уникальна и полна сюрпризов, а иногда и проблем. Поскольку медицинские технологии быстро совершенствуются, женщины получают больше информации и больше возможностей для выбора, когда речь идет о беременности и родах. Однако то, что вмешательства доступны, не означает, что это путь для всех матерей. Как мы узнали в случае с Сереной Уильямс, даже в США.S. иногда медицинская помощь может пойти наперекосяк. Каждая мать должна активно защищать себя и своего ребенка во время беременности и родов.
Как вы думаете, куда мы движемся с тем, как медицинские достижения используются во время беременности и родов? Все больше женщин могут забеременеть с помощью репродуктивной помощи, часто после того возраста, в котором они могли бы зачать ребенка естественным путем. В начале модуля была представлена тема «дизайнерские младенцы». Как вы думаете, после завершения этого модуля мы идем к этому в ближайшем будущем? Каковы этические последствия?
Веб-сайты
- Проект «Геном человека» (ссылки на внешний сайт.)
- Проект «Геном человека» (HGP) был путешествием внутрь страны, посвященным открытиям, возглавляемым международной группой исследователей, стремящихся секвенировать и картировать все гены — вместе известные как геном — представителей нашего вида, Homo sapiens. Начавшись в октябре 1990 года и завершившись в апреле 2003 года, HGP впервые дала нам возможность прочитать полный генетический план природы для создания человека.
- Институт поведенческой генетики (ссылки на внешний сайт.)
- IBG, основанная в 1967 году, является одним из лучших в мире центров генетических исследований поведения. Продолжается сбор и анализ данных для нескольких всемирно известных исследований, включая проект по усыновлению в Колорадо, реестр близнецов в Колорадо, национальное семейное исследование среди молодежи, Колорадский исследовательский центр с ограниченными способностями к обучению и национальное лонгитюдное исследование здоровья подростков.
Видео
- Внесение удобрений
- В этом видеоролике, созданном Nucleus Medical Media, показано оплодотворение человека, также известное как зачатие.На увеличенном клеточном уровне показано, как сперматозоиды преодолевают множество препятствий в женских половых путях, чтобы достичь яйцеклетки. Затем генетический материал из яйцеклетки и одного сперматозоида объединяется, чтобы сформировать нового человека.
- От зачатия до рождения — визуализированный
- Имиджмейкер Александр Циарас делится мощной медицинской визуализацией, показывающей развитие человека от зачатия до рождения и далее.
- Что такое ДНК и гены?
- Учебный центр генетических наук, спонсируемый Университетом штата Юта, предоставляет учебные материалы по генетике, биологическим наукам и вопросам здравоохранения.Все люди имеют одинаковые гены, расположенные в одном и том же порядке. И более 99,9% последовательности нашей ДНК одинаковы. Но немногочисленных различий между нами (всего их 1,4 миллиона!) достаточно, чтобы сделать каждого из нас уникальным.
- Что такое наследование?
- Учебный центр генетических наук, спонсируемый Университетом штата Юта, предоставляет учебные материалы по генетике, биологическим наукам и вопросам здравоохранения. Это видео объясняет важность генетической изменчивости.
- Синдром Дауна — осознание способностей
- Что приходит на ум, когда вы думаете о человеке с синдромом Дауна? У вас есть предвзятое представление об их возможностях? Крис Берк рассказывает о своем опыте и работе в Национальном обществе людей с синдромом Дауна.
- Варианты пренатального тестирования
- Мичиганский университет предоставляет это видео, в котором объясняется разница между пренатальным скринингом и диагностическим тестированием. Беременные женщины сталкиваются с решением, проходить ли пренатальный скрининг и тестирование, и если да, то какой из многих вариантов выбрать.
- Пренатальное развитие: чему мы учимся в утробе матери
- Давайте посмотрим, что мы переживаем и чему учимся в утробе матери с точки зрения плода.
- TED talk: Как CRISPR позволяет нам редактировать нашу ДНК
- Генетик Дженнифер Дудна изобрела революционную новую технологию редактирования генов под названием CRISPR-Cas9. Инструмент позволяет ученым вносить точные изменения в нити ДНК, что может привести к лечению генетических заболеваний… но также может быть использовано для создания так называемых «дизайнерских детей». Дудна рассматривает, как работает CRISPR-Cas9, и просит научное сообщество сделать паузу и обсудить этику этого нового инструмента.
Хронология: Генетика | Новый ученый
Джон Пикрелл
Первооткрыватели структуры ДНК.Джеймс Уотсон (1928 г. р.), слева, и Фрэнсис Крик (1916–2004) со своей моделью части молекулы ДНК в 1953 г.
(Изображение: A Barrington Brown / SPL)
5000 г. до н.э.
Демонстрируя некоторое понимание наследственности, люди во всем мире начинают выборочно разводить более полезные сорта скота и сельскохозяйственных культур, включая пшеницу, кукурузу, рис и финики
400 г. до н.э.
Греческие философы размышляют о механизмах наследственности человека. Аристотель считает, что черты, приобретенные в течение жизни, например травмы, могут передаваться потомству.Он также развивает теорию «пангенеза», которая пытается объяснить, как эти черты передаются через частицы, называемые «гемулами», репродуктивным клеткам
.1859
Чарльз Дарвин, сам сторонник пангенезиса, публикует «Происхождение видов » — свое объяснение эволюции путем естественного отбора. Дарвин приводит множество свидетельств того, как ценные признаки становятся более распространенными в популяции, но не дает никакого объяснения механизма передачи этих признаков
1866
Монах-августинец Грегор Мендель публикует свою работу о закономерностях наследования растений гороха.Его тщательные исследования знаменуют собой рождение современной генетики. Выводы Менделя ускользают от внимания других исследователей более трех десятилетий
1882
Хромосомы открыты немецким биологом Вальтером Флемингом и названы греческой приставкой, означающей «цвет», потому что они окрашиваются при окрашивании клеток
1902
Исследования Менделя вновь открыты ботаниками в 1900 году. Затем американские и немецкие клеточные биологи независимо друг от друга отмечают связь между «единицами наследственности» Менделя и хромосомами.Они заключают, что наследственная информация содержится в хромосомах
.1905
Термин «генетика» ввел британский биолог Уильям Бейтсон. Термины «ген» и «генотип» появились в 1909 году.
Половые хромосомы обнаружены после изучения бабочек и жуков
1910
Американский ученый Томас Хант Морган первым обнаружил сцепленный с полом признак при изучении плодовой мушки Drosophila . Признак цвета глаз на Х-хромосоме также является первым геном, который прослеживается до конкретной хромосомы
.1925
Исследования показывают, что рентгеновские лучи могут вызывать мутации в генетическом материале
1944
Трое американских генетиков пересматривают работу 1920-х годов и доказывают, что у бактерий наследственным материалом является ДНК, а не белок, как предполагалось ранее
1951
Четкие рентгеновские дифракционные изображения ДНК впервые получены британским исследователем Розалинд Франклин
1953
Основываясь на работе Франклина, биохимик Джеймс Уотсон и биофизик Фрэнсис Крик из Кембриджского университета, Великобритания, определили известную ныне структуру двойной спирали ДНК.За свои усилия они были удостоены Нобелевской премии в 1962 году.
1961
Крик и южноафриканский генетик Сидней Бреннер сообщают, что три основания ДНК, называемые нуклеотидами, содержат инструкции для одной из 20 аминокислот, которые объединяются в белки
1973
Исследователь из США Херб Бойер использует ферменты для разрезания ДНК и сращивания ее с бактериальными плазмидами, которые затем реплицируются, производя множество копий вставленного гена. Это предвещает рассвет генной инженерии
1978
Генетически модифицированные бактерии производят гормон инсулин
1983
Ген наследственного заболевания (болезнь Гентингтона) впервые картирован в хромосоме
1986
Кэри Маллис в США разрабатывает полимеразную цепную реакцию (ПЦР), которая позволяет исследователям производить многие миллионы копий молекул ДНК всего за несколько часов
1990
Начинается международный проект «Геном человека» с целью секвенирования всего генетического кода человека
Впервые успешно применена генная терапия для лечения четырехлетней девочки с редким наследственным иммунным заболеванием, дефицитом аденозиндезаминазы
1994
Помидоры FlavrSavr, генетически модифицированные для длительного хранения, являются первым генетически модифицированным продуктом, поступившим в продажу в США.ГМ томатное пюре поступает в продажу в Великобритании в 1996 году
1996
Пекарские дрожжи являются первым (не вирусным) геномом, который был завершен, за ним последовал червь Caenorhabditis elegans в 1998 году, а затем растение Arabidopsis и плодовая муха Drosophila в 2000 году
2000
Завершение проекта генома человека объявлено совместно американской фирмой Celera Genomics и Human Genome Project (международный общественный консорциум). Полная последовательность, включающая от 30 000 до 40 000 генов, завершена в 2003 г.
2003
Тропическая рыба, светящаяся ярко-красным светом, стала первым генетически модифицированным домашним животным, поступившим в продажу в США
Дополнительная информация по этим темам:
Current Opinion in Genetics & Development — Journal
Current Opinion in Genetics and Development направлен на стимулирование научно обоснованных, междисциплинарных, многомасштабных дебатов и обмена идеями.Он содержит полные, краткие и своевременные обзоры и мнения с особым акцентом на те статьи, которые были опубликованы за последние два года. Помимо описания последних тенденций, авторам предлагается высказать свое субъективное мнение по обсуждаемым темам.
В Текущее мнение в области генетики и развития мы помогаем читателю, систематически предоставляя:
1. Мнения экспертов о текущих достижениях в своей области в ясной и удобочитаемой форме.
2.Оценки наиболее интересных статей, аннотированные экспертами, из огромного количества оригинальных публикаций.
Current Opinion in Genetics and Development входит в набор журналов Current Opinion and Research (CO+RE) . Журналы CO+RE используют наследие Current Opinion, отличающееся редакционным мастерством, высокой отдачей и глобальным охватом, чтобы гарантировать, что они являются широко читаемым ресурсом, который является неотъемлемой частью рабочих процессов ученых.
Current Opinion in Genetics and Development будет служить бесценным источником информации для исследователей, лекторов, преподавателей, специалистов, политиков и студентов.
Разделение предмета на разделы
Предмет Генетика и Развитие разделен на шесть тематических разделов, каждый из которых пересматривается один раз в год:
• Геномика рака
2 Архитектура и экспрессия
• Молекулярно-генетические основы болезни
• Механизмы развития, формирование паттерна и эволюция
• Перепрограммирование, регенерация и восстановление клеток
• Генетика человеческого происхождения / Эволюционная генетика 9055 3 (альтернативные годы) Выбор тем для обзора
Редакторы разделов, являющиеся крупными авторитетами в данной области, назначаются редакторами журнала.Они делят свой раздел на ряд тем, обеспечивая всесторонний охват области и выделение всех актуальных вопросов. Редакторы разделов заказывают обзоры у властей по каждой выбранной ими теме. Редколлегия оказывает поддержку редакторам и редакторам разделов своими комментариями и предложениями по названиям и темам.
Обзорные статьи в Current Opinion in Genetics and Development доступны только по приглашению.
Обзорные статьи
Авторы пишут короткие обзорные статьи, в которых представляют последние достижения в своей теме, подчеркивая наиболее важные, по их мнению, аспекты.Кроме того, они дают краткие аннотации к статьям, которые считают наиболее интересными из всех, опубликованных по их теме за предыдущие два года.
Редакционный обзор
Редакторы раздела пишут краткий обзор в начале раздела, чтобы представить обзоры и привлечь внимание читателя к особенно интересным событиям.
Этот успешный формат сделал Current Opinion in Genetics and Development одним из самых уважаемых и цитируемых обзорных журналов в этой области.
Основы генетики | ЦКЗ
Генетические исследования изучают, как отдельные гены или группы генов влияют на здоровье и болезни. Понимание генетических факторов и генетических нарушений важно для получения дополнительной информации об укреплении здоровья и профилактике заболеваний.
Некоторые генетические изменения были связаны с повышенным риском рождения ребенка с врожденными дефектами или инвалидностью в развитии или с развитием таких заболеваний, как рак или болезни сердца. Генетика также может помочь нам понять, как возникают заболевания.
Как мы получаем наши гены
Люди получают (наследуют) свои хромосомы, содержащие их гены, от своих родителей. Хромосомы идут парами, а у человека 46 хромосом в 23 парах. Дети случайным образом получают по одной хромосоме каждой пары от матери и по одной хромосоме каждой пары от отца. Хромосомы, образующие 23-ю пару, называются половыми хромосомами. Они решают, рожден человек мужчиной или женщиной. У самки две Х-хромосомы, а у самца одна Х- и одна Y-хромосома.Каждая дочь получает X от матери и X от отца. Каждый сын получает X от матери и Y от отца.
Генетические расстройства
Генетические нарушения могут возникать по многим причинам. Генетические расстройства часто описываются с точки зрения хромосомы, содержащей ген, измененный у людей, страдающих этим расстройством. Если ген находится в одной из первых 22 пар хромосом, называемых аутосомами, генетическое заболевание называется аутосомным заболеванием. Если ген находится на Х-хромосоме, заболевание называется Х-сцепленным.
Генетические расстройства также группируются по тому, как они проявляются в семьях. Расстройства могут быть доминантными или рецессивными, в зависимости от того, как они вызывают состояния и как они передаются в семьях.
Доминант
Доминантные заболевания могут быть вызваны только одной копией гена с мутацией ДНК. Если у одного из родителей есть заболевание, у каждого ребенка есть 50% шанс унаследовать мутировавший ген.
Рецессивный
Для рецессивных заболеваний обе копии гена должны иметь мутацию ДНК, чтобы получить одно из этих заболеваний.Если у обоих родителей есть одна копия мутировавшего гена, у каждого ребенка есть 25% шанс заболеть этим заболеванием, даже если ни у одного из родителей оно отсутствует. В таких случаях каждого родителя называют носителем болезни. Они могут передать болезнь своим детям, но не болеют сами.
Нарушения одного гена
Некоторые генетические заболевания вызываются мутацией ДНК в одном из генов человека. Например, предположим, что часть гена обычно имеет последовательность TAC. Мутация может изменить последовательность на TTC у некоторых людей.Это изменение в последовательности может изменить способ работы гена, например, за счет изменения производимого белка. Мутации могут передаваться ребенку от родителей. Или они могут произойти впервые в сперматозоиде или яйцеклетке, так что у ребенка будет мутация, а у родителей — нет. Нарушения одного гена могут быть аутосомными или сцепленными с Х-хромосомой.
Например, серповидно-клеточная анемия – это аутосомное заболевание с одним геном. Это вызвано мутацией в гене, обнаруженном на хромосоме 11.Серповидноклеточная анемия вызывает анемию и другие осложнения. С другой стороны, синдром ломкой Х-хромосомы представляет собой сцепленное с Х-хромосомой заболевание одного гена. Это вызвано изменением гена на Х-хромосоме. Это наиболее распространенная известная причина умственной отсталости и задержки развития, которая может передаваться по наследству (передаваться от одного поколения к другому).
Хромосомные аномалии
Различное количество хромосом
Обычно у людей 23 пары хромосом. Но, иногда человек рождается с другим числом.Наличие дополнительной хромосомы называется трисомией. Отсутствие хромосомы называется моносомией.
Например, у людей с синдромом Дауна есть дополнительная копия хромосомы 21. Эта дополнительная копия изменяет нормальное развитие тела и мозга и вызывает у человека интеллектуальные и физические проблемы. Некоторые расстройства вызваны разным числом половых хромосом. Например, у людей с синдромом Тернера внешняя иконка обычно имеет только одну половую хромосому, X. У женщин с синдромом Тернера могут быть проблемы с ростом и пороки сердца.
Изменения в хромосомах
Иногда хромосомы неполные или имеют другую форму, чем обычно. Отсутствие небольшой части хромосомы называется делецией. Транслокация — это когда часть одной хромосомы перемещается на другую хромосому. Инверсия – это перевернутая часть хромосомы.
Например, у людей с синдромом Вильямса отсутствует небольшая часть хромосомы 7. Эта делеция может привести к умственной отсталости и отличительному внешнему виду лица и личности.
Сложные условия
Комплексное заболевание вызывается как генетическими изменениями, так и факторами окружающей среды. Сложные заболевания также называют многофакторными. Большинство хронических заболеваний, таких как болезни сердца, рак и диабет, являются сложными состояниями. Например, в то время как некоторые случаи рака связаны с наследственными генетическими изменениями, например, синдром Линча и наследственный рак груди и яичников, большинство, скорее всего, вызвано изменениями в нескольких генах, действующими вместе с воздействием окружающей среды.
