Термическое разложение метана
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s 2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s 1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t° кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Разложение органических соединений метана — Справочник химика 21
Метан составляет сырьевую основу важнейших химических промышленных процессов получения углерода и водорода, ацетилена, кислородсодержащих органических соединений — спиртов, альдегидов, кислот. Получаемый при термическом разложении метана (реакция 1) мелкодисперсный углерод (газовая сажа) используется как наполнитель при производстве резины, типографских красок. Водород используется в различных синтезах, в том числе в синтезе аммиака. При высокотемпературном крекинге метана (реакция 2) получается ацетилен, необходимая высокая температура (1400—1600 С) создается электрической дугой. Одной из важных областей применения метана является получение так называемого синтез-газа — смеси оксида углерода(П) и водорода (реакции 3 и 4), используемого в дальнейшем для получения многих органических соединений. [c. 69]
69]
Образование метана. Метан образуется в результате разложения органических соединений. Механизм образования метана в результате разложения органических соединений уже рассмотрен в гл. П, 2 и гл. 1П, 1. Кроме того, образование метана может [c.194]
Продуктами разложения органических соединений в диффузионных пламенах и пламенах гомогенных смесей являются водород и простейшие углеводороды. Общим простейшим углеводородом при разложении исследованных органических (соединений является метан. В пламенах кислородсодержащих соединений кроме этого образуются простейшие кислородсодержащие соединения типа СН2О, а в пламенах азотсодержащих соединений, вероятно, образуется азот, В процессе разложения некоторых соединений образуется этан, максимальное содержание которого составляет доли %. В качестве продукта разложения высокомолекулярных предельных углеводородов (парафина) обнаружен в незначительном количестве пропан. Наличие бутана в пламенах исследованных соединений не установлено. Продуктом разложения некоторых органических соединений является этилен. При горении высокомолекулярных предельных углеводородов (парафина) образуются кроме этилена другие непредельные соединения пропилен и в небольших количествах бутилен и бутадиен (дивинил). Характер распределения концентраций ацетилена в пламенах позволяет предположить, что он не является первичным продуктом разложения исходных соединений неароматического строения. [c.112]
Наличие бутана в пламенах исследованных соединений не установлено. Продуктом разложения некоторых органических соединений является этилен. При горении высокомолекулярных предельных углеводородов (парафина) образуются кроме этилена другие непредельные соединения пропилен и в небольших количествах бутилен и бутадиен (дивинил). Характер распределения концентраций ацетилена в пламенах позволяет предположить, что он не является первичным продуктом разложения исходных соединений неароматического строения. [c.112]
Характеристическим летучим водородным соединением углерода является метан. В обычных условиях водород с углеродом не реагирует. Синтез метана идет только при достаточно высокой температуре и в присутствии катализатора (мелкораздробленный никель). Применяются также и другие способы получения метана из сложных органических веществ. В лаборатории метан можно получить разложением карбида алюминия водой. В природе метан постоянно образуется при разложении органических веществ без доступа воздуха. Химическое строение метана определяется р -гибридизацией атома углерода. Молекула метана представляет собой правильный тетраэдр, в центре которого находится атом углерода, а по вершинам — атомы водорода. Метан — газ легче воздуха, почти нерастворим в воде, устойчив вплоть до 1000° С. Выше этой температуры разлагается с образованием ацетилена и водорода [c.362]
Химическое строение метана определяется р -гибридизацией атома углерода. Молекула метана представляет собой правильный тетраэдр, в центре которого находится атом углерода, а по вершинам — атомы водорода. Метан — газ легче воздуха, почти нерастворим в воде, устойчив вплоть до 1000° С. Выше этой температуры разлагается с образованием ацетилена и водорода [c.362]
Метан всегда образуется в природе при гниении и разложении органических соединений с ограниченным доступом воздуха, например в канализационных осадках очистных городских установок (здесь он улавливается и используется для промышленных [c.224]
Метан СН4 представляет собой бесцветный, не имеющий запаха газ с т. кип. —161,4° С, т. замерз. —184° С. Он является главнейшей составной частью природных газов. Выделяется со дна болот как один из продуктов бескислородного (анаэробного) гнилостного разложения органических остатков растительного и животного происхождения, содержится в воздухе каменноугольных шахт (рудничный газ). Метан получа.ют непосредственным соединением углерода с водородом при нагревании в присутствии катализатора [c.262]
Метан получа.ют непосредственным соединением углерода с водородом при нагревании в присутствии катализатора [c.262]
В надводной части коллекторов скапливаются вредные газы сероводород, аммиак, диоксид углерода, метан, пары бензина и др. Газы попадают в сеть через неплотности соединений труб, через колодцы, а также образуются в результате разложения органических составляющих осадков сточных вод. [c.47]
В природных условиях метан образуется высокоспециализированными анаэробными микроорганизмами-метаногенами. Субстратами для них служат уксусная кислота, метанол, метиламин, метилмеркаптан и смесь СО2 + Нз- Все эти соединения -продукты жизнедеятельности целого сообщества других анаэробных микроорганизмов-деструкторов, осуществляющих по-стадийное разложение мертвого органического вещества. В общем виде образование метана может быть представлено уравнениями [c.106]
Для очистки стоков по второму варианту (с высокой концентрацией органических веществ) применяют анаэробное разложение нх, состоящее из двух основных стадий 1) ферментативный гидролиз углеводов, белков и жиров, содержащихся в сточных водах 2) превращение образовавшихся продуктов гидролиза органических соединений в углекислый газ и метан. На второй стадии анаэробной очистки сточных вод могут образовываться минеральные соли и гумусоподобные вещества. [c.408]
На второй стадии анаэробной очистки сточных вод могут образовываться минеральные соли и гумусоподобные вещества. [c.408]
По-видимому, любое органическое соединение, содержащее ацетильную группу, будет при пиролизе давать некоторое количество кетена. Хотя этот синтез применим и для высших членов ряда, но его использование ограничено в основном первым членом ряда, который лучше всего может быть получен по этому методу как в промышленности, так и в лаборатории. Из различных лабораторных способов [5] наилучший выход (90—95%) был получен при пропускании ацетона над проволокой из хромеля А при 700—750 °С. При проведении пиролиза в камере предпочтительными являются более низкие температуры (около 500 С) для предотвращения дальнейшего разложения на окись углерода и газообразные олефины. Кетен, получаемый из ацетона, смешан с метаном, что может осложнять его абсорбцию. С другой стороны, при пиролизе уксусного ангидрида [6] или дикетена (разд. А.4) подобные газообразные продукты не образуются. [c.376]
[c.376]
Для каждой из этих зон характерны определенные процессы превращения органического вещества, сопровождающиеся образованием различных углеводородов. Самая верхняя зона — биохимическая. В этой зоне под воздействием микроорганизмов, в основном бактерий, происходит разложение органических остатков с образованием соединений, уже более устойчивых к действию бактерий. В биохимической зоне генерируются в основном метан и углекислый газ. [c.95]
Метан требует особо детального рассмотрения и вот по каким причинам во-первых, он представляет начальный член всего ряда во-BfrapiHx, он встречается в газах всякого нирогенетического разложения органических соединений наконец потому, что из всех углеводо-родо В парафинового ряда он является веществом с наибольшим содержанием водорода С — 75%, Н — 25 %, и потому обладает большей термической устойчивостью и реакционной способностью особенного xJapaiKrrepa. [c.24]
Полисапробная зона характерна для свежезагрязненной воды, где протекают начальные этапы разложения органических соединений. Полисапробные воды содержат большое количество органических веществ, в первую очередь белков и углеводов. При разложении этих веществ в большом количестве выделяются углекислота, сероводород, метан. Вода бедна кислородом, поэтому химические процессы носят восстановительный характер. Резко выраженные неблагоприятные условия среды ведут к ограничению числа видов в растительном и животном населении водоема. Основными обитателями являются бактерии, количество которых достигает сотен миллионов в I мл воды. Очень много серобактерий и инфузорий. Все обитатели полисапробной зоны по способу питания относятся к консуйентам (потребителям), или иначе гетеротрофам. Они нуждаются в готовом органическом веществе. Продуценты (производители), т. е. автотрофы, к которым относятся зеленые растения, создающие органическое вещество из минеральных соединений, здесь совершенно отсутствуют. [c.156]
Полисапробные воды содержат большое количество органических веществ, в первую очередь белков и углеводов. При разложении этих веществ в большом количестве выделяются углекислота, сероводород, метан. Вода бедна кислородом, поэтому химические процессы носят восстановительный характер. Резко выраженные неблагоприятные условия среды ведут к ограничению числа видов в растительном и животном населении водоема. Основными обитателями являются бактерии, количество которых достигает сотен миллионов в I мл воды. Очень много серобактерий и инфузорий. Все обитатели полисапробной зоны по способу питания относятся к консуйентам (потребителям), или иначе гетеротрофам. Они нуждаются в готовом органическом веществе. Продуценты (производители), т. е. автотрофы, к которым относятся зеленые растения, создающие органическое вещество из минеральных соединений, здесь совершенно отсутствуют. [c.156]
Осадок сточных вод и концентрированные производственные сточные воды с БПК выше 5 г/л подвергаются биохимическому разложению Б анаэробных условиях. Оно может происходить в сооружениях-септиках, представляющих собой отстойник, через который медленно проходит сточная жидкость. В двухъярусном отстойнике осадок отделен от проходящей сточной жидкости, его разложение осуществляется в иловой камере. На очистных сооружениях большой производительности осадок сточных вод выделяется в первичных отстойниках и вместе с избыточным активным илом подвергается сбраживанию в метантенках. Интенсивность и глубина разложения осадка прежде всего определяются его составом, который колеблется по соотношению содержания основных органических компонентов (углеводов, белков, жироподобных соединений) и неорганических веществ. Обычно в осадке городских сточных вод содержится 70—80% органических веществ. Так, примерный состав осадка ( % ) белки 24, углеводы 23, жироподобные вещества до 30. Чаще всего при кислом брожении осадка получаются уксусная, масляная, пропионовая кислоты. Образующиеся газы содержат диоксид углерода, метан, водород, сероводород. Водная фаза имеет кислую реакцию среды (рНбуферными свойствами, имеет резкий неприятный запах.
Оно может происходить в сооружениях-септиках, представляющих собой отстойник, через который медленно проходит сточная жидкость. В двухъярусном отстойнике осадок отделен от проходящей сточной жидкости, его разложение осуществляется в иловой камере. На очистных сооружениях большой производительности осадок сточных вод выделяется в первичных отстойниках и вместе с избыточным активным илом подвергается сбраживанию в метантенках. Интенсивность и глубина разложения осадка прежде всего определяются его составом, который колеблется по соотношению содержания основных органических компонентов (углеводов, белков, жироподобных соединений) и неорганических веществ. Обычно в осадке городских сточных вод содержится 70—80% органических веществ. Так, примерный состав осадка ( % ) белки 24, углеводы 23, жироподобные вещества до 30. Чаще всего при кислом брожении осадка получаются уксусная, масляная, пропионовая кислоты. Образующиеся газы содержат диоксид углерода, метан, водород, сероводород. Водная фаза имеет кислую реакцию среды (рНбуферными свойствами, имеет резкий неприятный запах. [c.274]
[c.274]
Полисанробная зона (зона сильного загрязнения) соответствует свежему загрязнению водоема бытовыми сточными водами. Она характеризуется наличием большого количества сложных белковых соединений. Свободный кислород отсутствует, поэтому протекают биохимические процессы, имеющие восстановительный характер. В результате разложения органических соединений образуются сероводород, метан, диоксид углерода, аммиак. Основное население этой зоны представлено большим количеством бактерий. Численность их может достигать миллиона и более в 1 мл воды. Наряду с бактериями в этой зоне развиваются бесцветные жгутиковые, грибы, в иле находятся малощетинковые черви — тубифициды. Общее количество видов 30—36, возможны колебания видового состава в зависимости от времени года. [c.242]
Анаэробные биохимические процессы используются для разложения осадка сточных вод и иногда в качестве предварительной ступени очистки концентрированных производственных сточных вод. Разложение органических веществ идет с образованием метана, диоксида углерода, азота, сероводорода, водорода и продуктов неполного распада органических соединений. Этот способ обработки осадка сточных вод называется сбраживанием, которое осуществляется в септиках, двухъярз сных отстойниках и метан-тенках. [c.256]
Разложение органических веществ идет с образованием метана, диоксида углерода, азота, сероводорода, водорода и продуктов неполного распада органических соединений. Этот способ обработки осадка сточных вод называется сбраживанием, которое осуществляется в септиках, двухъярз сных отстойниках и метан-тенках. [c.256]
Углеводороды в нефти своим происхождением обязаны, по-видимому, различным исто шикам и механизмам. Легкие углеводороды и газы, в которых ббычно содержится менее девяти атомов углерода, образуются в осадках в течение всего геологического времени в результате разложения органических соединений с большим числом углеродных атомов. Более тяжелые углеводороды синтезируются живыми организмами и образуются в осадках. По-видимому, образование углеводородов (УВ) продолжается до тех пор, пока из сильно измененных катагенезом пород не начнет выделяться только один метан. Вероятно, карбонатные осадки являются такими же эффективными материнскими породами, как и глинистые, хотя между ними существуют различия во времени и условиях образования, миграции и аккумуляции нефти. [c.278]
[c.278]
Самым простым но химическому составу углеводородным соединением является метан СИ4. Метан — газ, имеющий темпера- УРУ кипения —161,6°. Его часто называют болотным газом , так как он образуется при разложении органических веществ и выде- [c.174]
Первая стадия заключается в разложении крупных органических соединений и превращении их в органические кислоты с выделением газообразных побочных продуктов углекислого газа, метана и следов сероводорода. Эта стадия осуществляется разнообразными факультативными бактериями, функционирующими в лишенной кислорода среде. Если бы процесс на этом остановился, скопившиеся кислоты привели бы к понижению pH и к ингибированию последующего распада при закисании оставшихся сырых сточных вод. Для того чтобьг произошло сбраживание, на второй стадии необходима газификация для превращения органических кислот в метан и углекислый газ. Бактерии, расщепляющие кислоты с образованием метана, являются строгими анаэробами и очень чувствительны к условиям окружающей среды, т. е. к температуре, pH и анаэробиозу. [c.340]
е. к температуре, pH и анаэробиозу. [c.340]
А. П. Терентьев, Н. М. Туркельтауб, Е. А. Бондарев-ская, Л. А. Домочкина [39] разработали метод одновременного определения азота и кислорода. Анализируемую пробу органического соединения (5—10 мг) в платиновой или кварцевой лодочке разлагали в статических условиях в кварцевой трубке в атмосфере гелия, очищенного от кислорода, при разрежении 20 мм рт. ст. В присутствии никелированной сажи при 900° С конечными продуктами превращения кислорода и азота, содержащихся в анализируемом соединении, были окись углерода и азот. Авторы отмечают, что в некоторых случаях (по-видимому, в результате частичного гидрирования окиси и двуокиси углерода) в продуктах разложения в незначительных количествах появляется метан. [После разложения пробы простые продукты окисления [c.154]
Дёринг с сотр. [54] разработали реакционный метод определения муравьиной кислоты и ее производных. Метод основан на каталитическом разложении муравьиной кислоты на воду и оксид углерода и на количественном гидрировании оксида углерода в метан, который регистрируется пламенно-ионизационным детектором. Предел обнаружения 3-10 %. Относительное стандартное отклонение составляет 20% для области концентраций ниже 20-10 % и 5% для области концентраций 20- -100-10 %. Предложенный метод можно сочетать с газохроматографическим анализом компонентов смеси органических соединений. [c.238]
Предел обнаружения 3-10 %. Относительное стандартное отклонение составляет 20% для области концентраций ниже 20-10 % и 5% для области концентраций 20- -100-10 %. Предложенный метод можно сочетать с газохроматографическим анализом компонентов смеси органических соединений. [c.238]
В контактных печах попутно с основной реакцией каталитического разложения спирта протекает много побочных реакций,, в результате чего, кроме бутадиена, образуются десятки других органических соединений. В состав высококипящей части контактного газа входят непрореагировавший этиловый спирт, образовавшаяся при реакции вода, пиперилен, этиловый эфир, альдегиды, высшие спирты и углеводороды. Низкокипящая часть содержит бутадиен, псевдОбутилен, этилен и другие непредельные углеводороды, метан, водород, а также углекислый газ, окисъ углерода и воздух. Экспериментально доказано, что коррозия углеродистой стали возрастает с увеличением содержания в контактном газе воздуха, который может попадать в систему из-за недостаточной герметичности. [c.167]
[c.167]
Между углеродистыми водородами известен лишь один, заключающий в частице 1 атом углерода и 4 атома водорода следовательно, это есть соединение с наивысшим процентным содержанием водорода (СН содержит 25°/о водорода). Этот предельный углеродистый водород СН называется болотным газом или метаном. Если приток воздуха к остаткам растений и животных ограничен, или даже не существует, то их разложение сопровождается образованием болотного газа, будет ли это разложение происходить при обыкновенной тем-температуре, или при температуре сравнительно весьма высокой. Оттого растения, разлагающиеся в болотах,под водою, выделяют этот газ. Всякий анает, что если тину болотного дна потрогать чем-нибудь, то из нее выделяется большое количество пузырей газа эти пузыри, хотя медленно, однако, выделяются и сами собою. Выделяющийся газ содержит преимущественно болотный газ, и его легко собрать, если стклянку опрокинуть в воде и в горло ее вставить (под водою же) воронку тогда пузыри газа легко уловить в отверстие воронки. Если дерево, каменный уголь и множество других растительных и животных веществ разлагаются действием жара без доступа воздуха, т.-е. подвергаются сухой перегонке, то они также выделяют вместе с другими газообразными продуктами разложения (углекислотою, водородом и различными другими веществами) много метана. Обыкновенно газ, употребляющийся для освещения — светильный газ, — получается именно этим способом, и потому он всегда содержит в себе болотный газ, смешанный с водородом и другими парами и газами, хотя он и очищается от некоторых из них [236]. А так как разложение органических остатков, образующих каменные угли, еще продолжается под землею, то в каменноугольных копях нередко продолжается еще выделение массы болотного газа, содержащего азот и СО . Смешиваясь с воздухом, он дает взрывчатую смесь, составляющую одно из бедствий копей этого рода, так как подземные работы приходится вести с лампами. Но эта опасность значительно уменьшается предохранительною лампою Гумфри Деви., который заметил, что если в пламя ввести плотную металлическую сетку, то поглощается столь много тепла, что за сеткой горение не продолжается (проходящие [c.
Если дерево, каменный уголь и множество других растительных и животных веществ разлагаются действием жара без доступа воздуха, т.-е. подвергаются сухой перегонке, то они также выделяют вместе с другими газообразными продуктами разложения (углекислотою, водородом и различными другими веществами) много метана. Обыкновенно газ, употребляющийся для освещения — светильный газ, — получается именно этим способом, и потому он всегда содержит в себе болотный газ, смешанный с водородом и другими парами и газами, хотя он и очищается от некоторых из них [236]. А так как разложение органических остатков, образующих каменные угли, еще продолжается под землею, то в каменноугольных копях нередко продолжается еще выделение массы болотного газа, содержащего азот и СО . Смешиваясь с воздухом, он дает взрывчатую смесь, составляющую одно из бедствий копей этого рода, так как подземные работы приходится вести с лампами. Но эта опасность значительно уменьшается предохранительною лампою Гумфри Деви., который заметил, что если в пламя ввести плотную металлическую сетку, то поглощается столь много тепла, что за сеткой горение не продолжается (проходящие [c. 259]
259]
Попытки прямого фторирования органических соединений, предпринятые сразу после получения элементарного фтора, были многочисленны и неудачны. Первые из них были сделаны Муассаном и Шаваном, которые, пытаясь снизить энергию действия фтора, фторировали твердый метан жидким фтором при низкой температуре и в темноте. Несмотря на это и на высокое мастерство экспериментаторов, единственным итогом опыта был разрушительный взрыв. Муассан установил, что фтор реагирует со многими органическими соединениями настолько бурно, что в результате деструкции молекул образуются четырехфтористый углерод, фтористый водород, уголь и другие продукты разложения. Другие исследователи стремились получить фторуглероды путем взаимодействия углерода или углеродсодержащих соединений с элементарным фтором. Однако, как и Муассану, им удавалось получить только четырехфтористый метан, причем опыты часто заканчивались взрывами. Лебо и Дамену удалось более подробно изучить эту реакцию и определить свойства образующегося четырехфтористого углерода. [c.60]
[c.60]
Многие органические соединения разлагаются при относительно низкой температуре. Химическая природа и количество продуктов пиролкза зависят не только от строения исходного соединения, но также от конечной температуры разложения и от скорости нагревания. Характеристические фрагменты, главным образом, выделяются в интервале температур 300—700 °С. При более высокой температуре увеличивается степень образования простых веществ, таких как метан, монооксид и диоксид углерода, которые не могут достаточно полно характеризовать исходное соединение (рис. 3.1). [c.45]
При сожжении азотсодержащих органических соединений происходят два процесса термическое разложение вещества и окисление как самого вещества, так и продуктов его распада. В том случае, когда сожжение прошло количественно, в газах горения в конечном итоге не должно присутствовать соединений, не окислившихся полностью. Поэтому, хотя при термическом разложении азотсодержащих веществ и могут, в зависимости от их свойств, образоваться такие продукты пиролиза, как аммиак, дициан, цианистый водород, закись, окись и двуокись азота, свободный азот, закись углерода и метан или другие летучие углеводороды, в действительности в газах горения присутствуют лишь азот, окись или двуокись азота. Значительно реже и лишь при сожжении некоторых азотсодержащих веществ появляется реальная возможность недоокисления углеводородов или нитрильной группы. Многие исследователи указывают также на возможность недогорания угля, содержащего азот В последнем случае получатся, конечно, пониженные результаты, так же как и при образовании N-гpyппы, которая [c.73]
Значительно реже и лишь при сожжении некоторых азотсодержащих веществ появляется реальная возможность недоокисления углеводородов или нитрильной группы. Многие исследователи указывают также на возможность недогорания угля, содержащего азот В последнем случае получатся, конечно, пониженные результаты, так же как и при образовании N-гpyппы, которая [c.73]
Синтезы соединений, меченных изотонами. Органические соединения, меченные изотопами, синтезируются при помощи известных методов, причем выбирают, разумеется, те реакции, в которых потери ценного изотопа наименьшие. Так, тяжелая серная кислота ОаЗО получается из 50з + ОаО, тяжелый хлористый водород из Ог Ч- Оз и т.д. При разложении карбида алюминия окисью дейтерия получается тетра-дейтерометан, или метан- СВ , при разложении карбида кальция окисью дейтерия образуется aцemuлeн-D2 СаОз. В результате присоединения дейтерия к различным соединениям с двойной связью получаются дейтеропроизводные [c.404]
Сведения о фотохимическом разложении гербицидов других классов весьма скудны, но какова цена классификации, если она не содержит пункта прочие Токсикологически интересный пример прочих соединений, несомненно, представляют органические соединения ртути, из которых в качестве гербицида применяется только фенилмеркурацетат. Соединения ртути легко распадаются на свету, и это их свойство используется уже давно. Соединения ртути применяют в качестве инициаторов, они претерпевают разрыв связи С—Н5. Например, диметилртуть дает ртуть, метан и этан с квантовым выходом, равным единице [95]. Облучение окси-этилмеркурхлорида приводит к образованию каломели и бутан-диола-1,4 [96]. [c.350]
Соединения ртути легко распадаются на свету, и это их свойство используется уже давно. Соединения ртути применяют в качестве инициаторов, они претерпевают разрыв связи С—Н5. Например, диметилртуть дает ртуть, метан и этан с квантовым выходом, равным единице [95]. Облучение окси-этилмеркурхлорида приводит к образованию каломели и бутан-диола-1,4 [96]. [c.350]
В результате жизнедеятельности биоценоза метантенка происходит снижение концентрации органических загрязнений в отходах или сточных водах с одновременным образованием биогаза. В состав биогаза входят метан и диоксид углерода, общее количество и процентное соотношение компонентов биогаза во многом определяется исходным составом сбраживаемой среды. Так, при распаде 1 г жироподобных веществ в среднем образуется 1200 мл газа состава (в %) СН4 — 68, СО2 — 32. При распаде углеводоподобных соединений образуется около 800 мл газа из одного грамма, состав газа при этом (в %) СН4 — 50, СО2 — 50. Различным является и предел сбраживания различных органических соединений, например жироподобные вещества сбраживаются на 70, а углеводоподобные на 62,5 %. Предел сбраживания был найден экспериментально, по-видимо-му, если дальнейшее разложение органического вещества и имеет место, то оно не приводит к образованию газа. [c.136]
Предел сбраживания был найден экспериментально, по-видимо-му, если дальнейшее разложение органического вещества и имеет место, то оно не приводит к образованию газа. [c.136]
Глеевые воды. Термин глей пришел в науки о Земле из украинского языка. Так издавна называли сизый грунт со дна болот и озер. Этому народному термину академик Г. Н. Высоцкий (1865—1940) в 1905 г. придал значение научного понятия. Он выделил в иочвах особые глеевые горизонты сизого и зеленоватого цвета, для которых характерны соединения двухвалентного железа, восстановительная среда. С тех пор в почвоведении, а позднее и в грунтоведении укрепилось понятие об оглеенпи почв и грунтов — восстановительных процессах, для которых характерно двухвалентное железо. Оглеение возникает там, где разложение растительных остатков идет без доступа свободного кислорода, т. е. в анаэробной среде, При этом микроорганизмы отнимают кислород у минеральных соединений и с его помощью окисляют органические остатки, частично до СОз и Н2О, а частично до промежуточных продуктов — различных кислот и других органических соединений. Синтезируются и специфические органические вещества ночв — фульвокислоты и. гуминовые кислоты. Продуктами реакций служат также метан, водород и другпе газообразные восстановители, [c.90]
Синтезируются и специфические органические вещества ночв — фульвокислоты и. гуминовые кислоты. Продуктами реакций служат также метан, водород и другпе газообразные восстановители, [c.90]
Таково влияние на характер нефтей динамометаморфизма . Теоретически говоря, более древние нефти подверглись и большему его влиянию. В общем, это подтверждается примером нефтей Соединенных Штатов, где палеозойские нефти, вообще говоря, легче мезозойских, мезозойские же — легче третичных. Но из этого правила много исключений, объясняемых особенностями исходного материала и геологической обстановкой того или иного месторождения. Из заводской практики нам хорошо известно, что если нефть будет перегрета, то начинается распадение ее тяжелых молекул на более легкие (на этом основан крекинг нефти). Если применить очень высокую температуру, то мы можем всю нефть превратить в газ, в составе которого главную роль будет играть метан. Вероятно, п в природе, если нефтяные залежи попадали в условия чрезвычайно высокого давления или очень больших температур, начиналось разложение нефти, которое заканчивалось разрушением углеводородов с выделением водорода и углерода. Это — крайняя степень метаморфизма органического вещества. Так, вероятно, образовался графпт — один пз крайних членов ряда битумов, а водород вследствие его малого атомного веса и крайней подвижности, вероятно, улетучился из литосферы в-атмосферу. [c.348]
Это — крайняя степень метаморфизма органического вещества. Так, вероятно, образовался графпт — один пз крайних членов ряда битумов, а водород вследствие его малого атомного веса и крайней подвижности, вероятно, улетучился из литосферы в-атмосферу. [c.348]
Углеводороды (содержащие только углерод и водород) составляют большой класс природных и синтетических соединений. Простейший углеводород метан (СН4) представляет собой конечный продукт анаэробного разложения живых организмов и главную составную часть природного газа. На другом конце шкалы молекулярных масс расположен политен, который получается полимеризацией тысячи или большего числа молекул этена (этилена С2Н4). Углеводороды используются как топливо и в качестве сырья для промышленности органической химии. [c.77]
Новости ЖКХ. За разложение мусора ответят микроорганизмы. CNIS.RU
Издавна городским мусором, которого было гораздо меньше, чем теперь, постепенно засыпали овраги и заболоченные места, например Суково болото на юго-востоке современной Москвы. С ростом городов появились организованные свалки, для которых обычно использовали естественные понижения местности и овраги. А дальше, чтобы упорядочить обращение с бытовыммусором, вблизи российских городов на отведенных территориях стали создавать специализированные объекты — полигоны ТБО (твердых бытовых отходов).
С ростом городов появились организованные свалки, для которых обычно использовали естественные понижения местности и овраги. А дальше, чтобы упорядочить обращение с бытовыммусором, вблизи российских городов на отведенных территориях стали создавать специализированные объекты — полигоны ТБО (твердых бытовых отходов).
Мусорная отсталость
В развитых зарубежных странах проводится раздельный сбор и/или сортировка ТБО с отделением биоразлагаемых отходов, которые, как правило, подвергаются переработке в удобрения. На зарубежных полигонах ТБО проводится тщательный контроль поступающих отходов и их рациональное размещение, осуществляется очистка фильтрационных вод (личатов). В применении методов утилизации и переработки ТБО Россия сильно отстает от современного мирового уровня, поскольку основным методом утилизации ТБО в нашей стране является захоронение на полигонах несортированногомусора.
Исследование процессов, происходящих на полигонах ТБО, и их влияние на окружающую среду в нашей стране было начато в 1980-х годах. Под руководством академика Г. А. Заварзина группой ученых при участии инженеров, геологов, почвоведов и микробиологов, в том числе и автора настоящей статьи, было проведено научное обследование подмосковного полигона ТБО «Кучино».
Тогда впервые было установлено, что температура в свалочном теле на глубине 25 м достигает 53-55оС. В пробах свалочного грунта были изучены процессы микробной деградации органических отходов. Был исследован состав свалочного биогаза, представленного в основном метаном и углекислым газом с многочисленными, в том числе токсичными, примесями. Позже было установлено, что свалочный биогаз выделяется с поверхности полигона не равномерно, а потоками из вертикальных разломов и каналов в свалочном теле. Результаты выполненных исследований показали, что полигоны ТБО являются экологически вредными объектами.
Потоки метана с поверхности закрытого для захоронения ТБО более пяти лет назад участка полигона «Хметьево»
Ситуация с полигонами ТБО ухудшилась в двухтысячные годы после решения увеличивать объемы полигонов ТБО путем насыпи мусорных холмов высотой 40 м и более. Этот опыт был позаимствован из Европы, где такой подход к захоронению ТБО широко используются. Однако в России эта идея оказалась не вполне пригодной в связи с особенностями климата. Зимой наружный слой холма охлаждается и промерзает, оставаясь теплым внутри, где продолжается микробное разложениемусора, а весной наблюдаются осыпи стенок холма и выход потоков токсичных фильтрационных вод (личатов) и дурно пахнущих газов из полуразложившихся отходов.
Этот опыт был позаимствован из Европы, где такой подход к захоронению ТБО широко используются. Однако в России эта идея оказалась не вполне пригодной в связи с особенностями климата. Зимой наружный слой холма охлаждается и промерзает, оставаясь теплым внутри, где продолжается микробное разложениемусора, а весной наблюдаются осыпи стенок холма и выход потоков токсичных фильтрационных вод (личатов) и дурно пахнущих газов из полуразложившихся отходов.
Ядовитые мусорные нахлебники
Городские ТБО на 60-70 % состоят из органических биоразлагаемых компонентов, которые в основном включают пищевые отходы, бумагу и картон. Захороненные в свалочном теле полигона ТБО органические биоразлагаемые отходы находятся в условиях отсутствия кислорода и подвергаются разложению не нуждающимися в кислороде анаэробными микроорганизмами. В этом многостадийном биологическом процессе участвуют несколько основных групп микроорганизмов: как минимум три группы бактерий — гидролитические, бродильные и ацетогенные, а также метаногенные археи, образующие метан в качестве конечного продукта метаболизма.
Гидролитические бактерии разлагают сложные полимерные соединения до простых веществ, в основном сахаров, аминокислот и жирных кислот, из которых затем бродильные бактерии образуют кислоты и спирты, а ацетогенные бактерии расщепляют летучие жирные кислоты до ацетата (уксусной кислоты). На всех стадиях процесса образуются водород и углекислота, которые наряду с ацетатом служат субстратом для метаногенных архей.
Анаэробное микробное разложение содержащихся в ТБО органических веществ на полигоне ТБО длится в течение 30-50 лет с образованием выделяющегося в атмосферу свалочного биогаза, содержащего основные компоненты: метан и углекислый газ, а также большое количество газообразных и летучих примесей, многие из которых являются токсичными — в частности, аммиак, сероводород, а также фенол и другие ароматические соединения. В случае возгорания или пожара на полигоне токсичность выделяющегося газа резко возрастает.
Помимо биогаза в результате жизнедеятельности микробного сообщества образуются растворимые и нерастворимые органические и минеральные вещества. Вследствие дождей, таяния снега, процессов биодеградации и химических реакций накапливаются фильтрационные воды (личаты), которые содержат многочисленные компоненты органических и минеральных веществ, включая тяжелые металлы, такие как медь, кадмий, цинк, свинец, кобальт, ртуть и др., загрязняющие почвы.
Вследствие дождей, таяния снега, процессов биодеградации и химических реакций накапливаются фильтрационные воды (личаты), которые содержат многочисленные компоненты органических и минеральных веществ, включая тяжелые металлы, такие как медь, кадмий, цинк, свинец, кобальт, ртуть и др., загрязняющие почвы.
Сезонные изменения потоков метана на одном из участков полигона «Хметьево»
Следует отметить, что в верхнем слое полигона ТБО, куда проникает кислород воздуха, развиваются аэробные газоокисляющие бактерии. Наиболее важной группой являются бактерии, которые в качестве субстрата роста потребляют метан, образующийся в свалочном теле полигона ТБО, окисляя его кислородом воздуха. Метанокисляющие бактерии активны только в теплое время года, и пик их активности приходится на июль. Таким образом, летом эмиссия свалочных газов резко уменьшается, и выход метана может полностью прекратиться, особенно на закрытых полигонах. Наблюдалась очень хорошая корреляция между данными, полученными разными методами. Метанокисляющие бактерии, образуя микробную биомассу, также играют важную роль в образовании почвенного слоя на поверхности закрытых участков полигонов ТБО.
Метанокисляющие бактерии, образуя микробную биомассу, также играют важную роль в образовании почвенного слоя на поверхности закрытых участков полигонов ТБО.
Нажиться на мусоре
Прежде всего следует отметить, что мусоросжигательные заводы проблему ТБО не решат. К сожалению, на наших заводахмусорсжигают практически без сортировки, и в процессе горения при высокой температуре образуются диоксины и сотни других крайне опасных летучих соединений. В развитых странах осуществляется раздельный сбормусора, и на мусоросжигательные заводы поступают фракции ТБО, не образующие или образующие мало вредных соединений. Кроме того, эти заводы оснащены системой дорогостоящих очистительных фильтров, что требует больших эксплуатационных затрат, а также особых способов утилизации использованных фильтров.
Ниже перечислены предлагаемые методы обращения с ТБО в долгосрочной перспективе.
1. Раздельный сбор и сортировка ТБО с удалением металлов, стекла, пластмасс, пластиковых упаковочных материалов.
2. Отделение и последующая переработка пищевых отходов в анаэробных реакторах (метантенках) в биогаз для использования в качестве топлива для местных нужд и применение сброженной массы в качестве удобрения.
3. Совместное компостирование пищевых и бумажных отходов с получением удобрения для озеленения городов, дорог, лесопосадок.
4. Возобновление сбора и переработки макулатуры в бумагу и картон.
5. Прием или покупка у населения стеклотары и пластиковых емкостей для вторичного использования переработки и утилизации.
6. Строгий контроль за составом и размещением на полигоне поступающих на захоронение ТБО.
7. Очистка фильтрационных вод (личатов) для предотвращения загрязнения окружающих полигон ТБО почв, грунтов и водоемов.
Эти простые и давно используемые в развитых странах меры помогут уменьшить объеммусора, вывозимого на полигоны ТБО, по меньшей мере в два раза, кардинально снизить эмиссию вредных газов с поверхности полигонов ТБО и токсичность фильтрационных вод (личатов), а также получить из отходов полезные продукты по принципу «отходы — в доходы».
Корреляция между численностью культивируемых окисляющих метан бактерий (а) и метанокисляющей активностью покрывающей почвы (б) на том же участке полигона «Хметьево»
Сколько в России мусора
Общая величина накопленных и учтенных отходов производства и потребления в целом по стране составляла… на конец 2016 года порядка 40,7 млрд тонн. Из 268,8 млн кубометров (52,4 млн тонн) ТКО (твердых коммунальных/бытовых отходов.— Ред.), вывезенных в 2016 году, на обработку — то есть для целей передела, вторичного и/или повторного использования — было направлено 23,9 млн кубометров (3,9 млн тонн), или почти 9% общего вывоза ТКО. Около 6,4 млн кубометров (1,0 млн тонн) ТКО, или 2,4%, было передано на обезвреживание и уничтожение, в том числе на мусоросжигательные предприятия. …Подавляющая часть вывезенных отходов — 238,5 млн кубометров (47,6 млн тонн), или 88,7% от общего вывоза ТКО,— в отчетном 2016 году поступила на полигоны, свалки и в аналогичные места размещения (захоронения) данных отходов.
Приложения: Последние новости России и мира – Коммерсантъ Наука (117993)
Издавна городским мусором, которого было гораздо меньше, чем теперь, постепенно засыпали овраги и заболоченные места, например Суково болото на юго-востоке современной Москвы. С ростом городов появились организованные свалки, для которых обычно использовали естественные понижения местности и овраги. А дальше, чтобы упорядочить обращение с бытовым мусором, вблизи российских городов на отведенных территориях стали создавать специализированные объекты — полигоны ТБО (твердых бытовых отходов).
Алла Ножевникова, доктор биологических наук, зав. лабораторией «Микробиология антропогенных мест обитания», лауреат премии правительства России в области науки и техники.
Федеральный исследовательский центр «Фундаментальные основы биотехнологии» РАН
Мусорная отсталость
В развитых зарубежных странах проводится раздельный сбор и/или сортировка ТБО с отделением биоразлагаемых отходов, которые, как правило, подвергаются переработке в удобрения. На зарубежных полигонах ТБО проводится тщательный контроль поступающих отходов и их рациональное размещение, осуществляется очистка фильтрационных вод (личатов). В применении методов утилизации и переработки ТБО Россия сильно отстает от современного мирового уровня, поскольку основным методом утилизации ТБО в нашей стране является захоронение на полигонах несортированного мусора.
На зарубежных полигонах ТБО проводится тщательный контроль поступающих отходов и их рациональное размещение, осуществляется очистка фильтрационных вод (личатов). В применении методов утилизации и переработки ТБО Россия сильно отстает от современного мирового уровня, поскольку основным методом утилизации ТБО в нашей стране является захоронение на полигонах несортированного мусора.
Исследование процессов, происходящих на полигонах ТБО, и их влияние на окружающую среду в нашей стране было начато в 1980-х годах. Под руководством академика Г. А. Заварзина группой ученых при участии инженеров, геологов, почвоведов и микробиологов, в том числе и автора настоящей статьи, было проведено научное обследование подмосковного полигона ТБО «Кучино».
Тогда впервые было установлено, что температура в свалочном теле на глубине 25 м достигает 53-55оС. В пробах свалочного грунта были изучены процессы микробной деградации органических отходов. Был исследован состав свалочного биогаза, представленного в основном метаном и углекислым газом с многочисленными, в том числе токсичными, примесями. Позже было установлено, что свалочный биогаз выделяется с поверхности полигона не равномерно, а потоками из вертикальных разломов и каналов в свалочном теле. Результаты выполненных исследований показали, что полигоны ТБО являются экологически вредными объектами.
Позже было установлено, что свалочный биогаз выделяется с поверхности полигона не равномерно, а потоками из вертикальных разломов и каналов в свалочном теле. Результаты выполненных исследований показали, что полигоны ТБО являются экологически вредными объектами.
Ситуация с полигонами ТБО ухудшилась в двухтысячные годы после решения увеличивать объемы полигонов ТБО путем насыпи мусорных холмов высотой 40 м и более. Этот опыт был позаимствован из Европы, где такой подход к захоронению ТБО широко используются. Однако в России эта идея оказалась не вполне пригодной в связи с особенностями климата. Зимой наружный слой холма охлаждается и промерзает, оставаясь теплым внутри, где продолжается микробное разложение мусора, а весной наблюдаются осыпи стенок холма и выход потоков токсичных фильтрационных вод (личатов) и дурно пахнущих газов из полуразложившихся отходов.
Ядовитые мусорные нахлебники
Городские ТБО на 60-70 % состоят из органических биоразлагаемых компонентов, которые в основном включают пищевые отходы, бумагу и картон. Захороненные в свалочном теле полигона ТБО органические биоразлагаемые отходы находятся в условиях отсутствия кислорода и подвергаются разложению не нуждающимися в кислороде анаэробными микроорганизмами. В этом многостадийном биологическом процессе участвуют несколько основных групп микроорганизмов: как минимум три группы бактерий — гидролитические, бродильные и ацетогенные, а также метаногенные археи, образующие метан в качестве конечного продукта метаболизма.
Захороненные в свалочном теле полигона ТБО органические биоразлагаемые отходы находятся в условиях отсутствия кислорода и подвергаются разложению не нуждающимися в кислороде анаэробными микроорганизмами. В этом многостадийном биологическом процессе участвуют несколько основных групп микроорганизмов: как минимум три группы бактерий — гидролитические, бродильные и ацетогенные, а также метаногенные археи, образующие метан в качестве конечного продукта метаболизма.
Гидролитические бактерии разлагают сложные полимерные соединения до простых веществ, в основном сахаров, аминокислот и жирных кислот, из которых затем бродильные бактерии образуют кислоты и спирты, а ацетогенные бактерии расщепляют летучие жирные кислоты до ацетата (уксусной кислоты). На всех стадиях процесса образуются водород и углекислота, которые наряду с ацетатом служат субстратом для метаногенных архей.
Анаэробное микробное разложение содержащихся в ТБО органических веществ на полигоне ТБО длится в течение 30-50 лет с образованием выделяющегося в атмосферу свалочного биогаза, содержащего основные компоненты: метан и углекислый газ, а также большое количество газообразных и летучих примесей, многие из которых являются токсичными — в частности, аммиак, сероводород, а также фенол и другие ароматические соединения. В случае возгорания или пожара на полигоне токсичность выделяющегося газа резко возрастает.
В случае возгорания или пожара на полигоне токсичность выделяющегося газа резко возрастает.
Помимо биогаза в результате жизнедеятельности микробного сообщества образуются растворимые и нерастворимые органические и минеральные вещества. Вследствие дождей, таяния снега, процессов биодеградации и химических реакций накапливаются фильтрационные воды (личаты), которые содержат многочисленные компоненты органических и минеральных веществ, включая тяжелые металлы, такие как медь, кадмий, цинк, свинец, кобальт, ртуть и др., загрязняющие почвы.
Следует отметить, что в верхнем слое полигона ТБО, куда проникает кислород воздуха, развиваются аэробные газоокисляющие бактерии. Наиболее важной группой являются бактерии, которые в качестве субстрата роста потребляют метан, образующийся в свалочном теле полигона ТБО, окисляя его кислородом воздуха. Метанокисляющие бактерии активны только в теплое время года, и пик их активности приходится на июль. Таким образом, летом эмиссия свалочных газов резко уменьшается, и выход метана может полностью прекратиться, особенно на закрытых полигонах. Наблюдалась очень хорошая корреляция между данными, полученными разными методами. Метанокисляющие бактерии, образуя микробную биомассу, также играют важную роль в образовании почвенного слоя на поверхности закрытых участков полигонов ТБО.
Наблюдалась очень хорошая корреляция между данными, полученными разными методами. Метанокисляющие бактерии, образуя микробную биомассу, также играют важную роль в образовании почвенного слоя на поверхности закрытых участков полигонов ТБО.
Нажиться на мусоре
Прежде всего следует отметить, что мусоросжигательные заводы проблему ТБО не решат. К сожалению, на наших заводах мусор сжигают практически без сортировки, и в процессе горения при высокой температуре образуются диоксины и сотни других крайне опасных летучих соединений. В развитых странах осуществляется раздельный сбор мусора, и на мусоросжигательные заводы поступают фракции ТБО, не образующие или образующие мало вредных соединений. Кроме того, эти заводы оснащены системой дорогостоящих очистительных фильтров, что требует больших эксплуатационных затрат, а также особых способов утилизации использованных фильтров.
Ниже перечислены предлагаемые методы обращения с ТБО в долгосрочной перспективе.
1. Раздельный сбор и сортировка ТБО с удалением металлов, стекла, пластмасс, пластиковых упаковочных материалов.
2. Отделение и последующая переработка пищевых отходов в анаэробных реакторах (метантенках) в биогаз для использования в качестве топлива для местных нужд и применение сброженной массы в качестве удобрения.
3. Совместное компостирование пищевых и бумажных отходов с получением удобрения для озеленения городов, дорог, лесопосадок.
4. Возобновление сбора и переработки макулатуры в бумагу и картон.
5. Прием или покупка у населения стеклотары и пластиковых емкостей для вторичного использования переработки и утилизации.
6. Строгий контроль за составом и размещением на полигоне поступающих на захоронение ТБО.
7. Очистка фильтрационных вод (личатов) для предотвращения загрязнения окружающих полигон ТБО почв, грунтов и водоемов.
Эти простые и давно используемые в развитых странах меры помогут уменьшить объем мусора, вывозимого на полигоны ТБО, по меньшей мере в два раза, кардинально снизить эмиссию вредных газов с поверхности полигонов ТБО и токсичность фильтрационных вод (личатов), а также получить из отходов полезные продукты по принципу «отходы — в доходы».
Сколько в России мусора
Общая величина накопленных и учтенных отходов производства и потребления в целом по стране составляла… на конец 2016 года порядка 40,7 млрд тонн. Из 268,8 млн кубометров (52,4 млн тонн) ТКО (твердых коммунальных/бытовых отходов.— Ред.), вывезенных в 2016 году, на обработку — то есть для целей передела, вторичного и/или повторного использования — было направлено 23,9 млн кубометров (3,9 млн тонн), или почти 9% общего вывоза ТКО. Около 6,4 млн кубометров (1,0 млн тонн) ТКО, или 2,4%, было передано на обезвреживание и уничтожение, в том числе на мусоросжигательные предприятия. …Подавляющая часть вывезенных отходов — 238,5 млн кубометров (47,6 млн тонн), или 88,7% от общего вывоза ТКО,— в отчетном 2016 году поступила на полигоны, свалки и в аналогичные места размещения (захоронения) данных отходов.
Из государственного доклада «О состоянии и об охране окружающей среды Российской Федерации в 2016 году»
Страница не найдена — Саянский медицинский колледж
Я, субъект персональных данных, в соответствии с Федеральным законом от 27 июля 2006 года № 152 «О персональных данных» предоставляю ОГБПОУ «Саянский медицинский колледж» (далее — Оператор), расположенному по адресу Иркутская обл., г.Саянск, м/он Южный, 120, согласие на обработку персональных данных, указанных мной в форме веб-чата, обратной связи на сайте в сети «Интернет», владельцем которого является Оператор.
- Состав предоставляемых мной персональных данных является следующим: Имя, адрес электронной почты.
- Целями обработки моих персональных данных являются: обеспечение обмена короткими текстовыми сообщениями в режиме онлайн-диалога или обмена текстовыми сообщениями через электронную почту.
- Согласие предоставляется на совершение следующих действий (операций) с указанными в настоящем согласии персональными данными: сбор, систематизацию, накопление, хранение, уточнение (обновление, изменение), использование, передачу (предоставление, доступ), блокирование, удаление, уничтожение, осуществляемых как с использованием средств автоматизации (автоматизированная обработка), так и без использования таких средств (неавтоматизированная обработка).

- Я понимаю и соглашаюсь с тем, что предоставление Оператору какой-либо информации о себе, не являющейся контактной и не относящейся к целям настоящего согласия, а равно предоставление информации, относящейся к государственной, банковской и/или коммерческой тайне, информации о расовой и/или национальной принадлежности, политических взглядах, религиозных или философских убеждениях, состоянии здоровья, интимной жизни запрещено.
- В случае принятия мной решения о предоставлении Оператору какой-либо информации (каких-либо данных), я обязуюсь предоставлять исключительно достоверную и актуальную информацию и не вправе вводить Оператора в заблуждение в отношении своей личности, сообщать ложную или недостоверную информацию о себе.
- Я понимаю и соглашаюсь с тем, что Оператор не проверяет достоверность персональных данных, предоставляемых мной, и не имеет возможности оценивать мою дееспособность и исходит из того, что я предоставляю достоверные персональные данные и поддерживаю такие данные в актуальном состоянии.

- Согласие действует по достижении целей обработки или в случае утраты необходимости в достижении этих целей, если иное не предусмотрено федеральным законом.
- Согласие может быть отозвано мною в любое время на основании моего письменного заявления.
Физические свойства неметаллов — урок. Химия, 8–9 класс.
Из \(118\) известных на данный момент химических элементов \(22\) элемента образуют простые вещества, обладающие неметаллическими свойствами. Неметаллических простых веществ намного больше, чем самих неметаллических химических элементов. Причиной тому служит существование явления, называемого аллотропией.
Аллотропия — это способность атомов данного химического элемента образовывать несколько простых веществ, называемых аллотропными видоизменениями, или аллотропными модификациями.
Например, химический элемент кислород \(O\) образует простое вещество кислород O2, молекула которого состоит из двух атомов, и простое вещество озон O3, молекула которого состоит из трёх атомов данного элемента.
Химический элемент фосфор \(P\) образует множество аллотропных видоизменений, важнейшими из которых являются красный фосфор и белый фосфор.
Химический элемент углерод \(C\) образует встречающиеся в природе модификации — алмаз и графит.
Аллотропные видоизменения, образуемые одним и тем же химическим элементом, существенно отличаются между собой как по строению, так и по свойствам.
Аллотропия присуща не всем неметаллических химическим элементам.
Например, водород, азот, элементы \(VII\)A и \(VIII\)A групп не имеют аллотропных модификаций, т. е. каждый из упомянутых элементов образует только одно простое вещество.
Кристаллическая решетка неметаллов
Причина большого разнообразия физических свойств неметаллов кроется в различном строении кристаллических решёток этих веществ.
Часть неметаллов имеет атомную кристаллическую решетку. Кристаллы таких веществ состоят из атомов, соединённых между собой прочными ковалентными связями. Такие неметаллы находятся в твёрдом агрегатном состоянии и являются нелетучими. Примерами таких веществ служат алмаз, графит, красный фосфор и кремний.
Такие неметаллы находятся в твёрдом агрегатном состоянии и являются нелетучими. Примерами таких веществ служат алмаз, графит, красный фосфор и кремний.
Рис. \(1\). Модели кристаллических решёток алмаза (слева) и графита.
Кристаллы этих аллотропных видоизменений состоят из атомов углерода, соединённых между собой ковалентными связями. Кристаллы графита, в отличие от кристаллов алмаза, сложены из отдельных слоёв, которые располагаются друг по отношению к другу подобно тому, как листы бумаги — в книге
Другая часть неметаллов имеет молекулярную кристаллическую решетку. В этом случае в каждой молекуле атомы соединены достаточно прочно ковалентной связью, а вот отдельные молекулы друг с другом в кристаллах вещества связаны очень слабо. Поэтому вещества молекулярного строения при обычных условиях могут быть газами, жидкостями или легкоплавкими твёрдыми веществами.
Кислород O2, озон O3, азот N2, водород h3, фтор F2, хлор Cl2, бром Br2, иод I2, белый фосфор P4, кристаллическая сера S8 и инертные газы — это всё вещества, кристаллы которых состоят из отдельных молекул (а в случае инертных газов — из отдельных атомов, как бы выполняющих роль молекул).
Рис. \(2\). Модель молекулы серы (слева) и кристалл серы.
Кристалл серы состоит из отдельных молекул \(S_8\)
Физические свойства неметаллов
Свойства неметаллических простых веществ отличаются большим разнообразием. Собственно говоря, их объединяет только то, что они, как правило, не обладают теми физическими свойствами, которые типичны для металлов, т. е. не обладают характерным металлическим блеском, ковкостью, пластичностью, высокой тепло- и электропроводностью.
Агрегатное состояние
Неметаллы при обычных условиях могут быть газообразными, жидкими и твёрдыми веществами.
Газообразными неметаллами являются гелий \(He\), неон \(Ne\), аргон \(Ar\), криптон \(Kr\), ксенон \(Xe\) и радон \(Rn\). Их называют инертными (или благородными) газами. Каждая «молекула» инертного газа состоит только из одного атома.
Их называют инертными (или благородными) газами. Каждая «молекула» инертного газа состоит только из одного атома.
Такие химические элементы, как водород \(H\), кислород \(O\), азот \(N\), хлор \(Cl\), фтор \(F\) образуют газообразные вещества, состоящие из двухатомных молекул, соответственно — h3, O2, N2, Cl2, F2.
Из неметаллических простых веществ при обычных условиях жидкостью является только бром, молекулы которого двухатомны — Br2.
Остальные неметаллические химические элементы при обычных условиях находятся в твёрдом агрегатном состоянии. Например, химический элемент углерод образует такие твёрдые вещества, как алмаз и графит. Твёрдыми являются кристаллическая сера S8, фосфор красный и фосфор белый P4, кристаллический иод I2.
Цвет и блеск
Только некоторые неметаллы в отличие от металлов имеют блеск. Например, кристаллический иод, кремний и графит не похожи на остальные неметаллы — они имеют блеск, несколько напоминающий блеск металлов.
Например, кристаллический иод, кремний и графит не похожи на остальные неметаллы — они имеют блеск, несколько напоминающий блеск металлов.
В отличие от металлов, большинство которых имеют серебристо-серый цвет, окраска неметаллов очень разнообразна. Белый цвет имеет белый фосфор, красный — красный фосфор, жёлтый — сера и фтор, красно-бурый — жидкий бром, жёлто-зелёный — хлор, фиолетовый цвет имеют пары иода, синий — жидкий кислород, серый — графит и кремний. Бесцветным является алмаз, окраски не имеют также инертные газы, азот, кислород и водород.
Рис. \(3\). Алмаз
| Рис. \(4\). Иод
|
Рис. | Рис. \(6\). Хлор |
Неметаллы могут находиться в твёрдом, жидком и газообразном агрегатных состояниях.
Запах
Некоторые неметаллы имеют запах. Например, резкий удушливый запах имеют озон O3, фтор F2 (при попадании в органы дыхания практически моментально разрушает ткани), хлор Cl2, бром Br2 и иод I2.
Пластичность
Неметаллы в твёрдом агрегатном состоянии не обладают пластичностью. Они являются хрупкими.
Электро- и теплопроводность
Неметаллы, за исключением графита, плохо проводят тепло и практически не проводят электрический ток (являются диэлектриками).
Источники:
Рис. 1. Модели кристаллических решёток алмаза (слева) и графита. https://image.shutterstock.com/image-vector/illustration-chemical-carbon-has-several-600w-1717122967.jpg
Рис. 2. Модель молекулы серы (слева) и кристалл серы.
https://image.shutterstock.com/image-vector/illustration-chemical-allotropes-sulfur-including-600w-1732938125.jpg
https://www.shutterstock.com/ru/image-photo/yellow-natural-native-sulfur-crystal-isolated-729259936
Рис. 3. Алмаз https://cdn.pixabay.com/photo/2014/10/24/08/09/diamond-500872_960_720.jpg
Рис. 4. Иод https://image.shutterstock.com/image-photo/solid-iodine-sublimation-flushing-experiment-600w-1409329922.jpg
Рис. 5. Бром https://image.shutterstock.com/image-photo/macroview-on-ampoule-element-no-600w-1739647871.jpg
Рис. 6. Хлор https://image.shutterstock.com/image-photo/chlorine-gaz-glass-round-bottom-600w-713676862.jpg
Каталитическое разложение метана с образованием водорода: обзор
https://doi. org/10.1016/j.jechem.2020.10.049Get rights and content
org/10.1016/j.jechem.2020.10.049Get rights and content Highlights
- •
-
описано.
- •
-
Сравниваются различные пути каталитического разложения метана (CDM).
- •
-
Кратко изложены история и развитие катализаторов CDM.
- •
-
Обсуждаются катализаторы на основе металлов/углерода и нетрадиционные для CDM.
- •
-
Интерфейс жидкофазной реакции помогает осуществить коммерциализацию CDM.
Abstract
Растущие потребности в водороде и недавнее открытие больших запасов метана стимулировали преобразование метана в водород. Проблемы, вызванные интенсивным выбросом CO 2 при традиционной конверсии метана, привели к безэмиссионному производству водорода из метана. Таким образом, каталитическое разложение метана (CDM) с образованием водорода и усовершенствованного углерода принимается во внимание из-за короткого процесса и безвредности для окружающей среды. Хотя многие исследователи добились значительного прогресса в исследованиях CDM в лабораторных масштабах, CDM все еще находится в зачаточном состоянии в индустриализации. Здесь освещаются история его развития, фундаментальные механизмы и недавний прогресс в исследованиях катализаторов и каталитических систем. Рассматриваются проблемы каталитической деградации поверхности раздела с акцентом на дезактивацию в результате отложения кокса в процессе CDM. Введение интерфейса жидкой фазы, который может удалять углеродные продукты на месте, обеспечивает новую стратегию для этого процесса.Кроме того, включены проблемы и перспективы будущих исследований новых катализаторов CDM или каталитических систем.
Хотя многие исследователи добились значительного прогресса в исследованиях CDM в лабораторных масштабах, CDM все еще находится в зачаточном состоянии в индустриализации. Здесь освещаются история его развития, фундаментальные механизмы и недавний прогресс в исследованиях катализаторов и каталитических систем. Рассматриваются проблемы каталитической деградации поверхности раздела с акцентом на дезактивацию в результате отложения кокса в процессе CDM. Введение интерфейса жидкой фазы, который может удалять углеродные продукты на месте, обеспечивает новую стратегию для этого процесса.Кроме того, включены проблемы и перспективы будущих исследований новых катализаторов CDM или каталитических систем.
Ключевые слова
Производство водорода
Разложение метана
Катализаторы на основе металлов
Катализаторы на основе углерода
Жидкий катализатор
Рекомендуемые статьиСсылки на статьи (0)
Показать полный текст 90 , Китайская академия наук. Опубликовано ELSEVIER B.В. и Science Press. Все права защищены.
Опубликовано ELSEVIER B.В. и Science Press. Все права защищены. Рекомендуемые статьи
Ссылки на статьи
Климатические исследования Южной Флориды
Метан (CH 4 ) также состоит из одного атома углерода, окруженного четырьмя атомами водорода. Это основной компонент природного газа и второй по важности парниковый газ.Вы узнали, что молекула метана в 30 раз прочнее молекулы углекислого газа, но метан присутствует в меньших концентрациях и имеет меньшее время жизни, чем углекислый газ. Метан является основным компонентом природного газа. Метан попадает в атмосферу и в конечном итоге соединяется с кислородом (окисляется), образуя больше CO 2 . Метан превращается в CO 2 в результате этой простой химической реакции.
Источник изображения:
Microsoft Clip Art
Свалки, выращивание риса и животноводство выделяют в атмосферу Земли еще один незначительный парниковый газ, называемый метаном. Метан выделяется при разложении органических отходов и животноводстве. Метан образуется, когда бактерии разлагают органические вещества растений и животных в таких местах на водно-болотных угодьях (например, на болотах, илистых отмелях, затопленных рисовых полях), на очистных сооружениях, на свалках, в кишечнике крупного рогатого скота и термитов, а также при утечках из трубопроводов природного газа и нефти. колодцы.
Метан выделяется при разложении органических отходов и животноводстве. Метан образуется, когда бактерии разлагают органические вещества растений и животных в таких местах на водно-болотных угодьях (например, на болотах, илистых отмелях, затопленных рисовых полях), на очистных сооружениях, на свалках, в кишечнике крупного рогатого скота и термитов, а также при утечках из трубопроводов природного газа и нефти. колодцы.
CH 4 + O 2 → CO 2 + H 4
метан + кислород → углекислый газ + водород
Что такое вечная мерзлота?
Вечная мерзлота — это постоянно мерзлый грунт, который удерживает влагу, тепло и триллионы тонн метана глубоко под поверхностью.
 Вечная мерзлота может быть толщиной в несколько метров или толщиной более 1000 метров (3281 фут). Обширные районы вечной мерзлоты в Канаде, на Аляске, в Сибири и на Тибетском нагорье начинают таять. По мере таяния вечной мерзлоты выделяется углекислый газ или метан, что еще больше увеличивает концентрацию парниковых газов в атмосфере.
Вечная мерзлота может быть толщиной в несколько метров или толщиной более 1000 метров (3281 фут). Обширные районы вечной мерзлоты в Канаде, на Аляске, в Сибири и на Тибетском нагорье начинают таять. По мере таяния вечной мерзлоты выделяется углекислый газ или метан, что еще больше увеличивает концентрацию парниковых газов в атмосфере.
Посмотрите фильм НАСА «Спящий гигант» в арктической вечной мерзлоте.
Последние разработки в области разложения метана на гетерогенных катализаторах: обзор
Мандал Р. , Каур С.: Влияние загрязнения окружающей среды на микроэлементы в овощах и связанный с этим потенциальный риск для здоровья человека в промышленном городе Манди-гобиндгарх ( Индия). Хемосфера (2019). https://doi.org/10.1016/j.chemosphere.2018.12.034
, Каур С.: Влияние загрязнения окружающей среды на микроэлементы в овощах и связанный с этим потенциальный риск для здоровья человека в промышленном городе Манди-гобиндгарх ( Индия). Хемосфера (2019). https://doi.org/10.1016/j.chemosphere.2018.12.034
Артикул Google Scholar
Хан, X., Сунь, Т., Фэн, Q.: Исследование модели измерения потерь от загрязнения окружающей среды при потреблении энергии и ее применения в промышленных парках. науч. Общая окружающая среда. 668 , 1259–1266 (2019). https://doi.org/10.1016/j.scitotenv.2019.03.002
КАС Статья Google Scholar
Лян, Л., Ван, З., Ли, Дж.: Влияние урбанизации на загрязнение окружающей среды в быстро развивающихся городских агломерациях.Дж. Чистый. Произв. 237 , 117649 (2019). https://doi.org/10.1016/j.jclepro.2019.117649
Артикул Google Scholar

Вайдья, П.Д., Родригес, А.Е.: Риформинг глицерина для производства водорода: обзор. хим. англ. Технол. 32 , 1463–1469 (2009). https://doi.org/10.1002/ceat.2000
КАС Статья Google Scholar
Крюгер, П.: Альтернативные энергетические ресурсы: поиск устойчивой энергии. Уайли, Хобокен (2006)
Google Scholar
Цао, С., Ю, Дж.: Фотокаталитические материалы для производства h3 на основе углерода. Дж. Фотохим. Фотобиол. C Фотохим. Ред. 27 , 72–99 (2016)
CAS Статья Google Scholar
Ван, З., Инь, Ю., Уильямс, Т., Ван, Х., Сунь, К., Чжан, X.: Металлическая связь: стратегия объединения графена и диоксида титана для увеличения производства водорода. Междунар. Дж. Водородная энергия. (2016). https://doi.org/10.1016/j.ijhydene.2016.08.102
Артикул Google Scholar

Xie, G., Zhang, K., Guo, B., Liu, Q., Fang, L., Gong, J.R.: Материалы на основе графена для получения водорода путем расщепления воды под действием света. Доп. Матер. (2013). https://doi.org/10.1002/adma.201301207
Артикул Google Scholar
Лопес Герра, Э., Шанмугарадж, А.М., Чой, В.С., Рю, С.Х.: Термически восстановленный никелевый катализатор на носителе из оксида графена для производства водорода путем паровой конверсии пропана. заявл. Катал. A Gen. 468 , 467–474 (2013). https://doi.org/10.1016/j.apcata.2013.09.025
КАС Статья Google Scholar
Лу, Дж., Ли, X., Хе, С., Хань, К., Ван, Г., Лэй, Ю., Чен, Р., Лю, П., Чен, К. , Zhang, L., Luo, Y.: Производство водорода с помощью паровой конверсии метанола на катализаторах на основе Ni: влияние добавления лантана (La) и носителей.Междунар. Дж. Водородная энергия. (2016). https://doi. org/10.1016/j.ijhydene.2016.08.165
org/10.1016/j.ijhydene.2016.08.165
Артикул Google Scholar
Ириондо, А., Баррио, В.Л., Камбра, Дж.Ф., Ариас, П.Л., Гемес, М.Б., Санчес-Санчес, М.С., Наварро, Р.М., Фиерро, JLG: Паровой риформинг глицерина на никелевых катализаторах, нанесенных на оксид церия и промотированный церием оксид алюминия. Междунар. Дж. Водородная энергия. 35 , 11622–11633 (2010). https://doi.org/10.1016/j.ijhydene.2010.05.105
КАС Статья Google Scholar
Ириондо, А., Баррио, В.Л., Камбра, Х.Ф., Ариас, П.Л., Гуэмез, М.Б., Наварро, Р.М., Санчес-Санчес, М.С., Фиерро, JLG: Влияние Ла 2 O 3 модифицированный носитель и активные фазы Ni и Pt при паровой конверсии глицерина с получением водорода. Катал. коммун. 10 , 1275–1278 (2009). https://doi.org/10.1016/j.catcom.2009.02.004
КАС Статья Google Scholar

Seo, JG, Youn, MH, Bang, Y., Song, IK: Влияние атомного соотношения Ni/Al в мезопористых Ni e Al 2 O 3 аэрогелевых катализаторов на их каталитическую активность при производстве водорода паром риформинг сжиженного природного газа (СПГ). Междунар. Дж. Водородная энергия. 35 , 12174–12181 (2010). https://doi.org/10.1016/j.ijhydene.2010.08.094
КАС Статья Google Scholar
Цончева Т., Генова И., Димитров М., Саркади-Прибоцки Э., Венеция А.М., Ковачева Д., Скотти Н., Дал Санто В.: Наноструктурированные композиты медь-цирконий как катализаторы разложения метанола. заявл. Катал. Б Окружающая среда. 165 , 599–610 (2015). https://doi.org/10.1016/j.apcatb.2014.10.058
КАС Статья Google Scholar
Лорито, Д., Паредес-Нуньес, А., Миродатос, К., Шурман, Ю., Менье, Ф.К.: Определение скорости разложения формиата и связи с образованием продукта во время гидрирования СО над нанесенным кобальтом. Катал. Сегодня. 259 , 192–196 (2015). https://doi.org/10.1016/j.cattod.2015.06.027
Катал. Сегодня. 259 , 192–196 (2015). https://doi.org/10.1016/j.cattod.2015.06.027
КАС Статья Google Scholar
Тан, Х., Ли, К., Сиуд, С., Ча, Д., Амад, М.Х., Хедхили, М.Н., Аль-Талла, З.А.: Синтез наночастиц Ru, заключенных в модифицированный оксид магния мезопористого оксида алюминия и их повышенной каталитической активности при разложении аммиака. Катал. коммун. 26 , 248–252 (2012). https://дои.org/10.1016/j.catcom.2012.06.007
КАС Статья Google Scholar
Пинилла, Дж.Л., де Льобет, С., Молинер, Р., Селвес, И.: Производство газов с высоким содержанием водорода в результате каталитического разложения биогаза: жизнеспособность процесса, связанного с совместным производством углеродных нановолокон . Междунар. Дж. Водородная энергия. 42 , 23484–23493 (2017). https://doi.org/10.1016/j.ijhydene.2017.01.119
КАС Статья Google Scholar

Цончева Т., Галло А., Спасова И., Димитров М., Генова И., Марелли М., Христова М., Атанасова Г., Ковачева Д., Даль Санто В. .: Специализированные наночастицы меди в упорядоченном мезопористом кремнеземе КИТ-6: получение и применение в качестве катализаторов в комплексной системе удаления NO с продуктами разложения метанола. заявл. Катал. A Gen. 464–465 , 243–252 (2013). https://doi.org/10.1016/j.apcata.2013.06.006
КАС Статья Google Scholar
Абанадес, С., Кимура, Х., Оцука, Х.: Кинетическое исследование катализируемого углеродом разложения метана в термогравиметрическом солнечном реакторе. Междунар. Дж. Водородная энергия. (2015). https://doi.org/10.1016/j.ijhydene.2015.07.023
Артикул Google Scholar
Schwengber, C.A., Alves, HJ, Schaffner, R.A., Silva, F.A., Sequinel, R., Bach, V.R., Ferracin, R.J.: Обзор риформинга глицерина для производства водорода. Продлить.Поддерживать. Energy Rev. 58 , 259–266 (2016). https://doi.org/10.1016/j.rser.2015.12.279
Продлить.Поддерживать. Energy Rev. 58 , 259–266 (2016). https://doi.org/10.1016/j.rser.2015.12.279
КАС Статья Google Scholar
Гальегос-Суарес, Э., Герреро-Руис, А., Родригес-Рамос, И.: Эффективное производство водорода из глицерина путем паровой конверсии с рутениевыми катализаторами на углеродном носителе. Carbon NY 96 , 578–587 (2016). https://doi.org/10.1016/j.carbon.2015.09.112
КАС Статья Google Scholar
Lu, Q., Hou, Y., Laraib, SR, Khalifa, O., Li, K., Xie, W., Cui, M., Yang, Y.: Электрокаталитическая паровая конверсия метана на Ni- CeO 2 /Γ-Al 2 O 3 -MgO катализатор. Топливный процесс. Технол. 192 , 57–64 (2019). https://doi.org/10.1016/j.fuproc.2019.04.021
КАС Статья Google Scholar
Иглесиас, И. , Форти, М., Баронетти, Г., Мариньо, Ф.: Zr-повышенная стабильность подложек на основе церия для паровой конверсии метана в тяжелых условиях реакции.Междунар. Дж. Водородная энергия. 44 , 8121–8132 (2019). https://doi.org/10.1016/j.ijhydene.2019.02.070
, Форти, М., Баронетти, Г., Мариньо, Ф.: Zr-повышенная стабильность подложек на основе церия для паровой конверсии метана в тяжелых условиях реакции.Междунар. Дж. Водородная энергия. 44 , 8121–8132 (2019). https://doi.org/10.1016/j.ijhydene.2019.02.070
КАС Статья Google Scholar
Ибрагим, А.А., Факиха, А.Х., Аль-Фатеш, А.С., Абасаид, А.Е., Хан, В.У.: Разложение метана на железном катализаторе для производства водорода. Междунар. Дж. Водородная энергия. 40 , 7593–7600 (2015). https://doi.org/10.1016/j.ijhydene.2014.10.058
КАС Статья Google Scholar
Mondal, K.C., Chandran, S.R.: Оценка экономических последствий производства водорода путем разложения метана с помощью процесса паровой конверсии метана. Междунар. Дж. Энерджи Рез. 39 , 2–6 (2014). https://doi.org/10.1016/j.ijhydene.2014.04.087
КАС Статья Google Scholar

Zhang, J., Li, X., Chen, H., Qi, M., Zhang, G., Hu, H., Ma, X.: Производство водорода путем каталитического разложения метана: углеродные материалы в качестве катализаторов или носителей катализаторов.Междунар. Дж. Водородная энергия. 42 , 19755–19775 (2017). https://doi.org/10.1016/j.ijhydene.2017.06.197
КАС Статья Google Scholar
Данг, К., Ван, Х., Ю, Х., Пэн, Ф.: Катализаторы Co-Cu-CaO для получения водорода высокой чистоты в результате паровой конверсии глицерина с усиленной сорбцией. заявл. Катал. A Gen. 533 , 9–16 (2017). https://doi.org/10.1016/j.apcata.2017.01.006
КАС Статья Google Scholar
Аббас, Х.Ф., Дауд, В.М.А.: Производство водорода путем разложения метана: обзор. Междунар. Дж. Водородная энергия. 35 , 1160–1190 (2010). https://doi.org/10.1016/j.ijhydene.2009.11.036
КАС Статья Google Scholar

Ashik, U.P.M., Daud, W.M.A., Hayashi, J.: Обзор превращения метана в водород и наноуглерод: влияние характеристик катализатора и экспериментальных параметров на выход. Продлить.Поддерживать. Energy Rev. 76 , 743–767 (2017). https://doi.org/10.1016/j.rser.2017.03.088
КАС Статья Google Scholar
Лопес, Э., Ким, Дж., Шанмугарадж, А.М., Рю, С.Х.: Никелевые катализаторы паровой конверсии пропана на основе многостенных углеродных нанотрубок. Дж. Матер. науч. 47 , 2985–2994 (2012). https://doi.org/10.1007/s10853-011-6132-1
КАС Статья Google Scholar
Ничеле, В., Синьоретто, М., Менегаццо, Ф., Галло, А., Дал, В., Кручиани, Г., Серрато, Г.: Паровой риформинг глицерина для производства водорода: разработка катализаторов на никелевом носителе. заявл. Катал. Б Окружающая среда. 111–112 , 225–232 (2012). https://doi. org/10.1016/j.apcatb.2011.10.003
org/10.1016/j.apcatb.2011.10.003
КАС Статья Google Scholar
Луо, К., Се, Х., Ван, К., Луо, Г., Лю, К.: Обзор применения и характеристик углеродных нанотрубок в топливных элементах.Дж. Наноматер. 2015 , 560392 (2015)
Google Scholar
Lee, S.C., Seo, H.J., Han, G.Y.: Производство водорода путем каталитического разложения метана на катализаторе сажи при высоких температурах. Корейский J. Chem. англ. 30 , 1716–1721 (2013). https://doi.org/10.1007/s11814-013-0107-7
КАС Статья Google Scholar
Козлов С.М., Нейман, К.М.: Анализ разложения метана на наноструктурированном палладии. Дж. Катал. 337 , 111–121 (2016). https://doi.org/10.1016/j.jcat.2016.02.010
КАС Статья Google Scholar

Ижар С., Канесуги Х., Томинага Х., Нагаи М.: Карбиды кобальта-молибдена: свойства поверхности и реакционная способность при разложении метана. заявл. Катал. Ген. 317 , 82–90 (2007). https://doi.org/10.1016/j.apcata.2006.10.013
КАС Статья Google Scholar
Ким, Дж., Ким, Дж., Ли, Д.: Паровой риформинг глицерина на катализаторах Ru, нанесенных на металлокерамические микрокомпозиты ядро-оболочка, разработанные с помощью гидротермального метода, индуцированного микроволновым излучением. заявл. Катал. Ген. 499 , 197–204 (2015). https://doi.org/10.1016/j.apcata.2015.04.012
КАС Статья Google Scholar
Ниши Х., Миямото Д., Умеда Ю., Хамагути Х., Судзуки М., Танимото Т., Харигай Т., Такикава Х., Суда Ю.: Каталитическая активность нескольких углероды с различной структурой для разложения метана и побочный углерод. заявл. Серф. науч. (2019). https://doi.org/10.1016/j.apsusc.2018.12.073
науч. (2019). https://doi.org/10.1016/j.apsusc.2018.12.073
Артикул Google Scholar
Папагеридис К.Н., Сиакавелас Г., Харисиу Н.Д., Авраам Д.Г., Цунис Л., Куси К., Гоула, Массачусетс: Сравнительное исследование Ni Co, Cu, нанесенных на катализаторы из γ-оксида алюминия, для производства водорода с помощью реакции паровой конверсии глицерина. Топливный процесс. Технол. 152 , 156–175 (2016). https://doi.org/10.1016/j.fuproc.2016.06.024
КАС Статья Google Scholar
Кумар А., Чакраборти Дж. П., Сингх Р.: Бионефть: будущее производства водорода. Биотопливо 8 , 663–674 (2016). https://дои.орг/10.1080/17597269.2016.1141276
КАС Статья Google Scholar
Li, Y., Gao, W., Ci, L., Wang, C., Ajayan, P.M.: Каталитические характеристики наночастиц Pt на восстановленном оксиде графена для электроокисления метанола. Carbon NY 48 , 1124–1130 (2010). https://doi.org/10.1016/j.carbon.2009.11.034
Carbon NY 48 , 1124–1130 (2010). https://doi.org/10.1016/j.carbon.2009.11.034
КАС Статья Google Scholar
Гула, М.А., Чарисиу, Н.Д., Папагеридис, К.Н., Делимитис, А., Пачатуриду, Э., Илиопулу, Э.Ф. Катализаторы никеля на оксиде алюминия для производства смесей с высоким содержанием водорода посредством реакции сухого риформинга биогаза: влияние метода синтеза . Междунар. Дж. Водородная энергия. 40 , 9183–9200 (2015). https://doi.org/10.1016/j.ijhydene.2015.05.129
КАС Статья Google Scholar
Вегер, Л., Абанадес, А., Батлер, Т.: Крекинг метана как технология перехода к водородной экономике. Междунар. Дж. Водородная энергия. 42 , 720–731 (2016). https://doi.org/10.1016/j.ijhydene.2016.11.029
КАС Статья Google Scholar
Кейпи, Т., Толванен, К. Е.С., Толванен, Х., Конттинен, Дж.: Термокаталитическое разложение метана: влияние параметров реакции на разработку процесса и возможности использования полученного углерода.Преобразование энергии. Управление 126 , 923–934 (2016). https://doi.org/10.1016/j.enconman.2016.08.060
Е.С., Толванен, Х., Конттинен, Дж.: Термокаталитическое разложение метана: влияние параметров реакции на разработку процесса и возможности использования полученного углерода.Преобразование энергии. Управление 126 , 923–934 (2016). https://doi.org/10.1016/j.enconman.2016.08.060
КАС Статья Google Scholar
Растегарпанах, А., Мешкани, Ф., Резаи, М.: Термокаталитическое разложение метана на мезопористых нанокристаллических промотированных катализаторах Ni/MgO·Al2O 3 . Междунар. Дж. Водородная энергия. 42 , 16476–16488 (2017). https://doi.org/10.1016/j.ijhydene.2017.05.044
КАС Статья Google Scholar
Пудукуди, М., Яакоб, З., Такриф, М.С.: Разложение метана на мезопористых ферритах никеля без носителя: влияние температуры реакции на каталитическую активность и свойства наноуглеродов. RSC Adv. (2016). https://doi. org/10.1039/C6RA14660K
org/10.1039/C6RA14660K
Артикул Google Scholar
Гонсалес, О.А., Валенсуэла, М.А., Ван, Дж.-А.: Каталитическое разложение метана на никелевых катализаторах, легированных церием. В: Общество исследования материалов (2006)
Пинилла, Дж. Л., Суэлвес, И., Ласаро, М. Дж., Молинер, Р., Паласиос, Дж. М.: Активность катализатора NiCuAl в разложении метана изучалась с использованием термобаланса и структурных изменений в никеле и осажденном углероде. Междунар. Дж. Водородная энергия. 33 , 2515–2524 (2008). https://doi.org/10.1016/j.ijhydene.2008.02.041
КАС Статья Google Scholar
Wang, Z., Navarrete, J.: Производство углеродных нанотрубок и водорода на катализаторах Ni/MCM-41.Зеленый сустейн. хим. 2 , 91–96 (2012)
Статья Google Scholar
Авадаллах, А.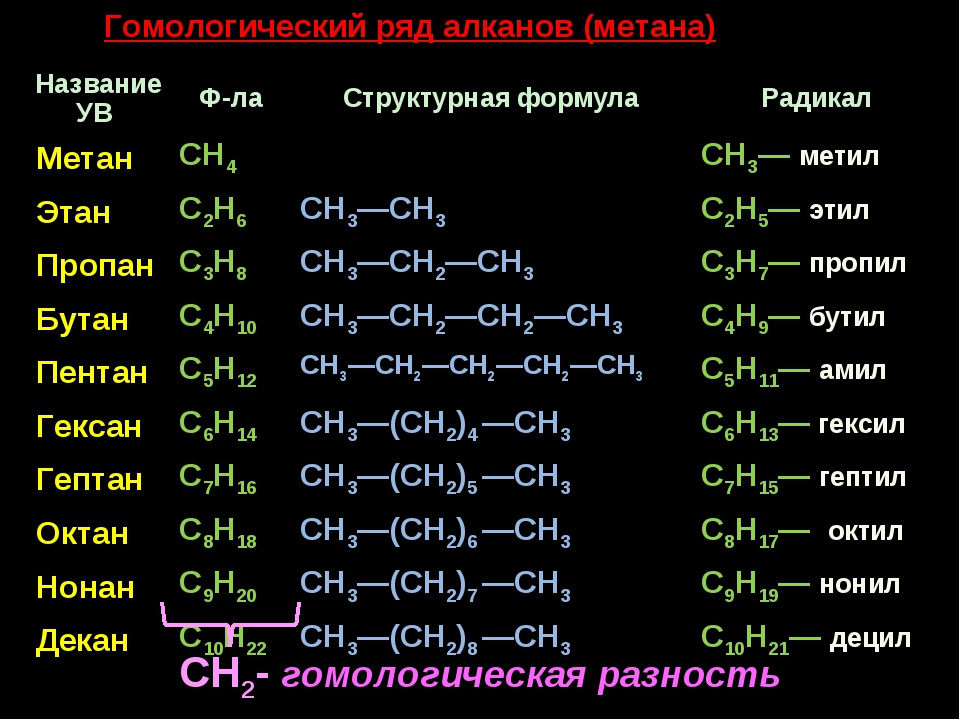 Э., Эль-Десуки, Д.С., Абул-Гейт, НАК, Ибрагим, А.Х., Абул-Гейт, А.К.: Влияние кристаллической структуры и геометрии пор материалов на основе диоксида кремния на каталитическое поведение металлических частицы никеля при разложении метана до CO x без водорода и углеродных наноматериалов. Междунар. Дж. Водородная энергия. 1 , 1–13 (2016). https://doi.org/10.1016/j.ijhydene.2016.07.081
Э., Эль-Десуки, Д.С., Абул-Гейт, НАК, Ибрагим, А.Х., Абул-Гейт, А.К.: Влияние кристаллической структуры и геометрии пор материалов на основе диоксида кремния на каталитическое поведение металлических частицы никеля при разложении метана до CO x без водорода и углеродных наноматериалов. Междунар. Дж. Водородная энергия. 1 , 1–13 (2016). https://doi.org/10.1016/j.ijhydene.2016.07.081
КАС Статья Google Scholar
Гарсия-Санчо, К., Гиль-Лопес, Р., Паскуаль, Л., Майрелес-Торрес, П., Наварро, Р.М., Фиерро, JLG: Оптимизация содержания никеля в смешанных оксидных катализаторах гидротальцит для производства H 2 разложением метана. заявл. Катал. Генерал (2017). https://doi.org/10.1016/j.apcata.2017.07.038
Артикул Google Scholar
Гац В., Денис А., Боровецкий Т., Кепински Л.: Разложение метана на катализаторах Ni–MgO–Al 2 O 3 . заявл. Катал. A Gen. 357 , 236–243 (2009). https://doi.org/10.1016/j.apcata.2009.01.029
заявл. Катал. A Gen. 357 , 236–243 (2009). https://doi.org/10.1016/j.apcata.2009.01.029
КАС Статья Google Scholar
Факиха, А.Х., Хан, В.У., Аль-Фатеш, А.С., Абасаид, А.Е., Наим, М.А.: Производство водородных и углеродных нановолокон из метана на катализаторах Ni-Co-Al.Междунар. Дж. Водородная энергия. 1 , 4–11 (2014). https://doi.org/10.1016/j.ijhydene.2014.12.011
КАС Статья Google Scholar
Bai, Z., Chen, H., Li, B., Li, W.: Разложение метана на активированном угле с никелем для производства водорода и образования волокнистого углерода. Междунар. Дж. Водородная энергия. 32 , 32–37 (2007). https://doi.org/10.1016/j.ijhydene.2006.06.030
КАС Статья Google Scholar
Ashik, U.P.M., Daud, W.M.A.W.: Стабилизация наночастиц Ni, Fe и Co с помощью модифицированного метода Штёбера для получения превосходных каталитических характеристик: подготовка, характеристика и каталитическая активность для разложения метана. Дж. Тайвань Инст. хим. англ. 1 , 1–14 (2016). https://doi.org/10.1016/j.jtice.2015.12.019
Дж. Тайвань Инст. хим. англ. 1 , 1–14 (2016). https://doi.org/10.1016/j.jtice.2015.12.019
КАС Статья Google Scholar
Ин, Ю., Мэйшен, К., Минлай, Л., На, З., Zhiqi, L., Yongxi, S.: Модифицированные редкоземельными элементами Ni-Si катализаторы для производства водорода путем разложения метана. Дж. Редкие земли. 32 , 709–714 (2014). https://doi.org/10.1016/S1002-0721(14)60130-7
КАС Статья Google Scholar
Zhang, J., Jin, L., Li, Y., Hu, H.: Углерод, легированный никелем, для производства водорода путем каталитического разложения метана. Междунар. Дж. Водородная энергия. 38 , 3937–3947 (2013).https://doi.org/10.1016/j.ijhydene.2013.01.105
КАС Статья Google Scholar
Уддин, М.Н., Дауд, В.М.А., Аббас, Х.Ф.: Кинетика и механизмы дезактивации термического разложения метана в совместном производстве водорода и углеродных нановолокон на катализаторах на основе цеолита Y, нанесенных на никеле. Преобразование энергии. Управление 87 , 796–809 (2014). https://doi.org/10.1016/j.enconman.2014.07.072
Преобразование энергии. Управление 87 , 796–809 (2014). https://doi.org/10.1016/j.enconman.2014.07.072
КАС Статья Google Scholar
Уддин, М.Н., Дауд, В.М.А., Аббас, Х.Ф.: Совместное производство водородных и углеродных нановолокон в результате разложения метана на никелевых катализаторах, нанесенных на цеолит Y. Преобразование энергии. Управление 90 , 218–229 (2015). https://doi.org/10.1016/j.enconman.2014.10.060
КАС Статья Google Scholar
Lua, A.C., Wang, H.Y.: Разложение метана на пористом катализаторе из никеля и сплава без носителя. заявл. Катал. Б Окружающая среда. 132–133 , 469–478 (2013). https://doi.org/10.1016/j.apcatb.2012.12.014
КАС Статья Google Scholar
Гиль-Лопес, Р., Ботас, Дж.А., Фиерро, Дж.Л.Г., Серрано, Д.П.: Сравнение металлических и углеродных катализаторов для производства водорода путем разложения метана. заявл. Катал. A Gen. 396 , 40–51 (2011). https://doi.org/10.1016/j.apcata.2011.01.036
заявл. Катал. A Gen. 396 , 40–51 (2011). https://doi.org/10.1016/j.apcata.2011.01.036
КАС Статья Google Scholar
Maneerung, T., Hidajat, K., Kawi, S.: Совместное производство водородных и углеродных нановолокон при каталитическом разложении метана над LaNi (1–x) M x O 3 -перовскит где М = Со, Fe и Х = 0, 0,2, 0,5, 0,8, 1). Междунар. Дж. Водородная энергия. 40 , 13399–13411 (2015). https://doi.org/10.1016/j.ijhydene.2015.08.045
КАС Статья Google Scholar
Пудукуды М., Яакоб З., Мазуки М.З., Такрифф М.С., Джахая С.С.: Однореакторный золь-гель синтез наночастиц MgO на никелевых и железных катализаторах для разложения неразбавленного метана на свободный водород и наноуглерод CO x . заявл. Катал. Б Окружающая среда. (2017). https://doi.org/10.1016/j.apcatb.2017.04.070
Артикул Google Scholar

Пудукуди, М., Яакоб, З., Кадиер, А., Такрифф, М.С., Мэт Хассан, Н.С.: Однореакторный золь-гель синтез Ni/TiO 2 катализаторов разложения метана на CO x свободный водород и многослойные углеродные нанотрубки.Междунар. Дж. Водородная энергия. 1 , 1–19 (2017). https://doi.org/10.1016/j.ijhydene.2017.04.223
КАС Статья Google Scholar
Pudukudy, M., Yaakob, Z., Takrif, MS: Разложение метана на CO x свободный водород и многостенные углеродные нанотрубки на никелевых катализаторах, нанесенных на оксид церия, циркония и лантана, приготовленных с помощью легкого твердофазного цитратного сплава метод. Преобразование энергии. Управление 126 , 302–315 (2016).https://doi.org/10.1016/j.enconman.2016.08.006
КАС Статья Google Scholar
Чесноков В.В., Чичкан А.С. Получение водорода каталитическим разложением метана на катализаторе Ni–Cu–Fe/Al 2 O 3 . Междунар. Дж. Водородная энергия. 34 , 2979–2985 (2009). https://doi.org/10.1016/j.ijhydene.2009.01.074
Междунар. Дж. Водородная энергия. 34 , 2979–2985 (2009). https://doi.org/10.1016/j.ijhydene.2009.01.074
КАС Статья Google Scholar
Абдуллахи, И., Сакулчайчароен, Н., Эррера, Дж. Э.: Исследование механизма роста многостенных углеродных нанотрубок путем разложения метана на никель-глиноземном катализаторе. Диам. Относ. Матер. 23 , 76–82 (2012). https://doi.org/10.1016/j.diamond.2012.01.017
КАС Статья Google Scholar
Фрустери Ф., Итальяно Г., Эспро К., Каннилла К., Бонура Г.: Получение h3 разложением метана: каталитические и технологические аспекты.Междунар. Дж. Водородная энергия. 37 , 16367–16374 (2012). https://doi.org/10.1016/j.ijhydene.2012.02.192
КАС Статья Google Scholar
Wen, Y., Wei, C., Chengfa, J., Jie, W., Wenjing, S.: Промотированный оксидом церия катализатор Ni/MgO для синтеза многостенных углеродных нанотрубок. Подбородок. Дж. Катал. 32 , 1323–1328 (2011). https://doi.org/10.1016/S1872-2067(10)60247-1
Подбородок. Дж. Катал. 32 , 1323–1328 (2011). https://doi.org/10.1016/S1872-2067(10)60247-1
КАС Статья Google Scholar
Chen, J., Qiao, Y., Li, Y.: Модификация состояния Ni для повышения стабильности катализатора Ni–Al 2 O 3 при разложении метана с образованием водородных и углеродных нановолокон. J. Химия твердого тела. 191 , 107–113 (2012). https://doi.org/10.1016/j.jssc.2012.03.019
КАС Статья Google Scholar
Awadallah, A.E., Ahmed, W., Noor El-Din, M.R., Aboul-Enein, A.A.: Новая алюмосиликатная полая сфера в качестве носителя катализатора для разложения метана с получением водорода без CO x .заявл. Серф. науч. 287 , 415–422 (2013). https://doi.org/10.1016/j.apsusc.2013.09.173
КАС Статья Google Scholar

Awadallah, AE, Solyman, SM, Aboul-Enein, AA, Ahmed, HA, Aboul-Gheit, NAK, Hassan, SA: Эффект объединения оксидов Al, Mg, Ce или La с экстрагированным нанокремнеземом из рисовой шелухи о каталитических характеристиках NiO во время производства водорода без CO x путем разложения метана.Междунар. Дж. Водородная энергия. (2017). https://doi.org/10.1016/j.ijhydene.2017.03.049
Артикул Google Scholar
Авадаллах, А.Е., Мостафа, М.С., Абул-Энейн, А.А., Ханафи, С.А.: Производство водорода путем разложения метана на Al 2 O 3 –TiO 2 двойные оксиды на никелевых катализаторах: влияние содержания Ti на каталитическую эффективность. Топливо 129 , 68–77 (2014). https://doi.org/10.1016/j.fuel.2014.03.047
КАС Статья Google Scholar
Pinilla, JL, Suelves, I., Lázaro, MJ, Moliner, R., Palacios, JM: Параметрическое исследование разложения метана с использованием катализатора NiCu/Al 2 O 3 в реактор с псевдоожиженным слоем. Междунар. Дж. Водородная энергия. 35 , 9801–9809 (2010). https://doi.org/10.1016/j.ijhydene.2009.10.008
Междунар. Дж. Водородная энергия. 35 , 9801–9809 (2010). https://doi.org/10.1016/j.ijhydene.2009.10.008
КАС Статья Google Scholar
Shen, Y., Lua, A.C.: Золь-гель синтез никелевых катализаторов на оксиде титана для производства водорода и углерода путем разложения метана. J. Источники энергии. 280 , 467–475 (2015). https://doi.org/10.1016/j.jpowsour.2015.01.057
КАС Статья Google Scholar
Тапиа-Парада, К., Вальверде-Агилар, Г., Мантилья, А., Валенсуэла, М.А., Эрнандес, Э.: Синтез и определение характеристик Ni/Ce–SiO 2 и Co/Ce –TiO катализаторы разложения метана.Топливо 110 , 70–75 (2013). https://doi.org/10.1016/j.fuel.2012.11.022
КАС Статья Google Scholar
Nuernberg, G.D.B., Foletto, E.L., Campos, C.E.M., Fajardo, H. V., Carreno, N.L.V., Probst, L.F.D.: Прямое разложение метана на никелевом катализаторе, нанесенном на алюминат магния. J. Источники энергии. 208 , 409–414 (2012). https://doi.org/10.1016/j.jpowsour.2012.02.037
V., Carreno, N.L.V., Probst, L.F.D.: Прямое разложение метана на никелевом катализаторе, нанесенном на алюминат магния. J. Источники энергии. 208 , 409–414 (2012). https://doi.org/10.1016/j.jpowsour.2012.02.037
КАС Статья Google Scholar
Тангарнянавалукул, К., Донфаи, В., Витун, Т., Чареонпанич, М., Лимтракул, Дж.: Дезактивация никелевых катализаторов в реакции крекинга метана: влияние бимодальной мезо-макропористой структуры кремнеземного носителя. хим. англ. J. 262 , 364–371 (2015). https://doi.org/10.1016/j.cej.2014.09.112
КАС Статья Google Scholar
Гевара, Дж. К., Ван, Дж. А., Чен, Л. Ф., Валенсуэла, М. А., Салас, П., Гарсия-Руис, А., Толедо, Дж.А., Кортес-Хакоме, М.А., Анхелес-Чавес, К., Новаро, О.: Мезоструктурированные катализаторы Ni/Ce-MCM-41 для одновременного производства водорода и наноуглерода посредством разложения метана. Междунар. Дж. Водородная энергия. 35 , 3509–3521 (2010). https://doi.org/10.1016/j.ijhydene.2010.01.068
Междунар. Дж. Водородная энергия. 35 , 3509–3521 (2010). https://doi.org/10.1016/j.ijhydene.2010.01.068
КАС Статья Google Scholar
Урдиана Г., Вальдес Р., Ластра Г., Валенсуэла М., Оливас А.: Производство водородных и углеродных наноматериалов с использованием катализаторов на основе переходных металлов путем разложения метана.Матер. лат. 217 , 9–12 (2018). https://doi.org/10.1016/j.matlet.2018.01.033
КАС Статья Google Scholar
Salmones, J., Wang, J.A., Valenzuela, M.A., Sanchez, E., Garcia, A.: Влияние геометрии пор на поведение дезактивации катализаторов на основе Ni для одновременного производства водорода и наноуглерода. Катал. Сегодня. 148 , 134–139 (2009). https://doi.org/10.1016/j.cattod.2009.03.005
КАС Статья Google Scholar

Ли, Дж., Чжао, Л., Хе, Дж., Дун, Л., Сюн, Л., Ду, Ю., Ян, Ю., Ван, Х., Пэн, С. : Разложение метана на высоконагруженных катализаторах Ni–Cu–SiO 2 . Фьюжн инж. Дес. (2016). https://doi.org/10.1016/j.fusengdes.2016.06.046
Артикул Google Scholar
Ван В., Ван Х., Ян Ю., Цзян С.: Ni–SiO 2 и Ni–Fe–SiO 2 катализаторы разложения метана для получения водородных и углеродных нитей. Междунар. Дж. Водородная энергия. 37 , 2–10 (2012). https://doi.org/10.1016/j.ijhydene.2012.03.003
КАС Статья Google Scholar
Баят, Н., Резаи, М., Мешкани, Ф.: Синтез водородных и углеродных нановолокон путем разложения метана на катализаторе Ni-Pd/Al 2 O 3 .Междунар. Дж. Водородная энергия. (2016). https://doi.org/10.1016/j.ijhydene.2016.01.134
Артикул Google Scholar

Ли, Дж., Гонг, Ю., Чен, К., Хоу, Дж., Юэ, Л., Фу, С., Чжао, Л., Чен, Х., Ван, Х. , Пэн, С.: Эволюция катализатора Ni–Cu–SiO 2 для разложения метана с получением водорода. Фьюжн инж. Дес. (2017). https://doi.org/10.1016/j.fusengdes.2017.05.040
Артикул Google Scholar
Pudukudy, M., Yaakob, Z., Takriff, M.S.: Разложение метана на катализаторе Ni/MgAl 2 O 4 , промотированном Pd, для производства CO x свободного водорода и многослойных углеродных нанотрубок. заявл. Серф. науч. (2015). https://doi.org/10.1016/j.apsusc.2015.08.246
Артикул Google Scholar
Пудукуди, М., Кадиер, А., Яакоб, З., Такриф, М.С.: Неокислительное термокаталитическое разложение метана на CO x свободный водород и наноуглерод над пористыми NiO и Fe без носителя 2 O 3 катализаторы.Междунар.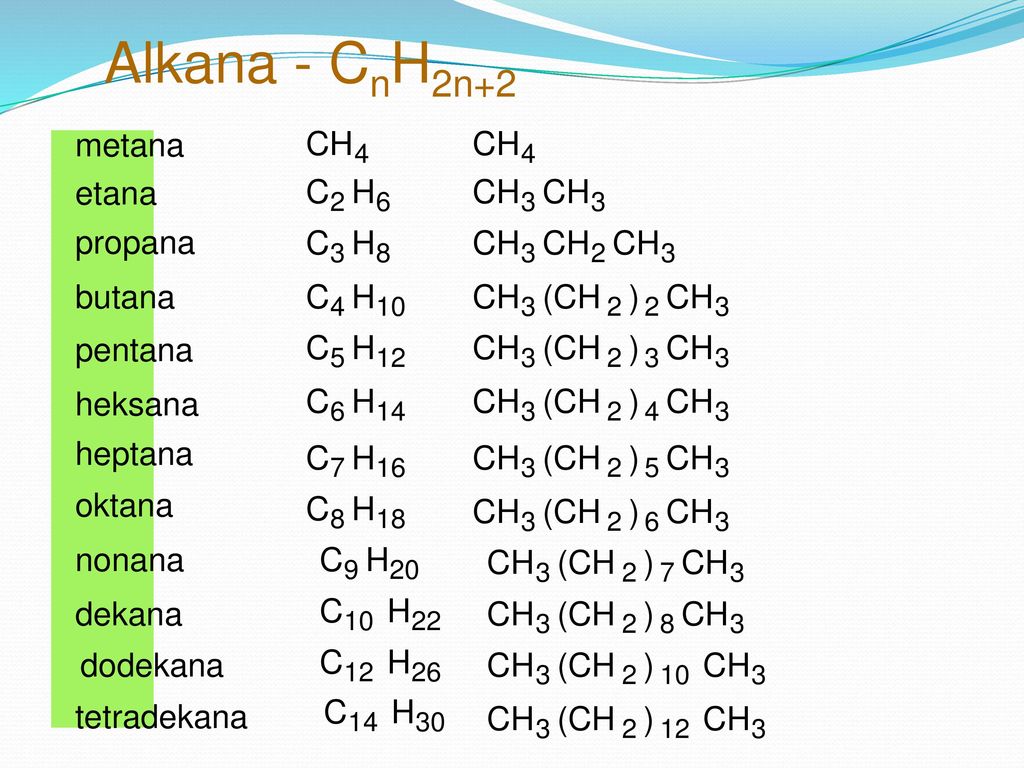 Дж. Водородная энергия. 1 , 1–13 (2016). https://doi.org/10.1016/j.ijhydene.2016.08.160
Дж. Водородная энергия. 1 , 1–13 (2016). https://doi.org/10.1016/j.ijhydene.2016.08.160
КАС Статья Google Scholar
Zhang, W., Ge, Q., Xu, H.: Влияние условий реакции на разложение метана на никелевом катализаторе без носителя. Дж. Нат. газ хим. 20 , 339–344 (2011). https://doi.org/10.1016/S1003-9953(10)60205-8
КАС Статья Google Scholar
Шрилата, К., Бхагаван, Д., Кумар, С.С., Химабинду, В.: Устойчивое производство топлива путем термокаталитического разложения метана — обзор. С. Афр. Дж. Хим. англ. (2017). https://doi.org/10.1016/j.sajce.2017.10.002
Артикул Google Scholar
Серрано, Д.П., Ботас, Х.А., Фиерро, Х.Л.Г., Гиль-Лопес, Р., Писарро, П., Гомес, Г.: Производство водорода путем разложения метана: происхождение каталитической активности углеродных материалов. Топливо 89 , 1241–1248 (2010 г.). https://doi.org/10.1016/j.fuel.2009.11.030
Топливо 89 , 1241–1248 (2010 г.). https://doi.org/10.1016/j.fuel.2009.11.030
КАС Статья Google Scholar
Казанья Ф., Латорре Н., Тарифа П., Лабарта Дж., Ромео Э., Монсон А.: Синтез графеновых наноматериалов путем разложения метана на Ni-Cu/ биоморфный углеродный катализатор. Кинетические и характеристические результаты. Катал. Сегодня. (2017). https://doi.org/10.1016/j.cattod.2017.03.056
Артикул Google Scholar
Сикандер, У., Самсудин, М.Ф., Суфиан, С., КуШари, К., Кейт, К.Ф., Накви, С.Р., Чен, В.-Х.: Индивидуальный катализатор Mg-Ni-Al на основе гидротальцита для производства водорода с помощью разложение метана: влияние концентрации никеля и шпинелеподобные структуры. Междунар. Дж. Водородная энергия. 44 , 14424–14433 (2019). https://doi.org/10.1016/j.ijhydene.2018.10.224
КАС Статья Google Scholar

Пинилья, Дж.Л., Торрес, Д., Лазаро, М.Дж., Суэльвес, И., Молинер, Р., Каннадас, И., Родригес, Дж., Видаль, А., Мартинес, Д.: Эффективность металлических и углеродсодержащих катализаторов в солнечном каталитическом разложении метана для производство водорода и углерода. Междунар. Дж. Водородная энергия. 37 , 9645–9655 (2012). https://doi.org/10.1016/j.ijhydene.2012.03.075
КАС Статья Google Scholar
Пудукуди, М., Яакоб, З.: Разложение метана на монометаллических катализаторах на основе никеля, кобальта и железа, нанесенных на золь-гель производные SiO 2 микрохлопья.хим. англ. J. 262 , 1009–1021 (2015). https://doi.org/10.1016/j.cej.2014.10.077
КАС Статья Google Scholar
Сарасват, С.К., Пант, К.К.: Синтез водородных и углеродных нанотрубок на промотированном медью катализаторе Ni/SiO 2 путем термокаталитического разложения метана. Дж. Нат. Газовые науки. англ. 13 , 52–59 (2013). https://doi.org/10.1016/j.jngse.2013.04.001
Дж. Нат. Газовые науки. англ. 13 , 52–59 (2013). https://doi.org/10.1016/j.jngse.2013.04.001
КАС Статья Google Scholar
Пудукуди, М., Яакоб, З., Акмал, З.С.: Прямое разложение метана на промотированном Pd катализаторе Ni/SBA-15. заявл. Серф. науч. (2015). https://doi.org/10.1016/j.apsusc.2015.06.073
Артикул Google Scholar
Сарасват, С.К., Пант, К.К.: Синтез углеродных нанотрубок путем термокаталитического разложения метана на промотированном Cu и Zn катализаторе Ni/MCM-22. Дж. Окружающая среда. хим. англ. 1 , 746–754 (2013). https://дои.org/10.1016/j.jece.2013.07.009
КАС Статья Google Scholar
Фигейредо, Дж. Л., Орфао, Дж. Дж. М., Кунья, А. Ф.: Производство водорода путем разложения метана на катализаторах типа Ренея. Междунар. Дж. Водородная энергия. 35 , 9795–9800 (2010). https://doi.org/10.1016/j.ijhydene.2009.12.071
35 , 9795–9800 (2010). https://doi.org/10.1016/j.ijhydene.2009.12.071
КАС Статья Google Scholar
Салам, М.А., Абдулла, Б.: Механизм катализа промотированного палладием γ-оксида алюминия при термическом разложении метана до водорода: исследование теории функционала плотности. Матер. хим. физ. 188 , 18–23 (2017). https://doi.org/10.1016/j.matchemphys.2016.12.022
КАС Статья Google Scholar
Dou, B., Wang, C., Song, Y., Chen, H., Xu, Y.: Активность катализатора на основе Ni–Cu–Al для возобновляемого производства водорода путем паровой конверсии глицерина.Преобразование энергии. Управление 78 , 253–259 (2014). https://doi.org/10.1016/j.enconman.2013.10.067
КАС Статья Google Scholar
Гупта, Р.Б.: Водородное топливо: производство, транспортировка и хранение. CRC Press, Бока-Ратон (2009)
CRC Press, Бока-Ратон (2009)
Google Scholar
Баят, Н., Резаи, М., Мешкани, Ф.: Разложение метана на Ni-Fe/Al 2 O 3 катализаторы для производства CO x без водорода и углеродных нановолокон .Междунар. Дж. Водородная энергия. 41 , 1574–1584 (2016). https://doi.org/10.1016/j.ijhydene.2015.10.053
КАС Статья Google Scholar
Контрерас, Дж.Л., Салмонес, Дж., Колин-Луна, Дж.А., Нуно, Л., Кинтана, Б., Кордова, И., Зейферт, Б., Тапиа, К., Фуэнтес, Г.А.: Катализаторы для производства Н3 методом паровой конверсии этанола (обзор). Междунар. Дж. Водородная энергия. 39 , 18835–18853 (2014). https://дои.org/10.1016/j.ijhydene.2014.08.072
КАС Статья Google Scholar
Ратегарпанах А., Мешкани Ф., Ван Ю., Арандиян Х., Резаи М. : Термокаталитическая конверсия метана в высокочистый водород на Ni–Cu/MgO·Al 2 O 3 катализаторы: Влияние благородных металлов (Pt и Pd) на каталитическую активность и стабильность. Преобразование энергии. Управление 166 , 268–280 (2018). https://doi.org/10.1016/j.enconman.2018.04.033
: Термокаталитическая конверсия метана в высокочистый водород на Ni–Cu/MgO·Al 2 O 3 катализаторы: Влияние благородных металлов (Pt и Pd) на каталитическую активность и стабильность. Преобразование энергии. Управление 166 , 268–280 (2018). https://doi.org/10.1016/j.enconman.2018.04.033
КАС Статья Google Scholar
Tian, M., Li, K., Zhu, X., Wei, Y., Zheng, Y., Zhang, L., Long, Y., Wang, H.: Modified Al@Al 2 O 3 материалы с фазовым переходом под действием углерода посредством каталитического разложения метана на месте. Сол. Энергия Матер. Сол. Клетки. 200 , 109924 (2019). https://doi.org/10.1016/j.solmat.2019.109924
КАС Статья Google Scholar
Растегарпанах А., Резаи М., Мешкани Ф., Чжан К., Чжао X., Пей В., Лю Ю., Дэн Дж., Арандиян Х., Дай Х. : Влияние металлов VIB группы на активность Ni/MgO катализатора разложения метана. заявл. Катал. Б Окружающая среда. (2019). https://doi.org/10.1016/j.apcatb.2019.01.067
заявл. Катал. Б Окружающая среда. (2019). https://doi.org/10.1016/j.apcatb.2019.01.067
Артикул Google Scholar
Wang, D., Zhang, J., Sun, J., Gao, W., Cui, Y.: Влияние металлических добавок на каталитические характеристики Ni/Al 2 O 3 катализатор термокаталитического разложения метана.Междунар. Дж. Водородная энергия. (2019). https://doi.org/10.1016/j.ijhydene.2019.01.272
Артикул Google Scholar
Наджафиширтари С., Гулььери К., Маррас С., Скарпеллини А., Брешиа Р., Прато М., Риги Г., Франчини А., Магри Р. , Манна, Л., Коломбо, М.: Взаимодействие металла и носителя в катализе: влияние морфологии нанооксидного домена на каталитическую активность. заявл. Катал. Б Окружающая среда. (2018). https://дои.org/10.1016/j.apcatb.2018.06.033
Артикул Google Scholar

Lai, C.: Применение наноматериалов из мезопористого кремнезема в катализе. Дж. Термодин. Катал. 5 , 1–3 (2013). https://doi.org/10.4172/2157-7544.1000e124
КАС Статья Google Scholar
Паласио, Р., Гальего, Дж., Габелика, З., Батио-Дюпейра, К., Барро, Дж., Валанж, С.: Разложение этанола на богатый водородом газ и углеродные нанотрубки на Ni, Co и Fe, нанесенных на SBA-15 и Aerosil. заявл. Катал. Генерал (2015). https://doi.org/10.1016/j.apcata.2015.03.041
Артикул Google Scholar
Цончева Т., Генова И., Стоянова М., Поль М.-М., Николов Р., Димитров М., Саркади-Прибоцкий Э., Михайлов М. , Ковачева Д., Хаджииванов К.: Влияние топологии мезопористого кремнезема на формирование активных центров в нанесенных на медь катализаторах разложения метанола.заявл. Катал. Б Окружающая среда. 147 , 684–697 (2014). https://doi.org/10. 1016/j.apcatb.2013.10.002
1016/j.apcatb.2013.10.002
КАС Статья Google Scholar
Азиз, М.А.А., Джалил, А.А., Тривахионо, С., Ахмад, А.: CO 2 метанирование на гетерогенном катализаторе: недавний прогресс и перспективы на будущее. Р. Соц. хим. (2015)
Jana, P., de la Pena O’Shea, VA, Coronado, JM, Serrano, DP: Катализаторы на основе кобальта, приготовленные по методу Печини для получения CO 2 свободного водорода путем разложения метана .Междунар. Дж. Водородная энергия. 35 , 3–12 (2010). https://doi.org/10.1016/j.ijhydene.2010.07.125
КАС Статья Google Scholar
Кабальеро, М., Анхель, Г.Д., Бонилья-Санчес, А., Ранхель-Васкес, И., Арриета, А., Васкес-Завала, А., Уэрта, Л., Сальгадо, М. : Высокая селективность по водороду в реакции разложения метана на катализаторах Rh/γ–Al 2 O 3 –Nd 2 O 3 . Междунар.Дж. Водородная энергия. 1 , 1–13 (2016). https://doi.org/10.1016/j.ijhydene.2016.10.001
Междунар.Дж. Водородная энергия. 1 , 1–13 (2016). https://doi.org/10.1016/j.ijhydene.2016.10.001
КАС Статья Google Scholar
Кабальеро, М., Анхель, Г.Д., Рангель-Васкес, И., Уэрта, Л.: Получение водорода путем разложения метана на Pt/γ-оксиде алюминия, легированном неодиниевым катализатором, и его кинетическое исследование. Катал. Сегодня. (2018). https://doi.org/10.1016/j.cattod.2018.05.024
Артикул Google Scholar
Лиз-Марзан, Л.М., Ладо-Турино, И.: Восстановление и стабилизация наночастиц серебра в этаноле с помощью неионогенных поверхностно-активных веществ. Ленгмюр 12 , 3585–3589 (1996)
CAS Статья Google Scholar
Лазаро, М.Дж., Эчегойен, Ю., Алегре, К., Суэвес, И., Молинер, Р., Паласиос, Дж.М.: TiO 2 в качестве структурного промотора на никелевых катализаторах с высокой нагрузкой для разложения метана. Междунар. Дж. Водородная энергия. 33 , 3320–3329 (2008).https://doi.org/10.1016/j.ijhydene.2008.03.050
Междунар. Дж. Водородная энергия. 33 , 3320–3329 (2008).https://doi.org/10.1016/j.ijhydene.2008.03.050
КАС Статья Google Scholar
Guil-López, R., La Parola, V., Pena, MA, Fierro, JLG: Эволюция Ni-активных центров в экс-гидротальцитоксидные катализаторы во время производства водорода без CO x путем разложение метана. Междунар. Дж. Водородная энергия. (2012). https://doi.org/10.1016/j.ijhydene.2011.11.083
Артикул Google Scholar
Li, D., Chen, J., Li, Y.: Свидетельство отклонения состава металлических частиц катализатора Ni–Cu/Al 2 O 3 при разложении метана до CO x свободного водорода. Междунар. Дж. Водородная энергия. 34 , 299–307 (2009). https://doi.org/10.1016/j.ijhydene.2008.09.106
КАС Статья Google Scholar

Guo, Z., Zheng, J.E., Liu, Y., Chu, W.: понимание роли взаимодействия металл/оксид и доступности никеля на NiAl-смешанном оксидном катализаторе для разложения метана.заявл. Катал. Генерал (2018). https://doi.org/10.1016/j.apcata.2018.01.031
Артикул Google Scholar
Jiao, Y., Zhang, J., Du, Y., Sun, D., Wang, J., Chen, Y., Lu, J.: Паровая конверсия углеводородного топлива над M (Fe Биметаллические катализаторы Co, Ni, Cu, Zn)-Ce, нанесенные на Al 2 O 3 . Междунар. Дж. Водородная энергия. 41 , 10473–10482 (2015). https://doi.org/10.1016/j.ijhydene.2015.09.151
КАС Статья Google Scholar
Li, L., Meng, Q., Ji, W., Shao, J., Xu, Q., Yan, J.: Внедрение наночастиц железа графитированным углеродом в качестве высокоактивного, но стабильного катализатора разложения аммиака. Мол. Катал. 442 , 147–153 (2017). https://doi.org/10.1016/j.mcat.2017.09.013
https://doi.org/10.1016/j.mcat.2017.09.013
КАС Статья Google Scholar
Tezel, E., Figen, H.E., Baykara, S.Z.: Производство водорода путем разложения метана с использованием биметаллических катализаторов Ni-Fe.Междунар. Дж. Водородная энергия. 44 , 9930–9940 (2019). https://doi.org/10.1016/j.ijhydene.2018.12.151
КАС Статья Google Scholar
Shen, Y., Lua, A.C.: Полиоловый синтез катализаторов на основе никеля и меди для производства водорода путем разложения метана. Междунар. Дж. Водородная энергия. 1 , 1–11 (2014). https://doi.org/10.1016/j.ijhydene.2014.10.071
КАС Статья Google Scholar
Вольфбайссер, А., Ковач, Г., Козлов, С.М., Феттингер, К., Бернарди, Дж., Клетцер, Б., Нейман, К.М., Рупрехтер, Г.: Состав поверхности CuNi–ZrO 2 в метане декомпозиция: операндо NAP-XPS и функциональное исследование плотности. Катал. Сегодня. 1 , 2–11 (2016). https://doi.org/10.1016/j.cattod.2016.04.022
Катал. Сегодня. 1 , 2–11 (2016). https://doi.org/10.1016/j.cattod.2016.04.022
КАС Статья Google Scholar
Боргей М., Каримзаде Р., Рашиди А., Изади Н.: Кинетика разложения метана до CO x без водорода и углеродного нановолокна на катализаторе Ni–Cu/MgO. Междунар. Дж. Водородная энергия. 35 , 9479–9488 (2010). https://doi.org/10.1016/j.ijhydene.2010.05.072
КАС Статья Google Scholar
Хорнес, А., Бера, П., Фернандес-Гарсия, М., Герреро-Руис, А., Мартинес-Ариас, А.: Каталитические и окислительно-восстановительные свойства биметаллических систем Cu–Ni в сочетании с CeO 2 или CeO, легированный Gd 2 , для окисления и разложения метана.заявл. Катал. Б Окружающая среда. 111–112 , 96–105 (2012). https://doi.org/10.1016/j.apcatb.2011.09.022
КАС Статья Google Scholar

Кунья, А.Ф., Орфао, Дж.Дж.М., Фигейредо, Дж.Л.: Разложение метана на катализаторах Fe-Cu типа Ренея. Топливный процесс. Технол. 90 , 1234–1240 (2009). https://doi.org/10.1016/j.fuproc.2009.06.004
КАС Статья Google Scholar
Lua, A.C., Wang, HY: Производство водорода путем каталитического разложения метана на частицах сплава Ni–Cu–Co. заявл. Катал. Б Окружающая среда. 156–157 , 84–93 (2014). https://doi.org/10.1016/j.apcatb.2014.02.046
КАС Статья Google Scholar
Pan, Y., Wen, M.: Благородные металлы повышают каталитическую активность анатаза TiO 2 в реакции выделения водорода. Междунар. Дж. Водородная энергия. 43 , 22055–22063 (2018).https://doi.org/10.1016/j.ijhydene.2018.10.093
КАС Статья Google Scholar
Ядав, А. К., Вайдья, П.Д.: Исследование эффективности катализаторов из благородных металлов для паровой конверсии бутанола. Междунар. Дж. Водородная энергия. 44 , 25575–25588 (2019). https://doi.org/10.1016/j.ijhydene.2019.07.191
К., Вайдья, П.Д.: Исследование эффективности катализаторов из благородных металлов для паровой конверсии бутанола. Междунар. Дж. Водородная энергия. 44 , 25575–25588 (2019). https://doi.org/10.1016/j.ijhydene.2019.07.191
КАС Статья Google Scholar
Сантос, Дж.Л., Мяки-Арвела, П., Верно, Дж., Монсон, А., Сентено, М.А., Мурзин, Д.Ю.: Гидродеоксигенация ванилина над катализатором из благородного металла, нанесенным на биоуголь: часть II: каталитическое поведение. заявл. Катал. Б Окружающая среда. (2019). https://doi.org/10.1016/j.apcatb.2019.118425
Артикул Google Scholar
Коробейник А.В., Уитби Р.Д.Л., Михаловски С.В., Инглезакис В.Дж.: Производство in situ наночастиц благородных металлов высокой чистоты на коллоидальном кремнеземе и каталитическая активность в отношении восстановления 2-нитрофенола.Дж. Физ. хим. Твердые вещества. 127 , 28–34 (2019). https://doi.org/10.1016/j.jpcs.2018.12.001
127 , 28–34 (2019). https://doi.org/10.1016/j.jpcs.2018.12.001
КАС Статья Google Scholar
Рейхани, А., Мортазави, С.З., Парвин, П., Махмуди, З.: Одновременная лазерно-индуцированная спектроскопия пробоя и разложение метана с помощью палладия при различных давлениях. Спектрохим. Acta Part B. 74–75 , 124–130 (2012). https://doi.org/10.1016/j.sab.2012.06.050
КАС Статья Google Scholar
Сарада Прасад, Дж., Дханд, В., Химабинду, В., Анджанейулу, Ю., Джейн, П.К.: Производство водородных и углеродных нановолокон путем разложения метана на катализаторах Pd, нанесенных на активированный уголь. Междунар. Дж. Водородная энергия. 35 , 10977–10983 (2010). https://doi.org/10.1016/j.ijhydene.2010.07.021
КАС Статья Google Scholar
Шиманская М. , Малайка А., Речня П., Миклашевская А., Козловский М.: Системы металл/активированный уголь как катализаторы реакции разложения метана. Катал. Сегодня. 249 , 94–102 (2015). https://doi.org/10.1016/j.cattod.2014.11.025
, Малайка А., Речня П., Миклашевская А., Козловский М.: Системы металл/активированный уголь как катализаторы реакции разложения метана. Катал. Сегодня. 249 , 94–102 (2015). https://doi.org/10.1016/j.cattod.2014.11.025
КАС Статья Google Scholar
Majewska, J., Michalkiewicz, B.: Производство водорода и углеродных наноматериалов из метана с использованием катализатора Co/ZSM-5. Междунар. Дж. Водородная энергия. 41 , 8668–8678 (2016). https://doi.org/10.1016/j.ijhydene.2016.01.097
КАС Статья Google Scholar
Сильва, Р.Р.К.М., Оливейра, Х.А., Гуарино, А.К.П.Ф., Толедо, Б.Б., Моура, М.Б.Т., Оливейра, Т.М., Пассос, Ф.Б.: Влияние носителя на разложение метана для производства водорода на кобальтовых катализаторах. Междунар. Дж. Водородная энергия. 41 , 6763–6772 (2016)
КАС Статья Google Scholar

Зардин, Л., Перес-Лопес, О.В.: Производство водорода путем разложения метана на смешанных оксидах Co-Al, полученных из гидроталькитов: эффект активации катализатора с помощью. Междунар. Дж. Водородная энергия. 42 , 7895–7907 (2017). https://doi.org/10.1016/j.ijhydene.2017.02.153
КАС Статья Google Scholar
Fakeeha, A.H., Ibrahim, A.A., Khan, W.U., Seshan, K., Al Otaibi, R.L., Al-Fatesh, A.S.: Производство водорода путем каталитического разложения метана на железном катализаторе, нанесенном на оксид алюминия.араб. Дж. Хим. (2016). https://doi.org/10.1016/j.arabjc.2016.06.012
Артикул Google Scholar
Аль-Фатеш, А.С., Факиха, А.Х., Хан, В.У., Ибрагим, А.А., Хе, С., Сешан, К.: Производство водорода каталитическим разложением метана на оксиде алюминия, нанесенном на моно-, би- и триметаллические катализаторы. Междунар. Дж. Водородная энергия. 41 , 22932–22940 (2016). https://doi.org/10.1016/j.ijhydene.2016.09.027
41 , 22932–22940 (2016). https://doi.org/10.1016/j.ijhydene.2016.09.027
КАС Статья Google Scholar
Дюпюи, А.-К.: Катализатор в CCVD углеродных нанотрубок — обзор. прог. Матер. науч. 50 , 929–961 (2005). https://doi.org/10.1016/j.pmatsci.2005.04.003
КАС Статья Google Scholar
Пудукуди, М., Яакоб, З., Акмаль, З.С.: Прямое разложение метана на биметаллических катализаторах на основе никеля, кобальта и железа на SBA-15. заявл. Серф. науч. 330 , 418–430 (2015). https://doi.org/10.1016/j.apsusc.2015.01.032
КАС Статья Google Scholar
Chen, J., Yang, X., Li, Y.: Исследование структуры и окислительной активности твердого углерода, полученного в результате каталитического разложения метана. Топливо 89 , 943–948 (2010). https://doi. org/10.1016/j.fuel.2009.08.017
org/10.1016/j.fuel.2009.08.017
КАС Статья Google Scholar
Виллакампа, Дж.И., Ройо, К., Ромео, Э., Монтойя, Дж.А., Анхель, П.Д., Монсон, А.: Каталитическое разложение метана на соосажденных катализаторах Ni-Al2O3 и исследования регенерации. заявл. Катал. A Gen. 252 , 363–383 (2003). https://doi.org/10.1016/S0926-860X(03)00492-7
КАС Статья Google Scholar
Zhang, T., Amiridis, MD: Производство водорода путем прямого крекинга метана на никелевых катализаторах, нанесенных на оксид кремния.заявл. Катал. A Gen. 167 , 161–172 (1998)
CAS Статья Google Scholar
Li, Y., Li, D., Wang, G.: Разложение метана до CO x без водорода и наноуглеродного материала на катализаторах из неблагородных металлов группы 8–10: обзор. Катал. Сегодня. 162 , 1–48 (2011). https://doi.org/10.1016/j.cattod.2010.12.042
https://doi.org/10.1016/j.cattod.2010.12.042
КАС Статья Google Scholar
Guizani, C., Sanz, F.J.E., Salvador, S.: Природа отложившегося углерода при крекинге метана над древесным углем, насыщенным никелем. Комптес Рендус Чим. 19 , 423–432 (2016). https://doi.org/10.1016/j.crci.2015.10.009
КАС Статья Google Scholar
Нареш, Г., Виджай Кумар, В., Анджанейулу, К., Тардио, Дж., Бхаргава, С.К., Патель, Дж., Венугопал, А.: Наноразмерный цеолит Hβ как эффективная подложка для Ni и Ni–Cu для производства свободного водорода CO x путем каталитического разложения метана.Междунар. Дж. Водородная энергия. (2016). https://doi.org/10.1016/j.ijhydene.2016.09.131
Артикул Google Scholar
Каталитическое разложение метана для производства водорода без CO2
Благодаря финансированию экологической программы Министерства энергетики по переработке и сбыту проекта «Реактивные мембраны протонного обмена для преобразования легких алканов в чистое жидкое топливо» компания INL разработала стабильный и эффективный катализатор для преобразования CH 4 по H 2 без образования CO 2 . Этот каталитический процесс может обеспечить значительный прогресс в развитии водородной экономики с использованием природного газа CH 4 без образования парниковых газов.
Этот каталитический процесс может обеспечить значительный прогресс в развитии водородной экономики с использованием природного газа CH 4 без образования парниковых газов.
В этом исследовании изучается прямое каталитическое разложение CH 4 с образованием H 2 и твердого углерода. Образующиеся твердые частицы углерода вытекают из слоя катализатора и собираются в расположенном ниже по потоку фильтрующем оборудовании. Катализатор был изготовлен с использованием смеси запатентованных солей металлов, которые были нанесены на общую площадь с высокой поверхностью с микропористой подложкой.
Без оптимизации катализатора, реактора или условий процесса была получена конверсия CH 4 более 50% с соответствующим высоким выходом H 2 . Ожидается более высокая конверсия при оптимизации системы. Было обнаружено, что катализатор имеет стабильную активность в течение 30 часов на экспериментальном стенде с насадкой непрерывного действия. Испытания проводились при атмосферном давлении, температурах 500-700°С и промышленно обоснованных объемных скоростях до 2.5 грамм (г) CH 4 на г катализатора в час. Стоимость катализаторов для этого процесса сопоставима со стоимостью стандартных промышленных катализаторов. В отсутствие катализатора реакция не идет. Ожидается, что капитальные затраты на эксплуатацию реактора и связанной с ним установки будут низкими, поскольку реактор и сепараторы просты и не требуют разработки новых технологий.
Испытания проводились при атмосферном давлении, температурах 500-700°С и промышленно обоснованных объемных скоростях до 2.5 грамм (г) CH 4 на г катализатора в час. Стоимость катализаторов для этого процесса сопоставима со стоимостью стандартных промышленных катализаторов. В отсутствие катализатора реакция не идет. Ожидается, что капитальные затраты на эксплуатацию реактора и связанной с ним установки будут низкими, поскольку реактор и сепараторы просты и не требуют разработки новых технологий.
Задачи проекта запланированы для выполнения следующего:
- Модификации экспериментальной системы и одобрения для проведения долгосрочных испытаний катализатора.
- Оптимизация катализатора с целью увеличения выхода h3.
- Расширенные испытания катализатора для непрерывного производства h3 с использованием перспективных катализаторов, разработанных в ходе предыдущих исследований.
- Расчет баланса энергии и массы с использованием кода моделирования процессов, такого как ASPEN Plus, для оценки эффективности преобразования энергии и сравнения эффективности паровой конверсии метана.

- Защита технологий, связь и передача с целью передачи технологии в промышленность.
Создана исходная численная модель процесса реакции ASPEN. Термодинамический анализ показывает, что эта реакция требует меньше энергии на моль H 2 , чем традиционная паровая конверсия метана, обычно используемая для получения H 2 . Реакция ограничена равновесием, при этом максимальные концентрации H 2 ограничиваются 75 мол.% при 600°C, увеличиваясь до 96 мол.% при 800°C. Экспериментальная работа была сосредоточена на цеолитном катализаторе, модифицированном металлом. На сегодняшний день катализатор демонстрирует 70 мол. % водорода в потоке, выходящем из реактора, при 700°C.и стабильная активность катализатора в течение 30 часов — все время испытаний.
Выход водорода в зависимости от времени работы (TOS) исследовали при различных температурах реакции. При 600-700°С образование Н 2 было относительно стабильным, но при 800°С было очевидно заметное снижение. В дополнение к H 2 другие продукты реакции включали бензол и высшие ароматические соединения. Для используемого ТОС катализатор сохранил большую часть своей исходной площади поверхности и объема микропор.Анализы с помощью трансмиссионной электронной микроскопии показали гомогенное покрытие поверхности цеолита углеродистыми отложениями.
В дополнение к H 2 другие продукты реакции включали бензол и высшие ароматические соединения. Для используемого ТОС катализатор сохранил большую часть своей исходной площади поверхности и объема микропор.Анализы с помощью трансмиссионной электронной микроскопии показали гомогенное покрытие поверхности цеолита углеродистыми отложениями.
Образцы катализатора регенерировали в токе воздуха при 600°С. После регенерации катализатора активность восстанавливалась; однако некоторая потеря наблюдалась на катализаторе, используемом при самой высокой температуре реакции. Эта потеря активности после регенерации приписывается углеродистым отложениям, оставшимся на поверхности катализатора после регенерации, что было подтверждено исследованиями температурно-программированного окисления.Углеродосодержащие частицы, осевшие на поверхности катализатора, более конденсировались по мере повышения температуры реакции. Углеродистые отложения на образце катализатора, используемого для получения h3 при 600°С, полностью десорбировались при окислении при 600°С. анализ. Кроме того, необходимо провести анализ рынка высококачественного углеродного продукта и экономический анализ процессов.
анализ. Кроме того, необходимо провести анализ рынка высококачественного углеродного продукта и экономический анализ процессов.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера для приема файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie.
 Попробуйте другой браузер, если вы подозреваете это.
Попробуйте другой браузер, если вы подозреваете это. - Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера для приема файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.

- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
ATSDR — грунтовка для свалочного газа
В этой главе содержится основная информация о свалочном газе — что
он состоит из того, как он производится, и условий, которые влияют на
его производство. Он также предоставляет информацию о том, как свалки
газ движется и уходит от полигона. Наконец,
В главе представлен обзор типов свалок, которые могут
присутствовать в вашем сообществе и нормативные требования, которые
применяются к каждому.
Он также предоставляет информацию о том, как свалки
газ движется и уходит от полигона. Наконец,
В главе представлен обзор типов свалок, которые могут
присутствовать в вашем сообществе и нормативные требования, которые
применяются к каждому.
Из чего состоит свалочный газ?
Свалочный газ состоит из смеси сотен различных газы. По объему свалочный газ обычно содержит от 45% до 60% метана. и от 40% до 60% углекислого газа. Свалочный газ также включает небольшие количество азота, кислорода, аммиака, сульфидов, водорода, углерода монооксид и неметановые органические соединения (НМОС), такие как трихлорэтилен, бензол и винилхлорид. В таблице 2-1 перечислены «типичные» свалочные газы, их процентное содержание по объему и их характеристики.
Как производится свалочный газ?
Три процесса: бактериальное разложение, улетучивание и химические реакции — образуют свалочный газ.
- Бактериальное разложение. Большая свалка
газ образуется при бактериальном разложении, которое происходит, когда
органические отходы разлагаются бактериями, естественным образом присутствующими в
отходов и в почве, используемой для покрытия полигона.
 Органический
отходы включают продукты питания, садовые отходы, подметание улиц, текстиль,
и изделия из дерева и бумаги.Бактерии разлагают органические отходы
в четыре фазы, а состав газа меняется в течение
каждую фазу. В поле ниже представлены подробные
информация о четырех фазах бактериального разложения
и газы, образующиеся на каждой фазе. Фигура
2-1 показана добыча газа на каждой из четырех стадий.
Органический
отходы включают продукты питания, садовые отходы, подметание улиц, текстиль,
и изделия из дерева и бумаги.Бактерии разлагают органические отходы
в четыре фазы, а состав газа меняется в течение
каждую фазу. В поле ниже представлены подробные
информация о четырех фазах бактериального разложения
и газы, образующиеся на каждой фазе. Фигура
2-1 показана добыча газа на каждой из четырех стадий. - Испарение . Свалочные газы могут образовываться когда некоторые отходы, особенно органические соединения, изменяются из жидкости или твердого тела в пар.Этот процесс известен как улетучивание. НМОК в свалочном газе могут быть результатом улетучивание некоторых химических веществ, вывозимых на свалку.
- Химические реакции. Свалочный газ, в том числе
NMOC могут быть созданы в результате реакций определенных химических веществ.
присутствует в отходах. Например, если хлорный отбеливатель и аммиак
вступают в контакт друг с другом в пределах свалки, вредные
производится газ.

|
Таблица 2-1: Типичные компоненты свалочного газа |
||
|---|---|---|
| Компонент | Проценты по объему | Характеристики |
| метан | 45–60 | Метан — природный газ. Это бесцветный и без запаха.Мусорные свалки являются крупнейшими источник антропогенных выбросов метана в США |
| двуокись углерода | 40–60 | Углекислый газ в природе встречается в небольших количествах. концентрации в атмосфере (0,03%). Он бесцветный, без запаха, слегка кислый. |
| азот | 2–5 | Азот составляет примерно 79%
атмосфера. Он не имеет запаха, вкуса и цвета. Он не имеет запаха, вкуса и цвета. |
| кислород | 0,1–1 | Кислород составляет примерно 21% атмосфера. Он не имеет запаха, вкуса и цвета. |
| аммиак | 0,1–1 | Аммиак — бесцветный газ с резким запахом. запах. |
| НМОК (неметановые органические соединения) |
0.01–0,6 | НМОК представляют собой органические соединения (т. е. соединения
содержащие углерод). (Метан является органическим соединением, но
не считается НМОК.) НМОК могут встречаться естественным образом или
быть образованы синтетическими химическими процессами. НМОК чаще всего
обнаруженные на свалках, включают акрилонитрил, бензол, 1,1-дихлорэтан,
1,2-цис-дихлорэтилен, дихлорметан, карбонилсульфид,
этилбензол, гексан, метилэтилкетон, тетрахлорэтилен,
толуол, трихлорэтилен, винилхлорид и ксилолы. |
| сульфиды | 0–1 | Сульфиды (например, сероводород, диметил сульфиды, меркаптаны) – природные газы, придать свалочной газовой смеси запах тухлых яиц. сульфиды может вызывать неприятные запахи даже при очень низких концентрациях. |
| водород | 0–0,2 | Водород — бесцветный газ без запаха. |
| монооксид углерода | 0–0.2 | Монооксид углерода – бесцветное вещество без запаха. газ. |
|
Источник: Чобаноглус, Тайзен и Виджил, 1993 г.; АООС 1995 |
||
| Четыре фазы бактериального разложения свалочных отходов |
|---|
| Бактерии разлагаются
захоронения отходов в четыре этапа. Фаза I Этап II Этап III Этап IV
|
Рисунок 2-1: Этапы производства типичный свалочный газ
К началу страницы
Какие условия влияют на производство свалочного газа?
Скорость и объем свалочного газа, производимого на конкретном объекте зависят от характеристик отходов (например, состава и возраст мусора) и ряд факторов окружающей среды (например,г., наличие кислорода на полигоне, влажность и температура).
- Состав отходов. Чем больше органических отходов присутствует на свалке, тем больше свалочного газа (например, углекислого газа, метан, азот и сероводород) производится бактерии при разложении. Чем больше химикатов утилизируется на свалке, тем больше вероятность того, что НМОК и другие газы будут быть получены либо путем улетучивания или химических реакций.
- Возраст отбросов . В общем, совсем недавно
захороненные отходы (т. е. отходы, захороненные менее 10 лет) производят
больше свалочного газа за счет бактериального разложения, улетучивания,
химических реакций, чем старые отходы (захороненные более
10 лет).
 Пик добычи газа обычно приходится на период от 5 до 7 лет.
после захоронения отходов.
Пик добычи газа обычно приходится на период от 5 до 7 лет.
после захоронения отходов. - Наличие кислорода на свалке. Метан будет производиться только тогда, когда кислорода больше не будет в свалка.
- Содержание влаги. Наличие влаги (ненасыщенные условия) на свалке увеличивает производство газа потому что это способствует бактериальному разложению. Влага может также способствуют химическим реакциям, в результате которых образуются газы.
- Температура. По температуре полигона повышается, бактериальная активность увеличивается, что приводит к увеличению добыча газа. Повышенная температура также может увеличить показатели испарения и химических реакций.Коробка на следующем страница содержит более подробную информацию о том, как эти переменные влияют на темпы и объемы производства свалочного газа.
Как движется свалочный газ?
Как только газы образуются под поверхностью свалки, они обычно
отойти подальше от свалки. Газы имеют свойство расширяться и заполнять имеющиеся
пространство, чтобы они двигались или «мигрировали» через ограниченную пору
пространства внутри мусорно-грунтового покрова полигона.То
естественная склонность свалочных газов, которые легче воздуха, такие
как и метан, должен двигаться вверх, обычно по поверхности полигона.
Восходящее движение свалочного газа может быть остановлено плотным уплотнением
отходы или материал покрытия свалки (например, ежедневный почвенный покров и
колпачки). Когда восходящее движение затруднено, газ имеет тенденцию мигрировать
горизонтально к другим участкам полигона или к участкам за его пределами
свалка, где он может возобновить свой восходящий путь.В принципе,
газы идут по пути наименьшего сопротивления. Некоторые газы, такие как углерод
двуокиси, плотнее воздуха и будут собираться в подповерхностных областях,
например, подсобные коридоры. Три основных фактора влияют на миграцию
свалочных газов: диффузия (концентрация), давление и проницаемость
Газы имеют свойство расширяться и заполнять имеющиеся
пространство, чтобы они двигались или «мигрировали» через ограниченную пору
пространства внутри мусорно-грунтового покрова полигона.То
естественная склонность свалочных газов, которые легче воздуха, такие
как и метан, должен двигаться вверх, обычно по поверхности полигона.
Восходящее движение свалочного газа может быть остановлено плотным уплотнением
отходы или материал покрытия свалки (например, ежедневный почвенный покров и
колпачки). Когда восходящее движение затруднено, газ имеет тенденцию мигрировать
горизонтально к другим участкам полигона или к участкам за его пределами
свалка, где он может возобновить свой восходящий путь.В принципе,
газы идут по пути наименьшего сопротивления. Некоторые газы, такие как углерод
двуокиси, плотнее воздуха и будут собираться в подповерхностных областях,
например, подсобные коридоры. Три основных фактора влияют на миграцию
свалочных газов: диффузия (концентрация), давление и проницаемость
- Диффузия (концентрация).
 Диффузия описывает
естественная тенденция газа к достижению однородной концентрации в
заданное пространство, будь то помещение или земная атмосфера.Газы на свалке перемещаются из областей с высокой концентрацией газа.
в районы с меньшей концентрацией газа. Поскольку концентрация газа
на свалке обычно выше, чем в окружающей
территории, свалочные газы диффундируют со свалки в окружающую среду.
места с меньшей концентрацией газа.
Диффузия описывает
естественная тенденция газа к достижению однородной концентрации в
заданное пространство, будь то помещение или земная атмосфера.Газы на свалке перемещаются из областей с высокой концентрацией газа.
в районы с меньшей концентрацией газа. Поскольку концентрация газа
на свалке обычно выше, чем в окружающей
территории, свалочные газы диффундируют со свалки в окружающую среду.
места с меньшей концентрацией газа. - Давление. Газы, скапливающиеся на свалке
создавать области высокого давления, в которых движение газа ограничено
по уплотненному мусорному или почвенному покрову и областям низкого давления
в котором движение газа не ограничено.Изменение давления
по всему полигону приводит к тому, что газы перемещаются из зон
высокого давления в области низкого давления. Движение газов из
областей высокого давления в области более низкого давления называется
конвекция. По мере образования большего количества газов давление в
свалок увеличивается, обычно вызывая подповерхностное давление в
полигон должен быть выше, чем атмосферное давление
или давление воздуха в помещении.
 Когда давление на полигоне выше,
газы имеют тенденцию перемещаться в окружающий воздух или воздух в помещении.
Когда давление на полигоне выше,
газы имеют тенденцию перемещаться в окружающий воздух или воздух в помещении. - Проницаемость. Газы также будут мигрировать в соответствии с туда, где проходят пути наименьшего сопротивления. Проницаемость является мерой того, насколько хорошо газы и жидкости проходят через соединенные пространства или поры в отбросах и почвах. Сухие песчаные почвы очень проницаемой (много связанных поровых пространств), в то время как влажная глина имеет тенденцию быть гораздо менее проницаемой (меньше связанных пор). Газы склонны перемещаться по участкам с высокой проницаемостью (т.г., районы песка или гравия), а не через участки с низкой проницаемостью (например, участки глины или ила). Покрытия для свалок часто делаются грунтов с низкой водопроницаемостью, таких как глина. Газы в закрытом поэтому свалка может с большей вероятностью перемещаться по горизонтали чем по вертикали.
|
Таблица 2-2: Факторы, влияющие на производство свалочного газа |
|---|
|
Состав отходов. Кислород на свалке. Только при кислородном
израсходуется, бактерии начнут производить метан. Чем больше
кислород присутствует на свалке, тем дольше аэробные бактерии
может разлагать отходы на этапе I. Если отходы захоронены неплотно
или часто беспокоит, больше кислорода доступно, так что
кислородозависимые бактерии живут дольше и производят углерод
диоксида и воды в течение более длительного времени. Содержание влаги. Наличие
определенное количество воды на свалке увеличивает производство газа
потому что влага способствует росту бактерий и транспорту
питательные вещества и бактерии во все зоны свалки. А
Влажность 40 % и выше в пересчете на влажную массу
отходов, способствует максимальной добыче газа (например, в закрытом
свалка). Температура. Повышение температуры тепла
бактериальной активности, что, в свою очередь, увеличивает скорость
производство свалочного газа. Более низкие температуры подавляют бактериальную
Мероприятия. Как правило, активность бактерий резко снижается.
ниже 50° по Фаренгейту (F).Погодные изменения имеют гораздо большее
влияние на газообразование на неглубоких свалках. Это потому что
бактерии не так изолированы от изменений температуры
по сравнению с глубокими свалками, где толстый слой почвы
покрывает отходы. Закрытая свалка обычно поддерживает
стабильная температура, максимальное производство газа. Бактериальный
активность выделяет тепло, стабилизируя температуру
на свалке от 77° F до 113° F, хотя температуры
до 158 ° F были отмечены. Эпоха отказа. Недавно похороненный
отходы производят больше газа, чем старые отходы. свалки
обычно выделяют значительное количество газа в течение 1–3
годы. Пик добычи газа обычно приходится на 5-7 лет после
отходы сбрасываются.Почти весь газ добывается в пределах 20
лет после захоронения отходов; однако небольшое количество
газ может продолжать выбрасываться со свалки в течение 50 или
больше лет. Однако сценарий с низким выходом метана оценивает
что медленно разлагающиеся отходы будут производить метан после
5 лет и продолжать выброс газа в течение 40 лет.
Различные части полигона могут находиться в разных
фазы процесса разложения одновременно в зависимости
о том, когда отходы были первоначально размещены в каждой области.То
количество органического материала в отходах является важным
Фактор того, как долго длится добыча газа. |

 \(5\). Бром
\(5\). Бром Состав газа
производил изменения с каждой из четырех фаз разложения.
Полигоны часто принимают отходы в течение 20–30 лет.
поэтому отходы на свалке могут проходить несколько этапов
разложения сразу. Это означает, что старые отходы в
одна область может находиться в другой фазе разложения
чем недавно захороненные отходы в другом районе.
Состав газа
производил изменения с каждой из четырех фаз разложения.
Полигоны часто принимают отходы в течение 20–30 лет.
поэтому отходы на свалке могут проходить несколько этапов
разложения сразу. Это означает, что старые отходы в
одна область может находиться в другой фазе разложения
чем недавно захороненные отходы в другом районе.  Уровень кислорода будет
варьироваться в зависимости от таких факторов, как степень рыхлости или сжатия
отходы были, когда он был похоронен.
Уровень кислорода будет
варьироваться в зависимости от таких факторов, как степень рыхлости или сжатия
отходы были, когда он был похоронен. Этот процесс вызывает
свалка, чтобы стать более нейтральной средой, в которой метанообразующие
бактерии начинают приживаться.Метановые и кислотообразующие
бактерии имеют симбиотические или взаимовыгодные отношения.
Кислотообразующие бактерии создают соединения для метаногенных
бактерии для потребления. Метаногенные бактерии потребляют углерод
диоксид и ацетат, избыток которых был бы ядовит для
кислотообразующие бактерии.
Этот процесс вызывает
свалка, чтобы стать более нейтральной средой, в которой метанообразующие
бактерии начинают приживаться.Метановые и кислотообразующие
бактерии имеют симбиотические или взаимовыгодные отношения.
Кислотообразующие бактерии создают соединения для метаногенных
бактерии для потребления. Метаногенные бактерии потребляют углерод
диоксид и ацетат, избыток которых был бы ядовит для
кислотообразующие бактерии. 
 Чем органичнее
отходов, присутствующих на свалке, тем больше образуется свалочного газа.
путем бактериального разложения. Некоторые виды органических отходов
содержат питательные вещества, такие как натрий, калий, кальций и
магний, который помогает бактериям процветать. Когда эти питательные вещества
присутствуют, производство свалочного газа увеличивается. Альтернативно,
некоторые отходы содержат соединения, наносящие вред бактериям, вызывая
газа будет производиться меньше. Например, производство метана.
бактерии могут подавляться, когда отходы имеют высокую концентрацию соли.
Чем органичнее
отходов, присутствующих на свалке, тем больше образуется свалочного газа.
путем бактериального разложения. Некоторые виды органических отходов
содержат питательные вещества, такие как натрий, калий, кальций и
магний, который помогает бактериям процветать. Когда эти питательные вещества
присутствуют, производство свалочного газа увеличивается. Альтернативно,
некоторые отходы содержат соединения, наносящие вред бактериям, вызывая
газа будет производиться меньше. Например, производство метана.
бактерии могут подавляться, когда отходы имеют высокую концентрацию соли. Если отходы сильно
уплотняется, однако добыча метана начнется раньше
на смену аэробным бактериям приходят метанообразующие.
анаэробные бактерии в фазе III.Газ метан начинает
вырабатывается анаэробными бактериями только тогда, когда кислород
на свалке израсходован аэробными бактериями; следовательно,
любой кислород, оставшийся на свалке, замедлит производство метана.
Барометрические максимумы будут иметь тенденцию вводить атмосферный кислород
в поверхностные почвы на неглубоких участках свалки, возможно
изменение активности бактерий. В этом случае отходы в
Фаза IV, например, может ненадолго вернуться к Фазе I, пока
весь кислород израсходован снова.
Если отходы сильно
уплотняется, однако добыча метана начнется раньше
на смену аэробным бактериям приходят метанообразующие.
анаэробные бактерии в фазе III.Газ метан начинает
вырабатывается анаэробными бактериями только тогда, когда кислород
на свалке израсходован аэробными бактериями; следовательно,
любой кислород, оставшийся на свалке, замедлит производство метана.
Барометрические максимумы будут иметь тенденцию вводить атмосферный кислород
в поверхностные почвы на неглубоких участках свалки, возможно
изменение активности бактерий. В этом случае отходы в
Фаза IV, например, может ненадолго вернуться к Фазе I, пока
весь кислород израсходован снова. Уплотнение отходов замедляет добычу газа, потому что
увеличивает плотность содержимого свалки, уменьшая
скорость, с которой вода может просачиваться в отходы.Оценка
добыча газа выше при сильных дождях и/или проницаемом
покрытие свалки вводит дополнительную воду на свалку.
Уплотнение отходов замедляет добычу газа, потому что
увеличивает плотность содержимого свалки, уменьшая
скорость, с которой вода может просачиваться в отходы.Оценка
добыча газа выше при сильных дождях и/или проницаемом
покрытие свалки вводит дополнительную воду на свалку.
 Также повышается температура
способствуют испарению и химическим реакциям. Как генерал
правило, выбросы NMOC удваиваются с каждым увеличением на 18 ° F
в температуре.
Также повышается температура
способствуют испарению и химическим реакциям. Как генерал
правило, выбросы NMOC удваиваются с каждым увеличением на 18 ° F
в температуре. 