Растворимость веществ | Подготовка к ЦТ и ЕГЭ по химии
Чтобы поделиться, нажимайте
Растворимость вещества показывает, сколько вещества в граммах может раствориться в 1 л воды или сколько вещества в граммах может раствориться в 100 г растворителя. Отношение массы вещества, образующего насыщенный раствор при данной температуре, к объему растворителя называется растворимостью этого вещества или коэффициентом растворимости. Массовая доля растворенного вещества показывает долю этого вещества, содержащегося в растворе
Растворимость веществ зависит от природы растворяемого вещества и растворителя, температуры и давления.
Причины различной растворимости веществ пока точно не установлены, их связывают с характером взаимодействия молекул растворителя и растворенного вещества. Поэтому точно установить растворимость вещества в некотором растворителе можно только экспериментальным путем. Однако замечено, что вещества, состоящие из полярных молекул и вещества с ионным типом связи лучше растворяются в полярных растворителях, а неполярные вещества – в неполярных растворителях.
При растворении твердых и жидких веществ объем раствора обычно почти не изменяется. Следовательно, растворимость твердых и жидких веществ не зависит от давления. При растворении газов объем системы уменьшится, поэтому их растворимость существенно зависит от давления и, согласно принципу Ле Шателье, растворимость газа увеличивается.
Если растворение эндотермичено повышение температуры увеличивает растворимость. Почти всегда этот процесс экзотермичен, следовательно, повышение температуры понижает растворимость газов, поэтому при кипячении газы удаляются из раствора.
Важной закономерностью, описывающей растворимость газов в жидкостях, является закон Генри: растворимость газа прямо пропорциональна его давлению над жидкостью.
Эта закономерность выражается формулой х = kp, где х — молярная доля растворенного вещества, р — давление, k — константа.
Примеры решения задач на растворимость
Также вы можете посмотреть ВИДЕО-уроки на эту тему:
И выполнить задания из ЦТ и ЕГЭ на эту тему вы можете здесь
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ, ЦТ и РТ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув здесь «Получить все материалы сайта»Растворимость
Существует несколько трактований термина растворимость.
Растворимость — это способность вещества растворяться в воде или другом растворителе.
Растворимость – это способность веществ растворяться друг в друге, количественно характеризуется коэффициентом растворимости (к или р) — это масса растворённого вещества, приходящаяся на 100 или 1000г растворителя, в насыщенном растворе — при определённой температуре.
Растворимость вещества зависит от различных факторов: природы вещества и растворителя, от агрегатного состояния, от температуры и давления (для газов).
Существует утверждение “Подобное растворяется в подобном”. Это означает, что молекулярные и ионные соединения с полярной связью хорошо растворяются в полярных растворителях, а вещества с неполярной связью – в неполярных .
Главным растворителем является вода. Но не все вещества, особенно органические, растворяются в воде. Для растворения используют различные растворители, такие как ацетон, спирт, бензол, эфир, хлороформ, метанол и т.д. Применяются также смеси растворителей, например, смеси спирта с водой.
Чтобы растворить твердое вещество, его следует очень мелко измельчить (истереть вступке или помолоть в мельнице). Это делается для того, чтобы увеличить поверхность соприкосновения растворяемого вещества и растворителя. При перемешивании или взбалтывании ускоряется процесс получения раствора. Часто на емкость, в которой готовится раствор, надевают обратный холодильник. Его используют в основном для приготовления растворов путем кипячения. Этим уменьшают потери растворителя. Образующиеся при нагреваниипары смеси осаждаются в холодильнике и стекают обратно. Особенно это важно для горючих растворителей, пары которых из открытого сосуда могли бы загореться от соприкосновения с нагревающим элементом.
Часто на емкость, в которой готовится раствор, надевают обратный холодильник. Его используют в основном для приготовления растворов путем кипячения. Этим уменьшают потери растворителя. Образующиеся при нагреваниипары смеси осаждаются в холодильнике и стекают обратно. Особенно это важно для горючих растворителей, пары которых из открытого сосуда могли бы загореться от соприкосновения с нагревающим элементом.
Растворимость веществ бывает:
- неограниченная
(Примеры: вода и спирт; калия хлорид и калия бромид; калий и рубидий) – эти вещества смешиваются в любых соотношениях.
- ограниченная (Пример: вода и соль поваренная) – определенное количество растворенного вещества
По степени растворимости все вещества делятся:
- Хорошо растворимые (растворимость при 200С более 1 г)
- Малорастворимые (растворимость при 200С от 0,01до 1,0 г)
- Нерастворимые (растворимость при 200С не более 0,01 г)
Хорошо растворимым считается вещество, если более 10 г его хорошо растворяется в 100 г воды.
Малорастворимым называют вещество, если в 100 г воды его растворяется менее 1 г.
И нерастворимые – это такие вещества, менее 0,01 г которых переходит в раствор.
Совсем нерастворимых веществ не бывает. Даже когда воду наливают в стеклянный сосуд, то незначительная часть молекул стекла переходит в раствор.
Что дает нам знание о растворимости веществ в производстве косметики? Существует множество вариантов композиций косметических продуктов. Чтобы предотвратить потенциальную несовместимость компонентов в них, для этого и необходимы знания о растворимости веществ. Зная, как и в чем растворяются вещества, подбирают правильный, последовательный ввод в реактор всех необходимых компонентов при изготовлении косметических средств. Понятие «растворимость» широко используется и в фармакологии. По определению растворимости судят о чистоте субстанции и вспомогательных веществ.
При изготовлении лекарственных средств, биологически активных добавок (БАД) зная о растворимости, применяют специальные технологические приемы:
-
Изменяют последовательность растворения (смешивания) ингредиентов.

- Используют приемы раздельного растворения компонентов.
- Смешивают части лекарственных веществ, различные основы и затем объединяют эти части в единое целое
Зная о растворимости веществ, подбирают различные сорастворители, солюбилизаторы и стабилизаторы для создания прочных лекарственных форм.
растворимости веществ в разных растворителях обычно приводятся в частных статьях на субстанции или вспомогательные вещества.
Под растворимостью веществ в фармакопее подразумевают условные термины, которые приведены в таблице № 1(1):
Таблица №1:
| Термины | Объем (мл.) растворителя для растворения 1г вещества |
| растворим очень легко | менее 1 |
| растворим легко | 1 — 10 |
| растворим | 10 — 30 |
| растворим умеренно | 30 — 100 |
| растворим мало | 100 — 1000 |
| растворим очень мало | 1000 — 10 000 |
| практически не растворим | более 10 000 |
Очень важны для приема лекарственных средств и БАД знания о растворимости препарата.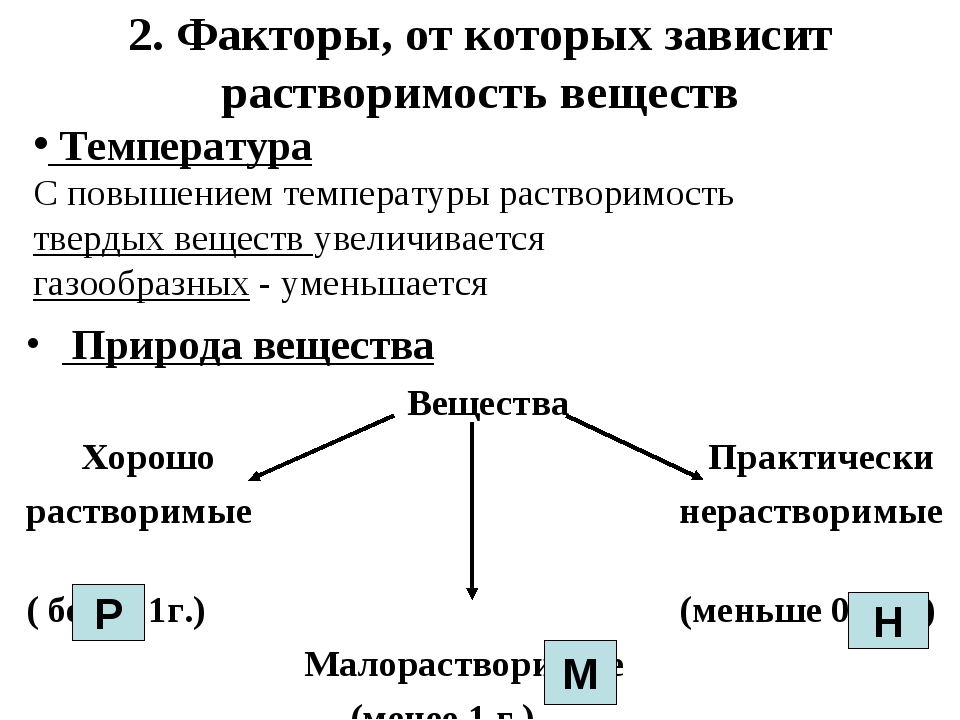 Лекарственное средство легче проникает в растворенном виде в желудочно – кишечный тракт, таким образом, принося более быстрый эффект облегчения больному, в отличие от мало растворимых или трудно растворимых лекарственных форм.
Лекарственное средство легче проникает в растворенном виде в желудочно – кишечный тракт, таким образом, принося более быстрый эффект облегчения больному, в отличие от мало растворимых или трудно растворимых лекарственных форм.
Как определяется растворимость веществ?
Берется навеска исследуемого вещества, помещается в отмеренное количество растворителя, раствор встряхивается в течение 10 мин.
Все определения проводят при температуре (18-22)0С.
Для медленно растворимых веществ (время растворения которых более 20 минут) возможно прогревание на водяной бане до 300С.
После энергичного встряхивания в течение двух минут и охлаждения раствора до (18-22)0С визуально фиксируют результат.
Для медленно растворимых веществ условия растворимости указываются в частных статьях.
Вещество считается растворившимся, если при рассмотрении раствора в проходящем свете в нем не обнаруживаются частицы.
Если неизвестна растворимость вещества, то методика испытания следующая:
Берут 1 г вещества, прибавляют 1 мл растворителя и проводят испытание, как описано выше. Если вещество полностью растворилось, оно считается растворимым очень легко.
Если растворение произошло не полностью, то берут 100 мг растертого вещества, добавляют 1 мл растворителя и снова растворяют. Навеска растворилась полностью — делают вывод, что вещество легко растворимо.
В случае, если растворение произошло не полностью, в этот раствор добавляют 2 мл растворителя и продолжают испытание. Навеска растворилась – считается, что вещество растворимо.
Если растворение прошло не полностью, то в раствор добавляют еще 7 мл растворителя и снова проводят растворение, как описано выше. Если при наблюдении в проходящем свете визуально не наблюдаются частицы, значит растворение прошло. Такое вещество считается 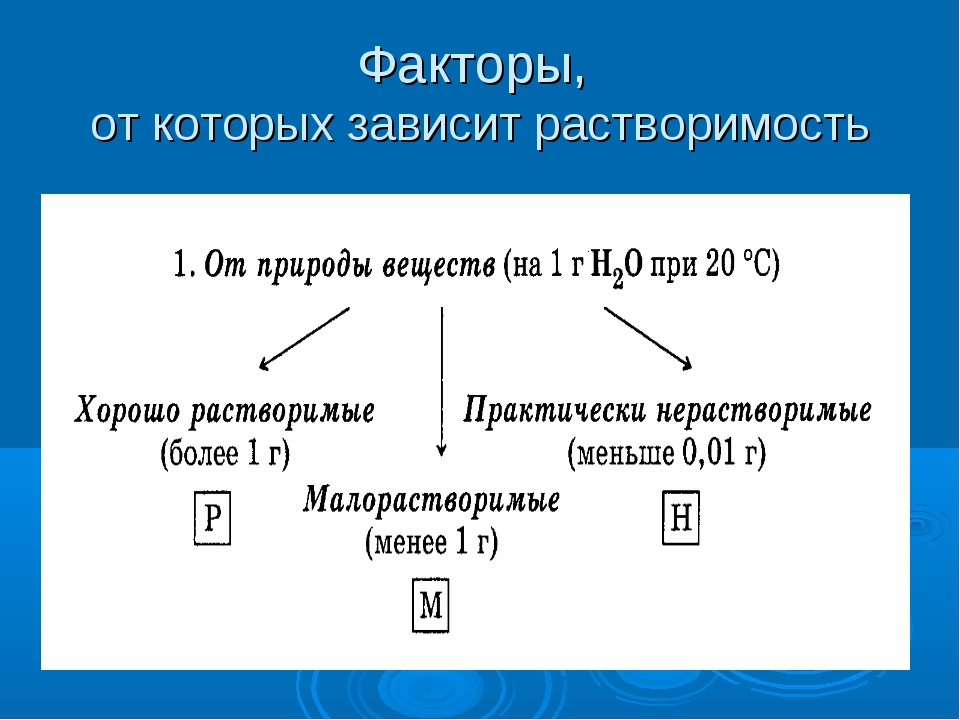
В случае обнаружения нерастворенных частиц навески испытания проводят с 10 мг растертого вещества, добавляя к нему 10 мл растворителя. В том случае, если оно растворилось полностью –вещество считается мало растворимым.
Если растворение прошло не полностью, берут 10 мг растертого вещества, прибавляют к нему 100 мл растворителя и снова проводят испытание, как описано в методике. Вещество полностью растворилось – оно очень мало растворимо.
Если не растворилось — считается, что вещество практически нерастворимо в этом растворителе.
Для веществ с известной растворимостью, проводят испытания по вышеизложенной методике, но только для крайних значений указанного термина растворимости. Например, если вещество растворимо, то 100 мг его не должно раствориться в 1 мл, но полностью растворяется в 3 мл растворителя.Литература.
Государственная Фармакопея Российской Федерации. ХII издание. Часть 1, Москва, 2007 г, с.92-93.
ХII издание. Часть 1, Москва, 2007 г, с.92-93.
Растворимость твердых веществ — Справочник химика 21
Изменение растворимости с температурой определяется знаком и величиной теплового эффекта растворения. Температурную зависимость растворимости твердых веществ часто выражают графически, в виде кривых растворимости (рис. 43). Растворимость нитрата рубидия и хлората калия при нагревании от О до 100° С увеличивается в несколько раз. Подобные изменения растворимости в соответствии с принципом Ле Шателье характерны для веществ, процесс растворения которых протекает с поглощением тепла. Для сульфата иттербия теплота гидратации преобладает над теплотой разрушения кристаллической решетки его растворение экзотермично, поэтому растворимость с ростом тем- [c.146]Идеальная растворимость твердых веществ [c.229]
Твердое вещество не может беспредельно растворяться в жидкостях по достижении некоторой концентрации, вполне определенной при данных температуре и давлении, твердое вещество перестает растворяться. Устанавливается равновесие между раствором и твердым веществом. Раствор, находящийся в равновесии с твердым веществом, называется насыщенным раствором, а его концентрация—растворимостью твердого вещества. [c.229]
Устанавливается равновесие между раствором и твердым веществом. Раствор, находящийся в равновесии с твердым веществом, называется насыщенным раствором, а его концентрация—растворимостью твердого вещества. [c.229]
Зависимость растворимости твердых веществ от давления [c.239]
Концентрация насыщенного раствора. Растворимость твердых веществ, как правило, растет с повышением температуры, тогда как растворимость газов при этом уменьшается. [c.81]
Растворимость твердых веществ [c.52]
Рассмотренные выше закономерности, относящиеся к растворимости твердых веществ в жидкости и понижению точки затвердевания растворов, имеют место в том случае, когда из раствора выделяются чистые твердые компоненты. Между тем нередко при охлаждении раствора выделяются твердые растворы—однородные кристаллические фазы переменного состава, состоящие из двух или нескольких компонентов. В этом случае давление пара компонента над твердым раствором (кривая Ьс на рис. VII, 5) меньше, чем над чистой твердой фазой (кривая ВС), и равновесие жидкого и твердого раствора осуществляется не при температуре Т , которой отвечает точка С, а при более высокой температуре Т , определяемой точкой с пересечения кривой D (давление пара над жидким раствором) с кривой Ьс. При этом температура может быть ниже Го—температуры затвердевания чистого растворителя (рис. VII, 5а) или выше ее (рис. VII, 56). [c.237]
VII, 5) меньше, чем над чистой твердой фазой (кривая ВС), и равновесие жидкого и твердого раствора осуществляется не при температуре Т , которой отвечает точка С, а при более высокой температуре Т , определяемой точкой с пересечения кривой D (давление пара над жидким раствором) с кривой Ьс. При этом температура может быть ниже Го—температуры затвердевания чистого растворителя (рис. VII, 5а) или выше ее (рис. VII, 56). [c.237]
Кристаллизация из растворов основана на ограниченной растворимости твердых веществ. Раствор, содержащий максимальное количество растворенного вещества в данном количестве растворителя при определенной температуре, называется насыщенным-, если раствор содержит большее количество растворенного вещества, то он является пересыщенным-, если же он содержит меньшее количество растворенного вещества, то называется ненасыщенным. Пересыщенные растворы неустойчивы из них выделяется избыточное количество растворенного вещества, т. е. происходит процесс кристаллизации.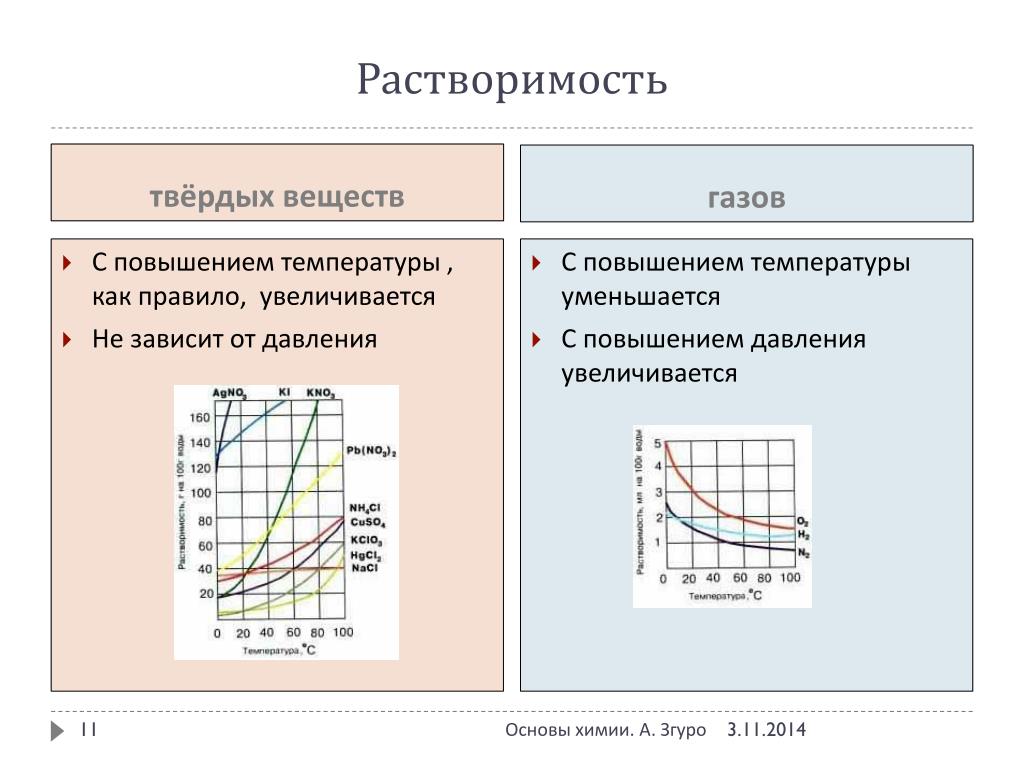 После выделения кристаллов раствор становится насыщенным. Этот насыщенный раствор, полученный в результате выделения кристаллов, называется маточным раствором, или маточником. Отделение маточного раствора от кристаллов производится центрифугированием и другими методами, рассмотренными в главе 8. [c.512]
После выделения кристаллов раствор становится насыщенным. Этот насыщенный раствор, полученный в результате выделения кристаллов, называется маточным раствором, или маточником. Отделение маточного раствора от кристаллов производится центрифугированием и другими методами, рассмотренными в главе 8. [c.512]
Используя тот же метод, который применялся для определения растворимости газа, можно получить выражение для растворимости твердых веществ, внешне идентичное уравнению (VII, 12) [c.229]
Здесь л —растворимость твердого вещества теплота растворения моля вещества в насыщенном растворе [см. уравнение (11,7), стр. 71]. [c.229]
Легко видеть, что, как и для газов, положительные отклонения от закона Рауля—Генри вызывают уменьшение растворимости твердого вещества, а отрицательные отклонения—увеличение ее. Общие же закономерности ограничиваются качественными обобщениями, охватывающими лишь отдельные классы растворов.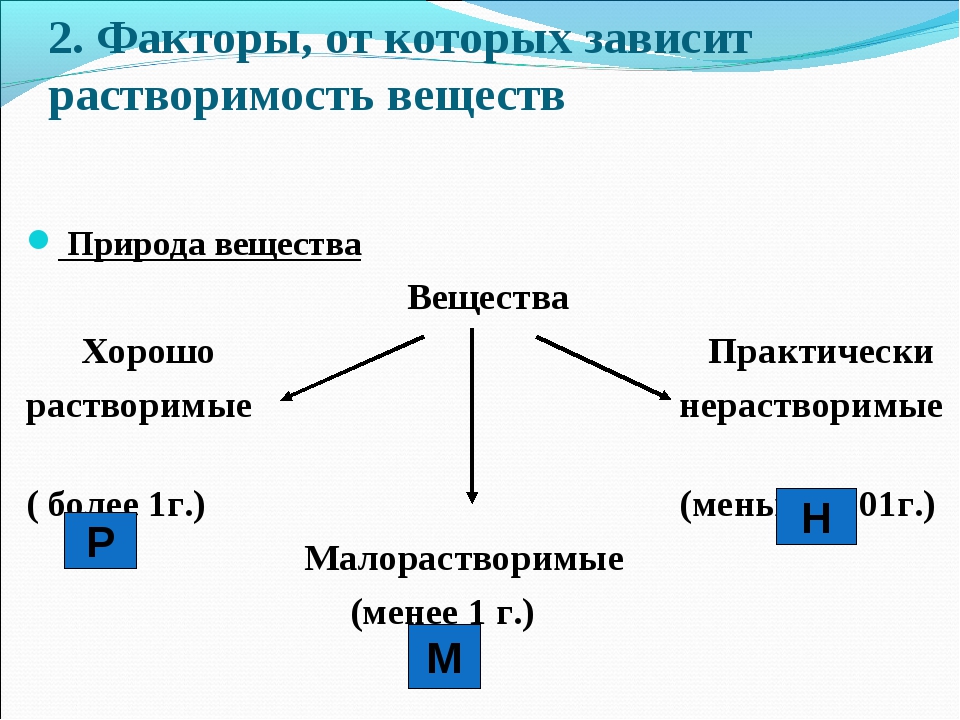 [c.232]
[c.232]
Зависимость растворимости твердых веществ ат давления 239 [c.239]
Используя уравнения (VII, 51а) и (VII,516), можно рассчитать растворимость твердого вещества в регулярном растворе. [c.251]
Растворимость вещества измеряется содержанием вещества в его насыщенном растворе. Обычно растворимость твердых веществ и жидкостей выражают значением коэффициента раство римости, т. е. массой вещества, растворяющегося при данны [c.109]
Теоретические основы. Процесс представляет собой одну из разновидностей процесса экстракции — экстрактивную кристаллизацию — и основан на разной растворимости твердых и жидких углеводородов в некоторых растворителях при низких температурах. Твердые углеводороды ограниченно растворяются в полярных и неполярных растворителях их растворимость -подчиняется общей теории растворимости твердых веществ в жидкостях и характеризуется следующими положениями [c. 223]
223]
Как мы уже видели, растворимость твердых веществ в воде уменьшается при понижении температуры. Поведение газов совершенно противоположно. Растворимость газов при понижении температуры возражает Поскольку содержание кислорода в воде весьма важно для водных живых организмов, рассмотрим влияние температуры в этом случае. [c.54]
Введение. Эта глава в основном посвящена рассмотрению растворимости твердых веществ в жидкостях и жидкостей в жидкостях. Процесс растворения в некоторой степени аналогичен процессу испарения. При растворении, как и при испарении, частицы данного вещества (молекулы, ионы) переходят в смежную фазу благодаря их тепловому движению. Термодинамически это означает, что влияние энтропийного фактора обычно преобладает в данных условиях над влиянием энергетического фактора. [c.329]
При растворении компонентов- нефтяного сырья в растворителях могут в той или иной степени проявляться все составляющие сил межмолекулярного взаимодействия. Очевидно, с повыщением температуры роль ориентационного взаимодействия и водородных связей снижается, роль дисперсионных сил возрастает. По способности растворять углеводороды органические и некоторые неорганические растворители можно разделить на две группы. К первой группе относятся растворители, при обычной температуре смешивающиеся с жидкими компонентами сырья практически во всех отношениях растворимость твердых компонентов в них подчиняется общей теории растворимости твердых веществ в жидких. Такими растворителями являются, например, неполярные соединения — низкомолекуляряые жидкие и сжиженные углеводороды парафинового ряда, а также соединения с очень небольшим дипольным моментом — четыреххлористый углерод, этиловый 5фир, хлороформ и т. д. [c.72]
Очевидно, с повыщением температуры роль ориентационного взаимодействия и водородных связей снижается, роль дисперсионных сил возрастает. По способности растворять углеводороды органические и некоторые неорганические растворители можно разделить на две группы. К первой группе относятся растворители, при обычной температуре смешивающиеся с жидкими компонентами сырья практически во всех отношениях растворимость твердых компонентов в них подчиняется общей теории растворимости твердых веществ в жидких. Такими растворителями являются, например, неполярные соединения — низкомолекуляряые жидкие и сжиженные углеводороды парафинового ряда, а также соединения с очень небольшим дипольным моментом — четыреххлористый углерод, этиловый 5фир, хлороформ и т. д. [c.72]
При работе с газовыми смесями состав смеси, выходящей из сосуда, отличается от состава исходной смеси вследствие неодинаковой растворимости компонентов газа в жидкости.
 Поэтому перед возвращением в сосуд газовой смеси в нее добавляют компоненты, необходимые для восстановления ее исходного состава. Об установлении равновесия судят по результатам анализа жидкой фазы. Особенно широкое применение получили динамические методы при определении растворимости твердых веществ, слабо растворимых в сжатых газах, так как позволяют отобрать на анализ любое количество газа. [c.28]
Поэтому перед возвращением в сосуд газовой смеси в нее добавляют компоненты, необходимые для восстановления ее исходного состава. Об установлении равновесия судят по результатам анализа жидкой фазы. Особенно широкое применение получили динамические методы при определении растворимости твердых веществ, слабо растворимых в сжатых газах, так как позволяют отобрать на анализ любое количество газа. [c.28]Пользуясь понятием идеальной растворимости твердых веществ, можно построить диаграмму плавкости идеальных систем теоретически, используя уравнение Шредера для вычисления растворимости твердых веществ [c.107]
Растворимость твердых веществ в жидко стях. В отличие от газов на растворимость твердых веществ давление значительно не сказывается (так как ДУр т 0). Его влияние становится ощутимым лишь при очень высоких давлениях. Например, лишь при давлениях порядка 10 Па растворимость нитрата аммония в воде снижается (ДУр > 0) почти вдвое. [c. 238]
238]
Растворимость твердых веществ в жидкостях можно характеризовать, рассматривая процессы кристаллизации веществ из жидких растворов. В этих процессах может играть существенную роль и взаимная растворимость веществ в кристаллическом состоянии. [c.338]
Причина различной растворимости твердых веществ в разных растворителях пока еще недостаточно выяснена. Твердые вещества растворяются лучше всего в растворителях, сходных с ними по химическому составу. Так, сера хорошо растворяется в сероуглероде, фосфор — в трихлориде фосфора, фенолы в воде, причем чем больше гидроксильных групп содержит в своем составе фенол, тем больше его растворимость в воде. [c.401]
А 1, Х-2 — мольные доли растворимого твердого вещества на поверхности раздела фаз в состоянии насыщения и в состоянии кристаллизации. [c.334]
Растворимость твердых веществ в воде и теплота кристаллизации [c.816]
Растворимость твердых веществ в растворах [c. 219]
219]
Линия Дюринга ограничивается растворимостью твердого вещества (насыщенный раствор). [c.222]
Растворимость твердого вещества, называемого в процессах кристаллизации солью , обычно увеличивается с повышением температуры. Кривая растворимости ограничена. Наиболее низкая температура соответствует состоянию, в котором замерзает растворитель (эвтектическая точка). Наиболее высокая температура соответствует плавлению чистой соли (когда кипение или критические явления не усложняют процесс). Если содержание соли в растворе выразить мольной или массовой долей, то получится система, изображенная на рис. У-24, а. [c.391]
Растворимость твердых веществ в жидкостях [c.91]
Согласно этому уравнению, логарифм растворимости твердого вещества является линейной функцией 1/Т и зависит только от природы растворяемого вещества. Из уравнения Шредера вытекают следующие правила, касающиеся растворимости твердых веществ [c. 20]
20]
Растворимость твердых веществ также определяется природой растворителя и растворенного вещества и также зависит от температуры. В отличие от растворимости газов растворимость твердых тел сравнительно мало изменяется с давлением . [c.91]
Растворимость твердых веществ в зависимости от температуры, г/100 г раствора [c.233]
Как изменяется растворимость твердых веществ в воде с изменением температуры Воспользуйтесь для ответа правилом Ле Шателье — Брауна. [c.64]
Растворимость твердых веществ в жидкостях……… [c.403]
Твердые углеводороды масляных фракций ограниченно растворяются в неполярных растворителях. Растворимость их подчиняется общим законам теории растворимости твердых веществ в жидкостях. Согласно этой теории, растворимость твердых углеводородов в неполярных растворителях, в том числе в жидких компонентах масляных фракций, уменьшается с повышением их концентрации и молекулярной массы, а также температуры кипения фракции. Растворимость твердых углеводородов увеличивается при повышении температуры, и при температуре плавления парафины и церезины, так же как и жидкие углеводороды, неограниченно растворяются в неполярных растворителях. Растворимость твердых углеводородов в масляных фракциях и неполярных растворителях, имеющая большое значение при выборе условий процессов депарафинизации рафинатов и обезмасливаиия гачей и петролатумов, может быть рассчитана по уравнению [2] [c.46]
Растворимость твердых углеводородов увеличивается при повышении температуры, и при температуре плавления парафины и церезины, так же как и жидкие углеводороды, неограниченно растворяются в неполярных растворителях. Растворимость твердых углеводородов в масляных фракциях и неполярных растворителях, имеющая большое значение при выборе условий процессов депарафинизации рафинатов и обезмасливаиия гачей и петролатумов, может быть рассчитана по уравнению [2] [c.46]
Процесс растворения идет самопроизвольно (АОсО) и раствор остается ненасыщенным. Когда энтальпийный и энтропийный факторы в уравнении (П. 10) станут одинаковыми, т. е. ДО = О, система окажется в состоянии истинного равновесия. Раствор становится насыщенным. В таком растворе неопределенно долго могут сосуществовать без каких-либо изменений раствор и избыток растворяемого вещества. Так как скорость, с которой молекулы, отрываясь от поверхности твердого тела (при наличии его избытка), переходят в раствор, равна скорости осаждения молекул растворенного вещества на той же поверхности, равновесное состояние может быть нарушено только в результате изменения температуры, давления или введения других веществ (см. ниже). Из изложенного следует, что растворимости твердых веществ способствует склонность к возрастанию неупорядоченности, а их кристаллизации — энергетический фактор, т. е. склонность к понижению потенциальной энергии. Равновесие соответствует концентрации, отвечающей уравновешиванию обоих процессов. Наоборот, растворимости газообразных веществ благоприятствует тенденция к уменьшению неупорядоченности. [c.138]
ниже). Из изложенного следует, что растворимости твердых веществ способствует склонность к возрастанию неупорядоченности, а их кристаллизации — энергетический фактор, т. е. склонность к понижению потенциальной энергии. Равновесие соответствует концентрации, отвечающей уравновешиванию обоих процессов. Наоборот, растворимости газообразных веществ благоприятствует тенденция к уменьшению неупорядоченности. [c.138]
Растворимость твердых веществ в жидкостях а вависимости от природы растворяемого вещества и растворителя может изменяться в очень широких пределах. Щ)вД( казвть растворимость какого-либо вещества по аналогии с растворимостью других веществ пока невозможно. Известно лишь, что неполярные вещества лучше расворяются в неполярных растворителях, как и полярные в полярных, чем неполярное вещество в полярном растворителе, или наоборот. [c.29]
Трибохимическое активирование химического процесса находит самое разнообразное применение, например для ускорения спекания, повышения растворимости твердых веществ и увеличения активности катализаторов. Напротив, необходимо замедлить трибохимические процессы разложения смазочных веществ в зазорах между трущимися поверхностями, а также вызываемую трением коррозию. [c.439]
Напротив, необходимо замедлить трибохимические процессы разложения смазочных веществ в зазорах между трущимися поверхностями, а также вызываемую трением коррозию. [c.439]
Растворимость большинства твердых тел с повышением температуры увеличивается. Однако бывают и исключения из этого правила. Так, растворимость СаСг04 и Са(0Н)2 в воде с повышением температуры уменьшается. Изменение растворимости тел от температуры зависит, как показывает опыт, от теплового эффекта растворения. Согласно принципу Ле Шателье растворимость вещества увеличивается с температурой, если процесс растворения данного вещества идет с поглощением теплоты. И наоборот, с повышением температуры уменьшается растворимость твердого вещества, если его растворение сопровождается выделением теплоты. [c.91]
Физическая и коллоидная химия (1988) — [ c.64 ]
Общая химия в формулах, определениях, схемах (1996) — [
c. 118
]
118
]
Общая химия в формулах, определениях, схемах (0) — [ c.118 ]
Общая химия в формулах, определениях, схемах (1985) — [ c.118 ]
Общая химия в формулах, определениях, схемах (0) — [ c.118 ]
Справочник Химия изд.2 (2000) — [ c.51 ]
Электрохимия растворов издание второе (1966) — [ c.18 , c.245 , c.246 ]
Общая и неорганическая химия (1981) — [ c.238 ]
Учебник общей химии 1963 (0) — [ c.7 ]
Неорганическая химия (1950) — [ c.55 ]
Техника лабораторных работ (1982) — [
c.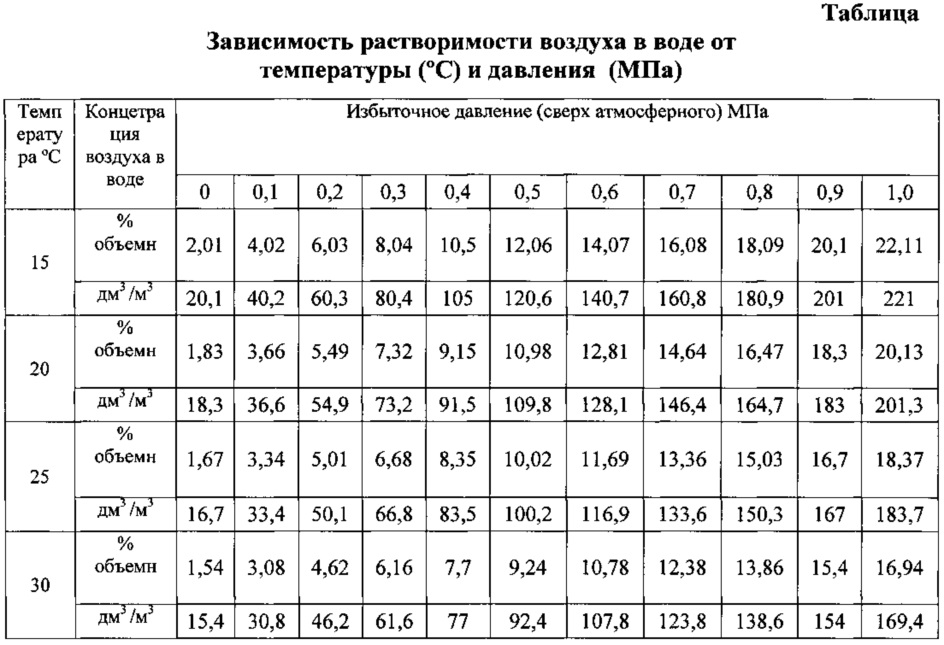 107
]
107
]
Курс физической химии Том 1 Издание 2 (1969) — [ c.215 ]
Курс физической химии Том 1 Издание 2 (копия) (1970) — [ c.215 ]
Процессы и аппараты химической технологии Издание 3 (1966) — [ c.816 ]
Курс физической химии Издание 3 (1975) — [ c.407 ]
Основы общей химии Том 2 Издание 3 (1973) — [ c.157 , c.163 ]
Общая химия Биофизическая химия изд 4 (2003) — [ c.56 ]
Процессы и аппараты химической технологии Издание 5 (0) — [ c.816 ]
Растворимость | CHEMEGE.RU
Растворимость (Р, χ или ks) – это характеристика насыщенного раствора, которая показывает, какая масса растворенного вещества может максимально раствориться в 100 г растворителя. Размерность растворимости — г/ 100 г воды. Поскольку мы определяем массу соли, которая приходится на 100 г воды, в формулу растворимости добавляем множитель 100:
Размерность растворимости — г/ 100 г воды. Поскольку мы определяем массу соли, которая приходится на 100 г воды, в формулу растворимости добавляем множитель 100:
здесь mр.в. – масса растворенного вещества, г
mр-ля – масса растворителя, г
Иногда используют обозначение коэффициент растворимости kS.
Задачи на растворимость, как правило, вызывают сложности, так как эта физическая величина для школьников не очень привычна.
Растворимость веществ в различных растворителях меняется в широких пределах.
В таблице приведена растворимость некоторых веществ в воде при 20oС:
|
Вещество |
Растворимость, г на 100 г H2O |
Вещество |
Растворимость, г на 100 г H2O |
|
NH4NO3 |
177 |
H3BO3 |
6 |
|
NaCl |
36 |
CaCO3 |
0,0006 |
|
NaHCO3 |
10 |
AgI |
0,0000002 |
От чего же зависит растворимость веществ? От ряда факторов: от природы растворенного вещества и растворителя, от температуры и давления. В справочных таблицах предлагается вещества делят на хорошо растворимые, малорастворимые и нерастворимые. Такое деление очень условное, поскольку абсолютно нерастворимых веществ нет. Даже серебро и золото растворимы в воде, однако их растворимость настолько мала, что можно пренебречь ей.
В справочных таблицах предлагается вещества делят на хорошо растворимые, малорастворимые и нерастворимые. Такое деление очень условное, поскольку абсолютно нерастворимых веществ нет. Даже серебро и золото растворимы в воде, однако их растворимость настолько мала, что можно пренебречь ей.
Зависимость растворимости от природы растворенного вещества и растворителя*
Растворимость твердых веществ в жидкостях зависит от структуры твердого вещества (от типа кристаллической решетки твердого вещества). Например, вещества с металлическими кристаллическими решетками (железо, медь и др.) очень мало растворимы в воде. Вещества с ионной кристаллической решеткой, как правило, хорошо растворимы в воде.
Есть замечательное правило: “подобное хорошо растворяется в подобном”. Вещества с ионным или полярным типом связи хорошо растворяются в полярных растворителях. Например, соли хорошо растворимы в воде. В то же время неполярные вещества, как правило, хорошо растворяются в неполярных растворителях.
В то же время неполярные вещества, как правило, хорошо растворяются в неполярных растворителях.
Большинство солей щелочных металлов и аммония хорошо растворимы в воде. Хорошо растворимы почти все нитраты, нитриты и многие галогениды (кроме галогенидов серебра, ртути, свинца и таллия) и сульфаты (кроме сульфатов щелочноземельных металлов, серебра и свинца). Для переходных металлов характерна небольшая растворимость их сульфидов, фосфатов, карбонатов и некоторых других солей.
Растворимость газов в жидкостях также зависит от их природы. Например, в 100 объемах воды при 20oС растворяется 2 объема водорода, 3 объема кислорода. В тех же условиях в 1 объеме Н2О растворяется 700 объемов аммиака.
Влияние температуры на растворимость газов, твердых веществ и жидкостей*
Растворение газов в воде вследствие гидратации молекул растворяемого газа сопровождается выделением теплоты. Поэтому при повышении температуры растворимость газов понижается.
Поэтому при повышении температуры растворимость газов понижается.
Температура различным образом влияет на растворимость твердых веществ в воде. В большинстве случаев растворимость твердых веществ возрастает с повышением температуры. Например, растворимость нитрата натрия NaNO3 и нитрата калия КNO3 при нагревании увеличивается (процесс растворения протекает с поглощением теплоты). Растворимость NaCl при увеличении температуры возрастает незначительно, что связано с почти нулевым тепловым эффектом растворения поваренной соли.
Влияние давления на растворимость газов, твердых веществ и жидкостей*
На растворимость твердых и жидких веществ в жидкостях давление практически не оказывает влияния, так как изменение объема при растворении невелико. При растворении газообразных веществ в жидкости происходит уменьшение объема системы, поэтому повышение давления приводит к увеличению растворимости газов. В общем виде зависимость растворимости газов от давления подчиняется закону У. Генри (Англия, 1803 г.): растворимость газа при постоянной температуре прямо пропорциональна его давлению над жидкостью.
В общем виде зависимость растворимости газов от давления подчиняется закону У. Генри (Англия, 1803 г.): растворимость газа при постоянной температуре прямо пропорциональна его давлению над жидкостью.
Закон Генри справедлив лишь при небольших давлениях для газов, растворимость которых сравнительно невелика и при условии отсутствия химического взаимодействия между молекулами растворяемого газа и растворителем.
Влияние посторонних веществ на растворимость*
В присутствии в воде других веществ (солей, кислот и щелочей) растворимость газов уменьшается. Растворимость газообразного хлора в насыщенном водном растворе поваренной соли в 10 раз меньше. Чем в чистой воде.
Эффект понижения растворимости в присутствии солей называется высаливанием. Понижение растворимости обусловлено гидратацией солей, что вызывает уменьшение числа свободных молекул воды. Молекулы воды, связанные с ионами электролита, уже не являются растворителем для других веществ.
Примеры задач на растворимость
Задача 1. Массовая доля вещества в насыщенном растворе равна 24% при некоторой температуре. Определите коэффициент растворимости этого вещества при данной температуре.
Решение:
Для определения растворимости вещества примем массу раствора равной 100 г. Тогда масса соли равна:
mр.в. = mр-ра⋅ωр.в. = 100⋅0,24 = 24 г
Масса воды равна:
mводы = mр-ра – mр.в. = 100 — 24 = 76 г
Определяем растворимость:
χ = mр.в./mр-ля⋅100 = 24/76⋅100 = 31,6 г вещества на 100 г воды.
Ответ: χ = 31,6 г
Еще несколько аналогичных задач:
2. Массовая доля соли в насыщенном растворе при некоторой температуре равна 28,5%. Определите коэффициент растворимости вещества при этой температуре.
3. Определите коэффициент растворимости нитрата калия при некоторой температуре, если массовая доля соли при этой температуре равна 0,48.
4. Какая масса воды и соли потребуется для приготовления 500г насыщенного при некоторой температуре раствора нитрата калия, если его коэффициент растворимости при этой температуре равен 63,9г соли в 100г воды?
Ответ: 194,95 г
5. Коэффициент растворимости хлорида натрия при некоторой температуре составляет 36г соли в 100г воды. Определите молярную концентрацию насыщенного раствора этой соли, если плотность раствора 1,2 г/мл.
Ответ: 5,49М
6. Какая масса соли и 5% раствора её потребуется для приготовления 450г насыщенного при некоторой температуре раствора сульфата калия, если его коэффициент растворимости при этой температуре равен 439г/1000г воды?
7. Какая масса нитрата бария выделится из раствора, насыщенного при 100ºС и охлаждённого до 0ºС, если во взятом растворе было 150мл воды? Коэффициент растворимости нитрата бария при температурах 0ºС и 100ºС равен соответственно 50г и 342г в 100г воды.
8. Коэффициент растворимости хлорида калия при 90ºС равен 500г/л воды. Сколько граммов этого вещества можно растворить в 500г воды при 90ºС и какова его массовая доля в насыщенном растворе при этой температуре?
9. В 500г воды растворено при нагревании 300г хлорида аммония. Какая масса хлорида аммония выделится из раствора при его охлаждении до 50ºС, если коэффициент растворимости соли при этой температуре равен 50г/л воды?
* Материалы портала onx.distant.ru
Растворимость газов в воде ⇆ Растворенные газы в воде
Растворимость газов в воде. Растворенные газы в воде и их коэффициенты растворимости.
Нам известно, что многие газы могут растворяться в воде. К примеру, рыбы, как и множество других водных обитателей, дышат растворенным в воде кислородом. Морские водоросли особенно активно разрастаются в прибрежных зонах, насыщенных растворенным в воде углекислым газом, который необходим для протекания фотосинтеза. Взгляните на газы, растворимые в воде. В таблице приведен коэффициент рсрастворимости Растворенный в воде газ присутствует в жизни практически какждого из нас, ведь сложно найти человека, который откажется от охлажденного газированного напитка, в котором любезно растворили CO2. Подобных глобальных примеров растворения газа в воде очень много, как и газов, которые немедленно начнут растворятся в воде при контакте с ней.
Взгляните на газы, растворимые в воде. В таблице приведен коэффициент рсрастворимости Растворенный в воде газ присутствует в жизни практически какждого из нас, ведь сложно найти человека, который откажется от охлажденного газированного напитка, в котором любезно растворили CO2. Подобных глобальных примеров растворения газа в воде очень много, как и газов, которые немедленно начнут растворятся в воде при контакте с ней.
Таблица №1 «Коэффициенты растворимости газов в воде»
В данной таблице приводятся коэффициенты растворимости (в литрах газа на литр воды) Числовое значение коэффициента выражает степень растворимости определенного газа в воде при давлении 1 бар (0,1 МПа)и температуре 20 °C. и является основным критерием оценки растворимости. |
Растворимость – это такой баланс, при котором количество растворенного газа пропорционально парциальному давлению в газообразной фазе над поверхностью воды. Если нам известно атмосферное давление и соответствующая концентрация газа, то можно вычислить максимальную концентрацию растворенного в воде газа, умножив значение парциального давления газа на расчетный коэффициент растворимости из таблици №1.
Если нам известно атмосферное давление и соответствующая концентрация газа, то можно вычислить максимальную концентрацию растворенного в воде газа, умножив значение парциального давления газа на расчетный коэффициент растворимости из таблици №1.
Пример №1 «Колличественная оценка содержания кислорода и азота, растворенных в воде»:
Классический пример, когда атмосферный воздух вступает с водой в реакцию, сопровождающуюся растворением основных его компоенетов.
1. Подсчитываем кислород O2: концентрация 20.9 объемн. % кислорода с атмосферным давлением 1000 мбар (750 мм. ртутного столба) создают парциальное давление 0.209 бар (0.0209 МПа), таким образом, получаем числовое значение:
0.031 x 0.209 = 0.00648 литра или 6.5 мл кислорода O2 растворены в 1 литре воды.
2. Подсчитываем азот N2: при создаваемом парциальном давление 0.791 бар N2) азот растворяется хуже кислорода, выражение:
Подсчитываем азот N2: при создаваемом парциальном давление 0.791 бар N2) азот растворяется хуже кислорода, выражение:
0.016 x 0.791 = 0.01266 л или 12.7 мл. азота N2 содеожится в 1 л. воды.
Мы только что получили данные по составу и насущению кислродом большиснва пресных водемво и рек россиии.
Пример №2 «Расчет содержания растворенного углекислого газа в газированной воде»:
Газировка производится посредством растворения в воде CO2 под давлением около 2 бара (0,2 МПа). Этих данных достаточно, что бы вычислить содержание CO2 в заданной жидкости, принятой за минеральную воду.
0.879 x 2 = 1.75 л CO2 растворенны в 1 литре газированной воды.
Как вы могли заметить, из таблицы и примеров, некоторые газы растворяются в воде очень быстро и эффективно.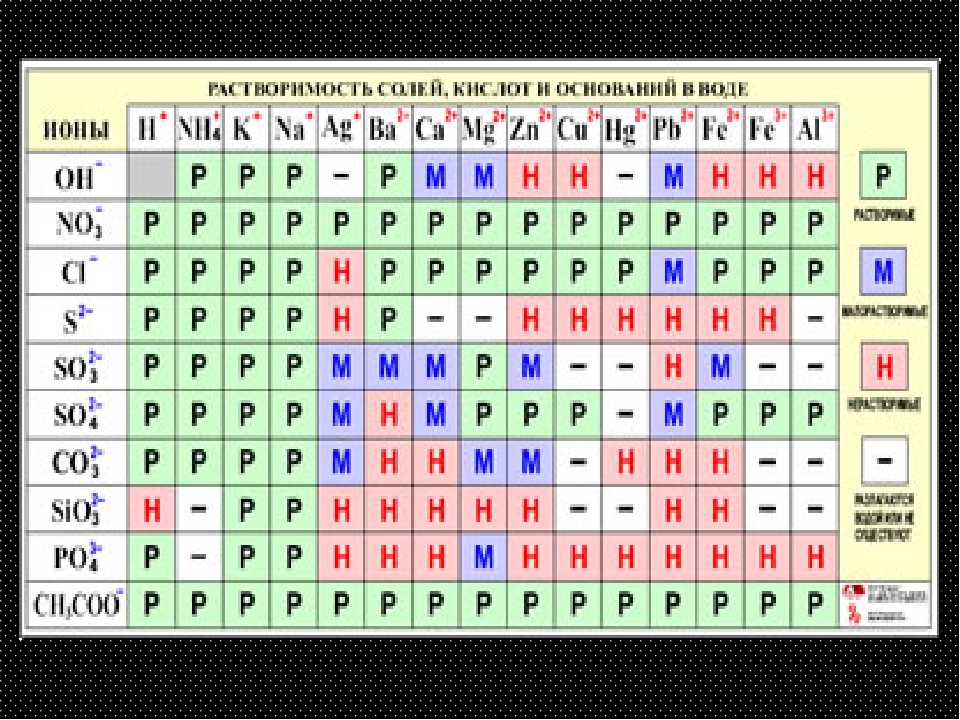 Именно поэтому в качестве мер безопасности широко распространено использование водяных распылителей, создание “водяных завес”, например, для снижения угрозы здоровью при выбросах значительных объемов аммиака, HCl и других токсичных газов.
Именно поэтому в качестве мер безопасности широко распространено использование водяных распылителей, создание “водяных завес”, например, для снижения угрозы здоровью при выбросах значительных объемов аммиака, HCl и других токсичных газов.
Помните, что растворимость во многом зависит от температуры. Чем выше температура воды, тем меньше газа можно в ней растворить. По этой причине для растворения загрязняющих газов в воздухе их пропускают сквозь холодную техническую воду, Нагревание такого раствора с газами, сопровождается десорбцией и высвобождением всех растворенных газообразных компонентов до полного испарения основы (воды).Обладая подобной информацией, проектировщики систем безопасности выбирают наиболее подходящие для комплектации модели приборов, обозначая на схеме их предварительные места установки и требуемое количество.
Отсюда вывод: избегайте условий образования конденсата при монтаже датчиков! Влага внутри прибора коварна даже в небольших малозметных колличествах.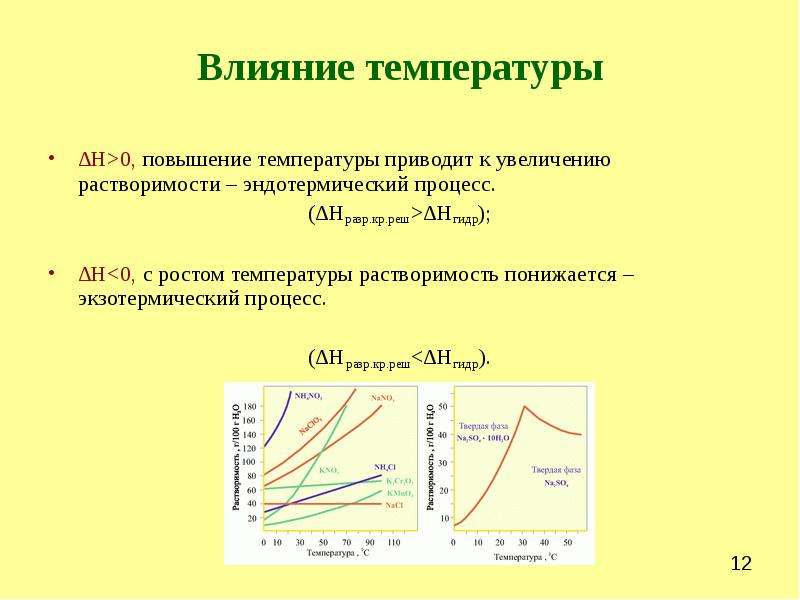 Применяйте специальные аксессуары и опции для дополнительной защиты газоанализатора от внешних воздействий — брызгозащитные комлекты, антибликовые козырьки, термокожухи, модули защиты от насекомых и т.д.
Применяйте специальные аксессуары и опции для дополнительной защиты газоанализатора от внешних воздействий — брызгозащитные комлекты, антибликовые козырьки, термокожухи, модули защиты от насекомых и т.д.
от каких факторов и как зависит растворимость в воде
Растворимость S – концентрация компонента в насыщенном раствореФакторы, влияющие на растворимость веществ в жидком состоянии.
1) Природа смешиваемых веществ.
В веществах с полярными молекулами (особенно с водородными связями) и в ионных веществах существует сильное взаимное притяжение частиц. Поэтому такие вещества не будут легко дробиться (смешиваться с другими) , если в растворе не будет сильного притяжения между частицами разных веществ.
Вещества с ионной связью или с полярными молекулами должны гораздо лучше растворяться в полярных или ионных растворителях, чем в растворителях с неполярными молекулами. Соответственно, вещества с неполярными молекулами лучше растворяются в неполярных растворителях и хуже — в полярных, а металлы — в металлах.
Не надо путать полярные связи и полярные молекулы. Например, если на одежде жирное пятно, его лучше смывать не водой, а бензином, а если пятно от соли или сахара — то лучше водой, а не бензином.
Точно так же в металлургии: металлы в жидком состоянии обычно хорошо растворяют друг друга и плохо растворяют вещества с ионной связью (собственные оксиды, фосфаты, силикаты, фториды) , которые образуют отдельную жидкую фазу — шлак.
2) Температура.
Здесь, как и в любых других равновесиях, действует принцип Ле Шателье. При нагревании растворимость возрастает, если DраствH > 0 (и тем круче, чем больше DH), и убывает, если DраствH < 0.
Для твердых веществ более характерно первое, а для газов — второе, хотя бывает и наоборот. Это особенно наглядно в случае солей, образующих кристаллогидраты. При растворении кристаллогидрата в воде не может быть сильной гидратации, поскольку вещество уже гидратировано. Поэтому преобладает первое слагаемое, и DраствH > 0. Если мы берем ту же соль в безводном виде, но знаем, что она способна давать кристаллогидрат, то можно ожидать, что у нее преобладает второе слагаемое, и DраствH < 0. Поэтому графики зависимости растворимости от температуры у кристаллогидрата и безводной соли часто имеют противоположный наклон.
Поэтому графики зависимости растворимости от температуры у кристаллогидрата и безводной соли часто имеют противоположный наклон.
3) Давление.
Давление влияет в основном на процессы с участием газов. Зависимость растворимости газов от давления видел всякий, кто открывал бутылку лимонада, пива или шампанского. Внутри бутылки повышенное давление, и углекислый газ находится в растворе. При открывании давление падает, газ смешивается с воздухом, и парциальное давление CO2 падает еще сильнее. Раствор становится пересыщенным, и из него выделяются пузырьки газа.
4) Присутствие третьего вещества.
Его влияние может быть разнообразно.
а) это вещество сильно сольватируется, связывает много молекул растворителя и этим уменьшает растворимость; пример: спирт по отношению к растворам солей;
б) это вещество связывает молекулы или ионы растворяемого вещества и этим повышает растворимость; пример: аммиак, связывающий ионы меди и повышающий растворимость Cu(OH)2;
в) это вещество дает ионы, одноименные с ионами растворяемого вещества, и тем смещает равновесие растворения влево; пример: в насыщенном растворе CaSO4 существует равновесие CaSO4 (тв) = Ca2+(р-р) + SO42- (р-р) . Добавляя крепкий раствор хлорида кальция, мы увеличиваем концентрацию ионов кальция, и часть сульфата выпадает.
Добавляя крепкий раствор хлорида кальция, мы увеличиваем концентрацию ионов кальция, и часть сульфата выпадает.
Какова растворимость газов в воде? — FAQ
Нам известно, что газы могут растворяться в воде. Рыбы дышат растворенным в воде кислородом, морским водорослям растворенный в воде углекислый газ необходим для реакции фотосинтеза – а нам нравится, когда в напитках присутствует шипучий CO2. В данной таблице приводятся коэффициенты растворимости (в литрах газа на литр вода при давлении 1 бар и температуре 20 °C), которые являются критерием растворимости отдельных газов в воде:
| ГАЗ | КОЭФФ.РАСТВОРИМОСТИ |
| Метиламин | 757 |
| Аммиак | 685 |
| Бромистый водород | 532 |
| Хлористый водород | 448 |
| Метилхлорид | 317 |
| Триметиламин | 180 |
| Диметиламин | 118 |
| Диоксид серы | 39 |
| Диметилэфир | 35 |
| Метилмеркаптан | 11 |
| Метилвинилэфир | 3,86 |
| Сероводород | 2,59 |
| Хлор | 2,26 |
| Этиленоксид | 1,89 |
| Винилхлорид | 1,07 |
| Ацетилен | 1,04 |
| Диоксид углерода | 0,879 |
| Динитроген моноксид | 0,665 |
| Арсин | 0,23 |
| Пропилен | 0,23 |
| 1,3-Бутадиен | 0,202 |
| Этилен | 0,119 |
| Оксид азота | 0,048 |
| Этан | 0,043 |
| Пропан | 0,039 |
| Аргон | 0,034 |
| n-Бутан | 0,034 |
| Метан | 0,033 |
| i-Бутан | 0,033 |
| Кислород | 0,031 |
| Оксид углерода | 0,023 |
| Водород | 0,018 |
| Азот | 0,016 |
| Гелий | 0,0083 |
| Гексафторид серы | 0,0056 |
| Тетрафторметан | 0,0038 |
Растворимость – это такой баланс, при котором количество растворенного газа пропорционально парциальному давлению в газообразной фазе над поверхностью воды. Если нам известно атмосферное давление и соответствующая концентрация газа, то можно вычислить максимальную концентрацию растворенного в воде газа, умножив значение парциального давления газа на указанный в таблице коэффициент растворимости:
Если нам известно атмосферное давление и соответствующая концентрация газа, то можно вычислить максимальную концентрацию растворенного в воде газа, умножив значение парциального давления газа на указанный в таблице коэффициент растворимости:
20.9 об. % кислорода с атмосферным давлением 1000 мбар создают парциальное давление 0.209 бар O2, таким образом, 1 литр воды содержит 0.031 ∗ 0.209 = 0.00648 литра или 6.5 мл кислорода. Азот (парциальное давление 0.791 бар N2) растворяется хуже, 1 л воды содержит 0.016 ∗ 0.791 = 0.01266 л или 12.7 мл азота. В воде у нас 34 об. % кислорода. Рыбы этим довольны.
Газированная вода производится посредством растворением в воде CO2 под давлением 2 бара. Можно вычислить содержание CO2, оно составляет 0.879 ∗ 2 = 1.75 л CO2, растворенных в 1 л воды.
Как вы видите, некоторые газы растворяются в воде очень быстро и очень эффективно. Именно поэтому в качестве мер безопасности широко распространено использование водяных распылителей и “водяных завес”, например, для снижения угрозы здоровью при выбросах значительных объемов аммиака или HCl.
Помните, что растворимость зависит от температуры. Чем выше температура воды, тем меньше газа можно в ней растворить. По этой причине для растворения загрязняющих газов в воздухе их пропускают сквозь холодную воду, тогда как при нагревании происходит десорбция и высвобождение растворенных в воде газов (часто этому способствует падение давления).
Тонкий слой водяного конденсата на входном отверстии электрохимического сенсора может создать определенные проблемы, растворяя, например, h3S или Nh4, в результате этого уменьшаются показания сенсора.
Отсюда вывод: избегайте образования конденсата!
Растворимость | Введение в химию
Цель обучения
- Распознавать различные ионы, которые заставляют соль обычно быть растворимой / нерастворимой в воде.
Ключевые моменты
- Растворимость — это относительная способность растворенного вещества растворяться в растворителе.
- Несколько факторов влияют на растворимость данного растворенного вещества в данном растворителе. Температура часто играет самую большую роль, хотя давление может иметь значительное влияние на газы.
- Чтобы предсказать, будет ли соединение растворимо в данном растворителе, запомните поговорку: «Подобное растворяется в подобном». Высокополярные ионные соединения, такие как соль, легко растворяются в полярной воде, но не растворяются в неполярных растворах, таких как бензол или хлороформ.
Условия
- растворенное вещество: соединение, которое растворяется в растворе (может быть твердым, жидким или газообразным)
- растворимость: относительная способность растворенного вещества растворяться в растворителе .
- растворитель: соединение (обычно жидкость), растворяющее растворенное вещество .
Определение растворимости
Растворимость — это способность твердого, жидкого или газообразного химического вещества (называемого растворенным веществом ) растворяться в растворителе (обычно в жидкости) и образовывать раствор .Растворимость вещества в основном зависит от используемого растворителя, а также от температуры и давления. Растворимость вещества в конкретном растворителе измеряется концентрацией насыщенного раствора. Раствор считается насыщенным, если добавление дополнительного растворенного вещества больше не увеличивает концентрацию раствора.
Степень растворимости широко варьируется в зависимости от веществ, от бесконечно растворимых (полностью смешиваемых), таких как этанол в воде, до плохо растворимых, таких как хлорид серебра в воде.Термин «нерастворимый» часто применяется к плохо растворимым соединениям. При определенных условиях равновесная растворимость может быть превышена, давая перенасыщенный раствор.
Растворимость не зависит от размера частиц; по прошествии достаточного времени даже крупные частицы со временем растворятся.
Факторы, влияющие на растворимость
Температура
Растворимость данного растворенного вещества в данном растворителе обычно зависит от температуры. Для многих твердых веществ, растворенных в жидкой воде, растворимость имеет тенденцию соответствовать повышению температуры.По мере того, как молекулы воды нагреваются, они вибрируют быстрее и могут лучше взаимодействовать с растворенным веществом и разрушать его.
Зависимость растворимости различных веществ от изменения температуры Для большинства веществ растворимость увеличивается с температурой; например, в горячей воде растворяется больше сахара, чем в холодной.Растворимость газов показывает обратную зависимость от температуры; то есть с повышением температуры растворимость газа имеет тенденцию к снижению. В диаграмме растворимости vs.Обратите внимание на то, как растворимость имеет тенденцию увеличиваться с повышением температуры для солей и уменьшаться с повышением температуры для газов.
Давление
Давление незначительно влияет на растворимость твердых и жидких растворенных веществ, но сильно влияет на растворы с газообразными растворенными веществами. Это становится очевидным каждый раз, когда вы открываете банку с содовой; Шипение из банки происходит из-за того, что ее содержимое находится под давлением, что гарантирует, что сода останется газированной (то есть углекислый газ остается растворенным в растворе).Вывод из этого состоит в том, что растворимость газов имеет тенденцию коррелировать с увеличением давления.
Полярность
Популярная поговорка, используемая для предсказания растворимости: «Подобное растворяется в подобном». Это утверждение указывает на то, что растворенное вещество лучше всего растворяется в растворителе, имеющем аналогичную химическую структуру; способность растворителя растворять различные соединения зависит в первую очередь от его полярности. Например, полярное растворенное вещество, такое как сахар, хорошо растворяется в полярной воде, менее растворяется в умеренно полярном метаноле и практически не растворяется в неполярных растворителях, таких как бензол.Напротив, неполярное растворенное вещество, такое как нафталин, нерастворимо в воде, умеренно растворимо в метаноле и хорошо растворимо в бензоле.
График растворимости
График растворимости показывает растворимость многих солей. Соли щелочных металлов (и аммония), а также соли нитрата и ацетата всегда растворимы. Карбонаты, гидроксиды, сульфаты, фосфаты и соли тяжелых металлов часто нерастворимы.
График растворимости Растворимость солей, образованных из катионов слева и анионов вверху, обозначается как: растворимые (S), нерастворимые (I) или малорастворимые (sS). Растворимость Растворимость растворенных солей и газов в жидком растворителе. Показать источникиBoundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
факторов, влияющих на растворимость | Безграничная химия
Растворимость в твердом состоянии и температура
Растворимость часто зависит от температуры; растворимость многих веществ увеличивается с повышением температуры.
Цели обучения
Напомним зависимость между растворимостью и температурой
Ключевые выводы
Ключевые моменты
- Для многих твердых веществ, растворенных в жидкой воде, растворимость увеличивается с температурой.
- Увеличение кинетической энергии, которое происходит с более высокими температурами, позволяет молекулам растворителя более эффективно разрушать молекулы растворенных веществ, которые удерживаются вместе за счет межмолекулярного притяжения.
- Повышенная вибрация (кинетическая энергия) молекул растворенного вещества заставляет их легче растворяться, потому что они менее способны удерживаться вместе.
Ключевые термины
- растворимость : Количество вещества, которое будет растворяться в данном количестве растворителя с образованием насыщенного раствора при определенных условиях.
- кинетическая энергия : энергия, которой обладает объект из-за его движения, равная половине массы тела, умноженной на квадрат его скорости.
Растворимость в твердом состоянии и температура
Растворимость данного растворенного вещества в данном растворителе обычно зависит от температуры.Растворимость многих солей сильно увеличивается с температурой. Некоторые растворенные вещества обладают растворимостью, которая практически не зависит от температуры. Некоторые из них, такие как сульфат церия (III), становятся менее растворимыми в воде при повышении температуры. Эту температурную зависимость иногда называют ретроградной или обратной растворимостью, и она существует, когда растворение соли является экзотермическим; это можно объяснить тем, что, согласно принципу Ле Шателье, дополнительное тепло вызовет смещение равновесия экзотермического процесса в сторону реагентов.
Зависимость растворимости от температуры : Эта диаграмма показывает растворимость различных веществ в воде при различных температурах (в градусах Цельсия). Обратите внимание на то, что растворимость NaCl относительно постоянна независимо от температуры, тогда как растворимость Na2SO4 экспоненциально возрастает при температуре выше 0–35 градусов Цельсия, а затем резко начинает уменьшаться.
Теоретическая перспектива
При повышении температуры раствора средняя кинетическая энергия молекул, составляющих раствор, также увеличивается.Это увеличение кинетической энергии позволяет молекулам растворителя более эффективно разрушать молекулы растворенных веществ, которые удерживаются вместе за счет межмолекулярного притяжения.
Средняя кинетическая энергия молекул растворенного вещества также увеличивается с температурой, что дестабилизирует твердое состояние. Повышенная вибрация (кинетическая энергия) молекул растворенного вещества снижает их способность удерживаться вместе, и поэтому они легче растворяются.
Применение в перекристаллизации
Полезное применение растворимости — перекристаллизация.Во время перекристаллизации нечистое вещество поглощается объемом растворителя при температуре, при которой оно нерастворимо, а затем нагревается до тех пор, пока оно не станет растворимым. Примеси также растворяются, но при охлаждении раствора часто можно избирательно кристаллизовать или осаждать желаемое вещество в более чистой форме.
Растворимость газа и температура
Растворимость газа в воде имеет тенденцию к снижению с повышением температуры, а растворимость газа в органическом растворителе имеет тенденцию к увеличению с повышением температуры.
Цели обучения
Напомним зависимость между растворимостью газа и температурой
Ключевые выводы
Ключевые моменты
- Растворимые в воде газы становятся менее растворимыми с повышением температуры.
- Газы, растворенные в органических растворителях, становятся более растворимыми с повышением температуры.
- Растворенный в воде кислород важен для выживания рыб, поэтому повышение температуры (и, следовательно, уменьшение растворенного кислорода в воде) может вызвать проблемы для рыб.
Ключевые термины
- растворимость : Количество вещества, которое будет растворяться в данном количестве растворителя с образованием насыщенного раствора при определенных условиях.
Несколько факторов влияют на растворимость газов: одним из этих факторов является температура. В общем, растворимость газа в воде будет уменьшаться с повышением температуры: более холодная вода может иметь больше растворенного в ней газа.
Растворимость газов в воде : Метан, кислород, окись углерода, азот и гелий имеют разную растворимость в воде, но все они становятся менее растворимыми с повышением температуры.
Последствия температурной зависимости растворимости газа
Когда температура реки, озера или ручья повышается до аномально высокой, обычно из-за сброса горячей воды в результате какого-либо промышленного процесса, растворимость кислорода в воде снижается.
Поскольку рыбы и другие организмы, обитающие в естественных водоемах, могут быть чувствительны к концентрации кислорода в воде, снижение уровня растворенного кислорода может иметь серьезные последствия для здоровья водных экосистем.В тяжелых случаях перепады температуры могут привести к крупномасштабной гибели рыбы.
Растворимость газа в органических растворителях
Тенденция уменьшения растворимости газа с повышением температуры сохраняется не во всех случаях. Хотя в целом это верно для газов, растворенных в воде, газы, растворенные в органических растворителях, имеют тенденцию становиться более растворимыми с повышением температуры.
Существует несколько молекулярных причин изменения растворимости газов с повышением температуры, поэтому не существует единой тенденции, независимой от газа и растворителя, в зависимости от того, станут ли газы более или менее растворимыми при повышении температуры.
Растворимость и давление
Повышение давления увеличивает растворимость газа в растворителе.
Цели обучения
Распознавать взаимосвязь между давлением и растворимостью газа
Ключевые выводы
Ключевые моменты
- Для конденсированных фаз (твердых и жидких) зависимость растворимости от давления обычно слабая и на практике ею обычно пренебрегают.
- Уильям Генри, английский химик, показал, что растворимость газа увеличивается с увеличением давления.
- Увеличение растворимости в зависимости от давления будет зависеть от того, какой газ растворяется, и должно определяться экспериментально для каждого газа.
Ключевые термины
- растворимость : Количество вещества, которое будет растворяться в данном количестве растворителя с образованием насыщенного раствора при определенных условиях.
- равновесие : Состояние реакции, в котором скорости прямой и обратной реакций одинаковы.
- Закон Генри : гласит, что растворимость газа в жидкости прямо пропорциональна парциальному давлению газа над жидкостью.
Влияние давления на растворимость
Для твердых веществ и жидкостей, известных как конденсированные фазы, зависимость растворимости от давления обычно слабая, и на практике ею обычно пренебрегают. Однако растворимость газов значительно варьируется в зависимости от давления. Обычно растворимость газа увеличивается с увеличением давления.Этот эффект можно математически описать с помощью уравнения, называемого законом Генри.
Закон Генри
Когда газ растворяется в жидкости, давление оказывает важное влияние на растворимость. Уильям Генри, английский химик, показал, что растворимость газа увеличивается с увеличением давления. Он обнаружил следующие отношения:
[латекс] \ text {C} = \ text {k} * \ text {P} _ {\ text {gas}} [/ latex]
В этом уравнении C — это концентрация газа в растворе, которая является мерой его растворимости, k — константа пропорциональности, которая была определена экспериментально, а P gas — парциальное давление газ над раствором.Константу пропорциональности необходимо определить экспериментально, потому что увеличение растворимости будет зависеть от того, какой газ растворяется.
Уильям Генри : Первооткрыватель закона Генри, который гласит, что растворимость газа в растворителе прямо пропорциональна давлению газа.
При работе с этим законом следует помнить о некоторых вещах:
- Закон Генри работает, только если молекулы находятся в равновесии и если одни и те же молекулы присутствуют во всем растворе.
- Закон Генри не применяется к газам с очень высоким давлением.
- Закон Генри не применяется, если существует химическая реакция между растворенным веществом и растворителем. Например, HCl (g) реагирует с водой в реакции диссоциации и влияет на растворимость, поэтому в этом случае нельзя использовать закон Генри.
- Если закон Генри используется для обозначения того, как концентрация будет изменяться с давлением, используется следующее уравнение: [latex] \ frac {\ text {P} _1} {\ text {C} _1} = \ frac {\ text { P} _2} {\ text {C} _2} [/ latex]
Пример
Если 2.К газированному напитку прилагается давление 5 атм. Какова концентрация растворенного CO 2 , учитывая k = 29,76 [латекс] \ frac {\ text {atm}} {\ text {M}} [/ latex] для CO 2 ?
[латекс] \ text {P} = \ text {k} \ times \ text {C} [/ latex]
[латекс] 2,5 \ text {atm} = 29,76 \ frac {\ text {atm}} {\ text {M}} \ times \ text {C} [/ latex]
Решая для C, находим, что концентрация растворенного CO 2 составляет 0,088 M.
Применения растворимости газа
Чтобы глубоководные ныряльщики могли дышать под водой, они должны вдыхать сильно сжатый воздух в глубокой воде, в результате чего больше азота растворяется в их крови, тканях и суставах.Если ныряльщик слишком быстро возвращается на поверхность, газообразный азот слишком быстро диффундирует из крови, вызывая боль и, возможно, смерть. Это состояние известно как «изгибы».
Чтобы предотвратить изгибы, дайвер должен медленно возвращаться на поверхность, чтобы газы приспособились к частичному снижению давления и распространялись медленнее. Дайвер может также дышать смесью сжатого гелия и газообразного кислорода, так как гелий только в пятой части растворяется в крови, чем азот.
Под водой наши тела похожи на бутылку содовой под давлением.Представьте, что вы роняете бутылку и пытаетесь ее открыть. Чтобы сода не шипела, вы открываете крышку медленно, чтобы давление снизилось. На суше мы вдыхаем около 78 процентов азота и 21 процент кислорода, но наш организм использует в основном кислород. Однако когда мы находимся под водой, высокое давление воды, окружающей наши тела, заставляет азот накапливаться в нашей крови и тканях. Как и в случае с бутылкой газировки, если мы будем двигаться или вылезать из воды слишком быстро, азот будет выходить из нашего тела слишком быстро, создавая пузырьки в нашей крови и вызывая «изгибы».”
Аквалангист : Растворимость и давление очень важны для аквалангистов, которые подвержены «изгибам». По мере того как дайверы плывут глубже, давление увеличивает количество растворенного в их крови азота. Если они не поднимаются медленно, азот может слишком быстро диффундировать из их крови, вызывая боль и даже смерть.
Факторы, влияющие на растворимость. От чего зависит растворимость?
Температура
Обычно растворимость увеличивается с температурой.Так обстоит дело с большинством растворителей. С газами дело обстоит иначе. С повышением температуры они становились менее растворимыми друг в друге и в воде, но более растворимыми в органических растворителях.
Полярность
В большинстве случаев растворенные вещества растворяются в растворителях с аналогичной полярностью. Химики используют популярный афоризм, чтобы описать эту особенность растворенных веществ и растворителей: «Подобное растворяется подобно» . Неполярные растворенные вещества не растворяются в полярных растворителях и наоборот.
Давление
Твердые и жидкие растворенные вещества
Для большинства твердых и жидких растворенных веществ давление не влияет на растворимость.
Растворенные вещества газа
Что касается газов, закон Генри гласит, что растворимость газа прямо пропорциональна давлению этого газа. Математически это представлено как: p = kc , где k — это константа, зависящая от температуры для газа. Хорошее доказательство закона Генри можно наблюдать, открывая бутылку газированного напитка.Когда мы уменьшаем давление в бутылке, газ, растворенный в напитке, выходит из нее.
Размер молекулы
Чем больше молекулы растворенного вещества, тем больше их молекулярная масса и размер. Молекулам растворителя труднее окружать более крупные молекулы. Если исключить все вышеперечисленные факторы, можно найти общее правило, согласно которому более крупные частицы обычно менее растворимы. Если давление и температура такие же, как у двух растворенных веществ одинаковой полярности, раствор с более мелкими частицами обычно более растворим.
Перемешивание увеличивает скорость растворения.
Перемешивание не влияет на растворимость вещества, но каждый знает, что если он кладет сахар в чай и не перемешивает, он не растворяется. На самом деле, если оставить чай постоять достаточно долго, сахар растворится. Перемешивание только увеличивает скорость процесса — оно увеличивает перемещение растворителя, который подвергает растворенное вещество свежим его частям, тем самым обеспечивая растворимость. Поскольку молекулы в жидких веществах находятся в постоянном движении, процесс все равно будет иметь место, но на это потребуется больше времени.
Растворимость и факторы, влияющие на растворимость
Растворимость определяется как верхний предел растворенного вещества, которое может быть растворено в данном количестве растворителя при равновесии. В таком равновесии принцип Ле Шателье можно использовать для объяснения большинства основных факторов, влияющих на растворимость. Принцип Ле Шателье гласит, что влияние напряжения на систему, находящуюся в химическом равновесии, можно предсказать, поскольку система имеет тенденцию сдвигаться таким образом, чтобы уменьшить это напряжение.
Взаимодействие раствор-растворитель влияет на растворимость
Соотношение между растворенным веществом и растворителем очень важно при определении растворимости . Сильное притяжение растворенного вещества к растворителю приравнивается к большей растворимости, в то время как слабое притяжение растворенного вещества к растворителю приравнивается к меньшей растворимости . В свою очередь, полярные растворенные вещества лучше всего растворяются в полярных растворителях, тогда как неполярные растворенные вещества лучше всего растворяются в неполярных растворителях. В случае полярного растворенного вещества и неполярного растворителя (или наоборот) он имеет тенденцию быть нерастворимым или растворимым только в минимальной степени. {2 -} _ {4 (aq)} \]
Сульфат кальция малорастворим; в равновесии большая часть кальция и сульфата существует в твердой форме сульфата кальция.{2 -} _ {4 (водн.)} \]
Сульфат-ионы, диссоциированные из сульфата меди, уже присутствуют (обычно) в смеси из-за небольшой диссоциации сульфата кальция. Таким образом, добавление сульфат-ионов нарушает ранее установленное равновесие. Принцип Ле Шателье гласит, что дополнительное напряжение на этой стороне продукта равновесия приводит к смещению равновесия в сторону реагентов, чтобы уменьшить это новое напряжение. Из-за сдвига в сторону реагента растворимость малорастворимого сульфата кальция снижается еще больше.
Температура влияет на растворимость
Изменения температуры по-разному влияют на растворимость твердых тел, жидкостей и газов. Однако эти эффекты окончательно определены только для твердых тел и газов.
Твердые вещества
Влияние температуры на растворимость твердых веществ различается в зависимости от того, является ли реакция эндотермической или экзотермической. Используя принцип Ле Шателье, можно определить влияние температуры в обоих сценариях.
- Во-первых, рассмотрим эндотермическую реакцию (\ (\ Delta {H_ {solvation}}> 0 \)): Повышение температуры приводит к возникновению напряжения на стороне реагентов из-за дополнительного тепла.Принцип Ле Шателье предсказывает, что система смещается в сторону продукта , чтобы уменьшить это напряжение. При перемещении в сторону продукта больше твердого вещества диссоциирует, когда снова устанавливается равновесие, в результате чего увеличивается растворимость .
- Во-вторых, рассмотрим экзотермическую реакцию ((\ (\ Delta {H_ {solvation}} <0 \)): Повышение температуры приводит к напряжению на стороне продуктов из-за дополнительного тепла. Принцип Ле Шателье предсказывает, что система смещается к стороне реагента, чтобы уменьшить это напряжение.При перемещении в сторону реагента меньше твердого вещества диссоциирует, когда снова устанавливается равновесие, в результате чего уменьшается растворимость .
Жидкости
В случае жидкостей нет определенных тенденций влияния температуры на растворимость жидкостей.
Газы
Чтобы понять влияние температуры на растворимость газов, прежде всего важно помнить, что температура является мерой средней кинетической энергии.С повышением температуры кинетическая энергия увеличивается. Большая кинетическая энергия приводит к большему молекулярному движению частиц газа. В результате частицы газа, растворенные в жидкости, с большей вероятностью уйдут в газовую фазу, а существующие частицы газа будут растворены с меньшей вероятностью. Верно и обратное. Таким образом, тенденция такова: повышенные температуры означают меньшую растворимость, а пониженные температуры означают более высокую растворимость.
Принцип Ле Шателье позволяет лучше понять эти тенденции.Во-первых, обратите внимание, что процесс растворения газа в жидкости обычно экзотермический . Таким образом, повышение температуры на приводит к возникновению напряжения на стороне продукта (поскольку тепло находится на стороне продукта). В свою очередь, принцип Ле Шателье предсказывает, что система смещается в сторону реагента, чтобы уменьшить это новое напряжение. Следовательно, равновесная концентрация частиц газа в газовой фазе увеличивается, в результате чего понижается растворимость .
И наоборот, понижение температуры приводит к напряжению на стороне реагента (потому что тепло находится на стороне продукта).В свою очередь, принцип Ле Шателье предсказывает, что система смещается в сторону продукта, чтобы компенсировать этот новый стресс. Следовательно, равновесная концентрация частиц газа в газовой фазе будет уменьшаться, что приведет к большей растворимости .
Давление влияет на растворимость газов
Воздействие давления оказывает существенное влияние только на растворимость газов в жидкостях.
- Твердые вещества и жидкости: Влияние изменений давления на растворимость твердых веществ и жидкостей незначительно.
- Газы : Влияние давления на растворимость газов в жидкостях лучше всего можно описать с помощью комбинации закона Генри и принципа Ле Шателье. Закон Генри гласит, что при постоянной температуре растворимость газа соответствует его парциальному давлению. Рассмотрим следующую формулу закона Генри:
\ [p = k_h \; c \]
где:
- \ (p \) — парциальное давление газа над жидкостью,
- \ (k_h \) — постоянная закона Генри, а
- \ (c \) — концентрат газа в жидкости.
Эта формула показывает, что (при постоянной температуре), когда парциальное давление уменьшается, концентрация газа в жидкости также уменьшается, и, следовательно, растворимость также уменьшается. И наоборот, когда парциальное давление увеличивается в такой ситуации, концентрация газа в жидкости также увеличивается; растворимость также увеличивается. Расширяя последствия закона Генри, полезность принципа Ле Шателье увеличивается при прогнозировании влияния давления на растворимость газов.
Рассмотрим систему, состоящую из газа, частично растворенного в жидкости. Повышение давления приведет к большему парциальному давлению (поскольку газ подвергается дальнейшему сжатию). Это повышенное парциальное давление означает, что больше частиц газа войдет в жидкость (следовательно, над жидкостью меньше газа, поэтому парциальное давление уменьшается), чтобы уменьшить напряжение, создаваемое увеличением давления, что приводит к большей растворимости.
Обратный случай в такой системе также верен, поскольку снижение давления означает, что больше частиц газа выходит из жидкости для компенсации.
Пример 1
Рассмотрим следующую экзотермическую реакцию, которая находится в равновесии
\ [CO_2 (г) + H_2O (l) \ правые левые гарпуны H_2CO_3 (водн.) \]
Что произойдет с растворимостью диоксида углерода, если:
- Температура повышена?
- Давление и температура повышены?
- Давление повышается, а температура понижается?
- Давление повышено?
Раствор
- Реакция экзотермическая, поэтому повышение температуры означает, что растворимость снизится.
- Изменение растворимости не может быть определено на основании данной информации. Повышение давления увеличивает растворимость, но повышение температуры снижает растворимость
- Повышение давления и температуры в этой реакции приводит к большей растворимости.
- Повышение давления приводит к тому, что в жидкость попадает больше частиц газа, чтобы снизить парциальное давление. Следовательно, растворимость увеличится.
Пример 2: Эффект обычных ионов
Боб занимается очисткой соединений серебра для извлечения настоящего серебра.Он крайне бережлив. Однажды он находит бочку с насыщенным раствором хлорида серебра. У Боба есть бутылка воды, банка поваренной соли (NaCl (s)) и бутылка уксуса (CH 3 COOH). Что из трех следует добавить Бобу в раствор, чтобы максимизировать количество твердого хлорида серебра (минимизировать растворимость хлорида серебра)?
Раствор
Боб должен добавить в раствор поваренную соль. Согласно эффекту общего иона, дополнительные ионы Cl — снизят растворимость хлорида серебра, что максимизирует количество твердого хлорида серебра.
Пример 3:
Эллисон всегда хотела открыть собственную компанию по производству газированных напитков. Недавно она открыла фабрику по производству своих напитков. Она хочет, чтобы ее напиток «перебил» всех конкурентов. То есть она хочет добиться максимальной растворимости газа в своем напитке. Какие условия (высокая / низкая температура, высокое / низкое давление) лучше всего позволят ей достичь этой цели?
Раствор
Она сможет максимизировать растворимость газа (в данном случае \ (CO_2 \)) в своем напитке (максимизировать шипение) при высоком давлении и низкой температуре.
Пример 4
Butters пытается увеличить растворимость твердого вещества в воде. Он начинает лихорадочно перемешивать смесь. Следует ли ему продолжать помешивать? Почему или почему нет?
Раствор
Он перестал мешать. Перемешивание влияет только на то, как быстро система достигнет равновесия, и совсем не влияет на растворимость твердого вещества.
Пример 5: Удаление газа
Что касается закона Генри, почему открывать банку с газировкой при низком давлении — плохой идеал?
Раствор
Газообразность соды возникает из-за растворенного \ (CO_2 \), частично в форме угольной кислоты.Концентрация растворенного в соде \ (CO_2 \) зависит от давления окружающей среды, оказывающего давление на жидкость. Следовательно, банка с содой будет находиться под давлением, чтобы поддерживать желаемую концентрацию \ (CO_2 \). Когда баллончик открыт в среду с более низким давлением (например, в окружающую атмосферу), сода быстро «улетучится» (\ (CO_2 \) выйдет из раствора) со скоростью, зависящей от окружающего атмосферного давления. Если банка с содовой открыта в среде с более низким давлением, это выделение газа будет быстрее и, следовательно, более взрывоопасным (и опасным), чем в среде с высоким давлением.
Условия
- Растворимость растворенного вещества — это концентрация насыщенного раствора.
- A насыщенный раствор раствор, в котором максимальное количество растворенного вещества растворилось в растворителе при данной температуре.
- Ненасыщенный раствор раствор, в котором растворенное вещество полностью растворилось в растворителе.
- Перенасыщенный раствор — это раствор, в котором количество растворенного вещества, растворенного в данных условиях, превышает его предполагаемый верхний предел.
- Принцип Ле Шателье гласит, что когда система, находящаяся в химическом равновесии, подвергается стрессу, система сдвигается таким образом, чтобы уменьшить напряжение.
- Эндотермическая реакция : реакция, при которой поглощается тепло (ΔH> 0)
- Экзотермическая реакция : реакция, при которой выделяется тепло (ΔH <0)
13.4: Влияние температуры и давления на растворимость
Экспериментально установлено, что растворимость большинства соединений сильно зависит от температуры и, если речь идет о газе, также от давления.Как мы увидим, возможность управлять растворимостью путем изменения температуры и давления имеет несколько важных последствий.
Влияние температуры на растворимость твердых тел
На рисунке \ (\ PageIndex {1} \) показаны графики растворимости некоторых органических и неорганических соединений в воде в зависимости от температуры. Хотя растворимость твердого вещества обычно увеличивается с повышением температуры, нет простой взаимосвязи между структурой вещества и температурной зависимостью его растворимости.Многие соединения (такие как глюкоза и \ (\ ce {CH_3CO_2Na} \)) демонстрируют резкое увеличение растворимости с повышением температуры. Другие (например, \ (\ ce {NaCl} \) и \ (\ ce {K_2SO_4} \)) мало изменяются, а третьи (например, \ (\ ce {Li_2SO_4} \)) становятся менее растворимыми с повышением температуры. .
Рисунок \ (\ PageIndex {1} \): растворимость некоторых неорганических и органических твердых веществ в воде в зависимости от температуры. Растворимость может увеличиваться или уменьшаться с температурой; величина этой температурной зависимости широко варьируется между соединениями.(CC BY-SA-NC; анонимно)Обратите внимание, в частности, на кривые для \ (\ ce {Nh5NO3} \) и \ (\ ce {CaCl2} \). Растворение нитрата аммония в воде эндотермическое (\ (ΔH_ {soln} = +25,7 \; кДж / моль \)), тогда как растворение хлорида кальция экзотермическое (\ (ΔH_ {soln} = -68,2 \; кДж / моль \)), но рисунок \ (\ PageIndex {1} \) показывает, что растворимость обоих соединений резко возрастает с повышением температуры. Фактически, величина изменений энтальпии и энтропии растворения зависит от температуры.Поскольку растворимость соединения в конечном итоге определяется относительно небольшими различиями между большими числами, обычно нет хорошего способа предсказать, как растворимость будет меняться с температурой.
Изменение растворимости в зависимости от температуры было измерено для широкого диапазона соединений, и результаты опубликованы во многих стандартных справочниках. Химики часто могут использовать эту информацию для разделения компонентов смеси путем фракционной кристаллизации, разделения соединений на основе их растворимости в данном растворителе.Например, если у нас есть смесь 150 г ацетата натрия (\ (\ ce {CH_3CO_2Na} \)) и 50 г \ (\ ce {KBr} \), мы можем разделить два соединения, растворив смесь в 100 г воды при 80 ° C, а затем медленно охлаждают раствор до 0 ° C. Согласно температурным кривым на рисунке \ (\ PageIndex {1} \) оба соединения растворяются в воде при 80 ° C, и все 50 г \ (\ ce {KBr} \) остаются в растворе при 0 ° C. Однако только около 36 г \ (\ ce {Ch4CO2Na} \) растворимо в 100 г воды при 0 ° C, поэтому кристаллизуется примерно 114 г (150 г — 36 г) \ (\ ce {CH_3CO_2Na} \) при охлаждении.Затем кристаллы можно отделить фильтрованием. Таким образом, фракционная кристаллизация позволяет нам восстановить около 75% исходного \ (\ ce {CH_3CO_2Na} \) в практически чистой форме всего за одну стадию.
Фракционная кристаллизация — это распространенный метод очистки таких разнообразных соединений, как показано на рисунке \ (\ PageIndex {1} \), и от антибиотиков до ферментов. Чтобы методика работала должным образом, интересующее соединение должно быть более растворимым при высокой температуре, чем при низкой температуре, чтобы понижение температуры заставляло его кристаллизоваться из раствора.Кроме того, примеси должны быть более растворимыми, чем представляющее интерес соединение (как было \ (\ ce {KBr} \) в этом примере), и предпочтительно присутствовать в относительно небольших количествах.
Влияние температуры на растворимость газов
Растворимость газов в жидкостях уменьшается с повышением температуры, как показано на рисунке \ (\ PageIndex {2} \). Для большинства веществ привлекательные межмолекулярные взаимодействия в газовой фазе практически равны нулю. Когда газ растворяется, это происходит потому, что его молекулы взаимодействуют с молекулами растворителя.Поскольку при образовании этих новых взаимодействий притяжения выделяется тепло, растворение большинства газов в жидкостях является экзотермическим процессом (\ (ΔH_ {soln} <0 \)). И наоборот, добавление тепла к раствору обеспечивает тепловую энергию, которая преодолевает силы притяжения между газом и молекулами растворителя, тем самым снижая растворимость газа. Это явление аналогично тому, что происходит при увеличении давления пара чистой жидкости с повышением температуры. Однако в случае давления пара именно силы притяжения между молекулами растворителя преодолеваются добавленной тепловой энергией при повышении температуры.
Рисунок \ (\ PageIndex {2} \): Растворимость нескольких обычных газов в воде как функция температуры при парциальном давлении 1 атм. Растворимость всех газов уменьшается с повышением температуры. (CC BY-SA-NC; анонимно)Уменьшение растворимости газов при более высоких температурах имеет как практические, так и экологические последствия. Любой, кто регулярно кипятит воду в чайнике или электрочайнике, знает, что внутри накапливается белый или серый налет, который в конечном итоге необходимо удалить.То же явление происходит в гораздо большем масштабе в гигантских котлах, используемых для подачи горячей воды или пара для промышленных применений, где оно называется «котловой накипью», отложением, которое может серьезно снизить пропускную способность труб для горячей воды (рис. PageIndex {3} \)). Проблема не только в современном мире: акведуки, построенные римлянами 2000 лет назад для транспортировки холодной воды из альпийских регионов в более теплые и засушливые регионы на юге Франции, были забиты аналогичными отложениями. Химический состав этих отложений умеренно сложен и будет описан в другом месте, но движущей силой является потеря растворенного \ (\ ce {CO2} \) из раствора.{2 -} (водн.) + H3O (l) + CO2 (водн.)} \ Label {13.9} \]
Нагревание раствора снижает растворимость \ (\ ce {CO2} \), который уходит в газовую фазу над раствором. В присутствии ионов кальция ионы карбоната осаждаются в виде нерастворимого карбоната кальция, основного компонента накипи в котле.
Рисунок \ (\ PageIndex {3} \): Отложения карбоната кальция (слева) Отложения карбоната кальция (\ (CaCO_3 \)) в трубах с горячей водой могут значительно снизить пропускную способность труб. Эти отложения, называемые котловой накипью, образуются, когда растворенный \ (\ ce {CO2} \) переходит в газовую фазу при высоких температурах.(справа) Сильно кальцинированные остатки Эйфелевого акведука возле Ойскирхен-Кройцвайнгартен, Германия. (Википедия)Термическое загрязнение
В позиции тепловое загрязнение озерная или речная вода, которая используется для охлаждения промышленного реактора или электростанции, возвращается в окружающую среду при более высокой температуре, чем обычно. Из-за пониженной растворимости \ (\ ce {O2} \) при более высоких температурах (рис. \ (\ PageIndex {2} \)) более теплая вода содержит меньше растворенного кислорода, чем вода, когда она попадала в растение.Рыбы и другие водные организмы, которым для жизни нужен растворенный кислород, могут буквально задохнуться, если концентрация кислорода в их среде обитания будет слишком низкой. Поскольку теплая, обедненная кислородом вода менее плотная, она имеет тенденцию плавать поверх более холодной, плотной и более богатой кислородом воды в озере или реке, образуя барьер, препятствующий растворению атмосферного кислорода. В конце концов, если проблему не устранить, можно задохнуться даже в глубоких озерах. Кроме того, большинство рыб и других водных организмов, не являющихся млекопитающими, хладнокровны, а это означает, что температура их тела такая же, как температура окружающей среды.Температура, значительно превышающая нормальный диапазон, может привести к тяжелому стрессу или даже смерти. Системы охлаждения для электростанций и других объектов должны быть спроектированы таким образом, чтобы свести к минимуму любые неблагоприятные воздействия на температуру окружающих водоемов.
Есть много причин гибели рыб, но наиболее распространенной является недостаток кислорода. (Общественное достояние; Служба охраны рыбных ресурсов и диких животных США)Аналогичный эффект наблюдается в повышении температуры водоемов, таких как залив Чесапик, крупнейший эстуарий в Северной Америке, причиной которого было замешано глобальное потепление.На каждые 1,5 ° C, которые нагревает вода в заливе, способность воды растворять кислород уменьшается примерно на 1,1%. Многие морские виды, находящиеся на южной границе своего распространения, переместили свои популяции дальше на север. В 2005 году угорь, являющийся важным местом обитания рыб и моллюсков, исчез на большей части залива после рекордно высоких температур воды. Предположительно, снижение уровня кислорода уменьшило популяцию моллюсков и других питателей, что затем уменьшило светопропускание, что позволило угрям расти.Сложные взаимоотношения в экосистемах, таких как Чесапикский залив, особенно чувствительны к колебаниям температуры, вызывающим ухудшение качества среды обитания.
Влияние давления на растворимость газов: закон Генри
Внешнее давление очень мало влияет на растворимость жидкостей и твердых тел. Напротив, растворимость газов увеличивается с увеличением парциального давления газа над раствором. Эта точка проиллюстрирована на рисунке \ (\ PageIndex {4} \), который показывает влияние повышенного давления на динамическое равновесие, которое устанавливается между молекулами растворенного газа в растворе и молекулами в газовой фазе над раствором.Поскольку концентрация молекул в газовой фазе увеличивается с увеличением давления, концентрация молекул растворенного газа в растворе в состоянии равновесия также выше при более высоких давлениях.
Рисунок \ (\ PageIndex {4} \): Модель, показывающая, почему растворимость газа увеличивается с увеличением парциального давления при постоянной температуре. (а) Когда газ входит в контакт с чистой жидкостью, некоторые молекулы газа (пурпурные сферы) сталкиваются с поверхностью жидкости и растворяются.Когда концентрация растворенных молекул газа увеличилась так, что скорость, с которой молекулы газа уходят в газовую фазу, была такой же, как скорость, с которой они растворяются, было установлено динамическое равновесие, как показано здесь. Это равновесие полностью аналогично тому, которое поддерживает давление пара жидкости. (б) Увеличение давления газа увеличивает количество молекул газа в единице объема, что увеличивает скорость, с которой молекулы газа сталкиваются с поверхностью жидкости и растворяются.(c) По мере того, как дополнительные молекулы газа растворяются при более высоком давлении, концентрация растворенного газа увеличивается до тех пор, пока не установится новое динамическое равновесие. (CC BY-SA-NC; анонимно)Взаимосвязь между давлением и растворимостью газа количественно описывается законом Генри, названным в честь его первооткрывателя, английского врача и химика Уильяма Генри (1775–1836):
\ [C = kP \ label {13.3.1} \]
где
- \ (C \) — концентрация растворенного газа при равновесии,
- \ (P \) — парциальное давление газа, а
- \ (k \) — постоянная закона Генри, которая должна определяться экспериментально для каждой комбинации газа, растворителя и температуры.
Хотя концентрацию газа можно выразить в любых удобных единицах, мы будем использовать исключительно молярность. Таким образом, единицами измерения постоянной закона Генри являются моль / (л · атм) = М / атм. Значения констант закона Генри для растворов нескольких газов в воде при 20 ° C приведены в таблице \ (\ PageIndex {1} \).
Как показывают данные в таблице \ (\ PageIndex {1} \), концентрация растворенного газа в воде при заданном давлении сильно зависит от ее физических свойств.Для ряда родственных веществ дисперсионные силы Лондона увеличиваются с увеличением молекулярной массы. Таким образом, среди элементов Группы 18 константы закона Генри плавно возрастают от \ (\ ce {He} \) до \ (\ ce {Ne} \) до \ (\ ce {Ar} \).
| Газ | Константа закона Генри [моль / (л · атм)] × 10 −4 |
|---|---|
| \ (\ ce {He} \) | 3.9 |
| \ (\ ce {Ne} \) | 4,7 |
| \ (\ ce {Ar} \) | 15 |
| \ (\ ce {H_2} \) | 8,1 |
| \ (\ ce {N_2} \) | 7,1 |
| \ (\ ce {O_2} \) | 14 |
| \ (\ ce {CO_2} \) | 392 |
Кислород особенно растворим
Азот и кислород — два наиболее распространенных газа в атмосфере Земли, и у них много схожих физических свойств.Однако, как показано в таблице \ (\ PageIndex {1} \), \ (\ ce {O2} \) в два раза более растворим в воде, чем \ (\ ce {N2} \). На растворимость влияют многие факторы, включая природу действующих межмолекулярных сил. Подробное обсуждение см. В статье Рубина Баттино и Пола Сейболда «The O 2 / N 2 Ratio Gas Solubility Mystery» (J. Chem. Eng. Data 2011, 56, 5036–5044),
Газы, которые химически реагируют с водой, такие как \ (\ ce {HCl} \) и другие галогениды водорода, \ (\ ce {h3S} \) и \ (\ ce {Nh4} \), не соответствуют , а не подчиняться закону Генри; все эти газы гораздо более растворимы, чем предсказывает закон Генри.{-} (aq)} \), а не растворенные молекулы \ (\ ce {HCl} \), и его диссоциация на ионы приводит к гораздо более высокой растворимости, чем ожидалось для нейтральной молекулы.
Газы, которые реагируют с водой, не подчиняются закону Генри.
Закон Генри имеет важные приложения. Например, пузырьки \ (\ ce {CO2} \) образуются, как только открывается газированный напиток, потому что напиток был разлит под \ (\ ce {CO2} \) при давлении более 1 атм. Когда бутылка открыта, давление \ (\ ce {CO2} \) над раствором быстро падает, и часть растворенного газа улетучивается из раствора в виде пузырьков.Закон Генри также объясняет, почему аквалангисты должны быть осторожны, чтобы медленно всплывать на поверхность после погружения, если они дышат сжатым воздухом. При более высоком давлении под водой больше N2 из воздуха растворяется во внутренних жидкостях дайвера. Если дайвер всплывает слишком быстро, быстрое изменение давления вызывает образование маленьких пузырьков \ (\ ce {N2} \) по всему телу, состояние, известное как «изгибы». Эти пузырьки могут блокировать кровоток по мелким кровеносным сосудам, вызывая сильную боль и в некоторых случаях даже заканчиваясь смертельным исходом.
Из-за низкой константы закона Генри для \ (\ ce {O2} \) в воде уровни растворенного кислорода в воде слишком низки для удовлетворения энергетических потребностей многоклеточных организмов, включая человека. Чтобы увеличить концентрацию \ (\ ce {O2} \) во внутренних жидкостях, организмы синтезируют хорошо растворимые молекулы-носители, которые обратимо связывают \ (\ ce {O2} \). Например, красные кровяные тельца человека содержат белок, называемый гемоглобином, который специфически связывает \ (\ ce {O2} \) и облегчает его транспортировку из легких в ткани, где он используется для окисления молекул пищи для получения энергии.Концентрация гемоглобина в нормальной крови составляет около 2,2 мМ, и каждая молекула гемоглобина может связывать четыре молекулы \ (\ ce {O2} \). Хотя концентрация растворенного \ (\ ce {O2} \) в сыворотке крови при 37 ° C (нормальная температура тела) составляет всего 0,010 мМ, общая концентрация растворенного \ (\ ce {O2} \) составляет 8,8 мМ, что почти соответствует в тысячу раз больше, чем было бы возможно без гемоглобина. Синтетические переносчики кислорода на основе фторированных алканов были разработаны для использования в качестве экстренной замены цельной крови.{-3} M / атм \), а мольная доля \ (\ ce {O2} \) в атмосфере составляет 0,21. Рассчитайте растворимость \ (\ ce {O2} \) в воде при 25 ° C и атмосферном давлении 1,00 атм.
Дано : постоянная закона Генри, мольная доля \ (\ ce {O2} \) и давление
Запрошено: растворимость
Стратегия :
- Используйте закон парциальных давлений Дальтона для расчета парциального давления кислорода. (Для получения дополнительной информации о законе парциальных давлений Дальтона)
- Используйте закон Генри для расчета растворимости, выраженной как концентрация растворенного газа.
Решение :
A Согласно закону Дальтона парциальное давление \ (\ ce {O2} \) пропорционально мольной доле \ (\ ce {O2} \):
\ [\ begin {align *} P_A & = \ chi_A P_t \\ [4pt] & = (0,21) (1,00 \; атм) \\ [4pt] & = 0,21 \; атм \ end {align *} \]
B Согласно закону Генри, концентрация растворенного кислорода в этих условиях составляет
\ [\ begin {align *} [\ ce {CO2}] & = k P _ {\ ce {O2}} \\ [4pt] & = (1,27 \ times 10 ^ {- 3} \; M / \ cancel {atm}) (0.{-5} М \)
Растворимость — обзор | ScienceDirect Topics
3.2 Растворимость
Растворимость возникает при динамическом равновесии, что означает, что растворимость является результатом одновременных и противоположных процессов растворения и соединения фаз (например, осаждения твердых веществ). Равновесие растворимости возникает, когда два процесса протекают с постоянной скоростью. При определенных условиях равновесная растворимость может быть превышена с образованием так называемого перенасыщенного раствора, который является метастабильным (Ojha and Prabhakar, 2013).
ИЮПАК определяет растворимость как аналитический состав насыщенного раствора, выраженный как пропорция указанного растворенного вещества в указанном растворителе. Растворимость может быть указана в единицах концентрации, моляльности, мольной доле, мольном соотношении и других единицах.
Растворимость — важный параметр для достижения желаемой концентрации лекарств в системном кровотоке, которая может вызывать желаемый физиологический ответ. Любой абсорбируемый препарат должен присутствовать в форме водного раствора в месте абсорбции.Поскольку вода остается предпочтительным растворителем для жидких фармацевтических составов, плохо растворимые в воде лекарственные средства обладают медленной абсорбцией, что приводит к недостаточной биодоступности. Большинство лекарств являются либо слабокислотными, либо слабощелочными, имеют плохую растворимость в воде, особенно в препаратах класса II BCS, лимитирующей стадией является высвобождение лекарственного средства из лекарственной формы и его растворимость в желудочном pH, чем абсорбция (Savjani et al., 2012 ).
Однако недостатком является то, что растворимость сильно зависит от присутствия других частиц в растворителе (например,g., обычный ионный эффект). Насыщенный раствор ионных соединений с низкой растворимостью выражается через константы растворимости, которые описывают баланс между нерастворенными и растворенными солями. Помимо константы растворимости, которая зависит от температуры и не зависит от присутствия других частиц в растворителе, для прогнозирования также используются другие физические константы, такие как энтальпия плавления и эмпирические методы, а именно параметры растворимости Хансена и параметры растворимости Гильдебранда. растворимость.Кроме того, растворимость полимеров описывается теорией раствора Флори-Хаггинса, а дифференциальная растворимость соединения в гидрофобном и гидрофильном растворителях измеряется коэффициентом распределения (log P) (Savjani et al., 2012).
Различные методы солюбилизации, включая совместную растворимость, добавление поверхностно-активных веществ, образование солей и твердую дисперсию, используются в солюбилизированных плохо растворимых лекарствах (Jouyban et al., 2014; Seo et al., 2015).
Растворимость
РастворимостьРастворимость
Определение растворимости — это максимальное количество растворенного вещества, которое может раствориться в определенном количестве растворителя или количестве раствора при определенной температуре или давлении (в случае газообразных растворенных веществ).В CHM1045 мы обсуждали растворимость как «да» или «нет». Но на самом деле почти все растворенные вещества растворяются в каждом растворителе до некоторой измеримой степени.
Как указано в определении, температура и давление играют важную роль в определении степени растворимости растворенного вещества.
Начнем с температуры:
Для газов растворимость уменьшается с повышением температуры (да… вы видели, как вода закипает, верно?) Физическая причина этого заключается в том, что когда большинство газов растворяется в растворе, процесс является экзотермическим.Это означает, что при растворении газа выделяется тепло. Это очень похоже на причину, по которой давление пара увеличивается с температурой. Повышенная температура вызывает увеличение кинетической энергии. Более высокая кинетическая энергия вызывает большее движение в молекулах газа, которые разрывают межмолекулярные связи и выходят из раствора. Посмотрите на график ниже:
При повышении температуры растворимость газа уменьшается, что показано на графике нисходящей тенденцией.
Для твердых или жидких растворенных веществ :
ВАРИАНТ I: Снижение растворимости с температурой:
Если тепло, выделяемое в процессе растворения, больше, чем тепло, необходимое для разрушения твердого вещества, итоговая реакция растворения является экзотермической (см. Процесс растворения , ). Добавление большего количества тепла (повышение температуры) тормозит реакцию растворения, поскольку в результате реакции уже выделяется избыточное тепло.Это не очень распространенная ситуация, когда повышение температуры приводит к снижению растворимости. Но это случай сульфата натрия и гидроксида кальция.
ВАРИАНТ II: Повышение растворимости с температурой:
Если тепло, выделяемое при реакции растворения, меньше тепла, необходимого для разрушения твердого вещества, итоговая реакция растворения является эндотермической. Добавление большего количества тепла облегчает реакцию растворения, обеспечивая энергию для разрыва связей в твердом веществе.Это наиболее распространенная ситуация, когда повышение температуры приводит к увеличению растворимости твердых веществ.
Применение этого принципа растворимости является применением холодных компрессов быстрого приготовления для оказания первой помощи. Такая соль, как нитрат аммония, растворяется в воде после того, как резким ударом разбиваются емкости для каждой. Реакция растворения эндотермическая — требует тепла. Поэтому тепло отбирается из окружающей среды, рюкзак кажется холодным.
Влияние температуры на растворимость можно объяснить на основе принципа Ле Шателье .Принцип Ле Шателье гласит, что если напряжение (например, тепло, давление, концентрация одного реагента) приложено к равновесию, система будет регулировать, если это возможно, чтобы минимизировать влияние напряжения. Этот принцип важен для прогнозирования того, насколько система будет реагировать на изменение внешних условий. Рассмотрим случай, когда процесс растворимости является эндотермическим (добавляется тепло). Повышение температуры ухудшает состояние равновесия и заставляет его сдвигаться вправо.Напряжение снимается, потому что процесс растворения потребляет часть тепла. Следовательно, растворимость (концентрация) увеличивается с повышением температуры. Если процесс экзотермический (выделяется тепло). Повышение температуры снижает растворимость за счет смещения равновесия влево.
Теперь посмотрим на давление:
Твердые и жидкие вещества почти не изменяют растворимость при изменении давления. Но газы очень зависят от давления в системе.Газы растворяются в жидкостях с образованием растворов. Это растворение представляет собой равновесный процесс, для которого можно записать константу равновесия. Например, равновесие между газообразным кислородом и растворенным кислородом в воде составляет O 2 (водн.) <=> O 2 (г). Константа равновесия для этого равновесия равна K = p (O 2 ) / c (O 2 ). Форма константы равновесия показывает, что концентрация растворенного газа в растворе прямо пропорциональна парциальному давлению этого газа над раствором.Это утверждение, известное как закон Генри , было впервые предложено в 1800 году Дж. У. Генри как эмпирический закон задолго до развития наших современных представлений о химическом равновесии.
Закон Генри:
S g обозначает растворимость газа, k H — константа закона Генри, а P g — парциальное давление растворенного газообразного вещества.
Таблица: Константы молярного закона Генри для водных растворов при 25
o C| Газ |
Константа |
Константа |
| (Па / (моль / дм 3 )) |
(атм / (моль / дм 3 )) |
|
| He |
282.7e6 |
2865 |
| O 2 |
74.68e6 |
756,7 |
| N 2 |
155.0e6 |
1600 |
| H 2 |
121.2e6 |
1228 |
| CO 2 |
2.937e6 |
29,76 |
| NH 3 |
5.69e6 |
56,9 |
Обратная величина постоянной закона Генри, умноженная на парциальное давление газа над раствором, составляет молярную растворимость газа.Таким образом, кислород при одной атмосфере будет иметь молярную растворимость (1 / 756,7) моль / дм 3 или 1,32 ммоль / дм 3 . Значения в этой таблице рассчитаны на основе таблиц молярных термодинамических свойств чистых веществ и водных растворенных веществ
.Сводка факторов, влияющих на растворимость
Обычно растворенные вещества становятся более растворимыми в данном растворителе при более высоких температурах. Один из способов предсказать эту тенденцию — использовать принцип Ле Шателье.Поскольку DHsoln является положительным для большинства растворов, реакция образования раствора обычно эндотермическая. Следовательно, при повышении температуры растворимость растворенного вещества также должна увеличиваться. Однако есть растворенные вещества, растворимость которых не увеличивается с повышением температуры. Одним из классов растворенных веществ, которые становятся менее растворимыми с повышением температуры, являются газы. Почти каждый газ становится менее растворимым с повышением температуры.
Другое свойство газообразных растворенных веществ резюмируется законом Генри, который предсказывает, что газы становятся более растворимыми, когда их давление над жидким раствором увеличивается.Это свойство газообразных растворенных веществ можно объяснить с помощью принципа Ле Шателье. Представьте, что у вас есть стакан воды внутри герметичного наполнителя контейнера с газообразным азотом. Если бы размер этого контейнера внезапно уменьшился вдвое, давление азота внезапно увеличилось бы вдвое. Чтобы снизить давление азота над раствором (как того требует принцип Ле Шателье), в стакане с водой растворяется больше газообразного азота.
.
