Концентрация раствора (вопросы ответы) — Знаешь как
Концентрация раствора это относительное количество растворенного вещества в растворе.
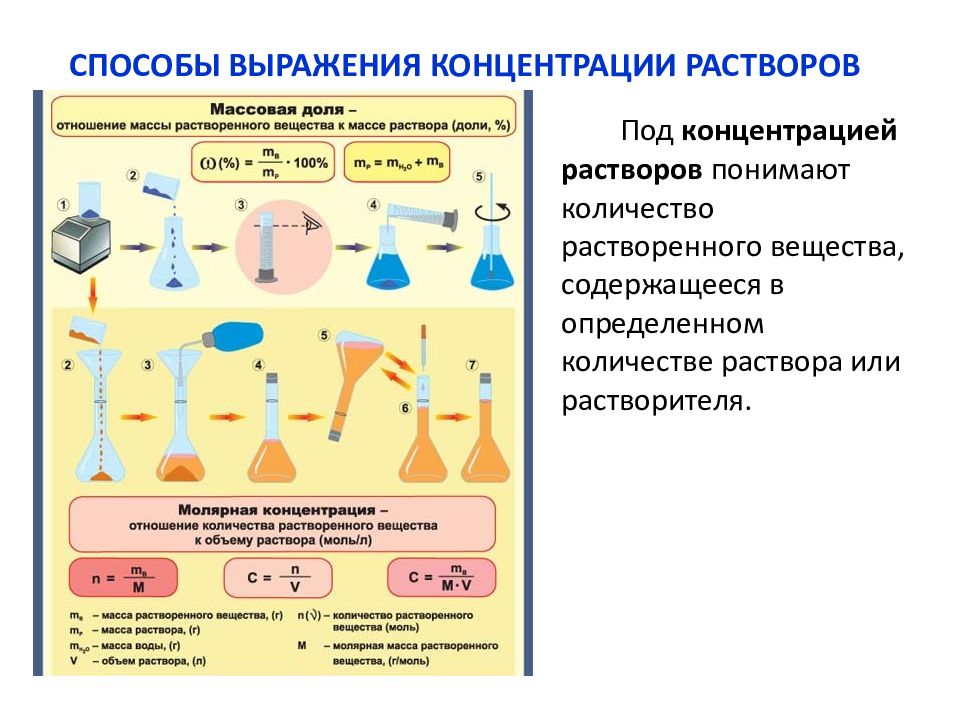
Количественный состав раствора выражают с помощью понятия «концентрация» или “доля”, под которым понимают содержание растворенного вещества в единице массы, объёма или количества вещества раствора.
Существует несколько способов выражения состава раствора: массовая доля (процентная концентрация), молярная концентрация (молярность), мольная доля растворённого вещества.
Содержание статьи
Что такое концентрация растворовКонцентрация растворов определяется количеством вещества, заключенного в определенном весовом или объемном количестве раствора или растворителя.
Для того чтобы определить существуют несколько способов выражения концентрации растворов: нормальная концентрации, молярная, процентная и молярная.
Процентная концентрация раствора выражается числом граммов растворенного вещества в 100 г раствора.
Например, в 100 г 5%-ного раствора сахара содержится 5 г сахара, а остальные 95 г растворитель.
Проверь хорошо ли Вы знаете наукиВаш ответ:
Правильный ответ:
СледующийТы получил {{SCORE_CORRECT}} снаружи {{SCORE_TOTAL}}
Молярная концентрация выражается количеством грамм-молекул растворенного вещества в 1 л раствора. Молярность раствора обозначается буквой М.
Если в литре раствора содержится одна грамм-молекула растворенного вещества, то такой раствор называется молярным, две грамм-молекулы двухмолярным, полграмм-молекулы 0,5-молярным и т. д.
Нормальная концентрация раствора выражается числом грамм-эквивалентов растворенного вещества, содержащихся в 1 л раствора. Нормальность раствора обозначается буквой Н.
Однонормальный раствор в литре содержит один грамм-эквивалент растворенного вещества, двухнормальный два грамм-эквивалента и т.
Между концентрацией растворов и их удельными весами существует определенная зависимость.
Количественная концентрация растворов Мерная колбаКоличественно концентрацию растворов можно выражать различным образом. В химической практике наиболее употребительны три способа выражения концентраций в процентах растворенного вещества (процентная концентрация раствора), числом молей растворенного вещества и моляльным:
Способы выражения концентрации растворов1. В процентах растворенного вещества по отношению ко всему количеству раствора. Например, 15%-ный раствор поваренной соли — это такой раствор, в 100 г которого содержится 15 г соли и 85 г воды.
2. Числом молей растворенного вещества, содержащихся в 1 л раствора. Растворы с выраженной таким способом концентрацией называются молярными.
Они обозначаются буквой М,
 е. число молей, приходящихся на 1 л раствора. Например, 2М раствор содержит в 1 л 2 моля растворенного вещества, 0,3М раствор содержит в 1 л 0,3 моля и т. д.
Моляльная концентрация раствора
е. число молей, приходящихся на 1 л раствора. Например, 2М раствор содержит в 1 л 2 моля растворенного вещества, 0,3М раствор содержит в 1 л 0,3 моля и т. д.
Моляльная концентрация раствора
Иногда концентрацию раствора выражают числом молей растворенного вещества, содержащихся в 1000 г растворителя. Такие растворы в отличие от молярных называются моляльными.
Моляльность, моляльная весовая концентрация — это количество растворённого вещества (число моль) в 1000 г растворителя.
Измеряется в молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-мольным. Рассчитывается по формуле:
mB = nB/mA
где nB — количество растворённого вещества, моль;
mA — масса растворителя, кг.
Сходство названий, молярная концентрация и моляльность — величины различные.
Уточнение, 1 л воды = 1 кг воды, и еще, 1 г/мл = 1 кг/л.
Пример получения определенной молярностиЧтобы приготовить раствор определенной молярности, например 0,5М раствор соды Na2CO3, поступают следующим образом.
Отвесив 0,5 моля соды, т. е. 53 г (молекулярный вес Na2CO3 равен 106), вносят ее в литровую мерную колбу, на шейке которой чертой отмечен объем, точно равный одному литру (рис.). Затем в колбу наливают столько воды, чтобы вся сода растворилась, после чего доливают колбу водой до метки.
Пользование молярными растворами удобно в том отношении, что при одинаковой молярности равные объемы растворов содержат одинаковое число молекул растворенного вещества.
Весовая процентная концентрация показывает, какой процент от общего веса раствора составляет растворенное вещество.
В лабораторной практике часто приходится иметь дело с кристаллогидратами — солями, содержащими кристаллизационную воду, например CuSО4 ·5H2O, FeSО4 · 7H2О и т. д.
д.
В этом случае следует уметь учитывать кристаллизационную воду.
Процентная концентрация раствора формула:
ω = (mраств. в-ва ·100%)/m р-ра
где ω – процентная концентрация (%),
mраств. в-ва – масса растворенного вещества в (г),
mр-ра – масса раствора в (г).
Задачи на процентную концентрацию растворов|
Пример 1. Сколько соли нужно для приготовления 500 г 3% ее раствора? |
|
|
Дано: 500 г. 3% раствора соли |
Решение: Если сказано, что имеется 3% раствор, это значит, что в любом количестве этого раствора содержится 3% соли. Чтобы рассчитать, сколько нужно соли для приготовления 500 г такого раствора, следует найти 3% от 500 г: (500 · 3) : 100 = 15г Следовательно, соли нужно 15 г, а воды 500— 15 = 485 г. |
|
Пример 2. Сколько кристаллогидрата медного купороса нужно взвесить, чтобы получить 200 г 5% раствора сульфата меди? Сколько воды нужно для этого взять? |
|
|
Дано: 200 г 5% CuSO4 |
Решение: Сначала требуется определить, сколько сульфата меди CuSО4 нужно для приготовления заданного количества раствора: (200 · 5) :100 = 10 г. CuSO4. Далее делаем пересчет на кристаллогидрат: грамм-молекула CuSO4 весит 160 г, а грамм-молекула CuSO4 · 5H2О весит 250 г. Следовательно, мы можем составить пропорцию: 160 г CuSO4— в 250 г CuSO4 · 5H2О 10» CuSО4 — » х » CuSO4· 5Н2О X=(250 · 10) : 160 = 15,625 г. Воды для приготовления раствора требуется 200— 16,6 15= 184,375 г. |
21. Сколько кристаллогидрата Na2SO4 · 10H2O понадобится для приготовления 2 кг 34 раствора Na2SО4?
22. Сколько кристаллогидрата железного купороса FeSO4·7h3O потребуется для приготовления 30 кг 0,5% раствора FeSO 4?
23. Сколько кристаллогидрата CaCl2 · 6H2O потребуется для приготовления 500 г 10% раствора СаСl2?
24. Сколько кристаллогидрата ZnSO4· 7H2O потребуется для приготовления 400 г 0,1 % раствора ZuSО4? (См. Ответ)
Определенная процентная концентрацияИногда приходится приготовлять растворы определенной процентной концентрации, пользуясь для этого другими, более концентрированными растворами.
Особенно часто с этим приходится сталкиваться в лаборатории при получении растворов кислот разной концентрации.
|
Пример 3. Сколько требуется 80% серной кислоты для приготовления 200 г 10% раствора этой кислоты?.
Обозначим массу первого раствора m1 |
|
|
Дано: m1 = 200г C1 = 10% C2 = 80%
|
Прежде всего нужно выяснить, сколько чистой безводной серной кислоты потребуется для приготовления 200 г. 10% раствора: (200 · 10) : 100 = 20 г. Определяем, в каком количестве 80% серной кислоты содержится 20 г чистой кислоты, рассуждая так: в 100 г 80% H2SО4 — 80 г чистой H2SО4 » х » 80% H2SО4 —20 » »H2SО4. Отсюда х = (100 · 20) : 80 = 25 г 80% раствора. Следовательно, для нашей цели нужно 25 г 80% раствора H2SО4 и 200—25 = 175 г воды. |
25. Сколько потребуется 80% фосфорной кислоты для приготовления 2 кг 5% раствора?
26. Сколько потребуется 20% щелочи для приготовления 5 кг. 1 % раствора?
27. Сколько потребуется 15% азотной кислоты для приготовления 700 г 5% раствора?
28. Сколько потребуется 40% серной кислоты для приготовления 4 кг 2% раствора?
29. Сколько потребуется 10% соляной кислоты для приготовления 500 г 0,5% раствора? (См. Ответ)
Приготовление растворов кислотОднако произвести правильный расчет — это для лаборанта еще не все. Нужно уметь не только рассчитать, но и приготовить раствор кислоты.
Но кислоты нельзя взвешивать на весах, их можно только отмерять при помощи мерной посуды. Мерная же посуда предназначена для измерений объема, а не веса.
Поэтому нужно суметь вычислить объем найденного количества раствора. Этого нельзя сделать, не зная удельного веса (плотности) раствора.
Обратимся снова к примеру 3, видно, что 80% серная кислота имеет плотность d = 1,7, а масса раствора Р =25 г. Следовательно, по формуле
V = P : d находим: V = 25 : 1,7 = 14,7 мл.
Плотность воды практически считаем равной единице. Следовательно, 175 г воды займут объем 175 мл. Таким образом, чтобы приготовить 200 г 10% раствора из 80% серной кислоты, следует взять 175 мл воды и налить в нее 14,7 мл 80% серной кислоты.
Смешивание можно производить в любой химической посуде.
Вопросы ответы для определения растворов кислот30. Сколько миллилитров 50% серной кислоты следует взять для приготовления 2 кг 10% раствора этой кислоты?
31. Сколько миллилитров 40% серной кислоты следует взять для приготовления 5 л 4% серной кислоты?
Сколько миллилитров 40% серной кислоты следует взять для приготовления 5 л 4% серной кислоты?
32. Сколько миллилитров 34% едкого кали потребуется для приготовления 10 л 10% раствора?
33. Сколько миллилитров 30% соляной кислоты потребуется для приготовления 500 мл 2% соляной кислоты? (См. Ответ)
Пример определения концентрации раствораПримеры расчетов, которые мы разбирали до сих пор, были посвящены определению веса или объема раствора, а также количества вещества, содержащегося в нем.
Однако бывают случаи, когда нужно определить концентрацию раствора. Рассмотрим простейший случай.
|
Пример 4, Рассчитайте, какова процентная концентрация раствора, если смешано 45 г воды и 5 г соли. |
|
|
Дано: mh3O = 45г mсоли = 5г
|
Решение: Сначала определяем общее количество раствора: 45 г + 5 г = 50 г. Затем определяем процентную концентрацию: (5 : 50) · 100 = 10% Следовательно раствор 10%. |
34 Смешано 25 г соли и 35 г воды. Какова процентная концентрация раствора?
35. Смешано 5 г кислоты и 75 г воды. Какова процентная концентрация раствора? (См. Ответ)
Пример определения разбавленных, выпаренных растворовДовольно часто приходится разбавлять, упаривать и смешивать растворы, после чего определять их концентрацию.
|
Пример 5. К 250 г 10% раствора добавили 150 г воды Какой стала концентрация раствора? |
|
|
Дано: m1 = 250г C1 = 10% mh3O = 150г
|
Решение: Сначала рассчитываем содержи ние вещества в 250 г раствора: (250 · 10) : 100 = 25 г. Определяем общее количество получившегося раствора: 250 + 150 = 400 г. Поскольку мы к раствору приливали только воду, а растворенное вещество не добавляли, то его количество осталось, очевидно, таким же. Следовательно, в 400 г полученного раствора содержится 25 г вещества, а его процентная концентрация(25 : 400) · 100 = 6,25% |
36. К 2 кг 20% раствора прилили 500 г воды. Какой стала концентрация раствора?
37. К 5 а 36% соляной кислоты прилили 1 л воды. Какой стала концентрация раствора?
38. Смешали 40 кг 2% и 10 кг 3% растворов одного и того же вещества. Какой стала концентрация полученного раствора?
39. Смешали 4 л 28% серной кислоты и 500 мл 60% серной кислоты. Какова концентрация полученного раствора?
40. 3 кг 20% раствора едкого натра упарили до 2 кг.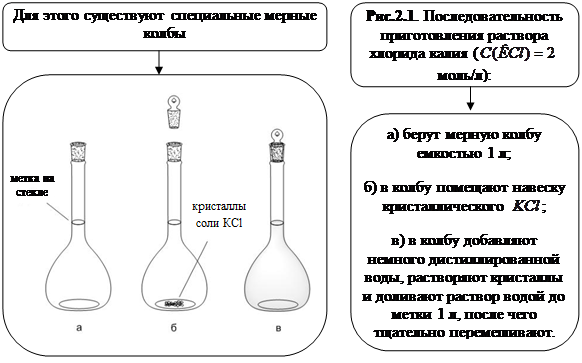 Какова концентрация полученного раствора?
Какова концентрация полученного раствора?
41. Сколько воды нужно прибавить к 500 мл 30% раствора (плотность 1,224 г/см3), чтобы получить 5% раствор? (См. Ответ)
Определение соотношение смешанных разных концентрацийДля определения, в каком соотношении следует смешать растворы разных концентраций, чтобы получить раствор искомой концентрации, можно применять так называемое «правило смешивания», или «диагональную
схему»
|
Пример 6. В каком весовом соотношении следует смешать 40% и 15% растворы, чтобы получить 35% раствор? |
|
Решение. Для решения составляют диагональную схему: 40→20 \ / 35 / \ 15→5 В центре пишут искомую концентрацию. У левого конца каждой диагонали пишут данные концентрации. Затем по диагонали производят вычитание: 35—15 = 20 40 — 35 = 5 (вычитают всегда из большей величины меньшую). Если в смешивании участвует вода, ее концентрация берется равной 0%. |
42. Рассчитайте по диагональной схеме, в каком соотношении следует смешать растворы:
а) 20% и 3% для получения 10%;
б) 70% и 17% для получения 25%;
в) 25% и воду для получения 6% (См. Ответ)
Объемная концентрация растворов Молярная концентрация раствораМолярная концентрация раствора (молярность, мольность) — это количество вещества (число молей) компонента в единице объёма смеси
Молярная концентрация раствора в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Также используют выражение «в молярности».
Возможно другое обозначение молярной концентрации, которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным, записывают «0,5 M».
Расчет молярной концентрацииРасчет концентрации раствора по определению концентрации вещества производят применительно к 1 литру выбранному раствору. Молярная концентрация раствора показывает сколько грамм-молекул (молей) содержится в 1 литре растворенного вещества.
Измерение молярной концентрации удобна тем, что в равных объемах раствора содержится одинаковое количество молей при условии, что они одинаковой молярностью.
Для этого готовят раствор молярной концентрации в мерных колбах определенного объема. На шейке такой колбы имеется отметка, точно ограничивающая нужный объем, а надпись на колбе указывает, на какой объем рассчитана данная мерная колба.
Например, если в 1л раствора содержится 1 моль вещества, то такой раствор называется одномолярным (1 М), если 2 моля, то двумолярным (2 М), если 0,1 моля, тo раствор децимолярный (0,1 М), если 0,01 моля, то раствор сантимолярный (0,01 М) и т. д. Для приготовления растворов молярной концентрации необходимо знать формулу вещества.
д. Для приготовления растворов молярной концентрации необходимо знать формулу вещества.
| Пример 7. Сколько нужно взять едкого натра, чтобы приготовить 200 мл 0,1 М раствора едкого натра NaOH. | |
|
Дано: V = 200 мл С = 0,1 М |
Решение: Прежде; всего вычислим вес грамм-молекулы едкого натра NaOH. 23 + 16 + 1 = 40 г. Так как раствор 0,1 М, то в 1 л раствора содержится 0,1 грамм-молекулы NaOH, т. е. 4 г, а в 200 мл или в 0,2 л, раствора будет содержаться неизвестное количество NaOH. Составляем пропорцию:в 1 л 0,1 М раствора — 4 г NaOH » 0.2 » » — х » NaOH Отсюда 1 : 0,2 = 4 : x x = (4 · 0,2) : 1 = 0,8 г. т. е. для приготовления 200 мл 0,1 М раствора нужно 0,8 г NaOH. |
Молярная концентрация очень удобна тем, что в равных объемах растворов с одинаковой молярностью содержится одинаковое количество молекул, так как в грамм-молекуле любого вещества содержится одно и то же число молекул.
Готовят раствор молярной концентрации в мерных колбах определенного объема.
На шейке такой колбы имеется отметка, точно ограничивающая нужный объем, а надпись на колбе указывает, на какой объем рассчитана данная мерная колба.
Вопросы ответы для определения объемная концентрация растворов, молярная концентрация43. Рассчитайте, какое количество вещества требуется для приготовления следующих растворов:
а) 5 л 0,1 М раствора серной кислоты;
б) 20 мл 2 М раствора соляной кислоты;
в) 500 мл 0,25 М раствора сульфата алюминия;
г) 250 мл 0,5 М раствора хлорида кальция. (См. Ответ)
Пример решения процентных растворовРастворы кислот молярной концентрации нередко приходится готовить из процентных растворов.
|
Пример 8. Сколько требуется 98 % серной кислоты для приготовления 5 л 0,1 М раствора. |
|
|
Дано: V1= 5 л С1= 0,1 М С2 = 98% |
Решение: Определяем содержание чистой серной кислоты в 5 л 0,1 М раствора. 1 моль H2SО4 = 98 г; 0,1 моля H2SО4 = 9,8 г. Для приготовления 5 л 0,1 М раствора H2SО4 необходимо 9,8 · 5 = 49 г чистой H2SО4. Далее найдем, сколько 98% раствора серной кислоты потребуется для приготовления 5 л 0,1 М раствора. Составим пропорцию: в 100 г раствора содержится 98 г h3SО4 » х » » » 49 » H2SO4. Отсюда х = (49 · 100) : 98 = 50 г. |
44. Сколько потребуется 50% азотной кислоты для приготовления 500 мл 0,5 М раствора.
45. Какой объем 98% серной кислоты необходим для приготовления 10 л 3 М раствора?
46. Вычислите молярность следующих растворов:
Вычислите молярность следующих растворов:
а) 20% серной кислоты;
б) 4% едкого натра;
в) 10% азотной кислоты;
г) 50% едкого кали. (См. Ответ)
Нормальная концентрация растворов (эквивалент)Нормальная концентрация растворов выражается количеством грамм-эквивалентов растворенного вещества в 1 л раствора.
Для того чтобы произвести расчет для приготовления раствора нормальной концентрации, нужно знать, что такое эквивалент. Слово «эквивалентный» означает «равноценный».
Эквивалентом называется весовое количество элемента, которое может соединяться с 1 весовой частью водорода или замещать ее в соединениях.
Если в молекуле воды Н2О содержится два атома водорода, весящих в сумме 2 у. е., и один атом кислорода, весящий 16 у. е., то на 1 у. е. водорода приходится 8 у. е. кислорода, что и будет эквивалентом кислорода.
Если мы возьмем какой-нибудь окисел, например закись железа FeO, то в нем водорода нет, но зато есть кислород, а мы нашли из предыдущего расчета, что 8 у. е. кислорода эквивалентны 1 у. е. водорода.
е. кислорода эквивалентны 1 у. е. водорода.
Следовательно, достаточно найти количество железа, способное соединиться с 8 у. е. кислорода, и это также будет его эквивалентом.
Атомный вес железа 56. В окисле 56 у. е. Fe приходится на 16 у. е. кислорода, а на 8 у. е. кислорода железа придется вдвое меньше.
Можно найти эквивалент и для сложных веществ, например для серной кислоты H2SО4.
В серной кислоте на 1 у. е. водорода приходится половина молекулы кислоты (включая, конечно, и водород), так как кислота двухосновная, т. е. эквивалент серной кислоты равен ее молекулярному весу (98 у. е.), деленному на 2, т. е. 49 у. е.
Эквивалент для основанийЭквивалент для основания можно найти, разделив его молекулярный вес на валентность металла.
Например, эквивалент NaOH равен молекулярному весу (40 у. е.), деленному на 1, т. е. на валентность натрия. Эквивалент NaOH равен 40 у. е.
Эквивалент гидроокиси кальция Са(ОН)2 равен молекулярному весу (74 у. е.), деленному на валентность кальция, а именно на 2, т. е. 37 у, е.
е.), деленному на валентность кальция, а именно на 2, т. е. 37 у, е.
Для того чтобы найти эквивалент для какой-нибудь соли, нужно молекулярный вес ее разделить на валентность металла и количество его атомов.
Так, молекулярный вес сульфата алюминия Al2(SO4)3 равен 342 у. е. Эквивалент его равен: 342 : (3 · 2) = 57 у.е. где 3 — валентность алюминия, а 2 — количество атомов алюминия.
■ 47. Рассчитайте эквиваленты следующих соединений; а) фосфорной кислоты; б) гидроокиси бария; в) сульфата натрия;г) нитрата алюминия. (См. Ответ)
Грамм-эквивалентом называется количество граммов вещества, численно равное эквиваленту.
Если в 1 л раствора содержится 1 грамм-эквивалент (г-экв) растворенного вещества, то раствор является одно-нормальным (1 н.), если 0,1 грамм-эквивалента, то деци-нормальным (0,1 н.), если 0,01 грамм-эквивалента, то сантинормальным (0,01 н.) и т. д.
Для расчета нормальной концентрации растворов также необходимо знать формулу вещества.
|
Пример 9. Приготовить 300 мл 0,1 н. раствора серной кислоты H2SО4. |
|
|
Дано: V = 300 мл С = 0,1 н. |
Решение: Молекулярный вес H2SО4 равен 98 у. е., эквивалент H2SО4 равен 98 : 2 = 49 у. е., грамм-эквивалент равен 49 г. Так как раствор 0,1 н., то в 1 л его содержится 0,1 г-экв т. е. 4,9 г, нужно же приготовить 300 мл или 0,3 л этого раствора. Поэтому составим пропорцию:1 : 0,3 = 4,9 : x x = (4,9 · 0,3) : 5 = 1,47 г. т. е. на приготовление 300 мл 0,1 н. раствора серной кислоты пойдет 1,47 г H2SО4. |
Растворы нормальной концентрации, как и молярные, готовят в мерных колбах.
■ 48. Сколько серной кислоты необходимо для приготовления 2 л 0,1 н. раствора?
49. Сколько нужно взять нитрата алюминия, чтобы приготовить 200 мл 0,5 н. раствора? (См. Ответ)
Что такое нормальные растворыЧислом грамм эквивалентов растворенного вещества, содержащихся в 1 л раствора. Такие растворы носят общее название нормальных растворов.
Раствор, содержащий в литре один грамм-эквивалент растворенного вещества, называется одно-нормальным или, просто, нормальным раствором и обозначается буквой «н». Если раствор содержит 0,5 грамм-эквивалента в 1 л, то он называется полунормальным (0,5 н.), если содержит 0,1 грамм-эквивалента,— децинормальным (0,1 н.) и т. д.
Для того чтобы записать такие растворы пользуются формулой:
с(fegB) = c ((1/z)B) = z • cB = z • ((nB)/V) = (1/feg)•(nB)/V)
nB — количество вещества компонента, моль;
V — общий объём смеси, литров;
z — число эквивалентности.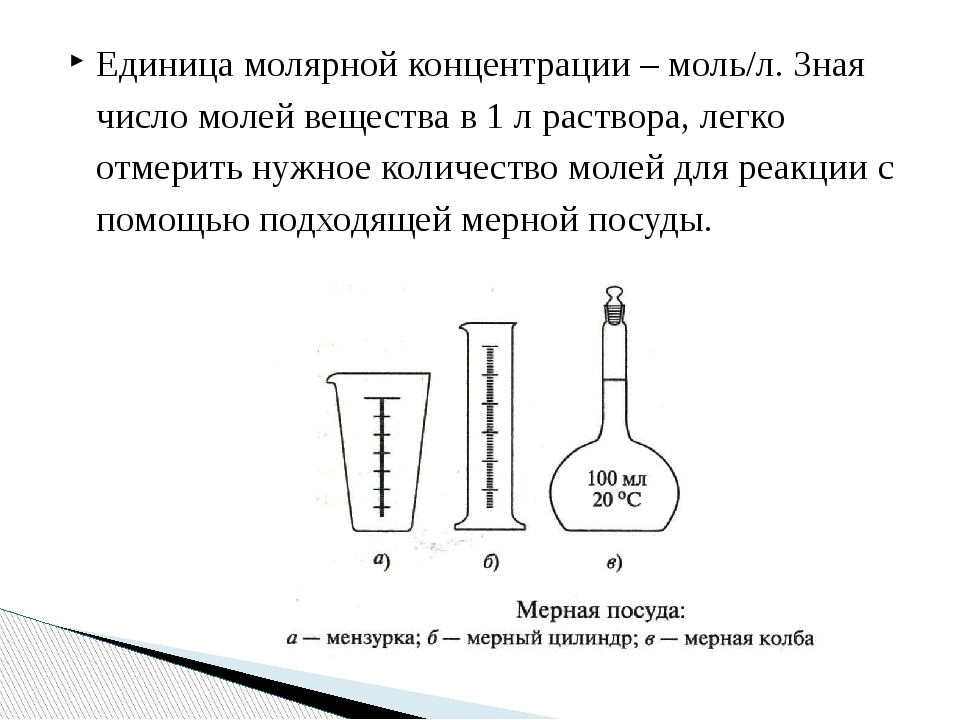
При приготовлении нормальных растворов сложных веществ — кислот, оснований и солей — следует иметь в виду, что эквивалент кислоты равен не молекулярному весу, деленному на основность, т. е. на число атомов водорода в молекуле кислоты, способных замещаться металлами.
Эквивалент основания равен его молекулярному весу, деленному на валентность соответствующего металла.
Что же касается солей, то для нахождения их эквивалентов молекулярный вес соли делят на число атомов металла в ее молекуле и на валентность этого металла.
Применение нормальных растворовНормальные растворы широко применяются в химии при проведении реакций между растворенными веществами.
Пользуясь нормальными растворами, легко заранее рассчитать, в каких объемных отношениях они должны быть смешаны, чтобы растворенные вещества прореагировали без остатка.
Так как весовые количества реагирующих веществ пропорциональны их эквивалентам, то для реакции всегда нужно брать такие объемы растворов, которые содержали бы одинаковое число грамм-эквивалентов растворенных веществ.
При одинаковой нормальности растворов эти объемы, очевидно, будут равны между собой, при различной — обратно пропорциональны нормальностям.
Если объемы затрачиваемых на реакцию растворов обозначить через υ1 и υ2, а их нормальности, т. е. концентрации, выраженные в грамм-эквивалентах на литр, соответственно через С1 и С2, то зависимость между этими величинами выразится пропорцией:
υ1 : υ2= c2 : c1 или υ1 • c1 = υ2 • c2
На оснований этой зависимости можно не только вычислять требуемые для проведения реакций объемы растворов, но и обратно, по объемам затраченных на реакцию растворов находить их концентрации, а следовательно, и весовые количества прореагировавших веществ.
Пример определения нормальных растворовЭквивалент HNO3 (мол. вес 63) равен 63: 1 = 63
> H2SO4 (мол. вес 98) » 98:2 = 49
вес 98) » 98:2 = 49
> Са(ОН)2 (мол. вес 74) > . 74:2 = 37
> Al2(SO4)3 (мол. вес 342) > 342 : (2 • 3) = 57
Примеры получения раствораПример 1. Сколько миллилитров 0,3 н. раствора NaCl надо прибавить к 150 мл 0,16 н. раствора AgNO3, чтобы осадить все находящееся в растворе серебро в виде AgCl?
Составляем пропорцию:
0,3:0,16= 150: л:
откуда
х = (0,16 х 150): 0,3 = 80 мл
Пример 2. Для нейтрализации 40 мл раствора серной кислоты потребовалось прибавить к ним 24 мл 0,2 н. раствора щелочи. Определить, сколько граммов h3SO4 содержалось во взятом объеме раствора.
Обозначив неизвестную нормальность раствора серной кислоты через х, составляем пропорцию:
40:24 = 0,2:x
откуда
х = (24 х 0,2) : 40 = 0,12
Так как грамм-эквивалент серной кислоты (мол. вес 98) равняется
вес 98) равняется
98:2 = 49,
то, очевидно, в литре 0,12 н. раствора содержится 49×0,12 = 5,88 г
H2SO4. Количество серной кислоты, содержащееся в 40 мл раствора, находим из пропорции:
1000 : 40 = 5,88 :х
x = (40×5,88):1000 =0,2352 г
Растворы нормальной концентрацииНередко приходится готовить растворы нормальной концентрации из концентрированных растворов процентной концентрации. Это делается так же, как и при приготовлении растворов молярной концентрации, но рассчитывается не грамм-молекулярный, а грамм-эквивалентный вес .
Сколько нужно взять 60% азотной кислот, чтобы приготовить 200 мл 3 н. раствора? 61. Какой объем 20% серной кислоты необходим для приготовления 20 л 0,1 н. раствора?
Нормальная концентрация очень удобна, так как если растворы имеют одинаковую нормальность, то в равных объемах этих растворов содержатся эквивалентные количества растворенных веществ.
Поэтому вещества, содержащиеся в равных объемах таких растворов, реагируют нацело (если, разумеется, вообще могут между собой реагировать).
Например, если взять 1,5 л 0,1 н. раствора едкого натра и 0,1 н. раствор соляной кислоты, то для реакции с едким натром потребуется также 1,5 л раствора соляной кислоты.
Чем выше концентрация раствора, тем меньший его объем требуется для реакции, т. е. между объемами растворов реагирующих веществ и их концентрациями существует обратная зависимость, которую можно выразить формулой:
где V — объем, а С — концентрация раствора.
Исходя из этой формулы, можно определить любую из четырех величин, если известны три остальные.
|
Пример 10. Какова нормальность соляной кислоты, если на нейтрализацию 20 мл ее пошло 30 мл 0,1 и. едкого натра. |
|
|
Дано: V1 = 20 мл V2 = 30 мл С2 = 0,1 н.
|
Решение: Подставляя данные задачи в фор мулу, получаем V1 : V2 = C2 : C1 20 : 30 = 0,1 : C1 ; C1 = (0,1 · 30) : 20 = 0,15 н. Следовательно, концентрация соляной кислоты 0,15 н. |
52. На нейтрализацию 10 мл 0,2 н. раствора кислоты пошло 8 мл раствора едкого кали. Какова нормальность раствора едкого кали?
53. Какой объем 0,1 н. раствора едкого натра будет затрачен на реакцию с 25 мл 0,5 н. раствора хлорида железа (III)?
54. Сколько граммов серной кислоты содержится в 300 мл раствора, если на нейтрализацию 5 мл его израсходовано 8 мл 1 н. раствора едкого натра? (См. Ответ)
Процентное содержание веществаПодобные расчеты широко применяются в количественном анализе.
Нередко лаборанту нужно знать процентное содержание вещества в растворе той или иной объемной концентрации.
В этом случае необходимо научиться производить перерасчет раствора объемной концентрации на весовую и наоборот.
Пример решения содержание вещества|
Пример 11. Рассчитать нормальность 10% раствора едкого натра. Плотность раствора 1,115 г/см3. |
|
|
Дано: CNaOH = 10% dNaOH = 1,115
|
Решение: Грамм-эквивалент NaOH = 40 : 1 = 40 г. В 100 г раствора содержится 10 г NaOH, что равно = 0,25 г·экв. Объем 100 раствора равен 100 : 1,115 мл, следовательно в 100 : 1,115 мл — 0,25 г · экв NaOH » 1000 » -x » NaOH Отсюда х = (0,25 · 1000 · 1,115) : 100 = 2,7875 н. |
56. Рассчитайте нормальность следующих растворов:
Рассчитайте нормальность следующих растворов:
а) 28% раствора едкого кали;
б) 8% раствора едкого натра;
в) 18% раствора соляной кислоты.
56. Смешано 500 мл 20%, 20 мл 0,2 н. и 300 мл 0,5 М растворов серной кислоты. Рассчитайте нормальность и молярность образовавшегося раствора.
57. Какова молярность 40% раствора едкого натра?
58. Какова нормальность 6% раствора едкого кали?
59. Какова нормальность соляной кислоты, если на нейтрализацию 20 мл ее израсходовано 40 мл 0,2 н. раствора гидроокиси кальция?
60. В каких соотношениях надо смешать 20% и 5% растворы одного и того же вещества, чтобы получился 12% раствор?
61. Какой объем 80% раствора серной Кислоты нужно взять, чтобы приготовить 2 л 2н. раствора этой кислоты? (См. Ответ)
Какой раствор называется насыщеннымДля получения насыщенного раствора к растворителю прибавляют растворяемое вещество в таком количестве, чтобы часть его осталась не растворенной. Насыщенными растворами приходится пользоваться сравнительно редко.
Насыщенными растворами приходится пользоваться сравнительно редко.
В большинстве случаев употребляют растворы ненасыщенные, т. е. с меньшей концентрацией растворенного вещества, чем в насыщенном растворе.
Не следует смешивать понятия «концентрированный» и «насыщенный». Концентрированный раствор отнюдь не обязательно должен быть насыщен.
Пример получения насыщенного раствораНапример, раствор, содержащий 20 г KNО3 на 100 г воды, является довольно концентрированным раствором, но если температура его 20°, то он еще далеко не насыщенный.
Для получения насыщенного раствора при этой температуре нужно было бы взять 31,5 г селитры на 100 г воды.
Насыщенный раствор может быть очень разбавленным, если данное вещество плохо растворимо.
В качестве примера можно указать на насыщенный раствор гипса, который при 20° содержит только 0,21 г гипса в 100 г раствора.
Измерение объемов растворовНа измерении объемов растворов, затрачиваемых на реакцию, основан метод количественного определения веществ, получивший название объемного анализа.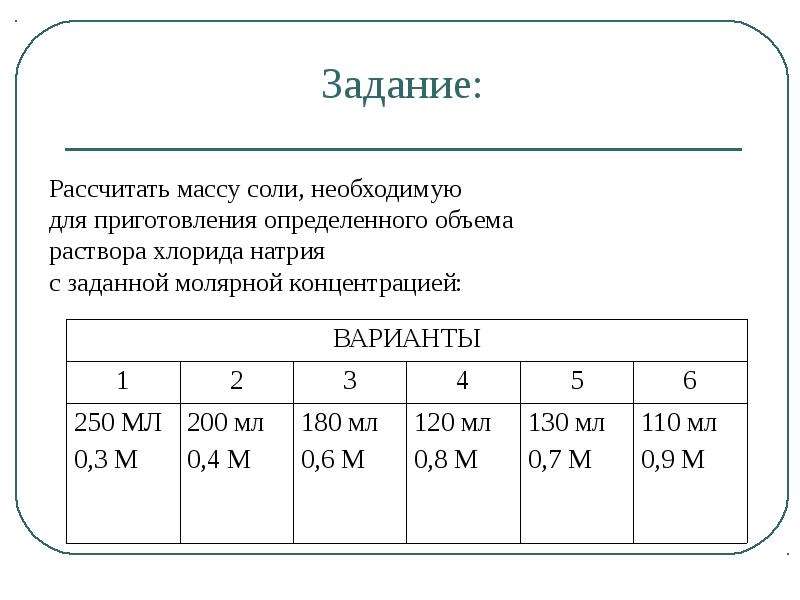
Точное измерение объемов растворов производится при помощи бюреток, представляющих собой стеклянные трубки, нижний конец которых сужен и снабжен краном для выпускания жидкости или стеклянным наконечником, присоединенным к бюретке посредством резиновой трубочки с зажимом.
На трубках нанесены деления, отмечающие обычно десятые доли миллилитра. Если требуется сразу отмерить определенный объем жидкости, то пользуются пипетками.
Для объемных определений необходимо, чтобы конец взаимодействия между растворенными веществами обнаруживался каким-либо достаточно резким внешним признаком, например изменением окраски раствора.
С этой целью к исследуемому раствору обычно прибавляют небольшое количество так называемого индикатора — вещества, которое, не влияя на направление процесса, резко изменяет свою окраску в тот момент, когда избыток находящегося в растворе одного вещества заменяется ничтожным избытком другого.
Так, например, при реакции между кислотой и щелочью индикатором может служить раствор лакмуса, изменяющий свою окраску при переходе от кислой среды к щелочной и обратно.
Определение концентрации раствора выполняется следующим образом. В небольшой стаканчик при помощи пипетки отмеривают определенный объем исследуемого раствора и прибавляют к нему несколько капель раствора индикатора.
Подставив стаканчик под бюретку, понемногу выпускают из нее в стаканчик второй раствор, концентрация которого точно известна.
Прибавление раствора из бюретки производят до момента изменения окраски индикатора. Затем по делениям на бюретке устанавливают объем выпущенного раствора.
Концентрацию исследуемого раствора рассчитывают на основании соотношения между объемами затраченных на реакцию растворов.
При объемном анализе концентрацию растворов часто выражают числом граммов растворенного вещества, содержащихся в 1 мл раствора. Выраженная таким образом концентрация называется титром раствора. Отсюда и самый метод определения концентрации, описанный выше, называется титрованием.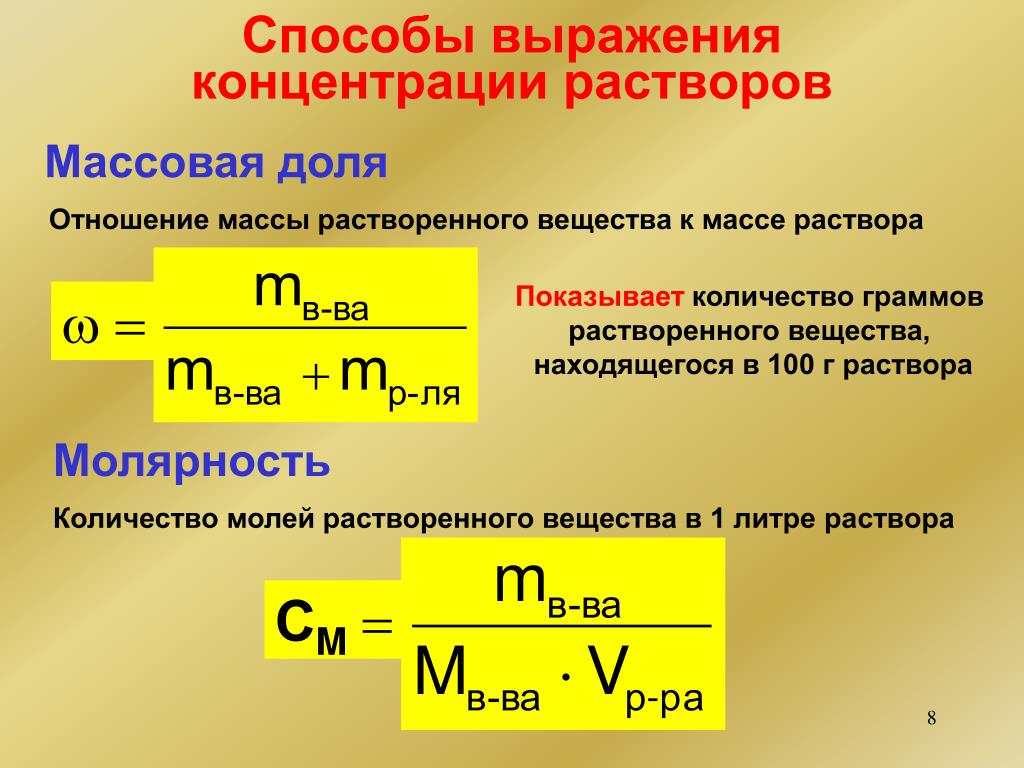
Статья на тему Концентрация раствора
75 76 77
Практическая работа №1. Приготовление растворов с заданной молярной концентрацией
1. Практическая работа №1
ПРИГОТОВЛЕНИЕ РАСТВОРОВС ЗАДАННОЙ МОЛЯРНОЙ
КОНЦЕНТРАЦИЕЙ
2. Цель:
Научитьсяготовить растворы
с
заданной молярной
концентрацией.
3. Правила техники безопасности
Не выполняйте опыты, не ознакомившись с общимиправилами техники безопасности в кабинете химии.
Используйте только чистую посуду.
При случайном повреждении посуды сообщите
учителю или лаборанту, осколки не убирайте
самостоятельно.
Рассыпанные твёрдые вещества не собирайте
руками.
При растворении твердых веществ в воде,
пользуйтесь стеклянной палочкой.
Закончив эксперимент, приведите рабочее место в
порядок.
4. Задание:
Рассчитать массу соли, необходимуюдля приготовления определенного объема
раствора хлорида натрия
с заданной молярной концентрацией:
ВАРИАНТЫ
1
2
250 МЛ 200 мл
0,3 М
0,4 М
3
180 мл
0,6 М
4
120 мл
0,8 М
5
130 мл
0,7 М
6
110 мл
0,9 М
5.
 C = ν / V C=ν/V
C = ν / V C=ν/VМолярной концентрацией раствора
называют отношение количества
растворенного вещества к объему
раствора
Молярная концентрация показывает
число молей растворённого вещества
в одном литре раствора
6. Алгоритм приготовления определённого объёма раствора с заданной молярной концентрацией
Рассчитать массу хлорида натрия.Для расчетов использовать формулы:
C = ν / V; ν = C V; m = ν M; m = C V M
Взвесить на весах рассчитанную навеску.
Перенести навеску соли в мерную колбу.
Прилить в колбу немного воды и перемешать стеклянной
палочкой до полного растворения соли.
Налить в мерную колбу воды до метки.
Чтобы не перелить воду, последние капли добавлять с
помощью пипетки.
7. Составьте отчет о работе.
Сделайте вывод:Научились ли Вы готовить растворы определенного
объема с заданной молярной концентрацией?
Приготовление титрованных растворов. Расчеты при приготовлении растворов молярной и нормальной концентрации
Определите, что вам известно и что нет. В химии разведение означает обычно получение небольшого количества раствора известной концентрации, с последующим его разбавлением нейтральной жидкостью (например водой) и получением, таким образом, менее концентрированного раствора большего объема. Эта операция очень часто применяется в химических лабораториях, поэтому в них реагенты хранятся для удобства в концентрированном виде и разбавляются при необходимости. На практике, как правило, вам известна начальная концентрация, а также концентрация и объем раствора, который вы хотите получить; при этом неизвестен объем концентрированного раствора, который необходимо разбавить.
В химии разведение означает обычно получение небольшого количества раствора известной концентрации, с последующим его разбавлением нейтральной жидкостью (например водой) и получением, таким образом, менее концентрированного раствора большего объема. Эта операция очень часто применяется в химических лабораториях, поэтому в них реагенты хранятся для удобства в концентрированном виде и разбавляются при необходимости. На практике, как правило, вам известна начальная концентрация, а также концентрация и объем раствора, который вы хотите получить; при этом неизвестен объем концентрированного раствора, который необходимо разбавить.
- В другой ситуации, например при решении школьной задачи по химии, в качестве неизвестной может выступать другая величина: к примеру, вам даны начальный объем и концентрация, и требуется найти конечную концентрацию итогового раствора при его известном объеме. В любом случае полезно выписать известные и неизвестные величины, прежде чем приступать к задаче.

- Рассмотрим пример. Пускай нам необходимо развести раствор концентрацией 5 M, чтобы получить раствор концентрацией 1 мM
. В данном случае нам известна концентрация начального раствора, а также объем и концентрация раствора, который необходимо получить; не
известен объем исходного раствора, который надо развести водой.
- Помните: в химии М служит мерой концентрации, называемой также молярностью , которая соответствует количеству молей вещества на 1 литр раствора.
Подставьте известные значения в формулу C 1 V 1 = C 2 V 2 . В этой формуле C 1 — концентрация начального раствора, V 1 — его объем, C 2 — концентрация конечного раствора, и V 2 — его объем. Из полученного уравнения вы без труда определите искомую величину.
- Иногда полезно поставить вопросительный знак перед величиной, которую вы собираетесь найти.
- Вернемся к нашему примеру. Подставим в равенство известные нам значения:
- C 1 V 1 = C 2 V 2
- (5 M)V 1 = (1 мM)(1 л).
 Концентрации имеют разные единицы измерения. Давайте чуть подробнее остановимся на этом.
Концентрации имеют разные единицы измерения. Давайте чуть подробнее остановимся на этом.
Учитывайте любое различие в единицах измерения. Поскольку разбавление приводит к уменьшению концентрации, и нередко значительному, иногда концентрации измерены в разных единицах. Если упустить это, вы можете ошибиться с результатом на несколько порядков. Перед решением уравнения приведите все значения концентрации и объема к одинаковым единицам измерения.
- В нашем случае используются две единицы концентрации, M и мM. Переведем все в М:
- 1 мM × 1 M/1.000 мM
- = 0,001 M .
Решим уравнение. Когда вы привели все величины к одинаковым единицам измерения, можете решать уравнение. Для его решения почти всегда достаточно знания простых алгебраических операций.
- Для нашего примера: (5 M)V 1 = (1 мM)(1 л). Приведя все к одинаковым единицам, решим уравнение относительно V 1 .
- (5 M)V 1 = (0,001 M)(1 л)
- V 1 = (0,001 M)(1 л)/(5 M).

- V 1 = 0,0002 л, или 0.2 мл.
Подумайте о применении полученного результата на практике. Допустим, вы вычислили искомую величину, но все еще затрудняетесь приготовить реальный раствор. Такая ситуация вполне понятна — язык математики и чистой науки иногда далек от реального мира. Если вам уже известны все четыре величины, входящие в уравнение C 1 V 1 = C 2 V 2 , поступите следующим образом:
- Измерьте объем V 1 раствора концентрацией C 1 . Затем долейте разводящую жидкость (воду и т.п.), чтобы объем раствора стал равен V 2 . Этот новый раствор и будет обладать необходимой концентрацией (C 2).
- В нашем примере мы сначала отмеряем 0,2 мл исходного раствора концентрацией 5 M. Затем разводим его водой до объема 1 л: 1 л — 0,0002 л = 0,9998 л, т.е. добавляем к нему 999,8 мл воды. Получившийся раствор будет иметь необходимую нам концентрацию 1 мM.
Для приготовления растворов молярной и нормальной концентрации навеску вещества отвешивают на аналитических весах, а растворы готовятся в мерной колбе. При приготовлении растворов кислот нужный объем концентрированного раствора кислоты отмеряют бюреткой со стеклянным краном.
При приготовлении растворов кислот нужный объем концентрированного раствора кислоты отмеряют бюреткой со стеклянным краном.
Навеска растворяемого вещества подсчитывается с точностью до четвертого десятичного знака, а молекулярные массы берутся с точностью, с которой они приведены в справочных таблицах. Объем концентрированной.кислоты подсчитывается с точностью до второго десятичного знака.
Пример 1. Сколько граммов хлорида бария необходимо для приготовления 2 л 0,2 М раствора?
Решение. Молекулярная масса хлорида бария равна 208,27. Следовательно. 1л 0,2 М раствора должен содержать 208,27-0,2= = 41,654 г ВаС1 2 . Для приготовления 2 л потребуется 41,654-2 = 83,308 г ВаС1 2 .
Пример 2. Сколько граммов безводной соды Na 2 C0 3 потребуется для приготовления 500 мл 0,1 н. раствора?
Решение. Молекулярная масса соды равна 106,004; эквивалент-пая масса 5 N a 2 C0 3 =М: 2 = 53,002; 0,1 экв. = 5,3002 г.
1000 мл 0,1 н. раствора содержат 5,3002 г Na 2 C0 3
500 »» » » » х
» Na 2 C0 3
5,3002-500
х=——
Гооо—- = 2-6501 г Na 2 C0 3 .
Пример 3. Сколько концентрированной серной кислоты (96%: d=l,84) требуется для приготовления 2 л 0,05 н. раствора серной кислоты?
Решение. Молекулярная масса серной кислоты равна 98,08. Эквивалентная масса серной кислоты 3h 2 so 4 =М: 2=98,08: 2 = 49,04 г. Масса 0,05 экв. = 49,04-0,05 = 2,452 г.
Найдем, сколько H 2 S0 4 должно содержаться в 2 л 0,05 н. раствора:
1 л-2,452 г H 2 S0 4
2 »- х » H 2 S0 4
х = 2,452-2 = 4,904 г H 2 S0 4 .
ЧтобА определить, сколько для этого надо взять 96,% раствора H 2 S0 4 , составим пропорцию:
\ в 100 г конц. H 2 S0 4 -96 г H 2 S0 4
У » » H 2 S0 4 -4,904 г H 2 S0 4
4,904-100
У
=——— §6—— = 5,11 г H 2 S0 4 .
Пересчитываем это количество на объем: ,. Р 5,11
К = 7 = ТЖ = 2 ‘ 77 мл —
Таким образом, для приготовления 2 л 0,05 н. раствора надо взять 2,77 мл концентрированной серной кислоты.
Пример 4. Вычислить титр раствора NaOH, если известно что его точная концентрация равна 0,0520 н.
Решение. Напомним, что титром называется содержание в 1 мл раствора вещества в граммах. Эквивалентная масса NaOH=40 01 г Найдем, сколько граммов NaOH содержится в 1 л данного раствора:
40,01-0,0520 = 2,0805 г.
1итр раствора: -щ=- =0,00208 г/мл. Можно воспользоваться также формулой:
9 N
где Т — титр, г/мл; Э — эквивалентная масса; N — нормальность раствора.
Тогда титр данного раствора:
ф 40,01 0,0520
«NaOH =——— jooo—— 0,00208 г/мл.
„ «Р ие Р 5 — Вычислить нормальную концентрацию раствора HN0 3 , если известно, что титр данного раствора равен 0,0065 Для расчета воспользуемся формулой:
Т ■ 1000 63,05
5hno 3 = j- = 63,05.
Нормальная концентрация раствора азотной кислоты равна:
— V = 63,05 = 0,1030 н.
Пример 6. Какова нормальная концентрация раствора, если известно, что в 200 мл этого раствора содержится 2,6501 г Na 2 C0 3
Решение.
Как было вычислено в примере 2, Зма 2 со(=53,002.
Найдем, сколько эквивалентов составляет 2,6501 г Na 2 C0 3: Г
2,6501: 53,002 = 0,05 экв. /
Для того чтобы вычислить нормальную концентрацию раствора, составим пропорцию:
1000 » » х »
1000-0,05
х =
—————— =0,25 экв.
В 1 л данного раствора будет содержаться 0,25 эквивалентов, т. е. раствор будет 0,25 н.
Для такого расчета можно воспользоваться формулой:
Р- 1000
где Р — количество вещества в граммах; Э — эквивалентная масса вещества; V — объем раствора в миллилитрах.
Зыа 2 со 3 =53,002, тогда нормальная концентрация данного раствора
2,6501-10С0 N = 53,002-200
Солевой раствор может понадобится для самых разных целей, например, он входит в состав некоторых средств народной медицины. Так как приготовить 1-процентный раствор, если дома нет специальных мензурок для измерения количества продукта? В целом даже и без них можно сделать 1-процентный раствор соли. Как приготовить его, подробно рассказано далее. Прежде чем приступать к приготовлению такого раствора, следует внимательно изучить рецепт и точно определиться с необходимыми ингредиентами. Все дело в том, что определение «соль» может относиться к разным веществам. Иногда это оказывается обычная пищевая соль, иногда каменная или и вовсе хлорид натрия. Как правило, в подробном рецепте всегда удается отыскать пояснение того, какое именно вещество рекомендуется использовать. В народных рецептах нередко указывается также сульфат магния, которые имеет второе название «английская соль».
Как приготовить его, подробно рассказано далее. Прежде чем приступать к приготовлению такого раствора, следует внимательно изучить рецепт и точно определиться с необходимыми ингредиентами. Все дело в том, что определение «соль» может относиться к разным веществам. Иногда это оказывается обычная пищевая соль, иногда каменная или и вовсе хлорид натрия. Как правило, в подробном рецепте всегда удается отыскать пояснение того, какое именно вещество рекомендуется использовать. В народных рецептах нередко указывается также сульфат магния, которые имеет второе название «английская соль».
Если вещество требуется, например, для полоскания горла или снятия боли с зуба, то чаще всего в таком случае рекомендуется применять именно солевой раствор хлорида натрия. Чтобы полученное средство обладало целебными свойствами и не нанесло вред организму человека, следует подбирать для него исключительно качественные ингредиенты. Например, каменная соль содержит много лишних примесей, поэтому вместо нее лучше использовать обычную мелкую (для полоскания можно и йодированную). Что касается воды, то в домашних условиях следует применять фильтрованную или хотя бы кипяченую. В некоторых рецептах рекомендуется использовать дождевую воду или снег. Но, учитывая современное экологическое состояние, делать этого не стоит. Особенно — жителям крупных мегаполисов. Лучше просто тщательно очистить воду из-под крана.
Что касается воды, то в домашних условиях следует применять фильтрованную или хотя бы кипяченую. В некоторых рецептах рекомендуется использовать дождевую воду или снег. Но, учитывая современное экологическое состояние, делать этого не стоит. Особенно — жителям крупных мегаполисов. Лучше просто тщательно очистить воду из-под крана.
Если специального фильтра дома не оказалось, то можно использовать для очистки воды известный «дедовский» метод. Он подразумевает замораживание воды из-под крана в морозилке. Как известно, в процессе в лед первым делом превращается именно самая чистая жидкость, а все вредные примеси и грязь опускается на дно емкости. Не дожидаясь замораживания всего стакана, следует снимать верхнюю ледяную часть и затем растапливать ее. Такая вода окажется максимально чистой и безопасной для здоровья. Именно ее можно использовать для приготовления солевого раствора.
Теперь стоит определиться с единицами измерения жидкости и твердого вещества. Для соли удобнее всего использовать чайную ложку. Как известно, в ней помещается 7 грамм продукта, если ложечка с горкой, то 10. Последний вариант удобнее применять для высчитывания процентного соотношения. Воду отмерить легко обычным граненым стаканом, если в доме нет специальных мензурок. В нем содержится 250 миллилитров воды. Масса 250 миллилитров чистой пресной воды равна 250 граммам. Удобнее всего использовать полстакана жидкости или 100 граммов. Далее самый сложный этап приготовления солевого раствора. Стоит еще раз внимательно изучить рецепт и определиться с пропорциями. Если в нем рекомендуется взять 1% раствор соли, то в каждых 100 граммах жидкости потребуется растворить 1 грамм твердого вещества. Максимально точные расчеты подскажут, что необходимо будет взять 99 граммов воды и 1 грамм соли, но вряд ли потребуется такая точность.
Как известно, в ней помещается 7 грамм продукта, если ложечка с горкой, то 10. Последний вариант удобнее применять для высчитывания процентного соотношения. Воду отмерить легко обычным граненым стаканом, если в доме нет специальных мензурок. В нем содержится 250 миллилитров воды. Масса 250 миллилитров чистой пресной воды равна 250 граммам. Удобнее всего использовать полстакана жидкости или 100 граммов. Далее самый сложный этап приготовления солевого раствора. Стоит еще раз внимательно изучить рецепт и определиться с пропорциями. Если в нем рекомендуется взять 1% раствор соли, то в каждых 100 граммах жидкости потребуется растворить 1 грамм твердого вещества. Максимально точные расчеты подскажут, что необходимо будет взять 99 граммов воды и 1 грамм соли, но вряд ли потребуется такая точность.
Вполне возможно допустить некоторую погрешность и, например, в один литр воды добавить одну чайную ложку соли с горкой, чтобы получить 1-процентный солевой раствор. В настоящее время он нередко применяется, например, при лечении простудных заболеваний и особенно боли в горле.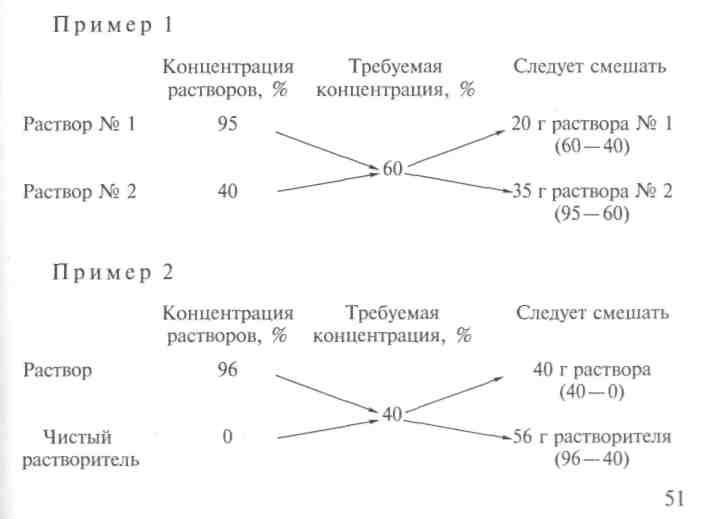 В готовый раствор можно добавить также соду или несколько капель йода. Получившаяся смесь для полоскания станет отличным действенным и эффективным средством против боли в горле. Неприятные ощущения уйдут всего после нескольких процедур. Кстати, такой раствор не запрещен для использования самым маленьким членам семьи. Главное, не переусердствовать с дополнительными ингредиентами (особенно с йодом), в противном случае можно повредить слизистую оболочку полости рта и лишь усугубить состояние больного горла.
В готовый раствор можно добавить также соду или несколько капель йода. Получившаяся смесь для полоскания станет отличным действенным и эффективным средством против боли в горле. Неприятные ощущения уйдут всего после нескольких процедур. Кстати, такой раствор не запрещен для использования самым маленьким членам семьи. Главное, не переусердствовать с дополнительными ингредиентами (особенно с йодом), в противном случае можно повредить слизистую оболочку полости рта и лишь усугубить состояние больного горла.
Также солевой раствор может применяться для облегчения тянущей ноющей зубной боли. Правда, эффективнее использовать более насыщенный, например, 10-процентный. Такая смесь действительно на непродолжительное время способна снять болезненные неприятные ощущения в полости рта. Но она не является лекарственным средством, поэтому откладывать посещение стоматолога после облегчения ни в коем случае нельзя.
Приблизительные растворы.
При приготовлении приблизительных растворов количества веществ, которые должны быть взяты для этого, вычисляют с небольшой точностью. Атомные веса элементов для упрощения расчетов допускается брать округленными иногда до целых единиц. Так, для грубого подсчета атомный вес железа можно принять равным 56 вместо точного -55,847; для серы — 32 вместо точного 32,064 и т. д.
Атомные веса элементов для упрощения расчетов допускается брать округленными иногда до целых единиц. Так, для грубого подсчета атомный вес железа можно принять равным 56 вместо точного -55,847; для серы — 32 вместо точного 32,064 и т. д.
Вещества для приготовления приблизительных растворов взвешивают на технохимических или технических весах.
Принципиально расчеты при приготовлении растворов совершенно одинаковы для всех веществ.
Количество приготовляемого раствора выражают или в единицах массы (г, кг), или в единицах объема (мл, л), причем для каждого из этих случаев вычисление количества растворяемого вещества проводят по-разному.
Пример. Пусть требуется приготовить 1,5 кг 15%-ного раствора хлористого натрия; предварительно вычисляем требуемое количе-ство соли. Расчет проводится согласно пропорции:
т. е. если в 100 г раствора содержится 15 г соли (15%), то сколько ее потребуется для приготовления 1500 г раствора?
Расчет показывает, что нужно отвесить 225 г соли, тогда воды иужио взять 1500 — 225 = 1275 г. ¦
¦
Если же задано получить 1,5 л того же раствора, то в этом случае по справочнику узнают его плотность, умножают последнюю на заданный объем и таким образом находят массу требуемого количества раствора. Так, плотность 15%-нoro раствора хлористого натрия при 15 0C равна 1,184 г/см3. Следовательно, 1500 мл составляет
Следовательно, количество вещества для приготовления 1,5 кг и 1,5 л раствора различно.
Расчет, приведенный выше, применим только для приготовления растворов безводных веществ. Если взята водная соль, например Na2SO4-IOh3O1 то расчет несколько видоизменяется, так как нужно принимать во внимание и кристаллизационную воду.
Пример. Пусть нужно приготовить 2 кг 10%-ного раствора Na2SO4, исходя из Na2SO4 *10h3O.
Молекулярный вес Na2SO4 равен 142,041, a Na2SO4*10h3O 322,195, или округленно 322,20.
Расчет ведут вначале па безводную соль:
Следовательно, нужно взять 200 г безводной соли. Количество десятиводной соли находят из расчета:
Воды в этом, случае нужно взять: 2000 — 453,7 =1546,3 г.
Так как раствор не всегда готовят с пересчетом на безводную соль, то на этикетке, которую обязательно следует наклеивать на сосуд с раствором, нужно указать, из какой соли приготовлен раствор, например 10%-ный раствор Na2SO4 или 25%-ный Na2SO4*10h3O.
Часто случается, что приготовленный ранее раствор нужно разбавить, т. е. уменьшить его концентрацию; растворы разбавляют или по объему, или по массе.
Пример. Нужно разбавить 20%-ный раствор сернокислого аммония так, чтобы получить 2 л 5%-иого раствора. Расчет ведем следующим путем. По справочнику узнаем, что плотность 5%-ного раствора (Nh5)2SO4 равна 1,0287 г/см3. Следовательно, 2 л его должны весить 1,0287*2000 = 2057,4 г. В этом количестве должно находиться сернокислого аммония:
Учитывая, что при отмеривании могут произойти потери, нужно взять 462 мл и довести их до 2 л, т. е. добавить к ним 2000-462 = = 1538 мл воды.
Если же разбавление проводить по массе, расчет упрощается. Но вообще разбавление проводят из расчета на объем, так как жидкости, особенно в больших количествах, легче отмерить по объему, чем взвесить.
Нужно помнить, что при всякой работе как с растворением, так и с разбавлением никогда не следует выливать сразу всю воду в сосуд. Водой ополаскивают несколько раз ту посуду, в которой проводилось взвешивание или отмеривание нужного вещества, и каждый раз добавляют эту воду в сосуд для раствора.
Когда не требуется особенной точности, при разбавлении растворов или смешивании их для получения растворов другой концентрации можно пользоваться следующим простым и быстрым способом.
Возьмем разобранный уже случай разбавления 20%-ного раствора сернокислого аммония до 5%-ного. Пишем вначале так:
где 20 — концентрация взятого раствора, 0 — вода и 5″—требуемая концентрация. Теперь из 20 вычитаем 5 и полученное значение пишем в правом нижнем углу, вычитая же нуль из 5, пишем цифру в правом верхнем углу. Тогда схема примет такой вид:
Это значит, что нужно взять 5 объемов 20%-ного раствора и 15 объемов воды. Конечно, такой расчет не отличается точностью.
Если смешивать два раствора одного и того же вещества, то схема сохраняется та же, изменяются только числовые значения. Пусть смешением 35%-ного раствора и 15%-ного нужно приготовить 25%-ный раствор. Тогда схема примет такой вид:
т. е. нужно взять по 10 объемов обоих растворов. Эта схема дает приблизительные результаты и ею можно пользоваться только тогда, когда особой точности не требуется.Для всякого химика очень важно воспитать в себе привычку к точности в вычислениях, когда это необходимо, и пользоваться приближенными цифрами в тех случаях, когда это не повлияет на результаты работы.Когда нужна большая точность при разбавлении растворов, вычисление проводят по формулам.
Разберем несколько важнейших случаев.
Приготовление разбавленного раствора . Пусть с — количество раствора, m%-концентрация раствора, который нужно разбавить до концентрации п%. Получающееся при этом количество разбавленного раствора х вычисляют по формуле:
а объем воды v для разбавления раствора вычисляют по формуле:
Смешивание двух растворов одного и того же вещества различной концентрации для получения раствора заданной концентрации. Пусть смешиванием а частей m%-ного раствора с х частями п%-ного раствора нужно получить /%-ный раствор, тогда:
Пусть смешиванием а частей m%-ного раствора с х частями п%-ного раствора нужно получить /%-ный раствор, тогда:
Точные растворы. При приготовлении точных растворов вычисление количеств нужных веществ проверят уже с достаточной степенью точности. Атомные весы элементов берут по таблице, в которой приведены их точные значения. При сложении (или вычитании) пользуются точным значением слагаемого с наименьшим числом десятичных знаков. Остальные слагаемые округляют, оставляя после запятой одним знаком больше, чем в слагаемом с наименьшим числом знаков. В результате оставляют столько цифр после запятой, сколько их имеется в слагаемом с наименьшим числом десятичных знаков; при этом производят необходимое округление. Все расчеты производят, применяя логарифмы, пятизначные или четырехзначные. Вычисленные количества вещества отвешивают только на аналитических весах.
Взвешивание проводят или на часовом стекле, или в бюксе. Отвешенное вещество высыпают в чисто вымытую мерную колбу через чистую сухую воронку небольшими порциями. Затем из промывалки несколько раз небольшими порциями воды обмывают над воронкой бнже или часовое стекло, в котором проводилось взвешивание. Воронку также несколько раз обмывают из промывалки дистиллированной водой.
Затем из промывалки несколько раз небольшими порциями воды обмывают над воронкой бнже или часовое стекло, в котором проводилось взвешивание. Воронку также несколько раз обмывают из промывалки дистиллированной водой.
Для пересыпания твердых кристаллов или порошков в мерную колбу очень удобно пользоваться воронкой, изображенной на рис. 349. Такие воронки изготовляют емкостью 3, 6, и 10 см3. Взвешивать навеску можно непосредственно в этих воронках (негигроскопические материалы), предварительно определив их массу. Навеска из воронки очень легко переводится в мерную колбу. Когда навеска пересыпается, воронку, не вынимая из горла колбы, хорошо обмывают дистиллированной водой из промывалки.
Как правило, при приготовлении точных растворов и переведении растворяемого вещества в мерную колбу растворитель (например, вода) должен занимать не более половины емкости колбы. Закрыв пробкой мерную колбу, встряхивают ее до полного растворения твердого вещества. После этого полученный раствор дополняют водой до метки и тщательно перемешивают.
Молярные растворы. Для приготовления 1 л 1 M раствора какого-либо вещества отвешивают на аналитических весах 1 моль его и растворяют, как указано выше.
Пример. Для приготовления 1 л 1 M раствора азотнокислого серебра находят в таблице или подсчитывают молекулярную массу AgNO3, она равна 169,875. Соль отвешивают и растворяют в воде.
Если нужно приготовить более разбавленный раствор (0,1 или 0,01 M), отвешивают соответственно 0,1 или 0,01 моль соли.
Если же нужно приготовить меньше 1 л раствора, то растворяют соответственно меньшее количество соли в соответствущем объеме воды.
Нормальные растворы готовят аналогично, только отвешивая не 1 моль, а 1 грамм-эквивалент твердого вещества.
Если нужно приготовить полунормальный или децинормальный раствор, берут соответственно 0,5 или 0,1 грамм-эквивалента. Когда готовят не 1 л раствора, а меньше, например 100 или 250 мл, то берут1/10 или 1/4 того количества вещества, которое требуется для приготовления I л, и растворяют в соответствующем объеме воды.
Рис 349. Воронки для пересыпания навески а колбу.
После приготовления раствора его нужно обязательно проверить титрованием соответствующим раствором другого вещества с известной нормальностью. Приготовленный раствор может не отвечать точно той нормальности, которая задана. В таких случаях иногда вводят поправку.
В производственных лабораториях иногда готовят точные растворы «по определяемому веществу». Применение таких растворов облегчает расчеты при анализах, так как достаточно умножить объем раствора, пошедший на титрование, на титр раствора, чтобы получить содержание искомого вещества (в г) во взятом для анализа количестве какого-либо раствора.
Расчет при приготовлении титрованного раствора по определяемому веществу ведут также по грамм-эквиваленту растворяемого вещества, пользуясь формулой:
Пример. Пусть нужно приготовить 3 л раствора марганцовокислого калия с титром по железу 0,0050 г/мл. Грамм-эквивалент KMnO4 равен 31,61., а грамм-эквивалент Fe 55,847.
Вычисляем по приведенной выше формуле:
Стандартные растворы. Стандартными называют растворы с разными, точно определенными концентрациями, применяемые в колориметрии, например растворы, содержащие в 1 мл 0,1, 0,01, 0,001 мг и т. д. растворенного вещества.
Кроме колориметрического анализа, такие растворы бывают нужны при определении рН, при нефелометрических определениях и пр. Иногда стандартные растворы» хранят в запаянных ампулах, однако чаще приходится готовить их непосредственно перед применением. Стандартные растворы готовят в объеме не больше 1 л, а ча ще — меньше. Только при большом расходе стандартного раствори можно готовить несколько литров его и то при условии, что стандартный раствор не будет храниться длительный срок.
Количество вещества (в г), необходимое для получения таких растворов, вычисляют по формуле:
Пример. Нужно приготовить стандартные растворы CuSO4 5h3O для колориметрического определения меди, причем в 1 мл первого раствора должно содержаться 1 мг меди, второго — 0,1 мг, третьего -0,01 мг, четвертого — 0,001 мг. Вначале готовят достаточное количество первого раствора, например 100 мл.
Вначале готовят достаточное количество первого раствора, например 100 мл.
Растворы щелочей. Едкие щелочи и их растворы активно поглощают влагу и углекислоту из воздуха, поэтому приготовление из них растворов точного титра затруднено. Лучше всего такие растворы изготовлять из фиксаналов. Для этого берут пробирку с фиксаналом требуемой нормальности и мерную колбу на 1 л. В колбу вставляют стеклянную воронку с вложенным в нее стеклянным бойком, острый конец которого обращен вверх.
Когда боек будет правильно уложен в воронке, ампуле с фиксаналом дают свободно падать, чтобы тонкое дно ампулы разбилось при ударе об острый конец бойка. После этого пробивают боковое углубление ампулы и дают содержимому вытечь. Затем, не меняя положения ампулы, ее тщательно промывают хорошо прокипяченной дистиллированной водой, остуженной до температуры 35- 40°С и взятой в таком количестве, чтобы по охлаждении раствора до 20°С надо было бы добавить до метки лишь несколько капель. Титрованный раствор щелочи следует хранить в таких условиях, которые исключают возможность его соприкосновения с воздухом.
Если же фиксанала нет, титрованные растворы приготовляют из препаратов едкого натра (или едкого кали). Молекулярная масса NaOH равна 40,01. Это число одновременно является и его грамм-эквивалентом.
Чтобы приготовить 1 л 1 и. раствора NaOH, нужно взять 40 г химически чистого едкого натра, а для приготовления 1 л0,1н. раствора — в десять раз меньше, т. е. 4 г.
Для удобства расчета требуемого количества исходных веществ на приготовление 1 л титрованных растворов щелочей разной нормальности рекомендуем пользоваться данными, приведенными в таблице 31.
Таблица 31
Исходные химические вещества, г | Молекулярная масса | Грамм-эквивалент | Нормальность раствора | Вещества для установки титров |
||||||
Янтарная плп щавелевая кислота |
||||||||||
То же |
||||||||||
Чтобы приготовить 1 л 0,1 н. раствора едкого натра, отвешивают немного больше 4 г (4,3-4,5 г) препарата и растворяют в небольшом объеме дистиллированной воды (около 7 мл).
раствора едкого натра, отвешивают немного больше 4 г (4,3-4,5 г) препарата и растворяют в небольшом объеме дистиллированной воды (около 7 мл).
После отстаивания раствор осторожно сливают (без осадка) в литровую мерную колбу и доводят дистиллированной свежепрокипяченной водой до метки.
Приготовленный раствор хорошо перемешивают и помещают в бутыль, защищенную от попадания углекислоты. После этого устанавливают титр, т. е. точную концентрацию раствора.
Титр можно устанавливать по щавелевой или янтарной кислоте. Щавелевая кислота (С г Н 2 0 4 -2Н 2 0) двухосновная, и, следовательно, ее грамм эквивалент будет равен половине молекулярной. Если молекулярная масса щавелевой кислоты равна 126,05 г, то ее грамм-эквивалент будет 126,05: 2=63,025 г.
Имеющуюся щавелевую кислоту следует один-два раза перекристаллизовать и только после этого применять для установки титра.
Перекристаллизацию проводят следующим образом: берут произвольное количество вещества, предназначенное для перекристаллизации, растворяют нагреванием, стараясь получить возможно большую концентрацию раствора или насыщенный раствор. При необходимости этот раствор фильтруют через воронку для горячего фильтрования. Фильтрат собирают в колбу Эрленмейера, фарфоровую чашку или стакан.
При необходимости этот раствор фильтруют через воронку для горячего фильтрования. Фильтрат собирают в колбу Эрленмейера, фарфоровую чашку или стакан.
В зависимости от характера кристаллизации вещества насыщенный в горячем состоянии раствор охлаждают. Для быстрого охлаждения раствора при перекристаллизации кристаллизатор помещают в холодную воду, снег или лед. При медленном охлаждении раствор оставляют стоять при температуре окружающего воздуха.
Если выпали очень мелкие кристаллы, их снова растворяют, нагревая; сосуд, в котором осуществлялось растворение, сразу же обертывают в несколько слоев полотенцем, накрывают часовым стеклом и оставляют стоять в полном покое в течение 12-15 ч.
Затем кристаллы отделяют от маточного раствора, фильтруя под вакуумом (воронка Бюхнера), тщательно отжимают, промывают и подсушивают.
Приготавливая 0,1 н. раствор NaOH, необходимо иметь раствор щавелевой кислоты такой же нормальности, для этого на 1 л раствора ее нужно взять 63,025: 10=6,3025 г. Но для установки титра такого количества раствора щавелевой кислоты много; достаточно приготовить 100 мл. Для этого на аналитических весах отвешивают около 0,63 г перекристаллизованной щавелевой кислоты с точностью до четвертого десятичного знака, например 0,6223 г. Взятую навеску щавелевой кислоты растворяют в мерной колбе (на 100 мл). Зная массу взятого вещества и объем раствора, легко вычислить его точную концентрацию, которая в данном случае равна не 0,1 н., а несколько меньше.
Но для установки титра такого количества раствора щавелевой кислоты много; достаточно приготовить 100 мл. Для этого на аналитических весах отвешивают около 0,63 г перекристаллизованной щавелевой кислоты с точностью до четвертого десятичного знака, например 0,6223 г. Взятую навеску щавелевой кислоты растворяют в мерной колбе (на 100 мл). Зная массу взятого вещества и объем раствора, легко вычислить его точную концентрацию, которая в данном случае равна не 0,1 н., а несколько меньше.
Из приготовленного раствора берут пипеткой 20 мл, добавляют несколько капель фенолфталеина и титруют приготовленным раствором щелочи до появления слабого розового окрашивания.
Пусть на титрование пошло 22,05 мл щелочи. Как же определить ее титр и нормальность?
Щавелевой кислоты было взято 0,6223 г вместо теоретически рассчитанного количества 0,6303 г. Следовательно, нормальность ее будет равна не точно 0,1
Чтобы вычислить нормальность щелочи, воспользуемся соотношением VN=ViNt,
т. е. произведение объема на нормальность известного раствора равно произведению объема на нормальность для неизвестного раствора. Получаем: 20-0,09873 =22,05-а:, откуда
е. произведение объема на нормальность известного раствора равно произведению объема на нормальность для неизвестного раствора. Получаем: 20-0,09873 =22,05-а:, откуда
Чтобы вычислить титр или содержание NaOH в 1 мл раствора, следует нормальность умножить на грамм-эквивалент щелочи и полученное произведение разделить на 1000. Тогда титр щелочи будет
Но этот титр не соответствует 0,1 н. раствору NaOH. Для этого прибегают к коэффициенту к, т. е. отношению практического титра к теоретическому. В данном случае он будет равен
При использовании для установки титра янтарной кислоты раствор ее приготовляют в том же порядке, что и щавелевой, исходя из следующего расчета: молекулярная масса янтарной кислоты (С 4 Н 6 0 4) равна 118,05 г, но так как она двухосновная, то ее грамм-эквивалент 59,02 г.
Чтобы приготовить 1 л децинормального раствора янтарной кислоты, ее нужно взять в количестве 59,02: 10 = =5,902, а для 100 мл раствора -0,59 г.
Установка титра 0,1 н. раствора NaOH весовым методом. Для установки титра 0,1 н. раствора NaOH берем навеску янтарной кислоты с точностью до 0,0001 г (например, 0,1827 г). Навеску растворяем в дистиллированной воде (около 100 мл), затем добавляем 3-5 капель фенолфталеина и титруем щелочью (NaOH). Предположим, что на титрование пошло 28 мл NaOH. Вычисление титра NaOH и поправку к нему проводим следующим образом: так как грамм-эквивалент NaOH, равный 40,01 г, соответствует грамм-эквиваленту янтарной кислоты, равному 59,02 г, то, составляя пропорцию, узнаем, какому количеству NaOH соответствует содержащееся в навеске количество янтарной кислоты: 40,01-59,02
раствора NaOH весовым методом. Для установки титра 0,1 н. раствора NaOH берем навеску янтарной кислоты с точностью до 0,0001 г (например, 0,1827 г). Навеску растворяем в дистиллированной воде (около 100 мл), затем добавляем 3-5 капель фенолфталеина и титруем щелочью (NaOH). Предположим, что на титрование пошло 28 мл NaOH. Вычисление титра NaOH и поправку к нему проводим следующим образом: так как грамм-эквивалент NaOH, равный 40,01 г, соответствует грамм-эквиваленту янтарной кислоты, равному 59,02 г, то, составляя пропорцию, узнаем, какому количеству NaOH соответствует содержащееся в навеске количество янтарной кислоты: 40,01-59,02
Вычисляем титр NaOH, т. е. содержание NaOH в 1 мл раствора. Оно равно: 0,1238: 28=0,00442. Поправка к титру NaOH равна отношению титра практического к теоретическому
Проверка нормальности раствора щелочи по титрованному раствору кислоты. В три конические колбочки отмеряют бюреткой по 20-25 мл титрованного раствора кислоты (НС1 или H 2 S0 4) и титруют раствором NaOH до изменения окраски метилоранжа.
Допустим, что на титрование трех проб по 20 мл 0,1015 н. раствора НС1 затрачено в среднем 19,50 мл раствора NaOH. Нормальность щелочи будет
Растворы кислот. В большинстве случаев в лаборатории приходится иметь дело с серной, соляной и азотной кислотами. Они находятся в виде концентрированных растворов, процентное содержание которых узнаем по плотности.
При аналитических работах используем химически чистые кислоты. Чтобы приготовить раствор той или иной кислоты, количество концентрированных кислот обычно берем по объему, вычисленному по плотности.
Например, нужно приготовить 0,1 н. раствор H 2 S0 4 . Это значит, что в 1 л раствора должно содержаться
Сколько же по объему нужно взять H 2 S0 4 с плотностью 1,84, чтобы, разбавив ее до 1 л, получить 0,1 н. раствор?
Кислота с плотностью 1,84 содержит 95,6% H 2 S0 4 . Следовательно, на 1 л раствора ее нужно взять в граммах:
Выражая массу в объемных единицах, получим
Отмерив из бюретки точно 2,8 мл кислоты, разбавляем ее до 1 л в мерной колбе, затем, титруя щелочью, проверяем нормальность.
Например, при титровании установлено, что 1 мл 0,1 н. раствора H 2 S0 4 содержит не 0,0049 г H 2 S0 4 , а 0,0051 г. Для вычисления количества воды, которое нужно добавить к 1 л кислоты, составляем пропорцию:
Следовательно, в этот раствор нужно добавить 41 мл воды. Но учитывая, что от исходного раствора было взято на титрование 20 мл, что составляет 0,02, то воды нужно брать меньше, т. е. 41-(41-0,02) =41-0,8 =40,2 мл. Это количество воды и добавляем из бюретки в колбу с раствором.
Приведенная выше работа при выполнении довольно кропотлива, поэтому можно готовить приблизительно точные растворы, вводя поправочный коэффициент, который применяют в работе при каждом титровании. При этом израсходованное число миллилитров раствора умножаем на поправочный коэффициент.
Поправочный коэффициент вычисляем по формуле
где V — объем испытуемого раствора, взятый для титрования;
k t — поправочный коэффициент раствора щелочи известной нормальности, по которому устанавливают титр вновь приготовленного раствора кислоты;
У х — объем раствора щелочи известной нормальности, пошедший на титрование испытуемой кислоты.
Таблица 32
Исходные химические вещества, мл | Молекулярная масса | Нормальность раствора |
|||||||
{ | |||||||||
H 2 S0 4 (плотность 1,84) | |||||||||
НС1 (плотность 1,19) | |||||||||
Для облегчения процесса приготовления титрованных растворов кислот предлагаем таблицу количества исходных веществ для приготовления 1 л растворов разной нормальности (табл. 32).
Необходимо иметь в виду, что при растворении кислот следует прибавлять кислоту к воде, а не наоборот.
Приготовление растворов. Способы выражения концентрации
Работа
3. ПРИГОТОВЛЕНИЕ РАСТВОРОВ
ПРИГОТОВЛЕНИЕ РАСТВОРОВ
Раствором называется гомогенная система, состоящая из двух или более компонентов, относительные количества которых могут изменяться в широких пределах. Всякий раствор состоит из растворителя и растворенного вещества.
Количественный состав раствора характеризуют концентрацией. В химии пользуются несколькими способами выражения концентрации.
Массовая доля растворенного вещества — это безразмерная физическая величина, равная отношению массы растворенного вещества к общей массе раствора, т.е. Wв = mв/m где -массовая доля растворенного вещества; mв— масса растворенного вещества; в — общая масса раствора. Масса раствора в равна сумме масс растворенного вещества mв и растворителя mр, тогда:
Wв = mв / mв + mр
Если известна плотность раствора P, то масса
раствора m = где U*p — объем раствора. Тогда массовую долю можно определять по
формуле Wв = mв / U*p. Массовую долю
растворенного вещества Wв обычно выражают в долях единицы или в процентах. Например,
массовая доля соляной кислоты в воде 0.1. или 10%. Это означает, что в
растворе соляной кислоты массой 100 г содержатся соляная кислота массой 10 г и вода массой 90 г.
Например,
массовая доля соляной кислоты в воде 0.1. или 10%. Это означает, что в
растворе соляной кислоты массой 100 г содержатся соляная кислота массой 10 г и вода массой 90 г.
Задача 1. В 1 л раствора содержится 110 г карбоната натрия (p = 1,1 г/мл). Вычислить массовую долю (в %) карбоната натрия.
Решение. Для определения массовой доли Na2CO3 необходимо найти массу одного литра раствора: m = U*p = 1000 мл * 1,1 г/мл = 1100 г. Зная, что в 1 л раствора содержится 110 г карбоната натрия, определяем массу данной соли в 100 г раствора:
1100 г раствора — 100% |
| х = 10%
110 г карбоната натрия — х% |
Следовательно, массовая доля карбоната натрия в растворе составляет 10%.
Задача 2. Сколько надо взять кристаллогидрата CuSO4 * Н20 и воды для приготовления 300 г 10%-ного раствора сульфата меди (II)?
Решение. Определим, сколько потребуется CuSO4 для приготовления
300 г 10%-ного раствора:
Определим, сколько потребуется CuSO4 для приготовления
300 г 10%-ного раствора:
300 г раствора CuS04 — 100% |
| х = 300 *10 / 100 = 30 г х г сульфата меди — 10% |
Зная молярные массы кристаллогидрата (250 г/моль) и сульфата меди (II) (160 г/моль), определим, в какой массе CuSO4 * 5 Н20 будет содержаться 30 г CuSO4:
160 г CuSO4 содержится в 250 г CuSO4 * 5 Н2О
30 г — “ — — “ — y г — “ y = 30 * 250 / 160 = 48,9 г.
Таким образом, для приготовления раствора потребуется 46,9 г кристаллогидрата CuS04 * 5 Н20 и (300 — 46,9) г = 253.1 г воды.
Молярная концентрация показывает число молей растворенного вещества в 1 л раствора.
Раствор, содержащий в одном литре 1 моль
растворенного вещества, называют одномолярным и обозначают 1 М; 0,5 М — полумолярный (в 1 л раствора 0.5 моль вещества): 0.1 М — децимолярный (в 1 л раствора 0.1 моль вещества) и т. д.
д.
Задача 3. Какова молярность раствора, если в 100 мл раствора содержится 2 г гидроксида натрия?
Решение, Молярная масса гидроксида натрия равна 40 г. 2 г его составляют 2/40 = 0.05 моль.
В 100 мл раствора содержится 0.05 моль NaOH |
| х = 0,5 моль
В 1000 мл — “ — — “ — x моль NaOH |
Нормальная концентрация показывает число эквивалентов растворенного вещества в 1 л раствора.
Однонормальный раствор (1 н.) — в 1 л раствора содержится 1 эквивалент растворенного вещества, двунормальный (2 н,) — 2 эквивалента вещества и т.д.
Задача 4. В 200 мл раствора содержится 1.14 г сульфата алюминия. Какова нормальность раствора?
Решение. Молярная масса сульфата алюминия 342 г/моль. Эквивалентна масса Al2(SO4)3 57 г (342/6). Определяем, сколько эквивалентов составляет 1,14 г сульфата алюминия: 1.14/57 = 0,02 экв.
Из пропорции находим г сколько эквивалентов содержится в 1 л раствора:
В 200 мл раствора содержится 0. 02 экв. |
02 экв. |
| х =0,1 экв.
в 1000 мл — “ — — “ — x экв. |
Нормальность раствора равна 0.1 н.
Перевод молярной концентрации в нормальную.
Задача 5, Какова нормальность 0,2 М растворов следующих веществ:
а) Al2(SO4)3; б)h4PO4; в) NaOH ?
Решение. а) 3Al2(SO4)3 М/б, следовательно, б 3 = М. Поэтому для этой соли, б н, раствор соответствует 1М |
| x = 1,2 н.
х н, — “ — — “ — 0,2 М |
б) 3 Э = М
3 н. раствор соответствует 1 М |
| х = 0,6 н.
х н. — “ — — “ — 0.2 M |
в)
0,2 М раствор будет иметь концентрацию 0,2 н.
Перевод массовой доли в молярную и нормальную концентрации.
Задача 6. Какова нормальная и молярная концентрации 10%-ного раствора серной кислоты ( p =1,066 г/мл)?
Решение. SO* и воды потребуется для приготовления 50 г раствора, в котором массовая доля сульфата натрия составляет 10%. Плотность воды принять равной
1 г/мл. Взвесить (с точностью до 0,02 г) расчетное количество сульфата натрия и
перенести его в стакан на 100 мл. Отмерить мерным цилиндром рассчитанный
объем дистиллированной воды и прилить в стакан. Смесь перемешать стеклянной
палочкой до полного растворения. Полученный раствор перелить в мерный цилиндр
на 50 мл, измерить ареометром плотность. По показаниям ареометра в табл.4
плотности водных растворов определить массовую долю сульфата натрия в
приготовленном растворе.
SO* и воды потребуется для приготовления 50 г раствора, в котором массовая доля сульфата натрия составляет 10%. Плотность воды принять равной
1 г/мл. Взвесить (с точностью до 0,02 г) расчетное количество сульфата натрия и
перенести его в стакан на 100 мл. Отмерить мерным цилиндром рассчитанный
объем дистиллированной воды и прилить в стакан. Смесь перемешать стеклянной
палочкой до полного растворения. Полученный раствор перелить в мерный цилиндр
на 50 мл, измерить ареометром плотность. По показаниям ареометра в табл.4
плотности водных растворов определить массовую долю сульфата натрия в
приготовленном растворе.
|
Массовая доля, % |
Плотность р-ра, г/мл |
Массовая доля, % |
Плотность р-ра, г/мл |
|
Na2SO4 | Al2(SO4)3 |
Na2SO4 | Al2(SO4)3 |
||
|
5 6 7 8 9 |
1,044 1,050 1,053 1,061 1,063 1,072 1,072 1,083 1,082 1,094 |
10 11 12 13 14 |
1,091 1,105 1,101 1,117 1,111 1,129 1,121 1,140 1,141 1,152 |
Результат записать в отчет. Вычислить
молярность растворам Определить относительную ошибку опыта.
Вычислить
молярность растворам Определить относительную ошибку опыта.
Опыт 2. Приготовление 1,5 н. раствора сульфата алюминия. Рассчитать, сколько граммов Al2(SO4)3 * 18 Н2О потребуется для приготовления 50 мл 1,5 н. раствора соли (расчет сверить у преподавателя). Взвесить расчетное количество кристаллогидрата сульфата алюминия на технических весах. С помощью микроворонки перенести навеску сульфата алюминия в мерную колбу на 50 мл. Остатки вещества смыть с микроворонки в колбу дистиллированной водой и налить примерно до половины воды; взбалтывать колбу до полного растворения навески. Затем уровень раствора довести до метки (последние капли добавлять при помощи пипетки). Приготовленный раствор перелить в цилиндр на 50 мл и измерить ареометром его плотность. Результат записать в отчет. По показаниям ареометра с помощью таблицы определить массовую долю соли (в %) в растворе.
Результаты перевести в нормальную концентрацию
и рассчитать относительную ошибку опыта.
Руководство по приготовлению раствора | Каролина.com
Каролина предлагает множество готовых решений, но некоторые учителя предпочитают делать их самостоятельно. Если это вас интересует, продолжайте читать. Это краткое руководство предоставит вам информацию, необходимую для создания ряда решений, обычно используемых в учебных лабораториях.
Давайте рассмотрим некоторые соображения безопасности:
- Всегда надевайте соответствующие средства индивидуальной защиты (СИЗ) при работе с химикатами и приготовлении растворов.Используйте это руководство, чтобы выбрать средства индивидуальной защиты, соответствующие вашим потребностям.
- Дважды прочитайте этикетку на химическом веществе перед использованием. Прочтите его, когда берете химическое вещество с полки, и еще раз перед тем, как вынуть какое-либо химическое вещество из бутылки.
- При использовании концентрированных химикатов для приготовления растворов убедитесь, что вы медленно добавляете более концентрированный раствор к менее концентрированному.
 Обратная процедура может привести к закипанию и разбрызгиванию раствора.
Обратная процедура может привести к закипанию и разбрызгиванию раствора.
Приготовление раствора
Молярные растворы
Молярность (М) означает количество молей растворенного вещества на литр раствора.Для приготовления 1 М раствора медленно добавляют 1 формульную массу соединения в чистую мерную колбу емкостью 1 л, наполовину заполненную дистиллированной или деионизированной водой. Дайте соединению полностью раствориться, осторожно встряхивая колбу, если это необходимо. Когда растворенное вещество полностью растворится и раствор станет комнатной температуры, разбавьте его водой до метки. Вставьте пробку и, положив большой палец на пробку, а руку на горлышко колбы. несколько раз перевернуть колбу для перемешивания. Вот несколько примеров использования этого метода:
-
Чтобы приготовить 1 М раствор гидроксида натрия, медленно добавьте 40 г гидроксида натрия к 500 мл дистиллированной или деионизированной воды в мерной колбе емкостью 1 л.
 Когда твердые вещества полностью растворятся и раствор станет комнатной температуры, разбавьте до метки, вставьте и закрепите пробку большим пальцем и несколько раз переверните колбу для перемешивания.
Когда твердые вещества полностью растворятся и раствор станет комнатной температуры, разбавьте до метки, вставьте и закрепите пробку большим пальцем и несколько раз переверните колбу для перемешивания. -
Чтобы приготовить 1 М раствор уксусной кислоты, растворите 60,05 г уксусной кислоты в 500 мл дистиллированной или деионизированной воды в мерной колбе вместимостью 1 л. Поскольку уксусная кислота является жидкостью, кислоту также можно измерять по объему. Разделите массу кислоты на ее плотность (1,049 г/мл), чтобы определить объем (57.24 мл). Для приготовления раствора используйте 60,05 г или 57,24 мл уксусной кислоты. Аккуратно встряхните колбу, чтобы перемешать раствор. Когда раствор станет комнатной температуры, разбавьте его до метки, вставьте и закрепите пробку большим пальцем и несколько раз переверните колбу для перемешивания.
Разведения
При приготовлении разбавления определите необходимый объем и молярную концентрацию полученного раствора. Используйте следующее уравнение, чтобы определить, сколько концентрированного реагента необходимо для приготовления разбавленного раствора,
Используйте следующее уравнение, чтобы определить, сколько концентрированного реагента необходимо для приготовления разбавленного раствора,
, где M — молярность, а V — объем.
Медленно добавьте расчетный объем концентрированного реагента в мерную колбу подходящего размера, наполовину заполненную дистиллированной или деионизированной водой, и перемешайте колбу, взбалтывая ее. Как только раствор станет комнатной температуры, разбавьте его водой до метки, вставьте и закрутите пробку и несколько раз переверните колбу для перемешивания.
Например, какой объем 10 М уксусной кислоты требуется для приготовления 1,0 л 0,50 М уксусной кислоты?
10 М × В реагент = 0.50 M × 1,0 л
V реагент = 0,050 л = 50 мл
Для приготовления 1,0 л 0,50 М уксусной кислоты требуется объем 50 мл 10 М уксусной кислоты.
Рецепты общих растворов
Для приготовления этих растворов медленно добавляйте необходимые ингредиенты в мерную колбу емкостью 1 л, наполовину заполненную дистиллированной или деионизированной водой. Дайте ингредиентам полностью раствориться, осторожно встряхивая колбу при необходимости. Когда растворенное вещество полностью растворится и раствор станет комнатной температуры, разбавьте его водой до метки.Вставьте и закрепите пробку и переверните колбу несколько раз, чтобы перемешать.
Каждый реагент в следующей таблице связан с нашим онлайн-каталогом для получения дополнительной информации и удобной покупки. Для жидкостей мы указали размер 500 мл реагента или химиката класса ACS, упакованного в безопасную бутылку с пластиковым покрытием. Для гидроксида натрия мы указали 500-граммовый размер реактивного химиката. Могут быть доступны другие размеры и классы. Пожалуйста, обратитесь к нашим каталогам для получения дополнительной информации.
Независимо от того, решите ли вы сделать свои собственные решения или купить их у нас в готовом виде, вы найдете все, что вам нужно, в Каролине.
Загрузить руководство по приготовлению раствора
Магазин химикатов
Глава 12.1: Подготовка растворов — Химия LibreTexts
-
- Последнее обновление
- Сохранить как PDF
- Приготовление растворов
- Пример 12.1.1
- Пример 12.1.2
- Пример 12.1.2
- Пример 12.1.3
- ионные концентрации в решении
- Пример 12.1.4
- Ключные уравнения
- Сводка
- Ключ на 50008
- Концептуальные проблемы
- Ответ
- Числовые проблемы
- Ответы
- Участники
Цель обучения
- Для количественного описания концентрации растворов.

В разделе 9.3 мы описали различные способы характеристики концентрации раствора, молярности (M), моляльности (m), концентрации в процентах и мольной доли (X). Количество растворенного вещества, растворенного в определенном количестве растворителя или раствора. раствора описывает количество растворенного вещества, которое содержится в определенном количестве растворителя или раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для реакций, протекающих в растворе. В этом разделе описывается, как можно приготовить растворы из маточного раствора известной концентрации
.Приготовление растворов
Чтобы приготовить раствор, содержащий указанную концентрацию вещества, необходимо растворить желаемое количество молей растворенного вещества в достаточном количестве растворителя, чтобы получить желаемый конечный объем раствора.
\(Молярность раствора = dfrac{моли\: of\: раствор {Объем раствора} \tag{12.1.1}\)
На рис. 12.1.1 показана эта процедура для раствора дигидрата хлорида кобальта(II) в этаноле. Обратите внимание, что объем растворителя не указан. Поскольку растворенное вещество занимает место в растворе, объем необходимого растворителя почти всегда на меньше, чем на желаемый объем раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно прибавлять 1.00 л воды на 342 г сахарозы, поскольку в результате получится более 1,00 л раствора. Как показано на рис. 12.1.2, для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
12.1.1 показана эта процедура для раствора дигидрата хлорида кобальта(II) в этаноле. Обратите внимание, что объем растворителя не указан. Поскольку растворенное вещество занимает место в растворе, объем необходимого растворителя почти всегда на меньше, чем на желаемый объем раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно прибавлять 1.00 л воды на 342 г сахарозы, поскольку в результате получится более 1,00 л раствора. Как показано на рис. 12.1.2, для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
Рис. 12.1.1 Приготовление раствора известной концентрации с использованием твердого растворенного вещества
Рисунок 12.1.2 Приготовление 250 мл раствора (NH 4 ) 2 Cr 2 O 7 в воде
Растворенное вещество занимает место в растворе, поэтому для приготовления 250 мл раствора требуется менее 250 мл воды.
Пример 12.1.1
Раствор на рис. 12.1.1 содержит 10,0 г дигидрата хлорида кобальта(II), CoCl 2 ·2H 2 O, в этаноле, достаточном для получения ровно 500 мл раствора. Какова молярная концентрация CoCl 2 ·2H 2 O?
Дано: масса растворенного вещества и объем раствора
Запрашиваемый: концентрация (M)
Стратегия:
Чтобы найти количество молей CoCl 2 ·2H 2 O, разделите массу соединения на его молярную массу.Рассчитайте молярность раствора, разделив количество молей растворенного вещества на объем раствора в литрах.
Решение:
Молярная масса CoCl 2 ·2H 2 O составляет 165,87 г/моль. Следовательно,
\( моль\: CoCl_2 \cdot 2H_2O = \left( \dfrac{10,0 \: \cancel{g}} {165,87\: \cancel{g} /моль} \right) = 0,0603\: моль \)
Объем раствора в литрах равен
\(объем = 500\: \cancel{мл} \left( \dfrac{1\: L} {1000\: \cancel{мл}} \right) = 0 . 500\: Л\)
500\: Л\)
Молярность — это количество молей растворенного вещества на литр раствора, поэтому молярность раствора равна
.\( молярность = \dfrac{0,0603\: моль} {0,500\: L} = 0,121\: M = CoCl_2 \cdot H_2O \)
Упражнение
Раствор, показанный на рис. 12.1.2, содержит 90,0 г (NH 4 ) 2 Cr 2 O 7 в воде, достаточной для получения конечного объема ровно 250 мл. Какова молярная концентрация дихромата аммония?
Ответ: (NH 4 ) 2 Cr 2 O 7 = 1.43 М
Чтобы приготовить определенный объем раствора, который содержит определенную концентрацию растворенного вещества, нам сначала необходимо рассчитать количество молей растворенного вещества в желаемом объеме раствора, используя соотношение, показанное в уравнении 12.1.1. Затем мы переводим количество молей растворенного вещества в соответствующую массу необходимого растворенного вещества. Эта процедура проиллюстрирована в примере 12.1.2.
Эта процедура проиллюстрирована в примере 12.1.2.
Пример 12.1.2
Так называемый раствор D5W, используемый для внутривенного замещения жидкостей организма, содержит 0.310 М глюкозы. (D5W представляет собой примерно 5% раствор декстрозы [медицинское название глюкозы] в воде.) Рассчитайте массу глюкозы, необходимую для приготовления пакета D5W объемом 500 мл. Глюкоза имеет молярную массу 180,16 г/моль.
Дано: молярность, объем и молярная масса растворенного вещества
Запрашиваемый: масса растворенного вещества
Стратегия:
A Рассчитайте количество молей глюкозы, содержащихся в указанном объеме раствора, умножив объем раствора на его молярность.
B Получите необходимую массу глюкозы, умножив количество молей соединения на его молярную массу.
Решение:
A Сначала нужно рассчитать количество молей глюкозы, содержащихся в 500 мл 0,310 М раствора:
\( V_L M_{моль/л} = моли \)
\( 500\: \cancel{mL} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{mL}} \right) \left( \dfrac{0 . 310\: моль\: глюкоза} {1\: \cancel{L}} \right) = 0 .155\:моль\:глюкоза\)
310\: моль\: глюкоза} {1\: \cancel{L}} \right) = 0 .155\:моль\:глюкоза\)
B Затем мы переводим количество молей глюкозы в требуемую массу глюкозы:
\( масса \: из \: глюкозы = 0,155 \: \отменить{моль\: глюкоза} \влево( \dfrac{180,16 \: г\: глюкоза} {1\: \отменить{моль\: глюкоза}} \ справа) = 27,9\:г\:глюкоза\)
Упражнение
Другим раствором, обычно используемым для внутривенных инъекций, является физиологический раствор, 0,16 М раствор хлорида натрия в воде. Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
Ответ: 2,3 г NaCl
Раствор нужной концентрации также можно приготовить, разбавив небольшой объем более концентрированного раствора дополнительным растворителем. Исходный раствор представляет собой коммерчески приготовленный раствор известной концентрации и часто используется для этой цели. Разбавление маточного раствора предпочтительнее, потому что альтернативный метод взвешивания крошечных количеств растворенного вещества трудно выполнить с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из исходного раствора показана на рис. 12.1.3. Это требует расчета количества молей растворенного вещества, желаемого в конечном объеме более разбавленного раствора, а затем расчета объема исходного раствора, содержащего это количество растворенного вещества. Помните, что разбавление заданного количества исходного раствора растворителем меняет , а не число молей присутствующего растворенного вещества. Таким образом, отношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора равно
.\((V_s)(M_s) = моли\: of\: растворенное вещество = (V_d)(M_d)\tag{12.1.2}\)
, где индексы s и d обозначают исходный и разбавленный растворы соответственно. Пример 5 демонстрирует расчеты, связанные с разбавлением концентрированного маточного раствора.
Рисунок 12.1.3 Приготовление раствора известной концентрации путем разбавления маточного раствора (a) Объем ( V s ), содержащий желаемое количество молей растворенного вещества (M s ), измеряется из исходного раствор известной концентрации.(b) Измеренный объем маточного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляют растворителем до объемной метки [( V s )(M s ) = ( V d )(M d ) ].
Пример 12.1.3
Какой объем исходного раствора глюкозы с концентрацией 3,00 М необходим для приготовления 2500 мл раствора D5W в примере 4?
Дано: объем и молярность разбавленного раствора
Запрошено: объем маточного раствора
Стратегия:
A Рассчитайте количество молей глюкозы, содержащихся в указанном объеме разбавленного раствора, умножив объем раствора на его молярность.
B Чтобы определить необходимый объем исходного раствора, разделите число молей глюкозы на молярность исходного раствора.
Решение:
A Раствор D5W в примере 4 представлял собой 0,310 М глюкозу. Начнем с использования уравнения 12.1.2 для расчета количества молей глюкозы, содержащихся в 2500 мл раствора:
.\( моль\: глюкоза = 2500\: \cancel{мл} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{мл}} \right) \left( \dfrac{ 0 .310\: моль\: глюкоза} {1\: \cancel{L}} \right) = 0,775\: моль\: глюкоза \)
B Теперь мы должны определить объем исходного раствора 3,00 М, который содержит такое количество глюкозы:
\( объем\: из\: запас\: раствор = 0,775\: \отменить{моль\: глюкоза} \влево( \dfrac{1\: л} {3,00\: \отменить{моль\: глюкоза}} \справа) = 0,258\: л\: или\: 258\: мл \)
При определении необходимого объема маточного раствора мы должны были разделить желаемое количество молей глюкозы на концентрацию исходного раствора, чтобы получить соответствующие единицы. Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Мы также могли бы решить эту задачу за один шаг, решив уравнение 12.1.2 для В с и подставив соответствующие значения:
\(V_s = \dfrac{( V_d )(M_d)}{M_s} = \dfrac{(2,500\: L)(0,310\: \cancel{M})} {3,00\: \ отменить {M}} = 0 .258\: L \)
Как мы уже отмечали, часто существует более одного правильного способа решения проблемы.
Упражнение
Какой объем исходного раствора 5,0 М NaCl необходим для приготовления 500 мл физиологического раствора (0,16 М NaCl)?
Ответ: 16 мл
Концентрация ионов в растворе
В разделе 9. {2-} (водн.)\tag{12.1.2} \)
{2-} (водн.)\tag{12.1.2} \)
Таким образом, 1 моль формульных единиц дихромата аммония растворяется в воде с образованием 1 моля анионов Cr 2 O 7 2− и 2 молей катионов NH 4 + (см. рис. 12.1.4).
Рис. 12.1.4 Растворение 1 моля ионного соединения В этом случае при растворении 1 моля (NH 4 ) 2 Cr 2 O 7 получается раствор, содержащий Cr 2 O 7 2− ионов и 2 моль NH 4 + ионов.(Для ясности молекулы воды не показаны на молекулярном изображении раствора.)
Когда мы проводим химическую реакцию с использованием раствора соли, такой как дихромат аммония, нам необходимо знать концентрацию каждого иона, присутствующего в растворе. Если раствор содержит 1,43 М (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 7 2−
4 должна быть также M 2 O 7 2− ион на формульную единицу. Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 М = 2,86 М. Поскольку каждая формульная единица (NH 4 ) 2 CR 2 CR 2 O 7 производит три ионы при растворенном в воде (2NH 4 + + 1Cr 2 O 7 O 7 Всего Концентрация ионов в раствор 3 × 1,43 М = 4,29 М.
Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 М = 2,86 М. Поскольку каждая формульная единица (NH 4 ) 2 CR 2 CR 2 O 7 производит три ионы при растворенном в воде (2NH 4 + + 1Cr 2 O 7 O 7 Всего Концентрация ионов в раствор 3 × 1,43 М = 4,29 М.
Пример 12.1.4
Каковы концентрации всех видов, полученных из растворенных веществ в этих водных растворах?
- 0,21 М NaOH
- 3,7 М (СН 3 )СНОН
- 0,032 М In(№ 3 ) 3
Дано: молярность
Запрашиваемый: концентрации
Стратегия:
A Классифицируйте каждое соединение как сильный электролит или неэлектролит. — (водн.) \)
— (водн.) \)
B Поскольку каждая формульная единица NaOH производит один ион Na + и один ион OH — , концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0.21 М и [ОН — ] = 0,21 М.
A Формула (CH 3 ) 2 CHOH представляет собой 2-пропанол (изопропиловый спирт) и содержит группу –OH, поэтому это спирт. Напомним из раздела 9.1, что спирты — это ковалентные соединения, которые растворяются в воде с образованием растворов нейтральных молекул. Таким образом, спирты являются неэлектролитами.
B Таким образом, единственным растворенным веществом в растворе является (CH 3 ) 2 молекул CHOH, поэтому [(CH 3 ) 2 CHOH] = 3.- (водн.) \)
B Одна форма формулы в (NO 3 ) 3 производит один в 3 + ион и три № 3 — ионы, так что 0,032 м в (NO 3 ) 3 раствор содержит 0,032 м в 3 + и 3 × 0,032 м = 0,096 м № 3 — — это такое, [в 3 + ] = 0,032 м и [№ 3 − ] = 0,096 М.
Упражнение
Каковы концентрации всех видов, полученных из растворенных веществ в этих водных растворах?
- 0.0012 М Ba(OH) 2
- 0,17 М Na 2 SO 4
- 0,50 М (CH 3 ) 2 CO, широко известный как ацетон
Ответ:
- [Ba 2 + ] = 0,0012 М; [ОН — ] = 0,0024 М
- [Na + ] = 0,34 М; [СО 4 2− ] = 0,17 М
- [(СН 3 ) 2 СО] = 0,50 М
Ключевые уравнения
связь между объемом и концентрацией основного и разбавленного растворов
Уравнение 12.1.2: \((V_s)(M_s) = моли\: of\: растворенное вещество = (V_d)(M_d)\)
Резюме
Концентрация вещества представляет собой количество растворенного вещества, присутствующего в данном количестве раствора. Концентрации обычно выражают как молярность , количество молей растворенного вещества в 1 л раствора. Растворы известной концентрации можно приготовить либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора ( исходный раствор ) до желаемого конечного объема.
Концентрации обычно выражают как молярность , количество молей растворенного вещества в 1 л раствора. Растворы известной концентрации можно приготовить либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора ( исходный раствор ) до желаемого конечного объема.
Ключ на вынос
- Концентрации растворов обычно выражаются в молярности и могут быть приготовлены путем растворения известной массы растворенного вещества в растворителе или разбавления исходного раствора.
Концептуальные проблемы
-
Какое из изображений лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- НХ 3
- ВЧ
- СН 3 СН 2 СН 2 ОН
-
Na 2 SO 4
-
Какое из представлений, показанных в задаче 1, лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.

- CH 3 CO 2 H
- NaCl
- Нет 2 С
- Нет 3 Заказ на поставку 4
- ацетальдегид
-
Ожидаете ли вы, что 1,0 М раствор CaCl 2 будет лучшим проводником электричества, чем 1,0 М раствор NaCl? Почему или почему нет?
-
Альтернативным способом определения концентрации раствора является моляльность , сокращенно m .Моляльность определяется как число молей растворенного вещества в 1 кг растворителя . Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.
-
Каковы преимущества использования растворов для количественных расчетов?
Ответить
-
Если количество вещества, необходимое для реакции, слишком мало для точного взвешивания, использование раствора вещества, в котором растворенное вещество диспергировано в гораздо большей массе растворителя, позволяет химикам измерить количество вещества точнее.

Численные задачи
-
Рассчитайте количество граммов растворенного вещества в 1000 л каждого раствора.
- 0,2593 М NaBrO 3
- 1,592 М КНО 3
- 1,559 М уксусная кислота
- 0,943 М йодата калия
-
Рассчитайте количество граммов растворенного вещества в 1000 л каждого раствора.
- 0.1065 М БаИ 2
- 1,135 М Na 2 SO 4
- 1,428 М NH 4 Br
- 0,889 М ацетат натрия
-
Если все растворы содержат одно и то же растворенное вещество, то в каком растворе масса растворенного вещества больше?
- 1,40 л 0,334 М раствора или 1,10 л 0,420 М раствора
- 25,0 мл 0,134 М раствора или 10,0 мл 0,295 М раствора
- 250 мл 0.
 489 М раствор или 150 мл 0,769 М раствора
489 М раствор или 150 мл 0,769 М раствора
-
Заполните следующую таблицу для 500 мл раствора.
Соединение Масса (г) Кроты Концентрация (М) сульфат кальция 4,86 уксусная кислота 3.62 дигидрат йодистого водорода 1,273 бария бромид 3,92 глюкоза 0,983 ацетат натрия 2.  42
42 -
Какова концентрация каждого вида в следующих водных растворах?
- 0,489 моль NiSO 4 в 600 мл раствора
- 1,045 моль бромида магния в 500 мл раствора
- 0,146 моль глюкозы в 800 мл раствора
- 0,479 моль CeCl 3 в 700 мл раствора
-
Какова концентрация каждого вида в следующих водных растворах?
- 0.324 моль K 2 MoO 4 в 250 мл раствора
- 0,528 моль формиата калия в 300 мл раствора
- 0,477 моль KClO 3 в 900 мл раствора
- 0,378 моль йодида калия в 750 мл раствора
-
Какова молярная концентрация каждого раствора?
- 8,7 г бромида кальция в 250 мл раствора
- 9,8 г сульфата лития в 300 мл раствора
- 12.
 4 г сахарозы (C 12 H 22 O 11 ) в 750 мл раствора
4 г сахарозы (C 12 H 22 O 11 ) в 750 мл раствора - 14,2 г гексагидрата нитрата железа (III) в 300 мл раствора
-
Какова молярная концентрация каждого раствора?
- 12,8 г гидросульфата натрия в 400 мл раствора
- 7,5 г гидрофосфата калия в 250 мл раствора
- 11,4 г хлорида бария в 350 мл раствора
- 4.3 г винной кислоты (C 4 H 6 O 6 ) в 250 мл раствора
-
Укажите концентрацию каждого реагента в следующих уравнениях, предполагая, что 20,0 г каждого реагента и объем раствора 250 мл для каждого реагента.
- BaCl 2 (водн.) + Na 2 SO 4 (водн.) →
- Ca(OH) 2 (водн.) + H 3 PO 4 (водн.) →
- Al(NO 3 ) 3 (водн.
 ) + H 2 SO 4 (водн.) →
) + H 2 SO 4 (водн.) → - Pb(NO 3 ) 2 (водн.) + CuSO 4 (водн.) →
- Al(CH 3 CO 2 ) 3 (водн.) + NaOH (водн.) →
-
Для эксперимента требуется 200.0 мл 0,330 М раствора Na 2 CrO 4 . Для приготовления этого раствора использовали исходный раствор Na 2 CrO 4 , содержащий 20,0% растворенного вещества по массе с плотностью 1,19 г/см 3 . Опишите, как приготовить 200,0 мл 0,330 М раствора Na 2 CrO 4 , используя исходный раствор.
-
Гипохлорит кальция [Ca(OCl) 2 ] является эффективным дезинфицирующим средством для одежды и постельных принадлежностей.Если раствор имеет концентрацию Ca(OCl) 2 3,4 г на 100 мл раствора, какова молярность гипохлорита?
-
Фенол (C 6 H 5 OH) часто используется в качестве антисептика в ополаскивателях для рта и леденцах от горла.
 Если жидкость для полоскания рта имеет концентрацию фенола 1,5 г на 100 мл раствора, какова молярность фенола?
Если жидкость для полоскания рта имеет концентрацию фенола 1,5 г на 100 мл раствора, какова молярность фенола? -
Если таблетку, содержащую 100 мг кофеина (C 8 H 10 N 4 O 2 ), растворить в воде, получится 10.0 унций раствора, какова молярная концентрация кофеина в растворе?
-
На этикетках некоторых лекарств есть инструкции по добавлению 10,0 мл стерильной воды с указанием, что каждый миллилитр полученного раствора будет содержать 0,500 г лекарства. Если больному назначена доза 900,0 мг, сколько миллилитров раствора следует ввести?
ответы
-
1.
 74 × 10 −3 М кофеин
74 × 10 −3 М кофеин
Авторы
Изменено Джошуа Халперном, Скоттом Синексом и Скоттом Джонсоном
Приготовление химических растворов
Лабораторные эксперименты и виды исследований часто требуют приготовления химических растворов в своей процедуре. Мы рассмотрим приготовление этих химических растворов по весу (масса/объем) и по объему (объем/объем). В приведенном ниже глоссарии приводятся определения, чтобы знать, когда ваша работа требует их создания, а также наиболее точные молярные растворы.
К этому мы добавляем информацию, предназначенную для понимания того, как использовать шкалу рН при измерении кислотности или щелочности раствора.
Глоссарий, основные термины для понимания…
Растворенное вещество — Вещество, растворяющееся в растворе
Растворитель — Вещество, растворяющее другое с образованием раствора. Например, в растворе сахара и воды вода является растворителем; сахар является растворенным веществом.
Например, в растворе сахара и воды вода является растворителем; сахар является растворенным веществом.
Раствор — Смесь двух или более чистых веществ.В растворе одно чистое вещество растворено в другом чистом веществе гомогенно. Например, в растворе сахара и воды раствор имеет одинаковую концентрацию повсюду, т.е. оно однородно.
Моль — Фундаментальная единица массы (например, «дюжина» для пекаря), используемая химиками. Этим термином обозначают большое количество элементарных частиц (атомов, молекул, ионов, электронов и т. д.) любого вещества. 1 моль равен 6,02 х 10 23 молекул этого вещества. (число Авогадро).М
Введение в приготовление растворов.
Многие эксперименты с химическими веществами требуют их использования в виде растворов. То есть два или более вещества смешиваются вместе в известных количествах. Это может включать взвешивание точного количества сухого материала или измерение точного количества жидкости. Точная подготовка растворов повысит безопасность эксперимента и шансы на успех.
Точная подготовка растворов повысит безопасность эксперимента и шансы на успех.
Решение 1: Использование процентного содержания по массе (w/v)
Формула
Формула для массового процента (вес/объем): [Масса растворенного вещества (г) / Объем раствора (мл)] x 100
Пример
10% раствор NaCl содержит десять граммов хлорида натрия, растворенных в 100 мл раствора.
Процедура
Взвесить 10 г хлорида натрия. Перелейте его в мерный цилиндр или мерную колбу, содержащую примерно 90 165 80 мл 90 166 воды. После полного растворения хлорида натрия (при необходимости осторожно встряхните колбу) добавьте воды, чтобы довести объем до окончательных 100 мл. Предостережение: не просто отмерьте 100 мл воды и добавьте 10 г хлорида натрия. Это приведет к ошибке, потому что добавление твердого вещества изменит конечный объем раствора и отбросит окончательный процент.
Решение 2. Использование объемных процентов (об./об.)
Когда растворенное вещество является жидкостью, иногда удобно выражать концентрацию раствора в объемных процентах.
Формула
Формула для объемного процента (v/v): [Объем растворенного вещества (мл) / Объем раствора (мл)] x 100
Пример
Приготовьте 1000 мл 5% по объему раствора этиленгликоля в воде.
Процедура
Сначала выразите процент растворенного вещества в виде десятичной дроби: 5% = 0.05
Умножьте это десятичное число на общий объем: 0,05 x 1000 мл = 50 мл (необходим этиленгликоль).
Вычесть объем растворенного вещества (этиленгликоля) из общего объема раствора:
1000 мл (общий объем раствора) — 50 мл (объем этиленгликоля) = 950 мл (необходимая вода)
Растворите 50 мл этиленгликоля в чуть менее чем 950 мл воды. Теперь доведите окончательный объем раствора до 1000 мл , добавив еще воды.(Это исключает любую ошибку, поскольку конечный объем раствора может не совпадать с рассчитанной суммой отдельных компонентов).
Итак, 50 мл этиленгликоля / 1000 мл раствора x100 = 5% (об./об.) раствора этиленгликоля.
Раствор 3: Молярные растворы
Молярные растворы наиболее полезны при расчетах химических реакций, поскольку они напрямую связывают количество молей растворенного вещества с объемом раствора.
Формула
Формула молярности (М): моли растворенного вещества/1 л раствора или грамм-молекулярная масса растворенного вещества/1 л раствора.
Примеры
Молекулярная масса молекулы хлорида натрия (NaCl) равна 58,44, поэтому молекулярная масса одного грамма (=1 моль) равна 58,44 г. Мы знаем это, глядя на периодическую таблицу. Атомная масса (или вес) Na равна 22,99, атомная масса Cl равна 35,45, поэтому 22,99 + 35,45 = 58,44.
Если вы растворите 58,44 г NaCl в конечном объеме 1 литр , вы получите 1M раствор NaCl , 1 молярный раствор.
Процедура
Для приготовления молярных растворов NaCl других концентраций массу соли разбавляют до 1000 мл раствора следующим образом:
0.Для 1M раствора NaCl требуется 0,1 x 58,44 г NaCl = 5,844 г
0,5 М раствор NaCl требуется 0,5 x 58,44 г NaCl = 29,22 г
2M раствор NaCl требуется 2,0 x 58,44 г NaCl = 116,88 г
Что такое молярный раствор?
Молярность — еще одно стандартное выражение концентрации раствора. Молярные растворы используют молекулярную массу растворенного вещества грамм при расчете молярной концентрации в литре (л) раствора.
Молекулярная масса граммов (GMW) вещества (иногда называемая «формульной массой») представляет собой сумму объединенных атомных масс всех атомов в молекуле, выраженную в граммах. Например, GMW NaCl равен атомному весу (эти атомные веса можно найти в периодической таблице или в виде формулы веса на флаконе с веществом) Na (22,99) и атомному весу Cl (35,45) для всего 58,44 г.
1 молярный (M) раствор будет содержать 1,0 GMW вещества, растворенного в воде, для получения 1 литра конечного раствора.Следовательно, 1М раствор NaCl содержит 58,44 г.
Пример:
HCl часто используется в гистохимии ферментов. GMW HCl будет представлять собой атомный вес H, добавленный к атомному весу Cl: H = 1 + Cl = 35,45 = 36,45 г. В литре 1М раствора HCl содержится 36,45 г.
Буфер мононатрий дигидрофосфат (NaH 2 PO 4 ) также используется в гистохимии ферментов. литров 1М раствора NaH 2 PO 4 будет содержать Na (22.99) + 2 H (1×2=2) + P (30,97) + 4 O (16×4 = 64) для общей GMW 119,98 г.
Чтобы просто рассчитать количество или вес вещества, необходимого для желаемого молярного раствора, можно использовать следующую формулу:
Вес в граммах = желаемая молярность x необходимый объем в литрах x GMW
— — ИЛИ —
(W = M x V x GMW)
Пример:
Для процедуры необходимо 500 мл 0,1 М раствора NaOH.Рассчитайте количество растворенного вещества (NaOH), необходимое для приготовления раствора. (атомные массы: Na = 22,99; O = 16; H = 1)
X г = 0,1M x 500 мл x GMW 39,99
X = 0,1 x 0,5 x 39,99 x 39,99 x
5 = 542,0 г NaOH необходимо развести до 500 мл для приготовления 0,1М раствора.
Концентрация | Основы химии растворов
В единицах СИ концентрация растворенного вещества выражается в моль м −3 , что необходимо для расчета конкретных параметров веществ, но неудобно при работе с растворами в лаборатории.Кубический метр (м −3 ) воды весит примерно одну тонну! Общий единицей объема, используемой в химии, является литр (л): это единица, не входящая в систему СИ, и преобразован в единицу объема СИ (м 3 ), используя 1,0 л = 10 -3 м 3 . Концентрация растворенного вещества обычно обозначается квадратными скобками, например [Наци].Ряд альтернативных способов выражения относительного количества растворенного вещества и растворитель широко используются, и вы можете встретить эти термины в своем практическую работу или литературу.
Молярность
Этот термин используется для обозначения молярной концентрации [C] , выраженной в молях.
растворенного вещества на литр объема раствора (моль л -1 ). Этот термин, не относящийся к системе СИ, продолжается
найти широкое применение, отчасти из-за знакомства с работой
ученых с этим термином, но и потому, что лабораторная посуда калибруется в миллилитрах и литрах, что делает препарат молярным и миллимолярным
решения относительно просты.Однако общеупотребительные символы
молярные (М) и миллимолярные (мМ) растворы не соответствуют системе СИ
и многие люди теперь предпочитают использовать моль л -1 и ммоль л -1 соответственно, чтобы
Во избежание путаницы. Подробная информация о некоторых полезных подходах к расчетам
с участием моляров приведены ниже:
- Приготовление раствора определенной молярности. для растворенного вещества известной относительной молекулярной массы (M r ), можно применить следующее соотношение:
[C] = масса растворенного вещества / M r объем раствора
Итак, если вы хотите сделать 200 мл (0.2 л) водного раствора NaCl (Mr = 58,44 г) при концентрации 500 ммоль л -1 (0,5 моль л -1 ), можно рассчитать необходимое количество NaCl, подставив эти значения в уравнение 6.1]:
0,5 = масса растворенного вещества / 58,44 0,2
который можно переставить на
масса растворенного вещества = 0,5 × 0,2 × 58,44 = 5,844 гЭто же соотношение можно использовать для расчета концентрации раствора, содержащего известное количество растворенного вещества, т.е.г. если 21,1 г NaCl мы довели до объема 100 мл (0,1 л), это даст:
NaCl = 21,1/58,44 = 3,61 моль л -1 0,1
- Разведения и концентрации. следующее соотношение очень полезно, если вы разбавляете (или концентрируете) раствор:
[C 1 ] В 1 = [C 2 ] В 2
где [C 1 ] и [C 2 ] — начальная и конечная концентрации, а V 1 и V 2 — их соответствующие объемы: каждая пара должна быть выражена в одних и тех же единицах.Таким образом, если вы хотите разбавить 200 мл 0,5 моль L -1 NaCl, чтобы получить конечную молярность 0,1 моль L -1 , то, подставив в уравнение [6.2]:
0,5 × 200 = 0,1 × В 2
Таким образом, V 2 = 1000 мл (другими словами, вам нужно будет добавить воду к 200 мл 0,5 моль L -1 NaCl, чтобы получить конечный объем 1000 мл для получения 0,1 моль L -1 раствора) - Взаимное преобразование: Простой способ взаимного преобразования количества и объема любого конкретного раствора состоит в том, чтобы разделить количество и объем на коэффициент 10 3 .Так, молярный раствор вещества содержит 1 моль л -1 , что эквивалентно 1 ммоль мл -1 или 1 мкмоль мкл -1 , или 1 нмоль нл -1 и т. д. Вы можете найти эту методику полезно при расчете количества вещества, присутствующего в небольшом объеме раствора известной концентрации, например для расчета количества NaCl, присутствующего в 50 мкл раствора с концентрацией (молярностью) 0,5 моль/л -1 NaCl:
- эквивалентен 50 мкмоль мкл -1
- , следовательно, 50 мкл будет содержать 50 x 0.5 мкмоль = 25 мкмоль.
Это используется для выражения концентрации растворенного вещества по отношению к массе растворителя, т.е. моль кг -1 . Моляльность — это независимый от температуры способ выражения растворенного вещества. концентрация, используется редко, за исключением случаев, когда осмотические свойства раствора представляет интерес.
Процентный состав (% ww)
Это масса растворенного вещества (в г) на 100 г раствора.Преимущество этого
выражением является легкость, с которой можно приготовить раствор, так как он просто
требует предварительного взвешивания каждого компонента (для воды
измерение может быть использовано, например, с помощью мерного цилиндра), а затем смешали
вместе. Аналогичные термины — части на тысячу (‰), т. е. мг г -1 , и части на тысячу
миллион (частей на миллион), т.е. мкг г -1 .
Процентная концентрация (% по массе и % по объему)
Для растворенных веществ, добавленных в твердой форме, это количество граммов растворенного вещества.
на 100 мл раствора.Это чаще используется, чем процентный состав,
поскольку растворы могут быть точно приготовлены путем взвешивания
необходимое количество растворенного вещества, а затем доведение его до известного объема
с помощью мерной колбы. Эквивалентное выражение для жидких растворенных веществ:
% об./об.
Основное использование терминов масса/масса или масса/объем (включая г л -1 ) для растворенных веществ, молекулярная масса которых неизвестна (например, полимеры), или для смеси определенных классов веществ (например,г. общее количество солей в морской воде). Ты следует ли никогда не использовать выражение в процентах без указания способа решения был подготовлен, т. е. с использованием определителя w/w, w/v или v/v. Для массы концентрации, часто проще использовать массу на единицу объема, т.е. мгл -1 , мкг мкл -1 и т. д.
Концентрация частей на миллион (ppm)
Это обычно используемый термин концентрации массы на объем (w/v), не относящийся к системе СИ.
в количественном анализе, таком как пламенная фотометрия, атомная абсорбция
спектроскопия и газовая хроматография, где низкие концентрации растворенных веществ
подлежат анализу.Термин ppm эквивалентен выражению
концентрации в виде IgmL-1 (10 -6 г мл -1 ) и 1,0 ppm раствора
вещество будет иметь концентрацию 1,0 мк гмл -1 (1,0 x 10 6 гмл -1 ). А
типичная процедура расчетов в ppm показана во вставке 6.2.
Частей на миллиард (ppb) является расширением этого термина концентрации, поскольку нг мл -1 (10 -9 гмл -1 ) и обычно используется для выражения концентраций очень разбавленных растворов.Например, допустимая концентрация мышьяка в воде может составлять 0,05 промилле, но ее удобнее выразить как 50 частей на миллиард.
Деятельность (а) Этот термин используется для описания эффективной концентрации растворенного вещества. В разбавленные растворы, можно считать, что растворенные вещества ведут себя в соответствии с идеальным (термодинамические) принципы, т.е. они будут иметь эффективную концентрацию соответствует реальной концентрации. Однако в концентрированных растворах ( ≥ 0.5 моль л -1 ), поведение растворенных веществ часто неидеально, и их эффективная концентрация (активность) будет меньше фактической концентрации [С]. Соотношение между эффективной концентрацией и фактической концентрацией равно называется коэффициентом активности ( γ ), где
⇒ Уравнение 6.3
| Уравнение [6.3] можно использовать для единиц СИ (моль м 7 — л м -1 молярность моль). ) или
моляльность (моль кг -1 ).Во всех случаях γ является безразмерным членом, поскольку a и [C] являются
выражены в тех же единицах. Коэффициент активности растворенного вещества эффективно
единица в разбавленном растворе, уменьшающаяся по мере увеличения концентрации растворенного вещества
(таблица 6.1). При высоких концентрациях некоторых ионных растворенных веществ I’ может увеличиваться до
стать больше единицы. *Примечание: Активность часто является правильным выражением теоретической зависимости, связанные с концентрацией растворенного вещества (т.г. где свойство раствор зависит от концентрации). Однако для наиболее практических целей можно использовать фактическую концентрацию растворенного вещества, а не чем активность, так как различием между двумя терминами можно пренебречь для разбавленных растворов. |
|
Эквивалентная масса (эквивалентный вес)
Эквивалентность и нормальность — устаревшие термины, хотя вы можете прийти к через них в более старых текстах.Величина эквивалентной массы (эквивалентная вес) можно просто определить из сбалансированного уравнения реакции рассматривается. Помните, что эквивалентная масса может на изменить в зависимости от на реакцию, как иллюстрируют следующие реакции.
За;
HCl + NaOH → NaCl + H 2 O
1 моль HCl реагирует с 1 моль NaOH, эквивалентная масса HCl составляет M r = 36,5 и эквивалентная масса NaOH также равна его Mr = 40.
За;
H 2 S0 4 + 2NAOOOOH → Na 2 S0 4 + 2H 2 o
С 1 МОЛ H 2 S0 4 реагирует с 2 моль NaOH, эквивалентной массы
H 2 S0 4 равно M r ÷ 2 = 98 ÷ 2 = 49, а эквивалентная масса NaOH по-прежнему равна M r = 40.
За;
5FES0 4 + KMN0 4 → FE 2 (S0 4 ) 3 + 2MNS0 4 + 2MNS0 4
с 1 МОЛ kmn0 4 реагирует с 5 моль FES0 4 , затем эквивалент масса
kmn0 4 составляет м г ÷ 5 = 158 ÷ 5 = 31,6, а что FES0 4 все еще м R = 152.
Но для:
H 2 S0 4 + Na 2 + Na 2 CO 3 → Na 2 → Na 2 SO 4 + CO 2 + H 2 O
С момента реакции 1: 1, эквивалентные массы H 2 S0 4 и Na 2 CO 3 являются их M r значения, 98 и 106 соответственно.
В результате этой возможной путаницы понятие эквивалентной массы (вес) используется редко.
Нормальность
1 нормальный раствор (1 Н) — это такой, который содержит один
вещества на литр раствора. Общая формула:
| нормальность = | масса вещества на литр |
| эквивалентная масса |
| Осмолярность Это выражение, не относящееся к системе СИ, используется для описания количества молей осмотически активных частиц растворенного вещества на литр раствора (osmol L -1 ).Необходимость поскольку такой термин возникает из-за того, что некоторые молекулы диссоциируют с образованием более одна осмотически активная частица в водном растворе. Осмоляльность Этот термин описывает количество молей осмотически активных частиц растворенного вещества. на единицу массы растворителя (осмоль кг -1 ). Для идеального растворенного вещества осмоляльность может можно определить путем умножения моляльности на n , количество растворенного вещества частицы, образующиеся в растворе (например, для NaCl n = 2). |
|
осмоляльность = моляльность × n × ø
При необходимости можно получить осмотические коэффициенты конкретного растворенного вещества из таблиц (например, Таблица 6.2): неидеальное поведение означает, что ø может иметь значения > 1 при высоких концентрациях.Кроме того, осмоляльность раствора можно измерить осмометром.
Осмотическое давление
Это основано на концепции мембраны, проницаемой для воды, но не для
растворенные молекулы. Например, если раствор сахарозы поставить с одной стороны и
чистой воды с другой, то будет создаваться пассивная движущая сила и
вода будет диффундировать через мембрану в раствор сахарозы, так как
эффективная концентрация воды в растворе сахарозы будет ниже.То
тенденцию к диффузии воды в раствор сахарозы можно противодействовать
путем приложения гидростатического давления, эквивалентного пассивной движущей силе.
Таким образом, осмотическое давление раствора равно избыточному гидростатическому давлению.
требуется для предотвращения чистого притока воды в сосуд, содержащий
решение. Единицей осмотического давления в СИ является паскаль, Па (= кг м -1 с -2 ).
В более старых источниках могут использоваться атмосферы или бары, и приводятся коэффициенты преобразования.
в поле 9.1. Осмотическое давление и осмоляльность могут взаимно преобразовываться
используя выражение 1осмоль кг -1 = 2,479 МПа при 25°C.
Использование осмотического давления подвергалось критике как вводящее в заблуждение, поскольку раствор не проявляет «осмотического давления», если он не помещен на другой сторона избирательно проницаемой мембраны из чистой воды!
Молярность (Молярная концентрация) ~ ChemistryGod
Молярность или молярная концентрация растворенного вещества является способом измерения, как молярная доля или массовая доля.Это свойство растворов, особенно однородных растворов. Прежде чем мы углубимся в молярность, давайте ознакомимся с некоторыми терминами, которые мы будем использовать в этой статье.
Раствор представляет собой гомогенную смесь, состоящую из двух или более веществ. Мы сталкиваемся со многими веществами в нашей повседневной жизни, которые являются растворами, например. соки, воздух, безалкогольные напитки, алкогольные напитки, телесные жидкости, такие как моча. Морская вода является одним из самых больших решений.
Морская вода — это раствор. Он состоит из воды (растворителя) и растворенных в ней многочисленных солей (растворенных веществ).Растворитель является основным компонентом раствора. например, вода является растворителем в морской воде. С другой стороны, растворенное вещество является второстепенным компонентом в растворе, например соли натрия в морской воде.
Содержание
Определение
Молярность растворенного вещества в растворе определяется как число молей растворенного вещества в единице объема раствора. Ее также называют молярной концентрацией.
Формула
Мы можем получить формулу, используя приведенное выше определение.
Здесь c i — молярность растворенного вещества, i , n i — число молей растворенного вещества, i ,
V — объем раствора.Единицы
Предпочтительной единицей молярности является моль дм -3 или моль л -1 .
Примечание: дм 3 (кубический дециметр) и л (литр) эквивалентны, т. е. 1 дм 3 = 1 л. химики.Единицей молярности в СИ является моль м -3 . Это неудобный и непрактичный прибор для лабораторного использования. Следовательно, моль дм -3 стал общепринятой единицей. Символ М традиционно используется для обозначения моль дм -3 . Кроме того, мы также можем использовать префиксы SI с символом M, например. мМ (миллимолярные), мкМ (микромолярные), нМ (наномолярные). В таблице перечислены некоторые из этих единиц.
| Блок Аббревиатура | эквивалент в М (моль L -1 ) | |
|---|---|---|
| megamolar ММ | 10 6 | |
| kilomolar | кМ 10 3 | |
| hectomolar Hm | 10 | 2|
| decamolar Dam | 10 | |
| decimolar дМ | 10 | -1|
| centimolar сМ | 10 | -2|
| миллимолей мМ | 10 | -3|
| микромолей мкМ | 10 | -6|
| нмоль нМ | 10 −9 | |
| пикомолярный | пМ | 10 −12 9041 8 |
Пояснение
Молярность – это отношение числа молей компонента к общему объему раствора.
В химических лабораториях молярность в основном выражается в моль л −1 . Более практичным определением будет количество молей растворенного вещества на литр раствора.
0,5 М раствора NaCl означает 0,5 моль NaCl в литре раствора. По мере увеличения значения молярной концентрации количество растворенного вещества на литр также увеличивается. Например, 1,0 М раствора NaCl будет содержать большее количество NaCl, чем 0,5 М NaCl на литр раствора. На рисунке ниже показано то же самое.
По мере увеличения молярной концентрации количество растворенного вещества также увеличивается.Раствор может быть жидким, газообразным или твердым. Рассмотрим пример сахара в воде. В этом примере раствор представляет собой жидкость.
Возьмем другой пример, но на этот раз раствором является газ.
Пример 2: Загрязнители воздуха
Утверждение: Изменение климата и глобальное потепление являются острой проблемой в мире. Увеличение загрязняющих веществ в воздухе представляет собой экзистенциальную угрозу для наших будущих поколений.Одним из таких загрязнителей является аммиак (NH 3 ). В основном это выбросы сельскохозяйственных отходов. Для объема 2,0 м 3 число молей аммиака в воздухе составляет 1,2 × 10 -7 моль. Найдите молярную концентрацию аммиака в воздухе.
Загрязнение аммиаком в СШАРешение: количество молей аммиака составляет 1,2 × 10 −7 моль, а объем воздуха составляет 2,0 м 3 . n NH 3 = 1,2 × 10 −7 моль и V = 2.0 м 3 .
Таким образом, содержание аммиака в воздухе составляет 60 нМ.
В приведенном ниже примере раствор представляет собой твердую смесь.
Для приготовления растворов
Каждый студент-естественник сталкивался с приготовлением растворов в химических лабораториях. Двумя основными входными данными, необходимыми для приготовления раствора, являются желаемая молярная концентрация (какая концентрация нам нужна?) и объем раствора (сколько мы хотим?).
Колба, химический стакан и мерный цилиндр с весамиСуществует два метода приготовления раствора:
- Приготовление маточного раствора
- Из маточного раствора (разведение)
Примечание: Исходный раствор представляет собой концентрированный раствор, который готовится заранее, а затем может быть разбавлен для получения раствора более низкой концентрации.
Оба метода кратко обсуждаются ниже.
Для приготовления основного раствора
Основной раствор готовится непосредственно из самих химикатов. Другими словами, мы должны взвесить или измерить растворенное вещество и смешать его с растворителем.
Зная молярность и объем раствора, мы можем рассчитать количество присутствующего в нем растворенного вещества. Давайте рассмотрим пример ниже, чтобы объяснить то же самое.
Из исходного раствора (разведение)
При разбавлении концентрированный раствор разбавляют путем вливания в него растворителя.Обычно мы готовим растворы путем разбавления. Это простой и быстрый метод, потому что нам нужно только разбавить существующий концентрированный раствор.
Рассмотрим следующие параметры, относящиеся к разбавлению:
- M 1 — начальная концентрация раствора — перед разбавлением. Это нам известно.
- V 1 — объем концентрированного раствора, который нам предстоит разбавить. Это нам неизвестно.
- M 2 — конечная концентрация раствора — после разбавления.Это нам известно.
- V 2 – объем разведенного раствора. Это известно и нам.
При разбавлении изменяется только количество растворителя, количество растворенного вещества остается постоянным. Пусть n растворенного вещества будет числом молей растворенного вещества.
Исключение n растворенного вещества из двух приведенных выше уравнений,
Это очень полезное уравнение. Это закон сохранения массы в разбавленном состоянии.Рассмотрим пример, чтобы лучше понять его.
Ионные соединения
Ионные соединения диссоциируют с образованием ионов, когда они растворяются в полярных растворителях, таких как вода. Молярная концентрация ионного соединения в целом может отличаться от молярной концентрации его ионов.
Свойства молярности
- Молярность – это характеристика гомогенного раствора.
- Интенсивное свойство, поскольку оно представляет собой соотношение двух экстенсивных свойств. Следовательно, его значение не будет меняться от образца к образцу.
- Однако его значение может меняться в зависимости от температуры и давления. Причина этого в том, что объем раствора зависит от температуры и давления.
Связь с другими величинами
Постоянная Авогадро
Постоянная Авогадро ( N A ) число молекул в моле вещества. Пусть N i — молекулы растворенного вещества.
Подставив вышеприведенное выражение,
Здесь соотношение N i ⁄ V представляет собой число молекул в единице объема, также известное как числовая плотность.
Массовая доля
Массовая доля компонента – это отношение массы компонента к общей массе раствора.
Пусть M i и ρ — молярная масса растворенного вещества и плотность раствора.
Массовая концентрация
Массовая концентрация растворенного вещества представляет собой отношение массы растворенного вещества к объему раствора.
Используя приведенную выше формулу,
Молярная доля
Молярная доля компонента представляет собой отношение молей компонента к общему количеству молей.
Пусть M будет средней молярной массой раствора.
.Моляльность
Моляльность растворенного вещества представляет собой отношение числа молей растворенного вещества к массе растворителя.
Рассмотрим бинарную смесь. Пусть нижний индекс 1 и нижний индекс 2 обозначают растворитель и растворенное вещество.
Молярная концентрация растворенного вещества:
Решенные задачи
Задача 1. Осаждение йодистого свинца
Утверждение: При введении водного раствора нитрата свинца при контакте с водным раствором йодида калия (KI) йодид свинца (PbI 2 ) осаждается в виде желтого твердого вещества.
Найдите объем 0,05 М KI, необходимый для полного осаждения 0,20 л 0,02 М Pb (NO 3 ) 2 ?
Решение: На каждый израсходованный моль Pb(NO 3 ) 2 расходуется 2 моля KI. Другими словами, количество молей KI вдвое больше количества молей Pb(NO 3 ) 2 . Таким образом, n KI = 2 n Pb(NO 3 ) 2 .
Но мы также знали N PB (№ 3 ) 2 = м PB (№ 3 ) 2 V Pb (NO 3 ) 2 и n KI = M KI V KI .Подставляя эти значения в приведенное выше уравнение,
Следовательно, 0,16 л 0,05 KI полностью осаждают 0,02 л 0,02 М Pb(NO 3 ) 2 .
Задача 2. Разбавление хлористого водорода
Утверждение. В лаборатории имеется 0,50 М раствор хлористого водорода (HCl). Для реакции нейтрализации нам требуется 0,10 л 0,10 М HCl. Найдите объем воды, которую нужно добавить в 0,50 М HCl?
Решение: Пусть M 1 и M 2 будут молярностью 0.50 М и 0,10 М HCl.
Объем добавляемой воды: V 1 − V 2 .
Задача 3. Гидроксид натрия
Утверждение. Найдите объем 5,0 М NaOH, если количество молей NaOH в растворе равно 2,5 моль?
Раствор: М NaOH = 5,0 М и n NaOH = 2,5 моль.
V NaOH – объем NaOH.
Практические задачи
Задача 1: Найдите молярную концентрацию ионов водорода и сульфата в 0.3 М серная кислота (H 2 SO 4 )?
Задача 2. Найдите количество литров воды, которое нужно добавить, чтобы развести 0,10 М гидроксида натрия (NaOH) до 1,0 л 0,050 М NaOH?
Задача 3. В приведенной ниже реакции осаждения молярность 0,20 л нитрата серебра (AgNO 3 ) равна 0,02 М.
Найдите количество литров 0,01 М KCl, необходимое для полного расходования AgNO 3 ?
Показать ответы- Молярная концентрация ионов H + и SO −
4 равна 0.6 М и 0,3 М. - Необходимо добавить 0,50 М воды в литрах.
- Требуется 0,40 л KCl.
Связанные статьи
3.3 Молярность — Химия 2e
Цели обучения
К концу этого раздела вы сможете:
- Описывать основные свойства растворов
- Расчет концентрации раствора с использованием молярности
- Выполнение расчетов разбавления с использованием уравнения разбавления
Предыдущие разделы этой главы были посвящены составу веществ: образцам вещества, которые содержат только один тип элемента или соединения.Однако смеси — образцы вещества, содержащие физически соединенные два или более вещества, — встречаются в природе чаще, чем чистые вещества. Подобно чистому веществу, относительный состав смеси играет важную роль в определении ее свойств. Относительное количество кислорода в атмосфере планеты определяет ее способность поддерживать аэробную жизнь. Относительное количество железа, углерода, никеля и других элементов в стали (смесь, известная как «сплав») определяет ее физическую прочность и устойчивость к коррозии.Относительное количество активного ингредиента в лекарстве определяет его эффективность в достижении желаемого фармакологического эффекта. Относительное количество сахара в напитке определяет его сладость (см. рис. 3.14). В этом разделе будет описан один из наиболее распространенных способов количественной оценки относительного состава смесей.
Фигура 3.14 Сахар является одним из многих компонентов сложной смеси, известной как кофе. Количество сахара в данном количестве кофе является важным фактором, определяющим сладость напитка.(кредит: Джейн Уитни)
Решения
Растворы ранее определялись как однородные смеси, что означает, что состав смеси (и, следовательно, ее свойства) однородны по всему ее объему. Решения часто встречаются в природе и также были реализованы во многих формах искусственных технологий. Более тщательное рассмотрение свойств растворов дано в главе о растворах и коллоидах, но здесь представлено введение в некоторые основные свойства растворов.
Относительное количество данного компонента раствора называется его концентрацией. Часто, хотя и не всегда, раствор содержит один компонент с концентрацией, значительно превышающей концентрацию всех остальных компонентов. Этот компонент называется растворителем и может рассматриваться как среда, в которой другие компоненты диспергированы или растворены. Растворы, в которых вода является растворителем, конечно, очень распространены на нашей планете. Раствор, в котором вода является растворителем, называется водным раствором.
Растворенное вещество — это компонент раствора, который обычно присутствует в гораздо более низкой концентрации, чем растворитель. Концентрации растворенных веществ часто описываются качественными терминами, такими как разбавленный (относительно низкой концентрации) и концентрированный (относительно высокой концентрации).
Концентрации могут быть количественно оценены с использованием множества единиц измерения, каждая из которых удобна для конкретных применений. Молярность ( M ) является полезной единицей концентрации для многих приложений в химии.Молярность определяется как количество молей растворенного вещества ровно в 1 литре (1 л) раствора:
M=моль растворенного L раствора M=моль растворенного L раствораПример 3.14
Расчет молярных концентраций
Образец безалкогольного напитка объемом 355 мл содержит 0,133 моль сахарозы (столовый сахар). Какова молярная концентрация сахарозы в напитке?Решение
Поскольку даны молярное количество растворенного вещества и объем раствора, молярность можно рассчитать, используя определение молярности.В соответствии с этим определением объем раствора необходимо преобразовать из мл в л: M = моль растворенного вещества L раствор = 0,133 моль 355 мл × 1 л 1000 мл = 0,375 мм = моль растворенного вещества L раствор = 0,133 моль 355 мл × 1 л 1000 мл = 0,375 MПроверьте свои знания
Чайная ложка столового сахара содержит около 0,01 моль сахарозы. Какова молярность сахарозы, если чайная ложка сахара растворена в чашке чая объемом 200 мл?Пример 3.15
Получение молей и объемов из молярных концентраций
Сколько сахара (моль) содержится в скромном глотке (~10 мл) безалкогольного напитка из примера 3.14?Решение
Измените определение молярности, чтобы выделить искомое количество, моли сахара, затем подставьте значение молярности, полученное в примере 3.14, 0,375 M : М=моль растворенного веществаL растворамоль растворенного вещества=M×L растворамоль растворенного вещества=0,375моль сахараL×(10мл×1л1000мл)=0,004моль сахараM=моль растворенного веществаL растворамоль растворенного вещества=M×L растворамоль растворенного вещества=0,375моль сахараL×(10мл×1л1000мл)=0,004моль сахарПроверьте свои знания
Какой объем (мл) подслащенного чая, описанного в примере 3.14, содержит такое же количество сахара (моль), что и 10 мл безалкогольного напитка в этом примере?Пример 3.16
Расчет молярных концентраций по массе растворенного вещества
Дистиллированный белый уксус (рис. 3.15) представляет собой раствор уксусной кислоты CH 3 CO 2 H в воде. В 0,500 л раствора уксуса содержится 25,2 г уксусной кислоты. Какова концентрация раствора уксусной кислоты в молярных единицах?Фигура 3.15 Дистиллированный белый уксус представляет собой раствор уксусной кислоты в воде.
Решение
Как и в предыдущих примерах, определение молярности является основным уравнением, используемым для расчета искомого количества.Поскольку вместо молярного количества указывается масса растворенного вещества, используйте молярную массу растворенного вещества, чтобы получить количество растворенного вещества в молях: M = моль растворенного вещества L раствор = 25,2 г Ch4CO2H × 1 моль Ch4CO2H60,052 г Ch4CO2H 0,500 л раствора = 0,839 мм = моль растворенного вещества L раствор = 25,2 г Ch4CO2H × 1 моль Ch4CO2H60,052 г Ch4CO2H 0,500 л раствора = 0,839 мм = моль растворенного вещества L раствор = 0,839 мм =0,839 моль растворенного вещества1,00 л раствораM=моль растворенного веществаL раствора=0,839MM=0,839 моль растворенного вещества1,00 л раствораПроверьте свои знания
Рассчитайте молярность 6,52 г CoCl 2 (128.9 г/моль) растворяют в водном растворе общим объемом 75,0 мл.Пример 3.17
Определение массы растворенного вещества в заданном объеме раствора
Сколько граммов NaCl содержится в 0,250 л раствора 5,30- М ?Решение
Объем и молярность раствора указаны, поэтому количество (моль) растворенного вещества легко вычислить, как показано в примере 3.15: M = моль растворенного вещества L раствор моль растворенного вещества = M × L раствор моль растворенного вещества = 5,30 моль NaClL × 0.250 л = 1,325 моль NaClM = моль растворенного вещества л раствора моль растворенного вещества = M × л раствора моль растворенного вещества = 5,30 моль NaClL × 0,250 л = 1,325 моль NaClНаконец, это молярное количество используется для получения массы NaCl:
1,325 моль NaCl×58,44 г NaClмоль NaCl=77,4 г NaCl1,325 моль NaCl×58,44 г NaClмоль NaCl=77,4 г NaClПроверьте свои знания
Сколько граммов CaCl 2 (110,98 г/моль) содержится в 250,0 мл 0,200- М раствора хлорида кальция ?При выполнении расчетов пошагово, как в примере 3.17, важно воздерживаться от округления любых промежуточных результатов расчета, что может привести к ошибкам округления в конечном результате. В примере 3.17 молярное количество NaCl, вычисленное на первом этапе, 1,325 моль, было бы должным образом округлено до 1,32 моль, если бы его нужно было сообщить; однако, несмотря на то, что последняя цифра (5) не имеет значения, ее необходимо сохранить в качестве защитной цифры в промежуточных вычислениях. Если бы защитная цифра не была сохранена, окончательный расчет массы NaCl был бы равен 77.1 г, разница 0,3 г.
В дополнение к сохранению защитной цифры для промежуточных вычислений ошибок округления также можно избежать, выполняя вычисления в один шаг (см. Пример 3.18). Это устраняет промежуточные шаги, так что округляется только окончательный результат.
Пример 3.18
Определение объема раствора, содержащего заданную массу растворенного вещества
В примере 3.16 определено, что концентрация уксусной кислоты в белом уксусе равна 0.839 М . В каком объеме уксуса содержится 75,6 г уксусной кислоты?Решение
Сначала используйте молярную массу для расчета молей уксусной кислоты по заданной массе: г растворенного вещества×моль растворенного веществаэг растворенного вещества=моль растворенного веществаэг растворенного вещества×моль растворенного веществаэг растворенного вещества=моль растворенного веществаЗатем используйте молярность раствора для расчета объема раствора, содержащего это молярное количество растворенного вещества:
моль растворенного вещества × л раствора моль растворенного вещества = л раствора моль растворенного вещества × л раствора моль растворенного вещества = л раствораОбъединение этих двух шагов в один дает:
г растворенного вещества×моль растворенного веществаэг растворенного вещества×л растворамоль растворенного вещества=л раствораг растворенного вещества×моль растворенного веществаэг растворенного вещества×л растворамоль растворенного вещества=л раствора 75.6гCh4CO2H(мольCh4CO2H60,05г)(л раствор0,839мольCh4CO2H)=1,50л раствора75,6гCh4CO2H(мольCh4CO2H60,05г)(л раствор0,839мольCh4CO2H)=1,50л раствораПроверьте свои знания
В каком объеме раствора 1,50- М KBr содержится 66,0 г KBr?Разведение растворов
Разбавление – это процесс, при котором концентрация раствора уменьшается путем добавления растворителя. Например, стакан чая со льдом становится все более разбавленным по мере таяния льда. Вода из тающего льда увеличивает объем растворителя (воды) и общий объем раствора (чай со льдом), тем самым уменьшая относительные концентрации растворенных веществ, которые придают напитку его вкус (рис. 3.16).
Фигура 3.16 Оба раствора содержат одинаковую массу нитрата меди. Раствор справа более разбавлен, потому что нитрат меди растворен в большем количестве растворителя. (кредит: Марк Отт)
Разбавление также является распространенным способом приготовления растворов желаемой концентрации. Путем добавления растворителя к отмеренной части более концентрированного маточного раствора можно приготовить раствор меньшей концентрации. Например, коммерческие пестициды обычно продаются в виде растворов, в которых концентрация активных ингредиентов намного выше, чем это необходимо для их применения.Прежде чем их можно будет использовать на сельскохозяйственных культурах, пестициды должны быть разбавлены. Это также очень распространенная практика приготовления ряда обычных лабораторных реагентов.
Можно использовать простое математическое соотношение для соотношения объемов и концентраций раствора до и после процесса разбавления. Согласно определению молярности количество молей растворенного вещества в растворе ( n ) равно произведению молярности раствора ( М ) на его объем в литрах ( л ):
Подобные выражения могут быть написаны для раствора до и после его разбавления:
, где индексы «1» и «2» относятся к раствору до и после разбавления соответственно.Поскольку процесс разбавления не меняет количество растворенного вещества в растворе, n 1 = n 2 . Таким образом, эти два уравнения можно приравнять друг другу:
Это соотношение обычно называют уравнением разбавления. Хотя в этом уравнении используется молярность в качестве единицы концентрации и литры в качестве единицы объема, другие единицы концентрации и объема могут использоваться при условии, что единицы должным образом сокращаются в соответствии с методом метки фактора.Отражая эту универсальность, уравнение разбавления часто записывают в более общей форме:
., где C и V — концентрация и объем соответственно.
Ссылка на обучение
Используйте моделирование, чтобы изучить отношения между количеством растворенного вещества, объемом раствора и концентрацией, а также подтвердить уравнение разбавления.
Пример 3.19
Определение концентрации разбавленного раствора
Если 0.850 л 5,00- М раствора нитрата меди Cu(NO 3 ) 2 разбавляют до объема 1,80 л добавлением воды, какова молярность разбавленного раствора?Решение
Приведены исходная концентрация, C 1 , и объем, V 1 , а также объем разбавленного раствора, V 2 . Измените уравнение разбавления, чтобы выделить неизвестное свойство, концентрацию разбавленного раствора, C 2 : C1V1=C2V2C2=C1V1V2C1V1=C2V2C2=C1V1V2Поскольку исходный раствор разбавляется более чем в два раза (объем увеличивается с 0.от 85 л до 1,80 л), ожидается, что концентрация разбавленного раствора будет меньше половины 5 M . Эта приблизительная оценка будет сравниваться с расчетным результатом, чтобы проверить любые грубые ошибки в вычислениях (например, такие как неправильная замена заданных величин). Подстановка данных значений для членов в правой части этого уравнения дает:
C2=0,850 л×5,00 мольL1,80 л=2,36 MC2=0,850 л×5,00 мольL1,80 л=2,36MЭтот результат хорошо согласуется с нашей приблизительной оценкой (это чуть меньше половины концентрации акций, 5 M ).
Проверьте свои знания
Какова концентрация раствора, полученного при разбавлении 25,0 мл 2,04- М раствора СН 3 ОН до 500,0 мл?Пример 3.20
Объем разбавленного раствора
Какой объем 0,12 М HBr можно получить из 11 мл (0,011 л) 0,45 М HBr?Решение
Указаны объем и концентрация исходного раствора, V 1 и C 1 , а также концентрация полученного разбавленного раствора, C 2 .Найдите объем разбавленного раствора V 2 путем преобразования уравнения разбавления, чтобы выделить V 2 : C1V1=C2V2V2=C1V1C2C1V1=C2V2V2=C1V1C2Поскольку разбавленная концентрация (0,12 М ) составляет чуть более одной четверти исходной концентрации (0,45 М ), ожидается, что объем разбавленного раствора будет примерно в четыре раза больше исходного объема, или около 44 мл. Подстановка данных значений и решение для неизвестного объема дает:
V2=(0.45 м)(0,011 л)(0,12 м)V2=0,041LV2=(0,45 м)(0,011 л)(0,12 м)V2=0,041 лОбъем 0,12- М раствора составляет 0,041 л (41 мл). Результат разумный и хорошо сравним с грубой оценкой.
Проверьте свои знания
Для лабораторного эксперимента требуется 0,125 M HNO 3 . Какой объем 0,125 M HNO 3 можно приготовить из 0,250 л 1,88 M HNO 3 ?Пример 3.21
Объем концентрированного раствора, необходимый для разбавления
Какой объем 1.59 M KOH требуется для приготовления 5,00 л 0,100 M KOH?Решение
Даны концентрация маточного раствора C 1 , а также объем и концентрация полученного разбавленного раствора V 2 и C 2 . Найдите объем исходного раствора V 1 , переформулировав уравнение разбавления, чтобы выделить V 1 : C1V1=C2V2V1=C2V2C1C1V1=C2V2V1=C2V2C1Так как концентрация разбавленного раствора 0.100 M составляет примерно одну шестнадцатую от исходного раствора (1,59 M ), ожидается, что объем исходного раствора составит примерно одну шестнадцатую объема разбавленного раствора, или около 0,3 литра. Подстановка данных значений и решение неизвестного объема дает:
V1=(0,100M)(5,00л)1,59MV1=0,314LV1=(0,100M)(5,00л)1,59MV1=0,314лТаким образом, для приготовления нужного раствора необходимо 0,314 л раствора 1,59- М . Этот результат согласуется с грубой оценкой.






 Результат вычитания проставляют у правого конца соответствующей диагонали. Получилось, что смешать требуется 5 в. ч. 15% и 20 в. ч. 40% раствора, т. е. в соотношении 1:4.
Результат вычитания проставляют у правого конца соответствующей диагонали. Получилось, что смешать требуется 5 в. ч. 15% и 20 в. ч. 40% раствора, т. е. в соотношении 1:4.
