Тест по теме Свой¬ства простых ве¬ществ − ме¬тал¬лов и неметаллов
Тест по теме Свойства простых веществ − металлов и неметаллов
Задание 7 № 1Химическая реакция протекает между:
1)
2)
3)
4)
Пояснение.
Более активные галогены вытесняют менее активные из их солей, бром менее активен чем хлор, но активнее чем йод, поэтому правильным ответом является ответ №4.
Задание 7 № 2. Йод, в отличие от хлора, НЕ реагирует с
1) алюминием
2) железом
3) бромидом натрия
4) фторидом натрия
Пояснение.
Более сильные галогены вытесняют менее сильные из их солей. Хлор сильнее чем бром, поэтому он его вытесняет из бромида натрия, иод слабее брома, поэтому с бромидом натрия он не реагирует.
Задание 7 № 3 Верны ли следующие суждения о металлах и их соединениях?
А. Все металлы реагируют с водой с образованием оксидов.
Б. Все оксиды металлов — основные.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Пояснение.
Оба суждения неверны, т.к. металлы IA и IIA образуют щелочи при взаимодействии с водой. Металлы, стоящие вряду напряжений после водорода, не реагируют с водой и кислотами.Металлы могут образовывать все типы оксидов: основные, кислотные, амфотерные, в зависимости от степени окисления металла.
Задание 7 № 4 С водой при обычной температуре взаимодействуют
1) кислород и сера
2) фтор и калий
3) кремний и кальций
4) железо и медь
Пояснение.
Калий -щелочной металл , при обычных условиях взаимодействует с водой с образованием щелочи и водорода.
Фтор активно реагирует с водой с образованием кислорода
Задание 7 № 5. Только при высокой температуре с водой реагирует
1)
2)
3)
4)
Пояснение.
Металлы, не относящиеся к группе щелочных и щелочноземельных металлов, реагируют с водой только при высокой температуре с образованием оксидов.
Благородные металлы (платина, золото, серебро…) с водой не реагируют.
Ответ: Zn
Задание 7 № 6. Общим свойством серебра и железа является их способность растворяться в
1) воде
2) серной кислоте (р-р)
3) азотной кислоте (конц. )
)
4) растворе щелочи
Пояснение.
С азотной кислотой реагируют оба металла, но только железо реагирует при нагревании, потому что концентрированная азотная кислота пассивирует железо. Она не реагирует с золотом, платиной, танталом, иридием, ниобием, родием.
Задание 7 № 7. Верны ли следующие суждения о свойствах железа?
А. При взаимодействии железа с разбавленной хлороводородной кислотой образуется
хлорид железа (II).
Б. При взаимодействии железа с хлором образуется хлорид железа (II).
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Пояснение.
Верно только А, потому что железо проявляет СО +3 в реакциях с сильными окислителями
( галогенами и концентрированными кислотами).
Задание 7 № 8. Верны ли следующие суждения о меди и ее соединениях?
А. Степень окисления меди в высшем оксиде равна +1.
Б. Медь вытесняет алюминий из раствора нитрата алюминия.
1) верно только А
3) верны оба суждения
4) оба суждения неверны
Пояснение.
оба суждения неверны, т.к. медь в ряду напряжений металлов стоит правее алюминия, значит вытеснить его из растворов солей не может.
Задание 7 № 9. Алюминий не вытесняет водород из
1)
2)
3)
4)
Пояснение.
Концентрированная серная кислота пассивирует алюминий, при нагревании она будет реагировать но не с образованием водорода.
Задание 7 № 10 С водой даже при нагревании не реагирует
1) магний
2) железо
3) цинк4) серебро
Пояснение.
Серебро это малоактивный металл, который стоит в ряду напряжений металлов правее водорода, поэтому не вытесняет водород из воды и растворов кислот
Задание 7 № 11. Верны ли следующие суждения о свойствах углерода?
А. Взаимодействие углерода с кислородом относится к экзотермическим реакциям.
Б. При полном сгорании углерода образуется оксид углерода (IV).
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Пояснение.
Верны оба суждения, т.к. реакции окисления относятся к экзотермическим реакциям, кроме окисления азота. Углерод может образовывать при окислении оксид углерода(II) — при недостке кислорода и оксид углерода (IV) при его избытке.
Задание 7 № 12 При обычных условиях практически осуществима реакция между железом и
1) серой (тв.)
2) серной кислотой (конц.)
3) нитратом меди (II) (р-р)
4) нитратом цинка (р-р)
Пояснение.
С растворами солей менее активных металлов железо реагирует при обычных условиях.
Задание 7 № 13. Сера реагирует с каждым из двух веществ:
1)
2)
3)
4)
Пояснение.
Задание 7 № 14Верны ли следующие суждения о свойствах углерода?
А. При обычной температуре углерод инертен.
Б. При нагревании углерод является сильным восстановителем.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Пояснение.
Верны оба суждения При обычной температуре углерод инертен.
При нагревании углерод является сильным восстановителем взаимодействует с кислородом и оксидами металлов, восстанавливая металлы.
Задание 7 № 15. Верны ли следующие суждения о свойствах кальция?
А. Для кальция характерны восстановительные свойства.
Б. При взаимодействии кальция с водой образуется оксид и вода.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Пояснение.
Кальций это щелочноземельный металл- это сильный восстановитель, при взаимодействии его с водой образуется щелочь и водород.
Тест по теме Свойства простых веществ − металлов и неметаллов
Задание 7 № 1 Химическая реакция протекает между:
1)
2)
3)
4)
Задание 7 № 2. Йод, в отличие от хлора, НЕ реагирует с
1) алюминием
2) железом3) бромидом натрия
4) фторидом натрия
Задание 7 № 3 Верны ли следующие суждения о металлах и их соединениях?
А. Все металлы реагируют с водой с образованием оксидов.
Все металлы реагируют с водой с образованием оксидов.
Б. Все оксиды металлов — основные.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Задание 7 № 4 С водой при обычной температуре взаимодействуют
1) кислород и сера
2) фтор и калий
3) кремний и кальций
4) железо и медь
Задание 7 № 5. Только при высокой температуре с водой реагирует
1)
2)
3)
4)
Задание 7 № 6. Общим свойством серебра и железа является их способность растворяться в
1) воде
2) серной кислоте (р-р)
3) азотной кислоте (конц. )
)
4) растворе щелочи
Задание 7 № 7. Верны ли следующие суждения о свойствах железа?
А. При взаимодействии железа с разбавленной хлороводородной кислотой образуется
хлорид железа (II).
Б. При взаимодействии железа с хлором образуется хлорид железа (II).
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Задание 7 № 8. Верны ли следующие суждения о меди и ее соединениях?
А. Степень окисления меди в высшем оксиде равна +1.
Б. Медь вытесняет алюминий из раствора нитрата алюминия.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Задание 7 № 9. Алюминий не вытесняет водород из
Алюминий не вытесняет водород из
1)
2)
3)
4)
Задание 7 № 10 С водой даже при нагревании не реагирует
1) магний
2) железо
3) цинк
4) серебро
Задание 7 № 11. Верны ли следующие суждения о свойствах углерода?
А. Взаимодействие углерода с кислородом относится к экзотермическим реакциям.
Б. При полном сгорании углерода образуется оксид углерода (IV).
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Задание 7 № 12 При обычных условиях практически осуществима реакция между железом и
1) серой (тв. )
)
2) серной кислотой (конц.)
3) нитратом меди (II) (р-р)
4) нитратом цинка (р-р)
Задание 7 № 13. Сера реагирует с каждым из двух веществ:
1)
2)
3)
4)
Задание 7 № 14Верны ли следующие суждения о свойствах углерода?
А. При обычной температуре углерод инертен.
Б. При нагревании углерод является сильным восстановителем.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Задание 7 № 15. Верны ли следующие суждения о свойствах кальция?
А. Для кальция характерны восстановительные свойства.
Б. При взаимодействии кальция с водой образуется оксид и вода.
При взаимодействии кальция с водой образуется оксид и вода.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Химические свойства углерода. Карбиды — Справочник химика 21
Химические свойства углерода. Карбиды. При низки.х температурах и уголь, и графит к, в особенности, алмаз инертны. Пря на.гревании их активность увеличивается уголь легко соединяется с кислородом и служит хорошим восстановителем. Важнейший процесс металлургии — выплавка металлов из руд — осуш есТ вляется путем восстановления оксидов металлов углем (или оксидом углерода). [c.437]Химические свойства углерода. Карбиды 433 [c.433]
ХИМИЧЕСКИЕ СВОЙСТВА УГЛЕРОДА, КАРБИДЫ МЕТАЛЛОВ [c.196]
Углерод присутствует в сплавах железа в трех формах связанный в твердом растворе (феррите), в карбидах и в виде графита Определение содержания различных видов углерода в сталях и чугунах основано на их различных физических и химических свойствах и их реакциях в растворах электролитов. [c.29]
[c.29]
Углерод непосредственно соединяется со многими металлами, образуя карбиды — соединения, в которых углерод электроотрицателен. Степень окисления углерода в карбидах различна. Различны и химические свойства карбидов. С активными металлами — щелочными и щелочноземельными — углерод образует солеподобные карбиды, в которых атомы углерода связаны между собой тройной связью в группировку — С С —, как, например, в СаС . Степень окисления углерода в них —1. При взаимодействии этих карбидов с водой они подвергаются гидролизу с образованием гидроксида металла и ацетилена [c.203]
Карбид кремния, или так называемый карборунд, 81С образуется при восстановлении двуокиси кремния углем при температуре около 2000° С. Чистый карбид кремния представляет собой бесцветные кристаллы (технический окрашен обычно примесями в темный цвет). Кристаллическая решетка карбида кремния напоминает кристаллические решетки алмаза и элементарного кремния структуру кристаллов карборунда можно представить, если в расширенной решетке алмаза половину атомов углерода заменить на атомы кремния. Плотность карбида кремния 3,20 г/см . Характерными свойствами его являются чрезвычайно большая твердость (в этом отношении он лишь немногим уступает алмазу) и химическая инертность. На карбид кремния не действуют даже сильнейшие окислители и кислоты. Он разлагается лишь при нагревании выше 2200° С, а также при сплавлении со щелочами в присутствии кислорода. [c.195]
Плотность карбида кремния 3,20 г/см . Характерными свойствами его являются чрезвычайно большая твердость (в этом отношении он лишь немногим уступает алмазу) и химическая инертность. На карбид кремния не действуют даже сильнейшие окислители и кислоты. Он разлагается лишь при нагревании выше 2200° С, а также при сплавлении со щелочами в присутствии кислорода. [c.195]
Химические свойства. При обычной температуре титан довольно устойчив при нагревании же легко соединяется со многими элементами, в том числе и со сравнительно инертным азотом. Так, в струе хлора он загорается при 350° С. В кислороде аморфный титан загорается при 610° С, сплавленный — при 800° С. При 800° С он образует с азотом нитрид титана TiN при более высокой температуре TiN разлагается на металлический титан и азот. С углеродом при нагревании титан образует карбид состава Ti , причем избыточный углерод выделяется в виде графита. Еще при более высокой температуре титан соединяется с кремнием и бором, образуя чрезвычайно твердые вещества — силициды и бориды титана. Такое большое сродство титана ко многим элементам весьма сильно усложняет и затрудняет переработку титановых руд. [c.293]
Такое большое сродство титана ко многим элементам весьма сильно усложняет и затрудняет переработку титановых руд. [c.293]
Химические свойства. При обычной температуре уголь весьма инертен. Его химическая активность проявляется лишь при высоких температурах. В качестве окислителя уголь реагирует с некоторыми металлами и неметаллами. Соединения углерода с металлами называются карбидами. Например [c.209]
Карбиды рубидия и цезия как бинарные соединения рубидия и цезия с углеродом можно разделить по их химическим свойствам и типу кристаллической решетки на две группы ацетилиды с о6> [c.110]
Технический карбид бора, получаемый электротермическим путем, содержит до 94% В4С. Примеси, особенно свободный углерод и графит, снижают абразивные свойства технического карбида бора, поэтому получаемый в печи продукт подвергают химическому обогащению. [c. 172]
172]
Химические свойства сульфидов титана изучены лишь качественно. При высоких температурах (порядка 2000° С) сульфиды титана взаимодействуют с углеродом с образованием карбида титана. При нагревании в среде азота при 2000° С образуется смесь карбида и нитрида титана. В табл. 42 приведены данные о химической устойчивости некоторых сульфидных фаз титана [261, с. 97]. [c.114]
Если ниобий или тантал нагреть до высокой температуры с графитом или с углеродом в другой аллотропной форме, то образуются очень твердые, тугоплавкие, химически инертные карбиды [1, 2]. В последнее время карбиды этих металлов, так же как и карбиды других переходных металлов, привлекают особое внимание технологов, что объясняется возможностью применения их в области высокотемпературной техники и способностью влиять (в качестве примесей) на механические свойства металлов. Карбиды тантала и ниобия были получены непосредственно из элементов, а также из различных соединений ниобия и тантала [3]. Наиболее часто используют реакции восстановления пятиокисей или субокисей только углем [4, 5] или углем в присутствии водорода [6, 7], а также восстановление пентахлоридов графитом (на раскаленной графитовой нити) [14] или водородом в присутствии углеводорода (на раскаленной нити или на нагретой поверхности) последняя реакция применяется для получения тугоплавких покрытий из паровой фазы [8]. [c.135]
Наиболее часто используют реакции восстановления пятиокисей или субокисей только углем [4, 5] или углем в присутствии водорода [6, 7], а также восстановление пентахлоридов графитом (на раскаленной графитовой нити) [14] или водородом в присутствии углеводорода (на раскаленной нити или на нагретой поверхности) последняя реакция применяется для получения тугоплавких покрытий из паровой фазы [8]. [c.135]
Физико-химический анализ обуглероженного слоя дает определенные сведения о свойствах материала, механизме абляции и механизме его разрушения . Элементарный химический анализ обуглившегося слоя показывает преимущественную потерю определенных элементов (см. рис. 2) и возможное осаждение углерода на стенках пор в результате термического разложения газообразных продуктов. Образование новых химических соединений, например карбида кремния, можно обнаружить методом дифракции рентгеновских лу-чей 94 Общая пористость обуглероженного слоя определяет объем пустот, образующихся при высокотемпературном разложении пластмассы, и косвенно отражает ее сопротивление воздействию механических сил. Распределение пор по размерам в обуглероженном слое показывает его склонность к растрескиванию и относительную эффективность теплообмена между раскаленным обуглероженным слоем и газами, образующимися в процессе абляции. Для определения структуры пор и характера взаимодействия между микрокомпонентами материала можно также использовать микрофотографирование в обычном и поляризованном свете . Очевидно, что для характеристики поведения и свойств пластмасс в газовых средах при высоких температурах необходима как качественная, так и количественная информация . Объем и степень достоверности информации, необходимой для оценки эксплуатационных свойств материалов, зависит от методов и условий испытаний. [c.430]
Распределение пор по размерам в обуглероженном слое показывает его склонность к растрескиванию и относительную эффективность теплообмена между раскаленным обуглероженным слоем и газами, образующимися в процессе абляции. Для определения структуры пор и характера взаимодействия между микрокомпонентами материала можно также использовать микрофотографирование в обычном и поляризованном свете . Очевидно, что для характеристики поведения и свойств пластмасс в газовых средах при высоких температурах необходима как качественная, так и количественная информация . Объем и степень достоверности информации, необходимой для оценки эксплуатационных свойств материалов, зависит от методов и условий испытаний. [c.430]
Металлические и металлоподобные соединения. Подобно другим d-элелентам,. железо с малоактивными неметаллами образует соединения типа металлических. Так, с углеродом оно дает карбид состава Fej (потентат), твердые растворы аустенит — раствор С и -Ре феррит. — раствор С в а-Ре), эвтектические смеси (железа с углеродом, цементита с аустенитом, железа с цементитом и др. ). Изучение условий образования и свойств соединений железа с углеродом имеет большое значение для понимания структуры, состава и свойств железоуглеродистых сплавов. В зависимости от условий кристаллизации и состава расплава Ре—С структура и соотношения компонентов существенно меняются, а следовательно, изменяются и физико-химические свойства получаемых сплавов. [c.583]
). Изучение условий образования и свойств соединений железа с углеродом имеет большое значение для понимания структуры, состава и свойств железоуглеродистых сплавов. В зависимости от условий кристаллизации и состава расплава Ре—С структура и соотношения компонентов существенно меняются, а следовательно, изменяются и физико-химические свойства получаемых сплавов. [c.583]
Влияние легирующих элементов на свойства стали обусловлено также тем, что некоторые из них образуют с углеродом карбиды, которые могут быть простыми, например, Мл.зС, СгуСз, а также сложными (двойными), например, (Ре, Сг)зС. Присутствие карбидов, особенно в виде дисперсных включений в структуре стали, в ряде случаев оказывает сильное влияние на ее механические и физико-химические свойства. [c.686]
Углерод в различных некристаллических формах является основным элементом химических, физических и биологических явлений и процессов.
 Поэтому понятен более вековой интерес к углеродсодержащим шунгитовым породам (шунгитам) Карелии, знаменитым высоким содержание аморфного углерода (по оценкам до 25х 10 тонн). Шунгиты обладают набором физикомеханических и физико-химических свойств, позволивших отнести их к перспективному углеродному сырью. Показана возможность их использования в процессах водоподготовки и водоочистки, в качестве катализатора в кислотных и кислотно-основных реакциях, многофункхщонального наполнителя полимерных композиционных материалов, в процессах выплавки кремнистых чугунов и получения карбида кремния. [c.174]
Поэтому понятен более вековой интерес к углеродсодержащим шунгитовым породам (шунгитам) Карелии, знаменитым высоким содержание аморфного углерода (по оценкам до 25х 10 тонн). Шунгиты обладают набором физикомеханических и физико-химических свойств, позволивших отнести их к перспективному углеродному сырью. Показана возможность их использования в процессах водоподготовки и водоочистки, в качестве катализатора в кислотных и кислотно-основных реакциях, многофункхщонального наполнителя полимерных композиционных материалов, в процессах выплавки кремнистых чугунов и получения карбида кремния. [c.174]Химические свойства. При обычной температуре углерод весьма инертен. Его хнмкчсская акп БЬ ссть проявляется лишь прн высоких температурах. В качестве окислителя углерод реагирует с некоторыми металлами и 1 ег1еталлг, и. Соедииеиия углерода с металлами называются карбидам и. Например [c.130]
Свойства. Порошкообразные карбиды имеют темную окраску в компактном виде они частично металлоподобны и имеют серебристую или золотистую окраску. Химически активны по отношению к воде и окислителям. Так называемые монокарбиды имеют кубическую кристаллическую структуру типа Na I, но с более редким расположением атомов углерода [c.1205]
Химически активны по отношению к воде и окислителям. Так называемые монокарбиды имеют кубическую кристаллическую структуру типа Na I, но с более редким расположением атомов углерода [c.1205]
Приведенные материалы по влиянию физико-химических свойств порошков карбонильного железа на их электромагнитные свойства показывают, что проницаемость первичного порошка (КЖ) значительно ниже проницаемости термообработанного порошка (ВКЖ)- Это различие можно объяснить тем, что первичный порошок содержит примеси углерода и азота (в виде карбида и нитрида железа) и обладает луковичной структурой, которая препятствует перемещению границ доменов при воздействии на ферромагнетик магнитного поля. [c.190]
Важными являются химические свойства УМ, в частности взаимодействия с газами, С кислородом графит не взаимодействует до 400°С. Скорость реакции с кислородом и диоксидом углерода (IV) повышается с ростом температуры. Однако при 2600-2700°С имеется явно выраженный минимум реакционной способности по диоксиду углерода, что связано с изменением кристаллической структуры. На реакционную способность графитов существенно влияют примеси некото-рь1х металлов, например железа, меди, ванадия, натрия, которые могут служить катализаторами. ДЛя повышения стойкости графита против окисления применяют покрытия металлами, карбидами, боридами, нитридами и т.д. Ингибиторами окисления графита являются хлор и фосфорсодержащие соединения. Графит взаимодействует с расплавленными металлами, образуя карбиды. Растворимость углерода в металлах связана с дефектностью электронной полосы. [c.217]
На реакционную способность графитов существенно влияют примеси некото-рь1х металлов, например железа, меди, ванадия, натрия, которые могут служить катализаторами. ДЛя повышения стойкости графита против окисления применяют покрытия металлами, карбидами, боридами, нитридами и т.д. Ингибиторами окисления графита являются хлор и фосфорсодержащие соединения. Графит взаимодействует с расплавленными металлами, образуя карбиды. Растворимость углерода в металлах связана с дефектностью электронной полосы. [c.217]
В соединениях проявляет степень окисления +2. По химическим свойствам самого металла и многих его соединений Б. сходен с кальцием и особенно стронцием и радием, однако по химической активности превосходит их быстро окисляется на воздухе, образуя на поверхности пленку, содержащую оксид, пероксид и нитрид Б. При нагревании на воздухе легко воспламеняется и сгорает красноватым пламенем энергичнее кальция разлагает воду с выделением водорода и образованием гидроксида Ва(0Н)2. С кислородом образует оксид ВаО, с водородом— гидрид ВаНг, с азотом — нитрид ВазЫг при 260—600 °С, с углеродом — карбид ВаСг. С углеродом и азотом Б. образует цианид Ba( N)2, с галогенами — галогениды. При взаимодействии Б. с безводным хлоридом Б. Ba l2 при 1050 °С образуется хлорид ВаС1. См. также приложение. [c.133]
С кислородом образует оксид ВаО, с водородом— гидрид ВаНг, с азотом — нитрид ВазЫг при 260—600 °С, с углеродом — карбид ВаСг. С углеродом и азотом Б. образует цианид Ba( N)2, с галогенами — галогениды. При взаимодействии Б. с безводным хлоридом Б. Ba l2 при 1050 °С образуется хлорид ВаС1. См. также приложение. [c.133]
В соединениях проявляет степень окисления +4. В особых условиях образуются соединения Г.(II) и (III). По химическим свойствам Г. похож на цирконий. Г. легко поглощает газы. На воздухе покрывается пленкой оксида НЮг, который также образуется при нагревании Г. с кислородом. При нагревании с галогенами образует галогениды типа Н1На14. При высоких температурах реагирует с азотом и углеродом с образованием нитрида Н1Ы и карбида НГС. См. также приложение. [c.452]
Ацетилиды и метаниды как по внешнему виду, так и по характеру химической связи напоминают соли и могут быть названы солеподобными карбидами. Исследование строения и свойств этих карбидов позволяет допустить наличие у них полярности. В частности, в молекулах метанидов и ацетилидов предполагается наличие отрицательных ионов углерода С ,. Металлы в них несут положительные заряды. [c.141]
В частности, в молекулах метанидов и ацетилидов предполагается наличие отрицательных ионов углерода С ,. Металлы в них несут положительные заряды. [c.141]
С металлами, а также с некоторыми неметаллами углерод образует соединения, которые представляют собой кристаллические вещества, называемые карбидами. По химическим свойствам карбиды подразделяют на две группы 1) разлагаемые водой или разбавленными кислотами и 2) не разлагаемые ни водой, ни разбавленными кислотами. Важнейшим представителем первой группы является карбид кальция a j 141), который получается накаливанием смеси угля и жженной извести [c.248]
Загрязняющие вещества 4 класса опасности — Челябинский гидрометеоцентр
Главная> Мониторинг среды> Загрязняющие вещества> Загрязняющие вещества 4 класса опасностиОксид углерода (угарный газ).
Оксид углерода – бесцветный газ, не имеющий запаха, немного легче воздуха, плохо растворим в воде, имеет температуру кипения: – 191,5°С. На воздухе загорается при температуре 700°С и сгорает синим пламенем до СО2.
На воздухе загорается при температуре 700°С и сгорает синим пламенем до СО2.
Источники поступления в окружающую среду.
Монооксид углерода входит в состав атмосферы (10%). В атмосферу оксид углерода попадает в составе вулканических и болотных газов, в результате лесных и степных пожаров, выделения микроорганизмами, растениями, животными и человеком. Из поверхностных слоев океанов в год выделяется 220х106 тонн оксида углерода в результате фоторазложения красных, сине-зеленых и др. водорослей, продуктов жизнедеятельности планктона. Естественный уровень содержания оксида углерода в атмосферном воздухе – 0,01-0,9 мг/м3.
Угарный газ попадает в атмосферу от промышленных предприятий, в первую очередь металлургии. В металлургических процессах при выплавке 1 млн. тонн стали образуется 320-400 тонн оксида углерода. Большое количество СО образуется в нефтяной промышленности и на химических предприятиях (крекинг нефти, производство формалина, углеводородов, аммиака и др. ). Еще одним немаловажным источником оксида углерода является табачный дым. Высока концентрация оксида углерода в угольных шахтах, на углеподающих трассах. Оксид углерода образуется при неполном сгорании топлива в печах и двигателях внутреннего сгорания. Важным источником оксида углерода является автомобильный транспорт.
). Еще одним немаловажным источником оксида углерода является табачный дым. Высока концентрация оксида углерода в угольных шахтах, на углеподающих трассах. Оксид углерода образуется при неполном сгорании топлива в печах и двигателях внутреннего сгорания. Важным источником оксида углерода является автомобильный транспорт.
В результате деятельности человека в атмосферу ежегодно поступает 350-600х106 тонн угарного газа. Около 56-62% этого количества приходится на долю автотранспорта (содержание оксида углерода в выхлопных газах может достигать величины 12%).
Поведение в окружающей среде.
При обычных условиях монооксид углерода инертен. Он химически не взаимодействует с водой. Растворимость СО в воде около 1:40 по объему. В растворе способен восстанавливать соли золота и платины до свободных металлов уже при обычной температуре. Не реагирует СО также с щелочами и кислотами. Взаимодействует с едкими щелочами только при повышенных температурах и высоких давлениях.
Убыль оксида углерода в окружающей среде происходит за счет его разложения почвенными грибами. Кроме того, при избытке кислорода в почвах тяжелого механического состава, богатых органическими веществами, имеет место переход СО в СО2.
Воздействие на организм человека.
Оксид углерода чрезвычайно ядовит. Допустимое содержание СО в производственных помещениях составляет 20 мг/м3 в течение рабочего дня, 50 мг/м3 в течение 1 часа, 100 мг/м3 в течение 30 минут, в атмосферном воздухе города максимальная разовая (за 20 мин) – 5 мг/м3, среднесуточная ПДК – 3 мг/м3. Естественный уровень содержания оксида углерода в атмосферном воздухе – 0,01-0,9 мг/м3.
СО вдыхается вместе с воздухом и поступает в кровь, где конкурирует с кислородом за молекулы гемоглобина. Оксид углерода, имея двойную химическую связь, соединяется с гемоглобином более прочно, чем молекула кислорода. Чем больше СО содержится в воздухе, тем больше молекул гемоглобина связывается с ним и тем меньше кислорода достигает клеток организма. Нарушается способность крови доставлять кислород к тканям, вызываются спазмы сосудов, снижается иммунологическая активность человека, сопровождающиеся головной болью, потерей сознания и смертью. По этим причинам СО в повышенных концентрациях представляет собой смертельный яд.
Чем больше СО содержится в воздухе, тем больше молекул гемоглобина связывается с ним и тем меньше кислорода достигает клеток организма. Нарушается способность крови доставлять кислород к тканям, вызываются спазмы сосудов, снижается иммунологическая активность человека, сопровождающиеся головной болью, потерей сознания и смертью. По этим причинам СО в повышенных концентрациях представляет собой смертельный яд.
СО нарушает фосфорный обмен. Нарушение азотистого обмена вызывает зотемию, изменение содержания белков плазмы, снижение активности холинэстеразы крови и уровня витамина В6. Угарный газ влияет на углеводный обмен, усиливает распад гликогена в печени, нарушая утилизацию глюкозы, повышая уровень сахара в крови. Поступление СО из легких в кровь обусловлено концентрацией СО во вдыхаемом воздухе и длительностью ингаляции. Выделение СО происходит главным образом через дыхательные пути.
Больше всего при отравлении страдает ЦНС. При вдыхании небольшой концентрации (до 1 мг/л) – тяжесть и ощущение сдавливания головы, сильная боль во лбу и висках, головокружение, дрожь, жажда, учащение пульса, тошнота, рвота, повышение температуры тела до 38-40°С.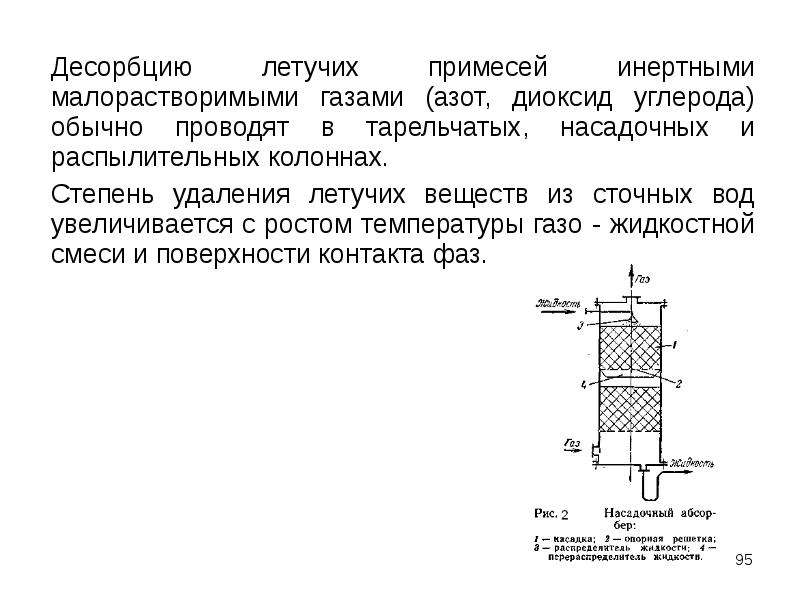 Слабость в ногах свидетельствует о распространении действия на спинной мозг.
Слабость в ногах свидетельствует о распространении действия на спинной мозг.
Чрезвычайная ядовитость СО, отсутствие у него цвета и запаха, а также очень слабое поглощение его активированным углем обычного противогаза делают этот газ особенно опасным.
Класс опасности вещества — 4.
Аммиак.
Аммиак – бесцветный газ с резким запахом, температура плавления – 80°С, температура кипения – 36°С, хорошо растворяется в воде, спирте и ряде других органических растворителей. Синтезируют из азота и водорода. В природе образуется при разложении азотсодержащих органических соединений.
Нахождение в природе.
В природе образуется при разложении азотсодержащих органических соединений.
Резкий запах аммиака известен человеку с доисторических времен, так как этот газ образуется в значительных количествах при гниении, разложении и сухой перегонке содержащих азот органических соединений, например мочевины или белков. Не исключено, что на ранних стадиях эволюции Земли в ее атмосфере было довольно много аммиака. Однако и сейчас ничтожные количества этого газа всегда можно обнаружить в воздухе и в дождевой воде, поскольку он непрерывно образуется при разложении животных и растительных белков.
Не исключено, что на ранних стадиях эволюции Земли в ее атмосфере было довольно много аммиака. Однако и сейчас ничтожные количества этого газа всегда можно обнаружить в воздухе и в дождевой воде, поскольку он непрерывно образуется при разложении животных и растительных белков.
Антропогенные источники поступления в окружающую среду.
Основными источниками выделения аммиака являются азотнотуковые комбинаты, предприятия по производству азотной кислоты и солей аммония, холодильные установки, коксохимические заводы и животноводческие фермы. В районах техногенного загрязнения концентрации аммиака достигают величин 0,015-0,057 мг/м3, в контрольных районах – 0,003-0,005 мг/м3.
Влияние на организм человека.
Этот газ токсичен. Человек способен почувствовать запах аммиака в воздухе уже в ничтожной концентрации – 0,0005 мг/л, когда еще нет большой опасности для здоровья. При повышении концентрации в 100 раз (до 0,05 мг/л) проявляется раздражающее действие аммиака на слизистую оболочку глаз и верхних дыхательных путей, возможна даже рефлекторная остановка дыхания. Концентрацию 0,25 мг/л с трудом выдерживает в течение часа даже очень здоровый человек. Еще более высокие концентрации вызывают химические ожоги глаз и дыхательных путей и становятся опасными для жизни. Внешние признаки отравления аммиаком могут быть весьма необычными. У пострадавших, например, резко снижается слуховой порог: даже не слишком громкие звуки становятся невыносимы и могут вызвать судороги. Отравление аммиаком вызывает также сильное возбуждение, вплоть до буйного бреда, а последствия могут быть весьма тяжелыми – до снижения интеллекта и изменения личности. Очевидно, аммиак способен поражать жизненно важные центры, так что при работе с ним надо тщательно соблюдать меры предосторожности.
При повышении концентрации в 100 раз (до 0,05 мг/л) проявляется раздражающее действие аммиака на слизистую оболочку глаз и верхних дыхательных путей, возможна даже рефлекторная остановка дыхания. Концентрацию 0,25 мг/л с трудом выдерживает в течение часа даже очень здоровый человек. Еще более высокие концентрации вызывают химические ожоги глаз и дыхательных путей и становятся опасными для жизни. Внешние признаки отравления аммиаком могут быть весьма необычными. У пострадавших, например, резко снижается слуховой порог: даже не слишком громкие звуки становятся невыносимы и могут вызвать судороги. Отравление аммиаком вызывает также сильное возбуждение, вплоть до буйного бреда, а последствия могут быть весьма тяжелыми – до снижения интеллекта и изменения личности. Очевидно, аммиак способен поражать жизненно важные центры, так что при работе с ним надо тщательно соблюдать меры предосторожности.
Хроническое воздействие сублетальных доз аммиака приводит к вегетативным расстройствам, повышению возбудимости парасимпатического отдела нервной системы, жалобы на слабость, недомогание, насморк, кашель, боли в груди.
Класс опасности вещества – 4.
«назад»
Химия углерода
Неорганическая химия из углерода
Неорганические Углерод
Уже более 200 лет химики делят соединения на две категории. Те, которые были выделены из растений или животных были названы органическими , а извлеченные из руд и минералы были неорганические . Органическая химия часто определяется как химия углерода.Но это определение будет включают карбонат кальция (CaCO 3 ) и графит, которые больше напоминают неорганические соединения. Поэтому мы будем определяют органическую химию как изучение соединений, таких как муравьиная кислота (HCO 2 H), метан (CH 4 ) и витамин С (C 6 H 8 O 6 ), содержащие как углерод, так и водород.
В химии углерода преобладают три фактора.
1.Углерод образует необычно сильные одинарные связи С-С, двойные связи С=С. связи и тройные углерод-углеродные связи.
2. Электроотрицательность углерода ( EN = 2,55) слишком небольшой, чтобы позволить углероду образовывать ионы C 4- с большинством металлов и слишком большой для того, чтобы углерод мог образовывать ионы C 4+ при реагирует с неметаллами. Таким образом, углерод образует ковалентные связи. со многими другими элементами.
3. Углерод образует прочные двойные и тройные связи с рядом других неметаллов, включая N, O, P и S.
Элементарные формы углерода: графит, алмаз, кокс и сажа
Углерод встречается в виде различных аллотропов. Есть два кристаллические формы алмаза и графита и ряд аморфных (некристаллические) формы, такие как древесный уголь, кокс и сажа.
Ссылки на характеристическую твердость алмаза (из
Греческое adamas , «непобедимый») датируется как минимум
2600 лет. Однако только в 1797 году Смитсон Теннант
смог показать, что алмазы состоят исключительно из углерода. То
свойства алмаза замечательны. Он входит в число наименее
известные летучие вещества ( MP = 3550 o C, BP
= 4827 o C), это также самое твердое известное вещество, и
он меньше расширяется при нагревании, чем любой другой материал.
Однако только в 1797 году Смитсон Теннант
смог показать, что алмазы состоят исключительно из углерода. То
свойства алмаза замечательны. Он входит в число наименее
известные летучие вещества ( MP = 3550 o C, BP
= 4827 o C), это также самое твердое известное вещество, и
он меньше расширяется при нагревании, чем любой другой материал.
Свойства алмаза являются логическим следствием его
структура. Углерод с четырьмя валентными электронами образует ковалентные
связи с четырьмя соседними атомами углерода, расположенными
углы тетраэдра, как показано на рисунке ниже.Каждый из
эти sp 3 -гибридизированные атомы затем связываются с
четыре других атома углерода, которые образуют связи с четырьмя другими атомами углерода
атомы и так далее. В результате можно представить идеальный бриллиант.
в виде единой гигантской молекулы. Сила индивидуального C-C
связи и их расположение в пространстве порождают необычное
свойства алмаза.
В некотором смысле свойства графита подобны свойствам алмаз. Оба соединения кипят, например, при 4827 o °С.Но графит также сильно отличается от алмаза. Алмаз (3,514 г/см 3 ) намного плотнее графита (2,26 г/см 3 ). В то время как алмаз является самым твердым из известных веществ, графит является одним из из самых мягких. Алмаз является отличным изолятором, с небольшим или отсутствие тенденции проводить электрический ток. Графит такой хороший проводник электричества, в котором используются графитовые электроды. электрические ячейки.
Физические свойства графита можно понять из Структура твердого тела показана на рисунке ниже.
Графит состоит из удлиненных плоскостей из sp 2 -гибридизированных
атомы углерода, в которых каждый углерод прочно связан с тремя другими
атомы углерода. (Сильные связи между атомами углерода внутри
каждый самолет объясняют исключительно высокой температурой плавления и
температура кипения графита. ) Расстояние между этими плоскостями
атомов, однако, намного больше, чем расстояние между
атомов внутри плоскостей.Потому что связи между плоскостями
слабы, легко деформировать твердое тело, позволяя одной плоскости
атомы двигаться относительно друг друга. В результате графит становится мягким.
достаточно для использования в карандашах и в качестве смазки в моторном масле.
) Расстояние между этими плоскостями
атомов, однако, намного больше, чем расстояние между
атомов внутри плоскостей.Потому что связи между плоскостями
слабы, легко деформировать твердое тело, позволяя одной плоскости
атомы двигаться относительно друг друга. В результате графит становится мягким.
достаточно для использования в карандашах и в качестве смазки в моторном масле.
«Свинцовые» карандаши, кстати, не содержат свинца. (Это к счастью, потому что многие люди жуют карандаши и свинец). соединения токсичны.) Графитные карандаши содержат графит или «черный свинец», как его когда-то называли, смешанный с глины (от 20% до 60% по весу), а затем обжигают, чтобы сформировать керамический стержень.Увеличение процентного содержания глины делает карандаш тверже, поэтому что меньше графита осаждается на бумаге.
Характерные свойства графита и алмаза могут
заставляют вас ожидать, что алмаз будет более стабильным, чем
графит. Это не то, что наблюдается экспериментально. То
стандартная энтальпия образования алмаза ( H o f
= 2,425 кДж/моль) немного больше энтальпии образования
графита, который является наиболее стабильной формой углерода при 25 o C
и давление 1 атм.При очень высоких температурах и давлениях
алмаз становится более стабильным, чем графит. В 1955 году генерал
Компания Electric разработала процесс изготовления алмазов промышленного качества с помощью
обработка графита металлическим катализатором при температуре 2000
до 3000 К и давлений свыше 125 000 атм. Примерно 40%
алмазы промышленного качества теперь синтетические. Несмотря на то что
можно синтезировать алмазы ювелирного качества, связанные с этим затраты составляют
запретительный.
То
стандартная энтальпия образования алмаза ( H o f
= 2,425 кДж/моль) немного больше энтальпии образования
графита, который является наиболее стабильной формой углерода при 25 o C
и давление 1 атм.При очень высоких температурах и давлениях
алмаз становится более стабильным, чем графит. В 1955 году генерал
Компания Electric разработала процесс изготовления алмазов промышленного качества с помощью
обработка графита металлическим катализатором при температуре 2000
до 3000 К и давлений свыше 125 000 атм. Примерно 40%
алмазы промышленного качества теперь синтетические. Несмотря на то что
можно синтезировать алмазы ювелирного качества, связанные с этим затраты составляют
запретительный.
И алмаз, и графит встречаются в виде правильно упакованных кристаллов.Другие формы углерода аморфны у них отсутствует
регулярная структура. Древесный уголь, сажа и кокс — все это
аморфные формы углерода. Уголь древесный получается в результате нагревания
древесины в отсутствие кислорода. Чтобы сделать сажу ,
природный газ или другие соединения углерода сжигаются в ограниченном количестве.
количество воздуха, чтобы получить густой черный дым, содержащий
чрезвычайно мелкие частицы углерода, которые могут быть собраны при
газ охлаждается и проходит через электростатический
осадитель. Кока-кола представляет собой более регулярно структурированный
материал, более близкий по структуре к графиту, чем древесный уголь или
сажа, которая производится из угля.
Чтобы сделать сажу ,
природный газ или другие соединения углерода сжигаются в ограниченном количестве.
количество воздуха, чтобы получить густой черный дым, содержащий
чрезвычайно мелкие частицы углерода, которые могут быть собраны при
газ охлаждается и проходит через электростатический
осадитель. Кока-кола представляет собой более регулярно структурированный
материал, более близкий по структуре к графиту, чем древесный уголь или
сажа, которая производится из угля.
Карбиды: Ковалентная, ионная и интерстициальная
Хотя углерод практически инертен при комнатной температуре, он
реагирует с менее электроотрицательными отрицательными элементами при высоких
температурах для образования соединений, известных как карбиды .Когда углерод реагирует с элементом аналогичного размера и
электроотрицательность, образуется ковалентный карбид . Карбид кремния, например, получают путем обработки диоксида кремния.
из кварца с избытком углерода в электропечи при
2300 К.
Карбид кремния, например, получают путем обработки диоксида кремния.
из кварца с избытком углерода в электропечи при
2300 К.
| SiO 2 ( с ) | + | 3 С( с ) | SiC( с ) | + | 2 CO( г ) |
Ковалентные карбиды обладают свойствами, подобными свойствам алмаза.И SiC, и алмаз инертны к химическим реакциям, за исключением очень высокие температуры; оба имеют очень высокие температуры плавления; и оба являются одними из самых твердых известных веществ. SiC был первым синтезирован Эдвардом Ачесоном в 1891 году. Вскоре после этого Ачесон основал компанию Carborundum для продажи этого материала. Тогда, как и сейчас, материалы этого класса чаще всего использовались в качестве абразивы.
Соединения, содержащие углерод и один из наиболее активных
металлы называются ионными карбидами .
| CaO( с ) | + | 3 С( с ) | ЦС 2 ( с ) | + | СО( г ) |
Полезно думать об этих соединениях так, как если бы они содержал отрицательно заряженные ионы углерода: [Ca 2+ ][C 2 2- ] или [Al 3+ ] 4 [C 4-] 3 .Эта модель полезна, потому что она объясняет, почему эти карбиды взрываются. в пламя при добавлении в воду. Ионные карбиды, формально содержат ион C 4-, реагируют с водой с образованием метана, который воспламеняется теплом, выделяющимся в этой реакции.
| С 4- | + | 4 Н 2 О | Ч 4 | + | 4 ОХ — |
Ионные карбиды, формально содержащие C 2 2-
ион реагирует с водой с образованием ацетилена, который воспламеняется
тепло реакции.
| С 2 2- | + | 2 Н 2 О | C 2 H 2 | + | 2 ОХ — |
Когда-то шахтерские лампы питались горением ацетилен, полученный реакцией карбида кальция с вода.
Карбиды внедрения , такие как карбид вольфрама (WC), образуются, когда углерод соединяется с металлом, который имеет промежуточное электроотрицательность и относительно большой атомный радиус. В этих соединения, атомы углерода упаковываются в отверстия (междоузлия) между плоскостями атомов металла. Внедренные карбиды, которые включают TiC, ZrC и MoC, сохраняют свойства металлов. Они действуют как сплавы, а не как соли или ковалентные соединения.
Оксиды Углерод
Хотя различные формы углерода в основном инертны
при комнатной температуре они соединяются с кислородом при высоких
температуры для получения смеси монооксида углерода и углерода
диоксид.
| 2 С( с ) | + | O 2 ( г ) | 2 CO( г ) | H или = -110,52 кДж/моль CO | ||||
| К( с ) | + | O 2 ( г ) | CO 2 ( г ) | H или = -393.51 кДж/моль CO 2 |
CO также может быть получен при обработке раскаленного угля Стим.
| К( с ) | + | H 2 O( г ) | СО( г ) | + | H 2 ( г ) |
Поскольку эта смесь газов образуется в результате реакции
древесный уголь или кокс с водой часто называют вода
газ . Он также известен как городской газ , потому что он был
когда-то производился городами и городами для использования в качестве топлива. Водяной газ или
городской газ был обычным топливом как для домашнего, так и для промышленного использования.
до того, как природный газ стал доступным. H 2
сгорает с образованием воды, а CO окисляется до CO 2 .
В конце концов, когда наши запасы природного газа истощатся,
становится экономически выгодным заменить природный газ другими видами топлива, такими как
как водяной газ, который может быть получен из наших обильных запасов
уголь.
Он также известен как городской газ , потому что он был
когда-то производился городами и городами для использования в качестве топлива. Водяной газ или
городской газ был обычным топливом как для домашнего, так и для промышленного использования.
до того, как природный газ стал доступным. H 2
сгорает с образованием воды, а CO окисляется до CO 2 .
В конце концов, когда наши запасы природного газа истощатся,
становится экономически выгодным заменить природный газ другими видами топлива, такими как
как водяной газ, который может быть получен из наших обильных запасов
уголь.
CO и CO 2 являются бесцветными газами. CO кипит при
-191,5 o C, а CO 2 возгоняется при -78,5 o C.
Хотя CO не имеет ни запаха, ни вкуса, CO 2 имеет слабый,
резкий запах и отчетливо кислый вкус. Оба опасны
веществ, но при очень разных уровнях воздействия. Воздуха
загрязнены всего 0,002 грамма CO на литр.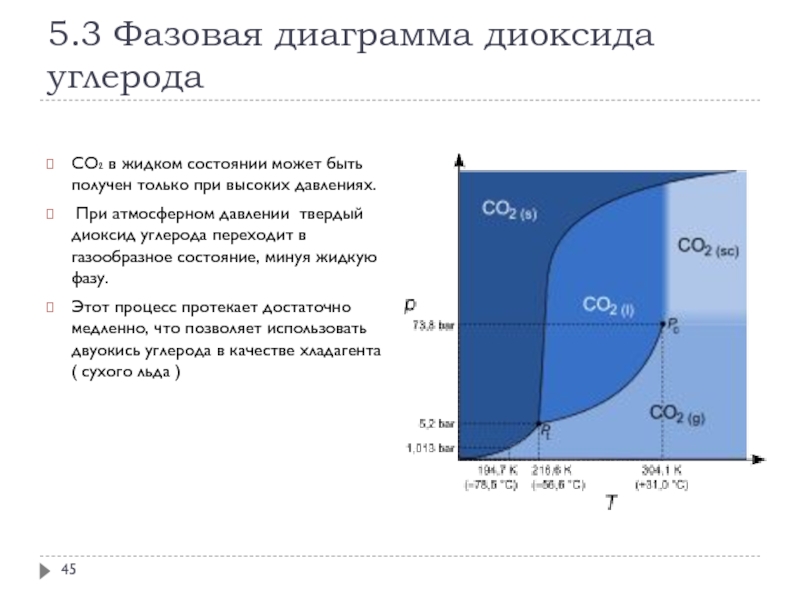 фатально, потому что CO прочно связывается с гемоглобином и миоглобином
которые переносят кислород через кровь.CO 2 не смертелен
пока концентрация в воздухе не приблизится к 15%. В таком случае,
он заменил столько кислорода, что человек, пытающийся
дышать этой атмосферой задыхается. Опасность CO 2
отравление усугубляется тем фактом, что CO 2 примерно
в 1,5 раза плотнее воздуха в нашей атмосфере. Таким образом, СО 2
может скапливаться на дне резервуаров или колодцев.
фатально, потому что CO прочно связывается с гемоглобином и миоглобином
которые переносят кислород через кровь.CO 2 не смертелен
пока концентрация в воздухе не приблизится к 15%. В таком случае,
он заменил столько кислорода, что человек, пытающийся
дышать этой атмосферой задыхается. Опасность CO 2
отравление усугубляется тем фактом, что CO 2 примерно
в 1,5 раза плотнее воздуха в нашей атмосфере. Таким образом, СО 2
может скапливаться на дне резервуаров или колодцев.
CO 2 В атмосфере
CO 2 влияет на температуру атмосферы
за счет парникового эффекта, который работает следующим образом.СО 2
поглощает часть более низкой энергии, длинноволнового инфракрасного
излучение солнца, которое в противном случае отражалось бы обратно
с поверхности планеты. Так, СО 2 в
атмосфера задерживает тепло. Хотя действуют и другие факторы,
стоит отметить, что Венера, атмосфера которой содержит большое
сделка CO 2 , имеет температуру поверхности примерно 400 o C,
в то время как Марс с небольшой атмосферой или без нее имеет поверхность
температура -50 o С.
Так, СО 2 в
атмосфера задерживает тепло. Хотя действуют и другие факторы,
стоит отметить, что Венера, атмосфера которой содержит большое
сделка CO 2 , имеет температуру поверхности примерно 400 o C,
в то время как Марс с небольшой атмосферой или без нее имеет поверхность
температура -50 o С.
В атмосфере много источников CO 2 . В масштабах геологического времени крупнейшим источником были вулканы. В течение прошлого столетия сжигание нефти, угля и природный газ внес значительный вклад в атмосферный уровни CO 2 (см. рисунок ниже). Между 1958 и 1978 г., средний уровень СО 2 в атмосфере увеличилось на 6%, с 315,8 до 334,6 промилле.
Одно время количество CO 2 , выпущенное в
атмосфера не вызывала беспокойства, поскольку естественные процессы
которые удалили CO 2 из атмосферы, могли компенсировать
для CO 2 , попавшего в атмосферу. Обширный, огромный
большая часть CO 2 высвобождается в результате вулканической деятельности, для
например, был захвачен оксидом кальция или оксидом магния с образованием
карбонат кальция или карбонат магния.
Обширный, огромный
большая часть CO 2 высвобождается в результате вулканической деятельности, для
например, был захвачен оксидом кальция или оксидом магния с образованием
карбонат кальция или карбонат магния.
| CaO( с ) | + | CO 2 ( г ) | CaCO 3 ( с ) | |
| MgO( с ) | + | CO 2 ( г ) | MgCO 3 ( с ) |
CaCO 3 встречается в виде известняка, мрамора или смешанных с MgCO 3 в виде доломита.Количество СО 2 в месторождениях карбонатных полезных ископаемых составляет не менее нескольких тысяч раз больше, чем в атмосфере.
CO 2 также частично растворяется в воде.
| Н 2 О | |||
| CO 2 ( г ) | СО 2 ( водный ) |
Затем он реагирует с водой с образованием угольной кислоты, H 2 CO 3 .
| CO 2 ( водный номер ) | + | Н 2 О( л ) | H 2 CO 3 ( водный ) |
В результате этих реакций в море содержится около 60 раз больше CO 2 , чем в атмосфере.
Может ли море поглотить больше CO 2 из атмосферы, или это близко к его уровню насыщения? Скорость, с которой море поглощает CO 2 больше, чем скорость, с которой мы добавить его в атмосферу? Наблюдаемый рост концентрация CO 2 в последние годы предполагает пессимистические ответы на эти два вопроса.Постепенное потепление земная атмосфера может возникнуть в результате продолжающегося увеличения CO 2 уровней с неблагоприятным воздействием на климат и поэтому земледелие по крайней мере северного полушария.
Химия карбонатов: CO 3 2- и ОХС 3 —
Яичная скорлупа состоит из почти чистого карбоната кальция. CaCO 3
также можно найти в раковинах многих морских организмов и в
как известняк, так и мрамор. Дело в том, что ни одно из этих веществ
растворяется в воде предполагает, что CaCO 3 обычно
нерастворим в воде. Карбонат кальция растворяется в воде
насыщен CO 2 , однако, поскольку газированная вода
(или угольная кислота) реагирует с карбонатом кальция с образованием кальция
бикарбонат, растворимый в воде.
CaCO 3
также можно найти в раковинах многих морских организмов и в
как известняк, так и мрамор. Дело в том, что ни одно из этих веществ
растворяется в воде предполагает, что CaCO 3 обычно
нерастворим в воде. Карбонат кальция растворяется в воде
насыщен CO 2 , однако, поскольку газированная вода
(или угольная кислота) реагирует с карбонатом кальция с образованием кальция
бикарбонат, растворимый в воде.
| CaCO 3 ( с ) | + | H 2 CO 3 ( водный ) | Ca 2+ ( водный ) | + | 2 HCO 3 — ( водный ) |
Когда вода, богатая углекислым газом, течет через известняк
образования, часть известняка растворяется.Если CO 2
вытекает из этой воды, или если часть воды испаряется,
твердый CaCO 3 переотложен. Когда это происходит, как вода
проходит по крыше пещеры, сталактитов , которые
свисают с крыши пещеры, образуются. Если вода падает
до повторного осаждения карбоната сталагмитов , которые
вырастают из пола пещеры, формируются.
Когда это происходит, как вода
проходит по крыше пещеры, сталактитов , которые
свисают с крыши пещеры, образуются. Если вода падает
до повторного осаждения карбоната сталагмитов , которые
вырастают из пола пещеры, формируются.
Химия углекислого газа, растворенного в воде, является основа индустрии безалкогольных напитков.Первый искусственно Газированные напитки появились в Европе в конце девятнадцатый век. Газированные безалкогольные напитки сегодня состоят из газированная вода, подсластитель (например, сахар, сахарин, или аспартам), кислота для придания кислого или терпкого вкуса, ароматизатор агенты, красители и консерванты. Целых 3,5 литра газообразного CO 2 растворить в литре безалкогольного напитка. То CO 2 способствует характерному прикусу, связанному с с газированными напитками.
Химия карбонатов играет важную роль в других частях
также пищевая промышленность. Пищевая сода или бикарбонат
соды, бикарбонат натрия, NaHCO 3 , слабое основание,
который добавляют в рецепты, чтобы нейтрализовать кислотность других
ингредиенты. Разрыхлитель представляет собой смесь пищевой соды.
и слабая кислота, такая как винная кислота или водород кальция
фосфат (CaHPO 4 ). При смешивании с водой кислота
реагирует с ионом HCO 3 — с образованием CO 2
газ, который заставляет тесто подниматься.
Разрыхлитель представляет собой смесь пищевой соды.
и слабая кислота, такая как винная кислота или водород кальция
фосфат (CaHPO 4 ). При смешивании с водой кислота
реагирует с ионом HCO 3 — с образованием CO 2
газ, который заставляет тесто подниматься.
| ОХС 3 — ( aq ) | + | Х + ( водный ) | H 2 CO 3 ( водный ) | Н 2 О( л ) | + | CO 2 ( г ) |
До появления коммерческих разрыхлителей повара
Тот же эффект был получен, если смешать примерно чайную ложку пекарского
соды с чашкой кислого молока или пахты.Кислоты, которые дают
кислое молоко и пахта также реагируют на их характерный вкус
с ионом бикарбоната с получением CO 2 .
Фуллерены
В 1985 году Ричард Смолли и его коллеги из Университета Райса сделали уникально стабильная форма углерода путем испарения графита с лазер. Аппарат, на котором проводился этот эксперимент, был предназначен для создания небольших молекул, которые были кластерами атомов.В этом кластерном генераторе импульс газообразного гелия проходил через поверхность графита при возбуждении лазером. То смесь атомов гелия и углерода, испарившаяся из поверхность графита охлаждалась по мере расширения газа, а молекулы с формулы C 60 , которые имеют структуру, которая имеет симметрию футбольного мяча. Поскольку эта структура напоминает геодезический купол, изобретенный Р. Бакминстером Фуллером, C 60 был назван бакминстерфуллерен , или «бакибол». коротко.
Хотя формально это была новая форма чистого углерода, C 60
до 1990 года казался не более чем лабораторной диковинкой,
когда Вольфганг Крачмер и Константинос Костиропулос на
Институт Макса Планка в Гейдельберге сообщил, что этот материал
можно получить, нагревая графитовый стержень в атмосфере
гелием до тех пор, пока графит не испарится. Когда-то было известно, что C 60
могут быть синтезированы в больших количествах, искали исследователи,
и нашел его в таких общих источниках, как пламя закопченного
свеча.Он был обнаружен даже в черной саже, которая собирается на
стеклянный экран перед камином.
Когда-то было известно, что C 60
могут быть синтезированы в больших количествах, искали исследователи,
и нашел его в таких общих источниках, как пламя закопченного
свеча.Он был обнаружен даже в черной саже, которая собирается на
стеклянный экран перед камином.
Некоторые химики испытали волнение, когда C 60 был синтезирован, можно понять, противопоставив эту форму чистый углерод с алмазом и графитом. C 60 уникален потому что он существует в виде отдельных молекул, а не расширенных массивов атомы. Что не менее важно, C 60 можно получить как чистое вещество, тогда как поверхности алмаза и графита неизбежно загрязнены атомами водорода, которые связываются с углеродом атомы на поверхности.
C 60 теперь известно как член семьи
соединения, известные как фуллерены . Другие соединения в
это семейство включает C 32 , C 44 , C 50 ,
C 58 и C 70 . С 60
С 60
может быть самым важным из фуллеренов, потому что это самая идеально симметричная молекула из возможных, вращающаяся в твердом теле со скоростью более 100 миллионов раз в секунду.Потому что своей симметрии молекулы C 60 упаковываются так же регулярно, как Шарики для пинг-понга. Полученное твердое вещество обладает необычными свойствами. Изначально он мягкий как графит, но при сжатии на 30%, становится тверже алмаза. Когда это давление сбрасывается, твердое тело возвращается к своему первоначальному объему. С 60 поэтому обладает замечательным свойством отскакивать назад, когда выстрелил в металлическую поверхность на больших скоростях.
C 60 также обладает замечательной способностью образовывать
соединения, в которых он является изолятором, проводником,
полупроводник или сверхпроводник.Сам по себе C 60 является
полупроводник. При смешивании с достаточным количеством калия, чтобы дать
соединение с эмпирической формулой K 3 C 60 ,
он проводит электричество, как металл. При избытке калия
добавлено, это твердое тело становится изолятором. Когда К 3 С 60
охлаждается до 18 К, в результате получается сверхпроводник. потенциал
химии фуллеренов как для практических материалов, так и
лабораторных курьезов достаточно велико, чтобы объяснить, почему это
молекула может быть описана как «экзохармическая», она выделяет
очарование.
При избытке калия
добавлено, это твердое тело становится изолятором. Когда К 3 С 60
охлаждается до 18 К, в результате получается сверхпроводник. потенциал
химии фуллеренов как для практических материалов, так и
лабораторных курьезов достаточно велико, чтобы объяснить, почему это
молекула может быть описана как «экзохармическая», она выделяет
очарование.
Углерод — информация об элементе, свойства и использование
Стенограмма:
Химия в ее стихии: углерод
(Промо)
Вы слушаете Химию в ее стихии, представленную вам Chemistry World , журналом Королевского химического общества.
(Конец промо)
Крис Смит
Привет, на этой неделе элемент, который объединяет свадьбы, войны, конфликты и кремации и объяснить, как, это Кэтрин Холт.
Кэтрин Холт
Любой химик может целыми днями говорить об углероде. В конце концов, это повседневный, заурядный, встречающийся почти во всем, вездесущий элемент для нас, углеродных форм жизни. Его реакциям посвящена целая отрасль химии.
В своей элементарной форме он преподносит некоторые сюрпризы в виде контрастных и увлекательных форм своих аллотропов. Кажется, что каждые несколько лет в моду входит новая форма углерода — несколько лет назад углеродные нанотрубки были новым черным цветом (или, лучше сказать, «новым бакиболом») — но графен — это так!
Но сегодня я собираюсь поговорить о самой гламурной форме, которую может принимать углерод — алмазе. На протяжении тысячелетий алмаз ассоциировался с богатством и богатством, так как из него можно получить драгоценные камни высокой чистоты, блеска и долговечности.Бриллианты действительно вечны! К сожалению, у алмаза есть и темная сторона – жадность, которую он вызывает, приводит к торговле так называемыми «конфликтными алмазами», которые поддерживают и финансируют гражданские войны.
Стремление человека к алмазу привело алхимиков и химиков на протяжении многих веков к попыткам синтезировать этот материал. После множества мошеннических заявлений о начале алмаз был наконец искусственно синтезирован в 1950-х годах. Ученые черпали вдохновение в природе, отмечая условия, при которых алмаз образуется естественным путем, глубоко под земной корой.Поэтому они использовали высокие температуры (свыше 3000 o C) и высокое давление (>130 атм) для превращения графита в углерод. Это был впечатляющий подвиг, но требуемые экстремальные условия сделали его непомерно дорогим как коммерческий процесс. С тех пор процесс был усовершенствован, и использование металлических катализаторов означает, что требуются более низкие температуры и давления. Кристаллы диаметром в несколько микрон могут быть сформированы за несколько минут, но для получения кристалла ювелирного качества весом в 2 карата может потребоваться несколько недель.
Эти методы означают, что теперь можно искусственно синтезировать алмазы качества драгоценных камней, которые без помощи специального оборудования невозможно отличить от природного алмаза. Само собой разумеется, что это может вызвать головную боль у компаний, торгующих природными алмазами! В алмаз можно превратить любой материал на основе углерода, включая волосы и даже останки кремации! Да, вы можете превратить своего дорого ушедшего питомца в бриллиант, чтобы сохранить его навсегда, если хотите! Искусственные бриллианты химически и физически идентичны натуральным камням и не имеют этического багажа.Однако психологически они остаются барьером — если он действительно любит тебя, он купит тебе настоящий бриллиант — не так ли?
Само собой разумеется, что это может вызвать головную боль у компаний, торгующих природными алмазами! В алмаз можно превратить любой материал на основе углерода, включая волосы и даже останки кремации! Да, вы можете превратить своего дорого ушедшего питомца в бриллиант, чтобы сохранить его навсегда, если хотите! Искусственные бриллианты химически и физически идентичны натуральным камням и не имеют этического багажа.Однако психологически они остаются барьером — если он действительно любит тебя, он купит тебе настоящий бриллиант — не так ли?
С точки зрения химика, материаловеда или инженера у нас быстро заканчиваются превосходные степени при описании удивительных физических, электронных и химических свойств алмаза. Это самый твердый материал, известный человеку, и более или менее инертный, способный противостоять самым сильным и агрессивным кислотам. У него самая высокая теплопроводность среди всех материалов, поэтому он отлично рассеивает тепло.Именно поэтому бриллианты всегда холодны на ощупь. Имея широкую запрещенную зону, он является примером изоляционного материала из учебника и по той же причине обладает удивительной прозрачностью и оптическими свойствами в самом широком диапазоне длин волн среди всех твердых материалов.
Имея широкую запрещенную зону, он является примером изоляционного материала из учебника и по той же причине обладает удивительной прозрачностью и оптическими свойствами в самом широком диапазоне длин волн среди всех твердых материалов.
Теперь вы понимаете, почему алмаз так интересен ученым. Его твердость и инертность предполагают применение в качестве защитных покрытий от истирания, химической коррозии и радиационного повреждения. Его высокая теплопроводность и электрическая изоляция требуют применения в электронике высокой мощности.Его оптические свойства идеально подходят для окон и линз, а его биосовместимость можно использовать в покрытиях для имплантатов.
Эти свойства были известны на протяжении веков — так почему же тогда использование алмаза не получило более широкого распространения? Причина в том, что природный алмаз и алмазы, образованные в результате высокотемпературного синтеза под высоким давлением, имеют ограниченный размер — обычно не более нескольких миллиметров, и их можно резать и формировать только вдоль определенных граней кристалла. Это предотвращает использование алмаза в большинстве предлагаемых приложений.
Это предотвращает использование алмаза в большинстве предлагаемых приложений.
Однако около 20 лет назад ученые открыли новый способ синтеза алмаза, на этот раз при низком давлении, условиях высокой температуры, с использованием химического осаждения из паровой фазы. Если бы кто-то рассмотрел термодинамическую стабильность углерода, мы бы обнаружили, что при комнатной температуре и давлении наиболее стабильной формой углерода на самом деле является графит, а не алмаз. Строго говоря, с чисто энергетической или термодинамической точки зрения алмаз должен самопроизвольно превращаться в графит в условиях окружающей среды! Ясно, что этого не происходит, потому что энергия, необходимая для разрыва прочных связей в алмазе и перегруппировки их с образованием графита, требует больших затрат энергии, и поэтому весь процесс настолько медленный, что в масштабах тысячелетий реакция не происходить.
Именно эта метастабильность алмаза используется при химическом осаждении из паровой фазы. Используется газовая смесь 99 % водорода и 1 % метана, а также некоторый источник активации, такой как горячая нить накаливания, используется для получения высокореакционноспособных водородных и метильных радикалов. Молекулы на основе углерода затем оседают на поверхности, образуя покрытие или тонкую пленку алмаза. На самом деле изначально образуются и графит, и алмаз, но в этих высокореактивных условиях графитовые отложения стираются с поверхности, оставляя только алмаз.Пленки являются поликристаллическими, состоящими из кристаллитов размером в микрон, поэтому им не хватает прозрачности и блеска драгоценного камня алмаза. Хотя они могут быть не такими красивыми, эти алмазные пленки могут быть нанесены на различные поверхности разного размера и формы, что значительно расширяет потенциальные области применения алмаза. Проблемы все еще остаются, чтобы понять сложную химию межкристаллитных границ и химию поверхности пленок и узнать, как лучше всего их использовать. Этот материал будет занимать внимание химиков, материаловедов, физиков и инженеров на долгие годы.
Используется газовая смесь 99 % водорода и 1 % метана, а также некоторый источник активации, такой как горячая нить накаливания, используется для получения высокореакционноспособных водородных и метильных радикалов. Молекулы на основе углерода затем оседают на поверхности, образуя покрытие или тонкую пленку алмаза. На самом деле изначально образуются и графит, и алмаз, но в этих высокореактивных условиях графитовые отложения стираются с поверхности, оставляя только алмаз.Пленки являются поликристаллическими, состоящими из кристаллитов размером в микрон, поэтому им не хватает прозрачности и блеска драгоценного камня алмаза. Хотя они могут быть не такими красивыми, эти алмазные пленки могут быть нанесены на различные поверхности разного размера и формы, что значительно расширяет потенциальные области применения алмаза. Проблемы все еще остаются, чтобы понять сложную химию межкристаллитных границ и химию поверхности пленок и узнать, как лучше всего их использовать. Этот материал будет занимать внимание химиков, материаловедов, физиков и инженеров на долгие годы. Однако в настоящее время мы все можем согласиться с тем, что бриллиант — это нечто большее, чем просто красивое лицо!
Однако в настоящее время мы все можем согласиться с тем, что бриллиант — это нечто большее, чем просто красивое лицо!
Крис Смит
Кэтрин Холт превозносит достоинства жемчужины в углеродной короне. На следующей неделе мы отправимся на вершину первой группы, чтобы услышать историю о металле, который произвел революцию в лечении маниакальной депрессии.
Matt Wilkinson
Его успокаивающее действие на мозг впервые было отмечено в 1949 году австралийским врачом Джоном Кейдом из Департамента психической гигиены штата Виктория.Он вводил морским свинкам 0,5% раствор карбоната лития, и, к его удивлению, эти обычно очень нервные животные стали послушными. Затем Кейд сделал инъекцию того же раствора своему наиболее психически неуравновешенному пациенту. Мужчина отреагировал так хорошо, что через несколько дней его перевели в обычную больничную палату, и вскоре он вернулся к работе.
Крис Смит
И это все еще используется сегодня, хотя, несмотря на 50 лет медицинского прогресса, мы до сих пор не знаем, как это работает. Это был Мэтт Уилкинсон, который будет здесь с рассказом о литии на следующей неделе в программе «Химия в ее элементах». Надеюсь, вы присоединитесь к нам. Я Крис Смит, спасибо за внимание и до свидания.
Это был Мэтт Уилкинсон, который будет здесь с рассказом о литии на следующей неделе в программе «Химия в ее элементах». Надеюсь, вы присоединитесь к нам. Я Крис Смит, спасибо за внимание и до свидания.
(Акция)
(Конец акции)
Инертная атмосфера — обзор
Тип керогена — методы пиролиза
Пиролиз, особенно широко распространенное коммерческое семейство анализаторов Rock-Eval, быстро дает «дешевую и веселую» информацию о типе керогена, зрелости, потенциальном выходе углеводородов и наличие мигрирующих углеводородов.Разработанный бельгийцами и популяризированный французами пиролиз Rock-Eval стал самым распространенным аппаратом для геохимического скрининга буровых проб. Его популярность обусловлена скромными требованиями к образцам, а также относительной дешевизной и простотой (хотя и не обязательно надежной) интерпретации. Для большинства применений данные TOC требуются для интерпретации данных Rock-Eval. Последние версии машины Rock-Eval, тем не менее, производят значение «эквивалента органического углерода», что, возможно, устраняет необходимость в отдельных данных TOC ( см. АНАЛИТИЧЕСКИЕ МЕТОДЫ | Геохимический анализ (включая рентгеновские лучи)).
Последние версии машины Rock-Eval, тем не менее, производят значение «эквивалента органического углерода», что, возможно, устраняет необходимость в отдельных данных TOC ( см. АНАЛИТИЧЕСКИЕ МЕТОДЫ | Геохимический анализ (включая рентгеновские лучи)).
Традиционная установка Rock-Eval постепенно нагревает (пиролиз) порошкообразную породу в инертной атмосфере для получения следующей последовательности действий (рис. 15):
Рис. TOC) производные параметры.
- •
-
Высвобождение «свободных» углеводородов с получением пика S 1 (примерно до 300°C).
- •
-
Моделирование созревания и образования новых углеводородов из керогена (300–550°C) с получением второго пика, S 2 , с максимумом при температуре T max (°C) .
- •
-
Высвобождение органически связанного CO 2 в диапазоне температур 300–550°C с пиком S 3 .
Интерпретация результатов пиролиза вообще и Rock-Eval в частности охватывает многие аспекты геохимии нефти. Интерпретация обычно проводится с использованием стандартных кросс-плотов. Самая простая, называемая диаграммой псевдована Кревелена, отображает кислородный индекс в зависимости от водородного индекса. Это показано на рисунке 16, где можно выделить четыре основных типа керогена:
Интерпретация обычно проводится с использованием стандартных кросс-плотов. Самая простая, называемая диаграммой псевдована Кревелена, отображает кислородный индекс в зависимости от водородного индекса. Это показано на рисунке 16, где можно выделить четыре основных типа керогена:
Рисунок 16.Тип керогена по водородным индексам Rock-Eval (мг пиролата/г TOC) и кислородным индексам (мг CO 2 /г TOC), тренды зрелости указаны жирными черными стрелками.
- •
-
Кероген типа I водорослевого происхождения, нефтеносный;
- •
-
Кероген типа II, происходящий из различных источников, хотя все они склонны к разложению нефти:
- •
-
Споры, экзины и смолы наземных растений;
- •
-
Бактериально разлагаемый водорослевой (первоначально тип I) кероген; и
- •
-
Смесь частиц типа I (водоросли) и типа III (гуминовые).
- •
-
Кероген типа III лигноцеллюлозного или гуминового происхождения, склонный к газообразованию;
- •
-
Кероген типа IIIb или IV, определяемый как измененный (окисленный) гуминовый материал или ископаемый уголь: он не имеет нефтегазового потенциала.

Надежность кислородных индексов была поставлена под сомнение, поскольку некоторые карбонаты (например, карбонаты железа) разлагаются при температурах, при которых собирается «органический CO 2 » (см. рис. 15).Высокие индексы кислорода вызывают подозрение, если они происходят из пород с высоким содержанием карбонатов.
Более подробный подход к идентификации керогена показан на Рисунке 17, где график зависимости выхода Rock-Eval S 2 от TOC используется для определения среднего процента мертвого углерода (%DC) как пересечения наилучшего тренд данных на оси TOC. Увеличивающаяся часть этого пересечения также была интерпретирована как результат адсорбции органических соединений S 2 на активных минеральных поверхностях.
Рисунок 17. Более детальное определение типа керогена в незрелых и ранних зрелых керогенах с использованием Rock-Eval S 2 и данных TOC, где градиент представляет собой водородный индекс (S 2 /TOC в единицах мг пиролизата/г TOC ).
Зеленые и красные тренды (данные плюс линии) проходят через начало графика и определяют два типа керогена с HI 385 и 255 мг/г TOC −1 соответственно. Игнорируя две точки, один синий тренд лучше соответствует всем значениям. Затем TOC можно рассматривать как сумму мертвого углерода (DC) и активного углерода (AC):
%TOC=%DC+%AC
Примечание %TOC представляет собой процент, а TOC относится к соотношению.
Из этого следует, что наклон синего тренда на Рисунке 17 представляет собой модифицированный водородный индекс (HI′), рассчитанный на основе отсутствия мертвого углерода (HI′ = 585 мг S 2 /г AC −1 ):
HI’=100×S2/(%TOC−%DC)=100×S2/%AC
Приведенный выше анализ действительно применим только к незрелым и рано созревшим керогенам (см. следующий раздел). Определение типа керогена для средне-, поздне- и постзрелых керогенов можно выполнить с помощью рисунка 18, где Rock-Eval T max — параметр зрелости. Типичный бактериально-водорослевый кероген II типа демонстрирует небольшое увеличение водородного индекса на незрелой стадии (до T max = 430°C) с последующим линейным снижением, отражающим образование нефти примерно до T макс. = 465°C. Склонный к газам кероген типа III с более низким начальным водородным индексом медленно падает в более широком диапазоне зрелости T max .
Типичный бактериально-водорослевый кероген II типа демонстрирует небольшое увеличение водородного индекса на незрелой стадии (до T max = 430°C) с последующим линейным снижением, отражающим образование нефти примерно до T макс. = 465°C. Склонный к газам кероген типа III с более низким начальным водородным индексом медленно падает в более широком диапазоне зрелости T max .
Рисунок 18. Влияние изменения зрелости на значения водородного индекса для трех основных типов керогена.
Для керогена водорослей Типа I с высокой нефтепроницаемостью граница между незрелыми и ранними зрелыми может достигать T max = 440°C, но как только достигается быстрое образование нефти, происходит быстрое снижение водородного индекса. Отдельный тип керогена, вероятно, потребует собственной калибровки T max : например, генерация из богатого серой керогена типа IIS приводит к снижению водородного индекса при аномально низком уровне зрелости. Таким образом, использование метода пиролиза Rock-Eval для типизации керогена требует знания зрелости материнской породы.
Таким образом, использование метода пиролиза Rock-Eval для типизации керогена требует знания зрелости материнской породы.
Пик пиролиза S 2 можно уловить и передать на газовый хроматограф (ГХ) для получения характерного отпечатка пальца (рис. 19). Этот отпечаток пиролиза-ГХ отличает нефтесодержащий кероген, в котором преобладают дублеты алкан-алкен, от газообразных керогенов, в которых преобладают ароматические соединения, такие как толуол, ксилолы и низкомолекулярные алканы.
Рис. 19. Типирование керогена с использованием отпечатков пальцев пиролиза-ГХ для подтверждения присутствия склонного к нефти керогена (сланец Lias из скважины в UK Western Approaches).
Тип керогена также может быть определен несколько более косвенно по ряду других свойств керогена, таких как элементный анализ, стабильные изотопы углерода и водорода, а также молекулярные отпечатки биомаркеров, таких как стераны и терпаны.
Используя эти более сложные свойства, кероген материнской породы можно отнести к органофации на основании химического состава воды (пресная, соленая, гиперсоленая), минералогии (обломочные породы, карбонаты) и уровня растворенного кислорода (бескислородный, дисоксический, кислородный) при отложении. Кроме того, молекулярные и изотопные характеристики могут накладывать ограничения на стратиграфический возраст и типы организмов, вносящих вклад в кероген. Важность этих молекулярных и изотопных свойств заключается в том, что они переносятся нефтью в ловушку или на поверхность. Это позволяет оценить органофации источника по мигрировавшей нефти и, следовательно, решить вопрос о корреляции нефти и материнской породы.
Кроме того, молекулярные и изотопные характеристики могут накладывать ограничения на стратиграфический возраст и типы организмов, вносящих вклад в кероген. Важность этих молекулярных и изотопных свойств заключается в том, что они переносятся нефтью в ловушку или на поверхность. Это позволяет оценить органофации источника по мигрировавшей нефти и, следовательно, решить вопрос о корреляции нефти и материнской породы.
ЭЛЕМЕНТЫ: Z1-Z10
ЭЛЕМЕНТЫ: Z1-Z10 ДОБРО ПОЖАЛОВАТЬ В РАЙ СТУДЕНТЫ VALLEY CC:ЭТО ВАШ » ЗНАЙ СВОИ ЭЛЕМЕНТЫ » ВЕБ-САЙТ
ВОДОРОД
(греч. вода), символ Н, реактивный, бесцветный, без запаха, и безвкусный газообразный элемент.Атомный номер водорода равен 1. элемент обычно классифицируется в группе 1 (или Ia) периодической таблицы. Нравится газообразных элементов, водород двухатомный (его молекулы содержат два атомов), но диссоциирует на свободные атомы при высоких температурах.

ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ: 1 с 1
Обнаружен свободный водород только в очень малых следах в атмосфере, но солнечные и звездные спектры показывают, что его много на Солнце и других звездах, и на самом деле это самый распространенный элемент во Вселенной.В сочетании с другими элементами он широко распространен на земле, где самые важные и обильные соединение водорода – вода, h3O. Является составной частью всех составляющих живого вещества, а также многих минералов.
Входит в состав всех углеводородов и множество других органических веществ. Все кислоты содержат водород; Отличительной чертой кислоты является ее диссоциация при переходе в раствор, к дают ионы водорода.
Самый легкий из всех газов, водород использовался для надувания воздушных шаров и дирижаблей. Это зажигает очень легко, однако, небольшая искра, заставляющая его гореть, и несколько дирижаблей, включая Гинденбург, были уничтожены водородными пожарами.
 гелий,
который имеет 92 процента подъемной силы водорода и не воспламеняется,
используется по возможности.
гелий,
который имеет 92 процента подъемной силы водорода и не воспламеняется,
используется по возможности.
Известно, что водород существует в виде трех изотопных формы. Ядро каждого атома обычного водорода состоит из один протон. Дейтерий, присутствующий в обычном водороде в количестве 0,02 процентов, содержит один протон и один нейтрон в ядре каждого атома и имеет атомную массу два. Тритий, нестабильный радиоактивный изотоп, содержит один протон и два нейтрона в ядре каждого атома и имеет атомная масса три и составляет только 1 из 10 18 атомов водорода.
ГЕЛИЙ
(греч. helios, «солнце»), символ He, инертный, бесцветный, газообразный без запаха
элемент.В группе 18 периодической таблицы. Гелий является одним из
благородные газы. Атомный номер гелия равен 2. Атомный вес
гелий 4,003.
ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ: 1 с 2
Французский астроном Пьер Янссен открыл гелий в спектре короны солнца во время затмения 1868 года.
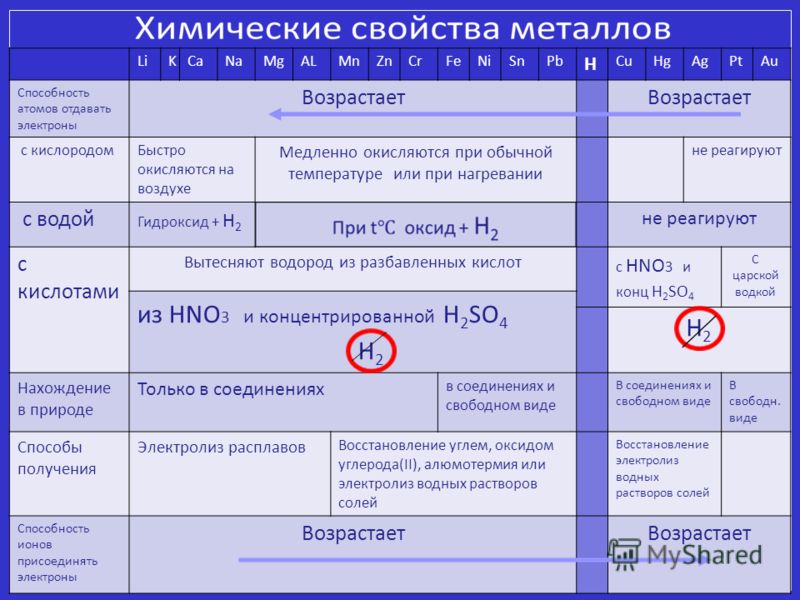 Гелий – второй
самый распространенный элемент во Вселенной после водорода.
Гелий – второй
самый распространенный элемент во Вселенной после водорода.
Гелий имеет одноатомные молекулы и является самым легким всех газов, кроме водорода.. Гелий, как и другие благородные газы, химически инертен. Его единственная электронная оболочка заполнена, что делает возможным реакции с другими элементами крайне затруднены и образующиеся соединения довольно нестабилен. Гелий труднее всего сжижать из всех газов. и невозможно затвердевать при нормальном атмосферном давлении. Эти свойства сделать жидкий гелий чрезвычайно полезным в качестве хладагента и для экспериментальных работы по получению и измерению температур, близких к абсолютному нулю. Жидкий гелий можно охладить почти до абсолютного нуля при нормальном давлении. путем быстрого удаления пара над жидкостью. При температуре немного выше абсолютного нуля он превращается в гелий II, также называемый сверхтекучим гелий, жидкость с уникальными физическими свойствами. У него нет точки замерзания, и его вязкость, по-видимому, равна нулю; легко проходит через минуту трещины и поры и даже ползут по бокам и над губой контейнер.
 Гелий-3, более легкий изотоп гелия с массой 3, имеет
даже более низкая температура кипения, чем у обычного гелия, заметно отличается
свойства в сжиженном состоянии.
Гелий-3, более легкий изотоп гелия с массой 3, имеет
даже более низкая температура кипения, чем у обычного гелия, заметно отличается
свойства в сжиженном состоянии.
Предпочтение отдается гелию, так как он негорюч. к водороду в качестве подъемного газа в воздушных шарах легче воздуха; у него 92 процентов подъемной силы водорода, хотя весит в два раза больше. Гелий используется для повышения давления и придания жесткости конструкции ракет перед полетом. взлета и наддува баков с жидким водородом или другим топливом в чтобы нагнетать топливо в ракетные двигатели. Это полезно для этого приложения потому что он остается газом даже при низкой температуре жидкого водорода.Возможное использование гелия в качестве теплоносителя в ядерных реакторах. потому что он остается химически инертным и нерадиоактивным в условиях которые существуют внутри реакторов.
ПОДУМАЙТЕ О ХИМИЧЕСКОЙ ИНЕРТНОСТИ ГЕЛИЯ В УСЛОВИЯ НАПОЛНЕНИЯ ЕГО ПЕРВОГО ГЛАВНОГО ЭНЕРГЕТИЧЕСКОГО УРОВНЯ ИЛИ ОБОЛОЧКИ.
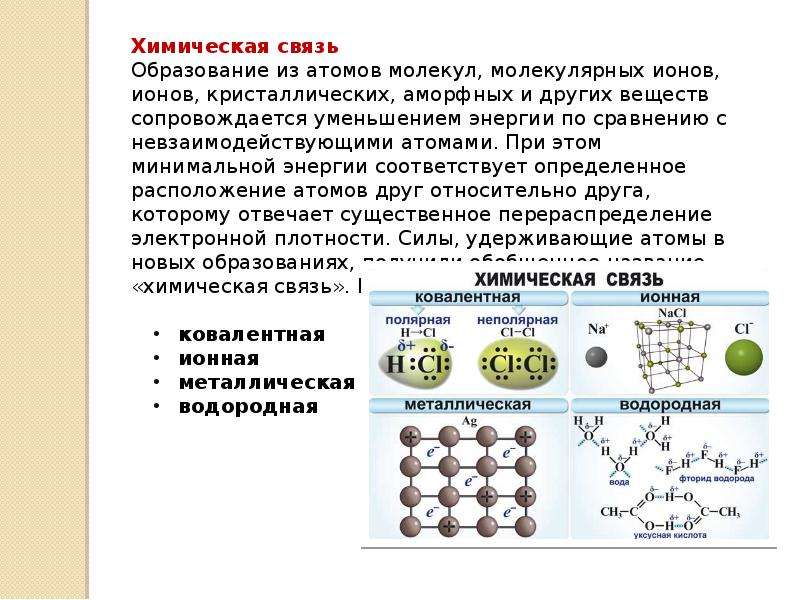 ДОЛЖЕН ЛИ ЭТОТ ЭЛЕМЕНТ ПРИНИМАТЬ ИЛИ ОТДАВАТЬ ЭЛЕКТРОНЫ?
ДОЛЖЕН ЛИ ЭТОТ ЭЛЕМЕНТ ПРИНИМАТЬ ИЛИ ОТДАВАТЬ ЭЛЕКТРОНЫ?
ЛИТИЙ
Символ Li, серебристо-белый, химически активный металлический элемент,
является самым легким по весу из всех металлов.В группе 1 (или Ia) периодического
Таблица. Литий относится к числу щелочных металлов.
Атомный номер лития 3.
ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ: 1s 2 , 2s 1
Химически литий напоминает натрий по своему поведению в том, что оба имеют np 1 валентный электрон. Они образуют катионы 1+. Оно делает не встречаются в природе в свободном состоянии, а только в виде соединений, которые широко распространенный.Важные соединения лития включают гидроксид, используется для связывания углекислого газа в системах вентиляции космических кораблей и подводные лодки; и гидрид, используемый для надувания спасательных шлюпок. Литий карбонат, распространенный минерал, используется при лечении маниакально-депрессивного состояния.
 психоз (основной компонент психоактивных препаратов, таких как валиум).
психоз (основной компонент психоактивных препаратов, таких как валиум).
БЕРИЛЛИЙ
Символ Be, серый, хрупкий металлический элемент, с атомным номером
из 4. Он находится в группе 2 (или IIa) периодической таблицы.Его атомный вес
составляет 9,012.
ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ: 1s 2 , 2с 2
Бериллий, один из щелочноземельных металлов . Он формирует 2+ катионы.
Добавление бериллия в некоторые сплавы часто приводит к продуктам с высокой термостойкостью, улучшенной коррозионной сопротивление, большая твердость, лучшие изоляционные свойства и лучшее литейные качества.Многие детали сверхзвуковых самолетов сделаны из бериллия. сплавов из-за их легкости, жесткости и стабильности размеров.
УГЛЕРОД
ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ : 1s 2 , 2с 2 , 2п 2
Символ C, элемент, имеющий решающее значение для существования живых организмов.
 и это имеет много важных промышленных применений. Атомный номер
углерода 6; элемент находится в группе 14 периодической таблицы.Его атомная масса равна 12,01115.
и это имеет много важных промышленных применений. Атомный номер
углерода 6; элемент находится в группе 14 периодической таблицы.Его атомная масса равна 12,01115.
Три формы элементарного углерода, встречающиеся в природе алмаз, графит и аморфный углерод представляют собой твердые тела с чрезвычайно высокие температуры плавления и нерастворимы во всех растворителях при обычных температурах. Физические свойства трех форм сильно различаются из-за различия в кристаллической структуре. В алмазе, самом твердом материале Известно, что каждый атом связан с четырьмя другими атомами в трехмерном каркасе, тогда как графит состоит из слабо связанных плоских слоев атомов, которые расположены шестиугольниками.
Углерод обладает уникальной способностью связываться с другими
атомы углерода образуют сложные цепи и кольца. Это свойство приводит к
почти бесконечное количество соединений углерода, наиболее распространенными из которых являются те,
содержащие углерод и водород.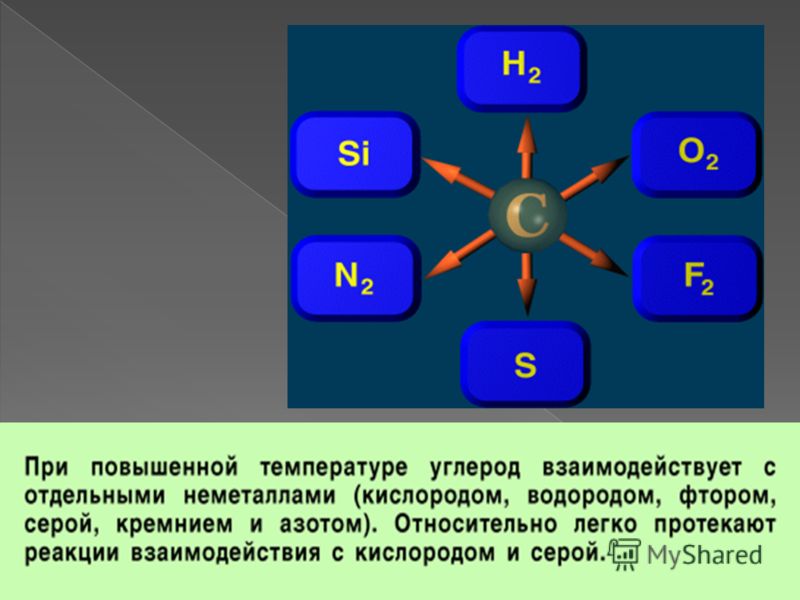 были обнаружены первые соединения углерода.
в живом веществе в начале 19 века, и поэтому
изучение соединений углерода получило название «органической» химии.
были обнаружены первые соединения углерода.
в живом веществе в начале 19 века, и поэтому
изучение соединений углерода получило название «органической» химии.
При нормальных температурах углерод характеризуется
по низкой реакционной способности.При высоких температурах он непосредственно реагирует с большинством
металлов с образованием карбидов , а с кислородом с образованием монооксида углерода
(CO) и диоксид углерода (CO 2 ). Углерод в виде кокса
используется для удаления кислорода из руд оксидов металлов с целью получения
чистый металл. Углерод также образует соединения с большинством неметаллических элементов.
Углерод — широко распространенный в природе элемент;
он встречается там преимущественно в виде карбонатов.Углекислый газ является
важная составляющая атмосферы и главный источник углерода
включены в живую материю. Растения в процессе фотосинтеза
превращать углекислый газ в органические соединения углерода, которые впоследствии
потребляется другими организмами. ЭТО ОДИН ИЗ САМЫХ ВАЖНЫХ БИОХИМИЧЕСКИХ
РЕАКЦИИ, ПРОИСХОДЯЩИЕ НА ЗЕМЛЕ.
ЭТО ОДИН ИЗ САМЫХ ВАЖНЫХ БИОХИМИЧЕСКИХ
РЕАКЦИИ, ПРОИСХОДЯЩИЕ НА ЗЕМЛЕ.
Наиболее распространенным изотопом углерода является углерод-12; в 1961 году этот изотоп был выбран для замены изотопа кислорода-16 в качестве стандарта атомной веса, и ему был присвоен атомный вес 12.
Этот веб-сайт был создан на основе материалов, взятых из энциклопедии Encarta.
96 от Майкрософт.
Что такое угольный графит | Сент-Мэрис Карбон
Углерод занимает царственное место среди элементов 4-й группы Периодической таблицы. Свойства и поведение углерода в сочетании с другими элементами настолько обширны, что ему посвящены две области научных исследований: органическая химия и биохимия.Они включают простые молекулы, такие как углекислый газ и уксусная кислота (уксус), сложные соединения, такие как дезоксирибонуклеиновая кислота (ДНК) и белки, функция которых определяется как их химическим составом, так и их трехмерной структурой.
Карбон также глубок и разнообразен, когда сочетается только с самим собой. Углерод аллотропен, что означает, что он может существовать в различных структурных модификациях. Эти разные структуры или аллотропы могут иметь совершенно разные повторяющиеся паттерны и результирующие физические свойства.Ниже показаны различные аллотропные формы углерода. Наиболее распространенными и широко используемыми из них являются аморфный углерод, графит и алмаз. Несмотря на популяризацию и впечатляющие физические свойства, измеряемые в микроскопическом масштабе, другие аллотропы углерода не нашли широкого применения. Углеродные нанотрубки представляют собой исключение, растущее в таких приложениях, как армирование искусственных пластиков.
В целях дальнейшего обсуждения мы сосредоточимся на аморфной и графитовой формах углерода.
В то время как аморфный углерод характеризуется отсутствием порядка или кристаллической структурой, графит представляет собой высокоупорядоченный материал с атомами углерода, организованными в 6 элементарных ячеек, которые взаимосвязаны с соседними ячейками, которые вместе образуют плоскости. Сила сцепления между слоями углерода довольно велика, а сцепление между слоями слабое, что приводит к самосмазывающейся природе графита, поскольку плоскости относительно легко скользят между собой. Молекулы воды также играют роль в этом явлении самосмазывания.
Сила сцепления между слоями углерода довольно велика, а сцепление между слоями слабое, что приводит к самосмазывающейся природе графита, поскольку плоскости относительно легко скользят между собой. Молекулы воды также играют роль в этом явлении самосмазывания.
Эти термины относятся к двум классам инженерных углеродных материалов, которые преимущественно представляют собой углерод и, как правило, отличаются своей пиковой температурой обработки, которая оказывает существенное влияние на ингредиенты.
Оба материала производятся по почти идентичному методу производства
.- Периодическое сырье – большинство из них, как правило, твердые, хотя иногда используются жидкие связующие вещества
- Смешивание – производится при нагревании до полной гомогенизации сырья и покрытия связующим наполнителей
- Мельница – в конце смешивания материал является консистенция шариков размером около 1 дюйма в большую массу, визуально похожая на замешиваемое тесто для хлеба.
 Для формирования компакта с однородной микроструктурой смесь необходимо охладить, а затем размолоть до частиц с максимальным размером частиц от 0,004 дюйма (105 мкм) до 0,010 дюйма (250 мкм) , фрезерование) необходимо сформировать в исходную форму или форму заготовки до компактной чистой формы для дальнейшей обработки, которая может включать механическую обработку. Это делается с помощью одноосного формования, влажного изостатического формования мешков и менее популярного сухого мешка или экструзии.
Для формирования компакта с однородной микроструктурой смесь необходимо охладить, а затем размолоть до частиц с максимальным размером частиц от 0,004 дюйма (105 мкм) до 0,010 дюйма (250 мкм) , фрезерование) необходимо сформировать в исходную форму или форму заготовки до компактной чистой формы для дальнейшей обработки, которая может включать механическую обработку. Это делается с помощью одноосного формования, влажного изостатического формования мешков и менее популярного сухого мешка или экструзии. - Обжиг – термообработка для карбонизации прекурсора углерода. Связующее для придания кузову углеродной связи.
Электрографитовые материалы проходят еще один этап термообработки, который всегда выполняется в отдельной печи. При обжиге основными проблемами являются управление парами углеводородов, которые являются побочным продуктом предшественника связующего, и достаточно медленная обжиг, чтобы предотвратить взрыв формованных компонентов из-за потери веса связующего. Для графитизации основной движущей силой печи является достижение требуемых пиковых температур, управление безопасностью и минимизация износа печи, что может быть значительным и дорогостоящим.
Таким образом, название «Углерод/графит» связано с тем, что связующее только карбонизировано, хотя наполнители могут содержать графит.
Как углеродно-графитовые, так и электрографитовые материалы становятся пористыми после обжига или графитизации (от 10% до 25% по объему) и многократно подвергаются пропитке для повышения производительности и/или физической прочности. Компоненты также обрабатываются с использованием различных типов станков (токарных, фрезерных, шлифовальных, притирочных и т. д.).
Электрографитовые материалы также могут быть пропитаны между стадиями спекания и графитизации.
Поскольку оба класса являются углеродными материалами, иногда проще сначала обсудить и понять их различия.
При температурах > 2200 C (3990 F) аморфный или неупорядоченный углерод конденсируется и реорганизуется в базисные плоскости графитоподобных структур. Типичные коммерческие циклы графитизации работают при температуре от 2450°C (4400°F) до 3000°C (5400°F). Имейте в виду, что в этих материалах используются преимущественно (и во многих случаях исключительно) углеродные наполнители и связующее вещество-предшественник углерода.Каждое из этих сырьевых материалов имеет уникальный источник и производственный процесс, который влияет на связи углерода с углеродом. Эта предварительная структура может повлиять на то, как этот конкретный материал будет «графитизироваться» и в какой степени он будет самосмазывающимся.
Имейте в виду, что в этих материалах используются преимущественно (и во многих случаях исключительно) углеродные наполнители и связующее вещество-предшественник углерода.Каждое из этих сырьевых материалов имеет уникальный источник и производственный процесс, который влияет на связи углерода с углеродом. Эта предварительная структура может повлиять на то, как этот конкретный материал будет «графитизироваться» и в какой степени он будет самосмазывающимся.
В качестве примера эффекта графитизации были выбраны три характеристики текущего материала и то, как их значения изменяются при пиковой температуре процесса.
| Процесс | Зола (% мас.) | Электрические Удельное сопротивление (Ом-дюйм) | Тепловая Проводимость (БТЕ/фут/ч/Ф |
|---|---|---|---|
| После обжига | 0,01 | 0,00225 | 8 |
| После графитизации | 0,001 | 0,0010 | 27 |
Таким образом, ассортимент углеродных/графитовых и электрографитовых материалов расширяется после термообработки
Что такое углеродные/графитовые и электрографитовые материалы?
Как указывалось ранее, углеродно-графитовые и электрографитовые материалы становятся пористыми после окончательной термообработки.
Эти материалы могут использоваться как есть или быть дополнены путем пропитки или инфильтрации пористости материала обычно смолой или металлом (баббитом, медью, серебром и т. д.). Эти пропитки используются для:
- Увеличить прочность
- Увеличить электропроводность
- Увеличить теплопроводность,
- Уменьшить пористость,
- Сделать тело непроницаемым, таким образом способным образовывать уплотнение, и/или
- Улучшить эксплуатационные характеристики.
Таким образом, углерод/графит или графитовый материал на самом деле представляет собой сумму своих частей: сырье + обработка + пропитка.
Покрытия
Углеродные компонентымогут быть покрыты тефлоном™ или пиролитическим графитом для герметизации поверхности и сохранения химической стойкости.
Твердые покрытия, такие как карбид кремния, алмазоподобные и алмазные покрытия, обычно не наносятся на углеродные/графитовые или электрографитовые материалы, потому что эти материалы уже имеют низкий коэффициент трения, поскольку, во-вторых, для твердых покрытий требуется материал подложки с очень высоким модулем упругости. .
.
Факторы, влияющие на углеродные/графитовые и электрографитовые материалы
Обзор применения углеродных/графитовых и электрографитовых материалов
Что такое приложение и его среда?
С точки зрения дизайна, каковы основные материалы для углеродного/графитового и электрографитового материалов?
Следующие 6 разделов представляют собой попытку ответить на поставленные выше вопросы и полностью изучить различные аспекты этих Материалов.
| Основные материалы | |||||||
|---|---|---|---|---|---|---|---|
| Применение | Трибологические характеристики, включая коэффициент трения | Тепловые свойства | Стойкость к окислению и предел температуры | Химическая стойкость | Физические характеристики | 4 Физические свойства | |
| 1. | 2. | 3. | 4. | 5. | |||
1. Приложения
1. 1 Статическая – электрическая
1 Статическая – электрическая
- Статические контакты
- 1.2 Статические – механические
- Стационарная шайба или уплотнение
- Сальник
- Компоненты или оборудование высокотемпературной печи
- Приспособления для обработки стекла
- Щетки
- Подвижные контакты
- Заземляющие пластины
1.4 Динамический – механический
- Подшипники (радиальные, упорные, Kingsbury и т. д.)
- Висячие подшипники
- Механические уплотнения (для жидкости и газа)
- Лабиринтные уплотнения
- Механические уплотнения (для исключения переносимых по воздуху летучих твердых частиц)
- Турбинные уплотнения
- Компоненты лопастного насоса
- Лопасти, ротор, вкладыш, концевые плиты
- Клапаны
- Компоненты роторного или шестеренчатого насоса
1.5 Динамика – смазка
- Смазочные пробки
- Смазочные пластины
1. 6 Окружающая среда и жидкость
6 Окружающая среда и жидкость
- Воздух (окружающий воздух, давление и вакуум)
Температурный предел Материал 500 F (260 C) Пропитанный смолой уголь/графит или электрографит 700 F (371 C) Непропитанный углерод/графит 900 F (482 C) Типичный электрографит 1150 F (621 C) Электрографит с высокотемпературной пропиткой - Криогенный
- Aerospace
- (специфический специфика эксплуатации)
- Углеводороды
- Масла (как продукт, посредник и теплопередача)
- растворители
- Органические и минеральные кислоты
- Caustic
1.7 Размер компонента
- от 0,5″ до 20″
Углеродные/графитовые и электрографитовые материалы могут быть изготовлены в форме сетки, чтобы предложить наиболее экономичное решение и обеспечить большие объемы, или легко обрабатываются в различных конфигурациях, допусках и отделке поверхности. От ± 0,005 дюйма до ± 0,020 дюйма, а в некоторых случаях до ± 0,001 дюйма. Углеродные кольца
От ± 0,005 дюйма до ± 0,020 дюйма, а в некоторых случаях до ± 0,001 дюйма. Углеродные кольца
можно отполировать до плоскостности 2 гелиевых светлых полос (0,000022 дюйма).
2. Трибологические характеристики и коэффициент трения
- Если устройство вращается, совершает возвратно-поступательное или скользящее движение, есть вероятность, что часть этой сборки выиграет от должным образом рекомендованной марки механического/углеродного или электрографитового материала.Как обсуждалось ранее, графит является самосмазывающимся благодаря своей многослойной структуре. Этот материал также очень способен переносить слой на сопрягаемую поверхность, чтобы снизить коэффициент трения и износа. Берем один для команды — механические / углеродные и электрографитовые компоненты часто считаются жертвенными и предпочтительнее изнашиваются, поскольку они могут делать так против очень большого и дорогого вала, который было бы трудно или невозможно заменить. Эта ситуация подчеркивает суть применения наилучшей сопряженной пары к приложению, пытаясь добиться ограниченного износа углерода, чтобы обеспечить приемлемый срок службы, но при этом достаточного износа, чтобы предотвратить повреждение другого компонента.
 Критическими факторами являются материалы конструкции, отделка поверхности и пористость поверхности трущихся поверхностей, конструктивные факторы уплотнения или подшипника, жидкость, температура и т. д. Например, если шероховатость поверхности или пористость поверхности твердого покрытия чрезмерны, это будет действовать. как шлифовальный круг и ускоряют износ углерода. Углерод/графит и электрографит имеют малый вес (от 1,7 до 1,85 г/куб. см без металлической пропитки). Это значительно улучшает вращательные приложения, уменьшая инерцию вращения.
Критическими факторами являются материалы конструкции, отделка поверхности и пористость поверхности трущихся поверхностей, конструктивные факторы уплотнения или подшипника, жидкость, температура и т. д. Например, если шероховатость поверхности или пористость поверхности твердого покрытия чрезмерны, это будет действовать. как шлифовальный круг и ускоряют износ углерода. Углерод/графит и электрографит имеют малый вес (от 1,7 до 1,85 г/куб. см без металлической пропитки). Это значительно улучшает вращательные приложения, уменьшая инерцию вращения.
3. Тепловые свойства
- Вообще говоря, вам нужны материалы, устойчивые к температуре – низкий коэффициент теплового расширения. Кроме того, для трущихся компонентов также желательна высокая теплопроводность для отвода тепла, выделяемого на трущихся поверхностях. Без этой проводимости тепло будет аккумулироваться и повышать температуру, потенциально вызывая повреждение одной из трущихся поверхностей или приводя к кавитации в жидкости.
 В меньшей степени желательно иметь низкую теплоемкость, которая помогает теплу проходить к более крупному телу.Параметр теплового удара RT указывает на устойчивость материала к растрескиванию и разрушению при воздействии теплового удара, например, если насос работает всухую, а затем внезапно заливается жидкостью.
В меньшей степени желательно иметь низкую теплоемкость, которая помогает теплу проходить к более крупному телу.Параметр теплового удара RT указывает на устойчивость материала к растрескиванию и разрушению при воздействии теплового удара, например, если насос работает всухую, а затем внезапно заливается жидкостью. k = теплопроводность
α = коэффициент теплового расширения
E = модуль упругости
Поскольку углерод/графит и графитовые материалы имеют относительно высокую теплопроводность, низкий коэффициент теплового расширения и скромный модуль упругости, они обладают превосходной термостойкостью .
| Физические характеристики | Диапазон значений для механических/углеродных материалов | Диапазон значений для электрографитных материалов |
|---|---|---|
| Коэффициент теплового расширения | 2,5–3,2 мкдюйм/дюйм/F 4,5–5,8 мкм/мм/C | 2,0–2,6 мкдюйм/дюйм/мм/F 4 3,6–3,6 µдюйм/дюйм/мм/F 4 3,6–3,6 мкдюйм/дюйм/F 4,7–3,6– |
| Теплопроводность | от 5 до 8 БТЕ/ч/фут/Ф от 9 до 14 Вт/м/Кл | от 25 до 105 БТЕ/ч/фут/Ф от 44 до 180 Вт/м/Кл |
| Теплоемкость | 0. 17 БТЕ/фунт/Ф (0,71 КДж/кг/К) 17 БТЕ/фунт/Ф (0,71 КДж/кг/К) |
|
4. Стойкость к окислению и температурный предел
- Углерод действительно окисляется при воздействии повышенной температуры в окислительной атмосфере (наиболее популярен воздух при 21% O2). Различные формы углерода будут окисляться с разной скоростью, которая определяется атомной связью этой конкретной структуры. Термореактивные смолы используются в качестве пропиток для углеродных материалов, чтобы уменьшить пористость, увеличить прочность или сделать корпус непроницаемым.Эти органические вещества окисляются первыми и обычно имеют номинальную температуру 500 F. Связь в углеродно-графитовом материале более устойчива к окислению и имеет номинальную температуру до 700 F. После графитизации и наполнители, и связующее в электрографите значительно более устойчив к окислению с номинальной температурой до 900 F. Неорганические добавки могут быть включены в электрографит, повышая его температурный предел до 1150 F. Предельная температура — это максимальная рекомендуемая температура использования в инертной среде, такой как вакуум, азот, аргон, или гелий.
 Температурный предел напрямую связан с максимальной температурой термообработки, которая составляет 1600 F (870 C) для углеродных/графитовых материалов и 5000 F (2760 C) для электрграфитовых материалов.
Температурный предел напрямую связан с максимальной температурой термообработки, которая составляет 1600 F (870 C) для углеродных/графитовых материалов и 5000 F (2760 C) для электрграфитовых материалов.
5. Химическая стойкость
- Химическая инертность углеродно-графитовых и электрографитовых материалов проявляется как в их стойкости к окислению при высокой температуре на воздухе, так и в отношении жидких химикатов и водных растворов.
- Растворители и углеводороды
Углеродные/графитовые и электрографитовые материалы устойчивы к большинству растворителей и не набухают и не размягчаются, как многие искусственные пластмассы.Однако следует соблюдать осторожность при выборе материала, пропитанного смолой, поскольку смола будет слабым звеном.
Легкие углеводороды под некоторыми конструкциями уплотнений вызывают вздутие угольного уплотнительного кольца. Если это невозможно решить изменением конструкции, рекомендуется использовать механический уголь, импрегнированный сурьмой.
- Кислоты
Механические угли устойчивы к большинству органических и минеральных кислот.
Из-за своей агрессивности хромовая кислота будет разрушать углеродное связующее, поэтому для таких применений следует выбирать электрографит.
Также фтористоводородная кислота встречается в некоторых нефтехимических применениях. HF будет связывать золу в механических компонентах, поэтому для таких применений снова следует выбирать электрографит. - Каустик
Углерод/графит и электрографит Материалы обладают высокой устойчивостью к щелочным растворам. При экстремальных концентрациях и повышенных температурах необходимо оценить совместимость пропитки смолой.
6. Физические характеристики
- Механические/углеродные и электрографитовые материалы обладают широким спектром физических свойств.Они имеют достаточно высокий модуль упругости для структурного использования и требований к жесткости и доступны с различными уровнями прочности. Этот модуль упругости представляет собой компромисс между модулем упругости искусственных пластмасс и карбидной или оксидной керамикой, такой как самоспекающийся карбид кремния и глинозем, которые предлагают проектировщику жесткий материал с «прощающей способностью».
 Из-за хрупкой природы этих материалов их прочность на растяжение Прочность низкая.
Из-за хрупкой природы этих материалов их прочность на растяжение Прочность низкая.
Платина
ПлатинаПлатина
Платина – это химический элемент серебристого цвета, член шести переходных элементов группы VIII периодическая таблица, известная под общим названием платиновые металлы (рутений, родий, палладий, осмий, иридий и платина).Платина имеет символ Pt, ее атомный номер 78, а его атомный вес 195,09. Название происходит от испанского platina, что означает «серебро».
Платина была
обнаружен в Южной Америке независимо Антонио де
Уллоа в 1735 г. и Н. Вудом в 1741 г., но это было в
использовали индейцы доколумбовой эпохи. Платиновые металлы являются
чрезвычайно редкие элементы; платина сама по себе самая
обыкновенный, с обилием в земной коре около
миллионная часть 1 процента, тогда как остальные группы
имеют изобилие около одной десятимиллионной 1 процента.Платина встречается в природе как чистый металл, а также в
сплавы с другими металлами группы, главным образом в
аллювиальные отложения Уральских гор, Колумбии и
некоторых частях западной части США. Кроме того
элемент встречается в минерале сперрилите и в
никельсодержащие месторождения Онтарио в Канаде.
Кроме того
элемент встречается в минерале сперрилите и в
никельсодержащие месторождения Онтарио в Канаде.
Большой масштабное производство никеля позволяет извлекать небольшое количество платины (только 1 часть платины до 2 млн частей руды).Восстановление личности платиновые металлы из природных сплавов представляет собой сложный процесс, который зависит от определенных свойств отдельные элементы, хотя все члены группы в целом сходны по своему химическому поведению и совсем нереактивный. Например, когда природный сплав платина, палладий, осмий и родий перевариваются с царская водка, палладий и платина растворяются и экстрагируют раствором хлорпалладиевой кислоты и хлорплатиновая кислота.Затем платину осаждают из этот раствор в виде хлороплатината аммония.
Платина
привлекательный серебристо-белый металл с температурой плавления
1774°С, температура кипения 3827°С и плотность
21,45 г/куб см при комнатной температуре. Он имеет коэффициент
тепловое расширение, близкое к натронно-известковому кремнезему
стекло и, следовательно, используется для изготовления герметичных электродов
в системах из мягкого стекла. Преобладающие степени окисления
платина +2 и +4. Платина химически инертна и
не окисляется на воздухе при любой температуре.Он устойчив
к кислотам и не подвергается воздействию какой-либо отдельной минеральной кислоты, кроме
легко растворяется в царской водке. Металл быстро
подвергается воздействию расплавленных оксидов щелочных металлов и пероксидов и будет
реагируют с фтором и при красном калении с хлором. На
нагревание, платина соединяется непосредственно с элементарным
фосфор, кремний, свинец, мышьяк, сурьма, сера и
селен, факт, который влияет на использование платины
Лабораторное оборудование. В соответствии с другими членами
платиновой группы металл проявляет довольно сильную
склонность к образованию сложных ионов.Самый распространенный Pt(I)
комплексы имеют квадратную плоскую структуру и
диамагнитный.
Преобладающие степени окисления
платина +2 и +4. Платина химически инертна и
не окисляется на воздухе при любой температуре.Он устойчив
к кислотам и не подвергается воздействию какой-либо отдельной минеральной кислоты, кроме
легко растворяется в царской водке. Металл быстро
подвергается воздействию расплавленных оксидов щелочных металлов и пероксидов и будет
реагируют с фтором и при красном калении с хлором. На
нагревание, платина соединяется непосредственно с элементарным
фосфор, кремний, свинец, мышьяк, сурьма, сера и
селен, факт, который влияет на использование платины
Лабораторное оборудование. В соответствии с другими членами
платиновой группы металл проявляет довольно сильную
склонность к образованию сложных ионов.Самый распространенный Pt(I)
комплексы имеют квадратную плоскую структуру и
диамагнитный.
Из-за инертности и привлекательности
внешний вид, одно из основных применений платины в
производство ювелирных изделий. Золотоплатиновые сплавы, наз.
как белое золото, широко используются в стоматологии и в
изготовление украшений.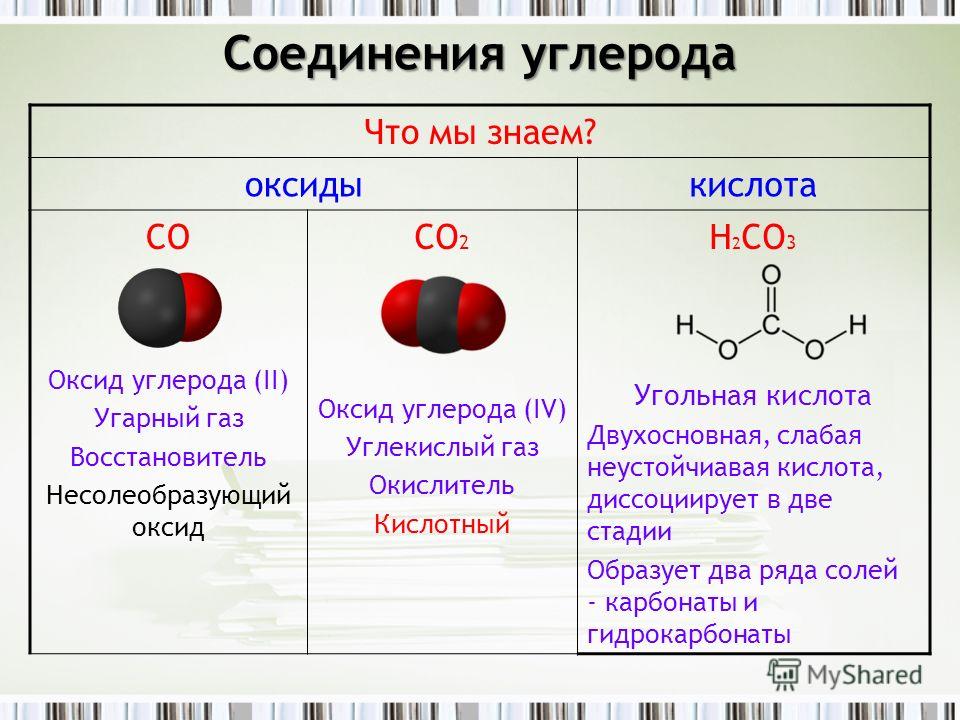 Платина и ее сплавы используются в
изготовление тиглей и выпарных чашек для
химические анализы. Другие приложения включают в себя
формирование термопарных проводов, электрических контактов,
коррозионностойкое оборудование, а также изготовление
платиновые термометры сопротивления, используемые для измерения температуры
управление печами.Сплав, состоящий из 76,7%
платины и 23,3% кобальта по весу, образует чрезвычайно
мощный магнит. Более поздние применения металла
включают покрытие обтекателей ракет и топливо для реактивных двигателей
сопла. Наряду с палладием металл поглощает большие
объемов водорода, удерживая его при обычных температурах
но десорбируя его при красном калении. Тот факт, что поглощается
водород чрезвычайно реакционноспособен, предполагает, что он присутствует
либо в виде атомарного водорода, либо в виде очень реакционноспособной платины
водородное соединение или комплекс.В мелкодисперсном виде
платина — отличный катализатор; около половины
ежегодное производство металла служит этой цели, большинство
из них в нефтехимической промышленности.
Платина и ее сплавы используются в
изготовление тиглей и выпарных чашек для
химические анализы. Другие приложения включают в себя
формирование термопарных проводов, электрических контактов,
коррозионностойкое оборудование, а также изготовление
платиновые термометры сопротивления, используемые для измерения температуры
управление печами.Сплав, состоящий из 76,7%
платины и 23,3% кобальта по весу, образует чрезвычайно
мощный магнит. Более поздние применения металла
включают покрытие обтекателей ракет и топливо для реактивных двигателей
сопла. Наряду с палладием металл поглощает большие
объемов водорода, удерживая его при обычных температурах
но десорбируя его при красном калении. Тот факт, что поглощается
водород чрезвычайно реакционноспособен, предполагает, что он присутствует
либо в виде атомарного водорода, либо в виде очень реакционноспособной платины
водородное соединение или комплекс.В мелкодисперсном виде
платина — отличный катализатор; около половины
ежегодное производство металла служит этой цели, большинство
из них в нефтехимической промышленности. Он также используется в качестве
катализатор в контактном процессе производства
серную кислоту из диоксида серы и кислорода. Существует много
текущий интерес к применению металла в качестве
катализатор в топливных элементах и в каталитических нейтрализаторах, как
противозагрязняющие устройства для автомобилей. В последнем
например, подходящая форма платины будет катализировать
окисление монооксида углерода в диоксид углерода и
превращают оксид азота в азот и воду.Отлично
платиновая проволока светится при помещении в пары метилового спирта,
где он действует как катализатор, превращая спирт в
формальдегид. Этот эффект используется в коммерческих целях для получения
зажигалки и грелки для рук. Цена на платину
колебался в широких пределах по отношению к цене на золото. Несмотря на то что
сегодня он немного более ценен, когда-то он использовался как
примесь золота.
Он также используется в качестве
катализатор в контактном процессе производства
серную кислоту из диоксида серы и кислорода. Существует много
текущий интерес к применению металла в качестве
катализатор в топливных элементах и в каталитических нейтрализаторах, как
противозагрязняющие устройства для автомобилей. В последнем
например, подходящая форма платины будет катализировать
окисление монооксида углерода в диоксид углерода и
превращают оксид азота в азот и воду.Отлично
платиновая проволока светится при помещении в пары метилового спирта,
где он действует как катализатор, превращая спирт в
формальдегид. Этот эффект используется в коммерческих целях для получения
зажигалки и грелки для рук. Цена на платину
колебался в широких пределах по отношению к цене на золото. Несмотря на то что
сегодня он немного более ценен, когда-то он использовался как
примесь золота.
Инертный газ: определение, типы и примеры — видео и расшифровка урока
Почему некоторые газы инертны?
Атомы считаются нестабильными, если они не имеют заполненной внешней орбитали. Для атомов с атомным номером больше 5 «магическое число» для заполнения внешней орбитали равно 8. Для атомов меньшего размера (атомы с атомным номером меньше 5, например гелий) самая внешняя орбиталь заполнена двумя электронами.
Для атомов с атомным номером больше 5 «магическое число» для заполнения внешней орбитали равно 8. Для атомов меньшего размера (атомы с атомным номером меньше 5, например гелий) самая внешняя орбиталь заполнена двумя электронами.
Электронная орбиталь — это место, где находятся электроны. У большинства атомов нет 8 электронов на этой внешней орбитали, поэтому они реагируют с другими атомами, образуя связи, заполняющие их внешнюю электронную орбиталь. Атомная структура благородных газов отличается от структуры большинства атомов, поскольку они имеют заполненную внешнюю орбиталь.Благодаря этому они стабильны и им «не нужно» взаимодействовать с другими атомами. Обратите внимание, что один из благородных газов, гелий, представляет собой очень маленький атом и имеет только 2 электрона на своей самой внешней электронной орбитали (которая является его единственной орбиталью). Он стабилен с этой заполненной внешней орбиталью.
В нашем описании того, что означает инертность для некоторых так называемых инертных газов, есть ошибка. Вплоть до 1962 года ученые считали, что благородные газы никогда не реагируют с другими веществами. В том же году химик Нил Бартлетт провел эксперименты с ксеноном и обнаружил, что он может образовывать соединение с платиной и фтором.
Вплоть до 1962 года ученые считали, что благородные газы никогда не реагируют с другими веществами. В том же году химик Нил Бартлетт провел эксперименты с ксеноном и обнаружил, что он может образовывать соединение с платиной и фтором.
Бартлетт шокировал научное сообщество этим открытием! Благодаря его работе мы теперь знаем, что при определенных условиях некоторые атомы некоторых инертных газов действительно образуют связи с другими атомами. Есть несколько соединений ксенона, несколько соединений криптона и по крайней мере одно соединение аргона, которые реагируют с другими веществами.
Благородные газы
Как вы только что узнали, некоторые инертные газы широко известны как благородные газы . Точно так же, как дворяне в средние века мало общались с простыми людьми, благородные газы не «социализируются» и не реагируют с другими веществами.Используя эту аналогию дворян и простолюдинов, вы можете вспомнить характерное свойство благородных газов, заключающееся в том, что большую часть времени они химически неактивны.
Другие инертные газы
Газообразный азот и двуокись углерода называются инертными газами из-за их очень низкой реакционной способности. Эти газы не инертны, как инертные газы, которые существуют в своей элементарной форме. Однако они ведут себя так же, как благородные газы.
Газообразный азот состоит из 2 атомов азота, связанных тройной связью.Поскольку он существует в этом бимолекулярном состоянии, он не вступает в реакцию с другими веществами. Обратите внимание, что элементарный азот (негазообразный азот) реагирует с другими веществами.
Углекислый газ — еще один инертный газ. В диоксиде углерода атом углерода ковалентно связан с двумя атомами кислорода. Этот тримолекулярный газ редко вступает в реакцию с другими веществами, поэтому считается инертным газом.
Применение
По той важной причине, что инертные газы редко реагируют с другими веществами, они идеально подходят для использования в качестве стабилизирующих газов в процессах, в которых используются неинертные газы (те, которые могут реагировать с другими веществами).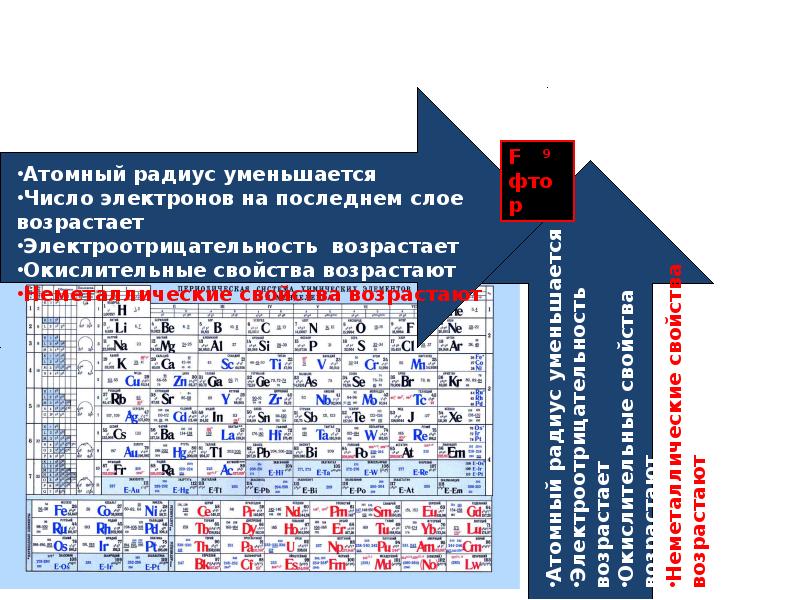 Давайте посмотрим на следующую диаграмму, которая суммирует некоторые распространенные способы использования инертных газов.
Давайте посмотрим на следующую диаграмму, которая суммирует некоторые распространенные способы использования инертных газов.
В дополнение к процессам, перечисленным в этой таблице, инертный газ радон имеет важное применение в медицине. Он используется в лучевой терапии для лечения некоторых видов рака и других состояний, таких как артрит. Как видите, инертные газы имеют множество полезных применений.
Итоги урока
Давайте повторим. Инертный газ — это газ, который имеет крайне низкую реакционную способность по отношению к другим веществам.Благородные газы — гелий, аргон, неон, ксенон, криптон, радон и элемент 118 (Uuo) — существуют в своей элементарной форме и находятся в группе 18 периодической таблицы. Благородные газы имеют чрезвычайно низкую реакционную способность по отношению к другим веществам, потому что они имеют заполненную внешнюю орбиталь и очень стабильны.
В дополнение к инертным газам газообразный азот и диоксид углерода считаются инертными, и оба они широко используются в промышленности в качестве сжатых газов и нейтрализаторов там, где присутствуют неинертные газы. Инертные газы имеют множество практических применений из-за их низкой реакционной способности. Их часто смешивают с неинертными газами, чтобы уменьшить реакции неинертных газов с веществами. Многие из них используются в освещении, а некоторые находят важное применение в ядерных реакторах и медицине.
Инертные газы имеют множество практических применений из-за их низкой реакционной способности. Их часто смешивают с неинертными газами, чтобы уменьшить реакции неинертных газов с веществами. Многие из них используются в освещении, а некоторые находят важное применение в ядерных реакторах и медицине.
Основные термины
- Инертный газ : газ с очень низкой реакционной способностью по отношению к другим веществам
- Благородный газ : газ в его элементарной форме; 18 группа периодической таблицы
Результаты обучения
После запоминания основных аспектов этого урока по инертному газу убедитесь, что вы можете:
- Расшифровать термин «инертный газ»
- Назовите благородные газы таблицы Менделеева и запомните их характеристики
- Идентификация других инертных газов
- Понять, почему некоторые газы инертны
- Перечислите некоторые виды использования инертных газов